OPMERKINGS: Uitstekende oorsig van byna al die relevante navorsing oor androgeen reseptore, dopamien en seksuele funksie. Fantastiese teken van die hipotalamus-beloning-kringverwantskappe.
Horm Behav. 2008 Mei; 53(5): 647-658.
Gepubliseer aanlyn 2008 February 13. doi: 10.1016 / j.yhbeh.2008.01.010
Abstract
Adolessensie word geassosieer met toename in plesier-soekende gedrag, wat op sy beurt gevorm word deur die pubertalaktivering van die hipotalamo-pituïtêre-gonadale as. In diermodelle van natuurlik bevredigende gedrag, soos seks, testikulêre androgeen, dra by tot die ontwikkeling en uitdrukking van die gedrag by mans. Om gedragsmognasie te bewerkstellig, ondergaan die brein beduidende remodeling tydens adolessensie, en baie van die veranderinge is ook sensitief vir androgenen, wat vermoedelik deur androgeenreseptore (AR) optree. Gegewe die delikate interaksie van gonadale hormone en breinontwikkeling, is dit nie verbasend dat die ontwrigting van hormoonvlakke gedurende hierdie sensitiewe tydperk aansienlik adolessente en volwasse gedrag verander nie. In manlike hamsters word blootstelling aan testosteroon tydens adolessensie benodig vir normale uitdrukking van seksuele gedrag van volwassenes. Mannetjies ontneem van androgene tydens puberteit vertoon volgehoue tekorte in paring. Omgekeerd is androgene alleen nie voldoende om paring in prepubertal mans te veroorsaak nie, alhoewel brein AR voor puberteit teenwoordig is. In hierdie konteks is wye verspreiding van anaboliese enrogeniese steroïede (AAS) tydens adolessensie 'n beduidende bekommernis. AAS misbruik het die potensiaal om beide die tydsberekening en die vlakke van androgen in adolessente mans te verander. In hamsters, adolessente AAS blootstelling verhoog aggressie, en veroorsaak permanente veranderinge in neurotransmitter stelsels. Daarbenewens versterk AAS hulself, soos aangedui deur self-administrasie van testosteroon en ander AAS. Nuwe bewyse dui egter daarop dat die versterkende effekte van androgene nie klassieke AR nodig mag hê nie. Daarom is verdere ondersoek van interaksies tussen androgenen en lonende gedrag in die adolessente brein nodig vir 'n beter begrip van AAS-misbruik.
Oorsig
Adolessensie wakker die brein vir beide plesier en risiko. In menslike tieners neem dit dikwels die vorm van eksperimentering met dwelms en seks. In die Verenigde State is die mediane ouderdom vir eerste omgang in mans mans 16.4 jaar, en 65% het gemeenskap gehad teen 12th grade (Kaiser Familie Stigting, 2005). Net so het hierdie bevolking die hoogste vlakke van onwettige dwelmgebruik in die Verenigde State. Volgens die 2004-nasionale opname oor dwelmgebruik en gesondheid het 38% van mans-jare 18-25 die afgelope jaar 'n onwettige dwelm gebruik (SAMHSA / OAS, 2005). Daarbenewens het 31% van tieners seuns dwelms of alkohol tydens hul laaste seksuele ontmoeting gebruik (Kaiser Familie Stigting, 2005). Daarbenewens is adolessensie 'n deurslaggewende tyd in die etiologie van sekere psigopatologieë, soos depressie, angs, versteurde eet- en gedragsversteuring. Ons stel voor dat die pubertalafskeiding van gonadale hormone, hul aktivering van steroïedreseptore in die brein en die interaksie tussen hormoon en ondervinding op adolessente breinontwikkeling bydra tot die gedragsveranderings wat tydens adolessensie gesien word.
Ons doel is om die bewyse te ondersoek dat gonadale androgenen die adolessente volwassenheid en volwasse prestasie van gemotiveerde gedrag bemoedig, sowel as die belonende eienskappe van hierdie gedrag. Ons bied ook bewyse aan dat testosteroon self lonend is, wat waarskynlik bydra tot veranderinge in gemotiveerde gedrag tydens adolessensie wanneer die testosteroonvlakke styg. Die fokus van hierdie vraestel is op ons studie van neurale stroombane onderliggend aan manlike seksuele gedrag, veral in die Siriese hamster, met spesiale klem op die interaksie tussen testosteroon en dopamien (DA). Ons stel voor dat pubertal androgene beide oorgangs- en langtermyn-effekte op beloningskringe en gemotiveerde gedrag het. Ons veronderstel verder dat aanvulling met eksogene androgenen in die vorm van anaboliese enrogeniese steroïede (AAS) die normale invloede van pubertal-androgenen vergroot, en sodoende adolessente ontwikkeling van brein en gedrag nadelig beïnvloed.
Adolessensie as 'n sensitiewe tydperk vir breinontwikkeling
Uiteindelik is die brein 'n sneller en 'n teiken vir androgeenaksie tydens adolessensie. By jong seuns (<12 jaar) en jong hamsters (<28 dae oud) is sirkulerende androgene en gonadotropiene op basale vlakke. Namate die afskeiding van luteïniserende hormoon uit die anterior hipofise toeneem in reaksie op hipotalamus-gonadotropien-vrystellende hormoon, verhoog die sirkulerende testosteroonkonsentrasies aansienlik. Dit vind plaas by Tanner stadium II / III (14 jaar) by seuns, en op 28 dae ouderdom by hamsters. Teen die tyd dat seuns Tanner stadium IV / V bereik (ongeveer 16 jaar oud) of wanneer hamsters 50-60 dae oud is, is endogene testosteroon binne die volwasse manlike reeks. Puberteitale hormoonafskeiding val saam met die periode van adolessensie, wat van ongeveer 12 tot 20 jaar by mense plaasvind. Pubertehormone werk nie net op perifere weefsels om sekondêre geslagseienskappe wat die openlike tekens van puberteit is, te laat voorkom nie, maar hulle werk ook sentraal om die opknapping van die adolessente brein en die gedrag van gedrag te beïnvloed. Verder lei die fisiologiese en neurologiese veranderinge wat deur puberteithormone teweeggebring word, tot beduidende veranderinge in die ervaring van 'n individu, wat die breinontwikkeling vanself kan verander. Die puberteitstoename in geslagsteroïedhormone, aangedryf deur ontwikkelingsgerigte rypwording van die reproduktiewe neuro-endokriene as, vorm dus weer die ontwikkeling van adolessente gedrag deur direkte en indirekte invloede op die senuweestelsel.
Menslike adolessensie word nou erken as 'n belangrike en dinamiese periode van neurale ontwikkeling waartydens gedragskringe herbou en verfyn word. Alhoewel die brein van 'n 5-jarige kind reeds 90% van sy volwasse grootte is (Dekaban, 1978), beduidende hermodellering is nog te kom. Hierdie konsep is aangesteek deur navorsing in beide mense en diere wat dokumenteer dat baie van die basiese ontwikkelingsprosesse wat tydens die perinatale breinontwikkeling voorkom, tydens die adolessensie herskep word. Hierdie prosesse sluit in neurogenese (Eckenhoff en Rakic, 1988; Hy en Spanne, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia, en Guillamon, 2001; Rankin, Partlow, McCurdy, Giles, en Fisher, 2003), geprogrammeerde sel dood (Nunez, Lauschke, en Juraska, 2001; Nunez, Sodhi, en Juraska, 2002), uitbreiding en snoei van dendritiese arborisasies en sinapse (Andersen, Rutstein, Benzo, Hostetter, en Teicher, 1997; Huttenlocher en Dabholkar, 1997; Lenroot en Giedd, 2006; Sowell, Thompson, Leonard, Welkom, Kan, en Toga, 2004), myelinisering (Benen, Turtle, Khan, en Farol, 1994; Paus, Collins, Evans, Leonard, Pike, en Zijdenbos, 2001; Sowell, Thompson, Tessner, en Toga, 2001), en seksuele differensiasie (Chung, De Vries, en Swaab, 2002; Davis, Shryne, en Gorski, 1996; Nunez et al., 2001). Dus, die ontwikkelingsbaan van die postnatale brein is nie lineêr nie, maar word in plaas daarvan gekenmerk deur 'n adolessente uitbarsting van vinnige verandering en behels beide progressiewe en regressiewe gebeure. Soos enige ontwikkelingsbioloog weet, het periodes van vinnige ontwikkelingsverandering seer sensitivity en kwesbaarheid vir beide ondervinding-afhanklike verandering en negatiewe gevolge van versteuring en belediging. Daar is geen rede om te dink dat menslike adolessente breinontwikkeling enige uitsondering is nie (Andersen, 2003; Spies, 2000). Dus, verwagtinge in die tydsberekening van pubertal hormoon invloede op die adolessente brein sal voorspel word om langdurige gevolge vir volwasse gedrag te hê.
Androgenen en neurale kringe vir gemotiveerde gedrag
Omdat adolessensie 'n oorgang en dinamiese fase van ontwikkeling is, sal dit moeilik wees om die adolessente brein en gedrag in isolasie te evalueer. In plaas daarvan om die unieke karakter van adolessensie te waardeer, is dit nuttig om dit te kontrasteer met die brein en gedrag van volwasse volwassenes. Dus, met die fokus van hierdie vraestel oor manlike seksuele gedrag en beloning, is dit hier belangrik om die neurale stroombane vir kopulasie en seksuele motivering in volwasse mans voor te stel, insluitende die rol van gonadale steroïedhormone in gedragsaktivering en die verspreiding van reseptore vir androgenen (AR) en oestrogenen (ER).
AR is teenwoordig in selgroepe wat die neurale stroombane vorm wat bemoedigende sosiale gedrag, soos seks, bemoedig. Verder word brein AR uitgedruk voor puberteit in hamsters en word deur androgenen in beide jong en volwasse mans opgerig (Kashon, Hayes, Shek, en Sisk, 1995; Meek, Romeo, Novak en Sisk, 1997). In knaagdierbrein is daar aansienlike oorvleueling in die verspreiding van AR en ER (Wood en Newman, 1995), en aromatase (Celotti, Negri-Cesi, en Poletti, 1997), insluitende beide α- en β-vorms van die estrogeenreseptor (Shughrue, Lane, en Merchenthaler, 1997). By bindend aan ligand, is "klassieke" AR en ER funksie as transkripsiefaktore transkripsie en sintese van nuwe proteïene te veroorsaak. Nie verrassend nie, hierdie effekte volg 'n relatief stadige tydskursus, met 'n vertraagde aanvang van aksie. Steroïedstimulasie van seksuele gedrag van manlike hamster (Noble en Alsum, 1975) is in ooreenstemming met aksies deur middel van klassieke genomiese aksies. Byvoorbeeld, 2 weke steroïde blootstelling word benodig om paring in langtermynkastrate te herstel. Meer onlangse studies in rotte het ook vinnige sellulêre effekte van androgenen in breingebiede getoon wat min klassieke reseptore besit (Mermelstein, Becker, en Surmeier, 1996). Hierdie steroïed-aksies word vermoedelik bemiddel deur nie-genomiese reseptore. Terwyl die verspreiding van klassieke AR en ER in die hamsterbrein relatief beperk is (Wood en Swann, 1999), die potensiële brein teikens vir nie-genomiese androgeen aksie is baie wyer.
Die mediale preoptiese area (MPOA) speel 'n sentrale rol in die samestelling by mans van goudvisse na mense (hersien in Hull, Wood, en McKenna, 2006). Verder, die hamster MPOA oordrag gonadale steroïed hormone via oorvloedige AR en ER, en testosteroon inplantings in MPOA is voldoende om seksuele aktiwiteit in langtermyn kastrate te herstel (Wood en Swann, 1999). In manlike rotte tree gonadale steroïde op in die MPOA om basale DA-vrystelling te reguleer (Putnam, Sato en Hull, 2003) en stimuleer paring (Hull, Du, Lorrain, en Matuszewich, 1995). Aanvanklik is daar 'n beskeie toename in DA as 'n vrou agter 'n skerm aangebied word. Tydens die samestelling verhoog MPOA DA verder (+ 50% van basislyn), en hierdie effek benodig androgenen (Hull et al., 1995; Putnam et al., 2003). Nie verrassend nie, in gekastreerde mans wat nie gesteel het nie, verhoog MPOA DA nie (Hull et al., 1995). Dit is 'n bietjie moeilik om hierdie uitkoms te interpreteer, aangesien die gebrek aan DA-vrylating beskaamd is deur die afwesigheid van seksuele aktiwiteit. Die DA-vrystelling in MPOA hou egter verband met die verlies van paring in korttermyn-kastrate (Hull et al., 1995), en met testosteroon-geïnduceerde herstel van seksuele aktiwiteit in langtermyn kastrate (Du, Lorrain en Hull, 1998; Putnam, Du, Sato en Hull, 2001).
Binne die knaagdier MPOA speel die androgene en estrogeen metaboliete van testosteroon spesifieke rolle in die regulering van paring (Putnam et al., 2003; Putnam, Sato, Riolo en Hull, 2005). Die latensie om kopulering te begin (berg of intromiet) is een maatstaf van seksuele motivering. Die latensie vir seksuele aktiwiteit is sensitief vir oestrogenen, deur die handhawing van MPOA-stikstofoksied-sintase, wat op sy beurt basale DA-vlakke behou. Oestrogeen behandelde kastrate toon hoë basale DA vlakke, wat sterk verband hou met die vermoë om kopulasie te begin. Hulle versuim egter om vroulike- en kopulasie-geïnduseerde toenames in DA-vrylating te toon, wat sterk verband hou met seksuele prestasie. Gevolglik is hul seksuele prestasie onder intakte vlakke. Aan die ander kant, kastrate wat behandel word met nie-aromatiseerbare androgeen alleen, toon nie verhoogde basale DA-vlakke nie, en hulle versuim om kopulasie te begin. Vir normale seksuele prestasie word dus beide estrogenen en androgenen vereis. Seksuele prestasie word gewoonlik uitgedruk as frekwensiemaatreëls van bande, intromissies en ejakulasies. Eers wanneer beide oestrogenen en androgenen vervang word, vertoon gekastreerde mannetjies verhoogde DA-vlakke (en korter latere maatreëls) en vroulike- en kopulasie-geïnduceerde DA verhoog (en verhoogde frekwensiemetings). Op hierdie manier dra oestrogenen in MPOA by tot seksuele motivering, en beide oestrogenen en androgene tot seksuele prestasie.
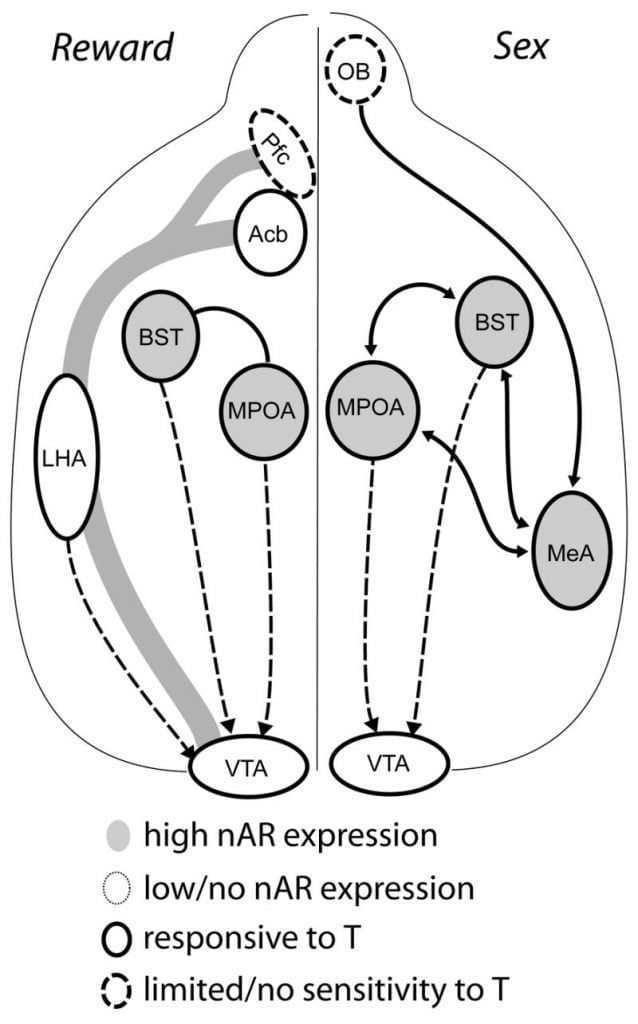
Alhoewel testosteroon nodig is vir MPOA DA vrylating tydens manlike copulatoriese gedrag en vir paring self, kan nie testosteroon of paring alleen DA in MPOA uitlok nie. In plaas daarvan word chemosensoriese leidrade van spesifieke vroue ook benodig vir DA-vrylating in MPOA. In knaagdiere is chemosensoriese stimuli die primêre sensoriese modaliteit om manlike seksuele gedrag te inisieer (Fig 1). Chemosensoriese leidrade word oorgedra vanaf die olfaktoriese bolle na MPOA via die mediale amigdaloid-kern en die bedkern van die stria terminus, strukture met volop AR en ER (Wood en Swann, 1999). Om die rol van chemosensoriese aanwysers in paringgeïnduceerde DA te bepaal, het ons MPOA DA gemeet tydens paring in gonad-intakte manlike hamsters met eensydige olfaktoriese bulbektomie (UBx, Triemstra, Nagatani, en Wood, 2005). Alhoewel bilaterale verwydering van die olfaktoriese bolle seksuele aktiwiteit en MPOA DA vrylating elimineer, versteur unilaterale bulbektomie nie paring nie. In hierdie studie het kopulasie-geïnduseerde MPOA DA-vrystelling gemeet wanneer dit kontralateraal aan die gebrekkige olfaktoriese gloeilamp gemeet is, maar nie in die ipsilaterale halfrond nie (Fig 2). Soortgelyke resultate is waargeneem in manlike rotte met letsels van die mediale amygdala (Dominguez, Riolo, Xu, en Hull, 2001). In 'n verbandhoudende studie het chemiese stimulasie van die mediale amygdala by rotte geïnduceerde MPOA DA-vrystelling gelykstaande aan dié tydens kopulasie (Dominguez en Hull, 2001). Saamgestel, dui hierdie data daarop dat testosteroon 'n permissiewe omgewing skep wat eksterne sensoriese stimuli toelaat om MPOA te bereik en DA-vrylating tydens die samestelling te veroorsaak.

Fig 2
Uiteindelik, seksuele gedrag en ander natuurlike belonings aktiveer neurale beloningspaaie. Die mesokortikolimbiese DA-stroombaan bestaan uit die ventrale tegmentale area (VTA), kernakkapensie (Acb) en prefrontale korteks (Pfc). Dopamien sel liggame woon in die VTA projek rostralies na die Acb en Pfc (Koob en Nestler, 1997). In rotte word DA gedurende die seks in Acb vrygestel (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips, en Fibiger, 1990). Baie dwelmmiddels tree ook op in die mesolimbiese DA-stelsel om DA-vrylating (amfetamines) te verhoog of DA-heropname (kokaïen, Di Chiara en Imperato, 1988), waardeur hulle verslawende eienskappe versterk word. Op hierdie manier het testosteroon die potensiaal om die vrylating van DA in Acb beide te beïnvloed deur middel van die verbetering van seksuele gedrag, en deur sy optrede as 'n dwelmmiddel van misbruik (sien hieronder).
Huidige bewyse dui daarop dat die mesokortikolimbiese DA-stelsel volwasse word tydens adolessensie. Acb DA veseldigtheid dramaties toeneem tydens adolessensie in gerbils, wat daarop dui dat beduidende volwassenheid van VTA dopaminerge projeksies na die akb gedurende die adolessente tydperk plaasvind (Lesting, Neddens, en Teuchert-Noodt, 2005). Verder word dopaminerge toevoer aan GABA (γ-aminosotoorsuur) -ergiese selle in die ratmediale prefrontale korteks verryk en gemoduleer deur serotonergiese stelsels gedurende pubertalontwikkeling (Benes, Taylor, en Cunningham, 2000), en die manipulasie van androgene by volwasse rotte lei tot veranderinge in dopaminerge-aksondigtheid binne prefrontale korteks (Kritzer, 2003). Die Pfc, Acb en die VTA het min AR of ER, hoewel ERβ in die VTA teenwoordig is (Shughrue et al., 1997). Dit is dus waarskynlik dat androgene die mesokortikolimbiese DA-stelsel beïnvloed deur androgeen-sensitiewe afferente of deur ERβ in die VTA soos in hipotalamus (Handa et al., Hierdie uitgawe). Ons data toon dat androgeen sensitiewe selle in manlike hamsters projekteer na die VTA van strukture wat verband hou met steroïed-sensitiewe gedrag. Byvoorbeeld, beide die MPOA en die bedkern van Stria Terminalis (BST) bevat 'n groot aantal AR-positiewe selle wat na die VTA uitsteek (Sato en Wood, 2006). Die ventrale pallidum, die hoof Acb efferente teiken (Zahm en Heimer, 1990) bevat ook baie AR-positiewe selle wat na die VTA uitsteek. Hierdie projeksies bied 'n geleentheid vir androgene om die aktiwiteit van die mesokortikolimbiese DA-stelsel te verander.
Steroïed-afhanklike organisasie van gedrag tydens adolessensie
Die tradisionele siening van hormoonaksie op adolessente gedrag is gebaseer op aktiverende effekte van steroïedhormone, wat verwys na die vermoë van steroïede om gedrag in spesifieke sosiale kontekste te vergemaklik deur aksie binne teikenselle in die neurale stroombane onderliggende gedrag. Aktiveringseffekte is oorgang in die sin dat hulle kom met die teenwoordigheid en afwesigheid van hormone, en hulle word tipies geassosieer met die uitdrukking van volwasse gedrag. In teenstelling verwys organisatoriese effekte na die vermoë van steroïede om die senuweestelselstruktuur tydens ontwikkeling te vorm. Strukturele organisasie is permanent, bly buite die periode van blootstelling aan hormoon, en bepaal neurale en gedragsreaksies op steroïede in volwasse jare. Ons begrip van die ontwikkelingsverhouding tussen organisatoriese en aktiewe effekte van steroïedhormone het gedurende die afgelope 50-jare ontwikkel. Phoenix en kollegas het eers voorgestel dat volwasse gedragsaktiwiteite (reaktiewe) reaksies op steroïedhormone geprogrammeer word (georganiseer) deur steroïedhormone tydens 'n maksimale sensitiewe periode van perinatale ontwikkeling (Phoenix, Goy, Gerall, en Young, 1959). Later het Scott en kollegas die teoretiese grondslag gelê vir die bestaan van veelvuldige sensitiewe periodes vir die progressiewe organisasie van die senuweestelsel, en het opgemerk dat sensitiewe periodes waarskynlik tydens periodes van vinnige ontwikkelingsverandering (1974) voorkom. Daarna het Arnold en Breedlove daarop gewys dat steroïed-afhanklike organisasie van die brein buite sensitiewe ontwikkelingsperiodes kan voorkom (Arnold en Breedlove, 1985). Oor die afgelope 15-jaar het navorsing wat 'n verskeidenheid diermodelle en gedragstelsels gebruik, dit duidelik gemaak dat die adolessente brein sensitief is vir beide aktiverings- en organisasie-effekte van gonadale steroïede (hersien in Sisk en Zehr, 2005). En, soos ander tydperke van vinnige ontwikkelingsverandering, verteenwoordig adolessensie 'n gedefinieerde geleentheidsgeleentheid vir steroïed-afhanklike breinhervorming.
Ons werk met behulp van die hamster as 'n diermodel verskaf bewyse dat manlike sosiale gedrag deur steroïede verander word tydens adolessensie (Schulz, Menard, Smith, Albers, en Sisk, 2006; Schulz en Sisk, 2006). Voor die puberteit kan testosteroonbehandeling nie seksuele gedrag in hamsters aktiveer nie. Dit dui daarop dat maturasieprosesse wat neurale stroombane vatbaar vir aktivering of organisasie deur steroïedhormone, nog nie plaasgevind het nie (Meek et al., 1997; Romeo, Richardson en Sisk, 2002a). Omgekeerd, terwyl die openlike uitdrukking van manlike voortplantingsgedrag in volwassenheid nie absoluut die teenwoordigheid van gonadale steroïede tydens adolessensie vereis nie, is die maksimum uitdrukking van gedrag wel. Deur manlike voortplantingsgedrag te vergelyk by mans wat óf prepubertaal (NoT@P) óf postpubertaal (T@P) gekastreer is en dan in volwassenheid met testosteroon behandel is, het prepubertale NoT@P-kastrate ten minste 'n 50% tekort in manlike gedrag in vergelyking met mans wat na adolessensie gekastreer is (Fig 3, Schulz, Richardson, Zehr, Osetek, Menard, en Sisk, 2004). Daarbenewens is tekorte in voortplantingsgedrag langdurig en kan dit nie oorkom word deur langdurige testosteroonbehandeling of seksuele ondervinding in volwassenheid nie (Schulz et al., 2004). Net so, na behandeling met estrogeen en progesteroon, vertoon NoT@P-mannetjies korter lordose-latensies en langer lordose-duur as mans wat as volwassenes gekastreer is (Schulz et al., 2004), wat daarop dui dat prepubertalkastrate minder gedeminiseer word as die mans wat aan pubertaltestosteroon blootgestel is.

Fig 3
Dit mag wees dat NoT@P-mannetjies aan verminderde seksuele motivering ly. Een manier om hierdie vraag aan te spreek, is om die latensies te vergelyk om betrokke te raak by beide ano-genitale ondersoek (AGI) en opbou tussen mans wat voor (NoT@P) en na puberteit (T@P) gonadektomie is. As seksuele motivering afhanklik is van blootstelling aan gonadale hormoon tydens adolessensie, sou ons langer vertragings voorspel om seksuele gedrag by NoT@P-mans te betrek. Inderdaad, met herhaalde blootstelling aan estrus wyfies, neem NoT@P-mannetjies langer om AGI te begin en op te laai in vergelyking met T@P-mannetjies (Fig 4). Dus, benewens die organisering van aspekte van seksuele prestasie, blyk dit dat puberteithormone ook die lonende aspekte van seksuele gedrag organiseer. Ter ondersteuning van hierdie moontlikheid herstel sentrale toediening van die DA agonis apomorfien in volwassenheid toenemende gedrag van NoT@P mans tot volwasse tipiese vlakke, wat daarop dui dat testosteroon tydens adolessensie normaalweg dopaminerge neurale stroombane organiseer (Salas-Ramirez, Montalto en Sisk, 2006 ). Nietemin bly baie interessante vrae oor. Sou 'n NoT@P manlike barpress vir 'n estrus wyfie of 'n gekondisioneerde plekvoorkeur vir 'n paringsplek ontwikkel? Toekomstige navorsing sal die rol van puberteitshormone in die organisering van seksuele motivering en seksuele prestasie ondersoek.

Fig 4
Anogenitale ondersoek (AGI) latensies en duur vertoon deur manlike hamsters wat voor puberteit (NoT@P) of na puberteit (T@P) gegonadektomiseer is. Alle mans is in volwassenheid 7 weke na gonadektomie en een week voor die eerste gedragstoets met testosteroon voorberei. A. T@P-mannetjies het soortgelyke AGI-latensies oor die drie toetse met 'n estrus-wyfie getoon, terwyl NoT@P-mannetjies AGI-latensies tydens die derde toets met 'n estrus-wyfie verhoog het. B. T@P-mannetjies het bergvertragings oor die drie gedragstoetse met 'n estrus vroulike afgeneem, terwyl nieT@P-mannetjies geen verandering in berglatentie getoon het oor die drie gedragstoetse nie. Hierdie data dui daarop dat pubertale gonadale hormone blywende, fasiliterende effekte het op volwasse manlike motivering om seksuele gedrag met 'n vrou te beoefen. (Ongepubliseerde data van diere proefpersone in Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA en Sisk, CL, 2004).
Prepuberale gedragsreaksies op steroïede
Een van die blywende kopkrapper van adolessente gedragsontwikkeling is waarom aktivering van voortplantingsgedrag in reaksie op steroïedblootstelling in prepubertal-manlike hamsters gedemp word. As lae vlakke androgene voor puberteit die uitdrukking van manlike seksuele gedrag in prepubertal mans beperk, moet die aanvulling van endogene androgene in prepubertal mans die paring oplewer. Dit blyk nie die geval te wees nie (Meek et al., 1997; Romeo, Cook-Wiens, Richardson, en Sisk, 2001; Romeo, Wagner, Jansen, Diedrich en Sisk, 2002b), ten spyte van die feit dat die aantal en verspreiding van AR en ER dwarsdeur die paringskring soortgelyk is aan hormoonbehandelde prepubertal en volwasse kastratore (Meek et al., 1997; Romeo, Diedrich en Sisk, 1999; Romeo et al., 2002a). Daarom blyk dit dat androgene en AR nodig is maar nie voldoende is vir die uitdrukking van manlike seksuele gedrag nie.
Pogings om faktore te identifiseer wat seksuele aktiwiteit voor puberteit beperk, is tot dusver gemeng. Fos reaksies op chemosensoriese leidrade van estrouse vroue is soortgelyk aan prepubertal en volwasse manlike hamsters (Romeo, Parfitt, Richardson, en Sisk, 1998). Hierdie data toon dat sensoriese transduksie meganismes volwasse is voor puberteit. So, jong mans kan chemosensoriese leidrade opspoor van vroue; waar hulle verskil van volwassenes, is in hoe hulle op die leidrade reageer. Een moontlike verduideliking is dat prepubertal mans nie gemotiveer word om seksuele gedrag te betrek nie. Ons het bevind dat prepubertal manlike hamsters nie meer dopaminerge response in die MPOA toon as gevolg van vroulike feromone nie, terwyl seksueel-naïewe volwasse mans robuuste MPOA-dopaminerge response aan dieselfde stimuli vertoon (Fig 5, Schulz, Richardson, Romeo, Morris, Lookingland, en Sisk, 2003). Net so, prepubertal mannetjies versuim om die volwasse-tipiese toename in sirkulerende testosteroon te toon na blootstelling aan vroulike feromone (Parfitt, Thompson, Richardson, Romeo en Sisk, 1999). Vroulike feromone blyk dus 'n onvoorsiene stimulus vir neurochemiese en neuro-endokriene response in volwasse, maar nie prepuberale mans te wees nie. Dit dui daarop dat die sielkunde van hierdie sosiaal-relevante sensoriese stimuli verander oor puberteitontwikkeling, moontlik in verband met die verkryging van belonende eienskappe en seksuele motivering. Daarbenewens, hoewel testosteroon die AGI van 'n vroulike vrou in prepubertal mans fasiliteer, hang hierdie effek af van of die manlike vorige blootstelling aan 'n estrouse vrou gehad het. Miskien verrassend verminder testosteroonbehandeling die vertraging en verhoog die duur van AGI slegs by seksueel-naïewe prepubertal mans (Fig 6). Verder het prepubertal mannetjies wat een vorige ervaring met 'n vroulike vertoning gehad het, baie langer AGI-laatstande en korter AGI-duur as mans wat vir die eerste keer met ontvanklike vroue interaksie het (Fig 6). Hierdie data dui daarop dat interaksies met 'n estrouse vroulike afkeer eerder as beloning voor puberteit is, en sodoende enige fasiliterende effekte van testosteroon op AGI tydens die daaropvolgende interaksies met 'n vroulike vrou uitskakel. Dit sal interessant wees om te weet of die negatiewe gedragsgevolge van vroeë blootstelling aan 'n estrouse vroulike volhard in adolessensie en volwassenheid, veral aangesien herhaalde blootstelling aan estrouse vroue tydens adolessensie fasiliteer gewoonlik die uitdrukking van manlike voortplantingsgedrag (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto en Sisk, 2007).

Fig 5
Prepuberale en volwasse manlike mediale preoptiese area (MPOA) dopaminerge reaksies op vroulike feromone wat in vaginale afskeidings voorkom. Volwasse mans toon toenames in MPOA dopaminerge aktiwiteit met blootstelling aan vroulike vaginale afskeidings, terwyl prepubertal mans nie verhoogde MPOA-dopaminerge response op vroulike feromone vertoon nie. (Redrawn from Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Soekland, KJ, en Sisk, CL, 2003).

Alhoewel prepubertal androgenbehandeling nie copulasie kan veroorsaak nie, dui onlangse werk uit ons laboratorium daarop dat die hamster se senuweestelsel sensitief is vir die organiserende aksies van testosteroon op reproduktiewe gedrag voor adolessensie (Schulz, Zehr, Salas-Ramirez en Sisk, 2007). Castrasie plus 19 dae van testosteroon blootstelling voor of tydens, maar nie na adolessensie fasiliteer toenemende gedrag toe testosteroon in volwassenheid vervang is nie. Mans wat vir testosteroon blootgestel is, het ook meer intromissies in volwassenheid getoon as mans wat tydens testament of tydens puberteit blootgestel is (Schulz et al., 2007). Hierdie data dui daarop dat die vermoë van testosteroon om gedrags neurale stroombane te organiseer afneem met ouderdom, en dat adolessensie die einde van 'n uitgerekte postnatale sensitiewe periode vir blootstelling aan testosteroon aandui.
Farmakologiese androgenen
Die voorafgaande data dui daarop dat endogene gonadale steroïede gemotiveerde gedrag tydens adolessensie verbeter. Nou, wat gebeur as 'n mens self-toedienings op vlakke tot 100x normale fisiologiese konsentrasies beheer? Dit is die probleem van anaboliese-androgeen steroïde (AAS) misbruik (hersien in Brower, 2002; Clark en Henderson, 2003). 'N Kort afwyking is hier toepaslik: alle AAS is afgeleides van testosteroon, al die AAS het 'n koolstofskelet met 4-gesmelte ringe, waarvan die meeste 19-koolstowwe het. AAS word hoofsaaklik gebruik vir hul anaboliese (spierbou-effekte). Soos hulle naam aandui, het AAS egter ook androgeen eienskappe. Testosteroon is 'n logiese keuse in dierlike studies om fundamentele meganismes van androgeenbeloning te ondersoek. Dit bly ook 'n gewilde keuse vir menslike gebruikers, meestal in die vorm van langwerkende testosteroon esters soos testosteroon propionaat. In 2006 was testosteroon die enkele mees algemene verbode middel wat in urine toetse by WADA-geakkrediteerde laboratoriums aangetref is (WADA, 2006). Testosteroon verantwoordelik vir die grootste breuk (34%) van AAS-positiewe urinetoetse by die 2000 Sydney Olimpiese Spele (Van Eenoo en Delbeke, 2003). Net so, in urine toetse van AAS gebruikers, 41% positief getoets vir testosteroon (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). By hoë dosisse produseer AAS beduidende gedragsveranderings. In die besonder, as gevolg van hul noue verhouding met testosteroon, sal die AAS-gebruik in die tienerjare voorkom dat die normale steroïedmilieu van die ontwikkelende menslike adolessente senuweestelsel versteur word, insluitend die hoeveelheid, tydsberekening en tipe steroïed blootstelling.
Soos met ander onwettige dwelms, is menslike AAS-misbruik 'n probleem van adolessensie. Volgens die 1994 Nasionale Huishoudelike Opname oor Dwelmgebruik (SAMHSA / OAS, 1996), steroïed gebruik pieke in die laat adolessensie by 18 jaar. Verder, in die Monitoring the Future-opname (Johnston, O'Malley en Bachman, 2003), was die leeftyd voorkoms van steroïedgebruik onder hoërskoolseerlinge (2.7%) vergelykbaar met dié van kraakkokaïen (3.5%) of heroïen (1.4%). Steroïedgebruik word ook toenemend algemeen op jonger ouderdomme: 2.5% van 8-graadstudente (13-14-jare) het steroïede gebruik, soortgelyk aan die voorkoms van krake (2.5%) en heroïengebruik (1.6%). Hierdie tendens teenoor AAS-gebruik in vroeë tienerjare is veral bekommerd in die lig van bekommernisse 1) dat adolessente besonder kwesbaar kan wees vir die misbruik van AAS en 2) dat adolessente blootstelling aan AAS op farmakologiese vlakke die potensiaal het om die normale veroudering van brein en gedrag om oordrewe morfologiese en gedragsreaksies, akuut en kronies te produseer.
Onvanpaste aggressie is die gedragsreaksie wat dikwels verband hou met menslike AAS-misbruik. In gepubliseerde gevalverslae is steroïedgebruik in verskeie gewelddadige moorde betrokke (Conacher en Workman, 1989; Pous en Katz, 1990; Pous, Kouri, Powell, Campbell, en Katz, 1996; Schulte, Hall en Boyer, 1993). In opnames van huidige AAS-gebruikers was verhoogde aggressie en geïrriteerdheid die algemeenste gedragseffekte van AAS-gebruik (Bond, Choi en Pous, 1995; Galligani, Renck, en Hansen, 1996; Midgley, Heather, en Davies, 2001; Parrott, Choi en Davies, 1994; Perry, Kutscher, Lund, Yates, Holman, en Demers, 2003). As gevolg van die verskeidenheid androgeen blootstelling, die verskeidenheid psigiatriese simptome en die potensiaal vir vooraf bestaande psigiatriese disfunksie, is dit egter moeilik om die presiese rol van AAS in hierdie gevalle van menslike aggressie te bepaal. Resultate van voornemende studies van menslike vrywilligers wat inspuitings van AAS ontvang het, is gemeng: Tricker et al (1996) en O'Connor et al (2004) gerapporteer geen toenames in kwaad gedrag, terwyl ander studies verhoogde aggressie waargeneem het (Daly, Su, Schmidt, Pickar, Murphy, en Rubinow, 2001; Hannan, Friedl, Zold, Kettler, en Plymate, 1991; Kouri, Lukas, Pous, en Oliva, 1995; Pous en Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz, en Rubinow, 1993). Desalniettemin is dit belangrik om in gedagte te hou dat die dosisse wat toegedien word aan menslike vrywilligers baie laer is as die dosisse wat op webwerwe vir die bou van liggame voorgestel word, en die duur van behandeling is oor die algemeen kort. In balans blyk dit dus regverdig dat die AAS die potensiaal het om agonistiese gedrag te verbeter, ten minste in vatbare individue. Pous et al (1994) bevind dat die AAS psigiatriese simptome in kwesbare individue ontlok.
Diere studies het ook dwingende bewyse vir AAS-geïnduseerde aggressie verskaf. Adolessente manlike hamsters wat chronies behandel word met hoë dosis steroïede het korter aanvallevertye en 'n groter aantal aanvalle en byt tot 'n manlike indringer in vergelyking met onbehandelde mans (Harrison, Connor, Nowak, Nash en Melloni, 2000; Melloni, Connor, Hang, Harrison, en Ferris, 1997). Net so, 'n sagte provokasie (stertknyp) lewer 'n aanhoudende toename in aggressie by adolessente manlike rotte, insluitende aggressie teenoor vroue (Cunningham en McGinnis, 2006). Van selfs groter kommer, veroorsaak adolessente blootstelling aan AAS in hamsters blywende toenames in agonistiese gedrag wat voortduur nadat steroïedgebruik gestaak is (Grimes en Melloni, 2006). Hierdie gedragsveranderings word vergesel deur die permanente hermodellering van neurale stroombane in die anterior hipotalamus. In die besonder, adolessente AAS blootstelling in hamsters verhoog arginien vasopressien (AVP, Grimes en Melloni, 2006) en verminder serotonien en die serotonergiese 5HT1A- en 5HT1B-reseptore (Ricci, Rasakham, Grimes, en Melloni, 2006). Dit behoort nie so verrassend te wees dat AAS ook breinvlakke van AR verander nie. Chroniese blootstelling aan testosteroon of nandrolone opreguleer sel-kern AR in manlike rotte (Menard en Harlan, 1993; Wesson en McGinnis, 2006). Daar is dus die potensiaal vir AAS om androgeenafhanklike gedrag te verbeter deur beide endogene androgene aan te vul en om androgeen responsiwiteit te verhoog via verhoogde AR-uitdrukking.
In vergelyking met agonistiese gedrag, het AAS minder gemerkte effek op paringsgedrag by manlike knaagdiere, en die respons hang af van die spesifieke steroïed wat gebruik word (hersien in Clark en Henderson, 2003). In manlike hamsters wat testosteroon in orale oplossings gebruik het, het ejakulasies op 'n dosis afhanklike wyse toegeneem (Wood, 2002). Egter nie testosteroon of nandroloon verbeter paring in adolessente manlike rotte nie. Stanozolol, 'n relatief minder kragtige AAS met minimale androgeniese aktiwiteit, het eintlik beide paring en aggressie (Farrell en McGinnis, 2003) geïmmiteer, vermoedelik deur die vermindering van endogene androgeenvlakke.
Dit is veral belangrik om daarop te let dat adolessente en volwasse hamsters verskillende gedragsresponse kan toon op AAS-blootstelling. Terwyl AAS die agonistiese gedrag in adolessente mans aansienlik verbeter het, het dieselfde behandeling in volwassenheid slegs 'n beskeie toename in aggressiewe gedrag en aansienlik verminderde seksuele gedrag (Salas-Ramirez, Montaldo en Sisk, 2008). Dit is in ooreenstemming met die konsep van adolessensie as 'n sensitiewe periode vir androgeen-aksie. Verder, net soos volwasse manlike hamsters verdraagsaamheid verkry teen eksogene testosteroon (Peters en Wood, 2005), glo ons dat die ontwikkeling van mans verdraagsaamheid teenoor testosteroon verkry soos wat hulle volwasse is. Dus, die effekte van AAS verander oor adolessente ontwikkeling, en adolessente AAS-blootstelling kan oormatige aggressiewe en seksuele gedragspatrone veroorsaak wat tot volwassenheid kan voortduur.
Versterkende effekte van androgenen
Paring en veg is elkeen beloonend (ten minste as jy die stryd wen). Manlike rotte sal herhaaldelik 'n hefboom druk om met 'n wyfie te kopieer (Everitt en Stacey, 1987). Net so sal manlike muise en vroulike hamsters 'n gekondisioneerde plekvoorkeur (CPP) vorm vir plekke waar hulle voorheen gevegte gewen het (Martinez, Guillen-Salazar, Salvador, en Simon, 1995; Meisel en Joppe, 1994). As AAS verrykende sosiale gedrag kan verbeter bokant vlakke wat normaalweg waargeneem word in gonad-intacte mans, is dit logies om te verwag dat testosteroon self lonend kan wees. Dit is getoets deur twee goed gevestigde diermodelle vir beloning en versterking: CPP en selfadministrasie. Die resultate van hierdie studies toon dat testosteroon versterk in 'n eksperimentele konteks waar anaboliese effekte en atletiese prestasie irrelevant is. Met CPP word die toetsstof herhaaldelik gepaard met 'n unieke omgewing (byvoorbeeld 'n spesifieke kamer in die toetsapparaat). Sodra die dier die versterkende toetsstof met daardie omgewing assosieer, sal hy die omgewing selfs in die afwesigheid van beloning soek. Die eerste verslae van androgeenbeloning in laboratoriumdiere het sistemiese inspuitings van testosteroon gebruik om CPP in manlike muise te veroorsaak (Arnedo, Salvador, Martinez-Sanchis, en Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis, en Pellicer, 2002) en rotte (Alexander, Packard en Hines, 1994; de Beun, Jansen, Slangen, en Van de Poll, 1992). Daarna het ons laboratorium self-administrasie van testosteroon gebruik om androgeen versterking te demonstreer (Johnson en Wood, 2001). Ons het bevind dat manlike hamsters vrywillig mondelinge oplossings van testosteroon sal gebruik deur gebruik te maak van beide 2-bottel keusetoetse en voedselgeïnduceerde drink. In latere studies het ons iv selfadministrasie in manlike rotte en hamsters gedemonstreer (Wood, Johnson, Chu, Schad, and Self, 2004). Intraveneuse lewering elimineer potensiële verwarrende effekte van smaak of dermvulling op androgeen inname.
In die konteks van AAS-misbruik is dit belangrik om te onderskei tussen sentrale en perifere effekte van androgenen. Aangesien testosteroon wydverspreide effekte regdeur die liggaam het, kan aangevoer word dat beloning en versterking met sistemiese testosteroon inspuitings sekondêr is aan testosteroon se sistemiese anaboliese en androgeenaktiwiteite. Met ander woorde, testosteroon verminder spiervermoeidheid en verbeter gesamentlike funksie sodat diere net voel beter. Inderdaad, hierdie verduideliking is in die kliniese literatuur gebruik (alhoewel sonder eksperimentele bewyse) om te argumenteer teen die potensiaal vir afhanklikheid en verslawing aan AAS (DiPasquale, 1998). Packard et al (Packard, Cornell, en Alexander, 1997) het getoon dat inspuitings van testosteroon direk in die rotbrein CPP kan veroorsaak. Net so, ons laboratorium het getoon intracerebroventricular (icv) testosteroon self-administrasie in manlike hamsters (Wood et al., 2004). Intracerebrale CPP en ICV selfadministrasie met testosteroon argumenteer vir sentrale teikens wat meditasie van androgeen versterking bevorder.
Dit is opmerklik dat testosteroon versterking nie noodwendig dieselfde meganismes volg wat vroeër vir steroïde-effekte op seksuele gedrag ingestel is nie. Soos voorheen bespreek, is die MPOA 'n sleutelblad vir die organisasie van manlike knaagdier seksuele gedrag (Hull, Meisel, en Sachs, 2002). In hamsters het die MPOA oorvloedige steroïed-reseptore, en testosteroon-inplantings in MPOA herstel seksuele aktiwiteit in langtermyn-kastrate (Wood en Swann, 1999). Die tydsverloop van hierdie steroïde-effekte is stadig: monitering gedrag bly weke na orkidektomie, en verlengde steroïedblootstelling is nodig om paring in langtermynkastrate te herstel (Noble en Alsum, 1975). Inspuitings van testosteroon in MPOA van manlike rotte versuim egter om CPP te veroorsaak (King, Packard, en Alexander, 1999). Dit dui daarop dat ander breinstreke belangrik is vir androgeen versterking.
In teenstelling hiermee sal manlike rotte 'n CPP vorm vir testosteroon inspuitings in Acb (Packard et al., 1997). Soos met ander dwelmmiddels, sal DA waarskynlik 'n belangrike neurotransmitter wees vir testosteroon versterking: CPP geïnduceerd deur sistemiese testosteroon inspuiting word geblokkeer deur D1 en D2 dopamien reseptor antagoniste (Schroeder en Packard, 2000). In teenstelling met ander dwelmmiddels, stel ons studies in hamsters egter voor dat testosteroon nie Acb DA vrylating veroorsaak nie (Triemstra, Sato en Wood, in pers). Net so toon studies van manlike rotte dat androgene geen effek op basale DA-vlakke of amfetamien-gestimuleerde DA-vrystelling het nie (Birgner, Kindlundh-Hogberg, Nyberg, en Bergstrom, 2006; maar sien ook Clark, Lindenfeld, en Gibbons, 1996). Verder het testosteroon 'n relatief klein invloed op Acb DA weefselvlakke (Thiblin, Finn, Ross, en Stenfors, 1999). Saam, hierdie data dui daarop dat hoewel testosteroon versterking uiteindelik kan verander DA aktiwiteit in Acb, die meganismes kan verskil van dié van kokaïen of ander stimulante. In hierdie verband dui onlangse data daarop dat chroniese blootstelling aan AAS die sensitiwiteit vir DA kan verander deur die DA metabolisme te verander (Kurling, Kankaanpaa, Ellermaa, Karila, en Seppala, 2005), vlakke van DA-reseptore (Kindlundh, Lindblom, Bergstrom, Wikberg, en Nyberg, 2001; Kindlundh, Lindblom, en Nyberg, 2003) of die DA-vervoerder (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom, en Nyberg, 2002).
Op die oomblik is die spesifieke steroïde seine, reseptore en brein terreine van aksie vir testosteroon versterking onbekend. Op grond van 'n onlangse studie van hamsters uit ons laboratorium blyk die versterkende effekte van testosteroon bemiddel te word deur beide androgenen en oestrogenen (DiMeo en Wood, 2006). Algemene misbruikte AAS sluit in beide aromatiseerbare en nie-aromatiseerbare androgeen (Gallaway, 1997; WADA, 2006). Dit impliseer dat beide AR en ER steroïdale stimuli vir beloning kan oordra. Daar is die bykomende moontlikheid dat testosteroon versterking bemiddel kan word deur 'n kombinasie van klassieke en nie-genomiese reseptore.
Verskeie bewyse dui op die werking van nie-genomiese reseptore in die versterkende effekte van AAS. Benewens die yl verspreiding van AR in Acb en VTA, is die tydsverloop van androgeenversterking vinnig (<30 min), en seinverwerking deur klassieke AR is miskien nie vinnig genoeg vir versterking nie. Gevolglik het ons twee aanvullende tegnieke gebruik om die rol van nie-genomiese AR in AAS-versterking te toets (Fig 7). In een eksperiment (Sato, Johansen, Jordanië en Wood, 2006), het ons rotte toegelaat met die testikulêre feminisering mutasie (Tfm, sien hierdie uitgawe) om selfhidrotestosteroon (DHT), 'n nie-aromatiseerbare androgeen, te administreer. Die Tfm mutasie verminder grootliks ligand binding by AR. Nietemin, Tfm rotte en hul wilde-tipe manlike broers en susters self geadministreer ongeveer dieselfde hoeveelheid DHT. Dit argumenteer vir nie-genomiese effekte van DHT. In 'n daaropvolgende studie het ons vasgestel of manlike hamsters selfbeheerde DHT konvervoeg na bees serumalbumine (BSA, Fig 8, Sato en Wood, 2007). DHT-BSA-verbindings is membraan-ondeurdringbaar; dus is hul effekte beperk tot die seloppervlak. Hamsters self-geadministreerde DHT, soos voorheen gedemonstreer (DiMeo en Wood, 2006). Hulle het 'n soortgelyke voorkeur vir DHT-BSA-verbindings getoon, maar het nie BSA alleen self toegedien nie.

Fig 7

Fig 8
Hierdie data dui op 'n sentrale rol vir sel-oppervlak-AR's in androgeen versterking. Tans is die presiese aard van sulke reseptore nie bekend nie. Daar is voorgestel dat androgene by die seloppervlak kan optree deur bindend aan toegewyde membraan AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff en Doughty, 2006, sien ook hierdie probleem). Dit kan wees in die vorm van ekstra-kern klassieke AR soos gerapporteer in hippokampus (Sarkey et al., In hierdie uitgawe). Alternatiewelik, het vorige studies ook steroïedbindende terreine op ander neurotransmitterstelsels beskryf. Spesifiek, 'n verskeidenheid steroïedhormone, insluitend AAS, kan die GABA-A-reseptor (AOR) allosteries moduleer (Henderson, 2007; Lambert, Belelli, Peden, Vardy, en Peters, 2003). Net so kan gesulfateerde neurosteroïede aktiwiteit van N-methyl-D-aspartaat-reseptor subtipes (Malayev, Gibbs, en Farb, 2002) reseptore. Dit is 'n belangrike gebied vir toekomstige navorsing.
Hoekom moet daar 'n membraan AR wees? Soos voorheen bespreek, is daar 'n noue assosiasie tussen androgeenafskeiding en lonende sosiale gedrag. Ons kan bespiegel dat die toename in testosteroon afskeiding wat volg paring of veg dien om die gedrag te versterk. Indien wel, is dit nodig om 'n vinnige koppeling van stimulus (gedrag) en beloning (testosteroon) te hê. Dit kan die beste bereik word deur bindend aan membraan AR. In hierdie verband sal dit van belang wees om vas te stel of klem enrogeenafskeiding tydens paring die lonende effekte van seksuele gedrag verminder.
Opsomming
Hier hersien ons die bewyse dat androgene kragtige bemiddelaars is van volwasse gemotiveerde gedrag, en verder dat die tydsberekening van androgeenblootstelling tydens ontwikkelingsprogramme androgeenafhanklike gemotiveerde gedrag in volwassenheid. Anaboliese steroïede word vinnig 'n begunstigde dwelmmisbruik van adolessente in die VSA. Terwyl AAS nie die verslawende sterkte van kokaïen of heroïen het nie, begin ons eers die potensiaal vir androgeen versterking en verslawing te verstaan. In die besonder, aangesien jeugsport meer mededingend word, is daar toenemende druk op die ontwikkeling van atlete om steroïede te gebruik, wat begin met jonger jare. Hierdie tendens is ontstellend in die lig van nuwe bewyse vir steroïed-sensitiewe neurale volwassenheid by adolessente.
Ten spyte van toenemende bewustheid deur beide die openbare en wetenskaplike gemeenskappe van die diepgaande neurale veranderinge wat adolessensie vergesel, is eksperimentele studie van die ontwikkelingsneurobiologie van puberteit beperk. Diere modelle van adolessente ontwikkeling is nodig om te ondersoek hoe die tydsberekening van hormoon blootstelling tydens ontwikkeling die risiko van 'n individu vir psigopatologie en dwelmgebruik verhoog en watter soort ervarings die gedragseffekte van afwykings in puberteit tydsberekening versag of versterk. Byvoorbeeld, sosiale faktore soos peer-invloed vererger die gevolge van puberteit tydsberekening vir die gebruik van die stof en alkohol (Biehl, Natsuaki, en Ge, 2007; Patton, Novy, Lee, en Hickok, 2004; Simons-Morton en Haynie, 2003; Wichstrom en Pedersen, 2001). Diere modelle van puberteit tydsberekening sal ook menslike navorsingspogings inlig, en kan moontlik lei tot doeltreffender terapeutiese intervensies tydens adolessensie.
Erkennings
Ons bedank Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers en Pamela Montalto vir hulp met hierdie studies. Hierdie werk word ondersteun deur toekennings van die NIH (DA12843 tot RIW, MH68764 tot CLS, en MH070125 na KMS).
voetnote
Disclaimer van die uitgewer: Hierdie is 'n PDF-lêer van 'n ongeredigeerde manuskrip wat aanvaar is vir publikasie. As 'n diens aan ons kliënte voorsien ons hierdie vroeë weergawe van die manuskrip. Die manuskrip sal kopieëring, tikwerk en hersiening van die gevolglike bewys ondergaan voordat dit in sy finale citable vorm gepubliseer word. Let asseblief daarop dat tydens die produksieproses foute ontdek kan word wat die inhoud kan beïnvloed, en alle wettige disklaimers wat van toepassing is op die tydskrif betrekking het.
Verwysings
- Alexander GM, Packard MG, Hines M. Testosteroon het belewende affektiewe eienskappe in manlike rotte: implikasies vir die biologiese basis van seksuele motivering. Gedragswetenskappe. 1994;108: 424-8. [PubMed]
- Andersen SL. Bane van breinontwikkeling: punt van kwesbaarheid of geleentheidsgeleentheid? Neurowetenskap en biogedragsresensies. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Seksverskille in dopamienreseptor oorproduksie en eliminasie. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Belonende eienskappe van testosteroon in intakte manlike muise: 'n loodsstudie. Farmakologie, biochemie en gedrag. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Soortgelyke lonende effekte van testosteroon by muise wat as kort en lang aanvalle vertraagde individue beskou word. Addiction Biology. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Organisatoriese en aktiewe effekte van sekssteroïede op brein en gedrag: 'n heranalise. Hormone en gedrag. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Konvergensie en plastisiteit van mono-aminergiese stelsels in die mediale prefrontale korteks tydens die postnatale periode: implikasies vir die ontwikkeling van psigopatologie. Serebrale korteks. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Mylinering van 'n belangrike relaisone in die hippocampale vorming vind plaas in die menslike brein gedurende die kinderjare, adolessensie en volwassenheid. Argiewe van Algemene Psigiatrie. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Die invloed van puberteit tydsberekening op alkoholgebruik en swaar drinkbane. Joernaal van Jeug en Adolessensie. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Neuroscience Letters. 2006. Veranderde ekstrasellulêre vlakke van DOPAC en HVA in die ratkern-accumbens-dop in reaksie op subchroniese nandroloon-toediening en 'n daaropvolgende amfetamien-uitdaging.
- Bond AJ, Choi PY, Pous HG., Jr. Assessering van aanduidende vooroordeel en bui in gebruikers en nie-gebruikers van anaboliese enrogeniese steroïede. Afhanklikheid van dwelms en alkohol. 1995;37: 241-5. [PubMed]
- Brower KJ. Anaboliese steroïedmisbruik en afhanklikheid. Huidige Psigiatrie Verslae. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Kliniese assessering en urien toetsing vir anaboliese-androgeniese steroïedmisbruik en afhanklikheid. Amerikaanse tydskrif vir dwelm- en drankmisbruik. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Steroïedmetabolisme in die soogdierbrein: 5alpha-reduksie en aromatisering. Breinnavorsingsbulletin. 1997;44: 365-75. [PubMed]
- Chung Wc, De Vries GJ, Swaab DF. Seksuele differensiasie van die bedkern van die stria terminus by mense kan tot volwassenheid strek. Blaar van Neurowetenskap. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Gedrags- en fisiologiese reaksies op anaboliese-androgene steroïede. Neurowetenskap en biogedragsresensies. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Anaboliese-androgene steroïede en breinbeloning. Farmakologie, biochemie en gedrag. 1996;53: 741-5.
- Conacher GN, Workman DG. Gewelddadige misdaad wat moontlik met anaboliese steroïedgebruik geassosieer word. Amerikaanse Tydskrif vir Psigiatrie. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Fisiese provokasie van pubertal anaboliese androgeniese steroïed blootgestelde manlike rotte veroorsaak aggressie teenoor vroue. Hormone en gedrag. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Serebrospinale vloeistof en gedragsveranderinge na metielstestosteroonadministrasie: voorlopige bevindinge. Argiewe van Algemene Psigiatrie. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Strukturele seksuele dimorfismes in die anteroventrale periventrikulêre kern van die rat-hipotalamus is perinataal sensitief vir gonadale steroïede, maar ontwikkel peripubertaal. Neuro-endokrinologie. 1996;63: 142-8. [PubMed]
- die Beun R, Jansen E, Slangen JL, Van die Poll NE. Testosteroon as aptyt en diskriminerende stimulus by rotte: seks- en dosisafhanklike effekte. Fisiologie en gedrag. 1992;52: 629-34. [PubMed]
- Dekaban AS. Veranderinge in breingewigte gedurende die span van die menslike lewe: verhouding van breingewigte tot liggaamshoogtes en liggaamsgewigte. Annale van Neurologie. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Geneesmiddels wat deur mense misbruik word, verhoog die sinaptiese dopamien konsentrasies in die mesolimbiese stelsel van vrybewegende rotte. Verrigtinge van die Nasionale Akademie van Wetenskappe van die Verenigde State van Amerika. 1988;85: 5274-8. [PMC gratis artikel] [PubMed]
- DiMeo AN, Wood RI. Selfadministrasie van estrogeen en dihidrotestosteroon in manlike hamsters. Hormone en gedrag. 2006;49: 519-26. [PubMed]
- DiPasquale M. Anaboliese Steroïede. In: Tarter RE, Ammerman RT, Ott PJ, redakteurs. Handboek van Middelmisbruik. Plenum Press; NY: 1998. pp. 547-565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Regulering deur die mediale amygdala van kopulasie en mediale preoptiese dopamien vrystelling. Blaar van Neurowetenskap. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stimulering van die mediale amygdala verhoog mediale preoptiese dopamien vrystelling: implikasies vir manlike rotse seksuele gedrag. Breinnavorsing. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastrasie verminder ekstrasellulêre, maar verhoog intrasellulêre, dopamien in mediale preoptiese area van manlike rotte. Breinnavorsing. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Aard en lot van proliferatiewe selle in die hippocampale dentate gyrus gedurende die lewensduur van die rhesus aap. Blaar van Neurowetenskap. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Studies van instrumentale gedrag met seksuele versterking in manlike rotte (Rattus norvegicus): II. Effekte van preoptiese area letsels, kastrasie, en testosteroon. Tydskrif van Vergelykende Sielkunde. 1987;101: 407-19. [PubMed]
- Gallaway S. Die Steroïde Bybel. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Persoonlikheidsprofiel van mans wat anaboliese androgeen steroïede gebruik. Hormone en gedrag. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Langdurige veranderinge in die serotoniene neurale stelsel na aanleiding van die staking van adolessente anaboliese enrogeniese steroïed blootstelling in hamsters (Mesocricetus auratus) Gedragswetenskappe. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Sielkundige en serum homovanilliese suur verander in mans wat androgeen steroïede toegedien het. Psychoneuroendocrinology. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr Chroniese anaboliese enrogeniese steroïedbehandeling tydens adolessensie verhoog anterior hipotalamiese vasopressien en aggressie in intakte hamsters. Psychoneuroendocrinology. 2000;25: 317-38. [PubMed]
- Hy J, Spanne FT. Neurogenese verminder tydens breinveroudering vanaf adolessensie tot volwassenheid. Farmakologie, biochemie en gedrag. 2007;86: 327-33.
- Henderson LP. Steroïedmodulasie van GABAA-reseptor-gemedieerde oordrag in die hipotalamus: effekte op reproduktiewe funksie. Neuro Farmacologie. 2007;52: 1439-53. [PMC gratis artikel] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Ekstracellulêre dopamien in die mediale preoptiese area: implikasies vir seksuele motivering en hormonale beheer van kopulasie. Blaar van Neurowetenskap. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Manlike seksuele gedrag. In: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, redakteurs. Hormone, Brein en Gedrag. Akademiese Pers; New York: 2002. pp. 3-137.
- Hull EM, Wood RI, McKenna KE. Neurobiologie van manlike seksuele gedrag. In: Neill JD, redakteur. Fisiologie van Reproduksie. Vol. 1. Elsevier Press; New York: 2006. pp. 1729-1824.
- Huttenlocher PR, Dabholkar AS. Streekverskille in sinaptogenese in menslike serebrale korteks. Tydskrif van vergelykende neurologie. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Mondelinge testosteroon selfadministrasie in manlike hamsters. Neuro-endokrinologie. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Sekondêre studente (NIH Publikasie No. 03-5375) I. Bethesda, MD: Nasionale Instituut vir Dwelmmisbruik; 2003. Monitering van die Toekoms-opname resultate oor dwelmgebruik, 1975-2002.
- Kaiser Familie Stigting. VSA teen seksuele aktiwiteit. 2005. pp. # 3040-02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulering van immuunreaktiwiteit van brein androgeen reseptore deur androgeen in prepubertal manlike frette. Biologie van Reproduksie. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminerge effekte na chroniese behandeling met nandrolone wat in rotbrein in die positronemissie-tomografie gevisualiseer word. Vordering in neuropsychofarmakologie en biologiese psigiatrie. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Die anaboliese-androgeniese steroïed-nandroloondekaanoaat beïnvloed die digtheid van dopamienreseptore in die manlike rotbrein. Europese Tydskrif vir Neurowetenschappen. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Chroniese toediening met nandroloondekaanoaat veroorsaak veranderinge in die geen-transkripsie-inhoud van dopamien D (1) - en D (2) -receptore in die rotbrein. Breinnavorsing. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Affektiewe eienskappe van intra-mediale preoptiese area inspuitings van testosteroon in manlike rotte. Neuroscience Letters. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Die neurobiologie van dwelmverslawing. Tydskrif vir neuropsigiatrie en kliniese neurowetenskappe. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Pous HG, Jr, Oliva PS. Toenemende aggressiewe reaksie in manlike vrywilligers na aanleiding van die toediening van geleidelik toenemende dosisse testosteroon-cypionaat. Afhanklikheid van dwelms en alkohol. 1995;40: 73-9. [PubMed]
- Kritzer MF. Langdurige gonadektomie beïnvloed die digtheid van tyrosienhidroksilase- maar nie dopamien-beta-hidroksilase-, cholienasetransferase- of serotonienimmunoreaktiewe aksone in die mediale prefrontale kortikale van volwasse manlike rotte nie. Serebrale korteks. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Die effek van subchroniese nandroloondekaanoaatbehandeling op dopaminerge en serotonergiese neuronale stelsels in die brein van rotte. Breinnavorsing. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Neurosteroïed modulasie van GABAA reseptore. Vordering in Neurobiologie. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Breinontwikkeling by kinders en adolessente: insigte uit anatomiese magnetiese resonansiebeeldvorming. Neurowetenskap en biogedragsoorsig. 2006;30: 718-29.
- Lesing J, Neddens J, Teuchert-Noodt G. Ontogenie van die dopamien-innervering in die nukleusbolletjies van gerbils. Breinnavorsing. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Inhibisie van die NMDA-respons deur pregnenolonsulfaat onthul selektiewe modulering van NMDA-reseptore deur subtipe deur gesulfateerde steroïede. Britse Tydskrif van Farmakologie. 2002;135: 901-9. [PMC gratis artikel] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Suksesvolle intermale aggressie en gekondisioneerde plekvoorkeur in muise. Fisiologie en gedrag. 1995;58: 323-8. [PubMed]
- Sagte LR, Romeo RD, Novak CM, Sisk CL. Aksies van testosteroon in prepubertal en postpubertal manlike hamsters: dissosiasie van effekte op reproduktiewe gedrag en immunoreaktiwiteit van brein androgeen reseptore. Hormone en gedrag. 1997;31: 75-88.
- Meisel RL, Joppa MA. Voorbeelde plek voorkeur in vroulike hamsters volgende aggressiewe of seksuele ontmoetings. Fisiologie en gedrag. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Anaboliese enrogeniese steroïed blootstelling tydens adolessensie en aggressiewe gedrag in goue hamsters. Fisiologie en Gedrag. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Upregulering van androgeen reseptor immunoreaktiwiteit in die rotbrein deur androgeen-anaboliese steroïede. Breinnavorsing. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiol verminder kalsiumstrome in rat neostriatale neurone via 'n membraanreseptor. Blaar van Neurowetenskap. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Vlakke van aggressie onder 'n groep anaboliese enrogeniese steroïedgebruikers. Geneeskunde, wetenskap en die regte. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Adolessente sosiale ervaring herstel volwasse ejakulatoriese gedrag in manlike Syriese hamsters wat pubertet testosteroon ontbreek. Vereniging vir Gedrags-Neuroendokrinologie; Stille Oseaan Grove, CA: 2007.
- Noble RG, Alsum PB. Hormoon-afhanklike seks-dimorfismes in die goue hamster (Mesocricetus auratus) Fisiologie en gedrag. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Sel dood in die ontwikkeling van die posterior korteks by manlike en vroulike rotte. Tydskrif van vergelykende neurologie. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Ovariumhormone na die postnatale dag 20 verminder die neurongetal in die primêre visuele korteks van die rat. Blaar van Neurobiologie. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Effekte van testosteroon op bui, aggressie en seksuele gedrag by jong mans: 'n dubbelblinde, placebo-beheerde, kruis-studie. Tydskrif vir kliniese endokrinologie en metabolisme. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Belonende affektiewe eienskappe van intra-nucleus accumbens inspuitings van testosteroon. Gedragswetenskappe. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH mRNA verhoog met puberteit in die manlike Siriese hamsterbrein. Blaar van Neuroendokrinologie. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Anaboliese steroïedgebruik deur amateuratlete: effekte op sielkundige gemoedstoestande. Tydskrif vir Sportgeneeskunde en liggaamlike fiksheid. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Die diagnose en reproduktiewe uitkoms na chirurgiese behandeling van die volledige septatale baarmoeder, gedupliseerde serviks en vaginale septum. Amerikaanse Tydskrif vir Verloskunde en Ginekologie. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Snoek B, Zijdenbos A. Maturasie van wit materie in die menslike brein: 'n oorsig van magnetiese resonansiestudies. Breinnavorsingsbulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Maatreëls van aggressie en bui veranderings in manlike gewigstellers met en sonder androgeen anaboliese steroïedgebruik. Tydskrif vir Forensiese Wetenskappe. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Androgeen afhanklikheid in hamsters: oordosis, toleransie en moontlike opioïdiese meganismes. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Seksuele gedrag vergemaklik sentrale dopamien-oordrag in die manlike rat. Breinnavorsing. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Jong toilet. Organiserende aksie van prenatale toegedien testosteroonpropionaat op die weefsels wat die paringsgedrag in die vroulike proefkonyn bemiddel. Endokrinologie. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Die ontwikkeling van geslagsverskille in die lokus coeruleus van die rat. Breinnavorsingsbulletin. 2001;56: 73-8. [PubMed]
- Pous HG, Jr, Katz DL. Moord en moord deur anaboliese steroïedgebruikers. [Sien kommentaar] Tydskrif vir Kliniese Psigiatrie. 1990;51: 28-31. [PubMed]
- Pous HG, Jr, Katz DL. Psigiatriese en mediese effekte van anaboliese-androgeniese steroïedgebruik. 'N Beheerde studie van 160-atlete. Argiewe van Algemene Psigiatrie. 1994;51: 375-82. [PubMed]
- Pous HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Anaboliese-androgeniese steroïedgebruik onder 133-gevangenes. Omvattende psigiatrie. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Testosteroon herstel van copulatoriese gedrag korreleer met mediale preoptiese dopamien vrystelling in gekastreerde manlike rotte. Hormone en gedrag. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Effekte van testosteroonmetaboliete op kopulasie en mediale preoptiese dopamien vrystelling in gekastreerde manlike rotte. Hormone en gedrag. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Effekte van testosteroonmetaboliete op kopulasie, mediale preoptiese dopamien, en NOS-immunoreaktiwiteit in gekastreerde manlike rotte. Hormone en gedrag. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Postnatale neurogenese in die vasopressien- en oksitosienbevattende kern van die varkhypothalamus. Breinnavorsing. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A reseptor aktiwiteit en uitdrukking moduleer adolessente anaboliese / androgeniese steroïed-geïnduseerde aggressie in hamsters. Farmakologie, biochemie en gedrag. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosteroon aktiveer seksuele gedrag in volwasse manlike hamsters, maar nie in jeugdiges nie. Fisiologie en gedrag. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Oestrogeen reseptor immunoreaktiwiteit in prepubertal en volwasse manlike Siriese hamsters. Neuroscience Letters. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromone verkry gelyke vlakke van Fos-immunoreaktiwiteit in prepubertal en volwasse manlike Syriese hamsters. Hormone en gedrag. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Puberteit en die volwassenheid van die manlike brein en seksuele gedrag: hersiening van 'n gedragspotensiaal. Neurowetenskap en biogedragsresensies. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiol veroorsaak hipotalamiese progesteroonreseptore, maar aktiveer nie paringsgedrag in manlike hamsters (Mesocricetus auratus) voor puberteit nie. Gedragswetenskappe. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Anaboliese androgeen steroïede (AAS) beïnvloed differensiaal sosiale gedrag in adolessente en volwasse manlike Siriese hamsters. Hormone en gedrag. 2008 in pers.
- SAMHSA / OAS. DHHS publikasie nommer (SMA) 1996. 1994 Nasionale Huishoudelike Opname oor Dwelmmisbruik, Hoofbevindings 1994; pp. 96-3085.
- SAMHSA / OAS. Resultate van die 2004 Nasionale Opname oor Dwelmgebruik en Gesondheid: Nasionale Bevindinge. 2005. NSDUH-reeks H-28, DHHS-publikasie No. SMA 05-4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Androgeen selfadministrasie in Tfm rotte. 10e Jaarlikse Vergadering van die Vereniging vir Gedrags-Neuroendokrinologie. 2006.
- Sato SM, Wood RI. Selfadministrasie van membraan-impermeabele anaboliese enrogeniese steroïede (aas) in Siriese hamsters. 11e Jaarlikse Vergadering van die Vereniging vir Gedrags Neuroendokrinologie. 2007.
- Schroeder JP, Packard MG. Rol van dopamienreseptor-subtipes in die verkryging van 'n testosteroon-gekondisioneerde plekvoorkeur by rotte. Neuroscience Letters. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Huishoudelike geweld wat verband hou met anaboliese steroïedmisbruik. Amerikaanse Tydskrif vir Psigiatrie. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Die blootstelling aan testikulêre hormone tydens adolessensie organiseer flankmarkeringsgedrag en vasopressienreseptorbinding in die laterale septum. Hormone en gedrag. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Soekland KJ, Sisk CL. Mediale preoptiese area dopaminerge antwoorde op vroulike feromone ontwikkel gedurende puberteit in die manlike Siriese hamster. Breinnavorsing. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadale hormone maskineer en verminder reproduktiewe gedrag tydens puberteit in die manlike Siriese hamster. Hormone en gedrag. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Pubertalhormone, die adolessente brein, en die veroudering van sosiale gedrag: Lesse uit die Siriese hamster. Molekulêre en sellulêre endokrinologie. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Neuroscience Meeting Planner. Sandiego, CA: Vereniging vir Neurowetenskap; 2007. Is adolessensie 'n tweede sensitiewe periode vir die organiserende effekte van testosteroon op volwasse manlike voortplantingsgedrag? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Kritiese tydperke in die organisasie van stelsels. Ontwikkelingspsigologie. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Vergelykende verspreiding van estrogeenreseptor-alfa en -beta mRNA in die sentrale senuweestelsel van die rat. Tydskrif van vergelykende neurologie. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Psigososiale voorspellers van verhoogde rookstadium onder sesde graders. Amerikaanse Tydskrif van Gesondheidsgedrag. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Pubertalhormone organiseer die adolessente brein en gedrag. Grense in Neuroendokrinologie. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Welkom SE, Kan E, Toga AW. Longitudinale kartering van kortikale dikte en breingroei by normale kinders. Blaar van Neurowetenskap. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Mapping voortgesette brein groei en grys materie digtheid verlaging in dorsale frontale korteks: Inverse verhoudings tydens postadolescent brein volwassenheid. Blaar van Neurowetenskap. 2001;21: 8819-29. [PubMed]
- Spies LP. Die adolessente brein en ouderdomverwante gedrags manifestasies. Neurowetenskap en biogedragsoorsig. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neuropsigiatriese effekte van anaboliese steroïede by manlike normale vrywilligers. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Verhoogde dopaminerge en 5-hidrokspektaminerge aktiwiteite in manlike rotbrein na langdurige behandeling met anaboliese androgeen steroïede. Britse Tydskrif van Farmakologie. 1999;126: 1301-6. [PMC gratis artikel] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestien, estrogeen en androgeen G-proteïen gekoppelde reseptore in visgonades. Steroïede. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Die effekte van suprafisiologiese dosisse testosteroon op kwaad gedrag by gesonde eugonadale mans - 'n kliniese navorsingsentrumstudie. Tydskrif vir kliniese endokrinologie en metabolisme. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Chemosensoriese aanwysers is noodsaaklik vir paring-geïnduseerde dopamien vrystelling in MPOA van manlike Siriese hamsters. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testosteroon en kern sluit dopamien in die manlike Siriese hamster. Psychoneuroendocrinology (in pers)
- Van Eenoo P, Delbeke FT. Die voorkoms van doping in Vlaandere in vergelyking met die voorkoms van doping in internasionale sport. Internasionale Tydskrif vir Sportgeneeskunde. 2003;24: 565-570. [PubMed]
- WADA. Onverskillige analitiese bevindings gerapporteer deur geakkrediteerde laboratoriums. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Stacking anaboliese androgeniese steroïede (AAS) tydens puberteit by rotte: 'n neuro-endokriene en gedragsassessering. Farmakologie, biochemie en gedrag. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Gebruik van anaboliese-androgeniese steroïede in adolessensie: wen, lyk goed of sleg? Tydskrif vir Alkoholstudies. 2001;62: 5-13. [PubMed]
- Hout RI, Johnson LR, Chu L, Schad C, Self DW. Testosteroon versterking: intraveneuse en intracerebroventrikulêre selfadministrasie by manlike rotte en hamsters. Psigofarmakologie. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Androgeen- en estrogeenreseptore bestaan saam in individuele neurone in die brein van die Siriese hamster. Neuro-endokrinologie. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Neuronale integrasie van chemosensoriese en hormonale seine wat manlike seksuele gedrag beheer. In: Wallen K, Schneider JS, redakteurs. Reproduksie in konteks. MIT Press; Cambridge: 1999. pp. 423-444.
- Zahm DS, Heimer L. Twee transpallidale weë van oorsprong in die ratkern. Tydskrif van vergelykende neurologie. 1990;302: 437-46. [PubMed]