Dialogues Clin Neurosci. 2013 Dec;15(4):431-43.
mücərrəd
Çoxsaylı psixososial amillərin əhəmiyyətinə baxmayaraq, narkotik maddə asılılığı bir bioloji prosesi əhatə edir: kompulsif axtarış və narkotik vasitələrin alınması ilə mübarizə aparan həssas bir beyində dəyişikliklərə səbəb olmaq üçün təkrarlanan bir dərmana məruz qalma bacarığı və nəzarətin itirilməsi narkotik maddənin istifadəsi, bir asılılıq vəziyyətini müəyyənləşdirir. Burada, asılılıqla əlaqəli davranış anormalliklərinə vasitəçilik etmək üçün xüsusi beyin bölgələrində baş verən molekulyar və hüceyrəli adaptasiyaların növləri nəzərdən keçirilir. Bunlar epigenetik mexanizmlər, neyronların və sinapsların nörofizioloji funksiyalarında plastisiyanı və nörotrofik amil siqnalının dəyişdirilməsi ilə qismən vasitəçilik edən sinir və sinaptik morfologiyada əlaqəli plastisiyanı vasitəsilə qismən əldə edilən gen ifadəində dəyişikliklər daxildir. Bu növ dərman vasitələrinə bağlı dəyişikliklərin hər biri "hüceyrə və ya molekulyar yaddaş" şəklində nəzərdən keçirilə bilər. Üstəlik, çox asılılıqla əlaqəli plastisit formaları, "davranışçı yaddaş" nın daha klassik formaları ilə əlaqəli olan plastisitik növlərə çox oxşardır, bəlkə də ətraf mühitlə qarşılaşdıqda neyronlara uyğun adaptiv mexanizmlərin son repertuarını əks etdirir çətinliklər. Nəhayət, asılılıqla əlaqəli molekulyar və hüceyrəli adaptasiya anormal anıların addiction syndromesinin mühüm sürücüsü olduğuna dair fikirlərlə uyğunlaşaraq, daha klassik yaddaş formalarını araşdıran eyni beyin bölgələrinin əksəriyyətini əhatə edir. Narkotik maddələrin asılılığının molekulyar və hücresel əsaslarını izah etməyə çalışmış bu tədqiqatların məqsədi bioloji əsaslı diaqnostik testləri, həmçinin asılılıq pozuntuları üçün daha effektiv müalicə etməkdir.
giriş
Narkomaniya və ya narkotik maddənin istifadəsi üzərində nəzarəti itirməsinə baxmayaraq, dərman vasitələrinin istifadəsi və istifadəsi kimi müəyyənləşdirilə bilən narkotik asılılığına müəyyən beyin bölgələrində baş verən uzunmüddətli dərman vasitələrindən meydana gələn dəyişikliklər səbəb olur.1 Ancaq bəzi şəxslər, təkrarlanan dərmana məruz qalma qarşısında asılılığa meyllidirlər, bəziləri isə bir dərman preparatından istifadə edə və bir asılılıq sindromundan qaça bilirlər. Genetik faktorlar, bağımlılıq zəifliyində bu fərdi dəyişkənliyin təxminən 50% -ni təşkil edir və bu dərəcədə övladlıq dərəcəsi stimulantlar, opiatlar, alkoqol, nikotin və kannabinoidlər.2 Bu genetik riski ehtiva edən genlərin əksəriyyətini müəyyənləşdirmək hələ mümkün deyildir, bəlkə də bir fərddə fərdi ehtiyatın zəifliyini təmin etmək üçün bəlkə də yüzlərlə genetik varyasyonun cəlb edilməsi səbəbindən (və ya digər şəxslərdə müqavimət).
Asılılıq riskinin digər 50% -i, bir insanın genetik tərkibi ilə qarşılıqlı təsir bağışlayan və ya daha az dərəcədə asılılığa məruz qalan bir sıra ətraf mühit faktorları ilə əlaqədardır. Psixososial streslər də daxil olmaqla bir neçə növ ətraf mühit faktoru asılılığa səbəb olub, lakin ən güclü amil sui-istifadə dərmanına məruz qalmasıdır. Bəzi “qapı” dərmanlarının, xüsusən nikotinin, başqa bir dərmana qarşı asılılığa qarşı həssaslığını artırdığı göstərilmişdir.3 Bununla yanaşı, əhali arasında asılılıq üçün bir sıra genetik risklərə baxmayaraq, uzun müddət ərzində kifayət qədər yüksək dozada dərmana məruz qalma nisbətən daha az genetik yükü olan bir insana çevirə bilər ki, artan dəlil var.4
Son iki onillikdə bir beyin sindromu vasitəçiliyində vacib olan ayrı-ayrı beyin bölgələrini, eləcə də bu bölgələrdə əsas aspektləri əsaslandırdığı dərmanların molekulyar və hüceyrə səviyyələrində dəyişikliklərin növlərini müəyyənləşdirməkdə böyük irəliləyişlər olmuşdur asılılıq.1,5 Ən çox diqqəti çəkən dövrə nüvə accumbens (nac, ventral striatum bir hissəsi) midbrain innervating orta spiny nöronların ventral tegmental sahəsində (VTA) dopamin nöronları daxil olan mesolimbic dopamin sistemi kimi istinad edilir. Bu VTA nöronları hipokampus, amigdala və prefrontal korteks (PFC) də daxil olmaqla, bir çox digər forebrain bölgələrində innerve olur.
Bu həcmdə bu narkotik maddələrlə bağlı asılılıq mexanizmlərini üç üst-üstə düşən səbəblərə görə yadda saxlamalı olur.6
- Birincisi, bütün dərmanlara səbəb olan adaptasiyalar "molekulyar və ya hüceyrəli yaddaş" tipləri kimi qəbul edilə bilər: bu dəyişikliklərə məruz qalan sinir hüceyrəsi dərmana məruz qalma nəticəsində fərqlənir və bu səbəbdən eyni dərmana fərqli cavab verir, digər narkotiklərə, ya da bir sıra digər xəbərdarlıqlara səbəb olur.
- İkincisi, maraqlıdır ki, bir çoxları, ehtimal ki, bir çox addımların dövləti ilə əlaqəli olan dəyişiklik növlərindən (məsələn, dəyişdirilmiş gen transkripsiyası, epigenetik, sinaptik və bütün hüceyrə plastisiyası, nöronal morfologiya və neyrotrofik mexanizmlər) başqaları arasında, məsələn, məkan yaddaşı, qorxu kondisionerləri və operant kondisionerləri kimi "davranışçı yaddaş" ın ənənəvi formalarına da aiddir.
- Üçüncüsü, sui-istifadədən dərmanlara məruz qalan beyin bölgələri arasında hipokampus, amigdala və PFC daxil olmaqla davranış yaddaşına əsas neyro substrat olanlar da vardır. Bu, klinikada görülən asılılığın ən əhəmiyyətli xüsusiyyətlərindən (məsələn, narkotik istək və relapsı) ənənəvi yaddaş dövriyyələrində anormallıqları əks etdirən artan reallıqla üst-üstə düşür və narkotik maddə təcrübəsinin uzunmüddətli xatirələrini bağımlılıq patologiyasının güclü sürücüləri kimi xidmət edir.4,7,8 Əksinə, beynin mükafat bölgələri (məsələn, VTA və NAc) davranış yaddaşına təsir göstərir.
Bu məqalə, ən çox məlumatın mövcud olduğu nüvə accumbenslərinə yoğunlaşaraq, asılılığın heyvan modellərində bir neçə beynin bölgəsində baş verən molekulyar və hüceyrəli dəyişmələrin əsas növlərini əks etdirir. Əhəmiyyətli olaraq, postmortem beyinlərin tədqiqatları əsasında insan bağımlılarının bu dəyişikliklərindən getdikcə daha çox şəkildə təsdiq olunmaq mümkün olmuşdur. İstifadəsi olan narkotik maddələri ayrı kimyəvi tərkiblərə malikdir və fərqli protein hədəfləri üzərində hərəkət etməsinə baxmayaraq, bir çox görkəmli asılılıqla əlaqəli uyğunlaşma bir çoxları üçün ümumi, bəzi hallarda, hamısı sui-istifadəyə qarşı olan narkotiklərdir və ehtimal ki, asılılıq sindromu.4,9 Əksinə, bir çox narkotik maddəyə uyğundur adaptasiya verilən bir dərmana aiddir və bir asılılığın daha çox unikal aspektlərinə vasitəçilik edə bilər. Burada digər dərmanlarla müqayisədə heyvan modellərində daha çox dramatik təsiri olan stimulant və istifadəsi olan narkotik maddələri üzərində dayanırıq. Gələcək tədqiqatlar üçün əhəmiyyətli sahələri də vurğulamaqdır ki, bu da addiction sindromları haqqında məlumatımızı daha da artıracaq və bu inkişafları təkmilləşdirilmiş diaqnostik testlər və müalicələrə çevirir.
Transkripsiya və epigenetik mexanizmlər
Bağımlılığa davam edən xəstəliklər, xəstəliyin ildönümünə baxmayaraq, relapsın artması riski altında qalmağı bilir ki, asılılıq beyində çox istikrarlı ola bilən dərmanlara səbəb olan dəyişiklikləri ehtiva edir. Bu, bir neçə qrupun gen ifadəsində dəyişikliklərin asılılıq prosesinin mühüm tərkib hissəsi kimi qəbul etməsinə səbəb olmuşdur (Şəkil 1). Buna görə, namizəd genlərinin və ya DNA mikroarraylarını və son zamanlarda RNA-seq (ifadə RNA'ların yüksək effektiv sequencing) ifadəsi köklü və primat modellərində və insan narkomaniyasında müəyyən bir beyin bölgəsində ifadə dəyişən çoxsaylı genləri müəyyən etmişdir (məsələn, refs 10-17). Bu cür genlərin nümunələri bu araşdırmanın sonrakı bölmələrində müzakirə olunur.
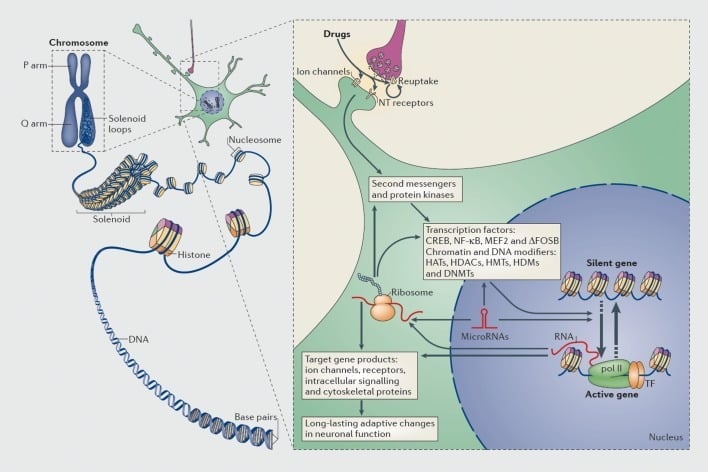
İstifadəsi olan narkotik vasitələrlə transkripsiya və epigenetik tənzimləmə mexanizmləri. Ökaryotik hüceyrələrdəki DNA, histonun octomers ətrafında nükleozomları meydana gətirmək üçün sarılır, daha sonra mütəşəkkil olan və xromosomları (sol hissəsi) meydana gətirən yoğunlaşır. Sıxılmış kromatinin müvəqqəti olaraq həll edilməsi ilə xüsusi bir genin DNT transkripsiyel mexanizmlər üçün əlçatan edilə bilər. Şüursuz dərmanlar, hüceyrə siqnalları cascades (sağ hissəsi) dəyişdirmək üçün geri alma mexanizmləri, ion kanalları və nörotransmitter (NT) reseptorları kimi sinaptik hədəflər vasitəsilə hərəkət edir. Bu, kromatin-tənzimləyici proteinlər (qalın oxlarla göstərilən) də daxil olmaqla, transkripsiyanın (TF) və bir çox digər nüvə hədəflərinin aktivləşdirilməsinə və ya qadağanına gətirib çıxarır; kromatin-tənzimləyici proteinlərin sinaptik tənzimlənməsində iştirak edən ətraflı mexanizmlər zəif başa düşülür. Bu proseslər nəticə etibarilə xüsusi genlərin induksiyasına və ya repressiyasına, o cümlədən mikroRNA'lar kimi qeyri-kodlaşdırıcı olmayan RNT-lərə aiddir; Bu genlərin bəzilərinin dəyişiklik ifadəsi gen transkripsiyasını daha da tənzimləyə bilər. Xromatin səviyyəsində bəzi dərman vasitələrinə səbəb olan dəyişikliklər son dərəcə sabitdir və bununla da asılılığı müəyyən edən uzunmüddətli davranışların əsasını qoyur. CREB, siklik AMP-reaksiyalı element bağlayıcı protein; DNMT'ler, DNT metiltransferazları; HAT, histon asetiltransferazlar; HDACs, histon deasetilazları; HDM'ler, histon demetilazlar; HMTs, histon metiltransferaziyaları; MEF2, miyosit xüsusi gücləndirici faktoru 2; NF-kB, nüvə faktoru-KB; pol II, RNT polimeraz II. Ref 44-dan çıxarılmışdır: Robison AJ, Nestler EJ. Bağımlılığın transkripsiyonel və epigenetik mexanizmləri. Nat Rev Neurosci. 2011; 12: 623-637.
Eyni şəkildə, genlərin tənzimləyici bölgələrinə bağlanan və bununla da genlərin transkripsiyasını artıran və ya azaltan transkripsiyanın bir çox növü olan proteinlər - narkotik maddə istifadəsinin dərman vasitəsinin uzun müddətli təsirlərini beynin gen ifadəsinə yönəldir. Tanınmış nümunələr arasında CREB (cAMP reaksiya elementli bağlayıcı protein), ΔFosB (bir Fos ailə transkripsiyası faktoru), NFkB (nüvə faktoru kB), MEF2 (miyosit artırıcı faktor-2) və digərləri arasında glukokortikoid reseptorları daxildir.5,10,18-22 İstismar dərmanlarının beyində müəyyən bir transkripsiya faktorunu aktivləşdirdiyi hüceyrə siqnal yollarını anlamaq və bu aktivasiyanı həmin transkripsiya amilinin hədəf genləri və bağımlılığın spesifik davranış aspektləri ilə əlaqələndirmək getdikcə daha da mümkün olmuşdur (bax Şəkil 1). Bu tərəqqi, bağımlılıq modellərində ən yaxşı tədqiq edilən transkripsiya faktoru olan CREB və ΔFosB nəzərə alınmaqla təsvir edilir.
cAMP Cavab elementi məcburi protein
İstifadəni stimullaşdırıcı və opiate dərmanlar aktivləşdirir CREB bir çox beyin bölgəsində NAc-da görkəmli olmaq da daxil olmaqla, asılılıq üçün vacibdir.23,24 CREB digər sistemlərdə cAMP, Ca tərəfindən aktivləşdiriləcəyi bilinir2+, və böyümə faktor yolları,25 Narkotik vasitələrin istifadəsi ilə narkotik vasitələrin istifadəsi ilə əlaqədar bu vasitələrdən hansı fəaliyyətə vasitəçilik etdiyini hələ bilmir. NAc-da CREB-in narkotik aktivasiyası klassik mənfi geribildirim mexanizmini təmsil edir, bunun sayəsində CREB bir heyvanın bu dərmanların faydalı təsirlərinə qarşı həssaslığını azaltmağa xidmət edir (tolerantlıq) və narkotikdən imtina (asılılıq) zamanı mənfi bir emosional vəziyyətə vasitəçilik etmək..18,26,27 Bu təsirlər son vaxtlar narkotiklərin özünü idarə etməsinin artması və ehtimal olunan mənfi möhkəmləndirmə prosesi ilə relapsın sürdüyünü göstərmişdir.28 CREB-in bu hərəkətləri NAc orta spiny nöronların əsas subtiplərini, əsasən D1 qarşı D2 dopamin reseptorları.24 IQəribədir ki, böyük bir ədəbiyyat orqanı göstərir ki, hipokampus və amigdala fəaliyyət göstərən CREB davranış yaddaşında əsas molekuldur.29-31 Bağımlılık və davranış yaddaşında bu geniş rol, ehtimal ki, nöronların davamlı dəyişən bir mühitə uyğunlaşmaq üçün olan sonlu sayda molekulyar mexanizmlərlə imbued olunur.
Bu davranış fenotipinə vasitəçilik edən CREB üçün hədəf genləri, genom geniş testlər və daha çox seçilmiş səylər vasitəsilə müəyyən edilmişdir.10,18,32 Bir nümunə opioid peptid dynorphin: NAc neyronlarında DYORF vasitəsi ilə dynorphin ifadəsinin stimulant induksiyası, k opioid reseptorlarının VTA dopamin nöronlarında dynorphin aktivləşdirilməsini artırır və bununla da NAc-yə dopaminergik ötürülməni basdırır mükafatını pozur.18 Bir neçə digər CREB hədəfləri aşağıda müzakirə olunduğu kimi dərman vasitələrinə səbəb olan sinaptik plastisitə üçün əhəmiyyətli olduğunu göstərmişdir. CREB stimulant və opiatlar tərəfindən bir çox digər beyin bölgələrində də aktivləşərkən,23,24 bu təsirin davranış nəticələri və meydana gəldikləri hədəf genləri haqqında daha az bilinir. Eynilə, CREB-nin digər sui-istifadə narkotiklərinin hərəkətlərinə vasitəçilik etməsindəki rolu haqqında daha az məlumat var.19
ΔFosB
Fəlakətin hər hansı bir dərmanına kəskin maruz qalma NAc və bir çox başqa beyin bölgələrindəki bütün Fos ailə transkripsiyası faktorlarını yaradır. Bu induksiya sürətli, eyni zamanda yüksək keçiddir, Fos protein səviyyəsi 8-da 12-a qədər normala dönən. Bu Fos ailə zülalları arasında fərqlənən FosB, FosB geninin kəsilmiş bir məhsuludur, qeyri-adi sabitliyinə görə tədricən təkrarlanan dərmanın marağına səbəb olur və bu şəraitdə ifadə edilən dominant Fos protein olur.22,33 Bundan əlavə, bu sabitliyin səbəbi ilə ΔFosB səviyyəsi narkotikdən çəkildikdən bir neçə həftə ərzində davam edir. ΔFosB-nin bu cür xroniki induksiyası demək olar ki, bütün sui-istifadələr üçün göstərilib34 və ən çox dərman üçün, Dl tipli NAc nöronları üçün seçicidir.34,35 Bu da olmuşdur insan narkomanları ilə nümayiş etdirilir.35 Böyük bir ədəbiyyat bürosu bu cür ΔFosB induksiyasını D1-tip NAc neyronları, heyvanın dərmana qarşı həssaslığını və təbii mükafatlarını artırır və dərmanların öz-özünə tətbiq olunmasını, ehtimal ki, müsbət möhkəmləndirmə prosesi vasitəsilə artırır (34-a 38-a baxın). Maraqlıdır ki, NAc-da ΔFosB dərmanının induksiyası adolesan heyvanlarda daha çox dramatik olur, daha çox asılılıq zəifliyi,39 və nikotinlə induksiya edilməsinin nikotinin kapitan kimi kokain mükafatını artırmasına vasitəçilik etdiyi göstərilmişdir.40
CREB-ə gəldikdə, ΔFosB üçün çoxsaylı hədəf genlər NAc-də namizəd geninin və genomun geniş yanaşmalarından istifadə edərək müəyyən edilmişdir.10,32 CREB dinorfini induksiya edərkən, ΔFosB onu basdırır və bu da ΔFosB-un mükafatlandırıcı təsirlərinə kömək edir..38 Digər bir ΔFosB hədəfi cFos: ΔFosB təkrarlanan dərmanlara məruz qaldıqda c-Fos'u təzyiqli və molekulyar keçiddə iştirak edir, bununla ΔFosB kronik narkotiklə müalicə vəziyyətində seçicidir.41 Digər bir ΔFosB hədəfləri müəyyən narkotik maddələrin istifadəsinin NAc-da sinaptik plastisiyaya səbəb olması və aşağıda müzakirə olunacaq NAc orta spiny nöronların dendritik arborizasiyası ilə əlaqədar dəyişikliklərin baş verməsinə imkan yaradır.
Digər beyin bölgələrindəki ΔFosB induksiyasının funksional nəticələri daha yaxşı başa düşülür, baxmayaraq ki, orbitofrontal korteksdə (OFC) induksiya ətraflı tədqiq olunmuşdur. Burada ΔFosB kronik məruz qalma prosesində kokainin bilişsel-pozucu təsiri ilə meydana gələn tolerantlığa vasitəçilik edir və bu uyğunlaşma, artan kokain özünü idarə etməsi ilə əlaqələndirilir.42,43
Genom geniş tədqiqatlar bu effektlərə vasitəçilik edən bir neçə potensial hədəf genləri təklif etmişdir.42 ΔFosB-nin bənzərsiz müvəqqəti xüsusiyyətləri və ənənəvi yaddaş dövrələrində (məsələn, hipokampus) əmələ gəldiyini bilməsinə baxmayaraq, gələcək tədqiqatlar üçün maraqlı bir mövzu olan ΔFosB-nin davranış yaddaşındakı rolunun araşdırılması hələ aparılmamışdır.
Epigenetik mexanizmlər
Sonrakı illərdə transkripsiyaya dair tədqiqatlar epigenetiklərə bir addım daha atılıb44 (Bax: Şəkil 1)DNT sekansında bir dəyişiklik olmaması halında baş verən gen ifadəsində bir dəyişiklik kimi geniş şəkildə müəyyən edilə bilən bir şeydir. Epigenetik mexanizmlər histonlarla qarşılıqlı əlaqələr və DNT-nin bir hüceyrə nüvəsi içərisində qablaşdırılmasını, birlikdə xromatin meydana gətirən bir çox nüvə zülal növü ilə nəzarət edir. Genin ifadəsi histonların, digər proteinlərin və DNT'nin özünün kovalent modifikasiyası vasitəsilə bu ambalajın dövləti tərəfindən idarə olunur. Yalnız bir neçə nümunə olaraq, histonların asetiliyi genlərin aktivləşdirilməsini təşviq edir, histonların metilliliyi bu modifikasiyaya məruz qalan Lys qalıqlarına əsasən ya da gen aktivliyini və ya repressiyanı təşviq edə bilər və DNT-nin metilasiyası ümumiyyətlə gen təzyiqinə aiddir məsələn, 5-hidroksimetilasyon) gen aktivasiyası ilə bağlı ola bilər.
Epigenetiklər cəlbedici mexanizmdir, çünki digər sistemlərdə, məsələn, inkişaf və xərçəng biologiyasında bəzi epigenetik dəyişikliklər qalıcı ola bilər. Bu səbəbdən, epigenetics öyrənmə və yaddaş modellərində (məsələn, 45-48 refs) həm də asılılıqda davam etdirilir;44,49 hər iki sistemdə də histon asetilasyonunda və metilasyonunda və DNT metilasyonunda dərin dəyişikliklər bildirilmişdir. Yalnız bir nümunə olaraq, histonun metiltransferaz, G9a, hər iki yaddaşda tətbiq olunur50 və asılılıq.51,52 Bağımlılıq modellərində, G9a ifadəsi aşağı tənzimlənir Narkotik vasitələrin istifadəsi və ya istifadəsi üçün istifadəyə verilmiş narkotik maddələrə və ya tonun bu dərmanların təltif təsirlərini artırmaq üçün göstərilmişdir.51,52 Maraqlıdır ki, G9a kokain bastırılması ΔFosB tərəfindən vasitələndirilir. G9a, histogen H9 (H3K3me9) Lys2-in gen təzyiqinin əsas vasitəçisi olan dimetilasyonunu katalizləyir. CHIP-chip və ya ChIP-seq (xromatin immunoprecipitasiyası, müvafiq olaraq, promoter çipsləri və ya yüksək ötürmə sıralaması ilə təqib olundu), NAc-da genlərin genom xəritələrini əldə etmək üçün stimulant və ya opiata məruz qaldıqdan sonra dəyişdirilmiş H3K9me2 göstəricisini göstərmək üçün istifadə edilmişdir.32,52,53 Bu gen siyahılarını gen ekspozisiyası dəyişikliklərinin genom geniş siyahıları ilə üst-üstə və digər epigenetik modifikasiyaların (məsələn, ΔFosB bağlanması, CREB bağlanması, digər histon dəyişiklikləri və s.) Genom geniş xəritələri ilə üst-üstə düşərək,32,53 sui-istifadəsi ilə tənzimlənən və əsaslanan epigenetik mexanizmləri anlamaq üçün gedən gedən genlərin müəyyənləşdirilməsi mümkün olmalıdır.
Yaddaş və asılılığa aid bir epigenetik tənzimləmənin digər bir forması mikroRNA-nun yaranmasıdır. Bu kiçik, qeyri-kodlayıcı RNT-lər mRNA-nın tamamlayıcı bölgələrinə bənzəyir və bununla onların tərcüməsini basdırır və ya onların parçalanmasına səbəb olur. Argonut, miRNA'ların işlənməsi üçün vacib olan bir protein, D1-D2 tipli orta spiny nöronlar üçün müşahidə edilən fərqli təsiri ilə kokainə davranış reaksiyalarını dəyişir.54 Bir neçə spesifik miRNA-ların eyni zamanda dərmana məruz qalması ilə tənzimləndikləri və narkotik maddələrə davranış reaksiyalarına təsir göstərməsi üçün göstərilmişdir (məsələn, 55,56 refs). Bu miRNA'ların mRNA hədəflərini müəyyən etmək və addiction prosesinə necə təsir göstərdiyini xarakterizə etmək üçün gələcək tədqiqatlarda maraqlı olacaq.
Sinaptik plastisitə
Hipokampus və amigdala davranış yaddaşında (bu mövzuda digər məqalələrə baxın) hipokampusda tətbiq olunan glutamateriqik sinapslarda eyni sinaptik dəyişikliklər, oxşar modellərdə beyinlərin mükafat bölgələrində baş verən və vasitəçilikdə əhəmiyyətli olan göstərilmişdir asılılıq prosesi.57,58 Bu cür uyuşturucuya bağlı sinaptik plastisite bir neçə beyin bölgəsində təsvir edilmişdir, lakin biz burada tədqiqatların çoxunun bu günə yönəldildiyi NAc üzərində konsentrə oluruq (Şəkil 2).
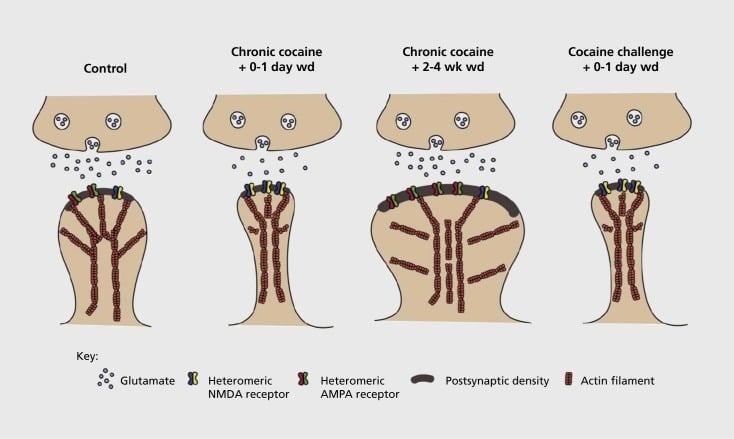
Nucleus accumbens (NAc) -də asılılıqla əlaqəli sinaptik və struktur plastisiyanın modeli. Kokainə xroniki məruz qalma α-amino-3-hidroksi-5-metil-4-isoksazolepropionik turşusu (AMPA) və NAc mühitində N-metil-D-aspartik asit (NMDA) glutamat reseptorlarına zaman-asılı və müvəqqəti yenidən təşkil edir spin neyron (MSN) sinapsları, həmçinin sinaptik plastisitənin fərqli formaları ilə əlaqəli olan NAc MSN-in baş belində baş verən struktur dəyişiklikləri. Məsələn, kronik kokain erkən çəkilmə zamanı nöqtələrində NMDA reseptorlarının səth ifadəini, səssiz sinaps formasiyasını və uzunmüddətli depressiyanı (ltd) induksiyaya səbəb olur. Daha uzadılmış çəkiliş zamanı (wd) bu sinaptik dəyişikliklər səth AMPA reseptorlarının səthinin artması, sinapsun bir mantar forması və uzunmüddətli potensiyasiyaya (LTP) birləşməsi ilə nəticələnir. Bu təsirlər sürətlə geri qayıtdıqdan sonra birbaşa kokain dozası, bel inqilabının yenidən qurulması və sinaptik gücün bir depressiyasına səbəb olur.
Başlanğıc təcrübələr göstərir ki, istifadənin stimulyasiya edən maddələrinə təkrar məruz qalma NAc-da glutamaterqik sinapslarda LTD (uzunmüddətli depressiya) kimi bir vəziyyətə səbəb olur.59 Bununla yanaşı, son vaxtlardakı iş daha çox vaxtdan asılı olmaq üçün belə bir plastisiyanı nümayiş etdirdi, çünki son kokain pozuntularının LTP-dən (uzunmüddətli potentiasiya) fərqli dövlətə daha çox vaxt keçdikdən sonra vaxt keçdikdən sonra erkən baş verir.60,61 Bu günə qədər baş verən müstəntiqin özünü idarə etdiyi dərman vasitələrindən istifadə edərək həyata keçirdiyi bu iş, özünü idarə edən modellərdə daha çox sistematik tədqiqatlara ehtiyac olduğunu müəyyən etdi, bu da glutamateriqik sinapslarda meydana gələn sinaptik plastisiyanın formasını izləyir Özünü idarə etmənin saxlanılmasına qədər fərqli bir vaxt kursuna keçərək, müxtəlif vaxtlarda çəkilmə və tükənmə müddətləri və relaps qəbul edən stimullara cavab olaraq. Bu günə qədər iş də AMPA reseptorlarının insan alveri quruluşuna gətirib çıxaran sinaptik plastifikasiyaya kömək edən bəzi molekulyar mexanizmləri müəyyənləşdirmişdir ki, bu da CaMKII (Ca2+/ calmodulin-bağlı protein kinaz II) müəyyən AMPA reseptor alt birimlerinin fosforilasyonu və AMPA reseptor alt birimlerinin değiştirilmiş ifadesi (məsələn, 60,62-65, 2 və 3 rəqəmləri). CREB və ΔFosB üçün rol bu hadisələrdə, eləcə də glutamateriqik sinapsların morfologiyasında bağlı dəyişikliklərə (aşağıda bax) aiddir. Məsələn, GluAl, NSc'de CREB üçün bir hədəfdir, burada GluA2 və CaMKII həm ΔFosB hədəfləri, həm də bu beyin bölgəsində .35,36,66,67 Əvvəlcədən hərəkət etmək, xüsusi adaptasiyaların sinaptik funksiyaya və bağımlılığın davranış xüsusiyyətlərinə bağlı zaman dəyişikliyinə bağlı olması vacibdir.
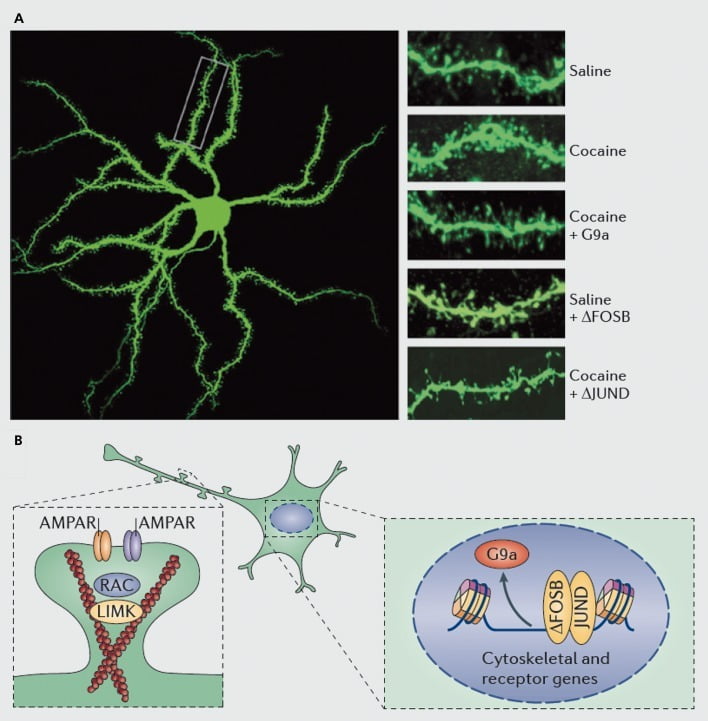
Dendritik tikanların nüvə akumbenslərinə (NAc) orta tikanlı neyronlara kokain induksiyası yatan molekulyar mexanizmlər. A) G9a və ya JunD viral aşırı ekspresyonu ilə bloklana bilən (AP1 əlaqəli transkripsiyanın antaqonisti) və ya FosB'nin viral aşırı ekspresyonu ilə təqlid edilə bilən dendritik onurğa sayında kokain səbəb olduğu artımları göstərir. B) AMPA reseptorlarının (AMPAR) dövriyyəsi və aktin sitoskeletinin (solda) tənzimlənməsi, həmçinin glutamat reseptorları və aktin tənzimləyici zülalların transkripsiyasının tənzimlənməsi (məsələn, ΔFosB vasitəsi ilə sağda) mühüm rol oynadı. kokainin NAc dendritik bel sıxlığının tənzimlənməsində vasitəçilik edir. UMK, LIM domen kinazı; RAC, Ras ilə əlaqəli C3 botulinum toksin substratı.
Yeni eksperimental alətlər, müəyyən dövrlərdə sinaptik plastisitənin bu formalarını və ardıcıl etdiyi davranış anormalliklərini əks etdirən həssaslıqla ilk dəfə müəyyənləşdirməyə imkan verir. Məsələn, thər subregionda D1-D2 tipli orta spiny neyronlar kimi, dərman preparatları ilə yaranan sinaptik plastisiyədə NAc displeyinin fərqli göstəricilərini əks etdirir.60,63,64,67 Eyni şəkildə, optogenetik təcrübələr NAc-da glutamateriqik sinapsların xüsusi populyasiyalarında müəyyən bir sinaptik plastisitin (məsələn, MM) bir hissəsinin yeni bir nəzəriyyəsini təmin etmişdir, məsələn, medial PFC-ə qarşı basolateral amigdala və ventral subikula qarşı (əsas məhsul hipokampus).68-70 Nəticədə, bu afferent neyronların hər birində dərmanla əlaqəli molekulyar uyğunlaşmaları postsinaptik dendritlərində meydana gələn sinaps spesifik uyğunlaşmaları ilə üst-üstə qoymaq lazım olacaqdır ki, sui-istifadə narkotiklərinin beyin dövranını müəyyən aspektlərini idarə etmək üçün necə dəyişdirdiyini tam başa düşsünlər. asılı vəziyyət. Bu cəhd, eyni beyin bölgələrində, indiyə qədər çox az diqqət yetirilən bir sahədəki inhibitor sinapslarda dərmanla əlaqəli plastisiyanın daha yüksək qiymətləndirilməsini tələb edəcəkdir.65
Bütün hüceyrəli plastiklik
Neyronların öyrənmə və yaddaş hadisələrində olduğu kimi, narkotik maddə istifadəsi hadisələrində neyrofizioloji dəyişiklikləri əhatə edən tədqiqatların əksəriyyəti sinaptik plastisiyaya yönəlmiş olsa da, bütün hüceyrə plastisitesinin əhəmiyyətinə dair sübutlar artmaqdadır. Homeostatik plastisitə olaraq da adlandırılan bütün hüceyrə plastisitəsi,71 bütün sinir hüceyrəsinin daxili həyəcanlanmasında sinaps xarakterli olmayan bir şəkildə dəyişiklikləri ehtiva edir. Narkotik asılılığının müəyyən xüsusiyyətləri bir dərmana artmış və ya azaldılmış həssaslığı ehtiva etdiyini nəzərə alsaq, müəyyən sinir hüceyrələrinin gücləndirilmiş və ya azaldılmasının bu davranış adaptasiyalarına qatqı təmin etdiyini anlamalıdır.5
The bütün hüceyrə plastisitesinin sui istifadəsinə ən yaxşı qurulmuş nümunəsi, lokus coeruleusun noradrenergik nöronların daxili həyəcanını artırmaq üçün kronik opiatların qabiliyyətidir (LC).72 Bu artmış excitability CREB vasitəsilə və ya Na + kanallarının induksiyası vasitəsilə LC nöronların artan atəş sürət adenylyl siklaz, müəyyən izoformları onun induksiyası vasitəçilik edir.72-75 LC neyronlarının bu hiperekstabilitəsi tolerantlıq və asılılığın klassik bir mexanizmini təmsil edir və opiatın çəkilməsinin bəzi əlamətləri və əlamətlərini idarə edir. Maraqlıdır ki, CREB, NAC orta spiny nöronlarda bütün hüceyrə plastisitesinin oxşar formasına vasitəçilik edir, bu da CREB vasitəsilə istifadəyə qarşı narkotiklərə xroniki şəkildə məruz qalmaqla həddindən artıq dərəcədə təsir göstərə bilər.76 Beləliklə, NAc orta spiny neyronlarda glutamateriqik sinapsların CREB-mediatlı sinaptik plastisitesinin necə olduğunu anlamaq üçün gələcək tədqiqatlarda kritik rol oynayacaqdır65,66 bu neyronların CREB vasitəsi ilə intrinsik həddindən artıq həssaslığı ilə yekunlaşdırır76 Bağımlılığın davranış xüsusiyyətlərini nəzarət etmək.
Bağımlılık modellərindəki bütün hüceyrə plastisitəsinin bir nümunəsi, abusun opiate dərmanlarına xroniki məruz qaldıqdan sonra baş verən VTA dopamin nöronlarının hipereksitivliyidirvəŞəkil 4).77,78 Bu sinir hüceyrələrindəki morfoloji dəyişikliklərlə əlaqəli olan bu uyğunlaşma (bax: sonrakı bölmə), CREB tərəfindən vasitəçiliyin deyil, aşağıda göstərildiyi kimi, neyrotrofik siqnal cascades tənzimlənməsi vasitəsilə yerinə yetirilir.

Ventral tegmental sahədə (VTA) dopamin nöronlarında kronik morfinə səbəb olan uyğunlaşma modeli. Kronik morfin VTA dopamin (DA) soma ölçüsünü azaldır, lakin nöronal excitability artırır, dopamin ötürülməsi nüvə accumbens azalır. Morfinin xalis təsiri daha az cavab verən mükafat yoludur, yəni mükafat tolerantlığıdır. VTA'daki IRS2-AKT sinyalizasyonunun downregulation kronik morfinin soma ölçüsünə və elektriksel uyanıklığına təsirini təmin edir; həyəcanlanmaya təsir azalmış γ-aminobutirik turşu (GABA) bir cərəyan və K 'kanalının ifrazının qarşısını alır.. VTA'daki mTORC2 aktivitesinin morfine bağlı aşağı regülasyonu morfine bağlı morfolojik ve fizyolojik adaptasyonların yanı sıra mükafat toleransları açısından da çox vacibdir. MT0RC2-dan fərqli olaraq, kronik morfin mTORCI aktivliyini artırır, bu morfinə səbəb olan uyğunlaşmaları təsir etmir. BDNF, beyindəki nörotrofik faktor; IRS, insulin reseptor maddəsi; mTORC, mTOR kompleksi; AKT, protein kinaz B Ref 77-dan çıxarılmışdır
Morfoloji plastisitə və nörotrofik mexanizmlər
Hippokamp və serebral kortikal nöronların tədqiqatlarından çoxu sübutların artması sinaptik plastisitə dəyişikliyinin sinapslarda morfoloji dəyişikliklərlə bağlı olduğunu göstərir. Məsələn, MMC və səssiz sinapsların yaranması ince və ya dodaqlı dendritik dayaqların formalaşması ilə əlaqələndirilir, LTP isə daha böyük, mantar biçimli dayaqlar ilə əlaqələndirilir.79,80 Beləliklə, narkotikdən sui-istifadə sahəsinin> 15 ildir ki, dendritik onurğada dərman səbəb olduğu dəyişikliklərə yönəldilməsi maraqlıdır. Xroniki məruz qalma istifadənin stimulant dərmanları NAc-nin orta sünbül neyronlarının dendritik bel yoğunluğunu artırır, Dl tipli nöronlar üçün üstünlük təşkil edən bir dəyişiklik.67,81,82 Həyata keçirilməkdə olan bu məmulatlar çox hissəsi üçün bu dərmanlara həssaslaşdırılmış davranış reaksiyaları ilə bağlıdır, baxmayaraq ki, bəzi sübutlar bu fikirlə ziddiyyət təşkil edir.
Sinaptik plastisitik tədqiqatlara baxmayaraq, narkotik maddənin özünü idarə etməsi, geri çəkilməsi və relapsın gedişi zamanı baş verən dendritik spinlərdəki dəyişiklikləri sistemli şəkildə müəyyənləşdirmək üçün daha çox iş aparmaq lazımdır. Sbu günə qədər tədqiqatçı və özünü idarə edən dərmanı əhatə edən, müxtəlif çəkiliş zamanı nöqtələrində və əksinə, NAc qabığında və əsas subregions.83-86 Kokain və ya başqa bir stimulyatorun bu zamanla bağlı və hüceyrə tipli spesifik təsirləri istehsal edən dəqiq molekulyar mexanizmləri müəyyən etmək də vacibdir. ΔFosB'nin Dl tipli NAc nöronları üzərində immatür spinlerin induksiyası üçün həm lazımlı, həm də kifayət qədər olması göstərilmişdir.35,51,67 Bu cür tənzimləmə, aktin sitoskeletonunun yenidən təşkilini bilən bir neçə zülalın kokain və ΔFosB tənzimləməsinə uyğun olaraq baş verir. Yalnız bir nümunə olaraq, bir neçə guanin nükleotid mübadiləsi faktoru və GTPaz aktivləşdirən zülalların transkripsiya tənzimlənməsi hər bir kokainə məruz qalma əleyhinə aktivlikdə müvəqqəti azalma üçün Rac1, kiçik bir GTPase təşkil edir və Rac1 aktivliyində belə pulsatil azalmalar optogenetik nəzarətdən Rak1-in, yetişməmiş haşiyələrin indüksiyasına vasitəçilik etmək.87 Raclın bu təsirləri ehtimal ki, kofenin və digər aktin normativ zülalların nəzarəti ilə də baş verir ki, bu da bel ürək böyüməsinin kokain tənzimlənməsinə vasitəçilik edir.87,88 Bununla birlikdə, bunun CDK5 (siklinə bağlı kinaz-5), CaMKII, NFkB da daxil olmaqla digər bir çox zülalın da mühüm rol oynadığı göstərildiyi üçün kokainin yetişməmiş tikanların tənzimlənməsində iştirak edən yalnız bir yol olduğunu vurğulamaq vacibdir. , MEF2, CREB, G9a və DNMT3 (DNA metiltransf silme 3a), bir neçəsinin adını çəkək.20,21,35,51,67,89,90 Maraqlıdır ki, CDK5, CaMKII və NFkB induksiyasını və G9a-nın repressiyasını da daxil olmaqla, bu genlərin bir hissəsinin kokain tənzimlənməsi də ΔFosB vasitəsi ilə vasitələnir.20,35,51,91
Təəccüblü olaraq, sui-istifadəki opiat dərmanları əks təsir göstərir və NAc orta spiny nöronların dendritik bel yoğunluğunu azaldır.81 Bu uyğunlaşmanın davranış nəticələrini və iştirak edən əsas molekulyar mexanizmləri az bilir. Bu fenomen, Bununla belə, CREB və ΔFosB həm stimulantlar, həm də opiatlar tərəfindən stimullaşdırıldığı və həm də NAc dendritik bel yoğunluğunun stimulyasiya vasitəsi ilə indüksiyasında tətbiq olunan təəccüblüdür. Bu, opiatların bu amillərin induksiyasına baxmayaraq, NAc-in bel yoğunluğunu necə boğduğu sualını doğurur.
Dərman istifadəsi modellərində görülən digər əsas morfoloji plastisitə xroniki opiat administrasiyası nəticəsində yaranan VTA dopamin nöronların hüceyrə soma ölçüsündə fiziki azalmadır.77,92,93 Bənzər bir adaptasiya kannabinoidlərə cavab olaraq baş verir.94 Vita dopamin nöronlarının bu azalması opiate self-administration ilə baş verir93 və postmortem müayinə olan insan eroin bağımlıları sənədləşdirilmiş,77 mükafat tolerantlığına vasitəçilik edir və NAc-da dopamin salınması azalır. İndi əhəmiyyətli sübutlar göstərir ki, hüceyrə soma ölçüsündə bu azalma bu neyronların içərisində beyin kökündən neyrotrofik amil (BDNF) ifadəsinin opiat təzyiqindən asılıdır. Biz BDNF dəstəyinin və VTA nöronun büzülməsindən bu istifadəyə səbəb olan birbaşa bağlılığımızı, VTA dopamin nöronlarında aşağı axın BDNF sinyalizasiya kaskalarının azalmasına, xüsusilə də IRS2 (insulin reseptor substratı-2), AKT (serin-treonin kinaz) və TORC2 (rapamisin-2 hədəfi, rapamisinə qarşı laqeyd).77,93 Bundan əvvəl də qeyd etdiyimiz kimi, morfinin bu neyronlarda indiyəcəyi artan həyəcan səmərəsinə birbaşa BDNF siqnalının aşağı salınmasını bağladıq.77,78 Həqiqətən, azalmış hüceyrə soma ölçüsü və artmış excitability sıx birləşdirilmişdir, çünki birinin indüksiyası digərinə və əksinə olur. Hüceyrə həyəcanına qarşı bu nəzarət K-nın qarşısını alır+ kanalları və GABAA bu nöronlarda mövcuddur.
BDNF üçün bu rol VTA səviyyəsində morfin reaksiyalarına nəzarət etməkdə onun kokain və digər stimulantların hərəkətlərində çox fərqli iştirakı ilə ziddiyyət təşkil edir. Stimulantlar BDNF sinyalizasyonunu NAc-yə təsir göstərir, BDNF-nin lokal sintezinin artırılması və bir sıra təsirli bölgələrdən sərbəst buraxılmasına səbəb olur.95 Bundan başqa, NAc-da BDNF siqnalını artırdı, lakin VTA-da deyil, bu dərmanların özünü idarə etməsi də daxil olmaqla, bu davranışların təsirlərini artırdı.95,96 VIA-NAc yolundakı tiryəklərə qarşı stimulantlara qarşı BDNF siqnalının əks tənzimlənməsi, bu fərqlərin dərmanların NAc dendritik tikanların əksinə tənzimlənməsinə vasitəçilik etmə ehtimalını artırır, bu da hazırda araşdırılır.
Gələcək istiqamətlər
Yuxarıda göstərilən povest, bir sui istifadəsinə təkrarlanan məruz qalmasına cavab olaraq beyin mükafat bölgələrində baş verən molekulyar və hüceyrəvi adaptasiyaları anlamaqda və heyvan modellərində asılılıq sindromlarının müəyyən davranış xüsusiyyətlərinə fərdi uyğunlaşmalarla əlaqələndirilməsində böyük irəliləyişlər vurğulamışdır . Bu inkişaflara baxmayaraq, böyük suallar qalır. Mövcud biliklərimizin əksəriyyəti VTA və NAc-ə diqqət yetirir, narkomaniya üçün də vacib olan digər əsas limbik beyin bölgələri barədə daha az məlumat verilir. Bundan əlavə, narkotiklə əlaqəli davranışda molekulyar-hüceyrəli bir uyğunlaşmanın nedensel rolu olan bütün eksperimental nümayişlər bir zamanda fərdi uyğunlaşmaları manipulyasiya etmişdir. Eyni zamanda çoxsaylı uyğunlaşmaları manipulyasiya etmək daha da çətindir, ancaq bu da vacibdir, çünki bilirik ki, narkotiklər hətta davranışlara təsir etmək üçün mürəkkəb yollarla ehtiva edən ayrı-ayrı nöronlar daxilində hətta çox müxtəlif dəyişiklik növlərini yaradır. Bioloji yanaşmanın bu cür sistemlərdən asılılığı bioloji cəhətdən asılılığın nəticəsidir. Nəhayət, addiction ilə əlaqəli xatirələrin molekulyar-hücum mexanizmlərini anlamaq üçün səylər indi davranış yaddaşının bioloji əsaslarını anlamaq üçün bütün digər səylərin mübarizə mərhələsindədir: bioloji hadisələri kompleks davranış yaddaşına bağlamaq qabiliyyətimiz son dərəcə çətin olaraq qalır. Bu bölünmənin aradan qaldırılması bəlkə nevrologiyada ən böyük problemdir.
Seçilmiş ixtisarlar və acronyms
- Nac
- nüvə akumbens
- CREB
- cAMP reaksiya elementli bağlayıcı protein
- ΔFosB
- bir Fos ailənin transkripsiyası faktoru
- VTA
- ventral tegmental sahəsi
- AMPA
- a-amino-3-hidroksi-5-metil-4-isoksazolepropionik turşusu
- LTD
- uzun müddətli depressiya
- LTP
- uzunmüddətli dayanıqlılıq
- BDNF
- beyindən nörotrofik amil
- NKkB
- nüvə amil kB
REFERANSLAR