Dialogy Clin Neurosci. 2013 Dec;15(4):431-43.
Abstraktní
Navzdory významu mnoha psychosociálních faktorů spočívá drogová závislost na svém biologickém procesu: schopnost opakovaného vystavení drogovému zneužívání k vyvolání změn v zranitelném mozku, které pohání kompulzivní hledání a užívání drog a ztráta kontroly přes užívání drog, které definují stav závislosti. Zde přezkoumáme typy molekulárních a buněčných adaptací, které se vyskytují v konkrétních oblastech mozku, které zprostředkovávají abnormality spojené se závislostmi na chování. Patří mezi ně změny v genové expresi dosažené částečně prostřednictvím epigenetických mechanismů, plasticita v neurofyziologickém fungování neuronů a synapsí a související plasticita v neuronální a synaptické morfologii zprostředkované částečně změněnou signalizací neurotrofického faktoru. Každý z těchto typů modifikací indukovaných léčivem lze považovat za formu "buněčné nebo molekulární paměti". Navíc je pozoruhodné, že většina forem plasticity souvisejících se závislostmi je velmi podobná typům plasticity, které byly spojeny s klasičtějšími formami "behaviorální paměti", což možná odráží konečný repertoár adaptivních mechanismů dostupných neuronům, když čelí životnímu prostředí výzvy. Konečně molekulární a buněčné adaptace související se závislostmi zahrnují většinu stejných oblastí mozku, které zprostředkovávají více klasických forem paměti, což je v souladu s názorem, že abnormální vzpomínky jsou důležitými hnacími silami syndromů závislosti. Cílem těchto studií, jejichž cílem je vysvětlit molekulární a buněčnou základnu drogové závislosti, je nakonec vyvinout biologicky založené diagnostické testy, stejně jako účinnější léčbu poruch závislosti.
Úvod
Drogová závislost, která může být definována jako kompulzivní hledání a užívání drog navzdory strašným následkům nebo ztrátě kontroly nad užíváním drog, je způsobena dlouhodobými změnami vyvolanými léky, které se vyskytují v určitých oblastech mozku.1 Pouze někteří jedinci však podléhají závislostem tváří v tvář opakované expozici léčiva, zatímco jiní jsou schopni užívat drogu náhodně a uniknout syndromu závislostí. Genetické faktory představují zhruba 50% této individuální variability v závislosti na zranitelnosti a tento stupeň dědičnosti platí pro všechny hlavní třídy návykových látek, včetně stimulantů, opiátů, alkoholu, nikotinu a kanabinoidů.2 Dosud nebylo možné identifikovat většinu genů, které tvoří toto genetické riziko, pravděpodobně kvůli zapojení asi stovek genetických variací, které se shromažďují v jediném jedinci, aby způsobily zranitelnost závislosti (nebo u jiných jedinců odpor).
Dalších 50% rizika závislosti je způsobeno řadou faktorů prostředí, které se vyskytují po celý život a které interagují s genetickým složením jednotlivce, aby se ve větší či menší míře staly zranitelnými vůči závislosti. Na závislosti se podílelo několik typů faktorů prostředí, včetně psychosociálních stresů, ale zdaleka nejsilnějším faktorem je vystavení se drogové závislosti. Ukázalo se, že některé „vstupní“ léky, zejména nikotin, zvyšují zranitelnost člověka vůči závislosti na jiném léku.3 Navíc se stále zvyšuje důkaz, že navzdory řadě genetických rizik pro závislost u celé populace může vystavení dostatečně vysokým dávkám léčiva po dlouhou dobu změnit člověka, který má poměrně nižší genetickou zátěž na závislého.4
Během posledních dvou desetiletí byl zaznamenán velký pokrok při identifikaci jak diskrétních oblastí mozku, které jsou důležité při zprostředkování syndromu závislostí, tak i typů změn na molekulární a buněčné úrovni, které drogy vyvolávají v těchto regionech, závislosti.1,5 Obvod, který získal největší pozornost, se nazývá mesolimbický dopaminový systém, který zahrnuje dopaminové neurony ve ventrální tegmentální oblasti (VTA) středního mozku, který inervuje středně velké spiny neurony v nucleus accumbens (NAc, část ventrálního striatu). Tyto neurony VTA také inervují mnoho dalších předních oblastí mozku, včetně hipokampu, amygdaly a prefrontální kůry (PFC).
Má smysl považovat tyto drogy-indukované závislosti mechanismy v tomto objemu na paměti pro tři překrývající se důvody.6
- Za prvé, všechna léčiva indukovaná adaptace mohou být viděna jako typy "molekulární nebo buněčné paměti:" nervové buňky, procházející takovými změnami, jsou odlišné v důsledku expozice léčiva, a proto reagují odlišně na stejnou drogu, na jiné léky nebo na řadu dalších podnětů jako výsledek.
- Za druhé, je zajímavé, že mnoho, možná většina, typů změn, které byly spojeny se stavem závislosti (např. změněná transkripce genu, epigenetika, plasticita synaptických a celých buněk a morfologie neuronů a neurotrofické mechanismy) jsou také zapleteny do tradičních forem "behaviorální paměti", jako je například prostorová paměť, kondicionování strachu a kondicionování operandů, mimo jiné.
- Za třetí, mezi oblastmi mozku postiženými zneužíváním drog jsou ty, které jsou klíčovými nervovými substráty pro behaviorální paměť, včetně hippocampu, amygdaly a PFC. To se shoduje s rostoucím uvědomováním, že některé z nejdůležitějších znaků klinicky pozorovaných závislostí (např. Touha po drogách a relaps) odrážejí abnormality v tradičních paměťových obvodech, s dlouhodobými vzpomínkami na zkušenosti s drogami, které slouží jako silné faktory návykové patologie.4,7,8 Naopak oblasti odměny mozku (např. VTA a NAc) účinně ovlivňují paměť chování.
Tento článek poskytuje přehled hlavních typů molekulových a buněčných změn, které se vyskytují v několika oblastech mozku ve zvířecích modelech závislostí, a soustředí se na nucleus accumbens, pro který je většina informací v současnosti k dispozici. Důležité je, že bylo možné stále častěji ověřit některé z těchto změn v závislých na člověku na základě studií post mortem mozků. Navzdory skutečnosti, že drogy zneužívání mají odlišné chemické struktury a působí na odlišné proteiny, je úžasné, že řada prominentních adaptací souvisejících se závislostmi je společná mnohým a v některých případech všem zneužívání drog a pravděpodobně přispívá ke společným rysům syndrom závislosti.4,9 Na rozdíl od toho je mnoho dalších léků indukovaných úprav specifických pro danou drogu a může zprostředkovat více jedinečných aspektů dané závislosti. Zaměřujeme se na stimulační a opiátové drogy zneužívání, které ve srovnání s jinými léky produkují dramatičtější účinky na zvířecích modelech. Zdůrazňujeme také důležité oblasti pro budoucí výzkum, které dále zvyšují naše znalosti o syndromech závislostí a překládají tyto pokroky do lepších diagnostických testů a léčby.
Transkripční a epigenetické mechanismy
Poznatky, že závislými osobami může zůstat zvýšené riziko relapsu navzdory letům abstinence, znamená, že závislost zahrnuje změny v mozku způsobené drogami, které mohou být velmi stabilní. Toto vedlo několik skupin, aby zvážily změny v genové expresi jako důležitou součást procesu závislosti (Obrázek 1). V souladu s tím studie kandidátních genů nebo genomové vyšetřování zahrnující DNA mikroskopické preparáty a novější RNA-sekvence (vysoce výkonné sekvenování exprimovaných RNA) identifikovala četné geny, jejichž exprese je změněna v dané oblasti mozku v modelech závislostí hlodavců a primátů a u lidí, kteří jsou závislí na člověku (např. odkaz 10-17). Příklady takových genů jsou diskutovány v následujících částech tohoto přehledu.
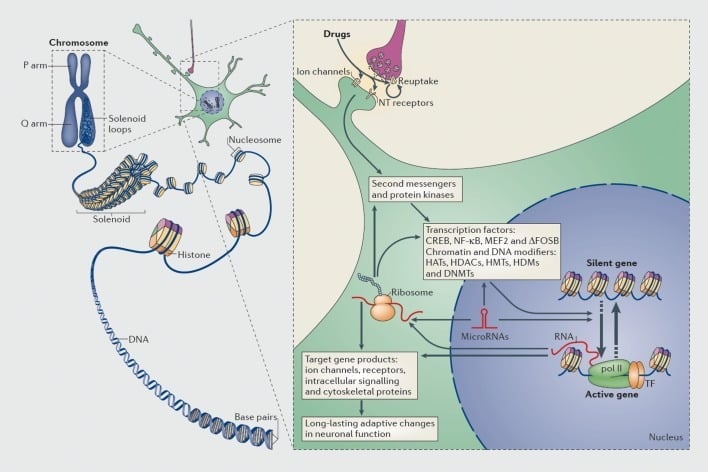
Mechanizmy transkripční a epigenetické regulace pomocí návykových látek. V eukaryotických buňkách je DNA organizována obalením kolem histonových oktomérů za vzniku nukleozomů, které jsou dále organizovány a kondenzovány za vzniku chromozomů (levá část). Pouze dočasným oddělením kompaktního chromatinu může být DNA specifického genu zpřístupněna transkripčnímu zařízení. Léčiva zneužívání působí prostřednictvím synaptických cílů, jako jsou mechanismy zpětného vychytávání, iontové kanály a receptory neurotransmiteru (NT), aby změnili intracelulární signalizační kaskády (pravá část). To vede k aktivaci nebo inhibici transkripčních faktorů (TF) a mnoha dalších jaderných cílů, včetně chromatin-regulačních proteinů (vyznačených silnými šipkami); podrobné mechanismy, které se podílejí na synaptické regulaci chromatin-regulačních proteinů, zůstávají špatně pochopitelné. Tyto procesy nakonec vedou k indukci nebo potlačení určitých genů, včetně těch, které se týkají nekódovaných RNA, jako jsou mikroRNA; pozměněná exprese některých těchto genů může dále regulovat genovou transkripci. Navrhuje se, aby některé z těchto změn indukovaných léčivem na úrovni chromatinu byly extrémně stabilní a tudíž podléhaly dlouhotrvajícímu chování, které definuje závislost. CREB, protein pro vazbu na prvek citlivý na cyklický AMP; DNMT, DNA methyltransferázy; HAT, histon acetyltransferázy; HDAC, histone deacetylázy; HDM, histon demethylasy; HMT, histon methyltransferázy; MEF2, faktor zvyšující specifické myocyty 2; NF-kB, jaderný faktor-KB; pol II, RNA polymeráza II. Reprodukce z ref 44: Robison AJ, Nestler EJ. Transkripční a epigenetické mechanismy závislosti. Nat Rev Neurosci. 2011; 12: 623-637.
Podobně mnoho typů transkripčních faktorů - proteinů, které se vážou na regulační oblasti genů a tím zvyšují nebo snižují transkripci těchto genů - se podílejí na zprostředkování dlouhodobých účinků zneužívajícího léku na genovou expresi v mozku. Mezi významné příklady patří CREB (protein vázající element cAMP odpovědi), ΔFosB (faktor transkripce rodiny Fos), NFkB (nukleární faktor kB), MEF2 (faktor zvyšující myocyty-2) a glukokortikoidní receptory.5,10,18-22 Bylo stále více možné pochopit buněčné signální dráhy, kterými zneužívající drogy aktivují daný transkripční faktor v mozku, a kauzálně spojovat takovou aktivaci s cílovými geny tohoto transkripčního faktoru a se specifickými behaviorálními aspekty závislosti (viz Obrázek 1). Tento pokrok je ilustrován zvážením CREB a ΔFosB, což jsou nejlépe studované transkripční faktory v modelech závislosti.
cAMP vazebný protein elementu odpovědi
Stimulační a opiátové léky zneužívání aktivují CREB v několika oblastech mozku důležitých pro závislost, včetně prominentně v NAc.23,24 Je známo, že CREB je aktivován v jiných systémech cAMP, Ca2+, a cesty růstového faktoru,25 a zatím není známo, které z nich zprostředkovává jeho aktivaci v NAc pomocí léků zneužívání. Ukázalo se, že aktivace léčiv CREB v NAc představuje klasický mechanismus negativní zpětné vazby, přičemž CREB slouží ke snížení citlivosti zvířete na prospěšné účinky těchto léků (tolerance) a ke zprostředkování negativního emočního stavu během vysazení léku (závislost).18,26,27 Tyto účinky byly nedávno prokázány za to, že vedou k zvýšenému samoadministraci a relapsu, pravděpodobně prostřednictvím procesu negativního zesílení.28 Zdá se, že tyto činy CREB zahrnují oba hlavní podtypy NAc středních nepravidelných neuronů, ty, které vyjadřují převážně D1 versus D2 dopaminových receptorů.24 IRozsáhlé množství literatury ukázalo, že CREB, působící v hipokampu a amygdale, je klíčovou molekulou v chování paměti.29-31 Tato široká role v závislosti a behaviorální paměti pravděpodobně odráží skutečnost, že neurony jsou napuštěny konečným počtem molekulárních mechanismů, které se přizpůsobí neustále se měnícímu prostředí.
Cílené geny pro CREB, které zprostředkovávají tento behaviorální fenotyp, byly zjištěny pomocí genomových testů a také více vybraných pokusů.10,18,32 Jedním příkladem je opioidní peptidový dynorfin: stimulační indukce exprese dynorfinů v neuronech NAc, zprostředkovaná prostřednictvím CREB, zvyšuje aktivitu dynorfinů k opioidním receptorům na neuronech VTA dopaminu a tím potlačuje dopaminergní přenos na NAc a poškozuje odměnu.18 Několik dalších cílů CREB bylo prokázáno jako důležité pro synaptickou plasticitu indukovanou léčivou látkou, jak je popsáno níže. Zatímco CREB je aktivován také v několika dalších oblastech mozku stimulanty a opiáty,23,24 méně je známo o důsledcích tohoto účinku na chování a cílových genech, přes které k nim dochází. Stejně tak méně je známo o úloze CREB při zprostředkování činnosti jiných návykových látek.19
ΔFosB
Akutní expozice prakticky jakéhokoli zneužívajícího léčiva indukuje všechny faktory transkripce rodiny Fos v NAc a několika dalších oblastech mozku. Tato indukce je rychlá, ale také velmi přechodná, přičemž hladiny proteinu Fos se vrátí k normálu v průběhu 8 až 12 hodin. Jedinečným z těchto proteinů rodiny Fos je ΔFosB, zkrácený produkt genu FosB, který se díky své neobvyklé stabilitě postupně akumuluje v průběhu opakované expozice léčiva a stává se převládajícím Fos proteinem exprimovaným za těchto podmínek.22,33 Navíc, kvůli této stabilitě, hladiny ΔFosB přetrvávají týdny po stažení léku. Taková chronická indukce ΔFosB byla prokázána prakticky všem zneužíváním34 a pro většinu léků je selektivní pro neurony NAc typu Dl.34,35 Bylo to také demonstrovat u lidí závislých.35 Velké množství literatury prokázalo, že taková indukce ΔFosB v D1-neurony typu NAc zvyšují citlivost zvířete na léčivo i přirozené odměny a podporují samopodávání léčiva, pravděpodobně prostřednictvím procesu pozitivního posilování (viz odkazy 34 na 38). Je zajímavé, že indukce DFosB v léčbě NAc je u dospívajících zvířat mnohem dramatičtější,,39 a bylo prokázáno, že jeho indukce nikotinem zprostředkovává nikotinové bráně podobné zvýšení kokainové odměny.40
Co se týče CREB, bylo v NAc identifikováno mnoho cílových genů pro ΔFosB za použití přístupů kandidátního genu a genomu.10,32 Zatímco CREB indukuje dynorphin, ΔFosB jej potlačuje, což přispívá k efektům ΔFosB pro odměnu.38 Dalším cílem ΔFosB je cFos: jak se ΔFosB akumuluje při opakované expozici léčiva, potlačuje c-Fos a přispívá k molekulárnímu přepnutí, při kterém je ΔFosB selektivně indukován v chronickém léčeném stavu.41 Bylo prokázáno, že mnoho jiných cílů ΔFosB zprostředkovává schopnost určitých léků zneužívání vyvolat synaptickou plasticitu v NAc a související změny v dendritické arborizaci NAc středních špinavých neuronů, jak bude popsáno níže.
Funkční důsledky indukce ΔFosB v jiných oblastech mozku je méně dobře známo, ačkoli byla podrobně studována jeho indukce v orbitofrontálním kortexu (OFC). DFosB zde zprostředkovává toleranci, která se vyskytuje na kognitivně narušujících účincích kokainu v průběhu chronické expozice, a tato adaptace je spojena se zvýšenou samoadministrací kokainu.42,43
Genomové testy naznačují několik potenciálních cílových genů, které zprostředkují tyto účinky.42 Navzdory jedinečným časovým vlastnostem ΔFosB a vědomím, že je indukován v tradičních paměťových obvodech (např. Hipokampu), dosud neproběhl průzkum role ΔFosB v behaviorální paměti, což je zajímavý předmět budoucího výzkumu.
Epigenetické mechanismy
V posledních letech byly studie transkripce posunuty o krok dál k epigenetice44 (Viz Obrázek 1), což může být široce definováno jako změna genové exprese, která nastává v nepřítomnosti změny v sekvenci DNA. Epigenetické mechanismy kontrolují balení DNA uvnitř buněčného jádra prostřednictvím interakcí s histony a mnoha jinými typy jaderných proteinů, které společně tvoří chromatin. Genetická exprese je řízena stavem tohoto balení prostřednictvím kovalentní modifikace histonů, jiných proteinů a samotné DNA. Jako jen některé příklady má acetylace histonů tendenci podporovat genovou aktivaci, metylace histonů může buď podporovat genovou aktivaci nebo represi v závislosti na reziduu Lys podstupujícím tuto modifikaci a methylace DNA je obecně spojena s represí genu, i když některé varianty formy methylace např. 5-hydroxymethylace) může být spojena s aktivací genu.
Epigenetika je atraktivní mechanismus, protože v jiných systémech, například vývojové a rakovinové biologii, mohou být některé epigenetické modifikace trvalé. Z tohoto důvodu, epigenetika byla sledována jak v učebních tak paměťových modelech (např. reflexe 45-48), stejně jako v závislosti;44,49 v obou systémech byly zaznamenány hluboké změny v acetylaci a methylaci histonu a v methylaci DNA. Jako jediný příklad je histonová methyltransferáza, G9a, zapojena do obou pamětí50 a závislost.51,52 V modelech závislosti, Výraz G9a je downregulován v odpovědi na stimulační nebo opiátové drogy zneužívání a tbylo prokázáno, že zvyšuje odměňující účinky těchto léků.51,52 Je zajímavé, že potlačení kokainu G9a je zprostředkováno pomocí ΔFosB. G9a katalyzuje dimethylaci Lys9 histonu H3 (H3K9me2), hlavního mediátoru represe genů. Chip-čip nebo ChIP-seq (chromatinová imunoprecipitace, následovaná promotorovými čipy nebo vysoce výkonným sekvenováním) byla použita pro získání genomových map genů v NAc, které vykazovaly změněný H3K9me2 po expozici stimulantu nebo opiátu.32,52,53 Tím, že se tyto seznamy genů překrývají se seznamy změn genové exprese v celém genomu a s mapami širokého rozsahu genomu mnoha dalších typů epigenetických modifikací (např. Vazba ΔFosB, vazba CREB, jiné histonové modifikace apod.),32,53 mělo by být možné identifikovat stále komplexnější skupinu genů, které jsou regulovány drogami zneužívajícími, a pochopit příslušné epigenetické mechanismy.
Další formou epigenetické regulace, která se podílí na paměti a závislostech, je generace mikroRNA. Tyto malé, nekódující RNA se vážou na komplementární oblasti mRNA a tím potlačují jejich translaci nebo indukují jejich degradaci. Vymazání Argonautu, proteinu rozhodujícího pro zpracování miRNA, mění reakce na chování kokainu, s odlišnými účinky pozorovanými pro středně spiny neurony typu D1 versus D2.54 Bylo také prokázáno, že několik specifických miRNA je regulováno expozicí léčiva a následně má vliv na reakce v chování na léky (např. Ref. 55,56). Bude vzrušující v budoucích studiích identifikovat cíle mRNA těchto miRNA a charakterizovat, jak ovlivňují proces závislostí.
Synaptická plasticita
Stejné obecné typy synaptických modifikací u glutamatergických synapsí, které se podílely na hipokampu a amygdálce v paměti chování (viz další články v tomto čísle), se podobně ukázalo, že se vyskytují v oblastech odměňování mozku v modelech závislosti a jsou důležité při zprostředkování procesu závislosti.57,58 Takováto synaptická plasticita vyvolaná léčivou látkou byla popsána v několika oblastech mozku, nicméně se zde soustředíme na NAc, kde se většina výzkumu soustředila (Obrázek 2).
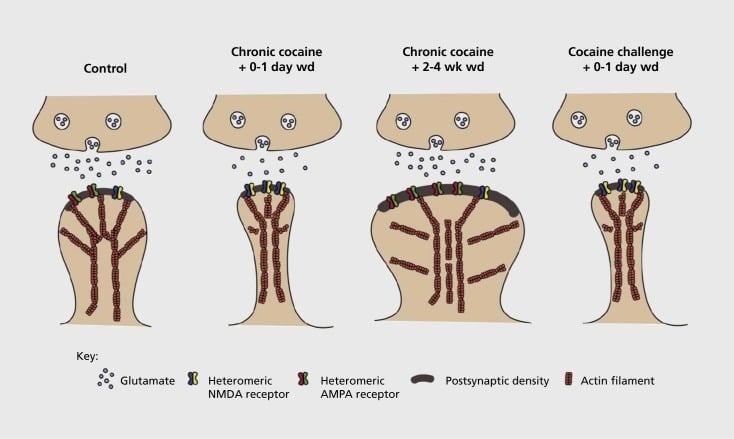
Model synaptické a strukturální plasticity související s návykem v nucleus accumbens (NAc). Chronická expozice kokainu vede k časově závislé a přechodné reorganizaci glutamátových receptorů kyseliny α-amino-3-hydroxy-5-methyl-4-isoxazolpropionové (AMPA) a N-methyl-D-asparagové (NMDA) (MSN), stejně jako strukturální změny v hlavě páteře NAn MSNs, které korelují s odlišnými formami synaptické plasticity. Například chronický kokain indukuje povrchovou expresi NMDA receptorů, tichou synapse a dlouhodobou depresi (LTD) v časných odstupech. Během delšího prodloužení (wd) se tyto synaptické změny mění, výsledkem je zvýšená exprese povrchových AMPA receptorů, konsolidace synapse do hřbetního tvaru hřbetu a dlouhodobé potenciace (LTP). Tyto účinky se rychle vracejí zpět po vystavení provokační dávce kokainu vedoucí k restrukturalizaci páteře do tenkých trupů a poklesu synaptické síly.
Počáteční experimenty prokázaly, že opakovaná expozice stimulativním lékům způsobuje abnormální stav v podobě glutamatergických synapsí v NAc.59 Nedávná práce však prokázala, že taková plasticita je velmi časově závislá a že LTD se vyskytuje brzy po poslední expozici kokainu, která se vyvíjí do více podoby stavu LTP (dlouhodobé potenciace) po delších časových odstínech.60,61 Tato práce, která se dosud provádí především za použití zkoušeného léku - na rozdíl od léků užívajících sama sebe, vymezuje potřebu systematičtějších výzkumů v modelech samosprávy, které sledují formy synaptické plasticity, které se vyskytují u glutamatergických synapsí NAc přes detailní časový průběh od získání samosprávy k jeho udržování, v různých časech odebrání a zániku a v reakci na podněty vyvolávající recidivu. Dosavadní práce také definovala některé z molekulárních mechanismů, které přispívají k této synergické plasticitě indukované léčivou látkou, včetně přenosu AMPA receptorů na synapsii částečně zprostředkovanou prostřednictvím CaMKII (Ca2+/ kalmodulin-dependentní proteinkináza II) fosforylace některých AMPA receptorových podjednotek stejně jako změněná exprese receptorových podjednotek AMPA (např. 60,62-65, Čísla 2 a 3). Role CREB a ΔFosB se podílí na těchto jevech i na souvisejících změnách v morfologii glutamatergických synapsí (viz níže). Například GluAI je cílem pro CREB v NAc, kde GluA2 a CaMKII jsou oba cíle DFosB v této oblasti mozku .35,36,66,67 Pohybem dopředu bude důležité propojit specifické úpravy s časově závislými změnami v synaptické funkci a behaviorálními vlastnostmi závislosti.
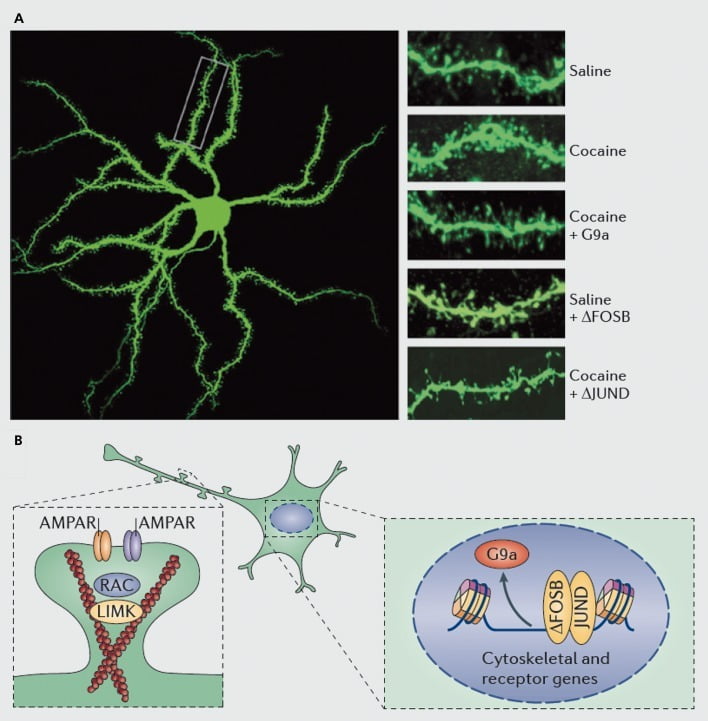
Molekulární mechanismy, které jsou základem indukce kokainu dendritických trnů na středně ostnatých neuronech nucleus accumbens (NAc). A) ukazuje zvýšení počtu dendritických páteřů vyvolané kokainem, které lze blokovat nadměrnou expresí viru G9a nebo JunD (antagonista transkripce zprostředkované AP1) nebo napodobit nadměrnou expresí viru FosB. B) Ukázalo se, že důležitou roli hraje regulace obchodování s AMPA receptorem (AMPAR) a aktinového cytoskeletu (vlevo), jakož i regulace transkripce glutamátových receptorů a regulačních proteinů aktinu (např. Zprostředkovaná prostřednictvím ΔFosB, vpravo) při zprostředkování regulace kokainu NAc hustoty dendritické páteře. Kináza UMK, LIM domény; RAC, substrát C3 botulotoxinu související s Ras.
Nové experimentální nástroje umožňují poprvé definovat s rostoucí přesností, které jednotlivé obvody zobrazují tyto formy synaptické plasticity a jaké behaviorální abnormality zprostředkovávají. Například thejnové a jádrové subregiony NAc vykazují rozdíly v synergické plasticitě indukované léčivou látkou, podobně jako u dusíkových neuronů typu D1 versus D2 v každém subregionu.60,63,64,67 Podobně optogenetické experimenty poskytly nový pohled na příspěvek konkrétní formy synaptické plasticity (např. LTD) u specifických populací glutamatergických synapsí v NAc, například těch, které vznikají od mediálního PFC versus bazolaterální amygdaly versus ventrální subiculum (hlavní produkční hipokampu).68-70 Nakonec bude nutné překrýt molekulární adaptace vyvolané léky v každém z těchto aferentních neuronů adaptacemi specifickými pro synapse, které se vyskytují v jejich postsynaptických dendritech, aby bylo možné získat úplné pochopení toho, jak zneužívané drogy modifikují obvody mozku, aby řídily konkrétní aspekty závislý stát. Tato snaha bude vyžadovat větší zhodnocení plasticity vyvolané léky na inhibičních synapsích v rámci stejných oblastí mozku, což je oblast, které se dosud věnovalo velmi málo pozornosti.65
Plastičnost celých buněk
Zatímco většina výzkumů zahrnujících neurofyziologické změny v neuronech v jevu zneužívání drog, jako u fenomén učení a paměti, se soustředila na synaptickou plasticitu, rostou důkazy o významu plasticity celých buněk. Plastičnost celých buněk, označovaná také jako homeostatická plasticita,71 zahrnuje změny v vnitřní excitabilitě celé nervové buňky způsobem, který není specifický pro synapse. Vzhledem k tomu, že některé vlastnosti drogové závislosti zahrnují zvýšenou nebo sníženou citlivost na léčivo, má smysl, že zvýšená nebo snížená elektrická excitabilita určitých nervových buněk přispívá k těmto adaptacím chování.5
Projekt nejlepším příkladem plasticity celých buněk vůči zneužívajícímu léku je schopnost chronických opiátů zvýšit vnitřní excitabilitu noradrenergních neuronů lokusu coeruleus (LC).72 Tato zvýšená excitabilita je zprostředkována pomocí CREB a jeho indukcí určitých isoforem adenylylcyklázy, které pohánějí zvýšené spalování LC neuronů snad indukcí Na + kanálů.72-75 Tato hyperexcitabilita LC neuronů představuje klasický mechanismus tolerance a závislosti a pohání některé z příznaků a symptomů opiátů. Je zajímavé, že CREB zprostředkovává podobnou plastičnost celých buněk v neuronech středních spiny neuronů NAc, které jsou také chronologicky vystaveny zneužívání drog prostřednictvím CREB.76 Bude proto kritické v budoucích výzkumech pochopit, jak CREB-zprostředkovaná synaptická plasticita glutamatergických synapsí na NAc středních špinavých neuronech65,66 souhrny s CREB-zprostředkovanou vnitřní hyperexcitabilitou těchto neuronů76 ke kontrole behaviorálních vlastností závislosti.
Dalším příkladem plasticity celých buněk u modelů závislosti je hyperexcitabilita dopaminových neuronů VTA, ke kterým dochází po chronické expozici opiátovým lékům abusaObrázek 4).77,78 Tato adaptace, která byla spojena s morfologickými změnami v těchto nervových buňkách (viz následující část), není zprostředkována CREB, ale dosáhla místo toho regulací neurotrofických signalizačních kaskád, jak je popsáno níže.

Pracovní model chronických adaptací indukovaných morfinem v dopaminových neuronech ventrální tegmentální oblasti (VTA). Chronický morfin snižuje velikost VTA dopaminu (DA) soma, ale zvyšuje excitabilitu neuronů, zatímco přenos dopaminu do nucleus accumbens je snížen. Čistý efekt morfinu je méně citlivý způsob odměňování, tj. Odměna tolerance. Downregulace signalizace IRS2-AKT ve VTA zprostředkovává účinky chronického morfinu na velikost soma a elektrickou excitabilitu; účinek na excitabilitu je zprostředkován sníženými proudy kyseliny γ-aminomáselné (GABA) A a potlačením exprese kanálu K '. Morfino-indukovaná downregulace aktivity mTORC2 ve VTA je zásadní pro tyto morfino-indukované morfologické a fyziologické adaptace, stejně jako pro toleranci odměňování. Na rozdíl od mT0RC2, chronický morfin zvyšuje aktivitu mTORCI, která neovlivňuje tato morfinem indukovaná adaptace. BDNF, neurotrofický faktor pocházející z mozku; IRS, inzulínová receptorová látka; mTORC, mTOR komplex; AKT, protein kináza B Reprodukce z ref 77
Morfologická plasticita a neurotrofické mechanismy
Zvyšující se důkazy, z velké části ze studií hipokampálních a mozkových kortikálních neuronů, ukázaly, že změny synaptické plasticity jsou spojeny s morfologickými změnami v synapsech. Například LTD a generace tichých synapsí jsou spojeny s tvorbou tenkých nebo trnitých dendritických hřbetů, zatímco LTP je spojeno s větším hřibem ve tvaru hub.79,80 Je tedy zajímavé, že oblast zneužívání drog se více než 15 let zaměřuje na změny vyvolané drogami v dendritických trnech. Chronické vystavení stimulační drogy zneužívání zvyšují hustotu dendritického páteře středních špicích neuronů NAc, což je změna, která převládá u neuronů typu Dl.67,81,82 Indukce páteře byla většinou spojena se senzitizovanými behaviorálními reakcemi na tyto léky, i když některé důkazy jsou v rozporu s tímto pohledem.
Stejně jako u studií synaptické plasticity je však zapotřebí mnohem více práce, aby bylo možné systémově definovat změny dendritických páteří, ke kterým dochází během průběhu samoadministrace, odvykání a relapsu. SDosavadní studie zahrnující vyšetřující a samovolně podávané léky naznačují velmi odlišné změny páteře, k nimž dochází v různých časových odstupech odběrů a v oblastech NAc shell versus core subregions.83-86 Bude také důležité definovat přesné molekulární mechanismy, kterými kokain nebo jiný stimulant produkuje tyto časově závislé a buněčné specifické účinky. Ukázalo se, že ΔFosB je nezbytný a dostatečný pro indukci nezralých trnů na neuronech NAc typu D1.35,51,67 Tato regulace nastává v součinnosti s kokainem a regulací ΔFosB několika proteinů, o nichž je známo, že kontrolují reorganizaci aktinového cytoskeletu. Jako jediný příklad transkripční regulace několika faktorů výměny guaninových nukleotidů a proteinů aktivujících GTPázu vyvolává rakovinu Rac1, malou GTPázu, pro přechodné snížení aktivity v odezvě na každou expozici kokainu a takové pulzující snížení aktivity Rac1 bylo prokázáno za použití optogenetické kontroly přípravku Rac1, aby zprostředkoval indukci nezralých trnů.87 Tyto účinky přípravku Racl se pravděpodobně vyskytují díky kontrole kofilinu a ostatních aktinových regulačních proteinů, u kterých se také ukázalo, že zprostředkovávají regulaci růstu páteře kokainem.87,88 Je však důležité zdůraznit, že toto je jen jedna cesta zapojená do regulace kokainu nezralých trnů, protože bylo prokázáno, že zásadní roli hraje také několik dalších proteinů, včetně CDK5 (cyklin-dependentní kináza-5), CaMKII, NFkB , MEF2, CREB, G9a a DNMT3 (DNA methyltransf mazat 3a), abychom jmenovali alespoň některé.20,21,35,51,67,89,90 Je zajímavé, že kokainová regulace několika těchto genů, včetně indukce CDK5, CaMKII a NFkB a potlačování G9a, je také zprostředkována pomocí ΔFosB.20,35,51,91
Překvapivě, opiátové drogy zneužívání mají opačný účinek a snižují hustotu dendritického páteře středních špinavých neuronů NAc.81 Málo se známe důsledky této adaptace na chování a příslušné molekulární mechanismy. Tento jev je, nicméně překvapující, vzhledem k tomu, že CREB a ΔFosB jsou indukovány oběma stimulanty a opiáty a oba jsou zapojeni do stimulačně zprostředkované indukce hustoty dendritické páteře NAc. To vyvolává otázku, jak opiáty potlačují hustotu páteře NAc navzdory jejich indukci.
Druhou hlavní formou morfologické plasticity, která se projevuje u modelů zneužívání drog, je fyzická redukce buněčné soma velikosti dopaminových neuronů VTA vyvolaných chronickým podáním opiátů.77,92,93 Podobná adaptace nastává v reakci na kanabinoidy.94 Toto smrštění dopaminových neuronů VTA, ke kterým dochází při opiátové samo-podávání93 a byl dokumentován u lidských závislých na heroinu vyšetřovaných postmortálně,77 zdá se, že zprostředkovává toleranci odměn a je spojena se sníženým uvolňováním dopaminu v NAc. Značný důkaz nyní naznačuje, že toto snížení velikosti buněčných soma je zprostředkováno opioidovou supresí exprese neurotrofního faktoru odvozeného z mozku (BDNF) v těchto neuronech. Přímé propojení tohoto opiátů vyvolaného stažení BDNF nosiče a smrštění neuronů VTA ke snížené aktivitě sestupných signálních kaskád BDNF v dopaminových neuronech VTA, specificky snížené aktivity IRS2 (substrát receptoru inzulínu-2), AKT (serin-threonin kinasa) a TORC2 (cíl rapamycinu-2, který je necitlivý na rapamycin).77,93 Také jsme spojili tuto downregulaci signalizace BDNF přímo se zvýšenou excitabilitou, kterou morfin indukuje v těchto neuronech, jak bylo poznamenáno dříve.77,78 Skutečně, snížená velikost buněčné somy a zvýšená excitabilita jsou těsně spojeny, protože indukce jednoho vede k druhému a naopak. Tato kontrola excitability buněk zahrnuje potlačení K+ kanálů a GABAA proud v těchto neuronech.
Tato role BDNF při kontrole morfinových odpovědí na úrovni VTA kontrastuje s jeho velmi odlišným zapojením do akcí kokainu a dalších stimulantů. Stimulanty indukují signalizaci BDNF na NAc, což je důsledek zvýšené lokální syntézy BDNF a také zvýšené uvolňování z několika aferentních oblastí.95 Kromě toho bylo prokázáno, že zvýšená signalizace BDNF v NAc, ale ne ve VTA, podporuje účinky na chování těchto léčiv, včetně jejich samosprávy.95,96 Opačná regulace signalizace BDNF v dráze VTA-NAc opiáty versus stimulanty zvyšuje možnost, že tyto rozdíly zprostředkovávají opačnou regulaci dendritických páteřů NAc, což je nyní zkoumána možnost.
Budoucí pokyny
Výše uvedený příběh podtrhuje obrovské pokroky, které byly učiněny při porozumění molekulárních a buněčných adaptací, které se vyskytují v oblastech odměňování mozku v reakci na opakované vystavení drogovému zneužívání, a v souvislosti individuálních úprav určitých charakteristik chování syndromů závislosti na zvířecích modelech . Navzdory těmto pokrokům zůstávají hlavní otázky. Většina našich stávajících znalostí se zaměřuje na VTA a NAc, s mnohem méně informací o jiných klíčových limbických oblastech mozku, které jsou také důležité pro drogovou závislost. Navíc všechny experimentální demonstrace příčinné úlohy molekulárně-buněčné adaptace v chování souvisejícím s drogami manipulovaly individuální adaptace po jednom. Manipulace s četnými úpravami současně je zjevně mnohem obtížnější, ale je také zásadní, protože víme, že drogy produkují velké množství různorodých typů změn i v rámci jednotlivých neuronů, což pravděpodobně sumarizuje složitými způsoby, jak ovlivňovat chování. Takový přístup založený na systémové biologii bude mít zásadní význam pro nakonec popraskání biologických podkladů závislosti. Konečně snahy o pochopení molekulárně-buněčných mechanismů vzpomínek souvisejících se závislostí se nacházejí v okamžiku, kdy se všechny ostatní snahy o pochopení biologické základny chování v paměti chovají: naše schopnost spojit biologické jevy s komplexní behaviorální pamětí zůstává extrémně obtížná. Překonání tohoto rozdílu představuje možná největší výzvu v neurovědách.
Vybrané zkratky a zkratky
- Nac
- nucleus accumbens
- CREB
- cAMP vazebný proteinový element
- ΔFosB
- faktor transkripce rodiny Fos
- VTA
- ventrální tegmentální oblast
- AMPA
- a-amino-3-hydroxy-5-methyl-4-isoxazolpropionová kyselina
- LTD
- dlouhodobé deprese
- LTP
- dlouhodobé protentiace
- BDNF
- neurotrofický faktor pocházející z mozku
- NKkB
- jaderný faktor kB
REFERENCE