Vědecké zprávy objem 9, Číslo článku: 16918 (2019)
Abstraktní
Nadměrná spotřeba sacharózy vyvolává touhu po závislosti, která může podpořit epidemii obezity. Opioidy a dopamin zprostředkovávají prospěšné účinky drog zneužívání a přírodních výhod z podnětů, jako je chutné jídlo. Zkoumali jsme účinky sacharózy pomocí PET zobrazování pomocí [11C] karfentanil (agonista μ-opioidního receptoru) a [11C] racloprid (antagonista dopaminového D2 / 3 receptoru) u sedmi ženských anestetizovaných miniprasů Göttingen. Poté jsme umožnili miniprasům přístup k roztoku sacharózy po dobu jedné hodiny ve 12 po sobě následujících dnech a znovu jsme provedli zobrazování 24 hodin po posledním přístupu k sacharóze. U menšího vzorku pěti miniprasek jsme provedli další [11C] carfentanil PET relace po první expozici sacharózy. Vypočítali jsme vazebné potenciály voxel (BPND) s využitím mozečku jako oblasti nevysunitelné vazby, analyzováním rozdílů se statistickým neparametrickým mapováním a provedením regionální analýzy. Po 12 dnech přístupu k sacharóze, BPND U obou indikátorů došlo k významnému poklesu ve striatu, nucleus accumbens, thalamus, amygdala, cingulate cortex a prefrontal cortex, což je v souladu se snížením hustoty receptorů. Po jediné expozici sacharóze jsme zjistili sníženou vazbu [11C] karfentanil v jádru accumbens a cingulate cortex, v souladu s uvolňováním opioidů. Nižší dostupnost opioidních a dopaminových receptorů může vysvětlit návykový potenciál spojený s příjmem sacharózy.
Úvod
Pět procent světové populace je klinicky obézních1. Jako punc metabolického syndromu je obezita spojena s diabetem 2. typu, kardiovaskulárním onemocněním, respiračními problémy a rizikem deprese a možná demence.2. Zvýšená spotřeba energeticky hustých potravin zveličovala fyziologické rozlišení mezi homeostatickým hladem, který následuje po nedostatku potravy, a hedonickým hladem, neboli „touhou“, ke které dochází při absenci nedostatku.3,4. Protože samotný homeostatický předpis nemůže vysvětlit současný nárůst obezity, je nutné testovat účinek odměn a potěšení návykových vlastností vysoce chutného jídla na mozkové mechanismy.
Spotřeba sacharózy je spojena s obezitou a sacharóza je stále více považována za návykovou látku5. Některá zjištění jsou v rozporu s tímto tvrzením kvůli obtížím při oddělování nepřijatelné konzumace potravin od hedonických potravinových reakcí a při určování návykové složky ve zpracovaných potravinách, jakož i různých mechanismů, kterými potravina mění obvody mozku přirozenými cestami.6. Ve specifických kontextech však příjem sacharózy vyvolává odměnu a touhu, srovnatelnou s těmi, které vyvolávají návykové drogy, což vede k nadměrné spotřebě a eventuální obezitě6,7.
Hlad je spojen s „touhou“, která úzce souvisí s účinky dopaminergní neurotransmise za řady okolností odměňování8, ale zůstává nejasné, jak je modulován účinek dopaminu (DA) v reakci na nutkavé stravování. Spotřeba chutných potravin je spojena s „laskavostí“, zprostředkovanou primárně endogenním opioidním systémem, zejména μ-opioidním receptorem (μOR)9,10, což může podpořit nadměrnou spotřebu při deregulaci. V této zprávě testujeme tvrzení, že sacharóza vede k uvolňování opioidů a dopaminu, což snižuje dostupnost μOR a DA D2 / 3 receptorů. Dostupnost je indexem počtu neobsazených receptorů dostupných pro navázání na stopovací látky a v zásadě nerozlišuje mezi obsazením ligandu a hustotou receptoru11.
Nástup kompulzivního stravování závisí na mnoha faktorech a kauzální studie na lidech vyvolávají etické problémy. Většina studií se proto zaměřuje na stravovací chování u potkanů12. Ačkoli krysy mají „sladký zub“, jejich homeostatické mechanismy důležité pro přibírání na váze, metabolismus a typ hromadění tuku se výrazně liší od mechanismů u lidí. Göttingenův minipig je velké všežravé zvíře s dobře vyvinutým gyrencefálním mozkem, který lze zobrazovat v dostatečném rozlišení. Její dobře definované subkortikální a prefrontální kortikální oblasti13 umožňují přímější překlad do funkce lidského mozku. K testování používáme zde pozitronovou emisní tomografii (PET) in vivo Dostupnost μOR a DA D2 / 3 v minipraskovém modelu subchronické expozice sacharóze. V menším vzorku jsme zkoumali okamžité účinky na obsazenost μOR po první expozici sacharóze. Nakonec jsme testovali vztah mezi změnami v dostupnosti receptoru těchto dvou indikátorů.
výsledky
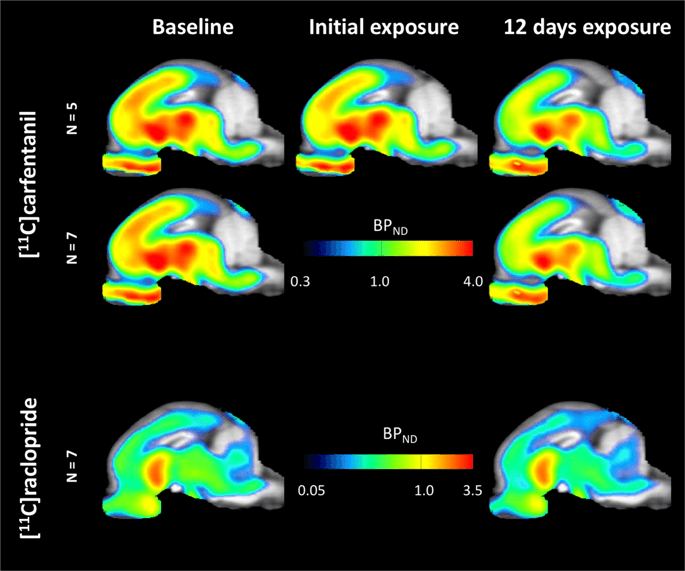
Průměrné parametrické mapy [11C] carfentanil a [11C] raclopridový vazebný potenciál (BPND) jsou znázorněny na obr. 1. Analyzovat změny, které nastaly po první expozici sacharóze u pěti minipraserů ve srovnání s výchozím stavem, a jeden den po 12th přístup k sacharóze v sedmi miniprasech ve srovnání s výchozím stavem, použili jsme permutační teorii a ne-regionálně omezenou analýzu celého mozku, preferovanou metodu pro vzorky této velikosti14.
Průměrný nevypojitelný vazebný potenciál voxelů (BPND) mapy umístěné na MRI obrazech v sagitálním pohledu. Data jsou uvedena pro [11C] karfentanil BPND z 5 miniparů zobrazených na počátku, po počáteční expozici sacharóze a po 12 dnech expozice sacharóze (horní řada). [11C] karfentanil BPND všech 7 miniparů zobrazených na začátku a po 12 dnech přístupu ke sacharóze je uvedeno ve střední řadě. [11C] racloprid BPND všech 7 miniparů zobrazených na začátku a po 12 dnech přístupu ke sacharóze je uvedeno ve spodním řádku. Mějte na paměti, že barevná stupnice je exponenciální pro zvýraznění [11C] racloprid BPND v mimozemských regionech.
Počáteční expozice sacharóze
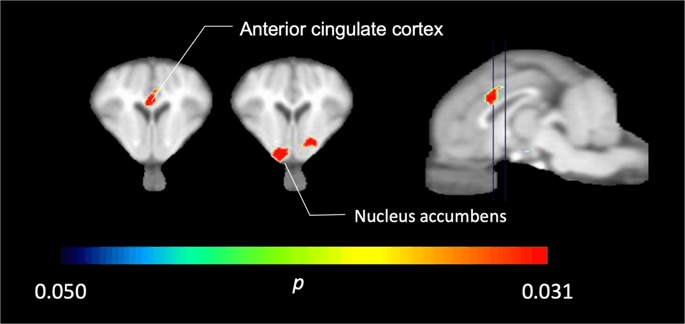
U pěti miniparů zobrazených pomocí [11C] karfentanilu na počátku a bezprostředně po první expozici sacharosy jsme zjistili signifikantně sníženou vazbu stopovací látky v kortexu předního cingulátu a jádro accumbens v reakci na sacharózu, znázorněné barevně na Obr. 2, což naznačuje p <0.05. Zjistili jsme až 14% snížení vazby značkovače v obou oblastech ve srovnání s výchozí hodnotou.
Významné snížení v [11C] karfentanil BPND po první expozici sacharosové vody ve srovnání s výchozím stavem (n = 5). Pouze voxely s významným (p <0.05) poklesy jsou zobrazeny jako barevné oblasti promítané na řezy MRI vážené T1 na úrovni přední cingulární kůry (vlevo) a nucleus accumbens (uprostřed) ze stereotaxického atlasu minipig prasete. Všimněte si, že maximální úroveň významnosti dosažitelná u 5 zvířat je 2-5 ≈ 0.031 (viz barevná lišta). Údaje jsou uvedeny na koronálních řezech mozku prasete v hladinách uvedených na sagitálním obrázku (vpravo).
12 dnů přístupu k sacharóze
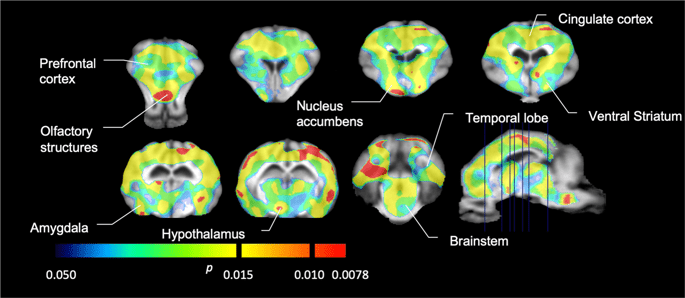
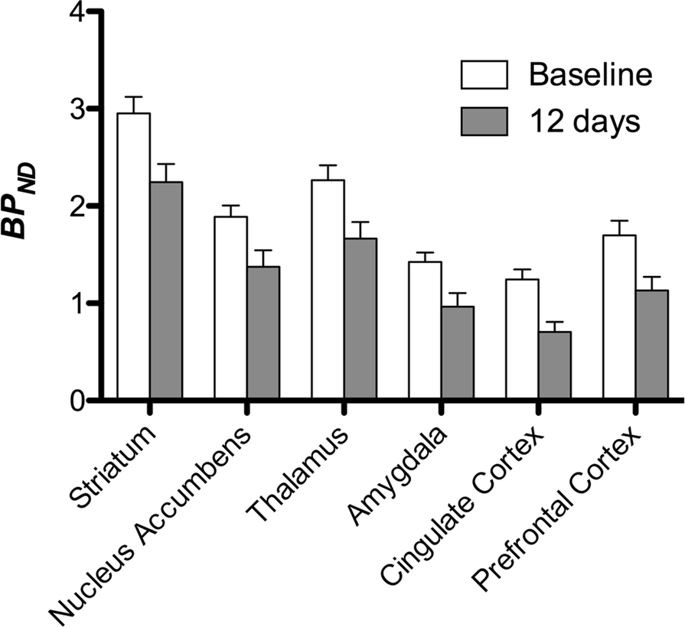
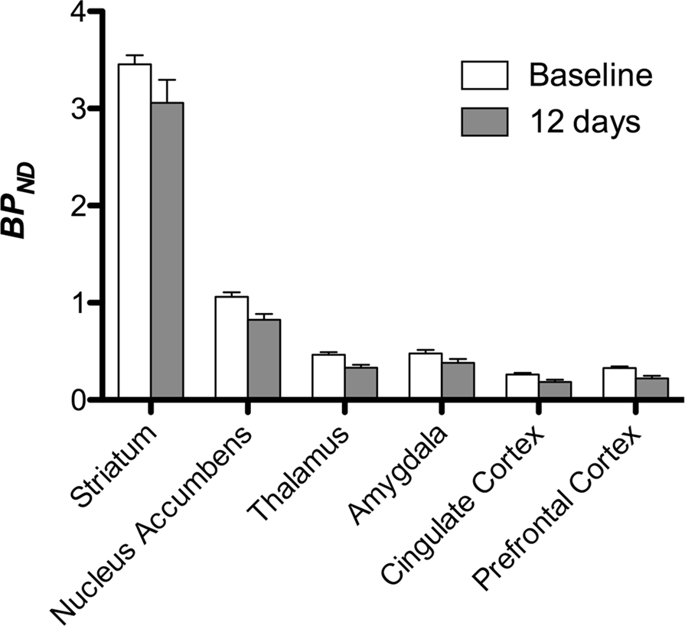
Poté jsme provedli analýzu sedmi miniprasek zobrazených pomocí [11C] karfentanil na začátku a po 12 dnech přístupu ke sacharóze a zjistil signifikantně sníženou vazbu stopovacích látek u zvířat vystavených sacharóze ve srovnání se základní hodnotou. Nejvýrazněji postižené oblasti jsou na obr. XNUMX znázorněny červeně. 3 (p <0.01) a zahrnují části čichových struktur, nucleus accumbens / ventrální striatum a temporální kůru / lalok, následované žlutými oblastmi (p <0.015), které zahrnovaly části prefrontální kůry, cingulární kůru, amygdalu a mozkový kmen . Za účelem získání BPND hodnoty a vyhodnotit procentuální změnu, provedli jsme regionální analýzu a získali průměrné hodnoty v každém regionu na začátku a po konzumaci sacharózy (Obr. 4).
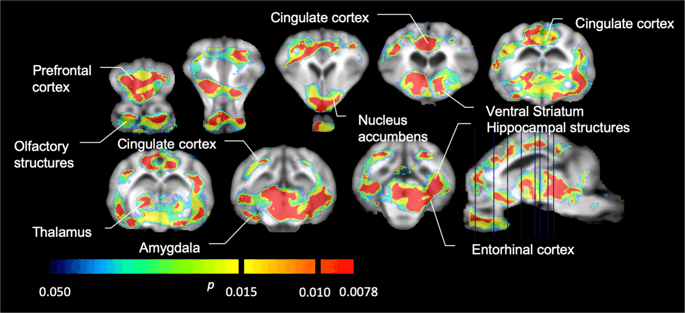
Významné snížení v [11C] vazebný potenciál karfentanilu (BPND) mezi základní hodnotou a po 12 dnech expozice sacharosové vodě (n = 7). Voxely s významnými (p <0.05) poklesy jsou zobrazeny jako barevné oblasti promítané na řezy MRI vážené T1 ze stereotaxického atlasu mozku mini prasat. Data jsou prezentována na řezech koronálního mozku na úrovních uvedených na sagitálním obrázku (vpravo dole). Všimněte si, že maximální úroveň významnosti dosažitelná u 7 zvířat je 2-7 ≈ 0.0078 (viz barevná lišta).
Použili jsme [11C] racloprid jako indikátor DA D2 / 3 receptorů ve striatálních a extrastriatálních mozkových oblastech v miniprasách na začátku a po 12 dnech přístupu ke sacharóze (Obr. 1). Zjistili jsme sníženou vazebnou stopu u zvířat exponovaných sacharóze ve srovnání s výchozí hodnotou s největšími účinky (p <0.01) v oblastech prefrontální kůry, nucleus accumbens / ventral striatum, cingulate cortex, amygdala, thalamus, mesencephalon, hipokampální oblasti a čichové oblasti (Obr. 5). Data z regionální analýzy jsou uvedena na Obr. 6.
Významné snížení v [11C] raclopridový vazebný potenciál (BPND) mezi základní hodnotou a po 12 dnech expozice sacharosové vodě (n = 7). Voxely s významnými (p <0.05) poklesy jsou zobrazeny jako barevné oblasti promítané na řezy MRI vážené T1 ze stereotaxického atlasu mozku mini prasat. Data jsou prezentována na koronálních částech vepřového mozku v úrovních uvedených na sagitálním obrázku (vpravo dole). Všimněte si, že maximální úroveň významnosti dosažitelná u 7 zvířat je 2-7 ≈ 0.0078 (viz barevná lišta).
Korelace mezi [11C] racloprid a [11C] carfentanil data
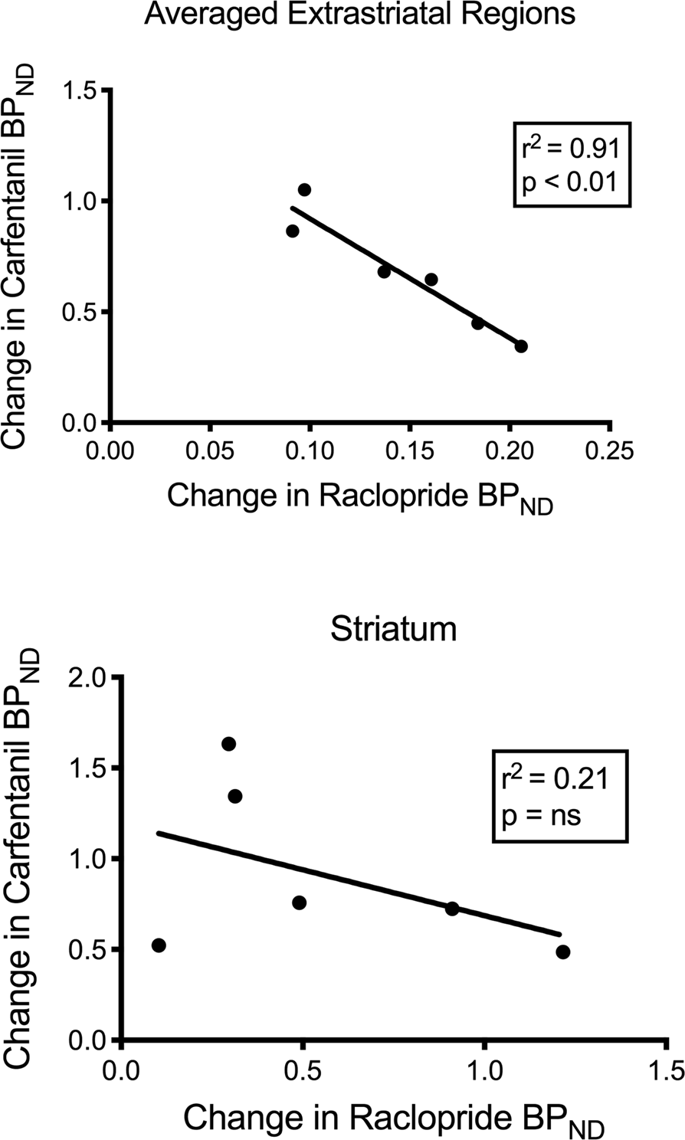
Testovali jsme potenciální korelaci mezi [11C] racloprid a [11C] hodnoty karfentanilu BPND ve striatálních a nestraniálních regionech v miniprasatech na začátku a po 12 dnech příjmu sacharózy, bez pozorování asociací. Potom jsme testovali, zda poklesy vazby indikátorů korelovaly, a porovnali jsme změny BPND pro [11C] raclopride se změnami BPND pro [11C] carfentanil pouze v miniprasatech, které měly nižší BPND obou indikátorů po příjmu sacharózy (n = 6). Zjistili jsme signifikantní negativní korelace v průměrném mimstriatálním (r2 = 0.91, p <0.01), ale ne ve striatálních oblastech (obr. 7).
Korelace mezi pre-minus post-odmítnutí [11C] racloprid a [11C] vazebné potenciály karfentanilu (BPND) u miniprasů se sníženou vazbou stopovacího činidla po příjmu sacharózy (n = 6). Jsou uvedena data z průměrovaných mimstriatálních oblastí (nahoře) a striata (dole). Koeficient stanovení (r2) a hodnoty p jsou zobrazeny pro každý graf.
Diskuse
Stanovili jsme účinky opakovaného přerušovaného přístupu k sacharóze na opioidní a DA neurotransmise v mozku savců. Podélný in vivo PET zobrazování receptorů μOR a DA D2 / 3 odhalilo sníženou dostupnost receptoru v okruhu odměňování, včetně nucleus accumbens, prefrontální kůry a přední mozkové kůry. Výsledky jasně ukazují, že sacharóza ovlivňuje mechanismy odměňování podobným způsobem jako zneužívání drog.
Je známo, že příjem sacharózy jako chutné látky uvolňuje DA a vyvolává závislost na hlodavcích15, se sacharózou se ukázalo být ještě příjemnější než kokain u hlodavců v určitých kontextech. Hlodavci tedy intenzivněji pracují na získání sacharózy než kokainu, a to i při nedostatku potravy5. Účinky sacharózy jsou však regulovány jak homeostatickým systémem, tak hedonickými systémy odměňování16,17 to může zprostředkovat rozlišení mezi nutričními a hedonickými aspekty působení sacharózy18. Rozhodli jsme se pro hodinový rozvrh hodin za účelem podpory „bingingu“, protože předchozí studie na potkanech odhalily vyšší příjem během první hodiny denního přístupu v přerušovaném režimu15,19. Behaviorální studie příjmu potravy se často zaměřují na zvířata omezená na potraviny, ale návrh nemusí nutně odrážet stejné nervové mechanismy aktivní v obezitě. Prasata v této studii nebyla omezena na potraviny a kromě přístupu ke sacharóze byla krmena obvyklým množstvím jejich normální stravy.
Opioidní receptory (OR) jsou široce exprimovány v mozku, konkrétně ve strukturách, o nichž je známo, že modulují procesy stravování a odměňování20. Ukázalo se, že nejvzdálenější regiony jsou důležité v odměňovacích a relabujících účincích kokainu21,22,23,24. Změny ve vazbě byly také spojeny s homeostatickými odpověďmi na jídlo a potěšením spojeným s chutným jídlem25. Zejména „obliba“ jídla je spojena s endogenním opioidním systémem, zejména s μOR9,10 ve skořápce nucleus accumbens a ventrálním pallidum26. Infuze agonisty μOR do odlišných částí nucleus accumbens a ventrálního pallidum silně zvyšují „oblíbená“ chování, včetně výběžků jazyka a olizování tlapky, po zvýšeném chutném příjmu potravy27,28,29. Další důkaz pro opioidní signalizaci při zpracování hedonické regulace pochází od μOR antagonistů, kteří utlumují spotřebu chutné chow v obou podle libosti- zvířata s omezeným příjmem potravy a zvířat s omezeným přístupem k potravě, ale s omezenějším účinkem na příjem neochutnatelných standardních pelet30,31. U lidí antagonisté μOR snižují krátkodobý příjem potravy a snižují příjemnost chutných potravin32,33,34. Signalizace opioidů v bazolaterální amygdale také přispívá k „chtění“ jídla prostřednictvím modulace hledání odměn a motivační hodnoty jídla35.
S [11C] carfentanil, získali jsme obrázky vazby stopovacích látek, které jsou citlivé jak na hladiny μOR, tak na uvolňování endogenních opioidů v mozku.36,37. Zjistili jsme okamžitou ztrátu dostupnosti μOR v oblastech jádra accumbens a předního cingulate cortexu, specifických oblastech mozku odměnové dráhy, po počáteční konzumaci sacharózy pěti miniprasami, což odpovídá endogennímu uvolňování opioidů. Předchozí studie ukázaly, že chutné jídlo může vést k pocitům potěšení38 stimulací uvolňování opioidů. Po 12 dnech přístupu k sacharóze jsme pozorovali pokles [11C] vazba karfentanilu, která má několik možných vysvětlení39 včetně uvolňování endogenního opioidu a vazby na μOR, internalizace μOR v důsledku zvýšené vazby opioidů a zvýšené aktivace DA D2 / 3 receptoru, což vede k heterologní desenzibilizaci μOR40.
Na podporu současných zjištění [11C] studie karfentanilu u pacientů s bulimií41, obezita42,43,44a porucha příjmu potravy45, ukazují sníženou dostupnost receptoru. Jedná se však o chronické stavy, zatímco miniprasata dostala sacharózu pouze 12 dní. Ve studii akutního chování při výživě u zdravých mužů vedlo krmení k robustnímu a rozšířenému endogennímu uvolňování opioidů v mozku, a to jak v přítomnosti, tak v nepřítomnosti hedonie, což naznačuje, že uvolňování opioidů odráží metabolické a homeostatické i hedonické reakce25. Tato studie, spolu s další, která zobrazovala pacienty po tekutém jídle s čokoládovou příchutí44, je přímo relevantní pro akutní studii pěti miniprasů po první expozici sacharóze, ale liší se od subchronické studie expozice sacharóze po dobu 12 dnů, kde snížená dostupnost receptoru s větší pravděpodobností odráží opakovanou nadstimulaci a souběžné snižování μOR.
Prefrontální kůra je důležitá při rozhodování a přisuzování hodnoty jednotlivým položkám, a proto μOR v prefrontální kůře může být odpovědný za pozměněné hodnocení potravinového významu, což může zvýšit návykový potenciál jídla. Zjistili jsme sníženou vazbu v prefrontální kůře, v souladu s předchozími studiemi, které ukazují, že strava s vysokým obsahem tuku snižuje hladiny μOR mRNA v prefrontální kůře46 a že infuze agonisty μOR v prefrontální kůře zvyšuje příjem sladkého jídla47. Znovu však vyvstává problém, zda strava s vysokým obsahem tuků je chroničtější stav, který s větší pravděpodobností zprostředkovává down-regulaci receptoru, ve srovnání s krátkodobějším návrhem krmení sacharózou, což naznačuje trvalé uvolňování endogenních opioidů, které vytlačují stopovací karfentanil vázaný na μOR , dokonce i po 12 dnech sacharózy.
DA se podílí na odměnách za drogy i chování. Bylo zjištěno, že chronické užívání kokainu inhibuje signalizaci DA48. Hladiny DA D1 a D2 / 3 receptoru se v mozku prasete mění nikotinem49, a u primátů (kromě člověka) s anamnézou zneužívání kokainu50, v souladu s downregulací D2 / 3 receptorů v mozcích závislých na lidském kokainu51,52. Co se týče drog zneužívání, ukázalo se, že sacharóza upreguluje receptory DA D119 a zvýšit uvolnění DA53, posílení role DA v „chtění“ ve vztahu k chutnému jídlu. Předchozí PET studie prokázaly snížení dostupnosti striatálního DA D2 / 3 receptoru u morbidní obezity vs. průměrné hmotnosti54,55, podobně jako je tomu u pacientů závislých na drogách56a u zvířat s modely obezity57. Ve studiích na hlodavcích podporuje knockdown receptoru D2 / 3 ve striatu vývoj nutkavého hledání potravy u potkanů s přístupem k chutnému jídlu57.
Naše pozorování snížené dostupnosti D2 / 3 receptoru u prasete může naznačovat zvýšené hladiny DA v reakci na motivační význam spojený s příjmem sacharózy, protože DA se uvolňuje jako součást potřeby zneužívání drog a dalších příjemných aktivit.52,58,59,60. Protože prasata byla během zobrazování anestetizována a neobdržela sacharózu během 24 hodin, snížený D2 / 3 BPND více pravděpodobně odráží snížení počtu receptorů v reakci na prodloužené zvýšení uvolňování DA v každém ze 12 dnů přístupu k sacharóze. Redukce může zvýšit prahové hodnoty mozkové odměny spojené s down-regulací striatálních DA D2 receptorů. To může vysvětlit zvýšenou náchylnost k zneužívání drog, která byla pozorována v předchozích studiích u potkanů přejídajících sacharózu, která vedla ke zkřížené senzibilizaci na kokain, hyperaktivitě po nízké dávce amfetaminu, zvýšenému příjmu alkoholu při abstinenci od sacharózy a toleranci k analgetickým účinkům opiátů.6.
Předchozí studie o obezitě v mincovníku Göttingen identifikovala snížený průtok krve mozkem v nucleus accumbens, ventrální tegmentální oblasti (VTA) a prefrontální kůře, s mozkovou tomografií s jedinou fotonovou emisí (SPECT) mozku61. V souladu s těmito zjištěními jsme pozorovali sníženou vazbu DA D2 / 3 v oblasti ventroforebrain obsahující jádro accumbens a v prefrontální kůře. Extracelulární hladiny DA se po příjmu sacharózy u volně se pohybujících potkanů podstupujících mikrodialýzu 3krát zvyšují v nucleus accumbens62. U zvířat závislých na sacharóze může opakovaný příjem sacharózy vést k uvolnění DA z obalu nucleus accumbens63. Zvířata krmená omezenou stravou s omezeným přístupem k sacharóze měla nižší vazbu DA D2 receptoru ve skořápce nucleus accumbens a dorzálním striatu64. Omezená strava s vysokým obsahem tuků a sacharózy může vést k trvalé regulaci mRNA receptoru D1 a D2 v nucleus accumbens65. Mikrodialyzační studie účinků chutného jídla odhalila zvýšené uvolňování DA v jádru accumbens a prefrontální kůře, když bylo jídlo stále považováno za nové; jakmile byly krysy zvyklé na nové jídlo, zvýšené uvolňování bylo otupeno v nucleus accumbens, ale ne v prefrontální kůře66. Rozdílná citlivost na návyk a kondicici aktivity ve dvou regionech může vysvětlit větší nárůst pozorovaný v prefrontální kůře než v jádrových accumbens miniprasů vystavených stejné chutné látce, která ztratila novost po dvanácti dnech. Nicméně, protože jsme si nepředstavovali minipigs s [11C] racloprid po prvním podání sacharózy, toto vysvětlení je spekulativní.
Prefrontální kůra moduluje výkonné funkce, rozhodování a sebeovládání67. Dysfunkční DA neurotransmise v prefrontální kůře narušuje modulaci zpracování odměn, což u obézních jedinců naznačuje zhoršenou výkonnou funkci a rozhodovací dovednosti68,69. Studie lidského PET navíc korelovala snížený metabolismus frontální kůry se sníženou vazbou striatální D2 v obezitě70. Zde nalézáme sníženou dostupnost D2 / 3 receptoru v prefrontální kůře, včetně orbitofrontální kůry prasat exponovaných režimu sacharózy.
Dopaminergní neurony VTA odesílají projekce do hippocampu a amygdaly, kde podporují návyková chování71 a zprostředkovávají kódování a získávání kondicionování do léku72,73 a narážky na jídlo74,75. Zobrazování lidského mozku ukázalo hippocampální aktivaci v reakci na chuť k jídlu a chuť76. V souladu s našimi nálezy snížené dostupnosti hipokampálního a amygdalarového D2 / 3 receptoru v reakci na sacharózu, mapování lidského mozku pomocí [18F] fallyprid vykazoval uvolňování DA vyvolané kokainem v amygdale a hippocampu77. U mozků hlodavců vyvolala expozice kokainu v amygdale uvolnění DA78, a změny hladin DA amygdaly ovlivňovaly chování při hledání kokainu79.
Ve studii obézních jedinců byla ve ventrálním striatu přerušena asociace mezi dostupností D2 / 3 a μOR, o nichž je známo, že existují ve striatálních oblastech štíhlých jedinců.80. Srovnali jsme hodnoty BPND dvou indikátorů k testování, zda data reprodukovaly tento účinek. Na rozdíl od štíhlých lidí neměli současné mozky prasat žádnou korelaci mezi hodnotami BPND dvou indikátorů, na začátku nebo po expozici sacharóze. Potom jsme testovali, zda by zvířata s největším poklesem vazby sledovacího raclopridu měla také největší pokles vazby sledovacího karfentanilu, ale místo toho jsme našli negativní korelaci v průměrovaných mimstriatálních oblastech, což naznačuje, že zvířata s největší změnou vazebného potenciálu sledovací racloprid měl nejnižší změnu vazebného potenciálu sledovacího karfentanilu. Inverzní vztah mezi změnami naznačuje, že účinky příjmu sacharózy na dostupnost příslušných receptorů jsou regulovány v opačných směrech. Je známo, že nadměrná konzumace chutných potravin nebo drog může být řízena chtíčem nebo chutěním, nebo obojí60,81. Je možné, že velikost touhy poháněné dopaminem neguje rozsah touhy poháněné opioidy nebo naopak. Nedávné důkazy ukazují na roli GABAA receptory ve VTA a cholinergních terminálech ve striatu a případně kůře, které působí jako přepínače mezi dopaminovými a dopaminově nezávislými mechanismy působení opioidů82,83 což může vysvětlit vzájemnost vzájemného působení dopaminu a opioidů v mimstriatálních oblastech prasat.
Nedostatkem PET, také u poměrně velkých zvířat, je omezené prostorové rozlišení tomografie, které ovlivňuje výsledky malých mozkových oblastí zapojených do chování spojeného s jídlem. Přes tyto obavy však [11Vazba C] raclopridu byla dříve zaznamenána ve striatálních i extrastriatálních oblastech84,85,86,87. Použití [11C] racloprid pro označení stejného typu receptorů nevyvolává žádné obavy z potenciálních afinitních rozdílů, které mohou ovlivnit použití oddělených značek pro stejné receptory v různých regionech. Nedávné studie zahrnovaly záznamy extrastriatální vazby [11C] racloprid. Alakurtti et al. našel dobrou reprodukovatelnost měření striatální vazby raclopridu ve striatu, s pouze dobrou až střední reprodukovatelností v kůře85. V pozdější studii, Svensson et al. projednali několik otázek ovlivňujících použití [11C] racloprid jako marker extrastriatálních receptorů D2 / 3 ve studii zdravých lidí, včetně špatné reprodukovatelnosti v kůře a omezeného poklesu extrastriatální vazby v čelní kůře v reakci na činidlo blokující D2 / 388. Porovnání testů a opakovaných testů odhalilo variabilitu 4–7% ve striatu a 13–59% v kortikálních regionech, ale doba mezi zkouškami byla v průměru 20 dní, na rozdíl od informativnějších 1–2 dnů většiny studií. Řada faktorů v životě těchto subjektů mohla mít čas ovlivnit zjištění. Ve skutečnosti zde ukazujeme, že pouhé přidání spotřeby sacharózy do ranní rutiny po dobu 12 dnů mohlo mít vliv na vazebná opatření získaná o dva týdny později. Jiné běžné faktory, jako je hraní videoher, nakupování, vstup do nových romantických vztahů a sexuální aktivity, užívání drog nebo změna stravovacích návyků a cvičení, mohou mít vliv na extrastriatální hladiny dopaminu s potenciálem velké variace datových sad. Současná studie na miniprascích zavedla dobře kontrolované uspořádání, přičemž jedinou proměnnou byla absence nebo přítomnost sacharózy ve stravě. V této souvislosti měly údaje od sedmi zvířat dostatečně nízkou variabilitu v relevantních mimostraniálních regionech, aby bylo možné identifikovat statisticky významné snížení vazby v reakci na sacharózu.
Omezením současné studie je použití anestetik potřebných k zajištění imobility během in vivo zobrazování zvířat. Účinky specifických anestetik a jejich interakce s drogami nebo jinými zásahy mohou zmást vazbu radioligandů89,90. Ketamin je antimagamatergické léčivo s rychlými antidepresivními účinky v sub anestetických dávkách91,92,93, které nesnižují striatal [11C] vázání raclopridu u lidí94. Bylo však zjištěno, že S-ketamin snižuje vazebnou dostupnost dopaminových D2 / 3 receptorů ve striatu vědomých nehumánních primátů.95. Isofluran je běžným anestetikem u zvířecích PET. V předchozích studiích jsme zjistili striatální akumulaci [11C] SCH23390, radioligand dopaminových D1 receptorů, který má být významně vyšší u miniprasů anestetizovaných izofluranem spíše než propofolem, což naznačuje citlivost dopaminergní neurotransmise na účinky anestezie96. V této studii byly všechny miniprapy zobrazeny v obou časových bodech pod předběžnou medikací ketaminem a anestézií isofluranem, což činí současné srovnání platným.
Proč investovat do čističky vzduchu?
Nadměrná konzumace chutných potravin může způsobovat závislost s přímými následky na zdraví způsobenou obezitou a stát se jejím výsledkem. Testovali jsme tvrzení, že opioidy a dopamin zprostředkovávají odměny, důležité pro přežití i pro zneužívání drog. Minipigy s přerušovaným přístupem k roztoku sacharózy ve 12 po sobě jdoucích dnech prokázaly sníženou dostupnost dopaminu D2 / 3 a μ-opioidního receptoru ve striatálních a extrastriatálních mozkových oblastech, což naznačuje, že potraviny s vysokým obsahem sacharózy ovlivňují obvody odměňování mozku podobným způsobem, jaký je pozorován u návykových látek jsou spotřebovány. Počáteční jednorázová expozice sacharóze byla konzistentní s uvolňováním opioidů v mozkových oblastech aktivních za odměnu. Změny dostupnosti opioidů a dopaminu vysvětlují nadměrný návykový potenciál sacharózy.
Materiály a metody
Etika zvířat
Tato studie byla schválena a regulována Dánským inspektorátem pokusů na zvířatech a všechny experimenty byly provedeny v souladu se směrnicí Evropského parlamentu a Rady 2010/63 / EU o ochraně zvířat používaných pro vědecké účely a pokyny ARRIVE. Použili jsme sedm čtrnáctiměsíční fena Göttingen (Ellegaard, Dalmose, Dánsko). Miniprasata byla krmena peletovou dietou (6 dL, 2krát denně, Special Diets Services, Aarhus, Dánsko) s dostupnou vodovodní vodou podle libosti. Teplota prostředí byla 20–22 ° C, relativní vlhkost 50–55% a vzduch byl měněn osmkrát každou hodinu.
Přerušovaná spotřeba sacharózy
Zobrazili jsme sedm miniprasek pomocí [11C] racloprid a [11C] carfentanil na začátku a znovu jeden den po 12 po sobě jdoucích dnech expozice sacharosové vodě. Expozice sacharóze spočívala v jedné hodině přístupu k vodě se sacharózou (sacharóza, Dansukker, Kodaň, Dánsko) (500 gramů sacharózy ve 2 litrech vody), denně po dobu 12 dnů. Bylo zaznamenáno množství příjmu sacharosy a všechna miniprasátka spotřebovala každý den 2 litry. Také jsme zobrazili pět stejných miniprasek pomocí [11C] karfentanil, 30 minut po prvním přístupu k sacharóze, aby se studovalo akutní uvolňování opioidů.
Miniprasátka získala průměrně 13.6% tělesné hmotnosti z 25.4 kg (± 0.73 SEM) na začátku do 28.9 kg (± 0.69 SEM) po 12denní expozici sacharóze, která byla významně vyšší (jednostranný t-test, p < 0.001) než zvýšení pozorovaná u vzorku kontrolních miniprasat získaných v předchozích studiích, kde se váhy ve stejném vývojovém období zvýšily v průměru pouze o 4.9%.
Mozkové PET zobrazování
Před zobrazením jsme prasata přes noc nechali hladovět s volným přístupem k vodě. Jak bylo popsáno výše, předběžně jsme léčili a anestetizovali miniprasata97 a položil je na záda do zařízení PET / CT (Siemens Biograph 64 Truepoint PET). Před každou akvizicí PET jsme provedli CT sken s nízkou dávkou pro anatomickou definici a korekci útlumu emisních dat PET. Intravenózně jsme podali [11C] racloprid ve výchozím stavu (360 ± 18 MBq, měrná aktivita 77 ± 76 GBq / μmol, vstřikovaná hmotnost 0.12 ± 0.08 μg / kg) a po 12 dnech sacharózy (374 ± 54 MBq, měrná aktivita 127 ± 85 GBq / μmol, vstřikovaná hmotnost 0.06 ± 0.05 μg / kg) a [11C] karfentanil ve výchozím stavu (377 ± 43 MBq, měrná aktivita 311 ± 195 GBq / μmol, vstřikovaná hmota 0.03 ± 0.02 μg / kg) a po 12 dnech sacharózy (337 ± 71 MBq, měrná aktivita 177 ± 157 GBq / μmol, injektovaná hmotnost 0.06 ± 0.08 μg / kg) do ušní žíly v 10 ml fyziologického roztoku, během první minuty 90 minutového skenování. Rekonstruovali jsme PET data pomocí TrueX 3D OSEM (3 iterace, 21 podmnožin), matice 256 × 256 × 109 a 2 mm Gaussova filtru pomocí struktury časových rámců 5 × 60, 3 × 300, 4 × 600 , 2 × 900 sekund (celkem 14 snímků, 90 minut). Na začátku a po 12 dnech sacharózy byly zobrazeny miniprasata s oběma indikátory injikovanými nejméně 100 minut od sebe, vzhledem k poločasu [11C] PET indikátory. Po ukončení poslední PET relace jsme eutanizovali miniprasata v hluboké anestezii intravenózním předávkováním pentobarbitálem (100 mg / kg).
Kvantitativní analýzy a statistiky
Provedli jsme kroky předběžného zpracování pomocí PMOD 3.7 (PMOD Technologies Ltd, Curych, Švýcarsko). K definování stereotaktických transformačních parametrů z časově průměrovaných PET obrazů jsme použili templáty specifické pro ligand. Generované transformační matice a deformační pole jsme aplikovali na odpovídající dynamickou PET časovou řadu. Vygenerovali jsme parametrické obrazy [11C] raclopridový vazebný potenciál (BPND) pomocí metody víceřádkové referenční tkáně Ichise a spolupracovníků98. Vytvořili jsme na míru vyrobenou masku mozečku, která vylučovala vermis za účelem získání radioaktivity mozkové tkáně v čase v oblasti zanedbatelné hustoty receptoru DA D2 / 3. Vygenerovali jsme parametrické obrazy [11C] carfentanil pomocí implementace referenčního modelu tkáně Logan99,100 s t * = 30 min. Studie [11Vazba C] karfentanilu v lidském mozku použila jako referenční oblast okcipitální kůru36; u prasat však podle křivek časové aktivity byla nevypovídatelná vazba nižší v mozečku než v týlní kůře, což je v souladu se zjištěními autoradiografické studie na potkanech101. Proto jsme vybrali mozek jako referenční oblast v této studii.
Statistická analýza
Mapy jsme podrobili analýze voxelů pomocí statistického neparametrického mapování (SnPM v13.01, http://warwick.ac.uk/snpm) Sada nástrojů SPM, která využívá neparametrickou permutační teorii, aby poskytla rámec pro statistickou inferenci, což je přístup ukázaný jako vhodný pro malé vzorky díky přísné kontrole falešných pozitiv14 a aplikováno, jak bylo popsáno výše102. Odborník na neuroanatomii prasat (DO) porovnal výsledné obrazy s prahovou hodnotou 5% významnosti s Göttingenovým atlasem minipig s vysokým rozlišením103,104 definovat a označit oblasti sníženého DA D2 / 3 a μOR BPND od výchozího stavu po stav po sacharóze. Poté jsme provedli analýzu zájmového regionu (ROI), abychom mohli extrahovat BPND hodnoty specifických oblastí, o kterých se zjistilo, že jsou zajímavé, na základě analýzy SnPM, včetně striata, nucleus accumbens, thalamu, amygdaly, cingulate cortex a prefrontální cortex. Nebyly provedeny žádné další statistiky týkající se analýzy návratnosti investic, protože tyto oblasti již byly zjištěny jako významné pomocí SnPM.
Reference
- 1.
Smyth, S. & Heron, A. Diabetes a obezita: epidemie dvojčat. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalence a trendy v obezitě u dospělých v USA, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamin pro „chtění“ a opioidy pro „líbení“: srovnání obézních dospělých s nekonečným přejídáním. Obezita (stříbrná pružina) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obezita a potravinové prostředí: hustota energie v potravě a náklady na stravu. Americký časopis preventivního lékařství 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Intenzivní sladkost předčí odměnu za kokain. PLoS jednoho 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurovědy v 21. století (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Další vývoj v neurobiologii potravin a závislosti: aktualizace stavu vědy. Výživa 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Potěšení mozku (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Od chuťové hedoniky k motivačnímu pohonu: centrální mu-opioidní receptory a chování při přejídání. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Food odměna: mozkové substráty, které chtějí a mají rádi. Neurovědy a biobehaviorální recenze 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Mapování neuroreceptorů v práci: o definici a interpretaci vazebných potenciálů po 20 letech pokroku. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Zvířecí modely záchvatů cukru a tuků: vztah k závislosti na jídle a zvýšené tělesné hmotnosti. Metody Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. Prefrontální kůra mozku Gottingenových miniprasů definovaná kritérii neuronální projekce a cytoarchitekturou. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Neparametrické permutační testy pro funkční neuroimaging: primer s příklady. Hum Brain Mapp 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Důkazy závislosti na cukru: behaviorální a neurochemické účinky občasného nadměrného příjmu cukru. Neurovědy a biobehaviorální recenze 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Systém odměňování potravin: současné perspektivy a budoucí potřeby výzkumu. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Samospráva sacharózy a aktivace CNS u krysy. Am J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Samostatné obvody kódují hedonické a nutriční hodnoty cukru. Přírodní neurověda 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. Nadměrný příjem cukru mění vazbu na dopaminové a mu-opioidní receptory v mozku. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiátový receptor: autoradiografická lokalizace v mozku krysy. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Kokainová odměna a hyperaktivita u potkanů: místa modulace mu opioidních receptorů. Neurovědy 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamin ovlivňuje samopodávání kokainu u potkanů v reakci na progresivní poměrový poměr posilování. Farmakologie, biochemie a chování 75, 301-307 (2003).
- 23.
Schroeder, JA et al. Role mu opioidních receptorů v kokainem indukované aktivitě, senzibilizaci a odměně u potkanů. Psychofarmakologie 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Obnovení vyvolané kokainem vyžaduje endogenní stimulaci mu-opioidních receptorů ve ventrálním palidu. Žurnál neurověd: oficiální žurnál společnosti pro neurovědu 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. Krmení uvolňuje endogenní opioidy u lidí. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioidní limbický obvod za odměnu: interakce mezi hedonickými hotspoty nucleus accumbens a ventral pallidum. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioidní místo ve skořápce nucleus accumbens zprostředkovává stravování a hedonické „chutě“ v potravinách: mapa založená na mikroinjekcích Fos. Brain Res 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE Příjem roztoků sacharinu, soli a ethanolu se zvyšuje infuzí mu opioidního agonisty do nucleus accumbens. Psychofarmakologie 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Příjem potravin s vysokým obsahem tuku je selektivně zvýšen stimulací mu opioidních receptorů v jádru accumbens. Žurnál farmakologie a experimentálních terapeutik 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxon blokuje tuto část krmení řízenou sladkou chutí u potkanů s omezeným příjmem potravy. Am J Physiol 268, R248 - 252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioidy a příjem potravy: distribuované funkční nervové dráhy? Neuropeptidy 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Antagonista opioidů, naltrexon, snižuje preferenci sacharózy u lidí. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Účinek naltrexonu na prahovou hodnotu detekce a rozpoznání chuti. Chuť 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxon, blokátor opiátů, snižuje spotřebu sladkých potravin s vysokým obsahem tuku u obézních a štíhlých žen. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Odlišné opioidní okruhy určují chutnost a vhodnost odměňování událostí. Proc Natl Acad Sci USA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Endogenní uvolňování opioidů v systému odměňování lidského mozku indukované akutním podáním amfetaminu. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Micku, I. et al. Amfetaminem indukované uvolňování endogenního opioidu v lidském mozku detekované pomocí [11C] karfentanilu PET: replikace v nezávislé kohortě. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW opioidní peptidy a kontrola lidského chování při konzumaci. Neurovědy a biobehaviorální recenze 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Z čeho se učit in vivo opioidergní zobrazování mozku? Eur J Bolest 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interakce dopaminu s opioidy ve striatu potkana: modulační role receptorů dopaminu D1 v signální transdukci zprostředkované delta opioidními receptory. Neurofarmakologie 39, 372-381 (2000).
- 41.
Bencherif, B. et al. Vazba regionálního mu-opioidního receptoru v ostrovní kůře je snížena u bulimie nervosa a koreluje inverzně s chováním nalačno. Žurnál nukleární medicíny: oficiální publikace, Společnost nukleární medicíny 46, 1349-1351 (2005).
- 42.
Karlsson, HK et al. Obezita je spojena se sníženou dostupností mu-opioidů, ale nezměněnou dostupností dopaminového D2 receptoru v mozku. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. Úbytek hmotnosti po bariatrické operaci normalizuje mozkové opioidní receptory v morbidní obezitě. Mol psychiatrie 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogenní opioidní mechanismy se podílejí na obezitě a úbytku hmotnosti u lidí. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopaminová a opioidní neurotransmise v závislostech na chování: Srovnávací studie PET v patologickém hraní a konzumaci alkoholu. Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Chronická strava s vysokým obsahem tuků řídí postnatální epigenetickou regulaci mu-opioidního receptoru v mozku. Neuropsychopharmacology: oficiální publikace americké vysoké školy neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Indukce hyperfagie a příjmu sacharidů stimulací mu-opioidních receptorů v vymezených oblastech frontální kůry. Žurnál neurověd: oficiální žurnál společnosti pro neurovědu 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Chronický kokain tlumí dopaminovou signalizaci během intoxikace kokainem a nerovnováhu D1 nad signalizací receptoru D2. Žurnál neurověd: oficiální žurnál společnosti pro neurovědu 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Účinky akutního nikotinu na hemodynamiku a vazbu [11C] raclopridu na receptory dopaminu D2,3 v mozku prasete. NeuroImage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Účinek samopodávání kokainu na receptory dopaminu D2 u opic rhesus. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Kokainové narážky a dopamin v dorzálním striatu: mechanismus touhy po závislosti na kokainu. Žurnál neurověd: oficiální žurnál společnosti pro neurovědu 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Zvýšená obsazenost dopaminových receptorů v lidském striatu během touhy po vyvolání kokainu. Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Orální stimulace sacharózy zvyšuje accumbens dopamin u potkanů. Am J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Zobrazování role dopaminu při zneužívání drog a závislosti. Neurofarmakologie 56(Dodatek 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Mozkový dopamin a obezita. Lanceta 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Podobnost mezi obezitou a drogovou závislostí hodnocená neurofunkčním zobrazováním: revize konceptu. Žurnál návykových nemocí 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopaminové D2 receptory v závislosti na dysfunkci odměn a nutkavém jídle u obézních potkanů. Přírodní neurověda 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Afektivní neurověda o potěšení: odměna u lidí a zvířat. Psychofarmakologie 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Systémy potěšení v mozku. Neuron 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Prediktivní signál odměny dopaminových neuronů. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Změny v mozkové aktivitě po obezitě vyvolané dietou. Obezita 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens dopaminové mechanismy v příjmu sacharózy. Brain Res 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM a Hoebel, BG Každodenní záchvaty cukru opakovaně uvolňují dopamin ve schránce accumbens. Neurovědy 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Opakovaný přístup k sacharóze ovlivňuje hustotu dopaminového D2 receptoru ve striatu. Neuroreport 13, 1575-1578 (2002).
- 65.
Alsio, J. et al. Exprese genu receptoru dopaminu D1 klesá v jádru accumbens po dlouhodobé expozici chutnému jídlu a liší se v závislosti na dietě vyvolaném fenotypu obezity u potkanů. Neurovědy 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Diferenciální vliv asociativních a neasociativních mechanismů učení na schopnost reakce prefrontálního a accumbálního přenosu dopaminu na potravní podněty u potkanů krmených ad libitum. J Neurosci 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Nevyvážené neuronální okruhy v závislosti. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexie, bulimie a obezita: společné deficity rozhodování o úkolu hazardu v Iowě (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Deficity rozhodování a přejídání: rizikový model obezity. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Nízké dopaminové striatální D2 receptory jsou spojovány s prefrontálním metabolismem u obézních jedinců: možné přispívající faktory. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Amygdala centrální jádro interaguje s dorsolaterálním striatem za účelem regulace získávání návyků. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al. Aktivace paměťových obvodů během cue-vyvolané kokainové touhy. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73.
Childress, AR et al. Limbická aktivace během touhy vyvolané kokainem. Am J Psychiatrie 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Co a kdy „chtít“? Amygdala zaměřená na motivační nápadnost na cukr a sex. Psychofarmakologie 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiologie závislosti: neurocircuitární analýza. Lancet Psychiatry 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Kortikální aktivace v reakci na podněty čisté chuti během fyziologických stavů hladu a sytosti. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotros, A. et al. Uvolňování dopaminu kokainem vyvolané u amygdaly a hippocampu: studie PET s vysokým rozlišením [[1] (8) F] fallypride u účastníků závislých na kokainu. Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Kontrola chování při hledání kokainu stimulacemi spojenými s léčivem u potkanů: účinky na regeneraci zhasnutých operátorem reagujících a extracelulárních hladin dopaminu v amygdale a nucleus accumbens. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Antagonismus dopaminových D1 nebo D2 receptorů v bazolaterální amygdale odlišně mění získávání asociací kokain-tágo, které jsou nezbytné pro opětovné navození hledání kokainu. Neurovědy 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Aberantní mezolimbická dopamin-opiátová interakce při obezitě. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Behaviorální dopaminové signály. Trendy Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. Neurobiologie opiátové motivace. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Regulace nikotinového a opioidního receptoru zprostředkovaného přenosu striatálního dopaminového D2-receptoru. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Snížení dostupnosti dopaminového D2 / 3 receptoru měřené pomocí [C-11] raclopridu v nestratálních oblastech lidského mozku související s věkem: Porovnání čtyř metod. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Dlouhodobá spolehlivost opakovaného testu vazby striatálních a mimstriatálních dopaminových D2 / 3 receptorů: studie s [(11) C] raclopridem a PET s vysokým rozlišením. J Cereb Blood Flow Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Endogenní uvolňování dopaminu po farmakologických výzvách u Parkinsonovy choroby. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Kognitivní deficity a striato-frontální uvolňování dopaminu u Parkinsonovy choroby. Mozek 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validita a spolehlivost extrastriatální [(11) C] raclopridové kvantifikace vazby v živém lidském mozku. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. Isofluranová anestezie zvyšuje inhibiční účinky kokainu a GBR12909 na dopaminový transportér: PET studie v kombinaci s mikrodialýzou v mozku opic. Brain Res 849, 85-96 (1999).
- 90.
Hassoun, W. et al. PET studie vazby [11C] raclopridu ve striatu probuzené kočky: účinky anestetik a role toku krve mozkem. Evropský žurnál nukleární medicíny a molekulárního zobrazování 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Role ketaminu v depresi rezistentní na léčbu: systematický přehled. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Antidepresivní účinky ketaminu u depresivních pacientů. Biol Psychiatry 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. Antidepresivní účinky ketaminu: mechanismy, které jsou základem rychle působících nových antidepresiv. Přední Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. Ketamin nesnižuje vazbu na striatální dopaminový receptor D2 u člověka. Psychofarmakologie 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Redukce vazby dopaminového D2 / 3 receptoru ve striatu po jednorázovém podání esketaminu, ale ne R-ketaminu: PET studujte na opicích při vědomí. Psychiatrická klinika Eur Arch Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Účinky anestezie a druhů na absorpci nebo vazbu radioligandů in vivo v Gottingen minipig. BioMed mezinárodní výzkum 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Podélné monoaminergní PET zobrazení chronické inhibice proteazomu u minipras. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategies to zlepšit odhad neuroreceptorových parametrů lineární regresní analýzou. J Cereb Blood Flow Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Distribuční objemové poměry bez odběru krve z grafické analýzy PET dat. J Cereb Blood Flow Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kvantifikace mozkových mu-opioidních receptorů pomocí [11C] karfentanilu: metody referenční tkáně. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. Autoradiografická mapa vazby (3H) diprenorfinu v mozku potkana: účinky sociální interakce. Brain Res Bull 7, 405-410 (1981).
- 102.
Landau, AM et al. Elektrokonvulzivní stimulace různě ovlivňuje vazbu [(11) C] MDL100,907 na kortikální a subkortikální receptory 5HT2A v mozku prasete. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Telencephalon Gottingen minipig, cytoarchitektura a kortikální povrchová anatomie. Brain Struct Funct 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histologický atlas Gottingenova minipig mozku. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Poděkování
Studii financovala „Aarhus University University“ Grants Project Development Grant pro projekt AML. Jsme vděčni za technickou podporu pracovníků Centra PEThuské nemocnice v Aarhusu a Farma v Aarhus University za pomoc s léčbou zvířat. Děkujeme profesorce Mortenovi Kringelbachovi, profesorovi Jørgenovi Scheel-Krugerovi a docentovi Arne Møllerovi za pomoc při zahájení těchto studií.
Etická prohlášení
Konkurenční zájmy
Autoři neprohlašují žádné konkurenční zájmy.
Další informace
Poznámka vydavatele Springer Nature zůstává neutrální, pokud jde o jurisdikční nároky v publikovaných mapách a institucionálních vztazích.
Práva a oprávnění
Volný přístup Tento článek je licencován pod licencí Creative Commons Attribution 4.0 International License, která umožňuje použití, sdílení, přizpůsobení, distribuci a reprodukci na jakémkoli médiu nebo formátu, pokud udělíte patřičný kredit původním autorům a zdroji, poskytnete odkaz na licenci Creative Commons a uveďte, zda byly provedeny změny. Obrázky nebo jiné materiály třetích stran v tomto článku jsou zahrnuty do licence Creative Commons, pokud není v úvěrové linii k materiálu uvedeno jinak. Pokud materiál není součástí licence Creative Commons článku a vaše zamýšlené použití není povoleno zákonnými předpisy nebo překračuje povolené použití, budete muset získat povolení přímo od držitele autorských práv. Chcete-li zobrazit kopii této licence, navštivte http://creativecommons.org/licenses/by/4.0/.