IHRE NACHRICHT: Der Abschnitt über Kontroversen dieses Dokuments enthält Folgendes:
Es gibt eine Reihe von auf Elektrophysiologie basierenden Studien von Prauses Gruppe, die einige Belege dafür liefern, dass das sexuelle Verlangen und nicht die Hypersexualität die Selbstregulierung der sexuellen Erregung vorhersagt [92]. Diese Forscher schlagen in anderen Arbeiten vor, dass Probanden, die über Probleme bei der Sichtbarmachung visueller sexueller Reize (VSS) berichteten, die ebenfalls über ein höheres sexuelles Verlangen berichteten, geringere spätere positive Potentiale (LPP) als Reaktion auf VSS aufwiesen. Die Autoren schlagen vor, dass dieses Muster sich von den Suchtmodellen unterscheidet [93].
Die beiden EEG-Papiere von „Prause's Group“ wurden in Fachzeitschriften und von anderen (einschließlich YBOP) ausführlich kritisiert. In Wirklichkeit stimmen die Ergebnisse beider Artikel trotz der zweifelhaften Schlussfolgerungen ihrer Autoren mit dem Suchtmodell überein. Für die EEG-Studie 2013 siehe:
- In der neuen Pornostudie von SPAN Lab (2013) korreliert nichts mit nichts
- Begutachtete Kritik: "Hoher Wunsch" oder "nur" eine Sucht? Eine Antwort auf Steele et al. (2014) von Donald L. Hilton, Jr., MD,
- Begutachtete Kritik: „Neurowissenschaften der Internetpornografiesucht: Ein Rückblick und ein Update“ (2015)
- Peer-Review-Analyse: „Neuronale Korrelate der sexuellen Cue-Reaktivität bei Personen mit und ohne zwanghaftem Sexualverhalten“ (2014)
Für die 2015 EEG-Studie siehe:
- Kritik an „Modulation spätpositiver Potenziale durch sexuelle Bilder bei problematischen Nutzern und Kontrollen, die nicht mit„ Pornosucht “vereinbar sind (2015)“
- Begutachtete Kritik: Neurowissenschaft der Internetpornographiesucht: Eine Überprüfung und Aktualisierung (2015)
Wäre es nicht großartig, wenn Forscher die von ihnen zitierten Studien tatsächlich lesen würden, anstatt nur die Schlagzeilen des Hauptautors zu lesen?
LINK ZUR VERÖFFENTLICHUNG
Veröffentlicht am: 12. Oktober 2015 (siehe Geschichte)
DOI: 10.7759 / cureus.348
Zitieren Sie diesen Artikel als: Blum K, Badgaiyan RD, Gold MS (Oktober 12, 2015) Hypersexualität Sucht und Entzug: Phänomenologie, Neurogenetik und Epigenetik. Cureus 7 (10): e348. doi: 10.7759 / cureus.348
Abstrakt
Hypersexualität wurde als abnormal erhöhte sexuelle Aktivität definiert. Epidemiologische und klinische Studien haben gezeigt, dass dieser nicht paraphile Zustand aus „übermäßigem“ sexuellem Verhalten und Störungen besteht, die von persönlicher Belastung sowie sozialer und medizinischer Morbidität begleitet werden. Es ist ein sehr kontroverses und politisches Thema in Bezug darauf, wie es am besten als ähnlich oder nicht ähnlich zu Suchtverhalten einschließlich Drogenmissbrauch eingestuft werden kann. Hypersexuelle Störung wird als nicht-paraphile sexuelle Luststörung mit Impulsivität konzipiert. Pathophysiologische Perspektiven umfassen eine Fehlregulation der sexuellen Erregung und des sexuellen Verlangens, sexuelle Impulsivität und sexuelle Zwanghaftigkeit. Der im ventralen Striatum befindliche Nucleus accumbens vermittelt die verstärkenden Wirkungen von Drogen wie Kokain, Alkohol, Nikotin und Nahrungsmitteln sowie Musik. In der Tat wird angenommen, dass diese Struktur Verhaltensweisen vorschreibt, die durch Anreizreize hervorgerufen werden. Diese Verhaltensweisen umfassen natürliche Belohnungen wie Füttern, Trinken, sexuelles Verhalten und explorative Fortbewegung. Eine wesentliche Regel für eine positive Verstärkung ist, dass die motorischen Reaktionen an Stärke und Kraft zunehmen, wenn ein lohnendes Ereignis folgt. Hier nehmen wir an, dass es einen gemeinsamen Wirkmechanismus (MOA) für die starken Auswirkungen von Drogen, Musik, Essen und Sex auf die menschliche Motivation gibt. Der menschliche Antrieb für die drei notwendigen Motivationsverhalten „Hunger, Durst und Sex“ kann alle gemeinsame molekulargenetische Vorboten haben, die, wenn sie beeinträchtigt werden, zu abweichenden Verhaltensweisen führen. Wir nehmen an, dass hypersexuelle Aktivitäten auf der Grundlage einer Vielzahl wissenschaftlicher Unterstützung tatsächlich wie Drogen, Lebensmittel und Musik sind, die die mesolimbische Belohnungsschaltung des Gehirns aktivieren. Darüber hinaus beeinflussen das dopaminerge Gen und möglicherweise andere mögliche Neurotransmitter-bezogene Genpolymorphismen sowohl das hedonische als auch das anhedonische Verhalten. Über die Genetik und Epigenetik der Hypersexualität ist in der aktuellen Literatur wenig bekannt. Wir gehen jedoch davon aus, dass zukünftige Studien, die auf Bewertungen mit klinischen Instrumenten in Kombination mit der Genotypisierung von Sexsüchtigen basieren, Hinweise auf eine spezifische Häufung sexueller Typologien mit polymorphen Assoziationen liefern werden. Es gab einige Studien mit elektrophysiologischen Techniken, die die Ansicht nicht stützen, dass Hypersexualität tatsächlich dem Drogenmissbrauch und anderen Verhaltensabhängigkeiten ähnlich ist. Die Autoren ermutigen sowohl klinische als auch akademische Wissenschaftler, mit Neuroimaging-Tools zu forschen, um natürliche dopaminerge Agonisten zu untersuchen, die auf bestimmte Genpolymorphismen abzielen, um das hypersexuelle Verhalten zu „normalisieren“.
Einführung & Hintergrund
Hypersexuelles Verhalten wurde in den letzten zehn Jahren sicherlich in klinischen und Forschungseinstellungen dokumentiert [1]. Benjamin Rush, ein Arzt des Gründervaters der Vereinigten Staaten, dokumentierte klinisch übermäßiges Sexualverhalten [2] Richard von Krafft-Ebing, ein westeuropäischer Sexualforscher aus dem 19-Jahrhundert, und Hirshfeld in 1948 führten beide die Arbeit fort [3-4]. Der Grundmieter dieser Ermittler wies darauf hin, dass Hypersexualität sowohl bei Männern als auch bei Frauen mit hartnäckigem, sozial abweichendem Sexualverhalten einherging, wobei der exzessive sexuelle Appetit unpassend war. In 1975 bezeichnete Kinderwagen den Zustand als Don Juanism [5]. In 1969 schlug Allen Satyriasis für Männer und Nymphomanie bei Frauen vor, die von Ellis und Sagarin unterstützt wurden [6-7]. Obwohl Hypersexualität nicht als psychiatrische Diagnose in DSM enthalten ist, könnte die Arbeit einer Reihe zeitgenössischer Forscher, darunter Kafka, Reid, Bancroft, ihre Kollegen und die Neigung der Weltgesundheitsorganisation, dazu führen, dass dieser Zustand als separate diagnostische Einheit aufgenommen wird [8-11].
Bewertung
Literaturmethodik
Die Medline-Datenbank wurde am 12. Juli 2015 verwendet, um eine internetbasierte Literatursuche durchzuführen. Die folgenden Begriffe wurden aufgenommen: hypersexuell (170), hypersexuell (479), sexuelle Sucht (1,652), sexsüchtig (1,842), sexuelle Impulsivität (989), zwanghafter Sex (946), zwanghafter Sex (1,512), sexueller Zwang (782) ), Paraphilie-bedingte Störung (234) und übermäßige sexuelle (857). Da dieser Artikel eher eine kurze Übersicht als eine Metaanalyse ist, basiert er auf einer repräsentativen Auswahl dieser Studien, die für die behandelten Unterthemen relevant sind. Die Nichteinbeziehung einer bestimmten Studie negiert nicht ihre Bedeutung für das Gebiet. Verständlicherweise gibt es diejenigen, die nicht mit dem Konzept übereinstimmen, dass Sexsucht tatsächlich eine echte Störung ist, und möglicherweise sogar Beweise dafür haben, dass sie auf festem Grund stehen. Wir argumentieren jedoch, dass es genügend Anhaltspunkte dafür gibt, dass sexuelle Sucht existiert, und Studien, die sich mit Neuroimaging, Neurogenetik und sogar Epigenetik befassen, stützen die Annahme, dass zwanghafte Sexsucht sowie Hypersexualität als Suchtstörung angesehen werden könnten. Obwohl wir uns dieser Diskrepanz bewusst sind, vertreten wir jeweils unseren Standpunkt, um eine weitere wissenschaftliche Prüfung zu generieren und die wissenschaftliche Rhetorik zu diesem wichtigen Thema nicht zu zerstreuen. Um zusätzliches Licht auf das Thema zu werfen, haben wir die Literatur nach einem Konsens durchsucht. Am 17. August 2015 haben wir PUBMED Central mit dem folgenden Begriff durchsucht: „Ist Sex eine echte Sucht?“ und 46 Artikel abgerufen.
Definition der sexuellen Abhängigkeit
Sexuelle Sucht ist definiert als jedes zwanghafte sexuelle Verhalten, das das normale Leben beeinträchtigt und die Familie, Freunde, Angehörige und das Arbeitsumfeld stark belastet. Sexuelle Sucht wurde als sexuelle Abhängigkeit, Hypersexualität und sexuelle Zwanghaftigkeit bezeichnet. Wie auch immer, es ist ein zwanghaftes Verhalten, das das Leben des Süchtigen vollständig dominiert. Sexsüchtige machen Sex zu einer Priorität wichtiger als Familie, Freunde und Arbeit. Sex wird zum Organisationsprinzip des Lebens eines Süchtigen. Sie sind bereit zu opfern, was sie am meisten schätzen, um ihr ungesundes Verhalten zu bewahren und fortzusetzen [12]. Hypersexuelles Verlangen wurde als Verlangen abgegrenzt, basierend auf einer lebenslangen Einschätzung der Häufigkeit des Sexualverhaltens und der Zeit, die in damit verbundenen sexuellen Phantasien verbracht wird. Bei Männern wurde eine Bewertung des hypersexuellen Verlangens von Kafka und Hannen als die höchste anhaltende Periode (mindestens sechs Monate Mindestdauer) des persistierend erzwungenen Sexualverhaltens definiert (totaler Sexualausbruch / Woche nach dem Alter 15). In der Tat wurde bei 72-80% der Männer, die auf der Suche nach Paraphilien und mit Paraphilien zusammenhängenden Erkrankungen behandelt wurden, eine longitudinale Vorgeschichte von hypersexuellem Verlangen, operativ wie oben definiert, identifiziert [13].
Hypersexualität und geschlechtsspezifische Unterschiede
Es ist allgemein bekannt, dass das sexuelle Verlangen in der menschlichen Sexualgemeinschaft und in der Literatur als das Vorhandensein sexueller Phantasien, Aktivitäten oder Triebe und als Motivation des Menschen, sich sexuell zu benehmen, kapituliert wird. Es gibt sowohl interne als auch externe relevante Hinweise [14]. Befürworter der Evolutionstheorie haben argumentiert, dass Männer und Frauen unterschiedliche Ziele in Bezug auf sexuelle Aktivitäten haben [15]. Zahlreiche Studien zeigen deutliche Unterschiede zwischen Männern und Frauen. Männer haben die sexuelle Fantasie erhöht [16], erhöhte Häufigkeit der Masturbation [17]erhöhte Anfälligkeit für extern erzeugte visuelle sexuelle Erregung [18] Freizügigkeit gegenüber Casual Sex [19]Leichtigkeit der Erregung [20]und intrinsische Motivation [21]. Im Gegensatz dazu zeigen Frauen eine andere sexuelle Landschaft mit sexueller Motivation, sexueller Erregung und sexuellem Verhalten, das von evolutionären Faktoren geprägt wird [22] und größere biologische, emotionale und zeitliche Investitionen in Fortpflanzung und Kindererziehung [23]. Frauen sind weniger anfällig für Hypersexualität [24] und angepasst, um partnerschaftliche Beziehungen und langfristiges Engagement der Partner zu fördern [25]. Es wird geschätzt, dass die sexuelle Abhängigkeit bis zu 3% bis 6% der Bevölkerung betroffen ist, das Verständnis der neurobiologischen Vorfahren ist jedoch begrenzt [26] sowie klinische Bewertungen [27]. Wir ermutigen zu weiterem Lesen über sexuellen Zwang, Anhaftung und sexuelle Orientierung [28]und geschlechtsspezifische Unterschiede bei der Reaktion auf sexuelle Reize [29-30].
Es ist bemerkenswert, dass Kafka und Hennen [13]fanden heraus, dass das mittlere Alter des Einsetzens von persistierendem hypersexuellem Verhalten bei sexuell aktiven Männern 18.7 ± 7.2 Jahre betrug und der Altersbereich des Einsetzens hypersexuellen Verhaltens das Alter 7-46 war. Die durchschnittliche Dauer dieser höchsten konsistenten Frequenz des sexuellen Appetits betrug 12.3 ± 10.1 Jahre. Das durchschnittliche Alter dieser aktiven sexuellen Männer, die eine Hypersexualität hatten und die Behandlung suchten, betrug jedoch 37 ± 9 Jahre. Hanson et al. untersuchte auch die Hypersexualität bei Straftätern und stellte fest, dass niedrige Straftäter geringere Rückfälligkeitsraten aufwiesen als Straftäter mit hohem Risiko [31].
Hypersexualität und Drogenmissbrauch
Es besteht eine hohe Komorbidität zwischen hypersexualer Störung und anderen Abhängigkeiten, z. B. der Substanzmissbrauchsstörung [32-33]. Garcia und Thibaut schlugen vor, dass die Phänomenologie exzessiver nicht-paraphiler sexueller Störungen eher als Suchtverhalten und nicht als zwanghafter Zwang oder als Impulskontrollstörung eingestuft werden sollte [34]. Sie weisen zu Recht darauf hin, dass die Kriterien den von anderen vorgeschlagenen Suchterkrankungen sehr nahe kommen [35]. Diese Forscher haben den Anstoß für weitere Forschungen auf diesem Gebiet und eine mögliche zukünftige Aufnahme einer hypersexuellen Störung in das DSM-6 gegeben. Drogenmissbrauch, Rock'n'Roll und Sex treten gleichzeitig auf, und von Woodstock bis heute wurden ganze Festivals um diese Kombinationen herum aufgebaut.
Aus der Literatur geht hervor, dass Methamphetamin-Anwender berichten, dass dieses stimulierende Medikament das sexuelle Verlangen, insbesondere das Risikoverhalten, erhöht. Es wurde jedoch gezeigt, dass Amphetamin die sexuelle Aktivität weiblicher Ratten verringert. In diesem Sinne haben Holder et al. untersuchte die Rolle von Methamphetamin bei weiblichen Ratten [36]. Sie stellten fest, dass Methamphetamin das sexuelle Verhalten von Frauen erleichterte, und dieser Effekt beruht auf der Verstärkung der dopaminergen Übertragung und sogar der möglichen Neurotransmission aufgrund der Kombination von Eierstockhormonen und Methamphetamin. Insbesondere fanden sie eine Verstärkung der sexuellen Motivation in Verbindung mit der Aktivierung der neuronalen Aktivität in der medialen Amygdala und dem ventromedialen Kern des Hypothalamus.
Darüber hinaus haben Wissenschaftler aus den Niederlanden die Komorbidität von Drogenmissbrauch bei selbst identifizierten Swingern untersucht [37]. In dieser Studie haben Spauwen et al. kam zu dem Schluss, dass 79% der Swinger den Konsum von Drogenkonsum zu Freizeitzwecken angaben (einschließlich Alkohol und Drogenkonsum mit erektiler Dysfunktion); 46% von ihnen berichteten über den mehrfachen Drogenkonsum. In der Tat war der Konsum von Erholungsdrogen (ohne Alkohol und Drogen mit erektiler Dysfunktion) signifikant mit sexuellem Verhalten bei Männern und Frauen verbunden. Der Drogenkonsum war auch unabhängig von sexuell übertragbaren Infektionen (STI) bei weiblichen Swingerinnen, insbesondere denjenigen, die an Gruppensex teilnehmen.
Castelo-Branco et al. berichteten, dass junge erwachsene Frauen erkennen, dass Sexualität ein wichtiger Teil ihres Lebens ist, aber kein Hauptanliegen ist (77.6%) [38]. Sie berichteten auch, dass Alkohol die Hürden für Sex (62.3%) beseitigt. Sie stellten auch fest, dass Alkoholmissbrauch eine prädiktive Variable bei der Verbesserung risikobehafteter Verhaltensweisen war, unabhängig vom Alter der Frau.
Es ist bemerkenswert, dass Jia et al. berichteten über gefährliches Sexualverhalten bei Psychostimulanzien und Heroinmissbrauchern, einschließlich mehrfachem Geschlechtsverkehr, gelegentlichen Sexualpartnern, homosexuellen Partnern und niemals oder gelegentlich Safer Sex [39].
Unser Hauptmieter ist, dass Medikamente wie Methamphetamin, Kokain, Heroin und Alkohol das sexuelle Verlangen bei Nichtabhängigen stimulieren können. Bei Süchtigen ist es ganz anders; Die gleichen Medikamente können chronisch Anhedonie verursachen. Nach der Sucht während der Erholungsphase wurden jedoch in vielen Fällen aphrodisierende Verhaltensweisen beobachtet.
Hypersexualität und Rücknahme
Eine PubMed-Suche (7-19-15) unter Verwendung des Begriffs "Hypersexualität und Entzugssymptome" ergab nur fünf Artikel, von denen keiner "Entzugssymptomatik" beschrieb. Eine alternative Suche unter Verwendung der Begriffe „Entzugssymptome bei hoher sexueller Aktivität“ ergab jedoch 25 aufgelistete Artikel.
Süchtige berichten über Genesungserhöhungen und Appetit auf bestimmte Nahrungsmittel und Zigarettenmissbrauch bei längerer Abstinenz. Die Gewichtszunahme wurde auch bei jüngst abstinenten Tieren und Menschen nachgewiesen und dokumentiert [39]. Bruijnzeel machte die interessante Beobachtung, dass ein akuter Entzug von Opiaten zu spontanen Orgasmen führen kann [40]. Wichtig ist, dass Bruijnzeel in dem Artikel vorschlug, dass Entzugssymptomatologie von Medikamenten und möglicherweise chronisch intensive sexuelle Aktivität auf die uneingeschränkte Funktion der Signalübertragung des Kappa-Opioidrezeptors zurückzuführen ist, die die Freisetzung von Dopamin hemmt und gleichzeitig Norepinephrin in Gehirnbelohnungskreisläufen erhöht.
Die Veröffentlichungen in der Literatur litten unter mangelnder Sorgfalt bezüglich akutem und längerem Entzug und Abstinenz, die durch Urintests bestätigt wurden. Klinische Behandlungsprogramme haben sich zunehmend von der Behandlung beider Geschlechter zur Isolation der beiden Geschlechter entwickelt und bieten geschlechtsspezifische Behandlungsprogramme an. Sie bieten auch Schulungen an, um dem frühen und anhaltenden Anstieg des sexuellen Interesses und der sexuellen Aktivität sowie der Beziehung zwischen Genesung, Ernährung und Überessen zu begegnen.
Einige Forscher hatten über hypersexualitätsbedingte Entzugserscheinungen mit unterschiedlichem Schweregrad und missbräuchlicher Substanzmissbrauch berichtet [41-45]. Als Ergebnis dieser Suche fanden wir kein einziges Dokument, in dem die tatsächlichen Entzugserscheinungen beschrieben werden, die mit Abstinenz bei aktiven sexuellen Begegnungen einhergehen. Die meisten der zitierten Artikel betrafen die Auswirkungen des Rückzugs von Missbrauchsmedikamenten wie Opioiden, Nikotin, Amphetaminen und Kokain, die die sexuelle Aktivität beeinträchtigen können.
Hypersexualität und Neurogenetik
Eine PubMed-Suche (7-19-15) ergab nur sechs aufgelistete Artikel mit dem Begriff „Gene und Hypersexualität“, die sich hauptsächlich auf Artikel zum Kleine-Levin-Syndrom (KLS) konzentrieren, einer sehr seltenen Krankheit, bei der Hypersexualität bis zu 27 Jahre andauern kann. In einer Studie wurde festgestellt, dass ein immunreaktives HLA-DQBl, DQBl * 0602, bei Patienten mit KLS in signifikanten Mengen nachgewiesen wurde und das KLS-Risiko erhöhen könnte [46-47].
Als wir jedoch die Begriffe „sexuelle Aktivität und Gene“ verwendeten, wurden 2,826 Artikel aufgelistet, und wir bieten eine kurze Zusammenfassung einiger wichtiger neurogenetischer Aspekte. Es ist unsere Hypothese, dass sowohl hedonisches als auch anhedonisches Verhalten Teil eines Teils der Risiko-Allele eines Individuums für dieses Verhalten sind und dass die Behandlung darin besteht, diese identifizierten Polymorphismen angemessen anzugehen. Darüber hinaus hängt das Ansprechen der Behandlung auch von diesen Risiko-Allelen ab und liefert eine wichtige Begründung für pharmakogenetische Tests und pharmakogenomische / Nutrigenom-Lösungen.
Nach dem umstrittenen ersten Befund von Blum et al. In 1990 des ersten Beweises für einen Zusammenhang zwischen dem DRD2 Al-Allel und schwerem Alkoholismus gab es 3,938-Artikel in PubMed (7-19-15). [48]. Die Studien decken den psychiatrischen Genpolymorphismus, das DRD2-Al-Allel und das damit verbundene Verhalten und die Physiologie ab. Es gibt jedoch einen Mangel an Daten, die die sexuelle Aktivität mit diesem und anderen verwandten Genen verknüpfen, trotz der überwältigenden Beweise für eine mesolimbische Aktivierung, insbesondere in dopaminergen Bahnen und neuronalen Loci, die mit sexuellen Stimuli und Aktivität zusammenhängen. Es ist bemerkenswert, dass Blum und Noble das DRD2-Gen als ein allgemeines Belohnungsgen, das für das gesamte RDS-Verhalten verantwortlich ist, richtig klassifiziert haben. Tatsächlich haben Träger des Taq Al-Allels unter Verwendung der Bayes'schen Theorem-Analyse während ihrer gesamten Lebensdauer eine 74-Chance, dass sie sich mit einem oder mehreren RDS-Verhalten (Rewdeficiency Syndrome) treffen [49].
Die erste Assoziation eines Genpolymorphismus und einer sexuellen Aktivität trat erst bei 1999 auf, als Miller et al. evaluierte einige dopaminerge Gene [50]. Das grundlegende Ergebnis ist, dass das dopaminerge System im Gehirn eine wichtige Rolle bei der Regulierung des Sexualverhaltens zu spielen scheint. Die Beziehung zwischen Genen für die Dl-, D2- und D4-Dopaminrezeptoren und dem Alter beim ersten Geschlechtsverkehr (AFSI) wurde in einer Stichprobe von nicht-hispanischen 414-Männern und Frauen in Europa untersucht. Ein signifikanter Zusammenhang wurde zwischen einem DRD2-Allel und AFSI beobachtet, und ein noch stärkerer Zusammenhang, wenn das DRD2-Allel mit einem DRDl-Allel interagierte. Ein eingeschränktes Regressionsmodell wurde erstellt, um den AFSI anhand des Geschlechts und einer Gruppe von neun psychosozialen Variablen als Prädiktoren vorherzusagen. Durch Hinzufügen der DRD2- und DRD2-by-DRD1-Prädiktoren zu diesem Modell wurde die erklärte Varianz um 23% bzw. 55% erhöht. Die Tatsache, dass diese Ergebnisse auf eine stärkere Assoziation zwischen Männern als auf Frauen schließen lassen, stimmt mit der jüngsten Arbeit anderer überein, die bei Männern eine höhere Reaktion auf sexuelle Reize zeigt als bei Frauen [51]. Vielleicht sind „Männer vom Mars und Frauen von der Venus“ und dies gilt möglicherweise sogar für Kokainmissbrauch [52].
Speziell sowohl in präklinischen als auch in klinischen Studien haben sexuell dimorphe Muster in Verhaltensreaktionen auf Kokain in allen Phasen des Kokainsuchtprozesses (Induktion, Aufrechterhaltung und Rückfall) gezeigt. Somit zeichnet sich ein klares Bild ab, das auf eine biologische Basis geschlechtsspezifischer Unterschiede bei der Kokainsucht hindeutet. Diese Unterschiede ergeben sich aus der unterschiedlichen Regulation des ZNS durch männliche und weibliche Gonadenhormone und können durch das Vorhandensein von DRD2-Genpolymorphismen vorhergesagt werden [53]. Darüber hinaus ist bekannt, dass genetische Assoziationen zwischen COMT und verschiedenen psychiatrischen Phänotypen häufig Unterschiede zwischen Männern und Frauen aufweisen. Dazu gehören der funktionelle Val (158) Met-Polymorphismus in COMT, der mit Zwangsstörungen bei Männern und mit Angstphänotypen bei Frauen assoziiert ist. Darüber hinaus hat der Polymorphismus Val (158) Met in COMT einen größeren Einfluss auf die kognitive Funktion von Jungen als Mädchen [54].
Miller et al. konnte keinen Zusammenhang zwischen den mit dem DRD4-Gen und dem Alter des ersten Geschlechtsverkehrs verknüpften Polymorphismen feststellen [50]. Andere fanden jedoch eine signifikante Assoziation in bestimmten ethnischen Gruppen. Insbesondere zeigt ihre Analyse der Polymorphismen in DRD4, dass diejenigen mit einem - 3R-Genotyp ein höheres Risiko für den ersten Geschlechtsverkehr hatten als diejenigen mit einem anderen (oder einem - 4R) Genotyp in allen Ethnien (n = 2,552). Interessanterweise unterscheidet sich das Risiko des ersten Geschlechts nicht zwischen den beiden Genotypen in der afroamerikanischen Stichprobe, was die Frage nach der kulturellen Erziehung aufwirft [55].
Die sexuelle Erfahrung führt wie wiederholter Drogenkonsum zu langfristigen Veränderungen, einschließlich einer Sensibilisierung des Nucleus accumbens (NAc) und des dorsalen Striatum. Bradley et al. Mit Hilfe der Microarray-Analyse wurde zum ersten Mal untersucht, dass Hamster feststellten, dass die sexuelle Erfahrung bei männlichen oder weiblichen Tieren die mRNA-Expression einer Reihe von Genen in der NAc differentiell nach oben oder unten reguliert [56]. Sie fanden heraus, dass sexuell erfahrene Hamster, die in Woche 7 einen Stimulus erhalten hatten, im Vergleich zu sexuell naiven Tieren eine Zunahme einer großen Anzahl von Genen zeigten. Umgekehrt zeigten sexuell erfahrene weibliche Hamster, die in Woche 7 keinen Stimulus erhalten hatten, eine Verringerung der Expression vieler Gene. Laut den Autoren könnte dieses erste Gen-Profiling bei weiblichen Hamstern Einblick in die Mechanismen geben, durch die sowohl Verhalten (Sex) als auch Missbrauchsdrogen langfristige Veränderungen in den mesolimbischen und nigrostriatalen Dopamin-Pfaden hervorrufen.
Bipolare Elektroden, die bilateral in den lateralen Hypothalamus und in die substantia nigraventral tegmentale Region implantiert wurden, wurden stereotaktisch verwendet, um chronische, selbststimulierende Belohnungserfahrungen zu ermöglichen, die dem sexuellen Verhalten ähneln. Es wurde festgestellt, dass diese Art der Stimulation eine signifikante Zunahme der Anzahl von Synapsen in der CA3-Region des Hippocampus und in der Molekülschicht des Motorkortex bei Ratten induziert. Im Wesentlichen induzierte chronische Hirnstimulation die Langzeitpotenzierung (LTP), die bekanntermaßen neue synaptische Verbindungen verstärkt [57]. Eine einmalige Kokain-Exposition bei naiven Tieren reicht aus, um anhaltende Veränderungen in den glutamatergen Synapsen des ventralen tegmentalen Bereichs (VTA) auszulösen, die in anderen Gehirnregionen aktivitätsabhängigen LTP ähneln. Dieses kokaininduzierte LTP scheint über die Aktivierung des D-Amin-D5-Rezeptors von N-Methyl-D-Aspartat (NMDA) -Rezeptoren vermittelt zu werden und erfordert die Proteinsynthese [58]Wir unterstützen erneut unsere hier vorgeschlagene Prämisse, dass Drogen und Sex übliche neurochemische Substrate haben können.
Empirische Untersuchungen haben gezeigt, dass eine positive Beziehung zwischen der Anzahl der Sexualpartner und der Beteiligung an unsozialem Verhalten besteht [59]. Die meisten Versuche, diesen Zusammenhang zu erklären, haben eine evolutionäre Perspektive eingenommen. Aus evolutionärer Sicht beziehen sich die gleichen Merkmale, zum Beispiel Impulsivität, Kurzsichtigkeit und Aggressivität, die sich auf eine große Anzahl von Sexualpartnern beziehen, auch auf kriminelle Aktivitäten. Es gibt jedoch auch Anlass zu der Annahme, dass die Ko-Variation zwischen Sexualpartnern und Verbrechenverhalten teilweise durch einen gemeinsamen genetischen Weg erklärt werden kann, bei dem Gene, die sich auf Sexpartnernummern beziehen, auch mit antisozialem Verhalten zusammenhängen. Unter Verwendung des oben beschriebenen Grundgedankens schlagen Beaver et al. Eine starke positive Assoziation zwischen Sexualpartnern und antisozialem Verhalten und Polymorphismen des Dopamin-Transporter-Gens (DAT1) ergab, dass sowohl die Anzahl der Sexualpartner als auch das kriminelle Verhalten von Männern erklärt wird [59]. Die polymorphe Wirkung des DAT1-Gens und die Anzahl der Sexualpartner kann auf einen Zusammenhang zwischen bestimmten Polymorphismen und der vorzeitigen männlichen Penis-Ejakulation zurückzuführen sein. Träger des 1OR / 1OR-Genotyps wiesen im Vergleich zu der kombinierten Trägergruppe 9R9R / 9R10R (9R mit höherer Aktivität und niedrigerer Dopaminverfügbarkeit) Werte auf, die bei jedem Indikator eine niedrigere Schwelle für die Ejakulation aufweisen [60]. Polymorphismen des DATI-Gens, insbesondere der 10R / 10R-Genotyp, wurden bei jugendlichen Delinquenten gefunden, die an der Brown School (San Marcos, Texas) wegen pathologisch aggressiven Verhaltens einschließlich antisozialem Verhalten teilgenommen haben [61]. In einer verblindeten klinischen Studie wurde eine positive Korrelation zwischen DRD2 und den DATl-Polymorphismen mit pathologischer Gewalt bei Jugendlichen beobachtet. Darüber hinaus, obwohl ursprünglich als Ergebnis einer Peer-Imitation von Kindern mit beginnendem oder lebensverlaufsbeständiger Jugend konzipiert, gibt es immer mehr Beweise aus Zwillingsstudien, dass das Auftreten von jugendlichem oder jugendlichem antisozialem Verhalten möglicherweise auch genetisch beeinflusst wird. Burt und Mikolajewski bestätigten diese Erkenntnisse nicht nur mit dem DATI-Gen, sondern erweiterten diese Erkenntnisse auch auf die His452Tyr-Variante des Gens, das für den 5-HT2A-Rezeptor kodiert [62]In jüngerer Zeit haben Jozkow et al. berichteten über einen Zusammenhang zwischen der sexuellen Dimension der Symptome alternder Männer (AMS) und genetischen Varianten von 5-HTRlB G861C [63]. Darüber hinaus haben Sales et al. Durch multivariable logistische Regressionsanalyse wurde eine Interaktion zwischen Missbrauch und der 5-HTTLPR-Gruppe gefunden, wobei eine signifikante Assoziation mit dem Status der Nichtveränderung bestand, zusammen mit der Häufigkeit der Kommunikation der Partner bei der Nachuntersuchung [64] Eine Missbrauchsgeschichte in der Vergangenheit war signifikant mit einer höheren Wahrscheinlichkeit der Nichtveränderung des Kondomgebrauchs nach einer Intervention für nur diejenigen mit dem Allel verbunden.
Es ist bekannt, dass Polymorphismen in nicht-kodierenden Regionen des Vasopressin-Rezeptor-Gens (Avpr1a) mit sozioemotionalen Merkmalen bei Menschen, Schimpansen und Wühlmäusen verknüpft sind und aufgrund einer ortsspezifischen Variation der Genexpression auftreten können. Laut Barrett et al. Bietet der sozial monogame Präriewürfel eine einzigartige Gelegenheit, die Neurobiologie der Monogamie zu studieren [65]. Tatsächlich ist die Signalisierung des Vasopressin-1a-Rezeptors (VlaR) für die Bildung der Paarbindung bei Männern erforderlich. Interessanterweise weisen soziale Präriewühlmäuse eine stärkere VlaR-Bindung in der Belohnungsverarbeitung von ventralem Pallidum auf als asoziale Wühlmäuse derselben Gattung. Barrett et al. stellten fest, dass die Herabregulierung der pallidalen VlaR-Dichte zu einer signifikanten Beeinträchtigung der Präferenz für eine verheiratete Partnerin und zu einer Verringerung des angstähnlichen Verhaltens im Erwachsenenalter führte [65]. Andere Arbeiten von Garcia et al. zeigten, dass Personen mit mindestens einem 7-Wiederholungs-Allel (7R +) des DRD4 eine höhere kategoriale Rate promiskuitiven Sexualverhaltens melden, einschließlich eines „One-Night-Stand“, und einen Anstieg von mehr als 50% in Fällen von sexuelle Untreue [66].
Daw und Guo berichteten, dass Personen, die die Genotypen DRD2 * Al / A2, DRD2 * A2 / A2, DAT1 * 9R / 10R und MAOA * 2R / tragen, mit einer höheren Wahrscheinlichkeit von ungeschütztem Geschlechtsverkehr in dieser Lokalität assoziiert sind [67]. Die DRD2-Verbände gelten sowohl für Männer als auch für Frauen, während die anderen Links nur für Frauen gelten. Schließlich haben Emanuele et al. berichteten über eine signifikante Assoziation zwischen den DRD2 TaqI A-Genotypen und „Eros · (ein liebevoller Stil, der durch die Tendenz gekennzeichnet ist, intensive emotionale Erfahrungen zu entwickeln, die auf der körperlichen Anziehungskraft auf den Partner beruhen) sowie zwischen dem C516T 5HT2A-Polymorphismus und„ Manie “( eine besitzergreifende und abhängige romantische Bindung, die durch selbstzerstörerische Emotionen gekennzeichnet ist) [68].
Epigenetik und sexuelle Aktivität
Eine Durchsicht der Literatur zeigt, dass eine Reihe von Artikeln in jüngster Zeit auf die Bedeutung epigenetischer Effekte für die sexuelle Aktivität hinweisen. Zum Beispiel überprüfte Matsuda die epigenetischen Veränderungen des Östrogenrezeptors a (ERalpha) und den Einfluss auf das soziosexuelle Verhalten [69]. Tatsächlich verändert eine durch epigenetische Mechanismen wie Histonmodifikationen und DNA-Methylierung vermittelte Veränderung der ER-Alpha-Genaktivität das sexuelle Verhalten. In Bezug auf Homosexualität haben Rice et al. entwickelten ein Modell, das die sexuelle Entwicklung der Kanalisierung (Konversion) Homosexualität erklären kann [70]. Sie erklären, dass dieses Modell auf epigenetischen Markierungen basiert, die als Antwort auf den XX-XY-Karyotyp in embryonalen Stammzellen festgelegt wurden. Dementsprechend erhöhen diese Markierungen die Empfindlichkeit gegenüber Testosteron bei XY-Feten und senken sie bei XX-Feten, wodurch die sexuelle Entwicklung kanalisiert wird. Es wurde postuliert, dass eine Teilmenge dieser umwandelnden epigenetischen Markierungen transgenetisch transgen übertragen werden könnte und zu Mosaik für die sexuelle Entwicklung bei geschlechtsspezifischen Nachkommen führen könnte - dem homosexuellen Phänotyp.
In dem sozial monogamen Präriewürfel (Microtus ochrogaster) induziert die Paarung dauerhafte Paarbindungen, die durch Partnerpräferenzbildung initiiert und durch verschiedene Neurotransmitter reguliert werden, einschließlich Oxytocin, Vasopressin und Dopamin. Arbeit von Gundersen [71]und Wang et al. [72] legt nahe, dass Histon-Deacetylase die Partnerbildung in weiblichen Präriewühlmäusen erleichtern könnte, die für den Menschen relevant sein könnten. Insbesondere haben Wang et al. fanden heraus, dass Histon-Acetylase-Inhibitoren-Natriumbutyrat und Trichostatin A (TSA) die Partnerpräferenzbildung in weiblichen Prärie-Wühlmäusen verstärkten [72]. Diese Partnerpräferenzbildung war mit einer Hochregulierung des Oxytocinrezeptors (OTR, Oxtr) und des Vasopressin-Vl-Rezeptors (VlaR, avprla) in der NAc durch eine Erhöhung der Histonacetylierung an ihren jeweiligen Promotoren verbunden.
Es gibt ein wachsendes Interesse an Indizien, die darauf hinweisen, dass Frauen aktiv an Polyandrie beteiligt sind, entweder um genetische Inkompatibilität zu vermeiden oder die Vaterschaft zugunsten genetisch überlegener Männer zu voreingenommen sind. Es besteht die Möglichkeit, dass die Auswahl einer überlegenen männlichen Fitness auf epigenetische Effekte zurückzuführen ist. Laut Zeh und Zeh kann die epigenetische Variation im Gegensatz zu auf DNA-Sequenzen basierenden Variationen stark durch Umwelt- und stochastische Effekte beeinflusst werden, die während der Lebensdauer eines Individuums auftreten [73]. Sie legen nahe, dass die epigenetische Variation für die postkopulatorische Sexualselektion wichtig sein kann und für Befunde, die die Konkurrenzfähigkeit der Spermien mit der Fitness von Nachkommen verbinden, verantwortlich sein kann.
Genetische und Mem-Evolution: Menschliche Fortpflanzung
Eysenck schlug eine positive Korrelation zwischen Extraversion und intensiviertem Sexualverhalten sowie zwischen Neurotizismus und Problemen im Sexualverhalten (asoziales Verhalten) vor. Eine frühere Studie mit verheirateten Menschen zeigte keine dieser Korrelationen. Es wurde angenommen, dass diese Verbindung nur für unverheiratete Personen besteht, die keine dauerhaften Beziehungen unterhalten, da die Qualität der Beziehung die sexuelle Interaktion bestimmt. Bei einer Stichprobe junger unverheirateter Männer bestand eine positive Korrelation zwischen Extraversion und Gegenständen, bei denen die Person frühere sexuelle Aktivitäten mit mehr Personen und häufiger beschrieb. Es wurde keine Korrelation mit Neurotizismus gefunden. Es gab auch leichte Korrelationen mit anderen Persönlichkeits- und sozialen Einstellungsskalen. Aufgrund der Korrelation mit einer ausspielenden Persönlichkeitsskala wurden die Ergebnisse aus einer sozialpsychologischen Perspektive interpretiert. In der heutigen Gesellschaft wird von dem jungen Mann erwartet, dass er die Initiative in einer sexuellen Interaktion ergreift, die ein extravertierter junger Mann besser realisieren kann als einer, der introvertiert ist [74]. Diese Perspektive steht in direkter Übereinstimmung mit Richard Brodies Vorstellung von egoistischen Genen des Geistes [75]. Aus Sicht der DNA würden Anthropologen natürlich zustimmen: „Wir sind immer noch nur aus einem Grund hier; ausgehen und sich vermehren. “ Während die evolutionären Fortschritte langsam sind, ein Schritt alle 20 Jahre oder so, verglichen mit „Meme Evolution, mutiert eine Idee in der Zeit, die zum Lesen eines Satzes benötigt wird“. Unser Gehirn hat nichts mit genetischer Evolution zu tun, außer dass es sich um kluge Menschen handelt, die weniger Babys haben. In der Tat, wenn es Gene gibt, die Menschen dazu neigen, Meme aufzunehmen, die ihre Anzahl an Nachkommen begrenzen, werden sie in einigen Generationen zugunsten von Genen aussterben, die Menschen dazu neigen, Kinder zu erwerben. Obwohl dies etwas umstritten ist, deuten einige Studien leider darauf hin, dass Homo sapiens in den letzten 42,000 Jahren ihren IQ aufgrund selektiver Paarung gesenkt hat [76].
Außergewöhnlich zeigt sich, dass der quantitative Genetiker die Heritabilität der extravertierten Persönlichkeit mit 40-60% einschätzt, da Extraversion insbesondere bei Männern mit erhöhter sexueller Aktivität einhergeht. Smillie und Mitarbeiter untersuchten und fanden heraus, dass eine Kopie des DRD2-Gens Al-Allel mit einer signifikant höheren Extraversion assoziiert war [77]. Diese Assoziation wirft eine interessante Frage in Bezug auf die menschliche Fortpflanzung auf. Die Ergebnisse deuten darauf hin, dass diese Träger des DRD2 Al aufgrund ihrer ausgeprägten Wirkung auf das Fortpflanzungsverhalten, Lernstörungen und andere impulsive, zwanghafte, aggressive und süchtig machende Störungen das Potenzial haben, progressive und dauerhafte Änderungen der Frequenz des DRD2Al-Allels zu verursachen, die zu „führen die genetische Kernschmelze der Art “ [78].
In seinem Buch, Comings liefert Beweise, dass Menschen mit süchtig-störendem Verhalten früher Kinder haben, und dies beeinflusst die Auswahl von Suchtgenen wie dem DRD2-Al-Allel [79]. Er schlägt vor, dass Personen, die dieses Allel mit störendem Risiko tragen, Kinder haben, sagen wir im Alter von 20 Jahren, und Personen ohne dieses Allel Kinder im Alter von 25 Jahren haben werden. Infolgedessen reproduziert sich das mutierte Gen schneller, nämlich alle 20 Jahre, während sich die normale Form des Gens alle 25 Jahre reproduziert. Das Verhältnis von 25/20 beträgt 1.25. Somit nimmt die Häufigkeit, mit der ein Gen, das einen 1.25-fachen selektiven Vorteil hat, von Generation zu Generation an Häufigkeit zu. Ein Altersunterschied von fünf Jahren bei Müttern oder Vätern, wenn sie ihre ersten Kinder haben, reicht aus, um eine signifikante und relativ schnelle Selektion für Gene zu erreichen, die von Gruppen getragen werden, die in einem früheren Alter gebären. Erhöhungen einiger RDS-Verhaltensweisen wurden von 1955 bis heute dokumentiert. Diese Erhöhungen umfassen das Verhaltenssyndrom bei Jugendlichen (Drogen, Sex, Schwangerschaften bei Teenagern und kriminelles Verhalten, Rauchen), Verhaltensstörungen, Kriminalität, Drogenmissbrauch, Alkoholismus, ungeschütztes Sexualverhalten, unverheiratete Mütter, Wohlfahrt, Schulausschluss und Schulabbrecher eine damit einhergehende Abnahme des IQ [80]. Diese Ergebnisse basieren auf der Berkeley-Studie, bei der Längsschnittdaten aus den Studien zu Kindergesundheit und Entwicklung sowie den National Longitudinal Surveys of Youth oder NLYS verwendet wurden [81]. Unter Verwendung dieser Informationen prognostizierte Comings, dass von 1955 zu 2015 beispielsweise die Häufigkeit des DRD2-Al-Allels verdoppelt wird, was die Prävalenz von RDS-Verhalten einschließlich vorzeitigem Geschlechtsverkehr erhöht [50]. Wir ermutigen zu einer Weiterverfolgung dieser interessanten Vorhersage.
Trotz einiger Meinungsverschiedenheiten schlagen wir die Hypersexualitätsstörung als einen Subtyp von RDS vor, der Eigenschaften mit substanz- und nicht substanzsüchtigem Verhalten teilt, wobei sein klinischer Ausdruck teilweise sowohl von der Genetik als auch von der Epigenetik beeinflusst wird. Obwohl dies zu diesem Zeitpunkt noch nicht getestet wurde, schlagen wir auch kurzzeitige, von der FDA genehmigte medikamentengestützte Behandlungen (MAT) vor, die die Blockierung der Dopaminfunktion begünstigen, gefolgt von einer sanften Aktivierung dopaminerger Wege, was zu einer langfristigen Dopaminhomöostase führt. Letzteres könnte durch einige Modalitäten erreicht werden, die zur Erholung beitragen können.
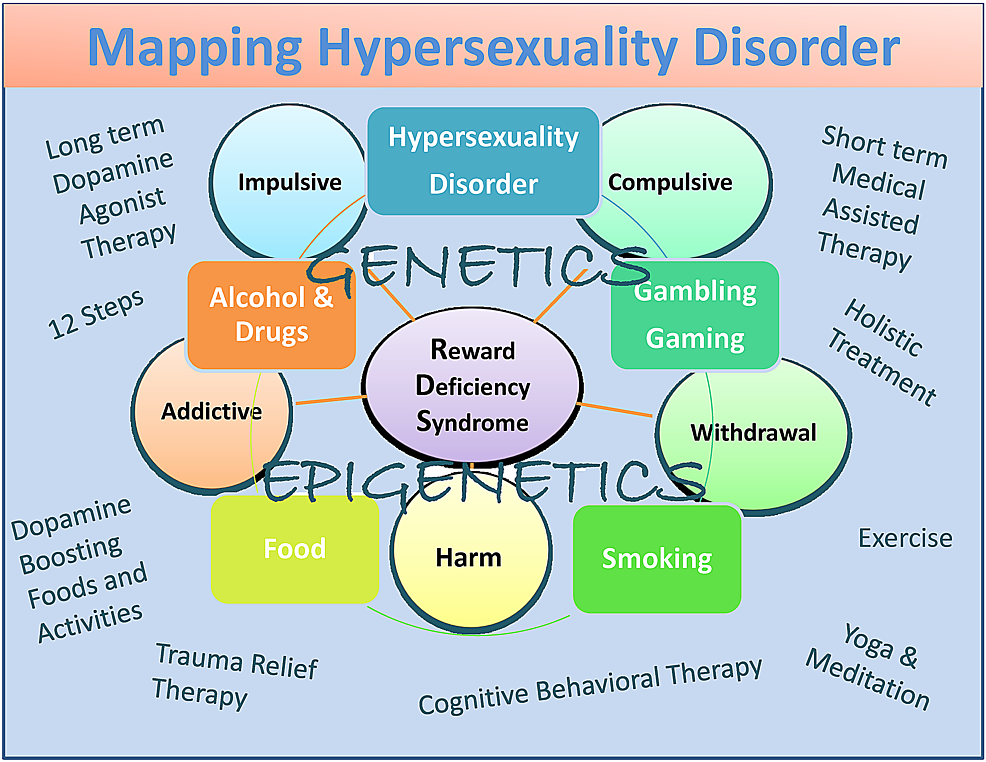
Obwohl potenziell befangen, umfassen sie Dopamin-Agonisten-Therapie-Nutrazeutika (KB220), das 12-Step-Programm und -Tradition, ganzheitliche Behandlung, kognitive Verhaltenstherapie (CBT) und Traumatherapie (TRT) sowie Dopamin-verstärkende Aktivitäten und Nahrungsmittel (Abbildung 1) [82].
Die Kontroverse
Wir sind der festen Überzeugung, dass die Hypersexualitätsstörung in zukünftige Ausgaben von DSM einbezogen werden sollte, wir sind etwas verblüfft, dass über diese Störung in Bezug auf Neurogenetik und Epigenetik und sogar Entzugssymptomatologie und Gesamtphänomenologie so wenig bekannt ist [83]. Die wichtigste Botschaft zum Mitnehmen ist, dass wir die wissenschaftliche Gemeinschaft jetzt dazu ermutigen, Experimente durchzuführen, insbesondere im Bereich der Bildgebung und der Neurogenetik, einschließlich epigenetischer Gene, die für Gene spezifisch sind, wie Oxytocin-Vasopressin-Orexin-Dopamin sowie andere Belohnungsgene. Möglicherweise kann diese Erkrankung von einer Behandlung profitieren, die auf die Belohnung von Genpolymorphismen zielt, um die Förderung der Dopamin-Homöostase zu unterstützen [84-89]. Eine Reihe von Reviews von Joranby et al. und Edge und Gold unterstützen gemeinsame Behandlungsmöglichkeiten im Zusammenhang mit gemeinsamen neurochemischen Mechanismen in Gehirnbelohnungsschaltkreisen, wie zuvor im RDS-Konzept vorgeschlagen [90-91].
Historisch gesehen war „Sexsucht“ in DSM-III enthalten, wurde jedoch aus DSM-1V entfernt, da der Konsens der Autoren von DSM-1V der Ansicht war, dass es nicht genügend Beweise gab, um seine Schlussfolgerung zu verdienen. Diese Entscheidung war von Führungskräften auf dem Gebiet mit immensen Emotionen behaftet. Im Anschluss an diese Veranstaltung beschlossen eine Reihe von Wissenschaftlern, darunter Kafka, Reid, Prause und andere, „Hypersexualität“ nicht als Sexsucht, sondern als eigenständige psychische Störung und nicht als Sucht an sich zu definieren. Während ihre frühere Arbeit im Jahr 2010 darauf hinwies, dass „Hypersexualität“ der Sexsucht und möglicherweise anderen Abhängigkeiten, einschließlich Drogenmissbrauch, ähnlich ist, weicht ihre neuere Arbeit von dieser Behauptung ab. Die jüngsten Arbeiten in diesem Bereich zeigen anhaltende Kontroversen. Es gibt eine Reihe elektrophysiologischer Studien von Prauses Gruppe, die einige Beweise dafür liefern, dass sexuelles Verlangen, nicht Hypersexualität, eine Selbstregulierung der sexuellen Erregung vorhersagt [92]. Diese Forscher schlagen in anderen Arbeiten vor, dass Probanden, die über Probleme bei der Sichtbarmachung visueller sexueller Reize (VSS) berichteten, die ebenfalls über ein höheres sexuelles Verlangen berichteten, geringere spätere positive Potentiale (LPP) als Reaktion auf VSS aufwiesen. Die Autoren schlagen vor, dass dieses Muster sich von den Suchtmodellen unterscheidet [93]. Die Arbeit der Voon-Gruppe hat zwar keine Probanden mit hypersexueller Störung betroffen, aber gezeigt, dass bei Probanden mit zwanghaftem Sexualverhalten sexuell expliziten Videos ausgesetzt ist, eine stärkere Aktivität im neuronalen Netzwerk, ähnlich der in Studien zur Reaktion auf Arzneimittelreaktionen beobachteten Aktivität [94]. Größeres Verlangen oder Wollen statt Gefallen wurde mit Aktivität in diesem neuronalen Netzwerk verbunden. Diese Arbeit verzahnt sich mit Theorien der Anreizmotivation [95].
Wir, die Autoren des aktuellen Artikels, geben zu, dass wir nicht mit allen wichtigen Wechselwirkungen vertraut waren, die zwischen den Befürwortern der „Hypersexualitätsstörung“ und ihrer ehrlichen Absicht, diese Störung in das aktuelle DSM-5 aufzunehmen, aufgetreten sind. Obwohl der sogenannte „Säuretest“ nicht bestanden wurde, gibt es allen Grund zu der Annahme, dass er in zukünftigen Ausgaben des DSM enthalten sein wird. Es ist bemerkenswert, dass Steven Hyman, der derzeitige NIH-Direktor, zu Recht argumentierte: „Das DSM ist ein schlechter Spiegel der klinischen und biologischen Realität. Ein grundlegend neuer Ansatz für die diagnostische Klassifizierung ist erforderlich, da Forscher neue Wege finden, um psychische Erkrankungen zu untersuchen und zu verstehen. “ [96]. Darüber hinaus berichten Casey et al. schlug vor, dass, während der DSM verschiedene Erkrankungen als unterschiedliche Entitäten betrachtet, "die Grenzen zwischen den Erkrankungen oft nicht so streng sind, wie der DSM nahe legt" [97].
In 2014 berichteten Karila et al. schlug vor, dass die sexuelle Abhängigkeit, die auch als hypersexuelle Störung bekannt ist, von einigen Psychiatern ignoriert wurde, obwohl sie schwere psychosoziale Probleme verursachte. Laut diesen Autoren schlagen sie vor, dass sexuelle Abhängigkeit oder hypersexuelle Störung unterschiedliche Begriffe für dasselbe Problem darstellen. Sie weisen darauf hin, dass die Prävalenzraten sexueller Suchtstörungen zwischen 3% und 6% liegen. Dementsprechend zeigt das Konstrukt der sexuellen Abhängigkeit / hypersexuellen Störung problematische Verhaltensweisen, einschließlich übermäßiges Masturbieren, Cybersex, Pornografie, anormales sexuelles Verhalten bei Erwachsenen, Telefonsex, Besuch im Strip-Club und andere Suchtverhalten [98]. Gewiss stimmen wir darin überein, dass zwischen Sexualsucht und Hypersexualität deutliche Unterschiede bestehen können, wie von Carvalho et al. [99], Rettenberger et al. [100], Kor et al. [1]Reid et al. [9], Kafka und Hennen [13]und Prause et al. [93-94] unter anderem.
Zusammenfassend haben wir vorgeschlagen, dass, obwohl es einige Unterschiede zwischen Hypersexualität und Sexsucht gibt, mehr Forschung erforderlich ist, um diese sehr wichtigen Bedingungen angemessen zu kategorisieren. Wir sind mit der Arbeit von Walters, et al. [101] Dies deutete darauf hin, dass individuelle Unterschiede in der Hypersexualität eher quantitativer als qualitativer Natur sind. Sie deuten auch an, dass Hypersexualität entlang eines Kontinuums organisiert wird, das am oberen Ende des Kontinuums abfällt (Abbildung 1).
Abbildung 1: Eine beschreibende Karte der Hypersexualitätsstörung als Subtyp von RDS
Die Abbildung zeigt interaktive neurogenetische und epigenetische Effekte. Es werden sowohl kurzfristige Dopaminblocker- als auch langfristige Behandlungen auf der Basis der „dopaminergen Homöostase“ sowie Dopamin-Boosting-Therapien und tägliche Aktivitäten aufgeführt. Kreise zeigen RDS-Eigenschaften an und Kästchen zeigen RDS-Verhalten an.
Schlussfolgerungen
Während wir die Kontroverse anerkennen, schlagen wir vor, dass mögliche Unterschiede und Ähnlichkeiten zwischen Hypersexualitätsstörung und Sexsucht unter Verwendung von Neuroimaging (fMRI, PET, SPECT), Optogenetik, Kandidaten- und Microarray-Analyse und epigenetischen Techniken angemessen untersucht werden sollten. Wir glauben, dass diese Untersuchungen die Grundlage für die Einbeziehung der Hypersexualität als Störung in zukünftige Ausgaben des DSM bilden werden.
Bibliographie
- Kor A, Fogel Y, Reid RC, Potenza MN: Sollte Hypersexual Disorder als Sucht eingestuft werden?. Sexsüchtiger Zwang. 2013, 20:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3836191/. 10.1080/10720162.2013.768132
- Rush B: Medizinische Untersuchungen und Beobachtungen zur Krankheit des Geistes. Rush B (Hrsg.): Gryphon Editions Ltd., Birmingham, AL; (Originalarbeit veröffentlicht 1812) in 1979 überprüft.
- von Krafft-Ebing R: Psychopathia Sexualis. Klaf FS (Hrsg.): Stein und Day, New York; (Originalarbeit veröffentlicht 1886) in 1965 überprüft.
- Hirshfeld M: Sexuelle Anomalien: Herkunft, Art und Behandlung sexueller Störungen. Hirshfeld M (Hrsg.): Emerson Books, New York; 1948.
- Kinderwagen RJ: Perversion: Die erotische Form des Hasses. Pantheon Books, New York; 1975.
- Allen CA: Ein Lehrbuch über psychosexuelle Störungen. Oxford University Press, London; 1962.
- Ellis A, Sagarin E: Nymphomanie: Eine Studie der übersexten Frau. Gilbert Press, New York; 1964.
- Kafka MP: Was ist mit Hypersexualstörung passiert?. Arch Sex Behav. 2014, 43: 1259-1261. 10.1007 / s10508-014-0326-y
- RC Reid, Temko J, Moghaddam JF, Fong TW: Scham, Wiederkäuen und Selbstmitgefühl bei Männern, die auf hypersexuelle Störungen untersucht wurden. J Psychiatr Praxis. 2014, 20: 260 – 268. 10.1097 / 01.pra.0000452562.98286.c5
- Bancroft J: Die menschliche Sexualität und ihre Probleme. Dritte Edition. Elsevier, Oxford, England; 2009.
- Internationale statistische Klassifikation von Krankheiten und verwandten Gesundheitsproblemen, 10-Revision . (2007). Zugriff: Juli 23, 2015: http://apps.who.int/classifications/apps/icd/icd10online2007/.
- Sänger B, Toates FM: Sexuelle Motivation. J Sex Research. 1987, 23: 481 – 501. 10.1080/00224498709551386
- Kafka MP, Hennen J: Hypersexuelles Verlangen bei Männern: Unterscheiden sich Männer mit Paraphilien von Männern mit paraphilischen Störungen?. Sexualmissbrauch. 2003, 15: 307 – 321. 10.1023 / A: 1025000227956
- Buss DM, Schmitt DP: Theorie der Sexualstrategien: Eine evolutionäre Perspektive auf die Paarung von Menschen. Psychol Rev. 1993, 100: 204-232. 10.1037 / 0033-295X.100.2.204
- Corbett-Detig RB, Hartl DL, Sackton TB: Die natürliche Auslese beschränkt die neutrale Vielfalt über eine Vielzahl von Arten. Psychol Bull. 1995, 13: e1002112.- 469-496. doi: 10.1371 / journal.pbio.1002112
- Laumann EO, Michael RT, Gagnon JH: Eine politische Geschichte der nationalen Sexualumfrage bei Erwachsenen. Fam-Plan-Perspektive. 1994, 26: 34 – 38. 10.2307/2136095
- Jones JC, Barlow DH: Häufigkeit von sexuellen Verlangen, Fantasien und Masturbationsphantasien bei heterosexuellen Männern und Frauen. Arch Sex Behav. 1990, 19: 269 – 79. 10.1007 / BF01541552
- Oliver MB, Hyde JS: Geschlechtsspezifische Unterschiede in der Sexualität: eine Metaanalyse. Psychol Bull. 1993, 114: 29 – 51. 10.1037 / 0033-2909.114.1.29
- Okami P, Shackelford TK: Geschlechtsspezifische Unterschiede in der Sexualpsychologie und im Verhalten. Annu Rev Sex Res. 2001, 12: 186–241. 10.1080/10532528.2001.10559798
- Leitenberg H, Detzer MJ, Srebnik D: Geschlechtsspezifische Unterschiede bei der Masturbation und das Verhältnis von Masturbationserfahrungen in der Präadoleszenz und / oder frühen Pubertät zum sexuellen Verhalten und zur sexuellen Anpassung im jungen Erwachsenenalter. Arch Sex Behav. 1993, 22: 87 – 98. 10.1007 / BF01542359
- Fetterman AK, Kruger NN, Dr. med. Robinson: Geschlechtsgebundene Paarungsstrategien weichen voneinander ab und manipulieren die Geschlechtsorgane. Motiv Emot. 2015, 39: 99 – 103. 10.1007/s11031-014-9420-7
- Basson R: Verwendung eines anderen Modells für die sexuelle Reaktion von Frauen, um das problematische niedrige sexuelle Verlangen von Frauen anzugehen. J Sex Ehe Ther. 2001, 27: 395–403. 10.1080/713846827
- Andersen BL, Cyranowski JM, Aarestad S: Jenseits künstlicher, geschlechtsgebundener Unterschiede, um weibliche Sexualität zu konzeptualisieren: Kommentar zu Baumeister. Psychol Bull. 2000, 126: 380 – 389. 10.1037 // 0033-2909.126.3.380
- Ritter RA, Sims-Ritter JE: Die Entwicklungsvorläufer sexueller Nötigung gegen Frauen: Prüfung alternativer Hypothesen mit Modellierung der Strukturgleichung. Ann NY Acad Sci. 2003, 989: 72 – 85. 10.1111 / j.1749-6632.2003.tb07294.x
- Blum K, Werner T., Carnes S., Carnes P., Bowirrat A., Giordano J., Oscar-Berman M., Gold M. Sex, Drogen und Rock'n'Roll: Hypothese einer häufigen mesolimbischen Aktivierung als Funktion von Belohnungsgenpolymorphismen. J Psychoaktive Drogen. 2012, 44: 38 – 55. 10.1080/02791072.2012.662112
- Carnes PJ, Green BA, Merlo LJ, Umfragen A, Carnes S, Gold MS: PATHOS: Eine kurze Screening-Anwendung zur Beurteilung der sexuellen Abhängigkeit. J Addict Med. 2012, 6: 29 – 34. 10.1097/ADM.0b013e3182251a28
- Hanson RK: Prognostiziert Static-99 einen Rückfall älterer Sexualstraftäter?. Sexueller Missbrauch. 2006, 18: 343–355. 10.1007 / s11194-006-9027-y
- Weinstein A, Katz L, Eberhardt H, Cohen K, Lejoyeux M: Sexueller Zwang - Beziehung zu Sex, Bindung und sexueller Orientierung. J Behav Addict. 2015, 4: 22 – 26. 10.1556 / JBA.4.2015.1.6
- Chung WS, Lim SM, Yoo JH, Yoon H: Geschlechtsspezifische Unterschiede bei der Aktivierung des Gehirns gegenüber audiovisueller sexueller Stimulation; Erleben Frauen und Männer als Reaktion auf denselben Videoclip das gleiche Maß an Erregung?. Int J Impot Res. 2013, 25: 138-142. 10.1038 / ijir.2012.47
- Rupp HA, Wallen K: Geschlechtsunterschiede als Reaktion auf visuelle sexuelle Reize: eine Überprüfung. Arch Sex Behav. 2008, 37: 206 – 218. 10.1007/s10508-007-9217-9
- Hanson RK, Harris AJ, Helmus L, Thornton D: Sexualstraftäter mit hohem Risiko sind möglicherweise nicht für immer ein hohes Risiko. J Gewalttätigkeit. 2014, 29: 2792-813. 10.1177/0886260514526062
- Reid RC, Cyders MA, Moghaddam JF Fong TW: Psychometrische Eigenschaften der Barratt-Impulsskala bei Patienten mit Spielstörungen, Hypersexualität und Methamphetaminabhängigkeit. Addict Behav. 2014, 39: 1640 – 1645. 10.1016 / j.addbeh.2013.11.008
- Reid RC, Carpenter BN, Hook JN, Garos S., Manning JC, Gilliland R., Cooper EB, McKittrick H., Davtian M., Fong T. Bericht über die Ergebnisse einer DSM-5-Feldstudie für hypersexuelle Störungen. J Sex Med. 2012, 9: 2868 – 2877. 10.1111 / j.1743-6109.2012.02936.x
- Garcia FD, Thibaut F: Sexuelle Abhängigkeiten. Bin J Alkoholmissbrauch. 2010, 36: 254-260. 10.3109/00952990.2010.503823
- Reid RC, Bramen JE, Anderson A, Cohen MS: Achtsamkeit, emotionale Dysregulation, Impulsivität und Stressanfälligkeit bei hypersexuellen Patienten. J Clin Psychol. 2014, 70: 313 – 321. 10.1002 / jclp.22027
- Halter MK, Hadjimarkou MM, Zup SL, Blutstein T, RS Benham, McCarthy MM, Mong JA: Methamphetamin erleichtert das sexuelle Verhalten von Frauen und verbessert die neuronale Aktivierung der medialen Amygdala und des ventromedialen Kerns des Hypothalamus. Psychoneuroendokrinologie. 2010, 35: 197 – 208. 10.1016 / j.psyneen.2009.06.005
- Spauwen LW, Niekamp AM, Hoebe CJ, Dukers-Muijrers NH: Drogenkonsum, sexuelles Risikoverhalten und sexuell übertragbare Infektionen bei Swingern: eine Querschnittsstudie in den Niederlanden. Sex Transm Infect. 2015, 91: 31 – 36. 10.1136 / sextrans-2014-051626
- Castelo-Branco C, Parera N, Mendoza N, Pérez-Campos E, Lete I, CEA-Gruppe: Alkohol- und Drogenmissbrauch sowie riskantes Sexualverhalten bei jungen erwachsenen Frauen. Gynecol Endocrinol. 2014, 30: 581 – 586. 10.3109/09513590.2014.910190
- Jia ZJ, Yan SY, Yo Bao, Lian Z, Zhang HR, Liu ZM: Sexuelle Verhaltensunterschiede zwischen Amphetamin-Konsumenten und Heroinkonsumenten. J Addict Med. 2013, 7: 422 – 427. 10.1097/ADM.0b013e3182a952b2
- Bruijnzeel AW: Kappa-Opioid-Rezeptorsignalisierung und Gehirnbelohnungsfunktion. Brain Res Rev. 2009, 62: 127 – 146. 10.1016 / j.brainresrev.2009.09.008
- Orsini CA, Ginton G, Shimp KG, Avena NM, Gold MS, Setlow B: Nahrungsaufnahme und Gewichtszunahme nach Absetzen einer chronischen Amphetamin-Verabreichung. Appetit. 2014, 78: 76 – 80. 10.1016 / j.appet.2014.03.013
- Ibrahim C, Reynaert C: Hypersexualität bei neurokognitiven Störungen bei älteren Menschen - eine umfassende Überprüfung der Literatur und Fallstudie. Psychiatr Danub. 2014, 26: 36 – 40.
- Vallejo-Medina P, Sierra JC: Einfluss des Drogenkonsums und Einfluss der Abstinenz auf die sexuelle Funktion in einer von Männern abhängigen spanischen Stichprobe: eine Studie mit mehreren Standorten. J Sex Med. 2013, 10: 333 – 341. 10.1111 / j.1743-6109.2012.02977.x
- Baskerville TA, Douglas AJ: Dopamin- und Oxytocin-Wechselwirkungen, die dem Verhalten zugrunde liegen: mögliche Beiträge zu Verhaltensstörungen. CNS Neurosci Ther. 2010, 16: e92-123. 10.1111 / j.1755-5949.2010.00154.x
- Riebe CJ, Lee TT, Hill MN, Gorzalka BBB: Der ausgefällte Entzug wirkt den Nebenwirkungen der subchronischen Verabreichung von Cannabinoid auf das Sexualverhalten männlicher Ratten entgegen. Neurosci Lett. 2010, 472: 171 – 174. 10.1016 / j.neulet.2010.01.079
- Korda JB, Pfaus JG, Kellner CH, Goldstein I: Persistierende Genitalerregungsstörung (PGAD): Fallbericht über eine langfristige symptomatische Behandlung mit Elektrokrampftherapie. J Sex Med. 2009, 6: 2901 – 2909. 10.1111 / j.1743-6109.2009.01421.x
- Huang CJ, Liao HT, Yeh GC, Hung KL: Verteilung von HLA-DQB1-Allelen bei Patienten mit Kleine-Levin-Syndrom. J Clin Neurosci. 2012, 19: 628 – 630. 10.1016 / j.jocn.2011.08.020
- Blum K, Edle EP, Sheridan PJ, Montgomery A, Ritchie T, Jagadeeswaran P, Nogami H, Briggs AH, Cohn JB: Allelische Assoziation des humanen Dopamin-D2-Rezeptor-Gens im Alkoholismus. JAMA. 1990, 263: 2055 – 2060. 10.1001 / jama.263.15.2055
- Sheridan PJ, Wood RC, ER Braverman, Chen TJ, Cull JG, Comings DE: Das D2-Dopaminrezeptor-Gen als Determinante des Belohnungsmangelsyndroms. JR Soc Med. 1996, 89: 396-400. 10.1177/014107689608900711
- Miller WB, Pasta DJ, Mac Murray J, Chiu C, Wu H, Kommen DE: Dopaminrezeptorgene sind mit dem Alter beim ersten Geschlechtsverkehr assoziiert. J Biosoc Sci. 1999, 31: 43 – 54. 10.1017 / S0021932099000437
- Hamann S., Herman RA, Nolan CL, Wallen K: Männer und Frauen unterscheiden sich in der Amygdala-Reaktion auf visuelle sexuelle Reize. Nat Neurosci. 2004, 7: 411 – 416. 10.1038 / nn1208
- Quiñones-Jenab V: Warum sind Frauen von der Venus und Männer vom Mars, wenn sie Kokain missbrauchen?. Brain Res. 2006, 1126: 200 – 203. 10.1016 / j.brainres.2006.08.109
- Edle EP, Blum K, Khalsa ME, Ritchie T, Montgomery, RC Wood, Fitch RJ, Ozkaragoz T, Sheridan PJ, MD Anglin, Paredes A, Treiman LJ, Funken RS: Allelische Assoziation des D2-Dopaminrezeptor-Gens mit der Kokainabhängigkeit. Drogen-Alkohol hängen ab. 1993, 33: 271 – 285. 10.1016/0376-8716(93)90113-5
- Harrison PJ, Tunbridge EM: Catechol-O-methyltransferase (COMT): Ein Gen, das zu Geschlechtsunterschieden bei der Gehirnfunktion und zu sexuellem Dimorphismus in der Prädisposition für psychiatrische Störungen beiträgt. Neuropsychopharmakologie. 2008, 33: 3037 – 3045. 10.1038 / sj.npp.1301543
- Guo G, Tong Y: Alter beim ersten Geschlechtsverkehr, Genen und sozialem Kontext: Beweise von Zwillingen und dem Dopamin-D4-Rezeptor-Gen. Demographie. 2006, 43: 747 – 769. 10.1353 / dem.2006.0029
- Bradley KC, Boulware MB, Jiang H, Doerge RW, Meisel RL, Mermelstein Veränderungen der Genexpression im Nucleus accumbens und im Striatum nach sexueller Erfahrung. Gene Brain Behav. 2005, 4: 31 – 44. 10.1111 / j.1601-183X.2004.00093.x
- Rao BS, Raju TR, Meti BL: Erhöhte numerische Dichte der Synapsen in der CA3-Region des Hippocampus und der molekularen Schicht des motorischen Kortex nach ermutigender Erfahrung der Selbststimulation. Neurowissenschaften 1999, 91: 799 – 803. 10.1016/S0306-4522(99)00083-4
- Heshmati M: Kokaininduzierte LTP im ventralen Tegmentbereich: Neue Einblicke in Mechanismen und Zeitverlauf beleuchten die zellulären Substrate der Sucht. J Neurophysiol. 2009, 101: 2735 – 2737. 10.1152 / jn.00127.2009
- Biber KM, Wright JP, Walsh A: Eine genbasierte evolutionäre Erklärung für den Zusammenhang zwischen krimineller Beteiligung und Anzahl der Sexualpartner. Biodemographie Soc Biol. 2008, 54: 47 – 55. 10.1080/19485565.2008.9989131
- Santtila P, Jern P, Westberg L, Walum H, Pedersen CT, Eriksson E, Sandnabba N: Der Polymorphismus des Dopamintransportergens (DAT1) ist mit einer vorzeitigen Ejakulation verbunden. J Sex Med. 2010, 7: 1538 – 1546. 10.1111 / j.1743-6109.2009.01696.x
- Chen TJH, Blum K, Mathews D, Fischer L, Schnautz N, Braverman Er, Schoolfield J, Downs W, Blum SH, Mengucci J, Maschkin B, Arcuri V, Bajaj A, Waite RL, Vorläufige Assoziation der Gene Dopamin D2 Receptor (DRD2) [Taq1 A1 Allele] und Dopamin-Transporter (DAT1) [480 bp Allele] mit pathologisch aggressivem Verhalten, einem klinischen Subtyp des Reward Deficiency Syndrome (RDS) in Adolescent. Gene Ther Mol Biol. 2007, 1: 93-112. Zugriff: Juli 23, 2015: http://gtmb.org/pages/Vol11A/HTML/11._Chen_et_al,_93-102.htm.
- Burt SA, Mikolajewski AJ: Vorläufige Beweise dafür, dass bestimmte Kandidatengene mit antisozialem Verhalten von Jugendlichen in Verbindung gebracht werden. Aggress Behavior. 2008, 34: 437 – 445. 10.1002 / ab.20251
- Jóźków P, Słowińska-Lisowska M, Łaczmański Ł, Mędraś M: Polymorphe Varianten von Neurotransmitterrezeptorgenen können die sexuelle Funktion bei alternden Männern beeinflussen: Daten aus der HALS-Studie. Neuroendokrinologie. 2013, 98: 51 – 59. 10.1159/000350324
- Vertrieb JM, DiClemente RJ, Brody GH, Philibert RA, Rose E: Wechselwirkung zwischen 5-HTTLPR-Polymorphismus und Missbrauchsgeschichte auf das Kondomgebrauchsverhalten jugendlicher afroamerikanischer Frauen nach Teilnahme an einer HIV-Präventionsmaßnahme. Prev Sci. 2014, 15: 257 – 267. 10.1007/s11121-013-0378-6
- Barrett CE, Keebaugh AC, Ahern TH, Bass CE, Terwilliger EF, Young LJ: Die Variation der Expression des Vasopressinrezeptors (Avpr1a) führt zu einer Vielfalt von Verhaltensweisen, die mit der Monogamie in Präriewühlmäusen zusammenhängen. Horm Behav. 2013, 63: 518 – 526. 10.1016 / j.yhbeh.2013.01.005
- Garcia JR, MacKillop J, Aller EL, Merriwether AM, Wilson DS, Lum JK: Assoziationen zwischen Dopamin-D4-Rezeptor-Genvariation sowohl mit Untreue als auch mit sexueller Promiskuität. Plus eins. 2010, 5: e14162. 10.1371 / journal.pone.0014162
- Daw J, Guo G: Der Einfluss von drei Genen auf die Frage, ob Jugendliche Verhütungsmittel anwenden, USA 1994-2002. Popul Gestüt (Camb). 2011, 65: 253 – 271. 10.1080/00324728.2011.598942
- Emanuele E, Brondino N, Pesenti S, Re S, Geroldi D: Genetische Belastung menschlicher Liebesstile. Neuro Endocrinol Lett. 2007, 28: 815 – 821.
- Matsuda KI: Epigenetische Veränderungen im Östrogenrezeptor-α-Genpromotor: Auswirkungen auf das Verhalten von Soziosexuellen. Front Neurosci. 2014, 8: 344. 10.3389 / fnins.2014.00344
- Reis WR, Friberg U, Gavrilets S: Homosexualität durch kanalisierte sexuelle Entwicklung: ein Testprotokoll für ein neues epigenetisches Modell. Bioessays. 2013, 35: 764 – 770. 10.1002 / bies.201300033
- Gundersen B: Paarbindung durch Epigenetik. Nat Neurosci. 2013, 16: 779. 10.1038 / nn0713-779
- Wang H, Duclot F, Liu Y, Wang Z, Kabbaj M: Histon-Deacetylase-Inhibitoren erleichtern die Präferenzbildung der Partner in weiblichen Prärie-Wühlmäusen. Nat Neurosci. 2013, 16: 919 – 924. 10.1038 / nn.3420
- Zeh JA, Zeh DW: Mütterliches Erbe, Epigenetik und die Entwicklung der Polyandrie. Genetica. 2008, 134: 45 – 54. 10.1007 / s10709-007-9192-z
- Addad M, Lesiau A: Extraversion, Neurotizismus, unmoralisches Urteil und kriminelles Verhalten. Med Law. 1989, 8: 611 – 622.
- Brodie R: Virus des Geistes: Die neue Wissenschaft des Meme. Hay House, Inc., New York, NY; 1996, pp. 66.
- Hernnstein R, Murray C: Die Bell-Kurve: Intelligenz und Klassenstruktur im amerikanischen Leben. Die freie Presse, New York, NY; 1994.
- Smillie LD, Cooper AJ, Proitsi P., Powell JF, Pickering AD: Die Variation im DRD2-Dopamin-Gen sagt extravertierte Persönlichkeit voraus. Neurosci Lett. 2010, 468: 234 – 327. 10.1016 / j.neulet.2009.10.095
- Kommen DE: Die Genbombe Beschleunigt Hochschulbildung und fortschrittliche Technologie die Auswahl von Genen für Lernstörungen, ADHS, süchtig machende und störende Verhaltensweisen?. Hope Press, Duarte CA; 1996.
- Kommen DE: Das Problemverhaltens-Syndrom der Jugendlichen. Die Genbombe Beschleunigt Hochschulbildung und fortschrittliche Technologie die Auswahl von Genen für Lernstörungen, ADHS, süchtig machende und störende Verhaltensweisen? Hope Press, Duarte CA; 1996. pp 91-94.
- Kommen DE: Genauswahl. Die Genbombe Beschleunigt Hochschulbildung und fortschrittliche Technologie die Auswahl von Genen für Lernstörungen, ADHS, süchtig machende und störende Verhaltensweisen? Hope Press, Duarte CA; 1996. pp 89-90.
- Kommen DE: Die Berkeley-Studie. Die Genbombe Beschleunigt Hochschulbildung und fortschrittliche Technologie die Auswahl von Genen für Lernstörungen, ADHS, süchtig machendes und störendes Verhalten? Hope Press, Duarte Kalifornien; 1996. pp 105 – 210.
- Borsten J: Malibu Beach Recovery Diet Kochbuch. Vidov Publishing Inc., Malibu, Kalifornien; 2015.
- Derbyshire KL, Grant JE: Zwanghaftes Sexualverhalten: Eine Überprüfung der Literatur. J Behav Addict. 2015, 4: 37 – 43. 10.1556/2006.4.2015.003
- Nirenberg MJ: Dopamin-Agonisten-Entzugssyndrom: Auswirkungen auf die Patientenversorgung. Drogen altern 2013, 30: 587 – 592. 10.1007 / s40266-013-0090-z
- Grant JE, Brauer JA, Potenza MN: Die Neurobiologie von Substanz- und Verhaltenssucht. CNS Spectr. 2006, 11: 924 – 930.
- Sakata K, Herzog SM: Das Fehlen der BDNF-Expression durch Promotor IV stört die Expression von Monoamin-Genen im frontalen Cortex und Hippocampus. Neurowissenschaften 2014, 260: 265 – 75. 10.1016 / j.neuroscience.2013.12.013
- Blum K, Liu Y, Wang W, Wang Y, Zhang Y, Oscar-Berman M., Smolen A., Febo M., Han D., Simpatico T., Cronjé FJ, Z. Demetrovics, Gold MS: rsfMRI-Effekte von KB220Z ™ auf neuronale Pfade in Belohnungsschaltungen von abstinent genotypisierten Heroinabhängigen. Postgrad Med. 2015, 127: 232 – 241.
- McLaughlin T., Blum K., Oscar-Berman M., Febo M., Demetrovics Z., Agan G., Fratantonio J., Gold MS: Mit dem Neuroadaptagen KB200z ™ können Sie furchterregende, luzide Albträume bei RDS-Patienten verbessern: die Rolle von verbesserter Gehirnbelohnung, funktioneller Konnektivität und dopaminerger Homöostase. J Belohnung Defic Syndr. 2015, 1: 24-35. 10.17756 / jrds.2015-006
- Blum K, Thanos PK, Badgaiyan RD, Febo M., Oscar-Berman M., Fratantonio J., Demotrovics Z, Gold MS: Neurogenetik und Gentherapie für das Belohnungsmangelsyndrom: Gehen wir in das gelobte Land?. Expertenmeinung Biol Ther. 2015, 5: 973 – 985. 10.1517/14712598.2015.1045871
- Joranby L, Pineda-Frost KY, Gold MS: Sucht nach Nahrung und Gehirnbelohnungssystemen. Sexuelle Sucht & Zwanghaftigkeit. 2005, 12: 201–217. 10.1080/10720160500203765
- Edge PJ, Gold MS: Drogenentzug und Hyperphagie: Lehren aus Tabak und anderen Drogen. Curr Pharm. Des. 2011, 17: 1173 – 1179. 10.2174/138161211795656738
- Moholy M, Prause N, Stolzfest, GH, Rahman A, Fong T: Sexuelles Verlangen, nicht Hypersexualität, sagt Selbstregulation der sexuellen Erregung voraus. Cogn Emot. 2015, 6: 1012.
- Prause N, Steele, VR, Staley C, Sabatinelli, D, Hajcak G: Modulation der späten positiven Potentiale durch sexuelle Bilder bei problematischen Nutzern und Kontrollen inkonsistent mit "Pornosucht". Biol Psychol. 2015, 109: 192-199. 10.1016 / j.biopsycho.2015.06.005
- Mechelmans DJ, Irvine M, Banca P, ua: Verstärkte Aufmerksamkeitsorientierung gegenüber sexuell eindeutigen Hinweisen bei Personen mit und ohne zwanghaftes Sexualverhalten. Plus eins. 2014, 25, 9 (8): e105476. 10.1371 / journal.pone.0105476
- Blum K, Gardner E, Oscar-Berman M, Gold M: "Liking" und "Wanting" im Zusammenhang mit dem Reward Deficiency Syndrome (RDS): Hypothese einer unterschiedlichen Reaktionsfähigkeit in der Belohnungsschaltung des Gehirns. Curr Pharm. Des. 2012, 18 (1): 113-118.
- Hyman SE: Diagnose des DSM: Diagnoseklassifizierung muss grundlegend reformiert werden. Großhirn. 2011, 2011: 6. Zugriff: 2011 Apr 26: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3574782/.
- Casey BJ, Craddock N, Cuthbert BN, Hyman SE, Lee FS, Ressler KJ: DSM-5 und RDoC: Fortschritt in der Psychiatrieforschung?. Nat Rev Neurosci. 2013, 14: 810-14. 10.1038 / nrn3621
- Karila L, Wéry A, Weinstein A, Cottencin O, Petit A, Reynaud M, Billieux J: Sexuelle Abhängigkeit oder hypersexuelle Störung: unterschiedliche Begriffe für dasselbe Problem? Eine Überprüfung der Literatur. Curr Pharm. Des. 2014, 20: 4012-20. 10.2174/13816128113199990619
- Carvalho J, Štulhofer A, Vieira AL, Jurin T: Hypersexualität und hohes sexuelles Verlangen: Untersuchung der Struktur problematischer Sexualität. J Sex Med. 2015, 12: 1356-67. Zugriff: 2015 Mar 23: http://onlinelibrary.wiley.com/doi/10.1111/jsm.12865/abstract;jsessionid=6F416CCBB66B7F0EA28E428D4993EBD5.f01t04. 10.1111 / jsm.12865
- Rettenberger M, Klein V, Briken P: Die Beziehung zwischen hypersexuellem Verhalten, sexueller Erregung, sexueller Hemmung und Persönlichkeitsmerkmalen. Arch Sex Behav. 2015, Jan 6: (Epub vor Druck). Zugriff: 2015 Jan 6: 10.1007/s10508-014-0399-7
- Walters GD, Ritter RA, Långström N: Ist Hypersexualität dimensionell? Nachweis für das DSM-5 aus allgemeinen Bevölkerungs- und klinischen Proben. Arch Sex Behav. 2011, 40: 1309-21. Zugriff: 2011 Feb 3: 10.1007/s10508-010-9719-8