Dialogoj Clin Neurosci. 2013 Dec;15(4):431-43.
abstrakta
Malgraŭ la graveco de multaj psikosociaj faktoroj, ĝia esenca drogo dependas de biologia procezo: la kapablo de ripetita ekspozicio al medikamentado de misuzo por indukti ŝanĝojn en vundebla cerbo, kiu pelas la serĉadon kaj kaptadon de drogoj, kaj perdo de kontrolo. super droguzo, kiu difinas staton de dependeco. Ĉi tie ni recenzas la specojn de molekulaj kaj ĉelaj adaptoj kiuj okazas en specifaj cerbaj regionoj por mediacii kondutismajn anomalojn asociitajn al dependeco. Ĉi tiuj inkluzivas ŝanĝojn en gena esprimo parte akiritajn de epigenezaj mekanismoj, plasticeco en la neŭrofiziologia funkciado de neŭronoj kaj sinapsioj, kaj asociita plastiko en neŭrona kaj sinapta morfologio parte fare de ŝanĝita signalotrofika faktoro. Ĉiu el ĉi tiuj specoj de drog-induktitaj modifoj povas esti vidata kiel formo de "ĉela aŭ molekula memoro". Plie, estas mirige, ke plej multaj dependaj manieroj de plasticeco estas tre similaj al la specoj de plasticeco, kiuj estis asociitaj kun pli klasikaj formoj de "konduta memoro", eble reflektante la finan repertuaron de adaptaj mekanismoj haveblaj al neŭronoj se temas pri mediaj defioj. Fine, molekulaj kaj ĉelaj adaptoj rilataj al dependeco implikas la plej multajn el la samaj cerbregionoj kiuj peras pli klasikajn memorojn, kongruas kun la opinio ke nenormalaj memoroj estas gravaj peliloj de dependaj sindromoj. La celo de ĉi tiuj studoj celantaj klarigi la molekulajn kaj ĉelajn bazojn de drogodependeco devas eventuale disvolvi biologiajn bazajn diagnozajn testojn, kaj ankaŭ pli efikajn kuracadojn por toksomanioj.
Enkonduko
Drogodependeco, kiu povas esti difinita kiel la deviga serĉado kaj prenado de medikamentoj malgraŭ teruraj konsekvencoj aŭ perdo de kontrolo de uzado de drogoj, estas kaŭzita de longdaŭra drogo-induktitaj ŝanĝoj okazantaj en certaj cerbaj regionoj.1 Nur iuj individuoj tamen falas al toksomanio antaŭ ripetata medikamenta ekspozicio, dum aliaj kapablas uzi drogon hazarde kaj eskapi de dependeca sindromo. Genetikaj faktoroj kaŭzas proksimume 50% de ĉi tiu individua ŝanĝiĝo en dependeco-vundebleco, kaj ĉi tiu grado de heredaĵo validas por ĉiuj ĉefaj klasoj de dependigaj medikamentoj, inkluzive de stimuliloj, opiaĵoj, alkoholo, nikotino kaj cannabinoidoj..2 Ankoraŭ ne eblis identigi la plej multajn el la genoj, kiuj konsistigas ĉi tiun genetikan riskon, verŝajne pro la implikiĝo de eble centoj da genetikaj varioj en sumaj en unu individuo por doni la dependecon-vundeblecon (aŭ, en aliaj individuoj, rezisto).
La alia 50% de la risko por toksomanio ŝuldiĝas al amaso da mediaj faktoroj, okazantaj dum la tuta vivo, kiuj interagas kun la genetika konsisto de individuo por fari lin aŭ ŝi vundebla al toksomanio en pli aŭ malpli granda mezuro. Pluraj specoj de medifaktoroj estis implikitaj en dependeco, inkluzive de psikosociaj stresoj, sed senkompare la plej potenca faktoro estas eksponiĝo al medikamento de fitraktado mem. Oni montris, ke iuj "enirejaj" drogoj, precipe nikotino, pliigas sian vundeblecon al toksomanio al alia drogo.3 Plie, estas pliiĝantaj indicoj, ke malgraŭ diversaj genetikaj riskoj de dependeco tra la populacio, ekspozicio al sufiĉe altaj dozo de drogo dum longaj periodoj povas transformi iun kiu havas relative malpli altan genetikan ŝarĝon en toksomaniulo..4
Grandaj progresoj estis faritaj dum la pasintaj du jardekoj en la identigo de la diskretaj regionoj de cerbo, kiuj gravas en mediacio de dependeco-sindromo, kaj ankaŭ la specojn de ŝanĝoj je la molekulaj kaj ĉelaj niveloj, kiujn drogoj en ĉi tiuj regionoj influas en kernaj aspektoj. de dependeco.1,5 La cirkvito, kiu plej multe atentis, nomiĝas sistemo dopolín mesolímbico, kiu implikas neŭronojn de dopaminoj en la areo ventral tegmental (VTA) de la meza cerbo inervanta mezvundajn neŭronojn en la kerno accumbens (NAc, parto de ventra striato). Ĉi tiuj neŭronoj de la VTA ankaŭ senaktivigas multajn aliajn regionojn de la cerbo antaŭa, inkludante la hipocampo, la amigdala kaj la ŝelo prefrontal (PFC).
Estas sencoplene konsideri ĉi tiujn drogo-induktitajn dependecajn me inanismojn en ĉi tiu volumo por memoro por tri koincidantaj kialoj.6
- Unue, ĉiuj drog-induktitaj adaptoj povas esti vidataj kiel specoj de "molekula aŭ ĉela memoro:" la nerva ĉelo spertanta tiajn ŝanĝojn diferencas kiel rezulto de drogo-ekspozicio kaj tial respondas al tiu sama drogo, al aliaj drogoj, aŭ al multaj aliaj stimuloj kiel rezulto.
- Due, estas interese, ke multaj, eble plej multaj, de la specoj de ŝanĝoj asociitaj kun stato de dependeco (ekz., ŝanĝita geno transskribo, epigenetiko, sinapta kaj tuta ĉelo plasticidad, kaj neuronal morfologio kaj neurotróficos mekanismoj) estas ankaŭ implikitaj en tradiciaj formoj de "konduta memoro" kiel spaca memoro, timo kondiĉita, kaj operantkondiĉo, inter aliaj.
- Trie, inter la cerbokaj regionoj tuŝitaj de medikamentoj de misuzo estas tiuj, kiuj estas ŝlosila neŭrona substrato por konduta memoro, inkluzive de hipokampo, amigdalo kaj PFC. Ĉi tio koincidas kun la pliiĝanta konscio, ke iuj el la plej gravaj ecoj de toksomanio vidita klinike (ekz., Avido de drogoj kaj reflekto) reflektas anomaliojn en tradiciaj memoraj cirkvitoj, kun longdaŭraj memoroj de la sperto pri drogo servantaj kiel potencaj ŝoforoj de dependeco.4,7,8 Male, la rekompencaj regionoj de la cerbo (ekz. VTA kaj NAc) forte influas kondutan memoron.
Ĉi tiu artikolo prezentas superrigardon pri la ĉefaj specoj de molekulaj kaj ĉelaj ŝanĝoj kiuj okazas en pluraj cerbaj regionoj en bestaj modeloj de dependeco, koncentrante sin sur la nukleon accumbens por kiu plej multaj informoj estas aktuale haveblaj. Gravas, ke estis eble pli kaj pli validigi iujn el tiuj ŝanĝoj en homaj droguloj bazitaj sur studoj de postmortemaj cerboj. Malgraŭ la fakto, ke medikamentoj de misuzo havas malsamajn kemiajn strukturojn kaj agas laŭ diferencaj proteinaj celoj, estas rimarkinde, ke multaj elstaraj dependaj dependaj adaptoj estas komunaj al multaj, kaj en iuj kazoj ĉiuj, drogoj kaj ofte kontribuas al komunaj trajtoj de sindromo de toksomanio.4,9 En kontrasto, multaj aliaj drog-induktitaj adaptoj estas specifaj al donita medikamento kaj povas mediacii pli unikajn aspektojn de donita dependeco. Ni enfokusigas ĉi tie la stimulilajn drogojn de misuzo, kiuj produktas pli dramecajn efikojn en bestaj modeloj kompare kun aliaj drogoj. Ni ankaŭ elstarigas gravajn areojn por estontaj esploroj, kiuj plialtigos nian scion pri dependaj sindromoj kaj tradukos ĉi tiujn progresojn en plibonigitaj diagnozaj testoj kaj kuracadoj.
Transkriptaj kaj epigenetaj mekanismoj
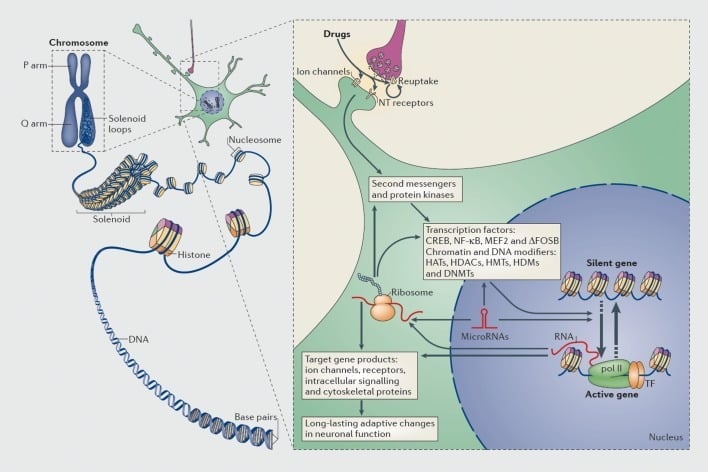
La scio, ke droguloj povas resti ĉe pli granda risko de recidivo malgraŭ jaroj da abstemio, signifas, ke la toksomanio implicas ŝanĝiĝojn en la cerbo, kiuj povas esti tre stabilaj. Ĉi tio igis plurajn grupojn konsideri ŝanĝojn en gena esprimo kiel grava komponanto de la dependiga procezo (figuro 1). Sekve, studoj de kandidataj genoj aŭ genar-ampleksaj enketoj implikantaj DNA-mikroarraojn kaj pli ĵuse RNA-seq (alt-traga sinsekvo de esprimitaj RNAoj) identigis multajn genojn, kies esprimo estas ŝanĝita en donita cerba regiono en ronĝuloj kaj primatoj-modeloj de toksomanio kaj en homaj droguloj. (ekz. refs 10-17). Ekzemploj de tiaj genoj estas diskutitaj en postaj sekcioj de ĉi tiu recenzo.
Mekanismoj de transcripta kaj epigeneta regulado de drogoj. En eŭkariotaj ĉeloj DNA preparas sin ĉirkaŭvolvante histonokombojn por formi nukleozomojn, kiuj tiam estas plue organizitaj kaj densigitaj por formi kromosomojn (maldekstra parto). Nur provizore malimpliki kompaktitan kromatinon la DNA de specifa geno povas esti alirebla por la transkripciaj maŝinoj. Medikamentoj de fitrakto agas tra sinaptaj celoj kiel reuptake mekanismoj, jonaj kanaloj, kaj neurotransmisoro (NT) riceviloj por ŝanĝi intracelular signalado akvofaloj (dekstra parto). Ĉi tio kondukas al aktivigo aŭ inhibicio de transkriptaj faktoroj (TF) kaj de multaj aliaj nukleaj celoj, inkluzive de kromatina reguliga proteinoj (montritaj de dikaj sagoj); la detalaj mekanismoj implikitaj en la sinapta regulado de kromatina-regulaj proteinoj restas nebone komprenitaj. Ĉi tiuj procezoj finfine rezultigas la indukton aŭ subpremon de specifaj genoj, inkluzive de tiuj por nekodaj RNAoj kiel microRNAoj; ŝanĝita esprimo de kelkaj el ĉi tiuj genoj povas siavice reguligi plu genan transskribon. Oni proponas, ke iuj el ĉi tiuj drog-induktitaj ŝanĝoj ĉe la kromatina nivelo estas ege stabilaj kaj tiel subtenas la longdaŭrajn kondutojn, kiuj difinas dependecon. CREB, cikla AMP-respondema elemento liganta proteino; DNMToj, DNA-metiltransferazoj; HAT-oj, histono-acetiltransferazoj; HDACoj, histona deacetilasoj; HDMoj, histonaj demetilazoj; HMTs, histona metiltransferazoj; MEF2, Myocyte-specific enhancer-faktoro 2; NF-kB, nuklea faktoro-KB; pol II, RNA-polimerazo II. Reproduktita de ref 44: Robison AJ, Nestler EJ. Transkriptaj kaj epigenetaj mekanismoj de dependeco. Nat Rev Neurosci. 2011: 12: 623.
Same, multaj specoj de transkriptaj faktoroj - proteinoj kiuj ligas al reguligaj regionoj de genoj kaj tiel plialtigas aŭ malpliigas la transskribon de tiuj genoj - estis implikitaj en mediacio de longdaŭraj efikoj de kuracilo de misuzo en gena esprimo en la cerbo.. Elstaraj ekzemploj inkluzivas CREB (cAMP-responda elementa liga proteino), ΔFosB (Fos-familio transkripciejo), NFkB (nuklea faktoro kB), MEF2 (miocito-pliboniga faktoro-2), kaj glukokortikozaj riceviloj, inter pluraj aliaj.5,10,18-22 Estis ĉiam pli eble kompreni la ĉelajn signalajn vojojn, per kiuj drogoj de misuzo aktivigas donitan transskriban faktoron en cerbo kaj kaŭze ligi tian aktivigon al la celaj genoj de tiu transkripta faktoro kaj al specifaj kondutaj aspektoj de toksomanio (vidu Figuro 1). Ĉi tiu progreso estas ilustrita de konsidero de CREB kaj ΔFosB, kiuj estas la plej bone studitaj transkriptaj faktoroj en dependaj modeloj.
CAMP Responda elemento obligacia proteino
Drogoj de stimulanta kaj opia ankao aktivas CREB en pluraj cerbaj regionoj gravaj por dependeco, ĉefe en la NAc.23,24 CREB estas sciata esti aktivigita en aliaj sistemoj de cAMP, Ca2+kaj kreskaj faktoraj vojoj,25 kaj ankoraŭ ne scias kiu el tiuj medias sian aktivigon en NAc de drogoj de misuzo. Oni pruvis, ke efiko de drogoj de CREB en NAc reprezentas klasikan negativan reagadon, per kio CREB helpas redukti la sentemon de besto al la fruktodonaj efikoj de ĉi tiuj drogoj (toleremo) kaj mediacii negativan emocian staton dum drogo (dependeco).18,26,27 Ĉi tiuj efikoj lastatempe montras por plialtigi la memadministradon kaj recidivon de drogoj, supozeble per procezo de negativa plifortigo.28 Ĉi tiuj agoj de CREB ŝajnas impliki ambaŭ gravajn subtipojn de NAc-meznivelaj neĝunoj, tiuj, kiuj esprimas ĉefe D1 kontraŭ D2 Riceviloj de dopaminoj.24 IEsence, granda kvanto de literaturo montris, ke CREB, aganta en hipokampo kaj amigdalo, estas ŝlosila molekulo en konduta memoro..29-31 Ĉi tiu larĝa rolo en dependeco kaj konduta memoro verŝajne reflektas la fakton, ke neŭronoj estas plenigitaj per finia nombro de molekulaj mekanismoj per kiuj adaptiĝi al konstante ŝanĝiĝanta medio.
Celaj genoj por CREB kiuj mediacias tiun kondutan fenotipon estis identigitaj tra genoma-larĝaj testoj same kiel pli multaj elektitaj klopodoj.10,18,32 Unu ekzemplo estas la opioida peptido dinorfino: stimulanta indukto de dinorfina esprimo en NAc-neŭronoj, mediaciita per CREB, pliigas dinorfinan aktivigon de k opioidaj riceviloj al VTA-dopamino-neŭronoj kaj tiel subpremas dopaminergian transdonon al la NAc kaj difektas rekompencon.18 Pluraj aliaj CREB-celoj montriĝis gravaj por drog-induktita sinapta plasticeco, kiel diskutita sube. Dum CREB ankaŭ estas aktivigita en pluraj aliaj cerbregionoj per stimuliloj kaj opiaĵoj,23,24 malpli oni scias pri la kondutaj konsekvencoj de ĉi tiu efiko kaj la celaj genoj, tra kiuj ili okazas. Same, oni scias malpli pri la rolo de CREB en la perado de la agoj de aliaj misuzoj.19
ΔFosB
Akra ekspozicio al preskaŭ ajna drogo el misuzo induktas ĉiujn faktorojn de Fos-famaj transskriboj en NAc kaj kelkaj aliaj cerbaj regionoj. Ĉi tiu indukto estas rapida sed ankaŭ tre pasema, kun niveloj de Fos-proteinoj revenantaj al normala en 8 al 12-horoj. Unike inter ĉi tiuj Fos-familiaj proteinoj estas ΔFosB, senpintigita produkto de la FosB-geno, kiu pro ĝia nekutima stabileco, iom post iom akumuliĝas tra kurso de ripetata medikamenta malkovro kaj iĝas la superreganta Fos-proteino esprimita sub ĉi tiuj kondiĉoj.22,33 Plie, pro ĉi tiu stabileco, niveloj de BFosB daŭras dum semajnoj post droga retiro. Tia kronika indukto de FosB estis montrita por preskaŭ ĉiuj medikamentoj de misuzo34 kaj, por plej multaj drogoj, estas selektema por Dl-tipaj NAc-neŭronoj.34,35 I ankaŭ estis montrita en homaj droguloj.35 Granda korpo da literaturo montris, ke tia ΔFosB-indukto en D1-tipo NAc-neŭronoj pliigas la sentemon de besto al drogo kaj ankaŭ naturajn rekompencojn kaj antaŭenigas drogadministradon, supozeble per procezo de pozitiva plifortigo (vidu refs 34 al 38). Interese, kurac-indukto de ΔFosB en NAc estas pli drasta en adoleskaj bestoj, tempo de pli granda toksomaneco.,39 kaj ĝia indukto de nikotino pruviĝis mediacii la enirejan plibonigon de nikotino de rekompenco de kokaino.40
Koncerne CREB, multaj celaj genoj por ΔFosB estis identigitaj en NAc per uzo de kandidata geno- kaj genoma-aliraj aliroj.10,32 Dum CREB induktas dinorfinon, ΔFosB subpremas ĝin, kio kontribuas al la por-rekompencaj efikoj de ΔFosB.38 Alia ΔFosB celo estas cFos: ĉar ΔFosB akumuliĝas per ripetata medikamenta ekspozicio, ĝi subpremas c-Fos kaj kontribuas al la molekula ŝaltilo, laŭ kiu osFosB estas selekteme induktita en la kronika traktato de drogoj..41 Multaj aliaj haveFosB-celoj medias la kapablon de certaj medikamentoj de misuzo indukti sinaptan plasticecon en la NAc kaj asociitajn ŝanĝojn en la dendrita arborigo de NAc-mezvundaj neŭronoj, kiel oni diskutos sube.
La funkciaj konsekvencoj de inFosB-indukto en aliaj cerbokaj regionoj estas malpli bone komprenitaj, kvankam ĝia indukto en orbitofrontala kortekso (OFC) estis studita en iu detalo. Ĉi tie, BFosB peras toleremon, kiu okazas al la kognozaj malhelpantaj efikoj de kokaino dum kurso de kronika ekspozicio, kaj ĉi tiu adapto asocias kun pliigo de kokaino mem-administrado..42,43
Tutaj genaraj testoj sugestis plurajn eblajn celojn, kiuj mediacios ĉi tiujn efikojn.42 Malgraŭ la unikaj tempaj ecoj de ΔFosB kaj la scio, ke ĝi estas induktita en tradiciaj memoraj cirkvitoj (ekz. Hipokampo), ankoraŭ ne estis esplorado de la rolo de ΔFosB en kondutmemoro, interesa temo por estonta esplorado.
Mekanismoj epigenéticos
Pli lastatempe, studoj pri transskribo estis puŝitaj unu paŝon al la epigenetiko44 (vidu Figuro 1), kiu povas esti larĝe difinita kiel ŝanĝo en gena esprimo kiu okazas en foresto de ŝanĝo en DNA-vico. Epigenetaj mekanismoj kontrolas la pakadon de DNA ene de ĉela kerno per ĝiaj interagoj kun histonoj kaj multaj aliaj specoj de nukleaj proteinoj, kiuj kune konsistas el kromateno. Gena esprimo estas kontrolita de la stato de ĉi tiu pakado per la kovalenta modifo de histonoj, aliaj proteinoj, kaj DNA mem. Kiel nur kelkaj ekzemploj, acetilado de histonoj tendencas antaŭenigi genan aktivigon, metilado de histonoj povas aŭ antaŭenigi genan aktivigon aŭ subpremon depende de la restaĵo Lys spertanta ĉi tiun modifon, kaj metilado de DNA ĝenerale asocias kun gena subpremo. ekzemple, 5-hidroximetilado povas esti asociita kun gen-aktivigo.
Epigenetiko estas alloga mekanismo ĉar, en aliaj sistemoj, ekzemple, evolua kaj kancera biologio, iuj epigenetaj modifoj povas esti konstantaj. Tial, epigenetiko estis plenumita kaj en lernaj kaj memoraj modeloj (ekz. refs 45-48) same kiel en dependeco;44,49 en ambaŭ sistemoj profundaj ŝanĝoj estis raportitaj en histona acetilado kaj metilado kaj en DNA-metilado. Kiel nur unu ekzemplo, la histona metiltransferazo, G9a, estas implicita en ambaŭ memoro50 kaj toksomanio.51,52 En dependeco-modeloj, G9a esprimo estas malreguligita en NAc responde al stimulaj aŭ opiiciaj drogoj de misuzo kaj tlia montris plibonigi la rekompencajn efikojn de tiuj drogoj.51,52 Kurioze, la forigo de kokaino de G9a estas mediata de FosB. G9a katalizas la dimetiladon de Lys9 de histono H3 (H3K9me2), grava mediaciisto de gena subpremo. ChIP-blato aŭ ChIP-seq (kromatina inmunoprecipitación sekvita, respektive, per reklama blatoj aŭ alta-prema sekvencado) estis uzata por akiri genoma-larĝajn mapojn de la genoj en NAc kiuj montras ŝanĝitan H3K9me2 post stimulaj ekspozicioj.32,52,53 Kovante ĉi tiujn genlistojn kun listoj de gena esprimo ŝanĝoj de genaro, kaj kun genoma-larĝaj mapoj de multaj aliaj formoj de epigenetikaj modifoj (ekz., ,FosB-ligilo, CREB-ligilo, aliaj histonaj modifoj, ktp)32,53 ĝi devus esti ebla identigi ĉiam pli kompletan aron de genoj reguligitaj de misuzoj kaj por kompreni la subestajn epigenetajn mekanismojn implikitajn.
Alia formo de epigeneta reguligo implikita en memoro kaj dependeco estas la generado de mikroRNA. Ĉi tiuj malgrandaj, ne kodigantaj RNA-ligoj al plaj regionoj de mRNA-oj kaj tiel subpremas sian tradukon aŭ induktas ilian degradadon. Forigo de Argonaŭto, proteino decida por la prilaborado de miRNA-oj, ŝanĝas kondutajn respondojn al kokaino, kun distingaj efikoj observitaj por D1- kontraŭ D2-tipaj mezvundaj neŭronoj.54 Pluraj specifaj miRNAoj ankaŭ estis montritaj esti reguligitaj per drogekspozicio kaj, siavice, influi kondutajn respondojn al la medikamentoj (ekz., Refs 55,56). Estus ekscite en estontaj studoj identigi la mRNA-celojn de ĉi tiuj miRNAoj kaj karakterizi kiel ili influas la dependigan procezon.
Plastika sinapta
La samaj ĝeneralaj tipoj de sinaptaj modifoj ĉe glutamatergaj sinapsoj, kiuj estis implikitaj en hipokampo kaj amigdalo en konduta memoro (vidu aliajn artikolojn en ĉi tiu eldono), simile pruvis esti en cerbaj rekompencaj regionoj en dependeco-modeloj kaj esti gravaj en mediacio. la dependiga procezo.57,58 Tia medikamenta sinapta plasticeco estis priskribita en pluraj cerbaj regionoj, tamen, ni koncentriĝas ĉi tie ĉe NAk kie la plej multaj esploroj centris ĝis nun. (figuro 2).
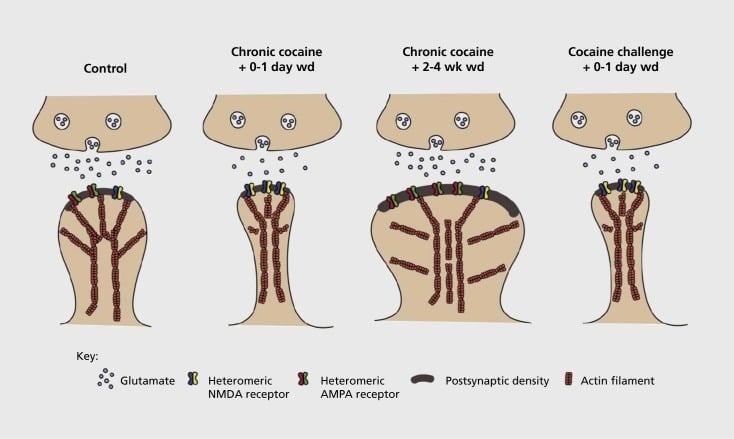
Modelo de dependeco sinapta kaj struktura plasticeco en kerno accumbens (NAc). Kronika ekspozicio al kokaino rezultigas tempon-dependa kaj pasema reorganizo de α-amino-3-hidroxi-5-metil-4-isoxazolepropiona-acida (AMPA) kaj N-metil-D-aspartika acidaj (NMDA) glutamataj riceviloj ĉe NAc-medio dornaj neŭronoj (MSN) sinapsioj, same kiel strukturaj ŝanĝoj en la spina kapo de NAc MSN-oj, kiuj rilatas al distingaj formoj de sinapta plasticeco. Ekzemple, kronika kokaino indukas surfacan esprimon de NMDA-receptoroj, silenta sinapse formado kaj longtempa depresio (LTD) ĉe fruaj retiraj punktoj. Dum pli longedaŭra retiro (wd), ĉi tiuj sinaptaj ŝanĝoj inversigas la rezulton esti pliigita esprimo de surfacaj AMPA-receptoroj, plifirmigo de la sinapsoj en fungo-forma vertebraro kaj longdaŭra potencigo. Ĉi tiuj efikoj rapide revenas denove post ekspozicio al defia dozo de kokaino kondukanta al restrukturado de la spino en maldikajn pikilojn kaj depresion de sinapta forto.
Komencaj eksperimentoj montris, ke ripetata ekspozicio al stimulaj medikamentoj de misuzo induktas similan staton al LTD (longtempa depresio) ĉe glutamatergaj sinapsoj en la NAc.59 Tamen, pli lastatempa laboro montris, ke tia plasticeco dependas de la tempo, kaj LTD okazas frue post la lasta ekspozicio de kokaino evoluanta al pli da LTP (longdaŭra potenciga) ŝtato post pli longaj retiraj punktoj.60,61 Ĉi tiu laboro, kiu ĝis nun efektivigis ĉefe uzante esploriston administritan - kontraste al mem-administritaj - medikamentoj, difinis la bezonon de pli sistemaj esploroj en memadministraj modeloj kiuj spuras la formojn de sinapta plasticeco, kiuj okazas ĉe glutamatergaj sinapsoj en NAc dum detala tempo-kurso de akiro de memadministrado ĝis ĝia prizorgado, tra malsamaj tempoj de retiro kaj formorto, kaj responde al recaŝo-elvokantaj stimuloj. Laboro ĝis nun difinis ankaŭ kelkajn molekulajn meanismojn, kiuj kontribuas al ĉi tiu drogo-induktita sinapta plasticeco, inkluzive la kontrabandadon de AMPA-riceviloj al la sinapsoj eble mediataj parte tra CaMKII (Ca2+/ calmodulin-dependa proteina kinazo II) fosforilado de certaj AMPA-receptoraj subunuoj kaj ankaŭ ŝanĝita esprimo de AMPA-receptoraj subunoj (ekz., 60,62-65, Ciferoj 2 kaj 3). Rolo por CREB kaj ΔFosB estis implikita en ĉi tiuj fenomenoj, same kiel en rilataj ŝanĝoj en la morfologio de glutamatergaj sinapsoj (vidu sube). Ekzemple, GluAl estas celo por CREB en NAc, kie GluA2 kaj CaMKII estas ambaŭ celoj de ΔFosB, en ĉi tiu cerba regiono. .35,36,66,67 Antaŭen, estos grave ligi specifajn adaptiĝojn al tempo-dependaj ŝanĝoj en sinapta funkcio kaj kondutaj ecoj de dependeco.
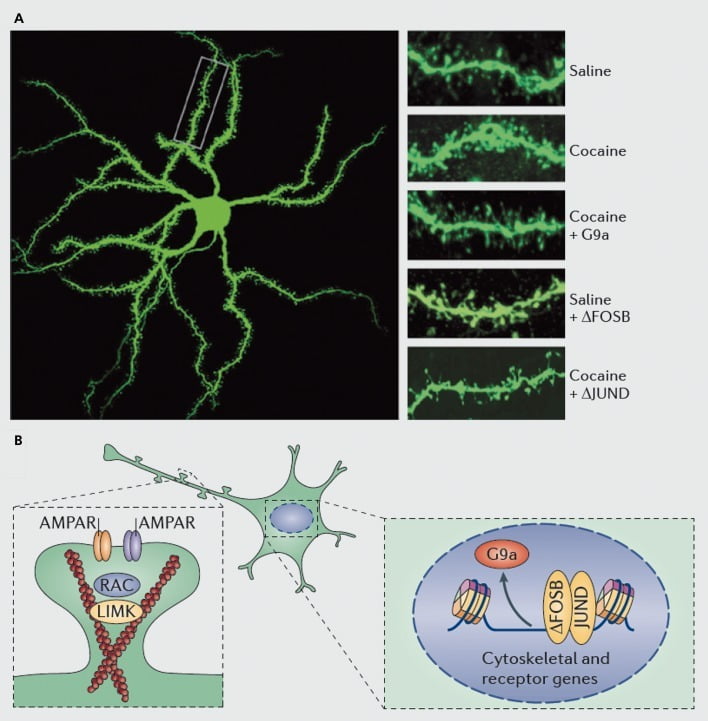
Molekulaj mekanismoj submetantaj kokainan indukton de dendritaj spinoj sur nukleoj accumbens (NAc) mezaj dornaj neŭronoj. A) montras kokain-induktitajn pliiĝojn de dendrita spina nombro, kiu povas esti blokita de vireca troesprimo de G9a aŭ JunD (antagonisto de AP1-mezumita transskribo), aŭ imitita de vireca troesprimo de FosB. B) Regulado de trafiko de AMPA-receptoro (AMPAR) kaj de la aktina ĉelskeleto (maldekstre), same kiel regulado de la transskribo de glutamataj riceviloj kaj aktinaj reguligaj proteinoj (ekz. Kiel perataj per ΔFosB, dekstre) montriĝis gravaj mediaciante la reguladon de kokaino de NAc-dendrita spina denseco. UMK, LIM-domajna kinazo; RAC, Ras-rilata C3-botulina toksinsubstrato.
Novaj eksperimentaj iloj ebligas por la unua fojo difini kun kreskanta precizeco kiun apartaj cirkvitoj montras ĉi tiujn formojn de sinapta plasticeco kaj kiaj kondutaj anomalioj ili mediacias. Ekzemple, tla ŝelaj kaj kernaj subregionoj de NAc montras diferencojn en drogo-induktita sinapta plasticeco, same kiel D1- kontraŭ D2-tipaj mezvundaj neŭronoj ene de ĉiu subrego.60,63,64,67 Same, optogenetaj eksperimentoj provizis novan komprenon pri la kontribuo de aparta formo de sinapta plasticeco (ekz., LTD) ĉe specifaj populacioj de glutamatergaj sinapsoj en NAc, ekzemple, tiuj elstaraj el mediala PFC kontraŭ basolaterala amigdalo kontraŭ ventra subvostaĵo. de hipokampo).68-70 Finfine, estos necese kovri drog-induktitajn molekulajn adaptiĝojn en ĉiu el ĉi tiuj aferaj neŭronoj kun sinapsaj specifaj adaptoj, kiuj okazas en siaj postsinaptaj dendritoj, por kompili kompletan komprenon pri kiel drogoj de misuzo modifas la cirkviton de la cerbo por peli apartajn aspektojn de la toksomaniulo. Ĉi tiu klopodo postulos pli grandan estimon de drog-induktita plastikeco ĉe inhibiciaj sinapsoj ene de ĉi tiuj samaj cerbaj regionoj, areo kiu ricevis tre malmultan atenton ĝis nun.65
Plena plasticeco de ĉeloj
Dum la plimulto de esploroj implikantaj neŭrofiziologiajn ŝanĝojn en neŭronoj en drogaj fenomenoj, kiel en lernaj kaj memoraj fenomenoj, enfokusigis sinapan plasticecon, estas ankaŭ kreskanta pruvo pri la graveco de tuta ĉel-plastiko. Plena plasticeco de ĉeloj, ankaŭ nomata homeostaj plasticeco,71 engaĝas ŝanĝojn en la esenca ekscitebleco de tuta nerva ĉelo tiel ke ĝi ne estas specifa de sinapsoj. Pro tio ke iuj ecoj de drogodependeco implikas plialtigon aŭ redukton de sentiveco al medikamento, ĝi havas sencon, ke plibonigita aŭ reduktita elektra eksciteco de iuj nervaj ĉeloj kontribuas al tiuj kondutaj adaptiĝoj..5
la plej bone establita ekzemplo de tuta ĉelbrileco al medikamento de misuzo estas la kapablo de kronikaj opiaĵoj pliigi la esencan ekscitecon de noradrenergiaj neŭronoj de la lokusko-kerno (LC)).72 Ĉi tiu pliigita eksciteco estas mediaciita per CREB kaj ĝia indukto de certaj izoformoj de adenylyl-ciklaso, kiuj instigas pli grandan pafadon de LC-neŭronoj eble per la indukto de Na + -kanaloj.72-75 Ĉi tiu hiperekskiteco de LC-neŭronoj reprezentas klasikan mekanismon de toleremo kaj dependeco kaj pelas iujn signojn kaj simptomojn de retenado de opiuloj. Kurioze, CREB mezuras similan formon de tuta ĉelbrileco en NAc-meznivelaj neŭronoj, kiuj ankaŭ fariĝas hiperekskeblaj per kronika ekspono al medikamentoj de misuzo per CREB.76 Do estos kritika en estontaj enketoj por kompreni kiel CREB-mediata sinapta sinmalteco de glutamaterikaj sinapsoj sur mezaj neŭronoj de NAc65,66 sumoj kun CREB-mediaciita ena hiperexcitabilidad de ĉi tiuj neŭronoj76 por kontroli kondutajn trajtojn de dependeco.
Alia ekzemplo de tuta ĉelbrileco en dependeco-modeloj estas la hipereksciteco de VTA-dopamino-neŭronoj, kiuj okazas post kronika ekspozicio al opiiciaj drogoj de abusoe (figuro 4).77,78 Ĉi tiu adapto, kiu estis ligita al morfologiaj ŝanĝoj en ĉi tiuj nervaj ĉeloj (vidu sekvan sekcion), ne estas mediaciita de CREB sed atingita anstataŭe per reguligo de neŭrofiliaj signaladoklasoj, kiel priskribite sube.

Laboranta modelo de kronikaj morfino-induktitaj adaptoj en ventra tegmental areo (VTA) dopaminaj neŭronoj. Kronika morfino malpliigas la soma grandeco de VTA-dopamino (DA) sed pliigas neuronal ekscitecon, dum dopamina transdono al la nuklea akcumbeno estas malpliigita. La pura efiko de morfino estas malpli respondema rekompencitino, te rekompenco toleremo. Malreguligo de IRS2-AKT-signalado en VTA mezuras la efikojn de kronika morfino sur soma grandeco kaj elektra ekscitebleco; la efiko al ekscitiĝemo estas perita per malpliigita γ-aminobutira acido (GABA) A-fluoj kaj subpremado de K-kanala esprimo. Malregulado de morfino-induktita de mTORC2-agado en VTA estas decida por ĉi tiuj morfologiaj kaj fiziologiaj adaptiĝoj al morfino same kiel por rekompenc toleremo. Kontraste al mT0RC2, kronika morfino pliigas la aktivecon de mTORCI, kiu ne influas tiujn morfajn induktajn adaptojn. BDNF, cerba-derivita neŭrotrofa faktoro; IRS, insulinecaj substancoj; mTORC, mTOR-komplekso; AKT, proteina kinazo B Reproduktita de ref 77
Morfologia plasticeco kaj neurotróficos mekanismoj
Pliigantaj indikaĵoj, plejparte el studoj de hipokampaj kaj cerba kortikaj neŭronoj, montris, ke ŝanĝoj en sinapta plasticeco estas asociitaj kun morfologiaj ŝanĝoj ĉe sinapsoj. Ekzemple, LTD kaj la generado de silentaj sinapses asocias kun la formado de maldikaj aŭ stumpaj dendritaj dornoj, dum LTP estas asociita kun pli grandaj, fungi-formaj dornoj.79,80 Estas tiel interese, ke la drogokampo fokusiĝis al drog-induktitaj ŝanĝoj en dendritaj spinoj dum> 15 jaroj. Kronika ekspozicio al stimulaj medikamentoj de misuzo pliigas la dendritan dornan densecon de mezaj dornaj neŭronoj de la NAc, ŝanĝo kiu superregas por Dl-tipaj neŭronoj.67,81,82 Indukto de dornoj estis plejparte asociita kun sentivigitaj kondutaj respondoj al ĉi tiuj medikamentoj, kvankam iuj evidentecoj konfliktas kun ĉi tiu vidpunkto.
Kiel ĉe studoj de sinapta plasticeco, tamen multe pli da laboro estas necesa por sisteme difini la ŝanĝojn en dendritaj dornoj kiuj okazas dum kurso de drog-mem-administrado, retiro kaj recidivo. Studies ĝis nun, implikante esploriston- kaj mem-administritan medikamenton, sugestas ŝanĝojn tre malsamajn spinojn en malsamaj tempokigoj kaj en NAcŝelo kontraŭ kernregionoj.83-86 Ankaŭ estos grave difini la precizajn molekulajn meanismojn per kiuj kokaino aŭ alia stimulilo produktas ĉi tiujn temp-dependajn kaj ĉelajn specifajn efikojn. ΔFosB pruvis esti ambaŭ necesa kaj sufiĉa por la indukto de nematuraj dornoj pri Dl-tipaj NAc-neŭronoj.35,51,67 Tia regulado okazas kune kun reguligo de kokaino kaj BFosB de pluraj proteinoj konataj por kontroli la reorganizon de la actina citoesqueleto. Kiel nur unu ekzemplo, transkripta regulado de pluraj faktoroj de interŝanĝo de nukleotaj guaninoj kaj GTPase-aktivaj proteinoj puŝas Rac1, malgrandan GTPazon, por pasemaj malpliiĝoj en agado responde al ĉiu kokainka ekspozicio, kaj tiaj pulsatilaj malpliiĝoj en Rac1-agado estas uzataj. de Rac1, por mediacii indukton de nematuraj dornoj.87 Tiuj efikoj de Racl supozeble okazas per ĝia kontrolo de cofilin kaj aliaj actin reguligaj proteinoj, kiuj ankaŭ montris perantojn de kokainregulado de spina kresko.87,88 Tamen gravas emfazi, ke ĉi tio estas nur unu vojo implikita en la regulado de kokaino de nematuraj pikiloj, ĉar pluraj aliaj proteinoj ankaŭ havas esencan rolon, inkluzive CDK5 (ciklin-dependa kinazo-5), CaMKII, NFkB , MEF2, CREB, G9a kaj DNMT3 (DNA-metiltransf forigas 3a), por mencii kelkajn.20,21,35,51,67,89,90 Interese, kokainregulado de kelkaj el tiuj genoj, inkluzive de indukto de CDK5, CaMKII, kaj NFkB, kaj subpremo de G9a, ankaŭ estas mediaciita per ΔFosB.20,35,51,91
Surprize, opiaciaj medikamentoj de misuzo praktikas la kontraŭan efekton kaj reduktas dendritan dornan densecon de NAc mezaj spongaj neŭronoj.81 Ne multe scias pri la kondutaj konsekvencoj de ĉi tiu adapto kaj la subaj molekulaj mekanismoj implikitaj. Ĉi tiu fenomeno estas, tamen, surprize, ĉar CREB kaj ΔFosB estas induktitaj per kaj stimuliloj kaj opiaĵoj kaj ambaŭ estas implikitaj en stimulanta-mediaciita indukto de NAc dendrita kurbaj denseco.. Ĉi tio levas la demandon pri kiel opciuloj subpremas NAc spino-densecon malgraŭ ilia indukto de ĉi tiuj faktoroj.
La alia grava formo de morfologia plasticeco vidata en droguzaj modeloj estas la fizika redukto de ĉela soma grandeco de VTA-dopamino-neŭronoj induktita de kronika opieca administrado.77,92,93 Simila adapto okazas responde al cannabinoidoj.94 Ĉi tiu kuntiriĝo de VTA-dopamino-neŭronoj, kiu okazas kun opi-mem-administrado93 kaj estis dokumentita en homaj heroinomanĝantoj ekzamenitaj postmortem,77 ŝajnas mediacii rekompencon tolereman kaj estas asociita kun reduktita dopamin-liberigo en la NAc. Konsiderindaj pruvoj nun indikas, ke ĉi tiu redukto en ĉela grandeco estas mediaciita de opiaĵa subpremo de esprimo de neŭrofra faktoro (BDNF) derivita de cerbo ene de ĉi tiuj neŭronoj. Ni rekte interligis ĉi tiun opiigatan retiriĝon de BDNF-subteno, kaj VTA-neŭrona malpliiĝo, al reduktita agado de laŭflue BDNF-signalaj kaskadoj en VTA-dopamino-neŭronoj, specife reduktitan agadon de IRS2 (insulina receptor substrato-2), AKT kinazo), kaj TORC2 (celo de rapamikin-2, kiu estas sensenta al rapamikino).77,93 Ni ankaŭ ligis ĉi tiun malreguladon de BDNF-signalado rekte al la pliigita ekscitebleco, kiun morfino induktas en tiuj neŭronoj, kiel antaŭe notite.77,78 Efektive, la malpliigita ĉela soma grandeco kaj pliigita ekscitebleco estas streĉe kunigitaj, ĉar indukto de unu kondukas al la alia kaj inverse. Ĉi tiu kontrolo de ĉelreguleco konsistas el subpremo de K+ kanaloj kaj de GABAA fluo en ĉi tiuj neŭronoj.
Ĉi tiu rolo por BDNF en kontrolo de morfaj respondoj je la nivelo de la VTA kontrastas kun ĝia tre malsama implikiĝo en la agoj de kokaino kaj aliaj stimuliloj. Stimuliloj induktas BDNF-signaladon al la NAc, efiko pro pliigita loka sintezo de BDNF same kiel pliigita liberigo de pluraj aferentaj regionoj.95 Plie, pliigita BDNF-signalado en NAc, sed ne en la VTA, estis montrita antaŭenigi la kondutajn efikojn de ĉi tiuj medikamentoj inkluzive de ilia mem-administrado.95,96 La kontraŭa regulado de BDNF-signalado en la VTA-NAc-vojo de opiaĵoj kontraŭ stimuliloj levas la eblon, ke tiaj diferencoj peras la kontraŭan reguladon de la drogoj de NAc-dendritaj spinoj, eblo nun esplorata.
Estontaj direktoj
La supra rakonto substrekas la grandegajn antaŭenigojn faritajn por kompreni la molekulajn kaj ĉelajn adaptiĝojn kiuj okazas en cerbaj rekompencoj regionoj kiel respondo al ripetata ekspozicio al medikamento de misuzo, kaj en rilatado de individuaj adaptoj al certaj kondutaj trajtoj de dependaj sindromoj en bestaj modeloj. . Malgraŭ ĉi tiuj antaŭenigoj, gravaj demandoj restas. Plejparto de nia ekzistanta scio temigas la VTA kaj NAc, kun multe malpli da informoj disponeblaj pri aliaj ĉefaj limbaj cerbaj regionoj, kiuj ankaŭ estas gravaj por drogomanio. Krome, ĉiuj eksperimentaj pruvoj de la kaŭza rolo de molekula-ĉela adapto en drogrilata konduto manipulis unuopajn adaptiĝojn unuope. Manipuli multajn adaptaĵojn samtempe estas klare multe pli malfacila, sed ĝi estas ankaŭ esenca, ĉar ni scias, ke drogoj produktas grandan nombron da diferencaj specoj de ŝanĝoj eĉ en individuaj neŭronoj, kiuj verŝajne komplikas manierojn influi konduton. Tia alirpunkto pri sistemaj biologio estos decida por finfine fendi la biologiajn fundamentojn de dependeco. Fine, penoj por kompreni la molekula-ĉelajn me ofanismojn de memoroj ligitaj al toksomanio troviĝas ĉe la punkto kiam ĉiuj aliaj klopodoj por kompreni la biologian bazon de konduta memoro nun luktas: nia kapablo rilatigi biologiajn fenomenojn al kompleksa konduta memoro restas ekstreme malfacila. Superi ĉi tiun dividadon eble estas la plej granda defio en la neŭciencoj.
Elektitaj mallongigoj kaj akronimoj
- Ne
- kerno accumbens
- CREB
- Eligo de proteinoj de elemento de cAMP
- ΔFosB
- faktoro de transskribo de Fos-familio
- VTA
- areo ventral tegmental
- AMPA
- Acido α-amino-3-hidroxi-5-metil-4-isoxazolepropiónico
- LTD
- longdaŭra depresio
- LTP
- longdaŭra protentigo
- BDNF
- faktoro neurotrófico derivita de cerbo
- NKkB
- nuklea faktoro kB
Referencoj