Rimarkoj: Bonega revizio pri preskaŭ ĉiuj koncernaj esploroj pri androgaj riceviloj, dopamino kaj seksa funkcio. Fantazia desegnado de la hipotalamo-rekompenco-interrilatoj.
Hormohako. 2008 majo; 53(5): 647-658.
Eldonita enreta 2008 Februaro 13. doi: 10.1016 / j.yhbeh.2008.01.010
abstrakta
Adoleskeco estas asociita kun pliigoj en serĉantaj kondutoj, kiuj siavice estas formitaj de la pubera aktivado de la hipotalamo-pituitaria-gonadal akso. En bestaj modeloj de nature rekompencaj kondutoj, kiel sekso, testikulaj androgoj kontribuas al disvolviĝo kaj esprimo de la konduto en viroj. Por efektivigi kondutan maturiĝon, la cerbo spertas signifan remodeladon dum adoleskeco, kaj multaj el la ŝanĝoj estas same sentemaj al androgenoj, supozeble agantaj per androgaj riceviloj (AR). Konsiderante la delikatan interagadon de gonadaj hormonoj kaj cerba disvolviĝo, ne estas surprizo, ke interrompo de hormonaj niveloj dum ĉi tiu sentema periodo signife ŝanĝas adoleskajn kaj plenkreskajn kondutojn. En viraj hamstroj, ekspozicio al testosterona dum adoleskeco estas bezonata por normala esprimo de plenkreska seksa konduto. Maskloj senigitaj de androgenoj dum pubereco montras daŭran deficiton en pariĝo. Male, androgenoj sole ne sufiĉas por indukti pariĝon ĉe prepubertaj viroj, kvankam cerba AR ĉeestas antaŭ pubereco. En ĉi tiu kunteksto, larĝe disvastigita uzo de anabolikaj androgenaj steroidoj (AAS) dum adoleskeco estas grava maltrankvilo. AAS-misuzo havas la potencialon ŝanĝi kaj la tempigon kaj la nivelojn de androgenoj en adoleskaj viroj. En hamsters, adoleska AAS-ekspozicio pliigas agreson, kaj kaŭzas daŭrajn ŝanĝojn en neurotransmisiaj sistemoj. Krome, AAS sin plifortigas, kiel pruvas mem-administrado de testosterona kaj aliaj AAS. Tamen, lastatempaj evidentecoj sugestas, ke la plifortigaj efikoj de androgenoj eble ne postulas klasikan AR. Tial necesas plia ekzamenado de interagoj inter androgenoj kaj rekompencaj kondutoj en adoleska cerbo por pli bona kompreno de AAS-misuzo.
Superrigardo
Adoleskeco vekas la cerbon al plezuro kaj risko. En homaj adoleskantoj, ĉi tio ofte formas la eksperimentadon kun drogoj kaj sekso. En Usono, la meza aĝo por unua sekskuniĝo ĉe viroj estis 16.4-jaroj, kaj 65% havis intergeedziĝon de 12-a grado (Kaiser Family Foundation, 2005). Same, ĉi tiu populacio havas la plej altajn indicojn de kontraŭleĝa drog-uzo en Usono. Laŭ la Nacia Enketo de 2004 pri Drogaj Uzoj kaj Sano, 38% de viroj en aĝo de 18-25 uzis nelican drogon en la pasinta jaro (SAMHSA / OAS, 2005). Plie, 31% de adoleskaj knaboj uzis drogojn aŭ alkoholon dum sia lasta seksa renkonto (Kaiser Family Foundation, 2005). Krome, adoleskeco estas pivota tempo en la etiologio de certaj psikopatologioj, kiel depresio, angoro, malordigita manĝado kaj konduta malordo. Ni opinias, ke la pubera sekrecio de gonadaj hormonoj, ilia aktivigo de steroidaj riceviloj en la cerbo kaj la interagado inter hormono kaj sperto pri adoleska cerba disvolviĝo kontribuas al la kondutaj ŝanĝoj viditaj dum adoleskeco.
Nia celo ĉi tie estas revizii la evidentaĵojn, ke gonadaj androgoj mediacias la adoleskan maturiĝon kaj plenkreskan agadon de instigitaj kondutoj, same kiel la rekompencajn propraĵojn de ĉi tiuj kondutoj. Ni ankaŭ montras evidentaĵojn, ke testosterona mem rekompencas, kio probable kontribuas al maturiĝaj ŝanĝoj en motivitaj kondutoj dum adoleskeco, kiam testosterona niveloj pliiĝas. Ĉi tiu fokuso estas sur niaj studoj pri neŭralaj cirkvitoj sub la vira seksa konduto, precipe en la siria hamstro, kun speciala emfazo de la interagado inter testosterona kaj dopamina (DA). Ni proponas, ke pubertaj androgoj havas ambaŭ trairajn kaj longtempajn efikojn sur rekompencaj cirkvitoj kaj motivita konduto. Ni plue hipotezas, ke suplemento kun ekzogenaj androgenoj en la formo de anabólicos-androgaj steroidoj (AAS) aŭdigas la normalajn influojn de pubertaj androgenoj, kaj influas negative en adoleska disvolviĝo de cerbo kaj konduto.
Adoleskeco kiel sentema periodo por cerba disvolviĝo
Finfine, la cerbo estas kaj ellasilo kaj celo por androgena agado dum adoleskeco. Ĉe junaj knaboj (<12 jaroj) kaj junaj hamstroj (<28 tagoj), cirkulantaj androgenoj kaj gonadotropinoj estas sur bazaj niveloj. Ĉar sekrecio de luteiniga hormono de la antaŭa hipofizo pliiĝas kiel respondo al hipotalama gonadotropina liberiga hormono, cirkulantaj testosterona koncentriĝo signife pliiĝas. Ĉi tio okazas per Tanner stadio II / III (14 jaroj) ĉe knaboj, kaj antaŭ 28 tagoj en hamstroj. Kiam knaboj atingas Tanner-stadion IV / V (ĉirkaŭ 16 jaroj) aŭ kiam hamstroj aĝas 50-60 tagojn, endogena testosterono estas ene de la plenkreska maskla teritorio. Publika hormona sekrecio koincidas kun la periodo de adoleskeco, kiu okazas de ĉirkaŭ 12 ĝis 20 jaroj en homoj. Pubertaj hormonoj agas ne nur sur ekstercentraj ŝtofoj por kaŭzi la aperon de duarangaj seksaj trajtoj, kiuj estas la malkaŝaj signoj de pubereco, sed ili ankaŭ agas centre por influi kaj la remodeladon de la adoleska cerbo kaj kondutan maturiĝon. Krome, la fiziologiaj kaj neŭrologiaj ŝanĝoj kaŭzitaj de pubertaj hormonoj kaŭzas signifajn ŝanĝojn en la sperto de individuo, kiu mem povas profunde ŝanĝi la kurson de cerba disvolviĝo. Tiel, la pubera kresko de seksaj steroidaj hormonoj, pelata de evolua tempa maturiĝo de la reprodukta neŭroendokrina akso, siavice formas adoleskan kondutevoluon per kaj rektaj kaj nerektaj influoj sur la nerva sistemo.
Homa adoleskeco nun estas agnoskita kiel grava kaj dinamika periodo de neŭra evoluo dum kiuj kondutaj cirkvitoj estas remodeligitaj kaj rafinitaj. Kvankam la cerbo de 5-jara infano jam estas 90% de ĝia plenkreskula grandeco (Dekaban, 1978), signifa remodelado ankoraŭ venas. Ĉi tiu koncepto eklumis per esplorado en homoj kaj bestoj dokumentantaj, ke multaj el la bazaj disvolvaj procezoj okazantaj dum perinatala cerba disvolviĝo estas rekapitulataj dum adoleskeco. Ĉi tiuj procezoj inkluzivas neurogenesis (Eckenhoff kaj Rakic, 1988; Li kaj Skipoj, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia, kaj Guillamon, 2001; Rankin, Partlow, McCurdy, Giles, kaj Fisher, 2003), programita ĉela morto (Nunez, Lauschke, kaj Juraska, 2001; Nunez, Sodhi, kaj Juraska, 2002), ellaborado kaj pritondado de dendritaj arborizoj kaj sinapsoj (Andersen, Rutstein, Benzo, Hostetter, kaj Teicher, 1997; Huttenlocher kaj Dabholkar, 1997; Lenroot kaj Giedd, 2006; Sowell, Thompson, Leonard, Bonvenon, Kan, kaj Toga, 2004), mielination (Benoj, Testudo, hanano, kaj Farol, 1994; Paus, Collins, Evans, Leonard, Pike, kaj Zijdenbos, 2001; Sowell, Thompson, Tessner, kaj Toga, 2001), kaj seksa diferenco (Chung, De Vries, kaj Swaab, 2002; Davis, Shryne, kaj Gorski, 1996; Nunez et al., 2001). Tiel la evolua trajektorio de la postnaska cerbo ne estas lineara, sed anstataŭe karakterizas per adoleska eksplodo de rapida ŝanĝo kaj implikas kaj progresajn kaj regresajn eventojn. Kiel iu disvolva biologo scias, periodoj de rapida disvolviĝo-signalo pliigis sentivecon kaj vundeblecon al ambaŭ spertoj-dependaj ŝanĝoj kaj al adversaj konsekvencoj de tumulto kaj insulto, kaj estas neniu kialo pensi, ke homa cerba disvolviĝo estas ia ajn escepto (Andersen, 2003; Spear, 2000). Tiel oni prognozus perturbojn en la tempoparto de pubertaj hormonaj influoj sur la adoleska cerbo, kiuj havas daŭrajn konsekvencojn por plenkreska konduto.
Androgenoj kaj Neŭralaj Cirkvitoj por Motivita Konduto
Ĉar adoleskeco estas traira kaj dinamika fazo de disvolviĝo, estus malfacile taksi izolite la cerbon kaj konduton de adoleskantoj. Anstataŭe, por estimi la unikan karakteron de adoleskeco, helpas ĝin kontrasti kun la cerbo kaj konduto de maturaj plenkreskuloj. Tiel, kun la fokuso de ĉi tiu artikolo pri vira seksa konduto kaj rekompenco, estas grave ĉi tie enkonduki la neŭrajn cirkvitojn por kopulacio kaj seksa instigo ĉe plenkreskaj viroj, inkluzive de la rolo de gonadaj steroidaj hormonoj en konduta aktivado kaj distribuado de receptoroj por androgenoj. (AR) kaj estrogenoj (ER).
AR ĉeestas en ĉelaj grupoj, kiuj formas la neŭrajn cirkvitojn mediante rekompencajn sociajn kondutojn, kiel ekzemple sekso. Plue, cerba AR estas esprimita antaŭ pubereco en hamsteroj kaj regata de androgenoj en junaj kaj plenkreskaj viroj (Kashon, Hayes, Shek, kaj Sisk, 1995; Meek, Romeo, Novak, kaj Sisk, 1997). En ronĝula cerbo, estas grava interkovro en la distribuado de AR kaj ER (Wood kaj Newman, 1995), kaj aromatase (Celotti, Negri-Cesi, kaj Poletti, 1997), inkluzive ambaŭ α kaj β-formojn de la estrogena ricevilo (Shughrue, Lane, kaj Merchenthaler, 1997). Kun ligado al ligando, "klasika" AR kaj ER funkcias kiel transskribaj faktoroj por indukti transskribon kaj sintezon de novaj proteinoj. Ne mirinde, ke ĉi tiuj efikoj sekvas relative malrapidan tempokurson, kun malfrua ekapero de agado. Esteroida stimulo de seksa konduto de vira hamstro (Nobla kaj Alsum, 1975) kongruas kun agoj per klasikaj genomicaj agoj. Ekzemple, 2-semajnoj da steroido-ekspozicio bezonas por restarigi pariĝon en longtempaj kastroj. Pli freŝaj studoj ĉe ratoj ankaŭ pruvis rapidajn ĉelajn efikojn de androgenoj en cerbaj regionoj, kiuj posedas malmultajn klasikajn receptorojnMermelstein, Becker, kaj Surmeier, 1996). Ĉi tiuj steroidaj agoj estas pensitaj esti mediaciitaj de ne-genomaj riceviloj. Dum la distribuado de klasikaj AR kaj ER en la hamstro cerbo estas relative restriktita (Wood kaj Swann, 1999), la eblaj cerbaj celoj por ne-genomaj androgaj agoj estas multe pli ampleksaj.
La mediprotekta areo (MPOA) ludas centran rolon en kopulado en viroj de orfiŝoj al homoj (reviziita en Hull, Wood, kaj McKenna, 2006). Plie, la hamster MPOA transduas gonadalajn steroidajn hormonojn per abundaj AR kaj ER, kaj testosterona enplantaĵoj en MPOA sufiĉas por restarigi seksan agadon en longtempaj kastroj (Wood kaj Swann, 1999). Ĉe viraj ratoj, gonadalaj steroidoj agas en la MPOA por reguligi bazan DA-liberigon (Putnam, Sato, kaj Hull, 2003) kaj stimuli pariĝon (Hull, Du, Lorrain, kaj Matuszewich, 1995). Komence, ekzistas modesta kresko de DA kiam ino estas prezentita malantaŭ ekrano. Dum kopulado, MPOA DA pliiĝas plu (+ 50% de bazlinio), kaj ĉi tiu efiko postulas androgenojn (Hull et al., 1995; Putnam et al., 2003). Ne mirinde, ke kastritaj viroj ne kongruas, MPOA DA ne pliiĝas (Hull et al., 1995). Estas iom malfacile interpreti ĉi tiun rezulton, ĉar la manko de liberigo de DA estas konfuzita de la foresto de seksa agado. Tamen, liberigo de DA en MPOA korelacias kun la perdo de pariĝo en mallongtempaj kastroj (Hull et al., 1995), kaj kun testosterona-induktita restarigo de seksa agado en longtempaj kastroj (Du, Lorrain, kaj Hull, 1998; Putnam, Du, Sato, kaj Hull, 2001).
Ene de la ronĝulo MPOA, la androgenaj kaj estrogenaj metabolitoj de testosterona ludas specifajn rolojn en la regulado de pariĝo (Putnam et al., 2003; Putnam, Sato, Riolo, kaj Hull, 2005). La latento por komenci kopulacion (monto aŭ intromito) estas unu mezuro de seksa instigo. La daŭro al seksa agado estas sentema al estrogenoj, per konservado de nitrofona rusto sintasa MPOA, kiu siavice subtenas bazajn DA-nivelojn. Estrogen-traktitaj kastroj montras altajn bazajn DA-nivelojn, kiuj forte korelacias kun la kapablo komenci kopulacion. Tamen, ili ne montras kreskajn virinajn kaj kopulaciojn induktitajn en DA-liberigo, kiuj forte korelacias kun seksa agado. Konsekvence, ilia seksa agado estas sub nedifektitaj niveloj. Aliflanke, kastroj traktitaj kun ne-aromatizaj androgenoj ne montras altajn bazajn DA-nivelojn, kaj ili malsukcesas kopii. Por normala seksa agado tial necesas ambaŭ estrogenoj kaj androgenoj. Seksa agado estas kutime esprimata kiel frekvencaj mezuroj de montoj, entombigoj kaj ejakuladoj. Nur kiam ambaŭ estrógenos kaj andrógenos estas anstataŭigitaj, la kastritaj maskloj montras levitajn DA-nivelojn (kaj pli mallongajn latentajn mezurojn) kaj DA-kaj-kopulaci-induktitajn DA kreskojn (kaj pliigis oftecajn mezurojn). Tiel, estrogenoj en MPOA kontribuas al seksa instigo, kaj ambaŭ estrogenoj kaj androgenoj al seksa agado.
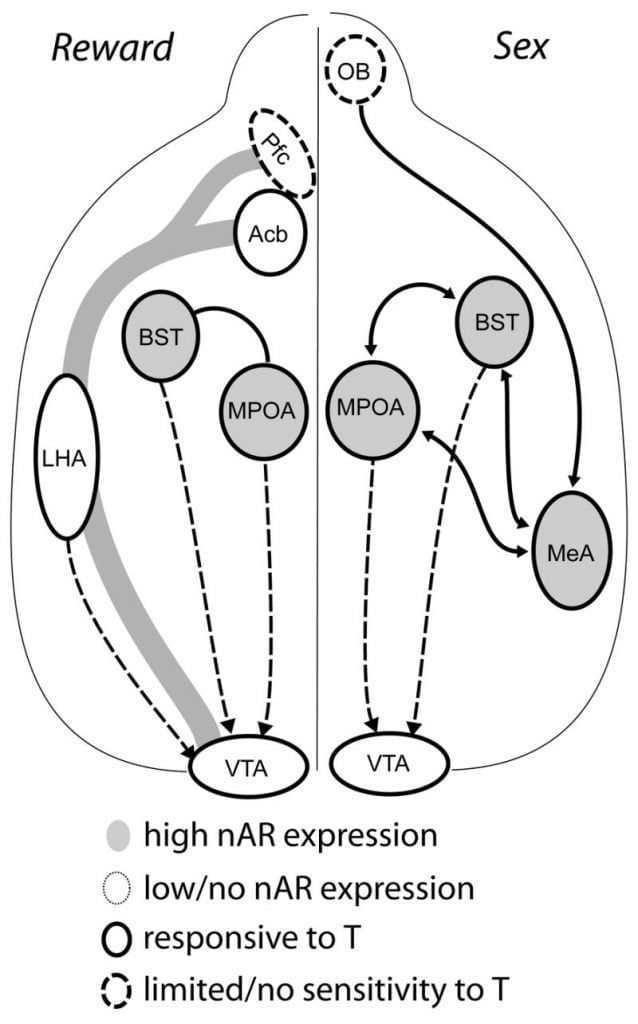
Kvankam testosterona estas necesa por liberigo de MPOA DA dum vira kopulacia konduto kaj por pariĝo mem, nek testosterona nek matigado sola povas eligi DA en MPOA. Anstataŭe, kemosensoraj aludoj de konsistemaj inoj ankaŭ estas bezonataj por liberigo de DA en MPOA. En ronĝuloj, kemosensoriaj stimuloj estas la ĉefa sentema eblo por iniciati viran seksan konduton (Figo. 1). Kemosensoriaj spuroj estas transdonitaj de la olfaktaj bulboj al MPOA per la meza amigdaloida kerno kaj la lito-kerno de la stria terminalis, strukturoj kun abundaj AR kaj ER (Wood kaj Swann, 1999). Por determini la rolon de kemiosensoraj kvadratoj en pariĝanta induktita DA, ni mezuris MPOA DA dum pariĝo en gonad-sendifektaj viraj hamstroj kun unuflanka bulbectomio (UBx, Triemstra, Nagatani, kaj Wood, 2005). Kvankam bilatera forigo de la olfaktaj bulboj forigas seksan agadon kaj MPOA DA-liberigon, unuflanka bulbektomio ne intermetas pariĝon. En ĉi tiu studo, kopulacio induktis MPOA DA-liberigon kiam mezurita kontralatera al la lezita olfakula bulbo, sed ne en la ipsilateral hemisfero (Figo. 2). Similaj rezultoj estis observitaj ĉe viraj ratoj kun lezoj de la meza amigdala (Dominguez, Riolo, Xu, kaj Hull, 2001). En rilata studo, kemia stimulo de la meza amigdala ĉe ratoj induktis MPOA DA-ekvivalenton al tiu dum kopulacio (Dominguez kaj Hull, 2001). Kunigitaj, ĉi tiuj datumoj sugestas, ke testosterona kreas permesan medion, kiu permesas eksterajn sensajn stimulojn atingi MPOA kaj indukti DA-liberigon dum kopulacio.

Figo. 2
Finfine, seksa konduto kaj aliaj naturaj rekompencoj aktivigas neŭrajn rekompencajn vojojn. La mezocorticolimbic DA-cirkvito konsistas el la ventra tegmentala areo (VTA), kerno accumbens (Acb), kaj antaŭfrontal-kortekso (Pfc). Dopamaj ĉelkorpoj loĝantaj en la VTA-projekto vizaĝe al la Acb kaj Pfc (Koob kaj Nestler, 1997). En ratoj, DA estas liberigita en Acb dum sekso (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips, kaj Fibiger, 1990). Multaj drogoj de misuzo ankaŭ agas en la mezolimbic DA-sistemo por pliigi DA-liberigon (amfetaminoj) aŭ malhelpi DA-reakiron (kokaino, Di Chiara kaj Imperato, 1988), tiel plifortigante iliajn toksajn propraĵojn. Tiamaniere, testosterona havas la eblon influi la liberigon de DA en Acb tiel per sia plibonigo de seksa konduto kaj per siaj agoj kiel drogo de misuzo (vidu sube).
Nuna evidenteco sugestas, ke la mezokorticolimbia DA-sistemo maturiĝas dum adoleskeco. Acb DA-densecoj de fibro DA kreskas draste dum adoleskeco en gerbiloj, sugestante, ke signifa maturiĝo de VTA dopaminergiaj projekcioj al la Acb okazas dum la adoleska periodo (Lesting, Neddens, kaj Teuchert-Noodt, 2005). Plue, dopaminergika enigo al GABA (γ-aminobutira acido) -ergikaj ĉeloj en la rat-media prefrontal-kortekso estas riĉigita kaj modulita per serotonergiaj sistemoj dum pubertala evoluo (Benes, Taylor, kaj Cunningham, 2000), kaj manipulado de androgenoj ĉe plenkreskaj ratoj kondukas al ŝanĝoj en dopaminergiaj aksonaj densecoj ene de antaŭfrontalaj kortekso (Kritzer, 2003). La Pfc, Acb kaj VTA havas malmultajn AR aŭ ER, kvankam ERβ ĉeestas en la VTA (Shughrue et al., 1997). Tial, ŝajnas probable, ke androgenoj influas la mezocorticolimbic DA-sistemon per androgen-sentemaj aferentoj aŭ per ERβ en la VTA kiel ĉe hipotalamo (Handa et al., Ĉi tiu afero). Niaj datumoj montras, ke androgen-sentemaj ĉeloj en viraj hamstroj projektas al la VTA el strukturoj asociitaj kun steroid-sentemaj kondutoj. Ekzemple, ambaŭ la MPOA kaj la lito-kerno de stria terminalis (BST) enhavas grandan nombron da AR-pozitivaj ĉeloj projekciantaj al la VTA (Sato kaj Ligno, 2006). La ventra pallidumo, la ĉefa Acb-efekto-celo (Zahm kaj Heimer, 1990), ankaŭ enhavas multajn AR-pozitivajn ĉelojn projektantajn al la VTA. Ĉi tiuj projekcioj donas eblon al androgenoj modifi la agadon de la mezokorticolimbia DA-sistemo.
Steroid-dependa organizo de konduto dum adoleskeco
La tradicia vidpunkto de hormona agado sur adoleska konduto baziĝas sur aktivaj efikoj de steroidaj hormonoj, kiuj rilatas al la kapablo de steroidoj faciligi konduton en specifaj sociaj kuntekstoj per ago ene de celaj ĉeloj en la neŭralaj cirkvitoj subhavaj kondutoj. Aktivecaj efikoj estas transiraj en la senco, ke ili venas kaj iras kun la ĉeesto kaj foresto de hormono, kaj ili estas tipe asociitaj kun la esprimo de plenkreska konduto. Kontraŭe, organizaj efikoj rilatas al la kapablo de steroidoj skulpti nervan sistemostrukturon dum disvolviĝo. Struktura organizo estas konstanta, persistas preter la periodo de ekspozicio al hormono, kaj determinas neŭralajn kaj kondutajn respondojn al steroidoj en plenaĝeco. Nia kompreno pri la evolua rilato inter organizaj kaj aktivaj efikoj de steroidaj hormonoj evoluis dum la pasintaj 50-jaroj. Fenikso kaj kolegoj unue proponis, ke plenkreskaj (aktivaj) respondoj al steroidaj hormonoj estas programitaj (organizitaj) de steroidaj hormonoj dum maksimume sentema periodo de perinata evoluo (Fenikso, Goy, Gerall, kaj Juna, 1959). Poste, Scott kaj kolegoj metis la teorian bazon por la ekzisto de multoblaj sentemaj periodoj por la progresiva organizado de la nerva sistemo, kaj rimarkis, ke sentemaj periodoj plej ofte okazas dum periodoj de rapida disvolva ŝanĝo (1974). Poste Arnold kaj Breedlove atentigis, ke steroido-dependa organizado de la cerbo povas okazi ekster sentivaj periodoj de disvolviĝo (Arnold kaj Breedlove, 1985). Dum la pasintaj 15-jaroj, esplorado uzanta diversajn animalajn modelojn kaj kondutajn sistemojn faras klare, ke la adoleska cerbo estas sentema al kaj aktivaj kaj organizaj efikoj de gonadaj steroidoj (reviziitaj en Sisk kaj Zehr, 2005). Kaj, kiel aliaj periodoj de rapida disvolviĝo, adoleskeco reprezentas difinitan fenestron de ŝanco por steroido-dependa cerba remodelado.
Nia laboro uzanta la hamstron kiel bestan modelon donas evidentecon, ke viraj sociaj kondutoj estas modifitaj de steroidoj dum adoleskeco (Schulz, Menard, Smith, Albers, kaj Sisk, 2006; Schulz kaj Sisk, 2006). Antaŭ pubereco, testosterona traktado ne povas aktivigi seksan konduton en hamsters, sugestante, ke maturigaj procezoj, kiuj faras neŭrajn cirkvitojn susceptibles al aktivigo aŭ organizado de steroidaj hormonoj, ankoraŭ ne okazis (Meek et al., 1997; Romeo, Richardson, kaj Sisk, 2002a). Male, dum la malkaŝa esprimo de maskla genera konduto en plenaĝeco ne absolute postulas la ĉeeston de gonadaj steroidoj dum adoleskeco, la maksimuma esprimo de konduto faras. Komparante viran generan konduton en maskloj kastritaj aŭ antaŭpubere (NoT@P) aŭ postpubere (T@P) kaj tiam traktitaj kun testosterono en plenaĝeco, antaŭpuberaj NoT@P kastras havas almenaŭ 50% deficiton en vira konduto kompare kun maskloj kastritaj post adoleskeco. (Figo. 3, Schulz, Richardson, Zehr, Osetek, Menard, kaj Sisk, 2004). Plie, deficitoj en reprodukta konduto estas daŭraj, kaj ne povas esti superitaj nek per daŭrigita testosterona traktado nek per seksa sperto en plenaĝeco (Schulz et al., 2004). Simile, post traktado kun estrogeno kaj progesterono, NoT@P maskloj montras pli mallongajn lordozajn latentecojn kaj pli longajn lordozodaŭrojn ol maskloj kastritaj kiel plenkreskuloj (Schulz et al., 2004), sugestante ke prepubertaj kastroj estas malpli defeminigitaj ol la viroj eksponitaj al puberta testosterona.

Figo. 3
Povas esti, ke NoT@P maskloj suferas pro malpliigita seksa instigo. Unu maniero trakti ĉi tiun demandon estas kompari la latentecojn por okupiĝi kaj pri ano-genitala esploro (AGI) kaj muntado inter maskloj gonadectomigitaj antaŭ (NoT@P) kaj post pubereco (T@P). Se seksa instigo dependas de gonada hormona eksponiĝo dum adoleskeco, ni antaŭdirus pli longajn latentecojn por okupiĝi pri seksa konduto ĉe NoT@P-maskloj. Efektive, kun ripeta eksponiĝo al estro-inoj, NoT@P-maskloj prenas pli longe por komenci AGI kaj pliiĝi kompare kun T@P-maskloj (Figo. 4). Tiel, krom organizi aspektojn de seksa agado, ŝajnas, ke puberaj hormonoj ankaŭ organizas la rekompencajn aspektojn de seksa konduto. En subteno de tiu ebleco, centra administrado de la DA agonista apomorfino en plenaĝeco restarigas kreskantan konduton de NoT@P-maskloj al plenkreskaj tipaj niveloj, sugestante ke testosterono dum adoleskeco normale organizas dopaminergiajn neŭralajn cirkvitojn (Salas-Ramirez, Montalto, kaj Sisk, 2006). ). Tamen restas multaj interesaj demandoj. Ĉu NoT@P masklo premus por estra ino aŭ evoluus kondiĉigitan preferon por pariĝa loko? Estonta esplorado esploros la rolon de puberaj hormonoj en organizado de seksa instigo kaj seksa agado.

Figo. 4
Anogenital-esploro (AGI) latentecoj kaj tempodaŭroj elmontritaj fare de masklaj hamstroj gonadektomigitaj antaŭ pubereco (NoT@P) aŭ post pubereco (T@P). Ĉiuj maskloj estis testosteron-pretigitaj en plenaĝeco 7 semajnojn post gonadektomio kaj unu semajnon antaŭ la unua konduttesto. A. T@P-maskloj montris similajn AGI-latentecojn trans la tri testoj kun estroplena ino, dum NoT@P-maskloj pliigis AGI-latentecojn dum la tria testo kun estroplena ino. B. T@P-maskloj malpliigis montlatentecojn trans la tri konduttestoj kun estro ino, dum noT@P-maskloj montris neniun ŝanĝon en montlatenteco trans la tri konduttestoj. Tiuj datenoj indikas ke puberaj gonadaj hormonoj havas daŭrajn, faciligajn efikojn al plenkreska maskla instigo por okupiĝi pri seksa konduto kun ino. (Neeldonitaj datenoj de bestaj temoj en Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA, kaj Sisk, CL, 2004).
Prepubertaj kondutaj respondoj al steroidoj
Unu el la daŭrantaj enigmoj de adoleska kondutisma disvolviĝo estas kial la aktivigo de reprodukta konduto en respondo al steroida ekspozicio atenas en prepubertaj viraj hamstroj. Se malaltaj niveloj de androgenoj antaŭ pubereco limigas la esprimon de vira seksa konduto en prepubertaj viroj, tiam suplementi andogenajn androgenojn en prepubertaj viroj devas instigi pariĝon. Ĉi tio rezultas ne esti la kazo (Meek et al., 1997; Romeo, Cook-Wiens, Richardson, kaj Sisk, 2001; Romeo, Wagner, Jansen, Diedrich, kaj Sisk, 2002b), malgraŭ la fakto, ke la nombro kaj distribuo de AR kaj ER tra la pariĝa cirkvito estas similaj en hormon-traktitaj prepubertaj kaj plenkreskaj kastroj (Meek et al., 1997; Romeo, Diedrich, kaj Sisk, 1999; Romeo et al., 2002a). Tial ŝajnas ke androgenoj kaj AR estas necesaj sed ne sufiĉas por esprimo de vira seksa konduto.
Ĝis nun miksiĝis penoj por identigi faktorojn, kiuj limigas seksan agadon antaŭ pubereco. Fosaj respondoj al kemosensoraj aludoj de estraj inoj estas similaj en prepubertaj kaj plenkreskaj masklaj hamstroj (Romeo, Parfitt, Richardson, kaj Sisk, 1998). Ĉi tiuj datumoj pruvas, ke sensaj transdukciaj mekanismoj maturiĝas antaŭ pubereco. Tiel, junaj maskloj kapablas detekti kemosensorcelojn de inoj; kie ili diferencas de plenkreskuloj estas en kiel ili respondas al tiuj indikoj. Unu ebla klarigo estas, ke prepubertaj viroj ne estas instigitaj okupiĝi pri seksa konduto. Ni trovis, ke prepubertaj viraj hamstroj ne montras pliigitajn dopaminergiajn respondojn en la MPOA en respondo al inaj feromonoj, dum sekse naivaj plenkreskaj viroj montras fortajn MPOA-dopaminergajn respondojn al la samaj stimuloj (Figo. 5, Schulz, Richardson, Romeo, Morris, Lookingland, kaj Sisk, 2003). Simile, prepubertaj viroj ne montras la plenkreskan tipan kreskon de cirkulanta testosterona post eksponiĝo al inaj feromonoj (Parfitt, Thompson, Richardson, Romeo, kaj Sisk, 1999). Tiel, inaj feromonoj ŝajnas esti senkondiĉa stimulo por neŭkemiaj kaj neŭroendokrinaj respondoj en plenkreskaj, sed ne prepubertaj maskloj, sugestante, ke la saleco de ĉi tiuj socie signifaj sensaj stimuloj ŝanĝiĝas super pubertara evoluo, eble rilata al akiro de rekompencaj propraĵoj kaj seksa instigo. Krome, kvankam testosterona faciligas AGI de ino en prepubertaj viroj, ĉi tiu efiko dependas de ĉu aŭ ne la masklo havis antaŭan eksponon al estra ino. Eble surprize, testosterona kuracado malpliigas la latentecon kaj pliigas la daŭron de AGI nur ĉe sekse naive prepubertaj viroj (Figo. 6). Plue, prepubertaj viroj kiuj havis unu antaŭan sperton kun ino montras multe pli longajn AGI-latencojn kaj pli mallongajn AGI-daŭrojn ol maskloj interagantaj kun akceptemaj inoj por la unua fojo (Figo. 6). Ĉi tiuj datumoj sugestas, ke interagoj kun estra ino estas pli avaraj ol rekompencaj antaŭ pubereco, tiel forigante ajnajn faciligajn efikojn de testosterona sur AGI dum postaj interagoj kun ino. Estus interese scii, ĉu la negativaj kondutaj konsekvencoj de frua ekspozicio al estra ino persistas en adoleskeco kaj plenkreskeco, precipe konsiderante ke ripetita ekspozicio al estraj inoj dum adoleskeco ĝenerale faciligas la esprimon de vira reprodukta konduto (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto, kaj Sisk, 2007).

Figo. 5
Prepubertaj kaj plenkreskaj masklaj mezaj preoptiikaj areoj (MPOA) dopaminergiaj respondoj al inaj feromonoj enhavitaj en vagaj sekrecioj. Plenkreskaj maskloj montras pliiĝojn de MPOA dopaminergic-agado kun eksponiĝo al inaj vaginaj sekrecioj, dum prepubertaj viroj ne montras pliigitajn MPOA-dopaminergajn respondojn al inaj feromonoj. (Elŝutita de Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ, kaj Sisk, CL, 2003).

Kvankam prepubertaj androgaj kuracadoj ne povas indukti kopuladon, lastatempaj laboroj de nia laboratorio sugestas, ke la hamster nerva sistemo estas sentema al la organizaj agoj de testosterona sur reprodukta konduto antaŭ la adoleskeco (Schulz, Zehr, Salas-Ramirez, kaj Sisk, 2007). Kastrado plus 19 tagoj da testosterona ekspozicio antaŭ aŭ dum sed ne post la adoleskeco faciligis montradan konduton kiam testosterona estis anstataŭigita en plenaĝeco. Maskloj eksponitaj al testosterona prepubertite ankaŭ montris pli da entrudiĝoj en plenaĝeco ol viroj elmontritaj al testosterona dum aŭ post pubereco (Schulz et al., 2007). Ĉi tiuj datumoj sugestas, ke la kapablo de testosterona organizi kondutajn neŭrajn cirkvitojn malpliiĝas kun la aĝo, kaj ke la adoleskeco markas la finon de plilongigita postnaska sentema periodo por ekspozicio al testosterona.
Farmacologiaj androgenoj
La antaŭaj datumoj sugestas, ke endogenaj gonadaj steroidoj plibonigas motivajn kondutojn dum adoleskeco. Nun, kio okazas, se oni mem-administras androgenojn je niveloj ĝis 100x normalaj fiziologiaj koncentriĝoj? Jen la problemo de anabola-androgena steroido (AAS) misuzo (reviziita en Foliumilo, 2002; Clark kaj Henderson, 2003). Mallonga digreso taŭgas ĉi tie: ĉiuj AAS estas derivaĵoj de testosterona, ĉiuj AAS havas karbonan skeleton kun 4-kunfanditaj ringoj, plej multaj havas 19-karbonojn. AAS estas uzataj ĉefe por iliaj anabolikaj (muskaptilaj) efikoj. Tamen, kiel ilia nomo implicas, AAS ankaŭ havas androgajn proprietojn. Testosterona estas logika elekto en bestaj studoj por esplorado de fundamentaj mekanismoj de androgena rekompenco. Ĝi daŭre estas populara elekto por homaj uzantoj, plej ofte en la formo de longedaŭraj testosterona esteroj kiel ekzemple testosterona propionato. En 2006, testosterona estis la ununura plej ofta malpermesita substanco detektita en urinaj provoj ĉe WADA-agnoskitaj laboratorioj (WADA, 2006). Testosterona respondecis pri la plej granda frakcio (34%) de AAS-pozitivaj urinaj provoj ĉe la 2000 Sidnejaj Olimpikoj (Van Eenoo kaj Delbeke, 2003). Same, en urinaj provoj de AAS-uzantoj, 41% pruvis pozitivajn testosterona (Foliumilo, Katlinio, Bato, Eliopulos, Beresford, 1991). Ĉe altaj dozoj, AAS produktas gravajn kondutajn ŝanĝojn. Precipe pro ilia proksima rilato al testosterona, AAS-uzo en la adoleskaj jaroj ŝajnus perturbi la normalan steroidan medion de la evoluanta homa nerva sistemo, inkluzive la kvanton, tempigon kaj specon de steroido.
Kiel ĉe aliaj kontraŭleĝaj drogoj, homa AAS-misuzo estas problemo de adoleskeco. Laŭ 1994 Nacia Hejma Enketo pri Drogaj Uzoj (SAMHSA / OAS, 1996), steroidoj uzas pintojn en malfrua adoleskeco en 18-jaraĝaj. Plie, en la enketo pri Monitoring the Future (Johnston, O'Malley kaj Bachman, 2003), la dumviva efiko de steroida uzo inter mezlernejaj maljunuloj (2.7%) estis komparebla al tiu por krakina kokaino (3.5%) aŭ heroino (1.4%). Esteroidaj uzoj ankaŭ estas pli kaj pli oftaj en pli junaj aĝoj: 2.5% de studentoj de 8a grado (13-14-jaroj) uzis steroidojn, similajn al la incidenco de fendo (2.5%) kaj uzino de heroino (1.6%). Ĉi tiu tendenco al AAS-uzo en fruaj junuloj estas precipe maltrankviliga konsiderante zorgojn pri 1), ke adoleskantoj povas esti precipe vundeblaj al misuzo de AAS, kaj 2), ke adoleska ekspozicio al AAS ĉe farmacologiaj niveloj havas la eblecon substance ŝanĝi la normalan maturiĝon de cerbo kaj konduto por produkti troigajn morfologiajn kaj kondutajn respondojn, akre kaj kronike.
Netaŭga agreso estas la kondutisma respondo plej ofte asociita kun homa AAS-misuzo. En publikigitaj kazaj raportoj, steroida uzo estis implikita en pluraj perfortaj murdoj (Conacher kaj Laboristo, 1989; Papo kaj Katz, 1990; Papo, Kouri, Powell, Campbell, kaj Katz, 1996; Schulte, Hall, kaj Boyer, 1993). En enketoj de aktualaj AAS-uzantoj, altigita agreso kaj malkuraĝeco estis la plej oftaj kondutaj kromefikoj de AAS-uzo (Obligacio, Choi, kaj Papo, 1995; Galligani, Renck, kaj Hansen, 1996; Midgley, Heather, kaj Davies, 2001; Parrott, Choi, kaj Davies, 1994; Perry, Kutscher, Lund, Yates, Holman, kaj Demers, 2003). Tamen, konsiderante la gamon de androgaj elmontroj, la varion de psikiatriaj simptomoj kaj la eblon de antaŭekzistanta psikiatria misfunkcio, estas malfacile determini la precizan rolon de AAS en ĉi tiuj kazoj de homa agreso. Rezultoj de eblaj studoj de homaj volontuloj ricevantaj injektojn de AAS miksiĝis: Tricker et al (1996) kaj O'Connor et al (2004) raportis neniujn pliiĝojn de kolera konduto dum aliaj studoj observis pliigitan agreso (Daly, Su, Schmidt, Pickar, Murphy, kaj Rubinow, 2001; Hannan, Friedl, Zold, Kettler, kaj Plymate, 1991; Kouri, Lukas, Papo, kaj Oliva, 1995; Papo kaj Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz, kaj Rubinow, 1993). Tamen estas grave memori, ke la dozoj administritaj al homaj volontuloj estas multe pli malaltaj ol la dozoj rekomenditaj en retejoj de korpokonstruado, kaj la daŭro de kuracado ĝenerale estas mallonga. Tiel, ekvilibre, ŝajnas juste konkludi, ke AAS havas eblecon plibonigi agonisman konduton, almenaŭ ĉe susceptaj individuoj. Pope et al (1994) ĝi trovis ke AAS estigas psikiatriajn simptomojn en vundeblaj individuoj.
Animalaj studoj ankaŭ provizis konvinkajn pruvojn por AAS-induktita agreso. Adoleskaj viraj hamstroj traktataj kronike kun alt-dozonaj steroidoj havas pli mallongajn atakajn latencojn kaj pli grandan numeron de atakoj kaj mordoj al vira entrudulo kompare kun maltraktitaj viroj (Harrison, Connor, Nowak, Nash, kaj Melloni, 2000; Melloni, Connor, Hang, Hangon, kaj Ferris, 1997). Simile, milda provoko (vosto-pinĉilo) produktas konstantan kreskon de agreso en adoleskaj viraj ratoj, inkluzive de agreso al inoj (Cunningham kaj McGinnis, 2006). De eĉ pli granda maltrankvilo, adoleska ekspozicio al AAS en hamsters kaŭzas daŭrajn pliiĝojn de agonisma konduto, kiu persistas post kiam steroida uzo estas ĉesigita (Grimes and Melloni, 2006). Ĉi tiuj kondutaj ŝanĝoj estas akompanataj de daŭra remodelado de neŭra cirkvito en la antaŭa hipotalamo. Precipe, adoleska AAS-ekspozicio en hamsters plibonigas argininan vasopresinon (AVP, Grimes and Melloni, 2006) kaj malreguligas serotoninon kaj la serotonergikajn 5HT1A kaj 5HT1B-receptorojn (Ricci, Rasakham, Grimes, kaj Melloni, 2006). Estu ne surprize, ke ankaŭ AAS ŝanĝas cerbajn nivelojn de AR. Kronika ekspozicio al testosterona aŭ nandrolona reguligas ĉelan nuklean AR en viraj ratoj (Menard kaj Harlan, 1993; Wesson kaj McGinnis, 2006). Tiel, ekzistas la potencialo por AAS plibonigi androgen-dependajn kondutojn ambaŭ per suplementado de endogenaj androgenoj kaj pliigante androgena respondeco per pliigita AR-esprimo.
Kompare kun agonisma konduto, AAS havas malpli markitan efikon sur pariĝa konduto en viraj ronĝuloj, kaj la respondo dependas de la aparta steroido uzita (reviziita en Clark kaj Henderson, 2003). En viraj hamstroj konsumantaj testosteronon en buŝaj solvoj, ejakuladoj pliiĝis laŭ dozo-dependa maniero (Ligno, 2002). Tamen, nek testosterona nek nandrolono plibonigis pariĝon en adoleskaj viraj ratoj. Stanozolol, relative malpli potenca AAS kun minimuma androgena agado, efektive malhelpis ambaŭ apareadon kaj agresemon (Farrell kaj McGinnis, 2003), supozeble reduktante endogenajn androgenajn nivelojn.
Estas precipe grave rimarki, ke adoleskaj kaj plenkreskaj hamsters povas montri malsamajn kondutajn respondojn al AAS-ekspozicio. Dum AAS signife plibonigis agonisman konduton en adoleskaj viroj, la sama traktado en plenaĝeco produktis nur modestan kreskon de agresema konduto kaj signife malpliigis seksan konduton (Salas-Ramirez, Montaldo kaj Sisk, 2008). Ĉi tio konformas al la koncepto de adoleskeco kiel sentema periodo por androgena agado. Plue, same kiel plenkreskaj viraj hamstroj akiras toleron al ekzogena testosterono (Peters kaj Wood, 2005), ni kredas, ke disvolvantaj maskloj akiras toleremon al testosterona dum ili maturiĝas. Tiel, la efikoj de AAS ŝanĝiĝas tra adoleska evoluo, kaj adoleska AAS-ekspozicio povas kaŭzi troajn agresemajn kaj seksajn kondutajn padronojn, kiuj eble persistas en plenaĝecon.
Plifortigaj efikoj de androgenoj
La apareamiento kaj la lukto estas ĉiu rekompencaj (almenaŭ se vi gajnas la batalon). Viraj ratoj premos levilon ripete por kopulacii kun ino (Everitt kaj Stacey, 1987). Simile, masklaj musoj kaj inaj hamstroj formos kondiĉan lokan preferon (CPP) por lokoj, kie ili antaŭe gajnis luktojn (Martinez, Guillen-Salazar, Salvador, kaj Simon, 1995; Meisel kaj Joppa, 1994). Se AAS povas plibonigi rekompencajn sociajn kondutojn super niveloj kutime observataj ĉe gonad-sendifektaj viroj, estas logike atendi, ke testosterona mem eble bonfartos. Ĉi tio estis provita uzante du bone establitajn bestajn modelojn por rekompenco kaj plifortigo: CPP kaj mem-administrado. La rezultoj de ĉi tiuj studoj pruvas, ke testosterona plifortiĝas en eksperimenta kunteksto, kie anabolaj efikoj kaj atleta agado estas senrilataj. Kun CPP, la prova substanco estas plurfoje kombinita kun unika medio (ekzemple, aparta ĉambro en la provo-aparato). Unufoje la besto asocias la plifortigan testan substancon kun tiu medio, li serĉos la medion eĉ sen manko de rekompenco. La unuaj raportoj pri androgena rekompenco en laboratoriaj bestoj uzis sistemajn injektojn de testosterona por indukti CPP en viraj musoj (Arnedo, Salvador, Martinez-Sanchis, kaj Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis, kaj Pellicer, 2002) kaj ratoj (Aleksandro, Packard, kaj Hines, 1994; de Beun, Jansen, Slangen, kaj Van de Poll, 1992). Poste nia laboratorio uzis memadministradon de testosterona por pruvi androgenan plifortigon (Johnson kaj Wood, 2001). Ni trovis, ke viraj hamstroj volonte konsumos buŝajn solvojn de testosterona uzante ambaŭ 2-botelajn elektajn testojn kaj manĝeblan trinkadon. En postaj studoj, ni pruvis iv-administradon ĉe viraj ratoj kaj hamstroj (Wood, Johnson, Chu, Schad, kaj Self, 2004). Intraŭna liverado forigas eblajn malklarajn efikojn de gusto aŭ intestaj plenigoj de androgena konsumado.
Kadre de AAS-misuzo, gravas diferenci inter centraj kaj ekstercentraj efikoj de androgenoj. Ĉar testosterona havas ampleksajn efikojn tra la tuta korpo, oni povus argumenti, ke rekompenco kaj plifortigo per sistemaj testosterona injektoj estas malĉefa al la sistemaj anabolikaj kaj androgaj agoj de testosterona. Alivorte, eble testosterona reduktas muskolan lacecon kaj plibonigas komunan funkcion tiel ke bestoj nur sentas pli bone. Efektive, ĉi tiu ekspliko estis uzata en la klinika literaturo (kvankam sen eksperimentaj evidentaĵoj) por argumenti kontraŭ la potencialo de dependeco kaj toksomanio al AAS (DiPasquale, 1998). Tamen, Packard et al (Packard, Cornell, kaj Aleksandro, 1997) montris, ke injektoj de testosterona rekte en la cerbo de rato povas indukti CPP. Tiel same, nia laboratorio pruvis intracerebroventricula (icv) testosterona memadministrado en viraj hamstroj (Wood et al., 2004). Intrararebra CPP kaj icv-memadministrado kun testosterona argumentas por centraj celoj mediante androgajn plifortigojn.
Notindas, ke testosterona plifortigo ne nepre sekvas la samajn mekanismojn antaŭe establitajn por steroidaj efikoj sur seksa konduto. Kiel diskutite antaŭe, la MPOA estas ŝlosila loko por organizado de vira ronĝula seksa konduto (Hull, Meisel, kaj Sachs, 2002). En hamsters, la MPOA havas abundajn steroidajn ricevilojn, kaj testosterona enplantaĵoj en MPOA restarigas seksan agadon en longtempaj kastroj (Wood kaj Swann, 1999). La tempodaŭro de ĉi tiuj steroidaj efikoj estas malrapida: muntanta konduto daŭras dum semajnoj post orkidektomio, kaj plilongigita steroido estas necesa por restarigi pariĝon en longtempaj kastroj (Nobla kaj Alsum, 1975). Tamen, injektoj de testosterona en MPOA de viraj ratoj malsukcesas indukti CPP (Reĝo, Packard kaj Aleksandro, 1999). Ĉi tio sugestas, ke aliaj cerbaj regionoj gravas por androgena plifortigo.
Kontraŭe, viraj ratoj formos CPP al testosterona injektoj en Acb (Packard et al., 1997). Kiel ĉe aliaj drogoj de misuzo, DA verŝajne estas ŝlosila neurotransmisilo por testosterona plifortigo: CPP induktita per sistema testosterona injekto estas blokita de antagonistoj de D1 kaj D2-dopamina-receptoro (Schroeder kaj Packard, 2000). Tamen, male al aliaj drogoj de misuzo, niaj studoj en hamstroj sugestas, ke testosterona ne induktas Acb DA-liberigon (Triemstra, Sato, kaj Ligno, en gazetaro). Same, studoj de viraj ratoj montras, ke androgenoj havas neniun efikon al bazaj DA-niveloj aŭ anfetamin-stimulita DA-liberigo (Birgner, Kindlundh-Hogberg, Nyberg, kaj Bergstrom, 2006; sed ankaŭ vidu Clark, Lindenfeld, kaj Ĝibono, 1996). Plue, testosterona praktikas relative negravan influon sur niveloj de Acb DA-histo (Thiblin, finno, Ross, kaj Stenfors, 1999). Kune, ĉi tiuj datumoj sugestas, ke kvankam testosterona plifortigo povas finfine ŝanĝi DA-agadon en Acb, la mekanismoj povas esti diferencaj de tiuj de kokaino aŭ aliaj stimuliloj. Tiurilate, lastatempaj datumoj sugestas, ke kronika ekspozicio al AAS povas ŝanĝi sentemon al DA ŝanĝante DA-metabolon (Kurling, Kankaanpaa, Ellermaa, Karila, kaj Seppala, 2005), niveloj de DA-riceviloj (Kindlundh, Lindblom, Bergstrom, Wikberg, kaj Nyberg, 2001; Kindlundh, Lindblom, kaj Nyberg, 2003) aŭ la transportilo DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom, kaj Nyberg, 2002).
La nuna tempo, la specifaj steroidaj signaloj, riceviloj kaj cerbaj lokoj de agado por testosterona plifortigo estas nekonataj. Bazita sur lastatempa studo de hamstroj de nia laboratorio, la plifortigaj efikoj de testosterona ŝajnas esti mediaciitaj de androgenoj kaj estrógenos (DiMeo kaj Ligno, 2006). Ofte misuzita AAS inkluzivas kaj aromatizajn kaj ne-aromatizajn androgenojn (Gallaway, 1997; WADA, 2006). Ĉi tio implicas, ke kaj AR kaj ER povas transdoni steroidajn stimulojn rekompencante. Ekzistas la plia ebleco, ke testosterona plifortigo povas esti mediaciita de kombinaĵo de klasikaj kaj ne-genomaj riceviloj.
Pluraj linioj de evidenteco montras al la agoj de ne-genomaj riceviloj en la plifortigaj efikoj de AAS. Aldone al la malabunda distribuado de AR en Acb kaj VTA, la tempokurso de androgena plifortikigo estas rapida (<30 min), kaj signal-prilaborado per klasika AR eble ne estas sufiĉe rapida por plifortigo. Sekve, por testi la rolon de ne-genomika AR en AAS-plifortigo, ni uzis du komplementajn teknikojn (Figo. 7). En unu eksperimento (Sato, Johansen, Jordanio, kaj Wood, 2006), ni permesis al ratoj kun la testikula feminiga mutacio (Tfm, vidi ĉi tiun aferon) mem-administri dihydrotestosterone (DHT), ne-aromatizan androgenon. La Tfm-mutacio multe malpliigas ligan ligadon ĉe AR. Tamen Tfm-ratoj kaj iliaj sovaĝaj tipaj viraj gefratoj mem-administris proksimume la saman kvanton de DHT. Ĉi tio argumentas por ne-genomaj efikoj de DHT. En posta studo, ni determinis ĉu viraj hamstroj mem-administrus DHT konjugita al bovina seruma albumino (BSA, Figo. 8, Sato kaj Ligno, 2007). DHT-BSA-konjugacioj estas membran-impermeigeblaj; tiel iliaj efikoj estas limigitaj al la ĉela surfaco. Hamsters mem-administritaj DHT, kiel antaŭe pruvite (DiMeo kaj Ligno, 2006). Ili montris similan preferon por DHT-BSA-konjugacioj, sed ne sukcesis mem-administri BSA sole.
Ĉi tiuj datumoj celas centran rolon por ĉelaj surfacaj ARoj en androgaj plifortigoj. Nuntempe, la ekzakta naturo de tiaj riceviloj ne estas konata. Oni sugestis, ke androgenoj povas agi ĉe la ĉela surfaco per ligado al dediĉita membrana AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff, kaj Doughty, 2006, vidu ankaŭ ĉi tiun aferon). Ĉi tio povas esti en la formo de ekster-nuklea klasika AR kiel raportita en hipokampo (Sarkey et al. En ĉi tiu numero). Alternative, antaŭaj studoj ankaŭ priskribis steroid-ligajn lokojn sur aliaj neurotransmisiloj. Specife, vario de steroidaj hormonoj inkluzive de AAS povas alosterie moduli la GABA-A-ricevilon (Henderson, 2007; Lambert, Belelli, Peden, Vardy, kaj Peters, 2003). Same, ili povas modifi aktivecon de sulfataj neurosteroidoj N-metil-D-aspartaj ricevilaj subtipoj (Malajaev, Gibbs, kaj Farb, 2002) riceviloj. Ĉi tio estas grava areo por estonta esplorado.
Kial devas esti membrana AR? Kiel diskutite antaŭe, ekzistas proksima asocio inter androgena sekrecio kaj rekompencaj sociaj kondutoj. Ni povas konjekti, ke la kresko de testosterona sekrecio, kiu sekvas pariĝon aŭ bataladon, utilas por plifortigi la konduton. Se jes, necesas rapida akcelado de stimulo (konduto) kaj rekompenco (testosterona). Ĉi tio plej bone atingas per ligado al membrana AR. Tiurilate, estus interese determini ĉu klakado de androgena sekrecio dum pariĝo reduktas la rekompencajn efikojn de seksa konduto.
resumo
Ĉi tie ni revizias la evidentecon, ke androgenoj estas potencaj mediatoj de plenkreskaj motivitaj kondutoj, kaj plue, ke la tempigo de androgena ekspozicio dum evoluaj programoj al androgen-dependaj motivoj en plenaĝeco. Anabolaj steroidoj rapide fariĝas favorita drogo de misuzo de adoleskantoj en Usono. Kvankam AAS eble ne havas la toksomanian potencon de kokaino aŭ heroino, ni ĵus komencas kompreni la potencialon por androgena plifortigo kaj toksomanio. Precipe, ĉar junulaj sportoj fariĝas pli konkurencaj, pli kaj pli kreskas premo sur evoluantaj atletoj por uzi steroidojn, ekde pli junaj aĝoj. Ĉi tiu tendenco maltrankviliĝas konsiderante novajn evidentecojn pri neŭra maturiĝo al steroidoj en adoleskantoj.
Malgraŭ pliigita konscio de kaj la publikaj kaj sciencaj komunumoj pri la profundaj neŭraj ŝanĝoj akompanantaj adoleskecon, eksperimenta studo pri la disvolviĝanta neŭbiologio de pubereco estis limigita. Bestaj modeloj de adoleska evoluo necesas por esplori kiel la tempopremo de hormona ekspozicio dum evoluo pliigas riskon de individuo por psikopatologio kaj uzado de drogoj, kaj kiaj specoj de spertoj mildigas aŭ amplifas la kondutajn efikojn de devioj en pubertaj tempoj. Ekzemple, sociaj faktoroj kiel interparenca influo pligravigas la efikojn de pubera tempa tempo por uzado de substanco kaj alkoholo (Biehl, Natsuaki, kaj Ge, 2007; Patton, Novy, Lee, kaj Hickok, 2004; Simons-Morton kaj Haynie, 2003; Wichstrom kaj Pedersen, 2001). Bestaj modeloj de pubertaj tempoj ankaŭ informos homajn esplorojn, kaj eble kondukos al pli efikaj terapiaj intervenoj dum adoleskeco.
Dankojn
Ni dankas Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers, kaj Pamela Montalto pro helpo kun ĉi tiuj studoj. Ĉi tiu laboro estas subtenata de subvencioj de la NIH (DA12843 al RIW, MH68764 al CLS, kaj MH070125 al KMS).
Piednotoj
Malgarantio de Eldonisto: Ĉi tio estas PDF-dosiero de unita manuskripto, kiu estis akceptita por publikigado. Kiel servo al niaj klientoj ni provizas ĉi tiun fruan version de la manuskripto. La manuskripto suferas kopion, kompostadon kaj revizion de la rezultanta pruvo antaŭ ol ĝi estas publikigita en ĝia fina maniero. Bonvolu noti, ke dum la procezo de produktado povas malkovri erarojn, kiuj povus influi la enhavon, kaj ĉiujn laŭleĝajn malvirtojn, kiuj aplikeblas al la ĵurnalo.
Referencoj
- Alexander GM, Packard MG, Hines M. Testosterono havas rekompencajn afektajn proprietojn ĉe viraj ratoj: implikaĵoj por la biologia bazo de seksa instigo. Behaviara Neŭrikeco. 1994;108: 424-8. [PubMed]
- Andersen SL. Trajektoj de cerba disvolviĝo: punkto de vundebleco aŭ fenestro de okazo? Recenzoj pri Neŭroscienco kaj Biokonduteco. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Seksdiferencoj en dopamina receptoro superproduktado kaj elimino. Neuroreporto. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Rekompencaj propraĵoj de testosterona en sendifektaj viraj musoj: pilota studo. Farmakologio, Biokemio kaj Konduto. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Similaj rekompencaj efikoj de testosterona ĉe musoj taksataj kiel mallongaj kaj longaj atakaj latencaj individuoj. Toksomanio Biologio. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Organizaj kaj aktivaj efikoj de seksaj steroidoj sur cerbo kaj konduto: reanalizo. Hormonoj kaj Konduto. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Konverĝo kaj plasteco de monoaminergiaj sistemoj en la media prefrontal-kortekso dum la postnaska periodo: implikaĵoj por la disvolviĝo de psikopatologio. Cerba Kortiko. 2000;10: 1014-27. [PubMed]
- Benes FM, Testudo M, Khan Y, Farol P. Mielinigo de ŝlosila relajso en la hipokampa formado okazas en la homa cerbo dum infanaĝo, adoleskeco, kaj plenaĝeco. Arkivoj de enerala Psikiatrio. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. La influo de pubertempoj sur alkohola uzo kaj pezaj trinkaj trajektorioj. Urnalo de Junularo kaj Adoleskeco. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Leteroj pri Neŭŭkienco 2006 Alteriĝintaj eksterĉelaj niveloj de DOPAC kaj HVA en la rato-kerno akuzas ŝelon en respondo al subkronika nandrolona administrado kaj posta amfetamina defio.
- Obligacio AJ, Choi PY, papo HG., Jr Taksado de atentaj fleksoj kaj humoro ĉe uzantoj kaj ne-uzantoj de anabolaj-androgenaj steroidoj. Drogo kaj Alkohola Dependeco. 1995;37: 241-5. [PubMed]
- Foliumilo KJ. Abuso kaj dependeco de anabolaj steroidoj. Aktualaj Psikiatraj Raportoj. 2002;4: 377-87. [PubMed]
- Foliumilo KJ, Catlin DH, Bato FC, Eliopulos GA, Beresford TP. Klinika testado kaj urina provado por anabola-androgena steroido misuzo kaj dependeco. Usona Journalurnalo de Drogo kaj Alkohola Misuzo. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Esteroida metabolo en la mamula cerbo: 5alfa-redukto kaj aromatigo. Bultena Esplora Bulteno. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Seksa diferencigo de la lito-kerno de la striata terminalo en homoj povas etendiĝi al la plenaĝeco. Ĵurnalo de Neŭrikeco. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Kondutismaj kaj fiziologiaj respondoj al anabolaj-androgaj steroidoj. Recenzoj pri Neŭroscienco kaj Biokonduteco. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Ĝibono CH. Anabolikaj-androgaj steroidoj kaj cerba rekompenco. Farmakologio, Biokemio kaj Konduto. 1996;53: 741-5.
- Conacher GN, DG Laboristo. Perforta krimo eble asociita kun anabola steroido. Usona Ĵurnalo de Psikiatrio 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MIA. Fizika provoko de pubertaj anabolaj androgenaj steroidoj elmontritaj al viraj ratoj provokas agreson al inoj. Hormonoj kaj Konduto. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Cerebrospina fluido kaj kondutaj ŝanĝoj post metiltestosterona administrado: preliminaj trovoj. Arkivoj de enerala Psikiatrio. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Strukturaj seksaj dimorfismoj en la anteroventra periventricula kerno de la rato hipotalamo estas sentemaj per gonadaj steroidoj perine, sed disvolviĝas periferie. Neuroendokrinologio. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Testosterona kiel apetita kaj diskrimina stimulo ĉe ratoj: seksaj kaj dozon-dependaj efikoj. Fiziologio kaj Konduto. 1992;52: 629-34. [PubMed]
- Dekaban AS. Ŝanĝoj en cerbaj pezoj dum la homa vivo: rilato de cerbaj pezoj al korpaj altecoj kaj korpaj pezoj. Analoj de Neŭrologio. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. La drogoj abusataj de homoj prefere pliigas sinapajn dopaminajn koncentriĝojn en la mesolimbia sistemo de libere movantaj ratoj. Proceedings de la Nacia Akademio de Sciencoj de Usono. 1988;85: 5274-8. [PMC libera artikolo] [PubMed]
- DiMeo AN, Ligno RI. Mem-administrado de estrogeno kaj dihidrotestosterono en viraj hamstroj. Hormonoj kaj Konduto. 2006;49: 519-26. [PubMed]
- DiPasquale M. Anabolaj Esteroidoj. En: Tarter RE, Ammerman RT, Ott PJ, redaktoroj. Manlibro pri Substancaj Misuzoj. Plenuma Gazetaro; NY: 1998. pp 547 – 565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Reguligo de la meza amigdalo de kopulacio kaj mediana preoptiko de dopamina liberigo. Ĵurnalo de Neŭrikeco. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stimuli la median amigdala plibonigas median preoptikan dopamin-liberigon: implicojn por seksa konduto de vira rato. Brain-Esploro. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastrado malpliiĝas eksterĉelaj, sed pliigas intracelanan, dopaminon en mez-preoptika areo de viraj ratoj. Brain-Esploro. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Naturo kaj sorto de proliferaj ĉeloj en la hipokampo dentata giruso dum la vivotempo de la simio de ruso. Ĵurnalo de Neŭrikeco. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Studoj de instrumenta konduto kun seksa plifortigo en masklaj ratoj (Rattus norvegicus): II. Efikoj de antaŭtemplaj lezoj, kastrado kaj testosterono. Revuo por Kompara Psikologio. 1987;101: 407-19. [PubMed]
- Gallaway S. La Steroida Biblio. Belle Internacia Gazetaro; Sakramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Persona profilo de viroj uzantaj anabolajn androgajn steroidojn. Hormonoj kaj Konduto. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Prolongigitaj ŝanĝoj en la neŭrona sistemo de serotonino post ĉeso de adoleska anabola-androgena steroido en hamsters (Mesocricetus auratus) Behaviara Neŭrikeco. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Psikologiaj kaj serumaj homovanilaj acidaj ŝanĝoj en viroj administritaj androgenaj steroidoj. Psikoneuroendokrinologio. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr Kronika anabola-androgena steroida traktado dum adoleskeco pliigas antaŭan hipotalaman vasopresinon kaj agreso en sendifektaj hamstroj. Psikoneuroendokrinologio. 2000;25: 317-38. [PubMed]
- Li J, Skipoj FT. Neŭrogezo malpliiĝas dum cerba maturiĝo de adoleskeco ĝis plenaĝeco. Farmakologio, Biokemio kaj Konduto. 2007;86: 327-33.
- Henderson LP. Esteroida modulado de GABAA-mediaciita transdono en la hipotalamo: efikoj sur reprodukta funkcio. Neurofarmacologio. 2007;52: 1439-53. [PMC libera artikolo] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Ekstelula dopamino en la media preoptika areo: implicoj por seksa instigo kaj hormonal kontrolo de kopulacio. Ĵurnalo de Neŭrikeco. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Vira seksa konduto. En: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, redaktistoj. Hormonoj, Cerbo, kaj Konduto. Akademia Gazetaro; Nov-Jorko: 2002. pp 3 – 137.
- Hull EM, Wood RI, McKenna KE. Neurobiologio de vira seksa konduto. En: Neill JD, redaktoro. Fiziologio de Reproduktado. Vol. 1 Elsevier Press; Nov-Jorko: 2006. pp 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Regionaj diferencoj en sinaptogenezo en homa cerba kortekso. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Parola testosterona memadministrado en viraj hamstroj. Neuroendokrinologio. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Studentoj de mezlernejo (NIH-Publikigado n-ro 03 – 5375) I. Bethesda, MD: Nacia Instituto pri Druguzo; 2003 Monitado de la estontaj naciaj enketrezultoj pri droguzo, 1975 – 2002.
- Kaiser Family Foundation. Usona adoleska seksa agado. 2005 pp # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulado de cerba androgena ricevilo imunoreaktiveco de androgenoj en prepubertaj viraj uretoj. Biologio de Reproduktado. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminergic-efikoj post kronika traktado kun nandrolono bildigita en rato-cerbo per emitio de pozitronoj. Progreso en Neŭropsikofarmakologio & Biologia Psikiatrio. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. La anabola-androgena steroido nandrolona decanoato influas la densecon de dopaminaj riceviloj en la vira rato-cerbo. Eŭropa Ĵurnalo de Neŭrikeco. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Kronika administrado kun nandrolona decanoato induktas ŝanĝojn en la gene-transskriba enhavo de dopaminaj D (1) - kaj D (2) -receptoroj en la cerbo de rato. Brain-Esploro. 2003;979: 37-42. [PubMed]
- Reĝo BE, Packard MG, Alexander GM. Afektaj ecoj de intra-mezaj preoptikaj areaj injektoj de testosterona ĉe viraj ratoj. Leteroj pri Neŭŭkienco 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. La neurobiologio de drogmanio. Journalurnalo de Neŭropsikiatrio kaj Klinikaj Neŭrosciencoj. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Papo HG, Jr, Oliva PS. Pliigita agresema respondo en viraj volontuloj post la administrado de iom post iom kreskantaj dozoj de testosterona cipionato. Drogo kaj Alkohola Dependeco. 1995;40: 73-9. [PubMed]
- Kritzer MF. Longtempa gonadektomio efikas sur la densecon de tirozina hidroksilase- sed ne dopamina-beta-hidroksilase-, kolina acetiltransferase- aŭ serotonin-imunoreaktaj axonoj en la mezaj prefrontalaj kortikoj de plenkreskaj viraj ratoj. Cerba Kortiko. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. La efiko de subkronika nandrolona decanoata traktado sur dopaminergiaj kaj serotonergiaj neuronaj sistemoj en la cerbo de ratoj. Brain-Esploro. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Neŭroteroida modulado de GABAA-riceviloj. Progreso en Neurobiologio. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Cerba disvolviĝo en infanoj kaj adoleskantoj: vidoj de anatomia magneta resonanca bildigo. Neŭroscienco kaj Biokonduta Revizio. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogeny de la dopamina inervaĵo en la kerno akombina de gerbiloj. Brain-Esploro. 2005;1066: 16-23. [PubMed]
- Malajaev A, Gibbs TT, Farb DH. Malhelpo de NMDA-respondo per pregnenolona sulfato rivelas subtipan selekteman moduladon de NMDA-riceviloj per sulfatataj steroidoj. Brita Revuo pri Farmakologio. 2002;135: 901-9. [PMC libera artikolo] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Sukcesa intermala agreso kaj kondiĉita loko preferita ĉe musoj. Fiziologio kaj Konduto. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Agoj de testosterona en prepubertaj kaj postpubertaj viraj hamstroj: disiĝo de efikoj al reprodukta konduto kaj cerba androgena ricevilo-imunoreaktiveco. Hormonoj kaj Kondutoj. 1997;31: 75-88.
- Meisel RL, Joppa MA. Preferita loko prefere en virinaj hamstroj sekvantaj agresemajn aŭ seksajn renkontojn. Fiziologio kaj Konduto. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Anabolika-androgena steroida ekspozicio dum adoleskeco kaj agresema konduto en oraj hamstroj. Fiziologio kaj Konduto. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Supreregulado de imunoreaktiveco de androgaj riceviloj en la cerbo de rato per androgenaj-anabolaj steroidoj. Brain-Esploro. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiol reduktas kaltajn fluojn en neŭtriatalaj neŭronoj pere de membrana ricevilo. Ĵurnalo de Neŭrikeco. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Niveloj de agreso inter grupo de anabolikaj-androgenaj steroidoj-uzantoj. Medicino, Scienco kaj Juro. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Adoleska socia sperto restarigas plenkreskan ejakulan konduton en viraj siriaj hamsters malhavantaj pubertan testosteronon. Socio por Konduta Neŭroendokrinologio; Pacific Grove, CA: 2007.
- Nobla RG, Alsum PB. Hormonaj dependaj seksaj dimorfismoj en la ora hamstro (Mesocricetus auratus) Fiziologio kaj Konduto. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Ĉela morto en la disvolviĝo de la posta kortekso en viraj kaj virinaj ratoj. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Ovaraj hormonoj post postnaska tago 20 reduktas neuronan nombron en la primara vida kortekso de rato. Revuo por Neurobiologio. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Efikoj de testosterona sur humoro, agreso, kaj seksa konduto en junaj viroj: duobla blinda, placebo-kontrolita, kruca studo. Journalurnalo de Klinika Endokrinologio kaj Metabolo. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Rekompenci afekciajn ecojn de intra-kerno akuzas injektojn de testosterona. Behaviara Neŭrikeco. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH mRNA pliiĝas kun pubereco en la maskla siria hamster-cerbo. Revuo por Neŭroendokrinologio. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Anabola steroido-uzo de amatoraj atletoj: efikoj al psikologiaj humoroŝtatoj. Journalurnalo de Sporta Medicino kaj Korpa Taŭgeco. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. La diagnoza kaj reprodukta rezulto post kirurgia traktado de la kompleta septata utero, duobligita kolo kaj vagina septumo. Amerika Journalurnalo de Obstetriko kaj Ginekologio. 2004;190: 1669 – 75. 1675 – 8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Maturiĝo de blanka materio en la homa cerbo: revizio de magnetaj resonancaj studoj. Bultena Esplora Bulteno. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Mezuroj de agreso kaj humoroŝanĝoj en viraj pezofiltriloj kun kaj sen androgenaj anabolaj steroidoj. Revuo por Kuracaj Sciencoj. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Dependa androgeno en hamstroj: superdozo, toleremo, kaj eblaj opioidergiaj mekanismoj. Neurokienco 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Seksa konduto plibonigas centran dopaminon en la maskla rato. Brain-Esploro. 1990;530: 345-348. [PubMed]
- Fenikso CH, Goy RW, Gerall AA, Juna WC. Organiza agado de testosterona propionato prenatale sur la histoj mediata kunportado en la virineca porko. Endokrinologio. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. La disvolviĝo de seksaj diferencoj en la locus coeruleus de la rato. Bultena Esplora Bulteno. 2001;56: 73-8. [PubMed]
- Papo HG, Jr, Katz DL. Homicido kaj preskaŭ-hommortigo fare de anabolaj steroidoj-uzantoj. [Vidu komenton] Ofurnalo de Klinika Psikiatrio. 1990;51: 28-31. [PubMed]
- Papo HG, Jr, Katz DL. Psikiatriaj kaj medicinaj efikoj de anabola-androgena steroida uzo. Kontrolita studo de atletoj 160. Arkivoj de enerala Psikiatrio. 1994;51: 375-82. [PubMed]
- Papo HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Anabola-androgena steroida uzo inter 133-kaptitoj. Ampleksa Psikiatrio. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Testosterona restarigo de kopulatoria konduto korelacias kun mediana preoptiko de dopamina liberigo en kastritaj viraj ratoj. Hormonoj kaj Konduto. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Efikoj de testosterona metabolitoj sur kopulacio kaj meza preoptiko de dopamina liberigo en kastritaj viraj ratoj. Hormonoj kaj Konduto. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Efikoj de testosterona metabolitoj sur kopulacio, mediana preoptiko dopamino, kaj NOS-imunoreaktiveco en kastritaj viraj ratoj. Hormonoj kaj Konduto. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Postnatalaj neŭgenezoj en la vasopresino kaj oksitocin-enhavanta kerno de la porka hipotalamo. Brain-Esploro. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A-receptora agado kaj esprimo modulas adoleskajn anabolajn / androgenajn steroid-induktitajn agresojn en hamstroj. Farmakologio, Biokemio kaj Konduto. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihidrotestosterona aktivigas seksan konduton en plenkreskaj viraj hamstroj sed ne en junuloj. Fiziologio kaj Konduto. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Imunoreaktiveco de riceviloj de estrogenoj en prepubertaj kaj plenkreskaj viraj siriaj hamsteroj. Leteroj pri Neŭŭkienco 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromonoj eligas ekvivalentajn nivelojn de Fos-imunoreaktiveco en prepubertaj kaj plenkreskaj viraj siriaj hamsteroj. Hormonoj kaj Konduto. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Pubereco kaj maturiĝo de la vira cerbo kaj seksa konduto: konfuzigado de konduta potencialo. Recenzoj pri Neŭroscienco kaj Biokonduteco. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiol induktas hipotalamajn progesteronajn receptorojn sed ne aktivigas pariĝan konduton en masklaj hamstroj (Mesocricetus auratus) antaŭ pubereco. Behaviara Neŭrikeco. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Anabolaj androgenaj steroidoj (AAS) malsame efikas sur sociajn kondutojn en adoleskaj kaj plenkreskaj viraj siriaj hamsteroj. Hormonoj kaj Konduto. 2008 en gazetaro.
- SAMHSA / OAS. Publikigado de DHHS Ne (SMA) 1996 Nacia enketo de 1994 pri misuzo pri drogoj, ĉefaj trovoj 1994; pp 96 – 3085.
- SAMHSA / OAS. Rezultoj de 2004 Nacia Enketo pri Drogaj Uzoj kaj Sano: Naciaj Trovoj. 2005 NSDUH-Serio H-28, DHHS-Publikigado n-ro SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Sendependa administrado de androgenoj en ratoj Tfm. 10th Ĉiujara Kunveno de Socio por Konduta Neŭroendokrinologio.2006.
- Sato SM, Ligno RI. Mem-administrado de membrano-nepermeblaj anabolikaj-androgaj steroidoj (aas) en siriaj hamstroj. 11a Ĉiujara Kunveno de Socio pri fokusa Neŭroendokrinologio.2007.
- Schroeder JP, Packard MG. Rolo de dopamina ricevilo subtipoj en akiro de testosterona kondiĉita loko prefero en ratoj. Leteroj pri Neŭŭkienco 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Hejma perforto asociita kun anabola steroida misuzo. Usona Ĵurnalo de Psikiatrio 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Testikula hormona ekspozicio dum adoleskeco organizas flank-markadan konduton kaj vasopresinan receptoron ligantan en la flanka septo. Hormonoj kaj Konduto. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Mediaj preoptikaj areoj dopaminergiaj respondoj al inaj feromonoj disvolviĝas dum pubereco en la vira siria hamstro. Brain-Esploro. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadaj hormonoj masklinigas kaj difektas reproduktajn kondutojn dum pubereco en la vira siria hamstro. Hormonoj kaj Konduto. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Pubertaj hormonoj, la adoleska cerbo kaj maturiĝo de sociaj kondutoj: Lecionoj de la siria hamstro. Molekula & Ĉela Endokrinologio. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Neuroscienca Renkontiĝplano. Sandiego, CA: Socio por Neŭroscienco; 2007 Ĉu adoleskeco estas dua sentema periodo por la organizaj efikoj de testosterona sur plenkreska vira reprodukta konduto? Rete 2007.
- Scott JP, Stewart JM, De Ghett VJ. Kritikaj periodoj en organizado de sistemoj. Disvolva Psikobiologio. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Kompara distribuo de estrogen-ricevilo-alfa kaj -beta mRNA en la rat-centra nerva sistemo. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Psikosociaj prognozoj de pliigita fumadpaŝo inter sesaj graduloj. American Journal of Health Behavior. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Pubertaj hormonoj organizas la adoleskan cerbon kaj konduton. Limoj en Neuroendokrinologio. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Bonvenon SE, Kan E, Toga AW. Longforma mapado de kortika dikeco kaj cerba kresko ĉe normalaj infanoj. Ĵurnalo de Neŭrikeco. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Karto daŭra cerba kresko kaj redukto de griza materio en dorsan frontan kortekson: Inversaj rilatoj dum postadoleska cerba maturiĝo. Ĵurnalo de Neŭrikeco. 2001;21: 8819-29. [PubMed]
- Lanco LP. La adoleskaj cerbaj kaj aĝaj kondutaj manifestacioj. Neŭroscienco kaj Biokonduta Revizio. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neŭropsikiatriaj efikoj de anabolaj steroidoj en viraj normalaj volontuloj. JAMO 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Pliigitaj dopaminergic kaj 5-hydroxytryptaminergic-agadoj en vira rato-cerbo post longtempa traktado kun anabolaj androgenaj steroidoj. Brita Revuo pri Farmakologio. 1999;126: 1301-6. [PMC libera artikolo] [PubMed]
- Thomas P, Vestante G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, estrogenajn kaj androgenajn G-proteinojn kunigitajn receptorojn en fiŝaj gonadoj. Esteroidoj. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. La efikoj de suprafiziologiaj dozoj de testosterono sur kolera konduto en sanaj eugonadaj viroj - studo pri klinika esplorcentro. Journalurnalo de Klinika Endokrinologio kaj Metabolo. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Kemosensoraj krizoj estas esencaj por pariĝado de dopamina liberigo en MPOA de viraj siriaj hamstroj. Neuropsychofarmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testosterono kaj kerno akuzas dopaminon en la vira siria hamstro. Psikoneuroendokrinologio (en gazetaro)
- Van Eenoo P, Delbeke FT. La prevalenco de dopado en Flandrio kompare kun la prevalenco de dopado en internaciaj sportoj. Internacia Revuo pri Sporta Medicino. 2003;24: 565-570. [PubMed]
- WADA. Adversaj analizaj trovoj raportitaj de agnoskitaj laboratorioj. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MIA. Plupado de anabolaj androgenaj steroidoj (AAS) dum pubereco en ratoj: neŭroendokrina kaj kondutisma takso. Farmakologio, Biokemio kaj Konduto. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Uzo de anabolaj-androgaj steroidoj en adoleskeco: gajni, aspekti bone aŭ esti malbona? Studiesurnalo de Studoj pri Alkoholo. 2001;62: 5-13. [PubMed]
- Ligno RI, Johnson LR, Chu L, Schad C, Mem DW. Testosterona plifortigo: intravena kaj intracerebroventrikula memadministrado en viraj ratoj kaj hamstroj. Psikofarmacologio. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. La androgenaj kaj estrogenaj riceviloj kunvivas kun individuaj neŭronoj en la cerbo de la siria hamstro. Neuroendokrinologio. 1995;62: 487-97. [PubMed]
- Ligno RI, Swann JM. Neŭrala integriĝo de kemiosensoriaj kaj hormonaj signaloj, kiuj kontrolas viran seksan konduton. En: Wallen K, Schneider JS, redaktistoj. Reproduktado en Kunteksto. MIT Gazetaro; Kembriĝo: 1999. pp 423 – 444.
- Zahm DS, Heimer L. Du interpallidalaj vojoj devenantaj de la rato-kerno accumbens. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]