COMENTARIOS DE YBOP: El efecto Coolidge está detrás del poder de la pornografía en Internet. El efecto Coolidge es un fenómeno observado en especies de mamíferos por el cual los machos (y en menor medida las hembras) exhiben un interés sexual renovado si se les presenta a nuevas parejas sexuales receptivas, incluso después de rechazar el sexo de parejas sexuales anteriores pero aún disponibles. La novedad sexual anula esta habituación con una emoción renovada causada por una mayor dopamina. Una corriente continua de novedad es lo que hace que la pornografía en Internet sea tan diferente de la pornografía del pasado.
Artículo original, con gráficos.
- Dennis F.Fiorino,
- Ariane Coury, y
- Anthony G. Phillips
- El diario de la neurociencia, 15 de junio de 1997, 17 (12): 4849-4855;
Resumen
El efecto Coolidge describe la reiniciación de la conducta sexual en un animal "saciado sexualmente" en respuesta a una nueva pareja receptiva. Dado el papel del sistema de dopamina mesolímbico (DA) en el inicio y mantenimiento del comportamiento motivado, se utilizó la microdiálisis para monitorear la transmisión de DA del núcleo accumbens (NAC) durante la cópula, la saciedad sexual y la reiniciación del comportamiento sexual. De acuerdo con informes anteriores, la presentación de una hembra de estro detrás de una pantalla y la cópula se asociaron con aumentos significativos en el flujo de salida de NAC DA. El retorno de las concentraciones de DA de NAC a los valores de referencia coincidió con un período de saciedad sexual, aunque las concentraciones de los metabolitos de la DA, el ácido dihidroxifenilacético y el ácido homovanílico permanecieron elevadas. La presentación de una nueva hembra receptiva detrás de una pantalla resultó en un ligero aumento en NAC DA, que se incrementó significativamente durante la nueva copulación con la novela femenina. Los datos actuales sugieren que las propiedades de estímulo de una nueva hembra receptiva pueden servir para aumentar la transmisión de NAC DA en una rata macho sexualmente saciada, y esto, a su vez, puede estar relacionado con la reiniciación del comportamiento sexual.
Introducción
Una rata macho que ha copulado a la saciedad puede inducirse a aparearse nuevamente si la hembra inicial se reemplaza con una hembra receptiva novedosa. Esto se conoce como efecto Coolidge y se ha observado en varias especies de mamíferos (Wilson et al., 1963). Los factores generales, como la fatiga o la depresión motora, no son suficientes para explicar el estado aparente de la saciedad sexual, porque los estímulos de una mujer nueva aún pueden inducir la copulación. La saciedad sexual también puede "revertirse" farmacológicamente, en un grado significativo, mediante la administración de una variedad de medicamentos que pueden actuar en diferentes sistemas de neurotransmisores. Estos medicamentos incluyen yohimbina, 8-OH-DPAT (Rodriguez-Manzo y Fernandez-Guasti, 1994, 1995a), nalaxona (Pfaus y Gorzalka, 1987; Rodriguez-Manzo y Fernandez-Guasti, 1995a,b), y apomorfina (Mas et al., 1995c). Aunque no se puede descartar la acción periférica de estos fármacos (p. Ej., Efectos adrenérgicos sobre la función eréctil), se han propuesto efectos sobre los mecanismos centrales que subyacen a la saciedad sexual sobre la base de experimentos selectivos de lesiones noradrenérgicas centrales (Rodriguez-Manzo y Fernandez-Guasti, 1995a) y experimentos de microdiálisis que monitorizaron el metabolismo dopaminérgico en el área preóptica medial (Mas et al., 1995a,b).
Dado que los mecanismos centrales pueden mediar la reiniciación del comportamiento sexual característico del efecto Coolidge, un candidato probable es el sistema de dopamina mesolímbica (DA), que se proyecta desde el área ventral tegmental hasta la NAC. Mesolimbic DA parece actuar como un modulador primario en procesos complejos integradores que involucran la evaluación de estímulos ambientales, como las señales de una mujer sexualmente receptiva, y la organización de conductas dirigidas a objetivos, incluida la cópula (Fibiger y Phillips, 1986; Blackburn et al., 1992; Phillips et al., 1992; LeMoal, 1995; Salamone, 1996).
Aunque las neuronas DA del cerebro medio responden a recompensas primarias y señales predictoras de recompensa, los estímulos ambientales novedosos o impredecibles inducen la activación neuronal de manera más robusta durante las sesiones de entrenamiento repetidas (Fabre et al., 1983; Schultz, 1992; Mirenowicz y Schultz, 1994). Existe una gran cantidad de evidencia que respalda un importante papel facilitador para la DA mesolímbica en el inicio y mantenimiento del comportamiento sexual de las ratas (Pfaus y Everitt, 1995), y una serie de estudios de microdiálisis reportan aumentos en el flujo de salida de NAC DA durante las fases apetitivas y consumatorias de la conducta sexual masculina (Pfaus et al., 1990; Pleim et al., 1990; Damsma et al., 1992; Wenkstern et al., 1993; Fumero et al., 1994; Mas et al., 1995b). Sin embargo, hay relativamente pocos datos sobre los correlatos neuroquímicos de la saciedad sexual y la reiniciación del comportamiento sexual. La aplicación de in vivo la microdiálisis para monitorear la neurotransmisión mesolímbica DA durante el efecto Coolidge brinda una oportunidad única para examinar el papel de la NAC DA en la cópula, la saciedad sexual y la reiniciación de la cópula.
Se realizó un experimento de microdiálisis para determinar lo siguiente: (1) si el inicio de la saciedad sexual está acompañado por el retorno de las concentraciones extracelulares de DA en el NAC a valores de precoblación o inferiores, y (2) si el restablecimiento del comportamiento de copulación en un " La rata macho saciada sexualmente con una hembra receptora novedosa se correlaciona con aumentos en el flujo de salida de NAC DA.
MATERIALES Y MÉTODOS
Asignaturas. Ratas Sprague Dawley macho, obtenidas del Animal Care Center (en la Universidad de British Columbia), y ratas Long-Evans hembra, obtenidas de Charles River Canadá (St. Constant, Quebec, Canadá), se alojaron en jaulas de malla de alambre (18 × 25 × 65 cm; cinco por jaula) en habitaciones de colonias separadas. Las habitaciones de las colonias se mantuvieron a una temperatura de ∼20 ° C en un ciclo de luz / oscuridad de 12 hr inverso. Las ratas tenían acceso ilimitado a la comida (Purina Rat Chow) y al agua.
Cirugía y pruebas de comportamiento ante microdiálisis cerebral.Las ratas hembras fueron ovariectomizadas bilateralmente con anestesia con gas halotano (Fluothane, Ayerst Laboratories) al menos 4 semanas antes de la prueba. La receptividad sexual en las hembras de estímulo se indujo mediante inyecciones subcutáneas de benzoato de estradiol (10 μg) y progesterona (500 μg), 48 y 4 hr, respectivamente, antes de cada sesión de prueba. Las ratas macho se examinaron en busca de comportamiento sexual en dos ocasiones, separadas por 4 d, en cámaras de plexiglás (35 × 35 × 40 cm) con pisos de malla de alambre. Sólo las ratas macho que alcanzaron un criterio de rendimiento, que incluía la intromisión dentro de 5 min de la presentación de la hembra y la eyaculación dentro de 15 min de la primera intromisión, durante las dos pruebas de detección fueron implantadas con cánulas de guía de sonda de microdiálisis.
Ratas machon = 5) se anestesiaron con clorhidrato de ketamina (100 mg / kg, ip) y xilazina (10 mg / kg, ip) antes de la cirugía estereotáxica. Las cánulas de guía de la sonda de microdiálisis (calibre 19) se implantaron bilateralmente sobre la NAC (coordenadas de bregma: anterior, + 1.7 mm; media, ± 1.1 mm; ventral, −1.0 mm; cráneo plano) y se fijaron al cráneo con acrílico dental y tornillos de joyeria. Se utilizaron implantes de cánulas de guía bilateral para maximizar la oportunidad de un experimento de microdiálisis exitoso. Afortunadamente, en el presente experimento, solo se necesitaba una cánula para cada rata. Las ratas macho se alojaron individualmente en grandes jaulas de plástico con ropa de cama de mazorcas de maíz durante el resto del experimento. Una semana después de la cirugía, las ratas fueron probadas para el comportamiento sexual. Durante esta parte del entrenamiento, la cámara de prueba estaba equipada con una pantalla deslizante de plexiglás que dividía la cámara en compartimientos grandes y pequeños. Se introdujeron ratas macho en el compartimiento grande y 15 minutos más tarde, se colocó una hembra detrás de la pantalla. Después de un período preparatorio de 15 min, se eliminó la pantalla y se dejó que las ratas copularan para 30 min. Se realizaron tres sesiones de entrenamiento, una cada 4 d. Todas las ratas alcanzaron el criterio de rendimiento durante cada sesión.
Experimento del efecto Coolidge. Las ratas se implantaron unilateralmente con sondas de microdiálisis 12-18 hr antes del experimento del efecto Coolidge y se colocaron en el compartimento grande de la cámara de prueba con acceso libre a alimentos y agua. En la mañana del experimento, se recogieron muestras de microdiálisis cada 15 min. El experimento consistió en las siguientes siete fases consecutivas: (1) línea de base (al menos 60 min); (2) 1 hembra detrás de la pantalla (15 min); (3) copulación con 1 hembra hasta que transcurra un período mínimo de 30 sin montura; (4) reintroducción de 1 hembra detrás de la pantalla (15 min); (5) acceso a 1 hembra durante un período mínimo de 15 siempre que no haya montaje (si se produjo el montaje, esta fase se trató como fase 3); (6) introducción de 2 hembra detrás de la pantalla (15 min); 7) copulación con 2 hembra para 60 mín.
El comportamiento se filmó con poca iluminación utilizando un sistema de video JVC y se observó en un monitor de video ubicado fuera de la sala de pruebas. Las medidas estándar de comportamiento sexual se registraron usando una computadora y un software apropiado (Holmes et al., 1987).
Después del experimento de microdiálisis, a los animales se les administró una sobredosis de hidrato de cloral y se perfundieron intracardialmente con solución salina y formalina (4%). Los cerebros se cortaron en rodajas y se congelaron y, posteriormente, las secciones coronales se tiñeron con violeta de cresilo para determinar la colocación de las sondas de microdiálisis. Solo las ratas con colocaciones de sonda dentro de la NAC se usaron para análisis de comportamiento y neuroquímicos.
Microdiálisis y detección electroquímica por HPLC. Las sondas de microdiálisis fueron de diseño concéntrico con una membrana de fibra hueca semipermeable (membrana 2 mm expuesta, diámetro externo de 340 μm, corte de peso molecular 65000, Filtral 12, Hospal) en el extremo distal. Las sondas se perfundieron a 1.0 μl / min con una solución de Ringer modificada (0.01 m tampón fosfato de sodio, pH 7.4, 1.3 mmCaCl).2, 3.0 mm KCl, 1.0 mmMgCl2, 147 mm NaCl) con una jeringa hermética (Hamilton, Reno, NV) y una bomba de jeringa (modelo 22, Harvard Apparatus, South Natick, MA). Se usó un collar guía de sonda de microdiálisis para asegurar la sonda de microdiálisis dentro de la cánula guía. Se usó una bobina de acero, unida a un giro de líquido (Instech 375) que se montó en la parte superior de la cámara de prueba, para proteger el tubo de la sonda (Fiorino et al., 1993).
Los analitos de microdializado, que incluían DA y sus metabolitos ácido dihidroxifenilacético (DOPAC) y ácido homovanílico (HVA), se separaron por cromatografía de fase inversa (columna de Ultrasphere; Beckman, Fullerton, CA, ODS 5 μm, 15 cm, 4.6 mm, diámetro interior ) utilizando un tampón de acetato de sodio 0.083m, pH 3.5 (5% metanol). Las concentraciones de analito se cuantificaron por detección electroquímica (EC). El aparato consistió en una bomba Bio-Rad (Richmond, CA), un inyector de dos posiciones EC10W de Valco Instruments (Houston, TX), un detector Coulochem II EC de ESA (Bedford, MA) y un registrador de gráficos de dos canales (Kipp y Zonen, Bohemia, NY). Los parámetros del detector electroquímico fueron los siguientes: electrodo 1, + 450 mV; electrodo 2, −300 mV; y célula de guarda, −450 mV. Recuperaciones de sondas típicas, realizadas in vitro ya temperatura ambiente, fueron 22% para DA, 18% para DOPAC y 18% para HVA.
RESULTADOS
Comportamiento
Las medidas de comportamiento del experimento del efecto Coolidge se presentan en la Tabla 1. Las latencias para montar, intromitir y eyacular, así como el intervalo posterior a la eyaculación después de la primera eyaculación fueron similares a las de la sesión de entrenamiento anterior (datos no mostrados). Esto sugiere que el procedimiento de microdiálisis no alteró el comportamiento sexual normal. El desarrollo de la saciedad sexual, según lo indicado por el número medio de eyaculaciones antes de que se cumpliera el criterio (7.8 ± 0.5), una disminución progresiva en el número de intromisiones que preceden a cada eyaculación y un aumento progresivo en el intervalo poste-eyaculatorio (datos no mostrados) , fue similar a lo reportado en estudios previos (Playa y Jordania, 1956; Fowler y Whalen, 1961; Fisher, 1962; Bermant et al., 1966; Rodriguez-Manzo y Fernandez-Guasti, 1994; Mas et al., 1995d). Se observó variabilidad individual con respecto al número de eyaculaciones logradas con 1 femenino, el tiempo dedicado a copular con 1 femenino y el número de presentaciones de 1 femenino necesarias para alcanzar el criterio de saciedad (Tabla 1, fondo). Algunas ratas requirieron numerosas reintroducciones de 1 hembra hasta que la fase 5 se completó (n = 3). Los actos de colocar 1 femenino detrás de la pantalla y la eliminación de la partición pueden haber servido como señales de apetito principales que condujeron a la copulación. También se debe tener en cuenta que un criterio de saciedad de 30 min sin montura, aunque se utilizó anteriormente (Playa y Jordania, 1965; Mas et al., 1995b), es arbitrario y no garantiza que una rata no hubiera montado más tiempo. Aun así, los retrasos o los procedimientos de eliminación y reemplazo no dieron como resultado una copulación renovada con 1 hembra (p. Ej., Fases 4 y 5).

Comportamiento durante el experimento del efecto Coolidge
Todas las ratas exhibieron el efecto Coolidge. La actividad asociada con la colocación de 2 femenino detrás de la pantalla y, en particular, la eliminación de la partición puede haber contribuido a este resultado, pero, nuevamente, estos eventos no fueron suficientes para renovar la cópula anteriormente en el experimento. Las comparaciones entre las medidas de comportamiento sexual con 1 femenina y 2 femenina se realizaron utilizando t Pruebas con una corrección de Bonferroni. Aunque las latencias de montura e intromisión en respuesta al 2 femenino no fueron significativamente diferentes de las de la primera pelea copulatoria con el 1 femenino, en general, el comportamiento sexual con el 2 femenino fue menos robusto, como lo indica una eyaculación significativamente menor (media, 0.6 vs 4.2; F = 49.86;p <0.01) e intromisiones (media = 11.2 vs 37.0;F = 20.17; p <0.05) durante la primera hora. El número de montajes en la primera hora con las hembras 1 y 2 no fue significativamente diferente.
Es importante tener en cuenta que las hembras utilizadas durante la porción de saciedad del experimento (es decir, 1 hembra) todavía mostraron un comportamiento proceptivo fuerte (es decir, salto y lanzamiento de dardos) y receptivo (es decir, lordosis) durante toda la duración de su contacto con el macho. .
neuroquímica
Las concentraciones nanomolares basales de DA y sus metabolitos en microdializados, presentados como la media ± SEM, de las tres primeras muestras de referencia fueron: DA, 3.0 ± 0.7; DOPAC, 619.1 ± 77.7; y HVA, 234.2 ± 49.0 (sin corregir para la recuperación de la sonda;n = 5). Estos valores representaron 100% puntos de referencia.
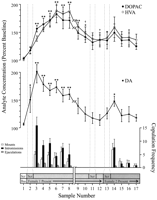
Los puntos de datos definidos por el comportamiento, correspondientes a cada fase del experimento y comunes a cada rata, se utilizaron para los análisis neuroquímicos. Estos incluyeron lo siguiente: (1) siete muestras después de la primera introducción de 1 hembra, (2) cuatro muestras que acompañan la ausencia de comportamiento copulador con 1 hembra, y (3) cinco muestras después de la presentación de 2 hembra. Figura 1 ilustra los cambios en las concentraciones de DA (gráfico de líneas, medio) y metabolitos de la DA (gráfica de líneas, parte superior) comportamiento copulatorio paralelo (gráfico de barras, fondo) Durante la prueba del efecto Coolidge.
Ver versión más grande:
Higo. 1.
Nucleus accumbens neuroquímico se correlaciona con el comportamiento sexual durante el efecto Coolidge. Las primeras ocho muestras representan puntos de datos cronológicamente continuos de las fases 1 a 3. Muestra 1 es la cuarta y última muestras de línea de base de precoblación (Bas). 2 de muestra representa la introducción de 1 hembra detrás de la pantalla (Scr). Después de 15 min, se eliminó la pantalla y se permitió que las ratas copularan (muestras 3 – 8). losromper en x-El eje corresponde a la exclusión de datos de tres ratas que copularon durante períodos prolongados con la hembra inicial. Las últimas nueve muestras también fueron continuas cronológicamente. Las muestras 9 y 10 corresponden al período de saciedad de la fase 3 (es decir, 30 min sin una montura). Luego se reinsertó la 1 hembra detrás de la pantalla (muestra 11) y, una vez más tarde, se eliminó la pantalla (muestra 15). Después de 12 min sin copulación, se colocó 15 hembra detrás de la pantalla (muestra 2). Las muestras 13 – 14 corresponden a la copulación con 17 hembra. El número de monturas, intromisiones o eyaculaciones asociadas con cada muestra de microdiálisis 2 min se muestra en la gráfico de barra inferior. Los datos neuroquímicos se expresan en términos de porcentaje de las concentraciones de referencia. Cambios en la NAC DA (cuadrados cerrados), DOPAC (círculos cerrados), y HVA (círculos abiertos) el flujo de salida se presenta como gráficos de líneas. Se realizaron las siguientes comparaciones: muestra de referencia 1 versus muestras 2 – 10; nueva muestra de referencia 10 versus muestras 11 y 12; nueva muestra de línea base 12 versus muestras 13 – 17 (*p <0.05; ** p <0.01). Independiente t se realizaron pruebas entre los valores de referencia (muestras 1, 10 y 12). Para diferencias significativas desde la primera línea de base (muestra 1), †p <0.05.
Se realizaron ANOVA de medidas repetidas y unidireccionales en datos neuroquímicos asociados con 1 hembra (muestras 1-12) y 2 hembra (muestras 12-17). A priori las comparaciones se realizaron utilizando la prueba de comparación múltiple de Dunn (Bonferroni t). Se realizaron las siguientes tres comparaciones principales: (1) línea de base inicial (muestra 1) versus muestras 2 – 10 (primera exposición a 1 femenino), (2) segunda línea de base (muestra 10) versus muestras 11 y 12 (reexposición a 1 femenino) y (3) tercera línea de base (muestra 12) versus muestras 13 – 17 (exposición a 2 femenino).
Hubo un cambio general significativo en el flujo de salida de DA en respuesta a 1 femenina [F (11,44) = 8.48; p <0.001] y mujeres 2 [F (5,20) = 2.83;p <0.05]. Se encontró un aumento significativo en la salida de DA cuando la hembra 1 estaba presente detrás de la pantalla (+ 44%,p <0.05; muestra 2). Durante la cópula, las concentraciones de DA aumentaron aún más, alcanzando un valor máximo (+ 95%;p <0.01) durante la primera pelea copulatoria (muestra 3). La DA permaneció elevada durante la cópula y sólo volvió a las concentraciones iniciales en el período de 30 minutos en el que no se produjo el montaje (muestras 9 y 10). Ni la reintroducción de la hembra 1 detrás de la pantalla (muestra 11) ni la oportunidad de interactuar físicamente, pero sin montar (muestra 12), concentraciones elevadas de DA en relación con el segundo valor de referencia (muestra 10). La presencia de la hembra 2 detrás de la pantalla (muestra 13) resultó en un pequeño aumento en el flujo de DA (12%) desde el tercer valor de referencia (muestra 12) que no alcanzó significación estadística. La copulación renovada con la hembra 2 resultó en un aumento significativo (34%) (p <0.05) en la salida de DA durante la primera muestra de cópula (muestra 14). Aunque el comportamiento copulatorio débil continuó durante las siguientes tres muestras, las concentraciones de DA disminuyeron hasta los valores iniciales (muestras 15-17). Independiente t las pruebas realizadas entre muestras de "línea de base" (es decir, 1, 10 y 12) demostraron que estos valores no eran significativamente diferentes.
En las tres ratas que reanudaron la copulación cuando se reintrodujo 1 hembra, las concentraciones de NAC DA aumentaron cuando 1 femenino estuvo presente detrás de la pantalla (rango, 25 – 47%) y durante la copulación (rango, 13 – 37%), con respecto a la muestra solo Antes de la reintroducción de la hembra. Sin embargo, estos aumentos solo ocurrieron cuando el comportamiento sexual fue vigoroso y condujo a la eyaculación.
Cambios generales significativos en DOPAC [F (11,44) = 9.57; p <0.001] y HVA [F (11,44) = 12.47; p <0. 001] se encontraron concentraciones en respuesta a la hembra 1, pero no a la hembra 2. Las concentraciones de metabolitos aumentaron levemente (+ 15% en ambos casos) durante la presentación de la hembra 1 detrás de la pantalla (muestra 2), pero esto no fue significativo estadísticamente. Sin embargo, hubo aumentos significativos en las concentraciones de DOPAC y HVA durante la cópula (muestras 3-8), alcanzando valores máximos (+80 y + 86%, respectivamente; p <0.01) después de 60 min (muestra 6 en ambos casos). Aunque las concentraciones de metabolitos disminuyeron durante el período de inactividad sexual al final del contacto con la hembra 1 (muestras 9 y 10), las concentraciones aún permanecieron elevadas con respecto a la línea de base (p <0.05 en ambos casos). La reintroducción de la hembra 1 detrás de la pantalla (muestra 11), el acceso a la hembra 1 después de retirar la pantalla (muestra 12) y la introducción de la hembra 2 (muestra 13) no dieron como resultado ningún cambio en las concentraciones de metabolitos. Leves, pero estadísticamente insignificantes, aumentos en las concentraciones de DOPAC y HVA (+ 23% en ambos casos) con respecto a la línea de base (muestra 12) correspondieron al primer episodio de cópula con la hembra 2 (muestra 14). Sin embargo, este aumento fue de corta duración y se redujo a los valores de referencia para las tres muestras restantes (15-17). Independiente tlas pruebas realizadas entre muestras de "línea de base" (es decir, 1, 10 y 12) indicaron que los valores de la segunda y la tercera línea de base (muestras 10 y 12, respectivamente), aunque no son diferentes entre sí, se mantuvieron significativamente elevados en comparación con la primera muestra de referencia para DOPAC y HVA (p <0.05 en ambos casos).
Histología
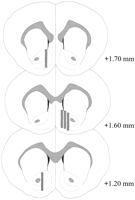
Las sondas de microdiálisis se localizaron en la NAC (Fig.2) en un rango que se extiende de + 1.20 a + 1.70 mm desde bregma (cráneo plano). Hubo variabilidad también en el plano mediolateral; los datos reflejan el muestreo de las subregiones shell y core de la NAC.
Ver versión más grande:
Higo. 2.
Ubicación de las sondas de microdiálisis dentro del NAC de ratas macho utilizadas en el experimento de efecto Coolidge. Rectángulos sombreados Corresponden al área de membrana expuesta de las sondas de microdiálisis. Las secciones seriales del cerebro coronal se redibujaron dePaxinos y Watson (1986).
DISCUSIÓN
De acuerdo con informes anteriores, los resultados actuales demuestran una transmisión mesolímbica mejorada de DA asociada con los componentes apetitivos y consumatorios del comportamiento sexual de ratas macho según lo evaluado porin vivo microdiálisisMas et al., 1990; Pfaus et al., 1990;Pleim et al., 1990; Damsma et al., 1992; Wenkstern et al., 1993; Fumero et al., 1994; Mas et al., 1995a,b,d). Además, estos resultados proporcionan un correlato neuroquímico para la saciedad sexual y la reiniciación posterior de la copulación en respuesta a una nueva hembra receptiva (el efecto Coolidge). Los datos actuales sugieren que las propiedades de estímulo de una nueva hembra receptiva pueden servir para aumentar la transmisión de NAC DA en una rata macho sexualmente saciada que, a su vez, puede estar relacionada con la reiniciación del comportamiento sexual. Esto es evidente por primera vez en el ligero aumento en NAC DA durante la presentación de una nueva hembra detrás de la pantalla y ocurre de manera más convincente como un aumento más pronunciado durante la copulación renovada con 2 femenina (Fig.1).
La presencia de la primera mujer receptiva detrás de la pantalla dio lugar a un robusto aumento del apetito en el flujo de salida de NAC DA (44% desde el inicio) similar en magnitud a lo que se informó en experimentos anteriores con un diseño similar (30%, Pfaus et al., 1990; 35%,Damsma et al., 1992). También estuvo de acuerdo con estos estudios la observación de que el flujo de salida de NAC DA se incrementó aún más durante la cópula (hasta> 95% por encima de la línea de base en el presente experimento). Aunque podemos ver los comportamientos consumatorios como asociados con una liberación mejorada de NAC DA (Wenkstern et al., 1993; Wilson et al., 1995), es importante examinar los términos "apetitivo" y "consumatorio" en el contexto del comportamiento sexual. Mientras que la fase en la que está presente la hembra detrás de la pantalla es exclusivamente apetitiva o preparatoria, el comportamiento durante la fase de copulación no puede considerarse puramente consumatorio. Debido a que el "apetito" se puede usar para describir todos los comportamientos que conducen a la consumación de un comportamiento motivado (cópula), el comportamiento primario que exhibe el hombre mientras está activo en la fase "consumatoria" se describe mejor como apetito; el macho pasa la mayor parte de su tiempo y esfuerzo persiguiendo a la hembra para copular. En este sentido, podemos correlacionar la transmisión máxima de NAC DA con la consumatoria al igual que Componentes apetitivos intensos del comportamiento sexual de rata macho.
El acceso a la segunda, novela femenina resultó en una renovada copulación en cada tema. Estudios anteriores han demostrado que la mayoría de las ratas que se permitieron copular a la saciedad, utilizando un protocolo de comportamiento similar al utilizado en el presente experimento, no reanudaron el apareamiento cuando se probaron 24 hr más tarde (Playa y Jordania, 1956). Es probable que la presencia de las nuevas propiedades de estímulo de la 2 femenina, que pueden haber incluido señales olfativas y visuales y auditivas, haya dado lugar a una nueva copulación. Una pregunta interesante, que queda por responder, es por qué mecanismo una rata macho distingue a una hembra nueva de una hembra con la que se ha apareado recientemente. Un sitio para ese mecanismo puede estar en el sistema olfativo principal. Se ha informado que la integridad de este sistema es esencial para el efecto Coolidge en hámsters (Johnston y Rasmussen, 1984). El sistema olfativo vomeronasal-accesorio, sin embargo, en el cual un proceso de memoria feromonal fue descrito recientemente en ratones (Kaba et al., 1994), también es un candidato principal. En este sentido, cabe destacar que los aumentos en la transmisión NAC DA se midieron utilizando in vivo La voltametría en ratas macho se presentó con ropa de cama que estuvo expuesta a ratas hembras en celo (Louillot et al., 1991; Mitchell y Gratton, 1992). Además, la aplicación de K+ directamente a la capa nerviosa vomeronasal del bulbo olfativo accesorio, así como al bulbo olfativo accesorio en sí, fue suficiente para aumentar la transmisión de NAC DA (Mitchell y Gratton, 1992).
El primer combate mínimo de copulación de 15 con 2 hembra se asoció con un aumento significativo en DA NAC. En contraste con 1 hembra, la interacción con 2 hembra no produjo aumentos en NAC DA de la misma magnitud durante las fases apetitiva (12%) o consumatoria (34%). Sin embargo, estos pequeños aumentos en NAC DA se correlacionan bien con el nivel reducido de comportamiento sexual mostrado con 2 femenino en comparación con 1 femenino. Las concentraciones de metabolitos se mantuvieron elevadas durante la fase de saciedad, lo que dio como resultado nuevas concentraciones de referencia (muestras 10 y 12) que se elevaron significativamente con respecto al valor inicial inicial (muestra 1).
El retraso temporal en el aumento de las concentraciones de DOPAC y HVA durante la copulación es consistente con su formación como metabolitos del compuesto original, DA. Se ha sugerido que las concentraciones del metabolito de la microdiálisis, al menos durante un comportamiento natural que no es impulsado farmacológicamente, proporcionan un índice útil de actividad neural (Damsma et al., 1992; Fumero et al., 1994). El hecho de que las concentraciones de metabolitos se mantuvieron elevadas incluso durante los períodos de inactividad sexual en este experimento, cuando las concentraciones de DA volvieron a los valores de referencia antes de la prueba, arrojan dudas sobre esta sugerencia.
La elevación persistente de las concentraciones de metabolitos de DA observada en este experimento refleja el perfil del área preóptica medial (mPOA) de los metabolitos de DA observados en ratas el primer día después de que hubieran copulado a la saciedad (Mas et al., 1995a,b). Las elevaciones sostenidas de las concentraciones de DOPAC y HVA en el NAC o mPOA no siempre se observan cuando el período de apareamiento es de una duración fija, mucho más corto que el tiempo requerido para alcanzar la saciedad. Por ejemplo, muchos estudios han demostrado que las concentraciones de DOPAC aumentaron y se mantuvieron elevadas durante la copulación, pero se redujeron a los valores de referencia poco después de que la hembra fue removida (Pfaus et al., 1990; Pleim et al., 1990; Damsma et al., 1992;Hull et al., 1993; Wenkstern et al., 1993; Hull et al., 1995). En el estudio por Mas et al. (1995b)Las concentraciones extracelulares basales de DOPAC y HVA en el mPOA se mantuvieron elevadas durante 4 días consecutivos correspondientes a un período de inactividad sexual. Al cuarto día, justo antes de que los animales reanudaran la copulación, las concentraciones basales de los metabolitos estaban cerca de los valores de presatiación. Los autores compararon el patrón de cambios neuroquímicos con los observados después de la administración de bloqueadores del receptor DA (Zetterström et al., 1984; Imperato y DiChiara, 1985) y han sugerido que el estado de inactividad sexual puede estar mediado a través de la liberación de prolactina, que puede actuar como un "neuroléptico endógeno" (Mas et al., 1995a,b,d). Está claro que la administración neuroléptica está acompañada por aumentos en las concentraciones de metabolitos extracelulares y flujo de salida de DA (Zetterström et al., 1984; Imperato y DiChiara, 1985). Desafortunadamente, Mas et al. (1995a,b) no pudieron detectar las concentraciones de mPOA DA. En el presente estudio, las concentraciones de DA en el NAC volvieron a los valores de precoblación, mientras que las concentraciones de DOPAC y HVA se mantuvieron elevadas. Este patrón es inconsistente con el papel de un neuroléptico endógeno que actúa en la NAC para inducir la saciedad sexual.
Dada la participación de las neuronas mesolímbicas DA en el comportamiento motivado (Fibiger y Phillips, 1986; Blackburn et al., 1992; Kalivas et al., 1993; LeMoal, 1995) y su sensibilidad a nuevos estímulos ambientales (Fabre et al., 1983; Schultz, 1992; Mirenowicz y Schultz, 1994), los aumentos observados en las concentraciones extracelulares de DA NAC en respuesta a la nueva hembra son consistentes con la hipótesis de que la actividad en este sistema de DA es importante para la reiniciación del comportamiento sexual. Además, informes de aumentos apetitivos y consumatorios en la transmisión de DA (Hull et al., 1993, 1995;Mas et al., 1995b; Sato et al., 1995) y la actividad neuronal (Shimura et al., 1994) en el mPOA de ratas macho durante el comportamiento sexual, se sugiere que esta estructura también puede contribuir a la característica de copulación renovada del efecto Coolidge.
De acuerdo con un papel general del sistema mesolímbico de DA en el comportamiento motivado, está bien establecido que las concentraciones extracelulares de DA también se elevan antes, durante e inmediatamente después del consumo de una comida, con un retorno a los valores de referencia N30 min más tarde (Wilson et al., 1995). Es bien sabido que la saciedad inducida por los alimentos está influenciada por sus propiedades sensoriales. Los seres humanos y los animales rechazan los alimentos en los que fueron alimentados para la saciedad e ingieren otros alimentos que no se habían comido (Rollos, 1986). Esto plantea la cuestión de si el flujo extracelular de DA en la NAC se incrementaría selectivamente por la presentación de un nuevo tipo de alimento, pero no por el alimento consumido recientemente a la saciedad de una manera análoga a la informada en el presente estudio en el contexto de motivacion sexual Si se confirma, esta relación general entre las propiedades sensoriales de la recompensa natural, la saciedad y la transmisión mesolímbica de la DA implicaría un papel crítico para este sistema neuronal en la regulación de los procesos motivacionales, cuya interrupción puede conducir a trastornos graves de la alimentación y la función sexual. .
Referencias
- ↵
- Playa FA,
- Jordan l
(1956) Agotamiento sexual y recuperación en la rata macho. QJ Exp Psychol 8: 121-133.
- ↵
- Bermant G,
- Lott DF,
- Anderson L
(1966) Características temporales del efecto Coolidge en el comportamiento copulador de rata macho. Psiquiatría de fisio comp. 65: 447-452.
- ↵
- Blackburn JR,
- Pfaus JG,
- Phillips AG
(1992) La dopamina funciona en los comportamientos apetitivos y defensivos. Prog Neurobiol 39: 247-279.
- ↵
- Damsma g
- Pfaus JG,
- Wenkstern D,
- Phillips AG,
- Fibiger HC
(1992) El comportamiento sexual aumenta la transmisión de dopamina en el núcleo accumbens y el cuerpo estriado de ratas macho: comparación con la novedad y la locomoción. Behav Neurosci 106: 181-191.
- ↵
- Fabre M,
- Rollos ET,
- Ashton JP,
- Williams G
(1983) Actividad de las neuronas en la región tegmental ventral del mono que se comporta. Behav Brain Res 9: 213-235.
- ↵
- Fibiger HC,
- Phillips AG
(1986) Recompensa, motivación, cognición: psicobiología de los sistemas mesotelencefálicos de dopamina. en el Manual de fisiología: el sistema nervioso IV, eds Bloom FE, Geiger SD (Sociedad Americana de Fisiología, Bethesda, MD), pp 647 – 675.
- ↵
- Fiorino DF,
- Coury AG,
- Fibiger HC,
- Phillips AG
(1993) La estimulación eléctrica de los sitios de recompensa en el área tegmental ventral aumenta la transmisión de dopamina en el núcleo accumbens de la rata. Behav Brain Res 55: 131-141.
- ↵
- Fisher A
(1962) Efectos de la variación del estímulo sobre la saciedad sexual en la rata macho. Psiquiatría de fisio comp. 55: 614-620.
- ↵
- Fowler H,
- Whalen RE
(1961) Variación en estímulo incentivo y comportamiento sexual en la rata macho. Psiquiatría de fisio comp. 54: 68-71.
- ↵
- Fumero B,
- Fernendez-Vera JR,
- Gonzalez-Mora JL,
- Mas m
(1994) Cambios en el recambio de monoaminas en áreas del cerebro anterior asociadas con el comportamiento sexual masculino: un estudio de microdiálisis. Brain Res. 662: 233-239.
- ↵
- Holmes GM,
- Holmes DG,
- Sachs BD
(1987) Un sistema de recopilación de datos basado en IBM-PC para registrar el comportamiento sexual de roedores y para la grabación de eventos en general. Physiol Behav 44: 825-828.
- ↵
- Casco EM,
- Eaton RC,
- Moisés J,
- Lorrain DS
(1993) La copulación aumenta la actividad de la dopamina en el área preóptica medial de ratas macho. Vida sci 52: 935-940.
- ↵
- Casco EM,
- Jianfang D,
- Lorrain DS,
- Matuszewich L
(1995) Dopamina extracelular en el área preóptica medial: implicaciones para la motivación sexual y el control hormonal de la cópula. J Neurosci 15: 7465-7471.
- ↵
- Imperato A,
- DiChiara G
(1985) Liberación y metabolismo de la dopamina en ratas despiertas después de neurolépticos sistémicos según se estudió mediante diálisis transestriatal. J Neurosci 5: 297-306.
- ↵
- Johnston RE,
- Rasmussen K
(1984) Reconocimiento individual de hámsters hembra por machos: papel de las señales químicas y de los sistemas olfativo y vomeronasal. Physiol Behav 33: 95-104.
- ↵
- Kaba H,
- Hayashi Y,
- Higuchi T,
- Nakanishi s
(1994) Inducción de una memoria olfativa por la activación de un receptor de glutamato metabotrópico. Ciencia: 265: 262-264.
- ↵
- Kalivas PW,
- Sorg BA,
- Ganchos MS
(1993) La farmacología y los circuitos neuronales de sensibilización a los psicoestimulantes. Behav Pharmacol 4: 315-334.
- ↵
- LeMoal M
(1995) Neuronas dopaminérgicas mesocorticolímbicas. Roles funcionales y regulatorios. en psicofarmacología: la cuarta generación del progreso, eds Bloom FE, Kupfer DJ (Raven, Nueva York), pp 283 – 294.
- ↵
- Louillot A,
- Gonzalez-Mora JL,
- Guadalupe T,
- Mas m
(1991) Los estímulos olfativos relacionados con el sexo inducen un aumento selectivo en la liberación de dopamina en el núcleo accumbens de ratas macho. Brain Res. 553: 313-317.
- ↵
- Mas M,
- Gonzalez-Mora JL,
- Louillot A,
- Sole C,
- Guadalupe T
(1990) Aumento de la liberación de dopamina en el núcleo accumbens de ratas macho copulantes como lo demuestra la voltametría in vivo. Neurosci Lett 110: 303-308.
- ↵
- Mas M,
- Fumero B,
- Fernández-Vera JR,
- Gonzalez-Mora JL
(1995a) correlatos neuroquímicos del agotamiento sexual y la recuperación según lo evaluado por microdiálisis in vivo. Brain Res. 675: 13-19.
- ↵
- Mas M,
- Fumero B,
- Gonzalez-Mora JL
(1995b) Vigilancia voltimétrica y microdiálisis de la liberación de neurotransmisores de monoaminas en el cerebro durante las interacciones sociosexuales. Behav Brain Res 71: 69-79.
- ↵
- Mas M,
- Fumero B,
- Perez-Rodriguez I
(1995c) Inducción del comportamiento de apareamiento por apomorfina en ratas sexualmente saciadas. Eur J Pharmacol 280: 331-334.
- ↵
- Mas M,
- Fumero B,
- Perez-Rodriguez I,
- Gonzalez-Mora JL
(1995d) La neuroquímica de la saciedad sexual. Un modelo experimental de deseo inhibido. en La farmacología de la función y disfunción sexual, ed Bancroft J (Raven, Nueva York), pp 115 – 126.
- ↵
- Mirenowicz J,
- Schultz W
(1994) Importancia de la imprevisibilidad para respuestas de recompensa en neuronas dopaminérgicas de primates. J neurofisiol 72: 1024-1027.
- ↵
- Mitchell JB,
- Gratton A
(1992) Liberación de dopamina mesolímbica provocada por la activación del sistema olfativo accesorio: un estudio cronoamperométrico de alta velocidad. Neurosci Lett 140: 81-84.
- ↵
- Paxinos G,
- Watson C
(1986) El cerebro de rata en coordenadas estereotáxicas (2nd ed). (Académico, San Diego).
- ↵
- Pfaus JG,
- Damsma g
- Nomikos GG,
- Wenkstern D,
- Blaha CD,
- Phillips AG,
- Fibiger HC
(1990) El comportamiento sexual aumenta la transmisión de dopamina central en la rata macho. Brain Res. 530: 345-348.
- ↵
- Pfaus JG,
- Everitt BJ
(1995) La psicofarmacología del comportamiento sexual. en psicofarmacología: la cuarta generación del progreso, eds Bloom FE, Kupfer DJ (Raven, Nueva York), pp 743 – 758.
- ↵
- Pfaus JG,
- Gorzalka BB
(1987) Opioides y comportamiento sexual. Neurosci Biobehav Rev 11: 1-34.
- ↵
- Phillips AG,
- Blaha CD,
- Pfaus JG,
- Blackburn JR
(1992) Correlatos neurobiológicos de estados emocionales positivos: dopamina, anticipación y recompensa. en Revista internacional de estudios sobre la emoción, ed Strongman (Wiley, Nueva York), pp 31 – 50.
- ↵
- Pleim et,
- Matochik ja,
- Barfield RJ,
- Auerbach SB
(1990) Correlación de la liberación de dopamina en el núcleo accumbens con el comportamiento sexual masculino en ratas. Brain Res. 524: 160-163.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1994) Reversión del agotamiento sexual por agentes serotoninérgicos y noradrenérgicos. Behav Brain Res 62: 127-134.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1995a) Participación del sistema noradrenérgico central en el restablecimiento del comportamiento copulador de ratas sexualmente agotadas por yohimbina, naloxona y 8-OH-DPAT. Brain Res Bull 38: 399-404.
- ↵
- Rodriguez-Manzo G,
- Fernandez-Guasti A
(1995b) Antagonistas opioides y el fenómeno de la saciedad sexual. Psicofarmacol 122: 131-136.
- ↵
- Rollos BJ
(1986) Saciedad sensorial específica. Nutr Rev 44: 93-101.
- ↵
- Salamone JD
(1996) La neuroquímica conductual de la motivación: cuestiones metodológicas y conceptuales en los estudios de la actividad dinámica del núcleo accumbens dopamina. Métodos de Neurosci J 64: 137-149.
- ↵
- Sato y,
- Wada h,
- Horita h
- Suzuki N,
- Shibuya A,
- Adachi H,
- Kato R,
- Tsukamoto T,
- Kumamoto Y
(1995) Liberación de dopamina en el área preóptica medial durante el comportamiento copulatorio masculino en ratas. Brain Res. 692: 66-70.
- ↵
- Schultz W
(1992) Actividad de las neuronas de dopamina en el primate de comportamiento. Semin Neurosci 4: 129-138.
- ↵
- Shimura T,
- Yamamoto T,
- Shimokochi M
(1994) El área preóptica medial está involucrada tanto en la excitación sexual como en el rendimiento en ratas macho: reevaluación de la actividad de las neuronas en animales que se mueven libremente. Brain Res. 640: 215-222.
- ↵
- Wenkstern D,
- Pfaus JG,
- Fibiger HC
(1993) La transmisión de dopamina aumenta en el núcleo accumbens de ratas macho durante su primera exposición a ratas hembras sexualmente receptivas. Brain Res. 618: 41-46.
- ↵
- Wilson C,
- Nomikos GG,
- Collu M,
- Fibiger HC
(1995) Correlaciones dopaminérgicas del comportamiento motivado: importancia del impulso. J Neurosci 15: 5169-5178.
- ↵
- Wilson JR,
- Kahn RE,
- Playa FA
(1963) Modificación en el comportamiento sexual de ratas macho producida por el cambio del estímulo femenino. Psiquiatría de fisio comp. 56: 636-644.
- ↵
- Zetterström T,
- Sharp T,
- Ungerstedt U
(1984) Efecto de los fármacos neurolépticos sobre la liberación y el metabolismo de la dopamina estriatal en la rata despierta estudiada por diálisis intracerebral. Eur J Pharmacol 106: 27-37.
Artículos que citan este artículo
- Neuroplasticidad endógena inducida por opioides de las neuronas dopaminérgicas en el área tegmental ventral influye en la recompensa natural y de opiáceos Journal of Neuroscience, 25 June 2014, 34 (26): 8825-8836
- Desequilibrio en la sensibilidad a diferentes tipos de recompensas en el juego patológico Cerebro, 1 Agosto 2013, 136 (8): 2527-2538
- Ley de Recompensas Naturales y de Drogas sobre Mecanismos de Plasticidad Neural Comunes con {Delta} FosB como mediador clave Journal of Neuroscience, 20 febrero 2013, 33 (8): 3434-3442
- Respuestas neuronales en el núcleo de Accumbens Shell durante el comportamiento sexual en ratas masculinas Journal of Neuroscience, 1 febrero 2012, 32 (5): 1672-1686
- Amor romántico: un sistema cerebral de mamíferos para la elección de pareja Transacciones filosóficas de la Royal Society B: Ciencias biológicas, 29 de diciembre 2006, 361 (1476): 2173-2186
- Puntos calientes hedónicos en el cerebro El neurocientífico, 1 diciembre 2006, 12 (6): 500-511
- Modulación por los núcleos amígdalas basolaterales y basolaterales de los correlatos dopaminérgicos de la alimentación a la saciedad en el núcleo de rata Accumbens y la corteza prefrontal medial Journal of Neuroscience, 15 December 2002, 22 (24): 10958-10965
- Frecuencia de los transitorios de concentración de dopamina Aumentos en el estriado dorsal y ventral de ratas macho durante la introducción de congéneres específicos Journal of Neuroscience, 1 December 2002, 22 (23): 10477-10486
- Reseña del libro: Dinámica de la dopamina extracelular en las acciones agudas y crónicas de la cocaína El neurocientífico, 1 August 2002, 8 (4): 315-322
- Participación diferencial de los receptores de NMDA, AMPA / kainato y dopamina en el núcleo de Nucleus Accumbens en la adquisición y desempeño del comportamiento del enfoque de Pavlovian Journal of Neuroscience, 1 December 2001, 21 (23): 9471-9477
- Control del comportamiento de búsqueda de cocaína mediante estímulos asociados con drogas en ratas: efectos en la recuperación de los niveles de dopamina extracelular y respondedores de operantes extinguidos en la amígdala y el núcleo accumbens PNAS, 11 Abril 2000, 97 (8): 4321-4326
- Facilitación del comportamiento sexual y la mejora del flujo de dopamina en el núcleo Accumbens de ratas masculinas después de la sensibilización conductual inducida por la D-anfetamina Journal of Neuroscience, 1 enero 1999, 19 (1): 456-463
- NEUROCIENCIA: captar la atención del cerebro Ciencia, 3 Octubre 1997, 278 (5335): 35-37
- Correlatos dopaminérgicos de la saciedad sensorial específica en la corteza prefrontal medial y el núcleo accumbens de la rata Journal of Neuroscience, 1 de octubre 1999, 19 (19): RC29