Frente. Psiquiatría, 25 Febrero 2016 | http://dx.doi.org/10.3389/fpsyt.2016.00024
Jarid goodman y Mark G. Packard*
- Departamento de Psicología, Instituto de Neurociencia de Texas A&M, Universidad de Texas A&M, College Station, TX, EE. UU.
La opinión de que los sistemas de memoria anatómicamente diferenciados contribuyen de manera diferente al desarrollo de la adicción a las drogas y la recaída ha recibido un amplio apoyo. La breve revisión actual retoma esta hipótesis, tal como se propuso originalmente hace 20 años (1) y destaca varios desarrollos recientes. Una amplia investigación que emplea una variedad de paradigmas de aprendizaje animal indica que los sistemas neuronales disociables median diversos tipos de aprendizaje y memoria. Cada sistema de memoria puede aportar componentes únicos a la conducta aprendida que respalda la adicción a las drogas y la recaída. En particular, el cambio del uso recreativo de drogas al abuso compulsivo de drogas puede reflejar un cambio neuroanatómico del control cognitivo de la conducta mediada por el hipocampo / cuerpo estriado dorsomedial hacia el control habitual de la conducta mediada por el cuerpo estriado dorsolateral (DLS). Además, el estrés / la ansiedad puede constituir un cofactor que facilita la memoria dependiente de DLS, y esto puede servir como un mecanismo neuroconductual subyacente al aumento del uso de drogas y la recaída en humanos después de eventos estresantes de la vida. La evidencia que respalda la visión de múltiples sistemas de la adicción a las drogas proviene principalmente de los estudios de aprendizaje y memoria que han empleado como refuerzo las sustancias adictivas que a menudo se consideran en el contexto de la investigación de la adicción a las drogas, incluida la cocaína, el alcohol y las anfetaminas. Además, la evidencia reciente sugiere que el enfoque de los sistemas de memoria también puede ser útil para comprender las fuentes tópicas de adicción que reflejan los problemas de salud emergentes, incluido el consumo de marihuana, la dieta alta en grasas y los videojuegos.
Introducción
Los investigadores a menudo buscan mecanismos de aprendizaje y comportamiento para explicar cómo se adquiere y expresa la psicopatología humana. Norman M. White proporcionó un ejemplo de una aplicación de este tipo, que empleó principios de la teoría clásica del aprendizaje y pruebas experimentales que respaldan la existencia de múltiples sistemas de memoria en el cerebro para brindar un enfoque novedoso e influyente de la adicción a las drogas (1). Específicamente, White indicó que las drogas pueden desempeñar el papel de "reforzadores" que, como los alimentos o el agua en una tarea de aprendizaje, fortalecen las asociaciones entre los estímulos, el contexto y el comportamiento relacionados con las drogas para promover el consumo de drogas y, con el tiempo, la adicción. White también incorporó la hipótesis emergente de que hay diferentes tipos de memoria que están mediados por sistemas neurales disociables. De acuerdo con esta visión novedosa, los medicamentos pueden modular directamente múltiples sistemas neuronales, y estos sistemas neuronales pasan a codificar distintos componentes de la memoria relacionada con el medicamento que, cuando se expresan, promueven una mayor toma de drogas.
El año en que 2016 marca el 20 aniversario de la vista de los sistemas de memoria múltiple de la adicción a las drogas como lo describe White. La presente revisión revisa esta hipótesis influyente, al tiempo que destaca algunos desarrollos recientes importantes que no solo han fundamentado la hipótesis original, sino que también han generado información adicional sobre cómo los sistemas de memoria múltiple pueden apoyar la adicción a las drogas.
La visión de la adicción de los sistemas de memoria múltiple
La evidencia convergente de estudios que emplean seres humanos y animales inferiores indica que la memoria de los mamíferos está mediada por sistemas neuronales relativamente independientes [para revisiones, ver Ref. (2–4)]. Los primeros experimentos de disociación de sistemas de memoria múltiple se llevaron a cabo principalmente en el laberinto radial e indicaron funciones mnemónicas únicas para el hipocampo, el cuerpo estriado dorsal y la amígdala (5, 6). El hipocampo media una forma cognitiva / espacial de la memoria, mientras que el cuerpo estriado dorsal media la memoria del hábito del estímulo-respuesta (S – R). La amígdala media las relaciones pavlovianas y de estímulo-afecto-asociativo (6, 7), al tiempo que sirve también el papel modulador de la excitación emocional en otros tipos de memoria (8–12).
En el contexto de la vista de múltiples sistemas de memoria, Blanco (1) sugirió que el hipocampo, el cuerpo estriado dorsal y la amígdala codifican componentes únicos de los recuerdos relacionados con las drogas (ver Figura 1). El hipocampo codifica el conocimiento explícito relacionado con la relación entre claves y eventos (es decir, asociaciones estímulo-estímulo) en el contexto de la droga. Es importante destacar que el hipocampo no codifica las respuestas de comportamiento, sino que la información adquirida por el hipocampo se puede usar para generar las respuestas de comportamiento apropiadas para recibir el refuerzo de medicamentos. Por otro lado, el cuerpo estriado dorsal codifica las asociaciones entre los estímulos relacionados con las drogas y las respuestas de comportamiento. Esto puede permitir que la presentación de una señal relacionada con el fármaco active una respuesta de comportamiento automática que resulte en el consumo de fármaco (por ejemplo, aproximación de carrera o pulsación de palanca instrumental). La amígdala codifica las relaciones asociativas de Pavlov, permitiendo así que señales neutrales en el contexto de la droga se asocien con la recompensa de la droga. Los animales luego reaccionan a estas señales condicionadas de manera similar a como reaccionaron originalmente al medicamento. Específicamente, las señales condicionadas activan las respuestas emocionales condicionadas, incluidos los estados afectivos internos y el enfoque condicionado hacia (o, en algunos casos, evitación) de la señal condicionada. Otro componente crítico de la hipótesis de White es que las drogas pueden modular la función de memoria de cada una de estas regiones del cerebro. Por lo tanto, los medicamentos pueden potencialmente mejorar su propia autoadministración mediante el aumento de la consolidación de los recuerdos relacionados con los medicamentos codificados por el hipocampo, la amígdala y el estriado dorsal (ver Figura 1).
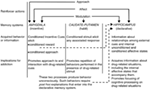
Figura 1. De blancos (1) sistemas de memoria múltiple vista de la adicción a las drogas. Al igual que los reforzadores naturales, las drogas adictivas poseen varias "acciones reforzadoras", incluida la capacidad de invocar afecto positivo / negativo, acercamiento y modulación de los sistemas de memoria. La amígdala, el caudado-putamen (es decir, el cuerpo estriado dorsal) y el hipocampo median los sistemas de memoria disociables, y cada sistema de memoria presumiblemente codifica componentes únicos de recuerdos relacionados con fármacos. Dadas sus propiedades moduladoras de la memoria, las drogas adictivas pueden potencialmente mejorar su propia autoadministración al mejorar la función de estos sistemas. (Reimpreso de White con permiso de John Wiley & Sons.)
Consistente con la visión de los sistemas de memoria múltiple de la adicción a las drogas, la amplia evidencia indica roles críticos para el hipocampo, el cuerpo estriado dorsal y la amígdala en la adicción a las drogas y la recaída de una variedad de sustancias de abuso [para una revisión, ver Ref. (13)]. El hipocampo dorsal parece tener un papel en el control contextual de la búsqueda de drogas para la cocaína (14–16). La región lateral del cuerpo estriado dorsal (DLS, por sus siglas en inglés) media la presión habitual de la palanca S – R para la cocaína y el alcohol (17, 18), y la amígdala basolateral (BLA) media en la búsqueda de drogas condicionadas para la cocaína, el alcohol y la heroína (19–22). También de acuerdo con la hipótesis de White, las sustancias de abuso pueden modular las funciones mnemotécnicas del hipocampo, el cuerpo estriado dorsal y la amígdala (23–31).
Estudios recientes han contribuido con nuevas modificaciones al enfoque de sistemas de memoria múltiple para la adicción a las drogas. Las características clave de esta visión contemporánea incluyen (1) un cambio neuroanatómico con el tiempo a la memoria de hábitos dependiente de DLS, (2) interacciones competitivas entre sistemas de memoria, (3) el papel del estrés y la ansiedad en la mejora de la búsqueda habitual de drogas, y (4) La aplicación de esta hipótesis a nuevas fuentes emergentes de adicción.
El cambio neuroanatómico de la cognición al hábito
En situaciones de aprendizaje experimental, los sujetos suelen emplear un comportamiento útil cuando inicialmente resuelven una tarea. Sin embargo, después de un entrenamiento extenso, el comportamiento se vuelve autónomo y se puede realizar con poca atención, intención o esfuerzo cognitivo, constituyendo un "hábito" [para una revisión, ver Ref. (32)]. En las primeras demostraciones de este cambio del control cognitivo del comportamiento al hábito, se entrenó a los roedores usando la recompensa de los alimentos en una tarea de solución doble más laberinto (33–35). En esta tarea, las ratas fueron liberadas desde la misma posición inicial (por ejemplo, el brazo sur) y tuvieron que hacer un giro consistente del cuerpo en la intersección del laberinto para recibir la recompensa de alimentos siempre ubicada en el mismo brazo objetivo (por ejemplo, siempre gire a la izquierda). girar para encontrar comida en el brazo oeste). Las ratas podrían resolver esta tarea aprendiendo una respuesta consistente de giro corporal o haciendo la respuesta necesaria para ir a la misma ubicación espacial. Para determinar qué estrategia emplearon las ratas, los investigadores implementaron una prueba de sonda en la que los animales se liberaron del brazo de inicio opuesto (por ejemplo, el brazo norte). Si los animales hacían el giro del cuerpo opuesto para ir a la ubicación de la meta original, se identificaban como aprendices de lugar. Si los animales hicieron el mismo giro corporal que durante el entrenamiento (es decir, yendo al brazo opuesto a la ubicación de la meta original), los animales se identificaron como aprendices de respuesta. La evidencia indica que después de algún entrenamiento, la mayoría de los animales muestran el aprendizaje de lugar, mientras que después de un entrenamiento extenso, los animales cambian al aprendizaje de respuesta habitual (34–36). Curiosamente, este cambio de aprendizaje de lugar a aprendizaje de respuesta puede reflejar un cambio neuroanatómico. El uso inicial del lugar de aprendizaje en esta tarea está mediado por el hipocampo y el cuerpo estriado dorsomedial [DMS (36, 37)], mientras que el uso del aprendizaje de respuesta después de una capacitación prolongada está mediado por el DLS (36).
Además de las primeras demostraciones usando el laberinto positivo (34, 35), el cambio de comportamiento a la memoria de hábitos se demostró más tarde usando paradigmas de presión operante (38–42). En estas tareas de aprendizaje instrumental, los animales inicialmente presionan la palanca a propósito para obtener el resultado y dejarán de presionarla una vez que se devalúe el resultado de la comida. Sin embargo, después de un entrenamiento extenso, los animales cambiarán a la respuesta habitual y continuarán presionando la palanca incluso después de que se haya devaluado el resultado del alimento (40). Como se demostró originalmente en el laberinto positivo (36), la transición de la cognición al hábito en las tareas de aprendizaje instrumental también podría atribuirse a un cambio neuroanatómico. El control cognitivo inicial del comportamiento en estas tareas de aprendizaje instrumental está mediado por el hipocampo y el DMS (43, 44), mientras que la respuesta habitual está mediada por el DLS (18, 45, 46).
Numerosos investigadores han sugerido que el cambio neuroanatómico a la memoria del hábito demostrado en el laberinto y las tareas de aprendizaje instrumental también podría ser la base del cambio del uso recreativo de drogas al abuso compulsivo de drogas (13, 47–50). De acuerdo con esta hipótesis, los investigadores han demostrado para una variedad de sustancias de abuso que el DMS media en la respuesta dirigida a los objetivos para el refuerzo de fármacos y el DLS media en la respuesta habitual al refuerzo de medicamentos (18, 31, 51–53).
Teniendo en cuenta el alto potencial de abuso de algunas drogas, los investigadores han sugerido que las drogas adictivas podrían mejorar la función de la memoria del hábito dependiente de la DLS y, por lo tanto, acelerar el cambio del control cognitivo al comportamiento habitual. De acuerdo con esta hipótesis, la exposición repetida a la anfetamina o la cocaína facilita el cambio de la respuesta dirigida por objetivo a la habitual para el refuerzo de alimentos en las tareas de presión de palanca instrumental (31, 54–59). Además, el presionar la palanca para sustancias adictivas (por ejemplo, alcohol o cocaína) versus recompensa de alimentos se ha asociado con una mayor respuesta habitual frente a una respuesta dirigida a la meta (24, 60, 61). En los seres humanos, los individuos dependientes del alcohol muestran una mayor respuesta habitual en una tarea de aprendizaje instrumental, en relación con los individuos de control no dependientes (62). Esta mejora de la memoria del hábito dependiente de DLS por las drogas adictivas también se ha observado en tareas de aprendizaje de laberinto de roedores. La exposición a la cocaína, a las anfetaminas y al alcohol se ha asociado con un mejor aprendizaje en tareas de laberinto dependientes de DLS o un mayor uso de estrategias de respuesta dependientes de DLS en versiones de laberinto de solución dual (25, 63, 64). En los seres humanos, el uso de sustancias de abuso, incluido el alcohol y el tabaco, se ha correlacionado con el mayor uso de estrategias de navegación dependientes del cuerpo estriado dorsal en un laberinto virtual (65). Por lo tanto, algunas drogas de abuso podrían mejorar la memoria del hábito dependiente de la DLS, y este mayor compromiso del sistema de memoria de la DLS podría acelerar la transición del uso recreativo de drogas al uso habitual de drogas. Este mecanismo propuesto es consistente con el de White (1) argumento original de que las drogas de abuso a veces pueden facilitar su autoadministración al mejorar la función de los sistemas de memoria.
Competencia entre sistemas de memoria
Aunque es posible que las drogas adictivas mejoren la memoria del hábito directamente al mejorar la función del DLS [por ejemplo, Ref. (29)], otra posibilidad es que las drogas de abuso mejoren la memoria del hábito indirectamente a través de la modulación de otros sistemas de memoria. Este mecanismo alternativo invoca la hipótesis de que, en algunas situaciones de aprendizaje, los sistemas de memoria compiten por el control del aprendizaje y que al afectar la función de un sistema de memoria, la función de otro sistema intacto podría mejorarse (11, 66). En particular, el hipocampo y la DLS a veces pueden competir por el control del aprendizaje, por lo que la lesión del hipocampo mejora la función de memoria dependiente de la DLS (5, 6, 67, 68). Las interacciones competitivas también se pueden demostrar en tareas de solución dual, cuando el deterioro de un sistema de memoria resulta en el uso de una estrategia mediada por otro sistema intacto. Por ejemplo, los animales que reciben lesiones DMS muestran una respuesta habitual dependiente de DLS para la recompensa de alimentos en tareas de aprendizaje instrumental (44).
Teniendo en cuenta las interacciones competitivas que a veces surgen entre los sistemas de memoria, una posibilidad es que algunas drogas de abuso puedan mejorar la memoria de hábitos dependiente de DLS indirectamente al afectar los mecanismos de memoria cognitiva mediados por el DMS y el hipocampo. Como se señaló anteriormente, el alcohol está asociado con un mayor uso de la memoria de hábitos dependiente de DLS en los paradigmas de laberinto y la palanca operante (24, 61, 62, 64, 65). La evidencia también indica que el alcohol afecta el aprendizaje en tareas de memoria espacial dependientes del hipocampo [(64, 69–72); para su revisión, ver ref. (73)], así como en tareas de aprendizaje de inversión dependientes de DMS (74–77). De acuerdo con una interacción competitiva entre los sistemas de memoria, se ha planteado la hipótesis de que el alcohol puede facilitar la memoria de hábitos dependiente de DLS indirectamente a través de mecanismos de memoria cognitiva perjudiciales (78).
Cabe señalar que, además del alcohol, numerosas drogas se han asociado con déficits de memoria cognitiva. La exposición a morfina, heroína, metanfetamina, MDMA (éxtasis) o cocaína crónica también produce deficiencias en la memoria espacial dependientes del hipocampo en una variedad de tareas (79–89). Es tentador especular que, como se sugiere para el alcohol, los trastornos cognitivos de la memoria producidos por las drogas adictivas podrían mejorar indirectamente la memoria del hábito dependiente de la DLS, y que este podría ser un mecanismo que permita que la autoadministración de drogas se vuelva habitual en los usuarios de drogas. Por otro lado, también es posible que los déficits de aprendizaje espacial producidos por las drogas adictivas puedan ocurrir indirectamente a través de la mejora de los procesos de memoria dependientes de DLS. De acuerdo con esta hipótesis, la estimulación de la actividad CREB en la DLS afecta la memoria espacial dependiente del hipocampo (90), mientras que la inhibición de la actividad CREB en el DLS revierte los deterioros de la memoria espacial producidos por la morfina (91).
Papel del estrés y la ansiedad
Una consideración adicional con respecto al enfoque de sistemas de memoria múltiple para la adicción a las drogas es el papel del estrés. La evidencia convergente indica que la excitación emocional robusta facilita la memoria del hábito dependiente de DLS en roedores y humanos [para revisiones, ver Ref. (9–12)]. La administración de fármacos ansiogénicos mejora el aprendizaje de respuesta dependiente de DLS en el laberinto de agua (92–97). Esta mejora de la memoria del hábito dependiente de DLS también se observa después de la exposición a factores de estrés del comportamiento no condicionados [por ejemplo, restricción crónica, choque de la cola, olor de depredadores, etc. (98–101)] y la exposición a estímulos condicionados por el miedo [tono previamente combinado con el shock (102, 103)]. Aunque se demostró originalmente en roedores (92), esta mejora de la memoria de hábitos inducida por una fuerte activación emocional también se ha demostrado ampliamente en los humanos (99, 104–110).
Los mecanismos que permiten que el estrés / la ansiedad faciliten la memoria del hábito siguen siendo en gran parte desconocidos; sin embargo, la evidencia indica un papel modulador crítico del BLA (93–95, 100). De acuerdo con una interacción competitiva entre los sistemas de memoria, algunas evidencias también sugieren que el estrés / la ansiedad pueden mejorar la memoria de hábitos dependiente de DLS indirectamente al dañar la función del hipocampo (94, 95).
La mejora de la memoria del hábito después del estrés o la ansiedad puede ser relevante para comprender algunos factores importantes que conducen al abuso de drogas. Es decir, los eventos estresantes de la vida o los períodos prolongados crónicos de estrés / ansiedad se asocian con una mayor vulnerabilidad a la adicción a las drogas y la recaída en los seres humanos (111–117), y se han realizado observaciones similares en modelos animales de autoadministración de fármacos [para una revisión, ver Ref. (118)]. Los investigadores han sugerido que en consonancia con la influencia de la excitación emocional en los sistemas de memoria múltiple (10), el estrés agudo o crónico puede aumentar la adicción a las drogas y la recaída en los seres humanos al involucrar procesos de memoria de hábitos dependientes de DLS (9, 49, 119). De acuerdo con esta sugerencia, el estrés en los individuos dependientes de la cocaína se asocia con una disminución de la actividad dependiente del nivel de oxígeno en la sangre (BOLD) en el hipocampo y una mayor actividad en el estriado dorsal, y estos cambios de actividad BOLD se asocian con los antojos de cocaína inducidos por el estrés (120).
Fuentes emergentes de adicción
Además de las drogas de abuso, la hipótesis de los sistemas de memoria múltiple también se ha empleado recientemente para comprender otras fuentes emergentes de adicción. Por ejemplo, el aumento de la obesidad en las últimas décadas ha llevado a un aumento comparable en el interés experimental, con muchos investigadores que establecen paralelismos entre la adicción a las drogas y la sobrealimentación [para una revisión, ver Ref. (121–123)]. Algunas evidencias recientes han sugerido que, como la adicción a las drogas, la adicción a la comida podría atribuirse en parte a una mayor participación de la memoria de hábitos dependiente de DLS. En ratas, el consumo de alimentos en forma de atracones facilita el cambio del control cognitivo al control habitual del comportamiento (124, 125). Además, el comportamiento habitual en animales que atracan está asociado con una mayor actividad de la DLS y se puede prevenir mediante el bloqueo de los receptores de AMPA o dopamina D1 en la DLS (125). La obesidad inducida por la dieta también se ha asociado recientemente con el uso de la memoria del hábito en una tarea del laberinto Y (126).
Otro trastorno de comportamiento emergente que es paralelo a algunas características de la adicción a las drogas es el juego patológico de videojuegos o la adicción a los videojuegos [para una revisión, ver Ref. (127)]. Al igual que la adicción a las drogas, el juego excesivo de videojuegos a largo plazo se ha asociado con una reducción en la unión del receptor D2 de dopamina en el estriado dorsal (128). La reproducción de videojuegos también se relaciona con una mayor activación del cuerpo estriado dorsal (129, 130), y un mayor volumen estriado dorsal predice niveles más altos de habilidad en videojuegos (131). Las personas que habitualmente juegan videojuegos de acción tienen más probabilidades de utilizar la memoria de hábitos dependiente del cuerpo estriado dorsal en un laberinto virtual (132), y el juego de videojuegos previo al entrenamiento conduce a la respuesta habitual a la respuesta dirigida por objetivo en una tarea de toma de decisiones en dos etapas (133). Por lo tanto, como se propone para las drogas de abuso, los videojuegos pueden mejorar la adicción a los videojuegos mediante el uso del sistema de memoria de hábitos dependiente de DLS.
Finalmente, el enfoque de sistemas de memoria múltiple también podría ser útil para comprender la adicción a la marihuana. Si bien la marihuana puede tener un menor potencial de abuso que otras sustancias ilícitas clásicamente consideradas en el contexto de la investigación de la adicción a las drogas (p. Ej., Cocaína, morfina, heroína, etc.), el consumo excesivo de cannabis puede promover la dependencia y los síntomas de abstinencia de las drogas como se observa con otras drogas abuso134–137). Recientemente se ha sugerido que la adicción a la marihuana podría atribuirse en parte a una mayor participación de la memoria de hábitos dependiente de DLS (138). Mientras que la exposición aguda a los cannabinoides perjudica la función de la memoria dependiente de DLS (139, 140), la exposición repetida a los cannabinoides conduce a una mayor respuesta habitual dependiente de DLS en una tarea de aprendizaje instrumental (141). Además, los usuarios pesados de cannabis muestran una mayor activación del estriado dorsal, en relación con los no usuarios, cuando realizan una versión de marihuana de la tarea de asociación implícita (142), y los participantes con un historial de consumo de cannabis son más propensos a utilizar la memoria de hábitos dependiente del cuerpo estriado dorsal en el laberinto virtual (65).
Dada la aplicación exitosa del enfoque de los sistemas de memoria a las fuentes emergentes de adicción, es razonable suponer que los sistemas de memoria múltiples también podrían estar implicados en otras patologías de comportamiento asociadas con la adicción, como las compras compulsivas, la adicción a Internet y la adicción al sexo. De hecho, si el enfoque de los sistemas de memoria podría ser útil para comprender el juego patológico también ha recibido cierta atención (143, 144).
Conclusión
Veinte años de evidencia experimental han corroborado en gran medida la de White (1) sistemas de memoria múltiple para la adicción a las drogas. La evidencia indica que el hipocampo media el control contextual de la autoadministración de drogas, el DLS media la respuesta habitual de S – R para el refuerzo de la droga y la amígdala media la búsqueda condicionada de la droga. Además, la investigación posterior ha llevado a obtener información adicional sobre la visión de los sistemas de memoria múltiple de la adicción a las drogas, incluido el cambio a la memoria del hábito, la competencia entre los sistemas de memoria y el papel del estrés y la ansiedad.
Las investigaciones futuras deberían intentar integrar el enfoque de los sistemas de memoria con otras teorías de la adicción, como los procesos motivacionales del oponente (145). También sería útil incorporar en la memoria de sistemas de memoria características adicionales de la adicción, como la dependencia de drogas, la tolerancia y la abstinencia. Aunque la presente revisión se centró principalmente en las regiones del cerebro originalmente consideradas por White (es decir, el hipocampo, el cuerpo estriado dorsal y la amígdala), debe señalarse que las regiones adicionales del cerebro relacionadas con el aprendizaje y la memoria también se han implicado de manera crítica en la adicción a las drogas y la recaída. , incluyendo la corteza prefrontal medial y el núcleo accumbens [para una revisión, ver Ref. (13)]. Finalmente, aunque más allá del alcance de la presente revisión, se debe reconocer que la evidencia extensa sugiere que los cambios celulares y moleculares en el sistema dopaminérgico del cerebro medio también contribuyen a la adicción (146).
Aunque las memorias de hábito pueden ser especialmente difíciles de controlar, algunas pruebas indican que la memoria dependiente de DLS, una vez adquirida, puede, en algunas circunstancias, suprimirse (147) o incluso revertido (148, 149). Por lo tanto, es posible que las manipulaciones farmacológicas y los procedimientos conductuales que conducen a la reversión o supresión de la memoria del hábito en modelos animales de aprendizaje puedan ser potencialmente adaptados para tratar la adicción a las drogas y la recaída en los seres humanos.
Contribuciones de autor
JG y MP contribuyeron tanto con ideas como con la redacción de la presente mini-revisión.
Declaracion de conflicto de interes
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Referencias
1. NM blanco. Las drogas adictivas como refuerzos: múltiples acciones parciales en los sistemas de memoria. Adicción (1996) 91(7):921–50. doi: 10.1111/j.1360-0443.1996.tb03586.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. White NM, McDonald RJ. Múltiples sistemas de memoria paralelos en el cerebro de la rata. Neurobiol aprender mem (2002) 77(2):125–84. doi:10.1006/nlme.2001.4008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Squire LR. Sistemas de memoria del cerebro: una breve historia y una perspectiva actual. Neurobiol aprender mem (2004) 82(3):171–7. doi:10.1016/j.nlm.2004.06.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. White NM, Packard MG, McDonald RJ. La disociación de los sistemas de memoria: la historia se desarrolla. Behav Neurosci (2013) 127(6):813–34. doi:10.1037/a0034859
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Packard MG, Hirsh R, White NM. Efectos diferenciales de las lesiones del núcleo y del núcleo caudado en dos tareas de laberinto radial: evidencia de múltiples sistemas de memoria. J Neurosci (1989) 9(5): 1465-72.
6. McDonald RJ, White NM. Una triple disociación de los sistemas de memoria: hipocampo, amígdala y cuerpo estriado dorsal. Behav Neurosci (1993) 107(1):3–22. doi:10.1037/0735-7044.107.1.3
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Maren S. Neurobiología del condicionamiento del miedo pavloviano. Annu Rev Neurosci (2001) 24(1):897–931. doi:10.1146/annurev.neuro.24.1.897
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. McGaugh JL. La amígdala modula la consolidación de recuerdos de experiencias emocionalmente excitantes. Annu Rev Neurosci (2004) 27: 1 – 28. doi: 10.1146 / annurev.neuro.27.070203.144157
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Packard MG. Ansiedad, cognición y hábito: una perspectiva de sistemas de memoria múltiple. Brain Res. (2009) 1293: 121 – 8. doi: 10.1016 / j.brainres.2009.03.029
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Packard MG, Goodman J. La excitación emocional y los sistemas de memoria múltiple en el cerebro de los mamíferos. Frente Behav Neurosci (2012) 6: 14. doi: 10.3389 / fnbeh.2012.00014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Packard MG, Goodman J. Factores que influyen en el uso relativo de múltiples sistemas de memoria. Hipocampo (2013) 23(11):1044–52. doi:10.1002/hipo.22178
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Schwabe L. Stress y el compromiso de los sistemas de memoria múltiple: integración de estudios en animales y humanos. Hipocampo (2013) 23(11):1035–43. doi:10.1002/hipo.22175
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Everitt BJ, Robbins TW. Sistemas neuronales de refuerzo para la adicción a las drogas: de las acciones a los hábitos, a la compulsión. Nat Neurosci (2005) 8(11):1481–9. doi:10.1038/nn1579
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Fuchs RA, Evans KA, Ledford CC, Parker MP, Case JM, Mehta RH, et al. El papel de la corteza prefrontal dorsomedial, la amígdala basolateral y el hipocampo dorsal en el restablecimiento contextual de la búsqueda de cocaína en ratas. Neuropsicofarmacología (2005) 30(2):296–309. doi:10.1038/sj.npp.1300579
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Fuchs RA, Eaddy JL, Su ZI, Bell GH. Las interacciones de la amígdala basolateral con el hipocampo dorsal y la corteza prefrontal dorsomedial regulan el restablecimiento inducido por el contexto de la droga de la búsqueda de cocaína en ratas. Eur J Neurosci (2007) 26(2):487–98. doi:10.1111/j.1460-9568.2007.05674.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Kramar CP, Barbano MF, Medina JH. Los receptores de dopamina D1 / D5 en el hipocampo dorsal son necesarios para la adquisición y expresión de un solo ensayo relacionado con la memoria asociada a la cocaína. Neurobiol aprender mem (2014) 116: 172 – 80. doi: 10.1016 / j.nlm.2014.10.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Zapata A, Minney VL, Shippenberg TS. Cambio de la búsqueda de cocaína dirigida a un objetivo después de una experiencia prolongada en ratas. J Neurosci (2010) 30(46):15457–63. doi:10.1523/JNEUROSCI.4072-10.2010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Corbit LH, Nie H, Janak PH. Búsqueda habitual de alcohol: tiempo y contribución de las subregiones del cuerpo estriado dorsal. Biol Psychiatry (2012) 72(5):389–95. doi:10.1016/j.biopsych.2012.02.024
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Whitelaw RB, Markou A, Robbins TW, Everitt BJ. Las lesiones excitotóxicas de la amígdala basolateral impiden la adquisición de conductas de búsqueda de cocaína bajo un programa de refuerzo de segundo orden. Psicofarmacología (1996) 127(1–2):213–24. doi:10.1007/BF02805996
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Alderson HL, Robbins TW, Everitt BJ. Los efectos de las lesiones excitotóxicas de la amígdala basolateral en la adquisición del comportamiento de búsqueda de heroína en ratas. Psicofarmacología (2000) 153(1):111–9. doi:10.1007/s002130000527
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Gabriele a, ver re. La inactivación reversible de la amígdala basolateral, pero no el putamen dorsolateral caudado, atenúa la consolidación del aprendizaje asociativo de referencia a la cocaína en un modelo de restablecimiento de la búsqueda de drogas. Eur J Neurosci (2010) 32(6):1024–9. doi:10.1111/j.1460-9568.2010.07394.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Sciascia JM, Reese RM, Janak PH, Chaudhri N. La búsqueda de alcohol desencadenada por señales pavlovianas discretas se estimula mediante contextos de alcohol y está mediada por la señalización de glutamato en la amígdala basolateral. Neuropsicofarmacología (2015) 40: 2801 – 12. doi: 10.1038 / npp.2015.130
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Packard MG, Teather LA. Modulación de amígdala de sistemas de memoria múltiple: hipocampo y caudado-putamen. Neurobiol aprender mem (1998) 69(2):163–203. doi:10.1006/nlme.1997.3815
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Dickinson A, Wood N, Smith JW. Búsqueda de alcohol por ratas: ¿acción o hábito? QJ Exp Psychol B (2002) 55(4):331–48. doi:10.1080/0272499024400016
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Udo T, Ugalde F, DiPietro N, Eichenbaum HB, Kantak KM. Efectos de la autoadministración persistente de cocaína en el aprendizaje dependiente de la amígdala y del estriado dorsal en ratas. Psicofarmacología (2004) 174(2):237–45. doi:10.1007/s00213-003-1734-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Madera SC, Fay J, Sage JR, Anagnostaras SG. El condicionamiento del miedo a la cocaína y pavloviano: análisis dosis-efecto. Behav Brain Res (2007) 176(2):244–50. doi:10.1016/j.bbr.2006.10.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Madera SC, Anagnostaras SG. Memoria y psicoestimulantes: modulación del condicionamiento del miedo pavloviano por la anfetamina en ratones C57BL / 6. Psicofarmacología (2009) 202(1–3):197–206. doi:10.1007/s00213-008-1185-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Iñiguez SD, Charntikov S, Baella SA, Herbert MS, Bolaños-Guzmán CA, Crawford CA. La exposición a la cocaína después del entrenamiento facilita la consolidación de la memoria espacial en ratones C57BL / 6. Hipocampo (2012) 22(4):802–13. doi:10.1002/hipo.20941
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. DePoy L, Daut R, Brigman JL, MacPherson K, Crowley N, Gunduz-Cinar O, et al. El alcohol crónico produce neuroadaptaciones para mejorar el aprendizaje del cuerpo estriado dorsal. Proc Natl Acad Sci EE.UU. (2013) 110(36):14783–8. doi:10.1073/pnas.1308198110
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Leri F, Nahas E, Henderson K, Limebeer CL, Parker LA, White NM. Efectos de la heroína y la d-anfetamina post-entrenamiento en la consolidación del aprendizaje de la estancia y el condicionamiento del miedo. J Psychopharmacol (2013) 27(3):292–301. doi:10.1177/0269881112472566
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Schmitzer-Torbert N, Apostolidis S, Amoa R, O'Rear C, Kaster M, Stowers J, et al. La administración de cocaína después del entrenamiento facilita el aprendizaje de hábitos y requiere la corteza infralímbica y el estriado dorsolateral. Neurobiol aprender mem (2015) 118: 105 – 12. doi: 10.1016 / j.nlm.2014.11.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Knowlton BJ. Ganglios basales: formación de hábito. En: Jaeger D, Jung R, editores. Enciclopedia de la neurociencia computacional. Nueva York: Springer (2014). pag. 1 – 17.
33. Tolman EC, Ritchie BF, Kalish D. Estudios en aprendizaje espacial. IV. La transferencia de lugar de aprendizaje a otros caminos de partida. J Exp Psychol (1947) 37(1):39–47. doi:10.1037/h0062061
34. Ritchie BF, Aeschliman B, Pierce P. Estudios en aprendizaje espacial. VIII. Lugar de actuación y la adquisición de disposiciones de lugar. J Comp Physiol Psychol (1950) 43(2):73–85. doi:10.1037/h0055224
35. Hicks LH. Efectos del sobreentrenamiento en la adquisición y reversión del aprendizaje de lugar y respuesta. Psychol Rep (1964) 15(2):459–62. doi:10.2466/pr0.1964.15.2.459
36. Packard MG, McGaugh JL. La inactivación del hipocampo o núcleo caudado con lidocaína afecta de manera diferencial la expresión de lugar y el aprendizaje de respuesta. Neurobiol aprender mem (1996) 65(1):65–72. doi:10.1006/nlme.1996.0007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Yin HH, Knowlton BJ. Aportaciones de las subregiones estriadas al lugar de aprendizaje y respuesta. Aprender mem (2004) 11(4):459–63. doi:10.1101/lm.81004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Adams CD, Dickinson A. Respuesta instrumental después de la devaluación del reforzador. QJ Exp Psychol (1981) 33B: 109 – 12. doi: 10.1080 / 14640748108400816
39. Adams CD, Dickinson A. Acciones y hábitos: variaciones en las representaciones asociativas durante el aprendizaje instrumental. En: Spear NE, Miller RR, editores. Procesamiento de la información en animales: mecanismos de memoria. Hillsdale, NJ: Erlbaum (1981). pag. 143 – 65.
40. Adams CD. Variaciones en la sensibilidad de la respuesta instrumental al reforzamiento de la devaluación. QJ Exp Psychol (1982) 34B: 77 – 98. doi: 10.1080 / 14640748208400878
41. Dickinson A, Nicholas DJ. Aprendizaje irrelevante de incentivos durante el condicionamiento instrumental: el papel de las relaciones impulsor-reforzador y respuesta-reforzador. QJ Exp Psychol (1983) 35B: 249 – 63. doi: 10.1080 / 14640748308400909
42. Dickinson A, Nicholas DJ, Adams CD. Los efectos de la contingencia instrumental sobre la susceptibilidad a reforzar la devaluación. QJ Exp Psychol (1983) 35B: 35 – 51. doi: 10.1080 / 14640748308400912
43. Corbit LH, Balleine BW. El papel del hipocampo en el condicionamiento instrumental. J Neurosci (2000) 20(11): 4233-9.
44. Yin HH, Ostlund SB, Knowlton BJ, Balleine BW. El papel del cuerpo estriado dorsomedial en el condicionamiento instrumental. Eur J Neurosci (2005) 22:513–23. doi:10.1111/j.1460-9568.2005.04218.x
45. Yin HH, Knowlton BJ, Balleine BW. Las lesiones del estriado dorsolateral preservan la expectativa de resultado pero interrumpen la formación de hábitos en el aprendizaje instrumental. Eur J Neurosci (2004) 19:181–9. doi:10.1111/j.1460-9568.2004.03095.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Quinn JJ, Pittenger C, Lee AS, Pierson JL, Taylor JR. Los hábitos dependientes del estriado son insensibles a los aumentos y disminuciones en el valor de refuerzo en ratones. Eur J Neurosci (2013) 37: 1012 – 21. doi: 10.1111 / ejn.12106
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Yin HH. De las acciones a los hábitos: neuroadaptaciones que conducen a la dependencia. Alcohol Res Salud (2008) 31(4): 340-4.
48. Belin D, Jonkman S, Dickinson A, Robbins TW, Everitt BJ. Procesos de aprendizaje paralelos e interactivos dentro de los ganglios basales: relevancia para la comprensión de la adicción. Behav Brain Res (2009) 199(1):89–102. doi:10.1016/j.bbr.2008.09.027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Schwabe L, Dickinson A, Lobo OT. Estrés, hábitos y adicción a las drogas: una perspectiva psiconeuroendocrinológica. Exp Clin Psicofarmacol (2011) 19(1):53–63. doi:10.1037/a0022212
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Hogarth L, Balleine BW, Corbit LH, Killcross S. Mecanismos de aprendizaje asociativo que sustentan la transición del uso recreativo de drogas a la adicción. Ann NY Acad Sci (2013) 1282(1):12–24. doi:10.1111/j.1749-6632.2012.06768.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Murray JE, Belin D, Everitt BJ. Doble disociación del control estriatal dorsomedial y dorsolateral sobre la adquisición y el rendimiento de la búsqueda de cocaína. Neuropsicofarmacología (2012) 37(11):2456–66. doi:10.1038/npp.2012.104
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Clemens KJ, Castino MR, Cornish JL, Goodchild AK, Holmes NM. Comportamiento y sustratos neurales de la formación de hábito en ratas por vía intravenosa autoadministración de nicotina. Neuropsicofarmacología (2014) 39: 2584 – 93. doi: 10.1038 / npp.2014.111
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Corbit LH, Nie H, Janak PH. La respuesta habitual para el alcohol depende de la señalización de los receptores AMPA y D2 en el cuerpo estriado dorsolateral. Frente Behav Neurosci (2014) 8: 301. doi: 10.3389 / fnbeh.2014.00301
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Schoenbaum G, Setlow B. La cocaína hace que las acciones sean insensibles a los resultados pero no a la extinción: implicaciones para la función alterada orbitofrontal-amígdala. Cereb Corteza (2005) 15(8):1162–9. doi:10.1093/cercor/bhh216
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Nelson A, Killcross S. La exposición a anfetaminas mejora la formación de hábitos. J Neurosci (2006) 26(14):3805–12. doi:10.1523/JNEUROSCI.4305-05.2006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
56. Nordquist RE, Voorn P, De Mooij-van Malsen JG, Joosten RNJMA, Pennartz CMA, Vanderschuren LJMJ. Valor reforzado aumentado y formación de hábito acelerada después de un tratamiento repetido con anfetaminas. Eur Neuropsychopharmacol (2007) 17(8):532–40. doi:10.1016/j.euroneuro.2006.12.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
57. LeBlanc KH, Maidment NT, Ostlund SB. La exposición repetida a la cocaína facilita la expresión de la motivación de incentivo e induce el control habitual en ratas. PLoS One. (2013) 8: e61355. doi: 10.1371 / journal.pone.0061355
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
58. Nelson AJ, Killcross S. La formación acelerada de hábitos después de la exposición a la anfetamina se revierte con D1, pero se ve reforzada por D2, antagonistas de los receptores. Frente neurosci (2013) 7: 76. doi: 10.3389 / fnins.2013.00076
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
59. Corbit LH, Chieng BC, Balleine BW. Efectos de la exposición repetida a la cocaína en el aprendizaje del hábito y la reversión por la N-acetilcisteína. Neuropsicofarmacología (2014) 39(8):1893–901. doi:10.1038/npp.2014.37
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
60. Miles FJ, Everitt BJ, Dickinson A. La búsqueda oral de cocaína por ratas: ¿acción o hábito? Behav Neurosci (2003) 117(5):927–38. doi:10.1037/0735-7044.117.5.927
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
61. Mangieri RA, Cofresí RU, Gonzales RA. La búsqueda de etanol por ratas Long Evans no es siempre un comportamiento dirigido hacia el objetivo. PLoS One. (2012) 7: e42886. doi: 10.1371 / journal.pone.0042886
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
62. Sjoerds Z, De Wit S, Van Den Brink W, Robbins TW, Beekman ATF, Penninx BWJH, et al. Evidencia de comportamiento y neuroimagen de confianza excesiva en el aprendizaje de hábitos en pacientes dependientes del alcohol. Psiquiatría Transl (2013) 3(12): e337. doi: 10.1038 / tp.2013.107
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
63. Packard MG, McGaugh JL. La administración posterior de la formación de quinpirol y d-anfetamina mejora la memoria en las discriminaciones espaciales y indicadas en un laberinto acuático. Psicobiología (1994) 22(1): 54-60.
64. Matthews DB, Ilgen M, White AM, Mejor PJ. La administración aguda de etanol altera el rendimiento espacial al tiempo que facilita el rendimiento no espacial en ratas. Neurobiol aprender mem (1999) 72(3):169–79. doi:10.1006/nlme.1998.3900
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
65. Bohbot VD, Balso D, Conrad K, Konishi K, Leyton M. Caudate Las estrategias de navegación dependientes del núcleo están asociadas con un mayor uso de drogas adictivas. Hipocampo (2013) 23(11):973–84. doi:10.1002/hipo.22187
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
66. Poldrack RA, Packard MG. Competencia entre los sistemas de memoria múltiple: evidencia convergente de estudios del cerebro humano y animal. Neuropsychologia (2003) 41(3):245–51. doi:10.1016/S0028-3932(02)00157-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
67. Matthews DB, Mejor PJ. Las lesiones de Fimbria / Fornix facilitan el aprendizaje de una tarea de respuesta no espacial. Psychon Bull Rev (1995) 2(1):113–6. doi:10.3758/BF03214415
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
68. Schroeder JP, Wingard JC, Packard MG. La inactivación reversible post-entrenamiento del hipocampo revela interferencia entre los sistemas de memoria. Hipocampo (2002) 12(2):280–4. doi:10.1002/hipo.10024
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
69. Matthews DB, Simson PE, Mejor PJ. El etanol agudo deteriora la memoria espacial pero no la memoria de estímulo / respuesta en la rata. Alcohol Clin Exp Res (1995) 19(4):902–9. doi:10.1111/j.1530-0277.1995.tb00965.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
70. Blanco AM, Elek TM, Beltz TL, Mejor PJ. El rendimiento espacial es más sensible al etanol que el rendimiento no espacial, independientemente de la proximidad de la señal. Alcohol Clin Exp Res (1998) 22(9):2102–7. doi:10.1111/j.1530-0277.1998.tb05922.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
71. Matthews DB, Morrow AL, Tokunaga S, McDaniel JR. La administración aguda de etanol y la administración aguda de alopregnanolona deterioran la memoria espacial en la tarea del agua de Morris. Alcohol Clin Exp Res (2002) 26(11):1747–51. doi:10.1111/j.1530-0277.2002.tb02479.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
72. Berry RB, Matthews DB. La administración aguda de etanol deteriora selectivamente la memoria espacial en ratones C57BL / 6J. Alcohol (2004) 32(1):9–18. doi:10.1016/j.alcohol.2003.09.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
73. Silvers JM, Tokunaga S, Berry RB, White AM, Matthews DB. Deterioros en el aprendizaje espacial y la memoria: etanol, alopregnanolona y el hipocampo. Brain Res Rev (2003) 43(3):275–84. doi:10.1016/j.brainresrev.2003.09.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
74. Badanich KA, Becker HC, Woodward JJ. Efectos de la exposición crónica intermitente al etanol en los comportamientos dependientes de la corteza prefrontal orbitofrontal y medial en ratones. Behav Neurosci (2011) 125(6):879–91. doi:10.1037/a0025922
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
75. Coleman LG Jr, He J, Lee J, Styner M, Crews FT. El consumo excesivo de alcohol en los adolescentes altera la expresión de genes de neurotransmisores cerebrales adultos, el comportamiento, los volúmenes regionales cerebrales y la neuroquímica en ratones. Alcohol Clin Exp Res (2011) 35(4):671–88. doi:10.1111/j.1530-0277.2010.01385.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
76. Kuzmin A, Liljequist S, Meis J, Chefer V, Shippenberg T, Bakalkin G. Las dosis repetidas de etanol en dosis moderadas afectan la función cognitiva en ratas Wistar. Adicto biol (2012) 17(1):132–40. doi:10.1111/j.1369-1600.2010.00224.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
77. Coleman LG, Liu W, Oguz I, Styner M, Crews FT. El tratamiento con etanol compulsivo en adolescentes altera los volúmenes regionales del cerebro adulto, la proteína de la matriz extracelular cortical y la flexibilidad conductual. Pharmacol Biochem Behav (2014) 116: 142 – 51. doi: 10.1016 / j.pbb.2013.11.021
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
78. Matthews DB, Silvers JR. El uso de la administración aguda de etanol como una herramienta para investigar múltiples sistemas de memoria. Neurobiol aprender mem (2004) 82(3):299–308. doi:10.1016/j.nlm.2004.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
79. Broening HW, Morford LL, Inman-Wood SL, Fukumura M, Vorhees CV. Los problemas de aprendizaje y memoria inducidos por 3, 4-metilendioximetanfetamina (éxtasis) dependen de la edad de exposición durante el desarrollo temprano. J Neurosci (2001) 21(9): 3228-35.
80. Williams MT, Morford LL, Wood SL, Wallace TL, Fukumura M, Broening HW, et al. El tratamiento del desarrollo con d-metanfetamina induce de manera selectiva las alteraciones de la navegación espacial en la memoria de referencia en el laberinto de agua de Morris, mientras se ahorra memoria de trabajo. Synapse (2003) 48(3):138–48. doi:10.1002/syn.10159
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
81. Vorhees CV, Reed TM, Skelton MR, Williams MT. Exposición a 3, 4-metilendioximetanfetamina (MDMA) en los días postnatales 11-20 induce deficiencias de referencia pero no de memoria de trabajo en el laberinto de agua de Morris en ratas: implicaciones del aprendizaje previo. Int J Dev Neurosci (2004) 22(5):247–59. doi:10.1016/j.ijdevneu.2004.06.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
82. Cohen MA, Skelton MR, Schaefer TL, Gudelsky GA, Vorhees CV, Williams MT. Aprendizaje y memoria después de la exposición neonatal a 3, 4-metilendioximetanfetamina (éxtasis) en ratas: interacción con la exposición en la edad adulta. Synapse (2005) 57(3):148–59. doi:10.1002/syn.20166
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
83. Skelton MR, Williams MT, Vorhees CV. El tratamiento con MDMA de P11-20 interrumpe el aprendizaje espacial y el aprendizaje de integración de caminos en ratas adolescentes, pero solo el aprendizaje espacial en ratas mayores. Psicofarmacología (2006) 189(3):307–18. doi:10.1007/s00213-006-0563-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
84. Ma MX, Chen YM, He J, Zeng T, Wang JH. Efectos de la morfina y su retirada en la memoria de reconocimiento espacial de laberinto Y en ratones. Neurociencia (2007) 147(4):1059–65. doi:10.1016/j.neuroscience.2007.05.020
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
85. Belcher AM, Feinstein EM, O'Dell SJ, Marshall JF. Influencias de la metanfetamina en la memoria de reconocimiento: comparación de regímenes de dosificación en un solo día. Neuropsicofarmacología (2008) 33(6):1453–63. doi:10.1038/sj.npp.1301510
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
86. Tramullas M, Martínez-Cué C, Hurlé MA. La administración crónica de heroína a ratones produce una regulación al alza de las proteínas relacionadas con la apoptosis cerebral y altera el aprendizaje espacial y la memoria. Neurofarmacología (2008) 54(4):640–52. doi:10.1016/j.neuropharm.2007.11.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
87. Norte A, Swant J, Salvatore MF, Gamble-George J, Prins P, Butler B, et al. La exposición crónica a la metanfetamina produce un déficit de memoria retrasado y de larga duración. Synapse (2013) 67(5):245–57. doi:10.1002/syn.21635
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
88. Fole A, Martin M, Morales L, Del Olmo N. Efectos del tratamiento crónico de cocaína durante la adolescencia en ratas Lewis y Fischer-344: deterioro novedoso del reconocimiento de ubicación y cambios en la plasticidad sináptica en la edad adulta. Neurobiol aprender mem (2015) 123: 179 – 86. doi: 10.1016 / j.nlm.2015.06.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
89. Zhou M, Luo P, Lu Y, Li CJ, Wang DS, Lu Q, y otros. El desequilibrio de la expresión de HCN1 y HCN2 en el área del hipocampo CA1 altera el aprendizaje espacial y la memoria en ratas con exposición crónica a morfina. Prog Neuropsychopharmacol Biol Psychiatry (2015) 56: 207 – 14. doi: 10.1016 / j.pnpbp.2014.09.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
90. Kathirvelu B, Colombo PJ. Efectos de la expresión CREB mediada por lentivirus en el cuerpo estriado dorsolateral: mejora de la memoria y evidencia de interacciones competitivas y cooperativas con el hipocampo. Hipocampo (2013) 23(11):1066–74. doi:10.1002/hipo.22188
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
91. Baudonnat M, Guillou JL, Husson M, Vandesquille M, Corio M, Decorte L, et al. Efecto perturbador de la recompensa inducida por el fármaco en el aprendizaje espacial pero no guiado por claves: implicación de la vía de la proteína de unión al elemento de respuesta de la proteína quinasa estriatal A / AMPc. J Neurosci (2011) 31:16517–28. doi:10.1523/JNEUROSCI.1787-11.2011
92. Packard MG, Wingard JC. La amígdala y la modulación "emocional" del uso relativo de múltiples sistemas de memoria. Neurobiol aprender mem (2004) 82(3):243–52. doi:10.1016/j.nlm.2004.06.008
93. Elliott AE, Packard MG. Infusión ansiogénica intra-amígdala de drogas antes de la recuperación sesga a las ratas hacia el uso de la memoria del hábito. Neurobiol aprender mem (2008) 90(4):616–23. doi:10.1016/j.nlm.2008.06.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
94. Wingard JC, Packard MG. La amígdala y la modulación emocional de la competencia entre memoria cognitiva y hábito. Behav Brain Res (2008) 193(1):126–31. doi:10.1016/j.bbr.2008.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
95. Packard MG, Gabriele A. Las inyecciones de drogas ansiogénicas periféricas afectan diferencialmente la memoria cognitiva y de hábitos: el papel de la amígdala basolateral. Neurociencia (2009) 164(2):457–62. doi:10.1016/j.neuroscience.2009.07.054
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
96. Leong KC, Goodman J, Packard MG. La buspirona bloquea el efecto de mejora de la droga ansiogénica RS 79948-197 en la consolidación de la memoria del hábito. Behav Brain Res (2012) 234(2):299–302. doi:10.1016/j.bbr.2012.07.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
97. Goodman J, Leong KC, Packard MG. El aumento glucocorticoide de la memoria del hábito dependiente del estriado dorsolateral requiere actividad noradrenérgica concurrente. Neurociencia (2015) 311: 1 – 8. doi: 10.1016 / j.neuroscience.2015.10.014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
98. Kim JJ, Lee HJ, Han JS, Packard MG. La amígdala es crítica para la modulación inducida por el estrés de la potenciación y el aprendizaje a largo plazo del hipocampo. J Neurosci (2001) 21(14): 5222-8.
99. Schwabe L, Dalm S, Schächinger H, Oitzl MS. El estrés crónico modula el uso de estrategias de aprendizaje espacial y de estímulo-respuesta en ratones y en el hombre. Neurobiol aprender mem (2008) 90(3):495–503. doi:10.1016/j.nlm.2008.07.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
100. Leong KC, Packard MG. La exposición al olor de los depredadores influye en el uso relativo de los sistemas de memoria múltiple: el papel de la amígdala basolateral. Neurobiol aprender mem (2014) 109: 56 – 61. doi: 10.1016 / j.nlm.2013.11.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
101. Taylor SB, Anglin JM, Paode PR, Riggert AG, Olive MF, Conrad CD. El estrés crónico puede facilitar el reclutamiento de neurocircuitos relacionados con el hábito y la adicción a través de la reestructuración neuronal del cuerpo estriado. Neurociencia (2014) 280: 231 – 42. doi: 10.1016 / j.neuroscience.2014.09.029
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
102. Leong KC, Goodman J, Packard MG. La reexposición posterior al entrenamiento a los estímulos condicionados por el miedo mejora la consolidación de la memoria y desvía a las ratas hacia el uso del aprendizaje de la respuesta dependiente del estriado dorsolateral. Behav Brain Res (2015) 291: 195 – 200. doi: 10.1016 / j.bbr.2015.05.022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
103. Goode TE, Leong KC, Goodman J, Maren S, Packard MG. La mejora de la memoria dependiente del cuerpo estriado por el miedo condicionado está mediada por receptores beta-adrenérgicos en la amígdala basolateral. Neurobiología del estrés (en prensa). doi: 10.1016 / j.ynstr.2016.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
104. Schwabe L, Oitzl MS, Philippsen C, Richter S, Bohringer A, Wippich W, et al. El estrés modula el uso de estrategias de aprendizaje espacial frente a estímulo-respuesta en humanos. Aprender mem (2007) 14(1–2):109–16. doi:10.1101/lm.435807
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
105. Schwabe L, Schächinger H, de Kloet ER, Oitzl MS. Los corticosteroides funcionan como un interruptor entre los sistemas de memoria. J Cogn Neurosci (2010) 22(7):1362–72. doi:10.1162/jocn.2009.21278
106. Schwabe L, Tegenthoff M, Höffken O, Wolf OT. La actividad concurrente de glucocorticoides y noradrenérgicos cambia el comportamiento instrumental de la meta dirigida al control habitual. J Neurosci (2010) 30(24):8190–6. doi:10.1523/JNEUROSCI.0734-10.2010
107. Schwabe L, Tegenthoff M, Höffken O, Wolf OT. El bloqueo del receptor de mineralocorticoides previene la modulación inducida por el estrés de múltiples sistemas de memoria en el cerebro humano. Biol Psychiatry (2013) 74(11):801–8. doi:10.1016/j.biopsych.2013.06.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
108. Schwabe L, Lobo OT. El estrés incita al hábito en los humanos. J Neurosci (2009) 29(22):7191–8. doi:10.1523/JNEUROSCI.0979-09.2009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
109. Schwabe L, Lobo OT. El estrés por presión fría socialmente evaluado después del aprendizaje instrumental favorece los hábitos sobre la acción dirigida hacia el objetivo. Psiconeuroendocrinología (2010) 35(7):977–86. doi:10.1016/j.psyneuen.2009.12.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
110. Guenzel FM, Wolf OT, Schwabe L. Los glucocorticoides estimulan la formación de memoria estímulo-respuesta en humanos. Psiconeuroendocrinología (2014) 45: 21 – 30. doi: 10.1016 / j.psyneuen.2014.02.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
111. Higgins RL, Marlatt GA. El miedo a la evaluación interpersonal como determinante del consumo de alcohol en los bebedores sociales masculinos. J abnorm psychol (1975) 84(6):644–51. doi:10.1037/0021-843X.84.6.644
112. Marlatt GA, Gordon JR. Determinantes de la recaída: implicaciones para el mantenimiento del cambio de comportamiento. En: Davidson PO, Davidson SM, editores. Medicina del comportamiento: cambiando estilos de vida. Nueva York: Brunne / Mazel (1980). pag. 410 – 52.
113. Newcomb MD, Bentler PM. Impacto del uso de drogas en adolescentes y apoyo social en los problemas de los adultos jóvenes: un estudio longitudinal. J abnorm psychol (1988) 97:64–75. doi:10.1037/0021-843X.97.1.64
114. Wallace BC. Determinantes psicológicos y ambientales de la recaída en fumadores de cocaína crack. Tratamiento de abuso de sustancia J (1989) 6(2):95–106. doi:10.1016/0740-5472(89)90047-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
115. Kaplan HB, Johnson RJ. Relaciones entre las circunstancias que rodean el uso inicial de drogas ilícitas y la escalada del uso de drogas: efectos moderadores del género y las primeras experiencias de los adolescentes. En: Glantz M, Pickens R, editores. Vulnerabilidad al abuso de drogas. Washington, DC: Asociación Americana de Psicología (1992). pag. 200 – 358.
116. Harrison PA, Fulkerson JA, Beebe TJ. Uso múltiple de sustancias entre adolescentes víctimas de abuso físico y sexual. Negligencia de abuso infantil (1997) 21:529–39. doi:10.1016/S0145-2134(97)00013-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
117. Chilcoat HD, Breslau N. Trastorno por estrés postraumático y trastornos farmacológicos: prueba de vías causales. Arch Gen Psychiatry (1998) 55(10):913–7. doi:10.1001/archpsyc.55.10.913
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
118. Piazza PV, Le Moal M. El papel del estrés en la autoadministración de fármacos. Tendencias Pharmacol Sci (1998) 19(2):67–74. doi:10.1016/S0165-6147(97)01115-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
119. Goodman J, Leong KC, Packard MG. Modulación emocional de los sistemas de memoria múltiple: implicaciones para la neurobiología del trastorno de estrés postraumático. Rev Neurosci (2012) 23(5–6):627–43. doi:10.1515/revneuro-2012-0049
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
120. Sinha R, Lacadie C, Skudlarski P, Fulbright RK, Rounsaville BJ, Kosten TR, et al. Actividad neuronal asociada con el deseo de cocaína inducido por el estrés: un estudio funcional de resonancia magnética. Psicofarmacología (2005) 183(2):171–80. doi:10.1007/s00213-005-0147-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
121. Avena NM, Rada P, Hoebel BG. Evidencia de la adicción al azúcar: efectos neuroquímicos y de comportamiento de la ingesta intermitente y excesiva de azúcar. Neurosci Biobehav Rev (2008) 32(1):20–39. doi:10.1016/j.neubiorev.2007.04.019
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
122. Gearhardt AN, Corbin WR, Brownell KD. Adicción a la comida: un examen de los criterios diagnósticos de dependencia. J Addict Med (2009) 3(1):1–7. doi:10.1097/ADM.0b013e318193c993
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
123. Smith DG, Robbins TW. Los fundamentos neurobiológicos de la obesidad y la alimentación compulsiva: una justificación para adoptar el modelo de adicción a la comida. Biol Psychiatry (2013) 73(9):804–10. doi:10.1016/j.biopsych.2012.08.026
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
124. de Jong JW, Meijboom KE, Vanderschuren LJ, Adan RA. El bajo control sobre la ingesta de alimentos sabrosos en ratas se asocia con el comportamiento habitual y la vulnerabilidad a las recaídas: diferencias individuales. PLoS One. (2013) 8(9): e74645. doi: 10.1371 / journal.pone.0074645
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
125. Furlong TM, Jayaweera HK, Balleine BW, Corbit LH. El consumo excesivo de una comida sabrosa acelera el control habitual del comportamiento y depende de la activación del cuerpo estriado dorsolateral. J Neurosci (2014) 34(14):5012–22. doi:10.1523/JNEUROSCI.3707-13.2014
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
126. Hargrave SL, Davidson TL, Zheng W, Kinzig KP. Las dietas occidentales inducen fugas en la barrera hematoencefálica y alteran las estrategias espaciales en ratas. Behav Neurosci (2016) 130(1):123–35. doi:10.1037/bne0000110
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
127. Smith KL, Hummer TA, Hulvershorn LA. Los videojuegos patológicos y su relación con los trastornos por uso de sustancias. Curr Adicto Rep (2015) 2(4):302–9. doi:10.1007/s40429-015-0075-6
128. Weinstein AM. Adicción a la computadora y los videojuegos: una comparación entre usuarios de juegos y usuarios que no son de juegos. Soy abuso de alcohol de drogas (2010) 36(5):268–76. doi:10.3109/00952990.2010.491879
129. Kätsyri J, Hari R, Ravaja N, Nummenmaa L. El oponente importa: las respuestas de recompensa fMRI elevadas para ganar contra un oponente humano contra un oponente de computadora durante un juego de video interactivo. Cereb Corteza (2013) 23(12):2829–39. doi:10.1093/cercor/bhs259
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
130. Kätsyri J, Hari R, Ravaja N, Nummenmaa L. Simplemente ver el juego no es suficiente: la RMN estriatal recompensa las respuestas a los éxitos y fracasos en un videojuego durante el juego activo y indirecto. Frente Hum Neurosci (2013) 7: 278. doi: 10.3389 / fnhum.2013.00278
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
131. Erickson KI, Boot WR, Basak C, Neider MB, Prakash RS, Voss MW, y otros. El volumen estriado predice el nivel de adquisición de habilidades de videojuegos. Cereb Corteza (2010) 20: 2522 – 30. doi: 10.1093 / cercor / bhp293
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
132. West GL, Drisdelle BL, Konishi K, Jackson J, Jolicoeur P, Bohbot VD. El juego habitual de videojuegos de acción se asocia con estrategias de navegación dependientes del núcleo caudado. Proc R Soc B (2015) 282(1808). doi: 10.1098 / rspb.2014.2952
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
133. Liu S, Schad DJ, Kuschpel MS, Rapp MA, Heinz A. Música y videojuegos durante los recesos: influencia de la toma de decisiones habitual frente a la meta. Documento presentado en la 45th reunión anual de la Society for Neuroscience. Chicago, IL: Sociedad para la Neurociencia (2015).
134. de Fonseca FR, Carrera MRA, Navarro M, Koob GF, Weiss F. Activación del factor liberador de corticotropina en el sistema límbico durante la retirada de cannabinoides. Ciencia: (1997) 276(5321):2050–4. doi:10.1126/science.276.5321.2050
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
135. Cornelius JR, Chung T, Martin C, Wood DS, Clark DB. La abstinencia de cannabis es común entre los adolescentes que buscan tratamiento con dependencia del cannabis y depresión mayor, y se asocia con una rápida recaída a la dependencia. Adicto Behav (2008) 33(11):1500–5. doi:10.1016/j.addbeh.2008.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
136. Greene MC, Kelly JF. La prevalencia de la abstinencia de cannabis y su influencia en la respuesta y los resultados del tratamiento de los adolescentes: una investigación prospectiva del 12-mes. J Addict Med (2014) 8: 359 – 67. doi: 10.1097 / ADM.0000000000000064
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
137. Wagner FA, Anthony JC. Desde el primer uso de drogas hasta la dependencia de drogas; Períodos de desarrollo del riesgo de dependencia de la marihuana, la cocaína y el alcohol. Neuropsicofarmacología (2002) 26:479–88. doi:10.1016/S0893-133X(01)00367-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
138. Goodman J, Packard MG. La influencia de los cannabinoides en los procesos de aprendizaje y memoria del cuerpo estriado dorsal. Neurobiol aprender mem (2015) 125: 1 – 14. doi: 10.1016 / j.nlm.2015.06.008
139. Rueda-Orozco PE, Soria-Gómez E, Montes-Rodríguez CJ, Martínez-Vargas M, Galicia O, Navarro L, et al. Una función potencial de los endocannabinoides en la selección de una estrategia de navegación por ratas. Psicofarmacología (2008) 198(4):565–76. doi:10.1007/s00213-007-0911-z
140. Goodman J, Packard MG. Las inyecciones en el estriado periférico e intra-dorsolateral del agonista del receptor de cannabinoides WIN 55,212-2 perjudican la consolidación de la memoria de estímulo-respuesta. Neurociencia (2014) 274: 128 – 37. doi: 10.1016 / j.neuroscience.2014.05.007
141. Nazzaro C, Greco B, Cerovic M, Baxter P, Rubino T, Trusel M, et al. La modulación del canal de SK rescata la plasticidad estriatal y el control del hábito en la tolerancia a los cannabinoides. Nat Neurosci (2012) 15: 284 – 93. doi: 10.1038 / nn.3022
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
142. Ames SL, Grenard JL, Stacy AW, Xiao L, He Q, Wong SW, y otros. Imágenes funcionales de las asociaciones de marihuana implícitas durante el desempeño en una prueba de asociación implícita (IAT). Behav Brain Res (2013) 256: 494 – 502. doi: 10.1016 / j.bbr.2013.09.013
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
143. Redish AD, Jensen S, Johnson A. Un marco unificado para la adicción: vulnerabilidades en el proceso de decisión. Behav Brain Sci (2008) 31(04):415–37. doi:10.1017/S0140525X0800472X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
144. Brevers D, Bechara A, Cleeremans A, Noël X. Iowa Gambling Task (IGT): veinte años después del trastorno del juego e IGT. Front psychol (2013) 4: 665. doi: 10.3389 / fpsyg.2013.00665
145. Koob GF, Le Moal M. Mecanismos neurobiológicos para los procesos motivacionales del oponente en la adicción. Philos Trans R Soc B Biol Sci (2008) 363(1507):3113–23. doi:10.1098/rstb.2008.0094
146. Hyman SE, Malenka RC, Nestler EJ. Mecanismos neuronales de la adicción: el papel del aprendizaje y la memoria relacionados con la recompensa. Annu Rev Neurosci (2006) 29: 565 – 98. doi: 10.1146 / annurev.neuro.29.051605.113009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
147. Goodman J, Packard M. El sistema de memoria activado durante la adquisición determina la efectividad de los diferentes protocolos de extinción. Frente Behav Neurosci (2015) 9: 314. doi: 10.3389 / fnbeh.2015.00314
148. Palencia CA, Ragozzino ME. La contribución de los receptores NMDA en el cuerpo estriado dorsolateral al aprendizaje de respuesta egocéntrica. Behav Neurosci (2005) 119(4):953–60. doi:10.1037/0735-7044.119.4.953
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
149. Rueda-Orozco PE, Montes-Rodriguez CJ, Soria-Gomez E, Méndez-Díaz M, Prospéro-García O. Deterioro de la actividad de endocannabinoides en el estriado dorsolateral retrasa la extinción de la conducta en una tarea de memoria de procedimiento en ratas. Neurofarmacología (2008) 55(1):55–62. doi:10.1016/j.neuropharm.2008.04.013
Palabras clave: memoria, adicción a las drogas, hipocampo, estriado, amígdala, estrés, ansiedad.
Cita: Goodman J y Packard MG (2016) Sistemas de memoria y el cerebro adicto. Frente. Psiquiatría 7: 24. doi: 10.3389 / fpsyt.2016.00024
Recibido: 01 Diciembre 2015; Aceptado: 11 febrero 2016;
Publicado: 25 February 2016
Editado por:
David Vicente, Centro Nacional de la Investigación Científica (CNRS), Francia
Revisado por:
Jacques Micheau, Universidad de Bordeaux 1, Francia
Roberto CiccocioppoUniversidad de Camerino, Italia
Copyright: © 2016 Goodman y Packard. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de atribución de Creative Commons (CC BY). Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite al autor o licenciantes originales y que se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
* Correspondencia: Mark G. Packard, [email protected]
