Diálogos Clin Neurosci. 2013 Dec;15(4):431-43.
Resumen
A pesar de la importancia de numerosos factores psicosociales, en su núcleo, la adicción a las drogas implica un proceso biológico: la capacidad de exposición repetida a una droga de abuso para inducir cambios en un cerebro vulnerable que impulsa la búsqueda y el consumo compulsivo de drogas y la pérdida de control. Sobre el uso de drogas, que definen un estado de adicción. Aquí, revisamos los tipos de adaptaciones moleculares y celulares que ocurren en regiones específicas del cerebro para mediar las anomalías de comportamiento asociadas a la adicción. Estas incluyen alteraciones en la expresión génica logradas en parte a través de mecanismos epigenéticos, plasticidad en el funcionamiento neurofisiológico de las neuronas y sinapsis, y plasticidad asociada en la morfología neuronal y sináptica mediada en parte por la señalización alterada del factor neurotrófico. Cada uno de estos tipos de modificaciones inducidas por medicamentos puede verse como una forma de "memoria celular o molecular". Además, es sorprendente que la mayoría de las formas de plasticidad relacionadas con la adicción son muy similares a los tipos de plasticidad que se han asociado con formas más clásicas de "memoria de comportamiento", tal vez reflejando el repertorio finito de mecanismos adaptativos disponibles para las neuronas cuando se enfrentan a factores ambientales. retos Finalmente, las adaptaciones moleculares y celulares relacionadas con la adicción involucran la mayoría de las mismas regiones cerebrales que median formas de memoria más clásicas, de acuerdo con la opinión de que las memorias anormales son factores importantes de los síndromes de adicción. El objetivo de estos estudios, cuyo objetivo es explicar las bases moleculares y celulares de la adicción a las drogas, es desarrollar pruebas de diagnóstico biológicas y tratamientos más efectivos para los trastornos de la adicción.
Introducción
La adicción a las drogas, que puede definirse como la búsqueda y el consumo compulsivo de drogas a pesar de las horrendas consecuencias o la pérdida de control sobre el uso de drogas, es causada por cambios inducidos por drogas de larga duración que ocurren en ciertas regiones del cerebro.1 Sin embargo, solo algunas personas sucumben a la adicción frente a la exposición repetida a las drogas, mientras que otras son capaces de usar una droga de manera casual y escapar de un síndrome de adicción. Los factores genéticos representan aproximadamente el 50% de esta variabilidad individual en la vulnerabilidad a la adicción, y este grado de heredabilidad es válido para todas las clases principales de drogas adictivas, incluidos estimulantes, opiáceos, alcohol, nicotina y cannabinoides..2 Todavía no ha sido posible identificar la mayoría de los genes que comprenden este riesgo genético, probablemente debido a la participación de quizás cientos de variaciones genéticas que se suman en un solo individuo para conferir vulnerabilidad a la adicción (o, en otros individuos, resistencia).
El otro 50% del riesgo de adicción se debe a una serie de factores ambientales, que ocurren a lo largo de la vida, que interactúan con la composición genética de un individuo para hacerlo vulnerable a la adicción en mayor o menor medida. Varios tipos de factores ambientales han estado implicados en la adicción, incluido el estrés psicosocial, pero el factor más poderoso es, con mucho, la exposición a una droga de abuso en sí. Se ha demostrado que ciertas drogas “de entrada”, en particular la nicotina, aumentan la vulnerabilidad a la adicción a otra droga.3 Además, hay cada vez más pruebas de que, a pesar de un rango de riesgos genéticos para la adicción en toda la población, la exposición a dosis suficientemente altas de un medicamento durante largos períodos de tiempo puede transformar a una persona con una carga genética relativamente menor en un adicto..4
En las últimas dos décadas se han logrado grandes avances en la identificación de las regiones discretas del cerebro que son importantes para mediar en un síndrome de adicción, así como los tipos de cambios a nivel molecular y celular que las drogas inducen en estas regiones para subrayar aspectos clave. de la adiccion.1,5 El circuito que ha recibido la mayor atención se conoce como el sistema de dopamina mesolímbico, que involucra neuronas de dopamina en el área tegmental ventral (VTA) del cerebro medio que inerva neuronas espinosas medias en el núcleo accumbens (NAc, una parte del estriado ventral). Estas neuronas VTA también inervan muchas otras regiones del cerebro anterior, como el hipocampo, la amígdala y la corteza prefrontal (PFC).
Tiene sentido considerar estos mecanismos de adicción inducidos por drogas en este volumen en la memoria por tres razones superpuestas.6
- En primer lugar, todas las adaptaciones inducidas por medicamentos pueden verse como tipos de "memoria molecular o celular:" la célula nerviosa que experimenta tales cambios es diferente como resultado de la exposición al medicamento y, por lo tanto, responde de manera diferente a ese mismo medicamento, a otras drogas, o a una serie de otros estímulos como resultado.
- En segundo lugar, es interesante que muchos, tal vez la mayoría, de los tipos de cambios que se han asociado con un estado de adicción. (p. ej., transcripción génica alterada, epigenética, plasticidad sináptica y de células completas, y morfología neuronal y mecanismos neurotróficos) también están implicados en las formas tradicionales de "memoria conductual", como la memoria espacial, el condicionamiento del miedo y el condicionamiento operante, entre otros.
- En tercer lugar, entre las regiones del cerebro afectadas por las drogas de abuso están aquellas que son sustratos neuronales clave para la memoria conductual, incluidos el hipocampo, la amígdala y la PFC. Esto coincide con la creciente comprensión de que algunas de las características más importantes de la adicción observadas clínicamente (p. Ej., Ansia y recaída de las drogas) reflejan anomalías en los circuitos de memoria tradicionales, con recuerdos a largo plazo de la experiencia de las drogas que sirven como potentes motores de la patología de la adicción.4,7,8 Por el contrario, las regiones de recompensa del cerebro (p. Ej., VTA y NAc) influyen poderosamente en la memoria conductual.
Este artículo proporciona una descripción general de los principales tipos de cambios moleculares y celulares que ocurren en varias regiones del cerebro en modelos animales de adicción, concentrándose en el núcleo accumbens para el cual la mayoría de la información está disponible actualmente. Es importante destacar que ha sido posible validar cada vez más algunos de estos cambios en adictos humanos basados en estudios de cerebros postmortem. A pesar del hecho de que las drogas de abuso tienen estructuras químicas distintas y actúan sobre distintos objetivos de proteínas, es sorprendente que muchas adaptaciones prominentes relacionadas con la adicción sean comunes a muchas, y en algunos casos todas, las drogas de abuso y probablemente contribuyan a las características compartidas de un síndrome de adicción.4,9 En contraste, muchas otras adaptaciones inducidas por medicamentos son específicas de un medicamento dado y pueden mediar aspectos más únicos de una adicción dada. Nos centramos aquí en las drogas de abuso de estimulantes y opiáceos, que producen efectos más dramáticos en modelos animales en comparación con otras drogas. También destacamos áreas importantes para futuras investigaciones que aumentarán aún más nuestro conocimiento de los síndromes de adicción y traducirán estos avances en mejores pruebas de diagnóstico y tratamientos.
Mecanismos transcripcionales y epigenéticos.
El conocimiento de que los adictos pueden permanecer en mayor riesgo de recaída a pesar de años de abstinencia significa que la adicción implica cambios en el cerebro inducidos por las drogas que pueden ser muy estables. Esto ha llevado a varios grupos a considerar los cambios en la expresión génica como un componente importante del proceso de adicción. (Figura 1 y XNUMX). En consecuencia, los estudios de genes candidatos o investigaciones de todo el genoma que involucran micromatrices de ADN y más recientemente RNA-seq (secuenciación de alto rendimiento de los RNA expresados) ha identificado numerosos genes cuya expresión está alterada en una región cerebral determinada en modelos de adicción a roedores y primates y en adictos humanos (por ejemplo, refs 10-17). Los ejemplos de tales genes se discuten en secciones posteriores de esta revisión.
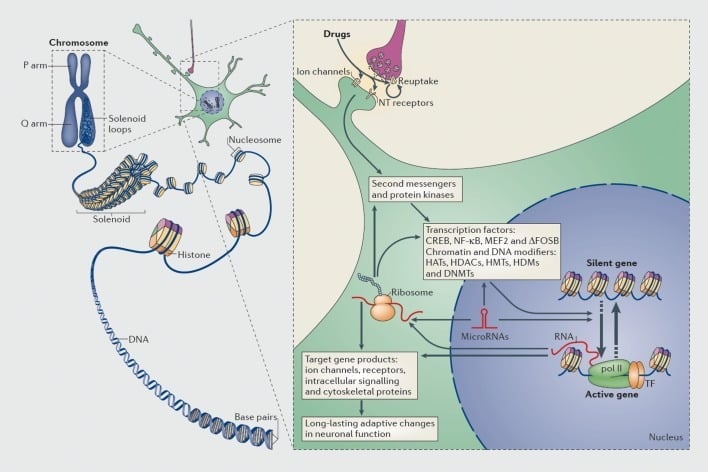
Mecanismos de regulación transcripcional y epigenética por drogas de abuso. En las células eucariotas, el ADN se organiza envolviendo los octómeros de histonas para formar nucleosomas, que luego se organizan y condensan para formar cromosomas (parte izquierda). Solo al desentrañar temporalmente la cromatina compactada se puede hacer que el ADN de un gen específico sea accesible a la maquinaria transcripcional. Las drogas de abuso actúan a través de objetivos sinápticos, como los mecanismos de recaptación, los canales iónicos y los receptores de neurotransmisores (NT) para alterar las cascadas de señalización intracelular (parte derecha). Esto conduce a la activación o inhibición de los factores de transcripción (TF) y de muchas otras dianas nucleares, incluidas las proteínas reguladoras de la cromatina (mostradas por flechas gruesas); los mecanismos detallados implicados en la regulación sináptica de las proteínas reguladoras de la cromatina siguen siendo poco conocidos. Estos procesos finalmente resultan en la inducción o represión de genes particulares, incluidos los de los ARN no codificantes, como los microARN; la expresión alterada de algunos de estos genes puede a su vez regular aún más la transcripción de genes. Se propone que algunos de estos cambios inducidos por fármacos a nivel de cromatina son extremadamente estables y, por lo tanto, subyacen a los comportamientos de larga duración que definen la adicción. CREB, proteína de unión a elemento sensible a AMP cíclica; DNMTs, ADN metiltransferasas; HATs, histona acetiltransferasas; HDACs, histonas deacetilasas; HDMs, histonas desmetilasas; HMTs, histona metiltransferasas; MEF2, factor potenciador de miocitos 2; NF-kB, factor nuclear-KB; pol II, ARN polimerasa II. Reproducido de la referencia 44: Robison AJ, Nestler EJ. Mecanismos transcripcionales y epigenéticos de la adicción. Nat Rev Neurosci. 2011; 12: 623-637.
Del mismo modo, muchos tipos de factores de transcripción (proteínas que se unen a las regiones reguladoras de los genes y, por lo tanto, aumentan o disminuyen la transcripción de esos genes) se han implicado en la mediación de los efectos a largo plazo del uso indebido de drogas en la expresión de genes en el cerebro.. Los ejemplos destacados incluyen CREB (proteína de unión al elemento de respuesta cAMP), ΔFosB (un factor de transcripción de la familia Fos), NFkB (factor nuclear kB), MEF2 (factor de potenciación de los miocitos-2), y receptores de glucocorticoides, entre varios otros.5,10,18–22 Ha sido cada vez más posible comprender las vías de señalización celular a través de las cuales las drogas de abuso activan un factor de transcripción dado en el cerebro y relacionar causalmente dicha activación con los genes diana de ese factor de transcripción y con aspectos conductuales específicos de la adicción (ver Figura 1). Este progreso se ilustra mediante la consideración de CREB y ΔFosB, que son los factores de transcripción mejor estudiados en los modelos de adicción.
cAMP proteína de unión al elemento de respuesta
Estimulante y drogas de abuso de opiáceos activan. CREB En varias regiones del cerebro importantes para la adicción, incluso en un lugar destacado en la NAc.23,24 Se sabe que CREB está activado en otros sistemas por cAMP, Ca2+, y vías de crecimiento,25 y aún no se sabe cuál de estos media su activación en NAc por drogas de abuso. Se ha demostrado que la activación de drogas de CREB en NAc representa un mecanismo clásico de retroalimentación negativa, mediante el cual CREB sirve para reducir la sensibilidad de un animal a los efectos gratificantes de estas drogas (tolerancia) y para mediar un estado emocional negativo durante la abstinencia de drogas (dependencia).18,26,27 Se ha demostrado recientemente que estos efectos conducen a un aumento de la autoadministración de fármacos y la recaída, presumiblemente a través de un proceso de refuerzo negativo.28 Estas acciones de CREB parecen involucrar a los dos subtipos principales de neuronas espinosas medianas NAc, aquellas que expresan predominantemente D1 versus D2 receptores de dopamina.24 ISin embargo, una gran cantidad de literatura ha demostrado que el CREB, que actúa en el hipocampo y la amígdala, es una molécula clave en la memoria conductual..29–31 Este amplio papel en la adicción y la memoria conductual probablemente refleja el hecho de que las neuronas están impregnadas de un número finito de mecanismos moleculares con los que adaptarse a un entorno en constante cambio.
Los genes diana para CREB que median este fenotipo de comportamiento se han identificado a través de ensayos de todo el genoma, así como esfuerzos más seleccionados.10,18,32 Un ejemplo es el péptido opioide dinorfina: inducción estimulante de la expresión de dinorfina en neuronas NAc, mediada a través de CREB, aumenta la activación de los receptores de opioides k en las neuronas dopaminérgicas VTA y, por lo tanto, suprime la transmisión dopaminérgica a la NAc y perjudica la recompensa.18 Se ha demostrado que varios otros objetivos CREB son importantes para la plasticidad sináptica inducida por fármacos, como se explica a continuación. Mientras que CREB también se activa en varias otras regiones del cerebro por estimulantes y opiáceos,23,24 se sabe menos sobre las consecuencias conductuales de este efecto y los genes diana a través de los cuales ocurren. Asimismo, se sabe menos sobre el papel de CREB en la mediación de las acciones de otras drogas de abuso.19
ΔFosB
La exposición aguda a prácticamente cualquier droga de abuso induce todos los factores de transcripción de la familia Fos en NAc y en varias otras regiones cerebrales. Esta inducción es rápida pero también altamente transitoria, con niveles de proteína Fos que vuelven a la normalidad dentro de las horas 8 a 12. Único de estas proteínas de la familia Fos es ΔFosB, un producto truncado del gen FosB, que en virtud de su estabilidad inusual, se acumula gradualmente a través de un curso de exposición repetida al fármaco y se convierte en la proteína Fos predominante expresada en estas condiciones.22,33 Además, debido a esta estabilidad, los niveles de ΔFosB persisten durante semanas después de la retirada del fármaco. Dicha inducción crónica de ΔFosB se ha demostrado para prácticamente todas las drogas de abuso34 y, para la mayoría de los medicamentos, es selectivo para las neuronas NAc de tipo Dl.34,35 También ha sido Demostrado en adictos humanos.35 Una gran cantidad de literatura ha demostrado que tal inducción de osFosB en D1-Las neuronas de tipo NAc aumentan la sensibilidad de un animal a las drogas, así como las recompensas naturales y promueven la autoadministración de drogas, presumiblemente a través de un proceso de refuerzo positivo. (ver refs 34 a 38). Curiosamente, la inducción de drogas de ΔFosB en NAc es más dramática en animales adolescentes, un momento de mayor vulnerabilidad a la adicción,39 y se ha demostrado que su inducción por la nicotina media la mejora de la recompensa de la cocaína, similar a la entrada de la nicotina.40
En cuanto a CREB, se han identificado numerosos genes diana para ΔFosB en NAc mediante el uso de genes candidatos y enfoques genómicos.10,32 Mientras que CREB induce dinorfina, ΔFosB la suprime, lo que contribuye a los efectos pro-recompensa de ΔFosB.38 Otro objetivo de ΔFosB es cFos: a medida que ΔFosB se acumula con la exposición repetida al fármaco, reprime c-Fos y contribuye al cambio molecular mediante el cual ΔFosB se induce selectivamente en el estado crónico tratado con el fármaco..41 Se ha demostrado que muchos otros objetivos de ΔFosB median la capacidad de ciertas drogas de abuso para inducir la plasticidad sináptica en la NAc y los cambios asociados en la arborización dendrítica de neuronas espinosas del medio NAc, como se explicará más adelante.
Las consecuencias funcionales de la inducción de BFosB en otras regiones del cerebro se entienden menos, aunque su inducción en la corteza orbitofrontal (OFC) se ha estudiado con cierto detalle. Aquí, ΔFosB media la tolerancia que se produce a los efectos cognitivos de la cocaína durante un curso de exposición crónica, y esta adaptación se asocia con un aumento de la autoadministración de cocaína..42,43
Los ensayos de todo el genoma han sugerido varios genes diana potenciales que median estos efectos.42 A pesar de las propiedades temporales únicas de ΔFosB y del conocimiento de que se induce en los circuitos de memoria tradicionales (por ejemplo, hipocampo), todavía no se ha explorado el papel de ΔFosB en la memoria conductual, un tema interesante para futuras investigaciones.
Mecanismos epigenéticos
En años más recientes, los estudios de transcripción han sido empujados un paso más hacia la epigenética.44 (consulta: Figura 1), que puede definirse en términos generales como un cambio en la expresión génica que se produce en ausencia de un cambio en la secuencia del ADN. Los mecanismos epigenéticos controlan el empaquetamiento del ADN dentro de un núcleo celular a través de sus interacciones con las histonas y muchos otros tipos de proteínas nucleares, que juntas comprenden la cromatina. La expresión génica está controlada por el estado de este empaquetamiento a través de la modificación covalente de las histonas, otras proteínas y el propio ADN. Como solo algunos ejemplos, la acetilación de las histonas tiende a promover la activación de los genes, la metilación de las histonas puede promover la activación o la represión de los genes dependiendo del residuo de Lys que experimenta esta modificación, y la metilación del ADN se asocia generalmente con la represión de los genes, aunque ciertas formas variantes de metilación ( por ejemplo, la hidroximetilación 5) puede estar asociada con la activación génica.
La epigenética es un mecanismo atractivo porque, en otros sistemas, por ejemplo, la biología del desarrollo y el cáncer, ciertas modificaciones epigenéticas pueden ser permanentes. Por esta razón, la epigenética se ha seguido tanto en el aprendizaje como en los modelos de memoria (por ejemplo, refs 45-48), así como en la adicción;44,49 en ambos sistemas se han reportado cambios profundos en la acetilación y metilación de las histonas y en la metilación del ADN. Como solo un ejemplo, la histona metiltransferasa, G9a, está implicada en la memoria50 y adicción.51,52 En los modelos de adicción, La expresión G9a está regulada a la baja en NAc en respuesta a drogas estimulantes u opiáceos de abuso ytSu ha demostrado mejorar los efectos gratificantes de estas drogas.51,52 Curiosamente, la supresión de G9a por la cocaína está mediada por ΔFosB. G9a cataliza la dimetilación de Lys9 de la histona H3 (H3K9me2), un mediador importante de la represión de genes. Se ha utilizado ChIP-chip o ChIP-seq (inmunoprecipitación de cromatina seguida, respectivamente, por chips promotores o secuenciación de alto rendimiento) para obtener mapas genómicos de los genes en NAc que muestran H3K9me2 alterado después de la exposición al estimulante u opiáceo.32,52,53 Al superponer estas listas de genes con listas de genomas de cambios en la expresión de genes y con mapas de genomas de muchas otras formas de modificaciones epigenéticas (por ejemplo, unión a ΔFosB, unión a CREB, otras modificaciones de histonas, etc.),32,53 debería ser posible identificar un conjunto cada vez más completo de genes regulados por drogas de abuso y comprender los mecanismos epigenéticos subyacentes involucrados.
Otra forma de regulación epigenética implicada en la memoria y la adicción es la generación de microRNAs. Estos pequeños ARN no codificantes se unen a regiones complementarias de ARNm y, por lo tanto, suprimen su traducción o inducen su degradación. La eliminación de Argonaut, una proteína crucial para el procesamiento de los miRNAs, altera las respuestas de comportamiento a la cocaína, con efectos distintos observados para las neuronas espinosas medianas de tipo D1 versus D2.54 También se ha demostrado que varios miRNAs específicos están regulados por la exposición al fármaco y, a su vez, influyen en las respuestas de comportamiento a los fármacos (por ejemplo, refs 55,56). Será emocionante en futuros estudios identificar los objetivos de ARNm de estos miARN y caracterizar cómo afectan el proceso de adicción.
Plasticidad sinaptica
Los mismos tipos generales de modificaciones sinápticas en las sinapsis glutamatérgicas, que se han relacionado con el hipocampo y la amígdala en la memoria conductual (véanse otros artículos de este número), también se ha demostrado que ocurren en las regiones de recompensa cerebral en los modelos de adicción y que son importantes para mediar el proceso de adiccion.57,58 Dicha plasticidad sináptica inducida por fármacos se ha descrito en varias regiones del cerebro, sin embargo, nos concentramos aquí en NAc, donde la mayor parte de la investigación se ha centrado hasta la fecha. (Figura 2 y XNUMX).
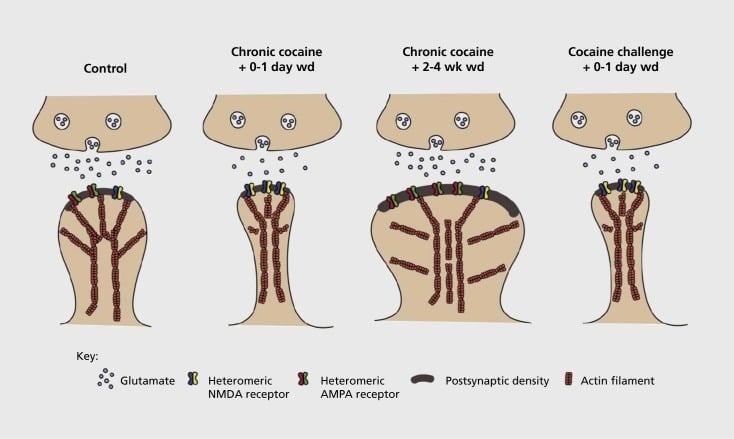
Modelo de plasticidad sináptica y estructural relacionada con la adicción en el núcleo accumbens (NAc). La exposición crónica a la cocaína da lugar a una reorganización temporal y dependiente del ácido α-amino-3-hidroxi-5-metil-4-isoxazolepropiónico (AMPA) y del ácido N-metil-D-aspártico (NMDA) en medio NAc Sinapsis de la neurona espinosa (MSN), así como cambios estructurales en la cabeza de la columna vertebral de las MSN con NAc que se correlacionan con distintas formas de plasticidad sináptica. Por ejemplo, la cocaína crónica induce la expresión en la superficie de los receptores de NMDA, la formación silenciosa de sinapsis y la depresión a largo plazo (LTD) en los primeros puntos de retiro. Durante la abstinencia más prolongada (wd), estos cambios sinápticos se revierten y el resultado es un aumento de la expresión de los receptores de AMPA de superficie, una consolidación de la sinapsis en una columna vertebral en forma de hongo y una potenciación a largo plazo (LTP). Estos efectos vuelven a recuperarse rápidamente al exponerse a una dosis de cocaína de prueba, lo que lleva a la reestructuración de la columna vertebral en espinas delgadas y una depresión de la fuerza sináptica.
Los experimentos iniciales demostraron que la exposición repetida a drogas estimulantes de abuso induce un estado similar a LTD (depresión a largo plazo) en las sinapsis glutamatérgicas en la NAc.59 Sin embargo, trabajos más recientes han demostrado que dicha plasticidad es altamente dependiente del tiempo, con LTD que ocurre temprano después de que la última exposición a la cocaína evoluciona a un estado similar a LTP (potenciación a largo plazo) después de un tiempo de retiro más prolongado.60,61 Este trabajo, que hasta la fecha se ha llevado a cabo principalmente mediante el uso de fármacos administrados por el investigador, a diferencia de los autoadministrados, ha definido la necesidad de investigaciones más sistemáticas en los modelos de autoadministración que rastrean las formas de plasticidad sináptica que se producen en las sinapsis glutamatérgicas en NAc a lo largo de un curso de tiempo detallado desde la adquisición de la autoadministración hasta su mantenimiento, a través de diferentes momentos de retiro y extinción, y en respuesta a estímulos que provocan recaídas. El trabajo hasta la fecha también ha definido algunos de los mecanismos moleculares que contribuyen a esta plasticidad sináptica inducida por fármacos, incluido el tráfico de receptores de AMPA a la sinapsis, tal vez mediado en parte a través de CaMKII (Ca2+/ proteína dependiente de la calmodulina quinasa II) fosforilación de ciertas subunidades del receptor AMPA, así como la expresión alterada de las subunidades del receptor AMPA (por ejemplo, 60,62-65, Figuras 2 y 3). Un papel para CREB y ΔFosB se ha implicado en estos fenómenos, así como en los cambios asociados en la morfología de las sinapsis glutamatérgicas (ver más abajo). Por ejemplo, GluAl es un objetivo para CREB en NAc, donde GluA2 y CaMKII son objetivos de ΔFosB, en esta región del cerebro .35,36,66,67 En el futuro, será importante vincular adaptaciones específicas a cambios dependientes del tiempo en la función sináptica y las características de comportamiento de la adicción.
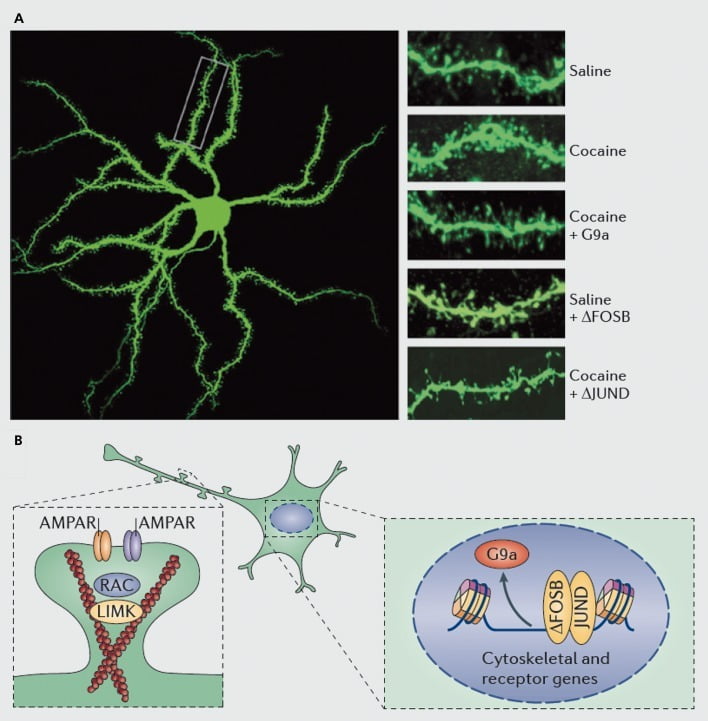
Mecanismos moleculares subyacentes a la inducción de cocaína de espinas dendríticas en neuronas espinosas medianas del núcleo accumbens (NAc). A) muestra aumentos inducidos por la cocaína en el número de espinas dendríticas que pueden bloquearse por la sobreexpresión viral de G9a o JunD (un antagonista de la transcripción mediada por AP1), o imitarse por la sobreexpresión viral de FosB. B) Se ha demostrado que la regulación del tráfico del receptor AMPA (AMPAR) y del citoesqueleto de actina (izquierda), así como la regulación de la transcripción de los receptores de glutamato y las proteínas reguladoras de actina (p. Ej., Mediada por ΔFosB, derecha) desempeñan funciones importantes en la mediación de la regulación de la cocaína de la densidad de la columna dendrítica de NAc. UMK, quinasa de dominio LIM; RAC, sustrato de toxina botulínica C3 relacionada con Ras.
Las nuevas herramientas experimentales hacen posible por primera vez definir con mayor precisión qué circuitos particulares muestran estas formas de plasticidad sináptica y qué anomalías de comportamiento median. Por ejemplo, tLas subregiones de concha y núcleo de NAc muestran diferencias en la plasticidad sináptica inducida por fármacos, al igual que las neuronas espinosas medianas de tipo D1 versus D2 dentro de cada subregión.60,63,64,67 Del mismo modo, los experimentos optogenéticos han proporcionado una nueva perspectiva sobre la contribución de una forma particular de plasticidad sináptica (p. Ej., LTD) en poblaciones específicas de sinapsis glutamatérgicas en NAc, por ejemplo, las que surgen de PFC medial versus amígdala basolateral versus subiculum ventral del hipocampo).68–70 En última instancia, será necesario superponer las adaptaciones moleculares inducidas por drogas en cada una de estas neuronas aferentes con adaptaciones específicas de la sinapsis que ocurren en sus dendritas postsinápticas para compilar una comprensión completa de cómo las drogas de abuso modifican los circuitos del cerebro para impulsar aspectos particulares del cerebro. estado adicto. Este esfuerzo requerirá una mayor apreciación de la plasticidad inducida por fármacos en las sinapsis inhibidoras dentro de estas mismas regiones del cerebro, un área que ha recibido muy poca atención hasta la fecha.65
Plasticidad celular entera
Si bien la mayoría de las investigaciones que involucran cambios neurofisiológicos en las neuronas en los fenómenos de abuso de drogas, como en los fenómenos de aprendizaje y memoria, se han centrado en la plasticidad sináptica, también hay evidencia creciente de la importancia de la plasticidad de la célula entera. Plasticidad de células enteras, también conocida como plasticidad homeostática,71 implica cambios en la excitabilidad intrínseca de una célula nerviosa completa de una manera que no es específica de sinapsis. Dado que ciertas características de la adicción a las drogas implican una mayor o menor sensibilidad a una droga, tiene sentido que la mayor o menor excitabilidad eléctrica de ciertas células nerviosas contribuya a estas adaptaciones de comportamiento..5
La El mejor ejemplo establecido de plasticidad de células enteras a una droga de abuso es la capacidad de los opiáceos crónicos para aumentar la excitabilidad intrínseca de las neuronas noradrenérgicas del locus coeruleus (LC).).72 Este aumento de la excitabilidad está mediado a través de CREB y su inducción de ciertas isoformas de la adenilil ciclasa, que impulsa el aumento de la activación de las neuronas LC, tal vez a través de la inducción de canales de Na +.72–75 Esta hiperexcitabilidad de las neuronas LC representa un mecanismo clásico de tolerancia y dependencia e impulsa algunos de los signos y síntomas de la abstinencia de opiáceos. Curiosamente, CREB media una forma similar de plasticidad de células enteras en neuronas espinosas medianas NAc, que también se vuelven hiperexcitables por exposición crónica a drogas de abuso a través de CREB.76 Por lo tanto, será crítico en futuras investigaciones para comprender cómo la plasticidad sináptica mediada por CREB de las sinapsis glutamatérgicas en las neuronas espinosas del medio NAc65,66 se suman con la hiperexcitabilidad intrínseca mediada por CREB de estas neuronas76 Para controlar las características de comportamiento de la adicción.
Otro ejemplo de la plasticidad de células enteras en los modelos de adicción es la hiperexcitabilidad de las neuronas de dopamina VTA que se produce después de la exposición crónica a medicamentos opiáceos de abus.y (Figura 4 y XNUMX).77,78 Esta adaptación, que se ha relacionado con cambios morfológicos en estas células nerviosas (ver la siguiente sección), no está mediada por CREB, sino que se logra a través de la regulación de las cascadas de señalización neurotróficas, como se describe a continuación.

Modelo de trabajo de las adaptaciones crónicas inducidas por la morfina en las neuronas dopaminérgicas del área tegmental ventral (VTA). La morfina crónica disminuye el tamaño del soma de dopamina (DA) VTA pero aumenta la excitabilidad neuronal, mientras que la transmisión de dopamina al núcleo accumbens disminuye. El efecto neto de la morfina es una vía de recompensa menos sensible, es decir, la tolerancia de la recompensa. La regulación a la baja de la señalización IRS2-AKT en VTA media los efectos de la morfina crónica en el tamaño del soma y la excitabilidad eléctrica; el efecto sobre la excitabilidad está mediado por la disminución de las corrientes de ácido γ-aminobutírico (GABA) A y la supresión de la expresión del canal de K '. La regulación a la baja inducida por la morfina de la actividad mTORC2 en VTA es crucial para estas adaptaciones morfológicas y fisiológicas inducidas por la morfina, así como para la tolerancia de la recompensa. En contraste con mT0RC2, la morfina crónica aumenta la actividad de mTORCI, lo que no influye en estas adaptaciones inducidas por la morfina. BDNF, factor neurotrófico derivado del cerebro; IRS, sustancia receptora de insulina; mTORC, complejo mTOR; AKT, proteína quinasa B reproducida de la referencia 77
Plasticidad morfológica y mecanismos neurotróficos.
La evidencia creciente, en gran parte de estudios de neuronas corticales del hipocampo y del cerebro, ha demostrado que los cambios en la plasticidad sináptica se asocian con cambios morfológicos en las sinapsis. Por ejemplo, la LTD y la generación de sinapsis silenciosas están asociadas con la formación de espinas dendríticas delgadas o rechonchas, mientras que la LTP se asocia con espinas más grandes con forma de seta.79,80 Por tanto, es interesante que el campo del abuso de drogas se haya centrado en los cambios inducidos por las drogas en las espinas dendríticas durante más de 15 años. Exposición crónica a Las drogas estimulantes del abuso aumentan la densidad de la columna dendrítica de las neuronas espinosas medias de la NAc, un cambio que predomina para las neuronas de tipo Dl..67,81,82 La inducción de espinas se ha asociado en su mayor parte con respuestas de comportamiento sensibilizadas a estos fármacos, aunque algunas pruebas están en conflicto con esta opinión.
Sin embargo, al igual que con los estudios de plasticidad sináptica, se necesita mucho más trabajo para definir sistémicamente los cambios en las espinas dendríticas que ocurren durante un curso de autoadministración, retiro y recaída de medicamentos. SLos estudios realizados hasta la fecha, que incluyen el investigador y el fármaco autoadministrado, sugieren cambios muy diferentes en la columna vertebral que ocurren en diferentes puntos de tiempo de retiro y en subregiones NAc versus núcleo..83–86 También será importante definir los mecanismos moleculares precisos mediante los cuales la cocaína u otro estimulante produce estos efectos específicos de tipo celular y dependientes del tiempo. Se ha demostrado que osFosB es tanto necesario como suficiente para la inducción de espinas inmaduras en neuronas NAc de tipo Dl.35,51,67 Dicha regulación se produce junto con la regulación de cocaína y ΔFosB de varias proteínas conocidas para controlar la reorganización del citoesqueleto de actina. Como solo un ejemplo, la regulación transcripcional de varios factores de intercambio de nucleótidos de guanina y las proteínas activadoras de GTPasa son Rac1, una pequeña GTPasa, para disminuciones transitorias de la actividad en respuesta a cada exposición a la cocaína, y dichas reducciones pulsátiles en la actividad de Rac1 se han demostrado, utilizando control optogenético. de Rac1, para mediar la inducción de espinas inmaduras.87 Es probable que estos efectos de Racl se produzcan a través de su control de la cofilina y otras proteínas reguladoras de la actina, que también se ha demostrado que median la regulación de la cocaína en el crecimiento de la columna vertebral.87,88 Sin embargo, es importante enfatizar que esta es solo una vía involucrada en la regulación de la cocaína de las espinas inmaduras, ya que se ha demostrado que varias otras proteínas también juegan un papel esencial, incluyendo CDK5 (quinasa dependiente de ciclina-5), CaMKII, NFkB , MEF2, CREB, G9a y DNMT3 (ADN metiltransf borrar 3a), por nombrar algunos.20,21,35,51,67,89,90 Curiosamente, la regulación de la cocaína de varios de estos genes, incluida la inducción de CDK5, CaMKII y NFkB, y la represión de G9a, también está mediada a través de ΔFosB.20,35,51,91
Sorprendentemente, las drogas de abuso de opiáceos ejercen el efecto opuesto y reducen la densidad de la columna dendrítica de las neuronas espinosas del medio NAc.81 Poco se sabe sobre las consecuencias conductuales de esta adaptación y los mecanismos moleculares subyacentes involucrados. Este fenomeno es sin embargo, es sorprendente, dado que tanto los estimulantes como los opiáceos inducen a CREB y ΔFosB, y ambos están implicados en la inducción mediada por estimulantes de la densidad de la columna dendrítica NAc. Esto plantea la cuestión de cómo los opiáceos suprimen la densidad de la columna vertebral NAc a pesar de su inducción de estos factores.
La otra forma principal de plasticidad morfológica que se observa en los modelos de abuso de drogas es la reducción física del tamaño del soma celular de las neuronas de dopamina VTA inducidas por la administración crónica de opiáceos..77,92,93 Una adaptación similar ocurre en respuesta a los cannabinoides.94 Esta reducción de las neuronas dopaminérgicas VTA, que se produce con la autoadministración de opiáceos93 y ha sido documentado en adictos a la heroína humana examinados postmortem,77 parece mediar la tolerancia de la recompensa y se asocia con una menor liberación de dopamina en la NAc. Una evidencia considerable ahora indica que esta reducción en el tamaño del tumor celular está mediada por la supresión de opiáceos de la expresión del factor neurotrófico derivado del cerebro (BDNF) dentro de estas neuronas. Hemos vinculado directamente esta retirada inducida por opiáceos del soporte de BDNF y la contracción de las neuronas VTA, a la actividad reducida de las cascadas de señalización BDNF en las neuronas de dopamina VTA, específicamente la actividad reducida de IRS2 (sustrato del receptor de insulina-2), AKT (una serina-treonina). quinasa) y TORC2 (objetivo de la rapamicina-2, que es insensible a la rapamicina).77,93 También hemos vinculado esta regulación a la baja de la señalización de BDNF directamente al aumento de la excitabilidad que la morfina induce en estas neuronas, como se señaló anteriormente.77,78 De hecho, el tamaño reducido del soma celular y el aumento de la excitabilidad están estrechamente vinculados, ya que la inducción de uno conduce al otro y viceversa. Este control sobre la excitabilidad celular implica la supresión de K+ Canales y de GABA.A Corriente en estas neuronas.
Este rol de BDNF en el control de las respuestas de morfina a nivel de VTA contrasta con su participación muy diferente en las acciones de la cocaína y otros estimulantes. Los estimulantes inducen la señalización de BDNF a la NAc, un efecto debido al aumento de la síntesis local de BDNF, así como al aumento de la liberación de varias regiones aferentes.95 Además, se ha demostrado que el aumento de la señalización de BDNF en NAc, pero no en el VTA, promueve los efectos de comportamiento de estos fármacos, incluida su autoadministración.95,96 La regulación opuesta de la señalización de BDNF en la vía VTA-NAc por opiáceos versus estimulantes plantea la posibilidad de que tales diferencias medien la regulación opuesta de las drogas de las espinas dendríticas de NAc, una posibilidad ahora bajo investigación.
Direcciones futuras
La narración anterior subraya los tremendos avances que se han hecho en la comprensión de las adaptaciones moleculares y celulares que ocurren en las regiones de recompensa cerebral en respuesta a la exposición repetida a una droga de abuso, y en la relación de las adaptaciones individuales a ciertas características de comportamiento de los síndromes de adicción en modelos animales. . A pesar de estos avances, quedan grandes preguntas. La mayor parte de nuestro conocimiento existente se centra en el VTA y el NAc, con mucha menos información disponible sobre otras regiones clave del cerebro límbico que también son cruciales para la adicción a las drogas. Además, todas las demostraciones experimentales del papel causal de una adaptación molecular-celular en un comportamiento relacionado con el fármaco han manipulado las adaptaciones individuales de una en una. Manipular numerosas adaptaciones al mismo tiempo es claramente mucho más difícil, pero también es esencial, ya que sabemos que las drogas producen una gran cantidad de tipos dispares de cambios incluso dentro de las neuronas individuales, que probablemente se suman en formas complicadas de influir en el comportamiento. Tal enfoque de biología de sistemas será crucial para finalmente romper las bases biológicas de la adicción. Finalmente, los esfuerzos para comprender los mecanismos moleculares-celulares de las memorias relacionadas con la adicción se encuentran en el punto en el que todos los demás esfuerzos para entender las bases biológicas de la memoria conductual ahora tienen dificultades: nuestra capacidad para relacionar los fenómenos biológicos con la memoria conductual compleja sigue siendo extremadamente difícil. Superar esta división representa quizás el mayor desafío en las neurociencias.
AGRADECIMIENTOS
Este trabajo fue apoyado por becas del Instituto Nacional sobre el Abuso de Drogas.
Abreviaturas y siglas seleccionadas
- Nac
- núcleo accumbens
- CREB
- proteína de unión al elemento de respuesta AMPc
- ΔFosB
- un factor de transcripción de la familia Fos
- VTA
- área tegmental ventral
- AMPA
- Ácido α-amino-3-hidroxi-5-metil-4-isoxazolepropiónico
- LTD
- depresión a largo plazo
- LTP
- protentiación a largo plazo
- BDNF
- factor neurotrófico derivado del cerebro
- NKkB
- factor nuclear kB
Referencias