Comentarios: Esta revisión fue producida por la jefa de NIDA, Nora Volkow, y su equipo. Deja pocas dudas de que las adicciones químicas y las adicciones conductuales comparten mecanismos y circuitos neuronales similares o similares. Esto tiene mucho sentido, ya que las adicciones químicas secuestran los circuitos neuronales para la unión, el sexo y la alimentación. Dado que el sexo libera dos veces más dopamina que comer tu comida favorita, y un usuario de pornografía puede mantenerla elevada durante horas, es una locura proponer que la adicción a la pornografía no puede existir.
Curr Top Behav Neurosci. 2011 Oct 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
Fuente
Instituto Nacional sobre el Abuso de Drogas, 6001 Executive Boulevard 6001, Sala 5274, Bethesda, MD, 20892, EE. UU., [email protected].
Resumen
Tanto la adicción a las drogas como la obesidad pueden definirse como trastornos en los cuales el valor de saliencia de un tipo de recompensa (drogas y alimentos, respectivamente) se incrementa de manera anormal en relación con otros y a expensas de otros. Este modelo es consistente con el hecho de que tanto las drogas como los alimentos tienen poderosos efectos reforzantes -en parte mediados por aumentos de dopamina en el sistema límbico- que, bajo ciertas circunstancias o en individuos vulnerables, podrían abrumar los mecanismos de control homeostático del cerebro. Tales paralelos han generado un interés significativo en la comprensión de las vulnerabilidades y trayectorias compartidas entre la adicción y la obesidad. Ahora, los descubrimientos de imágenes cerebrales han comenzado a descubrir características comunes entre estas dos condiciones ya delinear algunos de los circuitos cerebrales superpuestos cuyas disfunciones pueden explicar los déficits de comportamiento estereotipados y relacionados en sujetos humanos. TEstos resultados sugieren que tanto los individuos obesos como los adictos a las drogas sufren alteraciones en las vías dopaminérgicas que regulan los sistemas neuronales asociados no solo con la sensibilidad de recompensa y la motivación de incentivo, sino también con el condicionamiento (memoria / aprendizaje), el control de los impulsos (inhibición del comportamiento) y la reactividad al estrés. , y la conciencia interoceptiva. Aquí, integramos los hallazgos predominantemente derivados de la tomografía por emisión de positrones que arrojan luz sobre el papel de la dopamina en la adicción a las drogas y en la obesidad, y proponemos un modelo de trabajo actualizado para ayudar a identificar estrategias de tratamiento que puedan beneficiar ambas afecciones.
1 Antecedentes
2 El papel de la dopamina en la recompensa aguda a las drogas y los alimentos
3 Imágenes de DA en respuesta a drogas y señales condicionadas en adicción
4 El impacto de la disfunción en el control inhibitorio
5 Implicación de los circuitos de motivación.
6 Implicación del circuito interoceptivo
7 El circuito de la aversión
8 Medicamento patológico y recompensa de alimentos: un modelo de trabajo actualizado
1 Antecedentes
La dopamina (DA) se considera clave para los efectos gratificantes de las recompensas naturales y de drogas. Sin embargo, su papel en la pérdida de control y los comportamientos compulsivos asociados con la adicción y la obesidad son mucho menos claros. Los estudios de PET han desempeñado un papel crucial en la caracterización del papel de los sistemas DA cerebrales en la adicción (además de su papel en la recompensa de medicamentos) y en la obesidad. De hecho, las drogas de abuso (incluido el alcohol) son consumidas por los seres humanos o autoadministradas por animales de laboratorio porque son inherentemente gratificantes, un efecto que se media a través de sus propiedades de mejora de la DA en el sistema mesolímbico (Wise 2009). HSin embargo, en el caso de la adicción, los estudios de imagen han revelado que el trastorno afecta no solo al circuito de recompensa de la DA, sino también a otras vías de la DA involucradas en la modulación del condicionamiento / hábitos, la motivación y las funciones ejecutivas (control inhibitorio, atribución de saliencia y decisión). y las deficiencias de DA también pueden participar en la mayor reactividad al estrés y la interrupción de la conciencia interoceptiva asociada con la adicción. Los estudios preclínicos y clínicos también han revelado otros neurotransmisores (y neuropéptidos) que desempeñan funciones importantes en la recompensa de medicamentos y la adicción. (es decir, cannabinoides, opioides) y están íntimamente involucrados en los cambios neuroplásticos que siguen al uso repetido de drogas (es decir, glutamato, opioides, GABA, factor liberador de corticotropina). El sistema glutamatérgico es particularmente prominente en este sentido porque media las interrupciones en la potenciación a largo plazo y la depresión a largo plazo que se han observado en modelos animales de administración crónica de medicamentos. (Thomas et al. 2008). Las revisiones relativas a estos sistemas adicionales se pueden encontrar en otros lugares (Kalivas 2009; Koob 1992).
Dado que los fármacos activan los mismos sistemas de recompensa que subyacen a la recompensa de alimentos, no es del todo inesperado que, en general, los estudios de imágenes cerebrales hayan apoyado la idea de que las alteraciones en los circuitos modulados con DA también están implicadas en conductas alimentarias compulsivas y patológicas.. Los indicios de alimentos, como los indicios de drogas, aumentan el DA extracelular estriado y motivan a participar en los comportamientos necesarios para adquirir y comer los alimentos, lo que proporciona evidencia de la participación del DA no solo en la recompensa de los alimentos sino también en la motivación no hedónica las propiedades de los alimentos (es decir, los requisitos calóricos) y la disminución del control inhibitorio observada en la ingesta compulsiva (Avena et al. 2008; Volkow et al. 2008a).
Aquí, revisamos los hallazgos de estudios de imágenes que se enfocan específicamente en las superposiciones en los circuitos cerebrales que están alterados en la obesidad y en la adicción a las drogas. Vale la pena recordar, sin embargo, que la regulación de los comportamientos de la ingesta de alimentos es mucho más compleja que la regulación de la ingesta de medicamentos. Este último está predominantemente mediado por los efectos gratificantes de los medicamentos, mientras que el primero está modulado no solo por sus efectos gratificantes (factores hedónicos) sino también por múltiples factores periféricos y centrales que detectan los requerimientos de nutrientes en el cuerpo necesarios para la supervivencia (factores homeostáticos). Curiosamente, existe una creciente evidencia de que los factores homeostáticos (p. Ej., Insulina, leptina, grelina) modulan la ingesta de alimentos en parte al aumentar o disminuir la sensibilidad de los circuitos de recompensa cerebral a los estímulos alimentarios (Volkow et al. 2011a).
2 El papel de la dopamina en la recompensa aguda a las drogas y los alimentos
Ya sea directa o indirectamente, todas las drogas adictivas muestran la capacidad de aumentar la DA en el núcleo accumbens (NAc) a través de interacciones específicas con diferentes objetivos moleculares (Nestler 2004) (Higo. 1). La vía mesolímbica de la DA [células DA en el área tegmental ventral (VTA) que se proyecta en la NAc] parece ser crucial para la recompensa del fármaco (Wise 2009). Sin embargo, como se describe a continuación, otras vías DA [mesostriatal (células DA en la sustancia negra que se proyectan en el estriado dorsal) y mesocortical (células DA en la VTA que se proyectan en la corteza frontal)] también contribuyen a la recompensa y adicción a las drogas (Wise 2009). En general, parece que los efectos de recompensa y condicionamiento de las drogas son impulsados predominantemente por el disparo de células DA fásicas, lo que conduce a aumentos de DA grandes y transitorios. En contraste, los cambios posteriores en la función ejecutiva que se producen en la adicción están relacionados con los cambios en el disparo de las células tónicas DA y dan como resultado niveles de DA más bajos pero más estables (Grace) 2000; Wanat et al. 2009). Esto, a su vez, apunta a los receptores D1 (D1R), que son receptores DA de baja afinidad que estimulan la señalización AMP cíclica, ya que participan tanto en la recompensa aguda del fármaco como en el acondicionamiento, ya que están asociados con las altas concentraciones de DA necesarias. Para estimular el D1R. En contraste, los D2R, que inhiben la señalización AMP cíclica, son estimulados por DA tanto fásicas como tónicas. Tenga en cuenta que, debido a la falta de radiotrazadores específicos para las imágenes PET de los receptores de DA de los tipos D1, D3, D4 y D5, la mayoría de los estudios sobre los efectos de las drogas de abuso y adicción en el cerebro humano se han centrado en los D2R.
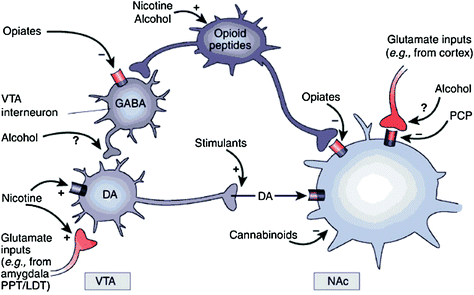
Las drogas de abuso actúan sobre la recompensa y los circuitos auxiliares a través de diferentes mecanismos, sin embargo, todos conducen a efectos dopaminérgicos similares en el VTA y NAc.. Por lo tanto, los estimulantes estimulan el DA acumbal directamente, mientras que los opiáceos lo hacen disminuyendo el tono inhibitorio de las interneuronas GABAérgicas en la señalización del DA tanto en el VTA como en el NAc. Si bien los mecanismos de otras drogas de abuso son menos claros, existe evidencia que sugiere que la nicotina puede activar VTA DA directamente a través del receptor nicotínico de acetilcolina (nAChR) en esas neuronas e indirectamente a través de la estimulación de sus receptores en los terminales nerviosos glutamatérgicos que inervan las células DA. El alcohol parece inhibir los terminales GABAérgicos en VTA, lo que lleva a la desinhibición de las neuronas DA en el VTA. Los cannabinoides actúan, entre otros, a través de la activación de los receptores CB1 en las terminales nerviosas glutamatérgica y GABAérgica en la NAc, y en las propias neuronas NAc. La fenciclidina (PCP) puede actuar inhibiendo los receptores de glutamato postsinápticos NMDA en la NAc. Además, hay algunas pruebas que sugieren que la nicotina y el alcohol también pueden interactuar con las opioides endógenas y las vías cannabinoides (no se muestra). PPT / LDT, tegmento pontino peduncular / tegmento dorsal lateral. Reimpreso con permiso Nestler (2005)
En humanos, los estudios de PET han demostrado que varios medicamentos [estimulantes (Drevets et al. 2001; Volkow et al. 1999b), nicotina (Brody et al. 2009), alcohol (Boileau et al. 2003), y la marihuana (Bossong et al. 2009)] aumentar la DA en el cuerpo estriado dorsal y ventral (donde se localiza la NAc). Estos estudios aprovechan varios radiotrazadores, tales como [11C] racloprida, que se une a D2R pero solo cuando no es un DA endógeno (desocupado), que en condiciones basales corresponde al 85 – 90% del D2R estriado (Abi-Dargham et al. 1998). Así, una comparación de [11C] la unión de raclopride después de placebo y después de la administración del fármaco puede ayudarnos a estimar las disminuciones en la disponibilidad de D2R inducida por el fármaco (u otros estímulos que pueden aumentar la DA). Estas disminuciones en [11C] la unión de raclopride es proporcional a los aumentos de DA (Breier et al. 1997). Estos estudios han demostrado que los aumentos de DA en el estriado inducidos por fármacos son proporcionales a la intensidad de la experiencia subjetiva de euforia o "alta" [ver revisión (Volkow et al. 2009a)] (Higo. 2).
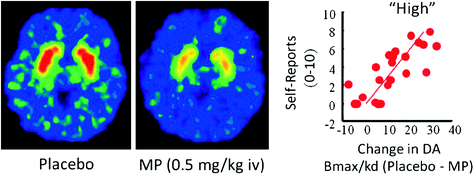
Efectos del metilfenidato (MP) intravenoso en la unión de racloprida y la relación entre los aumentos de DA estriatales inducidos por MP en el estriado y los autoinformes de "alto". Modificado de Volkow et al. (1999b)
Los estudios PET también han revelado una relación clara y directa entre el perfil farmacocinético de un fármaco (es decir, la velocidad con la que entra y sale del cerebro) y sus efectos de refuerzo. Específicamente, cuanto más rápido llegue un fármaco a los niveles máximos en el cerebro, más intenso será el "alto" (Volkow et al. 2009a). Por ejemplo, para un nivel equivalente de cocaína que llega al cerebro (evaluado a través de PET), cuando la cocaína ingresó al cerebro rápidamente (administración fumada o iv), provocó un "alto" más intenso que cuando ingresó a un ritmo más lento (resoplido) (Volkow et al. 2000). Esto es consistente con estudios preclínicos que muestran una correlación similar entre el perfil farmacocinético de un fármaco y sus propiedades de refuerzo (Balster y Schuster 1973). yoEs razonable suponer que dichos incrementos abruptos y grandes de DA, desencadenados por drogas de abuso, pueden imitar los aumentos rápidos y grandes de DA que resultan de los disparos de DA fásicos que se han asociado, en el cerebro, con el procesamiento de información sobre recompensa y saliencia. (Schultz 2010). Estos aumentos de DA inducidos por drogas en la NAc pueden ser necesarios para la adicción, pero el hecho de que ocurran también en individuos no adictos indica que son insuficientes para explicar el uso de drogas impulsivo y compulsivo característico de la adicción.
Ahora hay evidencia de que las respuestas dopaminérgicas comparables están vinculadas con la recompensa de alimentos y que estos mecanismos también pueden desempeñar un papel en el consumo excesivo de alimentos y la obesidad. Es bien sabido que ciertos alimentos, particularmente aquellos ricos en azúcares y grasas, son potencialmente gratificantes (Lenoir et al. 2007). Los alimentos ricos en calorías pueden promover comer en exceso (comer que no está unido a las necesidades energéticas) y desencadenar asociaciones aprendidas entre el estímulo y la recompensa (condicionamiento). En términos evolutivos, esta propiedad de los alimentos sabrosos solía ser ventajosa en entornos donde las fuentes de alimentos eran escasas y / o poco confiables, porque aseguraba que los alimentos se consumieran cuando estaban disponibles, lo que permitía que la energía se almacenara en el cuerpo (como grasa) para uso futuro. . Desafortunadamente, en sociedades como la nuestra, donde la comida es abundante y está disponible constantemente, esta adaptación se ha convertido en una responsabilidad.
Varios efectos neurotransmisores, incluyendo DA, cannabinoides, opioides y serotonina, así como hormonas y neuropéptidos involucrados en la regulación homeostática de la ingesta de alimentos, como la insulina, orexina, leptina y grelina, han sido implicados en los efectos gratificantes de la comida (Atkinson 2008; Cason et al. 2010; Cota et al. 2006). De estos, el DA ha sido el más investigado y es el mejor caracterizado. Los experimentos en roedores han demostrado que, al exponerse por primera vez a una recompensa de alimentos, la activación de las neuronas DA en el VTA aumenta con el consiguiente aumento de la liberación de DA en NAc (Norgren et al. 2006). De manera similar, en sujetos humanos sanos y de peso normal, se ha demostrado que la ingesta de alimentos sabrosos libera DA en el cuerpo estriado dorsal en proporción a las calificaciones de amabilidad de las comidas (Small et al. 2003) (Higo. 3). Sin embargo, y como se ha observado en estudios con drogadictos, los aumentos inducidos por los alimentos en DA estriatal por sí solos no pueden explicar la diferencia entre la ingesta normal de alimentos y el consumo compulsivo excesivo de alimentos, ya que estos también ocurren en individuos sanos que no comen en exceso. Por lo tanto, como es el caso de la adicción, es probable que las adaptaciones posteriores estén involucradas en la pérdida de control sobre la ingesta de alimentos.
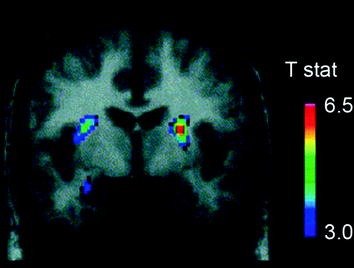
La liberación de dopamina inducida por la alimentación. Sección coronal del mapa T de reducciones estadísticamente significativas en [11C] potencial de unión de raclopride (BP) después de la alimentación. La barra de color representa los valores estadísticos t. (Reimpreso con permiso Small et al. 2003)
3 Imágenes de DA en respuesta a drogas y señales condicionadas en adicción
El papel de DA en el refuerzo es más complejo que solo codificar la recompensa per se (placer hedónico); por ejemplo, los estímulos que inducen aumentos rápidos y grandes de DA también desencadenan respuestas condicionadas y provocan incentivos para obtenerlos (Owesson-White et al. 2009). Esto es importante porque, a través del proceso de condicionamiento, los estímulos neutros que están vinculados con el reforzador (ya sea un reforzador natural o con un fármaco) adquieren la capacidad de aumentar la DA en el estriado (incluida la NAc) antes de la recompensa, lo que genera una fuerte motivación para buscar la droga (Owesson-White et al. 2009). Sin embargo, el desacoplamiento de los mecanismos de recompensa y condicionamiento en el proceso de adicción a las drogas es más desafiante que para el consumo de alimentos porque las drogas de abuso, a través de sus efectos farmacológicos, activan directamente las neuronas DA (es decir, la nicotina) o aumentan la liberación de DA (es decir, la anfetamina).
Los estudios de imágenes cerebrales que compararon los aumentos de DA inducidos por el fármaco estimulante metilfenidato (MP) o anfetamina (AMPH) entre sujetos adictos a la cocaína versus controles mostraron una atenuación marcada de MP o aumentos de DA inducidos por AMPH en el estriado (50% más bajo en los abusadores detoxificados y 80% en abusadores activos) y menores autoinformes de los efectos gratificantes de la droga en relación con los controles que no consumen drogas (Martinez et al. 2007; Volkow et al. 1997) (Higo. 4). Esto fue sorprendente ya que MP y AMPH son farmacológicamente similares a la cocaína y la metanfetamina, respectivamente, y los drogadictos no pueden distinguirlos cuando se administran por vía intravenosa. Dado que las reducciones marcadas en los aumentos de DA inducidos por drogas se observaron si los consumidores de cocaína habían sido desintoxicados o no, esto indica que el estado de abstinencia no es un factor de confusión (Volkow et al. 2011b). Estos y resultados relacionados (Volkow et al. 2009a) son consistentes con la hipótesis de que la respuesta hedónica se vuelve deficiente en individuos adictos a las drogas, y refuerza aún más la noción de que los efectos farmacológicos agudos que aumentan la DA de la droga en NAc no pueden explicar por sí mismos la mayor motivación para consumirlos.
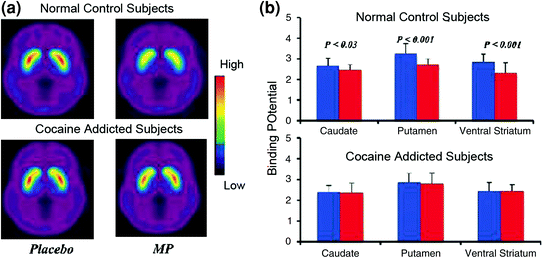
Cambios de DA inducidos por MP iv en controles y en sujetos activos adictos a la cocaína. a Imágenes de potencial de oferta no desplazable promedio (BPND) de [11C] racloprida en sujetos activos adictos a la cocaína (n = 19) y en controles (n = 24) probados después de placebo y después de MP. b Disponibilidad de D2R (BPND) en caudado, putamen y estriado ventral después de placebo (azul) y después de MP (rojo) en controles y en sujetos adictos a la cocaína. MP redujo D2R en controles pero no en sujetos adictos a la cocaína. Tenga en cuenta que los consumidores de cocaína muestran tanto disminuciones en la disponibilidad de D2R del estriado de referencia (medida de placebo) como disminuciones en la liberación de DA cuando se administra iv MP (medida como disminuciones en la disponibilidad de D2R desde el inicio). Aunque se podría cuestionar hasta qué punto la baja disponibilidad de D2R en el cuerpo estriado en sujetos adictos a la cocaína limita la capacidad de detectar nuevas disminuciones de MP, el hecho de que los sujetos adictos a la cocaína muestren reducciones en la disponibilidad de D2R cuando se expone a las señales de cocaína indica que los efectos atenuados de MP en [11C] raclopride vinculante refleja disminución de la liberación de DA. Reimpreso con permiso (Volkow et al. 1997; Wang et al. 2010)
La respuesta de las neuronas VTA DA a estímulos gratificantes cambia con la exposición repetida.
Mientras que las células DA se activan en la primera exposición a una recompensa novedosa, la exposición repetida a la DA hace que las neuronas dejen de activarse cuando se consumen las recompensas y cuando se exponen a estímulos que predicen la recompensa. (Schultz et al. 1997). Es probable que esto sea la base del papel de DA en el aprendizaje y el condicionamiento. De hecho, la señalización DA fásica inducida por fármacos puede eventualmente desencadenar neuroadaptaciones en circuitos auxiliares que están relacionados con la formación de hábitos y el condicionamiento del comportamiento. TEstos cambios son inducidos predominantemente por señalización D1R y cambios sinápticos en los receptores de NMDA y AMPA modulados con glutamato. (Luscher y Malenka 2011; Zweifel et al. 2009). El reclutamiento de estos circuitos es significativo en la progresión de la enfermedad porque las respuestas condicionadas subsiguientes ayudan a explicar el intenso deseo por la droga (deseo) y el uso compulsivo que se produce cuando los sujetos adictos están expuestos a señales asociadas con las drogas. Esta hipótesis es consistente con observaciones independientes (Volkow et al. 2006b; Wong et al. 2006) que muestran el poder de la exposición asociada a la cocaína para elevar los niveles de DA en el cuerpo estriado dorsal y desencadenar un aumento concomitante en la experiencia subjetiva del deseo de los consumidores de cocaína desintoxicados (Fig. 5). Dado que el cuerpo estriado dorsal desempeña un papel en el aprendizaje del hábito (Belin et al. 2009; Yin et al. 2004), es probable que la asociación refleje el fortalecimiento de los hábitos a medida que progresa la cronicidad de la adicción. Esto sugiere que una interrupción básica en la adicción podría estar relacionada con las respuestas condicionadas desencadenadas por el DA que resultan en hábitos que conducen a un deseo intenso y al consumo compulsivo de drogas. Curiosamente, al utilizar activamente sujetos adictos a la cocaína, los aumentos de DA desencadenados por señales condicionadas parecen ser incluso más grandes que los producidos por la droga estimulante en sí, según lo evaluado en dos grupos separados de sujetos (Volkow et al. 2011b, 2006b), sugiriendo que las respuestas condicionadas pueden impulsar la señalización de DA que mantiene la motivación para tomar el medicamento incluso cuando parece que se reducen sus efectos farmacológicos. Por lo tanto, aunque las drogas inicialmente pueden inducir sentimientos de recompensa inmediata a través de la liberación de DA en el estriado ventral, con uso repetido y a medida que se desarrolla el hábito, parece haber un cambio del fármaco al estímulo condicionado. Según estudios en animales de laboratorio, las proyecciones glutamatérgicas de la corteza prefrontal y de la amígdala a VTA / SN y NAc median estas respuestas condicionadas (Kalivas 2009). De esta manera, la mera predicción de una recompensa puede eventualmente convertirse en la recompensa que motiva el comportamiento necesario para el consumo de drogas (o alimentos).
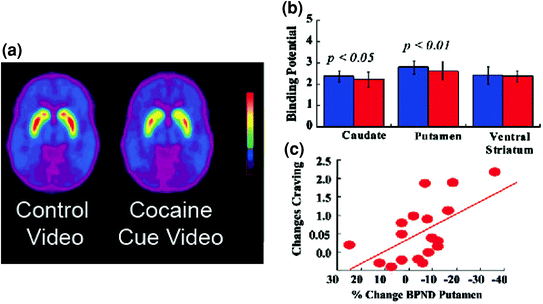
Cambios de DA inducidos por señales condicionadas en sujetos activos adictos a la cocaína. a Imágenes de potencial de unión no desplazable (BPND) promedio de [11C] raclopride en sujetos adictos a la cocaína (n = 17) probados mientras ve un video neutral (escenas de la naturaleza) y mientras mira un video de cuesillas de cocaína (sujetos que administran cocaína). b Disponibilidad de D2R (BPND) en caudado, putamen y estriado ventral para el video neutro (azul) y el video de señales de cocaína (rojo). Las señales de cocaína disminuyeron D2R en caudado y putamen. c Correlaciones entre los cambios en D2R (que reflejan los aumentos de DA) y los autoinformes del deseo de cocaína inducido por el video de señales de cocaína. Modificado de la ref. (Volkow et al. 2006b)
IAdemás, este tipo de "cambio" funcional también se ha reportado para reforzadores naturales, que probablemente induzcan un cambio equivalente y gradual en los aumentos de DA, desde regiones ventrales a más dorsales del estriado durante la transición de un estímulo nuevo que es inherentemente Recompensando a la de las claves asociadas que lo predicen. Esta transición se transmite a través de la señalización DA, que parece codificar un "error de predicción de recompensa" (Schultz 2010). Los extensos aferentes glutamatérgicos a las neuronas DA de las regiones involucradas en el procesamiento de la sensibilidad sensorial (ínsula o corteza gustativa primaria), homeostática (hipotálamo), recompensa (NAc), emocional (amígdala e hipocampo) y multimodal (corte orbitofrontal) para la importancia de la saliencia. , modular su actividad en respuesta a recompensas y señales condicionadas (Geisler y Wise 2008). Más específicamente, las proyecciones de la amígdala y la corteza orbitofrontal (OFC) a las neuronas DA y NAc están involucradas en las respuestas condicionadas a los alimentos (Petrovich 2010). De hecho, los estudios de imagen mostraron que cuando se les pedía a los sujetos masculinos no obesos que inhibieran su ansia de comer mientras estaban expuestos a las señales de los alimentos, exhibían una actividad metabólica disminuida en la amígdala y la OFC (así como en el hipocampo), la ínsula y el estriado. y que las disminuciones en la OFC se asociaron con reducciones en el deseo de alimentos (Wang et al. 2009). Se ha observado una inhibición similar de la actividad metabólica en la OFC (y también en la NAc) en los consumidores de cocaína cuando se les pidió que inhibieran su deseo de drogas al exponerse a señales de cocaína (Volkow et al. 2009b).
Aún así, la aparición de tales antojos poderosamente condicionados, que también se producen en personas sanas que no comen de más, no sería tan devastadora si no se juntaran con déficits crecientes en la capacidad del cerebro para inhibir conductas de mala adaptación.
4 El impacto de la disfunción en el control inhibitorio
La capacidad de inhibir las respuestas prepotentes está destinada a contribuir a la capacidad de un individuo para evitar comportamientos inapropiados, como tomar drogas o comer más allá del punto de saciedad, y así aumentar su vulnerabilidad a la adicción (o obesidad) (Volkow y Fowler 2000; Volkow et al. 2008a).
Los estudios PET han descubierto reducciones significativas en la disponibilidad de D2R en el cuerpo estriado de sujetos adictos que persisten durante meses después de una desintoxicación prolongada [revisado en (Volkow et al. 2009a)]. De manera similar, los estudios preclínicos en roedores y primates no humanos han demostrado que las exposiciones repetidas a los medicamentos están asociadas con reducciones en los niveles de D2R del cuerpo estriado (Nader et al. 2006; Thanos et al. 2007; Volkow et al. 2001). En el cuerpo estriado, los D2R median la señalización en la vía indirecta del cuerpo estriado que modula las regiones prefrontales; y se ha demostrado que su regulación a la baja aumenta la sensibilización a los efectos de los fármacos en modelos animales (Ferguson et al. 2011). En los seres humanos adictos a las drogas, la reducción del D2R estriatal se asocia con una disminución de la actividad de las regiones prefrontales, como lo demuestra la disminución del metabolismo basal de la glucosa (un marcador de la función cerebral) en la OFC, el giro cingulado anterior (ACC) y el córtex prefrontal dorsolateral (DLPFC) ) (Volkow et al. 2001, 1993, 2007) (Higo. 6). En la medida en que OFC, ACC y DLPFC están involucrados con la atribución de prominencia, el control inhibitorio / regulación de la emoción y la toma de decisiones, respectivamente, se ha postulado que su regulación inadecuada por la señalización DA mediada por D2R en sujetos adictos podría subyacer al mayor valor motivacional de las drogas en su comportamiento y la pérdida de control sobre la ingesta de drogas (Volkow y Fowler 2000). Además, debido a que las deficiencias en OFC y ACC están asociadas con conductas compulsivas e impulsividad (Fineberg et al. 2009), Es probable que la modulación de estas regiones por parte de la DA contribuya a la ingesta de drogas compulsiva e impulsiva observada en la adicción (Goldstein y Volkow 2002). De hecho, en los usuarios de metanfetamina, el D2R estriado bajo se asoció con la impulsividad (Lee et al. 2009), y también predijo la administración compulsiva de cocaína en roedores (Everitt et al. 2008). También es posible un escenario inverso, en el que una vulnerabilidad inicial para el uso de drogas preexiste en las regiones prefrontales, y mediante el cual el uso repetido de drogas provoca mayores disminuciones en el D2R del estriado. De hecho, un estudio realizado en sujetos que, a pesar de tener un alto riesgo de alcoholismo (antecedentes familiares positivos de alcoholismo) no eran alcohólicos, reveló una disponibilidad de D2R estriatal más alta de lo normal que se asoció con el metabolismo normal en OFC, ACC y DLPFC (Volkow et al. 2006a). Esto sugiere que, en estos sujetos con riesgo de alcoholismo, la función prefrontal normal estaba vinculada a una señalización D2R del estriado mejorada, que a su vez puede haberlos protegido del abuso de alcohol.
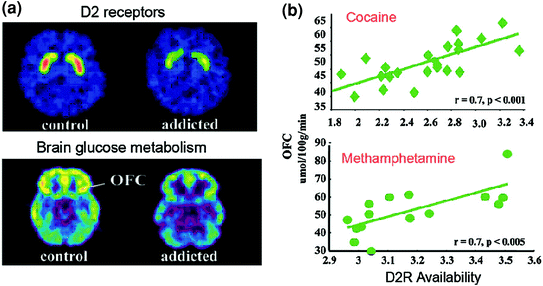
Correlaciones entre la disponibilidad de D2R del estriado y el metabolismo en las regiones cerebrales prefrontales. Imágenes cerebrales axiales para un control y para un sujeto adicto a la cocaína para imágenes de referencia. de la disponibilidad de D2R en el cuerpo estriado (obtenido con [11C] raclopride) y del metabolismo cerebral de la glucosa en OFC (obtenido con [18FDG). b Correlaciones entre el D2R estriado y el metabolismo en la OFC en sujetos adictos a la cocaína y adictos a la metanfetamina. Reimpreso de Volkow et al. (2009a) Copyright (2009), con permiso de Elsevier
Como era de esperar, también se ha encontrado evidencia de desregulación en los circuitos de control entre los individuos obesos. Tanto los estudios preclínicos como los clínicos han proporcionado evidencia de disminución de la señalización estriatal D2R, que, como se mencionó anteriormente, está relacionada con la recompensa (NAc), pero también con el establecimiento de hábitos y rutinas (estriado dorsal) en la obesidady (Geiger et al. 2009; Wang et al. 2001). Es importante destacar que la disponibilidad reducida de D2R estriatal se ha relacionado con la ingesta compulsiva de alimentos en roedores obesos (Johnson y Kenny 2010) y con una actividad metabólica disminuida en OFC y ACC en humanos obesos (Volkow et al. 2008b) (Higo. 7C.A). Dado que la disfunción en OFC y ACC resulta en compulsividad [ver revisión (Fineberg et al. 2009)], esto podría ser parte del mecanismo por el cual la señalización D2R del estriado bajo facilita la hiperfagia (Davis et al. 2009). Además, dado que la disminución de la señalización relacionada con D2R también es probable que reduzca la sensibilidad a otras recompensas naturales, este déficit en individuos obesos también podría contribuir a la sobrealimentación compensatoria. (Geiger et al. 2008).
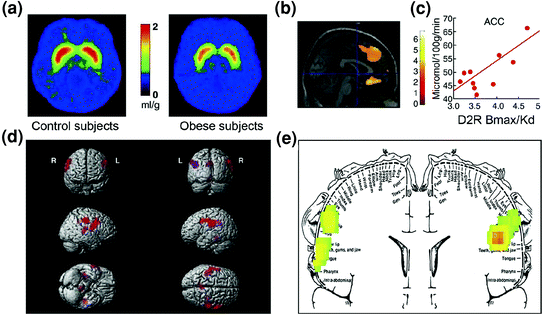
La hiperfagia podría resultar de un impulso para compensar un circuito de recompensa debilitado (procesado a través de circuitos corticostriatales regulados por dopamina) combinado con una mayor sensibilidad a la palatabilidad (propiedades hedónicas de los alimentos procesados en parte a través de la corteza somatosensorial). a Imágenes promediadas para la disponibilidad del receptor DA D2 (D2R) en controles (n = 10) y en sujetos con obesidad mórbida (n = 10). b Resultados de SPM (mapeo paramétrico estadístico) que identifica las áreas en el cerebro donde D2R se asoció con el metabolismo de la glucosa, estos incluyeron la OFC medial, ACC y la PFC dorsolateral (región no mostrada). c Pendiente de regresión entre D2R estriatal y actividad metabólica en ACC en sujetos obesos. d Imágenes SPM renderizadas en tres dimensiones que muestran las áreas con mayor metabolismo en sujetos obesos que en sujetos delgados (P <0.003, sin corregir). e Resultados de SPM codificados por colores que se muestran en un plano coronal con un diagrama superpuesto del homúnculo somatosensorial. Los resultados (valor z) se presentan usando la escala del arco iris donde rojo> amarillo> verde. En comparación con los sujetos delgados, los sujetos obesos tenían un mayor metabolismo basal en las áreas somatosensoriales donde están representados la boca, los labios y la lengua y que están involucrados con el procesamiento de la palatabilidad de los alimentos. Modificado, con autorización, de Volkow et al. (2008a) (a – c) y Wang et al. (2002(d, e)
Esta hipótesis es consistente con la evidencia preclínica que muestra que la disminución de la actividad de DA en VTA da como resultado un aumento dramático en el consumo de alimentos altos en grasa (Stoeckel et al. 2008). De manera similar, en comparación con los individuos de peso normal, los individuos obesos a los que se les presentaron imágenes de alimentos ricos en calorías (estímulos a los que están condicionados) mostraron un aumento de la activación neural en regiones que forman parte de los circuitos de recompensa y motivación (NAc, estriado dorsal, OFC , ACC, amígdala, hipocampo e ínsula) (Killgore y Yurgelun-Todd 2005). Por el contrario, en los controles de peso normal, la activación de ACC y OFC (regiones involucradas en la atribución de saliencia que se proyecta en la NAc) durante la presentación de alimentos con alto contenido calórico se correlacionó negativamente con su índice de masa corporal (IMC) ( Stice et al. 2008b). Esto sugiere una interacción dinámica entre la cantidad de alimentos consumidos (reflejada en parte en el IMC) y la reactividad de las regiones de recompensa a los alimentos con alto contenido calórico (reflejada en la activación de OFC y ACC) en individuos de peso normal, que se pierde en obesidad.
Sorprendentemente, los individuos obesos mostraron una menor activación de los circuitos de recompensa del consumo real de alimentos (denominado recompensa alimentaria consumatoria) que los individuos magros, mientras que mostraron una mayor activación de las regiones corticales somatosensoriales que procesan la palatabilidad cuando anticiparon el consumo (Stice et al. 2008b). La última observación correspondió a regiones en las que un estudio anterior había revelado una mayor actividad en sujetos obesos evaluados al inicio del estudio (sin estimulación) (Wang et al. 2002) (Higo. 7d, e). Una mayor actividad de las regiones que procesan la palatabilidad podría hacer que los sujetos obesos favorecieran los alimentos en lugar de otros reforzadores naturales, mientras que la disminución de la activación de los objetivos dopaminérgicos por el consumo real de alimentos podría llevar al consumo excesivo como un medio para compensar la señalización mediada por D2R débil (Stice et al. 2008a). Esta respuesta reducida del circuito de recompensa al consumo de alimentos en sujetos obesos recuerda a los aumentos reducidos de DA desencadenados por el consumo de drogas en individuos adictos en comparación con sujetos no adictos.
La corteza prefrontal (PFC) desempeña un papel crucial en la función ejecutiva, incluido el control inhibitorio (Miller y Cohen). 2001). D1R y D2R (presumiblemente también D4R) modulan estos procesos y, por lo tanto, es probable que la disminución de la actividad en PFC, tanto en la adicción como en la obesidad, contribuya a un control deficiente y una alta compulsividad. La disponibilidad inferior a lo normal de D2R en el cuerpo estriado de individuos obesos, que se ha asociado con una actividad reducida en PFC y ACC (Volkow et al. 2008b) es probable que contribuya a su control deficiente sobre la ingesta de alimentos. De hecho, la correlación negativa entre el IMC y el D2R del estriado se informó en los obesos (Wang et al. 2001) y en sobrepeso (Haltia et al. 2007a) Los individuos apoyan esto. Una mejor comprensión de los mecanismos que conducen a una función deficiente de PFC en la obesidad (o adicción) podría facilitar el desarrollo de estrategias para mejorar, o quizás incluso revertir, deficiencias específicas en dominios cognitivos cruciales. Por ejemplo, el descuento por retraso, que es la tendencia a devaluar una recompensa en función del retraso temporal de su entrega, es una de las operaciones cognitivas más investigadas en relación con los trastornos asociados con la impulsividad y la compulsividad. El descuento por demora se ha investigado de manera más exhaustiva en los drogadictos que muestran una preferencia exagerada por las recompensas pequeñas pero inmediatas sobre las grandes pero retrasadas (Bickel et al. 2007). Sin embargo, los pocos estudios realizados con individuos obesos también han descubierto evidencia de una preferencia por recompensas altas e inmediatas, a pesar de una mayor probabilidad de sufrir mayores pérdidas futuras (Brogan et al. 2010; Weller et al. 2008). Y más recientemente, otro estudio encontró una correlación positiva entre el IMC y el descuento hiperbólico, por lo que los pagos negativos futuros se descuentan menos que los pagos positivos futuros (Ikeda et al. 2010). Curiosamente, el descuento por demora parece depender de la función del estriado ventral (Gregorios-Pippas et al. 2009) y del PFC, incluida la OFC lateral (Bjork et al. 2009), y es sensible a las manipulaciones de DA (Pine et al. 2010). Específicamente, la mejora de la señalización DA (con tratamiento con L DOPA) incrementó la impulsividad y el descuento temporal.
5 Implicación de los circuitos de motivación.
La señalización dopaminérgica también modula la motivación. Los rasgos de comportamiento, como el vigor, la persistencia y la inversión de un esfuerzo continuo para lograr un objetivo, están sujetos a modulación por parte de DA que actúa a través de varias regiones objetivo, incluyendo NAc, ACC, OFC, DLPFC, amígdala, estriado dorsal y pálido ventral (Salamone et al. 2007). La señalización desregulada de DA se asocia con una mayor motivación para adquirir drogas, un sello distintivo de la adicción, por lo que los individuos adictos a las drogas a menudo se involucran en conductas extremas para obtener drogas, incluso cuando tienen consecuencias conocidas y adversas (Volkow y Li 2005). Debido a que el consumo de drogas se convierte en el principal impulso motivacional en la adicción a las drogas (Volkow et al. 2003), los sujetos adictos son despertados y motivados por el proceso de obtención de la droga, pero tienden a ser retraídos y apáticos cuando se exponen a actividades no relacionadas con la droga. Este cambio se ha estudiado comparando los patrones de activación cerebral que se producen con la exposición a señales condicionadas con los que se producen en ausencia de tales señales. En contraste con las disminuciones en la actividad prefrontal reportadas en los consumidores de cocaína desintoxicados cuando no se estimulan con drogas o señales de drogas [ver revisión (Volkow et al. 2009a)], estas regiones prefrontales se activan cuando los consumidores de cocaína están expuestos a estímulos que inducen el deseo (drogas o señales) (Grant et al. 1996; Volkow et al. 1999a; Wang et al. 1999). Este resultado es una reminiscencia de la observación de que los consumidores de cocaína, estudiados poco después de un episodio de atracones de cocaína, mostraron un aumento en la actividad metabólica en la OFC y la ACC (también estriado dorsal) que se asoció con el deseo (Volkow et al. 1991).
Además, cuando se comparan las respuestas a la MP iv entre individuos adictos a la cocaína y no adictos, los primeros respondieron con un aumento del metabolismo en el CAC ventral y la OFC medial (un efecto asociado con el deseo), mientras que los últimos mostraron la respuesta opuesta, es decir, disminuyeron El metabolismo en estas regiones (Volkow et al. 2005). Esto sugiere que la activación de estas regiones prefrontales con exposición al fármaco puede ser específica para la adicción y asociada con un mayor deseo por el fármaco. Además, un estudio que incitó a los sujetos adictos a la cocaína a inhibir deliberadamente el deseo cuando se exponen a las señales de las drogas mostró que los sujetos que tuvieron éxito en la inhibición del deseo mostraron una disminución del metabolismo en la CED medial (que procesa el valor motivacional de un reforzador) y la NCC (que predice recompensa) (Volkow et al. 2009b). Estos hallazgos corroboran aún más la participación de OFC, ACC y striatum en la mayor motivación para adquirir la droga observada en la adicción.
Como era de esperar, la OFC también se ha implicado en atribuir valor de prominencia a los alimentos (Grabenhorst et al. 2008; Rolls y McCabe 2007), ayudando a evaluar su amabilidad y palatabilidad esperadas en función de su contexto. Los estudios de PET con FDG para medir el metabolismo de la glucosa en el cerebro en individuos con peso normal informaron que la exposición a las señales de los alimentos aumentaba la actividad metabólica en la OFC, que era un efecto asociado con la percepción del hambre y el deseo de alimentos (Wang et al. 2004). Es probable que la activación mejorada de la OFC por la estimulación de los alimentos refleje los efectos dopaminérgicos corriente abajo y participe en la participación de DA en el impulso del consumo de alimentos. La OFC desempeña un papel en el aprendizaje de asociaciones de refuerzo-estímulo y condicionamiento (Cox et al. 2005; Gallagher et al. 1999), apoya la alimentación provocada de la señal condicionada (Weingarten 1983), y probablemente contribuye a comer en exceso independientemente de las señales de hambre (Ogden y Wardle 1990). De hecho, la disfunción de la OFC se ha relacionado con comer en exceso (Machado y Bachevalier 2007).
A pesar de algunas inconsistencias entre los estudios, los datos de imágenes cerebrales también apoyan la idea de que los cambios estructurales y funcionales en las regiones cerebrales implicadas en la función ejecutiva (incluido el control inhibitorio) pueden asociarse con un IMC alto en individuos por lo demás sanos. Por ejemplo, un estudio de IRM realizado en mujeres de edad avanzada, utilizando morfometría basada en voxel, encontró una correlación negativa entre el IMC y los volúmenes de materia gris (incluidas las regiones frontales), que, en la OFC, se asociaron con una función ejecutiva deteriorada (Walther et al. 2010). Al usar PET para medir el metabolismo de la glucosa en el cerebro en controles sanos, informamos una correlación negativa entre el IMC y la actividad metabólica en DLPFC, OFC y ACC. En este estudio, la actividad metabólica en las regiones prefrontales predijo el rendimiento de los sujetos en las pruebas de la función ejecutiva (Volkow et al. 2009c). De manera similar, un estudio espectroscópico de resonancia magnética nuclear (RMN) en controles sanos de mediana edad y ancianos mostró que el IMC se asoció negativamente con los niveles de N-acetil-aspartato (un marcador de integridad neuronal) en la corteza frontal y ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Los estudios de imágenes cerebrales que comparan individuos obesos y delgados también informaron una menor densidad de materia gris en las regiones frontales (opérculo frontal y giro frontal medio) y en giro post-central y putamen (Pannacciulli et al. 2006). Otro estudio, no encontró diferencias en los volúmenes de materia gris entre sujetos obesos y magros, sin embargo, sí registró una correlación positiva entre el volumen de materia blanca en las estructuras cerebrales basales y las relaciones cintura-cadera, una tendencia que se invirtió parcialmente con la dieta (Haltia et al. 2007b). Curiosamente, también se ha encontrado que las áreas corticales, como el DPFC y la OFC que están involucradas en el control inhibitorio, se activan en personas que hacen dieta con éxito en respuesta al consumo de comidas (DelParigi et al. 2007), sugiriendo un objetivo potencial para el reentrenamiento del comportamiento en el tratamiento de la obesidad (y también en la adicción).
6 Implicación del circuito interoceptivo
Los estudios de neuroimagen han revelado que la ínsula media desempeña un papel fundamental en los antojos de alimentos, cocaína y cigarrillos. (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). La importancia de la ínsula ha sido destacada por un estudio que informó que los fumadores con daños en esta región (pero no los fumadores de control que habían sufrido lesiones extra-insulares) pudieron dejar de fumar fácilmente y sin experimentar antojos ni recaídas (Naqvi et al . 2007). La ínsula, particularmente sus regiones más anteriores, está conectada recíprocamente a varias regiones límbicas (por ejemplo, corteza prefrontal ventromedial, amígdala y estriado ventral) y parece tener una función interoceptiva, integrando la información autónoma y visceral con emoción y motivación, proporcionando así conciencia consciente de estos impulsos (Naqvi y Bechara 2009). De hecho, los estudios de lesiones cerebrales sugieren que el PFC ventricular y la ínsula son componentes necesarios de los circuitos distribuidos que apoyan la toma de decisiones emocionales (Clark et al. 2008). De acuerdo con esta hipótesis, los estudios de imagen muestran consistentemente la activación diferencial de la ínsula durante el deseo (Brody et al. 2009; Goudriaan et al. 2010; Naqvi y Bechara 2009; Wang et al. 1999). En consecuencia, se ha sugerido que la reactividad de esta región cerebral sirve como un biomarcador para ayudar a predecir la recaída (Janes et al. 2010).
La ínsula es también un área gustativa primaria, que participa en muchos aspectos de las conductas alimentarias, como el gusto. Además, la ínsula rostral (conectada a la corteza del gusto primaria) proporciona información a la OFC que influye en su representación multimodal de la gratitud o el valor de recompensa de los alimentos entrantes (rollos 2008). Debido a la participación de la ínsula en el sentido interoceptivo del cuerpo, en la conciencia emocional (Craig 2003) y en motivación y emoción (rollos 2008), se podría esperar una contribución del deterioro insular en la obesidad. De hecho, la distensión gástrica da como resultado la activación de la ínsula posterior, que es probable que refleje su papel en la conciencia de los estados del cuerpo (en este caso de plenitud) (Wang et al. 2008). Además, en los sujetos magros, pero no en los obesos, la distensión gástrica provocó la activación de la amígdala y la desactivación de la ínsula anterior (Tomasi et al. 2009). La falta de respuesta de la amígdala en los sujetos obesos podría reflejar una conciencia interoceptiva embotada de los estados corporales relacionados con la saciedad (estómago completo). A pesar de que la modulación de la actividad insular por DA ha sido poco investigada, se reconoce que la DA está involucrada en las respuestas a la degustación de alimentos sabrosos que están mediados por la ínsula (Hajnal y Norgren). 2005). Los estudios en imágenes de seres humanos han demostrado que los alimentos sabrosos de degustación activaron las áreas de la ínsula y del cerebro medio (DelParigi et al. 2005; Frank et al. 2008). Sin embargo, la señalización de DA también puede ser necesaria para detectar el contenido calórico de los alimentos. Por ejemplo, cuando las mujeres de peso normal probaron un edulcorante con calorías (sacarosa), tanto la ínsula como las áreas del cerebro medio dopaminérgicas se activaron, mientras que el sabor de un edulcorante sin calorías (sucralosa) solo activó la ínsula (Frank et al. 2008). Los sujetos obesos exhiben mayor activación insular que los controles normales cuando prueban una comida líquida que consiste en azúcar y grasa (DelParigi et al. 2005). En contraste, los sujetos que se han recuperado de la anorexia nerviosa muestran menos activación en la ínsula al probar la sacarosa y no hay asociación de sentimientos de placer con la activación insular como se observa en los controles normales (Wagner et al. 2008). Cuando se combinan, estos resultados hacen probable que la desregulación de la ínsula en respuesta a los estímulos del gusto pueda estar involucrada en el control deficiente de varias conductas apetitivas.
7 El circuito de la aversión
Como se mencionó anteriormente, el entrenamiento (condicionamiento) en una señal que predice la recompensa conduce a que las células dopaminérgicas se disparen en respuesta a la predicción de la recompensa, y no a la recompensa en sí. Por otro lado, y de acuerdo con esta lógica, se ha observado que las células dopaminérgicas dispararán menos de lo normal si la recompensa esperada no se materializa (Schultz et al. 1997). Evidencia acumulada (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto y Hikosaka 2007; Nishikawa et al. 1986) señala a la habenula como una de las regiones que controla las disminuciones en el disparo de células dopaminérgicas en VTA que pueden seguir al fracaso en recibir una recompensa esperada (Kimura et al. 2007). Por lo tanto, una mayor sensibilidad de la habenula, como resultado de las exposiciones crónicas a los medicamentos, podría ser la base de una mayor reactividad a las señales de los medicamentos. De hecho, la activación de la habenula, en sujetos adictos a la cocaína, se ha asociado con la recaída del comportamiento a la toma de drogas tras la exposición a la señal (Brown et al. 2011; Zhang et al. 2005). En el caso de la nicotina, los receptores nicotínicos α5 en la habenula parecen modular las respuestas aversivas a grandes dosis de nicotina (Fowler et al. 2011); y los receptores α5 y α2 en la habenula están implicados en la retirada de nicotina (Salas et al. 2009). Debido a la respuesta opuesta de la habenula a la de las neuronas DA para recompensar (desactivación) y su activación tras la exposición a estímulos aversivos, nos referimos aquí a la señalización de la habenula como una que transmite una entrada "antireward".
La habenula parece desempeñar un papel similar con respecto a la recompensa de alimentos. Una dieta alimenticia altamente sabrosa puede inducir obesidad en ratas, y los aumentos de peso se correlacionan con los aumentos en la unión del péptido opioide μ en la amígdala basolateral y basomedial. Curiosamente, la habénula medial mostró una unión significativamente mayor al péptido opioide μ (aproximadamente en un 40%) después de la exposición al alimento sabroso en las ratas que aumentaron de peso (las que consumían más alimento) pero no en las que no lo hicieron (Smith et al. 2002). Esto sugiere que la habenula puede estar involucrada en comer en exceso en condiciones de disponibilidad de alimentos sabrosos. Además, las neuronas en el núcleo tegmental rostromedial, que reciben una importante aportación del habenula lateral, se proyectan a las neuronas VTA DA y se activan después de la privación de alimentos (Jhou et al. 2009). Estos hallazgos son consistentes con el papel de la habenula en la mediación de respuestas a estímulos aversivos o estados como los que ocurren durante la dieta o la abstinencia de drogas.
La participación de la habenula como un centro antirrobo dentro de las redes emocionales es consistente con los modelos teóricos previos de adicción que postulaban respuestas sensibilizadas contra la recompensa (mediadas por la sensibilidad aumentada de la amígdala y el aumento de la señalización a través del factor liberador de corticotropina) como impulsores de la ingesta de drogas en la adicción (Koob y Le Moal 2008). Respuestas antibalas similares también pueden contribuir al consumo excesivo de alimentos en la obesidad.
8 Medicamento patológico y recompensa de alimentos: un modelo de trabajo actualizado
TLa capacidad de resistir la tentación de usar un medicamento o comer más allá del punto de saciedad requiere el buen funcionamiento de los circuitos neuronales involucrados en el control de arriba hacia abajo para oponerse a las respuestas condicionadas que predicen la recompensa de ingerir el alimento / medicamento y el deseo de ingerir el medicamento. comida / droga. Aquí, destacamos seis de estos circuitos: recompensa / saliente, condicionamiento / hábitos, control inhibitorio / función ejecutiva, motivación / impulso, interocepción y evitación de aversión / reactividad al estrés (Fig. 8). Basándonos en los datos de imágenes presentados aquí, postulamos que es la discrepancia entre la expectativa de los efectos de los medicamentos / alimentos (respuestas condicionadas) y los efectos neurofisiológicos embotados que mantienen la toma de medicamentos o el consumo excesivo de alimentos en un intento por alcanzar el objetivo. recompensa esperada Además, ya sea que hayan sido evaluados durante períodos de abstinencia / dieta tempranos o prolongados, los sujetos adictos / obesos muestran una D2R más baja en el estriado (incluida la NAc), que se asocian con disminuciones en la actividad de referencia en las regiones frontales del cerebro implicadas en la atribución de saliencia (corteza orbitofrontal) e inhibitoria Control (ACC y DLPFC), cuya interrupción resulta en compulsividad e impulsividad. FEn general, también han surgido pruebas sobre el papel de los circuitos interoceptivos y aversivos en los desequilibrios sistémicos que dan como resultado el consumo compulsivo de drogas o alimentos.
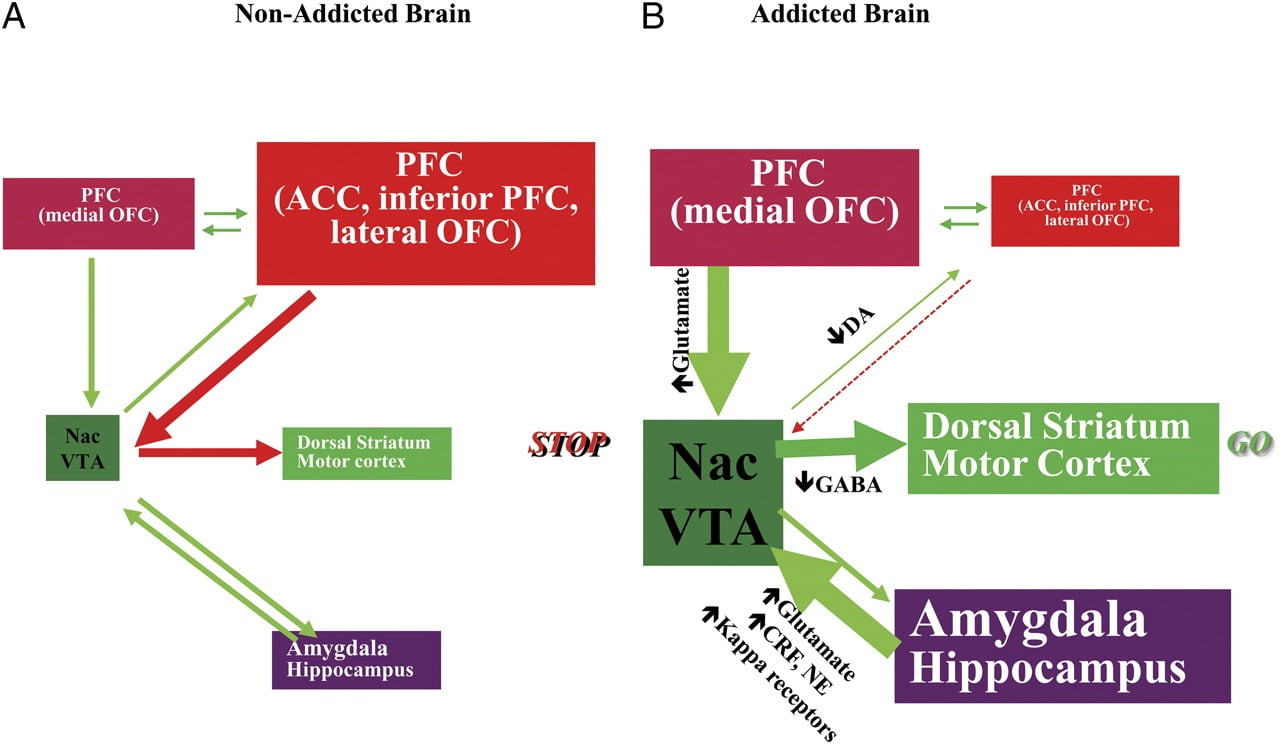
Modelo que propone una red de circuitos interactivos, interrupciones que contribuyen al complejo conjunto de comportamientos estereotipados que subyacen a la adicción a las drogas y la sobrealimentación crónica: recompensa (núcleo accumbens, VTA y pálido ventral), condicionamiento / memoria (amígdala, OFC medial para la atribución de saliencia, hipocampo y estriado dorsal para hábitos), control ejecutivo (DLPFC, CAC, corteza frontal inferior y CCI lateral) Motivación / conducción (OFC medial para la atribución de saliencia, ACC ventral, VTA, SN, cuerpo estriado dorsal y corteza motora). Nac, núcleo accumbens, interocepción (Insula y ACC), y aversión / evitación (Habenula). a Cuando estos circuitos están equilibrados, esto da como resultado un control inhibitorio y una toma de decisiones adecuados. b Durante la adicción, cuando el mayor valor de expectativa de la droga en los circuitos de recompensa, motivación y memoria supera el circuito de control, favorece un circuito de retroalimentación positiva iniciado por el consumo de la droga y perpetuado por la activación mejorada de la motivación / impulso y circuitos de memoria. Estos circuitos también interactúan con los circuitos involucrados en la regulación del estado de ánimo, incluida la reactividad al estrés (que involucra la amígdala, el hipotálamo, la habenula) y la interocepción (que involucra la ínsula y el CAC y contribuye a la toma de conciencia del deseo). Varios neurotransmisores están implicados en estas neuroadaptaciones, que incluyen glutamato, GABA, norepinefrina, factor liberador de corticotropina y receptores opioides. CRF, factor liberador de corticotropina; NE, norepinefrina. Modificado con permiso de Volkow et al. (2011b)
Como consecuencia de la interrupción secuencial en estos circuitos, los individuos pueden experimentar 1) un mayor valor motivacional del fármaco / alimento (secundario a las asociaciones aprendidas a través del condicionamiento y los hábitos) a expensas de otros reforzadores (secundario a la menor sensibilidad del circuito de recompensa) ), 2) una capacidad deficiente para inhibir las acciones intencionales (dirigidas a un objetivo) provocadas por el fuerte deseo de tomar el medicamento / alimento (secundario a la función ejecutiva deteriorada) que resulta en la toma compulsiva de medicamento / alimento, y 3) reactividad al estrés mejorada y evitación aversiva que resulta en el consumo impulsivo de drogas para escapar del estado aversivo.
Este modelo sugiere un enfoque terapéutico múltiple para la adicción diseñado para disminuir las propiedades de refuerzo de los medicamentos / alimentos, restablecer / mejorar las propiedades gratificantes de los reforzadores naturales, inhibir las asociaciones aprendidas condicionadas, aumentar la motivación para actividades no relacionadas con los medicamentos / alimentos, disminuir la reactividad al estrés , mejorar el estado de ánimo y fortalecer el control inhibitorio de propósito general.
AGRADECIMIENTOS
Los autores desean agradecer el apoyo del programa intramural NIAAA de los Institutos Nacionales de Salud.
Referencias