COMENTARIOS: revisión del principal investigador sobre obesidad y adicción a la comida.
Volumen 69, Número 4, 24 Febrero 2011, Páginas 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Revisar
Paul J. Kenny1, ,
1 Laboratorio de neurociencia conductual y molecular, Departamento de Terapéutica Molecular, Instituto de Investigación Scripps, Jupiter, FL 33458, EE. UU.
________________________________________
Los alimentos se consumen para mantener el balance energético a niveles homeostáticos. Además, los alimentos sabrosos también se consumen por sus propiedades hedónicas independientes del estado energético. Dicho consumo relacionado con la recompensa puede dar como resultado que la ingesta calórica exceda los requisitos y se considera un culpable importante en el rápido aumento de las tasas de obesidad en los países desarrollados. En comparación con los mecanismos homeostáticos de la alimentación, se sabe mucho menos sobre cómo los sistemas hedónicos en el cerebro influyen en la ingesta de alimentos. Curiosamente, el consumo excesivo de alimentos sabrosos puede desencadenar respuestas neuroadaptativas en circuitos de recompensa cerebral similares a las drogas de abuso. Además, las vulnerabilidades genéticas similares en los sistemas de recompensa cerebral pueden aumentar la predisposición a la adicción a las drogas y la obesidad. Aquí, se revisarán los avances recientes en nuestra comprensión de los circuitos cerebrales que regulan los aspectos hedónicos del comportamiento de alimentación. Además, también se considerarán las evidencias emergentes que sugieren que la obesidad y la adicción a las drogas pueden compartir mecanismos hedónicos comunes.
________________________________________
Texto Principal
"No hay amor más sincero que el amor por la comida".
-George Bernard Shaw
Introducción
La obesidad, definida como un índice de masa corporal (IMC) de> 30, es una condición en la que la adiposidad es anormalmente alta y puede resultar de hiperfagia o disminución de la tasa metabólica (O'Rahilly, 2009). La adiposidad excesiva es un factor de riesgo importante para las enfermedades cardiovasculares, el cáncer, la diabetes tipo 2 y los trastornos relacionados con el estado de ánimo, y las personas obesas suelen sufrir estigmatización social ([Bean et al., 2008], [Centros para el Control y la Prevención de Enfermedades, 2009] y [Luppino et al., 2010]). Según el Centro para el Control de Enfermedades (CDC), los gastos de atención médica relacionados con la obesidad en los Estados Unidos entre 1998 y 2000 fueron de aproximadamente $ 213 mil millones. Además, 300,000 muertes en los Estados Unidos cada año pueden atribuirse a enfermedades relacionadas con el sobrepeso y la obesidad (Allison et al., 1999), siendo la obesidad la segunda causa principal de muerte evitable después del consumo de tabaco. No obstante, la prevalencia de la obesidad en las sociedades occidentales sigue aumentando drásticamente, y las estimaciones actuales sugieren que más del 30% de los adultos en los Estados Unidos son obesos (Flegal et al., 2010).
La mayoría de las conceptualizaciones de la regulación de la alimentación proponen que dos sistemas paralelos interactúan para influir en la ingesta de alimentos ([Hommel et al., 2006], [Lutter y Nestler, 2009] y [Morton et al., 2006]). El sistema homeostático comprende reguladores hormonales del hambre, la saciedad y los niveles de adiposidad, como la leptina, la grelina y la insulina, que actúan en los circuitos hipotalámicos y del tronco cerebral para estimular o inhibir la alimentación a fin de mantener niveles adecuados de equilibrio energético. La disfunción en los componentes del sistema homeostático, como la deficiencia congénita de leptina, puede resultar en un estado persistente de balance energético positivo y en el desarrollo de obesidad ([Campfield et al., 1995], [Halaas et al., 1995] y [Pelleymounter et al., 1995]). Los mecanismos a través de los cuales los reguladores hormonales del hambre y la saciedad actúan en los circuitos hipotalámicos y del tronco encefálico para mantener la homeostasis energética se han descrito detalladamente en otra parte, y los lectores interesados en este tema se remiten a las excelentes revisiones sobre este tema (por ejemplo, [Abizaid et al., 2006a] y [Gao and Horvath, 2007]).
Además de los sistemas metabólicos, los sistemas de recompensa del cerebro también juegan un papel importante en la conducta alimentaria ([Lutter y Nestler, 2009] y [Saper et al., 2002]). En general, los alimentos de sabor suave no se comen en exceso, mientras que los alimentos sabrosos a menudo se consumen incluso después de que se han cumplido los requisitos energéticos. La facilidad de acceso a alimentos sabrosos ricos en energía se considera un factor de riesgo ambiental importante para la obesidad (Volkow y Wise, 2005), y el consumo excesivo de alimentos sabrosos se considera un factor importante que contribuye al reciente aumento de la obesidad ([Finkelstein et al., 2005], [Hill et al., 2003] y [Swinburn et al., 2009]). De hecho, obtener los efectos placenteros de una comida sabrosa es una poderosa fuerza motivadora que en ciertos individuos puede anular las señales homeostáticas ([Shomaker et al., 2010], [Sunday et al., 1983] y [Zheng et al., 2009]) . Cuando se les presenta una opción, las ratas prefieren abrumadoramente consumir una solución de sacarina sin calorías en lugar de autoadministrarse infusiones de cocaína intravenosa (Lenoir et al., 2007). Además, las ratas bien alimentadas se expondrán voluntariamente al frío extremo (-15 ° C), al dolor por calor nocivo o al escalofrío aversivo en las patas para obtener alimentos apetitosos, como tarta, paté de carne, mantequilla de maní, Coca-Cola, caramelos M&M, chocolate. chips o gotas de yogur, incluso cuando se dispone de comida estándar menos apetecible ([Cabanac y Johnson, 1983], [Foo y Mason, 2005] y [Oswald et al., 2010]). Estos hallazgos destacan cuán intensamente los macronutrientes en los alimentos sabrosos pueden estimular los sistemas de recompensa del cerebro independientemente de su valor calórico ([Wang et al., 2004a] y [Wang et al., 2004b]) y cuán alta puede ser la motivación para consumir alimentos sabrosos incluso en ausencia de requisitos de energía homeostática. Las drogas de abuso, como la cocaína o la nicotina, también pueden inducir altos niveles de conducta consumatoria, aunque carezcan de valor calórico o nutritivo. De hecho, debido a las muchas similitudes entre comer en exceso en la obesidad y el uso excesivo de drogas en la adicción (Volkow y Wise, 2005), se ha argumentado que la obesidad debe considerarse como un trastorno cerebral e incluirse como una categoría de diagnóstico en la próxima quinta edición. del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-V) ([Devlin, 2007] y [Volkow y O'Brien, 2007]). En comparación con los mecanismos homeostáticos de la conducta alimentaria, se sabe mucho menos sobre cómo influyen los sistemas hedónicos en la ingesta de alimentos. De manera similar, la influencia de las alteraciones intrínsecas o inducidas por la dieta sobre la capacidad de respuesta de los sistemas de recompensa del cerebro, y cómo estos efectos contribuyen a la sobrealimentación y la obesidad, sigue sin estar clara. A continuación se resumen los datos recientes que destacan los avances en nuestra comprensión de los mecanismos hedónicos de la alimentación y las alteraciones inducidas por la dieta en la actividad de recompensa del cerebro que pueden contribuir al desarrollo de la obesidad.
Activación de sistemas de recompensas cerebrales en respuesta a alimentos sabrosos: interacciones con reguladores hormonales del balance energético
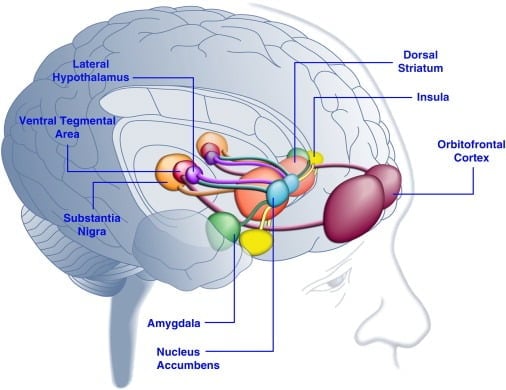
El consumo de alimentos sabrosos puede mejorar el estado de ánimo en humanos ([Dallman et al., 2003] y [Macht and Mueller, 2007]) y respaldar el establecimiento de una preferencia de lugar condicionada en animales de laboratorio ([Imaizumi et al., 2001] y [ Sclafani et al., 1998]). Es probable que estos efectos estén relacionados con la estimulación de los sistemas de recompensa cerebral mediante alimentos sabrosos (Figura 1). De hecho, los estudios de imágenes del cerebro humano han demostrado que los alimentos y las señales visuales u olfativas relacionadas con los alimentos pueden activar los circuitos cerebrales corticolímbicos y mesoacumbos implicados en la recompensa, especialmente las regiones de la corteza orbitofrontal (OFC), la ínsula, la amígdala, el hipotálamo, el estriado y el cerebro medio. incluyendo el área tegmental ventral (VTA) y la sustancia negra (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] y [Simmons et al., 2005] ). Las estructuras del cuerpo estriado, la ínsula, la corteza cingulada anterior y el cerebro medio codifican el valor subjetivo de las recompensas, independientemente de su tipo (p. Ej., Alimentos, sexo, recompensas monetarias), en consonancia con el papel de esta red neuronal en la representación hedónica general (Sescousse et al. , 2010). En contraste, la OFC parece desempeñar un papel particularmente importante en las representaciones relacionadas con el valor de tipos específicos de recompensas que incluyen alimentos sabrosos ([Man et al., 2009], [Rolls, 2008] y [Sescousse et al., 2010] ). El hambre puede mejorar la activación de las regiones corticolímbica y del cerebro medio inducida por los alimentos sabrosos (LaBar et al., 2001). Por ejemplo, la intensidad de la activación del cuerpo estriado ventral, la amígdala, la ínsula y la OFC en respuesta a los alimentos palatables altos en calorías fue mucho mayor cuando los sujetos humanos estaban hambrientos que bien alimentados (Goldstone et al., 2009). Esto es consistente con el hecho de que los períodos de hambre y de dieta aumentan las calificaciones autoinformadas del "poder" de los alimentos sabrosos y las ansias de alimentos "tentadores" ([Hofmann et al., 2010] y [Rolls et al., 1983] ). Por el contrario, la sobrealimentación puede reducir las respuestas neuronales a los alimentos sabrosos, especialmente en la corteza insular y el hipotálamo (Cornier et al., 2009). Por lo tanto, el valor hedónico de los alimentos está influenciado por el estado metabólico, lo que sugiere que los reguladores del metabolismo, como la leptina y la grelina, pueden influir en la actividad de los sistemas hedónicos en el cerebro. De acuerdo con este punto de vista, los sujetos humanos tratados con leptina o con el péptido factor posprandial derivado del intestino YY3-36 (PYY) ([Batterham et al., 2007] y [Farooqi et al., 2007]), o aquellos que presentan distensión gástrica La imitación de la ingesta de comida (Wang et al., 2008), tuvo una actividad reducida en las regiones cerebrales relacionadas con la recompensa. A la inversa, los pacientes humanos hiperfágicos con deficiencia congénita de leptina muestran una mayor actividad en la corteza insular y el cuerpo estriado en respuesta a las imágenes de alimentos ([Baicy et al., 2007] y [Farooqi et al., 2007]). En estos individuos, la terapia de reemplazo de leptina atenuó la actividad insular y estriatal aumentada y disminuyó el gusto por los alimentos ([Baicy et al., 2007] y [Farooqi et al., 2007]). El tratamiento con leptina también bloquea las propiedades gratificantes de la sacarosa en ratas con restricción alimenticia similares al antagonista del receptor de dopamina α-flupentixol (Figlewicz et al., 2001). Además, los receptores de leptina se expresan en las neuronas de dopamina del cerebro medio en el VTA y SN (Figlewicz et al., 2003), lo que sugiere que la leptina puede influir en los aspectos hedónicos del comportamiento de la alimentación a través de la modulación de la transmisión de dopamina mesostriatal. Confirmando esta posibilidad, las infusiones de leptina en el VTA inhibieron la actividad de las neuronas de dopamina y redujeron la ingesta de alimentos en ratas (Hommel et al., 2006; véase también Krügel et al., 2003). A la inversa, la eliminación de los receptores de leptina en el VTA aumentó la ingesta de alimentos, mejoró la actividad locomotora y aumentó la preferencia por alimentos sabrosos en ratas (Hommel et al., 2006). Por lo tanto, la leptina ejerce una influencia inhibitoria sobre la transmisión de dopamina mesoaccumbens, un sistema neurotransmisor que ha sido fuertemente implicado en la recompensa y la motivación, pero menos en la homeostasis energética ([de Araujo et al., 2010] y [Vucetic and Reyes, 2010]). Más recientemente, se demostró que la hormona grelina relacionada con el hambre ([Kojima et al., 1999] y [Nakazato et al., 2001]) potencia la activación de los sistemas hedónicos en el cerebro en respuesta a las señales de los alimentos (Malik et al. , 2008). Específicamente, la grelina mejoró la activación de OFC, amígdala, ínsula, estriado, VTA y SN en respuesta a imágenes de alimentos altamente sabrosos en individuos obesos (Malik et al., 2008). En ratas, la ghrelina ejerce un efecto estimulante sobre los sistemas de dopamina del cerebro medio ([Abizaid et al., 2006b], [Jerlhag et al., 2006] y [Jerlhag et al., 2007]) y aumenta el valor gratificante de los alimentos palatables (Perello et al., 2010).
Figura 1. Áreas del cerebro humano activadas en respuesta a alimentos apetecibles o señales asociadas a los alimentos. Se cree que la corteza orbitofrontal y la amígdala codifican información relacionada con el valor de recompensa de los alimentos ([Baxter y Murray, 2002], [Holland y Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] y [Rolls, 2010]). La ínsula procesa información relacionada con el sabor de los alimentos y su valoración hedónica ([Balleine y Dickinson, 2000] y [Small, 2010]). El núcleo accumbens y el cuerpo estriado dorsal, que reciben información dopaminérgica del área tegmental ventral y la sustancia negra, regulan las propiedades motivacionales e incentivadoras de los alimentos ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] y [Söderpalm y Berridge, 2000]). El hipotálamo lateral puede regular las respuestas gratificantes a los alimentos sabrosos e impulsar los comportamientos de búsqueda de alimentos (Kelley et al., 1996). Estas estructuras cerebrales actúan de manera concertada para regular el aprendizaje sobre las propiedades hedónicas de los alimentos, dirigiendo la atención y el esfuerzo hacia la obtención de recompensas alimentarias y regulando el valor incentivador de los estímulos ambientales que predicen la disponibilidad de recompensas alimentarias (Dagher, 2009). En aras de la claridad, no se muestran todas las interconexiones entre estas estructuras.
Las regiones cerebrales similares son activadas por alimentos sabrosos en el cerebro de rata como las activadas en humanos, según lo medido por la expresión de genes tempranos inmediatos (IEG) como c-fos, arc o zif268. De hecho, los alimentos sabrosos activan el estriado dorsal y ventral, VTA, hipotálamo lateral (LH) y los núcleos central y basolateral de la amígdala y estructuras corticales relacionadas con la recompensa en ratas ([Angeles-Castellanos et al., 2007], [Park y Carr, 1998] y [Schiltz et al., 2007]). Curiosamente, la inmunorreactividad de Fos en realidad disminuyó en la habénula lateral y medial en ratas después del consumo de alimentos sabrosos (LHb) (Park y Carr, 1998). En primates no humanos, la LHb es activada por estímulos aversivos u omisión de recompensas esperadas e inhibida por la entrega de una recompensa de jugo aceptable (Matsumoto y Hikosaka, 2007). Además, la actividad de LHb inhibe las neuronas que contienen dopamina mesoaccumbens relacionadas con la recompensa a través de una ruta indirecta que involucra el núcleo tegmental rostromedial (RMTg) (Jhou et al., 2009). Por lo tanto, la actividad habenular está inversamente relacionada con los alimentos hedónicos, lo que sugiere que el complejo habenular puede influir en la alimentación no homeostática. De hecho, recientemente se demostró que la activación de la LHb disminuye el consumo de sacarosa en ratas, mientras que las lesiones de la LHb aumentan el comportamiento de búsqueda de la sacarosa (Friedman et al., 2011). Teniendo en cuenta que el complejo habenular es pequeño y difícil de identificar y funcionalmente la imagen en humanos (Salas et al., 2010), esto puede explicar por qué no se han reportado alteraciones en la actividad habenular en estudios de imágenes en humanos en respuesta a alimentos sabrosos.
Circuitos cerebrales que regulan la alimentación hedónica: sistemas de dopamina de cerebro medio
La vía de la dopamina mesoaccumbens se activa en seres humanos y animales de laboratorio en respuesta a señales de comida apetecible o relacionadas con el apetito y la leptina, grelina y otros reguladores del apetito influyen en la actividad de este sistema. Esto sugiere que los sistemas de dopamina del mesencéfalo juegan un papel importante en el consumo de alimentos apetecibles. Quizás la indicación más clara de que la transmisión de dopamina en el mesencéfalo influye en la ingesta de alimentos apetitosos en los seres humanos es el hecho de que los pacientes con enfermedad de Parkinson (EP), en los que hay degeneración de neuronas que contienen dopamina en el mesencéfalo, tienden a consumir menos alimentos que los individuos no afectados (Nirenberg y Aguas, 2006). Además, el tratamiento de pacientes con EP con agonistas del receptor de dopamina puede desencadenar un consumo compulsivo de alimentos sabrosos ([Dagher y Robbins, 2009] y [Nirenberg y Waters, 2006]). De hecho, los agonistas del receptor de dopamina pueden inducir una sobrealimentación hedónica incluso en personas que no padecen EP (Cornelius et al., 2010). En los animales, las soluciones de sacarosa agradables estimulan la transmisión de dopamina en el NAc (Hernandez y Hoebel, 1988), un efecto consistente con los estudios de imágenes del cerebro humano (Small et al., 2003). Usando voltamperometría cíclica de barrido rápido, se demostró que las señales que predicen la entrega de una recompensa de sacarosa o la entrega inesperada de sacarosa evocan la transmisión de dopamina en NAc ([Roitman et al., 2004] y [Roitman et al., 2008]). Además, la administración inesperada de soluciones nocivas de quinina tuvo el efecto opuesto, disminuyendo la transmisión de dopamina accumbal (Roitman et al., 2008). Finalmente, los ratones en los que la enzima tirosina hidroxilasa (TH) ha sido inactivada, causando que tengan deficiencia de dopamina, todavía demuestran una marcada preferencia por las soluciones de sacarosa (o sacarina) en comparación con el agua, pero consumen menos cantidades totales de sacarosa que los ratones de control ( Cannon y Palmiter, 2003). Esto sugiere que los ratones con deficiencia de dopamina aún pueden detectar la palatabilidad de la sacarosa y prefieren estas soluciones al agua, pero no pueden sostener el consumo de soluciones apetitosas. Por lo tanto, se ha propuesto que la transmisión de dopamina mesoaccumbens regula los aspectos motivacionales del comportamiento de alimentación que están involucrados en la obtención de alimentos y que otros sistemas de neurotransmisores probablemente regulan los aspectos hedónicos del consumo de alimentos apetitosos.
Circuitos cerebrales que regulan la alimentación hedónica: sistemas estriatohipotalámicos
La infusión de agonistas de receptores opioides μ como [D-Ala2-N-Me-Phe4-gly-ol5] -enkephalin (DAMGO) en la NAc estimula el comportamiento de alimentación en ratas con acceso ad libitum a la comida (es decir, alimentación no homeostática) ( [Peciña y Berridge, 2005] y [Zhang et al., 1998]). A la inversa, los antagonistas de los receptores opioides infundidos en el NAc disminuyen el consumo de alimentos preferidos sin afectar la ingesta de alternativas menos sabrosas (Kelley et al., 1996). Estos datos son consistentes con la opinión de que los sistemas opiáceos del cuerpo estriado regulan las propiedades hedónicas de los alimentos sabrosos. La región de la cáscara de la NAc y en particular los "puntos calientes" hedónicos en la región rostrodorsal de la cáscara medial ([Peciña y Berridge, 2005] y [Peciña et al., 2006b]) desempeña un papel particularmente importante en la alimentación no homeostática. Debido a que la activación del receptor μ-opioide resulta en la inhibición de la actividad de la neurona espinosa media en la NAc, se ha propuesto que la cáscara de la NAc ejerce una influencia inhibitoria tónica sobre el consumo de alimentos sabrosos (Kelley et al., 2005). De acuerdo con este punto de vista, la estimulación de los receptores inhibidores de GABAA o GABAB ([Basso y Kelley, 1999] y [Stratford y Kelley, 1997]) o el bloqueo de los receptores de glutamato ionotrópico excitador (Maldonado-Irizarry et al., 1995) en la CACC Aumenta el consumo de alimentos. De manera similar, la lesión excitotóxica de la envoltura NAc también aumenta el consumo de alimentos y aumenta la sensibilidad a la recompensa de los alimentos ([Johnson et al., 1996] y [Maldonado-Irizarry and Kelley, 1995]). En particular, el consumo de alimentos sabrosos densos en energía se activa preferentemente por estas manipulaciones ([Basso y Kelley, 1999], [Kelley et al., 2005] y [Zhang et al., 1998]).
Tomando en cuenta la gran influencia de la señalización accumbal en la alimentación hedónica, Thompson y Swanson (2010) utilizaron un procedimiento de rastreo de circuitos para identificar con precisión las redes anatómicas precisas a través de las cuales la NAc puede influir en el consumo de alimentos sabrosos. En estos estudios elegantes, las ratas recibieron dos inyecciones no superpuestas de trazadores anterógrados / retrógrados (denominados COIN) en los sitios de la capa NAc que influyen poderosamente en el consumo de alimentos palatables, y se identificaron conexiones aferentes / eferentes. Se demostró que los sitios relacionados con la alimentación en el NAc extienden las proyecciones inhibitorias predominantemente a la LH anterior y al pálido ventral (VP) (Thompson y Swanson, 2010). A diferencia del resto de NAc, que se proyecta densamente al VTA, los puntos calientes hedónicos relacionados con los alimentos en NAc proyectan al núcleo interfascicular (IFN), una estructura ubicada adyacente al VTA que extiende las proyecciones dopaminérgicas de manera recíproca hacia el Shell NAc (Thompson y Swanson, 2010). Además, la LH anterior se proyecta a la LHb (Thompson y Swanson, 2010), lo que nuevamente sugiere que el complejo habenular puede desempeñar un papel en la hedonía de los alimentos (Friedman et al., 2011).
Los datos anteriores muestran que la LH recibe información inhibitoria prominente de los sitios en NAc que ejercen una influencia inhibitoria tónica en el consumo de alimentos sabrosos. La LH también tiene conectividad funcional con otros sitios cerebrales corticales y límbicos implicados en organizar y dirigir el comportamiento hacia la obtención de alimentos sabrosos (Figura 1), como la OFC, la ínsula y la amígdala. Es importante destacar que la inactivación de la LH elimina los efectos estimulantes de las manipulaciones de NAc en la ingesta de alimentos ([Maldonado-Irizarry et al., 1995] y [Will et al., 2003]). Además, la inactivación de la cáscara NAc aumenta la actividad de la LH, en particular las neuronas LH que sintetizan el neuropéptido hipocretina (también conocida como orexina), medida por la inmunorreactividad de Fos ([Baldo et al., 2004] y [Stratford and Kelley, 1999 ]). De hecho, la infusión del agonista del receptor opioide μ DAMGO en la cáscara NAc activa las neuronas que contienen hipocretina en el hipotálamo (Zheng et al., 2007), y la interrupción de la transmisión de hipocretina en VTA elimina la ingesta de alimentos palatables provocada por infusiones de DAMGO intra-NAc (Zheng et al., 2007). Por lo tanto, los puntos calientes hedónicos en la cáscara de NAc ejercen una influencia inhibitoria tónica sobre las neuronas LH, y en particular las neuronas que contienen hipocretina (Louis et al., 2010), lo que limita el consumo de alimentos sabrosos. La interrupción de esta "señal de parada" de acumulación a través de la señalización mejorada del receptor opioide, por ejemplo, resulta en una mayor actividad de la LH que impulsa el consumo no homeostático de alimentos de sabor agradable (Figura 2).
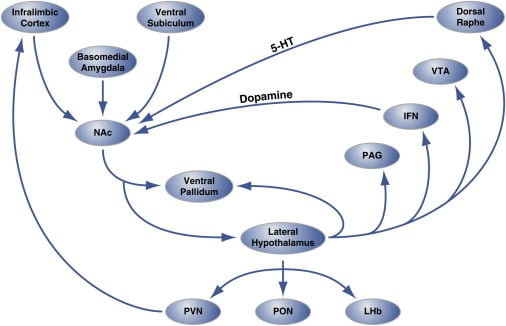
Figura 2. Organización a nivel de circuito de “puntos calientes” hedónicos en Nucleus Accumbens Shell que regula la alimentación hedónica
La región de la cáscara del núcleo accumbens (NAc) recibe inervación de los sitios del cerebro cortical y límbico y se proyecta hacia el hipotálamo lateral y el pálido ventral. A su vez, el hipotálamo lateral también se proyecta hacia el pálido ventral y también el núcleo PAG, IFN, VTA y rafe dorsal. El IFN y el rafe dorsal extienden las proyecciones dopaminérgicas y serotoninérgicas, respectivamente, a la NAc. El hipotálamo lateral también inerva las estructuras talámicas (PVN y PON) y epitalamicas (LHb). No se muestran las proyecciones menores desde el hipotálamo lateral a las áreas del cerebro septal. 5-HT, serotonina; IFN, núcleo interfascicular; LHb, habenula lateral; PON, núcleo preóptico; PVN, núcleo paraventricular del tálamo; VTA, área tegmental ventral. La figura está adaptada con permiso de Thompson y Swanson (2010).
Circuitos cerebrales que regulan la alimentación hedónica: sistemas estriatopalidales
Además de la LH, las neuronas de la cáscara NAc también se proyectan al VP (Figura 2). En una serie de experimentos interesantes, se demostró que las proyecciones de acumulación a VP y LH pueden regular los aspectos disociables de la alimentación no homeostática (Smith y Berridge, 2007). Las infusiones de DAMGO en la concha NAc o VP aumentaron las reacciones orofaciales a las soluciones de sacarosa que se suponía que reflejaban reacciones de "simpatía" en ratas (es decir, respuesta de palatabilidad) y también un mayor consumo de alimentos (Smith y Berridge, 2007). Las infusiones de naloxona en NAc o VP disminuyeron las reacciones de gusto facial a la sacarosa, lo que sugiere que la transmisión sincronizada de opioides en NAc y VP es necesaria para procesar la palatabilidad de los alimentos relacionada con la información. Sin embargo, la naloxona infundida en el NAc, pero no el VP, redujo la ingesta no homeostática (Smith y Berridge, 2007), lo que sugiere que la ingesta no homeostática se produce independientemente de esta conectividad NAc → VP y, en cambio, probablemente se basa en la vía NAc → LH ([Smith y Berridge, 2007] y [Taha et al., 2009]). Consistente con la noción de que los aspectos de la alimentación no homeostática pueden disociarse, los registros de una sola unidad han demostrado que una población de neuronas NAc parece codificar selectivamente la información relacionada con las propiedades de refuerzo relativas de los alimentos (es decir, palatabilidad) (Taha y Fields, 2005) . En las mismas ratas, los cambios en la actividad de una segunda población de neuronas NAc parecían coincidir con el inicio del comportamiento de alimentación (Taha y Fields, 2005).
Circuitos cerebrales que regulan la alimentación hedónica: sistemas amígdalar
Además de apoyar la noción de que los aspectos de la alimentación no homeostática son disociables, las infusiones de naloxona en la capa de NAc o VP, pero no la amígdala basolateral (BLA), disminuyeron la palatabilidad de las soluciones de sacarosa (Wassum et al., 2009). Sin embargo, cuando los antagonistas de los receptores opioides μ naloxona o CTOP se infundieron en el BLA, pero no en NAc shell o VP, hubo una marcada atenuación del aumento de la motivación para responder a las soluciones de sacarosa que se ven normalmente en un estado hambriento ([Wassum et al ., 2011] y [Wassum et al., 2009]). Esto sugiere que las propiedades de incentivo de la sacarosa están reguladas por circuitos amígdalares. En general, los hallazgos anteriores muestran que diferentes aspectos de la alimentación hedónica, como el procesamiento de información relacionada con la palatabilidad de los alimentos, los comportamientos de aproximación y los aumentos en el valor de incentivo de los alimentos sabrosos en animales hambrientos, están regulados diferencialmente por microcircuitos discretos en el contexto de un Circuito corticolímbico-estriatopalidal-hipotalámico-tálamocortical más grande (Figura 2).
¿Las adaptaciones en los circuitos hedónicos cerebrales impulsan la alimentación compulsiva?
Kelley et al. Han considerado la relevancia funcional de los puntos calientes hedónicos en la cáscara NAc y su influencia en circuitos más amplios relacionados con la alimentación en el cerebro. (2005). Ellos plantean la hipótesis de que la ruta NAc shell → LH, junto con las regiones cerebrales reguladoras ascendentes y descendentes (Figura 2), tienen un propósito "centinela" (Kelley et al., 2005). Específicamente, proponen que incluso en animales hambrientos cuando el deseo de comer es fuerte, la capacidad de cesar la conducta de alimentación debe mantenerse en caso de amenazas del medio ambiente (Kelley et al., 2005). Como tal, la activación de las neuronas de la capa NAc y la inhibición concomitante de las neuronas LH pueden interrumpir la alimentación en curso y facilitar el cambio de comportamiento a respuestas adaptativas más apropiadas, como la congelación o el escape (Kelley et al., 2005). Si este es realmente el caso, entonces será importante investigar si esta vía de control NAc → LH de NAc está comprometida por el consumo excesivo de alimentos sabrosos o por factores genéticos que influyen en la vulnerabilidad a la obesidad. Teniendo esto en cuenta, nuestro laboratorio y otros informaron recientemente que el consumo excesivo de alimentos sabrosos en calorías apetecibles está asociado con la aparición de un comportamiento de alimentación compulsivo en ratas ([Johnson y Kenny, 2010], [Latagliata et al., 2010] y [Oswald et al., 2010]). Específicamente, encontramos que el consumo de alimentos sabrosos en ratas obesas fue resistente a la interrupción por un estímulo condicionado aversivo que predijo un resultado negativo (descarga eléctrica) (Johnson y Kenny, 2010). Por lo tanto, será importante probar si los déficits en la ruta de control de NAc → LH de NAc desencadenados por la sobrealimentación, al menos parcialmente, contribuyen a que las personas con sobrepeso y obesas no logren utilizar información relacionada con las consecuencias perjudiciales de su comportamiento de consumo para moderar su ingesta de alimentos. .
Actividad de recompensa cerebral alterada en la obesidad: estudios con imágenes del cerebro humano
La obtención de los efectos estimulantes de los alimentos sabrosos en los sistemas de recompensa cerebral se considera un importante factor motivador que contribuye a la sobrealimentación. Por lo tanto, una pregunta importante es si las alteraciones en la función de recompensa cerebral pueden contribuir al desarrollo de la obesidad. Una predicción intuitiva es que la capacidad de respuesta constitutiva mejorada de los sistemas de recompensa cerebral a los alimentos sabrosos daría como resultado una sobrealimentación y un aumento de peso. De acuerdo con esta hipótesis, los individuos con altos niveles de sensibilidad de recompensa de rasgo muestran una actividad mejorada en las regiones cerebrales implicadas en la recompensa de alimentos, incluidas la NAc, la amígdala, la OFC y la VP, al exponerse a alimentos sabrosos como la torta de chocolate y la pizza (Beaver et al. , 2006). Los individuos obesos demuestran de manera similar una mayor activación de los circuitos de recompensa cerebral en respuesta a alimentos sabrosos o señales asociadas a los alimentos en comparación con los controles magros ([Gautier et al., 2000], [Karhunen et al., 1997] y [Rothemund et al., 2007 ]). Los altos niveles de sensibilidad de la recompensa del rasgo también se correlacionaron con el aumento del peso corporal en sujetos humanos ([Davis et al., 2004] y [Franken and Muris, 2005]). Sin embargo, es importante destacar que las mujeres obesas (IMC> 30) tenían niveles más altos de anhedonia (es decir, menor sensibilidad inicial a la recompensa) que las mujeres con sobrepeso (IMC> 25 <30) (Davis et al., 2004). Del mismo modo, Stice y sus compañeros de trabajo (2008b) han demostrado que las adolescentes obesas tenían una activación aumentada de la ínsula y otras regiones del cerebro cortical en respuesta a alimentos sabrosos o señales asociadas a los alimentos en comparación con los sujetos de control magra, pero esa activación del área caudada de el estriado en respuesta a los alimentos sabrosos se correlacionó inversamente con el IMC en los sujetos obesos. Además, las mujeres que aumentaron de peso durante un período de un mes 6 tuvieron una marcada disminución en la actividad estriatal en respuesta a los alimentos sabrosos durante este período de tiempo en comparación con las mujeres que no aumentaron de peso (Stice et al., 2010a). Tomando todo esto en conjunto, parece que la hipersensibilidad de los circuitos de recompensa puede predisponer a una persona a comer en exceso y a ganar peso (Stice et al., 2010b). Sin embargo, a medida que aumenta el aumento de peso, entonces comienzan a surgir déficits en la actividad de componentes específicos del sistema de recompensa del cerebro, particularmente el estriado. Se ha propuesto que la aparición de este estado de recompensa por hiposensibilidad puede perpetuar el consumo excesivo de alimentos sabrosos para superar tales déficits de recompensa ([Stice et al., 2008a] y [Wang et al., 2002]). Por lo tanto, muy poca o demasiada recompensa alimentaria parece aumentar la vulnerabilidad a comer en exceso y la obesidad (Stoeckel, 2010). Un marco conceptual atractivo para reconciliar estos puntos de vista aparentemente opuestos es que las áreas corticolímbicas involucradas en la organización del comportamiento para obtener recompensas de alimentos y hacer predicciones sobre la recompensa futura de alimentos anticipada pueden volverse hiperactivas en individuos con sobrepeso y aquellos predispuestos a la obesidad. A la inversa, los sitios del cerebro estriado que procesan la experiencia real del placer de la alimentación hedónica pueden volverse gradualmente menos funcionales en estos mismos individuos. Por lo tanto, se espera que el valor motivacional relativo de los alimentos sabrosos aumente durante el desarrollo de la obesidad al mismo tiempo que disminuye el valor hedónico obtenido al consumir alimentos sabrosos.
Actividad de recompensa cerebral alterada en la obesidad: estudios sobre roedores
Los efectos del consumo de alimentos sabrosos en los sistemas de recompensa cerebral se han evaluado directamente en animales de laboratorio mediante el procedimiento de recompensa de estimulación cerebral (BSR). Es bien sabido que la estimulación eléctrica de la LH, que recibe entradas inhibidoras tónicas de los puntos calientes hedónicos accumbal (Figura 2), es altamente gratificante y las ratas trabajarán arduamente para autoestimular esta región cerebral, por ejemplo, (Markou y Frank, 1987 ). Además de apoyar el comportamiento de autoestimulación, la estimulación eléctrica de LH también puede inducir episodios intensos de comportamiento de alimentación (Margules y Olds, 1962), y se ha propuesto que las propiedades gratificantes de la estimulación de LH pueden estar relacionadas con el papel intrínseco de este Sitio del cerebro en las propiedades de apetito e incentivo de los alimentos (Margules and Olds, 1962). De acuerdo con este punto de vista, el hambre y la pérdida de peso aumentan la sensibilidad de las ratas al valor gratificante de la autoestimulación de LH ([Blundell y Herberg, 1968], [Carr y Simon, 1984] y [Margules y Olds, 1962]), un efecto que puede ser bloqueada por la infusión intracerebroventricular de leptina (Fulton et al., 2000). Por el contrario, la autoestimulación eléctrica de la LH se inhibe en animales saciados (Wilkinson y Peele, 1962). De hecho, la sobrealimentación de ratas a través de sonda de alimentación intragástrica (Hoebel y Teitelbaum, 1962), distensión gástrica o infusión intravenosa de glucagón que imita la saciedad postprandial ([Hoebel, 1969], [Hoebel y Balagura, 1967] y [Mount and Hoebel, 1967] ), todos atenuados respondiendo por la estimulación de LH. De hecho, las ratas que previamente respondieron vigorosamente para recompensar la estimulación con LH responderán como si esta estimulación fuera aversiva después de la ingesta de alimentos o el desarrollo de obesidad (Hoebel y Thompson, 1969). Por lo tanto, la restricción crónica de alimentos y la pérdida de peso aumentan, mientras que la sobrealimentación disminuye la sensibilidad de los sitios relacionados con la recompensa en la LH. La sensibilidad de las neuronas LH a recompensar la autoestimulación eléctrica puede, por lo tanto, proporcionar información importante sobre el funcionamiento de los circuitos cerebrales que regulan las respuestas hedónicas a los alimentos.
Dado que la facilidad de acceso a los alimentos sabrosos y densos en energía y el consiguiente consumo excesivo se consideran un factor ambiental importante que contribuye a la obesidad (Volkow y Wise, 2005), nuestro laboratorio recientemente utilizó el procedimiento BSR para evaluar la actividad de recompensa cerebral en ratas con acceso extendido a alimentos palatables. . Específicamente, registramos la respuesta a la estimulación eléctrica de la LH en ratas que tuvieron acceso ad libitum a la comida nutricional sola o en combinación con 18 – 23, acceso diario a una dieta sabrosa. Esta dieta consistía en pastel de queso, tocino, salchichas y otros alimentos apetitosos (Johnson y Kenny, 2010). Encontramos que las ratas con acceso extendido a los alimentos sabrosos rápidamente ganaron cantidades significativas de peso y demostraron un déficit progresivo de recompensa cerebral (reflejado como una respuesta disminuida a la estimulación de LH gratificante) (Johnson y Kenny, 2010; Figura 3). Esto sugiere que el desarrollo de la obesidad inducida por la dieta se asocia con una disminución gradual en la capacidad de respuesta de los sitios de recompensa en la LH (Johnson y Kenny, 2010). También se han informado deficiencias en la señalización de recompensa en ratas adultas que anteriormente tenían acceso ilimitado a sacarosa o alimentos con alto contenido de grasa durante la adolescencia ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] y [Vendruscolo et al., 2010b]). Estos efectos en ratas recuerdan la disminución de la activación estriatal en respuesta a la recompensa alimentaria descrita anteriormente en sujetos humanos, ya que aumentaron de peso durante un período de un mes 6 (Stice et al., 2010a; ver Figura 4). Dichos déficits de recompensa inducidos por la dieta en ratas con sobrepeso, y quizás en humanos que aumentan de peso, probablemente reflejan una respuesta contraadaptativa en los circuitos de recompensa de alimentos para oponerse a su sobreestimulación con alimentos sabrosos (Johnson y Kenny, 2010). Un aspecto importante de este hallazgo es que también se detectan deficiencias similares en la función de recompensa en ratas que consumen demasiado cocaína o heroína ([Ahmed et al., 2002], [Kenny et al., 2006] y [Markou and Koob, 1991]; Figura 3). De hecho, se ha planteado la hipótesis de que la disfunción de la recompensa inducida por el fármaco puede contribuir a la transición del uso controlado del fármaco no controlado al proporcionar una nueva fuente de motivación para consumir el fármaco a fin de aliviar el estado persistente de recompensa disminuida ([Ahmed y Koob , 2005] y [Koob and Le Moal, 2008]). Por lo tanto, es posible que los déficits en la sensibilidad de los sitios de recompensa en la LH inducidos por la sobrealimentación puedan aumentar la persistencia a largo plazo del consumo de alimentos sabrosos en ratas con sobrepeso al cambiar la preferencia dietética hacia alimentos con mayor impacto hedónico para aliviar el estado persistente de negativo recompensa.
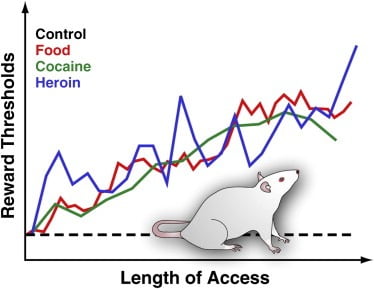
Figura 3. Umbrales de recompensa en ratas con acceso diario extendido a alimentos, cocaína o heroína sabrosos
Para medir los umbrales de recompensa, se implanta quirúrgicamente un electrodo de estimulación en el hipotálamo lateral de las ratas, una región en la que la estimulación eléctrica es poderosamente gratificante y puede desencadenar brotes intensos de comportamiento de alimentación. Después de la recuperación, los animales pueden autoestimularse esta región girando una rueda. Después de que se establece el comportamiento estable de autoestimulación, se determina la intensidad de estimulación mínima que mantiene el comportamiento de autoestimulación (es decir, el umbral de recompensa). Este umbral de recompensa proporciona una medida operativa de la actividad del sistema de recompensa. Los umbrales de recompensa se mantienen estables e inalterados en las ratas de control que tienen acceso a la comida de laboratorio estándar y que siguen siendo ingenuas. Sin embargo, los umbrales se elevan gradualmente en ratas con un acceso diario extendido a una dieta sabrosa y rica en energía que consiste en alimentos sabrosos (por ejemplo, tarta de queso, tocino, chocolate, etc.). De manera similar, los umbrales de recompensa se elevan progresivamente en ratas que tienen acceso diario extendido a infusiones intravenosas de cocaína o heroína. El umbral elevado de recompensas se interpreta para reflejar una sensibilidad disminuida del sistema de recompensas del cerebro. Estos efectos sugieren que el consumo excesivo de alimentos sabrosos y el aumento de peso asociado pueden inducir profundos déficits en la recompensa cerebral similares a los inducidos por el consumo excesivo de drogas adictivas.
Figura 4. Plasticidad estriatal en la obesidad El aumento de peso se asocia con una disminución de la activación del estriado en respuesta a los alimentos sabrosos, según lo medido por fMRI, y niveles más bajos de disponibilidad del receptor D2 de la dopamina estriatal (D2R) en seres humanos (consulte el texto para más detalles).
Señalización deficiente del receptor D2 de la dopamina en la obesidad
Varios informes recientes han revelado mecanismos potenciales a través de los cuales pueden surgir déficits de recompensa en respuesta al consumo excesivo de alimentos sabrosos durante el desarrollo de la obesidad. Como se señaló anteriormente, las mujeres que aumentaron de peso durante un período de un mes 6 tuvieron una marcada disminución de la actividad estriatal en respuesta a los alimentos sabrosos durante este período de tiempo en comparación con las mujeres que no aumentaron de peso (Stice et al., 2010a; Figura 4). Los individuos en ayunas a los que se les permitió comer su comida favorita a la saciedad tenían niveles más bajos de unión del antagonista del receptor D2 (D2R) de la dopamina en el estriado (Small et al., 2003), lo que sugiere que la señalización de D2R disminuye en respuesta al consumo de alimentos palatables. De hecho, los individuos obesos tienen niveles más bajos de disponibilidad de D2R estriatal en comparación con los controles magros ([Barnard et al., 2009], [Stice et al., 2008a] y [Wang et al., 2001]; Figura 4), mientras que la pérdida de peso en pacientes obesos se asocia con una mayor densidad de D2R del cuerpo estriado (Wang et al., 2008). Teniendo en cuenta que la transmisión de la dopamina estriatal desempeña un papel clave en la regulación de la alimentación hedónica, las disminuciones adaptativas en la señalización D2R podrían contribuir a reducir la capacidad de respuesta del estriado a los alimentos sabrosos en individuos obesos. Para probar esta posibilidad, Small y colaboradores examinaron la actividad en circuitos de recompensa cerebral en respuesta a un batido sabroso en individuos de control y en aquellos que portaban el alelo TaqIA A1 (Felsted et al., 2010). El polimorfismo de la longitud del fragmento de restricción TaqIA se encuentra corriente abajo del gen D2R (Neville et al., 2004), y los individuos que portan el alelo A1 del polimorfismo tienen entre 30% –40% menos D2R estriado que los que no tienen el alelo ([Jönsson et al., 1999], [Ritchie and Noble, 2003] y [Stice et al., 2010b]). Además, los portadores del alelo A1 también han reducido el metabolismo de la glucosa en las áreas del cerebro estriado y cortical involucradas en las respuestas hedónicas a los alimentos (Jönsson et al., 1999). Los individuos que albergan el alelo TaqIA A1 están sobrerrepresentados en poblaciones obesas ([Barnard et al., 2009], [Stice et al., 2008a] y [Wang et al., 2001]). Además, el alelo A1 también aumenta la vulnerabilidad a la adicción al alcohol, opioides y psicomotores ([Lawford et al., 2000], [Noble et al., 1993] y [Noble et al., 2000]). Se encontró que las áreas del cerebro medio que probablemente incluían el VTA y el SN, que proveen aportes dopaminérgicos al cuerpo estriado, se activaron en respuesta a un batido de pala agradable en individuos de control (Felsted et al., 2010). A la inversa, la actividad en estos sitios del cerebro en realidad disminuyó en respuesta a la recompensa de los alimentos en los portadores del alelo A1 (Felsted et al., 2010). También se detectaron respuestas inversas similares en la activación cerebral entre los portadores alélicos A1 y los no portadores en sitios cerebrales talámicos y corticales (Felsted et al., 2010). Estos datos son altamente consistentes con un papel clave para los D2R en la regulación de la respuesta mesostriatal a los alimentos sabrosos. Stice y sus colegas (2008a) encontraron una correlación inversa entre el IMC y la activación del cuerpo estriado (caudado y putamen) en respuesta al batido de chocolate del paladar en pacientes humanos. Además, esta relación inversa fue más evidente en individuos portadores del alelo TaqIA A1 (Stice et al., 2008a). El aumento de peso futuro en estos individuos, medido 1 año después de la imagen cerebral inicial, mostró que la magnitud de la activación del cuerpo estriado en respuesta a los alimentos sabrosos se correlacionó negativamente con el aumento de peso en sujetos con el alelo A1 y se correlacionó positivamente en los sujetos que no eran A1 ( Stice et al., 2008a). En un estudio de seguimiento, se informó que la magnitud de la activación del cuerpo estriado en respuesta a la ingesta de alimentos sabrosos, en comparación con su consumo real, se correlacionó inversamente con el aumento de peso durante el año siguiente en sujetos con el alelo A1, pero de manera positiva correlacionado en sujetos alelos no A1 (Stice et al., 2010b). Estos hallazgos sugieren que los D2R regulan la capacidad de respuesta del estriado a los alimentos sabrosos y que la disminución de la señalización D2R inducida por el aumento de peso o los factores genéticos puede aumentar la vulnerabilidad a la obesidad.
La señalización deficiente de D2R contribuye a los déficits de recompensa en la obesidad
Similar a los niveles de D2R estriado regulados en sujetos humanos obesos, los niveles de D2R también se reducen en ratones y ratas alimentadas con una dieta aceptable (por ejemplo, [Colantuoni et al., 2001], [Geiger et al., 2009] and [Johnson and Kenny , 2010]) y en ratas genéticamente predispuestas a la obesidad (ratas Zucker) (Thanos et al., 2008). Nuestro laboratorio ha investigado directamente el papel de la transmisión de dopamina estriatal interrumpida en general, y las disminuciones en la señalización D2R en particular, en los déficits de recompensas similares a la adicción que surgen en ratas durante el desarrollo de la obesidad (ver Figura 5). Específicamente, probamos los efectos de disminuir la expresión de D2Rs estriatales en ratas utilizando la interferencia de ARN mediada por virus, y luego evaluamos los umbrales de BSR cuando las ratas tenían acceso solo a chow o Chow en combinación con 18 – 23, acceso diario a una alta energía aceptable dieta (es decir, una dieta de cafetería) (Johnson y Kenny, 2010). Encontramos que la respuesta a la estimulación con LH gratificante comenzó a disminuir casi inmediatamente después de la exposición a la dieta de la cafetería en las ratas de caída D2R (Johnson y Kenny, 2010; Figura 5). La disminución en los niveles de D2R estriatal, por lo tanto, acelera rápidamente la aparición de la hipofuncionalidad de recompensa en ratas con acceso extendido a alimentos altamente sabrosos, un proceso que generalmente demora muchas semanas en emerger en ratas de control con acceso extendido a una dieta sabrosa. Sin embargo, la caída de los D2R estriatales en ratas con acceso al chow solo no alteró la respuesta para recompensar la estimulación de LH, lo que sugiere que la señalización D2R estriatal disminuida interactúa con otras respuestas adaptativas inducidas por la dieta en los circuitos de recompensa cerebral para desencadenar una hiposensibilidad de la recompensa. Además de la disminución de los niveles de D2R, otros aspectos de la transmisión dopaminérgica del cuerpo estriado también se alteran en los cerebros de ratas obesas. Por ejemplo, las ratas Sprague-Dawley criadas por selectividad para ganar peso rápidamente en una dieta rica en energía (ratas propensas a la obesidad) tienen niveles basales y evocados de dopamina evocada en la NAc que ratas que son resistentes al aumento de peso (ratas resistentes a la obesidad) (Geiger et al. al., 2008; véase también Rada et al., 2010). Las ratas propensas a la obesidad también tienen niveles reducidos de biosintética y maquinaria de almacenamiento de dopamina, lo que sugiere que un fallo en la producción y liberación de dopamina contribuye a los déficits en la transmisión de dopamina en el estriado en ratas obesas (Geiger et al., 2008). Las ratas que desarrollaron obesidad a través del consumo excesivo de una dieta sabrosa y de alta energía también tuvieron niveles basales y evocados de dopamina evocada en la NAc en comparación con las ratas que tuvieron acceso solo al chow estándar ([Davis et al., 2008] y [Geiger et al., 2009]). Es importante destacar que una comida de comida estándar era suficiente para aumentar los niveles de dopamina en el NAc de las ratas de control, mientras que solo los alimentos altamente sabrosos eran suficientes para desencadenar la liberación de dopamina accumbal en las ratas obesas que tenían un historial de acceso extendido a los alimentos palatables. (Geiger et al., 2009). Estos hallazgos demuestran que el desarrollo de la obesidad en ratas se asocia con disfunción en la transmisión mesostriatal de dopamina, principalmente en D2R estriatales, y que la señalización deficiente de D2R contribuye a la aparición de déficits de recompensa durante el desarrollo de obesidad en ratas. Esto es consistente con el hecho de que la regulación a la baja de los D2R estriatales es una respuesta neuroadaptativa notable al aumento de peso en humanos ([Barnard et al., 2009], [Stice et al., 2008a] y [Wang et al., 2001]), y que la señalización D2R estriada deficiente puede atenuar las respuestas del estriado a los alimentos hedónicos en sujetos humanos, lo que predispone al individuo a la ganancia de peso futura ([Stice et al., 2008a] y [Wang et al., 2001]).
Figura 5. Receptores de dopamina D2, disfunción de recompensa y compulsividad en la obesidad: la eliminación de los receptores de dopamina D2 (D2R) en el cuerpo estriado de rata acelera la aparición de disfunción de recompensa y alimentación compulsiva en ratas con acceso extendido a alimentos sabrosos.
La señalización deficiente de D2R puede desencadenar una alimentación compulsiva en la obesidad
La obesidad se caracteriza por un exceso de comida que persiste a pesar del deseo expresado de limitar el consumo y el conocimiento de las consecuencias sociales y sanitarias negativas profundas de un consumo excesivo continuo ([Booth et al., 2008], [Delin et al., 1997] y [Puhl et al., 2008]). Esto se ejemplifica por el hecho de que muchos pacientes obesos se someterán a una cirugía bariátrica (bypass gástrico) potencialmente peligrosa para controlar su peso (Yurcisin et al., 2009), aunque a menudo recaen en exceso a pesar de que la cirugía disminuye la clasificación subjetiva del hambre y reduce la Capacidad para consumir grandes cantidades de alimentos ([Kalarchian et al., 2002] y [Saunders, 2001]). La adicción a las drogas se define de manera similar como la pérdida del control inhibitorio sobre el consumo de drogas y la persistencia en el hábito a pesar de la conciencia de las consecuencias sociales, financieras o de salud potencialmente devastadoras (DSM-IV; American Psychiatric Association, 1994). Como tal, la obesidad y la adicción a las drogas comparten las características distintivas de los trastornos compulsivos en el sentido de que existe una falta notoria en el uso de la información sobre futuras consecuencias perjudiciales para el consumo moderado y la persistencia en el consumo a pesar de la disponibilidad de comportamientos alternativos menos perjudiciales.
El consumo compulsivo de drogas se ha definido operativamente en roedores como el consumo que es resistente a la supresión mediante el castigo o los estímulos ambientales que predicen el castigo ([Pelloux et al., 2007] y [Vanderschuren and Everitt, 2004]). Los períodos de acceso extendido a la cocaína y otras drogas de abuso pueden conducir al surgimiento de conductas compulsivas de consumo de drogas en ratas ([Ahmed y Koob, 1998], [Deroche-Gamonet et al., 2004] y [Vanderschuren and Everitt, 2004] ). De hecho, las ratas con un historial de consumo extenso de cocaína muestran una ingesta que es resistente a la interrupción por un estímulo condicionado aversivo (CS) que predice un resultado negativo (es decir, una luz indicadora que predice la administración de un choque del pie aversivo) ([Belin et al., 2008] y [Vanderschuren y Everitt, 2004]). A la inversa, el mismo CS aversivo puede disminuir profundamente las respuestas de búsqueda de drogas en ratas con un acceso relativamente limitado a la droga. Teniendo en cuenta las similitudes entre el uso compulsivo de drogas en la adicción y la sobrealimentación en la obesidad, recientemente investigamos si las ratas obesas consumirían alimentos sabrosos de manera compulsiva y si los D2R estriatales desempeñan un papel en este proceso (Johnson y Kenny, 2010). Encontramos que las ratas obesas con un historial de acceso extendido a alimentos sabrosos continuaron comiendo alimentos sabrosos incluso en presencia de un CS nocivo (un indicio ligero) que predijo la administración de descargas adversas (Johnson y Kenny, 2010). En contraste, el mismo CS aversivo interrumpió el consumo de alimentos sabrosos en ratas magras con una exposición muy limitada a alimentos palatables densos en energía. Por lo tanto, el consumo aceptable de alimentos puede volverse compulsivo en ratas obesas de la misma manera que el consumo de cocaína puede volverse compulsivo. De acuerdo con esta interpretación de los datos, los ratones que anteriormente tenían acceso a una dieta rica en grasas apetecible pasaron más tiempo en un ambiente aversivo (muy iluminado) para obtener el alimento aceptable que los ratones que no tenían experiencia previa con la dieta (Teegarden y Bale , 2007). Debido al miedo a la depredación, las arenas abiertas y muy iluminadas son muy adversas para los ratones (Suárez y Gallup, 1981). Por lo tanto, los ratones se vuelven resistentes a las consecuencias potencialmente negativas de su comportamiento de forrajeo y correrán el riesgo de depredación para obtener alimentos sabrosos, incluso cuando haya menos alimentos sabrosos disponibles a un riesgo mucho menor.
De manera intrigante, el alelo A1 del polimorfismo TaqIA que resulta en una disminución de la densidad del estriado D2R (Noble, 2000) y la activación estriatal embotada en respuesta a alimentos palatables (Stice et al., 2008a) también se asocia con deficiencias en el aprendizaje para evitar acciones que tienen Consecuencias negativas (Klein et al., 2007). Es precisamente este tipo de falta de uso de la información relacionada con las consecuencias negativas futuras de comer en exceso lo que puede contribuir al desarrollo de la alimentación compulsiva en individuos obesos. Encontramos que la aparición de una alimentación compulsiva en ratas con acceso a alimentos sabrosos se aceleró drásticamente luego de la caída del D2R estriatal (Johnson y Kenny, 2010). De hecho, las ratas con caída de D2R estriatal que anteriormente tenían solo 14 días de acceso extendido a alimentos palatables de gran densidad energética mostraron un consumo de alimentos palatable que era resistente a la interrupción por un CS adverso (Johnson y Kenny, 2010; Figura 5). Sin embargo, este período de 14 de exposición limitada a los alimentos sabrosos no fue suficiente para inducir el consumo compulsivo en ratas de control (Johnson y Kenny, 2010). Estos hallazgos sugieren que la ingesta compulsiva de alimentos sabrosos puede aparecer en ratas obesas. Además, la señalización deficiente de D2R del cuerpo estriado, que acelera la aparición de la hiposensibilidad de la recompensa en respuesta al consumo excesivo de alimentos sabrosos, también acelera la aparición de una alimentación de tipo compulsivo (Figura 5).
Interacciones entre D2Rs y reguladores hormonales del balance de energía en la obesidad
La leptina exógena administrada en el VTA inhibe la transmisión de dopamina por mesoaccumbens y el comportamiento de alimentación ([Hommel et al., 2006] y [Krügel et al., 2003]). Además de su efecto inhibitorio agudo en los sistemas de dopamina del cerebro medio, hay evidencia acumulada de que la señalización de leptina tónica también puede ser necesaria para mantener los niveles apropiados de señalización de dopamina mesostriatal. Flier y sus colegas encontraron que los ratones ob / ob tenían niveles más bajos de tirosina hidroxilasa en las neuronas de la dopamina del cerebro medio, una enzima clave en la biosíntesis de la dopamina (Fulton et al., 2006). Además, los ratones ob / ob habían reducido la liberación de dopamina evocada en el NAc (Fulton et al., 2006) y disminuyeron los depósitos vesiculares somatodendríticos de dopamina en VTA y SN (Roseberry et al., 2007). Estas deficiencias en la producción de dopamina y la maquinaria de transducción de señales en ratones ob / ob se corrigieron mediante tratamiento con leptina ([Fulton et al., 2006] y [Pfaffly et al., 2010]). De hecho, la leptina infundida solo en la LH fue suficiente para corregir la transmisión disfuncional de dopamina en ratones ob / ob (Leinninger et al., 2009), lo que sugiere que las células que expresan el receptor de leptina en la LH actúan para mantener los niveles adecuados de señalización de dopamina. Además de la producción y liberación disminuidas de dopamina, los ratones ob / ob también tendían a tener niveles más bajos de expresión de D2R en el cuerpo estriado (Pfaffly et al., 2010). Además, el tratamiento con leptina exógena bajo un régimen que resulta en el desarrollo de insensibilidad a la señalización de la leptina (es decir, resistencia a la leptina) redujo notablemente los niveles de D2R en los ratones de tipo salvaje (Pfaffly et al., 2010). Las ratas obesas desarrollan resistencia a la leptina en el VTA ([Matheny et al., 2011] y [Scarpace et al., 2010]) y también tienen niveles más bajos de TH en el VTA, disminución de la liberación de dopamina en el estriado y niveles reducidos del D2R del estriado (Geiger et al., 2008). En conjunto, estos datos demuestran que la leptina tiene acciones complejas en los sistemas de dopamina del cerebro medio. Por un lado, la activación aguda de los receptores de leptina en el VTA ejerce un efecto inhibitorio sobre la transmisión de dopamina mesoaccumbens y puede inhibir el comportamiento de alimentación ([Hommel et al., 2006] y [Krügel et al., 2003]). Por otro lado, la señalización de leptina en el cerebro medio es necesaria para mantener la producción adecuada de dopamina y la transmisión de señal, y los déficits genéticos en la señalización de leptina o el desarrollo de resistencia a la leptina en la obesidad interrumpen profundamente los sistemas de dopamina de mesoaccumbens. Como tal, es una posibilidad interesante que el desarrollo de la resistencia a la leptina en las neuronas dopaminérgicas del cerebro medio durante el desarrollo de la obesidad puede desempeñar un papel central en la interrupción de la señalización estriatal D2R que parece impulsar la aparición de una disfunción de recompensa similar a la adicción y la sobrealimentación compulsiva. (Figura 5) en ratas obesas.
Además de los efectos complejos de la señalización de leptina en la transmisión dopaminérgica mesostriatal, hay evidencia acumulada de que los D2Rs a su vez pueden regular la señalización de leptina. El agonista bromocriptina D2R reduce los niveles circulantes de leptina ([Doknic et al., 2002], [Kok et al., 2006] y [Mastronardi et al., 2001], lo que sugiere que D2Rs ejerce una influencia inhibitoria sobre los niveles de leptina. Además, los ratones con mutación nula en el gen D2R han mejorado la señalización de leptina en el hipotálamo y son más sensibles a los efectos anoréxicos de la leptina (Kim et al., 2010). Es bien sabido que los niveles de leptina aumentan durante el desarrollo de la obesidad (hiperleptinemia), pero existe una disminución concomitante en la sensibilidad a la señalización de la leptina (es decir, resistencia a la leptina) (Hamilton et al., 1995). Por lo tanto, es una posibilidad interesante que las disminuciones en la señalización estriatal D2R durante el desarrollo de la obesidad pueden representar una respuesta compensatoria al consumo excesivo de alimentos sabrosos y aumento de peso que aumenta los niveles de leptina circulante y aumenta su eficiencia de señalización para superar el desarrollo de la resistencia a la leptina. Dicha acción puede aumentar los efectos inhibitorios de la leptina en los sistemas del cuerpo estriado que regulan la capacidad de respuesta a los alimentos sabrosos ([Farooqi et al., 2007], [Fulton et al., 2006] y [Hommel et al., 2006]), actuando así Para atenuar las respuestas hedónicas a los alimentos palatables. Al juntar este hallazgo junto con el papel regulador de la leptina en los D2R descritos anteriormente, parece que la señalización de leptina y D2R se puede acoplar de manera recíproca para regular los aspectos homeostáticos y hedónicos del comportamiento de alimentación.
Sistemas de estrés cerebral disregulado en la obesidad
La señalización de leptina en el cerebro medio actúa para regular la transmisión de dopamina en mesoaccumbens y la capacidad de respuesta a los alimentos hedónicos. Sin embargo, las neuronas en el VTA que expresan los receptores de leptina se proyectan de manera dispersa hacia la NAc, y en su lugar muestran proyecciones más prominentes hacia el núcleo central de la amígdala (CeA) (Leshan et al., 2010). En el contexto del comportamiento de alimentación, se sabe que el CeA regula los efectos inhibidores de los estímulos ambientales nocivos sobre el consumo de alimentos (Petrovich et al., 2009). Específicamente, las lesiones de la CeA, pero no de la amígdala basolateral (BLA), eliminan los efectos inhibitorios de un estímulo condicionado emparejado en la pisada sobre la alimentación, lo que sugiere que la CeA es crítica para el control inhibitorio sobre el comportamiento de la alimentación en respuesta a las señales ambientales que predicen un resultado negativo ( Petrovich et al., 2009). Las ratas obesas, o ratas no obesas con caída de D2R estriatal y acceso a alimentos sabrosos, continúan consumiendo alimentos sabrosos de manera compulsiva en presencia de un CS aversivo. Estos efectos son sorprendentemente similares a la interrupción en la reactividad a un CS aversivo en ratas lesionadas con CeA (Petrovich et al., 2009). Por lo tanto, será importante determinar si las alteraciones en la actividad de CeA, tal vez como consecuencia de la regulación por disminución del D2R del estriado o el desarrollo de resistencia a la leptina en el cerebro medio, contribuyen a la aparición de una alimentación de tipo compulsivo en ratas obesas.
Además de regular los efectos de los estímulos ambientales nocivos sobre la conducta alimentaria, el CeA también puede desempeñar un papel clave en la alimentación hedónica relacionada con el estrés. En los seres humanos, el estrés motiva poderosamente la selección y el consumo de alimentos sabrosos y densos en energía independientemente de la necesidad calórica ([Gluck et al., 2004], [Kandiah et al., 2006] y [O'Connor et al., 2008]) , y la obesidad se asocia con una secreción elevada de glucocorticoides relacionada con el estrés ([Björntorp y Rosmond, 2000] y [la Fleur, 2006]). Los factores estresantes ambientales y sociales también inducen hiperfagia de alimentos sabrosos denso en energía en roedores y monos, y el consumo de alimentos sabrosos potencialmente atenúa los efectos adversos del estrés ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al., al., 2004] y [Wilson et al., 2008]). Además, la yohimbina, un fármaco que provoca estrés, puede restablecer en ratas respuestas de búsqueda de alimentos apetecibles (presión de palanca), un efecto atenuado por el antagonista del receptor del factor de liberación de corticotropina 1 (CRF-1), antalarmina (Ghitza et al., 2006). ). Es importante señalar que los efectos precisos del estrés sobre el consumo de alimentos en humanos y animales de laboratorio dependen de la naturaleza y la magnitud del factor estresante, el tipo de alimento disponible para el consumo (sabroso o blando), el peso corporal y el sexo (Dallman , 2010).
Los ratones con acceso extendido a una dieta rica en grasas apetecibles tuvieron una expresión reducida de la hormona del estrés CRF en el CeA (Teegarden and Bale, 2007). A la inversa, los ratones sometidos a "retirada" de la dieta sabrosa habían aumentado la expresión de CRF en el CeA (Teegarden y Bale, 2007). Este último efecto es muy similar al aumento de la expresión de CRF en CeA detectada en ratas sometidas a abstinencia de todas las principales drogas de abuso (Koob, 2010). Debido a que un mayor uso de drogas puede normalizar esta respuesta neurobiológica aversiva a la abstinencia de drogas, se ha planteado la hipótesis de que la transmisión hiperactiva de CRF en CeA y otras estructuras límbicas puede facilitar el desarrollo del uso compulsivo de drogas (Koob y Zorrilla, 2010). De acuerdo con este punto de vista, los ratones sometidos a la abstinencia de alimentos apetecibles con alto contenido de energía, que tenían niveles elevados de CRF en CeA, pasaron significativamente más tiempo en un ambiente aversivo (muy iluminado) para obtener alimentos sabrosos que los ratones sin experiencia previa de la comida, incluso aunque menos apetecible estaba disponible en un entorno no adverso (con poca luz) (Teegarden and Bale, 2007). Por lo tanto, los ratones se vuelven resistentes a las consecuencias potencialmente negativas de su comportamiento de forrajeo y arriesgan la depredación para obtener alimentos sabrosos, incluso cuando se dispone de alimentos menos sabrosos a un riesgo mucho menor, en parte para atenuar la transmisión de CRF en el CeA (Teegarden y Bale, 2007). Varias piezas de evidencia adicionales apoyan un papel para la transmisión de CRF en la alimentación compulsiva. En particular, un estudio reciente evaluó los efectos del antagonista del receptor CRF-1 R121919 en el consumo de alimentos en ratas que experimentaron una variación cíclica en su dieta en la que tuvieron acceso a los días de chow estándar de 5 por semana y al acceso a una dieta de azúcar palatable de 2 por día. semana (Cottone et al., 2009). Después de 7 semanas de esta variación cíclica en la dieta, R121919 atenuó el consumo excesivo de la dieta altamente sabrosa y aumentó el consumo de chow suave (Cottone et al., 2009). Además, los niveles de expresión de CRF en el CeA aumentaron en las ratas cicladas durante el retiro de la dieta sabrosa, pero volvieron a los niveles de referencia después de la reexposición a la dieta apetecible (Cottone et al., 2009). Finalmente, la regulación por CRF de la transmisión GABAérgica en el CeA se mejoró en las ratas cicladas que se retiraron de la dieta sabrosa en comparación con las ratas de control que anteriormente tenían acceso solo a comida blanda, lo que se refleja en el hecho de que R121919 interrumpió el potencial post-sináptico inhibidor de GABAergic evocado en Los cortes de CeA de las ratas cicladas a una concentración que no alteró la transmisión en los cortes de las ratas de control (Cottone et al., 2009). Curiosamente, un efecto similar de CRF en la transmisión GABAérgica en CeA también se ha observado en ratas sometidas a abstinencia de exposición crónica a etanol (Roberto et al., 2010). Finalmente, el CeA, el núcleo del lecho de la estría terminal (BNST) y el caparazón de NAc constituyen una estructura contigua más grande denominada "amígdala extendida". La infusión de CRF en el caparazón de NAc en sitios que estimulan la alimentación hedónica realza la salubridad motivacional de un ambiente señal que previamente se había combinado con la disponibilidad de alimentos sabrosos (Peciña et al., 2006a). Por lo tanto, el estrés puede mejorar la prominencia de las señales ambientales emparejadas con los alimentos mediante la modulación de la actividad de las neuronas de la capa NAc. En conjunto, estos hallazgos sugieren que el consumo excesivo de alimentos sabrosos o drogas de abuso puede inducir respuestas neuroadaptativas similares en las vías de estrés extrahipotalámico en el cerebro, lo que puede contribuir a comportamientos consumatorios compulsivos.
Conclusiones
Se ha avanzado mucho recientemente en la identificación de los sistemas cerebrales implicados en los efectos hedónicos de los alimentos sabrosos y las adaptaciones que se producen en estos circuitos en respuesta al consumo excesivo de alimentos sabrosos y al aumento de peso. Es sorprendente que sistemas cerebrales similares y respuestas adaptativas comunes se desencadenan en respuesta al consumo de alimentos apetecibles y drogas adictivas. En particular, el consumo excesivo de alimentos sabrosos o drogas de abuso induce déficits similares en la capacidad de respuesta de los sistemas de recompensa del cerebro. Los alimentos apetecibles y las drogas adictivas inducen déficits en la transmisión de dopamina estriatal y la expresión de D2R estriatales. La comida apetecible y las drogas adictivas también desencadenan la aparición de un comportamiento consumatorio de tipo compulsivo en los roedores y provocan respuestas de estrés extrahipotalámico. Finalmente, las vulnerabilidades genéticas comunes en los sistemas de recompensa del cerebro pueden predisponer a las personas a comer en exceso y a la obesidad, y también al consumo de drogas y la adicción. De hecho, sobre la base de estas y otras similitudes entre la obesidad y la adicción a las drogas, se ha argumentado que la obesidad debería incluirse como una categoría diagnóstica en el próximo DSM-V ([Devlin, 2007] y [Volkow y O'Brien, 2007] ). Teniendo esto en cuenta, las áreas críticas para la investigación futura involucrarán investigar más a fondo las posibles superposiciones neurobiológicas entre la alimentación compulsiva y el uso de drogas. Por ejemplo, será importante probar si la obesidad está relacionada con el desarrollo de una conducta consumatoria similar a un hábito resultante de la plasticidad en el cuerpo estriado dorsal de la misma manera que la adicción a las drogas puede estar relacionada con la remodelación del estriado y la aparición de la búsqueda de drogas similar a un hábito. comportamientos ([Everitt y Robbins, 2005], [Hollander et al., 2010] y [Kasanetz et al., 2010]). Además, las regiones cerebrales corticales involucradas en el control ejecutivo y la toma de decisiones (es decir, la corteza prefrontal) y en el procesamiento interoceptivo (corteza insular) han estado fuertemente implicadas en la adicción a las drogas ([Everitt et al., 2008], [Fineberg et al., 2010 ], [Koob y Volkow, 2010] y [Naqvi y Bechara, 2009]), aunque se sabe poco sobre su papel preciso en la alimentación compulsiva y la obesidad, por ejemplo, ([Nair et al., 2011] y [Volkow et al. , 2009]). En conjunto, los datos revisados anteriormente apoyan la noción de que la obesidad y la adicción a las drogas pueden surgir de respuestas neuroadaptativas similares en los circuitos de recompensa del cerebro, y sugieren que los mecanismos conocidos de adicción pueden proporcionar un marco heurístico para comprender la obesidad.
AGRADECIMIENTOS
El autor es apoyado por becas del Instituto Nacional sobre el Abuso de Drogas (NIDA). El autor agradece a Paul Johnson y Christie Fowler por sus valiosas ideas y comentarios sobre el manuscrito. Este es el número del manuscrito 21042 del Instituto de Investigación Scripps.
Referencias
1.
o Abizaid et al., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Pensamientos para la alimentación: mecanismos cerebrales y balance energético periférico.
o Neuron, 51 (2006), pp. 691 – 702
o
2.
o Abizaid et al., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp et al.
o Ghrelin modula la actividad y la organización de entrada sináptica de las neuronas de dopamina del cerebro medio mientras promueve el apetito
o J. Clin. Invest., 116 (2006), pp. 3229 – 3239
o
3.
o Ahmed y Koob, 1998
o SH Ahmed, GF Koob
o Transición de la ingesta de drogas moderada a excesiva: cambio en el punto de ajuste hedónico
o Ciencia, 282 (1998), pp. 298 – 300
o
4.
o Ahmed y Koob, 2005
o SH Ahmed, GF Koob
o Transición a la adicción a las drogas: un modelo de refuerzo negativo basado en una disminución alostática en la función de recompensa
o Psicofarmacología (Berl.), 180 (2005), pp. 473 – 490
o
5.
o Ahmed et al., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Evidencia neurobiológica de la alostasis hedónica asociada con el aumento del consumo de cocaína.
o nat. Neurosci., 5 (2002), pp. 625 – 626
o
6.
o Allison et al., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Muertes anuales atribuibles a la obesidad en los Estados Unidos.
o JAMA, 282 (1999), pp. 1530 – 1538
o
7.
o Asociación Americana de Psiquiatría, 1994
o Asociación Americana de Psiquiatría
o Manual diagnóstico y estadístico de trastornos mentales.
o (Cuarta edición) Asociación Americana de Psiquiatría, Washington, DC (1994)
o
8.
o Angeles-Castellanos et al., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Horarios diarios de alimentación restringida de la inmunorreactividad Per1 de c-Fos y proteína en regiones corticolímbicas en ratas
o Neurociencia, 144 (2007), pp. 344 – 355
o
9.
o Baicy et al., 2007
o K. Baicy, ED Londres, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
o El reemplazo de leptina altera la respuesta del cerebro a las señales de los alimentos en adultos con deficiencia de leptina genéticamente
o Proc. Natl Acad Sci. EE.UU., 104 (2007), pp. 18276 – 18279
o
10.
o Baldo et al., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Activación de una subpoblación de neuronas hipotalámicas que contienen orexina / hipocretina por inhibición mediada por el receptor GABAA de la cáscara del núcleo accumbens, pero no por exposición a un entorno nuevo
o Eur. J. Neurosci., 19 (2004), pp. 376 – 386
o
11.
o Balleine y Dickinson, 2000
o BW Balleine, A. Dickinson
o El efecto de las lesiones de la corteza insular sobre el condicionamiento instrumental: evidencia de un papel en la memoria de incentivos
o J. Neurosci., 20 (2000), pp. 8954 – 8964
o
12.
o Barnard et al., 2009
o ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o D2 receptor de dopamina Taq1A polimorfismo, peso corporal e ingesta alimentaria en la diabetes tipo 2
o Nutrición, 25 (2009), pp. 58 – 65
o
13.
o Basso y Kelley, 1999
o soy Basso, AE Kelley
o Alimentación inducida por la estimulación del receptor GABA (A) dentro de la cáscara del núcleo accumbens: mapeo regional y caracterización de macronutrientes y preferencia de sabor
o Behav. Neurosci., 113 (1999), pp. 324 – 336
o
14.
o Batterham et al., 2007
o RL Batterham, DH Ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o La modulación PYY de las áreas cerebrales cortical e hipotalámica predice el comportamiento de alimentación en los humanos
o Naturaleza, 450 (2007), pp. 106 – 109
o
15.
o Baxter y Murray, 2002
o MG Baxter, EA Murray
o La amígdala y la recompensa.
o nat. Rev. Neurosci., 3 (2002), pp. 563 – 573
o
16.
o Bean et al., 2008
o MK Bean, K. Stewart, ME Olbrisch
o Obesidad en América: implicaciones para los psicólogos clínicos y de la salud
o J. Clin. Psychol. Medicina. Configuraciones, 15 (2008), pp. 214 – 224
o
17.
o Beaver et al., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Las diferencias individuales en el impulso de recompensa predicen las respuestas neuronales a las imágenes de los alimentos
o J. Neurosci., 26 (2006), pp. 5160 – 5166
o
18.
o Belin et al., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o La alta impulsividad predice el cambio a la toma compulsiva de cocaína.
o Ciencia, 320 (2008), pp. 1352 – 1355
o
19.
o Berridge, 1996
o KC Berridge
o Recompensa de alimentos: sustratos cerebrales de querer y gustar.
o Neurosci. Biobehav. Rev., 20 (1996), pp. 1 – 25
o
20.
o Berridge, 2009
o KC Berridge
o 'Me gusta' y 'querer' recompensas de comida: sustratos cerebrales y roles en los trastornos de la alimentación
o fisiol. Behav., 97 (2009), pp. 537 – 550
o
21.
o Björntorp y Rosmond, 2000
o P. Björntorp, R. Rosmond
o Obesidad y cortisol
o Nutrición, 16 (2000), pp. 924 – 936
o
22.
o Blundell y Herberg, 1968
o JE Blundell, LJ Herberg
o Los efectos relativos del déficit nutricional y el período de privación sobre la tasa de autoestimulación eléctrica del hipotálamo lateral
o Naturaleza, 219 (1968), pp. 627 – 628
o
23.
o Booth et al., 2008
o ML Booth, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Percepciones de los adolescentes sobre el sobrepeso y la obesidad: el estudio sobre el peso de la opinión
o J. Paediatr. Salud Infantil, 44 (2008), pp. 248 – 252
o
24.
o Bragulat et al., 2010
o V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Sondas de olores relacionados con los alimentos de los circuitos de recompensa cerebral durante el hambre: un estudio piloto de fMRI
o Obesidad, Silver Spring, MD (2010)
o
25.
o Cabanac y Johnson, 1983
o M. Cabanac, KG Johnson
o Análisis de un conflicto entre la palatabilidad y la exposición al frío en ratas.
o fisiol. Behav., 31 (1983), pp. 249 – 253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Proteína OB de ratón recombinante: evidencia de una señal periférica que une la adiposidad y las redes neuronales centrales
o Ciencia, 269 (1995), pp. 546 – 549
o
27.
o Cañon y Palmiter, 2003
o CM Cannon, RD Palmiter
o Recompensa sin dopamina
o J. Neurosci., 23 (2003), pp. 10827 – 10831
o
28.
o Carr y Simon, 1984
o KD Carr, EJ Simon
o La potenciación de la recompensa por el hambre es mediada por opioides.
o Brain Res., 297 (1984), pp. 369 – 373
o
29.
o Centros para el Control y Prevención de Enfermedades, 2009
o Centros para el Control y Prevención de Enfermedades (2009). Tendencias de la obesidad en los Estados Unidos (Atlanta: Centros para el Control y la Prevención de Enfermedades).
o
30.
o Colantuoni et al., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o La ingesta excesiva de azúcar altera la unión a los receptores de dopamina y opioides mu en el cerebro
o Neuroreport, 12 (2001), pp. 3549 – 3552
o
31.
o Cornelius et al., 2010
o JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Trastornos del control del impulso con el uso de agentes dopaminérgicos en el síndrome de piernas inquietas: un estudio de casos y controles
o Sueño, 33 (2010), pp. 81 – 87
o
32.
o Cornier et al., 2009
o MA Cornier, AK Salzberg, DC Endly, DH Bessesen, DC Rojas, JR Tregellas
o Los efectos de la sobrealimentación en la respuesta neuronal a las señales visuales de alimentos en individuos delgados y con obesidad reducida
o PLoS ONE, 4 (2009), pág. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone et al., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o El reclutamiento del sistema CRF media el lado oscuro de la alimentación compulsiva
o Proc. Natl Acad Sci. EE.UU., 106 (2009), pp. 20016 – 20020
o
34.
o Dagher, 2009
o A. Dagher
o La neurobiología del apetito: el hambre como adicción.
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S30 – S33
o
35.
o Dagher y Robbins, 2009
o A. Dagher, TW Robbins
o Personalidad, adicción, dopamina: conocimientos de la enfermedad de Parkinson
o Neuron, 61 (2009), pp. 502 – 510
o
36.
o Dallman, 2010
o MF Dallman
o La obesidad inducida por el estrés y el sistema nervioso emocional.
o Tendencias del endocrinol. Metab., 21 (2010), pp. 159 – 165
o
37.
o Dallman et al., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Estrés crónico y obesidad: una nueva visión de la “comida reconfortante”
o Proc. Natl Acad Sci. EE.UU., 100 (2003), pp. 11696 – 11701
o
38.
o Dallman et al., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Glucocorticoides, estrés crónico y obesidad.
o Prog. Brain Res., 153 (2006), pp. 75 – 105
o
39.
o Davis et al., 2004
o C. Davis, S. Strachan, M. Berkson
o Sensibilidad de recompensa: implicaciones para comer en exceso y sobrepeso
o Appetite, 42 (2004), pp. 131 – 138
o
40.
o Davis et al., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o La exposición a niveles elevados de grasa en la dieta atenúa la recompensa psicoestimulante y la rotación de dopamina mesolímbica en la rata
o Behav. Neurosci., 122 (2008), pp. 1257 – 1263
o
41.
o de Araujo et al., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Detección metabólica en sistemas de dopamina cerebral.
o Resultados Probl. Diferencia de celda, 52 (2010), pp. 69 – 86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o Comportamiento alimentario y la experiencia del hambre después de la cirugía de bypass gástrico para la obesidad mórbida
o Obes. Surg., 7 (1997), pp. 405 – 413
o
43.
o Deroche-Gamonet et al., 2004
o V. Deroche-Gamonet, D. Belin, PV Piazza
o Evidencia de comportamiento similar a la adicción en la rata.
o Ciencia, 305 (2004), pp. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o ¿Hay un lugar para la obesidad en el DSM-V?
o Int. J. Comer. Disord., 40 (Suppl) (2007), pp. S83 – S88
o
45.
o Doknic et al., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Tono dopaminérgico y obesidad: una perspectiva de los prolactinomas tratados con bromocriptina
o Eur. J. Endocrinol., 147 (2002), pp. 77 – 84
o
46.
o Everitt y Robbins, 2005
o BJ Everitt, TW Robbins
o Sistemas neuronales de refuerzo para la adicción a las drogas: de las acciones a los hábitos, a la compulsión.
o nat. Neurosci., 8 (2005), pp. 1481 – 1489
o
47.
o Everitt et al., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Revisión. Mecanismos neuronales subyacentes a la vulnerabilidad para desarrollar hábitos compulsivos de búsqueda de drogas y adicción.
o Philos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), pp. 3125 – 3135
o
48.
o Farooqi et al., 2007
o ES Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o La leptina regula las regiones estriadas y el comportamiento alimentario humano.
o Ciencia, 317 (2007), pág. 1355
o
49.
o Felsted et al., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Pequeño
o Diferencias genéticamente determinadas en la respuesta del cerebro a una recompensa alimentaria primaria
o J. Neurosci., 30 (2010), pp. 2428 – 2432
o
50.
o Figlewicz et al., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
o La leptina revierte la preferencia de lugar condicionada por la sacarosa en ratas con restricción alimenticia
o fisiol. Behav., 73 (2001), pp. 229 – 234
o
51.
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Expresión de receptores para insulina y leptina en el área ventral tegmental / sustancia negra (VTA / SN) de la rata.
o Brain Res., 964 (2003), pp. 107 – 115
o
52.
o Fineberg et al., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlín, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o Sondeo de conductas compulsivas e impulsivas, desde modelos animales hasta endofenotipos: una revisión narrativa
o Neuropsicofarmacología, 35 (2010), pp. 591 – 604
o
53.
o Finkelstein et al., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Causas económicas y consecuencias de la obesidad.
o Annu. Rev. Salud Pública, 26 (2005), pp. 239 – 257
o
54.
o Flegal et al., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Prevalencia y tendencias en la obesidad en adultos de EE. UU., 1999-2008
o JAMA, 303 (2010), pp. 235 – 241
o
55.
o Foo y Mason, 2005
o H. Foo, P. Mason
o Supresión sensorial durante la alimentación.
o Proc. Natl Acad Sci. EE.UU., 102 (2005), pp. 16865 – 16869
o
56.
o Franken y Muris, 2005
o IH Franken, P. Muris
o Las diferencias individuales en la sensibilidad de la recompensa están relacionadas con el deseo de comer y el peso corporal relativo en mujeres sanas
o Appetite, 45 (2005), pp. 198 – 201
o
57.
o Friedman et al., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o La estimulación eléctrica de la habénula lateral produce un efecto inhibitorio sobre la autoadministración de la sacarosa.
o Neurofarmacología, 60 (2011), pp. 381 – 387
o
58.
o Fulton et al., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulación de los circuitos de recompensa cerebral por leptina.
o Ciencia, 287 (2000), pp. 125 – 128
o
59.
o Fulton et al., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Regulación de la leptina de la vía de dopamina mesoaccumbens
o Neuron, 51 (2006), pp. 811 – 822
o
60.
o Gao y Horvath, 2007
o Q. Gao, TL Horvath
o Neurobiología de la alimentación y gasto energético.
o Annu. Rev. Neurosci., 30 (2007), pp. 367 – 398
o
61.
o Gautier et al., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Respuestas cerebrales diferenciales a la saciedad en hombres obesos y delgados.
o Diabetes, 49 (2000), pp. 838 – 846
o
62.
o Geiger et al., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Evidencia de exocitosis de dopamina mesolímbica defectuosa en ratas propensas a la obesidad
o FASEB J., 22 (2008), pp. 2740 – 2746
o
63.
o Geiger et al., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Déficits de neurotransmisión de dopamina mesolímbica en la obesidad alimentaria de ratas
o Neurociencia, 159 (2009), pp. 1193 – 1199
o
64.
o Ghitza et al., 2006
o UE Ghitza, SM Gray, DH Epstein, KC Rice, Y. Shaham
o Neuropsicofarmacología
o La yohimbina ansiogénica restablece la búsqueda de alimentos sabrosos en un modelo de recaída de rata: un papel de los receptores CRF (1), 33 (2006), pp.
o
65.
o Gluck et al., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortisol, hambre y deseo de comer en exceso después de una prueba de estrés por frío en mujeres obesas con trastorno por atracón
o psicosom. Med., 66 (2004), pp. 876 – 881
o
66.
o Goldstone et al., 2009
o AP Goldstone, CG Prechtl de Hernández, JD Castor, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o El ayuno sesga los sistemas de recompensa cerebral hacia los alimentos ricos en calorías
o Eur. J. Neurosci., 30 (2009), pp. 1625 – 1635
o
67.
o Halaas et al., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Efectos reductores de peso de la proteína plasmática codificada por el gen obeso
o Ciencia, 269 (1995), pp. 543 – 546
o
68.
o Hamilton et al., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Aumento de la expresión del ARNm obeso en células de grasa omental de humanos con obesidad masiva
o nat. Med., 1 (1995), pp. 953 – 956
o
69.
o Hernández y Hoebel, 1988
o L. Hernández, BG Hoebel
o La recompensa de alimentos y la cocaína aumentan la dopamina extracelular en el núcleo accumbens, medida por microdiálisis
o Life Sci., 42 (1988), pp. 1705 – 1712
o
70.
o Hill et al., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Obesidad y medio ambiente: ¿A dónde vamos desde aquí?
o Ciencia, 299 (2003), pp. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o Alimentación y autoestimulación.
o Ann. NY Acad. Sci., 157 (1969), pp. 758 – 778
o
72.
o Hoebel y Balagura, 1967
o BG Hoebel, S. Balagura
o Autoestimulación del hipotálamo lateral modificado por insulina y glucagón.
o fisiol. Behav., 2 (1967), pp. 337 – 340
o
73.
o Hoebel y Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Control hipotalámico de la alimentación y autoestimulación.
o Ciencia, 135 (1962), pp. 375 – 377
o
74.
o Hoebel y Thompson, 1969
o BG Hoebel, RD Thompson
o Aversión a la estimulación hipotalámica lateral causada por alimentación intragástrica u obesidad
o J. Comp. Fisiol. Psychol., 68 (1969), pp. 536 – 543
o
75.
o Hofmann et al., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o A medida que se desarrolla el placer: respuestas hedónicas a la comida tentadora.
o Psychol. Sci., 21 (2010), pp. 1863 – 1870
o
76.
o Holanda y Gallagher, 2004
o PC Holland, M. Gallagher
o Intervalos amígdala-frontal y expectativa de recompensa.
o Curr. Opin. Neurobiol., 14 (2004), pp. 148 – 155
o
77.
o Hollander et al., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o MicroRNA estriado controla la ingesta de cocaína a través de la señalización CREB
o Naturaleza, 466 (2010), pp. 197 – 202
o
78.
o Hommel et al., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o La señalización del receptor de leptina en las neuronas de la dopamina del cerebro medio regula la alimentación
o Neuron, 51 (2006), pp. 801 – 810
o
79.
o Imaizumi et al., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Preferencia por alimentos altos en grasa en ratones: papas fritas en comparación con papas hervidas
o Appetite, 36 (2001), pp. 237 – 238
o
80.
o Jerlhag et al., 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Ghrelin estimula la actividad locomotora y el desbordamiento de dopamina accumbal a través de sistemas colinérgicos centrales en ratones: implicaciones para su participación en la recompensa cerebral
o Adicto. Biol., 11 (2006), pp. 45 – 54
o
81.
o Jerlhag et al., 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o La administración de grelina en áreas tegmentales estimula la actividad locomotora y aumenta la concentración extracelular de dopamina en el núcleo accumbens
o Adicto. Biol., 12 (2007), pp. 6 – 16
o
82.
o Jhou et al., 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o El núcleo tegmental rostromedial (RMTg), un aferente GABAérgico a las neuronas de la dopamina del cerebro medio, codifica estímulos aversivos e inhibe las respuestas motoras.
o Neuron, 61 (2009), pp. 786 – 800
o
83.
o Johnson y Kenny, 2010
o PM Johnson, PJ Kenny
o Receptores de dopamina D2 en disfunción de recompensa similar a la adicción y alimentación compulsiva en ratas obesas
o nat. Neurosci., 13 (2010), pp. 635 – 641
o
84.
o Johnson et al., 1996
o PI Johnson, MA Parente, JR Stellar
o Las lesiones inducidas por NMDA del núcleo accumbens o el pálido ventral aumentan la eficacia gratificante del alimento para las ratas privadas.
o Brain Res., 722 (1996), pp. 109 – 117
o
85.
o Jönsson et al., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polimorfismos en el gen del receptor D2 de dopamina y sus relaciones con la densidad de receptores de dopamina estriatal de voluntarios sanos
o mol. Psiquiatría, 4 (1999), pp. 290 – 296
o
86.
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Comer en exceso entre los pacientes con bypass gástrico en el seguimiento a largo plazo
o Obes. Surg., 12 (2002), pp. 270 – 275
o
87.
o Kandiah et al., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o El estrés influye en las preferencias de apetito y comodidad de los alimentos en las mujeres universitarias
o Nutr. Res., 26 (2006), pp. 118 – 123
o
88.
o Karhunen et al., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Flujo sanguíneo cerebral regional durante la exposición a alimentos en mujeres obesas y de peso normal
o Cerebro, 120 (1997), pp. 1675 – 1684
o
89.
o Kasanetz et al., 2010
o F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o La transición a la adicción se asocia con un deterioro persistente en la plasticidad sináptica
o Ciencia, 328 (2010), pp. 1709 – 1712
o
90.
o Kelley et al., 1996
o AE Kelley, EP Bless, CJ Swanson
o Investigación de los efectos de los antagonistas opiáceos infundidos en el núcleo accumbens sobre la alimentación y el consumo de sacarosa en ratas
o J. Pharmacol. Exp. Ther., 278 (1996), pp. 1499 – 1507
o
91.
o Kelley et al., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Circuito corticostriatal-hipotalámico y motivación de los alimentos: integración de energía, acción y recompensa.
o fisiol. Behav., 86 (2005), pp. 773 – 795
o
92.
o Kenny et al., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o La abstinencia condicionada impulsa el consumo de heroína y disminuye la sensibilidad de recompensa
o J. Neurosci., 26 (2006), pp. 5894 – 5900
o
93.
o Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Señalización de leptina hipotalámica mejorada en ratones que carecen de receptores D2 de dopamina
o J. Biol. Chem., 285 (2010), pp. 8905 – 8917
o
94.
o Klein et al., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Diferencias genéticamente determinadas en aprender de los errores.
o Ciencia, 318 (2007), pp. 1642 – 1645
o
95.
o Kojima et al., 1999
o M. Kojima, H. Hosoda, Y. Fecha, M. Nakazato, H. Matsuo, K. Kangawa
o Ghrelin es un péptido acilado liberador de hormona de crecimiento del estómago
o Naturaleza, 402 (1999), pp. 656 – 660
o
96.
o Kok et al., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o La activación de los receptores D2 de la dopamina reduce las concentraciones de leptina circadiana en mujeres obesas
o J. Clin. Endocrinol Metab., 91 (2006), pp. 3236 – 3240
o
97.
o Koob, 2010
o GF Koob
o El papel de CRF y péptidos relacionados con CRF en el lado oscuro de la adicción
o Brain Res., 1314 (2010), pp. 3 – 14
o
98.
o Koob y Le Moal, 2008
o GF Koob, M. Le Moal
o La adicción y el sistema antibalas del cerebro.
o Annu. Rev. Psychol., 59 (2008), pp. 29 – 53
o
99.
o Koob y Volkow, 2010
o GF Koob, ND Volkow
o neurocircuitos de la adicción
o Neuropsicofarmacología, 35 (2010), pp. 217 – 238
o
100.
o Koob y Zorrilla, 2010
o GF Koob, EP Zorrilla
o Mecanismos neurobiológicos de la adicción: enfoque en el factor liberador de corticotropina
o Curr. Opin. Investig. Drogas, 11 (2010), pp. 63 – 71
o
101.
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o La activación de la corteza orbitofrontal humana a un estímulo de alimento líquido se correlaciona con su agrado subjetivo
o Cereb. Cortex, 13 (2003), pp. 1064 – 1071
o
102.
o Krügel et al., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o La liberación de dopamina basal y provocada por la alimentación en el núcleo de rata accumbens está deprimida por la leptina
o Eur. J. Pharmacol., 482 (2003), pp. 185 – 187
o
103.
o la Fleur, 2006
o SE la Fleur
o Los efectos de los glucocorticoides sobre el comportamiento de alimentación en ratas
o fisiol. Behav., 89 (2006), pp. 110 – 114
o
104.
o LaBar et al., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o El hambre modula selectivamente la activación corticolímbica a los estímulos alimentarios en humanos
o Behav. Neurosci., 115 (2001), pp. 493 – 500
o
105.
o Latagliata et al., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o La búsqueda de alimentos a pesar de sus consecuencias dañinas está bajo control noradrenérgico cortical prefrontal
o BMC Neurosci., 11 (2010), pág. 15
o
106.
o Lawford et al., 2000
o BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o El alelo D (2) del receptor de dopamina A (1) y la dependencia de opioides: asociación con el uso de heroína y respuesta al tratamiento con metadona
o soy. J. Med. Genet., 96 (2000), pp. 592 – 598
o
107.
o Leinninger et al., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong et al.
o La leptina actúa a través de las neuronas hipotalámicas laterales que expresan el receptor de leptina para modular el sistema de dopamina mesolímbica y suprimir la alimentación
o Cell Metab., 10 (2009), pp. 89 – 98
o
108.
o Lenoir et al., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o La dulzura intensa supera la recompensa de la cocaína.
o PLoS ONE, 2 (2007), pág. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan et al., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Las neuronas receptoras de leptina del área tegmental ventral proyectan específicamente y regulan las neuronas de transcripción reguladas por cocaína y anfetamina de la amígdala central extendida
o J. Neurosci., 30 (2010), pp. 5713 – 5723
o
110.
o Louis et al., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Inervación y modulación directas de las neuronas de orexina por las neuronas LepRb hipotalámicas laterales
o J. Neurosci., 30 (2010), pp. 11278 – 11287
o
111.
o Luppino et al., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Sobrepeso, obesidad y depresión: una revisión sistemática y meta-análisis de estudios longitudinales
o Arco. Gen. Psychiatry, 67 (2010), pp. 220 – 229
o
112.
o Lutter y Nestler, 2009
o M. Lutter, EJ Nestler
o Las señales homeostáticas y hedónicas interactúan en la regulación de la ingesta de alimentos.
o J. Nutr., 139 (2009), pp. 629 – 632
o
113.
o Macht y Mueller, 2007
o M. Macht, J. Mueller
o Efectos inmediatos del chocolate en estados de ánimo inducidos experimentalmente
o Appetite, 49 (2007), pp. 667 – 674
o
114.
o Maldonado-Irizarry y Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Las lesiones excitotóxicas de las subregiones núcleo y concha del núcleo accumbens interrumpen de manera diferente la regulación del peso corporal y la actividad motora en ratas.
o Brain Res. Bull., 38 (1995), pp. 551 – 559
o
115.
o Maldonado-Irizarry et al., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Los receptores de glutamato en el núcleo accumbens controlan el comportamiento de alimentación a través del hipotálamo lateral
o J. Neurosci., 15 (1995), pp. 6779 – 6788
o
116.
o Malik et al., 2008
o S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o Ghrelin modula la actividad cerebral en áreas que controlan el comportamiento apetitivo
o Cell Metab., 7 (2008), pp. 400 – 409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o El papel de la corteza orbitofrontal y el estriado medial en la regulación de las respuestas prepotentes a las recompensas de alimentos
o Cereb. Cortex, 19 (2009), pp. 899 – 906
o
118.
o Margules and Olds, 1962
o DL Margules, J. Olds
o Sistemas idénticos de "alimentación" y "recompensa" en el hipotálamo lateral de las ratas
o Ciencia, 135 (1962), pp. 374 – 375
o
119.
o Markou y Frank, 1987
o A. Markou, RA Frank
o El efecto de la colocación operante y de electrodos en las funciones de respuesta de la duración del tren de autoestimulación
o fisiol. Behav., 41 (1987), pp. 303 – 308
o
120.
o Markou y Koob, 1991
o A. Markou, GF Koob
o Postcocaína anhedonia. Un modelo animal de extracción de cocaína.
o Neuropsicofarmacología, 4 (1991), pp. 17 – 26
o
121.
o Mastronardi et al., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o La liberación de leptina inducida por lipopolisacáridos es controlada neurológicamente
o Proc. Natl Acad Sci. EE.UU., 98 (2001), pp. 14720 – 14725
o
122.
o Matheny et al., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o La resistencia a la leptina celular inducida por la dieta y la leptina específica de la región incluye el área tegmental ventral en ratas
o Neurofarmacología (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 en prensa. Publicado en línea noviembre 5, 2010
o
123.
o Matsumoto y Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Habénula lateral como fuente de señales de recompensa negativas en las neuronas de dopamina.
o Naturaleza, 447 (2007), pp. 1111 – 1115
o
124.
o Morton et al., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Control del sistema nervioso central de la ingesta de alimentos y peso corporal.
o Naturaleza, 443 (2006), pp. 289 – 295
o
125.
o Monte y Hoebel, 1967
o G. Monte, BG Hoebel
o Autoestimulación hipotalámica lateral: umbral autodeterminado aumentado por la ingesta de alimentos
o Psychon. Sci., 9 (1967), pp. 265 – 266
o
126.
o Nair et al., 2011
o SG Nair, BM Navarra, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Papel de la familia dorsal D1 de la corteza prefrontal medial dorsal en la recaída a la búsqueda de alimentos ricos en grasa inducida por el medicamento ansiogénico yohimbina
o Neuropsicofarmacología, 36 (2011), pp. 497 – 510
o
127.
o Nakazato et al., 2001
o M. Nakazato, N. Murakami, Y. Fecha, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Un papel para la grelina en la regulación central de la alimentación.
o Naturaleza, 409 (2001), pp. 194 – 198
o
128.
o Naqvi y Bechara, 2009
o NH Naqvi, A. Bechara
o La isla oculta de la adicción: la ínsula.
o Trends Neurosci., 32 (2009), pp. 56 – 67
o
129.
o Neville et al., 2004
o MJ Neville, EC Johnstone, RT Walton
o Identificación y caracterización de ANKK1: un nuevo gen de cinasa estrechamente vinculado a DRD2 en la banda cromosómica 11q23.1
o Hum. Mutat., 23 (2004), pp. 540 – 545
o
130.
o Nirenberg y Waters, 2006
o MJ Nirenberg, C. Aguas
o Alimentación compulsiva y aumento de peso relacionado con el uso de agonistas de la dopamina.
o Mov. Disord., 21 (2006), pp. 524 – 529
o
131.
o Noble, 2000
o EP Noble
o La adicción y su proceso de recompensa a través de los polimorfismos del gen del receptor de dopamina D2: una revisión
o Eur. Psiquiatría, 15 (2000), pp. 79 – 89
o
132.
o Noble et al., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Asociación alélica del gen receptor de dopamina D2 con dependencia de cocaína
o Drogas Alcohol Depend., 33 (1993), pp. 271 – 285
o
133.
o Noble et al., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotipos en el locus DRD2 y alcoholismo severo
o soy. J. Med. Genet., 96 (2000), pp. 622 – 631
o
134.
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Efectos de las molestias diarias y el estilo de comer sobre el comportamiento alimentario
o Health Psychol., 27 (1, Suppl) (2008), pp. S20 – S31
o
135.
o O'Doherty et al., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Respuestas neuronales durante la anticipación de una recompensa de sabor primaria
o Neuron, 33 (2002), pp. 815 – 826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o La genética humana ilumina los caminos de la enfermedad metabólica.
o Naturaleza, 462 (2009), pp. 307 – 314
o
137.
o Oswald et al., 2010
o KD Oswald, DL Murdaugh, VL King, MM Boggiano
o Motivación por alimentos sabrosos a pesar de las consecuencias en un modelo animal de comer en exceso.
o Int. J. Comer. Desorden (2010) http://dx.doi.org/10.1002/eat.20808 en la prensa. Publicado en línea febrero 22, 2010
o
138.
o Park and Carr, 1998
o TH Park, KD Carr
o Patrones neuroanatómicos de la inmunorreactividad de tipo fos inducida por una comida sabrosa y un entorno pareado de comidas en ratas tratadas con solución salina y naltrexona
o Brain Res., 805 (1998), pp. 169 – 180
o
139.
o Peciña y Berridge, 2005
o S. Peciña, KC Berridge
o Punto caliente hedónico en la cáscara del núcleo accumbens: ¿dónde causan los opioides mu el aumento del impacto hedónico de la dulzura?
o J. Neurosci., 25 (2005), pp. 11777 – 11786
o
140.
o Peciña et al., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o El factor de liberación de corticotropina de Nucleus accumbens aumenta la motivación desencadenada por el estímulo de la sacarosa: ¿Efectos de incentivo positivos paradójicos en el estrés?
o BMC Biol., 4 (2006), pág. 8
o
141.
o Peciña et al., 2006b
o S. Peciña, KS Smith, KC Berridge
o puntos calientes hedónicos en el cerebro
o Neurocientífico, 12 (2006), pp. 500 – 511
o
142.
o Pecoraro et al., 2004
o N. Pecoraro, F. Reyes, F. Gómez, A. Bhargava, MF Dallman
o El estrés crónico promueve la alimentación sabrosa, lo que reduce los signos de estrés: efectos de retroalimentación y retroalimentación del estrés crónico
o Endocrinología, 145 (2004), pp. 3754 – 3762
o
143.
o Pelchat et al., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Imágenes del deseo: Activación de ansias de comida durante la IRMf
o Neuroimagen, 23 (2004), pp. 1486 – 1493
o
144.
o Pelleymounter et al., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Efectos del producto génico obeso en la regulación del peso corporal en ratones ob / ob
o Ciencia, 269 (1995), pp. 540 – 543
o
145.
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Búsqueda compulsiva de drogas por parte de ratas bajo castigo: efectos de la historia de consumo de drogas
o Psicofarmacología (Berl.), 194 (2007), pp. 127 – 137
o
146.
o Perello et al., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Ghrelin aumenta el valor gratificante de la dieta alta en grasas de una manera dependiente de la orexina
o Biol. Psiquiatría, 67 (2010), pp. 880 – 886
o
147.
o Petrovich et al., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holland, M. Gallagher
o La amígdala central, pero no basolateral, es crítica para el control de la alimentación mediante señales aprendidas aversivas
o J. Neurosci., 29 (2009), pp. 15205 – 15212
o
148.
o Pfaffly et al., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o La leptina aumenta la unión del receptor D2 de la dopamina estriatal en ratones obesos (ob / ob) deficientes en leptina
o Sinapsis, 64 (2010), pp. 503 – 510
o
149.
o Puhl et al., 2008
o RM Puhl, CA Musgo-Racusin, MB Schwartz, KD Brownell
o Estigmatización del peso y reducción del sesgo: perspectivas de adultos con sobrepeso y obesos
o Salud Educ. Res., 23 (2008), pp. 347 – 358
o
150.
o Rada et al., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Dopamina Accumbens reducida en ratas Sprague-Dawley propensas a comer en exceso una dieta rica en grasas
o fisiol. Behav., 101 (2010), pp. 394 – 400
o
151.
o Ritchie y Noble, 2003
o T. Ritchie, EP Noble
o Asociación de siete polimorfismos del gen del receptor de dopamina D2 con características de unión del receptor cerebral
o Neurochem. Res., 28 (2003), pp. 73 – 82
o
152.
o Roberto et al., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o La liberación del ácido gamma-aminobutírico de la amígdala inducida por el factor liberador de corticotropina juega un papel clave en la dependencia del alcohol
o Biol. Psiquiatría, 67 (2010), pp. 831 – 839
o
153.
o Roitman et al., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o La dopamina funciona como un modulador subsecundario de la búsqueda de alimentos.
o J. Neurosci., 24 (2004), pp. 1265 – 1271
o
154.
o Roitman et al., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Las respuestas químicas en tiempo real en el núcleo accumbens diferencian estímulos gratificantes y aversivos
o nat. Neurosci., 11 (2008), pp. 1376 – 1377
o
155.
o Rollos, 2008
o ET Rolls
o Funciones de la corteza cingulada orbitofrontal y pregenual en sabor, olfato, apetito y emoción.
o Acta Physiol. Hung., 95 (2008), pp. 131 – 164
o
156.
o Rollos, 2010
o ET Rolls
o El sabor, el olfato y la textura de los alimentos recompensan el procesamiento en el cerebro y la obesidad.
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 en prensa. Publicado en línea agosto 3, 2010
o
157.
o Rolls et al., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Saciedad sensorial y motivación específica para la vista y el sabor de los alimentos y el agua en el hombre.
o fisiol. Behav., 30 (1983), pp. 185 – 192
o
158.
o Roseberry et al., 2007
o AG Roseberry, T. Pintor, GP Mark, JT Williams
o Disminución de las reservas vesiculares somatodendríticas de dopamina en ratones deficientes en leptina
o J. Neurosci., 27 (2007), pp. 7021 – 7027
o
159.
o Rothemund et al., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Activación diferencial del cuerpo estriado dorsal por estímulos visuales de alimentos con alto contenido calórico en individuos obesos
o Neuroimagen, 37 (2007), pp. 410 – 421
o
160.
o Salas et al., 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
o Respuestas NEGRAS a errores de predicción de recompensa negativa en habenula humana
o frente Tararear. Neurosci., 4 (2010), p. 36
o
161.
o Saper et al., 2002
o CB Saper, TC Chou, JK Elmquist
o La necesidad de alimentar: control homeostático y hedónico de la alimentación.
o Neuron, 36 (2002), pp. 199 – 211
o
162.
o Saunders, 2001
o R. Saunders
o Comidas compulsivas y cirugía de bypass gástrico: ¿qué tiene que ver el hambre con eso?
o Obes. Surg., 11 (2001), pp. 757 – 761
o
163.
o Scarpace et al., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o La marcha de la rueda elimina la preferencia de alto contenido de grasa y mejora la señalización de leptina en el área ventral tegmental
o fisiol. Behav., 100 (2010), pp. 173 – 179
o
164.
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Las señales asociadas a los alimentos alteran la conectividad funcional del cerebro anterior según se evalúa con la expresión inmediata de gen y proenkephalin temprana
o BMC Biol., 5 (2007), pág. 16
o
165.
o Schur et al., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o La activación en la regulación de la energía cerebral y los centros de recompensa según las indicaciones de los alimentos varía con la elección del estímulo visual
o Int. J. Obes. (Lond.), 33 (2009), pp. 653 – 661
o
166.
o Sclafani et al., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Farmacología de las preferencias condicionadas por los alimentos.
o Appetite, 31 (1998), pág. 406
o
167.
o Sescousse et al., 2010
o G. Sescousse, J. Redouté, JC Dreher
o La arquitectura de codificación de valor de recompensa en la corteza orbitofrontal humana
o J. Neurosci., 30 (2010), pp. 13095 – 13104
o
168.
o Shomaker et al., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali y otros.
o Comer en ausencia de hambre en adolescentes: ingesta después de una comida de gran tamaño en comparación con una comida estandarizada
o soy. J. Clin. Nutr., 92 (2010), pp. 697 – 703
o
169.
o Simmons et al., 2005
o WK Simmons, A. Martin, LW Barsalou
o Las imágenes de los alimentos apetitosos activan las cortezas gustativas para el sabor y la recompensa.
o Cereb. Cortex, 15 (2005), pp. 1602 – 1608
o
170.
o Pequeño, 2010
o DM Small
o Representación del gusto en la ínsula humana.
o Struct cerebro. Funct., 214 (2010), pp. 551 – 561
o
171.
o Small et al., 2003
o DM Small, M. Jones-Gotman, A. Dagher
o La liberación de dopamina inducida por la alimentación en el estriado dorsal se correlaciona con las calificaciones de amabilidad de las comidas en voluntarios humanos sanos
o Neuroimagen, 19 (2003), pp. 1709 – 1715
o
172.
o Smith y Berridge, 2007
o KS Smith, KC Berridge
o Circuito límbico opioide para recompensa: interacción entre puntos calientes hedónicos del núcleo accumbens y el pálido ventral
o J. Neurosci., 27 (2007), pp. 1594 – 1605
o
173.
o Söderpalm y Berridge, 2000
o AH Söderpalm, KC Berridge
o Ingesta de alimentos después de diazepam, morfina o muscimol: microinyecciones en la cáscara del núcleo accumbens.
o Pharmacol. Biochem. Behav., 66 (2000), pp. 429 – 434
o
174.
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o La relación entre la obesidad y la respuesta estriatal a los alimentos es moderada por el alelo TaqIA A1
o Ciencia, 322 (2008), pp. 449 – 452
o
175.
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Relación de la recompensa de la ingesta de alimentos y la ingesta de alimentos prevista para la obesidad: un estudio funcional de imágenes de resonancia magnética
o J. Abnorm. Psychol., 117 (2008), pp. 924 – 935
o
176.
o Stice et al., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o El aumento de peso se asocia con una respuesta estriatal reducida a los alimentos sabrosos
o J. Neurosci., 30 (2010), pp. 13105 – 13109
o
177.
o Stice et al., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o La capacidad de respuesta del circuito de recompensa a los alimentos predice aumentos futuros en la masa corporal: efectos moderadores de DRD2 y DRD4
o Neuroimagen, 50 (2010), pp. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). El Principio de la Obesidad Goldilocks. Científico americano. Junio 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford y Kelley, 1997
o TR Stratford, AE Kelley
o GABA en el núcleo accumbens shell participa en la regulación central del comportamiento de alimentación
o J. Neurosci., 17 (1997), pp. 4434 – 4440
o
180.
o Stratford y Kelley, 1999
o TR Stratford, AE Kelley
o Evidencia de una relación funcional entre la cáscara del núcleo accumbens y el hipotálamo lateral que sirve para controlar el comportamiento de alimentación.
o J. Neurosci., 19 (1999), pp. 11040 – 11048
o
181.
o Suarez y Gallup, 1981
o SD Suarez, GGJ Gallup
o Un análisis etológico del comportamiento en campo abierto en ratas y ratones.
o Aprender. Motiv., 12 (1981), pp. 342 – 363
o
182.
o Sunday et al., 1983
o SR Sunday, SA Sanders, G. Collier
o Palatabilidad y patrones de comida.
o fisiol. Behav., 30 (1983), pp. 915 – 918
o
183.
o Swinburn et al., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o El aumento del suministro de energía alimentaria es más que suficiente para explicar la epidemia de obesidad en los EE. UU.
o soy. J. Clin. Nutr., 90 (2009), pp. 1453 – 1456
o
184.
o Taha y Campos, 2005
o SA Taha, HL Fields
o Codificación de los comportamientos apetitosos y de apetito por distintas poblaciones neuronales en el núcleo accumbens
o J. Neurosci., 25 (2005), pp. 1193 – 1202
o
185.
o Taha et al., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o Los circuitos convergentes, no en serie, estriados y palidas regulan la ingesta de alimentos inducida por opioides
o Neurociencia, 161 (2009), pp. 718 – 733
o
186.
o Teegarden y Bale, 2007
o SL Teegarden, TL Bale
o La disminución de la preferencia en la dieta produce mayor emocionalidad y riesgo de recaída en la dieta
o Biol. Psiquiatría, 61 (2007), pp. 1021 – 1029
o
187.
o Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o La exposición temprana a una dieta alta en grasas promueve cambios a largo plazo en las preferencias dietéticas y la señalización de recompensa central
o Neurociencia, 162 (2009), pp. 924 – 932
o
188.
o Thanos et al., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o La restricción de alimentos aumenta notablemente el receptor D2 de dopamina (D2R) en un modelo de obesidad en ratas según se evalúa con imágenes de muPET in vivo ([11C] raclopride) e in vitro ([3H] spiperone)
o Sinapsis, 62 (2008), pp. 50 – 61
o
189.
o Thompson y Swanson, 2010
o RH Thompson, LW Swanson
o El análisis de conectividad estructural basado en hipótesis es compatible con la red sobre un modelo jerárquico de arquitectura cerebral
o Proc. Natl Acad Sci. EE.UU., 107 (2010), pp. 15235 – 15239
o
190.
o Vanderschuren y Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o La búsqueda de drogas se vuelve compulsiva después de la autoadministración prolongada de cocaína
o Ciencia, 305 (2004), pp. 1017 – 1019
o
191.
o Vendruscolo et al., 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o El consumo excesivo de azúcar durante la adolescencia altera selectivamente la función de motivación y recompensa en ratas adultas
o PLoS ONE, 5 (2010), pág. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo et al., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Consumo reducido de alcohol en ratas adultas expuestas a sacarosa durante la adolescencia
o Neurofarmacología, 59 (2010), pp. 388 – 394
o
193.
o Volkow y O'Brien, 2007
o ND Volkow, CP O'Brien
o Problemas para el DSM-V: ¿Debería incluirse la obesidad como un trastorno cerebral?
o soy. J. Psychiatry, 164 (2007), pp. 708 – 710
o
194.
o Volkow y Wise, 2005
o ND Volkow, RA Wise
o ¿Cómo puede la adicción a las drogas ayudarnos a entender la obesidad?
o nat. Neurosci., 8 (2005), pp. 555 – 560
o
195.
o Volkow et al., 2009
o ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Asociación inversa entre el IMC y la actividad metabólica prefrontal en adultos sanos
o Obesidad (Silver Spring), 17 (2009), pp. 60 – 65
o
196.
o Vucetic y Reyes, 2010
o Z. Vucetic, TM Reyes
o Circuito dopaminérgico central que controla la ingesta y recompensa de alimentos: implicaciones para la regulación de la obesidad
o Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), pp. 577 – 593
o
197.
o Wang et al., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Dopamina cerebral y obesidad.
o Lancet, 357 (2001), pp. 354 – 357
o
198.
o Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o El papel de la dopamina en la motivación de los alimentos en humanos: implicaciones para la obesidad
o Opinión de los expertos. El r. Objetivos, 6 (2002), pp. 601 – 609
o
199.
o Wang et al., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o La exposición a estímulos alimenticios apetitivos activa notablemente el cerebro humano
o Neuroimagen, 21 (2004), pp. 1790 – 1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Similitud entre la obesidad y la adicción a las drogas según lo evaluado por imágenes neurofuncionales: una revisión de concepto
o J. Addict. Dis., 23 (2004), pp. 39 – 53
o
201.
o Wang et al., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o La distensión gástrica activa los circuitos de saciedad en el cerebro humano
o Neuroimagen, 39 (2008), pp. 1824 – 1831
o
202.
o Wassum et al., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Distintos circuitos opioides determinan la palatabilidad y la conveniencia de eventos gratificantes
o Proc. Natl Acad Sci. EE.UU., 106 (2009), pp. 12512 – 12517
o
203.
o Wassum et al., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
La activación del receptor de opioides μ en la amígdala basolateral media el aprendizaje de aumentos, pero no disminuye el valor de incentivo de una recompensa de alimentos
o J. Neurosci., 31 (2011), pp. 1591 – 1599
o
204.
o Wilkinson y Peele, 1962
o HA Wilkinson, TL Peele
o Modificación de la autoestimulación intracraneal por saciedad del hambre.
o soy. J. Physiol., 203 (1962), pp. 537 – 540
o
205.
o Will et al., 2003
o MJ Will, EB Franzblau, AE Kelley
o Los opioides mu de Nucleus accumbens regulan la ingesta de una dieta alta en grasas mediante la activación de una red cerebral distribuida
o J. Neurosci., 23 (2003), pp. 2882 – 2888
o
206.
o Wilson et al., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Cuantificación de la ingesta de alimentos en monos socialmente alojados: efectos del estatus social en el consumo de calorías
o fisiol. Behav., 94 (2008), pp. 586 – 594
o Artículo | PDF (553 K) |
Ver registro en Scopus
| Citado por en Scopus (22)
207.
o Yurcisin et al., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Obesidad y cirugía bariátrica.
o clin. Med. De pecho, 30 (2009), pp. 539 – 553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
o La ingesta de alimentos ricos en grasa se mejora de forma selectiva por la estimulación del receptor opioide mu dentro del núcleo accumbens
o J. Pharmacol. Exp. Ther., 285 (1998), pp. 908 – 914
o Ver registro en Scopus
| Citado por en Scopus (148)
209.
o Zheng et al., 2007
o H. Zheng, LM Patterson, HR Berthoud
o La señalización de orexina en el área tegmental ventral es necesaria para el apetito alto en grasa inducido por la estimulación con opioides del núcleo accumbens
o J. Neurosci., 27 (2007), pp. 11075 – 11082
o Ver registro en Scopus
| Citado por en Scopus (64)
210.
o Zheng et al., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Control del apetito y regulación del balance energético en el mundo moderno: el cerebro impulsado por la recompensa anula las señales de repleción
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pp. S8 – S13
o Ver registro en Scopus
| Citado por en Scopus (34)