Informes científicos volumen 9, Número de artículo: 16918 (2019)
Resumen
El consumo excesivo de sacarosa provoca antojos de adicción que pueden apuntalar la epidemia de obesidad. Los opioides y la dopamina median los efectos gratificantes de las drogas de abuso y de las recompensas naturales de los estímulos como la comida sabrosa. Investigamos los efectos de la sacarosa usando imágenes PET con [11C] carfentanilo (agonista del receptor opioide μ) y [11C] racloprida (antagonista del receptor de dopamina D2 / 3) en siete minipigs de Gotinga anestesiados. Luego le dimos acceso a minipigs a la solución de sacarosa durante una hora en 12 días consecutivos y realizamos imágenes nuevamente 24 horas después del acceso final a la sacarosa. En una muestra más pequeña de cinco minipigs, realizamos un [11C] sesión de PET con carfentanilo después de la primera exposición a sacarosa. Calculamos los potenciales de unión vóxel-sabio (BPND) utilizando el cerebelo como una región de unión no desplazable, analizó las diferencias con el mapeo estadístico no paramétrico y realizó un análisis regional. Después de 12 días de acceso a sacarosa, BPND de ambos trazadores había disminuido significativamente en el cuerpo estriado, el núcleo accumbens, el tálamo, la amígdala, la corteza cingulada y la corteza prefrontal, lo que concuerda con la baja regulación de las densidades de los receptores. Después de una sola exposición a sacarosa, encontramos una disminución de la unión de [11C] carfentanilo en el núcleo accumbens y la corteza cingulada, consistente con la liberación de opioides. La menor disponibilidad de receptores de opioides y dopamina puede explicar el potencial adictivo asociado con la ingesta de sacarosa.
Introducción
El cinco por ciento de la población mundial es clínicamente obeso1. Como sello distintivo del síndrome metabólico, la obesidad se asocia con diabetes tipo 2, enfermedad cardiovascular, problemas respiratorios y riesgo de depresión y posiblemente demencia.2. El aumento del consumo de alimentos densos en energía ha exagerado la distinción fisiológica entre el hambre homeostática que sigue a la privación de alimentos y el hambre hedónica, o "antojo", que ocurre en ausencia de privación.3,4. Como la regulación homeostática por sí sola no puede explicar el aumento actual de la obesidad, es obligatorio probar el efecto sobre los mecanismos cerebrales de recompensa y placer de las propiedades adictivas de los alimentos altamente sabrosos.
El consumo de sacarosa está asociado con la obesidad, y la sacarosa se considera cada vez más una sustancia adictiva.5. Algunos hallazgos están en desacuerdo con esta afirmación debido a las dificultades para separar el consumo de alimentos no apetecibles de las respuestas de alimentos hedónicos, y para determinar el ingrediente adictivo en los alimentos procesados, así como los diferentes mecanismos por los cuales los alimentos alteran los circuitos cerebrales a través de las vías naturales.6. Sin embargo, en contextos específicos, la ingesta de sacarosa induce recompensa y ansia, comparable en magnitud a las inducidas por drogas adictivas, que conducen al consumo excesivo y la obesidad eventual6,7.
El hambre se asocia con “querer” que está estrechamente relacionado con los efectos de la neurotransmisión dopaminérgica en varias circunstancias de recompensa.8, pero no está claro cómo se modula la acción de la dopamina (DA) en respuesta a la alimentación compulsiva. El consumo de alimentos sabrosos está relacionado con el "gusto", mediado principalmente por el sistema opioide endógeno, especialmente el receptor de opioides μ (μOR)9,10, que puede promover el consumo excesivo cuando se desregula. En el presente informe, probamos la afirmación de que la sacarosa conduce a la liberación de opioides y dopamina que disminuye la disponibilidad de los receptores μOR y DA D2 / 3. La disponibilidad es un índice del número de receptores desocupados disponibles para la unión del marcador y, en principio, no distingue entre la ocupación del ligando y la densidad del receptor11.
El inicio de la alimentación compulsiva depende de múltiples factores, y los estudios causales en humanos plantean problemas éticos. Por lo tanto, la mayoría de los estudios se centran en el comportamiento de alimentación en ratas.12. Aunque las ratas son “golosas”, sus mecanismos homeostáticos importantes para el aumento de peso, el metabolismo y el tipo de acumulación de grasa difieren significativamente de los de los humanos. El minipig de Göttingen es un gran animal omnívoro con un cerebro gyrencephalic bien desarrollado, que se puede obtener imágenes con una resolución suficiente. Sus regiones corticales subcorticales y prefrontales bien definidas13 permitir una traducción más directa a la función del cerebro humano. Aquí, utilizamos imágenes de tomografía por emisión de positrones (PET) para probar in vivo Disponibilidad de μOR y DA D2 / 3 en un modelo de minipig de exposición subcrónica a sacarosa. En una muestra más pequeña, investigamos los efectos inmediatos sobre la ocupación de μOR después de la primera exposición a sacarosa. Finalmente, probamos la relación entre los cambios en la disponibilidad del receptor de los dos trazadores.
Resultados
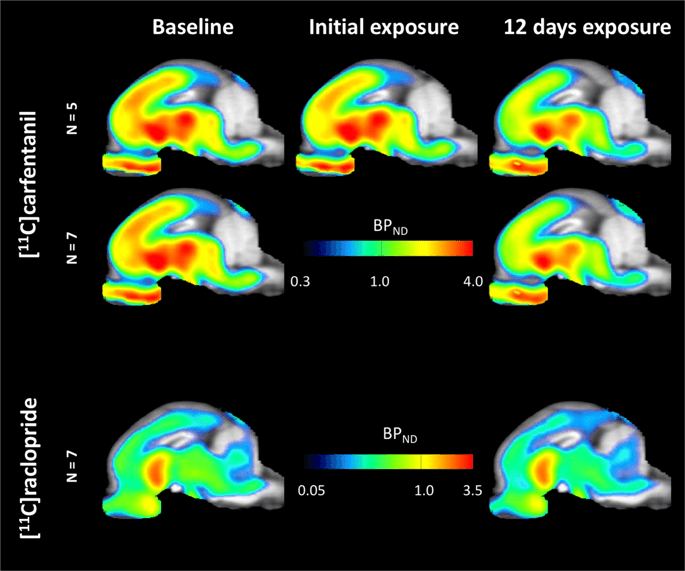
Mapas paramétricos promedio de [11C] carfentanilo y [11C] potencial de unión a racloprida (BPND) se muestran en la Fig. 1. Analizar los cambios que ocurren después de la primera exposición a sacarosa en cinco minipigs en comparación con la línea de base, y un día después de las 12th acceso a sacarosa en siete minipigs en comparación con la línea de base, utilizamos la teoría de permutación y el análisis de cerebro completo restringido no regionalmente, el método preferido para muestras de este tamaño14.
Promedio de potencial de unión no desplazable en voxel (BP)ND) mapas superpuestos en imágenes de resonancia magnética en vista sagital. Los datos se presentan para [11C] carfentanilo BPND de los 5 minipigs fotografiados al inicio del estudio, después de la exposición inicial a sacarosa y después de 12 días de exposición a sacarosa (fila superior). [11C] carfentanilo BPND de los 7 minipigs fotografiados al inicio del estudio y después de 12 días de acceso a sacarosa se presentan en la fila central. [11C] racloprida BPND de los 7 minipigs fotografiados al inicio del estudio y después de 12 días de acceso a sacarosa se muestran en la fila inferior. Tenga en cuenta que la escala de colores es exponencial para resaltar el [11C] racloprida BPND en regiones extraestriatales.
Exposición inicial a sacarosa
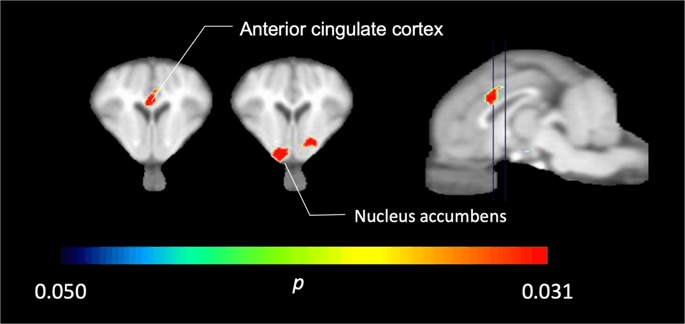
En los cinco minipigs fotografiados con [11C] carfentanilo al inicio del estudio e inmediatamente después de la primera exposición a sacarosa, encontramos una unión del marcador significativamente reducida en la corteza cingulada anterior y el núcleo accumbens en respuesta a la sacarosa, que se muestra en color en la Fig. 2, lo que indica p <0.05. Detectamos hasta un 14% de disminución de la unión del trazador en ambas áreas en comparación con la línea de base.
Disminuciones significativas en [11C] carfentanilo BPND después de la primera exposición al agua de sacarosa en comparación con la línea de base (n = 5). Solo vóxeles con significativa (p <0.05) las disminuciones se muestran como áreas coloreadas proyectadas en cortes de resonancia magnética ponderados en T1 al nivel de la corteza cingulada anterior (izquierda) y el núcleo accumbens (centro) de un atlas estereotáxico de cerebro minipig. Tenga en cuenta que el nivel de significancia máximo que se puede lograr con 5 animales es 2-5 ≈ 0.031 (ver barra de colores). Los datos se presentan en secciones coronales del cerebro del cerdo en los niveles indicados en la imagen sagital (derecha).
12 días de acceso a sacarosa
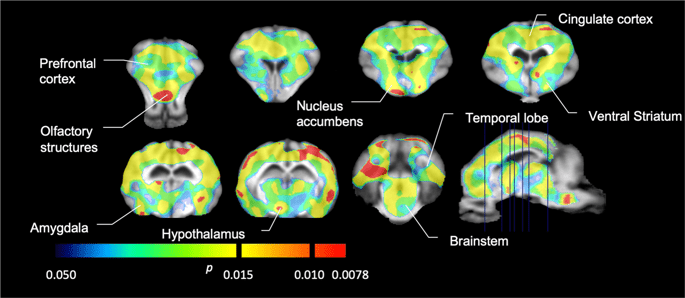
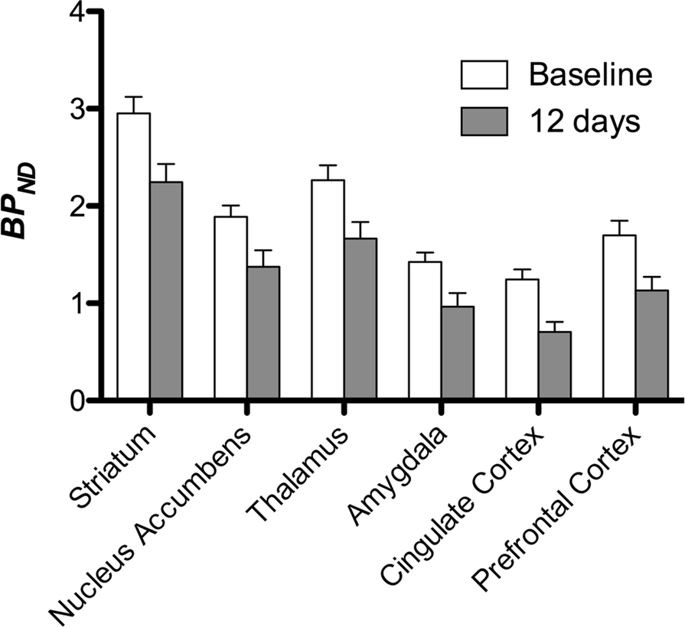
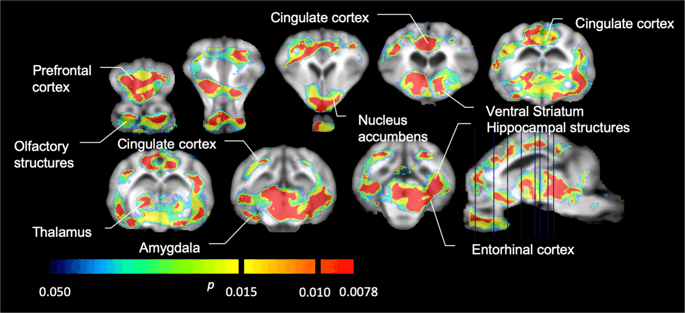
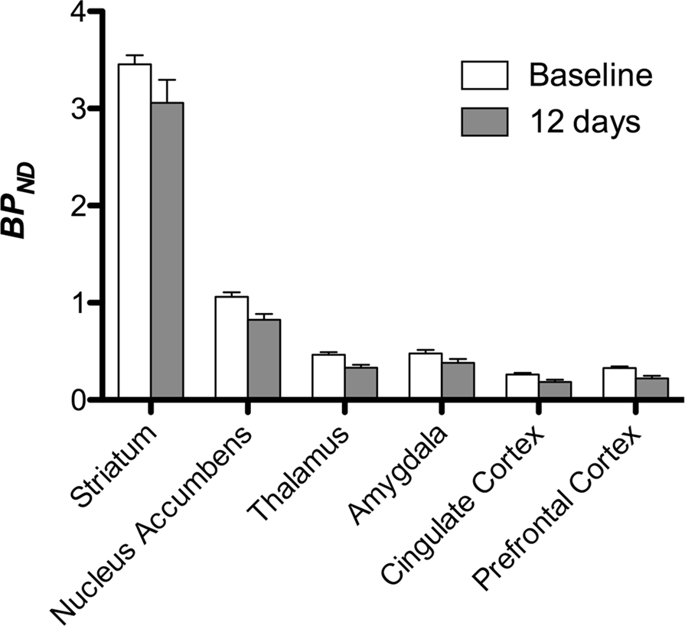
Luego realizamos el análisis de siete minipigs fotografiados con [11C] carfentanilo al inicio del estudio y después de 12 días de acceso a sacarosa y encontró una unión del marcador significativamente reducida en animales expuestos a sacarosa en comparación con el inicio. Las regiones más significativamente afectadas se muestran en rojo en la Fig. 3 (p <0.01) e incluyen partes de las estructuras olfativas, núcleo accumbens / estriado ventral y la corteza / lóbulo temporal, seguidas de áreas que se muestran en amarillo (p <0.015) que incluyen partes de la corteza prefrontal, corteza cingulada, amígdala y tronco encefálico . Para obtener BPND valores y evaluar el porcentaje de cambio, realizamos análisis regionales y obtuvimos valores medios en cada región al inicio y después del consumo de sacarosa (Fig. 4).
Disminuciones significativas en [11C] potencial de unión a carfentanilo (BPND) entre la línea de base y después de 12 días de exposición al agua de sacarosa (n = 7). Los vóxeles con significativa (p <0.05) las disminuciones se muestran como áreas coloreadas proyectadas en cortes de resonancia magnética ponderados en T1 de un atlas de cerebro estereotáxico de minipig. Los datos se presentan en secciones cerebrales coronales en los niveles indicados en la imagen sagital (abajo a la derecha). Tenga en cuenta que el nivel de significancia máximo alcanzable con 7 animales es 2-7 ≈ 0.0078 (ver barra de colores).
Nosotros usamos [11C] racloprida como el marcador de receptores DA D2 / 3 en regiones del cerebro estriatal y extraestriatal en minipigs al inicio del estudio y después de 12 días de acceso a sacarosa (Fig. 1). Encontramos una disminución de la unión del trazador en animales expuestos a sacarosa, en comparación con la línea de base con mayores efectos (p <0.01) en áreas de la corteza prefrontal, núcleo accumbens / estriado ventral, corteza cingulada, amígdala, tálamo, mesencéfalo, regiones del hipocampo y áreas olfativas. (Higo. 5) Los datos del análisis regional se presentan en la Fig. 6.
Disminuciones significativas en [11C] potencial de unión a racloprida (BPND) entre la línea de base y después de 12 días de exposición al agua de sacarosa (n = 7). Los vóxeles con significativa (p <0.05) las disminuciones se muestran como áreas coloreadas proyectadas en cortes de resonancia magnética ponderados en T1 de un atlas de cerebro de minipig estereotáxico. Los datos se presentan en secciones coronales del cerebro de cerdo en los niveles indicados en la imagen sagital (abajo a la derecha). Tenga en cuenta que el nivel de significancia máximo alcanzable con 7 animales es 2-7 ≈ 0.0078 (ver barra de colores).
Correlaciones entre [11C] raclopride y [11C] datos de carfentanilo
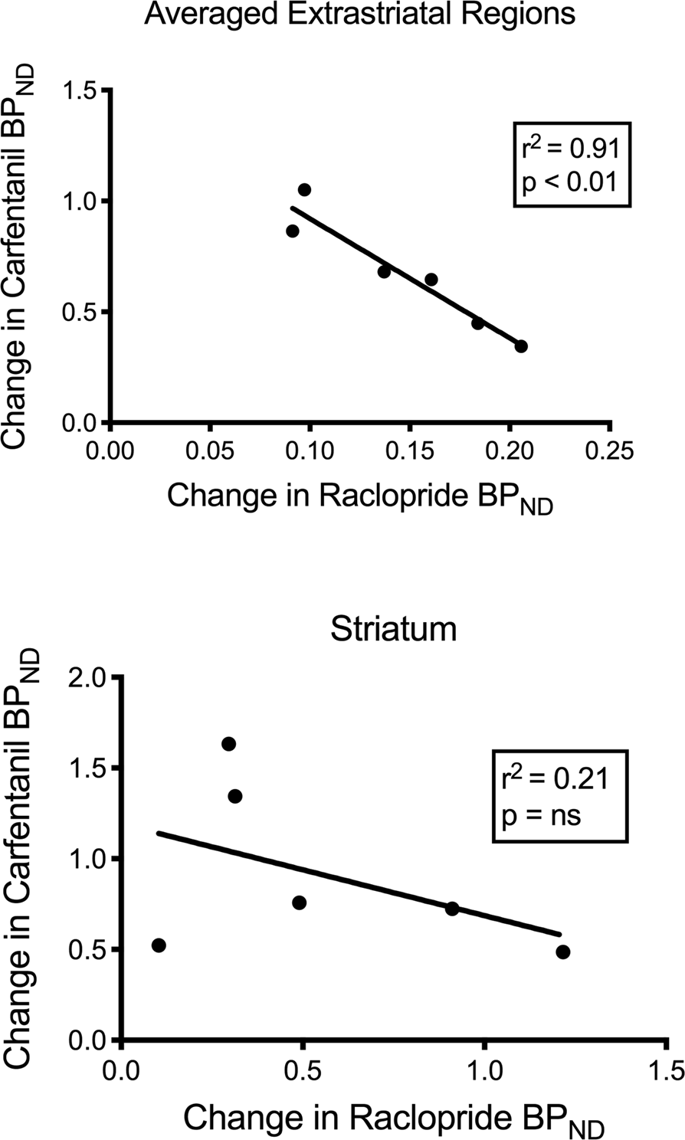
Probamos la posible correlación entre [11C] raclopride y [11C] valores de carfentanilo de BPND en regiones estriatales y no estriatales en minipigs al inicio del estudio y después de 12 días de consumo de sacarosa, sin asociaciones observadas. Luego probamos si las disminuciones de la unión del marcador estaban correlacionadas y comparamos los cambios de la PA.ND para [11C] racloprida con los cambios de BPND para [11C] carfentanilo solo en las minipigs que tenían una PA más bajaND de ambos trazadores después de la ingesta de sacarosa (n = 6). Encontramos correlaciones negativas significativas en el promedio extraestriatal (r2 = 0.91, p <0.01), pero no en las regiones estriatales (Fig. 7).
Correlaciones entre las disminuciones previas y posteriores de [11C] raclopride y [11C] potenciales de unión a carfentanilo (BPND) en minipigs con disminución de la unión del marcador después de la ingesta de sacarosa (n = 6). Se presentan datos de las regiones extraestriatales promedio (arriba) y el cuerpo estriado (abajo). El coeficiente de determinación (r2) y los valores de p se muestran para cada gráfico.
Discusión
Determinamos los efectos del acceso intermitente repetido a sacarosa en la neurotransmisión de opioides y DA en el cerebro de los mamíferos. Longitudinal in vivo Las imágenes PET de los receptores μOR y DA D2 / 3 revelaron una disponibilidad reducida del receptor en todo el circuito de recompensa, incluidos el núcleo accumbens, la corteza prefrontal y la corteza cingulada anterior. Los resultados demuestran claramente que la sacarosa afecta los mecanismos de recompensa de manera similar a la de las drogas de abuso.
Se sabe que la ingesta de sacarosa como sustancia sabrosa libera DA e induce dependencia en roedores15, con sacarosa demostrado ser aún más placentero que la cocaína en roedores en ciertos contextos. Por lo tanto, los roedores trabajan más intensamente para obtener sacarosa que la cocaína, incluso en ausencia de privación de alimentos.5. Sin embargo, los efectos de la sacarosa están regulados tanto por el sistema homeostático como por los circuitos de recompensa hedónica.16,17 que puede mediar la distinción entre los aspectos nutricionales y hedónicos de la acción de sacarosa18. Optamos por un horario de una hora por día para promover el "atracón", ya que estudios previos en ratas habían revelado una mayor ingesta durante la primera hora de acceso diario en un horario intermitente15,19. Los estudios de comportamiento de la ingesta de alimentos a menudo se dirigen a animales con restricción de alimentos, pero el diseño puede no reflejar necesariamente los mismos mecanismos neuronales activos en la obesidad. Los cerdos en el presente estudio no tenían restricción de alimentos y se les alimentó con las cantidades habituales de su dieta normal además del acceso a sacarosa.
Los receptores opioides (OR) se expresan ampliamente en el cerebro, específicamente en estructuras conocidas por modular los procesos de alimentación y recompensa.20. Se ha demostrado que las RUP son importantes en los efectos gratificantes y recurrentes de la cocaína.21,22,23,24. Las alteraciones en la unión también se han relacionado con las respuestas homeostáticas a la comida y al placer asociado con la comida sabrosa.25. En particular, el "gusto" de los alimentos está relacionado con el sistema opioide endógeno, especialmente el μOR9,10 en el caparazón del núcleo accumbens y el pálido ventral26. Las infusiones de un agonista μOR en distintas partes del núcleo accumbens y el pálido ventral mejoran en gran medida los comportamientos de "gusto", incluidas las protuberancias de la lengua y lamer las patas, después del aumento de la ingesta sabrosa de alimentos.27,28,29. La evidencia adicional para la señalización de opioides en el procesamiento de la regulación hedónica proviene de antagonistas μOR que atenúan el consumo de comida sabrosa en ambos ad libitum-alimentos y alimentos restringidos, pero con un efecto más limitado en la ingesta de pellets estándar no apetecibles30,31. En humanos, los antagonistas μOR disminuyen la ingesta de alimentos a corto plazo y reducen el placer de los alimentos sabrosos.32,33,34. La señalización de opioides en la amígdala basolateral también contribuye a la falta de alimentos mediante la modulación de la búsqueda de recompensas y el valor de incentivo de los alimentos35.
Con [11C] carfentanilo, obtuvimos imágenes de la unión del marcador que es sensible tanto a los niveles de μOR como a la liberación de opioides endógenos en el cerebro36,37. Detectamos la pérdida inmediata de la disponibilidad de μOR en áreas del núcleo accumbens y la corteza cingulada anterior, regiones cerebrales específicas de la vía de recompensa, después del consumo inicial de sacarosa por cinco minipigs, lo que es compatible con la liberación endógena de opioides. Estudios anteriores han demostrado que la comida sabrosa puede provocar sensaciones de placer.38 estimulando la liberación de opioides. Después de 12 días de acceso a sacarosa, observamos una disminución [11C] unión de carfentanilo, que tiene varias explicaciones posibles39 incluyendo la liberación endógena de opioides y la unión a μOR, la internalización de μOR como resultado de una mayor unión de opioides y una mayor activación del receptor DA D2 / 3 que conduce a la desensibilización heteróloga de μOR40.
En apoyo de los hallazgos actuales, [11C] estudios de carfentanilo en pacientes con bulimia41, obesidad42,43,44y trastorno por atracón45, muestran una disminución de la disponibilidad del receptor. Sin embargo, estas son condiciones crónicas, mientras que los minipigs solo recibieron sacarosa durante 12 días. En un estudio sobre el comportamiento de alimentación aguda en hombres sanos, la alimentación condujo a una liberación endógena de opioides cerebrales robusta y generalizada, tanto en presencia como en ausencia de hedonia, lo que sugiere que la liberación de opioides refleja respuestas metabólicas y homeostáticas, así como hedónicas.25. Este estudio, junto con otro que tomó imágenes de pacientes después de una comida líquida con sabor a chocolate44, es directamente relevante para el estudio agudo de cinco minipigs después de la primera exposición a sacarosa, pero es diferente del estudio subcrónico de exposición a sacarosa durante 12 días, donde la disponibilidad reducida del receptor probablemente refleje una sobreestimulación repetida y una regulación descendente concomitante de μOR.
La corteza prefrontal es importante en la toma de decisiones y la atribución de valor a los elementos y, por lo tanto, el μOR en la corteza prefrontal puede ser responsable de la evaluación alterada de la prominencia de los alimentos, lo que puede aumentar el potencial adictivo de los alimentos. Hemos encontrado una disminución de la unión en la corteza prefrontal, de acuerdo con estudios anteriores que muestran que una dieta rica en grasas reduce los niveles de ARNm μOR en la corteza prefrontal46 y que la infusión de un agonista μOR en la corteza prefrontal aumenta la ingesta de alimentos dulces47. Sin embargo, una vez más, surge el problema de si la dieta alta en grasas es una afección más crónica que probablemente medie la disminución de la regulación del receptor, en comparación con el diseño de alimentación con sacarosa a corto plazo, lo que sugiere la liberación sostenida de opioides endógenos que desplazan el carfentanilo marcador unido a μOR , incluso después de 12 días de sacarosa.
DA ha sido implicado en recompensas tanto de drogas como de comportamiento. Se ha encontrado que el consumo crónico de cocaína inhibe la señalización de DA48. Los niveles de receptores DA D1 y D2 / 3 están alterados por la nicotina en el cerebro de cerdo49, y en primates no humanos con antecedentes de abuso de cocaína50, consistente con la regulación negativa de los receptores D2 / 3 en el cerebro de los adictos a la cocaína humana51,52. En cuanto a las drogas de abuso, se ha demostrado que la sacarosa regula al alza los receptores DA D119 y aumentar la liberación de DA53, reforzando el papel de DA en "querer" en relación con la comida sabrosa. Estudios previos de PET han demostrado una disminución en la disponibilidad del receptor DA D2 / 3 estriatal en obesidad mórbida versus peso promedio54,55, similar en magnitud a la reducción en pacientes drogadictos56y en animales con modelos de obesidad57. En estudios con roedores, la caída del receptor D2 / 3 en el cuerpo estriado promueve el desarrollo de la búsqueda compulsiva de alimentos en ratas con acceso a alimentos sabrosos57.
Nuestras observaciones sobre la disminución de la disponibilidad del receptor D2 / 3 del cerdo pueden indicar un aumento de los niveles de DA en respuesta a la prominencia de incentivos asociada con la ingesta de sacarosa ya que se libera DA como parte de la falta de drogas de abuso y otras actividades placenteras52,58,59,60. Como los cerdos fueron anestesiados durante las imágenes y no habían recibido sacarosa en 24 horas, la disminución de D2 / 3 BPND Es más probable que refleje una reducción en el número de receptores en respuesta al aumento prolongado de la liberación de DA en cada uno de los 12 días de acceso a sacarosa. La reducción puede elevar los umbrales de recompensa cerebral, asociados con la baja regulación de los receptores estriados D2 de DA. Esto puede explicar el aumento de la susceptibilidad a las drogas de abuso visto en estudios previos de ratas que comían en exceso sacarosa que condujo a la sensibilización cruzada a la cocaína, hiperactividad después de dosis bajas de anfetamina, aumento de la ingesta de alcohol al abstenerse de sacarosa y tolerancia a los efectos analgésicos de los opiáceos.6.
Un estudio previo de obesidad en el minipig de Gotinga identificó disminución del flujo sanguíneo cerebral en el núcleo accumbens, área tegmental ventral (VTA) y corteza prefrontal, con tomografía computarizada de emisión de fotón único (SPECT)61. De acuerdo con estos hallazgos, observamos una reducción de la unión de DA D2 / 3 en la región ventroforebrain que contiene el núcleo accumbens y en la corteza prefrontal. Los niveles extracelulares de DA aumentan 3 veces en el núcleo accumbens después de la ingesta de sacarosa en ratas que se mueven libremente sometidas a microdiálisis62. En animales dependientes de sacarosa, la ingesta repetida de sacarosa puede conducir a la liberación de DA del caparazón del núcleo accumbens63. Los animales alimentados con una dieta restringida con acceso limitado a sacarosa tuvieron una menor unión del receptor DA D2 en la cubierta del núcleo accumbens y el cuerpo estriado dorsal64. Las dietas restringidas altas en grasas y sacarosa pueden conducir a una regulación negativa sostenida del ARNm del receptor D1 y D2 en el núcleo accumbens65. Un estudio de microdiálisis de los efectos de la comida sabrosa reveló una mayor liberación de DA en el núcleo accumbens y la corteza prefrontal cuando la comida todavía se consideraba nueva; Una vez que las ratas se acostumbraron a la nueva comida, la liberación aumentada se redujo en el núcleo accumbens, pero no en la corteza prefrontal66. La susceptibilidad diferencial a la habituación y el acondicionamiento de la actividad en dos regiones puede explicar el mayor aumento observado en la corteza prefrontal que en el núcleo accumbens de minipigs expuestos a la misma sustancia palatable que perdió la novedad después de doce días. Sin embargo, como no hicimos imágenes de minipigs con [11C] racloprida después de la primera administración de sacarosa, esta explicación es especulativa.
La corteza prefrontal modula la función ejecutiva, la toma de decisiones y el autocontrol.67. La neurotransmisión DA disfuncional en la corteza prefrontal perjudica la modulación del procesamiento de recompensas, lo que sugiere una función ejecutiva deteriorada y habilidades de toma de decisiones en individuos obesos68,69. Además, un estudio de PET humano correlacionó la disminución del metabolismo de la corteza frontal con la disminución de la unión del D2 estriatal en la obesidad70. Aquí, encontramos una disponibilidad reducida del receptor D2 / 3 en la corteza prefrontal, incluida la corteza orbitofrontal de los cerdos expuestos al régimen de sacarosa.
Las neuronas dopaminérgicas del VTA envían proyecciones al hipocampo y la amígdala, donde apoyan comportamientos similares a los hábitos.71 y mediar en la codificación y recuperación del condicionamiento a las drogas72,73 y señales de comida74,75. Las imágenes del cerebro humano han demostrado la activación del hipocampo en respuesta al antojo y la degustación de alimentos.76. De acuerdo con nuestros hallazgos de una reducción en la disponibilidad del receptor D2 / 3 de hipocampo y amígdala en respuesta a sacarosa, mapeo del cerebro humano con [18F] fallypride mostró liberación de DA inducida por señal de cocaína en amígdala e hipocampo77. En cerebros de roedores, la exposición a la señal de cocaína desencadenó la liberación de DA en la amígdala78, y las alteraciones de los niveles de amígdala DA influyeron en el comportamiento de búsqueda de cocaína inducido por señales79.
En un estudio de individuos obesos, la asociación entre las disponibilidades D2 / 3 y μOR, que se sabe que existe en las regiones estriatales de los individuos delgados, se vio interrumpida en el cuerpo estriado ventral.80. Comparamos los valores de BPND de los dos trazadores para probar si los datos reprodujeron este efecto. A diferencia de los humanos delgados, los cerebros actuales de los cerdos no tenían correlación entre los valores de BPND de los dos trazadores, al inicio del estudio o después de la exposición a sacarosa. Luego probamos si los animales con las mayores disminuciones de la unión del raclopride marcador también tendrían las mayores disminuciones de la unión del carfentanilo marcador, pero en su lugar encontramos una correlación negativa en las regiones extraestriatales promediadas, lo que sugiere que los animales con el mayor cambio del potencial de unión de el raclopride trazador tuvo el cambio más bajo del potencial de unión del carfentanilo trazador. La relación inversa entre los cambios sugiere que los efectos de la ingesta de sacarosa en la disponibilidad de los receptores respectivos están regulados en direcciones opuestas. Se sabe que el consumo excesivo de alimentos sabrosos, o drogas, puede ser impulsado por el deseo o el gusto, o ambos60,81. Es posible que la magnitud del deseo impulsado por la dopamina niegue la magnitud del gusto provocado por los opioides, o viceversa. La evidencia reciente apunta a los roles de GABAA receptores en el VTA y terminales colinérgicos en el cuerpo estriado y posiblemente en la corteza que actúan como interruptores entre los mecanismos de acción opioide dependientes de dopamina e independientes de dopamina82,83 eso puede explicar la reciprocidad de los efectos de la dopamina y los opioides en las regiones extraestriatales porcinas determinadas aquí.
Una deficiencia del PET, también en animales comparativamente grandes, es la resolución espacial limitada de la tomografía que afecta los resultados de las regiones cerebrales pequeñas involucradas en los comportamientos relacionados con los alimentos. Sin embargo, a pesar de estas preocupaciones, [11C] la unión de racloprida se registró previamente tanto en regiones estriatales como extraestriatales84,85,86,87. El uso de [11C] racloprida para etiquetar el mismo tipo de receptores no genera preocupación por las posibles diferencias de afinidad que pueden afectar el uso de trazadores separados para los mismos receptores en diferentes regiones. Estudios recientes incluyeron registros de unión extraestriatal de [11C] racloprida. Alakurtti et al. encontró buena reproducibilidad de las medidas de unión de racloprida estriatal en el cuerpo estriado, con solo una reproducibilidad buena a moderada en la corteza85. En un estudio posterior, Svensson et al. discutió varios problemas que afectan el uso de [11C] racloprida como marcador de receptores D2 / 3 extraestriatales en un estudio de humanos sanos, que incluye una reproducibilidad deficiente en la corteza y una disminución limitada de la unión extraestriatal en la corteza frontal en respuesta a un agente bloqueante D2 / 388. Las comparaciones test-retest revelaron variabilidades del 4–7% en el cuerpo estriado y del 13–59% en las regiones corticales, pero el tiempo entre exámenes promedió 20 días, a diferencia de los 1-2 días más informativos de la mayoría de los estudios. Varios factores en la vida de esos sujetos pueden haber tenido tiempo de influir en los hallazgos. De hecho, mostramos aquí que simplemente agregar el consumo de sacarosa a una rutina matutina durante 12 días puede haber influido en las medidas de unión obtenidas dos semanas después. Otros factores tan comunes como jugar videojuegos, ir de compras, entablar nuevas relaciones románticas y actividad sexual, usar drogas o cambiar la dieta y el ejercicio pueden influir en los niveles de dopamina extraestriatal con potencial para una gran variación de los conjuntos de datos. El estudio actual en minipigs introdujo una configuración bien controlada con la única variable que es la ausencia o presencia de sacarosa en la dieta. En este contexto, los datos de siete animales tenían una variabilidad suficientemente baja en las regiones extraestriatales relevantes para identificar una reducción estadísticamente significativa de la unión en respuesta a la sacarosa.
Una limitación del estudio actual es el uso de anestésicos necesarios para garantizar la inmovilidad durante in vivo Imágenes de animales. Los efectos de anestésicos específicos y sus interacciones con medicamentos u otras intervenciones pueden confundir la unión de radioligandos.89,90. La ketamina es un fármaco antiglutamatérgico con rápidos efectos antidepresivos en dosis sub anestésicas.91,92,93, que no reducen el estriado [11C] unión de racloprida en humanos94. Sin embargo, se encontró que la S-ketamina reduce la disponibilidad de unión de los receptores de dopamina D2 / 3 en el cuerpo estriado de primates no humanos conscientes95. El isoflurano es un anestésico común en la PET animal. En estudios previos, encontramos acumulación estriatal de [11C] SCH23390, un radioligando de los receptores de dopamina D1 para ser significativamente más alto en minipigs anestesiados con isoflurano en lugar de propofol, lo que sugiere la susceptibilidad de la neurotransmisión dopaminérgica a los efectos de la anestesia96. En el estudio actual, se tomaron imágenes de todos los minipigs en ambos puntos temporales con premedicación de ketamina y anestesia con isoflurano, lo que hace que las comparaciones actuales sean válidas.
Conclusión
El consumo excesivo de alimentos sabrosos puede causar y convertirse en el resultado de una adicción con consecuencias directas para la salud por la obesidad. Pusimos a prueba la afirmación de que los opioides y la dopamina median las recompensas, importantes para la supervivencia y el abuso de drogas. Las minipigs con acceso intermitente a una solución de sacarosa durante 12 días consecutivos demostraron una disminución de la disponibilidad de receptores de opioides D2 / 3 y μ-opioide en las regiones del cerebro estriatal y extraestriatal, lo que implica que los alimentos con alto contenido de sacarosa influyen en los circuitos de recompensa cerebral de manera similar a los observados cuando las drogas adictivas son consumidos La exposición única inicial a sacarosa fue consistente con la liberación de opioides en las regiones del cerebro activas en la recompensa. Los cambios en la disponibilidad de opioides y dopamina explican el potencial adictivo de la sacarosa consumida en exceso.
Materiales y Métodos
Ética animal
Este estudio fue aprobado y regulado por la Inspección Danesa de Experimentos con Animales y todos los experimentos se llevaron a cabo de conformidad con la directiva 2010/63 / UE del Parlamento Europeo y del Consejo sobre la Protección de Animales Usados con Fines Científicos y las directrices ARRIVE. Utilizamos siete minipigs hembra de Göttingen de catorce meses (Ellegaard, Dalmose, Dinamarca). Los minipigs fueron alimentados con una dieta de pellets (6 dL, 2 veces al día, Special Diets Services, Aarhus, Dinamarca) con agua del grifo disponible ad libitum. La temperatura ambiental era de 20 a 22 ° C, la humedad relativa de 50 a 55% y el aire se cambiaba ocho veces cada hora.
Consumo intermitente de sacarosa
Hemos fotografiado siete minipigs con [11C] raclopride y [11C] carfentanilo al inicio del estudio, y nuevamente un día después de 12 días consecutivos de exposición al agua de sacarosa. La exposición a la sacarosa consistió en una hora de acceso al agua de sacarosa (sacarosa, Dansukker, Copenhague, Dinamarca) (500 gramos de sacarosa en 2 litros de agua), diariamente durante un período de 12 días. Se registró la cantidad de consumo de sacarosa y todas las minipigs consumieron 2 litros cada día. También tomamos imágenes de cinco de los mismos minipigs con [11C] carfentanilo, 30 minutos después del primer acceso a sacarosa, para estudiar la liberación aguda de opioides.
Los minicerdos ganaron un promedio de 13.6% de peso corporal de 25.4 kg (± 0.73 SEM) al inicio del estudio a 28.9 kg (± 0.69 SEM) después de la exposición de 12 días a sacarosa, que fue significativamente mayor (prueba t de una cola, p < 0.001) que los aumentos observados en una muestra de minicerdos control obtenida en estudios previos, donde los pesos aumentaron en promedio solo 4.9%, durante el mismo período de desarrollo.
Imagen PET cerebral
Ayunamos a los cerdos durante la noche con acceso libre al agua antes de la imagen. Pre-medicamos y anestesiamos minipigs como se describió anteriormente97 y los colocó en posición supina en un dispositivo PET / CT (Siemens Biograph 64 Truepoint PET). Realizamos una tomografía computarizada de baja dosis antes de cada adquisición de PET para la definición anatómica y la corrección de atenuación de los datos de emisión de PET. Administramos por vía intravenosa [11C] racloprida al inicio del estudio (360 ± 18 MBq, actividad específica 77 ± 76 GBq / μmol, masa inyectada 0.12 ± 0.08 μg / kg) y después de 12 días de sacarosa (374 ± 54 MBq, actividad específica 127 ± 85 GBq / μmol, masa inyectada 0.06 ± 0.05 μg / kg), y [11C] carfentanilo al inicio del estudio (377 ± 43 MBq, actividad específica 311 ± 195 GBq / μmol, masa inyectada 0.03 ± 0.02 μg / kg) y después de 12 días de sacarosa (337 ± 71 MBq, actividad específica 177 ± 157 GBq / μmol, masa inyectada 0.06 ± 0.08 μg / kg) a través de la vena del oído, en 10 ml de solución salina, durante el primer minuto de una exploración de 90 minutos. Reconstruimos los datos de PET utilizando TrueX 3D OSEM (3 iteraciones, 21 subconjuntos), una matriz de 256 × 256 × 109 y un filtro Gauss de 2 mm, utilizando una estructura de marco temporal de 5 × 60, 3 × 300, 4 × 600 , 2 × 900 segundos (total 14 cuadros, 90 minutos). Al inicio del estudio y después de 12 días de sacarosa, se tomaron imágenes de minipigs con ambos trazadores inyectados con al menos 100 minutos de diferencia, debido a la vida media de [11C] trazadores de PET. Al finalizar la sesión final de PET, sacrificamos minipigs bajo anestesia profunda mediante una sobredosis intravenosa de pentobarbital (100 mg / kg).
Análisis cuantitativos y estadísticas.
Realizamos pasos de preprocesamiento utilizando PMOD 3.7 (PMOD Technologies Ltd, Zurich, Suiza). Para definir los parámetros de transformación estereotáctica a partir de imágenes PET promediadas en el tiempo, utilizamos plantillas específicas de ligando. Aplicamos las matrices de transformación generadas y los campos de deformación en las series temporales de PET dinámicas correspondientes. Generamos imágenes paramétricas de [11C] potencial de unión a racloprida (BPND) mediante el método de tejido de referencia multilineal de Ichise y colaboradores98. Creamos una máscara del cerebelo a medida que excluía el vermis para obtener la radioactividad del tejido cerebeloso con el tiempo en una región de densidad de receptor DA D2 / 3 insignificante. Generamos imágenes paramétricas de [11C] carfentanilo utilizando una implementación del modelo de tejido de referencia Logan99,100 con t * = 30 min. Estudios de [11C] la unión de carfentanilo en el cerebro humano ha utilizado la corteza occipital como región de referencia36; sin embargo, en el cerdo, de acuerdo con las curvas de actividad temporal, la unión no desplazable fue menor en el cerebelo que en la corteza occipital, de acuerdo con los hallazgos de un estudio de autorradiografía de ratas101. Por lo tanto, seleccionamos el cerebelo como la región de referencia en el estudio actual.
análisis estadístico
Sometimos los mapas a un análisis basado en vóxeles con mapeo estadístico no paramétrico (SnPM v13.01, http://warwick.ac.uk/snpm) Caja de herramientas SPM que utiliza la teoría de permutación no paramétrica para proporcionar un marco para la inferencia estadística, un enfoque que funciona bien para muestras pequeñas debido al control estricto de falsos positivos14 y aplicado como se describió previamente102. Un experto en neuroanatomía (DO) de cerdo comparó las imágenes resultantes con un nivel de significación del 5% con un atlas de minipig de alta resolución de Gotinga103,104 para definir y etiquetar regiones de disminución de DA D2 / 3 y μOR BPND desde el inicio hasta la condición posterior a la sacarosa. Luego realizamos un análisis de la región de interés (ROI) para extraer BPND Los valores de regiones específicas que resultan de interés se basan en el análisis SnPM, incluidos el cuerpo estriado, el núcleo accumbens, el tálamo, la amígdala, la corteza cingulada y la corteza prefrontal. No se realizaron estadísticas adicionales en el análisis de ROI, ya que se descubrió que estas regiones eran significativas usando SnPM.
Referencias
- 1.
Smyth, S. & Heron, A. Diabetes y obesidad: las epidemias gemelas. Nat. Med. 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL y Curtin, LR Prevalencia y tendencias de la obesidad entre los adultos de EE. UU., 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamina para "querer" y opioides para "gustar": una comparación de adultos obesos con y sin atracones. Obesidad (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obesidad y el entorno alimentario: densidad energética de la dieta y costos de la dieta. Revista estadounidense de medicina preventiva 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. y Ahmed, SH La dulzura intensa supera la recompensa de la cocaína. Más uno 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. y Guillem, K. En Neurociencia en el siglo 21 (Ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Nuevos desarrollos en la neurobiología de la alimentación y la adicción: actualización sobre el estado de la ciencia. Nutrición 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. En Placeres del cerebro (eds Kringelbach, ML y Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET De la hedónica del gusto al impulso motivacional: receptores centrales de opioides mu y comportamiento de atracones. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Recompensa alimentaria: sustratos cerebrales de querer y gustar. Revisiones de neurociencia y bio comportamiento. 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Mapeo de neurorreceptores en el trabajo: sobre la definición e interpretación de los potenciales de unión después de 20 años de progreso. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Modelos animales de atracones de azúcar y grasas: relación con la adicción a la comida y el aumento de peso corporal. Métodos Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Gelsing, J. et al. La corteza prefrontal en el cerebro minipig de Gottingen se define por criterios de proyección neural y citoarquitectura. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Pruebas de permutación no paramétricas para neuroimagen funcional: un manual con ejemplos. Mapeo Cerebral Hum 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Evidencia de adicción al azúcar: efectos conductuales y neuroquímicos de la ingesta intermitente y excesiva de azúcar. Revisiones de neurociencia y bio comportamiento. 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso Alonso, M. et al. Sistema de recompensa alimentaria: perspectivas actuales y necesidades futuras de investigación. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Autoadministración de sacarosa y activación del SNC en la rata. Soy J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Los circuitos separados codifican los valores hedónicos y nutricionales del azúcar. Neurociencia de la naturaleza 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. El consumo excesivo de azúcar altera la unión a los receptores de opioides y dopamina en el cerebro. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Receptor opiáceo: localización autorradiográfica en cerebro de rata. Proc Natl Acad Sci USA 73, 3729 – 3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Recompensa e hiperactividad de cocaína en la rata: sitios de modulación del receptor opioide mu. Neurociencia 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC La beta-funaltrexamina afecta la autoadministración de cocaína en ratas que responden en un programa de reforzamiento de proporción progresiva. Farmacología, bioquímica y comportamiento. 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. Un papel para los receptores opioides mu en la actividad inducida por la cocaína, la sensibilización y la recompensa en la rata. Psicofarmacología 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW El restablecimiento inducido por cocaína requiere la estimulación endógena de los receptores opioides mu en el pálido ventral. El Diario de la neurociencia: el diario oficial de la Sociedad de Neurociencia 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. La alimentación libera opioides endógenos en humanos. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Circuito límbico opioide para recompensa: interacción entre puntos calientes hedónicos del núcleo accumbens y pálido ventral. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC El sitio opioide en la cáscara del núcleo accumbens media la alimentación y el 'gusto' hedónico por la comida: mapa basado en plumas de Fos por microinyección. Brain Res. 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE La ingesta de soluciones de sacarina, sal y etanol aumenta mediante la infusión de un agonista opioide mu en el núcleo accumbens. Psicofarmacología 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE La ingesta de alimentos ricos en grasas se mejora de forma selectiva mediante la estimulación del receptor opioide mu dentro del núcleo accumbens. La revista de farmacología y terapéutica experimental. 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP y Billington, CJ La naloxona bloquea la porción de alimentación impulsada por el sabor dulce en ratas con restricción de alimentos. Soy J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioides e ingesta de alimentos: ¿vías neuronales funcionales distribuidas? Neuropéptidos 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. y Apfelbaum, M. Un antagonista opioide, naltrexona, reduce la preferencia por la sacarosa en los seres humanos. Soy J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS El efecto de la naltrexona en la detección del gusto y el umbral de reconocimiento. Apetito 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. y Gosnell, BA La naloxona, un bloqueador de opiáceos, reduce el consumo de alimentos dulces con alto contenido de grasa en las mujeres obesas y delgadas que comen compulsivamente. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT y Balleine, BW Distintos circuitos de opioides determinan la palatabilidad y la conveniencia de eventos gratificantes. Proc Natl Acad Sci USA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Liberación endógena de opioides en el sistema de recompensa del cerebro humano inducida por la administración aguda de anfetaminas. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, yo. et al. La anfetamina indujo la liberación de opioides endógenos en el cerebro humano detectada con [11C] PET con carfentanilo: replicación en una cohorte independiente. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Péptidos opioides y el control del comportamiento ingestivo humano. Revisiones de neurociencia y bio comportamiento. 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. y Tolle, TR Qué aprender de in vivo imágenes cerebrales opioidérgicas? Eur J Pain 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interacciones de dopamina-opioides en el cuerpo estriado de rata: un papel modulador de los receptores de dopamina D1 en la transducción de señales mediada por el receptor delta opioide. Neurofarmacología 39, 372 – 381 (2000).
- 41.
Bencherif, B. et al. La unión regional del receptor opioide mu en la corteza insular disminuye en la bulimia nerviosa y se correlaciona inversamente con el comportamiento en ayunas. Revista de medicina nuclear: publicación oficial, Sociedad de Medicina Nuclear 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. La obesidad se asocia con una disminución de la disponibilidad de receptores de dopamina D2 mu-opioides pero inalterados en el cerebro. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. La pérdida de peso después de la cirugía bariátrica normaliza los receptores de opioides cerebrales en la obesidad mórbida. Psiquiatría mol 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Los mecanismos opioides endógenos están implicados en la obesidad y la pérdida de peso en humanos. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. La neurotransmisión de dopamina y opioides en adicciones conductuales: un estudio comparativo de PET en juegos de azar patológicos y atracones. Neuropsicofarmacología 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM La dieta crónica alta en grasas impulsa la regulación epigenética posnatal del receptor mu-opioide en el cerebro. Neuropsicofarmacología: publicación oficial del Colegio Americano de Neuropsicofarmacología 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Inducción de la hiperfagia y la ingesta de carbohidratos mediante la estimulación del receptor opioide mu en regiones circunscritas de la corteza frontal. El Diario de la neurociencia: el diario oficial de la Sociedad de Neurociencia 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. La cocaína crónica amortigua la señalización de la dopamina durante la intoxicación por cocaína y desequilibra la señalización del receptor D1 sobre D2. El Diario de la neurociencia: el diario oficial de la Sociedad de Neurociencia 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, p. et al. Efectos de la nicotina aguda sobre la hemodinámica y la unión de [11C] racloprida a los receptores de dopamina D2,3 en el cerebro del cerdo. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Efecto de la autoadministración de cocaína sobre los receptores de dopamina D2 en monos rhesus. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Señales de cocaína y dopamina en el cuerpo estriado dorsal: mecanismo de deseo en la adicción a la cocaína. El Diario de la neurociencia: el diario oficial de la Sociedad de Neurociencia 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Aumento de la ocupación de receptores de dopamina en el cuerpo estriado humano durante el ansia de cocaína provocada por la señal. Neuropsicofarmacología 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. La estimulación oral con sacarosa aumenta la dopamina accumbens en la rata. Soy J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. y Telang, F. Imágenes del papel de la dopamina en el abuso de drogas y la adicción. Neurofarmacología 56(Supl. 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Dopamina cerebral y obesidad. un artículo del XNUMX de Lancet, 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Similitud entre la obesidad y la adicción a las drogas según lo evaluado por imágenes neurofuncionales: una revisión de concepto. Diario de enfermedades adictivas. 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM y Kenny, PJ Receptores de dopamina D2 en la disfunción de recompensa similar a la adicción y la alimentación compulsiva en ratas obesas. Neurociencia de la naturaleza 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neurociencia afectiva del placer: recompensa en humanos y animales. Psicofarmacología 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Sistemas de placer en el cerebro. Neurona 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Señal de recompensa predictiva de las neuronas de dopamina. J neurofisiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. y Malbert, CH Cambios en la actividad cerebral después de una obesidad inducida por la dieta. Obesidad 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. y Norgren, R. Accumbens mecanismos de dopamina en la ingesta de sacarosa. Brain Res. 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM y Hoebel, BG Los atracones diarios de azúcar liberan repetidamente dopamina en la cáscara accumbens. Neurociencia 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR y Hajnal, A. El acceso repetido a la sacarosa influye en la densidad del receptor de dopamina D2 en el estriado. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Alsío, J. et al. La expresión del gen del receptor de dopamina D1 disminuye en el núcleo acumulado tras la exposición a largo plazo a alimentos sabrosos y difiere dependiendo del fenotipo de obesidad inducido por la dieta en ratas. Neurociencia 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Influencia diferencial de los mecanismos de aprendizaje asociativos y no asociativos sobre la capacidad de respuesta de la transmisión de dopamina prefrontal y accumbal a los estímulos alimentarios en ratas alimentadas ad libitum. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Circuitos neuronales desequilibrados en la adicción. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. y Pignatti, R. Anorexia, bulimia y obesidad: déficits compartidos en la toma de decisiones en la Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Deficiencias en la toma de decisiones y comer en exceso: un modelo de riesgo para la obesidad. Obes res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Los receptores D2 estriatal bajos de dopamina están asociados con el metabolismo prefrontal en sujetos obesos: posibles factores contribuyentes. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW El núcleo central de la amígdala interactúa con el cuerpo estriado dorsolateral para regular la adquisición de hábitos. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Subsidios. et al. Activación de circuitos de memoria durante el ansia de cocaína provocada por la señal. Proc Natl Acad Sci USA 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Activación límbica durante el ansia de cocaína inducida por señal. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC ¿Qué y cuándo “querer”? Enfoque basado en la amígdala de la prominencia de los incentivos sobre el azúcar y el sexo. Psicofarmacología 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiología de la adicción: un análisis de neurocircuitos. Lancet Psiquiatría 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Activación cortical en respuesta a estímulos gustativos puros durante los estados fisiológicos de hambre y saciedad. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotoros, A. et al. Liberación de dopamina inducida por señal de cocaína en amígdala e hipocampo: un estudio de fallypride PET [(1) (8) F] de alta resolución en participantes dependientes de cocaína. Neuropsicofarmacología 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Control de la conducta de búsqueda de cocaína por estímulos asociados a drogas en ratas: efectos sobre la recuperación de niveles de dopamina extracelular y de respuesta operante extinguidos en amígdala y núcleo accumbens. Proc Natl Acad Sci USA 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE El antagonismo de los receptores de dopamina D1 o D2 dentro de la amígdala basolateral altera diferencialmente la adquisición de asociaciones de señales de cocaína necesarias para el restablecimiento de la búsqueda de cocaína inducida por señales. Neurociencia 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interacción aberrante mesolimbic de dopamina-opiáceos en la obesidad. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Señales conductuales de dopamina. Tendencias Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR y van der Kooy, D. La neurobiología de la motivación de los opiáceos. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Regulación de los receptores nicotínicos y opioides de la transmisión mediada por el receptor estriatal de dopamina D2. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Disminución relacionada con la edad de la disponibilidad del receptor de dopamina D2 / 3 medida con racloprida [C-11] en regiones del cerebro humano no estriatal: Comparación de cuatro métodos. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Fiabilidad test-retest a largo plazo de la unión al receptor D2 / 3 de dopamina estriatal y extraestriatal: estudio con [(11) C] racloprida y PET de alta resolución. Metabol de flujo sanguíneo J Cereb 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Liberación endógena de dopamina después de desafíos farmacológicos en la enfermedad de Parkinson. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Déficits cognitivos y liberación de dopamina estriato-frontal en la enfermedad de Parkinson. Cerebro 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validez y fiabilidad de la cuantificación de unión a racloprida extraestriatal [(11) C] en el cerebro humano vivo. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. La anestesia con isoflurano aumenta los efectos inhibitorios de la cocaína y el GBR12909 en el transportador de dopamina: estudios de PET en combinación con microdiálisis en el cerebro del mono. Brain Res. 849, 85 – 96 (1999).
- 90.
Hasson, W. et al. Estudio PET de la unión de [11C] racloprida en el cuerpo estriado del gato despierto: efectos de los anestésicos y función del flujo sanguíneo cerebral. Revista europea de medicina nuclear e imagen molecular 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. y Amore, M. El papel de la ketamina en la depresión resistente al tratamiento: una revisión sistemática. Curr Neurofarmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Efectos antidepresivos de la ketamina en pacientes deprimidos. Biol Psychiatry 47, 351 – 354 (2000).
- 93.
Browne, CA & Lucki, I. Efectos antidepresivos de la ketamina: mecanismos subyacentes a los nuevos antidepresivos de acción rápida. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. La ketamina no disminuye la unión del receptor D2 de dopamina estriatal en el hombre. Psicofarmacología 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. y Tsukada, H. Reducción de la unión del receptor de dopamina D2 / 3 en el cuerpo estriado después de una sola administración de esketamina, pero no de R-ketamina: una PET estudiar en monos conscientes. Eur Arch Psiquiatría Clin Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Efectos de la anestesia y las especies sobre la captación o unión de radioligandos in vivo en el minipig de Gottingen. BioMed Research International 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Imagen PET monoaminérgica longitudinal de la inhibición crónica del proteasoma en minipigs. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Estrategias para mejorar la estimación de parámetros de neurorreceptores mediante análisis de regresión lineal. Metabol de flujo sanguíneo J Cereb 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
logan, j. et al. Proporciones de volumen de distribución sin muestreo de sangre a partir del análisis gráfico de datos de PET. Metabol de flujo sanguíneo J Cereb 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Cuantificación de receptores de opioides mu cerebrales con [11C] carfentanilo: métodos de tejido de referencia. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. y Bishop, P. Un mapa autorradiográfico de la unión de (3H) diprenorfina en el cerebro de rata: efectos de la interacción social. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Landau, AM et al. La estimulación electroconvulsiva afecta de manera diferencial la unión de [(11) C] MDL100,907 a los receptores 5HT2A corticales y subcorticales en el cerebro porcino. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. El telencéfalo del minipig de Gottingen, citoarquitectura y anatomía de la superficie cortical. Función cerebral 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Atlas histológico en línea del cerebro minipig de Gotinga. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Agradecimientos
Una "Subvención para el Desarrollo del Proyecto de Ideas AU" de la Universidad de Aarhus para AML financió el estudio. Agradecemos el apoyo técnico del personal del Centro de PET del Hospital de la Universidad de Aarhus y la Granja de la Universidad de Aarhus por su ayuda con el tratamiento de los animales. Agradecemos al profesor Morten Kringelbach, al profesor Jørgen Scheel-Kruger y al profesor asociado Arne Møller por su ayuda con el inicio de estos estudios.
Declaraciones de ética
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Información Adicional
Nota del editor Springer Nature permanece neutral con respecto a los reclamos jurisdiccionales en mapas publicados y afiliaciones institucionales.
Derechos y permisos
Acceso Abierto Este artículo está licenciado bajo una licencia internacional Creative Commons Attribution 4.0, que permite el uso, intercambio, adaptación, distribución y reproducción en cualquier medio o formato, siempre que otorgue el crédito apropiado al autor o autores originales y a la fuente, proporcione un enlace a la licencia Creative Commons e indique si se realizaron cambios. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en una línea de crédito al material. Si el material no está incluido en la licencia Creative Commons del artículo y su uso previsto no está permitido por la regulación legal o excede el uso permitido, deberá obtener el permiso directamente del titular de los derechos de autor. Para ver una copia de esta licencia, visite http://creativecommons.org/licenses/by/4.0/.