Frente. Behav. Neurosci., 02 Abril 2014 |
Carla kalkhoven1, Cor Sennef1Ard Peeters1 y Ruud van den Bos2*
- 1Chardon Pharma, Herpen, Países Bajos
- 2Departamento de Fisiología Animal Organismal, Facultad de Ciencias, Radboud University Nijmegen, Nijmegen, Países Bajos
La enfermedad de Huntington (EH) es un trastorno genético, neurodegenerativo, que afecta específicamente a las neuronas del estriado de la vía indirecta, lo que resulta en una disminución progresiva de la coordinación muscular y la pérdida del control emocional y cognitivo. Curiosamente, la predisposición al juego patológico y otras adicciones involucran alteraciones en los mismos circuitos cortico-estriatales que se ven afectados en la EH, y muestran síntomas similares relacionados con la desinhibición, incluida una sensibilidad cambiada a los castigos y recompensas, la impulsividad y la incapacidad de considerar ventajas a largo plazo. sobre las recompensas a corto plazo. Tanto los pacientes con EH como los jugadores patológicos también muestran déficits de rendimiento similares en las tareas de toma de decisiones riesgosas, como la Iowa Gambling Task (IGT). Estas similitudes sugieren que los pacientes con EH son un grupo de riesgo probable para problemas de juego. Sin embargo, estos problemas solo se han observado de forma incidental en pacientes con EH. En esta revisión, nuestro objetivo es caracterizar el riesgo de juego patológico en la EH, así como los mecanismos neurobiológicos subyacentes. Especialmente con el aumento actual de oportunidades de juegos de azar en Internet de fácil acceso, es importante comprender estos riesgos y proporcionar el apoyo adecuado al paciente en consecuencia. Sobre la base de los hallazgos neuropatológicos y de comportamiento, proponemos que los pacientes con EH pueden no tener una mayor tendencia a buscar riesgos y comenzar a apostar, pero sí tienen una mayor probabilidad de desarrollar una adicción una vez que participan en actividades de juego. Por lo tanto, los desarrollos actuales y futuros de las posibilidades de juego en Internet y las adicciones relacionadas deben considerarse con cuidado, especialmente para grupos vulnerables como los pacientes con EH.
Introducción
La enfermedad de Huntington (EH) es un trastorno genético neurodegenerativo, heredado de manera autosómica dominante. La enfermedad se caracteriza por síntomas motores, cognitivos y conductuales progresivos, que generalmente se manifiestan entre 30 y 50 años, y conducen a una muerte prematura en 10 – 20 años después del inicio de la enfermedad. La HD es causada por una mutación en el gen Huntingtin (HTT), que conduce a la agregación de proteínas, la desregulación de varios procesos celulares y, finalmente, la muerte celular. La degeneración neuronal ocurre inicialmente de manera selectiva en el cuerpo estriado (núcleo caudado y putamen), donde afecta a las vías corticoestriadas que sirven para controlar las funciones motoras y cognitivas (Reiner et al., 2011; Vonsattel et al., 2011). A nivel motor, este proceso degenerativo se expresa como movimientos desorganizados (corea), mientras que a nivel cognitivo / conductual los pacientes muestran un "síndrome de disfunción ejecutiva", que abarca entre otros impulsividad, evaluación de riesgos deficiente e incapacidad para detener un curso deficiente de acción (Hamilton et al., 2003; Duff et al., 2010b). Se observan síntomas conductuales y cognitivos similares en conductas adictivas relacionadas con sustancias o actividades (Newman, 1987; Rosenblatt, 2007; Iacono et al., 2008). Por lo tanto, se puede esperar que los pacientes con EH tengan riesgo de desarrollar adicciones. Los paradigmas de toma de decisiones en entornos de laboratorio han sugerido déficits en la toma de decisiones de riesgo en pacientes con EH avanzada (por ejemplo, Stout et al., 2001), y el juego patológico se ha observado incidentalmente en este grupo de pacientes (De Marchi et al., 1998). Sin embargo, estos hallazgos son raros y, sorprendentemente, pocos estudios han examinado directamente los síntomas y las consecuencias de, por ejemplo, la desinhibición del comportamiento en la EH.
En esta revisión argumentaremos que los pacientes con EH pueden ser un grupo de riesgo para desarrollar apuestas problemáticas. En primer lugar, el juego problemático se caracteriza por la incapacidad de los sujetos para dejar de jugar a pesar de problemas financieros, personales o profesionales. Sobre la base de los trastornos neurobiológicos y los síntomas de comportamiento, la capacidad para detener el comportamiento de los juegos de azar parece disminuir o estar ausente en los pacientes con EH. En segundo lugar, debido a las actitudes más liberales hacia el juego y al aumento de las posibilidades de juego legal e ilegal en Internet (ver, por ejemplo, Griffiths, 2003), podemos esperar que la incidencia de problemas de juego aumente en los próximos años. El aumento de la accesibilidad puede suponer un riesgo específico para los grupos vulnerables, como los pacientes con EH, que no han estado expuestos previamente a tales riesgos.
En general, las condiciones externas cambiantes y los métodos de tratamiento pueden tener efectos inesperados e indeseables en el comportamiento del paciente, especialmente en enfermedades neurológicas complejas. Tales efectos son fácilmente pasados por alto cuando los síntomas de comportamiento no son reevaluados regularmente. Esto se puede ilustrar mejor con el caso de la enfermedad de Parkinson, donde la introducción del tratamiento farmacológico con agonistas de la dopamina condujo a trastornos del control de los impulsos como el juego compulsivo, las compras, la comida y la hipersexualidad, causados por la sobreestimulación del sistema dopaminérgico mesolímbico (Dodd et al., 2005; Witjas et al., 2012; Weintraub et al., 2013). Sin embargo, estos efectos secundarios no se reconocieron hasta años después de la introducción de terapias con agonistas de la dopamina en combinación con cambios sociales relacionados con (la disponibilidad de) las compras, el consumo de alimentos, la sexualidad, Internet y el juego. Este ejemplo ilustra que la reevaluación de los factores de riesgo es importante para poder brindar un tratamiento y una guía efectivos a los pacientes frente a un entorno cambiante.
Aquí, exploraremos el perfil de la enfermedad de la EH en relación con la adicción, los problemas de juego y los déficits en la toma de decisiones. En la sección HD: neuropatología, síntomas y progresiónLa progresión de los síntomas de la EH se discutirá en relación con las perturbaciones en los circuitos cortico-estriados involucrados en el aprendizaje de tareas, la sensibilidad al castigo y el control cognitivo / impulsivo. En la sección Riesgo y comportamiento patológico de juego en HDEl perfil neurobiológico de los pacientes con EH se analizará en el contexto del juego y las pruebas de toma de decisiones y toma de decisiones bien establecidas, como la Tarea de Juego de Iowa (IGT) y la Tarea de Juego de Cambridge (CGT). En la sección Discusión, analizaremos cómo una caracterización de los riesgos de juego puede llevar a recomendaciones para los pacientes con EH y sus cuidadores sobre cómo tratar este problema y qué situaciones se evitan mejor. También pretendemos identificar preguntas aún sin respuesta, que pueden actuar como punto de partida para futuras investigaciones sobre la incidencia y los riesgos de problemas de juego en pacientes con EH.
HD: neuropatología, síntomas y progresión
Mecanismos de enfermedad neurobiológica
La HD es causada por un CAG inestable (trinucleótido; citosina-adenina-guanina) que se repite en la región codificante del gen HTT, lo que conduce a la producción de proteína huntingtina mutante (Htt) con un tramo de poliglutamina expandida (polyQ) (MacDonald et al., 1993). El número de repeticiones de trinucleótidos se correlaciona inversamente con la edad de aparición de la enfermedad (Snell et al., 1993; Stine et al., 1993). La mayoría de los pacientes con EH tienen repeticiones de 40-55 que causan el trastorno típico de inicio en adultos, mientras que las expansiones de más de las repeticiones de 70 conducen al trastorno de inicio juvenil. Las personas con menos de 35 CAG repeticiones en el gen HTT no desarrollarán HD. Aunque los mecanismos exactos de la patogénesis de la EH siguen siendo desconocidos y no pueden discutirse aquí en detalle, implican la formación de agregados de proteínas por parte de polyQ expandido Htt, así como la interacción de Htt mutante con numerosas proteínas que participan en el metabolismo energético, las proteínas y la vesícula. transporte, y regulación de la transcripción de genes (Li y Li, 2004; Jones y Hughes, 2011). La desregulación resultante de estos procesos celulares conduce eventualmente a la degeneración neuronal a través de mecanismos que involucran excitotoxicidad y apoptosis.
La degeneración neuronal se restringe inicialmente a los ganglios basales, donde las neuronas espinosas medias en el cuerpo estriado (núcleo caudado y putamen) están específicamente afectadas (Vonsattel y DiFiglia, 1998; Kassubek et al., 2004). El estriado recibe su principal entrada excitadora (glutamatérgica) de las áreas corticales, mientras que recibe su entrada dopaminérgica de la sustancia negra. El cuerpo estriado tiene dos salidas inhibitorias principales (GABA-ergic): una vía directa e indirecta (Figura 1A). Las neuronas estriadas de la vía directa se proyectan hacia el globo pálido interno (GPi), que a su vez tiene proyecciones inhibitorias al tálamo. El tálamo da lugar a la entrada excitadora principal a la corteza. Así, en efecto, la activación de la vía estriada directa inhibe la actividad GPi, que a su vez desinhibe la actividad tálamocortical, facilitando así el movimiento y las funciones cognitivas. La vía indirecta del cuerpo estriado, por otro lado, se proyecta a la GP externa (GPe), que a su vez envía proyecciones inhibitorias al núcleo subtalámico (STN). El STN envía proyecciones excitatorias al GPi. Por consiguiente, la activación de la vía indirecta del estriado desinhibe el STN, lo que le permite activar el GPi, que a su vez inhibe la actividad tálamo-cortical, suprimiendo el movimiento y las funciones cognitivas. El comportamiento adaptativo resulta de un equilibrio (delicado) de actividad en la ruta directa e indirecta. La patología en la vía indirecta es clave para la EH y altera el equilibrio en el control del cuerpo estriado, lo que resulta en una pérdida del control inhibitorio sobre el funcionamiento y el comportamiento del motor (Figura 1B; Albin et al., 1989; Alexander y Crutcher, 1990).
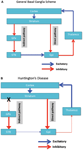
Figura 1. (UNA) Esquema simplificado de la organización de las redes de ganglios cortico-basales (áreas corticales, estriadas, pálidas y talámicas) que muestran las vías directas e indirectas en los cerebros normales. (B) La degeneración específica de la vía indirecta (X) en HD conduce a una disminución en el control inhibitorio sobre las funciones corticales. GPe: globo pálido externo; GPi: globo pálido interno; STN: núcleo subtalámico. Rojo: vías inhibitorias (GABA), Azul: Vías excitatorias (glutamato).
Los circuitos de ganglios cortico-basales, que abarcan conexiones entre áreas corticales, áreas estriadas, áreas pálidas y áreas talámicas, se organizan de manera paralela y sirven diferentes funciones en la organización del comportamiento. Como existen muchas revisiones excelentes sobre la anatomía y la función de estos circuitos (por ejemplo, Alexander et al., 1986, 1990; Alexander y Crutcher, 1990; Yin y Knowlton, 2006; Verny et al., 2007; Yin et al., 2008; Haber y Knutson, 2010; Sesack y Grace, 2010), aquí solo destacamos algunas cuestiones conducentes a nuestra revisión. En primer lugar, en términos generales, existe una organización topográfica dorsal a ventral en las áreas cortical y estriatal. Por lo tanto, las áreas prefrontales dorsales están asociadas con áreas del estriado dorsal, mientras que las áreas prefrontales más ventrales están asociadas con áreas del estriado más ventrales (incluyendo el núcleo accumbens). En segundo lugar, se pueden describir tres circuitos funcionalmente diferentes. El circuito sensoriomotor abarca el sensoriatomotor del estriado (putamen) y las cortezas sensoriomotoras asociadas con la ejecución del comportamiento del motor. El circuito de control asociativo / cognitivo involucra la corteza prefrontal dorsolateral, la corteza cingulada anterior y el estriado asociativo (núcleo caudado). Este circuito es especialmente relevante para el funcionamiento ejecutivo, es decir, está involucrado en el control cognitivo, la planificación y la memoria de trabajo. Además, participa en la promoción del comportamiento adaptativo a largo plazo reforzando o deteniendo (castigando) el comportamiento instrumental, es decir, secuencias de actos de comportamiento, aprendidas en la interacción con el entorno (Kravitz et al., 2012; Paton y Louie, 2012). El circuito límbico incluye la corteza orbitofrontal, la corteza prefrontal ventromedial, la amígdala y el estriado límbico (núcleo accumbens). Este circuito es especialmente relevante para evaluar el valor afectivo de los estímulos, señalar la recompensa o el castigo esperados de un próximo estímulo, elección o evento, control emocional y aprendizaje adaptativo (emocional)O'Doherty et al., 2001; Rushworth et al., 2007; van den Bos y otros, 2013b, 2014).
La patología en la EH se observa tanto en el putamen como en el núcleo caudado (Vonsattel y DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008; Vonsattel et al., 2011; Hadzi et al., 2012). Además, en ambas estructuras, la atrofia sigue un patrón característico, que comienza en las regiones dorsal y caudal y avanza hacia las regiones ventral y rostral a medida que avanza la enfermedad (Vonsattel y DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008). Sin embargo, en algunos estudios también se ha observado atrofia temprana en el núcleo accumbens y en el globo pálido (van den Bogaard y otros, 2011; Sánchez-Castañeda et al., 2013). Mientras que las perturbaciones en el circuito sensoriomotor (putamen) pueden estar relacionadas con los síntomas motores, las perturbaciones en el circuito de control asociativo / cognitivo (núcleo caudado) pueden estar relacionadas con la disfunción ejecutiva y pueden causar déficits en, por ejemplo, la memoria de trabajo en pacientes con EH temprana (Lawrence et al., 1996; Bonelli y Cummings, 2007; Wolf et al., 2007). Las alteraciones en el circuito límbico, como las debidas a la atrofia temprana en el núcleo accumbens, pueden estar relacionadas con la apatía y la depresión (Bonelli y Cummings, 2007; Unschuld et al., 2012). La atrofia progresiva en el cuerpo estriado puede conducir a una disfunción sucesiva de los circuitos córtico-estriado. Por ejemplo, el núcleo caudado ventral también forma parte del circuito orbitofrontal, que se ve afectado a medida que avanza la enfermedad. La disfunción de este circuito está relacionada con la desinhibición del comportamiento (Bonelli y Cummings, 2007). Con el tiempo, la degeneración puede extenderse a otras áreas del cerebro, incluidas otras partes de los ganglios basales (áreas pálidas y tálamo), hipocampo, amígdala y áreas corticales en las etapas finales de la enfermedad.
En resumen, la EH se caracteriza por una degeneración específica de las neuronas estriatales que pertenecen a la vía indirecta. A medida que avanza la enfermedad, la atrofia del cuerpo estriado se extiende a lo largo de un gradiente caudal-rostral y dorsal-ventral que causa una alteración secuencial de los circuitos córtico-estriado. La pérdida resultante de control inhibitorio en estos circuitos está directamente relacionada con la progresión de los síntomas motores, cognitivos y conductuales en la EH, como se explica a continuación.
Síntomas de HD
La EH se caracteriza por una variedad de síntomas motores, cognitivos y conductuales progresivos. Los primeros síntomas generalmente surgen a la edad media, con una edad de inicio promedio de 40, aunque un pequeño porcentaje de pacientes sufre de HD de inicio juvenil, que comienza antes de la edad de 20. Como los síntomas y la progresión de la EH de inicio juvenil son algo distintos del trastorno de aparición en adultos, nos centraremos en el último grupo de pacientes en esta revisión. Uno de los primeros síntomas que se manifiestan en la EH es la corea (trastorno de movimiento involuntario), y generalmente se hace un diagnóstico clínico después de la aparición de anomalías en el movimiento (Shannon, 2011). Sin embargo, algunos estudios informan sutiles cambios cognitivos y emocionales antes de la aparición de los síntomas motores, y el orden exacto de aparición y progresión de los síntomas de la EH sigue siendo un tema de debate. Sin embargo, varias revisiones completas de las manifestaciones clínicas de la EH están disponibles (Roos, 2010; Anderson, xnumx; Shannon, 2011).
Síntomas motores
Los síntomas motores comienzan a manifestarse en las primeras etapas de la EH, y suelen ser los primeros síntomas que se notan en los entornos de laboratorio y por los familiares de primer grado de los pacientes con EH (de Boo et al., 1997; Kirkwood et al., 1999, 2001). Las alteraciones motoras parecen comenzar como una disfunción en el control de retroalimentación de error (Smith et al., 2000), consistente con el papel del circuito motor corticoestriato en el aprendizaje y control sensoriomotor (Graybiel et al., 1994). Los primeros signos de anomalías motoras son a menudo movimientos involuntarios sutiles (corea) de, por ejemplo, músculos faciales, dedos y dedos de los pies ("contracciones"), hiperreflexia y movimientos voluntarios exagerados (Young et al., 1986; Shannon, 2011), que conduce a una apariencia general de inquietud y torpeza en los pacientes con EH precoz. Estos movimientos anormales son sutiles y con frecuencia pasan desapercibidos al principio, pero empeoran y se propagan gradualmente a todos los demás músculos con el tiempo. Otros síntomas motores tempranos incluyen movimientos oculares sacádicos lentos o retardados (Peltsch et al., 2008) y disartria (Ramig, 1986; Young et al., 1986). La disartria, un trastorno motor del habla, conduce a dificultades con la articulación y el arrastre de palabras, lo que hace que el habla sea cada vez más difícil de entender. La disfagia (dificultad para tragar) se observa en la mayoría de los pacientes con un inicio en las etapas medias de la enfermedad, y empeora gradualmente hasta que los pacientes ya no pueden comer sin asistencia y, a menudo, requieren una sonda de alimentación en la etapa tardía de la EH (Heemskerk y Roos, 2011). Otros síntomas motores no coreicos que suelen aparecer en la etapa media de la enfermedad son el trastorno complejo de la marcha, la inestabilidad postural y la distonía (contracciones musculares involuntarias que causan movimientos repetitivos lentos y posturas anormales), que a menudo se acompaña de caídas frecuentes (Koller y Trimble, 1985; Tian et al., 1992; Louis et al., 1999; Grimbergen et al., 2008). Algunas veces se observan rigidez y bradicinesia (lentitud de movimientos y reflejos), pero en su mayoría se restringen a casos de HD de inicio juvenil (Bittenbender y Quadfasel, 1962; Hansotia et al., 1968). Estos síntomas motores son consistentes con la disfunción de los circuitos córtico-estriatales sensoriomotores (y control asociativo / cognitivo) que comúnmente se ven afectados en la EH.
Síntomas conductuales y psiquiátricos.
Los trastornos del comportamiento en la EH pueden ser complejos y difíciles de clasificar, y su aparición y aparición es muy variable entre los individuos. Además, a veces puede ser difícil distinguir entre los trastornos de conducta y los problemas normales de afrontar una enfermedad angustiante (Caine y Shoulson, 1983). La cantidad de estudios que han caracterizado los síntomas de comportamiento en la EH es limitada, y como resultado hay relativamente poca información sobre su prevalencia en la enfermedad (van duijn et al., 2007). Los síntomas emocionales y de comportamiento más frecuentes y constantes en la EH son la irritabilidad, la apatía y la depresión, que se producen con una prevalencia de aproximadamente 50% (Caine y Shoulson, 1983; Folstein y Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van duijn et al., 2007, 2014; Tabrizi et al., 2009). Tanto la irritabilidad como la apatía se observan a veces en pacientes pre-manifiestos con EH (Tabrizi et al., 2009; van duijn et al., 2014), y también se ha reportado depresión en estadios clínicos tempranos (Shiwach, 1994; Julien et al., 2007; Epping et al., 2013). Estos síntomas afectivos se encuentran entre los primeros síntomas no motores notados por los familiares de primer grado (Kirkwood et al., 2001). Los síntomas típicos relacionados con la apatía, que empeoran gradualmente durante el curso de la enfermedad, incluyen falta de energía, motivación e iniciativa, disminución de la perseverancia y la calidad del trabajo, juicio deficiente, falta de cuidado personal y embotamiento emocional (Craufurd et al., 2001; Kirkwood et al., 2001). Los síntomas depresivos se han relacionado con una mayor actividad en la corteza prefrontal ventromedial (Unschuld et al., 2012). La irritabilidad está asociada con la disfunción del circuito orbitofrontal, que conduce a un menor control sobre las respuestas emocionales en la amígdala (Klöppel et al., 2010).
Otros síntomas y trastornos psiquiátricos que se observan con menos frecuencia en la EH son la ansiedad, el trastorno obsesivo-compulsivo, la manía y los síntomas psicóticos similares a la esquizofrenia, como paranoia, alucinaciones y delirios (Caine y Shoulson, 1983; Folstein y Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van duijn et al., 2007). Estos síntomas generalmente no se presentan hasta la etapa media o tardía de la enfermedad, aunque se ha informado de que ocurren incidentalmente en pacientes preclínicos con EH (Duff et al., 2007). El trastorno obsesivo-compulsivo se ha asociado con daños en la corteza orbitofrontal y la corteza cingulada anterior, mientras que la esquizofrenia, un trastorno que involucra déficits en la organización, planificación y atención, está relacionada con la disfunción de la corteza prefrontal dorsolateral (Tekin y Cummings, 2002).
Se sugiere que la mayoría de los síntomas psiquiátricos en la EH son, de hecho, parte de un "síndrome del lóbulo frontal" o "síndrome de disfunción ejecutiva" amplio y mal definido, que incluye síntomas como apatía, irritabilidad, desinhibición, impulsividad, obsesión y perseveración (Lyketsos et al., 2004; Rosenblatt, 2007), todos los cuales se observan comúnmente en pacientes con EH (Hamilton et al., 2003; Duff et al., 2010b). En conjunto, la literatura indica que el inicio y la progresión de los síntomas de comportamiento en la EH son heterogéneos, con trastornos afectivos que ocurren con mayor frecuencia y un inicio temprano, mientras que la ansiedad, el trastorno obsesivo-compulsivo y los síntomas psicóticos son menos comunes y generalmente ocurren más tarde en la enfermedad. . Estos síntomas psiquiátricos se asocian con la disfunción de los circuitos córtico-estriado de control límbico y asociativo / cognitivo que se afectan comúnmente en la EH.
Síntomas cognitivos
El deterioro cognitivo es otro aspecto importante de la patología de la EH. Muchos estudios se han centrado específicamente en la aparición de síntomas cognitivos en estadios preclínicos y clínicos tempranos de la EH, con la esperanza de descubrir biomarcadores clínicos tempranos de la enfermedad (revisados en Papp et al., 2011; Dumas et al., 2013). En general, los resultados sugieren que pueden observarse cambios cognitivos sutiles hasta 5-10 años antes del inicio de los síntomas motores con métodos suficientemente sensibles. Un estudio incluso encontró que, en estadios preclínicos y clínicos tempranos de la EH, aproximadamente el 40% de pacientes ya cumplen con los criterios de deterioro cognitivo leve (un trastorno asociado con la pérdida de memoria limitada, que no cumple con los criterios para el diagnóstico de demencia; Duff et al., 2010a). Sin embargo, no todos los estudios apoyan estos hallazgos (Blackmore et al., 1995; Giordani y otros, 1995; de Boo et al., 1997; Kirkwood et al., 2001). En general, la literatura está de acuerdo en que el procesamiento de la información y la velocidad psicomotora se ven especialmente afectados en esta etapa temprana (Rothlind y otros, 1993; Kirkwood et al., 1999; Verny et al., 2007; Paulsen et al., 2008). Otras deficiencias cognitivas tempranas observadas comúnmente incluyen problemas con la atención, la memoria (operativa) y el rendimiento visuoespacial (Jason et al., 1988; Rothlind y otros, 1993; Foroud et al., 1995; Lawrence et al., 1996; Hahn-Barma et al., 1998; Verny et al., 2007; Paulsen et al., 2008; Tabrizi et al., 2009; Papp et al., 2011; Stout et al., 2011). Se ha observado inflexibilidad cognitiva en pacientes con enfermedad temprana (Jason et al., 1988), en qué etapa los cambios extra-dimensionales están específicamente deteriorados, mientras que el aprendizaje de inversión sigue intacto (Lawrence et al., 1996). Por lo tanto, los pacientes aún pueden reevaluar el valor del estímulo y aprender nuevas contingencias de estímulo-recompensa dentro de la misma dimensión (por ejemplo, forma o color), pero tienen problemas para cambiar su atención a una dimensión diferente (por ejemplo, de color a forma) según lo requerido por La nueva regla de la tarea para obtener recompensa. En etapas posteriores de la enfermedad, la inflexibilidad cognitiva y la perseveración también causan un aprendizaje inverso deficiente en pacientes con EH (Josiassen et al., 1983; Lange et al., 1995). Esta progresión de los síntomas es consistente con una disfunción específica del circuito prefrontal dorsolateral en la etapa temprana de la enfermedad, ya que el cambio de conjunto extra-dimensional está mediado por la corteza prefrontal dorsolateral, mientras que el aprendizaje inverso está mediado por la corteza orbitofrontal (Dias et al., 1996; McAlonan y Brown, 2003). Otras deficiencias tempranas incluyen el comportamiento desorganizado, la planificación deficiente, el juicio deficiente y el control emocional y de comportamiento reducido (Watkins y otros, 2000; Paradiso et al., 2008; Duff et al., 2010b). Se ha observado desinhibición en pacientes con EH temprana, cuyo desempeño se ve afectado en tareas que requieren inhibición de respuestas prepotentes pero inapropiadas (Holl et al., 2013). Finalmente, varios estudios han encontrado que los pacientes preclínicos en la EH tienen problemas para reconocer emociones negativas como la ira, el disgusto, el miedo y la tristeza. El reconocimiento emocional disminuye progresivamente y puede extenderse a problemas con emociones neutrales en etapas clínicas tempranas de la enfermedad (Johnson et al., 2007; Tabrizi et al., 2009; Labuschagne et al., 2013). Este fenotipo está relacionado con la disfunción de la corteza orbitofrontal, que está involucrada en el procesamiento de información emocional y de recompensa (Henley et al., 2008; Ille et al., 2011).
Los estudios con modelos animales de EH muestran alteraciones cognitivas similares a las observadas en pacientes humanos. Aunque no todos los estudios encuentran deficiencias cognitivas robustas (Fielding et al., 2012), los hallazgos en modelos de ratas y ratones de EH incluyen ansiedad, mayor capacidad de respuesta a estímulos emocionales negativos y deficiencias en el aprendizaje inverso y el cambio de estrategia (Faure et al., 2011; Abada et al., 2013). Un estudio encontró déficits tempranos específicos en el aprendizaje de reversión antes del inicio de los síntomas motores en un modelo de rata de HD (Fink et al., 2012). Curiosamente, los animales con EH parecen tener una mayor capacidad de respuesta a los estímulos emocionales negativos, mientras que los pacientes humanos muestran un menor reconocimiento de las emociones negativas. En la actualidad, no está claro si esto refleja diferencias en la tarea administrada (reconocer emociones respuestas de comportamiento ante estímulos amenazantes), diferencias relacionadas con las especies en el resultado de la patología o una diferencia fundamental entre el modelo de rata y la condición humana. En general, los estudios tanto en pacientes humanos como en modelos animales de HD demuestran que una amplia gama de funciones cognitivas ya pueden verse afectadas en la HD temprana. Las anomalías tempranas incluyen principalmente déficits en la atención, la memoria, la flexibilidad cognitiva y el reconocimiento emocional. En esta etapa temprana, los pacientes a menudo tienen una conciencia deficiente de sus propias capacidades cognitivas (disminución de)Hoth et al., 2007). Con el tiempo, los síntomas cognitivos empeoran progresivamente, lo que finalmente conduce a una demencia subcortical grave en las últimas etapas de la enfermedad. Aunque la aparición de síntomas generalmente es consistente con el deterioro sucesivo del control asociativo / cognitivo y los circuitos córtico-estriados límbicos, respectivamente, las funciones específicas relacionadas con el circuito límbico también pueden verse afectadas en la etapa temprana de la EH.
Conclusión
Los síntomas motores, conductuales y cognitivos en la EH se han estudiado ampliamente en el pasado y siguen siendo un tema de interés debido a la gran variedad y variabilidad en la aparición y el inicio de estos síntomas en todos los pacientes. En general, los síntomas conductuales y cognitivos están relacionados con tres categorías frontales de comportamiento: apatía, disfunción ejecutiva y desinhibición. La combinación de estos síntomas a veces se denomina "síndrome de disfunción ejecutiva". Todos estos síntomas están relacionados con deficiencias en los circuitos corticoestiatiales que afectan a la corteza orbitofrontal, la corteza prefrontal dorsolateral y la corteza cingulada anterior. Como se discutió anteriormente, los estudios neuropatológicos han observado una degeneración gradual del estriado en dirección dorsal a ventral en pacientes con EH. Aunque las observaciones conductuales y cognitivas coinciden en parte con un deterioro progresivo de los circuitos córtico-estriados, los hallazgos sintomáticos parecen ser más difusos de lo esperado en base a las observaciones patológicas. El inicio y la progresión de los síntomas conductuales y cognitivos en la EH son altamente heterogéneos, lo que indica que el daño a las regiones del estriado puede ser más variable y generalizado en las primeras etapas de la EH de lo que se pensaba anteriormente. Esta visión está respaldada por la evidencia de varios estudios de imagen estructural (Thieben et al., 2002; Rosas et al., 2005; van den Bogaard y otros, 2011).
Riesgo y comportamiento patológico de juego en HD
Juego Patológico
Si bien muchas personas pueden apostar de forma recreativa, puede convertirse en un problema manifiesto para algunos, ya que desarrollan formas patológicas de este comportamiento. El juego patológico se caracteriza por un impulso excesivo de apostar a pesar de las claras consecuencias financieras, personales y profesionales negativas. Recientemente se ha clasificado como una adicción en el DSM-V, ya que se asemeja mucho a los trastornos por abuso de sustancias tanto en los criterios de diagnóstico como en la neuropatología (van Holst y otros, 2010; Clark y Goudriaan, 2012). El juego patológico será la primera y única "adicción conductual" reconocida dentro de la categoría "Adicción y trastornos relacionados ”. Sin embargo, debe observarse que existen diferencias entre la adicción a las sustancias psicoactivas y la adicción al juego. En primer lugar, satisfacer el deseo por las sustancias psicoactivas radica en consumir la sustancia de la que se conoce el efecto, mientras que satisfacer el deseo por el juego puede tener un resultado incierto, ya que el dinero se puede ganar o no, a menos que sea el acto del juego en sí mismo, por ejemplo. como una actividad emocionante. Por lo tanto, el juego patológico puede ser más heterogéneo a este respecto, y también tiene un resultado más incierto que el abuso de sustancias. Cabe señalar que la variabilidad del resultado, que incluye tanto las ganancias como las pérdidas, puede ser crucial para el desarrollo de la adicción al juego, ya que presenta un patrón variable de refuerzo intermitente, que es la forma más poderosa de condicionamiento instrumental / clásico (Sharpe, 2002; Fiorillo et al., 2003). En segundo lugar, las sustancias psicoactivas pueden cambiar más fuertemente la actividad en el cerebro y el sistema nervioso periférico que el juego, debido a su actividad farmacológica directa en varios sistemas de neurotransmisores, acelerando así los procesos adictivos, haciendo del abuso de sustancias una forma más poderosa de adicción.
Los mecanismos neurobiológicos subyacentes del juego son complejos e involucran a muchas regiones cerebrales y sistemas neurotransmisores diferentes (revisados en Raylu y Oei, 2002; Goudriaan et al., 2004; Potenza, 2013). La predisposición a la adicción se ha relacionado con un nivel reducido de receptores D2 de dopamina en el cuerpo estriado, que funcionan en un circuito de retroalimentación para inhibir una mayor liberación de dopamina. La hiperactividad resultante de las vías dopaminérgicas aumenta la sensibilidad a la recompensa, la motivación y el refuerzo positivo de la conducta adictiva (Volkow et al., 2002; Di Chiara y Bassareo, 2007). Los cambios motivacionales específicos que ocurren cuando se desarrolla el juego patológico incluyen una mayor motivación para apostar (van Holst y otros, 2012) y una mayor atención a los estímulos relacionados con el juego (Brevers et al., 2011a,b). Además, los jugadores patológicos han reducido el control cognitivo sobre el comportamiento en general, como lo ejemplifica la disminución del rendimiento en las tareas de inhibición de la respuesta, el aumento de la impulsividad y la preferencia por recompensas inmediatas con retraso en las tareas neurocognitivas (Goudriaan et al., 2004; Brevers et al., 2012a; Van den Bos y otros, 2013a).
Los jugadores patológicos tienen un desempeño deficiente en comparación con los controles en tareas formales de toma de decisiones de riesgo relacionadas con la recompensa (por ejemplo, Cavedini et al., 2002; Brand et al., 2005; Brevers et al., 2012b; revisión: Brevers et al., 2013). Este bajo rendimiento es independiente de si las tareas contienen reglas explícitas y estables para las ganancias y pérdidas, como la Tarea Juego de Dados (Brand et al., 2005) o si los sujetos tienen que aprender por ensayo y error qué opciones son ventajosas a largo plazo, como el IGT (Cavedini et al., 2002; Brevers et al., 2012b; mira la sección Toma de decisiones arriesgada por pacientes con EH en tareas de laboratorio para detalles de esta tarea). Sin embargo, la gravedad del juego estuvo más bien correlacionada con el rendimiento en las tareas de toma de decisiones en las que se desconoce la probabilidad de resultados (IGT) que con las tareas con reglas explícitas (Brevers et al., 2012b). Esta observación es interesante en vista del hecho de que en sujetos normales, la segunda mitad del IGT, cuando los sujetos han aprendido contingencias de tareas, es similar a las tareas con reglas explícitas. En conjunto, estos datos sugieren que, en el juego patológico, las deficiencias en la toma de decisiones pueden deberse tanto a la disminución del control ejecutivo, que se relaciona con reglas más explícitas, como al procesamiento de recompensa / castigo (emocional) perturbado, que está más relacionado con el juicio y la error de aprendizaje para evaluar el valor a largo plazo de las opciones (Van den Bos y otros, 2013a, 2014). Además, sugiere que las perturbaciones en este último pueden ser un factor predisponente a la escalada del comportamiento del juego.
De estos estudios queda claro que la predisposición neurobiológica para desarrollar un comportamiento patológico de juego implica alteraciones tanto en el circuito de control asociativo / cognitivo como en el circuito límbico (Van den Bos y otros, 2013a). Como resultado, los jugadores patológicos muestran un control cognitivo reducido, mayor impulsividad y mayor sensibilidad a la recompensa, todos los cuales son aspectos de la desinhibición conductual (Iacono et al., 2008). Sin embargo, la posibilidad de que una persona desarrolle una adicción en su vida también depende de muchos otros aspectos, como las experiencias de la vida temprana y los riesgos ambientales.
Juego Patológico en HD: Evidencia Epidemiológica
Con la creciente cantidad de posibilidades que ofrece Internet, también ha habido un aumento en las oportunidades de juego en línea tanto legales como ilegales en los últimos años. Estas actividades de juego fácilmente accesibles y, a menudo, no controladas pueden suponer un riesgo para cualquier persona que tenga una mayor susceptibilidad a la adicción al juego, pero que de lo contrario no se involucren en tales actividades (Griffiths, 2003). Los pacientes con EH son uno de los grupos en los que las apuestas por Internet pueden suponer un riesgo, ya que la desinhibición del comportamiento, una característica común en la enfermedad, es un factor importante en el desarrollo de adicciones (Iacono et al., 2008). De hecho, como se mencionó anteriormente, los pacientes con EH muestran varios signos de desinhibición, como irritabilidad, inhibición de la respuesta alterada y reconocimiento emocional reducido, en una etapa temprana de la enfermedad. Otros síntomas que se han observado en la EH, y que pueden influir en la capacidad de los pacientes para tomar decisiones racionales, son la inflexibilidad cognitiva, la perseverancia, el mal juicio y la autoconciencia reducida. Además de estas similitudes sintomáticas entre los pacientes con EH y los jugadores patológicos, ambos grupos muestran anomalías estructurales y funcionales en circuitos córtico-estriatales similares.
En vista de estas similitudes entre los jugadores patológicos y los pacientes con EH, podemos esperar que la incidencia de problemas de juego aumente entre los pacientes con EH en comparación con la población normal. Sin embargo, solo un estudio ha reportado casos de juego patológico en una familia italiana con EH (De Marchi et al., 1998). En esta familia, dos personas fueron diagnosticadas con juegos de azar patológicos alrededor de la edad de 18, mucho antes del inicio de los signos clínicos de la EH. Otros estudios epidemiológicos no han informado sobre este tema, aunque se ha demostrado que un deterioro en la toma de decisiones, la toma de riesgos y el mal juicio suponen un riesgo para los pacientes con EH que manejan importantes decisiones de vida y asuntos financieros (Klitzman et al., 2007; Shannon, 2011). De manera similar, los informes sobre temas relacionados, como el abuso de sustancias y la adicción al uso de Internet, faltan en la literatura actual sobre patología de la EH. En este momento, no está claro si la ausencia de informes de problemas de juego en la literatura sobre la EH se debe a la falta de atención a este fenómeno, o si realmente no existe una mayor prevalencia de juego patológico entre los pacientes con EH. Varias razones pueden explicar por qué tales problemas no se han reportado con más frecuencia. En primer lugar, incluso si la incidencia del juego patológico aumenta en la EH, es probable que esto solo afecte a un pequeño porcentaje de pacientes. En combinación con el hecho de que la población afectada de HD es limitada en número, esto puede hacer que los problemas de juego pasen inadvertidos como un problema específico en este grupo de pacientes. En segundo lugar, la falta de problemas con el juego en la EH puede estar relacionada con la incapacidad o la falta de voluntad de los pacientes para abandonar la casa debido a trastornos motores y signos frecuentes de apatía y depresión. Antes de la llegada de los juegos de azar por Internet, esto podría haber evitado que los pacientes de HD visitaran lugares de juego públicos como el casino. Finalmente, la adolescencia parece ser un período sensible para el desarrollo de problemas de juego (Van den Bos y otros, 2013a), mientras que la mayoría de los pacientes con EH no comienzan a mostrar síntomas relacionados con la desinhibición hasta más tarde en la vida. Sin embargo, con el aumento de las actividades de los adolescentes relacionadas con Internet, pueden adquirir formas de comportamiento recreativo, como el juego en línea, que se convierten en un problema cuando los síntomas de la EH se manifiestan más adelante en la vida. Por lo tanto, si bien el entorno en el que se encuentran los pacientes con EH susceptibles al juego puede que no haya promovido tal comportamiento en el pasado, está claro que un mayor acceso y disponibilidad de oportunidades de juego desde el hogar puede cambiar la prevalencia de problemas relacionados en la población con EH. .
Toma de decisiones arriesgada por pacientes con EH en tareas de laboratorio
Las tareas de laboratorio se usan comúnmente para evaluar anomalías cognitivas y de comportamiento en trastornos neurológicos. Para obtener información sobre los procesos y los impedimentos involucrados en la toma de decisiones y el comportamiento de riesgo, se han desarrollado varias tareas, incluida la IGT (Bechara et al., 1994) y la CGT (Rogers et al., 1999). En el IGT, a los participantes se les presentan cuatro barajas de cartas. Se les instruye a elegir las cartas de estos mazos, con las que pueden ganar o perder dinero; El objetivo de la tarea es ganar tanto dinero como sea posible. Las cubiertas difieren entre sí en la frecuencia y cantidad de ganancias y pérdidas. Dos de ellas son cubiertas “malas”, lo que lleva a una pérdida general a largo plazo, y dos son cubiertas “buenas”, lo que lleva a una ganancia general. Los participantes no reciben esta información, sin embargo, y necesitan descubrir qué cubiertas son más ventajosas durante los experimentos. Los participantes normales y saludables aprenden con éxito las reglas de la tarea después de una cierta cantidad de muestreo y, finalmente, comienzan a preferir las dos plataformas "buenas". Sin embargo, existen diferencias individuales significativas en el rendimiento incluso entre los participantes sanos, que incluyen, por ejemplo, claras diferencias de sexo (van den Bos y otros, 2013b). En la CGT, a los participantes se les presenta una fila de cajas 10 de dos colores diferentes, y deben tomar una decisión probabilística en qué caja de color se oculta un token. Luego deben apostar los puntos de crédito por su confianza en esta decisión. En esta tarea, toda la información relevante se presenta al participante durante el experimento, y las pruebas son independientes, lo que minimiza la memoria de trabajo y las demandas de aprendizaje. Ambas tareas de juego están bien establecidas, y el IGT se acepta como una simulación válida de la toma de decisiones en la vida real (Buelow y Suhr, 2009), mientras que la CGT es especialmente útil para estudiar la toma de decisiones fuera de un contexto de aprendizaje.
Los pacientes con EH han sido evaluados tanto en Iowa como en Cambridge Gambling Task. En un estudio con pacientes en estadio intermedio, Stout et al. (2001) encontró que el rendimiento en el IGT se redujo en comparación con los sujetos normales. La diferencia en el rendimiento se hizo evidente en la segunda parte de la tarea; donde los sujetos normalmente comienzan a mostrar una preferencia por los mazos buenos, los pacientes con EH continuaron haciendo selecciones frecuentes de los mazos malos. Esto sugiere que los pacientes con EH no aprendieron qué mazos eran ventajosos, o continuaron eligiendo tarjetas de los mazos malos a pesar de este conocimiento. Los autores notaron que varios participantes en la EH indicaron saber que algunas cubiertas eran desventajosas, pero aún así continuaron seleccionando tarjetas de esas barajas, lo que sugiere que los pacientes en la EH pueden aprender las reglas de la tarea, pero no pueden imponer un patrón de selección ventajoso y resistirse Respondiendo a los castigos y recompensas individuales. Sin embargo, se encontró que el rendimiento reducido estaba asociado con la memoria y la conceptualización deterioradas, lo que llevó a los autores a especular que los pacientes con EH pueden tener problemas para aprender o recordar las consecuencias a largo plazo de elegir las cartas de un mazo particular. Los pacientes con EH también obtuvieron puntuaciones más altas en la desinhibición que los controles sanos, pero esta medida no se correlacionó con el desempeño de la tarea. En un seguimiento de los mismos datos, Stout y sus colegas, compararon tres modelos de decisión cognitiva para explicar el déficit de rendimiento de los pacientes con EH, y encontraron que esto se explicaba mejor por los déficits en la memoria de trabajo y por los aumentos en la imprudencia y la impulsividad (Busemeyer y Stout, 2002). El rendimiento deficiente de los pacientes con HD en el IGT también puede estar relacionado con un impacto reducido de las pérdidas en estos pacientes, que se encontró al medir las respuestas de conductancia de la piel durante el IGT (Campbell et al., 2004). Este hallazgo es consistente con el reconocimiento deficiente de emociones negativas en pacientes con EH (Johnson et al., 2007; Ille et al., 2011), y sugiere que pueden ser menos sensibles a los castigos grandes y, por lo tanto, menos propensos a alejarse de los mazos de cartas malas. Especialmente la segunda parte del IGT requiere la capacidad de suprimir cursos de acción desventajosos en respuesta a los castigos, al tiempo que refuerza acciones rentables (de Visser et al., 2011; van den Bos y otros, 2013b, 2014).
Un número limitado de otros estudios han probado la toma de decisiones arriesgada en las primeras etapas de la EH, pero no encontraron dificultades de rendimiento en estos pacientes ni con el IGT ni con el CGT (Watkins y otros, 2000; Holl et al., 2013). Por lo tanto, parece que las deficiencias en la toma de decisiones y el riesgo de problemas de juego no se desarrollan hasta las etapas intermedias de la enfermedad. Sin embargo, estos estudios encontraron deficiencias en las tareas que requerían la planificación y la inhibición de respuestas prepotentes en pacientes con EH precoz. Por lo tanto, parece que los pacientes con EH primero desarrollan problemas sutiles con inhibición, planificación, reconocimiento emocional y memoria de trabajo. En algunos pacientes, esto ya puede llevar a problemas con el juicio y la toma de decisiones en las primeras etapas de la enfermedad, pero la mayoría de los pacientes con EH no tienen problemas con las tareas de toma de decisiones de riesgo hasta que alcanzan una etapa intermedia de la enfermedad.
Mecanismos neurobiológicos de la toma de decisiones en HD.
Vías neurobiológicas que subyacen a los procesos normales de toma de decisiones en el IGT.
Los mecanismos neurobiológicos que subyacen a los procesos de toma de decisiones en el IGT han sido bien estudiados y descritos (ver, por ejemplo, Bechara et al., 2000; Doya, 2008; de Visser et al., 2011; van den Bos y otros, 2013b, 2014). La ejecución normal de esta tarea requiere una interacción entre los circuitos córtico-estriado de control límbico y asociativo / cognitivo. Se piensa que la actividad en el circuito límbico es dominante durante la primera fase del IGT, durante la cual participa en conductas exploratorias, responde a recompensas y castigos, y aprende los valores afectivos de los resultados a corto y largo plazo de las decisiones en el país. tareaManes et al., 2002; Clark y Manes, 2004; Fellows y Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; Van den Bos y otros, 2014). El circuito de control asociativo / cognitivo, por otro lado, es más importante durante la segunda parte del IGT, cuando es necesario suprimir las respuestas impulsivas a las recompensas y los castigos por beneficios a largo plazo, reforzar patrones de comportamiento ventajosos y eliminar patrones desventajosos (Manes et al., 2002; Clark y Manes, 2004; Fellows y Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; Van den Bos y otros, 2014).
Anomalías neurobiológicas en los procesos de toma de decisiones IGT en HD
Dado que los procesos de toma de decisiones en el IGT implican una interacción de los circuitos córtico-estriado de control límbico y asociativo / cognitivo, no es sorprendente que los pacientes con EH se vean afectados en el desempeño de esta tarea. Una de las observaciones de Stout y sus colegas es que el impacto de la pérdida en la toma de decisiones se reduce en los pacientes con EH (Campbell et al., 2004). Esto es consistente con los hallazgos de que estos pacientes están afectados por el reconocimiento de emociones negativas y pueden explicarse por trastornos en la corteza orbitofrontal (Ille et al., 2011). La corteza orbitofrontal es importante para el procesamiento emocional y se activa en sujetos normales en respuesta a castigos y recompensas en una tarea de toma de decisiones (O'Doherty et al., 2001). Otro hallazgo por Stout et al. (2001) es que el rendimiento de los pacientes con HD en el IGT se correlaciona con una disminución de la conceptualización y las medidas de memoria a largo plazo en la Escala de Clasificación de la Demencia de Mattis. El hecho de no aprender o recordar qué plataformas son ventajosas a largo plazo puede estar asociado con una disminución de la actividad del circuito de control asociativo / cognitivo, que se requiere para la planificación a largo plazo y el control de impulsos (Manes et al., 2002; Clark y Manes, 2004; Fellows y Farah, 2005; Gleichgerrcht et al., 2010). Esto también es consistente con los déficits específicos de la vía indirecta en la EH, ya que un estudio reciente muestra que la vía indirecta es importante para la sensibilidad al castigo en una tarea de aprendizaje por refuerzo (Kravitz et al., 2012; Paton y Louie, 2012). La insensibilidad a las consecuencias futuras de una decisión también puede ser causada por una disfunción del córtex prefrontal ventromedial, ya que se observa una insensibilidad similar en pacientes con daño en esta área prefrontal (Bechara et al., 1994). Por lo tanto, la disminución en el rendimiento de los pacientes con HD en el IGT puede ser causada por una combinación de disfunciones en los circuitos corticoestriatales que involucran la corteza orbitofrontal, la corteza prefrontal ventromedial y la corteza prefrontal dorsolateral. Esto lleva a una menor capacidad de respuesta al castigo en la primera fase de la tarea, y al no saber qué mazos son ventajosos a largo plazo, planifique en consecuencia y suprima las respuestas impulsivas en la segunda fase del IGT.
Discusión
HD y el juego patológico: ¿cuáles son los riesgos?
El conjunto típico de síntomas motores, emocionales y cognitivos de la EH se debe a una atrofia estriatal progresiva que afecta a los diferentes circuitos córtico-estriados. Aunque el inicio y la progresión de los síntomas conductuales y cognitivos parecen ser altamente heterogéneos, los circuitos motores y cognitivos suelen verse afectados al principio de la enfermedad, mientras que el circuito límbico se ve afectado en una etapa posterior. Curiosamente, la predisposición neurobiológica al juego patológico y otras adicciones implica trastornos en los mismos circuitos córtico-estriados que se ven afectados en la EH. Sin embargo, a pesar de estas sorprendentes similitudes, en la literatura médica, la EH no se ha asociado con el juego patológico u otras conductas adictivas. Hasta ahora, solo un estudio ha descrito una familia en la que se presentaron problemas de juego en varios miembros de la familia afectados por la EH (De Marchi et al., 1998). Especulamos que los síntomas motores de los pacientes, así como su edad y entorno social, hasta ahora pueden haberles impedido desarrollar juegos patológicos, a pesar de su mayor susceptibilidad a tales problemas. Por otro lado, se puede esperar que la depresión diagnosticada con frecuencia aumente la impulsividad y el riesgo de problemas de juego, según los estudios de correlación (Clarke, 2006). Otra explicación de la falta de observaciones de los problemas de juego en la EH puede estar relacionada con las diferencias en la neuropatología subyacente. Si bien los trastornos cognitivos parecen ser muy similares entre los jugadores patológicos y los pacientes con EH, los cambios emocionales son de una naturaleza diferente. Los jugadores patológicos muestran principalmente una mayor sensibilidad a las recompensas, instándolos a comenzar y continuar jugando. Por otro lado, la EH se ha asociado con una disminución de la sensibilidad a los castigos y las emociones negativas. Esta diferencia puede ser una razón importante por la que los pacientes con EH no parecen tener una mayor tendencia a comenzar a apostar o participar en otras conductas adictivas y gratificantes.
Sin embargo, las alteraciones en el circuito córtico-estriado límbico de los pacientes con EH pueden promover una toma de decisiones arriesgada en situaciones con resultados inciertos, como se demuestra en el IGT (Doya, 2008). Además, la combinación de una menor sensibilidad al castigo, la incapacidad de inhibir las respuestas impulsivas a las recompensas inmediatas y la incapacidad de considerar las recompensas retrasadas a largo plazo y aplicar patrones de comportamiento ventajosos en consecuencia, hace que sea probable que los pacientes con HD desarrollen problemas de juego cuando se encuentren Situación que promueve tal comportamiento. Los problemas característicos de los pacientes con EH con cambios de estrategia y síntomas de inflexibilidad cognitiva y perseverancia pueden contribuir a la progresión del comportamiento patológico en estas situaciones. Por lo tanto, proponemos que los pacientes con EH no tienen una mayor tendencia a comenzar a apostar u otras conductas adictivas inherentes a su neuropatología, pero sí tienen un mayor riesgo de desarrollar una adicción una vez que participan en el juego. De acuerdo con esta idea, se ha observado que los pacientes con lesiones frontales se vuelven impulsivos y, a menudo, toman decisiones erróneas, pero no muestran un mayor comportamiento de riesgo (Miller, 1992; Bechara et al., 2000). Esto sugiere que el comportamiento deficiente en la toma de decisiones y la toma de riesgos o la búsqueda no necesariamente ocurren juntos, y que las diferentes combinaciones de perturbaciones del circuito de control límbico y asociativo / cognitivo pueden tener diferentes efectos en la toma de decisiones arriesgada y el comportamiento de juego. Nuestra hipótesis también explicaría por qué no se ha observado que los pacientes con EH se desempeñen peor en la CGT. Dado que toda la información sobre las posibilidades y los valores de ganancias y pérdidas está disponible desde el principio en esta tarea, es posible que los pacientes con EH no desarrollen estrategias desventajosas, ya que no están buscando riesgos de manera activa. Sin embargo, esto debería ser probado en pacientes con enfermedades más avanzadas.
Si los pacientes con EH tienen un mayor riesgo de desarrollar un comportamiento de juego patológico cuando se les presenta la situación adecuada, el aumento de oportunidades de acceso a Internet de fácil acceso puede suponer un riesgo específico para este grupo de pacientes. Incluso si no buscan activamente estas situaciones, los pacientes con EH ahora tienen muchas más probabilidades de encontrar oportunidades de juego que en el pasado. Esto es especialmente cierto para los pacientes que pasan la mayor parte del tiempo en casa debido a sus síntomas, donde Internet puede ser un medio importante para ocuparlos. Por lo tanto, una mayor probabilidad de involucrarse en el comportamiento del juego puede causar un aumento desproporcionado en los problemas relacionados en la población de HD. Sugerimos que los cuidadores estén conscientes de estos posibles riesgos y, preferiblemente, que intenten evitar que los pacientes con EH se involucren en actividades de juego (en línea). Además, argumentamos que los médicos deben evaluar regularmente el riesgo y la prevalencia de problemas relacionados con el juego en la población con HD, para poder brindar el tratamiento y la orientación adecuados a los pacientes y cuidadores.
Directrices para el futuro
Además de los estudios epidemiológicos para evaluar la prevalencia de los juegos de azar patológicos y otras adicciones en la EH, se pueden sugerir varias líneas de investigación para aumentar nuestra comprensión de los temas tratados en este documento. En primer lugar, sería interesante relacionar los déficits de rendimiento en el IGT directamente con las perturbaciones en la actividad córtico-estriada en pacientes con EH. Con este fin, los patrones de activación cerebral de los pacientes con EH pueden estudiarse con imágenes de resonancia magnética funcional mientras se realiza el IGT, y se pueden comparar con la actividad en sujetos normales. Se espera que la actividad en el cuerpo estriado, la corteza prefrontal dorsolateral y la corteza orbitofrontal disminuya en los pacientes con HD durante la toma de decisiones sobre el IGT.
Para estudiar los aspectos conductuales y neurobiológicos de la conducta de juego en la EH con más detalle, se pueden utilizar los modelos de enfermedad de roedores disponibles en la actualidad. En un nivel de comportamiento, se puede esperar que estos animales muestren una disminución del rendimiento en el IGT, similar a los pacientes humanos. Las versiones de roedores del IGT están disponibles (revisión: de Visser et al., 2011) y la participación de diferentes estructuras neuronales en estos modelos está bien caracterizada (de Visser et al., 2011; Van den Bos y otros, 2013a, 2014). Por lo tanto, tales experimentos son factibles y pueden combinarse con un análisis en profundidad de los cambios neuronales subyacentes en modelos de roedores de HD usando una variedad de técnicas. Además, con el advenimiento de métodos y herramientas de investigación más válidos y ecológicos para evaluar el desarrollo de comportamientos patológicos, el riesgo de desarrollar juegos de azar patológicos se puede estudiar bajo condiciones (semi) naturales en humanos y animalesVan den Bos y otros, 2013a). Juntos, estos estudios de síntomas relacionados con el juego y la neuropatología subyacente en pacientes humanos y modelos animales de HD nos brindarán una mejor comprensión de los riesgos relacionados con el juego (y posiblemente otras conductas adictivas) en HD, y mejorarán nuestra capacidad para proporcionar Tratamiento y orientación adecuados.
Declaracion de conflicto de interes
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Referencias
Abada, YK, Schreiber, R., y Ellenbroek, B. (2013). Déficits motores, emocionales y cognitivos en ratones BACHD adultos: un modelo para la enfermedad de Huntington. Behav. Brain Res. 238, 243 – 251. doi: 10.1016 / j.bbr.2012.10.039
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Albin, RL, Young, AB y Penney, JB (1989). La anatomía funcional de los trastornos de los ganglios basales. Tendencias Neurosci. 12, 366–375. doi: 10.1016/0166-2236(89)90074-x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Alexander, GE y Crutcher, MD (1990). Arquitectura funcional de los circuitos de ganglios basales: sustratos neurales de procesamiento paralelo. Tendencias Neurosci. 13, 266–271. doi: 10.1016/0166-2236(90)90107-l
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Alexander, GE, Crutcher, MD, y DeLong, MR (1990). Circuitos basales de los ganglios-talamocorticales: sustratos paralelos para funciones motoras, oculomotoras, "prefrontal" y "límbicas". Prog. Brain Res. 85, 119–146. doi: 10.1016/s0079-6123(08)62678-3
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Alexander, GE, DeLong, MR y Strick, PL (1986). Organización paralela de circuitos funcionalmente segregados que conectan los ganglios basales y la corteza. Annu. Rev. Neurosci. 9, 357 – 381. doi: 10.1146 / annurev.neuro.9.1.357
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Anderson, KE (2011). "Capítulo 2 - Enfermedad de Huntington", en Manual de Neurología Clínica., eds WJ Weiner y E. Tolosa, Hyperkinetic Motion Disorders (Londres: Elsevier), 15 – 24.
Bechara, A., Damasio, AR, Damasio, H. y Anderson, SW (1994). Insensibilidad a las consecuencias futuras después del daño a la corteza prefrontal humana. Cognición 50, 7–15. doi: 10.1016/0010-0277(94)90018-3
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Bechara, A., Damasio, H. y Damasio, AR (2000). Emoción, toma de decisiones y la corteza orbitofrontal. Cereb. Corteza 10, 295 – 307. doi: 10.1093 / cercor / 10.3.295
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Bittenbender, JB y Quadfasel, FA (1962). Formas rígidas y acinéticas de la corea de Huntington. Arco. Neurol. 7, 275 – 288. doi: 10.1001 / archneur.1962.04210040027003
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Blackmore, L., Simpson, SA y Crawford, JR (1995). Rendimiento cognitivo en una muestra del Reino Unido de personas presintomáticas portadoras del gen de la enfermedad de Huntington. J. Med. Gineta. 32, 358 – 362. doi: 10.1136 / jmg.32.5.358
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Bonelli, RM y Cummings, JL (2007). Circuito frontal-subcortical y comportamiento. Los diálogos de la clínica. Neurosci. 9, 141-151.
Brand, M., Kalbe, E., Labudda, K., Fujiwara, E., Kessler, J., y Markowitsch, HJ (2005). Deterioro en la toma de decisiones en pacientes con juego patológico. Res. Psiquiatría. 133, 91 – 99. doi: 10.1016 / j.psychres.2004.10.003
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Brevers, D., Bechara, A., Cleeremans, A. y Noël, X. (2013). Tarea de juego de Iowa (IGT): veinte años después: trastorno de juego e IGT. Frente. Psychol. 4: 665. doi: 10.3389 / fpsyg.2013.00665
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Criadores, D., Cleeremans, A., Bechara, A., Laloyaux, C., Kornreich, C., Verbanck, P., y col. (2011a). Curso en el tiempo del sesgo de atención para la información de juego en juegos de azar problemáticos. Psychol. Adicto. Behav. 25, 675 – 682. doi: 10.1037 / a0024201
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Criadores, D., Cleeremans, A., Goudriaan, AE, Bechara, A., Kornreich, C., Verbanck, P., y col. (2012b). La toma de decisiones bajo ambigüedad, pero no bajo riesgo, está relacionada con la gravedad del problema del juego. Res. Psiquiatría. 200, 568 – 574. doi: 10.1016 / j.psychres.2012.03.053
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Brevers, D., Cleeremans, A., Verbruggen, F., Bechara, A., Kornreich, C., Verbanck, P., y col. (2012a). La acción impulsiva, pero la elección impulsiva determina la gravedad del problema del juego. PLoS One. 7: e50647. doi: 10.1371 / journal.pone.0050647
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Criadores, D., Cleeremans, A., Tibboel, H., Bechara, A., Kornreich, C., Verbanck, P., y otros. (2011b). Reducido parpadeo de atención para estímulos relacionados con el juego en jugadores con problemas. J. Behav. El r. Exp. Psiquiatría 42, 265 – 269. doi: 10.1016 / j.jbtep.2011.01.005
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Buelow, MT y Suhr, JA (2009). Construir la validez de la tarea de juego iowa. Neuropsicol. Rdo. 19, 102–114. doi: 10.1007/s11065-009-9083-4
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Busemeyer, JR y Stout, JC (2002). Una contribución de los modelos de decisión cognitiva a la evaluación clínica: la descomposición del rendimiento en la tarea de juego de Bechara. Psychol. Evaluar. 14, 253 – 262. doi: 10.1037 / 1040-3590.14.3.253
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Caine, ED, y Shoulson, I. (1983). Síndromes psiquiátricos en la enfermedad de Huntington. A.m. J. Psiquiatría 140, 728-733.
Campbell, MC, Stout, JC y Finn, PR (2004). Reducción de la capacidad de respuesta autónoma a las pérdidas de tareas de juego en la enfermedad de Huntington. J. Int. Neuropsicol. Soc. 10, 239 – 245. doi: 10.1017 / s1355617704102105
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Cavedini, P., Riboldi, G., Keller, R., D'Annucci, A., y Bellodi, L. (2002). Disfunción del lóbulo frontal en pacientes con juego patológico. Biol. Psiquiatría 51, 334–341. doi: 10.1016/s0006-3223(01)01227-6
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Clark, L. y Goudriaan, AE (2012). "Neuroimagen en problemas de juego", en Enciclopedia de Comportamientos Adictivos, ed PM Miller (Londres: Elsevier).
Clark, L., y Manes, F. (2004). Toma de decisiones sociales y emocionales tras lesión del lóbulo frontal. Neurocase 10, 398 – 403. doi: 10.1080 / 13554790490882799
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Clarke, D. (2006). La impulsividad como mediadora en la relación entre la depresión y el problema del juego. Pers. Individuo Diferir de. 40, 5 – 15. doi: 10.1016 / j.paid.2005.05.008
Craufurd, D., Thompson, JC y Snowden, JS (2001). Cambios de comportamiento en la enfermedad de Huntington. Neuropsiquiatría Neuropsychol. Behav. Neurol. 14, 219-226.
de Boo, GM, Tibben, A., Lanser, JB, Jennekens-Schinkel, A., Hermans, J., Maat-Kievit, A., y otros. (1997). Los primeros síntomas cognitivos y motores en los portadores identificados del gen para la enfermedad de Huntington. Arco. Neurol. 54, 1353 – 1357. doi: 10.1001 / archneur.1997.00550230030012
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
De Marchi, N., Morris, M., Mennella, R., La Pia, S., y Nestadt, G. (1998). Asociación de trastorno obsesivo-compulsivo y juego patológico con la enfermedad de Huntington en un pedigrí italiano: posible asociación con la mutación de la enfermedad de Huntington. Acta Psychiatr. Scand. 97, 62–65. doi: 10.1111/j.1600-0447.1998.tb09964.x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
de Visser, L., Homberg, JR, Mitsogiannis, M., Zeeb, FD, Rivalan, M., Fitoussi, A., et al. (2011). Versiones en roedores de la tarea de juego de iowa: oportunidades y desafíos para la comprensión de la toma de decisiones. Frente. Neurosci. 5: 109. doi: 10.3389 / fnins.2011.00109
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Di Chiara, G., y Bassareo, V. (2007). Sistema de recompensa y adicción: lo que la dopamina hace y no hace. Curr. Opin. Pharmacol. 7, 69 – 76. doi: 10.1016 / j.coph.2007.02.001
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Dias, R., Robbins, TW y Roberts, AC (1996). Disociación en la corteza prefrontal de los cambios afectivos y atencionales. Naturaleza 380, 69 – 72. doi: 10.1038 / 380069a0
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Dodd, M., Klos, K., Bower, J., Geda, Y., Josephs, K., y Ahlskog, J. (2005). Juego patológico causado por medicamentos utilizados para tratar la enfermedad de Parkinson. Arco. Neurol. 62, 1377 – 1381. doi: 10.1001 / archneur.62.9.noc50009
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Doya, K. (2008). Moduladores de la toma de decisiones. Nat. Neurosci. 11, 410 – 416. doi: 10.1038 / nn2077
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, y Stout, JC (2007). Síntomas psiquiátricos en la enfermedad de Huntington antes del diagnóstico: el estudio predict-HD. Biol. Psiquiatría 62, 1341 – 1346. doi: 10.1016 / j.biopsych.2006.11.034
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, Wang, C., Stout, JC, et al. (2010b). Comportamientos "frontales" antes del diagnóstico de la enfermedad de Huntington y su relación con los marcadores de progresión de la enfermedad: evidencia de falta de conciencia temprana. J. Neuropsychiatry Clin. Neurosci. 22, 196 – 207. doi: 10.1176 / appi.neuropsych.22.2.196
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Duff, K., Paulsen, J., Mills, J., Beglinger, LJ, Moser, DJ, Smith, MM, et al. (2010a). Deterioro cognitivo leve en la enfermedad de Huntington prediagnosticada. Neurología 75, 500–507. doi: 10.1212/wnl.0b013e3181eccfa2
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Dumas, EM, van den Bogaard, SJ, Middelkoop, HA y Roos, RA (2013). Una revisión de la cognición en la enfermedad de Huntington. Frente. Biosci. (Schol. Ed.) 5, 1 – 18. doi: 10.2741 / s355
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Epping, EA, Mills, JA, Beglinger, LJ, Fiedorowicz, JG, Craufurd, D., Smith, MM, et al. (2013). Caracterización de la depresión en la enfermedad de Huntington prodromal en el estudio de los predictores neurobiológicos de la EH (PREDICT-HD). J. Psychiatr. Res. 47, 1423 – 1431. doi: 10.1016 / j.jpsychires.2013.05.026
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Faure, A., Höhn, S., Von Hörsten, S., Delatour, B., Raber, K., Le Blanc, P., y col. (2011). Procesamiento emocional y motivacional alterado en el modelo de rata transgénica para la enfermedad de Huntington. Neurobiol. Aprender. Mem. 95, 92 – 101. doi: 10.1016 / j.nlm.2010.11.010
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Fellows, LK, y Farah, MJ (2005). Diferentes deficiencias subyacentes en la toma de decisiones después del daño del lóbulo frontal ventromedial y dorsolateral en humanos. Cereb. Corteza 15, 58 – 63. doi: 10.1093 / cercor / bhh108
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Fielding, SA, Brooks, SP, Klein, A., Bayram-Weston, Z., Jones, L. y Dunnett, SB (2012). Perfiles de deterioro motor y cognitivo en el modelo de rata transgénica de la enfermedad de Huntington. Brain Res. Toro. 88, 223 – 236. doi: 10.1016 / j.brainresbull.2011.09.011
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Fink, KD, Rossignol, J., Crane, AT, Davis, KK, Bavar, AM, Dekorver, NW, y col. (2012). Disfunción cognitiva temprana en el modelo de rata transgénica HD 51 CAG de la enfermedad de Huntington. Behav. Neurosci. 126, 479 – 487. doi: 10.1037 / a0028028
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Fiorillo, CD, Tobler, PN y Schultz, W. (2003). Codificación discreta de la probabilidad de recompensa e incertidumbre por las neuronas de dopamina. Ciencia: 299, 1898 – 1902. doi: 10.1126 / science.1077349
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Folstein, SE, y Folstein, MF (1983). Características psiquiátricas de la enfermedad de Huntington: abordajes y hallazgos recientes. Psychiatr. Dev. 1, 193-205.
Foroud, T., Siemers, E., Kleindorfer, D., Bill, DJ, Hodes, ME, Norton, JA, y otros. (1995). Puntuaciones cognitivas en los portadores del gen de la enfermedad de Huntington en comparación con los no portadores. Ann. Neurol. 37, 657 – 664. doi: 10.1002 / ana.410370516
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Giordani, B., Berent, S., Boivin, MJ, Penney, JB, Lehtinen, S., Markel, DS, y col. (1995). Análisis neuropsicológico y de enlace genético longitudinal de personas en riesgo de enfermedad de Huntington. Arco. Neurol. 52, 59 – 64. doi: 10.1001 / archneur.1995.00540250063014
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Gleichgerrcht, E., Ibáñez, A., Roca, M., Torralva, T., y Manes, F. (2010). Toma de decisiones cognitivas en enfermedades neurodegenerativas. Nat. Rev. Neurol. 6, 611 – 623. doi: 10.1038 / nrneurol.2010.148
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Goudriaan, AE, Oosterlaan, J., de Beurs, E., y Van den Brink, W. (2004). Juego patológico: una revisión exhaustiva de los hallazgos del comportamiento biológico. Neurosci. Biobehav. Rdo. 28, 123 – 141. doi: 10.1016 / j.neubiorev.2004.03.001
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Graybiel, AM, Aosaki, T., Flaherty, AW y Kimura, M. (1994). Los ganglios basales y el control motor adaptativo. Ciencia: 265, 1826 – 1831. doi: 10.1126 / science.8091209
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Griffiths, M. (2003). El juego en internet: problemas, inquietudes y recomendaciones. Cyberpsychol. Behav. 6, 557 – 568. doi: 10.1089 / 109493103322725333
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Grimbergen, YAM, Knol, MJ, Bloem, BR, Kremer, BPH, Roos, RAC y Munneke, M. (2008). Caídas y trastornos de la marcha en la enfermedad de Huntington. Mov. Disord. 23, 970 – 976. doi: 10.1002 / mds.22003
Haber, SN y Knutson, B. (2010). El circuito de recompensa: vincula la anatomía de los primates y las imágenes humanas. Neuropsicofarmacología 35, 4 – 26. doi: 10.1038 / npp.2009.129
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Hadzi, TC, Hendricks, AE, Latourelle, JC, Lunetta, KL, Cupples, LA, Gillis, T., et al. (2012). Evaluación de la afectación cortical y estriatal en los cerebros de la enfermedad de Huntington 523. Neurología 79, 1708–1715. doi: 10.1212/wnl.0b013e31826e9a5d
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Hahn-Barma, V., Deweer, B., Dürr, A., Dodé, C., Feingold, J., Pillon, B., et al. (1998). ¿Son los cambios cognitivos los primeros síntomas de la enfermedad de Huntington? Un estudio de portadores de genes. J. Neurol. Neurosurg. Psiquiatría 64, 172 – 177. doi: 10.1136 / jnnp.64.2.172
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Hamilton, JM, Salmon, DP, Corey-Bloom, J., Gamst, A., Paulsen, JS, Jerkins, S., y col. (2003). Las anomalías de comportamiento contribuyen al deterioro funcional en la enfermedad de Huntington. J. Neurol. Neurosurg. Psiquiatría 74, 120 – 122. doi: 10.1136 / jnnp.74.1.120
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Hansotia, P., Cleeland, CS, y Chun, RW (1968). Corea de Huntington juvenil. Neurología 18, 217-224.
Heemskerk, A.-W., y Roos, RAC (2011). Disfagia en la enfermedad de Huntington: una revisión. Disfagia 26, 62–66. doi: 10.1007/s00455-010-9302-4
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Henley, SMD, Wild, EJ, Hobbs, NZ, Warren, JD, Frost, C., Scahill, RI, et al. (2008). El reconocimiento de emociones defectuosas en la HD temprana es neuropsicológica y anatómicamente genérica. Neuropsychologia 46, 2152 – 2160. doi: 10.1016 / j.neuropsychologia.2008.02.025
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Holl, AK, Wilkinson, L., Tabrizi, SJ, Painold, A. y Jahanshahi, M. (2013). Disfunción ejecutiva selectiva pero toma de decisiones intacta y arriesgada en la enfermedad de Huntington temprana. Mov. Disord. 28, 1104 – 1109. doi: 10.1002 / mds.25388
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Hoth, KF, Paulsen, JS, Moser, DJ, Tranel, D., Clark, LA y Bechara, A. (2007). Los pacientes con enfermedad de Huntington tienen una conciencia deficiente de las capacidades cognitivas, emocionales y funcionales. J. Clin. Exp. Neuropsicol. 29, 365 – 376. doi: 10.1080 / 13803390600718958
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Iacono, WG, Malone, SM y McGue, M. (2008). Desinhibición del comportamiento y el desarrollo de la adicción de inicio temprano: influencias comunes y específicas. Annu. Rev. Clin. Psychol. 4, 325 – 348. doi: 10.1146 / annurev.clinpsy.4.022007.141157
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Ille, R., Schäfer, A., Scharmüller, W., Enzinger, C., Schöggl, H., Kapfhammer, HP, y col. (2011). Reconocimiento de emociones y experiencia en la enfermedad de Huntington: un estudio de morfometría basado en voxel. J. Psiquiatría Neurosci. 36, 383 – 390. doi: 10.1503 / jpn.100143
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Jason, GW, Pajurkova, EM, Suchowersky, O., Hewitt, J., Hilbert, C., Reed, J., y otros. (1988). Deterioro neuropsicológico presintomático en la enfermedad de Huntington. Arco. Neurol. 45, 769 – 773. doi: 10.1001 / archneur.1988.00520310079021
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Johnson, SA, Stout, JC, Solomon, AC, Langbehn, DR, Aylward, EH, Cruce, CB, et al., Y Predict-HD Investigators del Huntington Study Group (2007). Más allá de la repugnancia: deterioro en el reconocimiento de emociones negativas antes del diagnóstico en la enfermedad de Huntington. Cerebro 130, 1732 – 1744. doi: 10.1093 / cerebro / awm107
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Jones, L., y Hughes, A. (2011). “Mecanismos patógenos en la enfermedad de Huntington”, en Revista Internacional de Neurobiología, eds J. Brotchie, E. Bezard y P. Jenner, Fisiopatología, Farmacología y Bioquímica de la discinesia (Londres: Academic Press), 373 – 418.
Josiassen, RC, Curry, LM y Mancall, EL (1983). Desarrollo de déficits neuropsicológicos en la enfermedad de Huntington. Arco. Neurol. 40, 791 – 796. doi: 10.1001 / archneur.1983.04050120041005
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Julien, CL, Thompson, JC, Wild, S., Yardumian, P., Snowden, JS, Turner, G., et al. (2007). Trastornos psiquiátricos en la enfermedad de Huntington preclínica. J. Neurol. Neurosurg. Psiquiatría 78, 939 – 943. doi: 10.1136 / jnnp.2006.103309
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Kassubek, J., Juengling, FD, Kioschies, T., Henkel, K., Karitzky, J., Kramer, B., y col. (2004). Topografía de la atrofia cerebral en la enfermedad de Huntington temprana: un estudio morfométrico de IRM basado en voxel. J. Neurol. Neurosurg. Psiquiatría 75, 213 – 220. doi: 10.1136 / jnnp.2002.009019
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Kirkwood, SC, Siemers, E., Stout, JC, Hodes, ME, Conneally, PM, Christian, JC, et al. (1999). Cambios cognitivos y motores longitudinales entre portadores de genes presintomáticos de la enfermedad de Huntington. Arco. Neurol. 56, 563 – 568. doi: 10.1001 / archneur.56.5.563
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Kirkwood, SC, Su, JL, Conneally, P. y Foroud, T. (2001). Progresión de los síntomas en las etapas iniciales y medias de la enfermedad de Huntington. Arco. Neurol. 58, 273 – 278. doi: 10.1001 / archneur.58.2.273
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Klitzman, R., Thorne, D., Williamson, J., Chung, W., y Marder, K. (2007). Toma de decisiones sobre las opciones reproductivas entre individuos en riesgo de contraer la enfermedad de Huntington. J. Genet. Contables. 16, 347–362. doi: 10.1007/s10897-006-9080-1
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Klöppel, S., Stonnington, CM, Petrovic, P., Mobbs, D., Tüscher, O., Craufurd, D., et al. (2010). Irritabilidad en la enfermedad de Huntington preclínica. Neuropsychologia 48, 549 – 557. doi: 10.1016 / j.neuropsychologia.2009.10.016
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Koller, WC y Trimble, J. (1985). La anormalidad de la marcha de la enfermedad de Huntington. Neurología 35, 1450 – 1454. doi: 10.1212 / wnl.35.10.1450
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Kravitz, AV, Tye, LD y Kreitzer, AC (2012). Distintos roles para las neuronas del estriado de la vía directa e indirecta en el refuerzo. Nat. Neurosci. 15, 816 – 818. doi: 10.1038 / nn.3100
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Labuschagne, I., Jones, R., Callaghan, J., Whitehead, D., Dumas, EM, Say, MJ, et al. (2013). Los déficits emocionales de reconocimiento facial y los efectos de la medicación en la manifestación previa a la enfermedad de Huntington en estadio II. Res. Psiquiatría. 207, 118 – 126. doi: 10.1016 / j.psychres.2012.09.022
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Lange, KW, Sahakian, BJ, Quinn, NP, Marsden, CD, y Robbins, TW (1995). Comparación de la función ejecutiva y la memoria visuoespacial en la enfermedad de Huntington y la demencia de tipo Alzheimer combinada para el grado de demencia. J. Neurol. Neurosurg. Psiquiatría 58, 598 – 606. doi: 10.1136 / jnnp.58.5.598
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Lawrence, AD, Sahakian, BJ, Hodges, JR, Rosser, AE, Lange, KW y Robbins, TW (1996). Funciones ejecutivas y mnemónicas en la enfermedad de Huntington temprana. Cerebro 119, 1633 – 1645. doi: 10.1093 / cerebro / 119.5.1633
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Li, SH y Li, XJ (2004). Interacciones Huntingtin-proteína y la patogénesis de la enfermedad de Huntington. Tendencias genet. 20, 146 – 154. doi: 10.1016 / j.tig.2004.01.008
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Louis, ED, Lee, P., Quinn, L., y Marder, K. (1999). Distonía en la enfermedad de Huntington: prevalencia y características clínicas. Mov. Disord. 14, 95–101. doi: 10.1002/1531-8257(199901)14:1<95::aid-mds1016>3.0.co;2-8
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Lyketsos, CG, Rosenblatt, A. y Rabins, P. (2004). Síndrome del lóbulo frontal olvidado o "Síndrome de disfunción ejecutiva". Psicosomática 45, 247 – 255. doi: 10.1176 / appi.psy.45.3.247
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
MacDonald, ME, et al., Y el Grupo de Investigación Colaborativa de la Enfermedad de Huntington (1993). Un nuevo gen que contiene una repetición de trinucleótidos que se expande e inestable en los cromosomas de la enfermedad de Huntington. Celular 72, 971–983. doi: 10.1016/0092-8674(93)90585-e
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Manes, F., Sahakian, B., Clark, L., Rogers, R., Antoun, N., Aitken, M., y otros. (2002). Procesos de toma de decisiones tras el daño a la corteza prefrontal. Cerebro 125, 624 – 639. doi: 10.1093 / cerebro / awf049
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
McAlonan, K., y Brown, VJ (2003). El córtex prefrontal orbital media el aprendizaje de inversión y no el cambio de atención en la rata. Behav. Brain Res. 146, 97 – 103. doi: 10.1016 / j.bbr.2003.09.019
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Miller, LA (1992). Impulsividad, toma de riesgos y la capacidad de sintetizar información fragmentada después de la lobectomía frontal. Neuropsychologia 30, 69–79. doi: 10.1016/0028-3932(92)90015-e
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Newman, JP (1987). Reacción al castigo en extravertidos y psicópatas: implicaciones para el comportamiento impulsivo de individuos desinhibidos. J. Res. Pers. 21, 464–480. doi: 10.1016/0092-6566(87)90033-x
O'Doherty, J., Kringelbach, ML, Rolls, ET, Hornak, J., y Andrews, C. (2001). Representaciones abstractas de recompensa y castigo en la corteza orbitofrontal humana. Nat. Neurosci. 4, 95 – 102. doi: 10.1038 / 82959
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Papp, KV, Kaplan, RF y Snyder, PJ (2011). Marcadores biológicos de la cognición en la enfermedad de Huntington prodrómica: una revisión. Cognición cerebral. 77, 280 – 291. doi: 10.1016 / j.bandc.2011.07.009
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Paradiso, S., Turner, BM, Paulsen, JS, Jorge, R., Ponto, LLB y Robinson, RG (2008). Bases neurales de la disforia en la enfermedad de Huntington temprana. Res. Psiquiatría. 162, 73 – 87. doi: 10.1016 / j.pscychresns.2007.04.001
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Paton, JJ y Louie, K. (2012). Recompensa y castigo iluminados. Nat. Neurosci. 15, 807 – 809. doi: 10.1038 / nn.3122
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Paulsen, JS, Langbehn, DR, Stout, JC, Aylward, E., Ross, CA, Nance, M., y col. (2008). Detección de la enfermedad de Huntington décadas antes del diagnóstico: el estudio predict-HD. J. Neurol. Neurosurg. Psiquiatría 79, 874 – 880. doi: 10.1136 / jnnp.2007.128728
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Peltsch, A., Hoffman, A., Armstrong, I., Pari, G., y Munoz, DP (2008). Alteraciones sacádicas en la enfermedad de Huntington. Exp. Brain Res. 186, 457–469. doi: 10.1007/s00221-007-1248-x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Potenza, MN (2013). Neurobiología de las conductas de juego. Curr. Opin. Neurobiol. 23, 660 – 667. doi: 10.1016 / j.conb.2013.03.004
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Ramig, LA (1986). Análisis acústicos de la fonación en pacientes con enfermedad de Huntington. Informe preliminar. Ana. Otol. Rhinol. Laryngol. 95, 288-293.
Raylu, N. y Oei, TPS (2002). Juego patológico. Una revisión exhaustiva. Clinica Psychol. Rdo. 22, 1009–1061. doi: 10.1016/S0272-7358(02)00101-0
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Reiner, A., Dragatsis, I., y Dietrich, P. (2011). “Genética y neuropatología de la enfermedad de Huntington”, en Revista Internacional de Neurobiología, eds J. Brotchie, E. Bezard y P. Jenner, Fisiopatología, Farmacología y Bioquímica de la discinesia (Londres: Academic Press), 325 – 372.
Rogers, RD, Everitt, BJ, Baldacchino, A., Blackshaw, AJ, Swainson, R., Wynne, K., et al. (1999). Déficits disociables en el proceso de toma de decisiones de los consumidores crónicos de anfetaminas, los adictos a los opiáceos, los pacientes con daño focal en la corteza prefrontal y los voluntarios normales con insuficiencia de triptófano: evidencia de mecanismos monoaminérgicos. Neuropsicofarmacología 20, 322–339. doi: 10.1016/s0893-133x(98)00091-8
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Roos, RA (2010). La enfermedad de Huntington: una revisión clínica. Orphanet J. Rare Dis. 5:40. doi: 10.1186/1750-1172-5-40
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Rosas, HD, Hevelone, ND, Zaleta, AK, Greve, DN, Salat, DH, y Fischl, B. (2005). Adelgazamiento cortical regional en la enfermedad de Huntington preclínica y su relación con la cognición. Neurología 65, 745 – 747. doi: 10.1212 / 01.wnl.0000174432.87383.87
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Rosenblatt, A. (2007). Neuropsiquiatría de la enfermedad de Huntington. Los diálogos de la clínica. Neurosci. 9, 191-197.
Rothlind, JC, Bylsma, FW, Peyser, C., Folstein, SE y Brandt, J. (1993). Correlaciones cognitivas y motoras del funcionamiento diario en la enfermedad de Huntington temprana. J. Nerv. Ment Dis. 181, 194–199. doi: 10.1097/00005053-199303000-00008
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Rushworth, MFS, Behrens, TEJ, Rudebeck, PH y Walton, ME (2007). Roles contrastantes para la corteza cingulada y orbitofrontal en las decisiones y el comportamiento social. Tendencias Cogn. Sci. 11, 168 – 176. doi: 10.1016 / j.tics.2007.01.004
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Sánchez-Castañeda, C., Cherubini, A., Elifani, F., Péran, P., Orobello, S., Capelli, G., y otros. (2013). En busca de biomarcadores de la enfermedad de Huntington por medio de imágenes multimodales y transversales de los ganglios basales. Tararear. Cerebro Mapp. 34, 1625 – 1635. doi: 10.1002 / hbm.22019
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Sesack, SR, y Grace, AA (2010). Red de recompensa de ganglios cortico-basales: microcircuitos. Neuropsicofarmacología 35, 27 – 47. doi: 10.1038 / npp.2009.93
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Shannon, KM (2011). "Capítulo 1 - Enfermedad de Huntington - signos clínicos, síntomas, diagnóstico y diagnóstico presintomático", en Manual de Neurología Clínica., eds WJ Weiner y E. Tolosa, Hyperkinetic Motion Disorders (Londres: Elsevier), 3 – 13.
Sharpe, L. (2002). Un modelo cognitivo-conductual reformulado del problema del juego. Una perspectiva biopsicosocial. Clinica Psychol. Rdo. 22, 1–25. doi: 10.1016/s0272-7358(00)00087-8
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Shiwach, R. (1994). Psicopatología en pacientes con enfermedad de Huntington. Acta Psychiatr. Scand. 90, 241–246. doi: 10.1111/j.1600-0447.1994.tb01587.x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Smith, MA, Brandt, J. y Shadmehr, R. (2000). El trastorno motor en la enfermedad de Huntington comienza como una disfunción en el control de retroalimentación de error. Naturaleza 403, 544 – 549. doi: 10.1038 / 35000576
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Snell, RG, MacMillan, JC, Cheadle, JP, Fenton, I., Lazarou, LP, Davies, P., y otros. (1993). Relación entre la expansión de la repetición de trinucleótidos y la variación fenotípica en la enfermedad de Huntington. Nat.. Genet. 4, 393 – 397. doi: 10.1038 / ng0893-393
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Stine, OC, Pleasant, N., Franz, ML, Abbott, MH, Folstein, SE y Ross, CA (1993). Correlación entre la edad de inicio de la enfermedad de Huntington y la duración de la repetición del trinucleótido en IT-15. Tararear. Mol. Gineta. 2, 1547 – 1549. doi: 10.1093 / hmg / 2.10.1547
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Stout, JC, Paulsen, JS, Queller, S., Solomon, AC, Whitlock, KB, Campbell, JC, et al. (2011). Signos neurocognitivos en la enfermedad de Huntington prodrómica. Neuropsicología 25, 1 – 14. doi: 10.1037 / a0020937
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Stout, JC, Rodawalt, WC y Siemers, ER (2001). Toma de decisiones arriesgada en la enfermedad de Huntington. J. Int. Neuropsicol. Soc. 7, 92 – 101. doi: 10.1017 / S1355617701711095
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Tabrizi, SJ, Langbehn, DR, Leavitt, BR, Roos, RA, Durr, A., Craufurd, D., y col. (2009). Manifestaciones biológicas y clínicas de la enfermedad de Huntington en el estudio longitudinal TRACK-HD: análisis transversal de datos de referencia. Lancet Neurol. 8, 791–801. doi: 10.1016/S1474-4422(09)70170-X
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Tekin, S., y Cummings, JL (2002). Circuitos neuronales frontal-subcorticales y neuropsiquiatría clínica: una actualización. J. Psychosom. Res. 53, 647–654. doi: 10.1016/s0022-3999(02)00428-2
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Thieben, MJ, Duggins, AJ, Good, CD, Gomes, L., Mahant, N., Richards, F., et al. (2002). La distribución de la neuropatología estructural en la enfermedad de Huntington pre-clínica. Cerebro 125, 1815 – 1828. doi: 10.1093 / cerebro / awf179
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Tian, J., Herdman, SJ, Zee, DS y Folstein, SE (1992). Estabilidad postural en pacientes con enfermedad de Huntington. Neurología 42, 1232 – 1238. doi: 10.1212 / wnl.42.6.1232
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Unschuld, PG, Joel, SE, Pekar, JJ, Reading, SA, Oishi, K., McEntee, J., et al. (2012). Los síntomas depresivos en la enfermedad de Huntington prodromal se correlacionan con la conectividad funcional relacionada con la interferencia del stroop en la corteza prefrontal ventromedial. Res. Psiquiatría. 203, 166 – 174. doi: 10.1016 / j.pscychresns.2012.01.002
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van den Bogaard, SJ, Dumas, EM, Acharya, TP, Johnson, H., Langbehn, DR, Scahill, RI, y otros. (2011). Atrofia temprana del núcleo pálido y accumbens en la enfermedad de Huntington. J. Neurol. 258, 412–420. doi: 10.1007/s00415-010-5768-0
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van den Bos, R., Davies, W., Dellu-Hagedorn, F., Goudriaan, AE, Granon, S., Homberg, J., et al. (2013a). Enfoques entre especies para el juego patológico: una revisión que aborda las diferencias de sexo, la vulnerabilidad de los adolescentes y la validez ecológica de las herramientas de investigación. Neurosci. Biobehav. Rdo. 37, 2454 – 2471. doi: 10.1016 / j.neubiorev.2013.07.005
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van den Bos, R., Homberg, J. y de Visser, L. (2013b). Una revisión crítica de las diferencias de sexo en las tareas de toma de decisiones: centrarse en la tarea de juego de iowa. Behav. Brain Res. 238, 95 – 108. doi: 10.1016 / j.bbr.2012.10.002
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van den Bos, R., Koot, S. y de Visser, L. (2014). Una versión para roedores de la tarea de juego de iowa: 7 años de progreso. Frente. Psychol. 5: 203.doi: 10.3389 / fpsyg.2014.00203
van Duijn, E., Kingma, EM y van der Mast, RC (2007). Psicopatología en portadores del gen de la enfermedad de Huntington verificados. J. Neuropsychiatry Clin. Neurosci. 19, 441 – 448. doi: 10.1176 / appi.neuropsych.19.4.441
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van Duijn, E., Reedeker, N., Giltay, EJ, Eindhoven, D., Roos, RAC y van der Mast, RC (2014). Curso de irritabilidad, depresión y apatía en la enfermedad de Huntington en relación con los síntomas motores durante un período de seguimiento de dos años. Neurodegenerador. Dis. 13, 9 – 16. doi: 10.1159 / 000343210
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van Holst, RJ, van den Brink, W., Veltman, DJ y Goudriaan, AE (2010). Por qué los jugadores no pueden ganar: una revisión de los hallazgos cognitivos y de neuroimagen en el juego patológico. Neurosci. Biobehav. Rdo. 34, 87 – 107. doi: 10.1016 / j.neubiorev.2009.07.007
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
van Holst, RJ, Veltman, DJ, Büchel, C., Van den Brink, W., y Goudriaan, AE (2012). Codificación de la expectativa distorsionada en problemas de juego: ¿es la adicción en la anticipación? Biol. Psiquiatría 71, 741 – 748. doi: 10.1016 / j.biopsych.2011.12.030
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Verny, C., Allain, P., Prudean, A., Malinge, MC, Gohier, B., Scherer, C., y col. (2007). Cambios cognitivos en portadores asintomáticos del gen de mutación de la enfermedad de Huntington. EUR. J. Neurol. 14, 1344 – 1350. doi: 10.1111 / j.1468-1331.2007.01975.x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Volkow, ND, Fowler, JS y Wang, GJ (2002). El papel de la dopamina en el refuerzo de drogas y la adicción en humanos: resultados de estudios de imagen. Behav. Pharmacol. 13, 355–366. doi: 10.1097/00008877-200209000-00008
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Vonsattel, JP, y DiFiglia, M. (1998). Enfermedad de Huntington. J. Neuropathol. Exp. Neurol. 57, 369–384. doi: 10.1097/00005072-199805000-00001
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Vonsattel, JPG, Keller, C. y Cortes Ramirez, EP (2011). Capítulo 4 - Enfermedad de Huntington - neuropatología ”en Manual de Neurología Clínica., eds W. Weiner y E. Tolosa, Hiperkinetic Motion Disorders (Londres: Elsevier), 83 – 100.
Vonsattel, JPG (2008). Modelos de enfermedad de Huntington y neuropatología humana: similitudes y diferencias. Acta Neuropathol. 115, 55–69. doi: 10.1007/s00401-007-0306-6
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Watkins, LHA, Rogers, RD, Lawrence, AD, Sahakian, BJ, Rosser, AE y Robbins, TW (2000). Planificación deficiente pero toma de decisiones intactas a principios de la enfermedad de Huntington: implicaciones para patología fronto-estriada específica. Neuropsychologia 38, 1112–1125. doi: 10.1016/s0028-3932(00)00028-2
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Weintraub, D., Papay, K., Siderowf, A. y la Iniciativa de Marcadores de Progresión del Parkinson. (2013). Detección de síntomas de control de impulsos en pacientes con enfermedad de Parkinson de novo: un estudio de casos y controles. Neurología 80, 176–180. doi: 10.1212/wnl.0b013e31827b915c
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Witjas, T., Eusebio, A., Fluchère, F., y Azulay, JP (2012). Comportamientos adictivos y enfermedad de Parkinson. Rev. Neurol. (París) 168, 624 – 633. doi: 10.1016 / j.neurol.2012.06.014
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Wolf, RC, Vasic, N., Schönfeldt-Lecuona, C., Landwehrmeyer, GB, y Ecker, D. (2007). Disfunción de la corteza prefrontal dorsolateral en la enfermedad de Huntington presintomática: evidencia de IRMf relacionada con eventos. Cerebro 130, 2845 – 2857. doi: 10.1093 / cerebro / awm210
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Yin, HH y Knowlton, BJ (2006). El papel de los ganglios basales en la formación del hábito. Nat. Rev. Neurosci. 7, 464 – 476. doi: 10.1038 / nrn1919
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Yin, HH, Ostlund, SB y Balleine, BW (2008). Aprendizaje guiado por la recompensa más allá de la dopamina en el núcleo accumbens: las funciones integradoras de las redes de ganglios cortico-basales. EUR. J. Neurosci. 28, 1437 – 1448. doi: 10.1111 / j.1460-9568.2008.06422.x
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Young, AB, Shoulson, I., Penney, JB, Starosta-Rubinstein, S., Gomez, F., Travers, H., y otros. (1986). Enfermedad de Huntington en Venezuela. Características neurológicas y deterioro funcional. Neurología 36, 244 – 249. doi: 10.1212 / WNL.36.2.244
Resumen Pubmed | PubMed texto completo | Texto completo de CrossRef
Palabras clave: enfermedad de Huntington, riesgo, juegos de azar, corteza prefrontal, ganglios basales, desinhibición
Cita: Kalkhoven C, Sennef C, Peeters A y van den Bos R (2014) Comportamiento de riesgo y juego patológico en la enfermedad de Huntington. Frente. Behav. Neurosci. 8: 103. doi: 10.3389 / fnbeh.2014.00103
Recibido: 30 Noviembre 2013; Trabajo pendiente publicado: 18 Enero 2014;
Aceptado: 12 marzo 2014; Publicado en línea: 02 Abril 2014.
Editado por:
Patrick Anselme, Universidad de Lieja, Bélgica
Revisado por:
Damien Brevers, Université Libre de Bruxelles, Bélgica
Bryan F. SingerUniversidad de Michigan, EE.UU.
