La disfunción eréctil (DE) es común con el envejecimiento. Anteriormente, el tratamiento para la disfunción eréctil se ofrecía principalmente por parte de los urólogos, pero la aprobación y el uso generalizado de inhibidores de la fosfodiesterasa ha permitido a los médicos de atención primaria proporcionar tratamiento dirigido contra la disfunción eréctil. Aunque grandes ensayos clínicos multicéntricos han demostrado eficacia y seguridad con estos medicamentos, no son efectivos en 30 a 35% de los hombres, pueden causar efectos secundarios y no mejoran la patología subyacente. Una comprensión profunda de la fisiología eréctil y las causas de la disfunción eréctil y un plan de tratamiento integral que aborde todos los factores contribuyentes pueden ser más efectivos que el tratamiento farmacéutico y pueden mejorar aspectos de la salud psicológica y física más allá de los problemas eréctiles.
La disfunción eréctil (DE), la incapacidad de desarrollar y mantener una erección lo suficientemente firme como para penetrar, es común con el envejecimiento. Aproximadamente el 40% de los hombres de 40 años y el 70% de los hombres de 70 años tienen alguna forma de disfunción eréctil.1 La disfunción eréctil está asociada con múltiples afecciones físicas, puede ser un precursor de enfermedades metabólicas o vasculares y afecta la salud psicosocial. Los inhibidores de la fosfodiesterasa tipo 5 (PDE5i) son el tratamiento de primera línea más común para la disfunción eréctil. Grandes ensayos clínicos multicéntricos han demostrado eficacia y seguridad con estos medicamentos; sin embargo, son ineficaces en 30 a 35% de los pacientes,2 puede causar efectos secundarios y no mejorar la patología subyacente. El tratamiento integral para la disfunción eréctil que se centra en todos los factores contribuyentes puede ser más efectivo que el tratamiento farmacéutico y puede mejorar aspectos de la salud psicológica y física más allá de los problemas eréctiles.
La disfunción eréctil se produce a partir de mecanismos complejos multifactoriales que involucran los sistemas nervioso, vascular y endocrino. Una revisión básica de la anatomía y la fisiología de las erecciones proporcionará un marco para comprender la fisiopatología y la justificación de las opciones de tratamiento (Figura 1 y XNUMX) La estructura del pene consta de dos cilindros de tejido vascular (cuerpos cavernosos) que corren a lo largo del eje del pene junto con el cuerpo esponjoso que rodea la uretra. El tejido del pene está inervado por aspectos autónomos (simpáticos y parasimpáticos) y somáticos (sensoriales y motores) del sistema nervioso periférico. Los nervios simpáticos surgen de T11 a L2 y son anti-eréctiles, controlando la eyaculación y la detumescencia. Los nervios parasimpáticos surgen de S2 a S4 y son pro-eréctiles. Los nervios simpático y parasimpático se fusionan para formar nervios cavernosos que entran en los cuerpos cavernoso, cuerpo esponjoso y glande, regulando el flujo sanguíneo durante la erección. El nervio pudendo proporciona sensación a toda la pelvis y la función motora a todos los esfínteres, el piso pélvico y los músculos de rigidez.
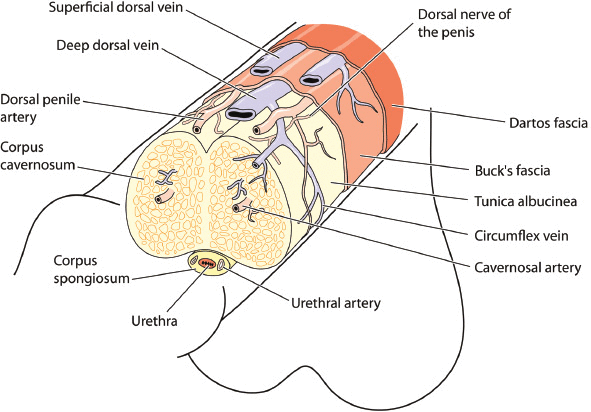
Figura 1:
Anatomía del pene que muestra las principales estructuras, vasos sanguíneos y nervios.
Las arterias pudendas internas proporcionan flujo sanguíneo al pene, ramificándose hacia las arterias bulbouretrales, dorsales y cavernosas. La arteria bulbouretral pasa a través de la fascia profunda del pene (Buck), suministrando el bulbo del pene y la uretra del pene. La arteria dorsal viaja entre el nervio dorsal y la vena dorsal profunda y emite ramas circunflejas que acompañan a las venas circunflejas con ramas terminales en el glande. El pene profundo o la arteria cavernosa ingresa al cuerpo cavernoso en la corteza y recorre la longitud del eje del pene, suministrando las arterias helicinas especializadas.
La estimulación sexual desencadena nervios parasimpáticos para liberar acetilcolina. Dentro de las células endoteliales que recubren las arterias del pene, la óxido nítrico sintasa (NOS) cataliza la oxidación de L-arginina a óxido nítrico (NO) y L-citrulina. El NO activa la guanilato ciclasa en los cuerpos cavernoso y esponjoso, lo que a su vez aumenta el monofosfato de guanosina cíclico (cGMP), lo que conduce a la relajación del músculo liso vascular, la vasodilatación y el aumento del flujo sanguíneo. El llenado y la expansión rápidos del sistema sinusoidal provocan la retención de sangre por la oclusión de los plexos venosos y la túnica albugínea, lo que resulta en una oclusión casi total del flujo venoso. La presión intracavernosa alcanza los 100 mmHg en la erección completa. Los músculos isquiocavernosos comprimen los cavernosos llenos de sangre a medida que los músculos perineales se contraen y hacen que la presión final alcance varios cientos de mmHg. Después de la eyaculación, la liberación de neurotransmisores cesa debido a la excitación del nervio simpático y las enzimas fosfodiesterasas descomponen la cGMP que conduce a la detumescencia y la flacidez (Figura 2 y XNUMX).
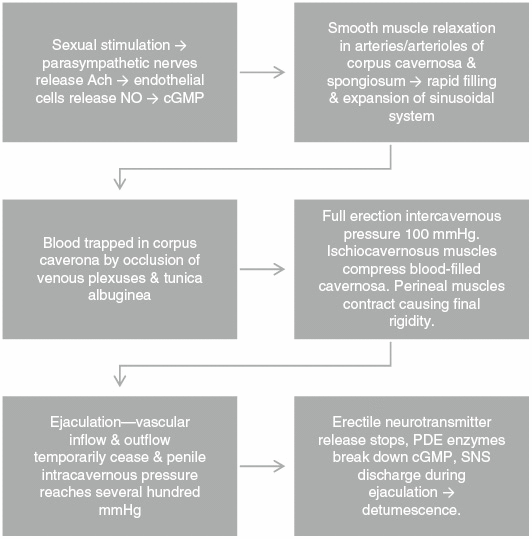
Figura 2:
Fisiología de las erecciones.
Ach, acetilcolina; cGMP, monofosfato de guanosina cíclico; NO, óxido nítrico; PDE, fosfodiesterasa; SNS, sistema nervioso simpático.
La evaluación exhaustiva de la disfunción eréctil requiere una historia completa, el uso de cuestionarios validados, un examen físico y un trabajo de laboratorio. Las imágenes, como la ecografía doppler dúplex, la arteriografía del pene y la resonancia magnética deben ser realizadas por un urólogo y reservadas para una posible intervención quirúrgica.
HISTORIA
Tomar un historial completo brinda la oportunidad de identificar todas las causas / factores contribuyentes relacionados con la DE. Con respecto a los factores psicosociales, es imperativo preguntar sobre los estresores actuales y los problemas de relación.
Las expectativas de autoimagen genital y frecuencia sexual a menudo son temas descuidados cuando se toma una historia sexual, pero afectan significativamente el rendimiento sexual. Los resultados del desarrollo y validación de la Escala de autoimagen genital masculina (MGSIS) que evaluó a hombres de 18 a 60 años encontraron que los hombres con mejor autoimagen genital informaron menos DE y el 20% de los hombres no estaban satisfechos con el tamaño de su pene.3 Los hombres que tienen una autoimagen genital negativa pueden preguntarse cómo se compara el tamaño de su pene con otros hombres. Los datos de Alfred Kinsey sobre 2500 hombres informaron que la longitud promedio del pene flácido era de 1 a 4 pulgadas y un pene erecto promedio de 5 a 6.5 pulgadas. Curiosamente, los hombres tienden a subestimar el tamaño de su pene en comparación con la medición real.4
Discutir las expectativas sobre la frecuencia de la actividad sexual es relevante para los hombres con baja libido, sentimientos de insuficiencia sexual o curiosidad sobre su frecuencia sexual en comparación con otros hombres. Las estadísticas sobre la frecuencia de los encuentros sexuales son limitadas. Una encuesta de AARP de 1670 hombres y mujeres mayores de 45 años informó que el 41% de los hombres de 50 años, el 24% de los hombres de 60 años y el 15% de los hombres de 70 años tienen relaciones sexuales al menos una vez por semana (reformulando estas estadísticas - El 59% de los hombres de 50 años, el 76% de 60 y el 85% de los hombres de 70 años tienen relaciones sexuales con menos frecuencia de una vez por semana).5 La Sociedad Internacional de Medicina Sexual (ISSM), informando los resultados de la Encuesta Nacional de Salud y Comportamiento Sexual 2010 del Instituto Kinsey, señaló que poco menos de la mitad de los hombres casados de 25 a 49 años tuvieron relaciones sexuales varias veces al mes o semanalmente, lo cual fue tasa más alta en cualquier categoría de edad.6 Otro estudio publicado por ISSM que encuestó a hombres y mujeres mayores de 50 años informó que solo el 20-30% de los hombres y mujeres permanecen sexualmente activos hasta los 80 años.7
El uso de la pornografía es un tema que puede ser incómodo para los médicos para discutir con sus pacientes masculinos. Aunque el diagnóstico de adicción a la pornografía es controvertido, existe una creciente evidencia que relaciona el uso frecuente de la pornografía con un impacto en la satisfacción sexual asociada, la felicidad matrimonial y de pareja, y la disfunción sexual, incluida la baja libido y la disfunción eréctil.8–11 La pornografía en Internet ofrece una novedad ilimitada y un formato de video a pedido que puede condicionar la excitación sexual, dificultando la transición de los hombres a parejas de la vida real.12 No se ha desarrollado una herramienta de detección validada para identificar dificultades relacionadas con la pornografía, incluida la DE. Después de preguntar sobre la frecuencia del uso de pornografía, los proveedores de atención médica deben preguntar sobre la capacidad de lograr y mantener una erección durante el sexo y la masturbación en pareja sin el uso o el recuerdo de la pornografía. Si se necesita usar o recordar imágenes pornográficas para producir una erección adecuada, la disfunción eréctil inducida por la pornografía puede ser un problema.
CUESTIONARIOS VALIDADOS
Los cuestionarios validados son útiles para la detección de DE. El cuestionario más utilizado en el entorno clínico y en la investigación publicada es el Índice Internacional de la Función Eréctil (IIEF-15) de 15 ítems, validado en 32 idiomas.13 Una versión más corta, el IIEF-5, o el cuestionario del Inventario de salud sexual para hombres (SHIM) también puede ser útil para el diagnóstico y para monitorear la efectividad del tratamiento.14,15
EXAMEN FÍSICO
El examen físico debe incluir un examen de pene y testículo, posiblemente la fuerza muscular del piso pélvico (mediante pruebas digitales), presión arterial, evidencia de enfermedad cardiovascular, altura, peso y circunferencia de la cintura.
TRABAJO
Según los antecedentes y el examen físico, las pruebas de laboratorio pueden incluir paneles metabólicos y lipídicos completos, insulina en ayunas, hemoglobina A1C, marcadores inflamatorios como hsCRP, testosterona total y libre, pruebas de tiroides y, en hombres más jóvenes con sospecha de hipogonadismo, hormona luteinizante y prolactina .
Las causas y los factores contribuyentes para la disfunción eréctil pueden superponerse. Estos incluyen problemas psicosociales, problemas neurológicos, uso excesivo de pornografía, trastornos endocrinos, efectos secundarios de medicamentos y cambios vasculares.
PSICOGÉNICO
El estrés significativo, las dificultades de relación, la depresión, la ansiedad y el trastorno de estrés postraumático pueden contribuir a la disfunción eréctil. Ansiedad de rendimiento, descrita por primera vez por Masters y Johnson en 1970,16 es la incapacidad de lograr una erección debido a experiencias pasadas con DE. La disfunción sexual, especialmente la disfunción eréctil y la disminución del deseo sexual, aumenta significativamente en los veteranos varones con trastorno de estrés postraumático.17 La DE psicógena generalmente ocurre durante el sexo en pareja con la función eréctil normal durante la masturbación. El inicio puede ser brusco, coincidiendo con el estrés, como la pérdida de empleo, la muerte de un familiar o problemas financieros. Las erecciones nocturnas o matutinas suelen ser normales.
NEUROLÓGICO
El sistema límbico, incluida la amígdala; hipocampo; y la circunvolución dentada y cingulada, es una de las áreas más antiguas del cerebro común a todos los mamíferos. Esta región del cerebro regula las emociones e intenta evitar el dolor y buscar placer. La investigación sugiere que los estímulos visuales sexualmente agradables activan la amígdala y el hipotálamo más en hombres que en mujeres.18 La entrada de la amígdala viaja al estriado ventral, una parte importante de los ganglios basales que funciona como parte del sistema de recompensa. El núcleo accumbens dentro del cuerpo estriado ventral contiene una gran concentración de neuronas dopaminérgicas y se considera el centro de placer del cerebro. La señalización de dopamina juega un papel central en la excitación sexual y la motivación. La activación de los receptores de dopamina en los nervios parasimpáticos lumbosacra de la médula espinal facilita las erecciones.19
Las afecciones que interrumpen la señalización normal de dopamina o la neurotransmisión, o que pueden dañar el sistema nervioso central, por ejemplo, la enfermedad de Parkinson, la esclerosis múltiple, la diabetes o el accidente cerebrovascular, también pueden causar disfunción eréctil. La lesión del nervio cavernoso durante la prostatectomía radical conduce a la disfunción eréctil en más del 50% de los hombres.20 El ciclismo de larga distancia puede comprimir el nervio pudendo y los vasos sanguíneos entre la silla y la sínfisis púbica, limitando el flujo sanguíneo y el oxígeno al pene.21,22 Los ciclistas pueden experimentar DE temporal y entumecimiento genital; sin embargo, pueden no tener un mayor riesgo de DE. Los resultados de una encuesta reciente de 5000 hombres atléticos mostraron que los ciclistas tenían la misma probabilidad de experimentar disfunción eréctil que los nadadores y corredores.23
USO DE PORNOGRAFÍA
Aunque el uso de pornografía puede considerarse socialmente aceptable y normal, no se conocen los riesgos para la salud del uso frecuente. La pornografía en Internet proporciona una novedad visual ilimitada que ejemplifica el efecto Coolidge, un fenómeno biológico que se observa en los animales machos cuando exhiben un interés renovado si se les presenta a diferentes parejas sexuales receptivas.24 Esto proporciona un posible beneficio evolutivo que permite a un hombre fertilizar a varias hembras. Los nuevos estímulos visuales sexuales provocan una excitación más fuerte, erecciones más firmes y una eyaculación más rápida con más producción móvil de esperma y semen.25–27
El uso excesivo de pornografía en Internet puede influir en la neuroplasticidad.28 Todas las drogas de abuso y adicciones conductuales, como los juegos en Internet y el consumo excesivo de alimentos, afectan la vía de la dopamina mesolímbica y el núcleo accumbens.29 La novedad promueve oleadas de dopamina en el núcleo accumbens, desencadenando la liberación de la proteína de unión al elemento de respuesta AMPc (CREB). CREB regula la expresión génica de dynorphin, una proteína que ralentiza la liberación de dopamina, amortiguando el sistema de recompensa.30 Se cree que esta es la base molecular de la tolerancia, ya que se requieren mayores cantidades de la droga o el comportamiento para superar las mayores cantidades de CREB. Cuando se abstiene, la reducción de dopamina promueve la anhedonia, lo que puede generar dependencia de la droga o el comportamiento.
Además de CREB, DeltaFosB se libera con inundaciones repetidas de dopamina en el núcleo accumbens. DeltaFosB promueve el refuerzo positivo del comportamiento adictivo al suprimir la liberación de dinorfina y aumentar la sensibilidad a la droga o el comportamiento. DeltaFosB persiste durante un tiempo relativamente largo, lo que lleva a algunos especialistas en adicciones a referirse a él como el "interruptor molecular para la adicción".31 Este mecanismo explica cómo el uso repetido de la pornografía, como otras sustancias adictivas, provoca la desensibilización y la disminución de la regulación del receptor de dopamina, lo que configura al usuario para un ciclo de atracones, ansias y erosión de la fuerza de voluntad.32
ENDOCRINO
Además de ser necesario para el desarrollo y crecimiento del pene y mejorar el deseo sexual, la testosterona regula la fisiología eréctil por varios mecanismos. La testosterona promueve la estructura, integridad y función nerviosas saludables, particularmente del nervio cavernoso.33 Los estudios en animales y humanos sugieren que la testosterona mejora la expresión del gen de óxido nítrico sintasa y la producción de NO en las arterias del pene, necesarias para la vasodilatación.34,35 La testosterona probablemente modula la actividad de PDE5 como lo demuestran los estudios en animales que muestran una regulación positiva de la expresión de PDE5 con suplementos de testosterona.36,37
Los bajos niveles de testosterona libre y biodisponible (pero no total) están asociados con la disfunción eréctil.38 Aunque se desconoce el nivel de testosterona necesario para lograr y mantener las erecciones, parece ser necesaria una cantidad mínima para la función eréctil.39,40 La suplementación con testosterona puede no mejorar la DE en todos los hombres; sin embargo, algunos estudios han demostrado que la terapia con testosterona puede ser útil y permitir que los inhibidores de la PDE-5 funcionen mejor.41,42
Algunos autores han documentado niveles altos de estradiol en hombres o una alta relación estradiol-testosterona asociada con la disfunción eréctil.43–45 Los inhibidores de la aromatasa evitan la conversión de testosterona en estradiol y pueden aumentar la testosterona total y biodisponible en hombres de edad avanzada con hipogonadismo leve mientras que reducen ligeramente los niveles de estradiol.46 Actualmente, no hay evidencia de que la inhibición de la aromatasa mejore la función sexual y no hay literatura que respalde el uso de inhibidores de la aromatasa para el hipogonadismo.47 Además, algunos estudios han encontrado que la proporción entre estradiol y testosterona no está relacionada con la función eréctil o el deseo sexual.48,49
La alta secreción de prolactina es una causa poco común de niveles bajos de testosterona y DE. Esto puede deberse a un tumor hipofisario (prolactinoma), marihuana o medicamentos como anfetaminas, bloqueadores H2, risperidona, ISRS, inhibidores de la MAO y algunos antidepresivos tricíclicos. La prolactina debe medirse solo en casos de bajo deseo sexual, ginecomastia y / o niveles totales de testosterona inferiores a 4 ng / ml (400 ng / dL).50
Tanto el hipotiroidismo como el hipertiroidismo pueden conducir a la disfunción eréctil y la disfunción eréctil es más frecuente en hombres con distiroidismo que en los controles.51 El tratamiento del hipotiroidismo y el hipertiroidismo pueden mejorar la DE.52 Por lo tanto, se recomienda la detección de disfunción tiroidea en hombres que presentan DE.
VASCULAR
La salud vascular óptima es primordial para lograr y mantener las erecciones. La disfunción vascular causa 70 a 80% de la DE no psicógena en hombres mayores. Debido a que la aterosclerosis de las arterias coronarias, carótidas, cerebrales o periféricas solo puede causar síntomas cuando está avanzada, la DE puede ser el primer signo de enfermedad vascular generalizada.53,54 En el Ensayo de prevención y cáncer de próstata, se evaluó a casi 10,000 hombres asignados al azar al grupo de placebo cada tres meses y se les realizó un seguimiento para la DE y la enfermedad cardiovascular entre 1994 y 2003. La DE era un factor de riesgo tan grande para futuros eventos cardiovasculares como el tabaquismo y los antecedentes familiares de ataques al corazón.55 La presencia de DE también puede ser un predictor de mortalidad por todas las causas.56 La disfunción eréctil comparte los mismos factores de riesgo que la enfermedad cardiovascular: presión arterial alta, falta de ejercicio, mala alimentación, tabaquismo, diabetes e hiperlipidemia. El mecanismo subyacente para la disfunción eréctil relacionada con los vasos implica disfunción endotelial.57,58 La regulación de la vasodilatación es una función del óxido nítrico (NO) liberado por las células endoteliales. El NO inicia la producción de cGMP causando la relajación del músculo liso y la vasodilatación de las arterias en el cuerpo cavernoso. La disfunción endotelial aumenta el riesgo de DE, independientemente de la evidencia clínica de enfermedad cardiovascular.59,60
EFECTOS SECUNDARIOS DE LA MEDICACIÓN
Muchos agentes farmacéuticos pueden contribuir a la DE al afectar los neurotransmisores, las hormonas, la función nerviosa o el flujo sanguíneo. Aunque no es una lista exhaustiva, los culpables comunes incluyen antidepresivos (especialmente ISRS como fluoxetina, sertralina, citalopram), ansiolíticos, depresores del SNC y relajantes musculares (lorazepam, ciclobenzaprina). Los diuréticos (HCTZ, espironolactona, triamtereno, furosemida) y antihipertensivos y betabloqueantes (clonidina, enalapril, metoprolol) también contribuyen comúnmente a la DE.
Es importante desarrollar un plan de tratamiento integral para la disfunción eréctil, ya que es probable que sea más efectivo que usar un solo agente para tratar solo los síntomas.
ASESORAMIENTO PSICOSEXUAL
La derivación para terapia cognitiva conductual, manejo del estrés o terapia de pareja puede ser apropiada para algunos hombres con DE. La relación causal entre la depresión y la disfunción eréctil no está clara y es probable que sea bidireccional.61 De hecho, un ensayo controlado aleatorio (ECA) de 152 hombres con depresión concomitante leve a moderada y disfunción eréctil mostró mejor humor en los hombres que recibieron sildenafil cuando su disfunción eréctil mejoró.62 La disfunción eréctil causada por la ansiedad o la depresión en el desempeño se trata mejor con terapia cognitiva conductual individual, asesoramiento de relaciones o trabajar con un terapeuta sexual certificado. También hay evidencia de que la terapia grupal puede mejorar la función eréctil. Una revisión Cochrane de 11 ensayos clínicos (nueve de los cuales fueron asignados al azar), concluyó que la terapia enfocada en grupos sexuales era más efectiva que ningún tratamiento para la DE. Un metaanálisis de ensayos que comparaban la terapia grupal más citrato de sildenafil versus sildenafil solo, encontró que los hombres que recibieron terapia grupal más sildenafil mostraron una mejoría significativa de las relaciones sexuales exitosas y tenían menos probabilidades de abandonarlos que aquellos que recibieron solo sildenafil. La terapia grupal también mejoró significativamente la DE en comparación con el citrato de sildenafil solo.63
REACONDICIONAMIENTO DEL USO EXCESIVO DE PORNOGRAFÍA
Revertir la disfunción eréctil atribuida al uso frecuente de pornografía requiere que el paciente elimine toda la pornografía, los sustitutos de la pornografía, el recuerdo de la pornografía y esencialmente toda la estimulación sexual artificial. Esto permite reacondicionar la excitación sexual y la capacidad eréctil con parejas de la vida real. Aunque se desconoce el momento para "reiniciar" el cerebro evitando la pornografía, el experto en adicción a la pornografía Gary Wilson sugiere que la experiencia clínica y los foros en línea muestran una recuperación más rápida para los hombres mayores de 50 años, lo que sugiere que 2 meses es típico.64 Los hombres más jóvenes pueden necesitar más tiempo, posiblemente hasta 5 meses, con la teoría de que su uso de pornografía en Internet comenzó a una edad más temprana. La excitación sexual está condicionada, especialmente durante la infancia y la adolescencia, y puede ser más fuerte en hombres que en mujeres.65–67
TERAPIA FÍSICA
Los músculos del piso pélvico que juegan un papel en el mantenimiento de las erecciones se debilitan con la edad. La fisioterapia para fortalecer los músculos bulbocavernoso e isquiocavernoso y el tejido conectivo pueden tratar eficazmente la DE en algunos pacientes. En un estudio aleatorizado y controlado, a 40 hombres con disfunción eréctil se les enseñó a retraer al máximo el pene y levantar el escroto dos veces al día mientras estaban de pie, sentados y acostados, y a apretar los músculos del piso pélvico después de orinar. Los resultados fueron sorprendentes: a los 6 meses, el 40% de los participantes recuperó la función eréctil normal y el 35% mostró alguna mejora; El 66% de los hombres también informaron una disminución del goteo después de orinar. Una técnica más simple puede ser enseñarles a los pacientes masculinos el ejercicio de Kegel haciendo que detengan la orina a mitad de camino para identificar los músculos que se necesitarán para realizar el ejercicio. Estos músculos deben contraerse durante 5 segundos, 10–20 veces seguidas, tres veces al día. Se puede incentivar a los hombres para que realicen ejercicios de Kegel o de fortalecimiento del piso pélvico debido a la posible mejoría en la calidad del orgasmo, un efecto secundario común que Arnold Kegel, MD documentó hace varias décadas en mujeres que realizaron Kegel frecuentes.68
DISPOSITIVO DE CONSTRICCIÓN DE VACÍO
El dispositivo de constricción de vacío (VCD), conocido coloquialmente como una "bomba de pene", fue diseñado por Geddings Osbon en 1974.69 Osbon se refirió a él como un "dispositivo equivalente para jóvenes" y afirmó que lo usó personalmente durante 20 años sin fallar. El primer dispositivo de constricción de vacío fue aprobado por la FDA para DE en 1982.
El VCD funciona aumentando el flujo sanguíneo al pene mediante la generación de una presión negativa de 110–225 mmHg (manualmente o mediante una bomba que funciona con batería) y evitando el flujo venoso con un anillo de constricción. Los estudios sugieren que aproximadamente el 55-70% de los hombres pueden lograr erecciones adecuadas con VCD.70, 71 Algunos hombres informan que la erección obtenida de un VCD tiende a ser de color púrpura, frío o adormecido, y los efectos secundarios incluyen hematomas en el eje del pene y atrapamiento de la eyaculación durante el orgasmo desde la banda de constricción. El anillo de constricción no debe dejarse en su lugar durante más de 30 minutos debido al riesgo de isquemia.
DIETA, EJERCICIO Y PÉRDIDA DE PESO
La búsqueda de afrodisíacos para estimular la libido y mejorar las fechas de rendimiento sexual hasta la antigüedad. De hecho, la palabra afrodisíaco proviene de la diosa griega del amor, Afrodita, que nació en el mar y fue llevada a la orilla en una vieira o concha de ostra. Aunque las ostras contienen grandes cantidades de zinc necesarias para la producción de testosterona, no se ha demostrado que comerlas mejore la libido o la capacidad eréctil.
Sin embargo, ciertos alimentos mejoran la salud vascular y, por lo tanto, pueden mejorar la función eréctil. Por ejemplo, los alimentos ricos en nitratos como la remolacha y las verduras de hoja verde aumentan los niveles de óxido nítrico, promueven la función endotelial normal y reducen la presión arterial.72–74 Las semillas y el jugo de granada también mejoran la función endotelial y reducen la presión arterial al tiempo que disminuyen las LDL oxidadas y glicadas, minimizando así la formación de placa aterosclerótica y mitigando el grosor y la rigidez de la pared arterial.75–78 El jarabe de maíz con alto contenido de fructosa y los refrescos aumentan el riesgo de desarrollar síndrome metabólico, aterosclerosis, diabetes y disfunción eréctil.79 Además, los alimentos con productos finales de glicación altamente avanzados como el tocino, las hamburguesas de comida rápida, los perritos calientes, el queso, la pizza y los alimentos fritos contribuyen a la diabetes, las enfermedades cardiovasculares y la disfunción eréctil.80–82 En lugar de centrarse en evitar alimentos específicos, puede ser más beneficioso para los pacientes con DE adoptar una dieta mediterránea con una ingesta abundante de verduras, frutas, aceite de oliva virgen extra, granos enteros, nueces y pescado y una ingesta moderada de vino. La evidencia de cuatro ensayos clínicos sugiere que la dieta y el estilo de vida mediterráneos influyen positivamente en la función sexual,83,84 además de disminuir la inflamación y retrasar la disfunción sexual en hombres diabéticos.
Existe poco debate acerca de que el ejercicio mejora varios factores de riesgo que contribuyen a la disfunción eréctil, incluida la reducción de la inflamación, la mejora de la función endotelial, la promoción de la sensibilidad a la insulina, la mejora de las lipoproteínas y la pérdida de grasa visceral.85–89 Una revisión sistemática y un metanálisis recientes confirman que el ejercicio intenso de moderado a intenso durante un mínimo de 8 semanas puede mejorar la DE.90
Tanto la grasa corporal excesiva como la insuficiente están asociadas con la disfunción eréctil. Por ejemplo, el Hallym Aging Study midió el porcentaje de grasa corporal y su relación con la DE en hombres coreanos.91 Los hombres con la grasa corporal más baja y más alta tenían más probabilidades de tener disfunción eréctil. La obesidad central se asocia con síndrome metabólico, disfunción vascular y niveles bajos de testosterona, todos los cuales contribuyen al desarrollo de la disfunción eréctil.92,93 El tejido adiposo secreta más de 35 hormonas y citoquinas, casi todas las cuales promueven inflamación, resistencia a la insulina y, finalmente, enfermedad vascular.94,95 La inflamación parece ser un jugador clave en la causa de la disfunción eréctil. Los hombres obesos con disfunción eréctil tienen niveles más altos de marcadores inflamatorios (IL-6, IL-9, IL-18 y PCR) y una función endotelial deteriorada que los hombres obesos sin disfunción eréctil.96
La pérdida de peso puede mejorar significativamente la función eréctil. En un ECA, los hombres obesos que perdieron un promedio de 33 libras durante 2 años mejoraron el rendimiento sexual.97 La DE mejoró en más del 30% del grupo de pérdida de peso en comparación con el 5% de los controles. El grupo de intervención recibió asesoramiento nutricional, consejos para aumentar la actividad física a aproximadamente 3 horas por semana y reuniones mensuales o bimensuales. Además de una pérdida de peso promedio del 15%, los hombres en el grupo de intervención también mostraron una reducción en los marcadores inflamatorios IL-6 y hsCRP, mejorando su perfil de riesgo cardiometabólico.
BOTÁNICOS Y AMINOÁCIDOS
El uso de productos botánicos, nutrientes y otras terapias naturales para aumentar el rendimiento sexual ha aumentado considerablemente debido al marketing en Internet. Pocas terapias naturales se han sometido a ensayos clínicos en humanos para respaldar la seguridad y la eficacia. Sin embargo, los siguientes ingredientes botánicos y aminoácidos pueden ser útiles para tratar la disfunción eréctil, especialmente para los hombres que prefieren no usar medicamentos PDE5i.
Pausinystalia yohimbe
Yohimbe es un nativo de hoja perenne de África central que contiene tres alcaloides: rauwolscina, corinancina y yohimbina. El componente más activo del yohimbe, la yohimbina, es un producto farmacéutico con un mecanismo de acción bien delineado como antagonista de la α presináptica.1 y α2-adrenérgicos y receptores 5-HT (1B) y agonista parcial de los receptores 5-HT (1A).98 Los metanálisis sugieren que la yohimbina es efectiva para la disfunción eréctil99,100 La yohimbina también puede ayudar con la capacidad retrasada o la incapacidad para eyacular.101 La dosis es de 15-30 mg, hasta 100 mg por día. Yohimbe puede ser mejor entregado a pedido ya que el inicio es rápido, dentro de 10-15 minutos, con una vida media de 35 minutos. La yohimbina penetra en el sistema nervioso central con posibles efectos secundarios que incluyen taquicardia, hipertensión, irritabilidad y ansiedad. Sudoración, náuseas, mareos, dolor de cabeza y enrojecimiento de la piel también son comunes. Al igual que con todos los productos botánicos, muchas marcas de suplementos de venta libre pueden no ser confiables. Un estudio que probó 49 marcas de yohimbe encontró una variabilidad considerable en la cantidad de yohimbina - 0 a 12.1 mg - por porción con 19 marcas que no contienen rauwolscina y corinancina, lo que sugiere que eran de origen vegetal altamente procesado o de origen sintético.102
Tribulus terrestris
T. terrestris crece en Europa, Asia, África y Medio Oriente. La raíz y la fruta tienen un uso a largo plazo en la medicina china y ayurvédica. Frecuentemente se hacen afirmaciones de que Tribulus mejora la producción de testosterona; sin embargo, los ensayos clínicos no han respaldado esta suposición, excepto en el uso intravenoso en primates.103–106 Los estudios en animales han demostrado que Tribulus puede mejorar la función eréctil y la producción de NO.107,108 Un ECA de 180 hombres con disfunción eréctil de leve a moderada con 500 mg de estandarizado T. terrestris tomado tres veces al día reportó mejor libido, disfunción eréctil, satisfacción sexual y calidad del orgasmo. No se informaron efectos adversos.109
Longifolia
Longifolia, conocido como ginseng de Malasia o Tongkat Ali, es una planta con flores originaria de Indonesia, Malasia, Tailandia, Vietnam, Laos e India. Un metaanálisis de ECA sugiere E. longifolia mejora significativamente la DE.110 Además, una revisión china de estudios publicados sugiere E. longifolia Mejora el volumen del semen, la libido y la testosterona.111 La planta puede tener una capacidad adaptógena y se ha demostrado que reduce la fatiga, mejora el bienestar, reduce el cortisol y aumenta la testosterona en sujetos estresados.112 Tomado como extracto de raíz de agua, Eurycoma parece seguro sin efectos secundarios significativos. La dosis sugerida es de 200 a 300 mg una o dos veces al día, con una forma patentada estandarizada a 22% de polipéptidos y 40% de glucosaponinas.
Epimedium spp.
Epimedio spp. crecen en China y Corea, y pertenecen a la familia Berberidaceae (que también contiene los conocidos productos botánicos, Mahonia aquifolium, Hydrastis canadensisy Berberis vulgaris) Se han identificado al menos 50 especies y se conocen comúnmente como "hierba de cabra en celo". El supuesto ingrediente activo, la icariina, es un flavonoide que mejora la función eréctil en estudios con animales mediante la inhibición de PDE5 y la inducción de óxido nítrico.113–115 - Ensayos clínicos en humanos sobre Epimedium faltan por lo tanto, las recomendaciones de dosificación no están disponibles.
L-arginina
La L-arginina es un aminoácido, esencial en condiciones con aumento de la enzima arginasa, como diabetes e insuficiencia renal.116,117 La arginina es utilizada por los enterocitos intestinales y los hepatocitos y se convierte en L-citrulina o L-ornitina. La variabilidad en la absorción de L-arginina oral es considerable: una dosis de 6 g se absorbe aproximadamente en un 68%, mientras que una dosis de 10 g solo se absorbe en un 20%.118,119
El óxido nítrico es el subproducto de la conversión de L-arginina a citrulina. Además, la suplementación con citrulina aumenta la arginina plasmática. La arginina puede mejorar la DE en dosis altas; por ejemplo, 5000 mg mejoran la DE, especialmente si los metabolitos urinarios de NO son bajos.120 Teóricamente, la L-arginina puede funcionar mejor si los niveles de ADMA están elevados. Dado que ADMA inhibe eNOS, la enzima endotelial necesaria para la producción de NO, la suplementación con L-arginina puede restablecer la relación arginina a ADMA.121 La suplementación con L-arginina puede ser más eficaz para la DE cuando se combina con yohimbina o pycnogenol (corteza de pino de Pinus pinaster).122–124 La suplementación con L-arginina puede activar el herpes y aumentar los brotes. Además, un ECA publicado en 2013 informó que 3000 mg de L-arginina tomados 3 veces al día aumentaron el riesgo de mortalidad en pacientes con IM reciente.125
TERAPIAS FARMACOLÓGICAS
Los principales enfoques farmacológicos para la disfunción eréctil son los inhibidores de la PDE5, la apomorfina y las terapias de inyección intracavernosa.
Inhibidores de PDE5
Los inhibidores de la fosfodiesterasa tipo 5 (PDE5i) son el tratamiento farmacológico más común para la disfunción eréctil. Su mecanismo de acción es bien conocido, inhibiendo la enzima fosfodiesterasa tipo 5 que descompone la cGMP, prolongando efectivamente la actividad de NO en las arterias del pene. Los medicamentos de esta clase difieren en sus selectividades para las 11 isoenzimas PDE diferentes. Esta reactividad cruzada con las isoenzimas PDE se encuentra especialmente en el músculo liso vascular, visceral y pulmonar y contribuye a los efectos secundarios.126 Por ejemplo, el vardenafil y el sildenafil tienen tres y siete veces más probabilidades de unirse a PDE6, una enzima en la retina que transfiere la luz a los impulsos nerviosos. La inhibición de esta enzima causa alteraciones en la percepción del color conocidas como "cromatopsia".
Cuatro fármacos PDE5i han sido aprobados por la FDA: sildenafil en 1998, vardenafil y tadalafil en 2003, y avanafil en 2012. No se han realizado ensayos comparativos que comparen la efectividad entre estos fármacos. Estos medicamentos difieren en el inicio, la duración de la acción y los efectos secundarios.127 La aparición de sildenafil y vardenafil es de 30 a 60 minutos con una duración de 10 a 12 horas. El inicio de Tadalafil es de 15 a 30 minutos, dependiendo de la dosis, con una duración más larga de 36 horas. Avanafil tiene el inicio más corto, en 15 minutos, y la duración, aproximadamente 6 horas.
El uso de PDE5i puede reducir el riesgo de cáncer de próstata, posiblemente porque los hombres que los usan pueden eyacular con más frecuencia, lo que protege contra el cáncer de próstata.128,129 Largo plazo sildenafilo El uso de citrato (Viagra) está asociado con un riesgo ligeramente mayor de melanoma.130 Los efectos secundarios más comunes de PDE5i incluyen dolor de cabeza en hasta el 20% de los hombres, enrojecimiento en hasta el 15% y dispepsia y congestión nasal en hasta el 10%. Aunque es poco frecuente, pueden producirse mareos y priapismo. Todos los PDE5i están contraindicados en hombres que toman nitratos.
Apomorfina
La apomorfina ha estado en uso desde 1869 para la enfermedad de Parkinson, y se ha estudiado por su efecto sobre la función eréctil. Aunque derivada de la morfina, la apomorfina no contiene morfina ni se une a los receptores opioides. Tiene una alta afinidad por los receptores de dopamina y el mecanismo para mejorar el deseo sexual y las erecciones es probable que sea a través de una afinidad moderada por los receptores D2 en el hipotálamo y el sistema límbico.131 En los ensayos clínicos en fase II y III en humanos con 5000 hombres, 3–4 mg de apomorfina sublingual produjeron erecciones lo suficientemente firmes para la penetración en 10–25 minutos, con una mejora de aproximadamente el 20–25% sobre el placebo.132,133 La única apomorfina farmacéutica patentada en los EE. UU. Es Apokyn inyectable, aprobado por la FDA para el avance de la enfermedad de Parkinson; sin embargo, la apomorfina se puede combinar como una pastilla sublingual y se puede combinar con un PDE5i. Las dosis de 2 a 3 mg pueden ser tan efectivas como las de 4 a 6 mg sin efectos secundarios como náuseas, dolor de cabeza o mareos. La apomorfina no debe usarse concomitantemente con el clorhidrato de ondansetrón, un antiemético prescrito con frecuencia, debido a una posible hipotensión.
Inyecciones intracavernosas
Introducido en 1983, las inyecciones intracavernosas modulan la función endotelial y son muy efectivas incluso en hombres con DE grave; El alprostadil produce erecciones en hasta el 93% de los hombres, con una efectividad de bi-, tri y quad-mix de hasta el 97.6%.134–136 Alprostadil, 20 o 40 μg de prostaglandina E1, es la única inyección intracavernosa patentada aprobada por la FDA, mientras que otros dos medicamentos, fentolamina y papaverina, se pueden agregar a PGE1 en una fórmula compuesta. El efecto secundario más común de PGE1 solo es el dolor en el 48.5% de los hombres. Bi-mix, que a menudo contiene 0.5–3.0 mg de fentolamina y 30 mg de papaverina, no causa dolor pero puede no ser tan efectivo. Tri-mix, que generalmente contiene 5–10 μg (y hasta 40 μg) de PGE1, 0.5–1.0 mg de fentolamina y 15–30 mg de papaverina, reduce la probabilidad de dolor a 2.9%. La adición de 0.15 mg de atropina en quad-mix, reservada para hombres en quienes tri-mix es ineficaz, mejora significativamente el dolor. La cantidad de PGE1, bi-, tri- o quad-mix necesaria varía de 0.1 a 0.3 mL. Empírica (usando PGE1 solo independientemente de la etiología o gravedad de la disfunción eréctil, con ajustes de dosis o fórmula realizados en función de los resultados del paciente) y basada en el riesgo (utilizando bi-mix, tri-mix o tri-mix de dosis alta en base a un algoritmo que factoriza ED etiología y número de factores de riesgo de DE) los enfoques de dosificación parecen ser similares en cuanto a efectividad y complicaciones y tasas de satisfacción.137 Los efectos secundarios incluyen dolor en el sitio de inyección, priapismo y desarrollo de tejido cicatricial o enfermedad de Peyronie. Para un excelente artículo que revisa la efectividad, las dosis y los efectos secundarios de las inyecciones intracavernosas, vea el resumen de Medscape "Algoritmo de inyección intracavernosa" de Jeffrey Albaugh.138
TERAPIA EXTRACORPORAL DE BAJA INTENSIDAD
La onda de choque extracorpórea de baja intensidad (LI-ESW) se originó en la década de 1990 cuando se demostró que la ecografía inducía la angiogénesis en heridas de ratas.139 LI-ESW utiliza ondas de choque, un tipo de onda acústica que transporta energía e induce reacciones biológicas cuando se aplica al tejido objetivo.140 El procedimiento varía en términos de densidad de flujo de energía, frecuencia (número de pulsos por segundo en Hz) y número total de pulsos entregados. El mecanismo de acción para la mejora de la DE parece ser la regeneración de los nervios positivos del óxido nítrico neuronal del pene (nNOS), la liberación mejorada de óxido nítrico y la reparación de células endoteliales y vasculares del músculo liso mediante el reclutamiento de células madre mesenquimales.141 El tratamiento también puede activar las células progenitoras locales del pene.142 Actualmente, LI-ESW no está aprobado por la FDA para la DE; Sin embargo, muchos ensayos clínicos se han realizado con un buen perfil de seguridad y un éxito variable.
El primer estudio piloto de DE publicado en 2010 utilizó seis sesiones LI-ESW en 20 hombres que no respondían a los inhibidores de PDE5 (PDE5i). Los resultados mostraron una mejor función eréctil, duración de las erecciones y rigidez del pene en 1 mes. Se informaron mejoras durante hasta 6 meses de seguimiento.143 Varios ECA han informado resultados positivos con LI-ESW. En un ensayo que involucró a 67 hombres con DE que respondieron a PDE5i, el brazo de tratamiento recibió 12 sesiones con función eréctil mejorada y hemodinámica del pene observadas en aproximadamente el 50% de los hombres sin el uso de su PDE5i.144 En un ECA similar en India que incluyó 135 respondedores PDE5i tratados con 12 sesiones, el 78% de los hombres tratados pudieron lograr erecciones lo suficientemente firmes como para penetrar sin medicación al mes.145 Aunque estos resultados se mantuvieron a 1 año de seguimiento, hubo una tasa de abandono muy alta, incluido el 58% de la simulación y el 42% de los brazos de tratamiento.
Los hombres que no responden a PDE5i pueden convertirse en respondedores después del tratamiento con LI-ESW. En un estudio prospectivo abierto de un solo brazo de 29 hombres que no respondieron a PDE5i, 12 tratamientos resultaron en un 72% de hombres capaces de lograr erecciones lo suficientemente firmes como para penetrar con un PDE5i.146 En un ECA más reciente que incluyó 58 PDE5i que no respondieron, el 54% respondió a PDE5i después de 1 mes de tratamiento con LI-ESW en comparación con el 0% en el grupo simulado.147
La mejora sostenida observada en estudios de seguimiento más largos sugiere que después del tratamiento, algunos hombres pueden revertir la patología subyacente que causa su DE o que LI-ESW puede proporcionar cierto grado de rehabilitación del pene. En un ECA con 6 meses de seguimiento de 112 hombres, todos los cuales recibieron cinco sesiones de tratamiento desde que el brazo de placebo recibió tratamiento activo a las 10 semanas, a los 6 meses, aproximadamente el 20% del brazo de tratamiento inicial y el 23% del tratamiento inicial el grupo placebo todavía pudo tener relaciones sexuales sin medicación.148 Otro seguimiento de 1 año de 50 hombres mayores (edad promedio de 65 años) con factores de riesgo vascular que incluyen diabetes, hipertensión, dislipidemia y enfermedad de las arterias coronarias encontró una mejora sostenida del 60% en la gravedad de la disfunción eréctil y la calidad de la erección autoinformada.149
Se desconoce la cantidad de tratamientos LI-ESW para un resultado ideal y cuánto tiempo el tratamiento sigue siendo efectivo. Un ECA reciente realizado en 126 hombres en un hospital danés comparó a hombres que recibieron cinco versus diez sesiones a los 6 y 12 meses; el tratamiento fue aproximadamente 38% efectivo en ambos grupos, lo que sugiere que sesiones adicionales pueden no mejorar el resultado.150,151 En un seguimiento de 2 años de un ensayo abierto de 156 hombres, el 63% mejoró a las 4 semanas con un 53% de efectividad sostenida a los 2 años.152 No es sorprendente que los hombres con disfunción eréctil grave hayan tenido un fracaso anterior. Todos los pacientes con diabetes y disfunción eréctil severa perdieron el efecto, mientras que el 76% de los hombres con disfunción eréctil leve y sin diabetes conservaron la efectividad.
El número de estudios que utilizan LI-ESWT para la DE ha aumentado dramáticamente en los últimos años. Una revisión narrativa de la literatura publicada realizada en 2013 informó que el 60-75% de los respondedores PDE5i podrían lograr erecciones lo suficientemente firmes para la penetración sin medicación y el 72% de los no respondedores PDE5i se convirtieron en respondedores.153 Metanálisis recientes que revisaron 14 estudios, incluidos 7 ECA, encontraron que la terapia LI-ESW es segura y efectiva, con resultados que duran al menos 3 meses.154 Los hombres con disfunción eréctil leve o moderada parecen tener una mejor respuesta que los hombres con disfunción eréctil grave, con densidad de flujo de energía, cantidad de ondas de choque administradas y duración del tratamiento estrechamente relacionada con el resultado.
Inyección de células madre y PRP
La inyección de plasma rico en plaquetas (PRP) o células madre mesenquimales en el cuerpo cavernoso promete mejorar la disfunción eréctil y restaurar la función de la arteria y los nervios del pene. Para preparar PRP, las plaquetas de sangre anticoagulada se hilan en una centrífuga y se concentran. El PRP contiene más de 300 proteínas bioactivas, factores de crecimiento y moléculas de adhesión que pueden mejorar la cicatrización del tejido y promover la regeneración del tejido nervioso y vascular.155–157 Dado que la vasculatura del pene es la región más rica en endotelio del cuerpo de un hombre y el flujo sanguíneo en el pene flácido es más lento en comparación con la circulación sistémica (lo que permite una mejor retención), en teoría, el PRP puede proporcionar beneficios en el tejido del pene similares a las mejoras observadas en las lesiones ortopédicas .
Se han publicado pocos estudios piloto de seguridad y viabilidad con PRP para DE. Un ensayo en humanos realizado en Italia evaluó a 9 hombres con DE que recibieron PRP además de la terapia de vacío. Se observó una mejoría leve con el único efecto adverso menor de dolor leve y hematomas en el sitio de inyección.158
Los niveles reducidos de células progenitoras endoteliales circulantes (EPC), un tipo de célula madre necesaria para la regeneración del revestimiento endotelial vascular, es un factor de riesgo independiente para la disfunción eréctil.159 Los EPC disminuyen con la inflamación crónica observada en diabetes, hipercolesterolemia, obesidad, enfermedad cardiovascular y tabaquismo.160 Los estudios en animales sugieren que la testosterona estimula la movilización de EPC de la médula ósea y mejora la angiogénesis.161,162 Dos revisiones de estudios en animales publicados que incluyen inyecciones intracavernosas de células madre derivadas de médula ósea, tejido adiposo y músculo esquelético informaron resultados favorables en la función endotelial, músculo liso y nervio en el tejido del pene.163,164
La PRP y la terapia con células madre pueden ayudar a los hombres con lesiones vasculares y nerviosas por diabetes o prostatectomía radical. Algunos estudios piloto en humanos sugieren que el procedimiento puede ser seguro y efectivo. Un estudio incluyó a 11 hombres que se sometieron a una prostatectomía radical debido al cáncer de próstata, y la DE resultante no respondió a PDE5i.165 Las células madre autólogas derivadas de tejido adiposo inyectadas en el cuerpo cavernoso recuperaron la función eréctil en ocho de los once hombres sin efectos adversos. En otro estudio piloto que utilizó células madre del cordón umbilical humano no autólogo, seis de cada siete hombres mayores con diabetes y disfunción eréctil que no respondían a PDE5i, recuperaron las erecciones matutinas al tercer mes, y dos de cada siete todavía pudieron lograr una erección con PDE5i después de 6 meses. Curiosamente, la glucosa en sangre disminuyó 2 semanas después de la inyección, con niveles de hemoglobina A1C mejorados por hasta 4 meses, y no se observaron efectos adversos. También se observaron resultados positivos en un estudio piloto en humanos en el que participaron 12 hombres con prostatectomía posradical severa que no respondía al alprostadil, PDE5i o dispositivo de vacío.166 Este ensayo de fase I utilizó dosis crecientes de células madre autólogas derivadas de médula ósea. Las dosis más altas fueron más efectivas con nueve de cada doce hombres capaces de lograr erecciones lo suficientemente firmes como para penetrar con PDE5i; los beneficios se mantuvieron al año sin efectos adversos.
Si bien las inyecciones de PRP y de células madre se consideran experimentales y carecen de la aprobación de la FDA y la cobertura de seguro, los hombres pueden buscar profesionales que realicen estos procedimientos. Los posibles efectos adversos incluyen infección y desarrollo de tejido cicatricial o enfermedad de Peyronie. Teóricamente, las células madre también pueden aumentar la tumorigénesis, aunque se desconoce el alcance de este riesgo.167
La disfunción eréctil es un problema médico común con varios factores y causas contribuyentes posibles, a menudo superpuestos. Es necesario tomar un historial cuidadoso y minucioso, el uso de cuestionarios validados, un examen físico y un examen de laboratorio para desarrollar un plan para mejorar los síntomas mientras se abordan las causas subyacentes. Las opciones de tratamiento incluyen modificaciones de dieta y estilo de vida, ejercicio de fisioterapia, uso de dispositivos de constricción al vacío, suplementos dietéticos botánicos y de aminoácidos, medicamentos, terapia de ondas de choque extracorpóreas de baja intensidad y posiblemente inyecciones intracavernosas de plasma o células madre ricas en plaquetas.
- Realizar un historial completo, documentación del cuestionario, examen, trabajo de laboratorio relevante
- Discuta las causas / factores contribuyentes:
- Psicogenico
- Neurológico
- Uso excesivo de pornografía
- Endocrino
- Efectos secundarios de los medicamentos.
- Cambios vasculares
- Revise las opciones de tratamiento relevantes:
- Asesoramiento psicosexual
- Abstinencia de pornografía
- Terapia física (Kegel's) o uso de dispositivo de constricción de vacío.
- Cambios dietéticos
- Recomendación de ejercicio
- Opciones de pérdida de peso
- Remedios herbales y aminoácidos
- Medicamentos:
- PDE5i: diferentes comienzos, duración de la acción y efectos secundarios
- Puede o no estar cubierto por un seguro, puede ser costoso
- La apomorfina, no aprobada por la FDA para la disfunción eréctil, debe estar compuesta
- PDE5i: diferentes comienzos, duración de la acción y efectos secundarios
- Onda de choque extracorpórea de baja intensidad
- No aprobado por la FDA para DE y falta de cobertura de seguro
- Los datos de seguridad son buenos con la mayoría de los estudios que muestran resultados positivos
- Puede necesitar tratamientos repetidos
- PRP e inyecciones de células madre
- No recomendado debido a la falta de ensayos aleatorios y posibles problemas de seguridad
No se recibió financiación para la preparación y redacción de este artículo.
- Feldman HA, Goldstein I, Hatzichristou DG, et al. La impotencia y sus correlatos médicos y psicosociales: resultados del Estudio de Envejecimiento Masculino de Massachusetts.
- McMahon CN, Smith CJ, Shabsigh R. Tratamiento de la disfunción eréctil cuando los inhibidores de PDE5 fallan.
- Herbenick D, Schick V, Reece M, et al. El desarrollo y la validación de la Escala de autoimagen genital masculina: resultados de una muestra de probabilidad representativa a nivel nacional de hombres en los Estados Unidos.
- Gebhard P, Johnson A.
- Fisher L, Anderson G, Chapagain M, et al.
- Schick V, Herbenick D, Reece M, et al. Comportamientos sexuales, uso de condones y salud sexual de estadounidenses mayores de 50 años: implicaciones para la promoción de la salud sexual en adultos mayores.
- Berger J, Doan A, Kehoe J, et al. PD69-12 encuesta de función sexual y pornografía.
- Zillmann D, Bryant J. Impacto de la pornografía en la satisfacción sexual 1.
- Sol C, Puentes A, Johnson JA, et al. La pornografía y el guión sexual masculino: un análisis del consumo y las relaciones sexuales.
- Poulsen FO, Busby DM, Galovan AM. Uso de la pornografía: quién lo usa y cómo se asocia con los resultados de la pareja.
- Perry SL. ¿Ver pornografía reduce la calidad marital con el tiempo? Evidencia de datos longitudinales.
- Parque B, Wilson G, Berger J, et al. ¿La pornografía en Internet está causando disfunciones sexuales? Una revisión con informes clínicos.
- Rosen RC, Riley A, Wagner G, et al. El índice internacional de la función eréctil (IIEF): una escala multidimensional para la evaluación de la disfunción eréctil.
- Rosen RC, Cappelleri JC, Smith MD, et al. Desarrollo y evaluación de una versión resumida de 5 ítems del Índice Internacional de Disfunción Eréctil (IIEF-5) como herramienta de diagnóstico para la disfunción eréctil.
- Cappelleri JC, Rosen RC. El Inventario de salud sexual para hombres (SHIM): una revisión de 5 años de investigación y experiencia clínica.
- Bruce T, Barlow D. La naturaleza y el papel de la ansiedad por el desempeño en la disfunción sexual. En: Leitenberg H, ed.
- Bentsen I, Giraldi A, Kristensen E, et al. Revisión sistemática de la disfunción sexual entre veteranos con trastorno de estrés postraumático.
- Hamann S, Herman RA, Nolan CL, et al. Los hombres y las mujeres difieren en la respuesta de la amígdala a los estímulos sexuales visuales.
- Simonsen U, Comerma-Steffensen S, Andersson KE. Modulación de vías dopaminérgicas para tratar la disfunción eréctil.
- Campbell J, Burnett A. Enfoques neuroprotectores y regenerativos nerviosos para el tratamiento de la disfunción eréctil después de una lesión del nervio cavernoso.
- Ricchiuti VS, Haas CA, Seftel AD, et al. Lesión del nervio pudendo asociada con un ávido ciclismo.
- Oberpenning F, Roth S, Leusmann DB, et al. El síndrome de Alcock: insensibilidad temporal al pene debido a la compresión del nervio pudendo dentro del canal de Alcock.
- Awad MA, Gaither TW, Murphy GP, et al. Ciclismo y función sexual y urinaria masculina: resultados de un gran estudio transversal, multinacional.
- Ventura-Aquino E, Fernández-Guasti A, Paredes R. Hormonas y el efecto Coolidge.
- Koukounas E, Over R. Asignación de recursos atencionales durante la habituación y la deshabilitación de la excitación sexual masculina.
- Kim SC, Bang JH, Hyun JS, et al. Cambios en la respuesta eréctil a la estimulación sexual audiovisual repetida.
- José P, Sharma R, Agarwal A, et al. Los hombres eyaculan grandes volúmenes de semen, más espermatozoides móviles y más rápidamente cuando se exponen a imágenes de mujeres novedosas.
- Volkow ND, Baler D. Ciencia de la adicción: descubriendo la complejidad neurobiológica.
- Amor T, Laier C, Marca M, et al. Neurociencia de la adicción a la pornografía en Internet: una revisión y actualización.
- Nestler EJ, Barrot M, Self DW. DeltaFosB: un cambio molecular sostenido para la adicción.
- Lanzadores KK, Frohmader KS, Vialou V, et al. Las recompensas naturales y farmacológicas actúan sobre mecanismos comunes de plasticidad neural con ΔFosB como mediador clave.
- Traish A, Goldstein I, Kim N. Testosterona y función eréctil: de la investigación básica a un nuevo paradigma clínico para el manejo de hombres con insuficiencia androgénica y disfunción eréctil.
- Parque KH, Kim SW, Kim KD, et al. Efectos de los andrógenos sobre la expresión de ARNm de óxido nítrico sintasa en el cuerpo cavernoso de la rata.
- Mikhail N. ¿La testosterona tiene un papel en la función eréctil?
- Morelli A, Filippi S, Mancina R, et al. Los andrógenos regulan la expresión de la fosfodiesterasa tipo 5 y la actividad funcional en los cuerpos cavernosos.
- Zhang XH, Morelli A, Luconi M, et al. La testosterona regula la expresión de PDE5 y la respuesta in vivo al tadalafil en el cuerpo cavernoso de la rata.
- Liao M, Huang X, Gao Y, et al. La testosterona está asociada con la disfunción eréctil: un estudio transversal en hombres chinos.
- Buena F, Swerdloff RS, Steiner BS, et al. La función sexual no cambia cuando los niveles séricos de testosterona varían farmacológicamente en el rango masculino normal.
- Armagan A, Kim NN, Goldstein I, et al. Relación dosis-respuesta entre testosterona y función eréctil: evidencia de la existencia de un umbral crítico.
- Jain P, Rademaker AW, McVary KT. Suplementos de testosterona para la disfunción eréctil: resultados de un metanálisis.
- Aversa A, Isidori AM, Spera G, et al. Los andrógenos mejoran la vasodilatación cavernosa y la respuesta al sildenafil en pacientes con disfunción eréctil.
- Mancini A, Milardi D, Bianchi A, et al. Aumento de los niveles de estradiol en el trastorno oclusivo venoso: un posible mecanismo funcional de fuga venosa.
- Wu F, Chen T, Mao S, et al. Los niveles de estradiol y testosterona están alterados en hombres chinos con disfunción sexual.
- Srilatha B, Adaikan PG, Chong YS. Relevancia del equilibrio estradiol-testosterona en el pronóstico de los pacientes con disfunción eréctil.
- Leder BZ, Rohrer JL, Rubin SD, et al. Efectos de la inhibición de la aromatasa en hombres de edad avanzada con niveles de testosterona sérica bajos o muy bajos.
- Tan RBW, Guay AT, Hellstrom WJG. Uso clínico de inhibidores de aromatasa en hombres adultos.
- Dastello-Porcar AM, Martinez-Jabaloyas JM. Relación testosterona / estradiol, ¿es útil en el diagnóstico de disfunción eréctil y bajo deseo sexual?
- Gades NM, Jacobson DJ, McGree ME, et al. Las asociaciones entre las hormonas sexuales séricas, la función eréctil y el deseo sexual: el estudio de Olmsted Country de síntomas urinarios y estado de salud entre hombres.
- Buvat J, Lemaire A. Evaluación endocrina en hombres con 1,022 con disfunción eréctil: importancia clínica y estrategia rentable.
- Gabrielson AT, Sartor RA, Hellstrom WJG. El impacto de la enfermedad tiroidea en la disfunción sexual en hombres y mujeres.
- Krassas GE, Tziomalos K, Papadopoulou F, et al. Disfunción eréctil en pacientes con hiper e hipotiroidismo: ¿qué tan común y qué debemos tratar?
- Cheitlin M. Disfunción eréctil: ¿el primer signo de enfermedad vascular generalizada?
- Billups KL. La disfunción eréctil como un signo temprano de enfermedad cardiovascular.
- Thompson MI, Tangen CM, Goodman PJ, et al. Disfunción eréctil y posterior enfermedad cardiovascular.
- Böhm M, Baumhäkel M, Teo K, et al. La disfunción eréctil predice eventos cardiovasculares en pacientes de alto riesgo que reciben telmisartán, ramipril o ambos: Telmisartán en curso solo y en combinación con Ramipril Global Endpoint Trial / Telmisartan Randomized EvaluationmeNt Study en ACE iNtolerant sujetos con enfermedad cardiovascular (EN TARGET / TRANSCEND) Ensayos.
- Guay at ED2: disfunción eréctil = disfunción endotelial.
- Aversa A, Bruzziches R, Francomano D, et al. Disfunción endotelial y disfunción eréctil en el hombre que envejece.
- Kaya C, Uslu Z, Karaman I. ¿Se deteriora la función endotelial en pacientes con disfunción eréctil?
- Kaiser DR, Billups K, Mason C, et al. Vasodilatación dependiente e independiente del endotelio de la arteria braquial deteriorada en hombres con disfunción eréctil y ninguna otra enfermedad clínica clínica.
- Seidman SN, Roose SP. La relación entre la depresión y la disfunción eréctil.
- Seidman SN, Roose SP, Menza MA, et al. Tratamiento de la disfunción eréctil en hombres con síntomas depresivos: resultados de un ensayo controlado con placebo con citrato de sildenafil.
- Melnick T, Soares BG, Nasselo AG. Intervenciones psicosociales para la disfunción eréctil.
- Wilson G.
- Brom M, Ambos S, Laan E, et al. El papel del condicionamiento, el aprendizaje y la dopamina en el comportamiento sexual: una revisión narrativa de estudios en animales y humanos.
- Klucken T, Schwekendiek J, Merz CJ, et al. Activaciones neuronales de la adquisición de la excitación sexual condicionada: efectos de la conciencia de contingencia y el sexo.
- Griffee K, O'Keefe S, Beard K, et al. El desarrollo sexual humano está sujeto a un período crítico de aprendizaje: implicaciones para la adicción sexual, la terapia sexual y la crianza de los hijos.
- Kegel AH. Ejercicio de resistencia progresiva en la restauración funcional de los músculos perineales.
- Hoyland K, Vasdev N, Adshead J. El uso de dispositivos de erección al vacío en la disfunción eréctil después de la prostatectomía radical.
- Vrijhof HJ, Delaere KP. Dispositivos de constricción al vacío en la disfunción eréctil: aceptación y efectividad en pacientes con impotencia de etiología orgánica o mixta.
- Kolettis PN, Lakin MM, Montague DK, et al. Eficacia del dispositivo de constricción de vacío en pacientes con disfunción oclusiva venosa corporal.
- Siervo M, Lara J, Ogbonmwan I, et al. La suplementación con nitrato inorgánico y jugo de remolacha reduce la presión arterial en adultos: una revisión sistemática y un metanálisis.
- Hord N, Tang Y, Bryan NS. Fuentes alimenticias de nitratos y nitritos: el contexto fisiológico para posibles beneficios para la salud.
- Hobbs DA, George TW, Lovegrove JA. Los efectos de la presión arterial de nitrato en la dieta y la función endotelial: una revisión de los estudios de intervención en humanos.
- Fuhrman B, Volkova N, Aviram M. El jugo de granada inhibe la absorción de LDL oxidada y la biosíntesis de colesterol en los macrófagos.
- Aviram M, Rosenblat M, Gaitini D, et al. El consumo de jugo de granada durante 3 años por parte de pacientes con estenosis de la arteria carótida reduce el grosor íntimo-media de la carótida común, la presión arterial y la oxidación de LDL.
- Ignarro LJ, Byrns RE, Sumi D, et al. El jugo de granada protege el óxido nítrico contra la destrucción oxidativa y mejora las acciones biológicas del óxido nítrico.
- Stowe CB. Los efectos del consumo de jugo de granada en la presión arterial y la salud cardiovascular.
- Adamowicz J, Drewa T. ¿Existe un vínculo entre los refrescos y la disfunción eréctil?
- Neves D. Productos finales de glicación avanzada: una vía común en la diabetes y la disfunción eréctil relacionada con la edad.
- Uribarri J, MD del Castillo, MP de la Maza, et al. Productos finales dietéticos de glicación avanzada y su papel en la salud y la enfermedad.
- Uribarri J, Woodruff S, Goodman S, et al. Productos finales de glicación avanzada en alimentos y una guía práctica para su reducción en la dieta.
- Maiorino MI, Bellastella G, Chiodini P, et al. Prevención primaria de la disfunción sexual con dieta mediterránea en diabetes tipo 2: el ensayo aleatorizado MÈDITA.
- Di Francesco S, Dietaglia R. Dieta mediterránea y disfunción eréctil: una perspectiva actual.
- Slentz CA, Houmard JA, Johnson JL, et al. Inactividad, entrenamiento físico y desentrenamiento, y lipoproteínas plasmáticas. STRRIDE: un estudio aleatorizado y controlado de intensidad y cantidad de ejercicio.
- Di Francescomarino S, Sciartilli A, Di Valerio, et al. El efecto del ejercicio físico sobre la función endotelial.
- Walther C, Gielen S, Hambrecht R. El efecto del entrenamiento físico sobre la función endotelial en la enfermedad cardiovascular en humanos.
- Fuchsjager-Mayrl G, Pleiner J, Wiesinger GF, et al. El entrenamiento físico mejora la función endotelial vascular en pacientes con diabetes tipo 1.
- Vina J, Sanchis-Gomar F, Martínez-Bellow V, et al. El ejercicio actúa como una droga; Los beneficios farmacológicos del ejercicio.
- Silva A, Sousa N, Azevedo LF, et al. Actividad física y ejercicio para la disfunción eréctil: revisión sistemática y metanálisis.
- Cho YG, Song HJ, Lee SK, et al. La relación entre la masa de grasa corporal y la disfunción eréctil en hombres coreanos: Hallym Aging Study.
- Díaz-Arjonilla M, Schwarcz M, Swerdloff RS, et al. Obesidad, niveles bajos de testosterona y disfunción eréctil.
- Kapoor D, Clarke S, Channer KS, et al. La disfunción eréctil se asocia con bajos niveles de testosterona bioactiva y adiposidad visceral en hombres con diabetes tipo 2.
- Fantuzzi G. Tejido adiposo, adipocinas e inflamación.
- Mattu HS, Randeva HS. Papel de las adipocinas en la enfermedad cardiovascular.
- Giugliano F. La disfunción eréctil se asocia con disfunción endotelial y niveles elevados de citocinas proinflamatorias en hombres obesos.
- Evans M. Pierde peso para perder la disfunción eréctil.
- Millán MJ, Newman-Tancredi A, Audinot V, et al. Acciones agonistas y antagonistas de la yohimbina en comparación con fluparoxano en los receptores adrenérgicos alfa (2) (AR), serotonina (5-HT) (1A), 5-HT (1B), 5-HT (1D) y dopamina D ( 2) y receptores D (3). Importancia para la modulación de la transmisión monoaminérgica frontocortical y los estados depresivos.
- Ernst E, Pittler MH. Yohimbina para la disfunción eréctil: una revisión sistemática y metaanálisis de ensayos clínicos aleatorios.
- Carey MP, Johnson BT. Eficacia de la yohimbina en el tratamiento del trastorno eréctil: cuatro integraciones metaanalíticas.
- Adeniyi AA, Brindley GS, Pryor JP, et al. Yohimbina en el tratamiento de la disfunción orgásmica.
- Cohen PA, Wang YH, Maller G, et al. Cantidades farmacéuticas de yohimbina encontradas en suplementos dietéticos en los EE. UU.
- Neychev V, Mitev V. Efectos pro-sexuales y potenciadores de andrógenos de Tribulus terrestris L .: ¿Realidad o ficción?
- Gauthaman K, Ganesan AP. Los efectos hormonales de Tribulus terrestris y su papel en el manejo de la disfunción eréctil masculina: una evaluación con primates, conejos y ratas.
- Qureshi A, Naughton DP, Petroczi A. Una revisión sistemática sobre el extracto de hierbas Tribulus terrestris y las raíces de su supuesto efecto afrodisíaco y de mejora del rendimiento.
- Neychev VK, Mitev Vi. La hierba afrodisíaca Tribulus terrestris no influye en la producción de andrógenos en hombres jóvenes.
- Gauthaman K, Ganesan AP, Prasad RN. Efectos sexuales de punturevina (Tribulus terrestris) extracto (protodioscina): una evaluación utilizando un modelo de rata.
- Adaikan PG, Gauthaman K, Prasad RN, et al. Efectos farmacológicos proerectiles de Tribulus terrestris Extracto en el cuerpo cavernoso del conejo.
- Kamenov Z, Fileva S, Kalinov K, et al. Evaluación de la eficacia y seguridad de Tribulus terrestris en la disfunción sexual masculina: un ensayo clínico prospectivo, aleatorizado, doble ciego, controlado con placebo.
- Kotirum S, Ismail SB, Chaiyakunapruk N. Eficacia de Tongkat Ali (Longifolia) sobre la mejora de la función eréctil: revisión sistemática y metanálisis de ensayos controlados aleatorios.
- Jue HE, Mohamed IN, Hussain Z, et al. Longifolia como un potencial adoptante de la salud sexual masculina: una revisión sistemática de estudios clínicos.
- Talbott SM, Talbott J, George A, et al. Efecto de Tongkat Ali sobre las hormonas del estrés y el estado de ánimo psicológico en sujetos con estrés moderado.
- Dell'Agli M, Galli GV, Dal Cero, et al. Potente inhibición de la fosfodiesterasa-5 humana por derivados de icariina.
- Ning H, Xin ZC, Lin G, et al. Efectos de la icariina sobre la actividad de la fosfodiesterasa-5 in vitro y el nivel de monofosfato de guanosina cíclico en las células del músculo liso cavernoso.
- Jiang Z, Hu B, Wang J, et al. Efecto de la icariina en los niveles de GMP cíclicos y en la expresión de ARNm de la fosfodiesterasa específica de cGMP de unión a cGMP (PDE5) en el pene cavernoso.
- Romero M, Platt DH, Tawfik HE, et al. La disfunción vascular coronaria inducida por la diabetes implica una mayor actividad de arginasa.
- Schramm L, La M, Heidbreder E, et al. Deficiencia de L-arginina y suplementación en insuficiencia renal aguda experimental y en trasplante de riñón humano.
- Curis E, Nicolis I, Moinard C, et al. Casi todo sobre la citrulina en los mamíferos.
- Bode-Böger SM, Böger RH, Galland A, et al. Vasodilatación inducida por L-arginina en humanos sanos: relación farmacocinética-farmacodinámica.
- Chen J, Wollman Y, Chernichovsky T, et al. Efecto del admnistratino oral de altas dosis de L-arginina donante de óxido nítrico en hombres con disfunción eréctil orgánica: resultados de un estudio doble ciego, aleatorizado, controlado con placebo.
- Bode-Böger SM, Scalera F, Ignarro LJ. La paradoja de la L-arginina: importancia de la relación L-arginina / dimetilaginina asimétrica.
- Lebret T, Hervé JM, Gorny P, et al. Eficacia y seguridad de una nueva combinación de glutamato de L-arginina y clorhidrato de yohimbina: una nueva terapia oral para la disfunción eréctil.
- Akhondzadeh S, Amiri A, Bagheri A. Eficacia y seguridad de la combinación oral de yohimbina y L-arginina (SX) para el tratamiento de la disfunción eréctil: un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo.
- Stanislavov R, Nikolova V. Tratamiento de la disfunción eréctil con pycnogenol y L-arginina.
- Schulman SP, Becker LC, Kass DA, terapia con L-arginina en el infarto agudo de miocardio: la interacción vascular con la edad en el infarto de miocardio (MI VINTAGE) ensayo clínico aleatorizado.
- Sáenz de Tejada I, Angulo J, Cuevas P, et al. Perfiles de selectividad comparativa de tadalafil, sildenafil y vardenafil utilizando un ensayo de actividad de fosfodiesterasa in vitro.
- Evans J, Hill S. Una comparación de los inhibidores de la fosfodiesterasa-5 disponibles en el tratamiento de la disfunción eréctil: un enfoque en avanafil.
- Chávez A, Coffield KS, Rajab MH, Jo C. Tasa de incidencia de cáncer de próstata en hombres tratados por disfunción eréctil con inhibidores de la fosfodiesterasa tipo 5: análisis retrospectivo.
- Jinete JR, Wilson KM, Sinnott JA, et al. Frecuencia de eyaculación y riesgo de cáncer de próstata: resultados actualizados con una década adicional de seguimiento.
- Tang H, Wu W, Fu S, et al. Inhibidores de la fosfodiesterasa tipo 5 y riesgo de melanoma: un metanálisis.
- Chen KK, Chan JY, Chang LS. Neurotransmisión dopaminérgica en el núcleo paraventricular del hipotálamo en la regulación central de la erección del pene en la rata.
- Altwein JE, Keuler FU. Tratamiento oral de la disfunción eréctil con apomorfina SL.
- Heaton JP. Cuestiones clave de los ensayos clínicos de apomorfina SL.
- Linet OI, Ogring FG. Eficacia y seguridad del alprostadil intracavernoso en hombres con disfunción eréctil.
- Porst H, Buvat J, Meuleman E, et al. Alprostadil alfadex intracavernoso: un tratamiento eficaz y bien tolerado para la disfunción eréctil. Resultados de un estudio europeo a largo plazo.
- Baniel J, Israilov S, Engelstein D, et al. Resultado a tres años de un programa de tratamiento progresivo para la disfunción eréctil con inyecciones intracavernosas de fármacos vasoactivos.
- Bernie HL, Segal R, Le B, et al. Un algoritmo de enfoque empírico versus basado en el riesgo para la terapia de inyección intracavernosa: un estudio prospectivo.
- Albaugh J. Algoritmo de inyección intracavernosa.
- Young SR, Dyson M. El efecto de la ecografía terapéutica en la angiogénesis.
- Lu Z, Lin G, Reed-Maldonado A, et al. El tratamiento con ondas de choque extracorpóreas de baja intensidad mejora la función eréctil: una revisión sistemática y un metanálisis.
- Qiu X, Lin G, Xin Z, et al. Efectos de la terapia de ondas de choque de baja energía sobre la función eréctil y el tejido de un modelo de rata diabética.
- Lin G, Reed-Maldonado AB, Wang B, et al. Activación in situ de células progenitoras del pene con terapia de onda de choque extracorpórea de baja intensidad.
- Vardi Y, Appel B, Jacob G, et al. ¿Puede la terapia de ondas de choque extracorpóreas de baja intensidad mejorar la función eréctil? Un estudio piloto de seguimiento de 6 meses en pacientes con disfunción eréctil orgánica.
- Vardi Y, Appel B, Kilchevsky A, et al. ¿La terapia de ondas de choque extracorpóreas de baja intensidad tiene un efecto fisiológico sobre la función eréctil? Resultados a corto plazo de un estudio aleatorizado, doble ciego, simulado y controlado.
- Srini VS, Reddy RK, Shultz T, et al. Terapia de ondas de choque extracorpóreas de baja intensidad para la disfunción eréctil: un estudio en una población india.
- Gruenwald I, Appel B, Vardi Y. Terapia de ondas de choque extracorpóreas de baja intensidad: un tratamiento novedoso y eficaz para la disfunción eréctil en pacientes con DE grave que responden mal a la terapia con inhibidores de la PDE5.
- Kitrey ND, Gruenwald I, Appel B, et al. El tratamiento de ondas de choque de baja intensidad en el pene es capaz de cambiar PDE5i no respondedores a respondedores: un estudio doble ciego, controlado simulado.
- Olsen AB, Persiani M, Boie S, et al. ¿Puede la terapia de ondas de choque extracorpóreas de baja intensidad mejorar la disfunción eréctil? Un estudio prospectivo, aleatorizado, doble ciego, controlado con placebo.
- Bechara A, Casabé A, De Bonis W, et al. Doce meses de eficacia y seguridad de la terapia de ondas de choque de baja intensidad para la disfunción eréctil en pacientes que no responden a los inhibidores de la fosfodiesterasa tipo 5.
- Fojecki GL, Tiessen S, Osther PJ. Efecto de la terapia de ondas de choque lineales de baja energía sobre la disfunción eréctil: un ensayo clínico aleatorizado, doble ciego, controlado con simulación.
- Fojecki GL, Tiessen S, Osther PJ. Efecto de la terapia de onda de choque extracorpórea lineal de baja intensidad para la disfunción eréctil: seguimiento de 12 meses de un estudio aleatorizado, doble ciego, controlado con simulación.
- Kitrey ND, Vardi Y, Apelación B, et al. Tratamiento de ondas de choque de baja intensidad para la disfunción eréctil: ¿cuánto dura el efecto?
- Gruenwald I, Kitrey ND, Appel B, et al. Terapia de ondas de choque extracorpóreas de baja intensidad en la enfermedad vascular y la disfunción eréctil: teoría y resultados.
- Clavijo R, Kohn TP, Kohn JR, et al. Efectos de la terapia de ondas de choque extracorpóreas de baja intensidad sobre la disfunción eréctil: una revisión sistemática y un metanálisis.
- Pavlovic V, Ciric M, Jovanovic V, et al. Plasma rico en plaquetas: una breve descripción de ciertos componentes bioactivos.
- Coppinger JA, Cagney G, Toomey S, et al. La caracterización de las proteínas liberadas de las plaquetas activadas conduce a la localización de nuevas proteínas plaquetarias en lesiones ateroscleróticas humanas.
- Yu W, Wang J, Yin J. Plasma rico en plaquetas: un producto prometedor para el tratamiento de la regeneración nerviosa periférica después de una lesión nerviosa.
- Banno JJ, Kinnick TR, Roy L, et al. La eficacia del plasma rico en plaquetas (PRP) como terapia complementaria para el tratamiento de la disfunción eréctil (DE): resultados iniciales.
- Baumhäkel M, Werner N, Bohm M, et al. Las células progenitoras endoteliales circulantes se correlacionan con la función eréctil en pacientes con enfermedad coronaria.
- Ichim TE, Warbington T, Cristea O, et al. Administración intracavernosa de células mononucleares de la médula ósea: ¿un nuevo método para tratar la disfunción eréctil?
- Franck-Lissbrant I, Häggström S, Damber JE, et al. La testosterona estimula la angiogénesis y el crecimiento vascular en la próstata ventral en ratas adultas castradas.
- Sieveking DP, Chow RW, Ng MK. Andrógenos, angiogénesis y regeneración cardiovascular.
- Mingchao Li, Ruan Y, Wang T, et al. Terapia con células madre para la disfunción eréctil diabética en ratas: un metanálisis.
- Lin CS, Xin ZC, Wang Z, et al. Terapia con células madre para la disfunción eréctil: una revisión crítica.
- Haahr MK, Jensen CH, Toyserkani NM, et al. Seguridad y efecto potencial de una inyección intracavernosa única de células regenerativas derivadas de tejido adiposo autólogo en pacientes con disfunción eréctil después de una prostatectomía radical: un ensayo clínico abierto de fase I.
- Yiou R, Hamidou L, Birebent B, et al. Seguridad de las células mononucleares de médula ósea intracavernosa para la disfunción eréctil de prostatectomía postradical: un estudio piloto abierto de escalada de dosis.
- Mousavinejad M, Andrews P, Shoraki E. Consideraciones actuales de bioseguridad en la terapia con células madre.