COMENTARIOS: La sección de controversia de este artículo contiene lo siguiente:
Existen varios estudios basados en electrofisiología, por el grupo de Prause, que proporcionan alguna evidencia de que el deseo sexual, no la hipersexualidad, predice la autorregulación de la excitación sexual. [ 92 ]. Estos investigadores sugieren en otro trabajo que los sujetos que informaron problemas para regular su visualización de estímulos sexuales visuales (VSS) que también informaron un mayor deseo sexual mostraron menores potenciales positivos tardíos (LPP) en respuesta a la VSS. Los autores proponen que este patrón parezca diferente de los modelos de adicción a sustancias. [ 93 ].
Los dos artículos de EEG del "grupo de Prause" han sido ampliamente criticados en revistas revisadas por pares y por otros (incluido YBOP). En realidad, los hallazgos de ambos artículos son consistentes con el modelo de adicción, a pesar de las dudosas conclusiones de sus autores. Para el estudio de EEG de 2013, consulte:
- Nada se correlaciona con nada en el nuevo estudio de pornografía de SPAN Lab (2013)
- Crítica revisada por pares: 'Alto deseo', o 'meramente' una adicción? Una respuesta a Steele et al. (2014) por Donald L. Hilton, Jr., MD,
- Crítica revisada por pares: "Neurociencia de la adicción a la pornografía en Internet: una revisión y actualización" (2015)
- Análisis revisados por pares: "Correlaciones neuronales de la reactividad de la señal sexual en individuos con y sin comportamientos sexuales compulsivos" (2014)
Para el estudio EEG de 2015 ver:
- Crítica de "Modulación de potenciales positivos tardíos por imágenes sexuales en usuarios problemáticos y controles incompatibles con 'Adicción a la pornografía' (2015)"
- Crítica revisada por pares: Neurociencia de la adicción a la pornografía en Internet: una revisión y actualización (2015)
¿No sería fantástico si los investigadores realmente leyeran los estudios que citan en lugar de simplemente repetir como loros los titulares del autor principal?
ENLACE A PUBLICACIÓN
Publicado: 12 de Octubre de 2015 (ver historia)
DOI: 10.7759 / cureus.348
Cita este artículo como: Blum K, Badgaiyan RD, Gold MS (octubre 12, 2015) Hipersexualidad Adicción y abstinencia: fenomenología, neurogenética y epigenética. Cureus 7 (10): e348. doi: 10.7759 / cureus.348
Resumen
La hipersexualidad se ha definido como un aumento anormal de la actividad sexual. Estudios epidemiológicos y clínicos han demostrado que esta condición no parafílica consiste en comportamientos y trastornos sexuales “excesivos” acompañados de angustia personal y morbilidad social y médica. Es un tema muy controvertido y político en términos de cómo clasificarlo mejor como similar o no similar a las conductas adictivas, incluido el abuso de sustancias. El trastorno hipersexual se conceptualiza como un trastorno del deseo sexual no parafílico con impulsividad. Las perspectivas fisiopatológicas incluyen la desregulación de la excitación y el deseo sexuales, la impulsividad sexual y la compulsividad sexual. El núcleo accumbens, situado dentro del cuerpo estriado ventral, media los efectos reforzantes de las drogas de abuso, como la cocaína, el alcohol, la nicotina y la comida, así como la música. De hecho, se cree que esta estructura exige comportamientos provocados por estímulos de incentivos. Estos comportamientos incluyen recompensas naturales como alimentarse, beber, comportamiento sexual y locomoción exploratoria. Una regla esencial del refuerzo positivo es que las respuestas motoras aumentarán en magnitud y vigor si van seguidas de un evento gratificante. Aquí, planteamos la hipótesis de que existe un mecanismo de acción común (MOA) para los poderosos efectos que las drogas, la música, la comida y el sexo tienen sobre la motivación humana. El impulso humano por las tres conductas motivacionales necesarias “hambre, sed y sexo” puede tener antecedentes genéticos moleculares comunes que, si se deterioran, conducen a conductas aberrantes. Nuestra hipótesis es que, sobre la base de una gran cantidad de apoyo científico, la actividad hipersexual es de hecho como las drogas, la comida y la música que activan los circuitos de recompensa mesolímbicos del cerebro. Además, el gen dopaminérgico y posiblemente otros polimorfismos de genes relacionados con neurotransmisores candidatos afectan los resultados conductuales tanto hedónicos como anhedónicos. Se sabe poco sobre la genética y la epigenética de la hipersexualidad en la literatura actual. Sin embargo, anticipamos que los estudios futuros basados en evaluaciones con instrumentos clínicos combinados con el genotipado de adictos al sexo proporcionarán evidencia para el agrupamiento específico de tipologías sexuales con asociaciones polimórficas. Se han realizado algunos estudios que utilizan técnicas electrofisiológicas que no respaldan la opinión de que la hipersexualidad sea de hecho similar al abuso de sustancias y otras adicciones conductuales. Los autores también están alentando a los científicos clínicos y académicos a embarcarse en una investigación utilizando herramientas de neuroimagen para examinar agentes agonistas dopaminérgicos naturales dirigidos a polimorfismos genéticos específicos para "normalizar" el comportamiento hipersexual.
Introducción y antecedentes
Ciertamente, el comportamiento hipersexual se ha documentado en entornos clínicos y de investigación durante la última década. [ 1 ]. Benjamin Rush, médico, uno de los padres fundadores de los Estados Unidos, documentó clínicamente conductas sexuales excesivas [ 2 ] Richard von Krafft-Ebing, un sexólogo pionero de Europa occidental del siglo 19, y Hirshfeld en 1948 continuaron el trabajo. [3 4-]. El inquilino básico de estos investigadores sugirió que la hipersexualidad constituía una conducta sexual persistente y desviada socialmente tanto en hombres como en mujeres con un apetito sexual excesivo y una mala adaptación. En 1975, el cochecito caracterizó la condición de don juanismo. [ 5 ]. En 1969, Allen sugirió satiriasis para hombres y ninfomanía en mujeres apoyadas por Ellis y Sagarin [6 7-]. Aunque la hipersexualidad no está incluida como un diagnóstico psiquiátrico en el DSM, el trabajo de varios investigadores contemporáneos, incluidos Kafka, Reid, Bancroft, sus colegas y la inclinación de la Organización Mundial de la Salud, podría llevar a la inclusión de esta condición como una entidad de diagnóstico separada. [8 11-].
Revisar
Metodología de la literatura
Se utilizó la base de datos de Medline, al 12 de julio de 2015, para realizar una búsqueda bibliográfica en Internet. Se incluyeron los siguientes términos: hipersexualidad (170), hipersexualidad (479), adicción sexual (1,652), adicto al sexo (1,842), impulsividad sexual (989), sexual compulsiva (946), sexo compulsivo (1,512), compulsión sexual (782). ), trastorno relacionado con la parafilia (234) y sexo excesivo (857). Dado que este artículo es una breve revisión más que un metanálisis, se basa en una selección representativa de estos estudios que tienen relevancia para los subtemas cubiertos. La no inclusión de un estudio en particular no niega su importancia para el campo. Es comprensible que haya quienes no están de acuerdo con el concepto de que la adicción al sexo es de hecho un trastorno real e incluso pueden tener pruebas que demuestren que están en una base sólida. Sin embargo, argumentamos que existe una amplia evidencia para proponer que la adicción sexual existe y los estudios que involucran neuroimagen, neurogenética e incluso epigenética apoyan la noción de que la adicción compulsiva al sexo y la hipersexualidad podrían considerarse un trastorno adictivo. Si bien somos conscientes de esta discrepancia, presentamos respectivamente nuestro punto de vista para generar un mayor escrutinio científico y no para disipar la retórica científica sobre este importante tema. Para arrojar luz adicional sobre el tema, hemos buscado en la literatura algún consenso. El 17 de agosto de 2015, hicimos una búsqueda en PUBMED Central con el siguiente término: "¿Es el sexo una adicción real?" y recuperó 46 artículos.
Definición de adicción sexual
La adicción sexual se define como cualquier comportamiento sexual compulsivo que interfiere con la vida normal y causa un estrés severo en la familia, los amigos, los seres queridos y el entorno laboral. La adicción sexual se ha denominado dependencia sexual, hipersexualidad y compulsividad sexual. Sea como sea, es un comportamiento compulsivo que domina por completo la vida del adicto. Los adictos al sexo hacen del sexo una prioridad más importante que la familia, los amigos y el trabajo. El sexo se convierte en el principio organizador de la vida de los adictos. Están dispuestos a sacrificar lo que más aprecian para preservar y continuar su comportamiento malsano. [ 12 ]. El deseo hipersexual se ha delineado como un deseo basado en una evaluación de por vida de la frecuencia del comportamiento sexual y el tiempo dedicado a las fantasías sexuales asociadas. En varones, Kafka y Hannen definieron una evaluación del deseo hipersexual como el período sostenido más alto (al menos seis meses de duración mínima) de conducta sexual persistentemente promulgada (salida sexual total / Semana después de la edad 15). De hecho, en el 72-80 se identificó una historia longitudinal de deseo hipersexual, operacionalmente definida como anteriormente, en el porcentaje de hombres que buscan tratamiento para parafilias y trastornos relacionados con parafilia. [ 13 ].
Hipersexualidad y diferencias de género.
Está bien establecido que en la comunidad sexual humana y en la literatura, el deseo sexual se capitula como la presencia de fantasías, actividades o impulsos sexuales, y la motivación del ser humano para participar en conductas sexuales. Hay señales relevantes tanto internas como externas [ 14 ]. Los defensores de la teoría evolutiva han argumentado que los hombres y las mujeres tienen diferentes agendas cuando se trata de la actividad sexual [ 15 ]. Numerosos estudios revelan diferencias distintivas entre hombres y mujeres. Los machos han aumentado la fantasía sexual. [ 16 ], mayor frecuencia de masturbación [ 17 ]Mayor propensión a la excitación sexual visual generada externamente. [ 18 ] actitudes permisivas hacia el sexo casual [ 19 ], facilidad de excitación [ 20 ], y la motivación intrínseca. [ 21 ]. En contraste, las hembras muestran un paisaje sexual diferente con motivación sexual, excitación sexual y comportamiento sexual moldeado por factores evolutivos. [ 22 ] y una mayor inversión biológica, emocional y temporal en la reproducción y la crianza de los hijos. [ 23 ]. Las hembras son menos vulnerables a la hipersexualidad. [ 24 ] y adaptado para fomentar las relaciones de afiliación y el compromiso del socio a largo plazo [ 25 ]. Si bien se estima que la adicción sexual afecta a 3% a 6% de la población, la comprensión clara de los antecedentes neurobiológicos es limitada. [ 26 ] así como evaluaciones clínicas [ 27 ]. Fomentamos la lectura adicional sobre compulsión sexual, apego y orientación sexual. [ 28 ]y diferencias de género en las respuestas a estímulos sexuales. [29 30-].
Es de destacar que Kafka y Hennen [ 13 ], encontraron que la edad media de inicio del comportamiento hipersexual persistente era 18.7 ± 7.2 años en hombres sexualmente activos y el rango de edad de inicio del comportamiento hipersexual era la edad 7-46. La duración promedio de esta frecuencia más alta mantenida consistentemente de la conducta apetitiva sexual fue 12.3 ± 10.1 años. Sin embargo, la edad media de estos varones sexuales activos siendo hipersexuales que buscaron tratamiento fue 37 ± 9 años. Hanson, et al. También evaluó la hipersexualidad en los infractores y encontró que los infractores bajos tenían tasas de reincidencia más bajas que los infractores de alto riesgo [ 31 ].
Hipersexualidad y abuso de sustancias comórbidas.
Existe una alta comorbilidad entre el trastorno hipersexual y otras adicciones, como el trastorno por uso de sustancias. [32 33-]. Específicamente, García y Thibaut propusieron que la fenomenología del desorden sexual no parafílico excesivo debe clasificarse como un comportamiento adictivo, en lugar de un trastorno obsesivo-compulsivo o de control de impulsos. [ 34 ]. Señalan correctamente que los criterios son bastante similares a los de los trastornos adictivos, como también lo proponen otros. [ 35 ]. Estos investigadores han impulsado la investigación continua en esta área y la posible inclusión futura del trastorno hipersexual en el DSM-6. Las drogas de abuso, el rock 'n' roll y el sexo coexisten, y se han construido festivales enteros en torno a estas combinaciones desde Woodstock hasta el presente.
La literatura revela que los usuarios de metanfetamina informan que esta droga estimulante aumenta el deseo sexual, especialmente las conductas de riesgo. Sin embargo, se ha demostrado que la anfetamina reduce la actividad sexual de las ratas hembras. Con esto en mente, Holder, et al. Evaluó el papel de la metanfetamina en ratas hembras. [ 36 ]. Encontraron que, por el contrario, la metanfetamina facilitó el comportamiento sexual femenino, y este efecto se debe al aumento de la transmisión dopaminérgica e incluso a la posible neurotransmisión debida a la combinación de hormonas ováricas y metanfetamina. Específicamente, encontraron un aumento de la motivación sexual junto con la activación de la actividad neuronal en la amígdala medial y el núcleo ventromedial del hipotálamo.
Además, los científicos de los Países Bajos han estudiado la comorbilidad del abuso de sustancias en personas que se identifican a sí mismas [ 37 ]. En este estudio, Spauwen, et al. llegó a la conclusión de que 79% de los swingers informaron el uso recreativo de drogas (incluido el alcohol y el uso de drogas para la disfunción eréctil); 46% de ellos reportaron múltiples usos de drogas. De hecho, el uso recreativo de drogas (excluyendo el alcohol y las drogas para la disfunción eréctil) se relacionó significativamente con conductas sexuales de alto riesgo en hombres y mujeres. Además, el uso de drogas se asoció de forma independiente con las infecciones de transmisión sexual (ITS) en mujeres que practican el swing, especialmente aquellas que participan en el sexo grupal.
Castelo-Branco, et al. informaron que las mujeres jóvenes adultas perciben que la sexualidad es una parte importante de su vida pero no una preocupación principal (77.6%) [ 38 ]. También informaron que el alcohol elimina las barreras para tener relaciones sexuales (62.3%). Es importante destacar que también encontraron que el abuso del alcohol era una variable predictiva para mejorar las conductas de riesgo independientemente de la edad de la mujer.
Es de destacar que Jia, et al. reportó conductas sexuales peligrosas entre los abusadores de psicoestimulantes y heroína, incluidas las relaciones sexuales múltiples, las parejas sexuales ocasionales, las parejas homosexuales y nunca u ocasionalmente practicó el sexo seguro [ 39 ].
Nuestro principal inquilino es que las drogas, como la metanfetamina, la cocaína, la heroína y el alcohol, pueden estimular el deseo sexual en los no adictos. En los adictos, es bastante diferente; los mismos medicamentos pueden causar anhedonia de forma crónica. Sin embargo, después de la adicción durante la fase de recuperación, en muchos casos se han observado conductas similares a las de los afrodisíacos.
Hipersexualidad y retirada.
Una búsqueda en PubMed (7/19-15) que utilizó el término "hipersexualidad y síntomas de abstinencia" dio como resultado solo cinco artículos, ninguno de los cuales describió "sintomatología de abstinencia". Sin embargo, una búsqueda alternativa usando los términos "síntomas de abstinencia de actividad sexual alta" dio como resultado 25 artículos enumerados.
Los adictos en la recuperación reportan aumentos en la alimentación y un apetito por ciertos alimentos y abuso de cigarrillos durante la abstinencia prolongada. El aumento de peso también se ha demostrado y documentado en animales y humanos abstinentes recientemente y prolongados. [ 39 ]. Bruijnzeel hizo la interesante observación de que la abstinencia aguda de opiáceos puede provocar orgasmos espontáneos [ 40 ]. Es importante destacar que, en el artículo, Bruijnzeel propuso que la sintomatología de abstinencia de los medicamentos y la actividad sexual intensiva posiblemente crónica pueden deberse a la función no opuesta de la señalización del receptor de opioides kappa que inhibe la liberación de dopamina a la vez que aumenta la noradrenalina en los circuitos de recompensa cerebral.
Los artículos en la literatura sufrieron de una falta de rigor con respecto a la abstinencia aguda y prolongada y la abstinencia confirmada por la prueba de orina. Los programas de tratamiento clínico se han movido cada vez más del tratamiento de ambos sexos al aislamiento de los dos sexos, proporcionando programas de tratamiento específicos de género. También ofrecen educación para abordar los aumentos tempranos y prolongados del interés y la actividad sexual, y la relación entre la recuperación y la alimentación y la sobrealimentación.
Algunos investigadores han informado síntomas de abstinencia inducidos por hipersexualidad con diversos grados de severidad y abuso de sustancias concomitantes [41 45-]. Como resultado de esta búsqueda, no encontramos un solo documento que describiera los síntomas de abstinencia reales asociados con la abstinencia de encuentros sexuales activos. La mayoría de los artículos citados involucraban los efectos de la abstinencia de drogas de abuso, como los opioides, la nicotina, las anfetaminas y la cocaína, que pueden afectar la actividad sexual.
Hipersexualidad y neurogenética.
Una búsqueda en PubMed (7-19-15) reveló solo seis artículos enumerados que usaban el término "genes e hipersexualidad", centrándose principalmente en artículos relacionados con el síndrome de Kleine-Levin (KLS), una enfermedad muy rara por la que la hipersexualidad podría durar hasta 27 años. En un estudio, se encontró que se detectó un HLA-DQB0602, DQBl * XNUMX con respuesta inmune en cantidades significativas en pacientes con KLS y podría elevar el riesgo de KLS [46 47-].
Sin embargo, cuando utilizamos los términos "actividad sexual y genes", se enumeraron 2,826 artículos y proporcionamos una breve sinopsis de algunos aspectos neurogenéticos importantes. Nuestra hipótesis es que tanto los comportamientos hedónicos como los anhedónicos son resultados en parte de los alelos de riesgo de un individuo para estos comportamientos y que el tratamiento consiste en apuntar adecuadamente a estos polimorfismos identificados. Además, la respuesta al tratamiento también depende de estos alelos de riesgo y proporciona un fundamento importante para las pruebas farmacogenéticas y las soluciones farmacogenómicas / nutrigenómicas.
Tras el controvertido hallazgo inicial de Blum, et al. En 1990 de la primera evidencia de una asociación entre el alelo DRD2 Al y el alcoholismo grave, ha habido artículos de 3,938 en PubMed (7-19-15) [ 48 ]. Los estudios cubren el polimorfismo del gen psiquiátrico, el alelo DRD2 Al y los comportamientos y la fisiología asociados. Sin embargo, existe una escasez de datos que vinculen la actividad sexual con este y otros genes relacionados a pesar de la evidencia abrumadora de la activación mesolímbica, especialmente en las vías dopaminérgicas y los loci neuronales relacionados con los estímulos y la actividad sexual. Cabe destacar que Blum y Noble clasificaron correctamente el gen DRD2 como un gen de recompensa generalizado responsable de todo el comportamiento del síndrome de deficiencia de recompensa (SDR). De hecho, al utilizar el análisis bayesiano, los portadores del alelo Taq Al tendrán, durante su vida, una probabilidad del 74%, de encontrarse con uno o más comportamientos del síndrome de deficiencia de recompensa (SDR) [ 49 ].
La primera asociación de cualquier gen de polimorfismo y actividad sexual no ocurrió hasta 1999 cuando Miller, et al. Evaluamos algunos genes dopaminérgicos. [ 50 ]. El hallazgo básico es que el sistema dopaminérgico en el cerebro parece jugar un papel importante en la regulación de la conducta sexual. La relación entre los genes para los receptores de dopamina Dl, D2 y D4 y la edad en la primera relación sexual (AFSI) se examinó en una muestra de hombres y mujeres europeo-americanos no hispanos de 414. Se observó una asociación significativa entre un alelo DRD2 y AFSI y una asociación aún más fuerte cuando el alelo DRD2 interactuó con un alelo DRDl. Se construyó un modelo de regresión restringida prediciendo AFSI utilizando el sexo y un grupo de nueve variables psicosociales como predictores. La adición de los predictores DRD2 y DRD2-by-DRD1 a este modelo aumentó la varianza explicada en 23% y 55%, respectivamente. El hecho de que estos hallazgos sugieran una asociación más fuerte entre los hombres que entre las mujeres está de acuerdo con el trabajo reciente de otros que muestran una mayor respuesta de estímulos sexuales en hombres que en mujeres [ 51 ]. Entonces, tal vez "los hombres son de Marte y las mujeres de Venus" y esto incluso puede ser cierto para el abuso de cocaína. [ 52 ].
Específicamente, los estudios preclínicos y clínicos han mostrado patrones dimórficos sexuales en las respuestas de comportamiento a la cocaína en todas las fases del proceso de adicción a la cocaína (inducción, mantenimiento y recaída). Por lo tanto, está surgiendo una imagen clara que sugiere que existe una base biológica de las diferencias específicas por sexo en la adicción a la cocaína. Estas diferencias resultan de la regulación dispar del SNC por hormonas gonadales masculinas y femeninas y pueden predecirse por la presencia de polimorfismos del gen DRD2 [ 53 ]. Además, se sabe que las asociaciones genéticas entre la COMT y diversos fenotipos psiquiátricos muestran con frecuencia diferencias entre hombres y mujeres. Estos incluyen el polimorfismo funcional de Val (158) Met en COMT que se asocia con trastorno obsesivo-compulsivo en hombres y con fenotipos de ansiedad en mujeres. Además, el polimorfismo Val (158) Met en COMT tiene un mayor impacto en la función cognitiva en niños que en niñas [ 54 ].
Miller, et al. no encontró una asociación de los polimorfismos relacionados con el gen DRD4 y la edad de la primera relación sexual [ 50 ]. Sin embargo, otros encontraron una asociación significativa en ciertos grupos étnicos. Específicamente, su análisis de los polimorfismos en DRD4 indica que aquellos con cualquier genotipo - 3R experimentaron un riesgo de primera relación sexual mayor que aquellos con otro genotipo (o cualquier - 4R) en todas las etnias (n = 2,552). Curiosamente, el riesgo de tener una primera relación sexual no difiere entre los dos genotipos en la muestra afroamericana, lo que plantea la cuestión de la educación cultural. [ 55 ].
La experiencia sexual, como el uso repetido de drogas, produce cambios a largo plazo, incluida la sensibilización en el núcleo accumbens (NAc) y el estriado dorsal. Bradley, et al. utilizando el análisis de micromatrices para estudiar hámsters, se descubrió por primera vez que la experiencia sexual en animales machos o hembras regulaba hacia arriba o hacia abajo la expresión de ARNm de una serie de genes en el NAc [ 56 ]. Encontraron que en comparación con los animales sexualmente ingenuos, los hámsters con experiencia sexual que recibieron un estímulo masculino en la Semana 7 mostraron un aumento en una gran cantidad de genes. Por el contrario, los hámsters hembras con experiencia sexual que no recibieron un estímulo masculino en la Semana 7 mostraron una reducción en la expresión de muchos genes. Según los autores, este primer perfil genético en hámsters hembras puede proporcionar una idea de los mecanismos por los cuales tanto las conductas (sexo) como las drogas de abuso inducen cambios a largo plazo en las vías de dopamina mesolímbica y nigrostriatal.
Los electrodos bipolares, implantados bilateralmente en el hipotálamo lateral y la zona tegmental nigraventral de la sustancia, se utilizaron estereotaxicamente para proporcionar experiencias de recompensa autoestimulables crónicas similares a la conducta sexual. Se ha encontrado que este tipo de estimulación induce un aumento significativo en el número de sinapsis en la región CA3 del hipocampo y la capa molecular de la corteza motora en ratas. En esencia, la estimulación cerebral crónica indujo potenciación a largo plazo (LTP), que se sabe que incrementa las nuevas conexiones sinápticas [ 57 ]. Una sola exposición a la cocaína en animales ingenuos es suficiente para desencadenar cambios sostenidos en las sinapsis glutamatérgicas del área tegmental ventral (VTA) que se asemejan a la LTP dependiente de la actividad en otras regiones del cerebro. Esta LTP inducida por la cocaína parece estar mediada a través de la activación del receptor D5 de dopamina de los receptores N-metil-D-aspartato (NMDA) y requiere síntesis de proteínas [ 58 ], una vez más apoyando nuestra premisa aquí propuesta de que las drogas y el sexo pueden tener sustratos neuroquímicos comunes.
La investigación empírica ha revelado una relación positiva entre el número de parejas sexuales y la participación en conductas antisociales [ 59 ]. La mayoría de los intentos de explicar esta asociación han tomado una perspectiva evolutiva. Desde la perspectiva evolutiva, los mismos rasgos, por ejemplo, la impulsividad, la miopía y la agresividad, que están relacionados con una gran cantidad de parejas sexuales también están relacionados con la participación criminal. Sin embargo, también hay razones para creer que la co-variación entre parejas sexuales y conductas delictivas puede explicarse parcialmente por una vía genética común, donde los genes que están relacionados con el número de parejas sexuales también están relacionados con la conducta antisocial. Utilizando la justificación descrita anteriormente, Beaver et al. encontró una fuerte asociación positiva entre las parejas sexuales y el comportamiento antisocial y los polimorfismos del gen transportador de dopamina (DAT1) explica la variación en el número de parejas sexuales y la conducta delictiva de los hombres [ 59 ]. El efecto polimórfico del gen DAT l y el número de parejas sexuales pueden deberse a una asociación encontrada entre ciertos polimorfismos y la eyaculación masculina prematura masculina. Los portadores del genotipo 1OR / 1OR tuvieron puntuaciones que indican un umbral inferior para eyacular en cada uno de los indicadores en comparación con el grupo portador combinado 9R9R / 9R10R (9R mayor actividad menor disponibilidad de dopamina) [ 60 ]. Se han encontrado polimorfismos del gen DATl, específicamente el genotipo 10R / 10R, en delincuentes juveniles que asisten a la Escuela Brown (San Marcos, Texas) por conductas agresivas patológicas, incluida la conducta antisocial [ 61 ]. Se observó una correlación positiva tanto de DRD2 como de los polimorfismos DAT1 con violencia patológica en adolescentes en un ensayo clínico a ciegas. Además, aunque inicialmente se conceptualiza como resultado de la imitación por pares de jóvenes de inicio en la niñez o de un curso de vida, hay evidencia creciente de estudios de gemelos que la conducta antisocial de aparición en la adolescencia o limitada por la adolescencia también puede estar influenciada genéticamente. Burt y Mikolajewski no solo confirmaron estos hallazgos con el gen DATl, sino que extendieron estos hallazgos para incluir la variante His452Tyr del gen que codifica el receptor 5-HT2A también. [ 62 ], Más recientemente, Jozkow et al. informó de una asociación entre la dimensión sexual de los síntomas del envejecimiento masculino (AMS) y variantes genéticas de 5-HTRlB G861C [ 63 ]. Por otra parte, Ventas, et al. Encontrado a través del análisis de regresión logística multivariable, una interacción entre el abuso y el grupo 5-HTTLPR por medio del cual hubo una asociación significativa con el estado de no cambio, junto con las puntuaciones de frecuencia de comunicación del compañero en el seguimiento [ 64 ] Tener un historial de abuso se asoció significativamente con mayores probabilidades de no cambiar el uso del condón después de la intervención solo para aquellos con el alelo s.
Se sabe que los polimorfismos en las regiones no codificantes del gen receptor de la vasopresina (Avpr la) están vinculados a las características socioemocionales en humanos, chimpancés y ratones, y pueden deberse a una variación específica del sitio en la expresión génica. Según Barrett, et al., El vole de la pradera socialmente monógamo ofrece una oportunidad única para estudiar la neurobiología de la monogamia. [ 65 ]. De hecho, la señalización de vasopressin la receptor (VlaR) es necesaria para la formación del enlace de par en los machos. Curiosamente, los campañoles de la pradera social exhiben una mayor unión de VlaR en el palidum ventral de procesamiento de recompensa que los voles asociales del mismo género. Barrett, et al. encontraron que la regulación negativa de la densidad VlaR pálida dio lugar a un deterioro significativo en la preferencia por una pareja femenina apareada y una reducción en el comportamiento similar a la ansiedad en la edad adulta [ 65 ]. Otro trabajo de García, et al. reveló que las personas con al menos un alelo de 7 repeticiones (7R +) del DRD4 informan una mayor tasa categórica de comportamiento sexual promiscuo, incluso haber tenido una "aventura de una noche", e informan un aumento de más del 50% en casos de infidelidad sexual [ 66 ].
Es importante destacar que Daw y Guo informaron que los individuos portadores de los genotipos DRD2 * Al / A2, DRD2 * A2 / A2, DATl * 9R / 10R, y MAOA * 2R / están asociados con mayores probabilidades de relaciones sexuales no observadas y otras características de género. [ 67 ]. Las asociaciones DRD2 se aplican tanto a hombres como a mujeres, mientras que los otros vínculos se aplican solo a mujeres. Finalmente, Emanuele, et al. reportaron una asociación significativa entre los genotipos DRD2 TaqI A y “Eros · (un estilo amoroso caracterizado por una tendencia a desarrollar experiencias emocionales intensas basadas en la atracción física hacia la pareja), así como entre el polimorfismo C516T 5HT2A y la“ manía ”( un apego romántico posesivo y dependiente, caracterizado por emociones autodestructivas) [ 68 ].
Epigenética y actividad sexual.
Una revisión de la literatura revela que varios artículos recientes señalan la importancia de los efectos epigenéticos sobre la actividad sexual. Por ejemplo, Matsuda revisó los cambios epigenéticos del receptor de estrógeno (ERalpha) y su influencia en el comportamiento sociosexual. [ 69 ]. De hecho, la alteración de la actividad del gen alfa de ER mediada por mecanismos epigenéticos, como las modificaciones de histonas y la metilación del ADN, altera los comportamientos sexuales. En términos de homosexualidad, Rice, et al. desarrolló un modelo que puede explicar la canalización (conversión) homosexualidad desarrollo sexual [ 70 ]. Explican que este modelo se basa en marcas epigenéticas establecidas en respuesta al cariotipo XX contra XY en células madre embrionarias. En consecuencia, estas marcas aumentan la sensibilidad a la testosterona en los fetos XY y la disminuyen en los fetos XX, lo que canaliza el desarrollo sexual. Se ha postulado que un subconjunto de estas marcas epigenéticas de conversión puede transferirse cuantitativamente de manera transgénica, y podría conducir a un mosaicismo para el desarrollo sexual en la descendencia del sexo opuesto: el fenotipo homosexual.
En el ratón de la pradera socialmente monógamo (Microtus ochrogaster), el apareamiento induce enlaces de pares duraderos que se inician mediante la formación de preferencias de la pareja y están regulados por una variedad de neurotransmisores, incluida la oxitocina, la vasopresina y la dopamina. Trabajo de Gundersen [ 71 ], y Wang, et al. [ 72 ] sugiere que la histona desacetilasa podría facilitar la formación de parejas en parejas de praderas femeninas que pueden tener relevancia para los humanos. Específicamente, Wang, et al. encontraron que los inhibidores de la histonedeacetilasa-butirato de sodio y tricostatina A (TSA) aumentaron la formación de preferencia de pareja en ratones de la pradera femenina [ 72 ]. Esta formación de preferencia de pareja se asoció con una regulación positiva del receptor de oxitocina (OTR, oxtr) y vasopresina Vla (VlaR, avprla) en la NAc, a través de un aumento de la acetilación de histonas en sus respectivos promotores.
Existe una creciente evidencia que indica que las hembras participan activamente en la poliandria, ya sea para evitar la incompatibilidad genética o para sesgar la paternidad en favor de los machos genéticamente superiores. Existe la posibilidad de que la selección de la aptitud masculina superior pueda deberse a efectos epigenéticos. Según Zeh y Zeh, a diferencia de la variación basada en la secuencia del ADN, la variación epigenética puede verse fuertemente influenciada por los efectos ambientales y estocásticos experimentados durante la vida de un individuo. [ 73 ]. Sugieren que la variación epigenética puede ser importante para la selección sexual post-copulatoria y puede explicar los hallazgos que relacionan la capacidad competitiva del esperma con la aptitud de la descendencia.
Evolución genética y meme: procreación humana.
Eysenck propuso una correlación positiva entre la extraversión y la conducta sexual intensificada y entre el neuroticismo y los problemas en la conducta sexual (conducta antisocial). Un estudio anterior con personas casadas no mostró ninguna de estas correlaciones. Se planteó la hipótesis de que esta conexión existe solo para personas no casadas que no tienen relaciones duraderas porque la calidad de la relación determina la interacción sexual. Dentro de una muestra de hombres jóvenes no casados, hubo una correlación positiva entre la extraversión y los elementos en los que la persona describió la actividad sexual anterior con más individuos y con mayor frecuencia. No se encontró correlación con el neuroticismo. También hubo leves correlaciones con otras escalas de personalidad y actitud social. Debido a la correlación con una escala de personalidad de actuación, los hallazgos se interpretaron desde una perspectiva socio-psicológica. En la sociedad actual, se espera que el joven tome la iniciativa en una interacción sexual que un joven extrovertido puede realizar mejor que uno que es introvertido. [ 74 ]. Esta perspectiva está en directa concordancia con la idea de Richard Brodie sobre los genes egoístas de la mente. [ 75 ]. Desde el punto de vista del ADN, por supuesto, los antropólogos estarían de acuerdo en que “todavía estamos aquí por una sola razón; para salir y multiplicarse ". Si bien los avances evolutivos son lentos, un paso cada 20 años aproximadamente, en comparación con la "evolución de los memes, una idea muta en el tiempo que lleva leer una oración". Nuestros cerebros no tienen nada que ver con la evolución genética, excepto que está relacionado con personas inteligentes que tienen menos bebés. De hecho, si hay genes que le dan a las personas la tendencia a asumir memes que limitan su número de descendientes, morirán en unas pocas generaciones a favor de genes que dan a las personas una tendencia a adquirir hijos. Aunque algo controvertido, desafortunadamente, varios estudios sugieren que el Homo sapiens durante los últimos 42,000 años ha reducido su coeficiente intelectual debido al apareamiento selectivo. [ 76 ].
Extraordinariamente, resulta que, dado que la extraversión está relacionada con el aumento de la actividad sexual, especialmente en los hombres, el genetista cuantitativo estima que la heredabilidad de la personalidad extravertida está alrededor del 40-60%. Smillie y sus asociados estudiaron y encontraron que una copia del gen Al DRD2 Al se asoció con una extraversión significativamente mayor [ 77 ]. Esta asociación plantea una pregunta interesante en términos de procreación humana. Comings sugirió que debido a su marcado efecto sobre el comportamiento reproductivo, los trastornos del aprendizaje y otros trastornos impulsivos, compulsivos, agresivos y adictivos, los portadores del DRD2 Al tienen el potencial de causar cambios progresivos y permanentes en la frecuencia del alelo DRD2Al “que conduce a el colapso genético de la especie " [ 78 ].
En su libro, Comings proporciona evidencia de que las personas con conductas adictivas y disruptivas tienen hijos antes, y esto afecta la selección de genes de adicción como el alelo DRD2 Al. [ 79 ]. Sugiere que las personas que portan este alelo de riesgo disruptivo tendrán hijos, digamos, a los 20 años de edad y las personas sin este alelo tendrán hijos a los 25 años. Como resultado, el gen mutante se reproducirá más rápido, es decir, cada 20 años, mientras que la forma normal del gen se reproducirá cada 25 años. La relación de 25/20 es 1.25. Por tanto, la velocidad a la que un gen que tiene una ventaja selectiva de 1.25 veces aumentará en frecuencia de generación en generación. Una diferencia de cinco años en la edad de las madres o los padres cuando tienen sus primeros hijos es suficiente para dar como resultado una selección significativa y relativamente rápida de genes transportados por el grupo que inicia la maternidad a una edad más temprana. Se han documentado aumentos en algunos comportamientos de SDR desde 1955 hasta el presente. Estos aumentos incluyen síndrome de conducta adolescente (drogas, sexo, embarazos adolescentes y conductas delictivas, tabaquismo), trastorno de conducta, crimen, abuso de drogas, alcoholismo, conducta sexual sin protección, madres solteras, asistencia social, expulsión escolar y deserción escolar, así como una disminución concomitante del coeficiente intelectual [ 80 ]. Estos resultados se basan en el estudio de Berkeley que utiliza datos longitudinales de los Estudios de desarrollo y salud infantil y las Encuestas nacionales longitudinales de jóvenes o NLYS [ 81 ]. Utilizando esta información, Comings predijo que, de 1955 a 2015, se duplicará la frecuencia de, por ejemplo, el alelo DRD2 Al, lo que aumentará la prevalencia de comportamientos de SDR, incluida la relación sexual precoz. [ 50 ]. Alentamos un seguimiento de esta interesante predicción.
A pesar de algunos desacuerdos, proponemos el trastorno de hipersexualidad como un subtipo de características de RDS que comparten comportamientos adictivos con sustancias y sin sustancias, y su expresión clínica se ve afectada en parte por la genética y la epigenética. Aunque no se ha probado en este momento, también proponemos tratamientos asistidos por medicamentos (MAT) a corto plazo aprobados por la FDA que favorecen el bloqueo de la función de la dopamina, seguidos de una suave activación de las vías dopaminérgicas que conducen a la homeostasis de la dopamina a largo plazo. Lo último podría lograrse mediante algunas modalidades que pueden ayudar en la recuperación.
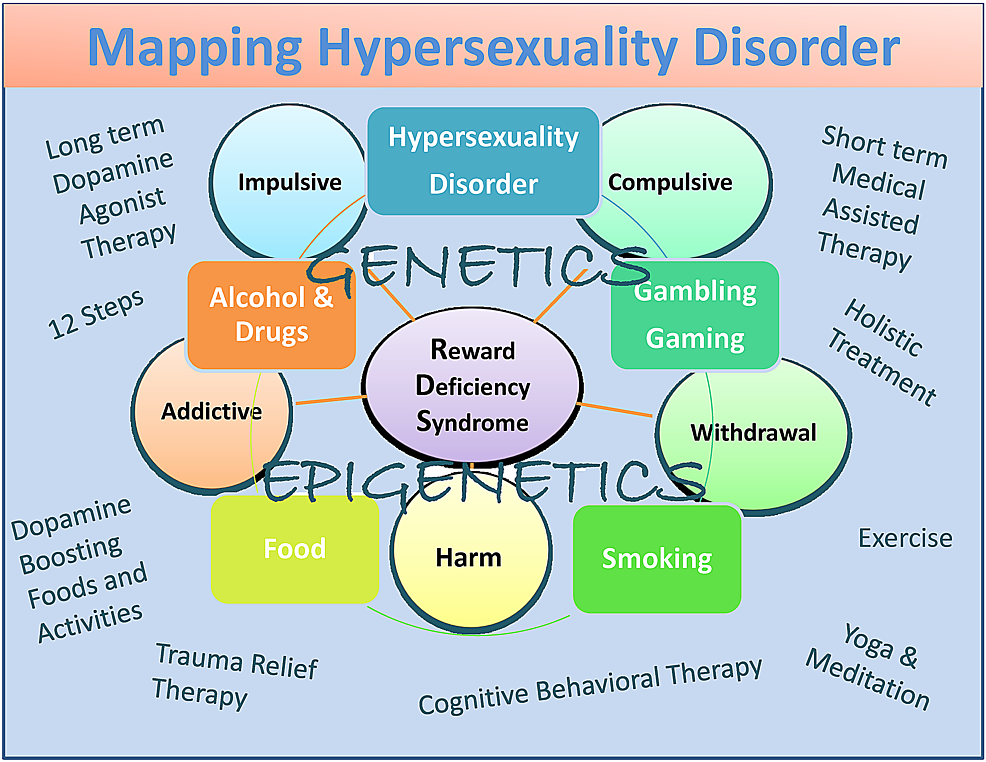
Si bien existen sesgos potenciales, incluyen la terapia con agonistas dopaminérgicos (KB220), el programa y la tradición 12 Step, el tratamiento holístico, la terapia conductual cognitiva (TCC) y la terapia de alivio de traumas (TRT), así como las actividades y alimentos para aumentar la dopamina (Figura 1) [ 82 ].
La controversia
Si bien creemos firmemente que el trastorno de hipersexualidad debe incluirse en futuras ediciones de DSM, estamos un tanto perplejos de que se sepa tan poco acerca de este trastorno en términos de neurogenética y epigenética e incluso de sintomatología de abstinencia y fenomenología general. [ 83 ]. El mensaje principal es que ahora alentamos a la comunidad científica a realizar experimentos, especialmente en el campo de la neuroimagen y la neurogenética, incluidas las epigenéticas específicas de genes, como la oxitocina-vasopresina-orexina-dopamina, así como otros genes de recompensa. Posiblemente esta condición pueda beneficiarse del tratamiento que se dirige a polimorfismos genéticos de recompensa para ayudar a promover la homeostasis de la dopamina. [84 89-]. Un número de revisiones por Joranby, et al. y Edge y Gold apoyan las oportunidades de tratamiento comunes relacionadas con los mecanismos neuroquímicos compartidos en los circuitos de recompensa cerebral como se expuso anteriormente en el concepto RDS [90 91-].
Históricamente, la “adicción al sexo” se incluyó en el DSM-III, sin embargo, se eliminó del DSM-1V porque el consenso de los autores del DSM-1V creía que no había pruebas suficientes para merecer su conclusión. Esta decisión estuvo cargada de inmensa emoción por parte de los líderes en el campo. Después de este evento, varios científicos, incluidos Kafka, Reid, Prause y otros, decidieron enmarcar la “hipersexualidad” no como una adicción al sexo, sino como un trastorno mental independiente y no como una adicción per se. Si bien su trabajo anterior en 2010 sugirió, como se menciona aquí, que la “hipersexualidad” era similar a la adicción al sexo y posiblemente a otras adicciones, incluido el abuso de sustancias, su trabajo más reciente se aleja de esta afirmación. El trabajo reciente en esta área revela una controversia continua. Hay una serie de estudios basados en electrofisiología, realizados por el grupo de Prause, que proporcionan alguna evidencia de que el deseo sexual, no la hipersexualidad, predice la autorregulación de la excitación sexual. [ 92 ]. Estos investigadores sugieren en otro trabajo que los sujetos que informaron problemas para regular su visualización de estímulos sexuales visuales (VSS) que también informaron un mayor deseo sexual mostraron menores potenciales positivos tardíos (LPP) en respuesta a la VSS. Los autores proponen que este patrón parezca diferente de los modelos de adicción a sustancias. [ 93 ]. Sin embargo, aunque no involucra a sujetos con trastorno hipersexual, el trabajo del grupo de Voon ha demostrado que en sujetos con comportamiento compulsivo y sexual, expuestos a videos sexualmente explícitos, una actividad mayor en la red neuronal similar a la observada en estudios de reactividad a las señales de drogas. [ 94 ]. Un mayor deseo o deseo en lugar de agrado se asoció aún más con la actividad en esta red neuronal. Este trabajo encaja con las teorías de la motivación de incentivos. [ 95 ].
Nosotros, los autores del artículo actual, admitimos que no hemos estado al tanto de todas las interacciones importantes que han ocurrido entre los defensores del “Trastorno de hipersexualidad” y su honesta intención de incluir este trastorno en el DSM-5 actual. Si bien no pasó la llamada "prueba de fuego", existen muchas razones para creer que se incluirá en futuras ediciones del DSM. Es de destacar que Steven Hyman, el actual director de los NIH, argumentó correctamente que “el DSM es un pobre espejo de las realidades clínicas y biológicas; se necesita un enfoque fundamentalmente nuevo para la clasificación diagnóstica a medida que los investigadores descubren nuevas formas de estudiar y comprender las enfermedades mentales ” [ 96 ]. Por otra parte, Casey, et al. propuso que si bien el DSM considera diferentes trastornos como entidades distintas, "los límites entre los trastornos a menudo no son tan estrictos como sugiere el DSM" [ 97 ].
En 2014, Karila, et al. sugirió que la adicción sexual, también conocida como trastorno hipersexual, ha sido ignorada por algunos psiquiatras, a pesar de que la condición causa graves problemas psicosociales. Según estos autores, proponen que la adicción sexual o el trastorno hipersexual representan términos diferentes para el mismo problema. Señalan que las tasas de prevalencia de los trastornos relacionados con la adicción sexual varían desde 3% a 6%. En consecuencia, el constructo de adicción sexual / trastorno hipersexual muestra comportamientos problemáticos que incluyen: masturbación excesiva, cibersexo, uso de pornografía, comportamiento sexual aberrante con adultos que lo consienten, sexo telefónico, visitas a clubes de striptease y otras conductas adictivas [ 98 ]. Ciertamente estamos de acuerdo en que puede haber diferencias distintivas entre la adicción sexual y la hipersexualidad, como lo señalan Carvalho, et al. [ 99 ], Rettenberger, et al. [ 100 ], Kor, et al. [ 1 ], Reid, et al. [ 9 ], Kafka y Hennen [ 13 ], y Prause, et al. [93 94-] Entre otros.
En resumen, hemos propuesto que, si bien hay algunas diferencias entre la hipersexualidad y la adicción al sexo, se requiere más investigación para clasificar adecuadamente estas condiciones tan importantes. Estamos de acuerdo con el trabajo de Walters, et al. [ 101 ] eso sugería que las diferencias individuales en la hipersexualidad son cuantitativas más que cualitativas por naturaleza. También sugieren que la hipersexualidad está organizada a lo largo de un continuo que cae en el extremo superior del continuo (Figura 1).
Figura 1: un mapa descriptivo del trastorno de hipersexualidad como un subtipo de RDS
La figura ilustra efectos neurogenéticos y epigenéticos interactivos. Se enumeran tanto el bloqueo de la dopamina a corto plazo como los tratamientos basados en la "homeostasis dopaminérgica" a largo plazo y las terapias de refuerzo de la dopamina y las actividades diarias. Los círculos indican características de RDS y los recuadros indican comportamientos de RDS.
Conclusiones
Si bien reconocemos la controversia, proponemos que las posibles diferencias y similitudes entre el trastorno de hipersexualidad y la adicción al sexo deben investigarse adecuadamente utilizando neuroimagen (fMRI, PET, SPECT), optogenética, análisis de candidatos y microarrays y técnicas epigenéticas. Creemos que estas investigaciones proporcionarán la base para la inclusión de la hipersexualidad como trastorno en futuras ediciones del DSM.
Referencias
- Kor A, Fogel Y, Reid RC, Potenza MN: ¿Debería el trastorno hipersexual ser clasificado como una adicción?. Compulsividad adicta al sexo. 2013, 20:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3836191/. 10.1080/10720162.2013.768132
- Rush B: Consultas médicas y observaciones sobre la enfermedad de la mente. Rush B (ed): Gryphon Editions Ltd., Birmingham, AL; (Trabajo original publicado 1812) revisado en 1979.
- von Krafft-Ebing R: Psychopathia Sexualis. Klaf FS (ed): Stein and Day, Nueva York; (Trabajo original publicado 1886) revisado en 1965.
- Hirshfeld M: Anomalías sexuales: los orígenes, naturaleza y tratamiento de los trastornos sexuales.. Hirshfeld M (ed): Emerson Books, Nueva York; 1948.
- Cochecito RJ: La perversión: la forma erótica del odio.. Pantheon Books, Nueva York; 1975.
- Allen CA: Un libro de texto de trastornos psicosexuales.. Oxford University Press, Londres; 1962.
- Ellis A, Sagarin E: Ninfomanía: un estudio de la mujer sobreexpuesta.. Gilbert Press, Nueva York; 1964.
- Kafka MP: ¿Qué pasó con el trastorno hipersexual?. Arch Sex Behav. 2014, 43: 1259-1261. 10.1007 / s10508-014-0326-y
- Reid RC, Temko J, Moghaddam JF, Fong TW: Vergüenza, rumia y autocompasión en hombres evaluados por trastorno hipersexual. J Psychiatr Pract. 2014, 20: 260 – 268. 10.1097 / 01.pra.0000452562.98286.c5
- Bancroft J: La sexualidad humana y sus problemas. Tercera edicion. Elsevier, Oxford, Inglaterra; 2009.
- Clasificación estadística internacional de enfermedades y problemas de salud relacionados, 10th Revision . (2007). Accedido: Julio 23, 2015: http://apps.who.int/classifications/apps/icd/icd10online2007/.
- Cantante B, Toates FM: Motivación sexual. J Sex Research. 1987, 23: 481 – 501. 10.1080/00224498709551386
- Diputado de Kafka, Hennen J: Deseo hipersexual en hombres: ¿son los hombres con parafilias diferentes de los hombres con trastornos relacionados con parafilia?. Abuso sexual. 2003, 15: 307 – 321. 10.1023 / A: 1025000227956
- Autobuses DM, Schmitt DP: Teoría de las estrategias sexuales: una perspectiva evolutiva sobre el apareamiento humano.. Psychol Rev. 1993, 100: 204 – 232. 10.1037 / 0033-295X.100.2.204
- Corbett-Detig RB, Hartl DL, Sackton TB: La selección natural limita la diversidad neutral en una amplia gama de especies. Psychol Bull. 1995, 13: e1002112.- 469-496. doi: 10.1371 / journal.pbio.1002112
- Laumann EO, Michael RT, Gagnon JH: Una historia política de la encuesta nacional de sexo de adultos.. Fam Plann Perspect. 1994, 26: 34 – 38. 10.2307/2136095
- Jones JC, Barlow DH: Frecuencia autonotificada de impulsos sexuales, fantasías y fantasías masturbatorias en hombres y mujeres heterosexuales. Arch Sex Behav. 1990, 19: 269 – 79. 10.1007 / BF01541552
- Oliver MB, Hyde JS: Diferencias de género en la sexualidad: un metaanálisis. Psychol Bull. 1993, 114: 29 – 51. 10.1037 / 0033-2909.114.1.29
- Okami P, Shackelford TK: Diferencias sexuales humanas en psicología sexual y comportamiento.. Annu Rev Sex Res. 2001, 12: 186–241. 10.1080/10532528.2001.10559798
- Leitenberg H, Detzer MJ, Srebnik D: Diferencias de género en la masturbación y la relación de la experiencia de la masturbación en la preadolescencia y / o la adolescencia temprana con el comportamiento sexual y la adaptación sexual en la adultez temprana. Arch Sex Behav. 1993, 22: 87 – 98. 10.1007 / BF01542359
- Fetterman AK, Kruger NN, Robinson MD: Las estrategias de apareamiento ligadas al sexo diverge con una manipulación de la prominencia genital. Motiv Emot. 2015, 39: 99 – 103. 10.1007/s11031-014-9420-7
- Basson R: Usar un modelo diferente para la respuesta sexual femenina para abordar el problema del bajo deseo sexual de las mujeres. J Sex Marital Ther. 2001, 27: 395–403. 10.1080/713846827
- Andersen BL, Cyranowski JM, Aarestad S: Más allá de las distinciones artificiales y vinculadas al sexo para conceptualizar la sexualidad femenina: comente sobre Baumeister. Psychol Bull. 2000, 126: 380 – 389. 10.1037 // 0033-2909.126.3.380
- Caballero RA, Sims-Caballero JE: Los antecedentes de desarrollo de la coerción sexual contra las mujeres: probando hipótesis alternativas con modelos de ecuaciones estructurales. Ann NY Acad Sci. 2003, 989: 72 – 85. 10.1111 / j.1749-6632.2003.tb07294.x
- Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Oro M: Sexo, drogas y rock 'n' roll: hipótesis de activación mesolímbica común en función de los polimorfismos del gen de recompensa. J Drogas psicoactivas. 2012, 44: 38 – 55. 10.1080/02791072.2012.662112
- Carnes PJ, Green BA, Merlo LJ, Polles A, Carnes S, Gold MS: PATHOS: una breve aplicación de detección para evaluar la adicción sexual. J Addict Med. 2012, 6: 29 – 34. 10.1097/ADM.0b013e3182251a28
- Hanson RK: ¿Static-99 predice la reincidencia entre los delincuentes sexuales de mayor edad?. Abuso sexual. 2006, 18: 343–355. 10.1007 / s11194-006-9027-y
- Weinstein A, Katz L, Eberhardt H, Cohen K, Lejoyeux M: Compulsión sexual - Relación con el sexo, apego y orientación sexual. J Behav Addict. 2015, 4: 22 – 26. 10.1556 / JBA.4.2015.1.6
- Chung WS, Lim SM, Yoo JH, Yoon H: Diferencia de género en la activación cerebral a la estimulación sexual audiovisual; ¿Las mujeres y los hombres experimentan el mismo nivel de excitación en respuesta al mismo videoclip?. Int J Impot Res. 2013, 25: 138-142. 10.1038 / ijir.2012.47
- Rupp HA, Wallen K: Diferencias sexuales en respuesta a estímulos sexuales visuales: una revisión. Arch Sex Behav. 2008, 37: 206 – 218. 10.1007/s10508-007-9217-9
- Hanson RK, Harris AJ, Helmus L, Thornton D: Los delincuentes sexuales de alto riesgo pueden no tener un alto riesgo para siempre. J Interpers Violence. 2014, 29: 2792-813. 10.1177/0886260514526062
- Reid RC, Cyders MA, Moghaddam JF Fong TW: Propiedades psicométricas de la Escala de Impulsividad de Barratt en pacientes con trastornos de juego, hipersexualidad y dependencia a la metanfetamina. Adicto Behav. 2014, 39: 1640 – 1645. 10.1016 / j.addbeh.2013.11.008
- Reid RC, Carpenter BN, Hook JN, Garos S, Manning JC, Gilliland R, Cooper EB, McKittrick H, Davtian M, Fong T: Informe de hallazgos en un ensayo de campo DSM-5 para trastorno hipersexual. J Sex Med. 2012, 9: 2868 – 2877. 10.1111 / j.1743-6109.2012.02936.x
- García FD, Thibaut F: Adicciones sexuales. Soy abuso de alcohol de drogas. 2010, 36: 254-260. 10.3109/00952990.2010.503823
- Reid RC, Bramen JE, Anderson A, Cohen MS: Atención plena, desregulación emocional, impulsividad y propensión al estrés en pacientes hipersexuales. J Clin Psychol. 2014, 70: 313 – 321. 10.1002 / jclp.22027
- Titular MK, Hadjimarkou MM, Zup SL, Blutstein T, Benham RS, McCarthy MM, Mong JA: La metanfetamina facilita el comportamiento sexual femenino y mejora la activación neuronal en la amígdala medial y el núcleo ventromedial del hipotálamo. Psiconeuroendocrinología. 2010, 35: 197 – 208. 10.1016 / j.psyneuen.2009.06.005
- Spauwen LW, Niekamp AM, Hoebe CJ, Dukers-Muijrers NH: El uso de drogas, las conductas de riesgo sexual y las infecciones de transmisión sexual en personas de intercambio de parejas: un estudio transversal en los Países Bajos. Transmisión sexual Infect. 2015, 91: 31 – 36. 10.1136 / sextrans-2014-051626
- Castelo-Branco C, Parera N, Mendoza N, Pérez-Campos E, Lete I, grupo CEA: Abuso de alcohol y drogas y comportamientos sexuales de riesgo en mujeres adultas jóvenes. Gynecol Endocrinol. 2014, 30: 581 – 586. 10.3109/09513590.2014.910190
- Jia ZJ, Yan SY, Bao YP, Lian Z, Zhang HR, Liu ZM: Diferencias de comportamiento sexual entre los usuarios de estimulantes de tipo anfetamínico y los de heroína.. J Addict Med. 2013, 7: 422 – 427. 10.1097/ADM.0b013e3182a952b2
- Bruijnzeel AW: Función de señalización del receptor kappa-opioide y recompensa cerebral. Brain Res Rev. 2009, 62: 127 – 146. 10.1016 / j.brainresrev.2009.09.008
- Orsini CA, Ginton G, Shimp KG, Avena NM, Gold MS, Setlow B: Consumo de alimentos y aumento de peso después del cese de la administración crónica de anfetaminas. Apetito. 2014, 78: 76 – 80. 10.1016 / j.appet.2014.03.013
- Ibrahim C, Reynaert C: Hipersexualidad en trastornos neurocognitivos en personas mayores: una revisión exhaustiva de la literatura y el estudio de caso. Psiquiatr Danub. 2014, 26: 36 – 40.
- Vallejo-Medina P, Sierra JC: Efecto del uso de drogas e influencia de la abstinencia en el funcionamiento sexual en una muestra masculina española dependiente de drogas: un estudio multisitio. J Sex Med. 2013, 10: 333 – 341. 10.1111 / j.1743-6109.2012.02977.x
- Baskerville TA, Douglas AJ: Interacciones entre la dopamina y la oxitocina conductas subyacentes: posibles contribuciones a los trastornos de conducta. CNS Neurosci Ther. 2010, 16: e92-123. 10.1111 / j.1755-5949.2010.00154.x
- Riebe CJ, Lee TT, Hill MN, Gorzalka BBB: La abstinencia precipitada contrarresta los efectos adversos de la administración subcrónica de cannabinoides en el comportamiento sexual de ratas macho. Neurosci Lett. 2010, 472: 171 – 174. 10.1016 / j.neulet.2010.01.079
- Korda JB, Pfaus JG, Kellner CH, Goldstein I: Trastorno de excitación genital persistente (PGAD, por sus siglas en inglés): reporte de caso de manejo sintomático a largo plazo con terapia electroconvulsiva. J Sex Med. 2009, 6: 2901 – 2909. 10.1111 / j.1743-6109.2009.01421.x
- Huang CJ, Liao HT, Yeh GC, Hung KL: Distribución de alelos HLA-DQB1 en pacientes con síndrome de Kleine-Levin. J Clin Neurosci. 2012, 19: 628 – 630. 10.1016 / j.jocn.2011.08.020
- Blum K, Noble EP, Sheridan PJ, Montgomery A, Ritchie T, Jagadeeswaran P, Nogami H, Briggs AH, Cohn JB: Asociación alélica del gen del receptor D2 de la dopamina humana en el alcoholismo. Jama 1990, 263: 2055 – 2060. 10.1001 / jama.263.15.2055
- Blum K, Sheridan PJ, Madera RC, Braverman ER, Chen TJ, Cull JG, Comings DE El gen del receptor de dopamina D2 como determinante del síndrome de deficiencia de recompensa. JR Soc Med. 1996, 89: 396-400. 10.1177/014107689608900711
- Miller WB, Pasta DJ, MacMurray J, Chiu C, Wu H, Comings DE: Los genes receptores de dopamina se asocian con la edad en la primera relación sexual. J Biosoc Sci. 1999, 31: 43 – 54. 10.1017 / S0021932099000437
- Hamann S, Herman RA, Nolan CL, Wallen K: Los hombres y las mujeres difieren en la respuesta de la amígdala a los estímulos visuales sexuales. Nat Neurosci. 2004, 7: 411 – 416. 10.1038 / nn1208
- Quiñones-Jenab V: ¿Por qué son mujeres de Venus y hombres de Marte cuando abusan de la cocaína?. Brain Res. 2006, 1126: 200 – 203. 10.1016 / j.brainres.2006.08.109
- Noble EP, Blum K, Khalsa ME, Ritchie T, Montgomery, A Wood RC, Fitch RJ, Ozkaragoz T, Sheridan PJ, Anglin MD, Paredes A, Treiman LJ, Sparkes RS: Asociación alélica del gen receptor de dopamina D2 con dependencia de cocaína. Dependen de drogas y alcohol. 1993, 33: 271 – 285. 10.1016/0376-8716(93)90113-5
- Harrison PJ, Tunbridge EM: Catecol-O-metiltransferasa (COMT): un gen que contribuye a las diferencias sexuales en la función cerebral y al dimorfismo sexual en la predisposición a los trastornos psiquiátricos.. Neuropsicofarmacología. 2008, 33: 3037 – 3045. 10.1038 / sj.npp.1301543
- Guo G, Tong Y: Edad en la primera relación sexual, genes y contexto social: evidencia de gemelos y el gen del receptor D4 de la dopamina. Demografía. 2006, 43: 747 – 769. 10.1353 / dem.2006.0029
- Bradley KC, Boulware MB, Jiang H, Doerge RW, Meisel RL, Mermelstein PG: Cambios en la expresión génica dentro del núcleo accumbens y el estriado después de la experiencia sexual. Genes Brain Behav. 2005, 4: 31 – 44. 10.1111 / j.1601-183X.2004.00093.x
- Rao BS, Raju TR, Meti BL: Mayor densidad numérica de las sinapsis en la región CA3 del hipocampo y la capa molecular de la corteza motora después de la experiencia gratificante de autoestimulación. Neurociencia 1999, 91: 799 – 803. 10.1016/S0306-4522(99)00083-4
- Heshmati M: LTP inducida por cocaína en el área tegmental ventral: nuevos conocimientos sobre el mecanismo y el curso del tiempo iluminan los sustratos celulares de la adicción. J. Neurofisiol. 2009, 101: 2735 – 2737. 10.1152 / jn.00127.2009
- Castor KM, Wright JP, Walsh A: Una explicación evolutiva basada en genes para la asociación entre la participación criminal y el número de parejas sexuales. Biodemografía Soc Biol. 2008, 54: 47 – 55. 10.1080/19485565.2008.9989131
- Santtila P, Jern P, Westberg L, Walum H, Pedersen CT, Eriksson E, Sandnabba N: El polimorfismo del gen transportador de dopamina (DAT1) está asociado con la eyaculación precoz. J Sex Med. 2010, 7: 1538 – 1546. 10.1111 / j.1743-6109.2009.01696.x
- Chen TJH, Blum K, Mathews D, Fisher L, Schnautz N, Braverman Er, Schoolfield J, Downs W, Blum SH, Mengucci J, Meshkin B, Arcuri V, Bajaj A, Waite RL, Próximamente disponible: Asociación preliminar del alelo Dopamina D2 (DRD2) [alelo de Taq1 A1] y el transportador de dopamina (DAT1) [Alelo de 480 bp] con comportamiento patológico agresivo, un subtipo clínico de Síndrome de Deficiencia de Recompensa (RDS) en adolescentes. Gene Ther Mol Biol. 2007, 1: 93-112. Accedido: Julio 23, 2015: http://gtmb.org/pages/Vol11A/HTML/11._Chen_et_al,_93-102.htm.
- Burt SA, Mikolajewski AJ: Evidencia preliminar de que los genes candidatos específicos están asociados con el comportamiento antisocial de inicio en la adolescencia. La agresividad del comportamiento. 2008, 34: 437 – 445. 10.1002 / ab.20251
- Jóźków P, Słowińska-Lisowska M, Łaczmański Ł, Mędraś M: Las variantes polimórficas de los genes del receptor de neurotransmisores pueden afectar la función sexual en los hombres que envejecen: datos del estudio HALS. Neuroendocrinología. 2013, 98: 51 – 59. 10.1159/000350324
- Ventas JM, DiClemente RJ, Brody GH, Philibert RA, Rose E: Interacción entre el polimorfismo 5-HTTLPR y el historial de abuso en el comportamiento de uso de condones de adolescentes afroamericanas después de participar en una intervención de prevención del VIH. Prev Sci. 2014, 15: 257 – 267. 10.1007/s11121-013-0378-6
- Barrett CE, Keebaugh AC, Ahern TH, Bass CE, Terwilliger EF, Young LJ: La variación en la expresión del receptor de vasopresina (Avpr1a) crea diversidad en los comportamientos relacionados con la monogamia en ratones de la pradera. Horma Behav. 2013, 63: 518 – 526. 10.1016 / j.yhbeh.2013.01.005
- Garcia JR, MacKillop J, Aller EL, Merriwether AM, Wilson DS, Lum JK: Asociaciones entre la variación del gen del receptor D4 de la dopamina con la infidelidad y la promiscuidad sexual. Más uno. 2010, 5: e14162. 10.1371 / journal.pone.0014162
- Daw J, Guo G: La influencia de tres genes sobre si los adolescentes usan anticonceptivos, EE. UU. 1994-2002. Popul Stud (Camb). 2011, 65: 253 – 271. 10.1080/00324728.2011.598942
- Emanuele E, Brondino N, Pesenti S, Re S, Geroldi D: Carga genética en estilos amorosos humanos.. Neuro endocrinol lett. 2007, 28: 815 – 821.
- Matsuda KI: Cambios epigenéticos en el promotor del gen del receptor de estrógeno α: implicaciones en los comportamientos sociosexuales. Neurosci delantera. 2014, 8: 344. 10.3389 / fnins.2014.00344
- Arroz WR, Friberg U, Gavrilets S: La homosexualidad a través del desarrollo sexual canalizado: un protocolo de prueba para un nuevo modelo epigenético. Bioessays. 2013, 35: 764 – 770. 10.1002 / bies.201300033
- Gundersen B: Vinculación de pareja a través de la epigenética. Nat Neurosci. 2013, 16: 779. 10.1038 / nn0713-779
- Wang H, Duclot F, Liu Y, Wang Z, Kabbaj M: Los inhibidores de la histona desacetilasa facilitan la formación de preferencias de la pareja en ratones de campo femeninos. Nat Neurosci. 2013, 16: 919 – 924. 10.1038 / nn.3420
- Zeh JA, Zeh DW: Herencia materna, epigenética y evolución de la poliandria. Genetica. 2008, 134: 45 – 54. 10.1007 / s10709-007, 9192-z
- Addad M, Lesiau A: Extraversión, neuroticismo, juicio inmoral y comportamiento criminal.. Ley med. 1989, 8: 611 – 622.
- Brodie R: Virus de la mente: la nueva ciencia del meme. Hay House, Inc., Nueva York, NY; 1996, pp 66.
- Hernnstein R, Murray C: La curva de la campana: inteligencia y estructura de clase en la vida americana. The Free Press, Nueva York, NY; 1994.
- Smillie LD, Cooper AJ, Proitsi P, Powell JF, Pickering AD: La variación en el gen de la dopamina DRD2 predice la personalidad extravertida. Neurosci Lett. 2010, 468: 234 – 327. 10.1016 / j.neulet.2009.10.095
- Venidas DE: La bomba de genes. ¿La educación superior y la tecnología avanzada aceleran la selección de genes para trastornos del aprendizaje, TDAH, conductas adictivas y disruptivas?. Hope Press, Duarte CA; 1996.
- Venidas DE: El síndrome del comportamiento problemático de los adolescentes. La bomba de genes. ¿La educación superior y la tecnología avanzada aceleran la selección de genes para trastornos del aprendizaje, TDAH, conductas adictivas y disruptivas? Hope Press, Duarte CA; 1996. pp 91-94.
- Venidas DE: Selección de genes. La bomba de genes. ¿La educación superior y la tecnología avanzada aceleran la selección de genes para trastornos del aprendizaje, TDAH, conductas adictivas y disruptivas? Hope Press, Duarte CA; 1996. pp 89-90.
- Venidas DE: El estudio de Berkeley. La bomba de genes. ¿La educación superior y la tecnología avanzada aceleran la selección de genes para trastornos del aprendizaje, TDAH, conductas adictivas y disruptivas? Hope Press, Duarte California; 1996. pp 105 – 210.
- Borsten J: Malibu Beach Recovery Diet Cookbook. Vidov Publishing Inc, Malibu, CA; 2015.
- Derbyshire KL, Grant JE: Comportamiento sexual compulsivo: una revisión de la literatura.. J Behav Addict. 2015, 4: 37 – 43. 10.1556/2006.4.2015.003
- Nirenberg MJ: Síndrome de abstinencia agonista de la dopamina: implicaciones para el cuidado del paciente. El envejecimiento de las drogas. 2013, 30: 587 – 592. 10.1007 / s40266-013, 0090-z
- Grant JE, Cervecero JA, Potenza MN: La neurobiología de la sustancia y las adicciones conductuales.. CNS Spectr. 2006, 11: 924 – 930.
- Sakata K, Duke SM: La falta de expresión de BDNF a través del promotor IV altera la expresión de genes de monoamina en la corteza frontal y el hipocampo. Neurociencia 2014, 260: 265 – 75. 10.1016 / j.neuroscience.2013.12.013
- Blum K, Liu Y, Wang W, Wang Y, Zhang Y, Oscar-Berman M, Smolen A, Febo M, Han D, Simpatico T, Cronjé FJ, Demetrovics Z, Oro MS: Los efectos de rsfMRI de KB220Z ™ en las vías neuronales en los circuitos de recompensa de los adictos a la heroína abstinentes y genotipados. Posgrado Med. 2015, 127: 232 – 241.
- McLaughlin T, Blum K, Oscar-Berman M, Febo M, Demetrovics Z, Agan G, Fratantonio J, Gold MS: Uso de Neuroadaptagen KB200z ™ para mejorar las pesadillas terroríficas y lúcidas en pacientes con SDR: el papel de la conectividad funcional mejorada, la recompensa del cerebro, la funcionalidad y la homeostasis dopaminérgica. Síndrome de recompensa J 2015, 1: 24-35. 10.17756 / jrds.2015-006
- Blum K, Thanos PK, Badgaiyan RD, Febo M, Oscar-Berman M, Fratantonio J, Demotrovics Z, Oro MS: Neurogenética y terapia génica para el síndrome de deficiencia de recompensa: ¿vamos a la Tierra Prometida?. Experto Opin Biol Ther. 2015, 5: 973 – 985. 10.1517/14712598.2015.1045871
- Joranby L, Pineda-Frost KY, MS de oro: Adicción a los alimentos y sistemas de recompensa cerebral.. Adicción y compulsividad sexual. 2005, 12: 201–217. 10.1080/10720160500203765
- PJ Edge, MS dorado: Retiro de drogas e hiperfagia: lecciones de tabaco y otras drogas. Curr Pharm Des. 2011, 17: 1173 – 1179. 10.2174/138161211795656738
- Moholy M, Prause N, Proudfit, GH, Rahman A, Fong T: El deseo sexual, no la hipersexualidad, predice la autorregulación de la excitación sexual. Cogn Emot. 2015, 6: 1012.
- Prause N, Steele, VR, Staley C, Sabatinelli, D, Hajcak G: Modulación de los potenciales positivos tardíos por imágenes sexuales en usuarios problemáticos y controles inconsistentes con la "adicción a la pornografía". Biol Psychol. 2015, 109: 192-199. 10.1016 / j.biopsycho.2015.06.005
- Mechelmans DJ, Irvine M, Banca P, y otros: Sesgo de atención mejorado hacia señales sexualmente explícitas en individuos con y sin conductas sexuales compulsivas. Más uno. 2014, 25, 9 (8): e105476. 10.1371 / journal.pone.0105476
- Blum K, Gardner E, Oscar-Berman M, Oro M: El "agrado" y el "deseo" relacionados con el síndrome de deficiencia de recompensa (SDR): hipótesis de respuesta diferencial en los circuitos de recompensa del cerebro. Curr Pharm Des. 2012, 18 (1): 113-118.
- Hyman SE: Diagnóstico del DSM: la clasificación diagnóstica necesita una reforma fundamental. Cerebro. 2011, 2011: 6. Accedido: 2011 Abr 26: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3574782/.
- Casey BJ, Craddock N, Cuthbert BN, Hyman SE, Lee FS, Ressler KJ: DSM-5 y RDoC: ¿progreso en la investigación en psiquiatría?. Nat Rev Neurosci. 2013, 14: 810-14. 10.1038 / nrn3621
- Karila L, Wéry A, Weinstein A, Cottencin O, Petit A, Reynaud M, Billieux J: Adicción sexual o trastorno hipersexual: ¿términos diferentes para el mismo problema? Una revisión de la literatura. Curr Pharm Des. 2014, 20: 4012-20. 10.2174/13816128113199990619
- Carvalho J, Štulhofer A, Vieira AL, Jurin T: Hipersexualidad y alto deseo sexual: explorando la estructura de la sexualidad problemática.. J Sex Med. 2015, 12: 1356-67. Accedido: 2015 Mar 23: http://onlinelibrary.wiley.com/doi/10.1111/jsm.12865/abstract;jsessionid=6F416CCBB66B7F0EA28E428D4993EBD5.f01t04. 10.1111 / jsm.12865
- Rettenberger M, Klein V, Briken P: La relación entre el comportamiento hipersexual, la excitación sexual, la inhibición sexual y los rasgos de personalidad. Arch Sex Behav. 2015, enero 6: (Epub antes de imprimir). Accedido: 2015 Ene 6: 10.1007/s10508-014-0399-7
- Walters GD, Knight RA, Långström N: ¿Es la hipersexualidad dimensional? Evidencia para el DSM-5 de poblaciones generales y muestras clínicas.. Arch Sex Behav. 2011, 40: 1309-21. Accedido: 2011 Feb 3: 10.1007/s10508-010-9719-8