Dev Rev. 2008; 28(1): 62-77. doi: 10.1016 / j.dr.2007.08.003
Abstract
L'adolescence est une période de développement caractérisée par des décisions et des actions sous-optimales entraînant une incidence accrue de blessures non intentionnelles et de violences, d'abus d'alcool et de drogues, de grossesses non désirées et de maladies sexuellement transmissibles. Les explications neurobiologiques et cognitives traditionnelles du comportement des adolescents n’ont pas permis de prendre en compte les changements de comportement non linéaires observés pendant l’adolescence, par rapport à l’enfance et à l’âge adulte. Cette revue fournit une conceptualisation biologiquement plausible des mécanismes neuronaux à la base de ces changements de comportement non linéaires, comme une réactivité accrue aux incitations alors que le contrôle des impulsions est encore relativement immature pendant cette période. L'imagerie humaine et les études animales récentes fournissent une base biologique à cette vision, suggérant le développement différentiel des systèmes de récompense limbique par rapport aux systèmes de contrôle descendants à l'adolescence par rapport à l'enfance et à l'âge adulte. Ce schéma de développement peut être exacerbé chez les adolescents prédisposés à la prise de risque, ce qui augmente le risque de résultats médiocres.
Selon le National Center for Health Statistics, il y a chaque année plus de décès d'adolescents 13,000 aux États-Unis. Environ 70% de ces décès résultent d’accidents de la route, de blessures non intentionnelles, d’homicides et de suicides (Eaton et al., 2006). Les résultats de l'enquête nationale 2005 sur le comportement des jeunes en matière de risque (YRBS) montrent que les adolescents adoptent des comportements qui augmentent les risques de décès ou de maladie en conduisant un véhicule après avoir bu ou sans ceinture de sécurité, portant des armes, en utilisant des substances illégales et en ayant des rapports sexuels non protégés entraînant des grossesses non désirées et des MST, y compris une infection par le VIH (Eaton et al., 2006). Ces statistiques soulignent l’importance de comprendre les choix et les actions à risque chez les adolescents.
Un certain nombre d'hypothèses cognitives et neurobiologiques ont été postulées pour expliquer pourquoi les adolescents adoptent un comportement de choix non optimal. Dans une revue récente de la littérature sur le développement du cerveau chez l'adolescent, Yurgelun-Todd (2007) suggère que le développement cognitif à l'adolescence est associé à une efficacité de plus en plus grande des capacités de contrôle cognitif. Cette efficacité est décrite comme dépendant de la maturation du cortex préfrontal, comme en témoigne une activité accrue dans les régions préfrontales focales (Rubia et al., 2000; Tamm, Menon et Reiss, 2002) et une activité diminuée dans des régions cérébrales non pertinentes (Brown et al., 2005; Durston et al., 2006).
Ce schéma général d'amélioration du contrôle cognitif avec la maturation du cortex préfrontal suggère une augmentation linéaire du développement de l'enfance à l'âge adulte. Cependant, les choix et les actions sous-optimales observés à l'adolescence représentent un changement de comportement non linéaire qui peut être distingué de l'enfance et de l'âge adulte, comme en témoigne le Centre national des statistiques sur la santé sur le comportement et la mortalité chez les adolescents. Si le contrôle cognitif et un cortex préfrontal immature sont à la base d'un comportement de choix sous-optimal, les enfants doivent alors avoir une apparence remarquablement similaire, voire pire, que les adolescents, en raison de leur cortex préfrontal et de leurs capacités cognitives moins développés. Ainsi, la fonction préfrontale immature seule ne peut expliquer le comportement des adolescents.
Une conceptualisation précise des changements cognitifs et neurobiologiques durant l'adolescence doit traiter l'adolescence comme une période transitoire du développement (Lance, 2000) plutôt qu’un seul instantané dans le temps (Casey, Tottenham, Liston et Durston, 2005). En d'autres termes, pour comprendre cette période de développement, des transitions à l'adolescence et à la sortie de l'adolescence sont nécessaires pour distinguer les attributs distincts de ce stade de développement. L'établissement de trajectoires de développement pour les processus cognitifs et neuronaux est essentiel pour caractériser ces transitions et contraindre les interprétations relatives aux changements de comportement au cours de cette période. Sur le plan cognitif ou comportemental, les adolescents sont caractérisés comme impulsifs (c’est-à-dire qu’ils manquent de contrôle cognitif) et de prise de risques, ces concepts étant utilisés de manière synonyme et sans prise en compte des trajectoires développementales distinctes de chacun. Sur le plan neurobiologique, l'imagerie humaine et les études chez l'animal suggèrent des bases neurobiologiques et des trajectoires développementales distinctes pour les systèmes neuronaux qui sous-tendent ces constructions distinctes du contrôle des impulsions et des décisions à risque.
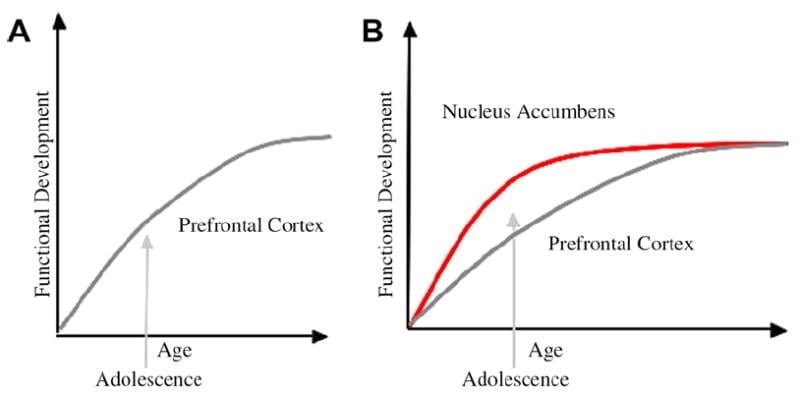
Nous avons développé un modèle neurobiologique de développement des adolescents dans ce cadre, qui repose sur des modèles de rongeurs (Laviola, Adriani, Terranova et Gerra, 1999; Lance, 2000) et des études d'imagerie récentes de l'adolescence (Ernst et al., 2005; Galvan, Hare, Voss, Glover et Casey, 2007; Galvan et al., 2006). Fig. 1 ci-dessous représente ce modèle. À gauche, la caractérisation traditionnelle de l'adolescence est liée presque exclusivement à l'immaturité du cortex préfrontal. À droite, notre modèle neurobiologique proposé montre comment les régions de contrôle limbiques sous-corticales et préfrontales top-down doivent être considérées ensemble. La bande dessinée illustre différentes trajectoires de développement pour ces systèmes, les systèmes limbiques se développant plus tôt que les régions de contrôle préfrontales. Selon ce modèle, l'individu est davantage biaisé par les régions limbiques matures sur le plan fonctionnel au cours de l'adolescence (c'est-à-dire le déséquilibre du contrôle limbique par rapport au contrôle préfrontal) par rapport aux enfants pour lesquels ces systèmes (à savoir limbique et préfrontal) sont encore en développement; et par rapport aux adultes, pour qui ces systèmes sont pleinement matures. Cette perspective fournit une base pour les changements non linéaires de comportement au cours du développement, en raison de la maturation plus précoce de cette région limbique par rapport à la région de contrôle préfrontal top-down moins mature. Avec le développement et l'expérience, la connectivité fonctionnelle entre ces régions fournit un mécanisme pour le contrôle de haut en bas de ces régions (Hare, Voss, Glover et Casey, 2007a). En outre, le modèle concilie la contradiction des statistiques de santé sur les comportements à risque au cours de l'adolescence, avec l'observation astucieuse de Reyna et Farley (2006) que les adolescents soient capables de raisonner et de comprendre les risques des comportements auxquels ils s’engagent. Selon notre modèle, dans des situations émotionnellement saillantes, le système limbique l'emporte sur les systèmes de contrôle compte tenu de sa maturité par rapport au système de contrôle préfrontal. Les preuves tirées d'études d'imagerie comportementale et humaine à l'appui de ce modèle sont fournies dans le contexte d'actions dans des contextes enrichissants et émotionnels (Galvan et al., 2006, 2007; Hare, Voss, Glover et Casey, 2007b; Hare et al., 2007a). De plus, nous spéculons sur les raisons pour lesquelles le cerveau peut se développer de cette manière et pourquoi certains adolescents risquent davantage de prendre des décisions sous-optimales menant à des résultats à long terme plus médiocres (Galvan et al., 2007; Hare et al., 2007b).
L'explication traditionnelle du comportement des adolescents a été suggérée comme étant due au développement prolongé du cortex préfrontal (A). Notre modèle prend en compte le développement du cortex préfrontal ainsi que des régions limbiques sous-corticales (par exemple, le noyau accumbens) qui ont été impliquées dans des choix et des actions à risque (B).
Développement d'un comportement orienté vers un objectif
Une des pierres angulaires du développement cognitif est la capacité de supprimer les pensées et actions inappropriées en faveur de celles orientées vers un objectif, en particulier en présence d'incitations convaincantes (Casey, Galvan et Hare, 2005; Casey et al., 2000b; Casey, Thomas, David-son, Kunz et Franzen, 2002a; Casey, Tottenham et Fossella, 2002b). Un certain nombre d'études classiques sur le développement ont montré que cette capacité se développe tout au long de l'enfance et de l'adolescence (Affaire 1972; Flavell, Feach et Chinsky, 1966; Keating et Bobbitt, 1978; Pascual-Leone, 1970). Plusieurs théoriciens ont soutenu que le développement cognitif est dû à une augmentation de la vitesse et de l'efficacité du traitement et non à une augmentation de la capacité mentale (par exemple, Bjorkland, 1985; Bjorkland, 1987; Affaire 1985). D’autres théoriciens ont inclus la construction de processus «inhibiteurs» dans leur description du développement cognitif (Harnishfeger et Bjorkland, 1993). Selon ce récit, la cognition immature est caractérisée par une susceptibilité aux interférences de sources concurrentes qui doivent être supprimées (par exemple, Brainerd et Reyna, 1993; Casey, Thomas, Davidson, Kunz et Franzen, 2002a; Dempster, 1993; Diamant, 1985; Munakata et Yerys, 2001). Ainsi, un comportement orienté vers un objectif nécessite la maîtrise des impulsions ou du retard de la gratification pour optimiser les résultats. Cette capacité semble mûrir au cours de l'enfance et de l'adolescence.
Le comportement des adolescents a été décrit comme impulsif et risqué, presque synonyme, mais ces constructions reposent sur différents processus cognitifs et neuronaux, qui suggèrent des constructions distinctes avec des trajectoires de développement différentes. En particulier, une revue de la littérature suggère que l’impulsivité diminue avec l’âge au cours de l’enfance et de l’adolescence (Casey et al., 2002a; Casey, Galvan et al., 2005; Galvan et al., 2007) et est associé au développement prolongé du cortex préfrontal (Casey, Galvan et al., 2005), bien qu’il y ait des différences dans le degré d’impulsion ou non d’un individu donné, quel que soit son âge.
En revanche, pour le contrôle cognitif / impulsif, la prise de risque semble augmenter pendant l’adolescence par rapport à l’enfance et à l’âge adulte et est associée aux systèmes sous-corticaux connus pour participer à l’évaluation des récompenses. Des études d'imagerie humaine qui seront examinées suggèrent une augmentation de l'activation sous-corticale (p. Ex., Accumbens) lors de choix risqués (Kuhnen et Knutson, 2005; Matthews et coll., 2004; Montague et Berne, 2002) exagérée chez les adolescents par rapport aux enfants et aux adultes (Ernst et al., 2005; Galvan et al., 2006). Ces résultats suggèrent des trajectoires différentes pour un comportement basé sur les récompenses ou les incitations, avec le développement antérieur de ces systèmes par rapport aux systèmes de contrôle montrant un parcours de développement long et linéaire, en termes de choix de décisions et d'actions inappropriées en faveur de ceux orientés vers des objectifs.
Preuve d'études de neuroimagerie sur le développement du cerveau humain
Des études récentes sur le développement du cerveau chez les adolescents ont été basées sur les progrès des méthodologies de neuroimagerie pouvant être facilement utilisées avec des populations humaines en développement. Ces méthodes reposent sur des méthodes d’imagerie par résonance magnétique (IRM) (voir Fig. 2) et comprennent: l'IRM structurelle, utilisée pour mesurer la taille et la forme des structures; l'IRM fonctionnelle utilisée pour mesurer les modèles d'activité cérébrale; et l'imagerie de tenseur de diffusion (DTI) qui est utilisée pour indexer la connectivité des faisceaux de fibres de matière blanche. Les preuves de notre modèle développemental de compétition entre les régions corticales et sous-corticales sont corroborées par une connectivité structurelle et fonctionnelle immature mesurée par DTI et IRMf, respectivement.
Études par IRM du développement du cerveau humain
Plusieurs études ont utilisé l’IRM structurelle pour cartographier l’évolution anatomique du développement normal du cerveau (voir le compte rendu de Durston et al., 2001). Bien que la taille totale du cerveau représente environ 90% de sa taille adulte à l'âge de six ans, les sous-composants de la substance grise et blanche du cerveau continuent de subir des changements dynamiques tout au long de l'adolescence. Les données d'études IRM longitudinales récentes indiquent que le volume de matière grise présente un motif en forme de U inversé, avec des variations régionales plus importantes que la substance blanche (Giedd, 2004; Gogtay et al., 2004; Sowell et al, 2003; Sowell, Thompson et Toga, 2004). En général, les régions qui desservent des fonctions principales, telles que les systèmes moteur et sensoriel, arrivent à maturité plus tôt; les zones d’association d’ordre supérieur, qui intègrent ces fonctions principales, mûrissent plus tard (Gogtay et al., 2004; Sowell, Thompson et Toga, 2004). Par exemple, des études utilisant des mesures basées sur l'IRM montrent que la perte de matière grise corticale se produit le plus tôt dans les zones sensorimotrices primaires et plus tard dans les cortex temporaux dorsolatéral préfrontal et latéral (Gogtay et al., 2004). Cette tendance est cohérente avec les études post mortem chez les primates non humains et chez l’homme montrant que le cortex préfrontal est l’une des dernières régions du cerveau à mûrir (Bourgeois, Goldman-Rakic et Rakic, 1994; Huttenlocher, 1979). Contrairement à la matière grise, le volume de la substance blanche augmente de manière à peu près linéaire, tout au long du développement jusqu’à l’âge adulte (Gogtay et al., 2004). Ces changements reflètent probablement la myélinisation en cours des axones par les oligodendrocytes, ce qui améliore la conduction neuronale et la communication.
Bien que moins d’attention ait été accordée aux régions sous-corticales lorsqu’on examine les changements structurels, certains des changements les plus importants dans le cerveau au cours du développement sont observés dans ces régions, en particulier dans les ganglions de la base (Sowell et al., 1999, Voir Fig. 3) et surtout chez les hommes (Giedd et al., 1996). Les changements développementaux du volume structural dans les noyaux gris centraux et les régions préfrontales sont intéressants à la lumière des processus de développement connus (par exemple, arborisation dendritique, mort cellulaire, élagage synaptique, myélinisation) qui se produisent pendant l'enfance et l'adolescence. Ces processus permettent d'affiner et de renforcer les liens entre les régions préfrontales et sous-corticales avec un développement et un apprentissage pouvant coïncider avec un contrôle cognitif accru. Quel est le lien entre ces changements structurels et les changements cognitifs? Un certain nombre d’études ont établi un lien entre la maturation structurelle du lobe frontal et la fonction cognitive à l’aide de mesures neuropsychologiques et cognitives (p. Ex. Sowell et al., 2003). Des associations spécifiques ont été rapportées entre les volumes régionaux corticaux préfrontaux et ganglionnaires basaux basés sur l’IRM et les mesures de contrôle cognitif (capacité de neutraliser une réponse inappropriée en faveur d’une autre ou de supprimer l’attention portée à un attribut de stimulus non pertinent en faveur d’un attribut de stimulus pertinent (Casey, Trainor et al., 1997). Ces résultats suggèrent que les changements cognitifs sont reflétés dans les changements structurels du cerveau et soulignent l'importance du développement sous-cortical (noyaux gris centraux) ainsi que du développement cortical (par exemple, le cortex préfrontal).

Etudes DTI sur le développement du cerveau humain
Les études de morphométrie basées sur l'IRM examinées suggèrent que les connexions corticales sont en train d'être affinées avec l'élimination d'une surabondance de synapses et le renforcement de liens pertinents avec le développement et l'expérience. Les avancées récentes de la technologie IRM, comme le DTI, offrent un outil potentiel pour examiner le rôle de certaines régions de la substance blanche dans le développement du cerveau et le comportement avec plus de détail. Les études de neuro-imagerie qui ont lié le développement de faisceaux de fibres à des améliorations des capacités cognitives sont pertinentes pour cet article. Plus précisément, des associations entre les mesures du développement préfrontal de la substance blanche et le contrôle cognitif basées sur la DTI ont été montrées. Dans une étude, le développement de cette capacité était positivement corrélé avec les faisceaux de fibres préfrontal-pariétaux (Nagy, Westerberg et Klingberg, 2004) en accord avec les études de neuroimagerie fonctionnelle montrant le recrutement différentiel de ces régions chez les enfants par rapport aux adultes.
En utilisant une approche similaire, Liston et al. (2005) ont montré que les faisceaux de substance blanche entre les noyaux ganglionnaires préfrontal-basal et les faisceaux de fibres postérieurs continuent de se développer pendant l'enfance jusqu'à l'âge adulte, mais que seuls les tracts situés entre le cortex préfrontal et les noyaux gris centraux sont corrélés au contrôle des impulsions, mesuré par la performance tâche. Les faisceaux de fibres préfrontales ont été définis par les régions d’intérêt identifiées dans une étude IRMf utilisant la même tâche. Dans les deux études de DTI sur le développement, les mesures du faisceau de fibres ont été corrélées au développement, mais la spécificité de certains faisceaux de fibres présentant des performances cognitives a été démontrée en dissociant le tract particulier (Liston et al., 2005) ou capacité cognitive (Nagy et al., 2004). Ces résultats soulignent l’importance d’examiner non seulement les changements régionaux, mais aussi ceux liés aux circuits, lorsqu’on fait des affirmations sur les changements liés au vieillissement des substrats neuronaux du développement cognitif.
Etudes IRM fonctionnelles du développement comportemental et cérébral
Bien que les changements structurels mesurés par l'IRM et le DTI aient été associés à des changements de comportement au cours du développement, une approche plus directe pour examiner l'association structure-fonction consiste à mesurer simultanément les changements dans le cerveau et le comportement, comme avec l'IRMf. La capacité de mesurer les changements fonctionnels dans le cerveau en développement avec l'IRM présente un potentiel important pour la science du développement. Dans le contexte du présent document, l'IRMf offre un moyen de contraindre les interprétations du comportement des adolescents. Comme indiqué précédemment, on pense que le développement du cortex préfrontal joue un rôle important dans la maturation des capacités cognitives supérieures telles que la prise de décision et le contrôle cognitif (Casey, Tottenham et Fossella 2002b; Casey, Trainor et al., 1997). De nombreux paradigmes ont été utilisés, ainsi que l’IRMf, pour évaluer la base neurobiologique de ces capacités, notamment les tâches flanker, Stroop et go / nogo (Casey, Castellanos et al., 1997; Casey, Giedd et Thomas, 2000a; Durston et al., 2003). Ensemble, ces études montrent que les enfants recrutent des régions préfrontales distinctes, mais souvent plus grandes et plus diffus, que les adultes. Le modèle d'activité dans les régions cérébrales essentielles à la performance d'une tâche (c'est-à-dire qui est corrélée à la performance cognitive) devient plus focalisé ou plus finement ajusté avec l'âge, tandis que les régions non corrélées à la performance d'une tâche diminuent avec l'activité. Cette tendance a été observée à la fois en coupe transversale (Brown et al., 2005) et des études longitudinales (Durston et al., 2006) et à travers une variété de paradigmes. Bien que les études de neuroimagerie ne puissent caractériser de manière définitive le mécanisme de tels changements développementaux (par exemple, arborisation dendritique, élagage synaptique), les résultats reflètent le développement et la précision des projections à partir et à destination des régions activées du cerveau avec la maturation et suggèrent que ces changements se produisent sur une période prolongée. période de temps (Brown et al., 2005; Bunge, Dudukovic, Thomason, Vaidya et Gabrieli, 2002; Casey, Trainor et al., 1997; Casey et al., 2002a; Crone, Donohue, Honomichl, Wendelken et Bunge, 2006; Luna et al., 2001; Moses et al., 2002; Schlaggar et al., 2002; Tamm et al., 2002; Thomas et al., 2004; Turkeltaub, Gareau, Fleurs, Zeffiro et Eden, 2003).
Comment cette méthodologie peut-elle nous indiquer si les adolescents manquent réellement de contrôle cognitif (impulsif) ou s'ils sont risqués dans leurs choix et leurs actions? Le contrôle des impulsions, mesuré par les tâches de contrôle cognitif telles que la tâche Go / Nogo, montre un schéma de développement linéaire au cours de l'enfance et de l'adolescence, comme décrit ci-dessus. Cependant, des études récentes en neuroimagerie ont commencé à examiner le traitement lié à la récompense spécifique à la prise de risque chez les adolescents (Bjork et al., 2004; Ernst et al., 2005; May et al., 2004). Ces études ont porté principalement sur la région des accumbens, une partie des noyaux gris centraux impliquée dans la prévision de la récompense, plutôt que sur la caractérisation du développement de cette région conjointement avec les régions de contrôle descendantes (cortex préfrontal). Bien qu'un récent rapport faisant état d'une activité préfrontale moins ventrale chez les adolescents par rapport aux adultes au cours d'une tâche de décision monétaire sur le comportement de prise de risque a été démontré (Eshel, Nelson, Blair, Pine et Ernst, 2007).
Dans l’ensemble, peu d’études ont porté sur l’évolution du développement des circuits de récompense dans les régions sous-corticales (par exemple, les accumbens) parallèlement au développement des régions préfrontales corticales. De plus, la manière dont ces changements neuronaux coïncident avec les comportements de recherche de récompense, d'impulsivité et de prise de risque reste relativement inconnue. Notre modèle neurobiologique propose que la combinaison d'une réactivité accrue aux récompenses et d'une immaturité dans les zones de contrôle comportemental puisse inciter les adolescents à rechercher des gains immédiats plutôt qu'à long terme, ce qui pourrait expliquer leur augmentation dans la prise de décision risquée et leurs comportements impulsifs. Suivre le développement sous-cortical (par exemple, accumbens) et cortical (par exemple, préfrontal) de la prise de décision tout au long de la vie, de l’enfance à l’âge adulte, offre des contraintes supplémentaires sur le point de savoir si les changements signalés à l’adolescence sont spécifiques à cette période de développement ou reflètent la maturation motif quelque peu linéaire de l'enfance à l'âge adulte.
Les preuves empiriques d'une récente étude IRMf aident à soutenir notre modèle neurobiologique et à adopter une approche transitoire pour comprendre l'adolescence en examinant les changements qui surviennent avant et après l'adolescence. Dans cette étude (Galvan et al., 2006), nous avons examiné les réponses comportementales et neurales à la manipulation des récompenses au cours du développement, en nous concentrant sur les régions du cerveau impliquées dans l'apprentissage et le comportement liés aux récompenses chez l'animal (Hikosaka et Watanabe, 2000; Pecina, Cagniard, Berridge, Aldridge et Zhuang, 2003; Schultz, 2006) et des études d’imagerie pour adultes (p. ex. Knutson, Adams, Fong et Hommer, 2001; O, Doherty, Kringelbach, Rouleaux, Hornak, Andrews, 2001; Zald et al., 2004) et dans les études sur la dépendance (Hyman et Malenka, 2001; Volkow et Li, 2004). Basé sur des modèles de rongeurs (Laviola et al., 1999; Lance, 2000) et travaux d'imagerie antérieurs (Ernst et al., 2005), nous avons émis l’hypothèse que, par rapport aux enfants et aux adultes, les adolescents montreraient une activation exagérée des accumbens, de concert avec un recrutement moins mature des régions de contrôle préfrontales descendantes. Des travaux récents montrant une connectivité fonctionnelle retardée entre ces régions sous-corticales préfrontales et limbiques à l'adolescence par rapport aux adultes fournissent un mécanisme pour le manque de contrôle descendant de ces régions (Hare et al., 2007a).
Nos résultats étaient compatibles avec les modèles de rongeurs (Laviola, Macri, Morley-Fletcher et Adriani, 2003) et des études d'imagerie antérieures (Ernst et al., 2005) suggérant une activité accrue d'accumbens aux récompenses pendant l'adolescence. En effet, par rapport aux enfants et aux adultes, les adolescents ont montré une réaction d’accumbens exagérée en prévision de la récompense. Cependant, les enfants et les adolescents ont montré une réponse moins mature dans les régions de contrôle préfrontal que les adultes. Ces résultats suggèrent que des trajectoires de développement différentes pour ces régions peuvent sous-tendre l’amélioration de l’activité d’Accumbens par rapport aux enfants ou aux adultes, ce qui pourrait être lié à l’augmentation des comportements impulsifs et à risque observés au cours de cette période de développement (voir plus loin). Fig. 4).

Le recrutement différentiel des régions préfrontales et sous-corticales a été rapporté dans un certain nombre d’études IRMf développementales (Casey et al., 2002b; Monk et al., 2003; Thomas et al., 2004). Généralement, ces résultats ont été interprétés en termes de régions préfrontales immatures plutôt qu’un déséquilibre entre le développement régional préfrontal et sous-cortical. Il a été démontré que les régions préfrontales guidaient les actions appropriées dans différents contextes (Miller et Cohen, 2001) une activité préfrontale immature pourrait entraver l’estimation appropriée des résultats futurs et des choix risqués, et pourrait donc avoir moins d’influence sur l’évaluation de la récompense que les accumbens. Cette tendance est cohérente avec les recherches précédentes montrant une activité sous-corticale élevée par rapport à l'activité corticale lorsque les décisions sont biaisées par des gains immédiats sur le long terme (McClure, Laibson, Loewenstein et Cohen, 2004). En outre, il a été démontré que l’activité IRT-IRM était corrélée positivement avec les comportements de prise de risque ultérieurs (Kuhnen et Knutson, 2005). Pendant l'adolescence, par rapport à l'enfance ou à l'âge adulte, le cortex préfrontal ventral immature peut ne pas fournir un contrôle descendant suffisant des régions de traitement de la récompense activées de manière robuste (par exemple, accumbens), ce qui entraîne une moindre influence des systèmes préfrontaux (cortex orbitofrontal) par rapport aux accumbens de la récompense. évaluation.
Pourquoi le cerveau serait-il programmé pour se développer de cette façon?
L'adolescence est la période de transition entre l'enfance et l'âge adulte qui coïncide souvent avec la puberté. La puberté marque le début de la maturation sexuelle (Graber et Brooks-Gunn, 1998) et peuvent être définis par des marqueurs biologiques. L’adolescence peut être décrite comme une transition progressive vers l’âge adulte avec une évolution temporelle ontogénétique nébuleuse (Lance, 2000). Sur le plan évolutif, l’adolescence est la période au cours de laquelle les compétences en matière d’indépendance sont acquises afin d’accroître le succès après avoir été séparées de la protection de la famille, tout en augmentant les risques de circonstances néfastesKelley, Schochet et Landry, 2004). Les comportements de recherche d'indépendance prévalent d'une espèce à l'autre, tels que l'augmentation des interactions sociales dirigées par les pairs et l'intensification des comportements de recherche de nouveauté et de prise de risques. Les facteurs psychosociaux influent sur la propension des adolescents à adopter un comportement à risque. Cependant, les comportements à risque résultent d'un déséquilibre d'origine biologique entre l'augmentation de la nouveauté et la recherche de sensations, associé à une «compétence d'autorégulation» immature (Steinberg, 2004). Nos données neurobiologiques suggèrent que cela se produit par le développement différentiel de ces deux systèmes (limbique et contrôle).
Les spéculations suggéreraient que ce modèle de développement est une caractéristique évolutive. Vous devez adopter un comportement à haut risque pour quitter votre famille et votre village afin de trouver un partenaire et une prise de risque en même temps que les hormones poussent les adolescents à rechercher des partenaires sexuels. Dans la société d'aujourd'hui, où l'adolescence peut durer indéfiniment, avec des enfants vivant avec leurs parents, ayant une dépendance financière et choisissant des partenaires plus tard dans la vie, cette évolution peut être jugée inappropriée.
Parmi les espèces, il existe des preuves d'une recherche accrue de nouveauté et d'une prise de risques au cours de l'adolescence. La recherche de pairs du même âge et la bagarre avec les parents, qui aident tous à éloigner l'adolescent du territoire d'origine pour l'accoupler, sont observées chez d'autres espèces, notamment les rongeurs, les primates non humains et certains oiseaux (Lance, 2000). Par rapport aux adultes, les rats péri-adolescents manifestent une augmentation des comportements de recherche de la nouveauté dans un paradigme de la nouveauté à choix libre (Laviola et al., 1999). Des preuves neurochimiques indiquent que l'équilibre dans le cerveau des adolescents entre les systèmes dopaminergiques corticaux et sous-corticaux commence à se déplacer vers des niveaux plus élevés de dopamine corticale pendant l'adolescence (Lance, 2000). Une énervation dopaminergique prolongée similaire à l’âge adulte a également été mise en évidence dans le cortex préfrontal de primates non humains (Rosenberg et Lewis, 1995). Ainsi, cette prise de risque apparente élevée semble concerner toutes les espèces et avoir d'importants objectifs d'adaptation.
Prédispositions biologiques, développement et risque
Des différences individuelles dans le contrôle des impulsions et la prise de risques ont été reconnues en psychologie depuis un certain temps (Benthin, Slovic et Severson, 1993). L’un des exemples classiques de différences individuelles signalées dans ces capacités dans la littérature sur la psychologie sociale, cognitive et du développement est le retard de satisfaction (Mischel, Shoda et Rodriguez, 1989). Le délai de gratification est généralement évalué chez les bambins âgés de 3 à 4. On demande au bambin s’il préférerait une petite récompense (un biscuit) ou une grosse récompense (deux biscuits). On dit ensuite à l'enfant que l'expérimentateur quittera la pièce afin de se préparer pour les activités à venir et lui expliquera que si elle reste à sa place et ne mange pas de biscuit, elle recevra la grande récompense. Si l'enfant n'attend pas ou ne peut pas attendre, il devrait sonner une cloche pour appeler l'expérimentateur et ainsi recevoir la récompense la plus faible. Une fois qu'il est clair que l'enfant comprend la tâche, il est assis à la table avec les deux récompenses et la cloche. Les distractions dans la pièce sont réduites au minimum, sans jouets, livres ou images. L'expérimentateur revient après 15 min ou après que l'enfant a sonné la cloche, mangé les récompenses ou montré des signes de détresse. Mischel a montré que les enfants se comportaient généralement de deux manières: (1), soit ils sonnaient presque immédiatement pour obtenir le cookie, ce qui signifie qu'ils n'en avaient qu'un; ou (2), ils attendent, optimisent leurs gains et reçoivent les deux cookies. Cette observation suggère que certaines personnes sont plus aptes que d’autres à maîtriser les pulsions face à des motivations très saillantes et que ce biais peut être détecté dès la petite enfance (Mischel et al., 1989) et ils semblent persister tout au long de l'adolescence et du début de l'âge adulte (Eigsti et al., 2006).
Qu'est-ce qui pourrait expliquer les différences individuelles dans la prise de décision et le comportement optimaux? Certains théoriciens ont postulé que les circuits dopaminergiques mésolimbiques, impliqués dans le traitement des récompenses, sous-tendent les comportements à risque. Les différences individuelles dans ce circuit, telles que les variants alléliques dans les gènes liés à la dopamine, entraînant trop ou pas assez de dopamine dans les régions sous-corticales, pourraient être liées à la propension à adopter un comportement à risque (O'Doherty, 2004). Il a été démontré que le noyau accumbens augmente son activité immédiatement avant de faire des choix risqués sur des paradigmes de risque monétaire (Kuhnen et Knutson, 2005; Matthews et al., 2004; Montague et Berne, 2002) et comme décrit précédemment, les adolescents font preuve d’une activité exagérée d’accumbens qui donne des résultats enrichissants par rapport aux enfants ou aux adultes (Ernst et al., 2005; Galvan et al., 2006). Ensemble, ces données suggèrent que les adolescents peuvent être plus enclins à faire des choix risqués en tant que groupe (Jardinier et Steinberg, 2005), mais certains adolescents seront plus enclins que d’autres à adopter des comportements à risque, ce qui les exposera potentiellement davantage à des résultats négatifs. Par conséquent, il est important de prendre en compte la variabilité individuelle lors de l'examen des relations complexes cerveau-comportement liées à la prise de risque et au traitement de récompense dans les populations en développement.
Explorer les différences individuelles dans les comportements à risque, Galvan et al. (2007) a récemment examiné l’association entre l’activité dans les circuits neuronaux liés aux récompenses en prévision d’une large récompense monétaire et de mesures du trait de personnalité de la prise de risque et de l’impulsivité chez les adolescents. L'imagerie par résonance magnétique fonctionnelle et les échelles d'évaluation anonyme de l'auto-évaluation du comportement à risque, de la perception du risque et de l'impulsivité ont été acquises chez des individus âgés de 7 à 29. Il y avait une association positive entre l'activité d'accumbens et la probabilité d'adopter un comportement à risque tout au long du développement. Cette activité variait en fonction de l'évaluation par les individus des conséquences positives ou négatives anticipées d'un tel comportement. Les individus qui percevaient des comportements à risque comme entraînant des conséquences désastreuses activaient moins les accumbens pour récompenser. Cette association était largement motivée par les enfants, les adultes estimant que les conséquences d'un tel comportement étaient possibles. Les indices d'impulsivité n'étaient pas associés à l'activité d'accumbens, mais plutôt à l'âge. Ces résultats suggèrent que pendant l'adolescence, certaines personnes pourraient être plus enclines à adopter des comportements à risque en raison de changements de développement concomitants avec la variabilité de la prédisposition d'un individu à adopter un comportement à risque plutôt que de simples changements d'impulsivité (voir ci-dessous). Fig. 5).

Le comportement des adolescents a été maintes fois caractérisé comme impulsif et risqué (Steinberg, 2004, 2007), cette revue de la littérature en imagerie suggère cependant différents substrats neurobiologiques et différentes trajectoires de développement pour ces comportements. Plus précisément, l'impulsivité est associée au développement préfrontal ventral immature et diminue progressivement de l'enfance à l'âge adulte (Casey, Galvan et al., 2005). La corrélation négative entre les cotes d’impulsivité et l’âge dans l’étude par Galvan et al. (2007) soutient davantage cette notion. En revanche, la prise de risque est associée à une augmentation de l’activité d’accumbens (Kuhnen et Knutson, 2005; Matthews et al., 2004; Montague et Berne, 2002), exagérée chez les adolescents, par rapport aux enfants et aux adultes (Ernst et al., 2005; Galvan et al., 2006). Ainsi, les choix et le comportement des adolescents ne peuvent pas être expliqués par l'impulsivité ou le développement prolongé du cortex préfrontal seul, car on prédirait alors que les enfants seront davantage porteurs de risques. Les résultats fournissent une base neuronale expliquant pourquoi certains adolescents courent un risque plus élevé que d'autres, mais fournissent en outre une base permettant de comprendre en quoi le comportement des adolescents diffère de celui des enfants et des adultes en matière de prise de risque.
Collectivement, ces données suggèrent que, bien que les adolescents en tant que groupe soient considérés comme des preneurs de risque (Jardinier et Steinberg, 2005), certains adolescents seront plus enclins que d’autres à adopter des comportements à risque, ce qui les exposera potentiellement davantage à des résultats négatifs. Ces résultats soulignent l'importance de prendre en compte la variabilité individuelle lors de l'examen de relations complexes cerveau-comportement liées à la prise de risque et au traitement de récompense dans les populations en développement. De plus, ces différences individuelles et développementales peuvent aider à expliquer la vulnérabilité chez certaines personnes à la prise de risque associée à la consommation de substances psychoactives et, finalement, à la dépendance.
Conclusions
Les études d'imagerie humaine montrent des changements structurels et fonctionnels dans les régions fronto-triatales (Giedd et al., 1996, 1999; Jernigan et al., 1991; Sowell et al., 1999; pour évaluation, Casey, Galvan et al., 2005) qui semblent parallèles aux augmentations du contrôle cognitif et de l'autorégulation (Casey, Trainor et al., 1997; Luna et Sweeney, 2004; Luna et al., 2001; Rubia et al., 2000; Steinberg, 2004; Voir aussi Steinberg, 2008, ce problème). Ces changements semblent indiquer un changement dans l'activation des régions préfrontales d'un recrutement diffus à un recrutement plus focal dans le temps (Brown et al., 2005; Bunge et al., 2002; Casey, Trainor et al., 1997; Durston et al., 2006; Moses et al., 2002) et le recrutement élevé de régions sous-corticales à l’adolescence (Casey et al., 2002a; Durston et al., 2006; Luna et al., 2001). Bien que les études de neuroimagerie ne puissent caractériser de manière définitive le mécanisme de tels changements développementaux, ces changements de volume et de structure peuvent refléter le développement au sein de et les affinements des projections vers et à partir de ces régions du cerveau au cours de la maturation suggérant un ajustement du système au développement.
Pris dans leur ensemble, les résultats synthétisés ici indiquent que l’augmentation du comportement de prise de risque à l’adolescence est associé à différentes trajectoires de développement des régions de plaisir sous-cortical et de contrôle cortical. Ces changements de développement peuvent être exacerbés par les différences individuelles d'activité des systèmes de récompense. Bien que l’adolescence ait été distinguée comme une période caractérisée par des comportements de recherche de récompense et de prise de risques (Jardinier et Steinberg, 2005; Lance, 2000) les différences individuelles dans les réponses neuronales à la récompense prédisposent certains adolescents à prendre plus de risques que d’autres, ce qui les expose davantage à des résultats négatifs. Ces résultats fournissent un travail de base essentiel en synthétisant les différentes conclusions relatives au comportement de prise de risque à l'adolescence et en comprenant les différences individuelles et les marqueurs développementaux de la propension à adopter un comportement négatif.
Remerciements
Ce travail a été financé en partie par des subventions de l'Institut national de lutte contre l'abus des drogues R01 DA18879 et de l'Institut national de la santé mentale 1P50 MH62196.
Bibliographie
- Benthin A, Slovic P, Severson H. Une étude psychométrique de la perception du risque chez les adolescents. Journal de l'adolescence. 1993;16: 153-168. [PubMed]
- Bjork JM, B Knutson, Fong GW, DM Caggiano, SM Bennett, Hommer DW. Activation cérébrale induite par incitation chez les adolescents: similitudes et différences avec les jeunes adultes. Journal of Neuroscience. 2004;24: 1793-1802. [PubMed]
- Bjorkland DF. Le rôle de la connaissance conceptuelle dans le développement de l'organisation dans la mémoire des enfants. Dans: Brainerd CJ, Pressley M, éditeurs. Processus de base dans le développement de la mémoire: Progrès dans la recherche sur le développement cognitif. New York: Springer-Verlag; 1985. pp. 103 – 142.
- Bjorkland DF. Comment les changements d'âge dans la base de connaissances contribuent au développement de la mémoire des enfants: une analyse interprétative. Examen de développement. 1987;7: 93-130.
- Bourgeois JP, PS Goldman-Rakic, Rakic P. Synaptogenesis dans le cortex préfrontal de singes rhésus. Cortex cérébral. 1994;4: 78-96. [PubMed]
- Le juge en chef Brainerd, Reyna VF. Indépendance de la mémoire et interférence de la mémoire dans le développement cognitif. Examen psychologique. 1993;100: 42-67. [PubMed]
- Brown TT, Lugar HM, RS Coalson, Miezin FM, Petersen SE, Schlaggar BL. Changements de développement dans l'organisation fonctionnelle cérébrale humaine pour la génération de mots. Cortex cérébral. 2005;15: 275-290. [PubMed]
- Bunge SA, NM Dudukovic, ME Thomason, juge en chef Vaidya, Gabrieli JD. Contributions immatures du lobe frontal au contrôle cognitif chez l'enfant: données factuelles tirées de l'IRMf. Neuron. 2002;33: 301-311. [PubMed]
- Cas R. Validation d'une construction de capacité néo-piagétienne. Journal of Experimental Child Psychology. 1972;14: 287-302.
- Cas R. Développement intellectuel: De la naissance à l'âge adulte. New York: Presse académique; 1985.
- Casey BJ, Castellanos FX, Giedd JN, Marsh WL, Hamburger SD, Schubert AB. et al. Implication des circuits frontostriataux droits dans l'inhibition de la réponse et le trouble déficit de l'attention / hyperactivité. Journal de l'Académie américaine de psychiatrie de l'enfant et de l'adolescent. 1997;36: 374-383. [PubMed]
- Casey BJ, Galvan A, Hare TA. Changements dans l'organisation fonctionnelle cérébrale au cours du développement cognitif. Opinion actuelle en neurobiologie. 2005;15: 239-244. [PubMed]
- Casey BJ, Giedd JN, Thomas KM. Le développement cérébral structurel et fonctionnel et sa relation avec le développement cognitif. Psychologie biologique. 2000a;54: 241-257. [PubMed]
- Casey BJ, Thomas KM, MC Davidson, Kunz K, Franzen PL. Dissocier la fonction striatale et hippocampique du développement avec une tâche de compatibilité stimulus-réponse. Journal of Neuroscience. 2002a;22: 8647-8652. [PubMed]
- Casey BJ, Thomas KM, GT gallois, Badgaiyan RD, Eccard CH, Jennings JR, et al. Dissociation du conflit de réponse, de la sélection de l'attention et de l'attente avec l'imagerie par résonance magnétique fonctionnelle. Actes de l'Académie nationale des sciences. 2000b;97: 8728-8733.
- Casey BJ, Tottenham N, Fossella J. Approches cliniques, d'imagerie, de lésion et génétiques pour un modèle de contrôle cognitif. Psychobiologie du développement. 2002b;40: 237-254. [PubMed]
- Casey BJ, Tottenham N, Liston C, Durston S. Imagerie du développement du cerveau: qu'avons-nous appris sur le développement cognitif? Tendances en sciences cognitives. 2005;9: 104-110.
- Casey BJ, Trainor RJ, Orendi JL, Schubert AB, Nystrom LE, Giedd JN et al. Une étude IRM fonctionnelle développementale de l'activation préfrontale lors de l'exécution d'une tâche de type «go-no-go». Journal of Cognitive Neuroscience. 1997;9: 835-847.
- Crone E, Donohue S, Honomichl R, Wendelken C, Bunge S. Régions cérébrales induisant une utilisation souple des règles au cours du développement. Journal of Neuroscience. 2006;26: 11239-11247. [PubMed]
- Dempster FN. Résistance aux interférences: changements de développement dans un mécanisme de traitement de base. Dans: Howe ML, Pasnak R, rédacteurs. Thèmes émergents du développement cognitif Volume 1: Foundations. New York: Springer; 1993. pp. 3 – 27.
- Diamant A. Développement de la capacité à utiliser le rappel pour guider l'action, comme indiqué par la performance du nourrisson sous AB. Développement de l'enfant. 1985;56: 868-883. [PubMed]
- Durston S, MC Davidson, Thomas KM, MS Worden, Tottenham N, Martinez A, et al. Manipulation paramétrique des conflits et de la concurrence d’intervention à l’aide d’une IRMf rapide à épreuves mixtes. Neuroimage. 2003;20: 2135-2141. [PubMed]
- Durston S, Davidson MC, Tottenham N, Galvan A, Spicer J, Fossella J, et al. Passage d'une activité corticale diffuse à une activité focale avec développement. Science du développement. 2006;1: 18-20. [PubMed]
- Durston S, Hulshoff Pol HE, Casey BJ, Giedd JN, Buitelaar JK, van Engeland H. IRM anatomique du cerveau en développement: qu'avons-nous appris? Journal de l'Académie américaine de psychiatrie enfantine. 2001;40: 1012-1020.
- Eaton LK, Kinchen S., Ross J., Hawkins, Harris, WA, Lowry, R. et al. Surveillance du comportement à risque des jeunes - États-Unis, 2005, résumés de surveillance. Rapport hebdomadaire sur la morbidité et la mortalité. 2006;55: 1-108. [PubMed]
- Eigsti IM, Zayas V, W Mischel, Y Shoda, O Ayduk, MB Dadlani, et al. Prédire le contrôle cognitif du préscolaire à la fin de l'adolescence et au début de l'âge adulte. Science psychologique. 2006;17: 478-484. [PubMed]
- Ernst M, Nelson EE, S Jazbec, McClure EB, Monk CS, Leibenluft E, et al. L'amygdale et le noyau accumbens en réponse à la réception et à l'omission de gains chez l'adulte et l'adolescent. Neuroimage. 2005;25: 1279-1291. [PubMed]
- Eshel N, Nelson EE, RJ Blair, Pine DS, Ernst M. Choix de substrats neuronaux chez l'adulte et l'adolescent: Développement du cortex ventrolatéral préfrontal et antérieur. Neuropsychologia. 2007;45: 1270-1279. [Article gratuit PMC] [PubMed]
- Flavell JH, Feach DR, Chinsky JM. Répétition verbale spontanée dans une tâche de mémoire en fonction de l'âge. Développement de l'enfant. 1966;37: 283-299. [PubMed]
- Galvan A, Hare TA, Parra CE, Penn J, H Voss, Glover G, et al. Un développement plus précoce de l'accumbens par rapport au cortex orbitofrontal pourrait être à la base d'un comportement à risque chez les adolescents. Journal of Neuroscience. 2006;26: 6885-6892. [PubMed]
- Galvan A, Hare T, Voss H, Glover G, Casey BJ. Prise de risque et cerveau des adolescents: qui est à risque? Science du développement. 2007;10: F8 – F14. [PubMed]
- Gardener M, Steinberg L. Influence des pairs sur la prise de risque, la préférence de risque et la prise de décision risquée à l'adolescence et à l'âge adulte: une étude expérimentale. La psychologie du développement. 2005;41: 625-635. [PubMed]
- Giedd JN. Imagerie par résonance magnétique structurelle du cerveau adolescent. Annales de l'Académie des sciences de New York. 2004;1021: 77-85. [PubMed]
- Giedd JN, J Blumenthal, Jeffries NO, Castellanos FX, Liu H., Zijdenbos A, et al. Développement du cerveau pendant l'enfance et l'adolescence: une étude longitudinale par IRM. Nature Neuroscience. 1999;2: 861-863.
- Giedd JN, Snell JW, Lange N, JC Rajapakse, Casey BJ, Kozuch PL, et al. Imagerie quantitative par résonance magnétique du développement du cerveau humain: Ages 4 – 18. Cortex cérébral. 1996;6: 551-560. [PubMed]
- N. Gogtay, J. Giedd, L. Lusk, KM Hayashi, D. Greenstein, AC Vaituzis et al. Cartographie dynamique du développement cortical humain de l'enfance au début de l'âge adulte. Actes de l'Académie nationale des sciences des États-Unis d'Amérique. 2004;101: 8174-8179. [Article gratuit PMC] [PubMed]
- Le juge Graber, Brooks-Gunn J. Puberty. Dans: Blechman EA, Brownell KD, éditeurs. Médecine comportementale et les femmes un manuel complet. New York, NY: Guilford Press; 1998. pp. 51 – 58.
- Hare TA, HU Voss, GH Glover, Casey BJ. Le cerveau de l'adolescent et le risque potentiel d'anxiété et de dépression. 2007 Soumis pour publication.
- Hare TA, HU Voss, GH Glover, Casey BJ. La compétition entre les systèmes limbiques préfrontal et sous-cortical est à la base de la réactivité émotionnelle au cours de l'adolescence. 2007b Soumis pour publication.
- Harnishfeger KK, Bjorkland F. L'ontogenèse des mécanismes d'inhibition: une approche renouvelée du développement cognitif. Dans: Howe ML, Pasnek R, rédacteurs. Thèmes émergents dans le développement cognitif. Vol. 1. New York: Springer-Verlag; 1993. pp. 28 – 49.
- Hikosaka K, Watanabe M. Retarder l'activité des neurones préfrontaux orbitaux et latéraux du singe, avec des récompenses différentes. Cortex cérébral. 2000;10: 263-271. [PubMed]
- Huttenlocher PR. Densité synaptique dans le cortex frontal humain - Changements développementaux et effets du vieillissement. Recherche sur le cerveau. 1979;163: 195-205. [PubMed]
- Hyman SE, Malenka RC. La toxicomanie et le cerveau: la neurobiologie de la compulsion et sa persistance. Examens de la nature Neuroscience. 2001;2: 695-703.
- Jernigan TL, Zisook S, Heaton RK, Moranville JT, Hesselink JR, Braff DL. Anomalies d'imagerie par résonance magnétique dans les noyaux lenticulaires et le cortex cérébral dans la schizophrénie. Archives de psychiatrie générale. 1991;48: 811-823.
- Keating DP, Bobbitt BL. Différences individuelles et développementales dans les composantes du traitement cognitif de la capacité mentale. Développement de l'enfant. 1978;49: 155-167.
- Kelley AE, Schochet T, Landry C. Annales de l'Académie des sciences de New York. 2004;1021: 27-32. [PubMed]
- Knutson B, CM Adams, Fong GW, Hommer D. L'anticipation de l'augmentation de la récompense monétaire recrute sélectivement le noyau accumbens. Journal of Neuroscience. 2001;21: RC159. [PubMed]
- Kuhnen CM, Knutson B. La base neurale de la prise de risque financier. Neuron. 2005;47: 763-770. [PubMed]
- Laviola G, Adriani W, Terranova ML, Gerra G. Facteurs de risque psychobiologiques pour la vulnérabilité aux psychostimulants chez les adolescents humains et les modèles animaux. Neuroscience and Biobehavioral Reviews. 1999;23: 993-1010. [PubMed]
- Laviola G, S Macri, S Morley-Fletcher, Adriani W. Résumé comportement de prise de risque chez les souris adolescentes: Déterminants psychobiologiques et influence épigénétique précoce. Neuroscience and Biobehavioral Reviews. 2003;27: 19-31. [PubMed]
- Liston C, R Watts, N Tottenham, MC Davidson, S Niogi, Ulug AM, et al. La microstructure frontostriatale module le recrutement efficace du contrôle cognitif. Cortex cérébral. 2005;16: 553-560. [PubMed]
- Luna B, Juge Sweeney L'émergence de la fonction cérébrale collaborative: études FMRI du développement de l'inhibition de la réponse. Annales de l'Académie des sciences de New York. 2004;1021: 296-309. [PubMed]
- Luna B, KR Thulborn, DP Munoz, EP Merriam, KE Garver, NJ Minshew et al. La maturation d'une fonction cérébrale largement répartie favorise le développement cognitif. Neuroimage. 2001;13: 786-793. [PubMed]
- Matthews SC, et al. L'activation sélective du noyau accumbens lors de la prise de décision. Neuroreport. 2004;15: 2123-2127. [PubMed]
- Mai JC, MR Delgado, RE Dahl, VA Stenger, ND ND Ryan, Fiez JA, et al. Imagerie par résonance magnétique fonctionnelle liée à l'événement des circuits cérébraux liés à la récompense chez les enfants et les adolescents. Psychiatrie biologique. 2004;55: 359-366. [PubMed]
- McClure SM, Laibson DI, Loewenstein G, Cohen JD. Les systèmes neuronaux distincts valorisent les avantages monétaires immédiats. Science. 2004;306: 503-507. [PubMed]
- Miller EK, Cohen JD. Une théorie intégrative de la fonction du cortex préfrontal. Examen annuel des neurosciences. 2001;24: 167-202.
- Mischel W, Shoda Y, Rodriguez MI. Retard de satisfaction chez les enfants. Science. 1989;244: 933-938. [PubMed]
- CS moine, EB McClure, Nelson EE, E. Zarahn, RM Bilder, E. Leibenluft, et al. Immaturité des adolescents dans l'engagement cérébral lié à l'attention aux expressions faciales émotionnelles. Neuroimage. 2003;20: 420-428. [PubMed]
- Montague PR, Berns GS. Économie neuronale et substrats biologiques de l'évaluation. Neuron. 2002;36: 265-284. [PubMed]
- Moses P, Roe K, RB Buxton, EC Wong, Frank LR, Stiles J. IRM fonctionnelle de traitement global et local chez les enfants. Neuroimage. 2002;16: 415-424. [PubMed]
- Munakata Y, Yerys BE. Tous ensemble maintenant: lorsque les dissociations entre connaissance et action disparaissent. Science psychologique. 2001;12: 335-337.
- Nagy Z, Westerberg H, Klingberg T. La maturation de la substance blanche est associée au développement des fonctions cognitives durant l'enfance. Journal of Cognitive Neuroscience. 2004;16: 1227-1233. [PubMed]
- O'Doherty J, ML Kringelbach, Rolls ET, J Hornak, Andrews C. Représentations abstraites de récompenses et de punitions dans le cortex orbitofrontal humain. Nature Neurosci. 2001;4: 95-102. [PubMed]
- O'Doherty JP. Représentations de récompense et apprentissage lié à la récompense dans le cerveau humain: informations tirées de la neuroimagerie. Opinions actuelles en neurobiologie. 2004;14: 769-776.
- Pascual-Leone JA. Un modèle mathématique pour la transition dans les stades de développement de Piaget. Acta Psychologica. 1970;32: 301-345.
- Pecina S, Cagniard B, KC Berridge, Aldridge JW, Zhuang X. Les souris mutantes hyperdopaminergiques ont plus de «désirs», mais ne «aiment pas» de belles récompenses. Journal of Neuroscience. 2003;23: 9395-9402. [PubMed]
- Reyna VF, Farley F. Risque et rationalité dans la prise de décision chez les adolescents: implications pour la théorie, la pratique et les politiques publiques. Science psychologique dans l'intérêt public. 2006;7: 1-44.
- Rosenberg DR, Lewis DA. Maturation postnatale de l'innervation dopaminergique des cortex préfrontal et moteur de singe: Une analyse immunohistochimique de la tyrosine hydroxylase. Journal de neurologie comparée. 1995;358: 383-400. [PubMed]
- Rubia K, Overmeyer S, E. Taylor, Brammer M., Williams SC, Simmons A, et al. Frontalisation fonctionnelle avec l'âge: Cartographie des trajectoires neurodéveloppementales avec l'IRMf. Neuroscience and Biobehavioral Reviews. 2000;24: 13-19. [PubMed]
- Schlaggar BL, TT brun, Lugar HM, KM Visscher, Miezin FM, Petersen SE. Différences neuroanatomiques fonctionnelles entre adultes et enfants d'âge scolaire dans le traitement de mots simples. Science. 2002;296: 1476-1479. [PubMed]
- Schultz W. Théories comportementales et neurophysiologie de la récompense. Examens annuels de psychologie. 2006;57: 87-115.
- Sowell ER, BS Peterson, Thompson PM, SE Bienvenue, Henkenius AL, Toga AW. Cartographier le changement cortical à travers la durée de vie humaine. Nature Neuroscience. 2003;6: 309-315.
- Sowell ER, PM PM Thompson, juge en chef Holmes, Jernigan TL, Toga AW. Preuve in vivo de la maturation cérébrale post-adolescente dans les régions frontale et striatale. Nature Neuroscience. 1999;2: 859-861.
- Sowell, ER, Thompson, PM, Toga, AW. Cartographie des changements dans le cortex humain tout au long de la vie. Neuroscientifique. 2004;10: 372-392. [PubMed]
- Spear LP. Le cerveau de l'adolescent et les manifestations comportementales liées à l'âge. Neuroscience and Biobehavioral Reviews. 2000;24: 417-463. [PubMed]
- Steinberg L. Prise de risque à l'adolescence: quels changements et pourquoi? Annales de l'Académie des sciences de New York. 2004;1021: 51-58. [PubMed]
- Steinberg L. Prise de risque à l'adolescence: nouvelles perspectives des sciences du cerveau et du comportement. Directions actuelles en sciences psychologiques. 2007;16: 55-59.
- Steinberg L. Une perspective de neuroscience sociale sur la prise de risque chez les adolescents. Examen de développement. 2008;28: 78-106. [Article gratuit PMC] [PubMed]
- Tamm L, Menon V, Reiss AL. Maturation de la fonction cérébrale associée à une inhibition de la réponse. Journal de l'Académie américaine de psychiatrie de l'enfant et de l'adolescent. 2002;41: 1231-1238. [PubMed]
- Thomas KM, Hunt RH, Vizueta N, Sommer T, S Durston, Yang Y et al. Preuve de différences développementales dans l’apprentissage séquentiel implicite: une étude IRMF sur des enfants et des adultes. Journal of Cognitive Neuroscience. 2004;16: 1339-1351. [PubMed]
- Turkeltaub PE, Gareau L, Fleurs DL, Zeffiro TA, Eden GF. Développement de mécanismes neuronaux pour la lecture. Nature Neuroscience. 2003;6: 767-773.
- Volkow ND, Li TK. Toxicomanie: Neurobiologie du comportement qui tourne mal. Examens de la nature Neuroscience. 2004;5: 963-970.
- Yurgelun-Todd D. Changements émotionnels et cognitifs à l'adolescence. Opinion actuelle en neurobiologie. 2007;17: 251-257. [PubMed]
- Zald DH, Boileau I, El-Dearedy W, Gunn R, McGlone F, Dichter GS, et al. Transmission de la dopamine dans le striatum humain lors de tâches rémunératrices. Journal of Neuroscience. 2004;24: 4105-4112. [PubMed]