Dialogues Clin Neurosci. 2013 Dec;15(4):431-43.
Abstract
Malgré l’importance de nombreux facteurs psychosociaux, la toxicomanie implique essentiellement un processus biologique: la capacité d’une exposition répétée à une drogue abusive à induire des changements dans un cerveau vulnérable qui motive la recherche et la prise compulsives de drogues et la perte de contrôle. sur la consommation de drogue, qui définissent un état de dépendance. Ici, nous passons en revue les types d’adaptations moléculaires et cellulaires qui se produisent dans des régions spécifiques du cerveau afin de traiter les anomalies comportementales associées à la dépendance. Celles-ci incluent des altérations de l'expression des gènes obtenues en partie via des mécanismes épigénétiques, la plasticité dans le fonctionnement neurophysiologique des neurones et des synapses, et la plasticité associée dans la morphologie neuronale et synaptique induite en partie par la signalisation de facteurs neurotrophiques altérés. Chacune de ces modifications induites par un médicament peut être considérée comme une forme de «mémoire cellulaire ou moléculaire». De plus, il est frappant de constater que la plupart des formes de plasticité liées à la toxicomanie sont très similaires aux types de plasticité associées aux formes plus classiques de «mémoire comportementale», reflétant peut-être le répertoire fini de mécanismes adaptatifs disponibles pour les neurones face aux problèmes environnementaux. défis. Enfin, les adaptations moléculaires et cellulaires liées à la dépendance impliquent la plupart des mêmes régions du cerveau qui médiatisent des formes de mémoire plus classiques, ce qui concorde avec l'idée selon laquelle des mémoires anormales sont des facteurs importants de syndrome de dépendance. Le but de ces études qui visent à expliquer les bases moléculaires et cellulaires de la toxicomanie est de développer à terme des tests de diagnostic basés sur la biologie, ainsi que des traitements plus efficaces pour les troubles de la toxicomanie.
Introduction
La toxicomanie, qui peut être définie comme la recherche et la prise compulsives de drogues malgré des conséquences terribles ou la perte de contrôle de la consommation de drogues, est causée par des modifications induites par la drogue et de longue durée qui se produisent dans certaines régions du cerveau.1 Cependant, seules certaines personnes succombent à la toxicomanie en cas d’exposition répétée à une drogue, alors que d’autres sont capables de consommer de la drogue avec désinvolture et d’éviter un syndrome de toxicomanie. Les facteurs génétiques expliquent approximativement 50% de cette variabilité individuelle de la vulnérabilité à la dépendance, et ce degré d'héritabilité est valable pour toutes les principales catégories de drogues entraînant une dépendance, y compris les stimulants, les opiacés, l'alcool, la nicotine et les cannabinoïdes..2 Il n'a pas encore été possible d'identifier la plupart des gènes qui composent ce risque génétique, probablement en raison de l'implication de centaines de variations génétiques pouvant résumer chez un seul individu afin de conférer une vulnérabilité de dépendance (ou, chez d'autres, une résistance).
L'autre 50% du risque de dépendance est dû à une multitude de facteurs environnementaux, survenant tout au long de la vie, qui interagissent avec la composition génétique d'un individu pour le rendre plus ou moins vulnérable à la dépendance. Plusieurs types de facteurs environnementaux ont été impliqués dans la dépendance, y compris les stress psychosociaux, mais le facteur de loin le plus puissant est l'exposition à une drogue d'abus elle-même. Il a été démontré que certaines drogues «d'entrée», en particulier la nicotine, augmentent la vulnérabilité d'une personne à une dépendance à une autre drogue.3 De plus, il existe de plus en plus de preuves que, malgré une gamme de risques génétiques de dépendance dans la population, l'exposition à des doses suffisamment élevées d'un médicament pendant de longues périodes peut transformer une personne ayant une charge génétique relativement faible en toxicomane..4
Au cours des deux dernières décennies, de grands progrès ont été réalisés dans l'identification des régions distinctes du cerveau qui jouent un rôle important dans la médiation d'un syndrome de dépendance, ainsi que des types de changements au niveau moléculaire et cellulaire induits par les médicaments dans ces régions de la dépendance.1,5 Le circuit qui a reçu le plus d'attention est appelé système dopaminergique mésolimbique, qui implique des neurones dopaminergiques situés dans la région tegmentale ventrale (VTA) des neurones médians du noyau cérébral innervant dans le noyau accumbens (NAc, une partie du striatum ventral). Ces neurones VTA innervent également de nombreuses autres régions du cerveau antérieur, y compris l'hippocampe, l'amygdale et le cortex préfrontal (PFC).
Il est logique de considérer ces mécanismes de dépendance induits par les drogues dans ce volume sur la mémoire pour trois raisons qui se chevauchent.6
- Premièrement, toutes les adaptations induites par un médicament peuvent être considérées comme des types de «mémoire moléculaire ou cellulaire»: la cellule nerveuse subissant de tels changements est différente du fait de l'exposition au médicament et réagit donc différemment à ce même médicament, à d'autres drogues ou à une foule d'autres stimuli à la suite.
- Deuxièmement, il est intéressant de noter que beaucoup, peut-être la plupart des types de changements associés à un état de dépendance. (p. ex. modification de la transcription des gènes, épigénétique, plasticité synaptique et globale des cellules, morphologie neuronale et mécanismes neurotrophiques) sont également impliqués dans les formes traditionnelles de «mémoire comportementale» telles que la mémoire spatiale, le conditionnement de la peur et le conditionnement opérant, entre autres.
- Troisièmement, parmi les régions du cerveau touchées par la toxicomanie, il y a celles qui sont des substrats neuronaux clés pour la mémoire comportementale, notamment l'hippocampe, l'amygdale et les PFC. Cela coïncide avec la prise de conscience croissante du fait que certaines des caractéristiques les plus importantes de la toxicomanie observées cliniquement (par exemple, le désir de drogue et les rechutes) reflètent des anomalies dans les circuits de mémoire traditionnels, la mémoire à long terme de l'expérience de la drogue servant de puissant facteur de toxicomanie.4,7,8 Inversement, les régions de récompense du cerveau (par exemple, VTA et NAc) influencent fortement la mémoire comportementale.
Cet article fournit un aperçu des principaux types de changements moléculaires et cellulaires qui se produisent dans plusieurs régions du cerveau dans des modèles animaux de dépendance, en se concentrant sur le noyau accumbens pour lequel la plupart des informations sont actuellement disponibles. Fait important, il a été de plus en plus possible de valider certains de ces changements chez les toxicomanes humains en se basant sur des études de cerveaux post-mortem. Bien que les drogues d'abus aient des structures chimiques distinctes et agissent sur des cibles protéiques distinctes, il est frappant de constater que de nombreuses adaptations importantes liées à la dépendance sont communes à beaucoup, et dans certains cas à toutes les drogues, d'abus et contribuent probablement aux caractéristiques communes d'un syndrome de dépendance.4,9 En revanche, de nombreuses autres adaptations induites par un médicament sont spécifiques à un médicament donné et peuvent induire des aspects plus uniques d’une dépendance donnée. Nous nous concentrons ici sur les abus de stimulants et d'opiacés, qui produisent des effets plus dramatiques chez les modèles animaux par rapport à d'autres médicaments. Nous soulignons également des domaines importants pour les recherches futures qui approfondiront davantage notre connaissance des syndromes de dépendance et traduiront ces avancées en tests de diagnostic et traitements améliorés.
Mécanismes transcriptionnels et épigénétiques
Le fait de savoir que les toxicomanes peuvent présenter un risque accru de rechute malgré des années d’abstinence signifie que la toxicomanie implique des modifications du cerveau induites par la drogue et qui peuvent être très stables. Ceci a conduit plusieurs groupes à considérer les changements dans l'expression des gènes comme une composante importante du processus de dépendance (Figure 1). En conséquence, des études de gènes candidats ou des études à l'échelle du génome impliquant des microréseaux d'ADN et plus récemment l'ARN-seq (séquençage à haut débit d'ARN exprimés) a identifié de nombreux gènes dont l'expression est altérée dans une région cérébrale donnée dans des modèles de toxicomanie chez les rongeurs et les primates et chez les toxicomanes humains (par exemple, références 10-17). Des exemples de tels gènes sont discutés dans les sections suivantes de cette revue.
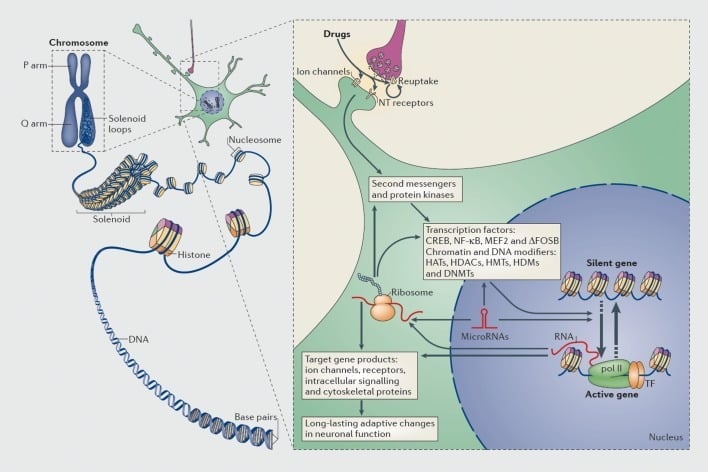
Mécanismes de régulation transcriptionnelle et épigénétique par les drogues d'abus. Dans les cellules eucaryotes, l'ADN est organisé en enveloppant des octomères d'histones pour former des nucléosomes, qui sont ensuite organisés et condensés pour former des chromosomes (partie gauche). Ce n'est qu'en démêlant temporairement la chromatine compactée que l'ADN d'un gène spécifique peut être rendu accessible à la machinerie de transcription. Les drogues d'abus agissent par le biais de cibles synaptiques telles que les mécanismes de réabsorption, les canaux ioniques et les récepteurs de neurotransmetteurs (NT) pour modifier les cascades de signalisation intracellulaire (partie droite). Cela conduit à l'activation ou à l'inhibition de facteurs de transcription (TF) et de nombreuses autres cibles nucléaires, y compris les protéines régulatrices de la chromatine (indiquées par des flèches épaisses); les mécanismes détaillés impliqués dans la régulation synaptique des protéines régulatrices de la chromatine restent mal compris. Ces processus aboutissent finalement à l'induction ou à la répression de gènes particuliers, y compris ceux d'ARN non codants tels que les microARN; Une expression altérée de certains de ces gènes peut à son tour réguler davantage la transcription des gènes. Il est suggéré que certains de ces changements induits par les médicaments au niveau de la chromatine sont extrêmement stables et sont donc à la base des comportements à long terme qui définissent la dépendance. CREB, protéine de liaison à un élément sensible à l'AMP cyclique; DNMT, ADN méthyltransférases; HAT, histone acétyltransférases; HDAC, histone déacétylases; HDM, histones déméthylases; Les HMT, les histones méthyltransférases; MEF2, facteur 2 amplificateur spécifique des myocytes; NF-kB, facteur nucléaire-KB; pol II, ARN polymérase II. Reproduit de la référence 44: Robison AJ, Nestler EJ. Mécanismes transcriptionnels et épigénétiques de la dépendance. Nat Rev Neurosci. 2011; 12: 623-637.
De même, de nombreux types de facteurs de transcription - des protéines qui se lient aux régions régulatrices des gènes et augmentent ou diminuent ainsi la transcription de ces gènes - ont été impliqués dans la médiation des effets à long terme de l'abus de médicaments sur l'expression des gènes dans le cerveau.. Les exemples les plus connus comprennent les protéines CREB (protéine de liaison aux éléments de réponse cAMP), AFOSB (facteur de transcription de la famille Fos), NFkB (facteur nucléaire kB), MEF2 (facteur 2 activant les myocytes) et les glucocorticoïdes.5,10,18-22 Il a été de plus en plus possible de comprendre les voies de signalisation cellulaire par lesquelles les drogues d'abus activent un facteur de transcription donné dans le cerveau et de lier de manière causale cette activation aux gènes cibles de ce facteur de transcription et à des aspects comportementaux spécifiques de la dépendance (voir Figure 1). Ces progrès sont illustrés par les facteurs CREB et ΔFosB, qui sont les facteurs de transcription les mieux étudiés dans les modèles de toxicomanie.
Protéine de liaison à l'élément de réponse cAMP
Stimulants et drogues opiacées d'abus activent CREB dans plusieurs régions du cerveau importantes pour la toxicomanie, y compris dans le NAc.23,24 CREB est connu pour être activé dans d’autres systèmes par cAMP, Ca2+et les voies de facteurs de croissance,25 et on ne sait pas encore lequel de ces facteurs déclenche son activation dans l’anémie néonatale par l’abus de drogues. Il a été démontré que l’activation médicamenteuse de CREB dans NAc représente un mécanisme classique de rétroaction négative, par lequel CREB sert à réduire la sensibilité d'un animal aux effets gratifiants de ces médicaments (tolérance) et à médier un état émotionnel négatif pendant le sevrage médicamenteux (dépendance).18,26,27 Récemment, il a été démontré que ces effets entraînaient une augmentation de l'auto-administration du médicament et une rechute, vraisemblablement par le biais d'un processus de renforcement négatif.28 Ces actions de CREB semblent impliquer les deux sous-types majeurs de neurones épineux de type NAc, ceux qui expriment principalement D1 versus D2 récepteurs de la dopamine.24 IFait intéressant, de nombreux ouvrages ont montré que le CREB, agissant dans l'hippocampe et l'amygdale, est une molécule clé de la mémoire comportementale..29-31 Ce rôle important dans la toxicomanie et la mémoire comportementale reflète probablement le fait que les neurones sont dotés d'un nombre fini de mécanismes moléculaires leur permettant de s'adapter à un environnement en constante évolution.
Les gènes cibles de CREB responsables de ce phénotype comportemental ont été identifiés par le biais d'essais portant sur l'ensemble du génome ainsi que par des efforts plus poussés.10,18,32 Un exemple est le peptide opioïde dynorphine: induction stimulante de l'expression de la dynorphine dans les neurones NAc, via médiateur CREB, augmente l'activation par la dynorphine des k récepteurs opioïdes sur les neurones à dopamine VTA et supprime ainsi la transmission dopaminergique à l'ANc et altère la récompense.18 Plusieurs autres cibles CREB se sont révélées être importantes pour la plasticité synaptique induite par le médicament, comme discuté ci-dessous. Le CREB est également activé dans plusieurs autres régions du cerveau par des stimulants et des opiacés,23,24 on en sait moins sur les conséquences comportementales de cet effet et sur les gènes cibles à travers lesquels ils se produisent. De même, on en sait moins sur le rôle du CREB dans la médiation des actions d'autres drogues abusives.19
ΔFosB
L'exposition aiguë à pratiquement n'importe quelle drogue d'abus induit tous les facteurs de transcription de la famille Fos dans l'AN et dans plusieurs autres régions du cerveau. Cette induction est rapide mais également très transitoire, les taux de protéine Fos revenant à la normale dans les heures 8 à 12. Parmi ces protéines de la famille Fos, on trouve ΔFosB, un produit tronqué du gène FosB, qui, en raison de sa stabilité inhabituelle, s'accumule progressivement au cours d'une exposition répétée à un médicament et devient la protéine Fos prédominante exprimée dans ces conditions.22,33 De plus, en raison de cette stabilité, les niveaux de ΔFosB persistent pendant des semaines après le retrait du médicament. Une telle induction chronique de ΔFosB a été démontrée pour pratiquement toutes les drogues faisant l'objet d'abus34 et, pour la plupart des médicaments, est sélectif pour les neurones NAc de type Dl.34,35 Il a également été démontré chez les toxicomanes humains.35 Une abondante littérature a démontré qu'une telle induction de ΔFosB chez D1-les neurones de type NAc augmentent la sensibilité d'un animal aux médicaments ainsi qu'aux récompenses naturelles et favorisent l'auto-administration des médicaments, vraisemblablement par le biais d'un processus de renforcement positif (voir les références 34 à 38). Il est intéressant de noter que l’induction de ΔFosB par le médicament dans NAc est plus dramatique chez les adolescents, une période de vulnérabilité accrue à la dépendance.,39 et il a été démontré que son induction par la nicotine médiatise l'amélioration de la récompense de la cocaïne par la nicotine.40
En ce qui concerne CREB, de nombreux gènes cibles de ΔFosB ont été identifiés dans NAc en utilisant des approches de gènes candidats et du génome entier.10,32 Alors que CREB induit la dynorphine, ΔFosB la supprime, ce qui contribue aux effets pro-récompense de ΔFosB.38 CFos est une autre cible de ΔFosB: comme ΔFosB s’accumule en cas d’exposition répétée à un médicament, il réprime le c-Fos et contribue au commutateur moléculaire par lequel ΔFosB est induit sélectivement dans l’état de traitement chronique du médicament..41 De nombreuses autres cibles de ΔFosB ont démontré la capacité de certaines drogues d'abus à induire une plasticité synaptique dans l'ANc et des modifications associées dans l'arborisation dendritique des neurones épineux au moyen d'ACN, comme on le verra plus loin.
Les conséquences fonctionnelles de l'induction du ΔFosB dans d'autres régions du cerveau sont moins bien comprises, bien que son induction dans le cortex orbitofrontal (OFC) ait été étudiée de manière assez détaillée. Ici, ΔFosB intervient dans la tolérance aux effets de perturbation cognitive de la cocaïne au cours d’une exposition chronique, et cette adaptation est associée à une auto-administration accrue de la cocaïne..42,43
Des analyses à l'échelle du génome ont suggéré plusieurs gènes cibles potentiels qui médient ces effets.42 Malgré les propriétés temporelles uniques de ΔFosB et la connaissance qu'il est induit dans les circuits de mémoire traditionnels (par exemple, l'hippocampe), il n'y a pas encore eu d'exploration du rôle de ΔFosB dans la mémoire comportementale, un sujet intéressant pour de futures recherches.
Mécanismes épigénétiques
Au cours des dernières années, les études sur la transcription ont été poussées plus loin que l'épigénétique44 (voir Figure 1), ce qui peut être défini de manière générale comme un changement dans l'expression des gènes qui survient en l'absence d'un changement dans la séquence de l'ADN. Les mécanismes épigénétiques contrôlent l'encapsidation de l'ADN dans un noyau cellulaire via ses interactions avec des histones et de nombreux autres types de protéines nucléaires, qui constituent ensemble la chromatine. L'expression des gènes est contrôlée par l'état de cet emballage via la modification covalente d'histones, d'autres protéines et de l'ADN lui-même. Comme exemples, l’acétylation des histones tend à favoriser l’activation des gènes, la méthylation des histones peut favoriser l’activation ou la répression des gènes en fonction du résidu Lys subissant cette modification, et la méthylation de l’ADN est généralement associée à la répression des gènes, bien que certaines variantes de la méthylation ( par exemple, 5-hydroxyméthylation) peut être associé à l'activation d'un gène.
L'épigénétique est un mécanisme intéressant car, dans d'autres systèmes, comme la biologie du développement et du cancer, certaines modifications épigénétiques peuvent être permanentes. Pour cette raison, L'épigénétique a été étudiée à la fois dans les modèles d'apprentissage et de mémoire (par exemple, références 45-48) ainsi que dans les dépendances;44,49 dans les deux systèmes, des changements profonds ont été rapportés dans l'acétylation et la méthylation d'histones et dans la méthylation de l'ADN. L’histone méthyltransférase, G9a, est impliquée à la fois dans la mémoire et dans la mémoire.50 et la dépendance.51,52 Dans les modèles de dépendance, L'expression G9a est régulée négativement dans la NAc en réponse à un abus de drogues stimulantes ou opiacées et tsa a été montré pour améliorer les effets enrichissants de ces médicaments.51,52 Fait intéressant, la suppression de G9a par la cocaïne est médiée par ΔFosB. G9a catalyse la diméthylation de Lys9 de l'histone H3 (H3K9me2), un médiateur majeur de la répression des gènes. ChIP-chip ou ChIP-seq (immunoprécipitation de la chromatine suivie, respectivement, de puces promotrices ou de séquençage à haut débit) a été utilisé pour obtenir des cartes du génome des gènes de NAc présentant une altération de H3KXNXXXXXUMX après une exposition à un stimulant ou à une opiacée.32,52,53 En chevauchant ces listes de gènes avec des listes de changements d'expression génique à l'échelle du génome et avec des cartes génomiques de nombreuses autres formes de modifications épigénétiques (par exemple, liaison ΔFosB, liaison à CREB, autres modifications d'histones, etc.),32,53 il devrait être possible d'identifier un ensemble de plus en plus complet de gènes régulés par des drogues abusives et de comprendre les mécanismes épigénétiques sous-jacents impliqués.
Une autre forme de régulation épigénétique impliquée dans la mémoire et la dépendance est la génération de microARN. Ces petits ARN non codants se lient à des régions complémentaires d’ARNm et suppriment ainsi leur traduction ou induisent leur dégradation. La suppression d'Argonaut, une protéine cruciale pour le traitement des miARN, modifie les réponses comportementales à la cocaïne, avec des effets distincts observés pour les neurones à épine moyenne de type D1 versus D2.54 De même, il a été démontré que plusieurs miARN spécifiques sont régulés par l'exposition à des médicaments et influencent à leur tour les réponses comportementales aux médicaments (par exemple, les références 55,56). Dans les études futures, il sera intéressant d’identifier les cibles d’ARNm de ces miARN et de décrire leur incidence sur le processus de toxicomanie.
Plasticité synaptique
Les mêmes types généraux de modifications synaptiques au niveau des synapses glutamatergiques, qui ont été impliquées dans l'hippocampe et l'amygdale dans la mémoire comportementale (voir d'autres articles dans ce numéro), se sont également révélés se produire dans les régions de récompense du cerveau dans les modèles de dépendance et jouer un rôle important dans la médiation. le processus de dépendance.57,58 Une telle plasticité synaptique induite par un médicament a été décrite dans plusieurs régions du cerveau. Cependant, nous nous concentrons ici sur l’ANc où la plupart des recherches se sont concentrées à ce jour. (Figure 2).
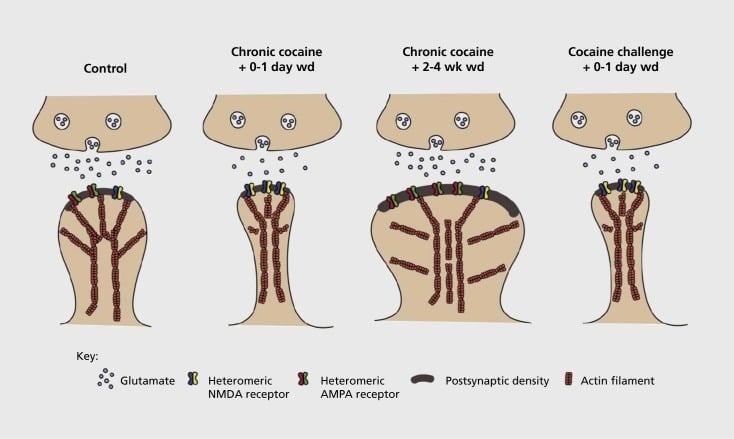
Modèle de plasticité structurale synaptique et structurale liée à la dépendance dans le noyau accumbens (NAc). L'exposition chronique à la cocaïne entraîne une réorganisation temporelle et transitoire des récepteurs de l'acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique (AMPA) et de l'acide N-méthyl-D-aspartique (NMDA) dans le milieu NAc synapses du neurone épineux (MSN), ainsi que des changements structurels dans la tête de la colonne vertébrale des MSN de l’ACN qui sont en corrélation avec des formes distinctes de plasticité synaptique. Par exemple, la cocaïne chronique induit l'expression de surface des récepteurs NMDA, la formation de synapse silencieuse et la dépression à long terme (LTD) à un stade précoce du sevrage. Au cours d'un sevrage plus prolongé (Wd), ces changements synaptiques s'inversent, entraînant une expression accrue des récepteurs AMPA de surface, une consolidation de la synapse en une colonne vertébrale en forme de champignon et une potentialisation à long terme (LTP). Ces effets disparaissent rapidement à la suite d'une exposition à une dose d'attaque de cocaïne conduisant à une restructuration de la colonne vertébrale en fines épines et à une diminution de la force synaptique.
Les expériences initiales ont démontré qu'une exposition répétée à des drogues stimulantes constitue un état de type LTD (dépression à long terme) au niveau des synapses glutamatergiques dans le NAc.59 Cependant, des travaux plus récents ont montré que cette plasticité était fortement dépendante du temps, l’assurance ILT apparaissant peu de temps après la dernière exposition à la cocaïne, évoluant davantage vers un état de type PLT (potentialisation à long terme) après des temps d’abandon plus longs.60,61 Ce travail, qui jusqu’à présent a été réalisé principalement à l’aide de médicaments administrés par des chercheurs - par opposition à des médicaments auto-administrés - a mis en évidence la nécessité d’examens plus systématiques dans des modèles d’auto-administration permettant de suivre les formes de plasticité synaptique observées au niveau des synapses glutamatergiques chez L'ACN sur une période de temps détaillée, de l'acquisition de l'auto-administration à son maintien, en passant par différentes périodes de sevrage et d'extinction et en réponse à des stimuli évoquant une rechute. Les travaux menés à ce jour ont également défini certains des mécanismes moléculaires qui contribuent à cette plasticité synaptique induite par le médicament, notamment le trafic de récepteurs AMPA vers la synapse, peut-être en partie via médiation via CaMKII (Ca2+/ kinase II / calmoduline-dépendante) phosphorylation de certaines sous-unités du récepteur AMPA ainsi que modification de l'expression des sous-unités du récepteur AMPA (par exemple, 60,62-65, Les figures 2 et 3). Un rôle pour CREB et ΔFosB a été impliqué dans ces phénomènes, ainsi que dans les modifications associées de la morphologie des synapses glutamatergiques (voir ci-dessous). Par exemple, GluAl est une cible pour CREB dans NAc, où GluA2 et CaMKII sont tous deux des cibles de ΔFosB, dans cette région du cerveau. .35,36,66,67 À l'avenir, il sera important de lier des adaptations spécifiques à des modifications de la fonction synaptique et des caractéristiques comportementales de la dépendance dépendantes du temps.
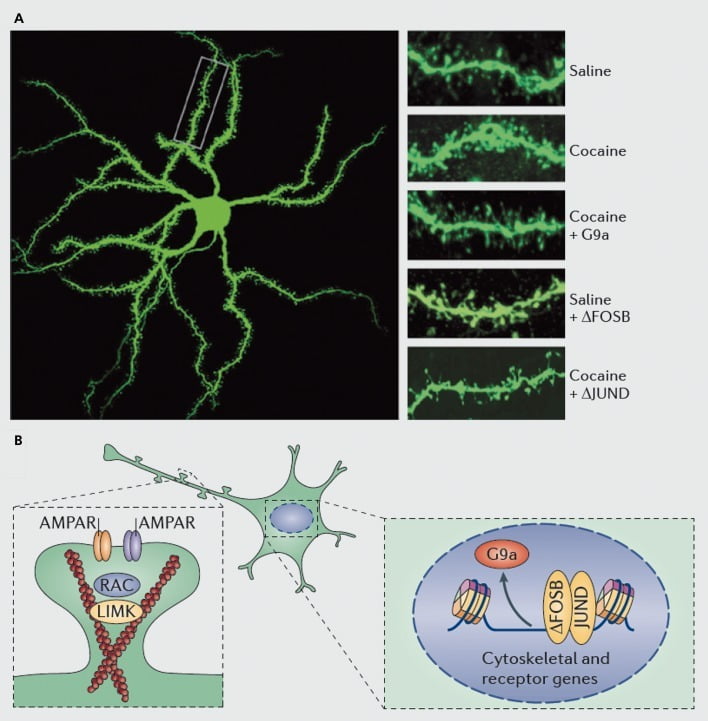
Mécanismes moléculaires sous-jacents à l'induction par la cocaïne d'épines dendritiques sur les neurones épineux moyens du nucleus accumbens (NAc). A) montre des augmentations induites par la cocaïne du nombre d'épines dendritiques qui peuvent être bloquées par la surexpression virale de G9a ou JunD (un antagoniste de la transcription médiée par AP1), ou imitées par la surexpression virale de FosB. B) Il a été démontré que la régulation du trafic des récepteurs AMPA (AMPAR) et du cytosquelette d'actine (à gauche), ainsi que la régulation de la transcription des récepteurs du glutamate et des protéines régulatrices de l'actine (par exemple, par l'intermédiaire de ΔFosB, à droite) jouent des rôles importants dans la régulation par la cocaïne de la densité de la colonne vertébrale dendritique NAc. UMK, domaine LIM kinase; RAC, substrat de la toxine botulique C3 liée à Ras.
De nouveaux outils expérimentaux permettent pour la première fois de définir avec une précision croissante les circuits particuliers qui affichent ces formes de plasticité synaptique et les anomalies comportementales qu’ils véhiculent. Par exemple, tLa coquille et les sous-régions principales de l’ANC présentent des différences de plasticité synaptique induite par le médicament, de même que les neurones épineux moyens de type D1 par rapport à ceux de D2 dans chaque sous-région.60,63,64,67 De même, des expériences optogénétiques ont fourni de nouvelles informations sur la contribution d’une forme particulière de plasticité synaptique (par exemple, l’ALL) au sein de populations spécifiques de synapses glutamatergiques dans l’ANc, par exemple, celles issues du PFC médian par rapport à l’amygdale basolatérale par rapport au subiculum ventral d'hippocampe).68-70 En fin de compte, il sera nécessaire de superposer les adaptations moléculaires induites par les médicaments dans chacun de ces neurones afférents avec des adaptations spécifiques aux synapses qui se produisent dans leurs dendrites post-synaptiques pour compiler une compréhension complète de la façon dont les drogues d'abus modifient les circuits du cerveau pour entraîner des aspects particuliers état dépendant. Cet effort nécessitera une meilleure appréciation de la plasticité induite par les médicaments au niveau des synapses inhibitrices dans ces mêmes régions cérébrales, une zone qui a reçu très peu d'attention à ce jour.65
Plasticité de cellules entières
Alors que la majorité des recherches impliquant des modifications neurophysiologiques des neurones dans les phénomènes d'abus de drogues, comme dans les phénomènes d'apprentissage et de mémoire, s'est concentrée sur la plasticité synaptique, il apparaît de plus en plus l'importance de la plasticité de cellules entières. Plasticité de cellules entières, également appelée plasticité homéostatique,71 implique des changements dans l'excitabilité intrinsèque d'une cellule nerveuse entière d'une manière qui n'est pas spécifique à la synapse. Étant donné que certaines caractéristiques de la toxicomanie impliquent une sensibilité accrue ou réduite à une drogue, il est logique qu'une excitabilité électrique accrue ou réduite de certaines cellules nerveuses contribue à ces adaptations comportementales..5
La L’exemple le mieux établi de plasticité de cellules entières à l’abus de drogues est la capacité des opiacés chroniques à augmenter l’excitabilité intrinsèque des neurones noradrénergiques du locus coeruleus (LC).72 Cette excitabilité accrue est médiée via le CREB et son induction de certaines isoformes de l'adénylyl cyclase, qui entraînent une augmentation du déclenchement des neurones LC, peut-être par l'induction de canaux Na +.72-75 Cette hyperexcitabilité des neurones LC représente un mécanisme classique de tolérance et de dépendance et entraîne certains des signes et symptômes du sevrage aux opiacés. Il est intéressant de noter que CREB gère une forme similaire de plasticité de cellules entières dans les neurones épineux moyens de NAc, qui sont également rendus hyperexcitables par une exposition chronique à des drogues faisant l'objet d'abus via CREB.76 Il sera donc essentiel, lors de futures investigations, de comprendre comment la plasticité synaptique des synapses glutamatergiques à médiation par CREB sur les neurones épineux de type NAc65,66 résume avec l'hyperexcitabilité intrinsèque à médiation CREB de ces neurones76 contrôler les caractéristiques comportementales de la dépendance.
L'hyperexcitabilité des neurones VTA dopamine qui survient après une exposition chronique à des médicaments opiacés abusifs est un autre exemple de plasticité de cellules entières dans les modèles de toxicomanie.etFigure 4).77,78 Cette adaptation, qui a été liée aux changements morphologiques de ces cellules nerveuses (voir section suivante), n’est pas médiée par le CREB, mais obtenue via la régulation des cascades de signalisation neurotrophique, comme décrit ci-dessous.

Modèle de travail des adaptations chroniques induites par la morphine dans les neurones dopaminergiques de la région du tegmental ventral (VTA). La morphine chronique diminue la taille du soma de la VTA dopamine (DA) tout en augmentant l'excitabilité neuronale, tandis que la transmission de la dopamine au noyau accumbens est diminuée. L’effet net de la morphine est une voie de récompense moins sensible, c’est-à-dire une tolérance à la récompense. La régulation négative de la signalisation IRS2-AKT dans la VTA atténue les effets de la morphine chronique sur la taille du soma et l'excitabilité électrique; l'effet sur l'excitabilité est médié par la diminution des courants d'acide γ-aminobutyrique (GABA) A et la suppression de l'expression du canal K '. La régulation négative de l'activité de mTORC2 dans la VTA induite par la morphine est cruciale pour ces adaptations morphologiques et physiologiques induites par la morphine, ainsi que pour la tolérance aux récompenses. Contrairement à mT0RC2, la morphine chronique augmente l'activité de mTORCI, qui n'influence pas ces adaptations induites par la morphine. BDNF, facteur neurotrophique dérivé du cerveau; IRS, substance réceptrice d'insuline; mTORC, complexe mTOR; AKT, protéine kinase B Reproduit à partir de la référence 77
Plasticité morphologique et mécanismes neurotrophiques
Des données de plus en plus nombreuses, issues pour la plupart d’études sur les neurones du cortex cérébral et hippocampique, ont montré que les modifications de la plasticité synaptique sont associées à des modifications morphologiques des synapses. Par exemple, LTD et la génération de synapses silencieuses sont associées à la formation d'épines dendritiques minces ou trapues, tandis que la LTP est associée à des épines plus grandes, en forme de champignon.79,80 Il est donc intéressant que le domaine de la toxicomanie se soit concentré sur les changements induits par la drogue dans les épines dendritiques pendant plus de 15 ans. Exposition chronique à l'abus de drogues stimulantes augmente la densité de la colonne vertébrale dendritique des neurones à épine moyenne de l'ANc, une modification qui prédomine pour les neurones de type Dl.67,81,82 L'induction d'épines a été associée pour la plupart à des réactions comportementales sensibilisées à ces drogues, bien que certaines preuves soient en contradiction avec ce point de vue.
Comme pour les études sur la plasticité synaptique, toutefois, il reste encore beaucoup à faire pour définir de manière systémique les modifications des épines dendritiques qui se produisent au cours de la procédure d’auto-administration, de sevrage et de rechute du médicament. Sdes études à ce jour, impliquant un médicament auto-administré par l'investigateur, suggèrent des modifications très différentes de la colonne vertébrale se produisant à différents moments du retrait et dans la coquille de NAc par rapport aux sous-régions principales.83-86 Il sera également important de définir les mécanismes moléculaires précis par lesquels la cocaïne ou un autre stimulant produit ces effets dépendant du temps et spécifiques au type cellulaire. Il a été démontré que ΔFosB était à la fois nécessaire et suffisant pour l’induction d’épines immatures sur les neurones NAc de type Dl.35,51,67 Une telle régulation se produit de concert avec la cocaïne et la régulation ΔFosB de plusieurs protéines connues pour contrôler la réorganisation du cytosquelette d'actine. Un exemple parmi d'autres: la régulation transcriptionnelle de plusieurs facteurs d'échange de nucléotide guanine et de protéines activant la GTPase, une petite GTPase, pour Rac1, permettant une diminution transitoire de l'activité en réponse à chaque exposition à la cocaïne et une diminution pulsatile de l'activité de Rac1 de Rac1, pour induire l’induction d’épines immatures.87 Ces effets de Racl sont vraisemblablement dus au contrôle de la cofiline et d’autres protéines régulatrices de l’actine, qui se sont également révélés médiateurs de la régulation par la cocaïne de la croissance de la colonne vertébrale.87,88 Cependant, il est important de souligner qu'il ne s'agit que d'une voie impliquée dans la régulation par la cocaïne des épines immatures, car plusieurs autres protéines jouent également un rôle essentiel, notamment CDK5 (kinase-5 dépendant de la cycline), CaMKII, NFkB , MEF2, CREB, G9a et DNMT3 (ADN méthyltransf effacement 3a), pour n'en nommer que quelques-uns.20,21,35,51,67,89,90 Il est intéressant de noter que la régulation de la cocaïne de plusieurs de ces gènes, y compris l’induction de CDK5, CaMKII et NFkB et la répression de G9a, est également médiée par ΔFosB.20,35,51,91
Étonnamment, les abus de drogues opiacées exercent l'effet inverse et réduisent la densité de la colonne vertébrale dendritique des neurones épineux de NAc.81 On en sait peu sur les conséquences comportementales de cette adaptation et sur les mécanismes moléculaires sous-jacents impliqués. Ce phénomène est, cependant, surprenant, étant donné que CREB et ΔFosB sont induits à la fois par des stimulants et des opiacés et sont tous deux impliqués dans l’induction induite par la densité de la colonne vertébrale dendritique de NAc. Cela soulève la question de savoir comment les opiacés suppriment la densité de la colonne vertébrale NAc en dépit de l'induction de ces facteurs.
L’autre forme majeure de plasticité morphologique observée dans les modèles d’abus de drogues est la réduction physique de la taille des cellules des neurones VTA de la dopamine induite par l’administration chronique d’opiacés..77,92,93 Une adaptation similaire se produit en réponse aux cannabinoïdes.94 Ce rétrécissement des neurones VTA dopamine, qui se produit avec l'auto-administration d'opiacés93 et a été documentée chez des toxicomanes à l'héroïne humaine examinés post mortem,77 semble médier la tolérance à la récompense et est associée à une libération réduite de dopamine dans le NAc. Des preuves considérables indiquent maintenant que cette réduction de la taille du soma cellulaire est médiée par la suppression par les opiacés de l'expression du facteur neurotrophique dérivé du cerveau (BDNF) dans ces neurones. Nous avons directement lié le retrait du support du BDNF induit par les opiacés et le rétrécissement des neurones VTA à l'activité réduite des cascades de signalisation du BDNF en aval dans les neurones à dopamine VTA, spécifiquement à l'activité réduite de IRS2 (substrat du récepteur de l'insuline-2), AKT (une sérine-thréonine kinase) et TORC2 (cible de la rapamycine-2, insensible à la rapamycine).77,93 Nous avons également lié cette régulation négative de la signalisation du BDNF directement à l'excitabilité accrue que la morphine induit dans ces neurones, comme indiqué précédemment.77,78 En effet, la diminution de la taille du soma cellulaire et l'augmentation de l'excitabilité sont étroitement liées, l'induction de l'un conduisant à l'autre et inversement. Ce contrôle de l’excitabilité cellulaire implique la suppression de K+ canaux et de GABAA courant dans ces neurones.
Ce rôle du BDNF dans le contrôle des réponses de la morphine au niveau de la VTA contraste avec son implication très différente dans les actions de la cocaïne et d'autres stimulants. Les stimulants induisent la signalisation du BDNF vers le NAc, un effet dû à une synthèse locale accrue du BDNF ainsi qu'à une libération accrue de plusieurs régions afférentes.95 De plus, il a été démontré que la signalisation accrue par le BDNF dans le NAc, mais pas dans le VTA, favorise les effets comportementaux de ces médicaments, y compris leur auto-administration.95,96 La régulation opposée de la signalisation du BDNF dans la voie VTA-NAc par les opiacés par rapport aux stimulants soulève la possibilité que de telles différences interviennent dans la régulation opposée des médicaments des épines dendritiques NAc, une possibilité actuellement à l'étude.
Directions futures
Le récit ci-dessus souligne les énormes progrès réalisés pour comprendre les adaptations moléculaires et cellulaires qui se produisent dans les régions de récompense du cerveau en réponse à une exposition répétée à une drogue, ainsi que pour relier les adaptations individuelles à certaines caractéristiques comportementales des syndromes de dépendance dans des modèles animaux. . Malgré ces avancées, des questions majeures demeurent. La plupart de nos connaissances actuelles se concentrent sur la VTA et la NAc, avec beaucoup moins d'informations disponibles sur d'autres régions clés du cerveau limbique qui sont également cruciales pour la toxicomanie. En outre, toutes les démonstrations expérimentales du rôle causal d'une adaptation molécule-cellulaire dans un comportement lié à la drogue ont manipulé des adaptations individuelles les unes après les autres. Manipuler de nombreuses adaptations à la fois est clairement beaucoup plus difficile, mais il est également essentiel, car nous savons que les drogues produisent un grand nombre de types de changements disparates, même au sein de neurones individuels, qui résument probablement de manière compliquée pour influencer le comportement. Une telle approche de biologie des systèmes sera cruciale pour casser les fondements biologiques de la dépendance. Enfin, les efforts visant à comprendre les mécanismes moléculaires et cellulaires de la mémoire liés à la toxicomanie se trouvent au point où se heurtent maintenant tous les autres efforts visant à comprendre la base biologique de la mémoire comportementale: notre capacité à relier les phénomènes biologiques à la mémoire comportementale complexe reste extrêmement difficile. Surmonter cette fracture constitue peut-être le plus grand défi des neurosciences.
Remerciements
Ce travail a été soutenu par des subventions de l'institut national sur l'abus de drogues.
Abréviations et acronymes sélectionnés
- Nac
- noyau accumbens
- CREB
- protéine de liaison aux éléments de réponse à l'AMPc
- ΔFosB
- un facteur de transcription de la famille Fos
- VTA
- zone tegmentale ventrale
- AMPA
- Acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique
- LTD
- dépression à long terme
- LTP
- protentiation à long terme
- BDNF
- Facteur neurotrophique dérivé du cerveau
- NKkB
- facteur nucléaire kB
Références