COMMENTAIRES: une revue du meilleur chercheur sur l'obésité et la dépendance alimentaire.
Volume 69, Numéro 4, 24 Février, Pages 2011 – 664
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Avis
Paul J. Kenny1, ,
1 Laboratoire de neurosciences comportementales et moléculaires, Département de thérapeutique moléculaire, Institut de recherche Scripps, Jupiter, FL 33458, États-Unis.
________________________________________
La nourriture est consommée afin de maintenir l'équilibre énergétique aux niveaux homéostatiques. De plus, les aliments savoureux sont également consommés pour leurs propriétés hédoniques indépendantes du statut énergétique. Une telle consommation liée aux récompenses peut entraîner un apport calorique supérieur aux besoins et est considérée comme l’un des principaux responsables de la rapide augmentation du taux d’obésité dans les pays développés. Comparé aux mécanismes homéostatiques de l'alimentation, on en sait beaucoup moins sur la manière dont les systèmes hédoniques du cerveau influencent la prise de nourriture. Curieusement, une consommation excessive d’aliments agréables au goût peut déclencher des réactions neuroadaptives dans les circuits de récompense du cerveau similaires à des abus de drogues. En outre, des vulnérabilités génétiques similaires dans les systèmes de récompense du cerveau peuvent augmenter la prédisposition à la toxicomanie et à l'obésité. Nous examinerons ici les avancées récentes dans notre compréhension des circuits cérébraux régulant les aspects hédoniques du comportement alimentaire. De plus, les nouvelles preuves suggérant que l'obésité et la toxicomanie pourraient partager des mécanismes hédoniques communs seront également prises en compte.
________________________________________
Texte principal
"Il n'y a pas d'amour plus sincère que l'amour de la nourriture."
-George Bernard Shaw
Introduction
L'obésité, définie comme un indice de masse corporelle (IMC)> 30, est une condition dans laquelle l'adiposité est anormalement élevée et peut résulter d'une hyperphagie ou d'une diminution du taux métabolique (O'Rahilly, 2009). Une adiposité excessive est un facteur de risque majeur pour les maladies cardiovasculaires, le cancer, le diabète de type 2 et les troubles liés à l'humeur, les personnes obèses souffrant souvent de stigmatisation sociale ([Bean et al., 2008], [Centers for Disease Control and Prevention, 2009] et [Luppino et al., 2010]). Selon le Center for Disease Control (CDC), les dépenses de santé liées à l'obésité aux États-Unis entre 1998 et 2000 s'élevaient à environ 213 milliards de dollars. En outre, 300,000 1999 décès aux États-Unis chaque année peuvent être attribués à des maladies liées au surpoids et à l'obésité (Allison et al., 30), l'obésité étant la deuxième cause de décès évitable derrière le tabagisme. Néanmoins, la prévalence de l'obésité dans les sociétés occidentales continue d'augmenter considérablement, les estimations actuelles suggérant que plus de 2010% des adultes aux États-Unis sont obèses (Flegal et al., XNUMX).
La plupart des conceptualisations de la régulation de l'alimentation suggèrent que deux systèmes parallèles interagissent pour influencer la prise de nourriture ([Hommel et al., 2006], [Lutter et Nestler, 2009] et [Morton et al., 2006]). Le système homéostatique comprend des régulateurs hormonaux des niveaux de faim, de satiété et d'adiposité, tels que la leptine, la ghréline et l'insuline, qui agissent sur les circuits hypothalamique et du tronc cérébral pour stimuler ou inhiber l'alimentation afin de maintenir les niveaux appropriés d'équilibre énergétique. Un dysfonctionnement des composants du système homéostatique, tel qu'une déficience congénitale en leptine, peut entraîner un état de bilan énergétique positif persistant et le développement de l'obésité ([Campfield et autres, 1995], [Halaas et autres, 1995] et [Pelleymounter] et al., 1995]). Les mécanismes par lesquels les régulateurs hormonaux de la faim et de la satiété agissent sur les circuits hypothalamiques et du tronc cérébral pour maintenir l'homéostasie énergétique ont été décrits en détail ailleurs, et les lecteurs intéressés par ce sujet sont invités à se reporter aux nombreuses excellentes critiques sur ce sujet (par exemple, [Abizaid et al., 2006a] et [Gao et Horvath, 2007]).
En plus des systèmes métaboliques, les systèmes de récompense du cerveau jouent également un rôle important dans le comportement alimentaire ([Lutter et Nestler, 2009] et [Saper et al., 2002]). En général, les aliments au goût fade ne sont pas consommés à l'excès, alors que les aliments au goût agréable sont souvent consommés même après que les besoins énergétiques ont été satisfaits. La facilité d'accès à des aliments savoureux et riches en énergie est considérée comme un facteur de risque environnemental majeur pour l'obésité (Volkow et Wise, 2005), et la surconsommation d'aliments au goût agréable est considérée comme un facteur majeur contribuant à la récente flambée de l'obésité ([Finkelstein et al., 2005], [Hill et al., 2003] et [Swinburn et al., 2009]). En effet, obtenir les effets agréables des aliments appétissants est une puissante force de motivation qui, chez certains individus, peut passer outre les signaux homéostatiques ([Shomaker et al., 2010], [Sunday et al., 1983] et [Zheng et al., 2009]) . Lorsqu'ils ont le choix, les rats préfèrent massivement consommer une solution de saccharine sans calorie plutôt que de s'auto-administrer des perfusions intraveineuses de cocaïne (Lenoir et al., 2007). De plus, les rats bien nourris s'exposeront volontairement à un froid extrême (-15 ° C), à des douleurs de chaleur nocives ou à des chocs de pieds aversifs pour obtenir des aliments au goût agréable, tels que le shortcake, le pâté de viande, le beurre d'arachide, le Coca-Cola, les bonbons M&M, le chocolat des chips, ou des gouttes de yogourt, même lorsque des aliments standard moins appétents sont disponibles gratuitement ([Cabanac et Johnson, 1983], [Foo et Mason, 2005] et [Oswald et al., 2010]). Ces résultats mettent en évidence à quel point les macronutriments contenus dans les aliments savoureux peuvent stimuler les systèmes de récompense cérébrale indépendamment de leur valeur calorique ([Wang et al., 2004a] et [Wang et al., 2004b]) et à quel point la motivation à consommer des aliments appétents peut être élevée. même en l'absence de besoins énergétiques homéostatiques. Les drogues abusives telles que la cocaïne ou la nicotine peuvent également induire des niveaux élevés de comportement de consommation même si elles sont dépourvues de valeur calorique ou nutritive. En fait, en raison des nombreuses similitudes entre la suralimentation dans l'obésité et la consommation excessive de drogues dans la toxicomanie (Volkow et Wise, 2005), il a été avancé que l'obésité devrait être considérée comme un trouble cérébral et incluse comme catégorie diagnostique dans la cinquième édition à venir. du Manuel diagnostique et statistique des troubles mentaux (DSM-V) ([Devlin, 2007] et [Volkow et O'Brien, 2007]). Par rapport aux mécanismes homéostatiques du comportement alimentaire, on en sait beaucoup moins sur la manière précise dont les systèmes hédoniques influencent la prise alimentaire. De même, l'influence des altérations intrinsèques ou induites par le régime alimentaire sur la réactivité des systèmes de récompense du cerveau, et comment ces effets contribuent à la suralimentation et à l'obésité, reste incertaine. Résumées ci-dessous sont des données récentes mettant en évidence les progrès dans notre compréhension des mécanismes hédoniques de l'alimentation et des modifications induites par l'alimentation dans l'activité de récompense cérébrale qui peuvent contribuer au développement de l'obésité.
Activation des systèmes de récompense du cerveau en réponse à un aliment palatable: Interactions avec les régulateurs hormonaux du bilan énergétique
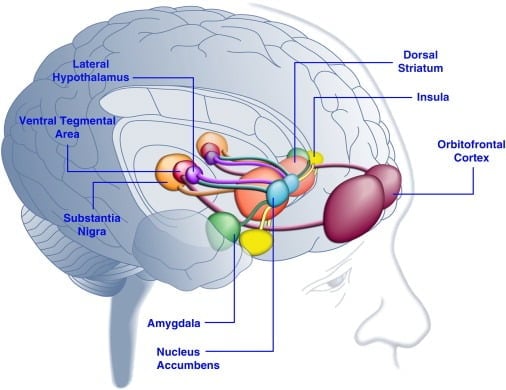
La consommation d'aliments au goût agréable peut améliorer l'humeur chez l'homme ([Dallman et al., 2003] et [Macht et Mueller, 2007]) et favoriser l'établissement d'une préférence pour le lieu de vie conditionné chez les animaux de laboratoire ([Imaizumi et al., 2001] et [ Sclafani et al., 1998]). Ces effets sont probablement liés à la stimulation des systèmes de récompense du cerveau par des aliments au goût agréable (Figure 1). En effet, des études d'imagerie cérébrale chez l'homme ont montré que les aliments et les indices visuels ou olfactifs liés aux aliments peuvent activer les circuits cérébraux corticolimbiques et méso-accumbens impliqués dans la récompense, notamment le cortex orbitofrontal (OFC), l'insula, l'amygdale, l'hypothalamus, le striatum et le mésbrain y compris la région tegmentale ventrale (VTA) et la substance noire (SN) ([Bragulat et al., 2010], [Pelchat et al., 2004], [Schur et al., 2009] et [Simmons et al., 2005] ). Les structures du striatum, de l'insula, du cortex cingulaire antérieur et du cerveau moyen codent la valeur subjective des récompenses quel que soit leur type (nourriture, sexe, récompenses monétaires), ce qui concorde avec le rôle que joue ce réseau neuronal dans la représentation hédonique générale (Sescousse et al. , 2010). En revanche, l'OFC semble jouer un rôle particulièrement important dans les représentations liées à la valeur de certains types de récompenses, notamment les aliments au goût agréable ([Man et al., 2009], [Rolls, 2008] et [Sescousse et al., 2010] ). La faim peut améliorer l'activation palatable induite par les aliments des régions corticolimbiques et du cerveau moyen chez l'homme (LaBar et al., 2001). Par exemple, l'intensité d'activation du striatum ventral, de l'amygdale, de l'insula et de l'OFC en réponse à un aliment savoureux riche en calories était beaucoup plus grande lorsque les sujets humains avaient faim plutôt que d'être bien nourris (Goldstone et al., 2009). Ceci est cohérent avec le fait que les périodes de faim et de régime augmentent les évaluations autodéclarées du «pouvoir» de la nourriture au goût agréable et du besoin impérieux de nourriture «tentante» ([Hofmann et al., 2010] et [Rolls et al., 1983] ). À l'inverse, la suralimentation peut réduire les réponses neuronales à une nourriture au goût agréable, en particulier dans le cortex insulaire et l'hypothalamus (Cornier et al., 2009). Par conséquent, la valeur hédonique des aliments est influencée par l'état métabolique, ce qui suggère que les régulateurs du métabolisme tels que la leptine et la ghréline pourraient influer sur l'activité des systèmes hédoniques du cerveau. Conformément à ce point de vue, les sujets humains traités avec la leptine ou le peptide de facteur postprandial dérivé de l'intestin YY3-36 (PYY) ([Batterham et al., 2007] et [Farooqi et al., 2007]), ou ceux qui ont subi une distension gastrique imitant l'ingestion de repas (Wang et al., 2008), avait une activité réduite dans les régions du cerveau liées aux récompenses. Inversement, les patients humains hyperphagiques présentant un déficit congénital en leptine présentent une activité accrue dans le cortex et le striatum insulaires en réponse à des images d'aliments ([Baicy et al., 2007] et [Farooqi et al., 2007]). Chez ces personnes, la thérapie de remplacement de la leptine a atténué l'activité insulaire et striatale accrue et a diminué le goût de soi pour la nourriture ([Baicy et al., 2007] et [Farooqi et al., 2007]). Le traitement à la leptine bloque également les propriétés valorisantes du saccharose chez les rats soumis à des restrictions alimentaires similaires à celles de l'antagoniste des récepteurs de la dopamine, l'α-flupenthixol (Figlewicz et al., 2001). De plus, les récepteurs de la leptine sont exprimés sur les neurones de la dopamine du cerveau moyen dans les VTA et SN (Figlewicz et al., 2003), ce qui suggère que la leptine pourrait influencer les aspects hédoniques du comportement alimentaire par le biais de la modulation de la transmission de la dopamine mésostriatale. Confirmant cette possibilité, les infusions de leptine dans la VTA ont inhibé l'activité des neurones dopaminergiques et diminué la consommation de nourriture chez le rat (Hommel et coll., 2006; voir aussi Krügel et coll., 2003). Inversement, l'inactivation des récepteurs de la leptine dans la VTA augmentait l'apport alimentaire, augmentait l'activité locomotrice et augmentait la préférence pour une nourriture au goût agréable chez le rat (Hommel et al., 2006). La leptine exerce donc une influence inhibitrice sur la transmission de la dopamine dans les mésoaccumbens, système de neurotransmetteurs fortement impliqué dans la récompense et la motivation mais moins dans l'homéostasie énergétique ([de Araujo et al., 2010] et [Vucetic et Reyes, 2010]). Plus récemment, il a été démontré que la ghréline, une hormone liée à la faim ([Kojima et al., 1999] et [Nakazato et al., 2001]), potentialisait l'activation des systèmes hédoniques du cerveau en réponse à des signaux alimentaires (Malik et al. , 2008). Spécifiquement, la ghréline a amélioré l'activation de l'OFC, de l'amygdale, de l'insula, du striatum, de la VTA et du SN en réponse à des images d'aliments extrêmement appétibles chez des individus obèses (Malik et al., 2008). Chez le rat, la ghréline exerce un effet stimulant sur les systèmes dopaminergiques du cerveau moyen ([Abizaid et al., 2006b], [Jerlhag et al., 2006] et [Jerlhag et al., 2007]) et augmente la valeur de récompense d'un aliment au goût agréable (Perello). et al., 2010).
Figure 1. Zones du cerveau humain activées en réponse à des aliments appétents ou à des signaux associés aux aliments. On pense que le cortex orbitofrontal et l'amygdale codent des informations relatives à la valeur de récompense de la nourriture ([Baxter et Murray, 2002], [Holland et Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] et [Rolls, 2010]). L'insula traite les informations liées au goût des aliments et à leur évaluation hédonique ([Balleine et Dickinson, 2000] et [Small, 2010]). Le noyau accumbens et le striatum dorsal, qui reçoivent un apport dopaminergique de la zone tegmentale ventrale et de la substantia nigra, régulent les propriétés motivationnelles et incitatives des aliments ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi et al., 2007], [Malik et al., 2008] et [Söderpalm et Berridge, 2000]). L'hypothalamus latéral peut réguler des réponses gratifiantes à des aliments savoureux et conduire à des comportements de recherche de nourriture (Kelley et al., 1996). Ces structures cérébrales agissent de manière concertée pour réguler l'apprentissage des propriétés hédoniques des aliments, en déplaçant l'attention et les efforts vers l'obtention de récompenses alimentaires et la régulation de la valeur incitative des stimuli environnementaux qui prédisent la disponibilité des récompenses alimentaires (Dagher, 2009). Par souci de clarté, toutes les interconnexions entre ces structures ne sont pas représentées.
Des régions du cerveau similaires sont activées dans le cerveau du rat par des aliments au goût agréable, de la même manière que celles activées chez l'homme, mesurées par l'expression de gènes précoces immédiats (IEG) tels que c-fos, arc ou zif268. En effet, une nourriture au goût agréable active le striatum dorsal et ventral, l'ATV, l'hypothalamus latéral (LH) et les noyaux centraux et basolatéraux de l'amygdale et les structures corticales liées à la récompense chez le rat ([Angeles-Castellanos et al., 2007], [Park et Carr, 1998] et [Schiltz et al., 2007]). Il est intéressant de noter que l’immunoréactivité de Fos était effectivement diminuée dans l’habénule latérale et médiale chez le rat après la consommation de nourriture au goût agréable (LHb) (Park and Carr, 1998). Chez les primates non humains, la LHb est activée par des stimuli aversifs ou par l’omission des récompenses escomptées et inhibée par la délivrance d’un jus au goût agréable (Matsumoto et Hikosaka, 2007). De plus, l'activité de la LHb inhibe les neurones contenant de la dopamine mésoaccumbens associés à la récompense par une voie indirecte impliquant le noyau tégmental rostromédial (RMTg) (Jhou et al., 2009). L'activité habénulaire est donc inversement liée aux effets hédoniques des aliments, ce qui suggère que le complexe habénulaire pourrait influer sur l'alimentation non homéostatique. En effet, il a récemment été démontré que l'activation de LHb diminuait la consommation de saccharose chez le rat, alors que les lésions de LHb augmentaient le comportement de recherche de saccharose (Friedman et al., 2011). Etant donné que le complexe habénulaire est petit et difficile à identifier et à reproduire fonctionnellement chez l'homme (Salas et al., 2010), cela peut expliquer pourquoi des modifications de l'activité habénulaire n'ont pas été rapportées dans les études d'imagerie humaine en réponse à un aliment appétant.
Circuits cérébraux régulant la consommation hédonique: systèmes de dopamine dans le cerveau moyen
La voie dopaminergique mésoaccumbens est activée chez les humains et les animaux de laboratoire en réponse à des aliments appétitifs ou à des signaux liés aux aliments appétitifs et à la leptine, à la ghréline et à d'autres régulateurs de l'activité d'influence de l'appétit dans ce système. Cela suggère que les systèmes dopaminergiques du mésencéphale jouent un rôle important dans la consommation alimentaire appétente. L'indication la plus claire que la transmission de la dopamine dans le mésencéphale influence la prise alimentaire appétente chez les humains est le fait que les patients atteints de la maladie de Parkinson (MP), dans lesquels il y a dégénérescence des neurones contenant de la dopamine dans le mésencéphale, ont tendance à consommer moins de nourriture que les individus non affectés (Nirenberg et Waters, 2006). De plus, le traitement des patients atteints de MP avec des agonistes des récepteurs de la dopamine peut déclencher une consommation compulsive d'aliments appétissants ([Dagher et Robbins, 2009] et [Nirenberg et Waters, 2006]). En fait, les agonistes des récepteurs de la dopamine peuvent induire une suralimentation hédonique même chez les individus non-PD (Cornelius et al., 2010). Chez les animaux, les solutions de saccharose appétentes stimulent la transmission de la dopamine dans la NAc (Hernandez et Hoebel, 1988), un effet cohérent avec les études d'imagerie cérébrale humaine (Small et al., 2003). En utilisant la voltamétrie cyclique à balayage rapide, il a été montré que les indices prédisant la délivrance d'une récompense de saccharose ou la délivrance inattendue de saccharose évoquaient une transmission de dopamine dans NAc ([Roitman et al., 2004] et [Roitman et al., 2008]). De plus, l'administration inattendue de solutions nocives de quinine a eu l'effet inverse, en diminuant la transmission de la dopamine accombale (Roitman et al., 2008). Enfin, les souris chez lesquelles l'enzyme tyrosine hydroxylase (TH) a été inactivée, entraînant un déficit en dopamine, manifestent toujours une préférence marquée pour les solutions de saccharose (ou saccharine) par rapport à l'eau, mais consomment moins de quantités totales de saccharose que les souris témoins ( Cannon et Palmiter, 2003). Cela suggère que les souris déficientes en dopamine peuvent encore détecter la palatabilité du saccharose et préfèrent ces solutions à l'eau mais ne sont pas en mesure de maintenir la consommation de solutions appétentes. Il a donc été proposé que la transmission de la dopamine par les mésoaccumbens régule les aspects motivationnels du comportement alimentaire qui sont impliqués dans l'approvisionnement alimentaire et que d'autres systèmes de neurotransmetteurs régulent probablement les aspects hédoniques de la consommation alimentaire appétente.
Circuits Cérébraux Qui Réglementent L'alimentation Hédonique: Systèmes Striatohypothalamiques
La perfusion d'agonistes des récepteurs opioïdes μ tels que [D-Ala2-N-Me-Phe4-gly-ol5] -enképhaline (DAMGO) stimule le comportement alimentaire des rats ayant un accès à la nourriture à volonté (alimentation non homéostatique) ( [Peciña et Berridge, 2005] et [Zhang et al., 1998]). Inversement, les antagonistes des récepteurs opioïdes infusés dans l'ANc diminuent la consommation de l'aliment préféré sans affecter la consommation d'alternatives moins agréables au goût (Kelley et al., 1996). Ces données concordent avec l’opinion selon laquelle les systèmes opioïdes striataux régulent les propriétés hédoniques des aliments au goût agréable. La région coquille de la NAc et en particulier les «points chauds» hédoniques de la région rostrodorsale de la coquille médiale ([Peciña et Berridge, 2005] et [Peciña et al., 2006b]) jouent un rôle particulièrement important dans l'alimentation non homéostatique. L'activation des récepteurs μ-opioïdes entraînant l'inhibition de l'activité des neurones épineux moyens dans le NAc, il a été suggéré que la coque du NAc exerce une influence inhibitrice tonique sur la consommation d'aliments au goût agréable (Kelley et al., 2005). En accord avec ce point de vue, stimulation des récepteurs GABAA ou GABAB inhibiteurs ([Basso and Kelley, 1999] et [Stratford et Kelley, 1997]) ou blocage des récepteurs ionotropes du glutamate excitateurs (Maldonado-Irizarry et al., 1995) augmente la consommation alimentaire. De même, une lésion excitotoxique de la coquille NAc augmente également la consommation de nourriture et augmente la sensibilité à la récompense alimentaire ([Johnson et al., 1996] et [Maldonado-Irizarry et Kelley, 1995]). En particulier, ces manipulations déclenchent préférentiellement la consommation d’aliments savoureux à forte densité énergétique ([Basso et Kelley, 1999], [Kelley et al., 2005] et [Zhang et al., 1998]).
Considérant l’influence majeure de la signalisation accumbale sur l’alimentation hédonique, Thompson et Swanson (2010) ont utilisé une procédure de traçage de circuit pour identifier avec précision les réseaux anatomiques précis par le biais desquels le NAc peut influer sur la consommation d’aliments au goût agréable. Dans ces études élégantes, les rats ont reçu deux injections non chevauchantes de traceurs antérogrades / rétrogrades (appelées COIN) dans les sites de la coquille d’acidone qui influent puissamment sur la consommation de nourriture au goût agréable, et des connexions afférentes / efférentes ont été identifiées. Il a été montré que les sites liés à l'alimentation dans le NAc étendaient les projections inhibitrices principalement à la LH antérieure et au pallidum ventral (VP) (Thompson et Swanson, 2010). Contrairement au reste de l’ANc, qui projette de façon dense vers la VTA, les points chauds hédoniques liés à l’alimentation dans le projet de coquille de NAc jusqu’au noyau interfasciculaire (IFN), une structure adjacente à la VTA qui étend les projections dopaminergiques de manière réciproque jusqu’au Coque NAc (Thompson et Swanson, 2010). En outre, les projets de LH antérieurs à la LHb (Thompson et Swanson, 2010) suggèrent une fois encore que le complexe habénulaire pourrait jouer un rôle dans l’hédonisme alimentaire (Friedman et al., 2011).
Les données ci-dessus montrent que la LH reçoit des informations inhibitrices importantes de la part de sites de l'ANc qui exercent une influence inhibitrice des toniques sur la consommation d'aliments au goût agréable. La LH possède également une connectivité fonctionnelle avec d'autres sites cérébraux corticaux et limbiques impliqués dans l'organisation et la direction du comportement visant à obtenir une nourriture au goût agréable (Figure 1), telle que l'OFC, l'insula et l'amygdale. Il est important de noter que l'inactivation de la LH supprime les effets stimulants des manipulations NAc sur la consommation de nourriture ([Maldonado-Irizarry et al., 1995] et [Will et al., 2003]). En outre, l'inactivation de la coque de NAc augmente l'activité de la LH, en particulier les neurones de la LH qui synthétisent l'hypocrétine du neuropeptide (également appelée orexine), mesurée par l'immunoréactivité de Fos ([Baldo et al., 2004] et [Stratford et Kelley, 1999 ]). En effet, la perfusion de l'agoniste des récepteurs opioïdes μ, DAMGO, dans la coquille NAc active les neurones contenant de l'hypocrétine dans l'hypothalamus (Zheng et al., 2007), ainsi que la perturbation de la transmission de l'hypocrétine dans l'ATV, qui annule la prise d'aliments appétissants déclenchés par des infusions intra-NAc DAMGO. (Zheng et al., 2007). Ainsi, les points chauds hédoniques dans la coquille NAc exercent une influence inhibitrice tonique sur les neurones LH, et en particulier les neurones contenant de l'hypocrétine (Louis et al., 2010), limitant ainsi la consommation d'aliments au goût agréable. La perturbation de ce «signal d'arrêt» accumbal, via une signalisation améliorée des récepteurs opioïdes, par exemple, se traduit par une activité accrue de la LH qui entraîne la consommation d'aliments non homéostatiques d'aliments au goût agréable (Figure 2).
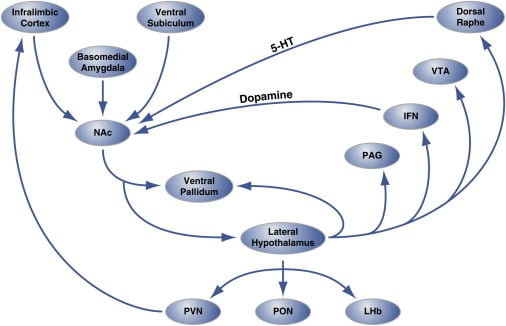
Figure 2. Organisation au niveau du circuit des «points chauds» hédoniques dans la coquille du Nucleus Accumbens qui régule la consommation hédonique
La région de la coquille du noyau accumbens (NAc) reçoit l'innervation des sites cérébraux corticaux et limbiques et se projette vers l'hypothalamus latéral et le pallidum ventral. À son tour, l’hypothalamus latéral s’applique également au pallidum ventral ainsi qu’au noyau PAG, IFN, VTA et au noyau du raphé dorsal. L'IFN et le raphé dorsal prolongent respectivement les projections dopaminergiques et sérotoninergiques jusqu'à l'ANc. L'hypothalamus latéral innerve également les structures thalamiques (PVN et PON) et épithalamiques (LHb). Les projections mineures de l’hypothalamus latéral aux zones septales du cerveau ne sont pas illustrées. 5-HT, sérotonine; IFN, noyau interfasciculaire; LHb, habénule latérale; PON, noyau pré-optique; PVN, noyau paraventriculaire du thalamus; VTA, zone tegmentale ventrale. La figure est adaptée avec l'autorisation de Thompson et Swanson (2010).
Circuits Cérébraux Qui Réglementent L'alimentation Hédonique: Systèmes Striatopallidaux
En plus de la LH, les neurones de shell NAc se projettent également vers le VP (Figure 2). Dans une série d’expériences intéressantes, il a été montré que les projections accumbales de VP et de LH pouvaient réguler des aspects dissociables de la consommation non homéostatique (Smith et Berridge, 2007). Les infusions de DAMGO dans la coquille de NAc ou dans le VP ont augmenté les réactions orofaciales aux solutions de saccharose supposées refléter des réactions de "sympathie" chez le rat (c.-à-d. La réponse au goût) ainsi qu'une augmentation de la consommation de nourriture (Smith and Berridge, 2007). Les infusions de naloxone dans le NAc ou le VP ont diminué les réactions de sympathie faciale au saccharose, ce qui suggère que la transmission synchronisée des opioïdes dans le NAc et le VP est nécessaire pour traiter la sapidité des aliments liée à l'information. Cependant, le naloxone infusé dans le NAc, mais pas le VP, a diminué l'alimentation non homéostatique (Smith et Berridge, 2007), suggérant que l'alimentation non homéostatique se produit indépendamment de la connectivité NAc → VP et repose plutôt sur la voie NAc → LH ([Smith et Berridge, 2007] et [Taha et al., 2009]). Conformément à la notion selon laquelle certains aspects de l'alimentation non homéostatique peuvent être dissociés, des enregistrements unitaires ont montré qu'une population de neurones NAc semble coder de manière sélective des informations relatives aux propriétés de renforcement relatives des aliments (à savoir la palatabilité) (Taha and Fields, 2005) . Chez les mêmes rats, les changements d'activité d'une deuxième population de neurones NAc semblaient coïncider avec l'initiation du comportement alimentaire (Taha et Fields, 2005).
Circuits Cérébraux Qui Réglementent La Alimentation Hédonique: Systèmes Amygdalar
Soutenant en outre la notion selon laquelle certains aspects de l’alimentation non homéostatique sont dissociables, les infusions de naloxone dans la coquille de NAc ou de VP, mais pas dans l’amygdale basolatérale (BLA), ont diminué l’aptitude au goût des solutions de saccharose (Wassum et al., 2009). Cependant, lorsque la naloxone ou CTOP, antagonistes des récepteurs opioïdes μ, ont été perfusées dans la BLA, mais pas dans la coquille NAc ou le VP, il y avait une atténuation marquée de la motivation accrue à répondre aux solutions de saccharose généralement observées dans un état affamé (Wassum et al. ., 2011] et [Wassum et al., 2009]). Ceci suggère que les propriétés incitatives du saccharose sont régulées par les circuits amygdalaires. Dans l’ensemble, les résultats ci-dessus montrent que différents aspects de l’alimentation hédonique, tels que le traitement des informations relatives à l’appétence des aliments, les comportements à l’approche et l’augmentation de la valeur incitative des aliments appétissants chez les animaux affamés, sont régulés de manière différenciée par des microcircuits discrets dans le contexte d’une circuits corticolimbiques-striatopallidaux-hypothalamiques-thalamocorticaux plus importants (Figure 2).
Les adaptations dans les circuits cérébraux hédoniques stimulent-elles la consommation compulsive?
La pertinence fonctionnelle des points chauds hédoniques dans la coquille de NAC et leur influence sur des circuits plus généraux du cerveau liés à l'alimentation ont été examinées par Kelley et al. (2005). Ils émettent l'hypothèse que la voie shell NAc → LH, ainsi que les régions cérébrales régulatrices en amont et en aval (Figure 2), remplissent une fonction «sentinelle» (Kelley et al., 2005). Plus précisément, ils suggèrent que même chez les animaux affamés, lorsque l'envie de manger est forte, la capacité de cesser de se nourrir doit être préservée en cas de menaces de l'environnement (Kelley et al., 2005). En tant que tel, l'activation des neurones coquilles de NAc et l'inhibition concomitante des neurones de la LH peuvent perturber l'alimentation en cours et faciliter la commutation du comportement vers des réponses adaptatives plus appropriées, telles que la congélation ou la fuite (Kelley et al., 2005). Si tel est effectivement le cas, il sera alors important de rechercher si cette voie de contrôle coquille d'ALC → LH est compromise par une surconsommation d'aliments appétibles au goût ou par des facteurs génétiques qui influencent la vulnérabilité à l'obésité. Dans cet esprit, notre laboratoire et d’autres ont récemment signalé que la surconsommation d’aliments savoureux et dense en calories était associée à l’émergence d’un comportement alimentaire compulsif chez le rat ([Johnson et Kenny, 2010], [Latagliata et al., 2010] et [Oswald et al., 2010]). Plus précisément, nous avons constaté que la consommation d'aliments au goût agréable chez les rats obèses était résistante aux perturbations provoquées par un stimulus conditionné aversif qui prédit un résultat négatif (choc électrique au pied) (Johnson et Kenny, 2010). Par conséquent, il sera important de vérifier si les déficits dans la voie de contrôle coquille NAc → LH déclenchés par une suralimentation au moins partiellement contribuent à l'incapacité manifeste des individus en surpoids et obèses à utiliser les informations relatives aux conséquences délétères de leur comportement de consommation pour modérer leur consommation alimentaire. .
Activité altérée de récompense du cerveau dans l'obésité: études d'imagerie du cerveau humain
L'obtention des effets stimulants d'aliments palatables sur les systèmes de récompense cérébrale est considérée comme un facteur de motivation important contribuant à une suralimentation. Ainsi, une question importante est de savoir si des altérations de la fonction de récompense du cerveau peuvent contribuer au développement de l'obésité. Une prédiction intuitive est qu'une réactivité constitutive améliorée des systèmes de récompense cérébrale à une nourriture au goût agréable entraînerait une surconsommation alimentaire et une prise de poids. Conformément à cette hypothèse, les individus présentant des niveaux élevés de sensibilité aux caractéristiques de récompense présentent une activité accrue dans les régions cérébrales impliquées dans la récompense de nourriture, y compris le NAc, l'amygdale, l'OFC et le VP, lors de l'exposition à des aliments savoureux comme le gâteau au chocolat et la pizza (Beaver et al. , 2006). Les individus obèses présentent de même une activation accrue des circuits de récompense cérébrale en réponse à des aliments appétissants ou associés à des aliments par rapport aux témoins maigres ([Gautier et al., 2000], [Karhunen et al., 1997] et [Rothemund et al., 2007 ]). Des niveaux élevés de sensibilité de caractère de récompense étaient également corrélés à une augmentation de poids corporel chez les sujets humains ([Davis et al., 2004] et [Franken et Muris, 2005]). Cependant, il est important de noter que la femme obèse (IMC> 30) avait des niveaux plus élevés d'anhédonie (c'est-à-dire une sensibilité de base réduite à la récompense) que la femme en surpoids (IMC> 25 <30) (Davis et al., 2004). De même, Stice et ses collègues (2008b) ont montré que les adolescentes obèses présentaient une activation accrue de l'insula et d'autres régions du cerveau corticales en réponse à des aliments appétissants ou à des signaux associés aux aliments par rapport aux sujets témoins maigres, mais cette activation de la zone caudée du striatum en réponse à la nourriture au goût agréable était inversement corrélée à l'IMC chez les sujets obèses. De plus, les femmes qui ont pris du poids au cours d'une mois 6 ont enregistré une baisse marquée de l'activité striatale en réponse à un aliment au goût agréable au cours de cette période par rapport aux femmes qui n'ont pas pris de poids (Stice et al., 2010a). En prenant tout cela ensemble, il semble que l'hypersensibilité des circuits de récompense puisse prédisposer un individu à trop manger et à prendre du poids (Stice et al., 2010b). Toutefois, à mesure que la prise de poids augmente, des déficits d'activité de composants spécifiques du système de récompense du cerveau, en particulier du striatum, peuvent commencer à apparaître. Il a été suggéré que l’émergence de cet état de hyposensibilité pourrait perpétuer la surconsommation d’aliments agréables au goût afin de remédier à ces déficits de récompense ([Stice et al., 2008a] et [Wang et al., 2002]). Par conséquent, trop peu ou trop de récompense alimentaire semble augmenter la vulnérabilité à la suralimentation et à l'obésité (Stoeckel, 2010). Un cadre conceptuel attrayant pour concilier ces points de vue apparemment opposés est que les zones corticolimbiques impliquées dans l’organisation du comportement en vue de l’obtention de récompenses alimentaires et la prévision de la récompense alimentaire anticipée peuvent devenir hyperactives chez les individus en surpoids et prédisposés à l’obésité. Inversement, les sites cérébraux striataux qui traitent l'expérience réelle du plaisir de manger hédonique peuvent devenir progressivement moins fonctionnels chez ces mêmes individus. La valeur de motivation relative des aliments au goût agréable devrait donc augmenter pendant le développement de l'obésité en même temps que diminue la valeur hédonique obtenue en consommant des aliments au goût agréable.
Activité de récompense cérébrale altérée dans l'obésité: études sur les rongeurs
Les effets de la consommation d'aliments au goût agréable sur les systèmes de récompense du cerveau ont été directement évalués chez des animaux de laboratoire à l'aide de la procédure de stimulation du cerveau (BSR). Il est bien connu que la stimulation électrique de la LH, qui reçoit une entrée inhibitrice tonique de points chauds hédoniques accumbaux (Figure 2), est très enrichissante et que les rats travailleront dur pour stimuler eux-mêmes cette région du cerveau, par exemple (Markou et Frank, 1987). ). En plus de soutenir le comportement d’autostimulation, la stimulation électrique de la LH peut également induire des épisodes intenses de comportement alimentaire (Margules and Olds, 1962), et il a été suggéré que les propriétés enrichissantes de la stimulation de la LH pourraient être liées au rôle intrinsèque de cette stimulation. site cérébral dans les propriétés d'appétit et d'incitation de la nourriture (Margules et Olds, 1962). Conformément à ce point de vue, la faim et la perte de poids augmentent la sensibilité des rats à l'auto-stimulation de la LH ([Blundell et Herberg, 1968], [Carr et Simon, 1984] et [Margules and Olds, 1962]), un effet qui peut être bloqué par une perfusion intracérébroventriculaire de leptine (Fulton et al., 2000). Inversement, l'auto-stimulation électrique de la LH est inhibée chez les animaux rassasiés (Wilkinson et Peele, 1962). En effet, la suralimentation de rats par sonde d'alimentation intragastrique (Hoebel et Teitelbaum, 1962), une distension gastrique ou une perfusion intraveineuse de glucagon mimant la satiété post-prandiale ([Hoebel, 1969], [Hoebel et Balagura, 1967] et [Mount and Hoebel, 1967] ), tous atténuent la réponse à la stimulation de la LH. En fait, les rats qui avaient précédemment réagi vigoureusement pour récompenser la stimulation de la LH répondraient comme si cette stimulation était aversive après la prise de nourriture ou le développement de l'obésité (Hoebel et Thompson, 1969). Par conséquent, la restriction chronique de l'alimentation et la perte de poids augmentent, alors que la suralimentation diminue, la sensibilité des sites liés à la récompense dans la LH. La sensibilité des neurones LH à récompenser l'auto-stimulation électrique peut donc fournir des informations importantes sur le fonctionnement des circuits cérébraux régulant les réponses hédoniques aux aliments.
Comme la facilité d'accès à des aliments appétissants à forte densité énergétique et la surconsommation qui en résulte sont considérées comme un facteur environnemental contribuant à l'obésité (Volkow and Wise, 2005), notre laboratoire a récemment utilisé la procédure BSR pour évaluer l'activité de récompense du cerveau chez les rats bénéficiant d'un accès étendu à des aliments agréables. . Plus précisément, nous avons enregistré la réponse à la stimulation électrique de la LH chez des rats ayant accès à volonté à des aliments nutritionnels seuls ou combinés à 18 – 23 à un régime quotidien agréable. Ce régime comprenait du gâteau au fromage, du bacon, des saucisses et d’autres mets appétissants (Johnson and Kenny, 2010). Nous avons constaté que les rats ayant un accès prolongé à la nourriture au goût agréable prenaient rapidement des quantités importantes de poids et montraient un déficit de récompense du cerveau qui s'aggravait progressivement (se traduisant par une diminution de la réactivité à la stimulation de la LH) (Johnson et Kenny, 2010; Figure 3). Ceci suggère que le développement de l'obésité d'origine alimentaire est associé à une diminution progressive de la réactivité des sites de récompense dans la LH (Johnson et Kenny, 2010). Des déficits en signalisation de récompense ont également été rapportés chez des rats adultes ayant déjà eu un accès illimité au saccharose ou à des aliments riches en graisses pendant l'adolescence ([Teegarden et al., 2009], [Vendruscolo et al., 2010a] et [Vendruscolo et al., 2010b]). Ces effets chez le rat rappellent la diminution de l'activation striatale en réponse à la récompense alimentaire décrite ci-dessus chez l'homme, à mesure qu'ils prenaient du poids au cours d'une période d'un mois 6 (Stice et al., 2010a; voir la figure 4). De tels déficits de récompense induits par le régime chez les rats en surpoids, et peut-être même chez les humains prenant du poids, traduisent probablement une réponse contre-adaptative dans les circuits de récompense des aliments pour s'opposer à leur surstimulation par des aliments au goût agréable (Johnson et Kenny, 2010). Un aspect important de cette découverte est que des déficits similaires de la fonction de récompense sont également détectés chez des rats qui surconsomment de la cocaïne ou de l'héroïne ([Ahmed et al., 2002], Kenny et al., 2006] et [Markou et Koob, 1991]; Figure 3). En fait, on a émis l’hypothèse que le dysfonctionnement des récompenses induit par la drogue pourrait contribuer à la transition d’une consommation de drogue contrôlée à une consommation non contrôlée en fournissant une nouvelle source de motivation pour consommer le médicament afin d’atténuer l’état persistant de diminution de la récompense ([Ahmed et Koob , 2005] et [Koob et Le Moal, 2008]). Par conséquent, il est possible que des déficits de sensibilité des sites de récompense dans la LH induits par une alimentation excessive augmentent la persistance à long terme de la consommation d'aliments appétibles chez les rats en surpoids en déplaçant les préférences alimentaires vers des aliments ayant un impact hédonique plus élevé, afin d'atténuer l'état persistant de toxicité négative. récompense.
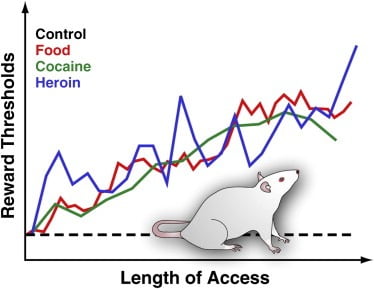
Figure 3. Seuils de récompense chez les rats bénéficiant d'un accès quotidien étendu à des aliments, de la cocaïne ou de l'héroïne agréables au palais
Pour mesurer les seuils de récompense, une électrode de stimulation est implantée chirurgicalement dans l'hypothalamus latéral du rat, une région dans laquelle la stimulation électrique est une méthode extrêmement gratifiante qui peut déclencher des crises d'alimentation intenses. Après la récupération, les animaux sont autorisés à stimuler eux-mêmes cette région en faisant tourner une roue. Une fois que le comportement stable de l’auto-stimulation est établi, l’intensité minimale de la stimulation qui maintient le comportement de l’auto-stimulation est déterminée (c’est-à-dire le seuil de récompense). Ce seuil de récompense fournit une mesure opérationnelle de l'activité du système de récompense. Les seuils de récompense restent stables et inchangés chez les rats témoins ayant accès aux aliments de laboratoire standard et naïfs de traitement. Toutefois, les seuils augmentent progressivement chez les rats bénéficiant d'un accès quotidien prolongé à un régime appétissant à forte densité énergétique composé de produits alimentaires savoureux (par exemple, un gâteau au fromage, du bacon, du chocolat, etc.). De même, les seuils de récompense ont été progressivement élevés chez les rats bénéficiant d'un accès quotidien prolongé aux perfusions intraveineuses de cocaïne ou d'héroïne. Le seuil de récompense élevé est interprété comme reflétant la sensibilité diminuée du système de récompense du cerveau. Ces effets suggèrent que la surconsommation d’aliments agréables au goût et la prise de poids associée peuvent induire des déficits profonds dans la récompense cérébrale similaires à ceux induits par une consommation excessive de drogue entraînant une dépendance.
Figure 4. Plasticité striatale dans l'obésitéLe gain de poids est associé à une diminution de l'activation striatale en réponse à un aliment au goût agréable, mesurée par IRMf, et à des taux inférieurs de disponibilité du récepteur D2 (D2) dopatal de la dopamine (voir le texte pour plus de détails).
Déficit Dopamine D2 Signalisation Déficitaire Dans L'obésité
Plusieurs rapports récents ont révélé des mécanismes potentiels par lesquels des déficits de récompenses pourraient apparaître en réponse à la surconsommation d’aliments agréables au goût pendant le développement de l’obésité. Comme indiqué ci-dessus, les femmes qui ont pris du poids au cours d'une mois 6 ont enregistré une baisse marquée de l'activité striatale en réponse à un aliment au goût agréable au cours de cette période par rapport aux femmes qui n'ont pas pris de poids (Stice et al., 2010a; Figure 4). Les individus à jeun autorisés à manger leur repas préféré jusqu’à satiété présentaient des taux de liaison du raclopride antagoniste du récepteur D2 (D2R) de la dopamine plus faibles dans le striatum (Small et al., 2003), ce qui suggère que le signal de D2R diminue en réponse à une consommation alimentaire acceptable. En effet, la disponibilité en D2R striatale est plus faible chez les individus obèses que chez les témoins maigres ([Barnard et al., 2009], [Stice et al., 2008a] et [Wang et al., 2001]; figure 4), tandis que la perte de poids chez les patients obèses est associée à une densité accrue de D2R striatale (Wang et al., 2008). Considérant que la transmission de la dopamine dans la bande striatale joue un rôle clé dans la régulation de la consommation hédonique, une diminution adaptative de la signalisation D2R pourrait contribuer à réduire la réactivité du striatum à une nourriture agréable au goût chez les personnes obèses. Pour tester cette possibilité, des collaborateurs de petite taille et des collègues ont examiné l'activité dans les circuits de récompense cérébrale en réponse à un milkshake agréable au goût chez des individus témoins et chez ceux portant l'allèle TaqIA A1 (Felsted et al., 2010). Le polymorphisme de longueur du fragment de restriction TaqIA est en aval du gène D2R (Neville et al., 2004), et les individus porteurs de l'allèle A1 du polymorphisme ont entre 30% –40 en moins de D2R striatales par rapport à ceux ne portant pas l'allèle ([Jönsson et al., 1999], [Ritchie et Noble, 2003] et [Stice et al., 2010b]). De plus, les porteurs d'allèles A1 ont également un métabolisme du glucose réduit dans les zones cérébrales striatales et corticales impliquées dans les réponses hédoniques à l'alimentation (Jönsson et al., 1999). Les individus hébergeant l'allèle TaqIA A1 sont surreprésentés parmi les populations obèses ([Barnard et al., 2009], [Stice et al., 2008a] et [Wang et al., 2001]). En outre, l'allèle A1 augmente également la vulnérabilité à l'alcool, aux opioïdes et à la dépendance aux stimulants psychomoteurs ([Lawford et al., 2000], [Noble et al., 1993] et [Noble et al., 2000]). Il a été constaté que des zones du cerveau moyen comprenant probablement la VTA et la SN, qui fournissent un apport dopaminergique au striatum, étaient activées en réponse à un milkshake au goût agréable chez les individus témoins (Felsted et al., 2010). Inversement, l'activité dans ces sites cérébraux était effectivement réduite en réponse à la récompense alimentaire chez les porteurs d'allèles A1 (Felsted et al., 2010). Des réponses inverses similaires dans l'activation cérébrale entre les porteurs alléliques A1 et les non-porteurs ont également été détectées dans les sites cérébraux thalamiques et corticaux (Felsted et al., 2010). Ces données concordent fortement avec le rôle clé que jouent les D2R dans la régulation de la réactivité mésostriatale à des aliments au goût agréable. Stice et ses collègues (2008a) ont trouvé une corrélation inverse entre l'IMC et l'activation du striatum (caudé et putamen) en réponse à un milkshake au chocolat agréable au goût chez des patients humains. De plus, cette relation inverse était plus apparente chez les individus porteurs de l'allèle TaqIA A1 (Stice et al., 2008a). Le gain de poids futur de ces individus, mesuré 1 un an après l’imagerie cérébrale initiale, a montré que l’ampleur de l’activation striatale en réponse à une nourriture au goût agréable était corrélée négativement avec le gain de poids chez les sujets porteurs de l’allèle A1 et positivement corrélée chez les sujets non allèles A1 ( Stice et al., 2008a). Dans une étude de suivi, il a été rapporté que la magnitude de l'activation striatale en réponse à une alimentation imaginaire, par opposition à sa consommation réelle, était inversement corrélée à la prise de poids l'année suivante chez les sujets porteurs de l'allèle A1, mais positivement. corrélés chez des sujets allèles non A1 (Stice et al., 2010b). Ces résultats suggèrent que les D2R régulent la réactivité du striatum à la nourriture au goût agréable et que la diminution de la signalisation D2R induite par la prise de poids ou des facteurs génétiques peut augmenter la vulnérabilité à l'obésité.
La signalisation D2R déficiente contribue à compenser les déficits en obésité
Semblable aux taux de D2R striataux régulés à la baisse chez les sujets humains obèses, les taux de D2R sont également abaissés chez les souris et les rats nourris avec un régime au goût agréable (par exemple, [Colantuoni et al., 2001], [Geiger et al., 2009] et [Johnson et Kenny , 2010]) et chez des rats génétiquement prédisposés à l’obésité (rats Zucker) (Thanos et al., 2008). Notre laboratoire a directement étudié le rôle de la transmission de la dopamine striatale perturbée en général, et de la diminution de la signalisation D2R en particulier, dans les déficits de récompense liés à la dépendance apparaissant chez les rats pendant le développement de l'obésité (voir la figure 5). Plus précisément, nous avons testé les effets de la diminution de l'expression des D2R striataux chez les rats en utilisant une interférence ARN médiée par un virus, puis en évaluant les seuils de BSR lorsque les rats avaient accès à des aliments seuls ou combinés à 18 – 23 h à un accès quotidien à une énergie agréable agréable. régime alimentaire (c.-à-d. régime à la cafétéria) (Johnson et Kenny, 2010). Nous avons constaté que la réponse pour récompenser la stimulation de la LH commençait à diminuer presque immédiatement après exposition au régime de la cafétéria chez les rats D2R (Johnson et Kenny, 2010; Figure 5). La diminution des taux de D2R striataux accélère donc rapidement l’émergence d’une hypofonctionnalité de récompense chez les rats bénéficiant d’un accès prolongé à une nourriture très appétissante, processus qui prend généralement plusieurs semaines à se manifester chez les rats témoins bénéficiant d’un accès prolongé à une alimentation attrayante. Cependant, l'inactivation des D2R striataux chez les rats ayant accès à la nourriture n'a pas altéré la réponse à la stimulation de la stimulation de la LH, suggérant que la diminution de la signalisation D2R striatale interagit avec d'autres réponses adaptatives induites par l'alimentation dans les circuits de récompense du cerveau pour déclencher une hyposensibilité. Outre l'abaissement des taux de D2R, d'autres aspects de la transmission dopaminergique striatale sont également modifiés dans le cerveau des rats obèses. Par exemple, les rats Sprague-Dawley, élevés dans la sélectivité pour prendre rapidement du poids avec un régime alimentaire riche en énergie (rats prédisposés à l'obésité), présentent des niveaux basaux et évoqués de dopamine dans l'ANc plus élevés que les rats résistants à la prise de poids (rats résistant à l'obésité) (Geiger et al., 2008; voir aussi Rada et al., 2010). Les rats prédisposés à l'obésité ont également une diminution des niveaux de biosynthèse de la dopamine et des équipements de stockage, ce qui suggère qu'un échec de la production et de la libération de dopamine contribue à un déficit de la transmission de la dopamine chez les rats obèses (Geiger et al., 2008). Les rats qui développaient l'obésité par la surconsommation d'un régime appétissant de haute énergie avaient également des niveaux basaux et évoqués de dopamine évoqués dans l'ANc par rapport aux rats n'ayant accès qu'au chow standard ([Davis et al., 2008] et [Geiger et al., 1993). 2009]). Il est important de noter qu'un repas de nourriture standard était suffisant pour augmenter les niveaux de dopamine dans la NAc des rats témoins, alors que seuls les produits alimentaires très appétissants étaient suffisants pour déclencher la libération de dopamine accumbal chez les rats obèses qui avaient des antécédents d'accès prolongé à l'alimentation. (Geiger et al., 2009). Ces résultats démontrent que le développement de l'obésité chez le rat est associé à un dysfonctionnement de la transmission dopaminergique mésostriatale, plus particulièrement chez les D2R striataux, et qu'une déficience de signalisation D2R contribue à l'apparition de déficits de récompense lors du développement de l'obésité chez le rat. Ceci est cohérent avec le fait que la régulation négative des D2R striataux est une réponse neuroadaptive notable au gain de poids chez l'homme ([Barnard et al., 2009], [Stice et al., 2008a] et [Wang et al., 2001]). et qu'une signalisation D2R striatale déficiente peut atténuer les réponses striatales à un aliment hédonique chez l'homme, prédisposant ainsi l'individu à une prise de poids future ([Stice et al., 2008a] et [Wang et al., 2001]).
Figure 5. Récepteurs de la dopamine D2, dysfonctionnement de la récompense et compulsivité dans l'obésité - Le renversement des récepteurs de la dopamine D2 (D2R) dans le striatum du rat accélère l'émergence d'un dysfonctionnement de la récompense et de l'alimentation compulsive chez les rats avec un accès prolongé à des aliments savoureux.
Une signalisation D2R déficiente peut déclencher une alimentation compulsive dans l'obésité
L'obésité est caractérisée par une suralimentation persistante malgré le désir exprimé de limiter la consommation et la connaissance des conséquences négatives profondes de la consommation continue sur la santé et la société ([Booth et al., 2008], [Delin et al., 1997] et [Puhl et al., 2008]). Ceci est illustré par le fait que de nombreux patients obèses vont subir une chirurgie potentiellement dangereuse de type bariatrique (pontage gastrique) afin de contrôler leur poids (Yurcisin et al., 2009). Cependant, ils rechutent souvent en une suralimentation même si la chirurgie diminue les évaluations subjectives de la faim et réduit capacité à consommer de grandes quantités de nourriture ([Kalarchian et al., 2002] et [Saunders, 2001]). La toxicomanie est définie de manière similaire comme une perte de contrôle inhibiteur de la consommation de drogue et de la persistance de cette habitude malgré la prise de conscience des conséquences potentiellement dévastatrices sur la santé, la société ou les finances (DSM-IV; Association américaine de psychiatrie, 1994). En tant que tels, l’obésité et la toxicomanie partagent les caractéristiques des troubles compulsifs en ce qu’ils omettent de manière évidente d’utiliser les informations concernant les conséquences néfastes futures d’une consommation modérée et de la persistance de la consommation malgré la disponibilité de comportements alternatifs moins nocifs.
La consommation compulsive de drogues a été définie opérationnellement chez les rongeurs comme une consommation résistante à la répression par punition ou à des stimuli environnementaux prédictifs de la punition ([Pelloux et al., 2007] et [Vanderschuren et Everitt, 2004]). Des périodes d'accès prolongé à la cocaïne et à d'autres drogues d'abus peuvent favoriser l'apparition de comportements de consommation compulsive de drogue chez le rat ([Ahmed et Koob, 1998], [Deroche-Gamonet et autres, 2004] et [Vanderschuren et Everitt, 2004] ). En effet, chez les rats ayant une longue consommation de cocaïne, leur consommation est résistante aux perturbations provoquées par un stimulus conditionnel aversif (CS) prédisant un résultat négatif (c.-à-d. Une lumière d'indication prédictive de l'accouchement d'un pied-de-biche aversif) ([Belin et al., 2008] et [Vanderschuren et Everitt, 2004]). Inversement, le même CS aversif peut considérablement réduire les réponses à la recherche de médicament chez les rats ayant un accès relativement limité au médicament. Compte tenu des similitudes entre la consommation compulsive de drogues dans la toxicomanie et la suralimentation dans l'obésité, nous avons récemment cherché à déterminer si les rats obèses consommeraient des aliments agréables au goût compulsif et si les D2R striataux jouent un rôle dans ce processus (Johnson et Kenny, 2010). Nous avons constaté que des rats obèses ayant des antécédents d'accès prolongé à une nourriture au goût agréable continuaient de manger des aliments au goût agréable, même en présence d'un CS nocif (signal lumineux) prédisant la délivrance d'un choc de pied aversif (Johnson et Kenny, 2010). En revanche, le même CS aversif a perturbé la consommation d'aliments au goût agréable chez des rats maigres exposés très peu à des aliments savoureux et denses en énergie. La consommation d'aliments palatables peut donc devenir compulsive chez les rats obèses de la même manière que la consommation de cocaïne peut devenir compulsive. Conformément à cette interprétation des données, les souris ayant déjà eu accès à un régime appétissant riche en graisses passaient plus de temps dans un environnement aversif (très éclairé) pour obtenir cet aliment au goût agréable que les souris sans expérience préalable du régime (Teegarden et Bale , 2007). En raison de la peur de la prédation, les arènes ouvertes très éclairées sont très réfractaires aux souris (Suarez et Gallup, 1981). Les souris deviennent donc résistantes aux conséquences potentiellement négatives de leur comportement de recherche de nourriture et risquent la prédation pour obtenir une nourriture au goût agréable, même si un aliment moins agréable au goût est disponible à un risque bien moindre.
Curieusement, l'allèle A1 du polymorphisme TaqIA qui entraîne une densité D2R striatale réduite (Noble, 2000) et une activation striatale émoussée en réponse à un aliment agréable au goût (Stice et al., 2008a) est également associé à des déficits dans l'apprentissage pour éviter les actions conséquences négatives (Klein et al., 2007). C’est précisément ce type d’incapacité à utiliser les informations liées aux conséquences négatives futures d’une alimentation excessive qui peut contribuer au développement d’une alimentation compulsive chez les personnes obèses. Nous avons constaté que l'émergence d'une alimentation de type compulsive chez les rats ayant accès à une nourriture au goût agréable était considérablement accélérée après le renversement striatal de D2R (Johnson et Kenny, 2010). En fait, les rats avec D2R knockdown striatal qui ne disposaient auparavant que de quelques jours 14 d'accès étendu à des aliments appétissants à forte densité énergétique affichaient une consommation alimentaire agréable au goût, résistante aux perturbations causées par un CS aversif (Johnson et Kenny, 2010; Figure 5). Toutefois, cette journée d’exposition limitée à l’aliment au goût de 14 ne suffisait pas à induire une alimentation compulsive chez le rat témoin (Johnson et Kenny, 2010). Ces résultats suggèrent qu'une consommation compulsive de nourriture au goût agréable, semblable à une dépendance, peut émerger chez des rats obèses. En outre, une signalisation D2R striatale déficiente, qui accélère l'émergence d'une hyposensibilité de récompense en réponse à une surconsommation d'aliments au goût agréable, accélère également l'émergence d'une alimentation de type compulsif (Figure 5).
Interactions entre les D2R et les régulateurs hormonaux du bilan énergétique dans l'obésité
La leptine exogène administrée dans la VTA inhibe la transmission de la dopamine et le comportement alimentaire des mésoaccumbens ([Hommel et al., 2006] et [Krügel et al., 2003]). En plus de son effet inhibiteur aigu sur les systèmes de dopamine du cerveau moyen, il existe de plus en plus de preuves que la signalisation tonique de la leptine peut également être nécessaire pour maintenir les niveaux appropriés de signalisation de la dopamine mésostriatale. Flier et ses collègues ont constaté que les souris ob / ob présentaient des niveaux plus bas de tyrosine hydroxylase dans les neurones à dopamine du cerveau moyen, une enzyme clé de la biosynthèse de la dopamine (Fulton et al., 2006). De plus, les souris ob / ob avaient réduit la libération évoquée de dopamine dans le NAc (Fulton et al., 2006) et diminué les réserves vésiculaires somatodendritiques de dopamine dans les AVT et les SN (Roseberry et al., 2007). Ces déficiences de la production de dopamine et de la machinerie de transduction du signal chez les souris ob / ob ont été corrigées par traitement à la leptine ([Fulton et al., 2006] et [Pfaffly et al., 2010]). En fait, la leptine infusée uniquement dans la LH était suffisante pour corriger la transmission dysfonctionnelle de la dopamine chez les souris ob / ob (Leinninger et al., 2009), ce qui suggère que les cellules exprimant le récepteur de la leptine dans la LH agissent pour maintenir des niveaux appropriés de signalisation de la dopamine. Outre la diminution de la production et de la libération de dopamine, les souris ob / ob avaient également tendance à avoir des niveaux d'expression de D2R plus faibles dans le striatum (Pfaffly et al., 2010). De plus, le traitement à la leptine exogène dans le cadre d'un régime entraînant le développement d'une insensibilité à la signalisation par la leptine (c.-à-d. La résistance à la leptine) a nettement abaissé les taux de D2R striataux chez des souris de type sauvage (Pfaffly et al., 2010). Les rats obèses développent une résistance à la leptine dans la VTA ([Matheny et al., 2011] et [Scarpace et al., 2010]) et présentent également des taux plus bas de TH dans la VTA, une diminution de la libération de dopamine dans le striatum et une réduction du taux de D2R dans le striatum (Geiger et al., 2008). Pris ensemble, ces données démontrent que la leptine a des actions complexes sur les systèmes de dopamine du cerveau moyen. D'une part, l'activation aiguë des récepteurs de la leptine dans la VTA exerce un effet inhibiteur sur la transmission de la dopamine mésoaccumbens et peut inhiber le comportement alimentaire ([Hommel et al., 2006] et [Krügel et al., 2003]). D'autre part, la signalisation de la leptine dans le cerveau moyen est nécessaire pour maintenir une production de dopamine et une transmission du signal appropriées, et des déficits génétiques en signalisation de la leptine ou le développement d'une résistance à la leptine dans l'obésité perturbe profondément les systèmes dopaminergiques mésoaccumbens. En tant que tel, il est intéressant de noter que le développement de la résistance à la leptine dans les neurones dopaminergiques du cerveau moyen pendant le développement de l'obésité pourrait jouer un rôle central dans la perturbation de la signalisation striatale D2R qui semble entraîner l'émergence d'un dysfonctionnement de type récompense et d'une dépendance excessive (Figure 5) chez des rats obèses.
Outre les effets complexes de la signalisation à la leptine sur la transmission dopaminergique mésostriatale, il existe de plus en plus de preuves que les D2R peuvent à leur tour réguler la signalisation à la leptine. La bromocriptine, agoniste de D2R, réduit les taux circulants de leptine ([Doknic et al., 2002], [Kok et al., 2006] et [Mastronardi et al., 2001]), suggérant que les D2R exercent une influence inhibitrice sur les taux de leptine. De plus, les souris à mutation nulle du gène D2R ont une signalisation accrue de la leptine dans l'hypothalamus et sont plus sensibles aux effets anorexigènes de la leptine (Kim et al., 2010). Il est bien connu que les taux de leptine augmentent pendant le développement de l'obésité (hyperleptinémie), mais qu'il existe une diminution concomitante de la sensibilité à la signalisation de la leptine (c'est-à-dire la résistance à la leptine) (Hamilton et al., 1995). Ainsi, il est intéressant de noter que la diminution de la signalisation striatale D2R pendant le développement de l'obésité peut représenter une réponse compensatoire à la surconsommation d'aliments et au gain de poids qui augmente les niveaux de leptine en circulation et augmente son efficacité de signalisation pour surmonter le développement de la résistance à la leptine. Une telle action peut renforcer les effets inhibiteurs de la leptine sur les systèmes striataux régulant la réactivité à la nourriture au goût agréable ([Farooqi et al., 2007], [Fulton et al., 2006] et [Hommel et al., 2006]), agissant ainsi atténuer les réponses hédoniques à une nourriture savoureuse. En associant ce résultat au rôle de régulation de la leptine sur les D2R décrits ci-dessus, il semble que la leptine et la signalisation D2R puissent être couplées de manière réciproque pour réguler les aspects homéostatique et hédonique du comportement alimentaire.
Systèmes de stress cérébral dérégulés dans l'obésité
La signalisation de la leptine dans le cerveau moyen permet de réguler la transmission de la dopamine dans les mésoaccumbens et la réactivité à la nourriture hédonique. Cependant, les neurones de la VTA qui expriment les récepteurs de la leptine se projettent faiblement sur le NAc et démontrent plutôt des projections plus importantes sur le noyau central de l'amygdale (CeA) (Leshan et al., 2010). Dans le contexte du comportement alimentaire, la CeA est connue pour réguler les effets inhibiteurs des stimuli environnementaux nocifs sur la consommation alimentaire (Petrovich et al., 2009). Plus précisément, les lésions de la CeA, mais non celles de l’amygdale basolatérale, suppriment les effets inhibiteurs d’un stimulus conditionnel couplé à un choc sur l’alimentation, suggérant que la CeA est essentielle pour le contrôle inhibiteur du comportement alimentaire en réponse à des signaux environnementaux prédictifs de résultats négatifs ( Petrovich et al., 2009). Les rats obèses, ou les rats non obèses avec inhibition de D2R striatale et accès à une nourriture au goût agréable, continuent de consommer une nourriture au goût agréable de manière compulsive en présence d'un CS aversif. Ces effets sont étonnamment similaires à la perturbation de la réactivité vis-à-vis d’un CS aversif chez des rats à lésions CeA (Petrovich et al., 2009). Il sera donc important de déterminer si des altérations de l'activité de la CeA, résultant peut-être de la diminution de la régulation striatale de D2R ou du développement d'une résistance à la leptine dans le cerveau moyen, contribuent à l'émergence d'une alimentation compulsive chez le rat obèse.
En plus de réguler les effets des stimuli environnementaux nocifs sur le comportement alimentaire, le CeA peut également jouer un rôle clé dans l'alimentation hédonique liée au stress. Chez l'homme, le stress motive puissamment la sélection et la consommation d'aliments savoureux et denses en énergie indépendamment du besoin calorique ([Gluck et al., 2004], [Kandiah et al., 2006] et [O'Connor et al., 2008]) , et l'obésité est associée à une sécrétion élevée de glucocorticoïdes liée au stress ([Björntorp et Rosmond, 2000] et [la Fleur, 2006]). Les facteurs de stress environnementaux et sociaux induisent également une hyperphagie des aliments appétents et denses en énergie chez les rongeurs et les singes, avec une consommation alimentaire appétente pouvant atténuer les effets néfastes du stress ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et al., 2004] et [Wilson et al., 2008]). De plus, la yohimbine, un médicament qui évoque le stress, peut rétablir chez le rat des réponses de recherche d'aliments savoureux auparavant éteintes (pression sur le levier), un effet atténué par l'antagoniste du récepteur du facteur de libération de la corticotropine 1 (CRF-1) (Ghitza et al., 2006). ). Il est important de souligner que les effets précis du stress sur la consommation alimentaire chez l'homme et les animaux de laboratoire dépendent de la nature et de l'ampleur du facteur de stress, du type de nourriture disponible pour la consommation (appétente ou fade), du poids corporel et du sexe (Dallman , 2010).
Les souris ayant un accès prolongé à un régime riche en matières grasses appétissant avaient une expression réduite de la CRF, une hormone du stress, dans la CeA (Teegarden and Bale, 2007). À l'inverse, les souris en cours de «retrait» de la diète au goût agréable avaient augmenté l'expression du CRF dans la CeA (Teegarden et Bale, 2007). Ce dernier effet est très similaire à l'augmentation de l'expression du CRF dans la CeA détectée chez les rats en cours de sevrage de toutes les principales drogues d'abus (Koob, 2010). Étant donné que l’utilisation ultérieure de drogues peut normaliser cette réponse neurobiologique aversive au sevrage, on a émis l’hypothèse que la transmission hyperactive de la CRF par la CeA et d’autres structures limbiques pourrait faciliter le développement de la consommation compulsive de drogues (Koob et Zorrilla, 2010). Conformément à ce point de vue, les souris qui se retiraient d’un aliment appétissant à forte densité énergétique, dont les taux de CRF étaient élevés dans ceA, passaient beaucoup plus de temps dans un environnement aversif (très éclairé) pour obtenir un aliment au goût agréable que les souris sans expérience préalable de cet aliment, même bien que moins agréable au goût était disponible dans un environnement non aversif (sombre) (Teegarden and Bale, 2007). Les souris deviennent donc résistantes aux conséquences potentiellement négatives de leur comportement de recherche de nourriture et de prédation risquée pour obtenir une nourriture au goût agréable même lorsque la nourriture disponible est à un risque beaucoup plus faible, en partie pour atténuer la transmission de CRF dans la CeA (Teegarden and Bale, 2007). Plusieurs autres éléments de preuve confirment le rôle de la transmission de la CRF dans l'alimentation compulsive. En particulier, une étude récente a évalué les effets de l’antagoniste du récepteur CRF-1, R121919, sur la consommation alimentaire de rats soumis à une variation cyclique de leur régime alimentaire dans laquelle ils avaient accès aux jours de traitement standard 5 par semaine et à un régime alimentaire au sucre agréable au goût 2 jours par semaine. semaine (Cottone et al., 2009). Après des semaines 7 de cette variation cyclique de régime, R121919 a atténué la consommation excessive du régime très agréable au goût et une consommation accrue d’aliments fades (Cottone et al., 2009). De plus, les niveaux d'expression du CRF dans la CeA étaient augmentés chez les rats soumis à un cycle lors du sevrage du régime acceptable au goût mais revenaient aux niveaux de base après une nouvelle exposition au régime acceptable au goût (Cottone et al., 2009). Enfin, la régulation par le CRF de la transmission GABAergique dans la CeA a été améliorée chez les rats cyclés en retrait du régime acceptable au goût par rapport aux rats témoins qui n’avaient auparavant accès qu’à un traitement fade, ce qui se reflète dans le fait que R121919 a perturbé le potentiel inhibiteur post-synaptique de GABAergique chez Tranches de CeA provenant de rats soumis à un cycle à une concentration ne modifiant pas la transmission en tranches provenant de rats témoins (Cottone et al., 2009). Il est intéressant de noter qu'un effet similaire du CRF sur la transmission GABAergique dans CeA a également été observé chez des rats en cours de retrait d'une exposition chronique à l'éthanol (Roberto et al., 2010). Enfin, le CeA, noyau du lit de la stria terminalis (BNST) et la coquille NAc constituent une structure contiguë plus large, appelée «amygdale étendue». L'injection de CRF dans la coquille NAc sur des sites stimulant la consommation hédonique améliore la motivation d'un environnement. signal qui était auparavant associé à la disponibilité d’aliments au goût agréable (Peciña et al., 2006a). Le stress peut donc augmenter la saillance des signaux environnementaux appariés par les aliments en modulant l'activité des neurones en couches de NAc. Pris ensemble, ces résultats suggèrent qu'une consommation excessive d'aliments ou de drogues d'abus appétissants peut induire des réponses neuroadaptives similaires dans les voies de stress extrahypothalamiques dans le cerveau, ce qui peut contribuer à des comportements compulsifs de consommation.
Conclusions
De nombreux progrès ont été réalisés récemment dans l'identification des systèmes cérébraux impliqués dans les effets hédoniques des aliments savoureux et les adaptations qui se produisent dans ces circuits en réponse à la surconsommation d'aliments savoureux et au gain de poids. Il est frappant de constater que des systèmes cérébraux similaires et des réponses adaptatives communes sont déclenchés en réponse à la consommation d'aliments appétissants et de drogues addictives. En particulier, la surconsommation d'aliments appétissants ou de drogues abusives induit des déficits similaires dans la réactivité des systèmes de récompense du cerveau. Les aliments au goût agréable et les drogues addictives induisent des déficits dans la transmission striatale de la dopamine et dans l'expression des D2R striataux. La nourriture appétente et les drogues addictives déclenchent également l'émergence d'un comportement de consommation de type compulsif chez les rongeurs et provoquent des réactions de stress extrahypothalamique. Enfin, les vulnérabilités génétiques courantes dans les systèmes de récompense du cerveau peuvent prédisposer les individus à la suralimentation et à l'obésité, ainsi qu'à la consommation de drogues et à la toxicomanie. En fait, sur la base de ces similitudes et d'autres entre l'obésité et la toxicomanie, il a été avancé que l'obésité devrait être incluse comme catégorie diagnostique dans le prochain DSM-V ([Devlin, 2007] et [Volkow et O'Brien, 2007] ). Dans cet esprit, les domaines critiques pour les recherches futures impliqueront une étude plus approfondie des chevauchements neurobiologiques potentiels entre la suralimentation compulsive et la consommation de drogues. Par exemple, il sera important de tester si l'obésité est liée au développement d'un comportement de consommation de type habitude résultant de la plasticité du striatum dorsal de la même manière que la toxicomanie peut être liée au remodelage striatal et à l'émergence de la recherche de drogues de type habitude. comportements ([Everitt et Robbins, 2005], [Hollander et al., 2010] et [Kasanetz et al., 2010]). De plus, les régions cérébrales corticales impliquées dans le contrôle exécutif et la prise de décision (c'est-à-dire le cortex préfrontal) et dans le traitement intéroceptif (cortex insulaire) ont été fortement impliquées dans la toxicomanie ([Everitt et al., 2008], [Fineberg et al., 2010). ], [Koob et Volkow, 2010] et [Naqvi et Bechara, 2009]), mais on en sait peu sur leur rôle précis dans l'alimentation compulsive et l'obésité, par exemple ([Nair et al., 2011] et [Volkow et al. , 2009]). Prises ensemble, les données examinées ci-dessus soutiennent l'idée que l'obésité et la toxicomanie peuvent résulter de réponses neuroadaptives similaires dans les circuits de récompense du cerveau, et suggèrent que les mécanismes connus de la dépendance peuvent fournir un cadre heuristique pour comprendre l'obésité.
Remerciements
L'auteur bénéficie de subventions de l'Institut national de lutte contre l'abus des drogues (NIDA). L'auteur remercie Paul Johnson et Christie Fowler pour leurs précieuses idées et commentaires sur le manuscrit. Il s’agit du numéro de manuscrit 21042 du Scripps Research Institute.
Bibliographie
1.
o Abizaid et al., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Pensées alimentaires: mécanismes cérébraux et bilan énergétique périphérique
o Neuron, 51 (2006), pp. 691 – 702
o
2.
o Abizaid et al., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp et al.
o La ghréline module l'activité et l'organisation des entrées synaptiques des neurones à dopamine du cerveau moyen tout en favorisant l'appétit
o J. Clin. Invest., 116 (2006), pp. 3229 – 3239
o
3.
o Ahmed et Koob, 1998
o SH Ahmed, GF Koob
o Passage d’un apport modéré à excessif: modification du point de consigne hédonique
o Science, 282 (1998), p. 298 – 300
o
4.
o Ahmed et Koob, 2005
o SH Ahmed, GF Koob
o Transition vers la toxicomanie: un modèle de renforcement négatif basé sur une diminution allostatique de la fonction de récompense
o Psychopharmacologie (Berl.), 180 (2005), pp. 473 – 490
o
5.
o Ahmed et al., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o preuves neurobiologiques d'allostase hédonique associées à une augmentation de la consommation de cocaïne
o Nat. Neurosci., 5 (2002), pp. 625 – 626
o
6.
o Allison et al., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens et TB VanItallie
o Décès annuels imputables à l'obésité aux États-Unis
JAMA, 282 (1999), pp. 1530 – 1538
o
7.
o American Psychiatric Association, 1994
o Association américaine de psychiatrie
o Manuel diagnostique et statistique des troubles mentaux
o (quatrième édition) American Psychiatric Association, Washington, DC (1994)
o
8.
o Angeles-Castellanos et al., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Programmes d'alimentation restreints rythmes journaliers de phase-décalage de l'immunoréactivité de c-Fos et de la protéine Per1 dans les régions corticolimbiques chez le rat
o Neuroscience, 144 (2007), pp. 344 – 355
o
9.
o Baicy et al., 2007
K. Baicy, ED, Londres, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio.
o Le remplacement de la leptine modifie la réponse du cerveau aux signaux alimentaires chez les adultes génétiquement déficients en leptine
o Proc. Natl. Acad. Sci. États-Unis, 104 (2007), p. 18276 – 18279
o
10.
o Baldo et al., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Activation d'une sous-population de neurones hypothalamiques contenant de l'orexine / hypocrétine par l'inhibition de la coque du noyau accumbens à médiation par le récepteur GABAA, mais non par exposition à un nouvel environnement.
o Eur. J. Neurosci., 19 (2004), pp. 376 – 386
o
11.
o Balleine et Dickinson, 2000
o BW Balleine, A. Dickinson
o L'effet des lésions du cortex insulaire sur le conditionnement instrumental: mise en évidence d'un rôle dans la mémoire de motivation
o J. Neurosci., 20 (2000), p. 8954 – 8964
o
12.
o Barnard et al., 2009
ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o Polymorphisme, poids corporel, et apport alimentaire dans le diabète de type 2 des récepteurs de la dopamine D1 Taq2A
o Nutrition, 25 (2009), pp. 58 – 65
o
13.
o Basso et Kelley, 1999
o AM Basso, AE Kelley
o Alimentation induite par la stimulation des récepteurs GABA (A) dans la coque du noyau accumbens: cartographie régionale et caractérisation du macronutriment et préférences gustatives
o Comportement. Neurosci., 113 (1999), pp. 324 – 336
o
14.
o Batterham et al., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o La modulation PYY des zones cérébrales corticales et hypothalamiques prédit le comportement alimentaire chez l'homme
o Nature, 450 (2007), p. 106 – 109
o
15.
o Baxter et Murray, 2002
o MG Baxter, EA Murray
o l'amygdale et la récompense
o Nat. Rev. Neurosci., 3 (2002), p. 563 – 573
o
16.
o Bean et al., 2008
MK Bean, K. Stewart, ME Olbrisch
L'obésité en Amérique: conséquences pour les psychologues cliniciens et de la santé
o J. Clin. Psychol. Med. Paramètres, 15 (2008), p. 214 – 224
o
17.
o Beaver et al., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Les différences individuelles dans le lecteur de récompense prédisent les réponses neuronales aux images de nourriture
o J. Neurosci., 26 (2006), p. 5160 – 5166
o
18.
o Belin et al., 2008
D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Une impulsivité élevée prédit le passage à la prise compulsive de cocaïne
o Science, 320 (2008), p. 1352 – 1355
o
19.
o Berridge, 1996
o KC Berridge
o Récompense alimentaire: substrats cérébraux du désir
o Neurosci. Biobehav. Rev., 20 (1996), p. 1 – 25
o
20.
o Berridge, 2009
o KC Berridge
o Récompenses alimentaires 'Aimant' et 'voulant': Substrats du cerveau et rôles dans les troubles de l'alimentation
o Physiol. Comportement, 97 (2009), pp. 537 – 550
o
21.
o Björntorp et Rosmond, 2000
o P. Björntorp, R. Rosmond
o obésité et cortisol
o Nutrition, 16 (2000), pp. 924 – 936
o
22.
o Blundell et Herberg, 1968
JE Blundell, LJ Herberg
o Effets relatifs du déficit nutritionnel et de la période de privation sur le taux d'autostimulation électrique de l'hypothalamus latéral
o Nature, 219 (1968), p. 627 – 628
o
23.
o Booth et al., 2008
o Booth ML, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Perceptions des adolescents sur le surpoids et l'obésité: étude du poids de l'opinion
o J. Pediatr. Santé de l'enfant, 44 (2008), pp. 248 – 252
o
24.
o Bragulat et al., 2010
o V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Sondes d’odeur alimentaires liées à des circuits de récompense du cerveau pendant la faim: étude pilote par IRMf
o obésité, Silver Spring, MD (2010)
o
25.
o Cabanac et Johnson, 1983
o M. Cabanac, KG Johnson
o Analyse d'un conflit entre la palatabilité et l'exposition au froid chez le rat
o Physiol. Comportement, 31 (1983), pp. 249 – 253
o
26.
o Campfield et al., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Protéine OB recombinante de souris: mise en évidence d’un signal périphérique liant l’adiposité et les réseaux de neurones centraux
o Science, 269 (1995), p. 546 – 549
o
27.
o Cannon et Palmiter, 2003
o CM Cannon, RD Palmiter
o Récompense sans dopamine
o J. Neurosci., 23 (2003), p. 10827 – 10831
o
28.
o Carr et Simon, 1984
o KD Carr, EJ Simon
o La potentialisation de la récompense par la faim dépend des opioïdes
o Brain Res., 297 (1984), p. 369 – 373
o
29.
o Centres de contrôle et de prévention des maladies, 2009
o Centres de contrôle et de prévention des maladies (2009). US Obesity Trends (Atlanta: Centres de contrôle et de prévention des maladies).
o
30.
o Colantuoni et al., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL cadet, GJ Schwartz, TH Moran et BG Hoebel.
o La consommation excessive de sucre modifie la liaison aux récepteurs dopaminergiques et mu-opioïdes dans le cerveau
o Neuroreport, 12 (2001), p. 3549 – 3552
o
31.
o Cornelius et al., 2010
JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Troubles du contrôle des impulsions lors de l’utilisation d’agents dopaminergiques dans le syndrome des jambes sans repos: étude cas-témoin
o Veille, 33 (2010), pp. 81 – 87
o
32.
o Cornier et al., 2009
o MA Cornier, AK Salzberg, DC Enfin, DH Bessesen, DC Rojas, JR Tregellas
o Les effets de la suralimentation sur la réponse neuronale aux signaux visuels vis-à-vis des aliments chez les individus minces et à obésité réduite
o PLoS ONE, 4 (2009), p. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone et al., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o Le recrutement dans le système CRF atténue le côté sombre de la consommation compulsive
o Proc. Natl. Acad. Sci. États-Unis, 106 (2009), p. 20016 – 20020
o
34.
o Dagher, 2009
o A. Dagher
o La neurobiologie de l'appétit: la faim comme dépendance
o Int. J. Obes. (Lond.), 33 (Suppl. 2) (2009), pp. S30 – S33
o
35.
o Dagher et Robbins, 2009
o A. Dagher, TW Robbins
o Personnalité, dépendance, dopamine: aperçus de la maladie de Parkinson
o Neuron, 61 (2009), pp. 502 – 510
o
36.
o Dallman, 2010
o MF Dallman
o l'obésité induite par le stress et le système nerveux émotionnel
o Tendances Endocrinol. Metab., 21 (2010), pp. 159 – 165
o
37.
o Dallman et al., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Stress chronique et obésité: une nouvelle vision de la «nourriture réconfortante»
o Proc. Natl. Acad. Sci. États-Unis, 100 (2003), p. 11696 – 11701
o
38.
o Dallman et al., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o glucocorticoïdes, stress chronique et obésité
o Prog. Brain Res., 153 (2006), pp. 75 – 105
o
39.
o Davis et al., 2004
o C. Davis, S. Strachan, M. Berkson
o Sensibilité à la récompense: conséquences pour le fait de trop manger et le surpoids
o Appetite, 42 (2004), pp. 131 – 138
o
40.
o Davis et al., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o L'exposition à des niveaux élevés de graisse alimentaire atténue la récompense psychostimulante et le turnover de la dopamine mésolimbique chez le rat
o Comportement. Neurosci., 122 (2008), pp. 1257 – 1263
o
41.
o de Araujo et al., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Détection métabolique dans les systèmes de dopamine du cerveau
o Résultats Probl. Différence de cellules., 52 (2010), pp. 69 – 86
o
42.
o Delin et al., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
Comportement alimentaire et expérience de la faim après un pontage gastrique pour obésité morbide
o obés. Surg., 7 (1997), pp. 405 – 413
o
43.
o Deroche-Gamonet et al., 2004
V. Deroche-Gamonet, D. Belin, PV Piazza
Preuve d'un comportement semblable à la dépendance chez le rat
o Science, 305 (2004), p. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o Le DSM-V a-t-il une place pour l'obésité?
o Int. J. Eat. Disord., 40 (Suppl) (2007), pp. S83 – S88
o
45.
o Doknic et al., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
Tonus dopaminergique et obésité: un aperçu des prolactinomes traités à la bromocriptine
o Eur. J. Endocrinol., 147 (2002), p. 77 – 84
o
46.
o Everitt et Robbins, 2005
o BJ Everitt, TW Robbins
o Systèmes neuronaux de renforcement pour la toxicomanie: des actions aux habitudes en passant par la contrainte
o Nat. Neurosci., 8 (2005), pp. 1481 – 1489
o
47.
o Everitt et al., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Révision. Mécanismes neuronaux sous-jacents à la vulnérabilité à développer des habitudes compulsives de recherche de drogue et de dépendance
o Philos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), pp. 3125 – 3135
o
48.
o Farooqi et al., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o La leptine régule les régions striatales et le comportement alimentaire de l'homme
o Science, 317 (2007), p. 1355
o
49.
o Felsted et al., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o Différences déterminées génétiquement dans la réponse du cerveau à une récompense alimentaire primaire
o J. Neurosci., 30 (2010), p. 2428 – 2432
o
50.
o Figlewicz et al., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans et PJ Havel
o La leptine annule la préférence accordée au lieu conditionné pour le saccharose chez les rats soumis à une restriction alimentaire
o Physiol. Comportement, 73 (2001), pp. 229 – 234
o
51.
o Figlewicz et al., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Expression des récepteurs de l'insuline et de la leptine dans la région tegmentale ventrale / substantia nigra (VTA / SN) du rat
o Brain Res., 964 (2003), p. 107 – 115
o
52.
o Fineberg et al., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, et Bullmore, E. Hollander.
o Analyse des comportements compulsifs et impulsifs, des modèles animaux aux endophénotypes: un récit narratif
o Neuropsychopharmacology, 35 (2010), p. 591 – 604
o
53.
o Finkelstein et al., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o causes et conséquences économiques de l'obésité
o Annu. Rév. Santé publique, 26 (2005), p. 239 – 257
o
54.
o Flegal et al., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Prévalence et tendances de l'obésité chez les adultes américains, 1999-2008
JAMA, 303 (2010), pp. 235 – 241
o
55.
o Foo et Mason, 2005
o H. Foo, P. Mason
o Suppression sensorielle pendant l'alimentation
o Proc. Natl. Acad. Sci. États-Unis, 102 (2005), p. 16865 – 16869
o
56.
o Franken et Muris, 2005
o IH Franken, P. Muris
o Les différences individuelles en matière de sensibilité aux récompenses sont liées au besoin de nourriture et au poids corporel relatif chez les femmes en bonne santé
o Appetite, 45 (2005), pp. 198 – 201
o
57.
o Friedman et al., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o La stimulation électrique de l'habenula latérale produit un effet inhibiteur sur l'auto-administration de saccharose
o Neuropharmacologie, 60 (2011), pp. 381 – 387
o
58.
o Fulton et al., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulation des circuits de récompense du cerveau par la leptine
o Science, 287 (2000), p. 125 – 128
o
59.
o Fulton et al., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Régulation de la leptine de la voie dopaminergique mésoaccumbens
o Neuron, 51 (2006), pp. 811 – 822
o
60.
o Gao et Horvath, 2007
o Q. Gao, TL Horvath
o Neurobiologie de l'alimentation et de la dépense énergétique
o Annu. Rev. Neurosci., 30 (2007), p. 367 – 398
o
61.
o Gautier et al., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Réponses cérébrales différentielles à la satiété chez les hommes obèses et maigres
o Diabète, 49 (2000), pp. 838 – 846
o
62.
o Geiger et al., 2008
BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Preuve d'exocytose mésolimbique dopaminergique défectueuse chez des rats prédisposés à l'obésité
o FASEB J., 22 (2008), p. 2740 – 2746
o
63.
o Geiger et al., 2009
BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Déficits de neurotransmission de la dopamine mésolimbique dans l'obésité alimentaire du rat
o Neuroscience, 159 (2009), pp. 1193 – 1199
o
64.
o Ghitza et al., 2006
o UE Ghitza, SM Gray, DH Epstein, KC Rice, Y. Shaham
o Neuropsychopharmacologie
o Le médicament anxiogène, la yohimbine, rétablit la recherche d'aliments palatiables dans un modèle de rechute du rat: rôle des récepteurs CRF (1), 33 (2006), p. 2188 – 2196
o
65.
o Gluck et al., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortisol, faim et désir de frénésie alimentaire à la suite d'un test de stress dû au froid chez des femmes obèses souffrant de frénésie alimentaire
o psychosome. Med., 66 (2004), pp. 876 – 881
o
66.
o Goldstone et al., 2009
o AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o Le jeûne pousse les systèmes de récompense du cerveau vers des aliments riches en calories
o Eur. J. Neurosci., 30 (2009), pp. 1625 – 1635
o
67.
o Halaas et al., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Effets de réduction de poids de la protéine plasmatique codée par le gène obèse
o Science, 269 (1995), p. 543 – 546
o
68.
o Hamilton et al., 1995
BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Augmentation de l'expression de l'ARNm obèse dans les cellules adipeuses de l'homme obèse de manière massive
o Nat. Med., 1 (1995), pp. 953 – 956
o
69.
o Hernandez et Hoebel, 1988
o L. Hernandez, BG Hoebel
o La récompense alimentaire et la cocaïne augmentent la dopamine extracellulaire dans le noyau accumbens, mesurée par microdialyse.
o Life Sci., 42 (1988), p. 1705 – 1712
o
70.
o Hill et al., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o L'obésité et l'environnement: où allons-nous?
o Science, 299 (2003), p. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o alimentation et auto-stimulation
o Ann. NY Acad. Sci., 157 (1969), pp. 758 – 778
o
72.
o Hoebel et Balagura, 1967
o BG Hoebel, S. Balagura
o Auto-stimulation de l'hypothalamus latéral modifié par l'insuline et le glucagon
o Physiol. Comportement, 2 (1967), pp. 337 – 340
o
73.
o Hoebel et Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Contrôle hypothalamique de l'alimentation et de l'autostimulation
o Science, 135 (1962), p. 375 – 377
o
74.
o Hoebel et Thompson, 1969
o BG Hoebel, RD Thompson
o Aversion pour la stimulation hypothalamique latérale provoquée par une alimentation intragastrique ou par l'obésité
o J. Comp. Physiol. Psychol., 68 (1969), pp. 536 – 543
o
75.
o Hofmann et al., 2010
o W. Hofmann, Directeur général van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o Au fur et à mesure que le plaisir se dévoile: réponses hédoniques à des mets tentants
o Psychol. Sci., 21 (2010), pp. 1863 – 1870
o
76.
o Holland et Gallagher, 2004
o PC Holland, M. Gallagher
o Interactions amygdale-frontales et espérance de récompense
o Curr. Opin. Neurobiol., 14 (2004), pp. 148 – 155
o
77.
o Hollander et al., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o Les microARN striataux contrôlent la consommation de cocaïne via la signalisation CREB
o Nature, 466 (2010), p. 197 – 202
o
78.
o Hommel et al., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o La signalisation des récepteurs de leptine dans les neurones à dopamine du cerveau moyen régule l’alimentation
o Neuron, 51 (2006), pp. 801 – 810
o
79.
o Imaizumi et al., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Préférence pour les aliments riches en gras chez les souris: pommes de terre frites par rapport aux pommes de terre bouillies
o Appetite, 36 (2001), pp. 237 – 238
o
80.
o Jerlhag et al., 2006
E. E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o La ghréline stimule l'activité locomotrice et le débordement de dopamine accumbal via les systèmes cholinergiques centraux chez la souris: implications pour son implication dans la récompense du cerveau
o toxicomane. Biol., 11 (2006), pp. 45 – 54
o
81.
o Jerlhag et al., 2007
E. E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o L’administration de ghréline dans les régions tegmentales stimule l’activité locomotrice et augmente la concentration extracellulaire de dopamine dans le noyau accumbens
o toxicomane. Biol., 12 (2007), pp. 6 – 16
o
82.
o Jhou et al., 2009
o TC Jhou, champs HL, MG Baxter, CB Saper, PC Hollande
o Le noyau tegmental rostromedial (RMTg), un neurone de la dopamine GABAergique au cerveau moyen, code pour les stimuli aversifs et inhibe les réponses motrices.
o Neuron, 61 (2009), pp. 786 – 800
o
83.
o Johnson et Kenny, 2010
PM Johnson, PJ Kenny
o Les récepteurs de la dopamine D2 dans le dysfonctionnement de récompense semblable à une dépendance et dans la consommation compulsive de rats obèses
o Nat. Neurosci., 13 (2010), pp. 635 – 641
o
84.
o Johnson et al., 1996
o PI Johnson, MA Parente, JR Stellar
o Les lésions induites par NMDA du noyau accumbens ou du pallidum ventral augmentent l'efficacité de l'alimentation des rats démunis
o Brain Res., 722 (1996), p. 109 – 117
o
85.
o Jönsson et al., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Arrondir, GC Sedvall
o Polymorphismes dans le gène du récepteur de la dopamine D2 et leurs relations avec la densité du récepteur de la dopamine striatale chez des volontaires sains
o Mol. Psychiatry, 4 (1999), pp. 290 – 296
o
86.
o Kalarchian et al., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Frénésie alimentaire chez les patients ayant un pontage gastrique lors du suivi à long terme
o obés. Surg., 12 (2002), pp. 270 – 275
o
87.
o Kandiah et al., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o Le stress influence l'appétit et les préférences alimentaires des femmes des collèges
o Nutr. Res., 26 (2006), pp. 118 – 123
o
88.
o Karhunen et al., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Circulation sanguine cérébrale régionale lors de l'exposition aux aliments chez les femmes obèses et de poids normal
o Cerveau, 120 (1997), pp. 1675 – 1684
o
89.
o Kasanetz et al., 2010
o F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o La transition vers la dépendance est associée à une altération persistante de la plasticité synaptique
o Science, 328 (2010), p. 1709 – 1712
o
90.
o Kelley et al., 1996
AE Kelley, EP Bless, CJ Swanson
o Etude des effets d'antagonistes des opiacés infusés dans le noyau accumbens sur l'alimentation et la consommation de saccharose chez le rat.
J. Pharmacol. Exp. Ther., 278 (1996), pp. 1499 – 1507
o
91.
o Kelley et al., 2005
AE Kelley, BA Baldo, WE Pratt, MJ Will
o Circulation corticostriatale-hypothalamique et motivation alimentaire: intégration de l'énergie, de l'action et de la récompense
o Physiol. Comportement, 86 (2005), pp. 773 – 795
o
92.
o Kenny et al., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Le retrait conditionné entraîne la consommation d'héroïne et diminue la sensibilité aux récompenses
o J. Neurosci., 26 (2006), p. 5894 – 5900
o
93.
o Kim et al., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Amélioration de la signalisation de la leptine hypothalamique chez les souris dépourvues de récepteurs D2 de la dopamine
o J. Biol. Chem., 285 (2010), pp. 8905 – 8917
o
94.
o Klein et al., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Différences déterminées génétiquement dans l'apprentissage à partir d'erreurs
o Science, 318 (2007), p. 1642 – 1645
o
95.
o Kojima et al., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o La ghréline est un peptide acylé de l'estomac libérant une hormone de croissance
o Nature, 402 (1999), p. 656 – 660
o
96.
o Kok et al., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o L’activation des récepteurs D2 de la dopamine diminue les concentrations de leptine circadienne chez les femmes obèses
o J. Clin. Endocrinol. Metab., 91 (2006), pp. 3236 – 3240
o
97.
o Koob, 2010
o GF Koob
o Le rôle des peptides CRF et apparentés dans le côté obscur de la dépendance
o Brain Res., 1314 (2010), p. 3 – 14
o
98.
o Koob et Le Moal, 2008
o GF Koob, M. Le Moal
o Addiction et le système anti-cerveau du cerveau
o Annu. Rev. Psychol., 59 (2008), p. 29 – 53
o
99.
o Koob et Volkow, 2010
o GF Koob, ND Volkow
o Neurocircuitry de la dépendance
o Neuropsychopharmacology, 35 (2010), p. 217 – 238
o
100.
o Koob et Zorrilla, 2010
o GF Koob, EP Zorrilla
o Mécanismes neurobiologiques de la dépendance: se concentrer sur le facteur de libération de la corticotropine
o Curr. Opin. Enquête Drogues, 11 (2010), pp. 63 – 71
o
101.
o Kringelbach et al., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o L’activation du cortex orbitofrontal humain en un stimulus alimentaire liquide est corrélée à son agrément subjectif
o Cereb. Cortex, 13 (2003), pp. 1064 – 1071
o
102.
o Krügel et al., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o La leptine inhibe la libération de dopamine à la base et évoquée par l’alimentation dans le noyau du rat accumbens
o Eur. J. Pharmacol., 482 (2003), p. 185 – 187
o
103.
o la Fleur, 2006
o SE la Fleur
o Les effets des glucocorticoïdes sur le comportement alimentaire chez le rat
o Physiol. Comportement, 89 (2006), pp. 110 – 114
o
104.
o LaBar et al., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o La faim module sélectivement l’activation corticolimbique en stimuli alimentaire chez l’homme
o Comportement. Neurosci., 115 (2001), pp. 493 – 500
o
105.
o Latagliata et al., 2010
o CE Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o La recherche de nourriture malgré les conséquences néfastes est sous contrôle noradrénergique cortical préfrontal
o BMC Neurosci., 11 (2010), p. 15
o
106.
o Lawford et al., 2000
o BR Lawford, RM Young, PE Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o Allèle et dépendance aux opioïdes du récepteur A (2) de la dopamine D (1): association à la consommation d'héroïne et réponse au traitement à la méthadone
o Am. J. Med. Genet., 96 (2000), pp. 592 – 598
o
107.
o Leinninger et al., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong et al.
o La leptine agit via les neurones hypothalamiques latéraux exprimant le récepteur de la leptine pour moduler le système dopaminergique mésolimbique et supprimer l'alimentation
o Métab. Cell, 10 (2009), pp. 89 – 98
o
108.
o Lenoir et al., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o La douceur intense surpasse la récompense de la cocaïne
o PLoS ONE, 2 (2007), p. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan et al., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Les neurones récepteurs de la leptine de la région tegmentale ventrale projettent spécifiquement de réguler les neurones de transcription régulés par la cocaïne et l'amphétamine de l'amygdale centrale étendue
o J. Neurosci., 30 (2010), p. 5713 – 5723
o
110.
o Louis et al., 2010
o GW Louis, directeur général, CJ Rhodes, MG Myers Jr.
o Innervation directe et modulation des neurones à orexine par les neurones LepRb hypothalamiques latéraux
o J. Neurosci., 30 (2010), p. 11278 – 11287
o
111.
o Luppino et al., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman.
Surpoids, obésité et dépression: revue systématique et méta-analyse d'études longitudinales
o Arch. Psychiatrie générale, 67 (2010), pp. 220 – 229
o
112.
o Lutter et Nestler, 2009
o M. Lutter, EJ Nestler
o Les signaux homéostatiques et hédoniques interagissent dans la régulation de la prise alimentaire
o J. Nutr., 139 (2009), p. 629 – 632
o
113.
o Macht et Mueller, 2007
o M. Macht, J. Mueller
o Effets immédiats du chocolat sur les états d'humeur induits expérimentalement
o Appetite, 49 (2007), pp. 667 – 674
o
114.
o Maldonado-Irizarry et Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Les lésions excitotoxiques des sous-régions du noyau et de la coquille du noyau accumbens perturbent de manière différentielle la régulation du poids corporel et l'activité motrice chez le rat
o Brain Res. Bull., 38 (1995), p. 551 – 559
o
115.
o Maldonado-Irizarry et al., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Les récepteurs du glutamate dans le noyau accumbens contrôlent le comportement alimentaire via l’hypothalamus latéral
o J. Neurosci., 15 (1995), p. 6779 – 6788
o
116.
o Malik et al., 2008
S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o La ghréline module l'activité cérébrale dans les zones qui contrôlent le comportement d'appétit
o Métab. Cell, 7 (2008), pp. 400 – 409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o Le rôle du cortex orbitofrontal et du striatum médian dans la régulation des réponses prépotentes aux récompenses alimentaires
o Cereb. Cortex, 19 (2009), pp. 899 – 906
o
118.
o Margules et Olds, 1962
o DL Margules, J. Olds
o Systèmes identiques d '«alimentation» et de «récompense» dans l'hypothalamus latéral du rat
o Science, 135 (1962), p. 374 – 375
o
119.
o Markou et Frank, 1987
o A. Markou, RA Frank
o L’effet du positionnement de l’opérateur et des électrodes sur les fonctions de réponse à la durée du train d’auto-stimulation
o Physiol. Comportement, 41 (1987), pp. 303 – 308
o
120.
o Markou et Koob, 1991
o A. Markou, GF Koob
o postcocaine anhédonie. Un modèle animal de sevrage de la cocaïne
o Neuropsychopharmacology, 4 (1991), p. 17 – 26
o
121.
o Mastronardi et al., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o La libération de la leptine induite par le lipopolysaccharide est contrôlée neuriquement
o Proc. Natl. Acad. Sci. États-Unis, 98 (2001), p. 14720 – 14725
o
122.
o Matheny et al., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o La résistance à la leptine cellulaire induite par le régime et par la leptine, spécifique à la région, inclut la zone tégmentale ventrale chez le rat
o Neuropharmacology (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 sous presse. Publié en ligne en novembre 5, 2010
o
123.
o Matsumoto et Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
Habénule latérale comme source de signaux de récompense négatifs dans les neurones dopaminergiques
o Nature, 447 (2007), p. 1111 – 1115
o
124.
o Morton et al., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Contrôle du système nerveux central sur la prise alimentaire et le poids corporel
o Nature, 443 (2006), p. 289 – 295
o
125.
o Mount et Hoebel, 1967
o G. Mount, BG Hoebel
o Auto-stimulation hypothalamique latérale: seuil autodéterminé augmenté par la prise de nourriture
o Psychon. Sci., 9 (1967), pp. 265 – 266
o
126.
o Nair et al., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Rôle des récepteurs de la famille D1 de la dopamine dans le cortex préfrontal médial dorsal lors de la rechute à la recherche d'aliments riches en graisse induite par le médicament anxiogène yohimbine
o Neuropsychopharmacology, 36 (2011), p. 497 – 510
o
127.
o Nakazato et al., 2001
o M. Nakazato, N. Murakami, Y. Date, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Un rôle de la ghréline dans la régulation centrale de l'alimentation
o Nature, 409 (2001), p. 194 – 198
o
128.
o Naqvi et Béchara, 2009
o NH Naqvi, A. Bechara
o L'île cachée de la dépendance: l'insula
o Trends Neurosci., 32 (2009), p. 56 – 67
o
129.
o Neville et al., 2004
o MJ Neville, EC Johnstone, RT Walton
o Identification et caractérisation d'ANKK1: un nouveau gène de kinase étroitement lié à DRD2 sur la bande de chromosome 11q23.1
o Hum. Mutat., 23 (2004), pp. 540 – 545
o
130.
o Nirenberg et les eaux, 2006
o MJ Nirenberg, C. Waters
o Alimentation compulsive et prise de poids liée à l'utilisation d'agonistes de la dopamine
o Mov. Disord., 21 (2006), pp. 524 – 529
o
131.
o Noble, 2000
o EP Noble
o Addiction et son processus de récompense à travers les polymorphismes du gène du récepteur de la dopamine D2: une revue
o Eur. Psychiatry, 15 (2000), pp. 79 – 89
o
132.
o Noble et al., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin et al.
o Association allélique du gène du récepteur de la dopamine D2 à la dépendance à la cocaïne
o Drug Alcohol Depend., 33 (1993), p. 271 – 285
o
133.
o Noble et al., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotypes au locus DRD2 et alcoolisme grave
o Am. J. Med. Genet., 96 (2000), pp. 622 – 631
o
134.
o O'Connor et al., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Effets des problèmes quotidiens et du style de vie sur le comportement alimentaire
o Psychol. santé, 27 (1, Suppl) (2008), pp. S20 – S31
o
135.
o O'Doherty et al., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Réponses neuronales pendant l'anticipation d'une récompense gustative principale
o Neuron, 33 (2002), pp. 815 – 826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o La génétique humaine éclaire les voies de la maladie métabolique
o Nature, 462 (2009), p. 307 – 314
o
137.
o Oswald et al., 2010
o KD Oswald, DL Murdaugh, VL King, MM Boggiano
o Motivation pour une nourriture au goût malgré les conséquences sur un modèle animal de la frénésie alimentaire
o Int. J. Eat. Désordre. (2010) http://dx.doi.org/10.1002/eat.20808 sous presse. Publié en ligne Février 22, 2010
o
138.
o Park and Carr, 1998
o TH Park, KD Carr
o Schémas neuroanatomiques d'immunoréactivité de type fos induite par un repas appétissant et un environnement apparié de repas chez des rats traités au sérum physiologique et à la naltrexone
o Brain Res., 805 (1998), p. 169 – 180
o
139.
o Peciña et Berridge, 2005
o S. Peciña, KC Berridge
o Point chaud hédonique dans la coque du noyau accumbens: où les opioïdes mu augmentent-ils l’impact hédonique de la douceur?
o J. Neurosci., 25 (2005), p. 11777 – 11786
o
140.
o Peciña et al., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Le facteur libérant de la corticotropine dans le noyau accumbens augmente la motivation de la récompense de saccharose à déclencher une réplique: Des effets incitatifs positifs paradoxaux dans le stress?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña et al., 2006b
o S. Peciña, KS Smith, KC Berridge
o points chauds hédoniques dans le cerveau
o Neuroscientifique, 12 (2006), pp. 500 – 511
o
142.
o Pecoraro et al., 2004
o N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
o Le stress chronique favorise une alimentation au goût agréable, ce qui réduit les signes de stress: effets directs et rétroactifs du stress chronique
o Endocrinology, 145 (2004), p. 3754 – 3762
o
143.
o Pelchat et al., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez et JD Ragland
o Images de désir: activation du besoin alimentaire pendant l'IRMf
o Neuroimage, 23 (2004), pp. 1486 – 1493
o
144.
o Pelleymounter et al., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Effets du produit du gène obèse sur la régulation du poids corporel chez les souris ob / ob
o Science, 269 (1995), p. 540 – 543
o
145.
o Pelloux et al., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Recherche compulsive de drogue par les rats sous punition: effets des antécédents de prise de drogue
o Psychopharmacologie (Berl.), 194 (2007), pp. 127 – 137
o
146.
o Perello et al., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman.
o La ghréline augmente la valeur enrichissante d'un régime riche en graisses de manière dépendante de l'orexine
o Biol. Psychiatry, 67 (2010), pp. 880 – 886
o
147.
o Petrovich et al., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holland, M. Gallagher
o L'amygdale centrale, mais pas basolatérale, est essentielle au contrôle de l'alimentation par des signaux aversifs
o J. Neurosci., 29 (2009), p. 15205 – 15212
o
148.
o Pfaffly et al., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o La leptine augmente la liaison au récepteur striatal D2 de la dopamine chez les souris obèses (ob / ob) déficientes en leptine
o Synapse, 64 (2010), pp. 503 – 510
o
149.
o Puhl et al., 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
o Stigmatisation pondérale et réduction des biais: perspectives des adultes en surpoids et obèses
o Santé Educ. Res., 23 (2008), pp. 347 – 358
o
150.
o Rada et al., 2010
P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Réduction de la dopamine accumbens chez les rats Sprague-Dawley enclins à trop manger avec un régime riche en graisse
o Physiol. Comportement, 101 (2010), pp. 394 – 400
o
151.
o Ritchie et Noble, 2003
o T. Ritchie, EP Noble
o Association de sept polymorphismes du gène du récepteur de la dopamine D2 aux caractéristiques de liaison au récepteur du cerveau
o Neurochem. Res., 28 (2003), pp. 73 – 82
o
152.
o Roberto et al., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o La libération d'acide gamma-aminobutyrique induite par le facteur de libération de la corticotropine joue un rôle clé dans la dépendance à l'alcool
o Biol. Psychiatry, 67 (2010), pp. 831 – 839
o
153.
o Roitman et al., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o La dopamine agit comme un modulateur inférieur à la seconde de la recherche d'aliments
o J. Neurosci., 24 (2004), p. 1265 – 1271
o
154.
o Roitman et al., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Les réponses chimiques en temps réel dans le noyau accumbens différencient les stimuli valorisants et aversifs
o Nat. Neurosci., 11 (2008), pp. 1376 – 1377
o
155.
o Rouleaux, 2008
ET Rolls
o Fonctions du cortex cingulaire orbitofrontal et prégénuel dans le goût, l'olfaction, l'appétit et l'émotion
o Acta Physiol. Hung., 95 (2008), pp. 131 – 164
o
156.
o Rouleaux, 2010
ET Rolls
o Le traitement du goût, de la texture olfactive et de la texture des aliments dans le cerveau et l’obésité
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 sous presse. Publié en ligne Août 3, 2010
o
157.
o Rolls et al., 1983
ET Rolls, BJ Rolls, EA Rowe
o Satiété sensorielle et motivationnelle pour la vue et le goût de la nourriture et de l'eau chez l'homme
o Physiol. Comportement, 30 (1983), pp. 185 – 192
o
158.
o Roseberry et al., 2007
o AG Roseberry, T. Painter, PDG Mark, JT Williams
o Diminution des réserves de dopamine somatodendritique vésiculaire chez les souris déficientes en leptine
o J. Neurosci., 27 (2007), p. 7021 – 7027
o
159.
o Rothemund et al., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Activation différentielle du striatum dorsal par des stimuli visuels alimentaires hypercaloriques chez les personnes obèses
o Neuroimage, 37 (2007), pp. 410 – 421
o
160.
o Salas et al., 2010
R. Salas, P. Baldwin, M. de Biasi, PR Montague
o les réponses en gras aux erreurs de prédiction de récompense négative chez habenula humain
o avant. Fredonner. Neurosci., 4 (2010), p. 36
o
161.
o Saper et al., 2002
o CB Saper, TC Chou, JK Elmquist
o La nécessité de se nourrir: contrôle homéostatique et hédonique de l'alimentation
o Neuron, 36 (2002), pp. 199 – 211
o
162.
o Saunders, 2001
o R. Saunders
o Alimentation compulsive et pontage gastrique: qu'est-ce que la faim a à voir avec cela?
o obés. Surg., 11 (2001), pp. 757 – 761
o
163.
o Scarpace et al., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o La roue en cours de course élimine les préférences riches en graisses et améliore la signalisation de la leptine dans la région tegmentale ventrale
o Physiol. Comportement, 100 (2010), pp. 173 – 179
o
164.
o Schiltz et al., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Les signaux liés à l'alimentation modifient la connectivité fonctionnelle du cerveau antérieur, évalués avec l'expression immédiate immédiate du gène et de la proenképhaline
o BMC Biol., 5 (2007), p. 16
o
165.
o Schur et al., 2009
EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o L’activation de la régulation de l’énergie du cerveau et des centres de récompense par les signaux alimentaires varie en fonction du choix du stimulus visuel
o Int. J. Obes. (Lond.), 33 (2009), pp. 653 – 661
o
166.
o Sclafani et al., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Pharmacologie des préférences alimentaires conditionnées
o Appetite, 31 (1998), p. 406
o
167.
o Sescousse et al., 2010
o G. Sescousse, J. Redouté, JC Dreher
o L’architecture du codage par valeur de récompense dans le cortex orbitofrontal humain
o J. Neurosci., 30 (2010), p. 13095 – 13104
o
168.
o Shomaker et al., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali et al.
o Manger en l'absence de faim chez les adolescents: apport après un repas copieux comparé à celui après un repas standardisé
o Am. J. Clin. Nutr., 92 (2010), pp. 697 – 703
o
169.
o Simmons et al., 2005
o WK Simmons, A. Martin, LW Barsalou
o Des images d'aliments appétissants activent les cortex gustatifs pour le goût et la récompense
o Cereb. Cortex, 15 (2005), pp. 1602 – 1608
o
170.
o petit, 2010
o DM Small
o Représentation du goût dans l'insula humaine
o Structure du cerveau. Funct., 214 (2010), pp. 551 – 561
o
171.
o Small et al., 2003
DM Small, M. Jones-Gotman, A. Dagher
o La libération de dopamine induite par l'alimentation dans le striatum dorsal est en corrélation avec le degré de plaisir du repas chez des volontaires humains en bonne santé
o Neuroimage, 19 (2003), pp. 1709 – 1715
o
172.
o Smith et Berridge, 2007
o KS Smith, KC Berridge
o Circuit limbique opioïde contre récompense: interaction entre les points chauds hédoniques du noyau accumbens et du pallidum ventral
o J. Neurosci., 27 (2007), p. 1594 – 1605
o
173.
o Söderpalm et Berridge, 2000
o AH Söderpalm, KC Berridge
o Prise de nourriture après le diazépam, la morphine ou le muscimol: microinjections dans la coquille du noyau d'accumbens
o Pharmacol. Biochem. Comportement, 66 (2000), pp. 429 – 434
o
174.
o Stice et al., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o La relation entre l'obésité et la réponse striatale émoussée à l'alimentation est modérée par l'allèle TaqIA A1
o Science, 322 (2008), p. 449 – 452
o
175.
o Stice et al., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Rapport entre la récompense de la consommation alimentaire et la consommation alimentaire anticipée et l'obésité: une étude d'imagerie par résonance magnétique fonctionnelle
o J. Anormal. Psychol., 117 (2008), pp. 924 – 935
o
176.
o Stice et al., 2010a
E. E. Stice, S. Yokum, K. Blum, C. Bohon
o Le gain de poids est associé à une réponse striatale réduite à une nourriture au goût agréable
o J. Neurosci., 30 (2010), p. 13105 – 13109
o
177.
o Stice et al., 2010b
E. E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o La réactivité des circuits de récompense aux aliments prédit une future augmentation de la masse corporelle: effets modérateurs de DRD2 et DRD4
o Neuroimage, 50 (2010), pp. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Le principe de l'obésité Goldilocks. Scientifique américain. Juin 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford et Kelley, 1997
o TR Stratford, AE Kelley
o Le GABA dans la coque du noyau accumbens participe à la régulation centrale du comportement alimentaire
o J. Neurosci., 17 (1997), p. 4434 – 4440
o
180.
o Stratford et Kelley, 1999
o TR Stratford, AE Kelley
o Preuve d'une relation fonctionnelle entre la coque du noyau accumbens et l'hypothalamus latéral servant au contrôle du comportement alimentaire
o J. Neurosci., 19 (1999), p. 11040 – 11048
o
181.
o Suarez et Gallup, 1981
o SD Suarez, GGJ Gallup
o Une analyse éthologique du comportement en champ ouvert chez le rat et la souris
o apprendre. Motiv., 12 (1981), pp. 342 – 363
o
182.
o Sunday et al., 1983
o SR dimanche, SA Sanders, G. Collier
o Palatabilité et modèles de repas
o Physiol. Comportement, 30 (1983), pp. 915 – 918
o
183.
o Swinburn et al., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o L'augmentation de l'approvisionnement en énergie alimentaire est plus que suffisante pour expliquer l'épidémie d'obésité aux États-Unis
o Am. J. Clin. Nutr., 90 (2009), pp. 1453 – 1456
o
184.
o Taha et les champs, 2005
o SA Taha, champs HL
o Encodage des comportements d'appétence et d'appétence de populations neuronales distinctes dans le noyau accumbens
o J. Neurosci., 25 (2005), p. 1193 – 1202
o
185.
o Taha et al., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o Les circuits convergents, non en série, striataux et pallidaux régulent la prise alimentaire induite par les opioïdes
o Neuroscience, 161 (2009), pp. 718 – 733
o
186.
o Teegarden et Bale, 2007
o SL Teegarden, TL Bale
o La diminution des préférences alimentaires produit une émotion accrue et un risque de rechute alimentaire
o Biol. Psychiatry, 61 (2007), pp. 1021 – 1029
o
187.
o Teegarden et al., 2009
o SL Teegarden, AN Scott, TL Bale
o L'exposition précoce à un régime riche en graisses favorise les changements à long terme des préférences alimentaires et la signalisation de la récompense centrale
o Neuroscience, 162 (2009), pp. 924 – 932
o
188.
o Thanos et al., 2008
PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o La restriction alimentaire augmente considérablement le récepteur D2 de la dopamine (D2R) dans un modèle d'obésité chez le rat, évalué par autoradiographie in-vivo avec muPET ([11C]) et in vitro ([3H] spipérone).
o Synapse, 62 (2008), pp. 50 – 61
o
189.
o Thompson et Swanson, 2010
o RH Thompson, LW Swanson
o L'analyse de la connectivité structurelle basée sur l'hypothèse prend en charge le réseau par rapport au modèle hiérarchique de l'architecture du cerveau
o Proc. Natl. Acad. Sci. États-Unis, 107 (2010), p. 15235 – 15239
o
190.
o Vanderschuren et Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o La recherche de drogue devient compulsive après une auto-administration prolongée de cocaïne
o Science, 305 (2004), p. 1017 – 1019
o
191.
o Vendruscolo et al., 2010a
LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o La surconsommation de sucre à l'adolescence modifie sélectivement la motivation et la fonction de récompense chez le rat adulte
o PLoS ONE, 5 (2010), p. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo et al., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Boire de l'alcool chez les rats adultes exposés au saccharose pendant l'adolescence
o Neuropharmacologie, 59 (2010), pp. 388 – 394
o
193.
o Volkow et O'Brien, 2007
o ND Volkow, CP O'Brien
o Problèmes pour le DSM-V: l'obésité devrait-elle être incluse en tant que trouble du cerveau?
o Am. J. Psychiatry, 164 (2007), p. 708 – 710
o
194.
o Volkow et Wise, 2005
o ND Volkow, RA Sage
o Comment la toxicomanie peut-elle nous aider à comprendre l'obésité?
o Nat. Neurosci., 8 (2005), pp. 555 – 560
o
195.
o Volkow et al., 2009
ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan.
o Association inverse entre l'IMC et l'activité métabolique préfrontale chez des adultes en bonne santé
o Obésité (Silver Spring), 17 (2009), pp. 60 – 65
o
196.
o Vucetic et Reyes, 2010
o Z. Vucetic, TM Reyes
o Circuit dopaminergique central contrôlant la prise alimentaire et la récompense: implications pour la régulation de l'obésité
Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), pp. 577 – 593
o
197.
o Wang et al., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o dopamine cérébrale et obésité
o Lancet, 357 (2001), pp. 354 – 357
o
198.
o Wang et al., 2002
o GJ Wang, ND Volkow, JS Fowler
o Le rôle de la dopamine dans la motivation à manger pour l'homme: conséquences pour l'obésité
o Opin expert. Ther. Cibles, 6 (2002), pp. 601 – 609
o
199.
o Wang et al., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler.
o L'exposition à des stimuli alimentaires appétitifs active considérablement le cerveau humain
o Neuroimage, 21 (2004), pp. 1790 – 1797
o
200.
o Wang et al., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
Similarité entre l'obésité et la toxicomanie évaluée par imagerie neurofonctionnelle: examen du concept
o J. Addict. Dis., 23 (2004), pp. 39 – 53
o
201.
o Wang et al., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow.
o La distension gastrique active les circuits de satiété dans le cerveau humain
o Neuroimage, 39 (2008), pp. 1824 – 1831
o
202.
o Wassum et al., 2009
o KM Wassum, SB Ostlund, Territoires du Nord-Ouest, BW Balleine
o Des circuits opioïdes distincts déterminent l'appétence et l'opportunité d'événements enrichissants
o Proc. Natl. Acad. Sci. États-Unis, 106 (2009), p. 12512 – 12517
o
203.
o Wassum et al., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
o L'activation des récepteurs μ-opioïdes dans l'amygdale basolatérale facilite l'apprentissage des augmentations mais non de la diminution de la valeur incitative d'une récompense alimentaire.
o J. Neurosci., 31 (2011), p. 1591 – 1599
o
204.
o Wilkinson et Peele, 1962
o HA Wilkinson, TL Peele
o Modification de l'auto-stimulation intracrânienne par satiété
o Am. J. Physiol., 203 (1962), p. 537 – 540
o
205.
o Will et al., 2003
o MJ Will, EB Franzblau, AE Kelley
o Les opioïdes mu du noyau accumbens régulent la consommation d’un régime riche en graisses en activant un réseau cérébral réparti
o J. Neurosci., 23 (2003), p. 2882 – 2888
o
206.
o Wilson et al., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Quantification de la prise alimentaire chez des singes hébergés socialement: effets du statut social sur la consommation calorique
o Physiol. Comportement, 94 (2008), pp. 586 – 594
o article | PDF (553 K) |
Voir l'enregistrement dans Scopus
| Cité par dans Scopus (22)
207.
o Yurcisin et al., 2009
BM Yurcisin, MM. Gaddor, EJ DeMaria
o obésité et chirurgie bariatrique
o Clin. Coffre Med., 30 (2009), pp. 539 – 553, ix
o
208.
o Zhang et al., 1998
o M. Zhang, BA Gosnell, AE Kelley
o La consommation d'aliments riches en graisse est augmentée de manière sélective par la stimulation des récepteurs opioïdes mu dans le noyau accumbens
J. Pharmacol. Exp. Ther., 285 (1998), pp. 908 – 914
o Voir l'enregistrement dans Scopus
| Cité par dans Scopus (148)
209.
o Zheng et al., 2007
o H. Zheng, LM Patterson, HR Berthoud
o La signalisation à l'orexine dans la région tégmentale ventrale est nécessaire pour un appétit riche en graisse induit par la stimulation opioïde du noyau accumbens
o J. Neurosci., 27 (2007), p. 11075 – 11082
o Voir l'enregistrement dans Scopus
| Cité par dans Scopus (64)
210.
o Zheng et al., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Contrôle de l'appétit et régulation du bilan énergétique dans le monde moderne: le cerveau motivé par la récompense prime sur les signaux de réplétion
o Int. J. Obes. (Lond.), 33 (Suppl. 2) (2009), pp. S8 – S13
o Voir l'enregistrement dans Scopus
| Cité par dans Scopus (34)