De face. Comportement Neurosci., 02 Avril 2014 |
Carla Kalkhoven1, Cor Sennef1Ard Peeters1 et Ruud van den Bos2*
- 1Chardon Pharma, Herpen, Pays-Bas
- 2Département de physiologie animale, faculté des sciences, Université Radboud de Nimègue, Nimègue, Pays-Bas
La maladie de Huntington (HD) est une maladie neurodégénérative génétique affectant spécifiquement les neurones striataux de la voie indirecte, entraînant un déclin progressif de la coordination musculaire et une perte de contrôle émotionnel et cognitif. Fait intéressant, la prédisposition au jeu pathologique et à d'autres dépendances implique des perturbations dans les mêmes circuits cortico-striataux que celles affectant la HD et présente des symptômes similaires liés à la désinhibition, notamment une sensibilité modifiée aux punitions et aux récompenses, une impulsivité et une incapacité à envisager des avantages à long terme. sur les récompenses à court terme. Les patients HD et les joueurs pathologiques présentent également des déficits de performance similaires dans les tâches de prise de décision à risque, telles que la tâche de jeu de l'Iowa (IGT). Ces similitudes suggèrent que les patients MH constituent un groupe de risque probable de problèmes de jeu. Cependant, de tels problèmes n’ont été observés qu’incidemment chez les patients HD. Dans cette revue, nous visons à caractériser le risque de jeu pathologique en HD, ainsi que les mécanismes neurobiologiques sous-jacents. Compte tenu en particulier de la multiplication actuelle des possibilités de jeu sur Internet facilement accessibles, il est important de comprendre ces risques et d’offrir aux patients le soutien approprié en conséquence. Sur la base de résultats neuropathologiques et comportementaux, nous proposons que les patients HD ne présentent pas une tendance accrue à rechercher les risques et commencent à jouer, mais qu'ils ont davantage de risques de développer une dépendance une fois qu’ils se lancent dans des activités de jeu. Par conséquent, les développements actuels et futurs des possibilités de jeu sur Internet et des dépendances associées doivent être considérés avec prudence, en particulier pour les groupes vulnérables tels que les patients MH.
Introduction
La maladie de Huntington (HD) est une maladie neurodégénérative génétique, héritée de manière autosomique dominante. La maladie se caractérise par des symptômes moteurs, cognitifs et comportementaux progressifs, apparaissant généralement entre l'âge de 30 et celui de 50 et entraînant une mort prématurée dans 10 – 20 après le début de la maladie. La MH est causée par une mutation du gène de la huntingtine (HTT), qui conduit à l’agrégation de protéines, à la dérégulation de plusieurs processus cellulaires et finalement à la mort cellulaire. La dégénérescence neuronale se produit initialement de manière sélective dans le striatum (noyau caudé et putamen), où elle affecte les voies cortico-striatales servant à contrôler les fonctions motrices et cognitives (Reiner et al., 2011; Vonsattel et al., 2011). Au niveau moteur, ce processus dégénératif s’exprime en mouvements désorganisés (chorée), tandis qu’au niveau cognitif / comportemental, les patients présentent un «syndrome de dysfonctionnement exécutif», englobant entre autres l’impulsivité, une mauvaise évaluation du risque et l’incapacité d’arrêter un processus médiocre. action (Hamilton et al., 2003; Duff et al., 2010b). Des symptômes comportementaux et cognitifs similaires sont observés dans les comportements addictifs liés à des substances ou à des activités (Newman, 1987; Rosenblatt, 2007; Iacono et al., 2008). Par conséquent, on peut s’attendre à ce que les patients HD présentent un risque de développer une dépendance. Les paradigmes de la prise de décision en laboratoire ont en effet suggéré des déficiences dans la prise de décision à risque chez les patients atteints de MH avancée (par exemple, Stout et al., 2001), et du jeu pathologique a d'ailleurs été observé chez ce groupe de patients (De Marchi et al., 1998). Cependant, ces résultats sont rares et, étonnamment, peu d'études ont directement examiné les symptômes et les conséquences, par exemple, de la désinhibition comportementale en HD.
Dans cette revue, nous soutiendrons que les patients HD peuvent constituer un groupe à risque de développer un jeu problématique. Premièrement, le jeu problématique est caractérisé par l'incapacité des sujets à arrêter de jouer en dépit de problèmes financiers, personnels ou professionnels. Sur la base de perturbations neurobiologiques et de symptômes comportementaux, la capacité d’arrêter de jouer au jeu semble diminuée ou absente chez les patients HD. Deuxièmement, en raison des attitudes plus libérales à l’égard des jeux de hasard et des possibilités accrues de jeux de hasard légaux et illégaux sur Internet (voir par exemple: Griffiths, 2003), on peut s’attendre à ce que l’apparition de problèmes de jeu augmente dans les années à venir. L'accessibilité accrue peut constituer un risque spécifique pour les groupes vulnérables, tels que les patients HD, qui n'ont jamais été exposés à de tels risques.
En général, l'évolution des conditions externes et des méthodes de traitement peut avoir des effets inattendus et indésirables sur le comportement du patient, en particulier dans le cas de maladies neurologiques complexes. Ces effets sont facilement omis lorsque les symptômes comportementaux ne sont pas régulièrement réévalués. C’est le cas de la maladie de Parkinson, où l’introduction d’un traitement médicamenteux aux agonistes de la dopamine a entraîné des troubles du contrôle des impulsions tels que jeu compulsif, achats, alimentation et hypersexualité, provoqués par une stimulation excessive du système dopaminergique mésolimbique (Dodd et al., 2005; Witjas et al., 2012; Weintraub et al., 2013). Cependant, ces effets secondaires n’ont été reconnus que des années après l’introduction des thérapies agonistes de la dopamine, associées aux changements sociétaux liés aux achats, à la consommation alimentaire, à la sexualité, à Internet et aux jeux de hasard. Cet exemple montre qu'il est important de réévaluer les facteurs de risque pour pouvoir fournir un traitement et des conseils efficaces aux patients dans un environnement en mutation.
Ici, nous explorerons le profil de maladie de la MH en relation avec la dépendance, les problèmes de jeu et les déficits décisionnels. Dans la section HD: Neuropathologie, symptômes et progression, la progression des symptômes de la MH sera abordée en relation avec les perturbations des circuits cortico-striataux impliquées dans l’apprentissage par la tâche, la sensibilité à la punition et le contrôle cognitif / impulsif. Dans la section Prise de risque et comportement de jeu pathologique en HD, le profil neurobiologique des patients MH sera abordé dans le contexte du jeu et de tests de prise de risque et de prise de décisions bien établis, tels que Iowa Gambling Task (IGT) et Cambridge Gambling Task (CGT). Dans la section a lieu, nous discuterons de la manière dont une caractérisation des risques liés au jeu peut conduire à des recommandations pour les patients HD et leurs gardiens sur la façon de traiter ce problème et sur les situations à éviter de préférence. Nous visons également à identifier des questions encore sans réponse, qui pourraient constituer un point de départ pour des recherches futures sur l'occurrence et les risques de problèmes de jeu chez les patients HD.
HD: Neuropathologie, symptômes et progression
Mécanismes de maladies neurobiologiques
La HD est provoquée par une répétition instable du CAG (trinucléotide; cytosine-adénine-guanine) dans la région codante du gène HTT, ce qui conduit à la production de la protéine huntingtine mutante (Htt) avec une extension de polyglutamine (polyQ) élargie (MacDonald et al., 1993). Le nombre de répétitions trinucléotidiques est inversement corrélé à l’âge de survenue de la maladie (Snell et al., 1993; Stine et al., 1993). La majorité des patients atteints de la maladie de Huntington ont des répétitions 40 – 55 qui provoquent une maladie typique de l'adulte, tandis que des extensions de plus de 70 conduisent à une maladie de l'adolescence. Les individus avec moins de répétitions 35 CAG dans le gène HTT ne développeront pas de MH. Bien que les mécanismes exacts de la pathogenèse de la MH restent inconnus et ne puissent pas être discutés ici en détail, ils impliquent la formation d'agrégats de protéines par Htt polyQ expansé, ainsi que l'interaction de Htt mutant avec de nombreuses protéines impliquées dans le métabolisme énergétique, les protéines et la vésicule. transport et la régulation de la transcription des gènes (Li et Li, 2004; Jones et Hughes, 2011). La dérégulation de ces processus cellulaires qui en résulte conduit finalement à une dégénérescence neuronale par le biais de mécanismes impliquant l'excitotoxicité et l'apoptose.
La dégénérescence neuronale est initialement limitée aux ganglions de la base, où les neurones à épines moyennes du striatum (noyau caudé et putamen) sont spécifiquement touchés (Vonsattel et DiFiglia, 1998; Kassubek et al., 2004). Le striatum reçoit son apport principal excitateur (glutamatergique) des zones corticales, alors qu'il reçoit son apport dopaminergique de la substance noire. Le striatum a deux sorties principales inhibitrices (GABA-ergic): une voie directe et une voie indirecte (Figure 1A). Neurones striataux du projet de voie directe vers le globus pallidus interne (GPi), qui à son tour présente des projections inhibitrices du thalamus. Le thalamus est la principale source d’excitation du cortex. Ainsi, en effet, l'activation de la voie striatale directe inhibe l'activité de la GPi, qui à son tour inhibe l'activité thalamocorticale, facilitant ainsi le mouvement et les fonctions cognitives. La voie striatale indirecte, en revanche, se projette sur le GP externe (GPe), qui à son tour envoie des projections inhibitrices au noyau sous-thalamique (STN). Le STN envoie des projections excitatrices au GPi. En conséquence, l'activation de la voie striatale indirecte désinhibe ainsi le STN, lui permettant d'activer le GPi, qui à son tour inhibe l'activité thalamocorticale, en supprimant le mouvement et les fonctions cognitives. Le comportement adaptatif résulte d'un équilibre (délicat) d'activités entre les voies directe et indirecte. La pathologie de la voie indirecte est la clé de la HD et perturbe l'équilibre du contrôle striatal, ce qui entraîne une perte de contrôle inhibiteur sur le fonctionnement moteur et le comportement (Figure 1B; Albin et al., 1989; Alexander et Crutcher, 1990).
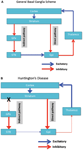
Figure 1. (UNE) Schéma simplifié de l'organisation des réseaux de ganglions cortico-basaux (zones corticales, striatales, pallidales et thalamiques) montrant les voies directe et indirecte dans le cerveau normal. (B) La dégénérescence spécifique de la voie indirecte (X) dans la HD entraîne une diminution du contrôle inhibiteur des fonctions corticales. GPe: globus pallidus externe; GPi: interne globus pallidus; STN: noyau sous-thalamique. Rouge: voies d'inhibition (GABA), Bleu: voies excitatrices (glutamate).
Les circuits des ganglions cortico-basaux, englobant les connexions entre les zones corticales, les zones striatales, les zones pallidales et les zones thalamiques, sont organisés de manière parallèle et servent différentes fonctions d'organisation du comportement. Il existe autant d'excellentes critiques sur l'anatomie et la fonction de ces circuits (par exemple, Alexander et al., 1986, 1990; Alexander et Crutcher, 1990; Yin et Knowlton, 2006; Verny et al., 2007; Yin et al., 2008; Haber et Knutson, 2010; Sesack et Grace, 2010), nous ne soulignons ici que quelques points propices à notre examen. Premièrement, il existe une organisation topographique dorsale à ventrale dans les zones corticales et striatales. Ainsi, les régions préfrontales dorsales sont associées aux régions striatales dorsales, tandis que les régions préfrontales plus ventrales sont associées à des zones striatales plus ventrales (y compris le noyau accumbens). Deuxièmement, on peut décrire en gros trois circuits différents sur le plan fonctionnel. Le circuit sensorimoteur comprend le cortex sensorimoteur (putamen) et les cortex sensorimoteurs associés à l'exécution du comportement moteur. Le circuit de contrôle associatif / cognitif implique le cortex préfrontal dorsolatéral, le cortex cingulaire antérieur et le striatum associatif (noyau caudé). Ce circuit est particulièrement pertinent pour le fonctionnement exécutif, c’est-à-dire qu’il est impliqué dans le contrôle cognitif, la planification et la mémoire de travail. En outre, il participe à la promotion d'un comportement adaptatif à long terme en renforçant ou en sanctionnant le comportement instrumental, c'est-à-dire des séquences d'actes comportementaux apprises en interaction avec l'environnement (Kravitz et al., 2012; Paton et Louie, 2012). Le circuit limbique comprend le cortex orbitofrontal, le cortex préfrontal ventromédial, l'amygdale et le striatum limbique (nucleus accumbens). Ce circuit est particulièrement utile pour évaluer la valeur affective des stimuli, signaler la récompense ou la punition attendue d'un stimulus, d'un choix ou d'un événement à venir, du contrôle émotionnel et de l'apprentissage adaptatif (émotionnel) (O'Doherty et al., 2001; Rushworth et al., 2007; van den Bos et al., 2013b, 2014).
La pathologie de la HD est observée à la fois dans le putamen et le noyau caudé (Vonsattel et DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008; Vonsattel et al., 2011; Hadzi et al., 2012). En outre, dans les deux structures, l’atrophie suit un schéma caractéristique, commençant dans les régions dorsale et caudale et se dirigeant vers les régions ventrale et rostrale au fur et à mesure de l’évolution de la maladie (Vonsattel et DiFiglia, 1998; Kassubek et al., 2004; Vonsattel, 2008). Une atrophie précoce a également été observée dans le noyau accumbens et le globus pallidus dans certaines études (van den Bogaard et al., 2011; Sánchez-Castañeda et al., 2013). Les perturbations du circuit sensorimoteur (putamen) peuvent être liées aux symptômes moteurs, mais les perturbations du circuit de contrôle associatif / cognitif (noyau caudé) peuvent être liées à un dysfonctionnement de l’exécutif et provoquer des déficits, par exemple, de la mémoire de travail chezLawrence et al., 1996; Bonelli et Cummings, 2007; Wolf et al., 2007). Les perturbations du circuit limbique, telles que l’atrophie précoce du noyau accumbens, peuvent être liées à l’apathie et à la dépression (Bonelli et Cummings, 2007; Unschuld et al., 2012). L'atrophie progressive du striatum peut entraîner des dysfonctionnements successifs des circuits cortico-striataux. Par exemple, le noyau caudé ventral fait également partie du circuit orbitofrontal, qui est affecté à mesure que la maladie progresse. Le dysfonctionnement de ce circuit est lié à la désinhibition comportementale (Bonelli et Cummings, 2007). À terme, la dégénérescence peut se propager à d’autres régions du cerveau, y compris d’autres parties des noyaux gris centraux (zones pallidales et thalamus), de l’hippocampe, de l’amygdale et de la corticale aux stades avancés de la maladie.
En résumé, la HD est caractérisée par une dégénérescence spécifique de neurones striataux appartenant à la voie indirecte. Au fur et à mesure que la maladie progresse, l'atrophie du striatum se propage le long d'un gradient caudo-rostral et dorsal-ventral, provoquant une perturbation séquentielle des circuits cortico-striataux. La perte de contrôle inhibiteur qui en résulte dans ces circuits est directement liée à la progression des symptômes moteurs, cognitifs et comportementaux chez HD, comme indiqué ci-dessous.
Symptômes de la HD
La HD est caractérisée par une variété de symptômes moteurs, cognitifs et comportementaux progressifs. Les premiers symptômes apparaissent généralement vers le milieu de l’âge, avec un début moyen de 40, bien qu’un faible pourcentage des patients souffrent d’une MH juvénile qui commence avant l’âge de 20. Comme les symptômes et la progression de la MH juvénile sont quelque peu distincts de la maladie apparente chez l’adulte, nous nous concentrerons sur ce dernier groupe de patients dans cette revue. La chorée (trouble du mouvement involontaire) est l'un des premiers symptômes de la maladie de Huntington. Un diagnostic clinique est généralement posé après l'apparition d'anomalies du mouvement (Shannon, 2011). Certaines études, cependant, rapportent de subtils changements cognitifs et émotionnels avant l'apparition des symptômes moteurs, et l'ordre exact d'apparition et la progression des symptômes de la MH font encore l'objet de débats. Néanmoins, plusieurs revues complètes des manifestations cliniques de la HD sont disponibles (Roos, 2010; Anderson, 2011; Shannon, 2011).
Symptômes moteurs
Les symptômes moteurs commencent à se manifester dès les premiers stades de la MH et sont généralement les premiers symptômes observés en laboratoire et chez les parents au premier degré de patients MH (de Boo et al., 1997; Kirkwood et al., 1999, 2001). Les perturbations motrices apparaissent comme un dysfonctionnement du contrôle de retour d'erreur (Smith et al., 2000), compatible avec le rôle du circuit moteur cortico-striatal dans l'apprentissage et le contrôle sensorimoteur (Graybiel et al., 1994). Les premiers signes d’anomalies motrices sont souvent de subtils mouvements involontaires (chorée), tels que muscles du visage, doigts et orteils («contractions»), hyperréflexie et mouvements volontaires exagérés (Young et al., 1986; Shannon, 2011), ce qui conduit à une apparence générale d’agitation et de maladresse chez les patients HD débutants. Ces mouvements anormaux sont subtils et passent souvent inaperçus au début, mais ils s'aggravent progressivement et se propagent progressivement à tous les autres muscles. Les autres symptômes moteurs précoces incluent des mouvements oculaires saccadiques lents ou retardés (Peltsch et al., 2008) et la dysarthrie (Ramig, 1986; Young et al., 1986). La dysarthrie, trouble de l'élocution motrice, entraîne des difficultés d'articulation et de confusion des mots, ce qui rend la parole de plus en plus difficile à comprendre. On observe une dysphagie (difficultés de déglutition) chez la plupart des patients apparaissant à mi-stade de la maladie. Elle s'aggrave progressivement jusqu'à ce que les patients ne puissent plus manger sans assistance et nécessitent souvent une sonde d'alimentation à un stade avancé de la HD (Heemskerk et Roos, 2011). Parmi les autres symptômes moteurs non chorés apparaissant généralement à mi-stade de la maladie, on peut citer le trouble de la marche complexe, l’instabilité posturale et la dystonie (contractions musculaires involontaires entraînant des mouvements lents et répétitifs et des postures anormales), souvent accompagnées de chutes fréquentesKoller et Trimble, 1985; Tian et al., 1992; Louis et al., 1999; Grimbergen et al., 2008). Une rigidité et une bradykinésie (lenteur des mouvements et des réflexes) sont parfois observées, mais elles se limitent principalement aux cas de HD d'apparition juvénile (Bittenbender et Quadfasel, 1962; Hansotia et al., 1968). Ces symptômes moteurs sont compatibles avec un dysfonctionnement des circuits cortico-striataux sensorimoteurs (et de contrôle associatif / cognitif) qui sont généralement affectés par la HD.
Symptômes comportementaux et psychiatriques
Les troubles du comportement liés à la MH peuvent être complexes et difficiles à classer. Leur apparition et leur apparition varient considérablement d'un individu à l'autre. De plus, il peut parfois être difficile de distinguer les troubles du comportement de la réaction normale face à une maladie pénible (Caine et Shoulson, 1983). Le nombre d'études ayant caractérisé les symptômes comportementaux en HD est limité, de sorte qu'il existe relativement peu d'informations sur leur prévalence dans la maladie (van Duijn et al., 2007). Les symptômes comportementaux et émotionnels les plus fréquemment signalés dans la MH sont l’irritabilité, l’apathie et la dépression, qui surviennent avec une prévalence d’environ 50% (Caine et Shoulson, 1983; Folstein et Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007, 2014; Tabrizi et al., 2009). Des cas d’irritabilité et d’apathie sont parfois observés chez les patients HD pré-manifestes (Tabrizi et al., 2009; van Duijn et al., 2014), et une dépression a également été rapportée aux stades cliniques précoces (Shiwach, 1994; Julien et al., 2007; Epping et al., 2013). Ces symptômes affectifs sont parmi les premiers symptômes non moteurs observés par des parents au premier degré (Kirkwood et al., 2001). Les symptômes typiques liés à l'apathie, qui s'aggravent progressivement au cours de l'évolution de la maladie, comprennent le manque d'énergie, de motivation et d'initiative, une diminution de la persévérance et de la qualité du travail, une altération du jugement, des soins auto-administrés médiocres et un émoussement émotionnel (Craufurd et al., 2001; Kirkwood et al., 2001). Les symptômes dépressifs ont été liés à une activité accrue dans le cortex préfrontal ventromédial (Unschuld et al., 2012). L’irritabilité est associée à un dysfonctionnement du circuit orbitofrontal, ce qui entraîne une perte de contrôle des réponses émotionnelles de l’amygdale (Klöppel et al., 2010).
L'anxiété, les troubles obsessionnels compulsifs, la manie, les symptômes psychotiques de type schizophrénie, tels que la paranoïa, les hallucinations et les délires (autres) sont des symptômes et troubles psychiatriques moins fréquemment observés lors de la MH.Caine et Shoulson, 1983; Folstein et Folstein, 1983; Craufurd et al., 2001; Kirkwood et al., 2001; van Duijn et al., 2007). Ces symptômes ne se manifestent généralement pas jusqu'aux stades moyen ou tardif de la maladie, bien qu'ils aient été signalés accidentellement chez des patients HD pré-cliniques (Duff et al., 2007). Le trouble obsessionnel-compulsif a été associé à des lésions du cortex orbitofrontal et du cortex cingulaire antérieur, tandis que la schizophrénie, trouble entraînant un déficit d'organisation, de planification et d'attention, est liée à un dysfonctionnement du cortex préfrontal dorsolatéral (Tekin et Cummings, 2002).
Il est suggéré que la plupart des symptômes psychiatriques de la MH font en fait partie d’un vaste «syndrome du lobe frontal» ou «syndrome de dysfonctionnement exécutif», mal défini, qui comprend des symptômes tels que l’apathie, l’irritabilité, la désinhibition, l’impulsivité, l’obsessivité et la persévérance (Lyketsos et al., 2004; Rosenblatt, 2007), qui sont tous couramment observés chez les patients HD (Hamilton et al., 2003; Duff et al., 2010b). Dans l'ensemble, la littérature indique que l'apparition et la progression des symptômes comportementaux dans la MH sont hétérogènes, les troubles affectifs se produisant le plus souvent et le plus tôt, tandis que l'anxiété, les troubles obsessionnels compulsifs et les symptômes psychotiques sont moins fréquents et se manifestent généralement plus tard dans la maladie. . Ces symptômes psychiatriques sont associés à un dysfonctionnement des circuits cortico-striataux limbiques et contrôle cognitif / associatif / cognitif généralement affectés par la HD.
Symptômes cognitifs
Le déclin cognitif est un autre aspect important de la pathologie de la maladie de Huntington. De nombreuses études ont été spécifiquement axées sur l’apparition de symptômes cognitifs aux stades précliniques et cliniques précoces de la HD, dans l’espoir de découvrir des biomarqueurs cliniques précoces de la maladie (revue récente). Papp et al., 2011; Dumas et al., 2013). Dans l’ensemble, les résultats suggèrent que des changements cognitifs subtils peuvent être observés jusqu’à 5 – 10 années avant l’apparition de symptômes moteurs avec des méthodes suffisamment sensibles. Une étude a même révélé que, aux stades précliniques et cliniques précoces de la HD, environ 40% des patients remplissaient déjà les critères de déficience cognitive légère (trouble associé à une perte de mémoire limitée, ne répondant pas aux critères de diagnostic de la démence; Duff et al., 2010a). Cependant, toutes les études ne corroborent pas ces résultats (Blackmore et al., 1995; Giordani et al., 1995; de Boo et al., 1997; Kirkwood et al., 2001). En général, la littérature convient que le traitement de l’information et la vitesse psychomotrice sont particulièrement affectés à ce stade précoce (Rothlind et al., 1993; Kirkwood et al., 1999; Verny et al., 2007; Paulsen et al., 2008). Parmi les autres troubles cognitifs précoces fréquemment observés figurent les problèmes d’attention, de mémoire (de travail) et de performance visuospatiale (Jason et al., 1988; Rothlind et al., 1993; Foroud et al., 1995; Lawrence et al., 1996; Hahn-Barma et al., 1998; Verny et al., 2007; Paulsen et al., 2008; Tabrizi et al., 2009; Papp et al., 2011; Stout et al., 2011). Une inflexibilité cognitive a été observée chez des patients présentant une maladie précoce (Jason et al., 1988), à ce stade, les mutations extra-dimensionnelles sont spécifiquement altérées, tandis que l’apprentissage par inversion est toujours intact (Lawrence et al., 1996). Ainsi, les patients peuvent toujours réévaluer la valeur du stimulus et apprendre de nouvelles contingences stimulus-récompenses dans la même dimension (par exemple, la forme ou la couleur), mais ont des difficultés à déplacer leur attention sur une autre dimension (par exemple, de la couleur à la forme) requise par la nouvelle règle de tâche pour obtenir une récompense. Aux stades ultérieurs de la maladie, la rigidité cognitive et la persévération entraînent également une altération de l'apprentissage en retour chez les patients MH (Josiassen et al., 1983; Lange et al., 1995). Cette progression des symptômes est compatible avec un dysfonctionnement spécifique du circuit préfrontal dorsolatéral au début de la maladie, car le décalage de jeu extra-dimensionnel est médié par le cortex préfrontal dorsolatéral, tandis que l’apprentissage par inversion est véhiculé par le cortex orbitofrontal (Dias et al., 1996; McAlonan et Brown, 2003). Parmi les autres déficiences précoces, citons un comportement désorganisé, une planification altérée, un manque de jugement et un contrôle limité du comportement et des émotions (Watkins et al., 2000; Paradiso et al., 2008; Duff et al., 2010b). Une désinhibition a été observée chez des patients HD débutants, dont les performances sont altérées lors de tâches nécessitant l'inhibition de réponses pré-puissantes mais inappropriées (Holl et al., 2013). Enfin, plusieurs études ont démontré que les émotions négatives telles que la colère, le dégoût, la peur et la tristesse sont gênées par la détection des émotions négatives chez les patients pré-cliniques atteints de la maladie de Huntington La reconnaissance émotionnelle décline progressivement et peut se propager à des problèmes d’émotions neutres aux premiers stades cliniques de la maladie (Johnson et al., 2007; Tabrizi et al., 2009; Labuschagne et al., 2013). Ce phénotype est lié au dysfonctionnement du cortex orbitofrontal, impliqué dans le traitement des informations émotionnelles et de récompense (Henley et al., 2008; Ille et al., 2011).
Des études portant sur des modèles animaux de MH font apparaître des altérations cognitives similaires à celles observées chez des patients humains. Bien que toutes les études ne révèlent pas de déficits cognitifs robustes (Fielding et al., 2012), les résultats obtenus chez des modèles de souris chez le rat et la souris incluent l’anxiété, une réactivité accrue aux stimuli émotionnels négatifs et des déficiences dans l’apprentissage par renversement et le changement de stratégie (Faure et al., 2011; Abada et al., 2013). Une étude a révélé des déficits précoces spécifiques dans l’apprentissage par inversion avant l’apparition des symptômes moteurs dans un modèle de HD de ratFink et al., 2012). Fait intéressant, les animaux MH semblent avoir une réactivité accrue aux stimuli émotionnels négatifs, tandis que les patients humains montrent une moins grande reconnaissance des émotions négatives. À l’heure actuelle, il n’est pas clair si cela reflète les différences de tâches administrées (reconnaissance des émotions versus réponses comportementales à des stimuli menaçants), des différences liées aux espèces dans les résultats de la pathologie ou une différence fondamentale entre le modèle de rat et la condition humaine. En général, des études chez des patients humains et des modèles animaux de HD ont démontré qu'un large éventail de fonctions cognitives peut déjà être altéré au début de la HD. Les anomalies précoces comprennent principalement les déficits d'attention, de mémoire, de flexibilité cognitive et de reconnaissance émotionnelle. À ce stade précoce, les patients ont souvent une conscience altérée de leurs propres capacités cognitives (déclin)Hoth et al., 2007). Au fil du temps, les symptômes cognitifs s’aggravent progressivement, menant finalement à une démence sous-corticale grave aux derniers stades de la maladie. Bien que l’apparition de symptômes soit généralement compatible avec l’affaiblissement successif des circuits de contrôle associatif / cognitif et du circuit cortico-striatal limbique, des fonctions spécifiques liées au circuit limbique peuvent également déjà être affectées au début de la HD.
Conclusion
Les symptômes moteurs, comportementaux et cognitifs liés à la MH ont fait l'objet d'études approfondies dans le passé et continuent d'être un sujet d'intérêt en raison de la grande variété et de la variabilité de l'apparition et de l'apparition de ces symptômes chez les patients. En général, les symptômes comportementaux et cognitifs sont liés à trois catégories comportementales frontales: l'apathie, le dysfonctionnement exécutif et la désinhibition. La combinaison de ces symptômes est parfois appelée «syndrome de dysfonctionnement exécutif». Tous ces symptômes sont liés à des déficits dans les circuits cortico-striataux impliquant le cortex orbitofrontal, le cortex dorsolatéral préfrontal et le cortex cingulaire antérieur. Comme discuté ci-dessus, des études neuropathologiques ont observé une dégénérescence progressive du striatum dans la direction dorsale à ventrale chez les patients HD. Bien que les observations comportementales et cognitives soient en partie en accord avec une déficience progressive des circuits cortico-striataux, les résultats symptomatiques semblent être plus diffus que prévu d'après les observations pathologiques. Le début et la progression des symptômes comportementaux et cognitifs dans la HD sont très hétérogènes, ce qui indique que les dommages causés aux régions striatales pourraient être plus variables et plus répandus dans les premiers stades de la HD que l'on ne le pensait auparavant. Cette opinion est corroborée par les preuves de plusieurs études d'imagerie structurale (Thieben et al., 2002; Rosas et al., 2005; van den Bogaard et al., 2011).
Prise de risque et comportement de jeu pathologique en HD
Jeu pathologique
Bien que beaucoup de gens soient capables de jouer de manière récréative, cela peut devenir un problème manifeste pour certains, à mesure qu'ils développent des formes pathologiques de ce comportement. Le jeu pathologique se caractérise par une envie excessive de jouer malgré des conséquences financières, personnelles et professionnelles clairement négatives. Il a récemment été classé dans le DSM-V comme une dépendance, car il ressemble beaucoup aux troubles liés à la toxicomanie, à la fois en termes de critères diagnostiques et en neuropathologie (van Holst et al., 2010; Clark et Goudriaan, 2012). Le jeu pathologique sera la première et la seule "dépendance au comportement" reconnue dans la catégorie "Toxicomanie et troubles connexes ». Néanmoins, il convient de noter qu'il existe des différences entre la dépendance aux substances psychoactives et la dépendance au jeu. Premièrement, satisfaire le besoin impérieux de substances psychoactives consiste à consommer la substance dont l’effet est connu, tout en satisfaisant le désir de jouer peut avoir un résultat incertain puisque l’argent peut être gagné ou non, sauf s’il s’agit du jeu lui-même, par exemple comme une activité passionnante. Ainsi, le jeu pathologique peut être plus hétérogène à cet égard, avec également une issue plus incertaine que la toxicomanie. Il convient de noter que la variabilité des résultats, y compris les gains et les pertes, peut être cruciale pour le développement de la dépendance au jeu, car elle présente un schéma de renforcement variable et intermittent, qui est la forme la plus puissante de conditionnement classique / instrumental (Sharpe, 2002; Fiorillo et al., 2003). Deuxièmement, les substances psychoactives peuvent modifier plus fortement l'activité du cerveau et du système nerveux périphérique que le jeu, en raison de leur activité pharmacologique directe sur plusieurs systèmes de neurotransmetteurs, ce qui accélère les processus de dépendance, faisant de la toxicomanie une forme de dépendance plus puissante.
Les mécanismes neurobiologiques sous-jacents du jeu sont complexes et impliquent un grand nombre de régions du cerveau et de systèmes de neurotransmetteurs différents. Raylu et Oei, 2002; Goudriaan et al., 2004; Potenza, 2013). La prédisposition à la dépendance a été associée à une réduction du niveau de récepteurs D2 de la dopamine dans le striatum, qui fonctionnent dans une boucle de rétroaction pour inhiber la libération ultérieure de la dopamine. L’hyperactivité des voies dopaminergiques qui en résulte accroît la sensibilité à la récompense, à la motivation et au renforcement positif du comportement provoquant une dépendance (Volkow et al., 2002; Di Chiara et Bassareo, 2007). Les changements de motivation spécifiques qui se produisent lorsque le jeu pathologique se développe incluent une motivation accrue à jouer (van Holst et al., 2012) et une attention accrue portée aux stimuli liés au jeu (Brevers et al., 2011a,b). En outre, les joueurs pathologiques ont réduit le contrôle cognitif sur le comportement en général, comme en témoignent une diminution des performances lors des tâches d’inhibition de la réponse, une impulsivité accrue et une préférence pour les récompenses immédiates aux retards dans les tâches neurocognitives (Goudriaan et al., 2004; Brevers et al., 2012a; van den Bos et al., 2013a).
Les joueurs pathologiques ont un rendement médiocre par rapport aux contrôles des tâches décisionnelles à risque liées aux récompenses (par exemple, Cavedini et al., 2002; Brand et al., 2005; Brevers et al., 2012b; la revue: Brevers et al., 2013). Cette faible performance est indépendante de la question de savoir si les tâches contiennent des règles explicites et stables pour les victoires et les pertes telles que la tâche Jeu de désBrand et al., 2005) ou si les sujets doivent apprendre, par essais et erreurs, quels choix sont avantageux à long terme, comme l'IGT (Cavedini et al., 2002; Brevers et al., 2012b; voir section Prise de décision risquée par les patients MH sur des tâches de laboratoire pour plus de détails sur cette tâche). Cependant, la gravité du jeu était plutôt en corrélation avec la performance dans les tâches de prise de décision dans lesquelles la probabilité de résultat est inconnue (IGT) qu'avec les tâches avec des règles explicites (Brevers et al., 2012b). Cette observation est intéressante compte tenu du fait que chez les sujets normaux, la seconde moitié de l'IGT, lorsque les sujets ont appris les contingences de tâches, s'apparente à des tâches avec des règles explicites. Collectivement, ces données suggèrent donc que, dans le jeu pathologique, la prise de décision peut être altérée par une perte de contrôle de l’exécutif, liée à des règles plus explicites, et par une perturbation du processus de récompense-punition (émotionnelle), davantage liée à la procédure d’essai et de erreur d'apprentissage pour évaluer la valeur à long terme des options (van den Bos et al., 2013a, 2014). En outre, cela suggère que les perturbations de ces dernières peuvent être un facteur prédisposant à l’escalade du comportement de jeu.
Il ressort clairement de ces études que la prédisposition neurobiologique à développer un comportement de jeu pathologique implique des perturbations à la fois dans le circuit de contrôle associatif / cognitif et dans le circuit limbique (van den Bos et al., 2013a). En conséquence, les joueurs pathologiques présentent un contrôle cognitif réduit, une impulsivité accrue et une sensibilité accrue à la récompense, qui sont tous des aspects de la désinhibition comportementale (Iacono et al., 2008). Cependant, la probabilité qu’un individu développe une dépendance au cours de sa vie dépend également de nombreux autres aspects, tels que les premières expériences de vie et les risques pour l’environnement.
Jeu pathologique en HD: données épidémiologiques
Avec le nombre croissant de possibilités offertes par Internet, les possibilités de jeux en ligne légaux et illégaux ont également augmenté ces dernières années. Ces activités de jeu facilement accessibles et souvent incontrôlées peuvent poser un risque pour quiconque est plus susceptible de développer une dépendance au jeu, mais ne peuvent autrement pas participer à de telles activités (Griffiths, 2003). Les patients HD sont l’un des groupes pour lesquels les jeux sur Internet peuvent présenter un tel risque, car la désinhibition comportementale - une caractéristique commune à la maladie - est un facteur important dans le développement de la toxicomanie (Iacono et al., 2008). En effet, comme mentionné ci-dessus, les patients HD présentent plusieurs signes de désinhibition, tels qu'irritabilité, inhibition de la réponse altérée et diminution de la reconnaissance émotionnelle, à un stade précoce de la maladie. Parmi les autres symptômes observés au cours de la MH, qui peuvent influencer la capacité des patients à prendre des décisions rationnelles, sont la rigidité cognitive, la persévération, un manque de jugement et une conscience de soi réduite. Outre ces similitudes symptomatiques entre les patients HD et les joueurs pathologiques, les deux groupes présentent des anomalies structurelles et fonctionnelles dans des circuits cortico-striataux similaires.
Compte tenu de ces similitudes entre les joueurs pathologiques et les patients HD, on peut s’attendre à ce que l’incidence des problèmes de jeu augmente chez les patients HD par rapport à la population normale. Néanmoins, à ce jour, une seule étude a rapporté des cas de jeu pathologique dans une famille italienne souffrant de MH (De Marchi et al., 1998). Dans cette famille, le jeu pathologique a été diagnostiqué chez deux personnes vers l'âge de 18, bien avant l'apparition des signes cliniques de la MH. D’autres études épidémiologiques n’ont pas fait état de ce problème, bien qu’il ait été démontré que des prises de décision altérées, une prise de risque et un manque de discernement posaient un risque pour les patients MH prenant en charge des décisions de vie importantes et des problèmes financiers (Klitzman et al., 2007; Shannon, 2011). De même, la littérature actuelle sur la pathologie de la MH ne contient aucun rapport sur des questions connexes telles que la toxicomanie et la dépendance à Internet. À l'heure actuelle, il est difficile de savoir si l'absence de rapports sur les problèmes de jeu dans la littérature sur la HD est due à un manque d'attention pour ce phénomène, ou s'il n'y a pas vraiment d'augmentation de la prévalence du jeu pathologique chez les patients HD. Plusieurs raisons peuvent expliquer pourquoi de tels problèmes n’ont pas été signalés plus fréquemment. Premièrement, même si l'incidence du jeu pathologique est accrue en HD, cela ne concernera probablement qu'un faible pourcentage des patients. En combinaison avec le fait que la population affectée par la HD est elle-même limitée en nombre, cela peut amener les problèmes de jeu à passer inaperçus en tant que problème spécifique chez ce groupe de patients. Deuxièmement, l’absence de problèmes de jeu dans la MH peut être liée à l’incapacité ou au refus des patients de quitter la maison en raison de troubles moteurs et de signes fréquemment observés d’apathie et de dépression. Avant l'avènement des jeux sur Internet, cela aurait peut-être empêché les patients HD de se rendre dans des lieux de jeux publics comme le casino. Enfin, l’adolescence semble être une période sensible pour le développement de problèmes de jeu (van den Bos et al., 2013a), alors que la plupart des patients HD ne commencent à présenter des symptômes liés à la désinhibition que plus tard dans la vie. Cependant, avec la montée en puissance des activités des adolescents sur Internet, ceux-ci peuvent acquérir des comportements tels que les jeux de hasard en ligne, qui peuvent devenir un problème lorsque les symptômes de la MH se manifestent plus tard dans la vie. Ainsi, bien que l'environnement dans lequel se trouvent les patients atteints de MH prédisposés au jeu puisse ne pas avoir encouragé un tel comportement dans le passé, il est clair qu'une accessibilité et une disponibilité accrues des possibilités de jeu à domicile peuvent modifier la prévalence de problèmes liés dans la population MH. .
Prise de décision risquée par les patients MH sur des tâches de laboratoire
Les tâches de laboratoire sont couramment utilisées pour évaluer les anomalies cognitives et comportementales dans les troubles neurologiques. Pour mieux comprendre les processus et les déficiences inhérents à la prise de décision et au comportement de prise de risque, plusieurs tâches ont été développées, notamment l’IGT (Bechara et al., 1994) et la CGT (Rogers et al., 1999). Sur l'IGT, les participants reçoivent quatre jeux de cartes. Ils ont pour instruction de choisir parmi ces cartes des cartes avec lesquelles ils peuvent gagner ou perdre de l'argent; le but de la tâche est de gagner le plus d'argent possible. Les decks diffèrent les uns des autres par la fréquence et le nombre de victoires et de défaites. Deux de ces cartes sont «mauvaises», entraînant une perte globale à long terme, et deux sont «bonnes», entraînant un gain général. Les participants ne reçoivent toutefois pas ces informations et doivent découvrir quels sont les ponts les plus avantageux au cours des expériences. Normaux et en bonne santé, les participants apprennent les règles de la tâche après un certain nombre d’échantillons et finissent par préférer les deux «bons» decks. Néanmoins, il existe des différences de performances individuelles significatives, même parmi les participants en bonne santé, notamment des différences claires entre les sexes (van den Bos et al., 2013b). Sur la CGT, les participants sont présentés avec une rangée de boîtes 10 de deux couleurs différentes et doivent prendre une décision probabiliste dans laquelle la boîte de couleur d’un jeton est masquée. Ils doivent ensuite parier leurs points sur leur confiance en cette décision. Dans cette tâche, toutes les informations pertinentes sont présentées au participant au cours de l'expérience et les essais sont indépendants, minimisant ainsi les besoins en mémoire de travail et en apprentissage. Les deux tâches de jeu sont bien établies et l’IGT est accepté comme une simulation valable de la prise de décision réelle (Buelow et Suhr, 2009), tandis que la CGT est particulièrement utile pour étudier la prise de décision en dehors d’un contexte d’apprentissage.
Les patients MH ont été testés à la fois sur l'Iowa et le Cambridge Gambling Task. Dans une étude avec des patients à un stade intermédiaire, Stout et al. (2001) ont constaté que les performances sur l’IGT étaient réduites par rapport aux sujets normaux. La différence de performance est apparue dans la deuxième partie de la tâche; là où les sujets commencent normalement à montrer une préférence pour les bons decks, les patients HD continuaient à faire des sélections fréquentes dans les bad decks. Cela suggère que les patients MH n'ont pas appris quels jeux étaient avantageux ou ont continué à choisir des cartes parmi les mauvais malgré ces connaissances. Les auteurs ont noté que plusieurs participants à la HD avaient indiqué qu'ils savaient que certains jeux étaient désavantageux, mais ils continuaient néanmoins à sélectionner les cartes parmi ces jeux, suggérant que les patients HD pouvaient apprendre les règles de la tâche, mais n'étaient pas en mesure d'appliquer un modèle de sélection avantageux répondre aux punitions et aux récompenses individuelles. Néanmoins, une baisse des performances était associée à une altération de la mémoire et à une conceptualisation, amenant les auteurs à supposer que les patients HD pourraient avoir des difficultés à apprendre ou à se souvenir des conséquences à long terme du choix des cartes d'un jeu particulier. Les patients HD avaient également un score de désinhibition plus élevé que les contrôles sains, mais cette mesure n'était pas en corrélation avec la performance de la tâche. Dans un suivi des mêmes données, Stout et ses collègues ont comparé trois modèles de décision cognitive pour expliquer le déficit de performance des patients MH. Ils ont ainsi constaté que cette situation était mieux expliquée par les déficits de la mémoire de travail et par une augmentation de l'imprudence et de l'impulsivité (Busemeyer et Stout, 2002). La baisse de performance des patients HD sur l’IGT peut également être liée à une réduction des pertes sur ces patients, constatée par la mesure des réponses de conductance cutanée au cours de l’IGT (Campbell et al., 2004). Cette constatation est compatible avec une altération de la reconnaissance des émotions négatives chez les patients HD (Johnson et al., 2007; Ille et al., 2011), et suggère qu'ils peuvent être moins sensibles aux punitions lourdes, et donc moins susceptibles de se détourner des jeux de cartes incorrects. En particulier, la deuxième partie de l’IGT exige la capacité de supprimer les actions défavorables en réponse aux sanctions tout en renforçant les actions rentables (de Visser et al., 2011; van den Bos et al., 2013b, 2014).
Un nombre limité d’autres études ont testé la prise de décision à risque dans les premiers stades de la HD, mais n’ont pas mis en évidence de difficultés de performance chez ces patients, ni sur l’IGT ni sur la CGT (Watkins et al., 2000; Holl et al., 2013). Ainsi, il apparaît que les altérations de la prise de décision et le risque de problèmes de jeu ne se développent qu’aux stades intermédiaires de la maladie. Cependant, ces études ont révélé des déficiences dans les tâches nécessitant une planification et une inhibition des réponses prépuissantes chez les patients HD en début de développement. Il semble donc que les patients MHD développent d’abord des problèmes subtils d’inhibition, de planification, de reconnaissance émotionnelle et de mémoire de travail. Chez certains patients, cela peut déjà entraîner des problèmes de jugement et de prise de décision dans les stades précoces de la maladie, mais la plupart des patients HD n'ont pas de problèmes de prise de décision risquée jusqu'à ce qu'ils atteignent un stade intermédiaire de la maladie.
Mécanismes Neurobiologiques De Prise De Décision En HD
Les voies neurobiologiques sous-jacentes aux processus de prise de décision normaux dans l'IGT
Les mécanismes neurobiologiques sous-jacents aux processus décisionnels de l’IGT ont été bien étudiés et décrits (voir par exemple, Bechara et al., 2000; Doya, 2008; de Visser et al., 2011; van den Bos et al., 2013b, 2014). L'exécution normale de cette tâche nécessite une interaction entre les circuits cortico-striataux limbique et contrôle associatif / cognitif. On pense que l’activité dans le circuit limbique est dominante pendant la première phase de l’IGT, au cours de laquelle elle participe à un comportement exploratoire, réagissant aux récompenses et aux punitions et apprenant les valeurs affectives des résultats à court et à long terme des décisions prises dans le processus décisionnel. tâche (Manes et al., 2002; Clark et Manes, 2004; Fellows et Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos et al., 2014). Le circuit de contrôle associatif / cognitif, en revanche, est plus important au cours de la deuxième partie de l’IGT, lorsqu’il est nécessaire de supprimer les réactions impulsives aux récompenses et aux punitions pour obtenir des avantages à long terme, de renforcer les comportements comportementaux avantageux et de supprimer les comportements défavorables (Manes et al., 2002; Clark et Manes, 2004; Fellows et Farah, 2005; Gleichgerrcht et al., 2010; de Visser et al., 2011; van den Bos et al., 2014).
Anomalies neurobiologiques dans les processus décisionnels de l'IGT en HD
Étant donné que les processus décisionnels au sein de l’IGT impliquent une interaction des circuits cortico-striataux limbiques et contrôle cognitif / associatif / cognitif, il n’est pas surprenant que les patients HD soient altérés dans l’exécution de cette tâche. Une des observations de Stout et de ses collègues est que l’impact de la perte sur la prise de décision est réduit chez les patients MH (Campbell et al., 2004). Ceci est cohérent avec les conclusions selon lesquelles ces patients sont altérés dans la reconnaissance des émotions négatives et peuvent être expliqués par des perturbations du cortex orbitofrontal (Ille et al., 2011). Le cortex orbitofrontal est important pour le traitement des émotions et est activé chez les sujets normaux en réponse à des punitions et à des récompenses dans une tâche de prise de décision (O'Doherty et al., 2001). Une autre découverte par Stout et al. (2001) est que la performance des patients HD sur l’IGT est corrélée à une conceptualisation réduite et à des mesures de la mémoire à long terme sur l’échelle de Mattis pour la démence. Une incapacité à apprendre ou à se souvenir quels jeux sont avantageux sur le long terme peut être associée à une activité réduite du circuit de contrôle associatif / cognitif, nécessaire pour la planification à long terme et le contrôle des impulsions (Manes et al., 2002; Clark et Manes, 2004; Fellows et Farah, 2005; Gleichgerrcht et al., 2010). Ceci est également cohérent avec des déficits spécifiques de la voie indirecte en HD, puisqu’une étude récente montre que la voie indirecte est importante pour la sensibilité à la punition dans une tâche d’apprentissage par renforcement (Kravitz et al., 2012; Paton et Louie, 2012). L’insensibilité aux conséquences futures d’une décision peut également être provoquée par un dysfonctionnement du cortex préfrontal ventromédial, puisqu’une insensibilité similaire est observée chez les patients présentant des lésions de cette région préfrontale (Bechara et al., 1994). Ainsi, une diminution des performances des patients HD sur l’IGT peut être causée par une combinaison de dysfonctionnements des circuits cortico-striataux impliquant le cortex orbitofrontal, le cortex préfrontal ventromedial et le cortex préfrontal dorsolatéral. Cela conduit à une réactivité réduite à la punition dans la première phase de la tâche et à l'impossibilité de savoir quels ponts sont avantageux à long terme, de planifier en conséquence et de supprimer les réponses impulsives dans la seconde phase de l'IGT.
a lieu
HD et jeu pathologique: quels sont les risques?
La gamme typique de symptômes moteurs, émotionnels et cognitifs de la MH est causée par une atrophie progressive du striatum qui affecte les différents circuits cortico-striataux. Bien que le début et la progression des symptômes comportementaux et cognitifs semblent être très hétérogènes, les circuits moteurs et cognitifs sont généralement affectés au début de la maladie, tandis que le circuit limbique est affecté à un stade ultérieur. Il est intéressant de noter que la prédisposition neurobiologique au jeu pathologique et à d’autres dépendances implique des perturbations dans les mêmes circuits cortico-striataux que ceux affectant la HD. Malgré ces similitudes frappantes, cependant, dans la littérature médicale, la MH n’a pas été associée au jeu pathologique ni à d’autres comportements addictifs. À ce jour, une seule étude a décrit une famille dans laquelle des problèmes de jeu se sont produits chez plusieurs membres de la famille affectés par la MH (De Marchi et al., 1998). Nous pensons que les symptômes moteurs des patients, ainsi que leur âge et leur environnement social, les ont peut-être empêchés jusqu'à présent de développer un jeu pathologique, en dépit de leur vulnérabilité accrue à de tels problèmes. En se basant sur des études de corrélation, on peut s’attendre à ce que la dépression fréquemment diagnostiquée augmente l’impulsivité et le risque de problèmes de jeu.Clarke, 2006). Une autre explication de l'absence d'observations de problèmes de jeu dans la maladie de Huntington peut être liée aux différences de neuropathologie sous-jacente. Alors que les perturbations cognitives semblent être très similaires entre les joueurs pathologiques et les patients MH, les changements émotionnels sont de nature différente. Les joueurs pathologiques montrent principalement une sensibilité accrue aux récompenses, les incitant à commencer et à continuer à jouer. La MH, en revanche, a été associée à une diminution de la sensibilité aux punitions et aux émotions négatives. Cette différence peut être une raison importante pour laquelle les patients MH ne semblent pas avoir davantage tendance à commencer à jouer ou à adopter d'autres comportements addictifs valorisants.
Néanmoins, des perturbations dans le circuit cortico-striatal limbique de patients HD peuvent toujours favoriser la prise de décisions risquées dans des situations à l'issue incertaine, comme le montre l'étude IGT (Doya, 2008). En outre, la combinaison d’une sensibilité diminuée à la punition, d’une incapacité à inhiber les réponses impulsives à des récompenses immédiates et de l’incapacité à envisager des récompenses différées à long terme et à imposer des comportements comportementaux avantageux situation qui favorise un tel comportement. Les problèmes caractéristiques des patients HD présentant un changement de stratégie et des symptômes d'inflexibilité cognitive et de persévération peuvent contribuer à la progression du comportement pathologique dans ces situations. Ainsi, nous proposons que les patients MH n'ont pas une tendance accrue à jouer au jeu ou à d'autres comportements addictifs inhérents à leur neuropathologie, mais qu'ils courent un risque accru de développer une dépendance une fois qu'ils se sont lancés dans le jeu. Conformément à cette idée, il a été observé que les patients présentant une lésion frontale deviennent impulsifs et prennent souvent de mauvaises décisions, mais qu’ils ne manifestent pas un comportement à risque accru (Miller, 1992; Bechara et al., 2000). Ceci suggère que des comportements altérés de prise de décision et de prise de risque ou de recherche de risque ne se produisent pas nécessairement ensemble, et que différentes combinaisons de perturbations des circuits de contrôle limbiques et associatifs / cognitifs peuvent avoir des effets différents sur la prise de décision à risque et le comportement de jeu. Notre hypothèse expliquerait également pourquoi on n’observe pas de mauvais résultats chez les patients HD. Étant donné que toutes les informations sur les chances et les valeurs de gains et de pertes sont disponibles dans cette tâche, les patients HD ne peuvent pas développer de stratégies désavantageuses, car ils ne recherchent pas activement les risques. Cependant, cela devrait être testé chez des patients plus avancés.
Si les patients HD présentent effectivement un risque accru de développer un comportement de jeu pathologique lorsque la situation appropriée leur est présentée, la multiplication d'opportunités de jeu facilement accessibles sur Internet peut poser un risque spécifique pour ce groupe de patients. Même s'ils ne recherchent pas activement ces situations, les patients HD sont maintenant beaucoup plus susceptibles de se voir offrir des opportunités de jeu qu'auparavant. Cela est particulièrement vrai pour les patients qui passent le plus clair de leur temps à la maison en raison de leurs symptômes, où Internet peut constituer un moyen important de les occuper. Une probabilité plus élevée de comportement de jeu peut donc entraîner une augmentation disproportionnée des problèmes liés dans la population MH. Nous suggérons que les gardiens d'enfants soient conscients de ces risques potentiels et tentent de préférence d'empêcher les patients HD de se livrer à des activités de jeu (en ligne). De plus, nous soutenons que les cliniciens devraient évaluer régulièrement le risque et la prévalence des problèmes liés au jeu dans la population MH, afin de pouvoir fournir un traitement et des conseils appropriés aux patients et aux soignants.
Directions futures
Outre les études épidémiologiques visant à évaluer la prévalence du jeu pathologique et d'autres dépendances chez les personnes atteintes de la maladie de Huntington, plusieurs axes de recherche peuvent être suggérés pour améliorer notre compréhension des problèmes abordés dans le présent document. Tout d'abord, il serait intéressant de relier directement les déficits de performance de l'IGT aux perturbations de l'activité cortico-striatale chez les patients HD. À cette fin, les schémas d'activation cérébrale des patients atteints de MH peuvent être étudiés à l'aide de l'imagerie par résonance magnétique fonctionnelle lors de l'exécution de l'IGT, et comparés à ceux des sujets normaux. L'activité dans le striatum, le cortex préfrontal dorsolatéral et le cortex orbitofrontal devrait être diminuée chez les patients HD lors de la prise de décision concernant l'IGT.
Pour étudier plus en détail les aspects comportementaux et neurobiologiques du jeu-comportement en HD, il est possible d'utiliser les modèles actuellement disponibles de la maladie des rongeurs. Sur le plan comportemental, on peut s’attendre à ce que ces animaux présentent une performance réduite sur l’IGT, semblable à celle des patients humains. Des versions rongeurs de l’IGT sont disponibles (revue: de Visser et al., 2011) et l'implication de différentes structures neuronales dans ces modèles est bien caractérisée (de Visser et al., 2011; van den Bos et al., 2013a, 2014). Par conséquent, de telles expériences sont réalisables et peuvent être combinées à une analyse en profondeur des modifications neuronales sous-jacentes dans des modèles de rongeurs atteints de HD en utilisant diverses techniques. De plus, avec l’apparition de méthodes et d’outils de recherche plus valables sur le plan écologique pour évaluer l’évolution des comportements pathologiques, le risque de développer un jeu pathologique peut être étudié dans des conditions (semi) naturelles à la fois chez l’homme et chez l’animal (van den Bos et al., 2013a). Ensemble, ces études sur les symptômes liés au jeu et la neuropathologie sous-jacente chez des patients humains et des modèles animaux de MH nous permettront de mieux comprendre les risques liés au jeu - et éventuellement à d’autres comportements de dépendance - en MH, et d’améliorer notre capacité à fournir des services. traitement et conseils appropriés.
Déclaration de conflit d'intérêts
Les auteurs déclarent que la recherche a été menée en l'absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d'intérêts potentiel.
Bibliographie
Abada, YK, Schreiber, R. et Ellenbroek, B. (2013). Déficits moteurs, émotionnels et cognitifs chez les souris BACHD adultes: un modèle pour la maladie de Huntington. Behav. Cerveau Res. 238, 243 – 251. doi: 10.1016 / j.bbr.2012.10.039
Albin, RL, Young, AB et Penney, JB (1989). L'anatomie fonctionnelle des troubles des ganglions de la base. Tendances Neurosci. 12, 366–375. doi: 10.1016/0166-2236(89)90074-x
Alexander, GE et Crutcher, MD (1990). Architecture fonctionnelle des circuits des noyaux gris centraux: substrats neuronaux du traitement parallèle. Tendances Neurosci. 13, 266–271. doi: 10.1016/0166-2236(90)90107-l
Alexander, GE, Crutcher, MD et DeLong, MR (1990). Circuits ganglionnaires-thalamocorticaux basaux: substrats parallèles pour les fonctions motrices, oculomotrices, «préfrontales» et «limbiques». Programme. Brain Res. 85, 119–146. doi: 10.1016/s0079-6123(08)62678-3
Alexander, GE, DeLong, MR et Strick, PL (1986). Organisation parallèle des circuits fonctionnellement séparés reliant les noyaux gris centraux et le cortex. Annu. Rev. Neurosci. 9, 357 – 381. doi: 10.1146 / annurev.neuro.9.1.357
Anderson, KE (2011). «Chapitre 2 - Maladie de Huntington», dans Manuel de neurologie clinique, eds WJ Weiner et E. Tolosa, Troubles du mouvement hyperkinétique (Londres: Elsevier), 15 – 24.
Bechara, A., Damasio, AR, Damasio, H. et Anderson, SW (1994). Insensibilité aux conséquences futures des dommages au cortex préfrontal humain. Cognition 50, 7–15. doi: 10.1016/0010-0277(94)90018-3
Bechara, A., Damasio, H. et Damasio, AR (2000). Émotion, prise de décision et cortex orbitofrontal. Cereb. Cortex 10, 295 – 307. doi: 10.1093 / cercor / 10.3.295
Bittenbender, JB et Quadfasel, FA (1962). Formes rigides et akinétiques de la chorée de Huntington. Cambre. Neurol. 7, 275 – 288. doi: 10.1001 / archneur.1962.04210040027003
Blackmore, L., Simpson, SA et Crawford, JR (1995). Performance cognitive dans un échantillon britannique de personnes présymptomatiques portant le gène de la maladie de Huntington. J. Med. Genet. 32, 358 – 362. doi: 10.1136 / jmg.32.5.358
Bonelli, RM et Cummings, JL (2007). Circuit frontal et sous-cortical et comportement. Dialogues Clin. Neurosci. 9, 141-151.
Brand, M., E. Kalbe, K. Labudda, E. E. Fujiwara, J. Kessler et HJ Markowitsch (2005). Déficience décisionnelle chez les patients présentant un jeu pathologique. Psychiatrie Res. 133, 91 – 99. doi: 10.1016 / j.psychres.2004.10.003
Brevers, D., Bechara, A., Cleeremans, A., et Noël, X. (2013). Iowa Gambling Task (IGT): vingt ans après - trouble du jeu et IGT. De face. Psychol. 4: 665. doi: 10.3389 / fpsyg.2013.00665
Brevers, D., Cleeremans, A., Bechara, A., C. Laloyaux, C., Kornreich, P., Verbanck, et al. (2011a). Évolution temporelle du biais attentionnel pour les informations sur le jeu dans le jeu problématique. Psychol. Toxicomane. Comportement 25, 675 – 682. doi: 10.1037 / a0024201
Brevers, D., Cleeremans, A., Goudriaan, AE, Bechara, A., C. Kornreich, P., Verbanck, P. et al. (2012b). La prise de décision sous ambiguïté mais non sous risque est liée à la gravité du jeu problématique. Psychiatrie Res. 200, 568 – 574. doi: 10.1016 / j.psychres.2012.03.053
Brevers, D., Cleeremans, A., Verbruggen, F., Bechara, A., C. Kornreich, P., Verbanck, P., et al. (2012a). Une action impulsive mais un choix impulsif déterminent la gravité du jeu problématique. PLoS One 7: e50647. doi: 10.1371 / journal.pone.0050647
Brevers, D., Cleeremans, A., H. Tibboel, A., Bechara, C., C. Kornreich, P. Verbanck, et al. (2011b). Clignotement de l'attention réduit pour les stimuli liés au jeu chez les joueurs problématiques. J. Behav. Ther. Exp. Psychiatrie 42, 265 – 269. doi: 10.1016 / j.jbtep.2011.01.005
Buelow, MT, et Suhr, JA (2009). Construire la validité de la tâche de jeu de l'Iowa. Neuropsychol. Tour. 19, 102–114. doi: 10.1007/s11065-009-9083-4
Busemeyer, JR, et Stout, JC (2002). Une contribution des modèles de décision cognitifs à l’évaluation clinique: décomposition de la performance lors de la tâche de jeu de Bechara. Psychol. Évaluer. 14, 253 – 262. doi: 10.1037 / 1040-3590.14.3.253
Caine, ED et Shoulson, I. (1983). Syndromes psychiatriques dans la maladie de Huntington. Un m. J. Psychiatrie 140, 728-733.
Campbell, MC, Stout, JC et Finn, PR (2004). Réduction de la réactivité autonome aux pertes de tâches de jeu dans la maladie de Huntington. J. Int. Neuropsychol. Soc. 10, 239 – 245. doi: 10.1017 / s1355617704102105
Cavedini, P., Riboldi, G., Keller, R., D'Annucci, A. et Bellodi, L. (2002). Dysfonctionnement du lobe frontal chez des patients souffrant de jeu pathologique. Biol. Psychiatrie 51, 334–341. doi: 10.1016/s0006-3223(01)01227-6
Clark, L. et Goudriaan, AE (2012). «Neuroimagerie dans le jeu problématique», dans Encyclopédie des comportements de dépendancePM Miller (Londres: Elsevier).
Clark, L. et Manes, F. (2004). Prise de décision sociale et émotionnelle suite à une lésion au lobe frontal. Neurocase 10, 398 – 403. doi: 10.1080 / 13554790490882799
Clarke, D. (2006). L'impulsivité en tant que médiateur dans la relation entre la dépression et le jeu problématique. Pers. Individuel Différer. 40, 5 – 15. doi: 10.1016 / j.paid.2005.05.008
D. Craufurd, JC JC et Snowden JS (2001). Changements comportementaux dans la maladie de Huntington. Neuropsychiatrie Neuropsychol. Comportement Neurol. 14, 219-226.
de Boo, GM, Tibben, A., Lanser, JB, Jennekens-Schinkel, A., Hermans, J., Maat-Kievit, A., et al. (1997). Symptômes cognitifs et moteurs précoces chez les porteurs identifiés du gène de la maladie de Huntington. Cambre. Neurol. 54, 1353 – 1357. doi: 10.1001 / archneur.1997.00550230030012
De Marchi, N., M. Morris, R. Mennella, S. La Pia et G. Nestadt (1998). Association du trouble obsessionnel-compulsif et du jeu pathologique avec la maladie de Huntington dans un pedigree italien: association possible avec la mutation de la maladie de Huntington. Acta Psychiatr. Scand. 97, 62–65. doi: 10.1111/j.1600-0447.1998.tb09964.x
de Visser, L., Homberg, JR, M. Mitsogiannis, Zeeb, FD, M. Rivalan, A. Fitoussi, et al. (2011). Les versions pour rongeurs de la tâche de jeu dans l'Iowa: opportunités et défis pour la compréhension de la prise de décision. De face. Neurosci. 5: 109. doi: 10.3389 / fnins.2011.00109
Di Chiara, G. et Bassareo, V. (2007). Système de récompense et dépendance: ce que la dopamine fait et ne fait pas. Curr. Opin. Pharmacol. 7, 69 – 76. doi: 10.1016 / j.coph.2007.02.001
Dias, R., Robbins, TW et Roberts, AC (1996). Dissociation dans le cortex préfrontal des changements affectifs et attentionnels. Nature 380, 69 – 72. doi: 10.1038 / 380069a0
Dodd, M., Klos, K., Bower, J., Geda, Y., Josephs, K. et Ahlskog, J. (2005). Jeu pathologique causé par des médicaments utilisés pour traiter la maladie de Parkinson. Cambre. Neurol. 62, 1377 – 1381. doi: 10.1001 / archneur.62.9.noc50009
Doya, K. (2008). Modulateurs de la prise de décision. Nat. Neurosci. 11, 410 – 416. doi: 10.1038 / nn2077
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR et Stout, JC (2007). Symptômes psychiatriques dans la maladie de Huntington avant le diagnostic: étude prédictive-HD. Biol. Psychiatrie 62, 1341 – 1346. doi: 10.1016 / j.biopsych.2006.11.034
Duff, K., Paulsen, JS, Beglinger, LJ, Langbehn, DR, Wang, C., Stout, JC, et al. (2010b). Comportements «frontaux» avant le diagnostic de la maladie de Huntington et sa relation avec les marqueurs de la progression de la maladie: preuves d'un manque précoce de sensibilisation. J. Neuropsychiatry Clin. Neurosci. 22, 196 – 207. doi: 10.1176 / appi.neuropsych.22.2.196
K. Duff, J. Paulsen, J. Mills, LJ Beglinger, DJ Moser, MM Smith et autres. (2010a). Déficience cognitive légère dans la maladie de Huntington pré-diagnostiquée. Neurologie 75, 500–507. doi: 10.1212/wnl.0b013e3181eccfa2
Dumas, EM, van den Bogaard, SJ, Middelkoop, HA et Roos, RA (2013). Une revue de la cognition dans la maladie de Huntington. De face. Biosci. (Schol. Ed.) 5, 1 – 18. doi: 10.2741 / s355
Epping, EA, Mills, JA, Beglinger, LJ, Fiedorowicz, JG, D. Craufurd, MM. Smith, et al. (2013). Caractérisation de la dépression dans la maladie de Huntington prodromique dans l'étude prédictive neurobiologique de la HD (PREDICT-HD). J. Psychiatr. Res. 47, 1423 – 1431. doi: 10.1016 / j.jpsychires.2013.05.026
Faure, A., Höhn, S., Von Hörsten, S., Delatour, B., K. Raber, Le Blanc, P., et al. (2011). Traitement émotionnel et motivationnel altéré dans le modèle de rat transgénique pour la maladie de Huntington. Neurobiol. Apprendre. Mem. 95, 92 – 101. doi: 10.1016 / j.nlm.2010.11.010
Fellows, LK et Farah, MJ (2005). Différentes altérations sous-jacentes dans la prise de décision suite à des lésions du lobe frontal ventromédial et dorsolatéral chez l’homme. Cereb. Cortex 15, 58 – 63. doi: 10.1093 / cercor / bhh108
Fielding, SA, Brooks, SP, Klein, A., Bayram-Weston, Z., Jones, L. et Dunnett, SB (2012). Profils de déficience motrice et cognitive dans le modèle de gène transgénique de la maladie de Huntington. Cerveau Res. Taureau. 88, 223 – 236. doi: 10.1016 / j.brainresbull.2011.09.011
Fink, KD, Rossignol, J., Crane, AT, Davis, KK, Bavar, AM, Dekorver, NW, et al. (2012). Dysfonctionnement cognitif précoce dans le modèle de rat transgénique HD 51 CAG de la maladie de Huntington. Comportement Neurosci. 126, 479 – 487. doi: 10.1037 / a0028028
Fiorillo, CD, Tobler, PN et Schultz, W. (2003). Codage discret de la probabilité de récompense et de l'incertitude par les neurones dopaminergiques. Sciences 299, 1898 – 1902. doi: 10.1126 / science.1077349
Folstein, SE et Folstein, MF (1983). Caractéristiques psychiatriques de la maladie de Huntington: approches récentes et résultats. Psychiatr. Dev. 1, 193-205.
Foroud, T., Siemers, E., Kleindorfer, D., Bill, DJ, Hodes, ME, Norton, JA, et al. (1995). Scores cognitifs chez les porteurs du gène de la maladie de Huntington comparés aux non porteurs. Ann. Neurol. 37, 657 – 664. doi: 10.1002 / ana.410370516
Giordani, B., Berent, S., Boivin, MJ, Penney, JB, Lehtinen, S., Markel, DS, et al. (1995). Analyse longitudinale des liens neuropsychologiques et génétiques des personnes à risque de maladie de Huntington. Cambre. Neurol. 52, 59 – 64. doi: 10.1001 / archneur.1995.00540250063014
Gleichgerrcht, E., Ibanez, A., Roca, M., Torralva, T. et Manes, F. (2010). Cognition décisionnelle dans les maladies neurodégénératives. Nat. Rev. Neurol. 6, 611 – 623. doi: 10.1038 / nrneurol.2010.148
Goudriaan, AE, Oosterlaan, J., de Beurs, E. et Van den Brink, W. (2004). Jeu pathologique: examen complet des résultats du comportement biologique. Neurosci. Biobehav. Tour. 28, 123 – 141. doi: 10.1016 / j.neubiorev.2004.03.001
Graybiel, AM, Aosaki, T., Flaherty, AW et Kimura, M. (1994). Les noyaux gris centraux et le contrôle moteur adaptatif. Sciences 265, 1826 – 1831. doi: 10.1126 / science.8091209
Griffiths, M. (2003). Jeu sur Internet: problèmes, préoccupations et recommandations. Cyberpsychol. Comportement 6, 557 – 568. doi: 10.1089 / 109493103322725333
Grimbergen, YAM, Knol, MJ, Bloem, BR, Kremer, HBP, Roos, RAC et Munneke, M. (2008). Chutes et troubles de la marche dans la maladie de Huntington. Mov. Disord. 23, 970 – 976. doi: 10.1002 / mds.22003
Haber, SN et Knutson, B. (2010). Le circuit de la récompense: lien entre l'anatomie des primates et l'imagerie humaine. Neuropsychopharmacology 35, 4 – 26. doi: 10.1038 / npp.2009.129
Hadzi, TC, Hendricks, AE, Latourelle, JC, Lunetta, KL, Cupples, LA, Gillis, T., et al. (2012). Evaluation de l'implication corticale et striatale dans le cerveau de la maladie de 523 Huntington. Neurologie 79, 1708–1715. doi: 10.1212/wnl.0b013e31826e9a5d
Hahn-Barma, V., Deweer, B., Dürr, A., Dodé, C., Feingold, J., Pillon, B. et al. (1998). Les changements cognitifs sont-ils les premiers symptômes de la maladie de Huntington? Une étude des porteurs de gènes. J. Neurol. Neurosurg. Psychiatrie 64, 172 – 177. doi: 10.1136 / jnnp.64.2.172
Hamilton, JM, Saumon, DP, Corey-Bloom, J., Gamst, A., Paulsen, JS, Jerkins, S., et al. (2003). Les anomalies comportementales contribuent au déclin fonctionnel dans la maladie de Huntington. J. Neurol. Neurosurg. Psychiatrie 74, 120 – 122. doi: 10.1136 / jnnp.74.1.120
Hansotia, P., Cleeland, CS et Chun, RW (1968). Chorée juvénile de Huntington. Neurologie 18, 217-224.
Heemskerk, A.-W., et Roos, RAC (2011). Dysphagie dans la maladie de Huntington: une revue. Dysphagie 26, 62–66. doi: 10.1007/s00455-010-9302-4
Henley, SMD, Wild, EJ, Hobbs, NZ, Warren, JD, Frost, C., Scahill, RI, et al. (2008). La reconnaissance défectueuse des émotions au début de la MH est génériques sur le plan neuropsychologique et anatomique. Neuropsychologia 46, 2152 – 2160. doi: 10.1016 / j.neuropsychologia.2008.02.025
Holl, AK, Wilkinson, L., Tabrizi, SJ, Painold, A. et Jahanshahi, M. (2013). Dysfonctionnement exécutif sélectif mais prise de décision à risque intacte au début de la maladie de Huntington. Mov. Disord. 28, 1104 – 1109. doi: 10.1002 / mds.25388
Hoth, KF, Paulsen, JS, Moser, DJ, D. Tranel, Clark, LA et Bechara, A. (2007). Les patients atteints de la maladie de Huntington ont une conscience altérée de leurs capacités cognitives, émotionnelles et fonctionnelles. J. Clin. Exp. Neuropsychol. 29, 365 – 376. doi: 10.1080 / 13803390600718958
Iacono, WG, Malone, SM et McGue, M. (2008). La désinhibition comportementale et le développement d'une dépendance précoce: influences communes et spécifiques. Annu. Rev. Clin. Psychol. 4, 325 – 348. doi: 10.1146 / annurev.clinpsy.4.022007.141157
Ille, R., Schäfer, A., Scharmüller, W., Enzinger, C., H. Schöggl, H., Kapfhammer, HP et al. (2011). Reconnaissance des émotions et expérience de la maladie de Huntington: une étude de morphométrie à base de voxel. J. Psychiatry Neurosci. 36, 383 – 390. doi: 10.1503 / jpn.100143
Jason, GW, Pajurkova, EM, Suchowersky, O., Hewitt, J., Hilbert, C., Reed, J., et al. (1988). Déficience neuropsychologique présymptomatique dans la maladie de Huntington. Cambre. Neurol. 45, 769 – 773. doi: 10.1001 / archneur.1988.00520310079021
Johnson, SA, Stout, JC, AC Solomon, Langbehn, DR, Aylward, EH, Cruce, CB, et al., Et investigateurs Predict-HD du groupe d'étude Huntington (2007). Au-delà du dégoût: altération de la reconnaissance des émotions négatives avant le diagnostic dans la maladie de Huntington. Cerveau 130, 1732 – 1744. doi: 10.1093 / brain / awm107
Jones, L. et Hughes, A. (2011). «Mécanismes pathogènes dans la maladie de Huntington», dans Revue Internationale de Neurobiologie, eds J. Brotchie, E. Bezard et P. Jenner, physiopathologie, pharmacologie et biochimie de la dyskinésie (London: Academic Press), 373 – 418.
Josiassen, RC, Curry, LM et Mancall, EL (1983). Développement de déficits neuropsychologiques dans la maladie de Huntington. Cambre. Neurol. 40, 791 – 796. doi: 10.1001 / archneur.1983.04050120041005
Julien, CL, JC, Thompson, S., Wild, P., Yardumian, JS Snowden, G. Turner, et al. (2007). Troubles psychiatriques dans la maladie de Huntington préclinique. J. Neurol. Neurosurg. Psychiatrie 78, 939 – 943. doi: 10.1136 / jnnp.2006.103309
Kassubek, J., Juengling, FD, Kioschies, T., K. Henkel, J., Karitzky, B., Kramer, et al. (2004). Topographie de l'atrophie cérébrale au début de la maladie de Huntington: étude par IRM morphométrique à base de voxel. J. Neurol. Neurosurg. Psychiatrie 75, 213 – 220. doi: 10.1136 / jnnp.2002.009019
Kirkwood, SC, Siemers, E., Stout, JC, Hodes, ME, Conneally, PM, Christian, JC, et al. (1999). Changements cognitifs et moteurs longitudinaux chez les porteurs de gènes présymptomatiques de la maladie de Huntington. Cambre. Neurol. 56, 563 – 568. doi: 10.1001 / archneur.56.5.563
Kirkwood, SC, Su, JL, Conneally, P. et Foroud, T. (2001). Progression des symptômes dans les stades précoce et moyen de la maladie de Huntington. Cambre. Neurol. 58, 273 – 278. doi: 10.1001 / archneur.58.2.273
Klitzman, R., D. Thorne, J. Williamson, W. Chung et K. Marder (2007). Prise de décision concernant les choix en matière de reproduction chez les personnes à risque de la maladie de Huntington. J. Genet. Conseils 16, 347–362. doi: 10.1007/s10897-006-9080-1
Klöppel, S., CM Stonnington, P. Petrovic, D. Mobbs, O. Tüscher, D. Craufurd et autres. (2010). Irritabilité dans la maladie de Huntington pré-clinique. Neuropsychologia 48, 549 – 557. doi: 10.1016 / j.neuropsychologia.2009.10.016
Koller, WC et Trimble, J. (1985). La démarche anormale de la maladie de Huntington. Neurologie 35, 1450 – 1454. doi: 10.1212 / wnl.35.10.1450
Kravitz, AV, Tye, LD et Kreitzer, AC (2012). Rôles distincts pour les neurones à voies directes et indirectes dans le renforcement. Nat. Neurosci. 15, 816 – 818. doi: 10.1038 / nn.3100
Labuschagne, I., Jones, R., Callaghan, J., Whitehead, D., Dumas, EM, Say, MJ, et al. (2013). Déficits de reconnaissance des visages émotionnels et effets des médicaments avant la manifestation de la maladie de Huntington de stade II. Psychiatrie Res. 207, 118 – 126. doi: 10.1016 / j.psychres.2012.09.022
Lange, KW, BJ Sahakian, NP NP, Marsden, CD et Robbins, TW (1995). Comparaison de la fonction de la mémoire exécutive et visuospatiale dans la maladie de Huntington et la démence de type Alzheimer comparée au degré de démence. J. Neurol. Neurosurg. Psychiatrie 58, 598 – 606. doi: 10.1136 / jnnp.58.5.598
Lawrence, AD, Sahakian, BJ, Hodges, JR, Rosser, AE, Lange, KW et Robbins, TW (1996). Fonctions exécutives et mnémoniques au début de la maladie de Huntington. Cerveau 119, 1633 – 1645. doi: 10.1093 / brain / 119.5.1633
Li, SH et Li, XJ (2004). Interactions Huntingtine-protéine et la pathogenèse de la maladie de Huntington. Tendances Genet. 20, 146 – 154. doi: 10.1016 / j.tig.2004.01.008
Louis, ED, Lee, P., L. Quinn et K. Marder (1999). Dystonie dans la maladie de Huntington: prévalence et caractéristiques cliniques. Mov. Disord. 14, 95–101. doi: 10.1002/1531-8257(199901)14:1<95::aid-mds1016>3.0.co;2-8
Lyketsos, CG, A. Rosenblatt et P. Rabins (2004). Syndrome du lobe frontal oublié ou «Syndrome de dysfonctionnement exécutif». Psychosomatique 45, 247 – 255. doi: 10.1176 / appi.psy.45.3.247
MacDonald, ME et autres, et le groupe de recherche en collaboration sur la maladie de Huntington (1993). Nouveau gène contenant une répétition de trinucléotide qui est étendue et instable sur les chromosomes de la maladie de Huntington. Cellule 72, 971–983. doi: 10.1016/0092-8674(93)90585-e
Manes, F., Sahakian, B., Clark, L., Rogers, R., Antoun, N., M. Aitken, et al. (2002). Processus décisionnels consécutifs aux dommages au cortex préfrontal. Cerveau 125, 624 – 639. doi: 10.1093 / brain / awf049
McAlonan, K. et Brown, VJ (2003). Le cortex préfrontal orbital intervient dans l'apprentissage par inversion et non dans le déplacement de l'attention chez le rat. Behav. Cerveau Res. 146, 97 – 103. doi: 10.1016 / j.bbr.2003.09.019
Miller, LA (1992). Impulsivité, prise de risque et capacité à synthétiser des informations fragmentées après une lobectomie frontale. Neuropsychologia 30, 69–79. doi: 10.1016/0028-3932(92)90015-e
Newman, JP (1987). Réaction aux punitions chez les extravertis et les psychopathes: implications pour le comportement impulsif des individus désinhibés. J. Res. Pers. 21, 464–480. doi: 10.1016/0092-6566(87)90033-x
O'Doherty, J., Kringelbach, ML, Rolls, ET, Hornak, J. et Andrews, C. (2001). Représentations abstraites de récompense et de punition dans le cortex orbitofrontal humain. Nat. Neurosci. 4, 95 – 102. doi: 10.1038 / 82959
Papp, KV, Kaplan, RF et Snyder, PJ (2011). Marqueurs biologiques de la cognition dans la maladie de Huntington prodromique: une revue. Cerveau Cogn. 77, 280 – 291. doi: 10.1016 / j.bandc.2011.07.009
Paradiso, S., Turner, BM, Paulsen, JS, Jorge, R., Ponto, LLB et Robinson, RG (2008). Bases neurales de la dysphorie au début de la maladie de Huntington. Psychiatrie Res. 162, 73 – 87. doi: 10.1016 / j.pscychresns.2007.04.001
Paton, JJ et Louie, K. (2012). Récompense et punition illuminées. Nat. Neurosci. 15, 807 – 809. doi: 10.1038 / nn.3122
Paulsen, JS, Langbehn, DR, Stout, JC, E. Aylward, Ross, CA, Nance, M., et al. (2008). Détection de la maladie de Huntington plusieurs décennies avant le diagnostic: étude Pred-HD. J. Neurol. Neurosurg. Psychiatrie 79, 874 – 880. doi: 10.1136 / jnnp.2007.128728
Peltsch, A., Hoffman, A., I. Armstrong, Pari, G. et Munoz, DP (2008). Déficience saccadique dans la maladie de Huntington. Exp. Brain Res. 186, 457–469. doi: 10.1007/s00221-007-1248-x
Potenza, MN (2013). Neurobiologie des comportements de jeu. Curr. Opin. Neurobiol. 23, 660 – 667. doi: 10.1016 / j.conb.2013.03.004
Ramig, LA (1986). Analyses acoustiques de la phonation chez des patients atteints de la maladie de Huntington. Rapport préliminaire. Ann. Otol. Rhinol. Laryngol. 95, 288-293.
Raylu, N. et Oei, TPS (2002). Jeu pathologique. Un examen complet. Clin. Psychol. Tour. 22, 1009–1061. doi: 10.1016/S0272-7358(02)00101-0
Reiner, A., Dragatsis, I. et Dietrich, P. (2011). «Génétique et neuropathologie de la maladie de Huntington», dans Revue Internationale de Neurobiologie, eds J. Brotchie, E. Bezard et P. Jenner, physiopathologie, pharmacologie et biochimie de la dyskinésie (London: Academic Press), 325 – 372.
Rogers, RD, Everitt, BJ, Baldacchino, A., Blackshaw, AJ, R. Swainson, K. Wynne, et al. (1999). Déficits dissociables dans la connaissance décisionnelle des consommateurs chroniques d'amphétamines, des consommateurs d'opiacés, des patients présentant des lésions focales du cortex préfrontal et des volontaires normaux épuisés en tryptophane: preuves de mécanismes monoaminergiques. Neuropsychopharmacology 20, 322–339. doi: 10.1016/s0893-133x(98)00091-8
Roos, RA (2010). La maladie de Huntington: un examen clinique. Orphanet J. Rare Dis. 5:40. doi: 10.1186/1750-1172-5-40
Rosas, HD, Hevelone, ND, Zaleta, AK, Greve, DN, Salat, DH et Fischl, B. (2005). Amincissement cortical régional dans la maladie préclinique de Huntington et ses relations avec la cognition. Neurologie 65, 745 – 747. doi: 10.1212 / 01.wnl.0000174432.87383.87
Rosenblatt, A. (2007). Neuropsychiatrie de la maladie de Huntington. Dialogues Clin. Neurosci. 9, 191-197.
Rothlind, JC, Bylsma, FW, Peyser, C., Folstein, SE et Brandt, J. (1993). Corrélations cognitives et motrices du fonctionnement quotidien au début de la maladie de Huntington. J. Nerv. Ment. Dis. 181, 194–199. doi: 10.1097/00005053-199303000-00008
Rushworth, MFS, Behrens, TEJ, Rudebeck, PH et Walton, ME (2007). Rôles contrastés du cortex cingulaire et du cortex orbitofrontal dans les décisions et le comportement social. Trends Cogn. Sci. 11, 168 – 176. doi: 10.1016 / j.tics.2007.01.004
Sánchez-Castañeda, A. Cherubini, F. Elifani, P. Péran, S. Orobello, G. Capelli et al. (2013). Recherche de biomarqueurs de la maladie de Huntington par imagerie multimodale et transversale des noyaux gris centraux. Fredonner. Cerveau Mapp. 34, 1625 – 1635. doi: 10.1002 / hbm.22019
Sesack, SR et Grace, AA (2010). Réseau de récompense des noyaux gris centraux: microcircuits. Neuropsychopharmacology 35, 27 – 47. doi: 10.1038 / npp.2009.93
Shannon, KM (2011). «Chapitre 1 - Maladie de Huntington - signes cliniques, symptômes, diagnostic présymptomatique et diagnostic», dans Manuel de neurologie clinique, eds WJ Weiner et E. Tolosa, Troubles du mouvement hyperkinétique (Londres: Elsevier), 3 – 13.
Sharpe, L. (2002). Un modèle cognitivo-comportemental reformulé du jeu problématique. Une perspective biopsychosociale. Clin. Psychol. Tour. 22, 1–25. doi: 10.1016/s0272-7358(00)00087-8
Shiwach, R. (1994). Psychopathologie chez les patients atteints de la maladie de Huntington. Acta Psychiatr. Scand. 90, 241–246. doi: 10.1111/j.1600-0447.1994.tb01587.x
Smith, MA, Brandt, J. et Shadmehr, R. (2000). Le trouble moteur dans la maladie de Huntington débute par un dysfonctionnement du contrôle du retour d'erreur. Nature 403, 544 – 549. doi: 10.1038 / 35000576
Snell, RG, MacMillan, JC, Cheadle, JP, Fenton, I., Lazarou, LP, Davies, P., et al. (1993). Relation entre l'expansion répétée du trinucléotide et la variation phénotypique dans la maladie de Huntington. Nat. Genêt. 4, 393 – 397. Doi: 10.1038 / ng0893-393
Stine, OC, Pleasant, N., Franz, ML, Abbott, MH, Folstein, SE et Ross, CA (1993). Corrélation entre l'âge d'apparition de la maladie de Huntington et la longueur de la répétition du trinucléotide dans IT-15. Fredonner. Mol. Genet. 2, 1547 – 1549. doi: 10.1093 / hmg / 2.10.1547
Stout, JC, Paulsen, JS, S. Queller, Solomon, AC, Whitlock, KB, Campbell, JC, et al. (2011). Signes neurocognitifs dans la maladie de Huntington prodromique. Neuropsychologie 25, 1 – 14. doi: 10.1037 / a0020937
Stout, JC, Rodawalt, WC et Siemers, ER (2001). Prise de décision risquée dans la maladie de Huntington. J. Int. Neuropsychol. Soc. 7, 92 – 101. doi: 10.1017 / S1355617701711095
Tabrizi, SJ, Langbehn, DR, Leavitt, BR, Roos, RA, Durr, A., D. Craufurd, et al. (2009). Manifestations biologiques et cliniques de la maladie de Huntington dans l'étude TRACK-HD longitudinale: analyse transversale des données de base. Lancet Neurol. 8, 791–801. doi: 10.1016/S1474-4422(09)70170-X
Tekin, S. et Cummings, JL (2002). Circuits neuronaux frontal-sous-corticaux et neuropsychiatrie clinique: mise à jour. J. Psychosom. Res. 53, 647–654. doi: 10.1016/s0022-3999(02)00428-2
Thieben, MJ, Duggins, AJ, Good, CD, L. Gomes, N. Mahant, F. Richards, et al. (2002). La distribution de la neuropathologie structurale dans la maladie de Huntington pré-clinique. Cerveau 125, 1815 – 1828. doi: 10.1093 / brain / awf179
Tian, J., Herdman, SJ, Zee, DS et Folstein, SE (1992). Stabilité posturale chez les patients atteints de la maladie de Huntington. Neurologie 42, 1232 – 1238. doi: 10.1212 / wnl.42.6.1232
Unschuld, PG, Joël, SE, Pekar, JJ, Reading, SA, K. Oishi, J. McEntee, et al. (2012). Les symptômes dépressifs dans la maladie de Huntington prodromique sont en corrélation avec la connectivité fonctionnelle liée au brouillage dans le cortex préfrontal ventromédial. Psychiatrie Res. 203, 166 – 174. doi: 10.1016 / j.pscychresns.2012.01.002
van den Bogaard, SJ, Dumas, EM, Acharya, TP, Johnson, H., Langbehn, DR, Scahill, RI, et al. (2011). Atrophie précoce du noyau de pallidum et d'accumbens dans la maladie de Huntington. J. Neurol. 258, 412–420. doi: 10.1007/s00415-010-5768-0
R. van den Bos, W. Davies, F. Dellu-Hagedorn, AE, Goudriaan, S., H. Homberg, J. et al. (2013a). Approches inter-espèces du jeu pathologique: une analyse ciblant les différences entre les sexes, la vulnérabilité des adolescents et la validité écologique des outils de recherche. Neurosci. Biobehav. Tour. 37, 2454 – 2471. doi: 10.1016 / j.neubiorev.2013.07.005
van den Bos, R., Homberg, J. et de Visser, L. (2013b). Examen critique des différences entre les sexes dans les tâches de prise de décision: concentrez-vous sur la tâche du jeu dans l'Iowa. Behav. Cerveau Res. 238, 95 – 108. doi: 10.1016 / j.bbr.2012.10.002
van den Bos, R., Koot, S. et de Visser, L. (2014). Une version de rongeur de la tâche de jeu de l'Iowa: 7 années de progrès. De face. Psychol. 5: 203.doi: 10.3389 / fpsyg.2014.00203
van Duijn, E., Kingma, EM et van der Mast, RC (2007). Psychopathologie chez les porteurs de gènes vérifiés de la maladie de Huntington. J. Neuropsychiatry Clin. Neurosci. 19, 441 – 448. doi: 10.1176 / appi.neuropsych.19.4.441
E. van Duijn, N. Reedeker, EJ Giltay, D. Eindhoven, RAC Roos et RC van der Mast (2014). Evolution de l'irritabilité, de la dépression et de l'apathie de la maladie de Huntington en relation avec des symptômes moteurs pendant une période de suivi de deux ans. Neurodégénére. Dis. 13, 9 – 16. doi: 10.1159 / 000343210
van Holst, RJ, W. van den Brink, DJ Veltman, et Goudriaan, AE (2010). Pourquoi les joueurs ne parviennent pas à gagner: une revue des résultats cognitifs et de la neuroimagerie dans le jeu pathologique. Neurosci. Biobehav. Tour. 34, 87 – 107. doi: 10.1016 / j.neubiorev.2009.07.007
van Holst, RJ, DJ Veltman, C. Büchel, W. Van den Brink, et Goudriaan, AE (2012). Code d’attente déformé dans le jeu problématique: la dépendance est-elle une anticipation? Biol. Psychiatrie 71, 741 – 748. doi: 10.1016 / j.biopsych.2011.12.030
Verny, C., Allain, P., Prudean, A., Malinge, MC, Gohier, B., Scherer, C. et al. (2007). Changements cognitifs chez les porteurs asymptomatiques du gène de la mutation de la maladie de Huntington. EUR. J. Neurol. 14, 1344 – 1350. Doi: 10.1111 / j.1468-1331.2007.01975.x
Volkow, ND, Fowler, JS et Wang, GJ (2002). Rôle de la dopamine dans le renforcement des drogues et la toxicomanie chez l'homme: résultats d'études d'imagerie. Comportement Pharmacol. 13, 355–366. doi: 10.1097/00008877-200209000-00008
Vonsattel, JP et DiFiglia, M. (1998). Maladie de Huntington. J. Neuropathol. Exp. Neurol. 57, 369–384. doi: 10.1097/00005072-199805000-00001
Vonsattel, JPG, Keller, C. et Cortes Ramirez, EP (2011). Chapitre 4 - Maladie de Huntington - neuropathologie »dans Manuel de neurologie clinique, eds W. Weiner et E. Tolosa, Troubles du mouvement hyperkinétique (Londres: Elsevier), 83 – 100.
Vonsattel, JPG (2008). Modèles de maladie de Huntington et neuropathologie humaine: similitudes et différences. Acta Neuropathol. 115, 55–69. doi: 10.1007/s00401-007-0306-6
Watkins, LHA, Rogers, RD, Lawrence, AD, Sahakian, BJ, Rosser, AE et Robbins, TW (2000). Planification avec facultés affaiblies mais prise de décision intacte au début de la maladie de Huntington: implications pour une pathologie fronto-striatale spécifique. Neuropsychologia 38, 1112–1125. doi: 10.1016/s0028-3932(00)00028-2
Weintraub, D., Papay, K., Siderowf, A. et l'initiative des marqueurs de la progression de Parkinson. (2013). Dépistage des symptômes de contrôle des impulsions chez les patients atteints d'une maladie de Parkinson de novo: une étude cas-contrôle. Neurologie 80, 176–180. doi: 10.1212/wnl.0b013e31827b915c
Witjas, T., Eusebio, A., Fluchère, F. et Azulay, JP (2012). Comportements addictifs et maladie de Parkinson. Rev. Neurol. (Paris) 168, 624 – 633. doi: 10.1016 / j.neurol.2012.06.014
Wolf, RC, Vasic, N., C. Schönfeldt-Lecuona, Landwehrmeyer, GB et Ecker, D. (2007). Dysfonctionnement du cortex préfrontal dorsolatéral dans la maladie de Huntington présymptomatique: évidence de l'IRMf événementielle. Cerveau 130, 2845 – 2857. doi: 10.1093 / brain / awm210
Yin, HH et Knowlton, BJ (2006). Le rôle des ganglions de la base dans la formation des habitudes. Nat. Rev Neurosci. 7, 464 – 476. doi: 10.1038 / nrn1919
Yin, HH, Ostlund, SB et Balleine, BW (2008). Apprentissage guidé par récompense au-delà de la dopamine dans le noyau accumbens: les fonctions intégratrices des réseaux de noyaux gris centraux. EUR. J. Neurosci. 28, 1437 – 1448. Doi: 10.1111 / j.1460-9568.2008.06422.x
Young, AB, I. Shoulson, Penney, JB, S. Starosta-Rubinstein, F. Gomez, H. Travers et autres. (1986). La maladie de Huntington au Venezuela Caractéristiques neurologiques et déclin fonctionnel. Neurologie 36, 244 – 249. doi: 10.1212 / WNL.36.2.244
Mots-clés: maladie de Huntington, prise de risque, jeu, cortex préfrontal, ganglions de la base, désinhibition
Citation: Kalkhoven C, C Sennef, Peeters A et van den Bos R (2014). Prise de risque et comportement pathologique au jeu dans la maladie de Huntington. De face. Comportement Neurosci. 8: 103. doi: 10.3389 / fnbeh.2014.00103
Reçu: 30 novembre 2013; Document en attente publié: 18 January 2014;
Accepté: 12 March 2014; Publié en ligne: 02 April 2014.
Édité par:
Patrick Anselme, Université de Liège, Belgique
Commenté par:
Damien Brevers, Université Libre de Bruxelles, Belgique
Bryan F. Singer, Université du Michigan, États-Unis
