La dysfonction érectile (DE) est courante avec le vieillissement. Auparavant, le traitement ED était principalement offert par les urologues, mais l'approbation et l'utilisation généralisée des inhibiteurs de la phosphodiestérase ont permis aux cliniciens de soins primaires de fournir un traitement ED ciblé. Bien que de grands essais cliniques multicentriques aient montré l'efficacité et l'innocuité de ces médicaments, ils sont inefficaces chez 30 à 35% des hommes, peuvent provoquer des effets secondaires et n'améliorent pas la pathologie sous-jacente. Une compréhension approfondie de la physiologie érectile et des causes de la dysfonction érectile et un plan de traitement complet traitant de tous les facteurs contributifs peuvent être plus efficaces que la gestion pharmaceutique et peuvent améliorer les aspects de la santé psychologique et physique au-delà des problèmes érectiles.
La dysfonction érectile (DE) - l'incapacité de développer et de maintenir une érection suffisamment ferme pour la pénétration - est courante avec le vieillissement. Environ 40% des hommes de 40 ans et 70% des hommes de 70 ans souffrent d'une forme quelconque de dysfonction érectile.1 La dysfonction érectile est associée à de multiples conditions physiques, peut être un signe avant-coureur de maladies métaboliques ou vasculaires et affecte la santé psychosociale. Les inhibiteurs de la phosphodiestérase de type 5 (PDE5i) sont le traitement de première intention le plus courant pour la dysfonction érectile. De grands essais cliniques multicentriques ont montré l'efficacité et l'innocuité de ces médicaments; cependant, ils sont inefficaces chez 30 à 35% des patients,2 peut provoquer des effets secondaires et n'améliore pas la pathologie sous-jacente. Un traitement complet de la DE qui se concentre sur tous les facteurs contributifs peut être plus efficace que la gestion pharmaceutique et peut améliorer certains aspects de la santé psychologique et physique au-delà des problèmes érectiles.
La dysfonction érectile se produit à partir de mécanismes multifactoriels et complexes impliquant les systèmes nerveux, vasculaire et endocrinien. Un examen de base de l'anatomie et de la physiologie des érections fournira un cadre pour comprendre la physiopathologie et la justification des options de traitement (Figure 1). La structure du pénis se compose de deux cylindres de tissu vasculaire (corps caverneux) qui parcourent la longueur de la tige du pénis avec le corps spongieux entourant l'urètre. Le tissu pénien est innervé par les aspects autonomes (sympathiques et parasympathiques) et somatiques (sensoriels et moteurs) du système nerveux périphérique. Les nerfs sympathiques proviennent de T11 – L2 et sont anti-érectiles, contrôlant l'éjaculation et la détumescence. Les nerfs parasympathiques proviennent de S2 – S4 et sont pro-érectiles. Les nerfs sympathiques et parasympathiques fusionnent pour former des nerfs caverneux qui pénètrent dans les corps caverneux, le corps spongieux et le gland du pénis, régulant le flux sanguin pendant l'érection. Le nerf pudendal procure une sensation à l'ensemble du bassin et une fonction motrice à tous les sphincters, le plancher pelvien et les muscles rigides.
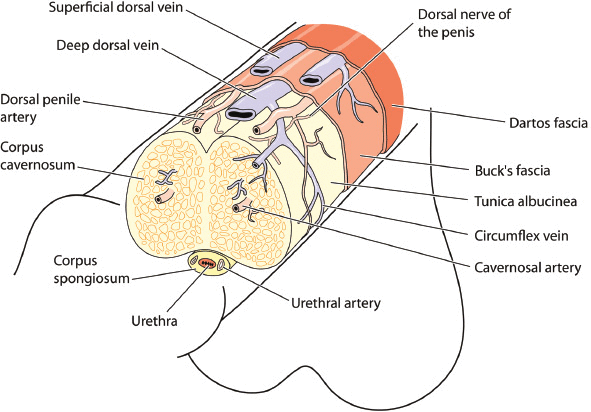
Figure 1:
Anatomie du pénis montrant les principales structures, vaisseaux sanguins et nerfs.
Les artères pudendales internes fournissent le flux sanguin vers le pénis, se ramifiant dans les artères bulbo-urétrales, dorsales et caverneuses. L'artère bulbo-urétrale traverse le fascia profond du pénis (Buck), alimentant le bulbe du pénis et l'urètre du pénis. L'artère dorsale se déplace entre le nerf dorsal et la veine dorsale profonde, dégageant des branches circonflexes qui accompagnent les veines circonflexes avec des branches terminales dans le gland. L'artère pénienne ou caverneuse profonde pénètre dans le corps caverneux au niveau des crus et s'étend sur toute la longueur de la tige du pénis, alimentant les artères d'hélicine spécialisées.
La stimulation sexuelle déclenche les nerfs parasympathiques pour libérer l'acétylcholine. À l'intérieur des cellules endothéliales qui tapissent les artères péniennes, l'oxyde nitrique synthase (NOS) catalyse l'oxydation de la L-arginine en oxyde nitrique (NO) et en L-citrulline. Le NO active la guanylate cyclase dans les corps caverneux et spongieux, ce qui à son tour augmente la guanosine monophosphate cyclique (GMPc) conduisant à la relaxation des muscles lisses vasculaires, à la vasodilatation et à l'augmentation du flux sanguin. Le remplissage et l'expansion rapides du système sinusoïdal provoquent le piégeage du sang par l'occlusion des plexus veineux et la tunique albuginée, entraînant une occlusion presque totale de l'écoulement veineux. La pression intracaverneuse atteint 100 mmHg à l'érection complète. Les muscles ischiocaverneux compressent la caverneuse remplie de sang lorsque les muscles périnéaux se contractent, entraînant une pression finale atteignant plusieurs centaines de mmHg. Après l'éjaculation, la libération des neurotransmetteurs cesse en raison de l'excitation des nerfs sympathiques et les enzymes de la phosphodiestérase décomposent le cGMP conduisant à la détumescence et à la flaccidité (Figure 2).
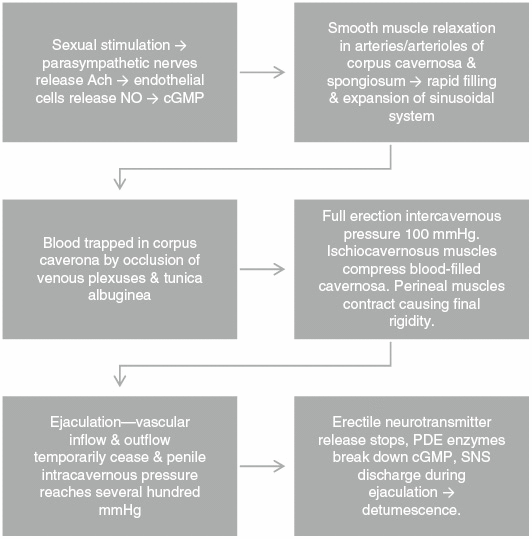
Figure 2:
Physiologie des érections.
Ach, acétylcholine; cGMP, guanosine monophosphate cyclique; NON, oxyde nitrique; PDE, phosphodiestérase; SNS, système nerveux sympathique.
Une évaluation approfondie de la DE nécessite un historique complet, l'utilisation de questionnaires validés, un examen physique et des travaux de laboratoire. L'imagerie, comme l'échographie Doppler duplex, l'artériographie du pénis et l'IRM, doit être réalisée par un urologue et réservée à une éventuelle intervention chirurgicale.
HISTOIRE
Prendre un historique complet offre la possibilité d'identifier toutes les causes / facteurs contributifs liés à la dysfonction érectile. En ce qui concerne les facteurs psychosociaux, il est impératif de poser des questions sur les facteurs de stress actuels et les problèmes relationnels.
L'image de soi génitale et les attentes en matière de fréquence sexuelle sont souvent des sujets négligés lors de la prise d'une histoire sexuelle, mais affectent considérablement les performances sexuelles. Les résultats du développement et de la validation de l'échelle de l'auto-image génitale masculine (MGSIS) qui a évalué les hommes âgés de 18 à 60 ans ont révélé que les hommes avec une meilleure image de soi génitale rapportaient moins de DE et 20% des hommes étaient insatisfaits de la taille de leur pénis.3 Les hommes qui ont une image de soi génitale négative peuvent se demander comment leur taille de pénis se compare aux autres hommes. Les données d'Alfred Kinsey sur 2500 hommes ont rapporté une longueur de pénis flasque moyenne de 1 à 4 pouces et un pénis en érection moyen de 5 à 6.5 pouces. Fait intéressant, les hommes avaient tendance à sous-estimer la taille de leur pénis par rapport à la mesure réelle.4
Discuter des attentes concernant la fréquence de l'activité sexuelle est pertinent pour les hommes ayant une faible libido, des sentiments d'insuffisance sexuelle ou une curiosité quant à leur fréquence sexuelle par rapport aux autres hommes. Les statistiques sur la fréquence des rencontres sexuelles sont limitées. Une enquête AARP auprès de 1670 hommes et femmes de plus de 45 ans a indiqué que 41% des hommes dans la cinquantaine, 50% des hommes dans la soixantaine et 24% des hommes dans la soixantaine ont des relations sexuelles au moins une fois par semaine (recadrage de ces statistiques - 60% des hommes dans la cinquantaine, 15% dans la soixantaine et 70% des hommes dans la soixantaine ont des relations sexuelles moins d'une fois par semaine).5 La Société internationale de médecine sexuelle (ISSM), qui rapporte les résultats de l'Enquête nationale de 2010 sur la santé et le comportement sexuels du Kinsey Institute, a noté qu'un peu moins de la moitié des hommes mariés âgés de 25 à 49 ans avaient des relations sexuelles quelques fois par mois ou chaque semaine, ce qui était le taux le plus élevé dans toutes les catégories d'âge.6 Une autre étude publiée par l'ISSM auprès des hommes et des femmes de plus de 50 ans a rapporté que seulement 20 à 30% des hommes et des femmes restent sexuellement actifs jusqu'à 80 ans.7
L'utilisation de la pornographie est un sujet qui peut être inconfortable pour les médecins de discuter avec leurs patients masculins. Bien que le diagnostic de dépendance à la pornographie soit controversé, il existe de plus en plus de preuves établissant un lien entre l'utilisation fréquente de pornographie et un impact sur la satisfaction sexuelle en couple, le bonheur conjugal et relationnel et les dysfonctionnements sexuels, notamment une faible libido et une dysfonction érectile.8-11 La pornographie sur Internet offre une nouveauté illimitée et un format vidéo à la demande qui peut conditionner l'excitation sexuelle, ce qui rend difficile la transition des hommes vers des partenaires réels.12 Aucun outil de dépistage validé pour identifier les difficultés liées à la pornographie, y compris la DE, n'a été développé. Après avoir posé des questions sur la fréquence d'utilisation de la pornographie, les fournisseurs de soins de santé devraient s'enquérir de la capacité à obtenir et à maintenir une érection pendant les relations sexuelles et la masturbation en couple sans utilisation ou rappel de pornographie. Si l'utilisation ou le rappel d'images pornographiques est nécessaire pour produire une érection adéquate, la dysfonction érectile induite par la pornographie peut être un problème.
QUESTIONNAIRES VALIDÉS
Les questionnaires validés sont utiles pour le dépistage de la dysfonction érectile. Le questionnaire le plus couramment utilisé en milieu clinique et dans les recherches publiées est l'indice international de la fonction érectile (IIEF-15) en 15 éléments, validé en 32 langues.13 Une version plus courte, le IIEF-5, ou le questionnaire de l'inventaire de la santé sexuelle des hommes (SHIM) peut également être utile pour le diagnostic et pour contrôler l'efficacité du traitement.14,15
EXAMEN PHYSIQUE
L'examen physique doit inclure un examen du pénis et des testicules, éventuellement la force musculaire du plancher pelvien (via des tests numériques), la pression artérielle, des signes de maladie cardiovasculaire, la taille, le poids et le tour de taille.
TRAVAIL
Sur la base de l'historique et de l'examen physique, les tests de laboratoire peuvent inclure des panels métaboliques et lipidiques complets, de l'insuline à jeun, de l'hémoglobine A1C, des marqueurs inflammatoires tels que le hsCRP, la testostérone totale et libre, des tests thyroïdiens et, chez les hommes plus jeunes suspectés d'hypogonadisme, l'hormone lutéinisante et la prolactine .
Les causes et les facteurs contributifs de la dysfonction érectile peuvent se chevaucher. Ceux-ci incluent les problèmes psychosociaux, les problèmes neurologiques, l'utilisation excessive de pornographie, les troubles endocriniens, les effets secondaires des médicaments et les changements vasculaires.
PSYCHOGÈNE
Un stress important, des difficultés relationnelles, la dépression, l'anxiété et le trouble de stress post-traumatique peuvent tous contribuer à la DE. L'anxiété de performance, décrite pour la première fois par Masters et Johnson en 1970,16 est une incapacité à obtenir une érection en raison des expériences passées avec ED. La dysfonction sexuelle, en particulier la dysfonction érectile et la diminution du désir sexuel, sont considérablement augmentées chez les vétérans de sexe masculin souffrant de trouble de stress post-traumatique.17 La dysfonction érectile psychogène se produit généralement lors de relations sexuelles en couple avec une fonction érectile normale pendant la masturbation. Le début peut être brusque, coïncidant avec un stress tel que la perte d'emploi, la mort d'un parent ou des problèmes financiers. Les érections nocturnes ou matinales sont souvent normales.
NEUROLOGIQUE
Le système limbique, y compris l'amygdale; hippocampe; et le gyri denté et cingulé, est l'une des plus anciennes zones du cerveau communes à tous les mammifères. Cette région du cerveau régule les émotions et tente d'éviter la douleur et de rechercher le plaisir. La recherche suggère que des stimuli visuels sexuellement agréables activent l'amygdale et l'hypothalamus plus chez les hommes que chez les femmes.18 L'apport de l'amygdale se déplace vers le striatum ventral, une partie importante des noyaux gris centraux qui fonctionne dans le cadre du système de récompense. Le noyau accumbens dans le striatum ventral contient une grande concentration de neurones dopaminergiques et est considéré comme le centre de plaisir du cerveau. La signalisation de la dopamine joue un rôle central dans l'excitation sexuelle et la motivation. L'activation des récepteurs de la dopamine dans les nerfs parasympathiques lombo-sacrés de la moelle épinière facilite les érections.19
Des conditions qui perturbent la signalisation ou la neurotransmission de la dopamine, ou qui peuvent endommager le système nerveux central, par exemple, la maladie de Parkinson, la sclérose en plaques, le diabète ou un accident vasculaire cérébral, peuvent également provoquer une dysfonction érectile. Une lésion du nerf caverneux lors d'une prostatectomie radicale entraîne une DE chez plus de 50% des hommes.20 Le vélo à longue distance peut comprimer le nerf pudendal et les vaisseaux sanguins entre la selle et la symphyse pubienne, limitant le flux sanguin et l'oxygène vers le pénis.21,22 Les cyclistes peuvent éprouver une ED temporaire et un engourdissement génital; cependant, ils peuvent ne pas présenter un plus grand risque de dysfonction érectile. Les résultats d'une récente enquête auprès de 5000 XNUMX hommes sportifs ont montré que les cyclistes étaient tout aussi susceptibles de souffrir de dysfonction érectile que les nageurs et les coureurs.23
UTILISATION DE LA PORNOGRAPHIE
Bien que l'utilisation de la pornographie puisse être considérée comme socialement acceptable et normale, les risques pour la santé d'une utilisation fréquente ne sont pas connus. La pornographie sur Internet offre une nouveauté visuelle illimitée illustrant l'effet Coolidge, un phénomène biologique observé chez les animaux mâles lorsqu'ils présentent un intérêt renouvelé s'ils sont introduits auprès de différents partenaires sexuels réceptifs.24 Cela offre un avantage évolutif possible permettant à un mâle de féconder plusieurs femelles. De nouveaux stimuli visuels sexuels provoquent une excitation plus forte, des érections plus fermes et une éjaculation plus rapide avec une production de sperme et de sperme plus mobile.25-27
Une utilisation excessive de la pornographie sur Internet peut influencer la neuroplasticité.28 Toutes les drogues d'abus et les dépendances comportementales, telles que les jeux sur Internet et la consommation excessive de nourriture, affectent la voie mésolimbique de la dopamine et le noyau accumbens.29 La nouveauté favorise les poussées de dopamine dans le noyau accumbens, déclenchant la libération de la protéine de liaison des éléments de réponse à l'AMPc (CREB). Le CREB régule l'expression des gènes de la dynorphine, une protéine qui ralentit la libération de dopamine, amortissant le système de récompense.30 On pense que c'est la base moléculaire de la tolérance, car des quantités accrues de médicament ou de comportement sont nécessaires pour surmonter des quantités accrues de CREB. En cas d'abstinence, la réduction de la dopamine favorise l'anhédonie, créant potentiellement une dépendance à la drogue ou au comportement.
En plus du CREB, DeltaFosB est libéré avec des inondations répétées de dopamine du noyau accumbens. DeltaFosB favorise le renforcement positif du comportement addictif en supprimant la libération de dynorphine et en augmentant la sensibilité au médicament ou au comportement. DeltaFosB persiste pendant une période relativement longue, ce qui a amené certains spécialistes de la toxicomanie à l'appeler le «commutateur moléculaire de la toxicomanie».31 Ce mécanisme explique comment l'utilisation répétée de la pornographie, comme d'autres substances provoquant une dépendance, provoque une désensibilisation et une régulation négative des récepteurs de la dopamine, ce qui configure l'utilisateur pour un cycle de fringales, d'envie et d'érosion de la volonté.32
ENDOCRINE
En plus d'être nécessaire au développement et à la croissance du pénis et à l'amélioration de la libido, la testostérone régule la physiologie érectile par plusieurs mécanismes. La testostérone favorise la structure, l'intégrité et la fonction nerveuses saines, en particulier du nerf caverneux.33 Des études animales et humaines suggèrent que la testostérone améliore l'expression des gènes de l'oxyde nitrique synthase et la production de NO dans les artères péniennes, nécessaires à la vasodilatation.34,35 La testostérone module probablement l'activité PDE5 comme en témoignent les études animales montrant une régulation à la hausse de l'expression de PDE5 avec une supplémentation en testostérone.36,37
De faibles niveaux de testostérone libre et biodisponible (mais pas total) sont associés à la dysfonction érectile.38 Bien que le niveau de testostérone nécessaire pour atteindre et maintenir des érections soit inconnu, une quantité minimale semble être nécessaire pour la fonction érectile.39,40 La supplémentation en testostérone peut ne pas améliorer la DE chez tous les hommes; cependant, certaines études ont montré que le traitement à la testostérone peut être utile et permettre aux inhibiteurs de la PDE-5 de mieux fonctionner.41,42
Certains auteurs ont documenté des niveaux élevés d'estradiol chez les hommes ou un rapport élevé estradiol / testostérone associé à la dysfonction érectile.43-45 Les inhibiteurs de l'aromatase empêchent la conversion de la testostérone en œstradiol et peuvent augmenter la testostérone totale et biodisponible chez les hommes âgés souffrant d'hypogonadisme léger tout en abaissant légèrement les taux d'estradiol.46 Actuellement, il n'y a aucune preuve que l'inhibition de l'aromatase améliore la fonction sexuelle et aucune littérature ne soutient l'utilisation des inhibiteurs de l'aromatase pour l'hypogonadisme.47 De plus, certaines études ont montré que le rapport entre l'estradiol et la testostérone n'est pas lié à la fonction érectile ou au désir sexuel.48,49
Une sécrétion élevée de prolactine est une cause rare de faible testostérone et DE. Cela peut être dû à une tumeur hypophysaire (prolactinome), à la marijuana ou à des médicaments tels que les amphétamines, les bloqueurs H2, la rispéridone, les ISRS, les inhibiteurs de la MAO et certains antidépresseurs tricycliques. La prolactine ne doit être mesurée qu'en cas de faible désir sexuel, de gynécomastie et / ou de taux de testostérone totale inférieurs à 4 ng / mL (400 ng / dL).50
L'hypothyroïdie et l'hyperthyroïdie peuvent toutes deux entraîner une DE et la DE est plus fréquente chez les hommes atteints de dysthyroïdie que chez les témoins.51 Le traitement de l'hypothyroïdie et de l'hyperthyroïdie peut améliorer la DE.52 Par conséquent, le dépistage de la dysfonction thyroïdienne chez les hommes présentant une dysfonction érectile est recommandé.
VASCULAIRE
Une santé vasculaire optimale est primordiale pour atteindre et maintenir des érections. La dysfonction vasculaire provoque 70 à 80% de la dysfonction érectile non psychogène chez les hommes plus âgés. Étant donné que l'athérosclérose des artères coronaires, carotides, cérébrales ou périphériques ne peut provoquer des symptômes qu'à l'état avancé, la dysfonction érectile peut être le premier signe d'une maladie vasculaire généralisée.53,54 Dans l'essai sur le cancer de la prostate et la prévention, près de 10,000 1994 hommes randomisés dans le bras placebo ont été évalués tous les trois mois et suivis pour la dysfonction érectile et les maladies cardiovasculaires de 2003 à XNUMX. La dysfonction érectile était un facteur de risque pour les événements cardiovasculaires futurs aussi important que le tabagisme et les crises cardiaques.55 La présence de DE peut également être un prédicteur de mortalité toutes causes confondues.56 ED partage les mêmes facteurs de risque que les maladies cardiovasculaires - hypertension artérielle, manque d'exercice, mauvaise alimentation, tabagisme, diabète et hyperlipidémie. Le mécanisme sous-jacent de la DE vasculaire est lié à une dysfonction endothéliale.57,58 La régulation de la vasodilatation est fonction de l'oxyde nitrique (NO) libéré par les cellules endothéliales. NO déclenche la production de GMPc provoquant une relaxation des muscles lisses et une vasodilatation des artères dans le corps caverneux. La dysfonction endothéliale augmente le risque de dysfonction érectile, indépendamment des preuves cliniques de maladie cardiovasculaire.59,60
EFFETS SECONDAIRES DES MÉDICAMENTS
De nombreux agents pharmaceutiques peuvent contribuer à la dysfonction érectile en affectant les neurotransmetteurs, les hormones, la fonction nerveuse ou la circulation sanguine. Bien qu'ils ne soient pas une liste exhaustive, les coupables courants comprennent les antidépresseurs (en particulier les ISRS tels que la fluoxétine, la sertraline, le citalopram), les anxiolytiques, les dépresseurs du SNC et les myorelaxants (lorazépam, cyclobenzaprine). Les diurétiques (HCTZ, spironolactone, triamtérène, furosémide) et les antihypertenseurs et les bêta-bloquants (clonidine, énalapril, métoprolol) contribuent également couramment à l'ED.
Il est important d'élaborer un plan de traitement complet pour la dysfonction érectile, car il est susceptible d'être plus efficace que d'utiliser un seul agent pour traiter uniquement les symptômes.
CONSEIL PSYCHOSEXUEL
L'orientation vers une thérapie cognitivo-comportementale, une gestion du stress ou une thérapie de couple peut être appropriée pour certains hommes atteints de DE. La relation causale entre la dépression et la DE n'est pas claire et probablement bidirectionnelle.61 En fait, un essai contrôlé randomisé (ECR) portant sur 152 hommes souffrant de dépression et de DE concomitante à légère à modérée a montré une amélioration de l'humeur chez les hommes recevant du sildénafil lorsque leur DE s'est améliorée.62 La dysfonction érectile causée par l'anxiété ou la dépression de la performance est mieux traitée avec une thérapie cognitivo-comportementale individuelle, des conseils relationnels ou en travaillant avec un sexologue agréé. Il existe également des preuves que la thérapie de groupe peut améliorer la fonction érectile. Une revue Cochrane de 11 essais cliniques (dont neuf randomisés) a conclu que la thérapie ciblée par groupe sexuel était plus efficace que l'absence de traitement pour la DE. Une méta-analyse d'essais comparant la thérapie de groupe plus le citrate de sildénafil par rapport au sildénafil seul, a révélé que les hommes qui ont reçu une thérapie de groupe plus le sildénafil ont montré une amélioration significative de la réussite des rapports sexuels et étaient moins susceptibles que ceux qui ne recevaient que du sildénafil d'abandonner. La thérapie de groupe a également considérablement amélioré la DE par rapport au citrate de sildénafil seul.63
RECONDITIONNEMENT À PARTIR D'UNE UTILISATION EXCESSIVE DE PORNOGRAPHIE
Pour inverser la dysfonction érectile attribuée à une utilisation fréquente de la pornographie, le patient doit éliminer toute pornographie, substituts de pornographie, rappel de pornographie et essentiellement toute stimulation sexuelle artificielle. Cela permet de reconditionner l'excitation sexuelle et la capacité érectile avec des partenaires de la vie réelle. Bien que le moment de «redémarrer» le cerveau en évitant la pornographie soit inconnu, l'expert en toxicomanie pornographique Gary Wilson suggère une expérience clinique et les forums en ligne montrent une récupération plus rapide pour les hommes de plus de 50 ans, suggérant que 2 mois est typique.64 Les jeunes hommes peuvent avoir besoin de plus de temps, peut-être jusqu'à 5 mois, avec la théorie selon laquelle leur utilisation de la pornographie sur Internet a commencé à un plus jeune âge. L'excitation sexuelle est conditionnée, en particulier pendant l'enfance et l'adolescence, et peut être plus forte chez les hommes que chez les femmes.65-67
THÉRAPIE PHYSIQUE
Les muscles du plancher pelvien qui jouent un rôle dans le maintien des érections s'affaiblissent avec l'âge. La physiothérapie pour renforcer les muscles bulbocaverneux et ischiocaverneux et le tissu conjonctif peut traiter efficacement la dysfonction érectile chez certains patients. Dans une étude randomisée et contrôlée, 40 hommes atteints de dysfonction érectile ont appris à rétracter le pénis au maximum et à lever leur scrotum deux fois par jour en position debout, assise et couchée, et à resserrer les muscles de leur plancher pelvien après avoir uriné. Les résultats étaient surprenants - à 6 mois, 40% des participants ont retrouvé une fonction érectile normale et 35% ont montré une certaine amélioration; 66% des hommes ont également signalé une diminution du dribble après la miction. Une technique plus simple peut être d'enseigner aux patients masculins l'exercice de Kegel en leur faisant arrêter l'urine en cours de route pour identifier les muscles qui seront nécessaires pour effectuer l'exercice. Ces muscles doivent être contractés pendant 5 secondes, 10 à 20 fois de suite, trois fois par jour. Les hommes peuvent être incités à effectuer des exercices de renforcement du plancher pelvien ou de Kegel en raison d'une possible amélioration de la qualité de l'orgasme, un effet secondaire courant qu'Arnold Kegel, MD a documenté il y a plusieurs décennies chez les femmes qui pratiquaient des Kegels fréquentes.68
DISPOSITIF DE CONSTRICTION SOUS VIDE
Le dispositif de constriction du vide (VCD), communément appelé «pompe à pénis», a été conçu par Geddings Osbon en 1974.69 Osbon l'a qualifié de «dispositif équivalent pour les jeunes» et a affirmé l'utiliser personnellement pendant 20 ans sans échec. Le premier dispositif de constriction sous vide a été approuvé par la FDA pour ED en 1982.
Le VCD agit en augmentant le flux sanguin vers le pénis en générant une pression négative de 110–225 mmHg (manuellement ou par pompe à piles) et en empêchant l'écoulement veineux avec un anneau de constriction. Des études suggèrent qu'environ 55 à 70% des hommes peuvent obtenir des érections adéquates avec des VCD.70, 71 Certains hommes rapportent que l'érection obtenue à partir d'un VCD a tendance à être violacée, froide ou engourdie, et les effets secondaires comprennent des ecchymoses sur la tige du pénis et le piégeage de l'éjaculation pendant l'orgasme de la bande de constriction. L'anneau de constriction ne doit pas être laissé en place pendant plus de 30 minutes en raison du risque d'ischémie.
ALIMENTATION, EXERCICE ET PERTE DE POIDS
La recherche d'aphrodisiaques pour stimuler la libido et améliorer les performances sexuelles remonte à l'Antiquité. En effet, le mot aphrodisiaque vient de la déesse grecque de l'amour, Aphrodite, qui est née de la mer et amenée à terre dans une coquille Saint-Jacques ou une huître. Bien que les huîtres contiennent de grandes quantités de zinc nécessaires à la production de testostérone, il n'a pas été démontré que les manger améliore la libido ou la capacité érectile.
Cependant, certains aliments améliorent la santé vasculaire et peuvent donc améliorer la fonction érectile. Par exemple, les aliments riches en nitrates comme les betteraves et les légumes-feuilles augmentent les niveaux d'oxyde nitrique, favorisent la fonction endothéliale normale et abaissent la pression artérielle.72-74 Les graines et le jus de grenade améliorent également la fonction endothéliale et abaissent la tension artérielle tout en diminuant les LDL oxydés et glyqués, minimisant ainsi la formation de plaques athérosclérotiques et atténuant l'épaisseur et la rigidité de la paroi artérielle.75-78 Le sirop de maïs et les boissons gazeuses riches en fructose augmentent le risque de développer un syndrome métabolique, l'athérosclérose, le diabète et la dysfonction érectile.79 De plus, les aliments avec des produits finaux à glycation avancée tels que le bacon, les hamburgers de restauration rapide, les hot-dogs, le fromage, la pizza et les aliments frits contribuent au diabète, aux maladies cardiovasculaires et à la dysfonction érectile.80-82 Plutôt que de se concentrer sur l'évitement d'aliments spécifiques, il peut être plus avantageux pour les patients souffrant de dysfonction érectile d'adopter un régime méditerranéen avec une consommation abondante de légumes, de fruits, d'huile d'olive extra vierge, de grains entiers, de noix et de poisson et une consommation modérée de vin. Les preuves de quatre essais cliniques suggèrent que le régime et le mode de vie méditerranéens influencent positivement la fonction sexuelle,83,84 ainsi que de réduire l'inflammation et de retarder la dysfonction sexuelle chez les hommes diabétiques.
Il y a peu de débat sur le fait que l'exercice améliore plusieurs facteurs de risque qui contribuent à la dysfonction érectile, notamment la réduction de l'inflammation, l'amélioration de la fonction endothéliale, la promotion de la sensibilité à l'insuline, l'amélioration des lipoprotéines et l'amélioration de la perte de graisse viscérale.85-89 Une revue systématique et une méta-analyse récentes confirment qu'un exercice d'intensité modérée à vigoureuse pendant au moins 8 semaines peut améliorer la DE.90
La graisse corporelle excessive et insuffisante est associée à la DE. Par exemple, l'étude Hallym Aging a mesuré le pourcentage de graisse corporelle et sa relation avec la DE chez les hommes coréens.91 Les hommes ayant la graisse corporelle la plus faible et la plus élevée étaient plus susceptibles d'avoir une DE. L'obésité centrale est associée au syndrome métabolique, à un dysfonctionnement vasculaire et à une faible testostérone, qui contribuent tous au développement de la dysfonction érectile.92,93 Les tissus adipeux sécrètent plus de 35 hormones et cytokines, dont presque toutes favorisent l'inflammation, la résistance à l'insuline et, éventuellement, les maladies vasculaires.94,95 L'inflammation semble être un acteur clé dans la cause de la dysfonction érectile. Les hommes obèses atteints de DE présentent des niveaux plus élevés de marqueurs inflammatoires (IL-6, IL-9, IL-18 et CRP) et une fonction endothéliale altérée que les hommes obèses sans DE.96
La perte de poids peut améliorer considérablement la fonction érectile. Dans un ECR, les hommes obèses qui ont perdu en moyenne 33 livres sur 2 ans ont amélioré leurs performances sexuelles.97 ED a amélioré dans plus de 30% du groupe de perte de poids par rapport à 5% des témoins. Le groupe d'intervention a reçu des conseils nutritionnels, des conseils pour augmenter l'activité physique à environ 3 heures par semaine et des réunions mensuelles ou bimensuelles. Outre une perte de poids moyenne de 15%, les hommes du groupe d'intervention ont également montré une réduction des marqueurs inflammatoires IL-6 et hsCRP, améliorant leur profil de risque cardiométabolique.
BOTANIQUES ET ACIDES AMINÉS
L'utilisation de plantes, de nutriments et d'autres thérapies naturelles pour augmenter les performances sexuelles a considérablement augmenté en raison du marketing Internet. Peu de thérapies naturelles ont fait l'objet d'essais cliniques humains pour soutenir l'innocuité et l'efficacité. Cependant, les plantes et acides aminés suivants peuvent être utiles dans le traitement de la dysfonction érectile, en particulier pour les hommes qui préfèrent ne pas utiliser de médicaments PDE5i.
Pausinystalia yohimbe
Le yohimbe est un arbre à feuilles persistantes originaire d'Afrique centrale qui contient trois alcaloïdes: la rauwolscine, la corynanthine et la yohimbine. Le constituant le plus actif de la yohimbe, la yohimbine, est un produit pharmaceutique doté d'un mécanisme d'action bien défini en tant qu'antagoniste de l'α présynaptique1 et α2-récepteurs adrénergiques et 5-HT (1B) et agoniste partiel des récepteurs 5-HT (1A).98 Les méta-analyses suggèrent que la yohimbine est efficace pour la DE99,100 La yohimbine peut également aider à retarder la capacité ou l'incapacité d'éjaculer.101 La posologie est de 15 à 30 mg, jusqu'à 100 mg par jour. Le yohimbe peut être mieux livré à la demande, car son début est rapide, en 10 à 15 minutes, avec une demi-vie de 35 minutes. La yohimbine pénètre dans le système nerveux central avec des effets secondaires possibles, y compris la tachycardie, l'hypertension, l'irritabilité et l'anxiété. La transpiration, les nausées, les étourdissements, les maux de tête et les bouffées de chaleur sont également courants. Comme pour tous les végétaux, de nombreuses marques de suppléments en vente libre peuvent ne pas être fiables. Une étude testant 49 marques de yohimbe a révélé une variabilité considérable de la quantité de yohimbine - 0 à 12.1 mg - par portion avec 19 marques ne contenant pas de rauwolscine et de corynanthine, suggérant qu'elles provenaient d'extrait végétal hautement transformé ou d'origine synthétique.102
Tribulus terrestris
T. terrestris pousse en Europe, en Asie, en Afrique et au Moyen-Orient. La racine et le fruit ont une utilisation à long terme en médecine chinoise et ayurvédique. On prétend souvent que Tribulus améliore la production de testostérone; cependant, les essais cliniques n'ont pas soutenu cette hypothèse, sauf dans l'utilisation intraveineuse chez les primates.103-106 Des études animales ont montré que Tribulus peut améliorer la fonction érectile et la production de NO.107,108 Un ECR de 180 hommes atteints de DE légère à modérée utilisant 500 mg de T. terrestris pris trois fois par jour a rapporté une amélioration de la libido, ED, la satisfaction des rapports sexuels et la qualité de l'orgasme. Aucun effet indésirable n'a été signalé.109
Eurycoma longifolia
Eurycoma longifolia, connue sous le nom de ginseng malaisien ou Tongkat Ali, est une plante à fleurs originaire d'Indonésie, de Malaisie, de Thaïlande, du Vietnam, du Laos et de l'Inde. Une méta-analyse des ECR suggère E. longifolia améliore considérablement ED.110 De plus, une revue chinoise des études publiées suggère E. longifolia améliore le volume de sperme, la libido et la testostérone.111 La plante peut avoir une capacité adaptogène, et il a été démontré qu'elle réduit la fatigue, améliore le bien-être, réduit le cortisol et augmente la testostérone chez les sujets stressés.112 Pris comme un extrait de racine d'eau, Eurycoma semble sûr sans effets secondaires significatifs. La posologie suggérée est de 200 à 300 mg une ou deux fois par jour, avec une forme brevetée normalisée à 22% d'eurypeptides et 40% de glycosaponines.
Epimedium spp.
Epimedium spp. poussent en Chine et en Corée et appartiennent à la famille des Berberidaceae (qui contient également les plantes botaniques bien connues, Mahonia aquifolium, Hydrastis canadensiset Berberis vulgaris). Au moins 50 espèces ont été identifiées et sont communément appelées «mauvaise herbe cornée de chèvre». L'ingrédient actif présumé, l'icariine, est un flavonoïde qui améliore la fonction érectile dans les études animales via l'inhibition de la PDE5 et l'induction de l'oxyde nitrique.113-115 - Essais cliniques humains sur Epimedium font défaut; par conséquent, les recommandations posologiques ne sont pas disponibles.
L-arginine
La L-arginine est un acide aminé, essentiel dans des conditions avec une augmentation de l'enzyme arginase, comme le diabète et l'insuffisance rénale.116,117 L'arginine est utilisée par les entérocytes et les hépatocytes intestinaux et convertie en L-citrulline ou L-ornithine. La variabilité de l'absorption de la L-arginine par voie orale est considérable - une dose de 6 g est absorbée à environ 68% alors qu'une dose de 10 g n'est absorbée qu'à 20%.118,119
L'oxyde nitrique est le sous-produit de la conversion de la L-arginine en citrulline. De plus, la supplémentation en citrulline augmente l'arginine plasmatique. L'arginine peut améliorer la DE à des doses élevées; par exemple, 5000 XNUMX mg améliorent la DE, surtout si les métabolites urinaires de NO sont faibles.120 Théoriquement, la L-arginine peut fonctionner mieux si les niveaux d'ADMA sont élevés. Étant donné que l'ADMA inhibe l'eNOS, l'enzyme endothéliale nécessaire à la production de NO, la supplémentation en L-arginine peut rétablir le rapport arginine / ADMA.121 La supplémentation en L-arginine peut être plus efficace pour la dysfonction érectile lorsqu'elle est associée à de la yohimbine ou du pycnogénol (écorce de pin de Pinus Pinaster).122-124 La supplémentation en L-arginine peut activer l'herpès et augmenter les épidémies. De plus, un ECR publié en 2013 a rapporté que 3000 mg de L-arginine pris 3 fois par jour augmentaient le risque de mortalité chez les patients atteints d'un IM récent.125
THÉRAPIES PHARMACOLOGIQUES
Les principales approches pharmacologiques de la DE sont les inhibiteurs de la PDE5, l'apomorphine et les thérapies par injection intracaverneuse.
Inhibiteurs de PDE5
Les inhibiteurs de la phosphodiestérase de type 5 (PDE5i) sont le traitement médicamenteux le plus courant pour la dysfonction érectile. Leur mécanisme d'action est bien connu, inhibant l'enzyme phosphodiestérase de type 5 qui décompose le cGMP, prolongeant efficacement l'activité NO dans les artères péniennes. Les médicaments de cette classe diffèrent dans leurs sélectivités pour les 11 isoenzymes PDE différentes. Cette réactivité croisée avec les isoenzymes PDE se trouve particulièrement dans les muscles lisses vasculaires, viscéraux et pulmonaires et contribue aux effets secondaires.126 Par exemple, le vardénafil et le sildénafil sont trois et sept fois plus susceptibles de se lier à la PDE6, une enzyme de la rétine qui transfère la lumière dans les influx nerveux. L'inhibition de cette enzyme provoque des troubles de la perception des couleurs appelés «chromatopsie».
Quatre médicaments PDE5i ont été approuvés par la FDA - le sildénafil en 1998, le vardénafil et le tadalafil en 2003 et l'avanafil en 2012. Aucun essai comparatif comparatif de l'efficacité de ces médicaments n'a été réalisé. Ces médicaments diffèrent par leur apparition, leur durée d'action et leurs effets secondaires.127 Le début du sildénafil et du vardénafil est de 30 à 60 minutes pour une durée de 10 à 12 heures. Le début du tadalafil est de 15 à 30 minutes selon la posologie, avec la durée la plus longue de 36 heures. Avanafil a le début le plus court, dans les 15 minutes, et la durée, environ 6 heures.
L'utilisation de PDE5i peut réduire le risque de cancer de la prostate, peut-être parce que les hommes qui les utilisent peuvent éjaculer plus fréquemment, ce qui protège contre le cancer de la prostate.128,129 À long terme sildénafil l'utilisation de citrate (Viagra) est associée à un risque légèrement accru de mélanome.130 Les effets secondaires les plus courants du PDE5i incluent des maux de tête chez jusqu'à 20% des hommes, des bouffées vasomotrices jusqu'à 15% et une dyspepsie et une congestion nasale jusqu'à 10%. Bien que rares, des étourdissements et un priapisme peuvent survenir. Tous les PDE5i sont contre-indiqués chez les hommes prenant des nitrates.
Apomorphine
L'apomorphine est utilisée depuis 1869 pour la maladie de Parkinson et a été étudiée pour son effet sur la fonction érectile. Bien que dérivée de la morphine, l'apomorphine ne contient pas de morphine ni ne se lie aux récepteurs opioïdes. Il a une affinité élevée pour les récepteurs de la dopamine et le mécanisme d'amélioration de la libido et des érections est probable via une affinité modérée pour les récepteurs D2 dans l'hypothalamus et le système limbique.131 Dans les essais cliniques humains de phase II et III portant sur 5000 3 hommes, 4 à 10 mg d'apomorphine sublinguale ont produit des érections suffisamment fermes pour pénétrer en 25 à 20 minutes, avec une amélioration d'environ 25 à XNUMX% par rapport au placebo.132,133 La seule apomorphine pharmaceutique brevetée aux États-Unis est Apokyn injectable, approuvée par la FDA pour faire progresser la maladie de Parkinson; cependant, l'apomorphine peut être composée comme une pastille sublinguale et peut être combinée avec une PDE5i. Des doses de 2 à 3 mg peuvent être aussi efficaces que celles de 4 à 6 mg sans effets secondaires tels que nausées, maux de tête ou vertiges. L'apomorphine ne doit pas être utilisée en association avec le chlorhydrate d'ondansétron, un antiémétique fréquemment prescrit, en raison d'une possible hypotension.
Injections intracaverneuses
Introduites en 1983, les injections intracaverneuses modulent la fonction endothéliale et sont très efficaces même chez les hommes atteints de dysfonction érectile sévère; l'alprostadil produit des érections chez jusqu'à 93% des hommes, avec une efficacité des mélanges bi, tri et quad jusqu'à 97.6%.134-136 L'alprostadil, 20 ou 40 μg de prostaglandine E1, est la seule injection intracaverneuse brevetée approuvée par la FDA, tandis que deux autres médicaments, la phentolamine et la papavérine, peuvent être ajoutés au PGE1 dans une formule composée. L'effet secondaire le plus courant de la PGE1 seule est la douleur chez 48.5% des hommes. Le bi-mélange, qui contient souvent 0.5 à 3.0 mg de phentolamine et 30 mg de papavérine, ne provoque pas de douleur mais peut ne pas être aussi efficace. Tri-mix, contenant généralement 5 à 10 μg (et jusqu'à 40 μg) de PGE1, 0.5 à 1.0 mg de phentolamine et 15 à 30 mg de papavérine, réduit la probabilité de douleur à 2.9%. L'ajout de 0.15 mg d'atropine en quad-mix, réservé aux hommes chez qui le tri-mix est inefficace, améliore significativement la douleur. La quantité de PGE1, bi-, tri- ou quad-mix nécessaire varie de 0.1 à 0.3 ml. Empirique (en utilisant PGE1 uniquement indépendamment de l'étiologie ou de la gravité de l'urgence, avec des ajustements de la posologie ou de la formule en fonction des résultats du patient) et en fonction du risque (en utilisant le bi-mélange, le tri-mélange ou le tri-mélange à haute dose basé sur un algorithme prenant en compte la DE étiologie et nombre de facteurs de risque de dysfonction érectile) les approches de dosage semblent être similaires en ce qui concerne l'efficacité et les taux de complications et de satisfaction.137 Les effets secondaires incluent la douleur au site d'injection, le priapisme et le développement de tissu cicatriciel ou la maladie de La Peyronie. Pour un excellent article examinant l'efficacité, les dosages et les effets secondaires des injections intracaverneuses, voir le résumé de Medscape «Algorithme d'injection intracaverneux» par Jeffrey Albaugh.138
THÉRAPIE PAR ONDES DE CHOC EXTRACORPORELLE À FAIBLE INTENSITÉ
L'onde de choc extracorporelle de faible intensité (LI-ESW) est née dans les années 1990, lorsque l'on a montré que l'échographie induisait l'angiogenèse dans les plaies de rat.139 LI-ESW utilise des ondes de choc, un type d'onde acoustique qui transporte l'énergie et induit des réactions biologiques lorsqu'elle est appliquée au tissu cible.140 La procédure varie en termes de densité de flux d'énergie, de fréquence (nombre d'impulsions par seconde en Hz) et de nombre total d'impulsions délivrées. Le mécanisme d'action pour l'amélioration de l'ED semble être la régénération des nerfs positifs de l'oxyde nitrique neuronal pénien (nNOS), une meilleure libération d'oxyde nitrique et la réparation des cellules musculaires lisses endothéliales et vasculaires via le recrutement de cellules souches mésenchymateuses.141 Le traitement peut également activer des cellules progénitrices péniennes locales.142 Actuellement, LI-ESW n'est pas approuvé par la FDA pour ED; cependant, de nombreux essais cliniques ont été réalisés avec un bon profil d'innocuité et un succès variable.
La première étude pilote ED publiée en 2010 a utilisé six sessions LI-ESW chez 20 hommes qui ne répondaient pas aux inhibiteurs de la PDE5 (PDE5i). Les résultats ont montré une amélioration de la fonction érectile, de la durée des érections et de la rigidité du pénis en 1 mois. Des améliorations ont été signalées pour un maximum de 6 mois de suivi.143 Plusieurs ECR ont rapporté des résultats positifs en utilisant LI-ESW. Dans un essai impliquant 67 hommes atteints de dysfonction érectile qui ont répondu au PDE5i, le bras de traitement a reçu 12 séances avec une amélioration de la fonction érectile et de l'hémodynamique du pénis observées chez environ 50% des hommes sans utiliser leur PDE5i.144 Dans un ECR similaire en Inde comprenant 135 répondeurs PDE5i traités en 12 séances, 78% des hommes traités ont pu obtenir des érections suffisamment fermes pour une pénétration sans médicament à 1 mois.145 Bien que ces résultats se soient maintenus à 1 an de suivi, il y avait un taux d'abandon très élevé comprenant 58% du simulacre et 42% des bras de traitement.
Les hommes qui ne répondent pas au PDE5i peuvent devenir des répondeurs après un traitement par LI-ESW. Dans une étude prospective ouverte à un seul bras portant sur 29 hommes ne répondant pas au PDE5i, 12 traitements ont permis à 72% des hommes d'obtenir des érections suffisamment fermes pour pénétrer avec un PDE5i.146 Dans un ECR plus récent comprenant 58 non-répondeurs PDE5i, 54% ont répondu à PDE5i après 1 mois de thérapie LI-ESW contre 0% dans le groupe factice.147
Une amélioration soutenue observée dans des études de suivi plus longues suggère que, après le traitement, certains hommes peuvent inverser la pathologie sous-jacente à l'origine de leur dysfonction érectile ou que LI-ESW peut fournir un certain degré de rééducation pénienne. Dans un ECR avec suivi à 6 mois de 112 hommes, qui ont tous reçu cinq séances de traitement depuis que le bras placebo a reçu un traitement actif à 10 semaines, à 6 mois, environ 20% du bras de traitement initial et 23% du bras traité initial le groupe placebo était toujours en mesure d'avoir des rapports sexuels sans médicament.148 Un autre suivi d'un an de 1 hommes plus âgés (âge moyen de 50 ans) présentant des facteurs de risque vasculaires, notamment le diabète, l'hypertension, la dyslipidémie et la coronaropathie, a révélé une amélioration durable de 65% de la gravité de la DE et de la qualité de l'érection autodéclarée.149
Le nombre de traitements LI-ESW pour un résultat idéal et la durée du traitement restent inconnus. Un récent ECR réalisé sur 126 hommes dans un hôpital danois a comparé les hommes qui ont reçu cinq contre dix séances à 6 et 12 mois; le traitement était efficace à environ 38% dans les deux groupes, ce qui suggère que des séances supplémentaires pourraient ne pas améliorer les résultats.150,151 Dans un suivi de 2 ans d'un essai ouvert de 156 hommes, 63% se sont améliorés à 4 semaines avec une efficacité de 53% maintenue à 2 ans.152 Sans surprise, les hommes atteints de dysfonction érectile sévère ont connu un échec antérieur. Tous les patients atteints de diabète et de dysfonction érectile sévère ont perdu l'effet, tandis que 76% des hommes atteints de dysfonction érectile légère et sans diabète ont conservé leur efficacité.
Le nombre d'études utilisant LI-ESWT pour ED a considérablement augmenté ces dernières années. Une revue narrative de la littérature publiée réalisée en 2013 a révélé que 60 à 75% des répondeurs PDE5i pouvaient obtenir des érections suffisamment fermes pour une pénétration sans médicament et 72% des non-répondeurs PDE5i sont devenus des répondeurs.153 Des méta-analyses récentes examinant 14 études, dont 7 ECR, ont montré que la thérapie LI-ESW est sûre et efficace, avec des résultats d'une durée d'au moins 3 mois.154 Les hommes atteints de dysfonction érectile légère ou modérée semblent avoir une meilleure réponse que les hommes souffrant de dysfonction érectile sévère, avec une densité de flux d'énergie, le nombre d'ondes de choc délivrées et la durée du traitement étroitement corrélée aux résultats.
INJECTION DE PRP ET DE CELLULES SOUCHES
L'injection de plasma riche en plaquettes (PRP) ou de cellules souches mésenchymateuses dans le corps caverneux promet d'améliorer la DE et de restaurer l'artère pénienne et la fonction nerveuse. Pour préparer le PRP, les plaquettes de sang anti-coagulé sont centrifugées dans une centrifugeuse et concentrées. Le PRP contient plus de 300 protéines bioactives, facteurs de croissance et molécules d'adhésion qui peuvent améliorer la cicatrisation des tissus et favoriser la régénération des tissus nerveux et vasculaires.155-157 Étant donné que le système vasculaire pénien est la région la plus riche en endothélium du corps d'un homme et que le flux sanguin dans le pénis flasque est plus lent par rapport à la circulation systémique (permettant une meilleure rétention), théoriquement, le PRP peut fournir des avantages dans le tissu pénien similaires aux améliorations observées dans les blessures orthopédiques .
Peu d'études pilotes de sécurité et de faisabilité utilisant le PRP pour la DE ont été publiées. Un essai humain mené en Italie a évalué 9 hommes atteints de DE qui ont reçu du PRP en plus d'une thérapie sous vide. Une légère amélioration a été observée avec le seul effet indésirable mineur d'une légère douleur et d'ecchymoses au site d'injection.158
Des niveaux réduits de cellules progénitrices endothéliales circulantes (EPC), un type de cellules souches nécessaires à la régénération de la muqueuse endothéliale vasculaire, est un facteur de risque indépendant de DE.159 Les EPC diminuent avec l'inflammation chronique observée dans le diabète, l'hypercholestérolémie, l'obésité, les maladies cardiovasculaires et le tabagisme.160 Des études animales suggèrent que la testostérone stimule la mobilisation de l'EPC à partir de la moelle osseuse et améliore l'angiogenèse.161,162 Deux revues d'études animales publiées impliquant des injections intracaverneuses de cellules souches dérivées de la moelle osseuse, du tissu adipeux et du muscle squelettique ont rapporté des résultats favorables sur la fonction endothéliale, musculaire lisse et nerveuse dans le tissu pénien.163,164
Le PRP et la thérapie par cellules souches peuvent aider les hommes souffrant de lésions vasculaires et nerveuses dues au diabète ou à une prostatectomie radicale. Quelques études pilotes humaines suggèrent que la procédure peut être sûre et efficace. Une étude a impliqué 11 hommes qui ont subi une prostatectomie radicale en raison d'un cancer de la prostate, avec ED résultant ne répondant pas à PDE5i.165 Des cellules souches dérivées de l'adipose autologue injectées dans le corps caverneux ont récupéré la fonction érectile chez huit des onze hommes sans effets indésirables. Dans une autre étude pilote utilisant des cellules souches de cordon ombilical humain non autologues, six hommes âgés sur sept atteints de diabète et de dysfonction érectile ne répondant pas à PDE5i, ont retrouvé des érections matinales au troisième mois, et deux sur sept étaient encore en mesure de réaliser une érection avec PDE5i après 6 mois. Fait intéressant, la glycémie a diminué 2 semaines après l'injection, les taux d'hémoglobine A1C se sont améliorés jusqu'à 4 mois et aucun effet indésirable n'a été observé. Des résultats positifs ont également été observés dans une étude pilote chez l'homme portant sur 12 hommes atteints de prostatectomie post-radicale sévère ED ne répondant pas à l'alprostadil, au PDE5i ou à un appareil à vide.166 Cet essai de phase I a utilisé des doses croissantes de cellules souches dérivées de moelle osseuse autologues. Des doses plus élevées étaient plus efficaces avec neuf hommes sur douze capables d'obtenir des érections suffisamment fermes pour pénétrer avec PDE5i; les avantages ont été maintenus à un an sans effets négatifs.
Alors que les injections de PRP et de cellules souches sont considérées comme expérimentales et manquent d'approbation par la FDA et de couverture d'assurance, les hommes peuvent rechercher des praticiens qui effectuent ces procédures. Les effets indésirables possibles incluent l'infection et le développement de tissu cicatriciel ou la maladie de La Peyronie. Théoriquement, les cellules souches peuvent également augmenter la tumorigenèse, bien que l'étendue de ce risque soit inconnue.167
La dysfonction érectile est un problème médical courant avec plusieurs facteurs et causes contributifs possibles qui se chevauchent souvent. La prise d'antécédents minutieux et approfondis, l'utilisation de questionnaires validés, un examen physique et un travail de laboratoire sont nécessaires pour élaborer un plan visant à améliorer les symptômes tout en s'attaquant aux causes sous-jacentes. Les options de traitement comprennent des modifications du régime alimentaire et du mode de vie, des exercices de physiothérapie, l'utilisation de dispositifs de constriction du vide, des compléments alimentaires à base de plantes et d'acides aminés, des médicaments, une thérapie par ondes de choc extracorporelle de faible intensité et éventuellement des injections intracaverneuses de plasma riche en plaquettes ou de cellules souches.
- Effectuer un historique complet, la documentation du questionnaire, l'examen, le travail de laboratoire pertinent
- Discutez des causes / facteurs contributifs:
- Psychogène
- Neurologique
- Utilisation excessive de pornographie
- Endocrine
- les effets secondaires des médicaments
- Changements vasculaires
- Passez en revue les options de traitement pertinentes:
- Conseil psychosexuel
- Abstinence pornographique
- Physiothérapie (Kegel) ou utilisation d'un dispositif de constriction du vide
- Changements diététiques
- Recommandation d'exercice
- Options de perte de poids
- Remèdes à base de plantes et acides aminés
- Médicaments:
- PDE5i: différents effets, durée d'action et effets secondaires
- Peut ou non être couvert par une assurance, peut être coûteux
- L'apomorphine, non approuvée par la FDA pour la DE, doit être mélangée
- PDE5i: différents effets, durée d'action et effets secondaires
- Onde de choc extracorporelle de faible intensité
- Non approuvé par la FDA pour l'urgence et le manque de couverture d'assurance
- Les données de sécurité sont bonnes, la plupart des études montrant des résultats positifs
- Peut nécessiter des traitements répétés
- Injections de PRP et de cellules souches
- Non recommandé en raison du manque d'essais randomisés et des problèmes de sécurité possibles
Aucun financement n'a été reçu pour la préparation et la rédaction de cet article.
- Feldman HA, Goldstein I, Hatzichristou DG, et al. L'impuissance et ses corrélats médicaux et psychosociaux: résultats de la Massachusetts Male Aging Study.
- McMahon CN, Smith CJ, Shabsigh R. Traitement de la dysfonction érectile lorsque les inhibiteurs de PDE5 échouent.
- Herbenick D, Schick V, Reece M, et al. L'élaboration et la validation de l'échelle de l'auto-image génitale masculine: résultats d'un échantillon probabiliste représentatif des hommes aux États-Unis.
- Gebhard P, Johnson A.
- Fisher L, Anderson G, Chapagain M, et al.
- Schick V, Herbenick D, Reece M, et al. Comportements sexuels, utilisation du préservatif et santé sexuelle des Américains de plus de 50 ans: implications pour la promotion de la santé sexuelle des personnes âgées.
- Berger J, Doan A, Kehoe J, et al. Enquête PD69-12 sur la fonction sexuelle et la pornographie.
- Zillmann D, Bryant J. L'impact de la pornographie sur la satisfaction sexuelle 1.
- Sun C, ponts A, Johnson JA, et al. Pornographie et scénario sexuel masculin: une analyse de la consommation et des relations sexuelles.
- Poulsen FO, Busby DM, Galovan AM. Utilisation de la pornographie: qui l'utilise et comment elle est associée aux résultats du couple.
- Perry SL. La visualisation de la pornographie réduit-elle la qualité du mariage au fil du temps? Preuve à partir de données longitudinales.
- Parc B, Wilson G, Berger J, et al. La pornographie sur Internet provoque-t-elle des dysfonctionnements sexuels? Un examen avec des rapports cliniques.
- Rosen RC, Riley A, Wagner G, et al. L'indice international de la fonction érectile (IIEF): une échelle multidimensionnelle pour l'évaluation de la dysfonction érectile.
- Rosen RC, Cappelleri JC, Smith MD, et al. Développement et évaluation d'une version abrégée de 5 éléments de l'Index international de la dysfonction érectile (IIEF-5) comme outil de diagnostic de la dysfonction érectile.
- Cappelleri JC, Rosen RC. L'inventaire de la santé sexuelle des hommes (SHIM): un examen quinquennal de la recherche et de l'expérience clinique.
- Bruce T, Barlow D. La nature et le rôle de l'anxiété de performance dans la dysfonction sexuelle. Dans: Leitenberg H, éd.
- Bentsen I, Giraldi A, Kristensen E, et al. Examen systématique de la dysfonction sexuelle chez les anciens combattants atteints de trouble de stress post-traumatique.
- Hamann S, Herman RA, Nolan CL, et al. Les hommes et les femmes diffèrent dans la réponse amygdale aux stimuli sexuels visuels.
- Simonsen U, Comerma-Steffensen S, Andersson KE. Modulation des voies dopaminergiques pour traiter la dysfonction érectile.
- Campbell J, Burnett A. Approches neuroprotectrices et régénératrices des nerfs pour le traitement de la dysfonction érectile après une lésion du nerf caverneux.
- Ricchiuti VS, Haas CA, Seftel AD, et al. Lésion du nerf pudendal associée à la bicyclette passionnée.
- Oberpenning F, Roth S, Leusmann DB, et al. Le syndrome d'Alcock: insensibilité temporaire du pénis due à la compression du nerf pudendal dans le canal d'Alcock.
- Awad MA, Gaither TW, Murphy GP, et al. Cyclisme et fonction sexuelle et urinaire masculine: résultats d'une vaste étude multinationale transversale.
- Ventura-Aquino E, Fernandez-Guasti A, Paredes R. Hormones et l'effet Coolidge.
- Koukounas E, Over R. Allocation des ressources attentionnelles pendant l'accoutumance et la déshabituation de l'excitation sexuelle masculine.
- Kim SC, Bang JH, Hyun JS, et al. Changements dans la réponse érectile à la stimulation sexuelle audiovisuelle répétée.
- Joseph P, Sharma R, Agarwal A, et al. Les hommes éjaculent de plus gros volumes de sperme, plus de spermatozoïdes mobiles et plus rapidement lorsqu'ils sont exposés à des images de nouvelles femmes.
- Volkow ND, Baler D. Science de la toxicomanie: découvrir la complexité neurobiologique.
- Love T, Laier C, Marque M, et al. Neuroscience de la dépendance à la pornographie sur Internet: un examen et une mise à jour.
- Nestler EJ, Barrot M, Self DW. DeltaFosB: un commutateur moléculaire durable pour la dépendance.
- Pichers KK, Frohmader KS, Vialou V, et al. Les récompenses naturelles et médicamenteuses agissent sur les mécanismes communs de plasticité neuronale avec ΔFosB comme médiateur clé.
- Traish A, Goldstein I, Kim N. Testostérone et fonction érectile: de la recherche fondamentale à un nouveau paradigme clinique pour la prise en charge des hommes souffrant d'insuffisance androgénique et de dysfonction érectile.
- Park KH, Kim SW, Kim KD, et al. Effets des androgènes sur l'expression des ARNm de l'oxyde nitrique synthase dans le corps caverneux du rat.
- Mikhail N. La testostérone a-t-elle un rôle dans la fonction érectile?
- Morelli A, Filippi S, Mancina R, et al. Les androgènes régulent l'expression et l'activité fonctionnelle de la phosphodiestérase de type 5 dans les corps caverneux.
- Zhang XH, Morelli A, Luconi M, et al. La testostérone régule l'expression de la PDE5 et la réactivité in vivo au tadalafil dans le corps caverneux du rat.
- Liao M, Huang X, Gao Y, et al. La testostérone est associée à la dysfonction érectile: une étude transversale chez les hommes chinois.
- Buena F, Swerdloff RS, Steiner BS, et al. La fonction sexuelle ne change pas lorsque les taux sériques de testostérone varient pharmacologiquement dans la gamme masculine normale.
- Armagan A, Kim NN, Goldstein I, et al. Relation dose-réponse entre la testostérone et la fonction érectile: preuve de l'existence d'un seuil critique.
- Jain P, Rademaker AW, McVary KT. Supplémentation en testostérone pour la dysfonction érectile: résultats d'une méta-analyse.
- Aversa A, Isidori AM, Spera G, et al. Les androgènes améliorent la vasodilatation caverneuse et la réponse au sildénafil chez les patients atteints de dysfonction érectile.
- Mancini A, Milardi D, Bianchi A, et al. Augmentation des niveaux d'estradiol dans le trouble occlusif veineux: un mécanisme fonctionnel possible de fuite veineuse.
- Wu F, Chen T, Mao S, et al. Les niveaux d'estradiol et de testostérone sont modifiés chez les hommes chinois souffrant de dysfonction sexuelle.
- Srilatha B, Adaikan PG, Chong YS. Pertinence de l'équilibre œstradiol-testostérone dans le pronostic des patients atteints de dysfonction érectile.
- Leder BZ, Rohrer JL, Rubin SD, et al. Effets de l'inhibition de l'aromatase chez les hommes âgés avec des niveaux de testostérone sérique faibles ou limites.
- Tan RBW, Guay AT, Hellstrom WJG. Utilisation clinique des inhibiteurs de l'aromatase chez les hommes adultes.
- Dastello-Porcar AM, Martinez-Jabaloyas JM. Le rapport testosteorne / estradiol, est-il utile dans le diagnostic de la dysfonction érectile et du faible désir sexuel?
- Gades NM, Jacobson DJ, McGree ME, et al. Les associations entre les hormones sexuelles sériques, la fonction érectile et la libido: l'étude d'Olmsted Country sur les symptômes urinaires et l'état de santé des hommes.
- Buvat J, Lemaire A. Dépistage endocrinien chez les hommes 1,022 atteints de dysfonction érectile: signification clinique et stratégie rentable.
- Gabrielson AT, Sartor RA, Hellstrom WJG. L'impact de la maladie thyroïdienne sur la dysfonction sexuelle chez les hommes et les femmes.
- Krassas GE, Tziomalos K, Papadopoulou F, et al. Dysfonction érectile chez les patients souffrant d'hyper- et d'hypothyroïdie: quelle est la fréquence et faut-il traiter?
- Cheitlin M. Dysfonction érectile: le premier signe de maladie vasculaire généralisée?
- Billups KL. La dysfonction érectile comme signe précoce de maladie cardiovasculaire.
- Thompson IM, Tangen CM, Goodman PJ, et al. Dysfonction érectile et maladies cardiovasculaires subséquentes.
- Bohm M, Baumhäkel M, Teo K, et al. La dysfonction érectile prédit les événements cardiovasculaires chez les patients à haut risque qui reçoivent du telmisartan, du ramipril ou les deux: le Telmisartan seul et en combinaison avec le Ramipril Global Endpoint Trial / Telmisartan Randomized AssessmeNt Study chez les sujets ACE iNtololerants with a cardiovasculaire (ON TARGET / TRANSCEND) Trials.
- Guay AT. ED2: dysfonction érectile = dysfonction endothéliale.
- Aversa, R. Bruzziches, D. Francomano, et al. Dysfonction endothéliale et dysfonction érectile chez l'homme vieillissant.
- Kaya C, Uslu Z, Karaman I. La fonction endothéliale est-elle altérée chez les patients souffrant de dysfonction érectile?
- Kaiser DR, Billups K, Mason C, et al. Altération de la vasodilatation de l'artère brachiale dépendante et indépendante de l'endothélium chez les hommes présentant une dysfonction érectile et aucune autre maladie cardiovasculaire clinique.
- Seidman SN, Roose SP. La relation entre la dépression et la dysfonction érectile.
- Seidman SN, Roose SP, Menza MA, et al. Traitement de la dysfonction érectile chez les hommes présentant des symptômes dépressifs: résultats d'un essai contrôlé par placebo avec du citrate de sildénafil.
- Melnick T, Soares BG, Nasselo AG. Interventions psychosociales pour la dysfonction érectile.
- Wilson G.
- Brom M, les deux S, Laan E, et al. Le rôle du conditionnement, de l'apprentissage et de la dopamine dans le comportement sexuel: revue narrative d'études animales et humaines.
- Klucken T, Schweckendiek J, juge en chef Merz, et al. Activations neuronales de l'acquisition de l'excitation sexuelle conditionnée: effets de la conscience de contingence et du sexe.
- Griffee K, O'Keefe S, Beard K, et al. Le développement sexuel humain est soumis à une période d'apprentissage critique: implications pour la dépendance sexuelle, la thérapie sexuelle et l'éducation des enfants.
- Kegel AH. Exercice de résistance progressive dans la restauration fonctionnelle des muscles périnéaux.
- Hoyland K, Vasdev N, Adshead J. L'utilisation de dispositifs d'érection sous vide dans la dysfonction érectile après une prostatectomie radicale.
- Vrijhof HJ, Delaere KP. Dispositifs de constriction du vide dans la dysfonction érectile: acceptation et efficacité chez les patients présentant une impuissance d'étiologie organique ou mixte.
- Kolettis PN, Lakin MM, Montague DK, et al. Efficacité du dispositif de constriction du vide chez les patients présentant un dysfonctionnement occlusif veineux corporel.
- Siervo M, Lara J, Ogbonmwan I, et al. La supplémentation en nitrate inorganique et en jus de betterave réduit la pression artérielle chez l'adulte: revue systématique et méta-analyse.
- Hord N, Tang Y, Bryan NS. Sources alimentaires de nitrates et de nitrites: le contexte physiologique des bénéfices potentiels pour la santé.
- Hobbs DA, George TW, Lovegrove JA. Les effets de la pression artérielle et des fonctions endothéliales des nitrates alimentaires: un examen des études d'intervention humaine.
- Fuhrman B, Volkova N, Aviram M. Le jus de grenade inhibe l'absorption des LDL oxydés et la biosynthèse du cholestérol dans les macrophages.
- Aviram M, Rosenblat M, Gaitini D, et al. La consommation de jus de grenade pendant 3 ans par les patients présentant une sténose de l'artère carotide réduit l'épaisseur intima-média carotidienne commune, la pression artérielle et l'oxydation des LDL.
- Ignarro LJ, Byrns RE, Sumi D, et al. Le jus de grenade protège l'oxyde nitrique contre la destruction oxydative et améliore les actions biologiques de l'oxyde nitrique.
- Stowe CB. Les effets de la consommation de jus de grenade sur la tension artérielle et la santé cardiovasculaire.
- Adamowicz J, Drewa T. Y a-t-il un lien entre les boissons gazeuses et la dysfonction érectile?
- Neves D. Produits finaux de glycation avancée: une voie courante dans le diabète et la dysfonction érectile liée à l'âge.
- Uribarri J, del Castillo MD, député de la Maza, et al. Produits finaux de glycation avancés alimentaires et leur rôle dans la santé et la maladie.
- Uribarri J, Woodruff S, Goodman S, et al. Produits finaux de glycation avancés dans les aliments et un guide pratique pour leur réduction de l'alimentation.
- Maiorino MI, Bellastella G, Chiodini P, et al. Prévention primaire des dysfonctionnements sexuels avec un régime méditerranéen dans le diabète de type 2: l'essai randomisé MÈDITA.
- Di Francesco S, Tenaglia R. Régime méditerranéen et dysfonction érectile: une perspective actuelle.
- CA Slentz, juge Houmard, juge Johnson, et al. Inactivité, entraînement et entraînement à l'effort et lipoprotéines plasmatiques. STRRIDE: une étude randomisée et contrôlée de l'intensité et de la quantité d'exercice.
- Di Francescomarino S, Sciartilli A, Di Valerio, et al. L'effet de l'exercice physique sur la fonction endothéliale.
- Walther C, Gielen S, Hambrecht R. L'effet de l'entraînement physique sur la fonction endothéliale dans les maladies cardiovasculaires chez l'homme.
- Fuchsjager-Mayrl G, Pleiner J, Wiesinger GF, et al. L'entraînement physique améliore la fonction endothéliale vasculaire chez les patients atteints de diabète de type 1.
- Vina J, Sanchis-Gomar F, Martinez-Bellow V, et al. L'exercice agit comme une drogue; les avantages pharmacologiques de l'exercice.
- Silva A, Sousa N, Azevedo LF, et al. Activité physique et exercice pour la dysfonction érectile: revue systématique et méta-analyse.
- Cho YG, Song HJ, Lee SK, et al. La relation entre la masse grasse corporelle et la dysfonction érectile chez les hommes coréens: Hallym Aging Study.
- Diaz-Arjonilla M, Schwarcz M, Swerdloff RS, et al. Obésité, faibles niveaux de testostérone et dysfonction érectile.
- Kapoor D, Clarke S, Channer KS, et al. La dysfonction érectile est associée à de faibles niveaux de testostérone bioactive et à l'adiposité viscérale chez les hommes atteints de diabète de type 2.
- Fantuzzi G. Tissu adipeux, adipokines et inflammation.
- Mattu HS, Randeva HS. Rôle des adipokines dans les maladies cardiovasculaires.
- Giugliano F. La dysfonction érectile s'associe à une dysfonction endothéliale et augmente les niveaux de cytokines pro-inflammatoires chez les hommes obèses.
- Evans M. Perdre du poids pour perdre la dysfonction érectile.
- Millan MJ, Newman-Tancredi A, Audinot V, et al. Actions agonistes et antagonistes de la yohimbine par rapport au fluparoxan aux récepteurs alpha (2) -adrénergiques (AR), à la sérotonine (5-HT) (1A), à la 5-HT (1B), à la 5-HT (1D) et à la dopamine D ( Récepteurs 2) et D (3). Signification pour la modulation de la transmission monoaminergique frontocorticale et des états dépressifs.
- Ernst E, Pittler MH. Yohimbine pour la dysfonction érectile: une revue systématique et une méta-analyse d'essais cliniques randomisés.
- MP Carey, Johnson BT. Efficacité de la yohimbine dans le traitement du trouble érectile: quatre intégrations méta-analytiques.
- Adeniyi AA, Brindley GS, Pryor JP, et al. Yohimbine dans le traitement de la dysfonction orgasmique.
- Cohen PA, Wang YH, Maller G, et al. Quantités pharmaceutiques de yohimbine trouvées dans les compléments alimentaires aux États-Unis.
- Neychev V, Mitev V. Effets pro-sexuels et améliorant les androgènes de Tribulus terrestris L .: Réalité ou fiction?
- Gauthaman K, Ganesan AP. Les effets hormonaux de Tribulus terrestris et son rôle dans la gestion de la dysfonction érectile masculine - une évaluation utilisant des primates, des lapins et des rats.
- Qureshi A, Naughton DP, Petroczi A. Une revue systématique de l'extrait de plantes Tribulus terrestris et les racines de son effet putatif aphrodisiaque et améliorant la performance.
- Neychev VK, Mitev Vi. L'herbe aphrodisiaque Tribulus terrestris n'influence pas la production d'androgènes chez les jeunes hommes.
- Gauthaman K, Ganesan AP, RN Prasad. Effets sexuels de la punturevine (Tribulus terrestris) extrait (protodioscine): une évaluation utilisant un modèle de rat.
- Adaikan PG, Gauthaman K, RN Prasad, et al. Effets pharmacologiques proérectiles de Tribulus terrestris extrait sur le corps caverneux de lapin.
- Kamenov Z, Fileva S, Kalinov K, et al. Évaluation de l'efficacité et de l'innocuité de Tribulus terrestris dans la dysfonction sexuelle masculine - un essai clinique prospectif, randomisé, en double aveugle, contrôlé par placebo.
- Kotirum S, Ismail SB, Chaiyakunapruk N.Efficacité de Tongkat Ali (Eurycoma longifolia) sur l'amélioration de la fonction érectile: revue systématique et méta-analyse d'essais contrôlés randomisés.
- Jeu HE, Mohamed IN, Hussain Z, et al. Eurycoma longifolia comme adoptogène potentiel de la santé sexuelle masculine: une revue systématique des études cliniques.
- Talbott SM, Talbott J, George A, et al. Effet de Tongkat Ali sur les hormones de stress et l'état d'humeur psychologique chez des sujets modérément stressés.
- Dell'Agli M, Galli GV, Dal Cero, et al. Inhibition puissante de la phosphodiestérase-5 humaine par les dérivés de l'icariine.
- Ning H, Xin ZC, Lin G, et al. Effets de l'icariine sur l'activité de la phosphodiestérase-5 in vitro et le niveau cyclique de guanosine monophosphate dans les cellules musculaires lisses caverneuses.
- Jiang Z, Hu B, Wang J, et al. Effet de l'icariine sur les niveaux de GMP cycliques et sur l'expression de l'ARNm de la phosphodiestérase spécifique du cGMP se liant au cGMP (PDE5) dans le cavernosum pénien.
- Romero M, Platt DH, Tawfik HE, et al. La dysfonction vasculaire coronaire induite par le diabète implique une activité accrue de l'arginase.
- Schramm L, La M, Heidbreder E, et al. Carence en L-arginine et supplémentation dans l'insuffisance rénale aiguë expérimentale et dans la transplantation rénale humaine.
- Curis E, Nicolis Ier, Moinard C, et al. Presque tout sur la citrulline chez les mammifères.
- Bode-Böger SM, Böger RH, Galland A, et al. Vasodilatation induite par la L-arginine chez l'homme en bonne santé: relation pharmacocinétique-pharmacodynamique.
- Chen J, Wollman Y, Chernichovsky T, et al. Effet de l'administration orale de L-arginine donneuse d'oxyde nitrique à haute dose chez les hommes atteints de dysfonction érectile organique: résultats d'une étude en double aveugle, randomisée et contrôlée par placebo.
- Bode-Böger SM, Scalera F, Ignarro LJ. Le paradoxe L-arginine: importance du rapport L-arginine / diméthylarginine asymétrique.
- Lebret T, Hervé JM, Gorny P, et al. Efficacité et innocuité d'une nouvelle combinaison de glutamate de L-arginine et de chlorhydrate de yohimbine: une nouvelle thérapie orale pour la dysfonction érectile.
- Akhondzadeh S, Amiri A, Bagheri A. Efficacité et innocuité de l'association orale de yohimbine et de L-arginine (SX) pour le traitement de la dysfonction érectile: un essai clinique multicentrique, randomisé, en double aveugle, contrôlé par placebo.
- Stanislavov R, Nikolova V. Traitement de la dysfonction érectile avec pycnogenol et L-arginine.
- Schulman SP, Becker LC, Kass DA, L-arginine thérapie dans l'infarctus aigu du myocarde: l'interaction vasculaire avec l'âge dans l'infarctus du myocarde (VINTAGE MI) essai clinique randomisé.
- Saenz de Tejada I, Angulo J, Cuevas P, et al. Profils de sélectivité comparatifs du tadalafil, du sildénafil et du vardénafil en utilisant un test d'activité de la phosphodiestérase in vitro.
- Evans J, Hill S. Une comparaison des inhibiteurs de phosphodiestérase-5 disponibles dans le traitement de la dysfonction érectile: un focus sur l'avanafil.
- Chavez A, Coffield KS, Rajab MH, Jo C.Taux d'incidence du cancer de la prostate chez les hommes traités pour une dysfonction érectile avec des inhibiteurs de la phosphodiestérase de type 5: analyse rétrospective.
- Pilote JR, Wilson KM, Sinnott JA, et al. Fréquence de l'éjaculation et risque de cancer de la prostate: résultats actualisés avec une décennie supplémentaire de suivi.
- Tang H, Wu W, Fu S, et al. Inhibiteurs de la phosphodiestérase de type 5 et risque de mélanome: une méta-analyse.
- Chen KK, Chan JY, Chang LS. Neurotransmission dopaminergique au noyau paraventriculaire de l'hypothalamus dans la régulation centrale de l'érection du pénis chez le rat.
- Altwein JE, Keuler FU. Traitement oral de la dysfonction érectile avec l'apomorphine SL.
- Heaton JP. Problèmes clés des essais cliniques de l'apomorphine SL.
- Linet OI, Ogring FG. Efficacité et innocuité de l'alprostadil intracaverneux chez les hommes atteints de dysfonction érectile.
- Porst H, Buvat J, Meuleman E, et al. Alprostadil alfadex intracaverneux - un traitement efficace et bien toléré pour la dysfonction érectile. Résultats d'une étude européenne à long terme.
- Baniel J, Israilov S, Engelstein D, et al. Résultat à trois ans d'un programme de traitement progressif de la dysfonction érectile avec des injections intracaverneuses de médicaments vasoactifs.
- Bernie HL, Segal R, Le B, et al. Un algorithme empirique vs approche basée sur le risque pour la thérapie par injection intracaverneuse: une étude prospective.
- Albaugh J. Algorithme d'injection intracaverneuse.
- Young SR, Dyson M. L'effet de l'échographie thérapeutique sur l'angiogenèse.
- Lu Z, Lin G, Reed-Maldonado A, et al. Le traitement par ondes de choc extracorporelles de faible intensité améliore la fonction érectile: une revue systématique et une méta-analyse.
- Qiu X, Lin G, Xin Z, et al. Effets de la thérapie par ondes de choc à faible énergie sur la fonction érectile et les tissus d'un modèle de rat diabétique.
- Lin G, Reed-Maldonado AB, Wang B, et al. Activation in situ de cellules progénitrices péniennes avec une thérapie par ondes de choc extracorporelles de faible intensité.
- Vardi Y, Appel B, Jacob G, et al. La thérapie par ondes de choc extracorporelles de faible intensité peut-elle améliorer la fonction érectile? Une étude pilote de suivi de 6 mois chez des patients atteints de dysfonction érectile organique.
- Vardi Y, Appel B, Kilchevsky A, et al. La thérapie par ondes de choc extracorporelles de faible intensité a-t-elle un effet physiologique sur la fonction érectile? Résultats à court terme d'une étude randomisée, en double aveugle et simulée.
- Srini VS, Reddy RK, Shultz T, et al. Thérapie extracorporelle par ondes de choc de faible intensité pour la dysfonction érectile: une étude dans une population indienne.
- Gruenwald I, Appel B, Vardi Y. Thérapie par ondes de choc extracorporelles de faible intensité - un nouveau traitement efficace pour la dysfonction érectile chez les patients atteints de dysfonction érectile sévère qui répondent mal à la thérapie inhibitrice de la PDE5.
- Kitrey ND, Gruenwald I, Appel B, et al. Le traitement pénien à ondes de choc de faible intensité est capable de déplacer les non-répondeurs PDE5i vers les répondeurs: une étude contrôlée en double aveugle et simulée.
- Olsen AB, Persani M, Boie S, et al. La thérapie extracorporelle par ondes de choc de faible intensité peut-elle améliorer la dysfonction érectile? Une étude prospective, randomisée, en double aveugle, contrôlée contre placebo.
- Bechara A, Casabé A, De Bonis O, et al. Efficacité et innocuité sur douze mois du traitement par ondes de choc de faible intensité pour la dysfonction érectile chez les patients qui ne répondent pas aux inhibiteurs de la phosphodiestérase de type 5.
- Fojecki GL, Tiessen S, Osther PJ. Effet de la thérapie par ondes de choc linéaires à faible énergie sur la dysfonction érectile - un essai clinique randomisé en double aveugle, contrôlé de façon factice.
- Fojecki GL, Tiessen S, Osther PJ. Effet de la thérapie par ondes de choc extracorporelles linéaires de faible intensité pour la dysfonction érectile - suivi de 12 mois d'une étude randomisée, en double aveugle et simulée.
- Kitrey ND, Vardi Y, Appel B, et al. Traitement par ondes de choc de faible intensité pour la dysfonction érectile - combien de temps dure l'effet?
- Gruenwald I, Kitrey ND, Appel B, et al. Thérapie extracorporelle par ondes de choc de faible intensité dans les maladies vasculaires et la dysfonction érectile: théorie et résultats.
- Clavijo R, Kohn TP, Kohn JR, et al. Effets de la thérapie par ondes de choc extracorporelles de faible intensité sur la dysfonction érectile: revue systématique et méta-analyse.
- Pavlovic V, Ciric M, Jovanovic V, et al. Plasma riche en plaquettes: un bref aperçu de certains composants bioactifs.
- Coppinger JA, Cagney G, Toomey S, et al. La caractérisation des protéines libérées par les plaquettes activées conduit à la localisation de nouvelles protéines plaquettaires dans les lésions athérosclérotiques humaines.
- Yu W, Wang J, Yin J. Plasma riche en plaquettes: un produit prometteur pour le traitement de la régénération nerveuse périphérique après une lésion nerveuse.
- Les juges Banno, Kinnick TR, Roy L, et al. L'efficacité du plasma riche en plaquettes (PRP) comme thérapie supplémentaire pour le traitement de la dysfonction érectile (DE): premiers résultats.
- Baumhäkel M, Werner N, Bohm M, et al. Les cellules progénitrices endothéliales circulantes sont en corrélation avec la fonction érectile chez les patients atteints de maladie coronarienne.
- Ichim TE, Warbington T, Cristea O, et al. L'administration intracaverneuse de cellules mononucléaires de la moelle osseuse: une nouvelle méthode pour traiter la dysfonction érectile?
- Franck-Lissbrant I, Häggström S, Damber JE, et al. La testostérone stimule l'angiogenèse et la repousse vasculaire de la prostate ventrale chez le rat adulte castré.
- Sieveking DP, Chow RW, Ng MK. Androgènes, angiogenèse et régénération cardiovasculaire.
- Mingchao Li, Ruan Y, Wang T, et al. Thérapie par cellules souches pour la dysfonction érectile diabétique chez le rat: une méta-analyse.
- Lin CS, Xin ZC, Wang Z, et al. Thérapie par cellules souches pour la dysfonction érectile: un examen critique.
- Haahr MK, Jensen CH, Toyserkani NM, et al. Innocuité et effet potentiel d'une injection intracaverneuse unique de cellules régénératives dérivées de l'adipose autologue chez les patients atteints de dysfonction érectile après prostatectomie radicale: un essai clinique de phase I en ouvert.
- Yiou R, Hamidou L, Birebent B, et al. Sécurité des cellules mononucléaires intracaverneuses de la moelle osseuse pour la dysfonction érectile de la prostatectomie postradicale: une étude pilote à escalade de dose ouverte.
- Mousavinejad M, Andrews P, Shoraki E. Considérations actuelles sur la biosécurité en thérapie par cellules souches.
