COMMENTAIRES: La section controversée de ce document contient les éléments suivants:
Un certain nombre d'études basées sur l'électrophysiologie, par le groupe de Prause, fournissent certaines preuves que le désir sexuel, et non l'hypersexualité, prédit une autorégulation de l'excitation sexuelle . Ces enquêteurs suggèrent dans d'autres travaux que les sujets signalant des problèmes régulant leur perception des stimuli visuels sexuels (SSV), qui signalaient également un désir sexuel plus élevé, présentaient des potentiels positifs tardifs (LPP) plus faibles en réponse à un SSV. Les auteurs proposent que ce modèle paraisse différent des modèles de toxicomanie .
Les deux articles EEG du «groupe de Prause» ont été largement critiqués dans des revues à comité de lecture et par d'autres (y compris YBOP). En réalité, les résultats des deux articles sont cohérents avec le modèle de dépendance, malgré les conclusions douteuses de leurs auteurs. Pour l'étude EEG 2013, voir:
- Rien ne correspond à rien dans la nouvelle étude sur le porno de SPAN Lab (2013)
- Critique revue par les pairs: «Désir élevé» ou «simplement» une dépendance? Une réponse à Steele et al. (2014) par Donald L. Hilton, Jr., MD,
- Critique revue par les pairs: «Neuroscience de la dépendance à la pornographie sur Internet: examen et mise à jour» (2015)
- Analyse revue par les pairs: «Corrélats neuronaux de la réactivité des signaux sexuels chez les individus avec et sans comportements sexuels compulsifs» (2014)
Pour l'étude 2015 EEG, voir:
- Critique de la «modulation des potentiels positifs tardifs par des images sexuelles chez les utilisateurs à problèmes et des contrôles incompatibles avec la« dépendance au porno »(2015)»
- Critique revue par les pairs: Neuroscience de la dépendance à la pornographie sur Internet: examen et mise à jour (2015)
Ne serait-il pas formidable que les chercheurs lisent réellement les études qu'ils citent plutôt que de simplement répéter les gros titres de l'auteur principal?
LIEN AVEC LA PUBLICATION
Publié le: 12 octobre 2015 (voir l'historique)
DOI: 10.7759 / cureus.348
Citez cet article comme suit: Blum K, RDA Badgaiyan, MS Gold (octobre 12, 2015) Hypersexualité Dépendance et retrait: Phénoménologie, neurogénétique et épigénétique. Cureus 7 (10): e348. doi: 10.7759 / cureus.348
Abstract
L'hypersexualité a été définie comme une activité sexuelle anormalement accrue. Des études épidémiologiques et cliniques ont montré que cette affection non paraphilique consiste en des comportements sexuels «excessifs» et des troubles accompagnés de détresse personnelle et de morbidité sociale et médicale. C'est un sujet très controversé et politique en termes de la meilleure façon de le classer comme similaire ou non similaire aux comportements addictifs, y compris la toxicomanie. Le trouble hypersexuel est conceptualisé comme un trouble du désir sexuel non paraphilique avec impulsivité. Les perspectives physiopathologiques incluent la dérégulation de l'excitation et du désir sexuels, l'impulsivité sexuelle et la compulsivité sexuelle. Le noyau accumbens, situé dans le striatum ventral, médie les effets de renforcement des drogues d'abus, telles que la cocaïne, l'alcool, la nicotine et la nourriture ainsi que la musique. En effet, on pense que cette structure impose des comportements suscités par des stimuli incitatifs. Ces comportements incluent des récompenses naturelles comme l'alimentation, la boisson, le comportement sexuel et la locomotion exploratoire. Une règle essentielle du renforcement positif est que les réponses motrices augmenteront en ampleur et en vigueur si elles sont suivies d'un événement enrichissant. Ici, nous émettons l'hypothèse qu'il existe un mécanisme d'action commun (MOA) pour les effets puissants que les drogues, la musique, la nourriture et le sexe ont sur la motivation humaine. La pulsion humaine pour les trois comportements de motivation nécessaires «faim, soif et sexe» peut tous avoir des antécédents génétiques moléculaires communs qui, s'ils sont altérés, conduisent à des comportements aberrants. Nous émettons l'hypothèse que, sur la base d'une pléthore de soutien scientifique, l'activité hypersexuelle est en effet comme des médicaments, de la nourriture et de la musique qui activent les circuits de récompense mésolimbiques du cerveau. De plus, le gène dopaminergique et peut-être d'autres polymorphismes de gènes associés aux neurotransmetteurs candidats affectent à la fois les résultats comportementaux hédoniques et anhédoniques. La génétique et l'épigénétique de l'hypersexualité sont peu connues dans la littérature actuelle. Cependant, nous prévoyons que les futures études basées sur des évaluations avec des instruments cliniques combinés avec le génotypage des toxicomanes sexuels fourniront des preuves d'un regroupement spécifique de typologies sexuelles avec des associations polymorphes. Certaines études utilisant des techniques électrophysiologiques ne soutiennent pas l'idée que l'hypersexualité est en effet similaire à la toxicomanie et à d'autres dépendances comportementales. Les auteurs encouragent également les scientifiques cliniques et universitaires à se lancer dans des recherches utilisant des outils de neuroimagerie pour examiner les agents agonistes dopaminergiques naturels ciblant des polymorphismes géniques spécifiques pour «normaliser» le comportement hypersexuel.
Introduction et contexte
Certes, le comportement hypersexuel a été documenté dans les milieux cliniques et de recherche au cours de la dernière décennie . Benjamin Rush, médecin membre du père fondateur des États-Unis et documenté cliniquement sur les comportements sexuels excessifs Richard von Krafft-Ebing, sexologue pionnier de l'Europe occidentale au 19e siècle, et Hirshfeld dans 1948 poursuivirent tous deux leurs travaux. [3-4]. Le locataire de base de ces chercheurs a suggéré que l'hypersexualité constituait un comportement sexuel social déviant persistant chez les hommes et les femmes ayant un appétit sexuel excessif, étant mal adaptatifs. En 1975, Poussette a qualifié la condition de Don Juanism . Dans 1969, Allen a suggéré la satyriase chez les hommes et la nymphomanie chez les femmes, soutenue par Ellis et Sagarin. [6-7]. Même si l'hypersexualité n'est pas incluse comme diagnostic psychiatrique dans le DSM, les travaux d'un certain nombre d'enquêteurs contemporains dont Kafka, Reid, Bancroft, leurs collègues et l'inclination de l'Organisation mondiale de la Santé pourraient conduire à l'inclusion de cette condition en tant qu'entité diagnostique distincte. [8-11].
Avis
Méthodologie de la littérature
La base de données Medline, au 12 juillet 2015, a été utilisée pour effectuer une recherche documentaire sur Internet. Les termes suivants ont été inclus: hypersexuel (170), hypersexualité (479), dépendance sexuelle (1,652), toxicomane sexuel (1,842), impulsivité sexuelle (989), sexualité compulsive (946), relations sexuelles compulsives (1,512), compulsion sexuelle (782) ), un trouble lié à la paraphilie (234) et une sexualité excessive (857). Étant donné que cet article est une brève revue plutôt qu'une méta-analyse, il est basé sur une sélection représentative de ces études qui ont un rapport avec les sous-thèmes abordés. La non-inclusion d'une étude particulière ne nie pas son importance pour le domaine. Naturellement, il y a ceux qui ne sont pas d'accord avec le concept selon lequel la dépendance sexuelle est en effet un vrai trouble et peuvent même avoir des preuves pour montrer qu'ils sont sur des bases solides. Cependant, nous soutenons qu'il existe de nombreuses preuves pour suggérer que la dépendance sexuelle existe et que des études impliquant la neuroimagerie, la neurogénétique et même l'épigénétique soutiennent l'idée que la dépendance sexuelle compulsive ainsi que l'hypersexualité pourraient être considérées comme un trouble de dépendance. Bien que nous soyons conscients de cette divergence, nous soumettons respectivement notre point de vue pour susciter un examen scientifique plus approfondi et non pour dissiper la rhétorique scientifique sur ce sujet important. Pour apporter un éclairage supplémentaire sur le sujet, nous avons recherché dans la littérature un certain consensus. Le 17 août 2015, nous avons effectué une recherche dans PUBMED Central en utilisant le terme suivant: «Le sexe est-il une vraie dépendance?» et récupéré 46 articles.
Définition de la dépendance sexuelle
La dépendance sexuelle est définie comme tout comportement sexuel compulsif qui interfère avec la vie normale et provoque un stress sévère sur la famille, les amis, les proches et l'environnement de travail. La dépendance sexuelle a été appelée dépendance sexuelle, hypersexualité et compulsivité sexuelle. Quel que soit son nom, c'est un comportement compulsif qui domine complètement la vie du toxicomane. Les toxicomanes sexuels font du sexe une priorité plus importante que la famille, les amis et le travail. Le sexe devient le principe organisateur de la vie des toxicomanes. Ils sont prêts à sacrifier ce qu'ils chérissent le plus pour préserver et continuer leur comportement malsain . Le désir hypersexuel a été défini comme un désir basé sur une évaluation au cours de la vie de la fréquence du comportement sexuel et du temps passé dans les fantasmes sexuels associés. Chez les hommes, Kafka et Hannen ont défini le désir hypersexuel comme la période prolongée la plus longue (au moins six mois) de comportement sexuel persistant (sortie sexuelle totale / Semaine après l'âge 15). En fait, des antécédents longitudinaux de désir hypersexuel, définis opérationnellement comme ci-dessus, ont été identifiés chez 72-80% d'hommes recherchant un traitement pour une paraphilie et des troubles liés à la paraphilie .
Hypersexualité et différences de genre
Il est bien établi que dans la communauté et la littérature sexuelles humaines, le désir sexuel est capitulé par la présence de fantasmes, d’activités ou de désirs sexuels, ainsi que par la motivation de l’humain à adopter un comportement sexuel. Il y a des indices pertinents internes et externes . Les partisans de la théorie de l'évolution ont soutenu que les hommes et les femmes ont des programmes différents en matière d'activité sexuelle . De nombreuses études révèlent des différences distinctes entre les hommes et les femmes. Les hommes ont augmenté leur fantaisie sexuelle , fréquence accrue de la masturbation , propension accrue à l'éveil sexuel visuel généré de l'extérieur attitudes permissives envers le sexe occasionnel , facilité d'excitation et motivation intrinsèque . En revanche, les femmes présentent un paysage sexuel différent avec une motivation sexuelle, une excitation sexuelle et un comportement sexuel façonnés par des facteurs évolutifs. et des investissements biologiques, émotionnels et temporels plus importants dans la reproduction et l'éducation des enfants . Les femmes sont moins vulnérables à l'hypersexualité et adapté pour favoriser les relations d'affiliation et l'engagement des partenaires à long terme . Bien que l'on estime que la dépendance sexuelle affecte jusqu'à 3% à 6% de la population, la compréhension claire des antécédents neurobiologiques est limitée. ainsi que des évaluations cliniques . Nous encourageons des lectures supplémentaires sur la compulsion sexuelle, l'attachement et l'orientation sexuelle , et les différences de genre dans les réponses aux stimuli sexuels [29-30].
Il convient de noter que Kafka et Hennen , a constaté que l’âge moyen d’apparition du comportement hypersexuel persistant était de 18.7 ± 7.2 chez les hommes sexuellement actifs et que la fourchette d’âge de l’apparition du comportement hypersexuel était de 7-46. La durée moyenne de cette fréquence constamment maintenue la plus élevée de comportement sexuel en appétit était de 12.3 ± 10.1 années. Cependant, l'âge moyen de ces hommes sexuels actifs hypersexuels qui ont demandé un traitement était les années 37 ± 9. Hanson et al. a également évalué l'hypersexualité chez les délinquants et a constaté que les taux de récidive étaient moins élevés chez les délinquants à faible risque que chez les délinquants à risque élevé .
Hypersexualité et toxicomanie concomitante
Il y a une forte comorbidité entre le trouble hypersexuel et d'autres dépendances, telles que le trouble lié aux substances [32-33]. En particulier, Garcia et Thibaut ont proposé que la phénoménologie du trouble sexuel excessif non paraphilique soit considérée comme un comportement de dépendance plutôt que comme un trouble obsessionnel-compulsif ou de contrôle impulsif. . Ils soulignent à juste titre que les critères sont assez proches de ceux des troubles addictifs, également proposés par d’autres . Ces chercheurs ont donné l'impulsion à la poursuite des recherches dans ce domaine et à l'inclusion future possible du trouble hypersexuel dans le DSM-6. Les drogues d'abus, le rock'n'roll et le sexe coexistent, et des festivals entiers ont été construits autour de ces combinaisons de Woodstock à nos jours.
La littérature révèle que les utilisateurs de méthamphétamine signalent que cette drogue stimulante augmente le désir sexuel, en particulier les comportements à risque. Cependant, il a été démontré que l’amphétamine réduisait l’activité sexuelle des rats femelles. Dans cet esprit, Holder et al. évalué le rôle de la méthamphétamine chez les rats femelles . Ils ont constaté qu'au contraire, la méthamphétamine facilitait le comportement sexuel féminin et que cet effet était dû à une augmentation de la transmission dopaminergique et même à une possible neurotransmission due à l'association d'hormones ovariennes et de méthamphétamine. Plus précisément, ils ont constaté un renforcement de la motivation sexuelle associé à l'activation de l'activité neuronale de l'amygdale médiale et du noyau ventromédial de l'hypothalamus.
En outre, des scientifiques des Pays-Bas ont étudié la comorbidité liée à la toxicomanie chez des échangistes auto-identifiés. . Dans cette étude, Spauwen et al. a conclu que 79% des échangistes ont déclaré avoir consommé de la drogue à des fins récréatives (y compris l’alcool et des drogues pour le dysfonctionnement érectile); 46% d’entre eux ont déclaré avoir pris plusieurs drogues. En fait, la consommation de drogues à des fins récréatives (à l'exclusion de l'alcool et des drogues contre la dysfonction érectile) était étroitement liée aux comportements sexuels à haut risque chez les hommes et les femmes. En outre, la consommation de drogue était indépendamment associée aux infections sexuellement transmissibles (IST) chez les femmes échangistes, en particulier celles qui participent à des rapports sexuels en groupe.
Castelo-Branco et al. ont rapporté que les jeunes femmes adultes perçoivent que la sexualité est une partie importante de leur vie mais pas une préoccupation principale (77.6%) . Ils ont également signalé que l'alcool supprime les obstacles à la sexualité (62.3%). Fait important, ils ont également constaté que l'abus d'alcool était une variable prédictive dans l'amélioration des comportements à risque, indépendamment de l'âge de la femme.
Il est à noter que Jia et al. a signalé des comportements sexuels dangereux chez les consommateurs de psychostimulant et d'héroïne, y compris les rapports sexuels multiples, les partenaires sexuels occasionnels, les partenaires homosexuels et les rapports sexuels sans risque ou jamais .
Notre principal locataire est que des drogues, telles que la méthamphétamine, la cocaïne, l'héroïne et l'alcool, peuvent stimuler le désir sexuel chez les non-toxicomanes. Chez les toxicomanes, c'est très différent. les mêmes médicaments peuvent causer l'anhédonie de façon chronique. Cependant, des post-toxicomanies ont été observées pendant la phase de rétablissement dans de nombreux cas.
Hypersexualité et retrait
Une recherche PubMed (7-19-15) utilisant le terme «hypersexualité et symptômes de sevrage» n'a abouti qu'à cinq articles, dont aucun ne décrivait les «symptômes de sevrage». Cependant, une recherche alternative utilisant les termes «symptômes de sevrage liés à une activité sexuelle élevée» a donné 25 articles répertoriés.
Les toxicomanes en convalescence signalent une augmentation de l'alimentation et une pulsion d'appétit pour certains aliments et une consommation excessive de cigarettes pendant une abstinence prolongée. La prise de poids a également été démontrée et documentée chez des animaux abstinents et des humains abstinents récemment et de manière prolongée. . Bruijnzeel a fait l'observation intéressante que le sevrage aigu aux opiacés peut entraîner des orgasmes spontanés . Il est important de noter que, dans l'article, Bruijnzeel a suggéré que la symptomatologie de sevrage liée aux drogues et éventuellement à une activité sexuelle intensive chronique pourrait être due à la fonction non opposée du récepteur kappa des opioïdes, qui inhibe la libération de dopamine tout en augmentant la noradrénaline dans les circuits de récompense du cerveau.
Les articles de la littérature souffraient d'un manque de rigueur en matière de sevrage aigu et prolongé et d'abstinence confirmée par les tests d'urine. Les programmes de traitement clinique sont passés de plus en plus du traitement des deux sexes à l'isolement des deux sexes, offrant des programmes de traitement spécifiques au genre. Ils offrent également une éducation pour faire face aux augmentations précoces et prolongées de l’intérêt et de l’activité sexuelle, ainsi qu’à la relation entre la récupération, la nourriture et les excès alimentaires.
Des symptômes de sevrage induits par l'hypersexualité ont été rapportés par certains chercheurs avec divers degrés de sévérité et toxicomanie concomitante. [41-45]. À la suite de cette recherche, nous n’avons trouvé aucun article décrivant les symptômes de sevrage réels associés à l’abstinence de relations sexuelles actives. La plupart des articles cités traitaient des effets du sevrage des drogues, telles que les opioïdes, la nicotine, les amphétamines et la cocaïne, susceptibles de nuire aux activités sexuelles.
Hypersexualité et neurogénétique
Une recherche PubMed (7-19-15) n'a révélé que six articles répertoriés utilisant le terme «gènes et hypersexualité» principalement axés sur des articles liés au syndrome de Kleine-Levin (KLS), une maladie très rare dans laquelle l'hypersexualité pouvait durer jusqu'à 27 ans. Dans une étude, il a été constaté qu'un HLA-DQBl immuno-réactif, le DQBl * 0602, a été détecté en quantités significatives chez les patients atteints de KLS et pouvait augmenter le risque de KLS. [46-47].
Cependant, lorsque nous avons utilisé les termes «activité sexuelle et gènes», 2,826 XNUMX articles ont été répertoriés, et nous fournissons un bref résumé de quelques aspects neurogénétiques importants. Notre hypothèse est que les comportements hédoniques et anhédoniques sont des résultats dans une partie des allèles de risque d'un individu pour ces comportements et que le traitement consiste à cibler de manière appropriée ces polymorphismes identifiés. De plus, la réponse au traitement dépend également de ces allèles de risque et fournit une justification importante pour les tests pharmacogénétiques et les solutions pharmacogénomiques / nutrigénomiques.
À la suite de la découverte controversée de Blum et al. dans 1990 de la première preuve d'association entre l'allèle DRD2 Al et l'alcoolisme grave, des articles sur 3,938 ont été publiés dans PubMed (7-19-15) . Les études couvrent le polymorphisme des gènes psychiatriques, l'allèle DRD2 Al, ainsi que les comportements et la physiologie associés. Il existe toutefois peu de données reliant l'activité sexuelle à ce gène et à d'autres gènes apparentés, en dépit des preuves accablantes d'activation mésolimbique, en particulier dans les voies dopaminergiques et les loci neuronaux liés aux stimuli et à l'activité sexuels. Il est à noter que Blum and Noble a correctement classé le gène DRD2 en tant que gène de récompense généralisé responsable de tout le comportement du syndrome de déficit de récompense (RDS). En fait, en utilisant l'analyse du théorème bayésien, les porteurs de l'allèle Taq Al auront, au cours de leur vie, une chance sur 74, de rencontrer un ou plusieurs comportements du syndrome de déficit de récompense (RDS). .
La première association d’un polymorphisme de gène et d’une activité sexuelle n’a eu lieu avant 1999, lorsque Miller et al. évalué certains gènes dopaminergiques . La découverte fondamentale est que le système dopaminergique dans le cerveau semble jouer un rôle majeur dans la régulation du comportement sexuel. La relation entre les gènes des récepteurs de la dopamine Dl, D2 et D4 et l'âge au premier rapport sexuel (AFSI) a été examinée dans un échantillon d'hommes et de femmes américano-européens 414 non hispaniques. Une association significative a été observée entre un allèle DRD2 et AFSI et une association encore plus forte lorsque l’allèle DRD2 était en interaction avec un allèle DRDl. Un modèle de régression contrainte a été construit pour prédire l'AFSI en utilisant le sexe et un groupe de neuf variables psychosociales comme facteurs prédictifs. L'ajout des prédicteurs DRD2 et DRD2-by-DRD1 à ce modèle a augmenté la variance expliquée respectivement de 23% et 55%. Le fait que ces résultats suggèrent une association plus forte entre les hommes que parmi les femmes est en accord avec les travaux récents d'autres personnes montrant une réponse plus forte aux stimuli sexuels chez les hommes que chez les femmes. . Alors peut-être que "les hommes viennent de Mars et les femmes de Vénus" et cela peut même être vrai pour l'abus de cocaïne .
Spécifiquement, des études précliniques et cliniques ont montré des schémas dimorphes sexuellement dans les réponses comportementales à la cocaïne à toutes les phases du processus de dépendance à la cocaïne (induction, maintien et rechute). Ainsi, une image claire est en train de se dégager qui suggère qu’il existe une base biologique aux différences sexospécifiques dans la dépendance à la cocaïne. Ces différences résultent de la régulation disparate du SNC des hormones gonadiques masculines et féminines et peuvent être prédites par la présence de polymorphismes du gène DRD2. . De plus, il est connu que les associations génétiques entre la COMT et divers phénotypes psychiatriques montrent fréquemment des différences entre les hommes et les femmes. Ceux-ci incluent le polymorphisme fonctionnel Val (158) Met dans COMT, associé à un trouble obsessionnel-compulsif chez les hommes et à des phénotypes d'anxiété chez les femmes. De plus, le polymorphisme Val (158) Met dans COMT a un impact plus important sur la fonction cognitive chez les garçons que chez les filles. .
Miller et al. n'a pas trouvé d'association des polymorphismes liés au gène DRD4 et à l'âge du premier rapport sexuel . Cependant, d'autres ont trouvé une association significative dans certains groupes ethniques. Plus précisément, leur analyse des polymorphismes dans DRD4 indique que ceux avec n'importe quel génotype - 3R ont connu un risque de premier rapport sexuel plus élevé que ceux avec un autre (ou n'importe quel - 4R) génotype dans toutes les ethnies (n = 2,552). Fait intéressant, le risque de premier rapport sexuel ne diffère pas entre les deux génotypes de l'échantillon afro-américain, soulevant la question de l'éducation culturelle. .
L'expérience sexuelle, à l'instar de l'usage répété de drogues, produit des changements à long terme, notamment une sensibilisation du noyau accumbens (NAc) et du striatum dorsal. Bradley et al. en utilisant l'analyse par microréseau pour étudier les hamsters ont découvert pour la première fois que l'expérience sexuelle chez les animaux mâles ou femelles régule de manière différentielle l'activation ou la réduction de l'ARNm d'une série de gènes de la NAc . Ils ont découvert qu'en comparaison avec des animaux naïfs sexuellement, les hamsters expérimentés sexuellement recevant un stimulus masculin au cours de la semaine 7 présentaient une augmentation d'un grand nombre de gènes. Inversement, les hamsters femelles sexuellement expérimentées n'ayant pas reçu de stimulus masculin au cours de la Semaine 7 ont présenté une réduction de l'expression de nombreux gènes. Selon les auteurs, ce tout premier profilage génétique chez les hamsters femelles pourrait donner une idée des mécanismes par lesquels les comportements (sexe) et la toxicomanie induisent des modifications à long terme des voies dopaminergiques mésolimbique et nigrostriatale.
Les électrodes bipolaires, implantées bilatéralement dans l’hypothalamus latéral et dans la région tégmentale de la substance nigraventrale, ont été utilisées stéréotaxiquement pour fournir des expériences de récompense chroniques auto-stimulantes similaires au comportement sexuel. On a constaté que ce type de stimulation induisait une augmentation significative du nombre de synapses dans la région CA3 de l'hippocampe et dans la couche moléculaire du cortex moteur chez le rat. Essentiellement, la stimulation cérébrale chronique induit une potentialisation à long terme (LTP), connue pour augmenter les nouvelles connexions synaptiques . Une seule exposition à la cocaïne chez des animaux naïfs suffit à déclencher des modifications durables des synapses glutamatergiques de la région tegmentale ventrale (VTA) qui ressemblent à la LTP dépendante de l'activité dans d'autres régions du cerveau. Cette LTP induite par la cocaïne semble être médiée par l'activation des récepteurs N-méthyl-D-aspartate (NMDA) par le récepteur D5 de la dopamine et nécessiter une synthèse protéique. , soutenant encore une fois notre hypothèse proposée ici que la drogue et le sexe peuvent avoir des substrats neurochimiques communs.
Des recherches empiriques ont révélé une relation positive entre le nombre de partenaires sexuels et la participation à des comportements antisociaux . La plupart des tentatives pour expliquer cette association ont pris une perspective évolutive. Du point de vue de l'évolution, les mêmes traits, tels que l'impulsivité, la myopie et l'agressivité, qui sont liés à un grand nombre de partenaires sexuels, sont également liés à une implication criminelle. Cependant, il y a aussi des raisons de croire que la co-variation entre les partenaires sexuels et les comportements criminels peut être partiellement expliquée par une voie génétique commune, les gènes liés au nombre de partenaires sexuels étant également liés à un comportement antisocial. En utilisant la logique décrite ci-dessus, Beaver et al. a découvert une forte association positive entre les partenaires sexuels et le comportement antisocial et les polymorphismes du gène du transporteur de la dopamine (DAT1) expliquent les variations du nombre de partenaires sexuels et du comportement criminel des hommes . L'effet polymorphique du gène DAT 1 et le nombre de partenaires sexuels peuvent être dus à une association constatée entre certains polymorphismes et l'éjaculation pénienne précoce. Les porteurs du génotype 1OR / 1OR présentaient des scores indiquant un seuil d'éjaculation plus bas pour chacun des indicateurs par rapport au groupe de porteurs combiné 9R9R / 9R10R (activité plus faible de la dopamine de 9R) . Des polymorphismes du gène DATl, en particulier du génotype 10R / 10R, ont été découverts chez des délinquants juvéniles fréquentant la Brown School (San Marcos, Texas) pour comportements agressifs pathologiques, notamment anti-sociaux. . Une corrélation positive entre les polymorphismes DRD2 et DATl a été observée avec la violence pathologique chez les adolescents dans un essai clinique en aveugle. En outre, bien qu’ils aient été initialement conçus comme résultant de l’imitation par des pairs de jeunes apparaissant au début de l’enfance ou persistants, des études jumelées montrent de plus en plus de preuves que les comportements antisociaux à l’adolescence ou limités par l’adolescent peuvent également être génétiquement influencés. Burt et Mikolajewski ont non seulement confirmé ces résultats avec le gène DATl, mais ils ont également été étendus à la variante His452Tyr du gène codant pour le récepteur 5-HT2A. , Plus récemment, Jozkow et al. ont rapporté une association entre la dimension sexuelle des symptômes masculins vieillissants (MAM) et les variantes génétiques du 5-HTRlB G861C . De plus, Sales et al. découverte par analyse de régression logistique multivariable, une interaction entre l'abus et le groupe 5-HTTLPR dans laquelle il existait une association significative avec le statut de non-changement, ainsi que les scores de fréquence de communication des partenaires au suivi Avoir des antécédents d'abus était significativement associé à une probabilité plus élevée de non-utilisation du préservatif après l'intervention pour les personnes ayant l'allèle uniquement.
Il est connu que les polymorphismes dans les régions non codantes du gène du récepteur de la vasopressine la (Avpr la) sont liés aux caractéristiques socio-émotionnelles chez l'homme, le chimpanzé et le campagnol et peuvent être dus à une variation d'expression du gène spécifique à un site. Selon Barrett et al., Le campagnol socialement monogame des Prairies offre une occasion unique d'étudier la neurobiologie de la monogamie. . En fait, la signalisation du récepteur de la vasopressine la (VlaR) est nécessaire à la formation de la liaison de paires chez les hommes. Il est intéressant de noter que les campagnols des prairies sociales présentent une liaison VlaR supérieure dans le pallidum ventral de traitement de la récompense par rapport aux campagnols asociaux du même genre. Barrett et al. ont constaté que la régulation à la baisse de la densité pallidale de VlaR entraînait une diminution significative de la préférence pour un partenaire féminin et une réduction du comportement de type anxiété à l'âge adulte . D'autres travaux de Garcia et al. ont révélé que les personnes ayant au moins un allèle à 7 répétitions (7R +) du DRD4 rapportent un taux catégoriel plus élevé de comportement sexuel promiscuité, y compris avoir déjà eu une «aventure d'une nuit», et signalent une augmentation de plus de 50% des cas de infidélité sexuelle .
Daw et Guo ont signalé que les individus porteurs des génotypes DRD2 * Al / A2, DRD2 * A2 / A2, DATl * 9R / 10R et MAOA * 2R / sont associés à des probabilités plus élevées d’avoir un rapport sexuel non protégé avec d’autres génotypes au cours de ces loci . Les associations DRD2 concernent aussi bien les hommes que les femmes, tandis que les autres liens ne concernent que les femmes. Enfin, Emanuele et al. ont rapporté une association significative entre les génotypes DRD2 TaqI A et «Eros · (un style amoureux caractérisé par une tendance à développer des expériences émotionnelles intenses basées sur l'attirance physique pour le partenaire), ainsi qu'entre le polymorphisme C516T 5HT2A et la« manie »( un attachement romantique possessif et dépendant, caractérisé par des émotions autodestructrices) .
Epigénétique et activité sexuelle
Une revue de la littérature révèle qu'un certain nombre d'articles récents soulignent l'importance des effets épigénétiques sur l'activité sexuelle. Par exemple, Matsuda a examiné les modifications épigénétiques du récepteur des œstrogènes a (ERalpha) et leur influence sur le comportement sociosexuel. . En fait, l'altération de l'activité du gène ER alpha médiée par des mécanismes épigénétiques, tels que les modifications d'histones et la méthylation de l'ADN, modifie les comportements sexuels. En termes d'homosexualité, Rice et al. développé un modèle pouvant expliquer la canalisation (conversion) du développement sexuel de l'homosexualité . Ils expliquent que ce modèle est basé sur les marques épigénétiques définies en réponse au caryotype XX vs. XY dans les cellules souches embryonnaires. En conséquence, ces marques augmentent la sensibilité à la testostérone chez les fœtus XY et la diminuent chez les fœtus XX, ce qui permet de canaliser le développement sexuel. Il a été postulé qu'un sous-ensemble de ces marques épigénétiques convertissantes quantitativement pourrait être transgénique et pourrait conduire à un mosaïcisme pour le développement sexuel chez les enfants de sexe opposé, le phénotype homosexuel.
Chez le campagnol des Prairies (Microtus ochrogaster), socialement monogame, l'accouplement induit des liaisons par paires durables initiées par la formation des préférences du partenaire et régulées par divers neurotransmetteurs, notamment l'ocytocine, la vasopressine et la dopamine. Oeuvre de Gundersen et Wang et al. suggère que l’histone désacétylase pourrait faciliter la formation de partenaires chez les campagnols femelles des Prairies pouvant avoir une incidence sur les humains. Plus précisément, Wang et al. ont constaté que les inhibiteurs de l'histone désacétylase - butyrate de sodium et trichostatine A (TSA) renforçaient la formation de préférences des partenaires chez les campagnols des prairies . Cette formation de préférence de partenaire était associée à une régulation à la hausse du récepteur de l'ocytocine (OTR, oxtr) et du récepteur de la vasopressine Va (VlaR, avprla) dans le NAc, via une augmentation de l'acétylation de l'histone au niveau de leurs promoteurs respectifs.
Il y a de plus en plus d'intérêt qui montre que les femmes s'engagent activement dans la polyandrie soit pour éviter l'incompatibilité génétique, soit pour favoriser la paternité en faveur des hommes génétiquement supérieurs. Il est possible que le choix d'une forme physique supérieure pour les hommes soit dû aux effets épigénétiques. Selon Zeh et Zeh, contrairement à la variation basée sur une séquence d'ADN, la variation épigénétique peut être fortement influencée par les effets environnementaux et stochastiques ressentis au cours de la vie d'un individu. . Ils suggèrent que la variation épigénétique peut être importante pour la sélection sexuelle post-copulatoire et peut expliquer les conclusions reliant la capacité compétitive du sperme à la forme de la progéniture.
Evolution génétique et génétique: procréation humaine
Eysenck a proposé une corrélation positive entre l'extraversion et l'intensification du comportement sexuel et entre le névrosisme et les problèmes de comportement sexuel (comportement antisocial). Une étude antérieure sur des personnes mariées n'a montré aucune de ces corrélations. On a émis l'hypothèse que ce lien n'existe que pour les personnes non mariées qui ne sont pas engagées dans des relations de longue durée parce que la qualité de la relation détermine l'interaction sexuelle. Dans un échantillon de jeunes hommes célibataires, il y avait une corrélation positive entre l'extraversion et les items dans lesquels la personne décrivait une activité sexuelle antérieure avec plus d'individus et avec une fréquence plus élevée. Aucune corrélation n'a été trouvée avec le névrosisme. Il y avait également de légères corrélations avec d'autres échelles de personnalité et d'attitude sociale. En raison de la corrélation avec une échelle de personnalité de passage à l'acte, les résultats ont été interprétés d'un point de vue socio-psychologique. Dans la société d'aujourd'hui, on attend du jeune homme qu'il prenne l'initiative d'une interaction sexuelle qu'un jeune homme extraverti peut réaliser mieux qu'un homme introverti . Cette perspective est en accord direct avec l'idée de Richard Brodie sur les gènes égoïstes de l'esprit . Du point de vue de l'ADN, bien sûr, les anthropologues conviendraient que «nous sommes toujours là pour une seule raison; aller de l'avant et se multiplier. Alors que les progrès évolutifs sont lents, un pas tous les 20 ans environ, par rapport à "l'évolution des mèmes, une idée mute dans le temps qu'il faut pour lire une phrase." Notre cerveau n'a rien à voir avec l'évolution génétique, sauf parce qu'il est lié au fait que les personnes intelligentes ont moins de bébés. En fait, s'il y a des gènes qui donnent aux gens la tendance à prendre des mèmes qui limitent leur nombre de descendants, ils mourront dans quelques générations au profit de gènes qui donnent aux gens une tendance à acquérir des enfants. Bien que quelque peu controversé, malheureusement, un certain nombre d'études suggèrent que l'Homo sapiens au cours des 42,000 dernières années a abaissé son QI en raison de l'accouplement sélectif. .
De manière extraordinaire, il s'avère que, puisque l'extraversion est liée à une activité sexuelle accrue, en particulier chez les hommes, un généticien quantitatif estime que l'héritabilité de la personnalité extravertie est d'environ 40-60%. Smillie et ses collaborateurs ont étudié et découvert qu'un exemplaire de l'allèle Al, gène DRD2, était associé à une extraversion significativement plus élevée . Cette association soulève une question intéressante en termes de procréation humaine. Comings a suggéré qu'en raison de leur effet marqué sur le comportement reproducteur, les troubles d'apprentissage et d'autres troubles impulsifs, compulsifs, agressifs et addictifs, ces porteurs du DRD2 Al ont le potentiel de provoquer des changements progressifs et permanents de la fréquence de l'allèle DRD2Al «conduisant à la fusion génétique de l’espèce » .
Dans son livre, Comings fournit des preuves que les personnes ayant un comportement addictif-perturbateur ont des enfants plus tôt, ce qui a une incidence sur la sélection de gènes de dépendance tels que l'allèle DRD2 Al. . Il suggère que les personnes porteuses de cet allèle à risque perturbateur auront des enfants, disons à 20 ans, et les personnes sans cet allèle auront des enfants à 25 ans. En conséquence, le gène mutant se reproduira plus rapidement, à savoir tous les 20 ans tandis que la forme normale du gène se reproduira tous les 25 ans. Le rapport de 25/20 est de 1.25. Ainsi, la vitesse à laquelle un gène qui a un avantage sélectif de 1.25 fois augmentera en fréquence d'une génération à l'autre. Une différence de cinq ans dans l'âge des mères ou des pères au moment où ils ont leurs premiers enfants est suffisante pour aboutir à une sélection significative et relativement rapide des gènes portés par le groupe qui commence à procréer à un âge plus précoce. Des augmentations de certains comportements RDS ont été documentées de 1955 à nos jours. Ces augmentations comprennent le syndrome du comportement de l'adolescent (drogue, sexe, grossesses chez les adolescentes et comportements délinquants, tabagisme), les troubles des conduites, la criminalité, la toxicomanie, l'alcoolisme, les comportements sexuels non protégés, les mères célibataires, l'aide sociale, les expulsions scolaires et les abandons scolaires, ainsi que une diminution concomitante du QI . Ces résultats sont basés sur l’étude Berkeley utilisant des données longitudinales tirées des études sur la santé et le développement de l’enfant et des enquêtes longitudinales nationales sur les jeunes ou NLYS. . En utilisant ces informations, Comings a prédit que, de 1955 à 2015, la fréquence de l'allèle DRD2 Al, par exemple, doublerait, ce qui augmenterait la prévalence des comportements RDS, y compris les rapports sexuels précoces. . Nous encourageons un suivi de cette prédiction intéressante.
Malgré quelques désaccords, nous proposons le trouble de l'hypersexualité en tant que sous-type du SDR partageant des caractéristiques avec des comportements de dépendance fondés sur une substance ou non, son expression clinique étant en partie affectée à la fois par la génétique et l'épigénétique. Bien que non encore testés à ce jour, nous proposons également des traitements médicamenteux assistés (MAT) approuvés à court terme par la FDA, favorisant le blocage de la fonction dopaminergique, suivis d'une activation en douceur des voies dopaminergiques conduisant à l'homéostasie dopaminergique à long terme. Ce dernier pourrait être accompli selon certaines modalités qui pourraient aider au rétablissement.
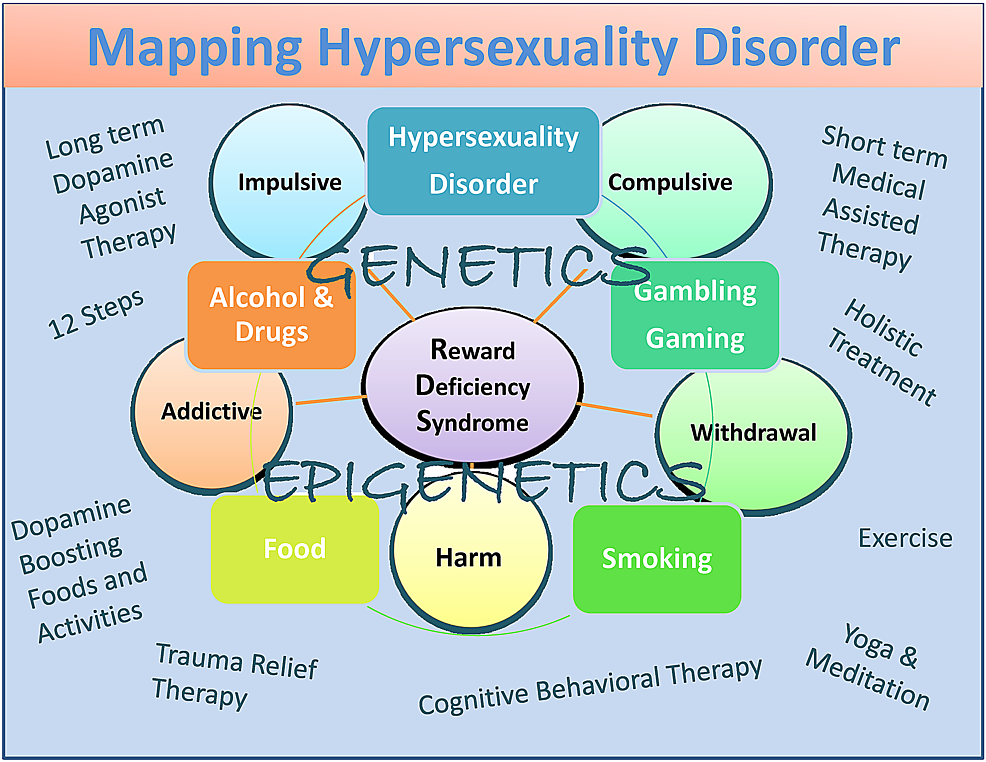
Bien qu’ils soient potentiellement biaisés, ils comprennent la thérapie par les nutraceutiques dopaminergiques (KB220), le programme et la tradition 12 Step, le traitement holistique, la thérapie cognitivo-comportementale (TCC) et la thérapie de soulagement des traumatismes (TRT), ainsi que des activités et des aliments dopants pour la dopamine (Figure 1). 1) .
La controverse
Bien que nous croyions fermement que le trouble de l'hypersexualité devrait figurer dans les prochaines éditions de DSM, nous sommes quelque peu perplexes de savoir si peu de choses sur ce trouble en termes de neurogénétique et d'épigénétique, voire de symptomatologie du sevrage et de phénoménologie globale. . Le principal message à retenir est que nous encourageons maintenant la communauté scientifique à réaliser des expériences, notamment dans les domaines de la neuroimagerie et de la neurogénétique, y compris l'épigénétique spécifique de gènes, tels que l'ocytocine-vasopressine-orexine-dopamine ainsi que d'autres gènes de récompense. Peut-être que cette condition pourrait bénéficier d'un traitement qui cible les polymorphismes du gène de récompense pour aider à promouvoir l'homéostasie de la dopamine [84-89]. Un certain nombre de critiques de Joranby, et al. et Edge et Gold soutiennent les opportunités de traitement communes liées aux mécanismes neurochimiques partagés dans les circuits de récompense du cerveau, comme cela avait été envisagé précédemment dans le concept RDS [90-91].
Historiquement, la «dépendance sexuelle» était incluse dans le DSM-III, cependant, elle a été supprimée du DSM-1V parce que le consensus des auteurs du DSM-1V estimait que les preuves étaient insuffisantes pour justifier sa conclusion. Cette décision a suscité une immense émotion de la part des leaders du domaine. Suite à cet événement, un certain nombre de scientifiques, dont Kafka, Reid, Prause et d'autres, ont décidé de présenter «l'hypersexualité» non pas comme une dépendance sexuelle mais comme un trouble mental autonome et non comme une dépendance en soi. Alors que leurs travaux antérieurs en 2010 suggéraient comme mentionné ici que «l'hypersexualité» était similaire à la dépendance sexuelle et peut-être à d'autres dépendances, y compris la toxicomanie, leurs travaux plus récents s'éloignent de cette affirmation. Des travaux récents dans ce domaine révèlent une controverse persistante. Il existe un certain nombre d'études électrophysiologiques, menées par le groupe de Prause, qui fournissent des preuves que le désir sexuel, et non l'hypersexualité, prédit l'autorégulation de l'excitation sexuelle. . Ces enquêteurs suggèrent dans d'autres travaux que les sujets signalant des problèmes régulant leur perception des stimuli visuels sexuels (SSV), qui signalaient également un désir sexuel plus élevé, présentaient des potentiels positifs tardifs (LPP) plus faibles en réponse à un SSV. Les auteurs proposent que ce modèle paraisse différent des modèles de toxicomanie . Cependant, bien que n'impliquant pas de sujets présentant un trouble hypersexuel, les travaux du groupe de Voon ont montré que, chez les sujets présentant un comportement sexuel compulsif, exposés à des vidéos sexuellement explicites, une plus grande activité dans le réseau neuronal similaire à celle observée dans les études de réactivité médicamenteuse . Un plus grand désir ou un désir plutôt que d’aimer était en outre associé à une activité dans ce réseau de neurones. Ce travail s'inscrit dans les théories de la motivation incitative .
Nous, les auteurs de l'article actuel, admettons que nous n'avons pas été au courant de toutes les interactions importantes qui se sont produites entre les partisans du «trouble d'hypersexualité» et leur intention honnête d'inclure ce trouble dans le DSM-5 actuel. Bien qu'il ait échoué au soi-disant «test d'acide», il y a tout lieu de croire qu'il sera inclus dans les prochaines éditions du DSM. Il est à noter que Steven Hyman, l'actuel directeur du NIH, a correctement soutenu que «le DSM est un piètre miroir des réalités cliniques et biologiques; une approche fondamentalement nouvelle de la classification diagnostique est nécessaire alors que les chercheurs découvrent de nouvelles façons d'étudier et de comprendre la maladie mentale » . De plus, Casey et al. a proposé que bien que le DSM considère différents troubles comme des entités distinctes, «les frontières entre les troubles ne sont souvent pas aussi strictes que le suggère le DSM» .
Dans 2014, Karila et al. certains psychiatres ont ignoré la dépendance sexuelle, également connue sous le nom de trouble hypersexuel, en dépit de la maladie causant de graves problèmes psychosociaux. Selon ces auteurs, ils proposent que la dépendance sexuelle ou le trouble hypersexuel représente différents termes pour le même problème. Ils soulignent que les taux de prévalence des troubles liés à la dépendance sexuelle vont de 3% à 6%. En conséquence, le concept de dépendance sexuelle / trouble hypersexuel présente des comportements problématiques, notamment: masturbation excessive, cybersexe, utilisation de pornographie, comportement sexuel aberrant avec des adultes consentants, relations sexuelles au téléphone, visites dans des clubs de strip-tease et autres comportements de dépendance. . Nous convenons certainement qu'il peut exister des différences distinctes entre la dépendance sexuelle et l'hypersexualité, comme l'a souligné Carvalho, et al. Rettenberger et al. , Kor et al. , Reid et al. , Kafka et Hennen et Prause et al. [93-94] entre autres.
En résumé, nous avons proposé que, même s’il existe certaines différences entre l’hypersexualité et la dépendance sexuelle, des recherches supplémentaires sont nécessaires pour classer de manière appropriée ces conditions très importantes. Nous sommes d'accord avec le travail de Walters et al. cela suggère que les différences individuelles d'hypersexualité sont de nature quantitative plutôt que qualitative. Ils suggèrent également que l'hypersexualité est organisée le long d'un continuum tombant à l'extrémité supérieure du continuum (Figure 1).
Figure 1: Carte descriptive du trouble de l'hypersexualité en tant que sous-type de RDS
La figure illustre les effets neurogénétiques et épigénétiques interactifs. Les traitements à court terme de blocage de la dopamine et à long terme d '«homéostasie dopaminergique» ainsi que les thérapies dopaminergiques et les activités quotidiennes sont répertoriés. Les cercles indiquent les caractéristiques RDS et les cases indiquent les comportements RDS.
Conclusions
Tout en reconnaissant la controverse, nous proposons que les différences et similitudes possibles entre le trouble d'hypersexualité et la dépendance sexuelle devraient être correctement étudiées à l'aide de la neuroimagerie (IRMf, TEP, SPECT), de l'optogénétique, de l'analyse des candidats et des microréseaux et des techniques épigénétiques. Nous pensons que ces enquêtes fourniront la base pour l'inclusion de l'hypersexualité en tant que trouble dans les prochaines éditions du DSM.
Bibliographie
- Kor A, Y Fogel, RC Reid, Potenza MN: Le trouble hypersexuel doit-il être classé dans la dépendance?. Compulsivité Sex Addict. 2013, 20:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3836191/. 10.1080/10720162.2013.768132
- Rush B: Enquêtes médicales et observations sur la maladie mentale. Rush B (éd): Gryphon Editions Ltd., Birmingham, AL; (Travail original publié 1812) révisé dans 1979.
- von Krafft-Ebing R: Psychopathie sexuelle. Klaf FS (ed): Stein et Day, New York; (travail original publié 1886) révisé dans 1965.
- Hirshfeld M: Anomalies sexuelles: origine, nature et traitement des troubles sexuels. Hirshfeld M (éd): Emerson Books, New York; 1948.
- Poussette RJ: Perversion: La forme érotique de la haine. Pantheon Books, New York; 1975.
- Allen CA: Un manuel de troubles psychosexuels. Oxford University Press, Londres; 1962.
- Ellis A, Sagarin E: Nymphomanie: Une étude de la femme surexploitée. Gilbert Press, New York; 1964.
- Kafka MP: Qu'est-il arrivé au trouble hypersexuel?. Arch Sex Behav. 2014, 43: 1259-1261. 10.1007 / s10508-014-0326-y
- Reid RC, Temko J, Moghaddam JF, Fong TW: Honte, rumination et compassion envers les hommes chez qui un trouble hypersexuel a été évalué. J Psychiatr Pract. 2014, 20: 260 – 268. 10.1097 / 01.pra.0000452562.98286.c5
- Bancroft J: La sexualité humaine et ses problèmes. Troisième édition. Elsevier, Oxford, Angleterre; 2009.
- Classification statistique internationale des maladies et des problèmes de santé connexes, 10th Revision . (2007). Consulté: July 23, 2015: http://apps.who.int/classifications/apps/icd/icd10online2007/.
- Chanteur B, Toates FM: Motivation sexuelle. J Sex Research. 1987, 23: 481 – 501. 10.1080/00224498709551386
- Le député de Kafka, Hennen J: Désir hypersexuel chez les hommes: les hommes atteints de paraphilie sont-ils différents des hommes atteints de troubles paraphiliens?. Abus de sexe. 2003, 15: 307 – 321. 10.1023 / A: 1025000227956
- Buss DM, Schmitt DP: Théorie des stratégies sexuelles: une perspective évolutive sur l'accouplement humain. Psychol Rev. 1993, 100: 204 – 232. 10.1037 / 0033-295X.100.2.204
- Corbett-Detig RB, Hartl DL, Sackton TB: La sélection naturelle limite la diversité neutre parmi un large éventail d'espèces. Psychol Bull. 1995, 13: e1002112.- 469-496. doi: 10.1371 / journal.pbio.1002112
- Laumann EO, Michael RT, Gagnon JH: Une histoire politique de l'enquête nationale sur le sexe des adultes. Fam Plann Perspect. 1994, 26: 34 – 38. 10.2307/2136095
- Jones JC, Barlow DH: Fréquence autodéclarée des pulsions sexuelles, des fantasmes et des fantasmes masturbatoires chez les hommes et les femmes hétérosexuels. Arch Sex Behav. 1990, 19: 269 – 79. 10.1007 / BF01541552
- Oliver MB, Hyde JS: Différences entre les sexes en matière de sexualité: une méta-analyse. Psychol Bull. 1993, 114: 29 – 51. 10.1037 / 0033-2909.114.1.29
- Okami P, Shackelford TK: Différences entre le sexe humain et la psychologie sexuelle et le comportement. Annu Rev Sex Res. 2001, 12: 186–241. 10.1080/10532528.2001.10559798
- Leitenberg H, Detzer MJ, Srebnik D: Différences entre les sexes en matière de masturbation et relation entre l'expérience de la masturbation à la préadolescence et / ou au début de l'adolescence et le comportement sexuel et l'adaptation sexuelle au début de l'âge adulte. Arch Sex Behav. 1993, 22: 87 – 98. 10.1007 / BF01542359
- Fetterman AK, Kruger NN, Robinson MD: Les stratégies d'accouplement liées au sexe divergent avec une manipulation de la saillance génitale. Motiv Emot. 2015, 39: 99 – 103. 10.1007/s11031-014-9420-7
- Basson R: Utiliser un modèle différent de réponse sexuelle féminine pour répondre au faible désir sexuel problématique des femmes. J Sex Marital Ther. 2001, 27: 395–403. 10.1080/713846827
- Andersen BL, Cyranowski JM, Aarestad S: Au-delà des distinctions artificielles liées au sexe pour conceptualiser la sexualité féminine: commenter Baumeister. Psychol Bull. 2000, 126: 380 – 389. 10.1037 // 0033-2909.126.3.380
- Chevalier RA, JE Sims-Knight: Les antécédents développementaux de la contrainte sexuelle sur les femmes: tester des hypothèses alternatives avec la modélisation par équation structurelle. Ann NY Acad Sci. 2003, 989: 72 – 85. 10.1111 / j.1749-6632.2003.tb07294.x
- Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Or M: Sexe, drogues et rock'n'roll: hypothèse d'une activation mésolimbique commune en fonction des polymorphismes des gènes de récompense. J Drogues psychoactives. 2012, 44: 38 – 55. 10.1080/02791072.2012.662112
- Carnes PJ, Green BA, Merlo LJ, Polles A, Carnes S, Gold MS: PATHOS: une brève application de dépistage pour évaluer la dépendance sexuelle. J Addict Med. 2012, 6: 29 – 34. 10.1097/ADM.0b013e3182251a28
- Hanson RK: Static-99 prévoit-il la récidive chez les délinquants sexuels plus âgés?. Abus sexuel. 2006, 18: 343–355. 10.1007 / s11194-006-9027-y
- Weinstein A, Katz L, Eberhardt H, Cohen K, Lejoyeux M: Compulsion sexuelle - Relation avec le sexe, l'attachement et l'orientation sexuelle. J Behav Addict. 2015, 4: 22 – 26. 10.1556 / JBA.4.2015.1.6
- Chung WS, SM SM, Yoo JH, Yoon H: Différence entre les sexes dans l'activation du cerveau jusqu'à la stimulation sexuelle audiovisuelle; Les femmes et les hommes éprouvent-ils le même niveau d'excitation en réponse au même clip vidéo?. Int J Impot Res. 2013, 25: 138-142. 10.1038 / ijir.2012.47
- Rupp HA, Wallen K: Différences entre les sexes en réponse à des stimuli visuels sexuels: une revue. Arch Sex Behav. 2008, 37: 206 – 218. 10.1007/s10508-007-9217-9
- Hanson RK, AJ Harris, Helmus L, Thornton D: Les délinquants sexuels à haut risque peuvent ne pas être à risque élevé pour toujours. J Interpers Violence. 2014, 29: 2792-813. 10.1177/0886260514526062
- Reid RC, MA Cyders, Moghaddam JF Fong TW: Propriétés psychométriques de l'échelle d'impulsion de Barratt chez les patients souffrant de troubles du jeu, d'hypersexualité et de dépendance à la méthamphétamine. Addict Behav. 2014, 39: 1640 – 1645. 10.1016 / j.addbeh.2013.11.008
- Reid RC, BN Charpentier, Crochet JN, Garos S, JC Manning, Gilliland R, Cooper EB, McKittrick H, Davtian M, Fong T: Rapport des résultats d'un essai sur le terrain du DSM-5 pour un trouble hypersexuel. J Sex Med. 2012, 9: 2868 – 2877. 10.1111 / j.1743-6109.2012.02936.x
- Garcia FD, Thibaut F: Dépendances sexuelles. Am J Toxicomanie. 2010, 36: 254-260. 10.3109/00952990.2010.503823
- Reid RC, Bramen JE, Anderson A, Cohen MS: Pleine conscience, dysrégulation émotionnelle, impulsivité et prédisposition au stress chez les patients hypersexuels. J Clin Psychol. 2014, 70: 313 – 321. 10.1002 / jclp.22027
- Titulaire MK, Hadjimarkou MM, Zup SL, Blutstein T, Benham RS, McCarthy MM, Mong JA: La méthamphétamine facilite le comportement sexuel féminin et améliore l'activation neuronale dans l'amygdale médiale et le noyau ventromédian de l'hypothalamus. Psychoneuroendocrinologie. 2010, 35: 197 – 208. 10.1016 / j.psyneuen.2009.06.005
- Spauwen LW, Niekamp AM, Hoebe CJ, Dukers-Muijrers NH: Consommation de drogue, comportements sexuels à risque et infections sexuellement transmissibles chez les échangistes: une étude transversale aux Pays-Bas. Sex Transm Infect. 2015, 91: 31 – 36. 10.1136 / sextrans-2014-051626
- Castelo-Branco C, Parera N, Mendoza N, Pérez-Campos E, Lete I, groupe CEA: Abus d'alcool et de drogues et comportements sexuels à risque chez les jeunes femmes adultes. Gynécol Endocrinol. 2014, 30: 581 – 586. 10.3109/09513590.2014.910190
- Jia ZJ, Yan SY, Bao YP, Lian Z, Zhang HR, Liu ZM: Différences de comportement sexuel entre les utilisateurs de stimulants de type amphétamine et les consommateurs d'héroïne. J Addict Med. 2013, 7: 422 – 427. 10.1097/ADM.0b013e3182a952b2
- Bruijnzeel AW: Signalisation des récepteurs kappa-opioïdes et fonction de récompense cérébrale. Brain Res Rev. 2009, 62: 127 – 146. 10.1016 / j.brainresrev.2009.09.008
- Orsini CA, Ginton G, Shimp KG, Avena NM, Or MS, Setlow B: Consommation d'aliments et prise de poids après l'arrêt de l'administration chronique d'amphétamine. Appétit. 2014, 78: 76 – 80. 10.1016 / j.appet.2014.03.013
- Ibrahim C, Reynaert C: Hypersexualité dans les troubles neurocognitifs chez les personnes âgées - revue complète de la littérature et étude de cas. Psychiatr Danub. 2014, 26: 36 – 40.
- Vallejo-Medina P, Sierra JC: Effet de la consommation de drogue et influence de l'abstinence sur le fonctionnement sexuel chez un échantillon de toxicomanes de sexe masculin espagnol: une étude multisite. J Sex Med. 2013, 10: 333 – 341. 10.1111 / j.1743-6109.2012.02977.x
- Baskerville TA, Douglas AJ: Comportements sous-jacents aux interactions dopamine / oxytocine: contributions potentielles aux troubles du comportement. CNS Neurosci Ther. 2010, 16: e92-123. 10.1111 / j.1755-5949.2010.00154.x
- Riebe CJ, Lee TT, Hill MN et Gorzalka BBB: Le sevrage précipité contrecarre les effets indésirables de l'administration subchronique de cannabinoïdes sur le comportement sexuel des rats mâles. Neurosci Lett. 2010, 472: 171 – 174. 10.1016 / j.neulet.2010.01.079
- Korda JB, Pfaus JG, Kellner CH, Goldstein I: Trouble persistant de l'excitation génitale (PGAD): rapport de cas de traitement symptomatique à long terme par électroconvulsivothérapie. J Sex Med. 2009, 6: 2901 – 2909. 10.1111 / j.1743-6109.2009.01421.x
- Le juge en chef Huang, Liao HT, Yeh GC et Hung KL: Distribution des allèles HLA-DQB1 chez les patients atteints du syndrome de Kleine-Levin. J Clin Neurosci. 2012, 19: 628 – 630. 10.1016 / j.jocn.2011.08.020
- Blum K, Noble EP, Sheridan PJ, Montgomery A, Ritchie T, P Jagadeeswaran, Nogami H, Briggs AH, Cohn JB: Association allélique du gène du récepteur D2 de la dopamine humaine dans l'alcoolisme. JAMA. 1990, 263: 2055 – 2060. 10.1001 / jama.263.15.2055
- Blum K, Sheridan PJ, Wood RC, Braverman ER, Chen TJ, Cull JG, Comings DE: Le gène du récepteur de la dopamine D2 en tant que déterminant du syndrome de déficit de récompense. JR Soc Med. 1996, 89: 396-400. 10.1177/014107689608900711
- Miller WB, DJ Pasta, MacMurray J, Chiu C, Wu H, Comings DE: Les gènes des récepteurs de la dopamine sont associés à l'âge lors du premier rapport sexuel. J Biosoc Sci. 1999, 31: 43 – 54. 10.1017 / S0021932099000437
- Hamann S, Herman RA, Nolan CL, Wallen K: La réponse de l'amygdale aux stimuli visuels sexuels diffère chez les hommes et les femmes. Nat Neurosci. 2004, 7: 411 – 416. 10.1038 / nn1208
- Quiñones-Jenab V: Pourquoi les femmes de Vénus et les hommes de Mars utilisent-ils de la cocaïne?. Brain Res. 2006, 1126: 200 – 203. 10.1016 / j.brainres.2006.08.109
- Noble EP, Blum K, Khalsa ME, Ritchie T, Montgomery, Un bois RC, Fitch RJ, Ozkaragoz T, Sheridan PJ, Anglin MD, Paredes A, Treiman LJ, Sparkes RS: Association allélique du gène du récepteur de la dopamine D2 à la dépendance à la cocaïne. La drogue dépend de l'alcool. 1993, 33: 271 – 285. 10.1016/0376-8716(93)90113-5
- Harrison PJ, Tunbridge EM: Catéchol-O-méthyltransférase (COMT): gène contribuant aux différences de fonction cérébrale entre les sexes, et au dimorphisme sexuel prédisposé aux troubles psychiatriques. Neuropsychopharmacologie. 2008, 33: 3037 – 3045. 10.1038 / sj.npp.1301543
- Guo G, Tong Y: Âge au premier rapport sexuel, gènes et contexte social: données provenant de jumeaux et du gène du récepteur de la dopamine D4. Démographie. 2006, 43: 747 – 769. 10.1353 / dem.2006.0029
- Bradley KC, MB Boulware, Jiang H, RW Doerge, Meisel RL, Mermelstein PG: Modifications de l'expression des gènes dans le noyau accumbens et le striatum après une expérience sexuelle. Gènes Brain Behav. 2005, 4: 31 – 44. 10.1111 / j.1601-183X.2004.00093.x
- Rao BS, Raju TR, Meti BL: Augmentation de la densité numérique des synapses dans la région CA3 de l'hippocampe et de la couche moléculaire du cortex moteur après une expérience d'auto-stimulation enrichissante. Neuroscience. 1999, 91: 799 – 803. 10.1016/S0306-4522(99)00083-4
- Heshmati M: LTP induite par la cocaïne dans la région tegmentale ventrale: de nouvelles informations sur le mécanisme et le cours du temps éclairent les substrats cellulaires de la dépendance. J Neurophysiol. 2009, 101: 2735 – 2737. 10.1152 / jn.00127.2009
- KM Castor, Wright JP, Walsh A: Explication évolutive basée sur les gènes de l'association entre une implication criminelle et le nombre de partenaires sexuels. Biodémographie Soc Biol. 2008, 54: 47 – 55. 10.1080/19485565.2008.9989131
- Santtila P, Jern P, Westberg L, Walum H, Pedersen CT, Eriksson E, Sandnabba N: Le polymorphisme du gène transporteur de la dopamine (DAT1) est associé à l'éjaculation précoce. J Sex Med. 2010, 7: 1538 – 1546. 10.1111 / j.1743-6109.2009.01696.x
- Chen TJH, Blum K, Mathews D, Fisher L, Schnautz N, Braverman Er, Schoolfield J, Downs W, Blum SH, Mengucci J, Meshkin B, Arcuri V, Bajaj A, Waite RL, Vient de: Association préliminaire des gènes du récepteur dopaminergique D2 (DRD2) [Allèle Taq1 A1] et du transporteur de la dopamine (DAT1) [480 bp] avec un sous-type clinique du syndrome de déficit de récompense (RDS) chez les adolescents. Gene Ther Mol Biol. 2007, 1: 93-112. Consulté: July 23, 2015: http://gtmb.org/pages/Vol11A/HTML/11._Chen_et_al,_93-102.htm.
- Burt SA, Mikolajewski AJ: Preuve préliminaire que des gènes candidats spécifiques sont associés à un comportement antisocial chez l'adolescent. Comportement agressif. 2008, 34: 437 – 445. 10.1002 / ab.20251
- Jóźków P, Słowińska-Lisowska M, Łaczmański Ł, Mędraś M: Des variantes polymorphes des gènes des récepteurs des neurotransmetteurs peuvent affecter la fonction sexuelle chez les hommes vieillissants: données de l'étude HALS. Neuroendocrinologie. 2013, 98: 51 – 59. 10.1159/000350324
- Ventes JM, DiClemente RJ, Brody GH, Philibert RA, Rose E: Interaction entre le polymorphisme 5-HTTLPR et les antécédents d'abus sur le comportement d'utilisation du préservatif des adolescentes afro-américaines après leur participation à une intervention de prévention du VIH. Prev Sci. 2014, 15: 257 – 267. 10.1007/s11121-013-0378-6
- Barrett CE, Keebaugh AC, Ahern TH, Bass CE, Terwilliger EF, Young LJ: La variation de l'expression du récepteur de la vasopressine (Avpr1a) crée une diversité dans les comportements liés à la monogamie chez les campagnols des prairies. Horm Behav. 2013, 63: 518 – 526. 10.1016 / j.yhbeh.2013.01.005
- Garcia JR, MacKillop J, Aller EL, Merriwether AM, Wilson DS, Lum JK: Associations entre la variation du gène du récepteur D4 de la dopamine avec l'infidélité et la promiscuité sexuelle. PLoS One. 2010, 5: e14162. 10.1371 / journal.pone.0014162
- Daw J, Guo G: L'influence de trois gènes sur l'utilisation ou non de la contraception par les adolescents, États-Unis 1994-2002. Popul Stud (Camb). 2011, 65: 253 – 271. 10.1080/00324728.2011.598942
- Emanuele E, Brondino N, Pesenti S, Re S, Geroldi D: Charge génétique sur les styles d'amour humain. Neuro Endocrinol Lett. 2007, 28: 815 – 821.
- Matsuda KI: Changements épigénétiques dans le promoteur du gène α du récepteur des œstrogènes: implications pour les comportements sociosexuels. Neurosci avant. 2014, 8: 344. 10.3389 / fnins.2014.00344
- Riz WR, Friberg U, Gavrilets S: L'homosexualité via le développement sexuel canalisé: un protocole de test pour un nouveau modèle épigénétique. Bioessays. 2013, 35: 764 – 770. 10.1002 / bies.201300033
- Gundersen B: Liaison de paires par épigénétique. Nat Neurosci. 2013, 16: 779. 10.1038 / nn0713-779
- Wang H, Duclot F, Liu Y, Wang Z, Kabbaj M: Les inhibiteurs d'histone désacétylase facilitent la formation des préférences du partenaire chez les campagnols des prairies. Nat Neurosci. 2013, 16: 919 – 924. 10.1038 / nn.3420
- Zeh JA, Zeh DW: Héritage maternel, épigénétique et évolution de la polyandrie. Genetica. 2008, 134: 45 – 54. 10.1007 / s10709-007-9192-z
- Addad M, Lesiau A: Extraversion, neuroticisme, jugement immoral et comportement criminel. Loi Med. 1989, 8: 611 – 622.
- Brodie R: Virus de l'esprit: la nouvelle science du meme. Hay House, Inc, New York, NY; 1996, pp 66.
- Hernnstein R, Murray C: La courbe de Bell: Intelligence et structure de classe dans la vie américaine. La presse libre, New York, NY; 1994.
- Smillie LD, Cooper AJ, Proitsi P, Powell JF, Pickering AD: La variation du gène de la dopamine DRD2 prédit une personnalité extravertie. Neurosci Lett. 2010, 468: 234 – 327. 10.1016 / j.neulet.2009.10.095
- À venir DE: La bombe génétique. L'enseignement supérieur et les technologies de pointe accélèrent-ils la sélection de gènes pour les troubles d'apprentissage, le TDAH, les comportements addictifs et perturbateurs?. Hope Press, Duarte CA; 1996.
- À venir DE: Le syndrome de comportement problématique de l'adolescent. La bombe génétique. L’enseignement supérieur et les technologies de pointe accélèrent-ils la sélection de gènes pour les troubles de l’apprentissage, le TDAH, les comportements addictifs et perturbateurs?. Hope Press, Duarte CA; 1996. pp 91-94.
- À venir DE: Sélection de gènes. La bombe génétique. L’enseignement supérieur et les technologies de pointe accélèrent-ils la sélection de gènes pour les troubles de l’apprentissage, le TDAH, les comportements addictifs et perturbateurs?. Hope Press, Duarte CA; 1996. pp 89-90.
- À venir DE: L'étude de Berkeley. La bombe génétique. L’enseignement supérieur et les technologies de pointe accélèrent-ils la sélection de gènes pour les troubles de l’apprentissage, le TDAH, les comportements addictifs et perturbateurs?. Hope Press, Duarte California; 1996. pp 105 – 210.
- Borsten J: Livre de recettes pour le régime de récupération de la plage Malibu. Vidov Publishing Inc, Malibu, CA; 2015.
- Derbyshire KL, Grant JE: Comportement sexuel compulsif: une revue de la littérature. J Behav Addict. 2015, 4: 37 – 43. 10.1556/2006.4.2015.003
- Nirenberg MJ: Syndrome de sevrage de l'agoniste dopaminergique: implications pour les soins aux patients. Drogues Vieillissement. 2013, 30: 587 – 592. 10.1007 / s40266-013-0090-z
- Grant JE, Brewer JA, Potenza MN: Neurobiologie de la toxicomanie et des dépendances comportementales. CNS Spectr. 2006, 11: 924 – 930.
- Sakata K, Duke SM: Le manque d'expression du BDNF via le promoteur IV perturbe l'expression des gènes de monoamine dans le cortex frontal et l'hippocampe. Neuroscience. 2014, 260: 265 – 75. 10.1016 / j.neuroscience.2013.12.013
- Blum K, Liu Y, Wang W, Wang Y, Zhang Y, M Oscar-Berman, Smolen A, M Febo, Han D, Simpatico T, FJ Cronjé, Demetrovics Z, Or MS: Effets rsfMRI de KB220Z ™ sur les voies neuronales dans le circuit de récompense des héroïnomanes abstinents génotypés. Postgrad Med. 2015, 127: 232 – 241.
- McLaughlin T, Blum K, Oscar-Berman M, Febo M, Demetrovics Z, Agan G, Fratantonio J, Gold MS: Utilisation du neuroadaptagène KB200z ™ pour atténuer les cauchemars terrifiants et lucides chez les patients RDS: le rôle de l'amélioration de la récompense cérébrale, de la connectivité fonctionnelle et de l'homéostasie dopaminergique. J Récompense Defic Syndr. 2015, 1: 24-35. 10.17756 / jrds.2015-006
- Blum K, PK Thanos, RD Badgaiyan, M Febo, M Oscar-Berman, Fratantonio J, Demotrovics Z, Or MS: Neurogénétique et thérapie génique pour le syndrome de déficit de récompense: allons-nous au pays promis?. Expert Opin Biol Ther. 2015, 5: 973 – 985. 10.1517/14712598.2015.1045871
- Joranby L, Pineda-Frost KY, Or MS: Dépendance aux systèmes de récompense alimentaire et cérébrale. Dépendance sexuelle et compulsivité. 2005, 12: 201–217. 10.1080/10720160500203765
- Edge PJ, or MS: Retrait de drogue et hyperphagie: leçons de tabac et d’autres drogues. Curr Pharm Des. 2011, 17: 1173 – 1179. 10.2174/138161211795656738
- Moholy M, Prause N, Proudfit, GH, Rahman A, Fong T: Le désir sexuel, et non l'hypersexualité, prédit la maîtrise de l'excitation sexuelle. Cogn Emot. 2015, 6: 1012.
- Prause N, Steele, VR, Staley C, Sabatinelli, D, Hajcak G: Modulation des potentiels positifs tardifs par des images sexuelles chez des utilisateurs à problème et contrôles incompatibles avec une «dépendance au porno». Biol Psychol. 2015, 109: 192-199. 10.1016 / j.biopsycho.2015.06.005
- DJ Mechelmans, Irvine M, Banca P, et autres: Augmentation du biais de l'attention vers les indices sexuellement explicites chez les individus avec et sans comportements sexuels compulsifs. PLoS One. 2014, 25, 9 (8): e105476. 10.1371 / journal.pone.0105476
- Blum K, Gardner E, Oscar-Berman M, Or M: «Aimer» et «vouloir» liés au syndrome de déficit de récompense (RDS): hypothèse de la réactivité différentielle dans les circuits de récompense du cerveau. Curr Pharm Des. 2012, 18 (1): 113-118.
- Hyman SE: Diagnostiquer le DSM: la classification diagnostique nécessite une réforme fondamentale. Cerveau. 2011, 2011: 6. Consulté: 2011 Apr 26: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3574782/.
- Casey BJ, Craddock N, BN Cuthbert, Hyman SE, Lee FS, Ressler KJ: DSM-5 et RDoC: progrès de la recherche en psychiatrie?. Nat Rev Neurosci. 2013, 14: 810-14. 10.1038 / nrn3621
- Karila L, Wéry A, Weinstein A, Cottencin O, Petit A, Reynaud M, Billieux J: Dépendance sexuelle ou trouble hypersexuel: des termes différents pour le même problème? Une revision de la littérature. Curr Pharm Des. 2014, 20: 4012-20. 10.2174/13816128113199990619
- Carvalho J, Štulhofer A, Vieira AL, Jurin T: Hypersexualité et désir sexuel élevé: explorer la structure de la sexualité problématique. J Sex Med. 2015, 12: 1356-67. Consulté: 2015 Mar 23: http://onlinelibrary.wiley.com/doi/10.1111/jsm.12865/abstract;jsessionid=6F416CCBB66B7F0EA28E428D4993EBD5.f01t04. 10.1111 / jsm.12865
- Rettenberger M, Klein V, Briken P: La relation entre le comportement hypersexuel, l'excitation sexuelle, l'inhibition sexuelle et les traits de personnalité. Arch Sex Behav. 2015, Jan 6: (Epub en avant de l'impression). Consulté: 2015 Jan 6: 10.1007/s10508-014-0399-7
- Walters GD, Chevalier RA, Långström N: L'hypersexualité est-elle dimensionnelle? Données probantes sur le DSM-5 dans la population générale et des échantillons cliniques. Arch Sex Behav. 2011, 40: 1309-21. Consulté: 2011 Février 3: 10.1007/s10508-010-9719-8