Párbeszédek Clin Neurosci. 2013 Dec;15(4):431-43.
Absztrakt
Annak ellenére, hogy számos pszichoszociális tényező fontos, a kábítószer-függőség magában foglalja a biológiai folyamatot: a visszaélésszerű kábítószerrel való ismételt expozíció képességét a sérülékeny agyban, amely a kényszeres keresést és a kábítószer-bevételt okozza, és az ellenőrzés elvesztését. a kábítószer-használat felett, amely meghatározza a függőséget. Itt tekintjük át a molekuláris és celluláris adaptációk típusait, amelyek bizonyos agyi régiókban fordulnak elő a függőséggel kapcsolatos viselkedési rendellenességek közvetítésére. Ezek közé tartoznak a génexpresszió változásai, amelyek részben az epigenetikai mechanizmusok révén érhetők el, a neuronok és a szinapszisok neurofiziológiai működésének plaszticitása, valamint a neuronális és szinaptikus morfológia kapcsolódó plaszticitása, amelyet részben a megváltozott neurotróf faktor jelzés közvetít. Az ilyen típusú gyógyszerek által indukált módosítások mindegyike a „celluláris vagy molekuláris memória” formájának tekinthető. Ráadásul feltűnő, hogy a legtöbb plaszticitásfüggőség nagyon hasonló a plaszticitás típusaihoz, amelyek a „viselkedésmemória” klasszikusabb formáihoz kapcsolódnak, ami talán a neuronok számára rendelkezésre álló adaptív mechanizmusok véges repertoárját tükrözi, amikor a környezet kihívásokat. Végül, a függőséggel kapcsolatos molekuláris és celluláris adaptációk magukban foglalják ugyanazok az agyrégiók többségét, amelyek a klasszikusabb memóriaformákat közvetítik, összhangban azzal a nézettel, hogy a rendellenes emlékek fontos tényezők a függőségi szindrómák számára. Ezeknek a vizsgálatoknak a célja, amelyek célja a kábítószerfüggőség molekuláris és celluláris alapjainak felderítése, hogy végül biológiai alapú diagnosztikai teszteket, valamint a függőségi rendellenességek hatékonyabb kezeléseit fejlesszék ki.
Bevezetés
A kábítószer-függőséget, amely a kábítószer-fogyasztás iránti kényszerkeresés és a kábítószer-fogyasztás elleni védekezés elvesztése ellenére is meghatározható, a kábítószer okozta hosszú távú változások okozzák, amelyek bizonyos agyi régiókban előfordulnak.1 Azonban csak néhány ember vesz részt a függőségnek az ismétlődő kábítószer-expozícióval szemben, míg mások alkalmasak arra, hogy a kábítószert véletlenül használják, és elmeneküljenek egy függőségi szindrómától. A genetikai tényezők a függőségi sebezhetőség egyéni variabilitásának nagyjából 50% -át teszik ki, és ez az öröklési fok az addiktív gyógyszerek valamennyi főbb osztályára érvényes, beleértve a stimulánsokat, az opiátokat, az alkoholt, a nikotint és a kannabinoidokat..2 Még nem sikerült azonosítani a legtöbb gént, amely ezt a genetikai kockázatot magában foglalja, valószínűleg a több száz genetikai variáció bevonásával, amelyek egyetlen személyben összegeznek függőségi sebezhetőséget (vagy más személyek ellenállását).
A függőség kockázatának további 50% -át számos környezeti tényező okozza, amelyek az egész életen át előfordulnak, amelyek kölcsönhatásba lépnek az egyén genetikai összetételével, hogy kisebb-nagyobb mértékben kiszolgáltatottá tegyék őt a függőséggel szemben. A függőség számos környezeti tényezőt érint, beleértve a pszichoszociális stresszt is, de messze a legerősebb tényező maga a kábítószerrel való kitettség. Bizonyos „átjáró” gyógyszerek, különösen a nikotin, kimutatták, hogy fokozzák az ember sebezhetőségét egy másik drogtól való függőséggel szemben.3 Emellett egyre több bizonyíték van arra, hogy a népesség függőségének számos genetikai kockázata ellenére, a hosszú ideig tartó, elég nagy dózisú gyógyszerrel való érintkezés olyan személyt alakíthat át, aki viszonylag alacsonyabb genetikai terheléssel rendelkezik egy függővé..4
Az elmúlt két évtizedben nagy előrelépés történt az agyi diszkrét régiók azonosításában, amelyek fontosak a függőségi szindróma közvetítésében, valamint a molekuláris és celluláris szinteken bekövetkező változások típusai, amelyeket a kábítószerek ezekben a régiókban a kulcsfontosságú szempontok alapján indukálnak. függőség.1,5 A legnagyobb figyelmet kapó áramkört a mezolimbikus dopamin rendszernek nevezzük, amely magában foglalja a dopamin neuronokat a középső agyvérsejtek (VTA) ventralis tegmentális területén (VTA) a magban accumbens (NAc, a ventrális striatum része). Ezek a VTA idegsejtek számos más előrégióterületet is beidegeznek, beleértve a hippocampust, az amygdala-t és a prefrontális kéregeket (PFC).
Jó értelme, hogy ezeket a kábítószer-indukált addiktív mechanizmusokat a memóriában három átfedő ok miatt vegyük figyelembe.6
- Először is, minden gyógyszer által indukált adaptációt „molekuláris vagy sejtmemória típusnak” tekinthetünk: az ilyen változásokon átesett idegsejt a kábítószer-expozíció következtében eltérő, és így másként reagál az ugyanazon gyógyszerre, más gyógyszerekhez, vagy számos más ingerhez.
- Másodszor, érdekes, hogy sok, talán leginkább a függőségi állapothoz kapcsolódó változások típusai (pl. megváltozott gén transzkripció, epigenetika, szinaptikus és teljes sejt plaszticitás, neuronális morfológia és neurotróf mechanizmusok) a „viselkedési memória” hagyományos formáiban is szerepet játszanak, mint például a térbeli memória, a félelem kondicionálása és az operáns kondicionálás.
- Harmadszor, a drogok által érintett agyterületek között a visszaélés a viselkedésmemória kulcsfontosságú neurális szubsztrátja, beleértve a hippocampust, az amygdala-t és a PFC-t. Ez egybeesik azzal a növekvő felismeréssel, hogy a klinikailag észlelt függőség (pl. A kábítószer-vágy és a visszaesés) néhány legfontosabb jellemzője a hagyományos memóriaáramkörök rendellenességeit tükrözi, a kábítószer-élmény hosszú távú emlékeit pedig a függőségi patológiák erős hajtóerejeként szolgálják.4,7,8 Ezzel szemben az agy jutalomterületei (pl. VTA és NAc) erőteljesen befolyásolják a viselkedési memóriát.
Ez a cikk áttekintést ad a molekuláris és celluláris változások főbb típusairól, amelyek több agyi régióban jelentkeznek a függőség állatmodelljeiben. Fontos, hogy a humán függőkben bekövetkezett változások közül néhányat egyre inkább validáltak a postmortem agyi vizsgálatok alapján. Annak ellenére, hogy a bántalmazás kábítószerei különböző kémiai szerkezetekkel rendelkeznek, és különböző fehérje-célokra hatnak, feltűnő, hogy sok kiemelkedő függőséggel kapcsolatos adaptáció sok, és néhány esetben mindegyik visszaélésszerű kábítószer esetében közös, és valószínűleg hozzájárul egy közös funkcióhoz. függőség szindróma.4,9 Ezzel ellentétben sok más gyógyszer által indukált adaptáció egy adott gyógyszerre specifikus, és egy adott függőség több egyedi aspektusát közvetítheti. Itt az élénkítő és opiát kábítószerekre összpontosítunk, amelyek drámaibb hatást fejtenek ki az állatmodellekben más gyógyszerekkel összehasonlítva. A jövőbeli kutatások fontos területeit is kiemeljük, amelyek tovább fokozzák a függőségi szindrómákra vonatkozó ismereteinket, és ezeket az előrehaladásokat javított diagnosztikai tesztekre és kezelésekre fordítják.
Transkripciós és epigenetikai mechanizmusok
Az a tudat, hogy a függők a fokozott visszaesés kockázatában maradnak az évek absztinenciája ellenére, azt jelenti, hogy a függőség kábítószer-indukált változásokat okoz az agyban, amelyek nagyon stabilak lehetnek. Ez számos csoportot vezetett a génexpresszió változásának megfontolására, mint a függőségi folyamat fontos eleme (ábra 1). Ennek megfelelően a DNS-mikroszkópokkal és újabban az RNS-szekvenciával (expresszált RNS-ek nagy teljesítményű szekvenálása) végzett gének vagy genom-kiterjedt vizsgálatok vizsgálata számos olyan gént azonosított, amelyek expressziója egy adott agyrégióban megváltozott rágcsáló és főemlős függőségi modellekben és az emberi függőkben (pl. 10-17 ref). Az ilyen gének példáit a felülvizsgálat következő részében tárgyaljuk.
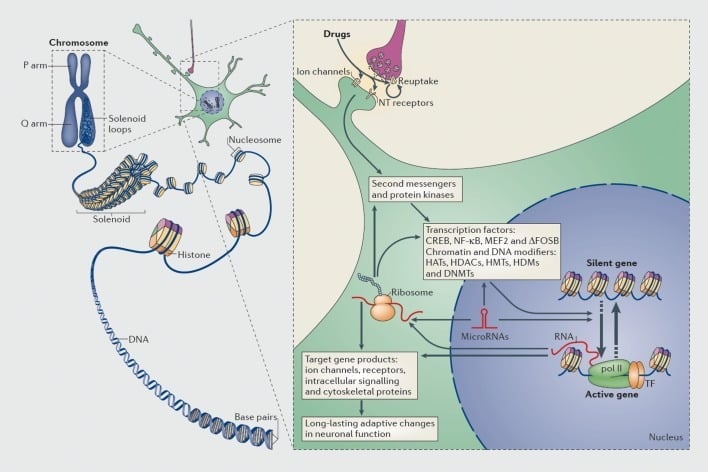
A transzkripciós és epigenetikai szabályozás mechanizmusai a kábítószerrel való visszaélés miatt. Az eukarióta sejtekben a DNS-t a hiszton-oktomerek köré szervezve, hogy nukleozómákat képezzenek, amelyeket ezután tovább szervezünk és kondenzálunk kromoszómák (bal oldali rész) kialakításához. Csak a tömörített kromatin ideiglenes feloldásával a specifikus gén DNS-je hozzáférhetővé válik a transzkripciós géphez. Az intracelluláris jelátviteli kaszkádok (jobb oldali rész) megváltoztatására a visszaélés kábítószerei szinaptikus célpontok, mint például az újrafelvételi mechanizmusok, az ioncsatornák és a neurotranszmitter (NT) receptorok révén hatnak. Ez a transzkripciós faktorok (TF-ek) aktiválódásához vagy gátlásához és számos más nukleáris célponthoz vezet, beleértve a kromatin-szabályozó fehérjéket (vastag nyilakkal jelezve); a kromatin-szabályozó fehérjék szinaptikus szabályozásában résztvevő részletes mechanizmusok még kevéssé érthetőek. Ezek a folyamatok végső soron bizonyos gének indukciójához vagy elnyomásához vezetnek, beleértve azokat, amelyek nem kódoló RNS-ek, például mikroRNS-ek; ezeknek a géneknek néhány megváltozott expressziója tovább szabályozhatja a gén transzkripcióját. Javasoljuk, hogy a kromatin szintjén ezek a gyógyszer által indukált változások némelyike rendkívül stabil és ezáltal alátámasztja a függőséget meghatározó hosszú távú viselkedéseket. CREB, ciklikus AMP-re reagáló elem kötő fehérje; DNMT-k, DNS-metil-transzferázok; HAT-ok, hiszton-acetil-transzferázok; HDAC-k, hiszton-dezacetilázok; HDM-ek, hiszton-demetilázok; HMT-k, hiszton-metil-transzferázok; MEF2, myocyte-specifikus 2 fokozó faktor; NF-kB, nukleáris faktor-KB; pol II, RNS polimeráz II. A ref 44: Robison AJ, Nestler EJ. A függőség transzkripciós és epigenetikai mechanizmusai. Nat Rev Neurosci. 2011: 12: 623-637.
Hasonlóképpen, sokféle transzkripciós faktor - fehérjék, amelyek a gének szabályozó régióihoz kötődnek, és ezáltal növelik vagy csökkentik az ilyen gének transzkripcióját - szerepet játszanak a visszaélés drogjának hosszú távú hatásainak közvetítésében a gén expressziójában az agyban. Jó példák közé tartoznak a CREB (cAMP válaszelem kötő fehérje), AFosB (Fos család transzkripciós faktor), NFkB (nukleáris faktor kB), MEF2 (myocyta-fokozó faktor-2) és glükokortikoid receptorok, többek között.5,10,18-22 Egyre inkább meg lehetett érteni azokat a sejtszignalizációs útvonalakat, amelyeken keresztül a bántalmazás kábítószerei aktiválják az agyban az adott transzkripciós faktort, és az ilyen aktiválást ok-okozati összefüggésbe hozni az adott transzkripciós faktor célgénjeivel és a függőség specifikus viselkedési vonatkozásaival (lásd 1 ábra). Ezt az előrehaladást a CREB és az AFosB vizsgálata szemlélteti, amelyek a legjobban vizsgált transzkripciós faktorok a függőségi modellekben.
cAMP válaszelem kötő fehérje
A visszaélés stimuláló és opiát gyógyszerek aktiválódnak CRE több, a függőség szempontjából fontos agyi régióban, többek között a NAc-ben is.23,24 A CREB ismert, hogy más rendszerekben aktiválódik a cAMP, Ca2+, és növekedési faktor útvonalak,25 és még nem ismert, hogy ezek közül melyik közvetíti a NAc-ben való aktiválódását a visszaélésszerű gyógyszerekkel. A CREB drogaktiválása NAc-ben klasszikus negatív visszacsatolási mechanizmust képvisel, ezáltal a CREB az állat érzékenységének csökkentését szolgálja ezeknek a gyógyszereknek a jutalmazó hatásaival szemben (tolerancia) és negatív érzelmi állapot közvetítésére a gyógyszer megvonása során (függőség)..18,26,27 Ezek a hatások a közelmúltban kimutatták, hogy fokozzák a drog önadagolását és a visszaesést, valószínűleg negatív megerősítéssel.28 Úgy tűnik, hogy ezek a CREB hatásai magukban foglalják a NAc közepes tüskés neuronok mindkét fő altípusát, amelyek túlnyomórészt D-t expresszálnak.1 D ellen2 dopamin receptorok.24 IAz irodalom nagy része azt mutatta, hogy a CREB, a hippocampusban és az amygdala-ban, kulcsfontosságú molekula a viselkedési memóriában.29-31 Ez a széleskörű függőség és viselkedési memória szerepe valószínűleg azt a tényt tükrözi, hogy a neuronok véges számú molekuláris mechanizmussal rendelkeznek, amellyel alkalmazkodni tudnak a folyamatosan változó környezethez.
A CREB célgénjeit, amelyek közvetítik ezt a viselkedési fenotípust, azonosították a genomra kiterjedő vizsgálatok, valamint több kiválasztott erőfeszítés révén.10,18,32 Ilyen például az opioid-peptid-dinamorfin: dinamikus expresszió stimuláló indukciója NAc neuronokban, CREB-en keresztül közvetítve, \ t növeli a k opioid receptorok dinamikus aktiválódását VTA dopamin neuronokon, és ezáltal elnyomja a dopaminerg transzmissziót az NAc-nek és rontja a jutalmat.18 Számos más CREB célpont is bizonyult fontosnak a gyógyszer által indukált szinaptikus plaszticitás szempontjából, amint azt az alábbiakban ismertettük. Míg a CREB számos más agyi régióban is aktiválódik stimulánsok és opiátok által,23,24 kevesebbet tudni e hatás viselkedési következményeiről és azokról a célgénekről, amelyeken keresztül előfordulnak. Hasonlóképpen, kevésbé ismert a CREB szerepe a más bántalmazó szerek cselekedeteinek közvetítésében.19
ΔFosB
A gyakorlatilag bármelyik kábítószerrel való akut expozíció minden Fos család transzkripciós faktorát indukálja a NAc-ben és számos más agyi régióban. Ez az indukció gyors, de rendkívül átmeneti, a Fos fehérje szintje normál értékre változik az 8 alatt 12 óráig. Ezen Fos család egyedülállóan a FosB, a FosB gén csonka terméke, amely szokatlan stabilitásából adódóan fokozatosan halmozódik fel az ismételt gyógyszeres expozíció során és a domináns Fos fehérjévé válik ezekben a körülmények között.22,33 Ezen túlmenően, a stabilitás miatt az AFosB szintje a hatóanyag visszavonását követően hetekig fennmarad. Az ΔFosB ilyen krónikus indukcióját gyakorlatilag minden visszaélés esetén bizonyították34 és a legtöbb gyógyszer esetében szelektív a Dl-típusú NAc neuronokra.34,35 Ez is volt emberi szenvedélybetegeknél.35 Számos szakirodalom kimutatta, hogy az ilyen ΔFosB indukció D-ben1-a NAc típusú neuronok növelik az állat érzékenységét a gyógyszerekkel szemben, valamint természetes előnyökkel járulnak hozzá, és elősegítik a gyógyszer önadagolását, feltehetően a pozitív megerősítés folyamata révén (lásd az 34-t az 38-hoz). Érdekes, hogy a ΔFosB kábítószer-indukálása a NAc-ben drámaibb a serdülőknél, a nagyobb függőség sebezhetősége,39 és nikotin általi indukciója kimutatta, hogy közvetíti a nikotin átjárószerű növekedését a kokain jutalomban.40
Ami a CREB-t illeti, az NAc-ben számos célgént azonosítottak az NAc-ben a jelölt gén és a genom-szerű megközelítések alkalmazásával.10,32 Míg a CREB dinamort indukál, a ΔFosB elnyomja azt, ami hozzájárul a ΔFosB prémium hatásához.38 Egy másik AFosB célpont a cFos: mivel az AFosB ismétlődő gyógyszer-expozícióval halmozódik fel, elnyomja a c-Fos-t, és hozzájárul a molekuláris kapcsoláshoz, ahol az AFosB szelektíven indukálódik a krónikus gyógyszerrel kezelt állapotban.41 Számos egyéb AFosB célpontról kimutatták, hogy közvetítik az egyes kábítószerekkel való visszaélések azon képességét, hogy szinaptikus plaszticitást indukáljanak az NAc-ben, és a NAc közepes tüskés neuronok dendritikus arborizációjában bekövetkező változásokat, amint azt az alábbiakban tárgyaljuk.
A más agyrégiókban az ΔFosB indukció funkcionális következményei kevésbé ismertek, bár az orbitofrontális kéregben (OFC) történő indukcióját részletesen tanulmányozták. Itt az AFosB közvetíti a toleranciát, amely a krónikus expozíció során a kokain kognitív-zavaró hatásaihoz vezet, és ez az alkalmazkodás a fokozott kokain önadagoláshoz kapcsolódik..42,43
A genomra kiterjedő vizsgálatok számos potenciális célgént jeleztek, amelyek közvetítik ezeket a hatásokat.42 A ΔFosB egyedülálló időbeli tulajdonságai és annak ismerete ellenére, hogy a hagyományos memóriaáramkörökben (pl. Hippocampus) indukálódik, még nem készült feltárás a ΔFosB szerepéről a viselkedési memóriában, amely érdekes téma a jövőbeni kutatás számára.
Epigenetikai mechanizmusok
Az utóbbi években a transzkripció tanulmányait egy lépéssel tovább tolták az epigenetikához44 (Lásd: 1 ábra), amely széles körben definiálható a génexpresszió változásaként, amely a DNS-szekvencia változásának hiányában fordul elő. Az epigenetikai mechanizmusok szabályozzák a DNS-nek a sejtmagon belüli csomagolását hisztonokkal és sok más nukleáris fehérjével való kölcsönhatás révén, amelyek együttesen kromatint tartalmaznak. A gén expresszióját e csomagolás állapota szabályozza a hisztonok, más fehérjék és a DNS kovalens módosításával. Mivel csak néhány példa, a hisztonok acetilezése általában elősegíti a génaktiválást, a hisztonok metilálása elősegítheti a génaktiválást vagy a repressziót a Lys-maradéktól függően, amely ezen a modifikáción keresztül megy végbe, és a DNS metilálása általában összefüggésben van a gén-elnyomással, bár a metilezés bizonyos formái ( pl. az 5-hidroxi-metilezés) összefüggésben állhat a génaktiválással.
Az epigenetika vonzó mechanizmus, mivel más rendszerekben, például a fejlődési és a rákbiológiában bizonyos epigenetikai módosítások állandóak lehetnek. Emiatt, az epigenetikát mind a tanulási, mind a memóriamodellekben (pl. 45-48 refs), valamint a függőségben folytatták;44,49 mindkét rendszerben a hiszton-acetilezésben és a metilezésben és a DNS-metilációban jelentős változásokat jelentettek. Mint egy példa, a G9a hiszton-metil-transzferáz mindkét memóriában van jelen50 és függőség.51,52 A függőségi modellekben: A G9a kifejezés nem szabályozott a NAc-ben a stimuláns vagy opiát kábítószerrel való visszaélés hatására és tkimutatták, hogy fokozza e gyógyszerek előnyös hatásait.51,52 Érdekes, hogy a G9a kokainszuppresszióját a ΔFosB közvetíti. A G9a katalizálja a hiszton H9 (H3K3me9) Lys2 dimetilezését, amely a gén elnyomás egyik fő közvetítője. ChIP-chipet vagy ChIP-seq-t (a kromatin immunprecipitációt, amelyet a promóter chipek követnek, vagy nagy áteresztőképességű szekvenálás) használnak arra, hogy genom-széles térképeket készítsenek a NAc génekről, amelyek stimulált vagy opiát expozíciót követően módosított H3K9me2-et mutatnak.32,52,53 A génlisták átfedésével a gén-expressziós változások genom-kiterjedt listáival, valamint az egyéb epigenetikai módosítások genom-kiterjedt térképeivel (pl. ΔFosB-kötés, CREB-kötés, más hisztonmódosítások stb.)32,53 lehetővé kell tenni, hogy azonosítsanak egy egyre komplettebb génkészletet, amelyet a kábítószerek szabályoznak, és megértsék az érintett epigenetikus mechanizmusokat.
A memóriában és a függőségben szerepet játszó epigenetikai szabályozás egy másik formája a mikroRNS-ek generálása. Ezek a kis, nem kódoló RNS-ek az mRNS-ek komplementer régióihoz kötődnek, és ezáltal elnyomják a transzlációjukat vagy indukálják azok lebomlását. Az Argonaut, a miRNS-ek feldolgozásához nélkülözhetetlen fehérje törlése megváltoztatja a kokain viselkedési reakcióit, és a D1-D2-típusú közepes tüskés neuronokhoz hasonló hatásokat észlel.54 Számos specifikus miRNS-t is kimutattak, hogy szabályozzák a kábítószer-expozíciót, és ezáltal befolyásolják a gyógyszerekkel szembeni viselkedési válaszokat (pl. 55,56 refs). Érdekes lesz a jövőben a miRNS-ek mRNS-céljai azonosítására, és jellemezni, hogyan befolyásolják a függőség folyamatát.
Szinaptikus plaszticitás
A glutamatergikus szinapszisokban ugyanazok a szinaptikus módosítások általános típusai, amelyek a hippocampusban és az amygdala-ban szerepeltek a viselkedési memóriában (lásd a jelen cikk többi cikkét), hasonlóan kimutatták, hogy az agy jutalmi régióiban a függőségi modellekben előfordulnak és fontosak a közvetítésben a függőségi folyamat.57,58 Az ilyen kábítószer-indukált szinaptikus plaszticitást számos agyrégióban írták le, de itt a NAc-re koncentrálunk, ahol a legtöbb kutatás a mai napig összpontosított. (ábra 2).
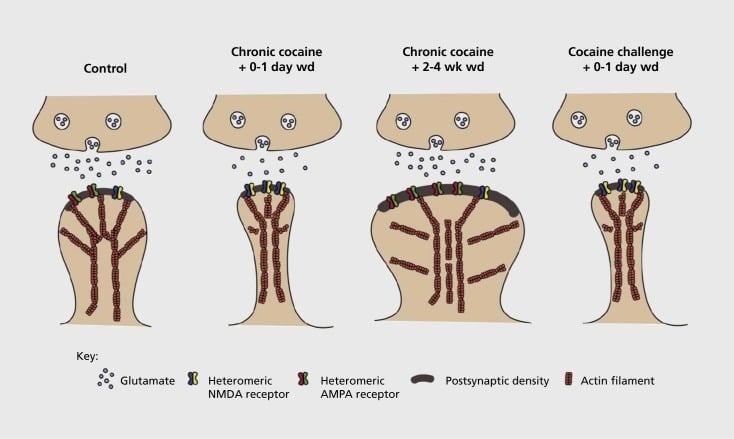
A függőséggel összefüggő szinaptikus és szerkezeti plaszticitás modellje a nukleusz accumbensben (NAc). A kokain krónikus expozíciója az α-amino-3-hidroxi-5-metil-4-izoxazolepropionsav (AMPA) és az N-metil-D-aszparaginsav (NMDA) glutamát receptorok időfüggő és átmeneti átszervezését eredményezi NAc közegben tüskés neuron (MSN) szinapszisok, valamint a NAc MSN gerincfejének strukturális változásai, amelyek korrelálnak a szinaptikus plaszticitás különböző formáival. Például a krónikus kokain az NMDA receptorok felszíni expresszióját, a csendes szinapszis kialakulását és a hosszú távú depressziót (LTD) indítja el korai kilépési időpontokban. A hosszabb távú visszavonás (wd) során ezek a szinaptikus változások megfordulnak, aminek következtében a felületi AMPA-receptorok expressziója fokozódik, a szinapszis konszolidációja gomba alakú gerincré és hosszú távú potencírozás (LTP). Ezek a hatások ismét visszaállnak a kokain hatásos dózisának kitéve, ami a gerinc vékony tüskékké való átalakulásához vezet, és a szinaptikus szilárdság depressziója.
A kezdeti kísérletek azt mutatták, hogy a stimuláns hatóanyagokkal való visszaélés ismételt expozíciója indukál egy (hosszú távú depresszió) -szerű állapotot a glutamáterg szinapszisokban a NAc-ben.59 Azonban a legújabb munkák azt mutatták, hogy a plaszticitás nagyon időfüggő, a LTD pedig az utolsó kokain expozíciót követően hamarosan LTP-ként (hosszú távú potencírozás) alakul ki hosszabb visszavonási időpontok után.60,61 Ez a munka, melyet eddig az elsődlegesen alkalmazott kutatókkal végeztek - az önadagolással ellentétben - meghatározta, hogy szisztematikusabb vizsgálatokat kell végezni az önadagolási modellekben, amelyek nyomon követik a glutamatergikus szinapszisokban előforduló szinaptikus plaszticitás formáit. NAc az önigazgatás megszerzésétől kezdve a fenntartásig, a visszavonás és a kihalás különböző időpontjain, valamint a relapszus-kiváltó ingerekre adott válaszként. Az eddigi munka meghatározta azokat a molekuláris mechanizmusokat is, amelyek hozzájárulnak a gyógyszer által indukált szinaptikus plaszticitáshoz, beleértve az AMPA receptorok kereskedelmét a szinapszisba, ami talán részben CaMKII-n keresztül közvetíthető (Ca2+/ ramodulin-függő protein kináz II) bizonyos AMPA receptor alegységek foszforilációja, valamint az AMPA receptor alegységek megváltozott expressziója (pl. 60,62-65, Az 2 és 3 ábrák). A CREB és az ΔFosB szerepe ezekben a jelenségekben, valamint a glutamatergikus szinapszisok morfológiájának kapcsolódó változásaiban (lásd alább). Például a GluAl a CREB célpontja a NAc-ben, ahol a GluA2 és a CaMKII mind az AFosB célpontjai, ebben az agyi régióban .35,36,66,67 Előre haladva fontos, hogy a szinaptikus függvényben és a függőség viselkedési sajátosságaiban bekövetkező konkrét alkalmazkodásokat összekapcsoljuk az időfüggő változásokkal.
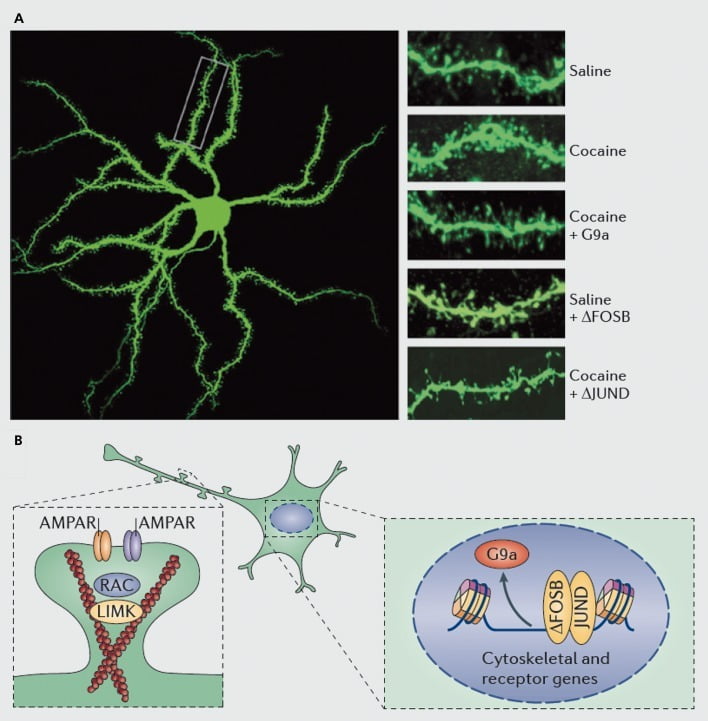
A dendritikus tüskék kokain-indukciójának molekuláris mechanizmusai a nucleus accumbens (NAc) közepes tüskés neuronokon. A) a dendritikus gerincszám kokain által kiváltott növekedését mutatja, amelyet a G9a vagy JunD (AP1-közvetített transzkripció antagonistája) vírusos túlzott expressziója blokkolhat, vagy a FosB vírusos túlzott expressziója utánozhatja. B) Az AMPA receptor (AMPAR) kereskedelem és az aktin citoszkeleton (bal oldalon) szabályozása, valamint a glutamát receptorok és az aktin szabályozó fehérjék transzkripciójának szabályozása (pl., Ahogy a ΔFosB közvetíti, jobbra) fontos szerepet játszik a kokain NAc dendritikus gerincsűrűség-szabályozásának közvetítésében. UMK, LIM domén kináz; RAC, Ras-rokon C3 botulinum toxin szubsztrát.
Az új kísérleti eszközök lehetővé teszik, hogy az első alkalommal egyre nagyobb pontossággal meghatározzuk, hogy az egyes áramkörök hogyan mutatják a szinaptikus plaszticitás ilyen formáit és milyen magatartási rendellenességeket közvetítenek. Például, tA NAc kagylója és alaprégiói különbségeket mutatnak a kábítószer-indukált szinaptikus plaszticitásban, ugyanúgy, mint a D1-versus D2-típusú közepes tüskés neuronokat az egyes alrégiókban.60,63,64,67 Hasonlóképpen, az optogenetikai kísérletek újszerű betekintést nyertek a szinaptikus plaszticitás egy bizonyos formájának (pl. LTD) a NAc-ben a glutamatergikus szinapszisok meghatározott populációiban betöltött szerepére, például a mediális PFC-ből a bazolaterális amygdala és a ventralis aliculum (a fő kimenet) között. hippocampus).68-70 Végső soron szükség lesz a gyógyszer által kiváltott molekuláris adaptációk átfedésére ezekben az afferens idegsejtekben a szinapszis-specifikus adaptációkkal, amelyek a posztszinaptikus dendritjeikben fordulnak elő, hogy teljes körűen megértsék, hogyan befolyásolják a visszaélés kábítószerei az agy áramkörét a függő állapot. Ehhez a törekvéshez nagyobb szükség lesz a gyógyszer által kiváltott plaszticitás felismerésére a gátló szinapszisokban ugyanazon agyrégiókban, amely területre mindeddig nagyon kevés figyelmet fordítottak.65
Teljes sejt plaszticitás
Míg a neuronok neurofiziológiai változásait érintő kutatások többsége a kábítószerrel való visszaélés jelenségeiben, mint a tanulás és a memória jelenségek, a szinaptikus plaszticitásra összpontosított, egyre inkább bizonyíték van a teljes sejtek plaszticitásának fontosságára is. Teljes sejt-plaszticitás, más néven homeosztatikus plaszticitás,71 magában foglalja a teljes idegsejt belső ingerlékenységének megváltozását oly módon, hogy nem szinapszis-specifikus. Tekintettel arra, hogy a kábítószer-függőség bizonyos jellemzői fokozott vagy csökkent érzékenységet okoznak egy gyógyszerre, értelme, hogy bizonyos idegsejtek fokozott vagy csökkent villamos ingerlékenysége hozzájárul ezekhez a viselkedési adaptációkhoz.5
A a legelterjedtebb példa a teljes sejtek plaszticitására a kábítószerrel szemben a krónikus opiátok képessége arra, hogy növelje a lokus coeruleus noradrenerg neuronjainak belső ingerlékenységét (LC).72 Ezt a megnövekedett ingerlékenységet a CREB közvetíti, és az adenilil-cikláz bizonyos izoformáinak indukálását, ami az LC neuronok megnövekedett tüzelését hajtja végre, talán Na + csatornák indukcióján keresztül.72-75 Az LC neuronok ez a hiperexcililitása a tolerancia és a függőség klasszikus mechanizmusát képviseli, és az opiátvonás egyes jeleit és tüneteit hajtja végre. Érdekes, hogy a CREB a teljes sejtes plaszticitás hasonló formáját közvetíti a NAc közepes tüskés neuronokban, amelyek a CREB-n keresztül történő visszaélés krónikus expozíciójával is túlérzékenyek.76 Ezért kritikus lesz a jövőbeni vizsgálatok során annak megértése, hogy a glutamatergikus szinapszisok CREB által közvetített szinaptikus plaszticitása NAc közepes tüskés neuronokon65,66 összegyűjti e neuronok CREB által közvetített belső túlérzékenységét76 a függőség viselkedési sajátosságainak ellenőrzése.
Egy másik példa a teljes sejt plaszticitására a függőségi modellekben a VTA dopamin idegsejtek túlérzékenysége, amely az abusok opiát gyógyszereinek krónikus expozíciója után következik be.és (ábra 4).77,78 Ez az adaptáció, amely ezen idegsejtek morfológiai változásaihoz kapcsolódik (lásd a következő szakaszt), nem közvetíti a CREB-t, hanem a neurotróf jelátviteli kaszkádok szabályozásával érhető el, amint azt az alábbiakban ismertetjük.

A krónikus morfin által kiváltott adaptációk működési modellje a ventrális tegmentális terület (VTA) dopamin neuronjaiban. A krónikus morfin csökkenti a VTA dopamin (DA) soma méretét, ugyanakkor növeli az idegsejtek ingerlékenységét, míg a dopamin átvitele a magba akumbuszba csökken. A morfin nettó hatása kevésbé érzékeny jutalomút, azaz a jutalom tolerancia. Az IRS2-AKT jelzés visszaszorítása a VTA-ban közvetíti a krónikus morfin hatását a soma méretére és az elektromos ingerlékenységre; az ingerlékenységre gyakorolt hatást a csökkent γ-amino-vajsav (GABA) A áramok és a K 'csatorna expressziójának elnyomása közvetíti.. Az mTORC2 aktivitásának morfin által indukált csökkenése a VTA-ban döntő jelentőségű ezeknek a morfin-indukált morfológiai és fiziológiai adaptációknak, valamint a jutalom toleranciának. Az mT0RC2-szel ellentétben a krónikus morfin növeli az mTORCI aktivitást, amely nem befolyásolja ezeket a morfin által indukált adaptációkat. BDNF, agyból származó neurotróf faktor; IRS, inzulin receptor anyag; mTORC, mTOR komplex; AKT, fehérje-kináz B A ref 77-ből származik
Morfológiai plaszticitás és neurotróf mechanizmusok
A hippokampális és agykérgi idegsejtek tanulmányozásából fakadóan növekvő bizonyítékok kimutatták, hogy a szinaptikus plaszticitás változásai a szinapszisok morfológiai változásaihoz kapcsolódnak. Például a LTD és a csendes szinapszisok generálása a vékony vagy makacs dendritikus tüskék kialakulásához kapcsolódik, míg az LTP nagyobb, gomba alakú tüskékhez kapcsolódik.79,80 Érdekes tehát, hogy a kábítószerrel való visszaélés terén a dendritikus tüskék kábítószer által kiváltott változásaira koncentráltak> 15 éve. Krónikus expozíció a visszaélésgátló szerek fokozzák a NAc közepes tüskés neuronjainak dendritikus gerincsűrűségét, ami a Dl-típusú neuronok uralma..67,81,82 A tüskék indukciója többnyire szenzitizált viselkedési válaszokkal társult ezekre a gyógyszerekre, bár néhány bizonyíték ellentétes ezzel a nézettel.
A szinaptikus plaszticitás vizsgálataihoz hasonlóan azonban sokkal több munka szükséges a dendritikus tüskékben bekövetkező változások szisztematikus meghatározásához a gyógyszer önadagolása, visszavonása és visszaesése során. Sa kutatók és önmaguk által beadott gyógyszerek bevonásával végzett tudományok nagyon különböző gerincváltozásokat jeleznek a különböző kivonási időpontokban és a NAc héjban a főbb alrégiókban.83-86 Fontos továbbá meghatározni azokat a pontos molekuláris mechanizmusokat, amelyek révén a kokain vagy más stimuláns ezeket az időfüggő és sejt típusú specifikus hatásokat eredményezi. Az AFosB bizonyítottan szükséges és elegendő az éretlen gerincek indukálásához a Dl-típusú NAc neuronokon.35,51,67 Az ilyen szabályozás a kokain és a αFosB szabályozásával párhuzamosan történik, amely az aktin citoszkeleton reorganizációját szabályozza. Csak egy példa, hogy számos guanin nukleotidcserélő faktor és a GTPáz aktiváló fehérje transzkripciós szabályozása Rac1-et, egy kis GTP-ázot ad ki, az átmeneti aktivitáscsökkenéshez az egyes kokain-expozíciók hatására, és az ilyen pulzatikus csökkenést kimutatták az optogenetikus kontroll segítségével A Rac1 \ t87 A Racl ezen hatásai feltehetően a cofilin és más aktin szabályozó fehérjék szabályozásán keresztül jelentkeznek, amelyekről kimutatták, hogy a gerinc növekedésének kokainszabályozását is közvetítik.87,88 Fontos azonban hangsúlyozni, hogy ez csak egy út vesz részt a kokain éretlen tüskék szabályozásában, mivel számos más fehérje is alapvető szerepet játszik, köztük a CDK5 (ciklin-függő kináz-5), a CaMKII, az NFkB , MEF2, CREB, G9a és DNMT3 (DNS-metiltranszf-törlő 3a), hogy csak néhányat említsünk.20,21,35,51,67,89,90 Érdekes módon számos gén kokainszabályozása, beleértve a CDK5, a CaMKII és az NFkB indukcióját, valamint a G9a elnyomását is, az AFosB-n keresztül közvetül.20,35,51,91
Meglepő módon az ópiátok a visszaélés hatására ellentétes hatást fejtenek ki és csökkentik a dendritikus gerincsűrűséget a NAc közepes tüskés neuronoknál.81 Keveset tudunk ennek az adaptációnak a viselkedési következményeiről és az érintett molekuláris mechanizmusokról. Ez a jelenség ugyanakkor meglepő, mivel a CREB és az AFosB mind stimulánsok, mind az opiátok által indukálva vannak, és mindkettő szerepet játszik a NAc dendritikus gerincsűrűség stimuláns-közvetített indukciójában. Ez felveti azt a kérdést, hogy az opiátok hogyan gátolják a NAc gerincsűrűségét, annak ellenére, hogy ezeket a tényezőket indukálták.
A kábítószerrel való visszaélés modelljeiben tapasztalt morfológiai plaszticitás másik fő formája a krónikus opiát-beadás által kiváltott VTA dopamin neuronok sejtmagjának fizikai csökkenése..77,92,93 Hasonló alkalmazkodás történik a kannabinoidokra adott válaszként.94 Ez a VTA dopamin neuronok zsugorodása, ami az ópiát önadagolásával történik93 és azt a humán heroin-függőknél dokumentálták,77 úgy tűnik, hogy közvetíti a jutalom-toleranciát, és a csökkentett dopamin-kibocsátáshoz kapcsolódik a NAc-ben. Jelentős bizonyítékok azt mutatják, hogy ez a sejt-só méretének csökkenése az agyi eredetű neurotrofikus faktor (BDNF) expressziójának opiát-elnyomását közvetíti ezekben a neuronokban. Ezt az opiát-indukálta BDNF-támogatás visszavonását és a VTA neuronok zsugorodását közvetlenül összekapcsoltuk a lefelé irányuló BDNF jelátviteli kaszkádok csökkent aktivitásával VTA dopamin neuronokban, kifejezetten az IRS2 (inzulin receptor szubsztrát-2), AKT (szerin-treonin) aktivitásának csökkentésével kináz) és a TORC2 (a rapamycin-2 célpontja, amely érzéketlen a rapamicinre).77,93 A BDNF jelátviteli szabályozást közvetlenül kapcsoltuk a megnövekedett ingerlékenységhez, amelyet a morfin ezekben a neuronokban indukál, amint azt korábban említettük.77,78 Valóban, a csökkent sejttömeg és a megnövekedett ingerlékenység szorosan összekapcsolódik, mivel az egyik indukciója a másikhoz vezet, és fordítva. Ez a kontroll a sejtek ingerlékenysége felett a K szuppresszióját jelenti+ csatornák és a GABAA idegsejtekben.
Ez a BDNF szerepe a VTA szintjén a morfinválaszok szabályozásában ellentétben áll azzal, hogy a kokain és más stimulánsok tevékenységeiben nagyon különböző szerepet játszanak. A stimulátorok BDNF jelátvitelt indukálnak az NAc-nek, ami a BDNF fokozott lokális szintézisének, valamint több afferens régió fokozott felszabadulásának köszönhető.95 Ezenkívül kimutatták, hogy a NAc-ben, de nem a VTA-ban a megnövekedett BDNF-jelátvitel elősegíti ezen gyógyszerek viselkedési hatásait, beleértve az önadagolást is.95,96 A BDNF jelátvitel ellentétes szabályozása a VTA-NAc útvonalban az opiátokkal szemben a stimulánsokkal felveti annak lehetőségét, hogy ezek a különbségek közvetítsék a gyógyszerek ellentétes NAc dendritikus tüskék szabályozását, ezt a lehetőséget jelenleg vizsgálják.
Jövőbeli irányok
A fenti elbeszélés kiemeli a hatalmas előrelépéseket, amelyek az agy jutalmi régióiban előforduló molekuláris és celluláris adaptációk megértésében tettek szert a visszaélés kábítószerrel való ismételt kitettségre adott válaszként, valamint az állatkísérletekben a függőségi szindrómák bizonyos viselkedési jellemzőihez való egyéni alkalmazkodásban. . Ezen előrelépések ellenére továbbra is jelentős kérdések merülnek fel. A meglévő ismereteink nagy része a VTA-ra és a NAc-re összpontosít, sokkal kevésbé áll rendelkezésre információ a más fontos limbikus agyrégiókról, amelyek szintén fontosak a kábítószer-függőség szempontjából. Ezen túlmenően a molekuláris-celluláris adaptáció okozati szerepének kísérleti bemutatása egy gyógyszerrel kapcsolatos viselkedésben egyenként módosította az egyéni adaptációkat. A sokféle adaptáció egyidejű kezelése egyértelműen sokkal nehezebb, de elengedhetetlen is, mivel tudjuk, hogy a gyógyszerek számos különféle típusú változást hoznak létre az egyes neuronokon belül is, ami valószínűleg bonyolult módon befolyásolja a viselkedést. Egy ilyen rendszerbiológiai megközelítés döntő fontosságú lesz a függőség biológiai alapjainak megrepedéséhez. Végül, a függőséggel kapcsolatos emlékek molekuláris-sejtes mechanizmusainak megértésére irányuló erőfeszítések abban a pontban találhatók, amikor minden más erőfeszítés a viselkedési memória biológiai alapjainak megértésére küzd: a biológiai jelenségek komplex viselkedési memóriával való összekapcsolásának képessége rendkívül nehéz. Ennek a szakadéknak a leküzdése talán a legnagyobb kihívás az idegtudományokban.
Kiválasztott rövidítések és rövidítések
- nac
- nucleus accumbens
- CRE
- cAMP válaszelem kötő fehérje
- ΔFosB
- Fos család transzkripciós faktor
- VTA
- ventrális tegmentális terület
- AMPA
- a-amino-3-hidroxi-5-metil-4-izoxazolepropionsav
- LTD
- hosszú távú depresszió
- LTP
- hosszú távú védekezés
- BDNF
- agyi eredetű neurotróf faktor
- NKkB
- kB nukleáris tényező
REFERENCIÁK