MEGJEGYZÉSEK: Az egyik olyan tanulmány, amely az absztinenciát befolyásolja a dopamin receptorok szintje a főemlősökben.
- A D2 receptorok meglehetősen gyorsan - kevesebb, mint egy hónap alatt - visszapattannak
- A D1 receptorok egy hónap alatt túl magasak, de az 90 napokon belül visszafordulnak.
- A magas vagy alacsony D1 receptorok kulcsfontosságúak lehetnek az akut kivonás és a vágyakozásban
Neuropsychop (2009) 34, 1162 – 1171; doi: 10.1038 / npp.2008.135; közzétett online 3 szeptember 2008
Thomas JR Beveridge1, Hilary R Smith1, Michael A Nader1 és Linda J Porrino1
1Fiziológiai és Farmakológiai Tanszék, Gyógyszerhasználat Neurobiológiai Kutatóközpontja, Wake Forest Egyetem Orvostudományi Iskola, Winston-Salem, NC, USA
Levelezés: Dr. LJ Porrino, Fiziológiai és Farmakológiai Tanszék, Kábítószer-visszaélések neurobiológiai vizsgálatának központja, Wake Forest Egyetem Orvostudományi Iskola, Medical Center Boulevard, Winston-Salem, NC 27157-1083, USA. Tel: + 1 336 716 8575; Fax: + 1 336 716 8501; Email: [e-mail védett]
29. április 2008-én érkezett; Felülvizsgált 25. július 2008 .; Elfogadva 30. július 2008 .; Megjelent online 3. szeptember 2008-án.
Absztrakt
Bár a dopamin (DA) rendszeren belüli diszreguláció a krónikus kokain-expozíció jellemzője, a kérdés, hogy ezek a változások az absztinenciában továbbra is fennmaradnak-e, nagyrészt megválaszolatlan. A nem humán főemlősök ideális modellt jelentenek a krónikus kokain-expozíciót követő DA rendszerre gyakorolt absztinencia hatásainak felmérésére. Ebben a vizsgálatban a férfi rhesus majmok önmagukban adták be a kokainot (0.3 mg/kg / injekció, 30 erősítők per munkamenetben) fix intervallumban 3-min s100 napokra, majd 30 vagy 90 napok absztinenciájára. A kokain önadagolásának időtartama korábban kimutatta, hogy csökkenti a DA D2-szerű receptor sűrűségét és növeli a D1-szerű receptorok és DA transzporterek (DAT) szintjét.. A kontroll majmok reagáltatását az élelmiszer-prezentáció azonos protokollal és ugyanazokkal az absztinenciaidőszakokkal tartotta fenn. [3H]SCH 23390 kötelező A DA D1 receptorok az 30 abstinencia napjait követően szignifikánsan magasabbak voltak a striatum minden részében, összehasonlítva a kontroll állatokéval, míg [3H]A DA D2 receptorokhoz kötődő racloprid kötés nem különbözött a csoportok között. [3H]A 35 428 kötődése a DAT-hoz szignifikánsan magasabb volt a dorzális és ventrális striatum gyakorlatilag minden részében az 30 abstinenci napok után. Az 90 absztinencia napja után azonban a DA D1 receptorok és a DAT szintje nem különbözött a kontroll értékektől. Bár ezek az eredmények azt mutatják, hogy a DA rendszer különálló elemeinek helyreállítása lehetséges, ezek a komponensek dinamikus jellegét is kiemelik a krónikus kokain önadagolásból való absztinencia kezdeti fázisaiban.
Kulcsszavak:
kokain, dopamin, autoradiográfia, absztinencia, striatum
BEVEZETÉS
A krónikus kokainhasználatot az emberfüggők körében a dopamin (DA) rendszer neuroadaptációjával társították (Átok et al, 1998; Volkow et al, 1993, 1997). Ezek közé tartozik a DA transzporterek (DAT) sűrűségének növekedése és a DA D2-szerű receptorok koncentrációjának csökkenése (Kicsit et al, 1999; Mash et al, 2002; Volkow et al, 1993). Emellett megfigyelték a DA felszabadulás változását is. Például a pozitron emissziós tomográfiai (PET) vizsgálatokat végző kutatók [11C]a racloprid és a metilfenidát a DA felszabadulás csökkenését mutatta a krónikus kokainhasználók striatumában (Volkow et al, 1997; Wong et al, 2006). Az egyik probléma azonban az, hogy gyakran nehéz kizárni más olyan tényezők hatását, mint az egyéb illegális és törvényes gyógyszerek alkalmazása, az előzetes kábítószer-bevitel és a felhasználási minták közötti különbségek, valamint az életmód különbségei. Ezek a különbségek, valamint a kábítószer-használat előtti feltételek megléte korlátozhatja a humán betegekben végzett vizsgálatok értelmezését.
A nem humán főemlős modellek, amelyekben a változók rendszeresen manipulálhatók, alternatív megközelítést jelentenek a krónikus kokain önadagolás és az azt követő absztinencia következményeinek vizsgálatára. Korábbi vizsgálatok kimutatták, hogy a krónikus kokain expozíciót a DA D2 receptorok koncentrációjának jelentős csökkenése, valamint a D1 receptorok szintjének és a DAT sűrűségének csökkenése kíséri.Letchworth et al, 2001; Moore et al, 1998a, 1998b; Nader et al, 2002, 2006). Ezek a hatások tükrözik az embereknél tapasztalt hatásokat, ezáltal alátámasztva ezeknek a gyógyszer-expozíciós modelleknek a hasznosságát.
Annak ellenére, hogy jelentős bizonyítékok állnak rendelkezésre a DA-rendszerek dysregulációjával kapcsolatban, nehezebb értékelni, hogy van-e bizonyíték arra, hogy a kábítószer-használat megszűnése után a gyógyulás helyreáll-e (Átok et al, 1998; Jacobsen et al, 2000; Volkow et al, 1993), vagy ezek a változások a kokain expozíció folytatásának határideje után is fennállnak. Ismét a nem humán főemlős modellek betekintést nyújthatnak a függőség e szakaszába. tarhonyával et al (1992) beszámoltak a DAT és D1-szerű receptorok koncentrációjának csökkenéséről a majmok striatumában, miután a krónikus noncontingent kokain-expozíció absztinenciája következett be. Az absztinencia sajátos szerepét azonban nehéz volt meghatározni, mert nem volt absztinenciaidőszak alatt egy csoport. Hasonló módon, Melega et al (2008) jelentették a DAT szignifikáns csökkenését a vervet majmok striatumában, miután 3 hetek absztinenciája volt a fokozódó metamfetamin kezelési rendből. A stimulánsok mindkét vizsgálatban történő beadása azonban nem volt összefüggésben. Az alkalmazás módja (kontingens vs kimutatták, hogy mindkét DA felszabadulás tekintetében eltérően hat az agyra (Hemby et al, 1997) és a glükóz anyagcsere (Graham és Porrino, 1995; Porrino et al, 2002). Így az önigazgatás használata a jelen tanulmányban megkerüli ezt a problémát. Ezen túlmenően a hosszú távú kokain önadagolásának hatását az agy DA rendszerekre széles körűen tanulmányozták a rhesus majmok önadagolásának ezen modelljével, ezáltal alapértéket szolgáltatva az absztinencia során fellépő neuroadaptációk értékelésére.
A vizsgálatok célja tehát annak meghatározása volt, hogy a DAT és DA D1 és a D2 receptor koncentrációk változásai, amelyeket korábban kimutattak a kokain önadagolásának kitett állatokban (Letchworth et al, 2001; Moore et al, 1998a, 1998b; Nader et al, 2002) a hosszabb tartózkodási időszakok után megfordulna. Az emberi kábítószer-használókkal végzett vizsgálatok alapján (vö Volkow et al, 1993), feltételeztük, hogy ezek a DA-rendszerben bekövetkezett változások az 3 hónapok absztinenciája után is fennmaradnak. Ebből a célból a majmok önmagukban adták be a kokainot az 100 szekciókhoz, az 900 teljes bevitelével mg/kg, majd 30 vagy 90 napok absztinenciája a gyógyszerből. A DA D1 és a D2 receptorokat, valamint a DAT-t kvantitatívan mértük in vitro receptor autoradiográfia.
MÓD
Tantárgyak
Összesen 17 kísérletileg naiv felnőtt férfi rhesus majmok (Macaca mulatta) az 7.7 és az 13 között A vizsgálat kezdetén kg (átlag ± SD, 10.2 ± 1.32) volt alanyként. Az összes eljárást a megállapított gyakorlatnak megfelelően hajtottuk végre A laboratóriumi állatok gondozására és használatára vonatkozó nemzeti egészségügyi intézmények útmutatója. Emellett a Wake Forest Egyetem Állatgondozási és Felhasználási Bizottsága minden eljárást felülvizsgálta és jóváhagyott. A majmokat egyedileg rozsdamentes acél ketrecekben tartottuk vízzel ad libitum; az állatoknak fizikai és vizuális érintkezésük volt. Testtömegüket körülbelül 90 – 95 értéken tartottuk% a kísérleti ülések során nyert banán-ízű pelletek szabadon adagolható súlyának és a Lab Diet Monkey Chow kiegészítő táplálásának köszönhetően, amelyet legkorábban az 30 adtak meg min. Emellett hetente legalább háromszor friss gyümölcsöt vagy földimogyorót kaptak. Mindegyik majom hetente egyszer megmérésre került, és szükség esetén a táplálékot úgy állítottuk be, hogy stabil súlyokat tartsanak fenn.
Viselkedési eszközök
A kísérleti üléseket szellőztetett és hangcsillapított operátorkamrákban végeztük (1.5 × 0.74 × 0.76 m; Med Associates Inc., East Fairfield, VT), amely egy főemlős szék elhelyezésére készült (R001; Primate Products, Redwood City, CA). A kamra egy intelligens panelt tartalmazott (48 × 69 cm), amely két visszahúzható karból állt (5 cm széles) és három ingerlámpa. A karok a főemlős székben ülő majom könnyen megközelíthetők voltak. Banán-ízű élelmiszer-pelletek (1 g; A Bio-Serv, Frenchtown, NJ) a kamra tetején elhelyezett adagolóból szállították. A perisztaltikus infúziós pumpa (7531-10; Cole-Parmer Co., Chicago, IL) a gyógyszer injekció beadására körülbelül 1 sebességgel történt. ml / 10 s azoknak az állatoknak, akik önmagukban adagolják a kokainot. A kamrák működtetése és az adatgyűjtés egy Power Macintosh számítógépes rendszerrel valósult meg, egy interfésszel (Med Associates Inc.).
Műtéti beavatkozások
Az összes majmot, beleértve a kontrollokat is, steril körülmények között, belsõ intravénás katéterekkel és vaszkuláris hozzáférési portokkal (Model GPV; Access Technologies, Skokie, IL) készítettük. A majmokat ketamin (15.) Kombinációjával érzéstelenítettük mg/kg, im) és butorfanol (0.03 mg/kg, im) és egy metszés történt a combcsont véna közelében. A vén tompa szétválasztása és elkülönítése után a katéter proximális végét behelyeztük a vénába egy olyan távolságra, amelyet úgy számítottak ki, hogy az a vena cava alsó szakaszában végződik. A katéter disztális végét szubkután csavart hajtottuk végre a hátoldal közepétől kissé leeresztett metszésig. A vaszkuláris belépőnyílást egy zsebbe helyeztük, amely tompa szétválasztással alakult ki a bemetszés közelében. A majmokat 24 – 48-nek adták h helyreállítási idő az élelmiszer-megerősítésre való visszatérés előtt. Körülbelül 5 nappal a terminális eljárás előtt mindegyik majom krónikusan elhelyezett katéterrel beültetett a szomszédos combcsont artériába időzített artériás vérminták összegyűjtésére. A sebészeti beavatkozások megegyeztek a vénás katétereknél leírtakkal. Az utolsó ülés napján végleges agyi glükóz anyagcsere-vizsgálatot végeztek, amelyben a majmokat 2- \ t[14C]deoxiglükóz (2-DG) körülbelül 2 perccel a szekció befejezése után, és vérmintákat vettünk az artériás katéteren keresztül egy 45-en min Beveridge et al, 2006 a részletekért). Az ezekből a vizsgálatokból származó anyagcsere-adatok itt nem szerepelnek.
Önfenntartási eljárások
A majmok először képzettek arra, hogy válaszoljanak a két kar egyikére, hogy megerősítsék az egyes válaszokat a megfelelő karon egy élelmiszer-pellettel. Körülbelül egy 3-hetes időszak alatt fokozatosan nőtt az élelmiszer-pelletek rendelkezésre állása közötti időintervallum, amíg egy 3-perc intervallumot el nem értek (azaz a rögzített intervallumú 3-min erősítés ütemezését; Az utolsó ütemezési körülmények között az első válasz a karon az 3 után min az élelmiszer-pellet szállítását eredményezte; az 30 élelmiszer-előadások után befejeződött. Minden egyes ülés végén a válaszkarok visszahúzódtak, a háztartási fények és az ingerlámpák eltűntek, és az állatok a sötétített kamrában maradtak kb. min., mielőtt visszatértek a ketrecbe. Az összes majom az FI 3-min táplálék-prezentáció menetrendjében válaszolt legalább 20 szekcióban, és amíg stabil teljesítményt nem kaptunk (± 20% három egymást követő munkamenetben, a válaszarányok alakulása nélkül). Amikor az élelmiszer-fenntartott válasz stabil volt, az adagolót kihúzták, és a kihalás hatását a válaszadásra öt egymást követő ülésen vizsgáltuk, majd a reakciót helyreállították és fenntartották az élelmiszer-megjelenítéssel.
A kiindulási teljesítmény megállapítása után az összes majmot a fentiekben leírt módon vénás katéterekkel állítottuk elő, és véletlenszerűen három csoportba soroltuk. A majmok egy csoportja kontrollként működött, és továbbra is válaszolt az FI 3 min.N=6). A fennmaradó 11 majmokat a kokain önadagoló csoportjába (0.3 mg/kg / injekció). Mert 0.3 mg/A kokain egy injekciónkénti kg-ját korábban a kokain-naiv majmok nagy dózisának tekintették, a legtöbb állatnál ez a dózis két alkalommal történt meg, először lehetővé téve a majomnak, hogy önállóan beadja a 0.1-ot mg/kg kokain. Az élelmiszer-fenntartott teljesítmény a műtét után (kb. 4 – 6 nap) stabilizálódott, mielőtt megkezdődtek a kokain önadagolása. Minden kísérleti munkamenet előtt az állat hátsó részét 95-el tisztítottuk% az etanol és a betadin-bozót és egy 22-mérő Huber Point tű (PG20-125 modell) a vénás katéterhez vezető portba került, és a kokainoldatot tartalmazó infúziós pumpa a katéterhez csatlakozik. A munkamenet megkezdése előtt a szivattyút kb s, töltse ki a portot a kísérleti ülés során rendelkezésre álló kokaindózissal. Az ülések az 30 injekciók után végződtek; mint a kontroll körülmények között, a majmok a sötétített kamrában maradtak körülbelül 30 körül min. Minden egyes ülés végén a portot heparinizált sóoldattal töltöttük (100 U/ml) a véralvadás megelőzésére.
A kísérleti munkameneteket minden nap körülbelül ugyanabban az időben végeztük, és összesen 100 munkamenetet folytattunk. Az 100 szekciók befejezését követően az 30 vagy 90 napok absztinenciájú periódusát vezettük be, amelynek során a katétereket naponta heparinizált sóoldattal öblítettük, de nem végeztek kokain- vagy élelmiszer-önadagolást. A kontroll csoportban az 30 napok absztinenciáját négy állatban és 90 napokban határozták meg a két másikban. A kokaincsoport esetében az 30 napok absztinenciaidőt nyolc állatra és 90 napra három állatra vetették. Az absztinencia időtartamának végén egy végső önadminisztrációs munkamenetet (élelmiszer-kontroll vagy kokain) végeztünk, és az 2-DG eljárást közvetlenül az ülés után kezdeményezték. Két kontrollban és négy kokain önadagoló állatban az 30-napi absztinencia csoportban nem kaptak kokainot az utolsó ülésen. Az állatokat humán módon megölték pentobarbitál túladagolásával (100 mg/kg, iv) az 45 végén min nyomjelző felvételi időszak.
Szövetfeldolgozás
A leölést követően az agyat azonnal eltávolítottuk, blokkoltuk és izopentánban -35-on -55 ° C-ra fagyasztottuk, majd -80 ° C-on tároltuk. A striatumot tartalmazó szövetblokkot ezután -20 ° C-on krónosztáttal vágtuk a koronális síkban 20-ba μAz elektrosztatikusan feltöltött tárgylemezekre gyűjtött metszeteket egy éjszakán át vákuumban szárítottuk 4 ° C-on, majd -80 ° C-on tároltuk addig, amíg az autoradiográfiás feldolgozásra nem kerül sor. Az agyszakaszokat a caudate mag, a putamen és a nucleus accumbens részekből gyűjtöttük össze, amelyek az elülső commissure-hoz rostrálisan fekszenek. Ezt a régiót úgy nevezik, mint a pre-hasural striatum. Ezenkívül a preumissuralis striatum rostrális és caudalis szintjeit az atom accumbensre hivatkozva jelöljük. A rostrális előszegélyes striatum az a régió, ahol az atommagok nem különböznek egymástól különböző héj- és magkomponenseknek. A caudalis előszárnyas striatum az a régió, amely egybeesik a magvak és a mag magja megjelenésével, amely a szagló tubercle kialakulásának hátsó része. Mindegyik kötési vizsgálathoz két szomszédos szekciót vettünk mind az öt szinten (két rostrális és három caudalis) az előzetes hasi striatumon keresztül egy állatonként összesen 10 szekciókhoz.
D1 Receptor Binding
A DA D1 receptor kötőhelyének sűrűségét a következőkkel határozzuk meg: [3H]SCH 23390 (specifikus tevékenység - 85 Ci/mmol; PerkinElmer, Boston, MA) mennyiségi szempontból in vitro a receptorok autoradiográfiája az alkalmazott eljárások szerint Lidow et al (1991) és a Nader et al (2002). A szekciókat előinkubáltuk 20-re min. pufferben (50 mM Tris, 120 mM NaCl, 5 mM KCI, 2 mM CaCl2, 1 mM MgCI2, pH 7.4, 25 ° C) az endogén DA, kokain és [14C] az 2-DG eljárásából. A szekciókat ezután 30-hez inkubáltuk percben ugyanabban a pufferben, pH 7.4, 25 ° C, amely 1-ot tartalmaz mM aszkorbinsav, 40 nM ketanserin és 1 nM [3H]SCH 23390. Inkubálás után a szakaszokat kétszer öblítettük 20-re s 1-et tartalmazó pufferben mM aszkorbinsav pH-n 7.4, 4 ° C, majd 4 ° C-on desztillált vízbe merítve, és hűvös levegőáramban szárítottuk. A nemspecifikus kötődést úgy határoztuk meg, hogy az inkubációs oldatban lévő szomszédos szakaszokat 5 jelenlétében inkubáltuk. μM (+) -Butaclamol. Szekciók, kalibrált [3H] az autoradiográfiás szabványokat (Amersham, Piscataway, NJ) a Kodak Biomax MR filmhez (Fisher Scientific, Pittsburgh, PA) 6 hetekre telepítették.
D2 Receptor Binding
A DA D2 receptor kötőhelyeinek sűrűségét és eloszlását a következőkkel határoztuk meg: [3H]racloprid (specifikus aktivitás, 87 Ci/mmol; PerkinElmer) Lidow et al (1991) és a Nader et al (2002). A szekciókat előinkubáltuk 20-re min. pufferben (50 mM Tris, 120 mM NaCl, 5 mM KCl, pH 7.4, 25 ° C) az endogén DA, kokain és [14C] az 2-DG eljárásából. A lemezeket ezután 30-hez inkubáltuk percben ugyanabban a pufferben, amely 5-ot tartalmaz mM aszkorbinsav és 2 nM [3H]rakloprid. A szakaszokat öblítettük 3 × 2 percben, pufferben, pH = 7.4, 4 ° C, majd desztillált vízbe mártottuk 4 ° C-on, és hűvös levegőáramban szárítottuk. A nemspecifikus kötődést úgy határoztuk meg, hogy az inkubációs oldatban lévő szomszédos szakaszokat 1 jelenlétében inkubáltuk. μM (+) -Butaclamol. Szekciók, kalibrált [3H] az autoradiográfiás szabványokat a Kodak Biomax MR filmhez 8 hetekben alkalmazták.
Dopamin transzporter kötés
Meghatároztuk a DAT kötőhelyek sűrűségét [3H]WIN 35,428 (specifikus aktivitás, 87 Ci/mmol; PerkinElmer) autoradiográfiája az alkalmazott módszerek szerint Canfield et al (1990) és a Letchworth et al (2001). A szövetszakaszokat pufferben előinkubáltuk (50 mM Tris, 100 mM NaCl, pH 7.4, 4 ° C) 20 esetén min az összes maradék DA, kokain és [14C] az 2-DG eljárásából. A szekciókat ezután 2-hez inkubáltuk h 4 ° C-on ugyanabban a pufferben, amely 5-et tartalmaz nM [3H]WIN 35 428. A szakaszokat összesen 2-re öblítettük percen át 4 ° C-on, majd 4 ° C-on desztillált vízbe mártottuk, és hideg levegő alatt szárítottuk. A nemspecifikus kötődést úgy határoztuk meg, hogy az inkubációs oldatban lévő szomszédos szakaszokat 30 jelenlétében inkubáltuk. μM kokain. Szekciók, kalibrált [3H] az autoradiográfiás szabványokat a Kodak Biomax MR filmhez 6 hetekben alkalmazták.
Denzitometria és adatelemzés
A filmeket Kodak GBX fejlesztővel, stopfürdővel és Rapid Fixerrel (VWR, West Chester, PA) fejlesztettük ki, majd öblítettük. Az autoradiogramok analízisét kvantitatív denzitometriával, számítógépes képfeldolgozó rendszerrel (MCID, Imaging Research; InterFocus Imaging Ltd, Cambridge, UK) végeztük. Az optikai sűrűség értékeit fmol-ra alakítottuk át/mg (nedves tömegű szövet) a kalibrált érték alapján [3H] szabványoknak. A specifikus kötődést úgy határoztuk meg, hogy a nem-specifikus kötődés képeit digitálisan kivontuk a teljes kötés egymásba eső szomszédos képeiből. A struktúrákat Nissl-festéssel azonosítottuk a receptorokhoz kötődő részek szomszédságában. Az egyes vizsgálatok adatait egymástól függetlenül elemeztük egyirányú varianciaanalízissel, majd a legkisebb négyzetbeli különbségeket post hoc tesztek több összehasonlításhoz. Minden régió külön elemzést tartalmazott. Mivel az 30 és 90 napok ellen szülött kontrollállatokból származó kötési adatok nem különböztek szignifikánsan egymástól, hasonlóan a korábbi vizsgálatokhoz (Nader et al, 2002), a kontrollcsoportok adatait kombináltuk. Ezen túlmenően nem volt szignifikáns különbség a kokain és a végső munkamenetben nem vett állatok adatai között, így ezekből a csoportokból származó adatokat is kombináltak.
EREDMÉNYEK
A krónikus kokain-önigazgatás absztinenciájának hatása az 30 napokra
A [3H]A SCH 23390 DA D1 receptorokhoz való kötődését a pre-hasural striatumban mutatjuk be Táblázat 1. A [3H]Az SCH 23390 nagyobb volt, mint az 90% teljes kötés. A korábbi jelentésekkel összhangban (Moore et al, 1998a; Nader et al, 2002), a [3H]SCH23390 és D1 receptorok a nem hatóanyaggal kezelt kontroll állatokban heterogének voltak, és szignifikáns különbségek voltak a striatum alrégiói közötti kötődés mértékében. A címkézés sűrűbb volt a rostrális és mediális részekben a striatumban.
A kokain-expozíciótól való 30-napok után a D1-receptorokhoz való kötődést az előszárnyas striatum teljes rostralis-caudalis kiterjedésének széles körű emelkedése jellemezte, összehasonlítva a nem hatóanyaggal kezelt kontrollállatok kötési sűrűségével (Táblázat 1; ábra 1). A rostrálisabb striatumban a koncentrációk szignifikánsan magasabbak voltak a caudate-magban, beleértve a dorsolateralis (+27%), központi (+27%), dorsomedial (+27%) és ventromedial (+23%) részek, valamint a hátsó részekben (+17%), központi (+22%) és ventrális (+23%) a putamen részei, összehasonlítva a nem kábítószerrel kezelt állatok sűrűségével. Jelentős emelkedés volt megfigyelhető az accumbens magban is.+23%) ezen a szinten. A striatum szintjén, ahol a mag magja és héja a legkülönbözőbb, a D1-szerű receptorok sűrűsége is szignifikánsan magasabb volt a dorsolaterális egészben (+31%), központi (+29%), dorsomedial (+30%) és ventromedial (+18%) caudate mag, valamint a dorsalis (+23%), központi (+29%) és ventrális (+28%) putamen, összehasonlítva a nem hatóanyaggal kezelt kontrollok sűrűségével. Ezen a szinten a ventrális striatumban a D koncentrációja1 a receptorok kötőhelyei magasabbak voltak a sejtmagban (+45%) és héj (+20%), valamint a szagló tubercle-ben (+26%) a kontrollok sűrűségéhez képest.
Ábra 1.
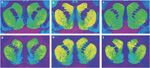 Reprezentatív autoradiogramok [3H] SCH 23390 kötődik a D1 receptorokhoz (felső panel) és [3H]WIN 35428 kötődés dopamin transzporterekhez (alsó panel) a rhesus majom striatum koronális szakaszaiban. (a, d) Ellenőrizze az állati válaszokat az élelmiszer-megerősítésre. (b, e) A kokain önadagoló állata, 30 napok absztinenciájával. (c, f) A kokain önadagoló állata, 90 napok absztinenciájával.
Reprezentatív autoradiogramok [3H] SCH 23390 kötődik a D1 receptorokhoz (felső panel) és [3H]WIN 35428 kötődés dopamin transzporterekhez (alsó panel) a rhesus majom striatum koronális szakaszaiban. (a, d) Ellenőrizze az állati válaszokat az élelmiszer-megerősítésre. (b, e) A kokain önadagoló állata, 30 napok absztinenciájával. (c, f) A kokain önadagoló állata, 90 napok absztinenciájával.
A [3H]A DA-D2 receptorokhoz kötődő racloprid kötődés a pre-hasural striatumban látható Táblázat 2. Speciális kötés [3H]A raclopride nagyobb volt, mint az 90% teljes kötés. A [3H]A D2 receptorokhoz kötődő racloprid kötődése heterogén volt a dorzális és ventrális striatum alrégióiban is, mint a korábbi jelentésekben (Moore et al, 1998b; Nader et al, 2002). A nem hatóanyaggal kezelt kontrollokban a D2-kötőhelyek nagyobb koncentrációi voltak jelen a dorzálisban a ventrális striatumhoz képest. Ezen túlmenően bizonyítottak, hogy a striatum több oldalsó részében a kötőhelyek magasabb koncentrációi mediális-laterális gradienst mutatnak.
Az 30 abstinencia napja után a D2 receptorok kötődése a kokainnak kitett és az élelmiszerrel megerősített állatokban a striatum legtöbb régiójában nem különbözött szignifikánsan egymástól. A kötőhelyek nagyobb koncentrációit figyelték meg a ventrális putamenben (+10%) és az elülső magszemek (+12%) a kokain által kitett majmok szövetében a kontrollokhoz képest. Más jelentős különbség nem volt megfigyelhető.
A [3H]A WIN 35428 DAT-hez való kötődése a pre-hasural striatumban látható Táblázat 3. A korábbi jelentésekkel összhangban (Letchworth et al, 2001), a DAT-helyekhez való kötődés a nem hatóanyaggal érintkezett állatoknál nagyobb volt a hátsóban, mint a ventrális striatum. A magban a magban nagyobb sűrűséget figyeltünk meg a héj-osztásokhoz képest. Végül a nemspecifikus kötés kevesebb, mint az 10% a teljes összeg.
A kokain-expozíciótól való 30-nap elteltével a DAT-hez való kötődés szignifikánsan magasabb volt a striatum legtöbb régiójában, az elülső commissure-hoz képest, szemben a nem hatóanyaggal kezelt kontrollállatok kötődésével (ábra 1). Pontosabban, a DAT-kötőhelyek koncentrációja rostrális szinten szignifikánsan magasabb volt a központi (+22%), dorsomedial (+25%) és ventromedial (+28%) caudate mag és a hátsó (+16%) és központi (+23%) putamen, összehasonlítva az élelmiszer-megerősített kontrollokkal. Ezenkívül szignifikánsan magasabb kötődés volt a DAT-hez az elülső magban.+37%) kokainban - az élelmiszer-megerősített majmokhoz képest. A pre-hasuralis striatum több fafajú részén belül a DAT kötőhelyek sűrűsége szignifikánsan magasabb volt a központi caudate magban (+21%) és putamen, központi (+20%) és ventrális (+19%; ábra 1). Ezen a szinten a ventrális striatumon belül a DAT-hez való kötődés szignifikánsan magasabb volt a mag-akumbens magban (+20%) és a szagló tubercle (+24%) a kokainból származó szövetekben vs élelmiszer-megerősített majmok.
A krónikus kokain-önigazgatás absztinenciájának hatása az 90 napokra
Ellentétben az 1 absztinencia utáni kokain-expozíciós állatokban megfigyelt D30 receptor kötőhelyek sűrűségének széles körű eltéréseivel, az 90 abstinencia napja után nem volt szignifikáns különbség az élelmiszer-erősítésű kontrollokhoz képest az előzetes rezisztencia bármely részében. striatum (Táblázat 1; ábra 1). Hasonlóképpen a [3H]az 2 abstinencia utáni előduralis striatumban a DA D90 receptorokhoz való kötődés nem szignifikánsan különbözött a nem hatóanyag-expozíciós állatok esetében alkalmazottaktól.Táblázat 2).
A koncentráció [3H]A WIN 35428 DAT-hoz való kötődése hasonló volt, mint a D1 és D2 receptorok esetében. Az 90 absztinencia-napok után a DAT-s sűrűségben nem volt szignifikáns különbség a kokain-kitett majmok között, szemben a nem hatóanyaggal kezelt kontrollok szintjével (Táblázat 3; ábra 1), bár meg kell jegyeznünk, hogy az anterior nucleus accumbensben a kötődés magasabb szintje volt megfigyelhető.
VITA
A csoportunk korábbi tanulmányai kimutatták, hogy a kokain önadagolásának krónikus expozíciója a nem humán főemlősök DA-rendszerének jelentős szabályozási szabályait követi (Letchworth et al, 2001; Moore et al, 1998a, 1998b; Nader et al, 2002, 2006). A jelen vizsgálat eredményei azt mutatják, hogy ez a diszreguláció nyilvánvaló marad a kokain expozíció befejezése után. Az 30 absztinencia napok után a DA D1 receptorok és a DAT koncentrációja szignifikánsan emelkedett a majmok striatumában, a krónikus kokain önadagolásával, az élelmiszer-megerősített kontrollokkal összehasonlítva. A jelen tanulmány ugyanakkor egyértelmű bizonyítékot szolgáltat a DA rendszeren belül a hosszabb ideig tartó absztinencia (90 napok) után történő helyreállásra, amint azt a kokain-expozíció és a kontrollok közötti jelentős különbségek hiánya bizonyítja. Ezek az adatok arra utalnak, hogy a kokain-expozíció nem okozhat állandó változásokat a DA rendszerben, de a gyógyszerek felhasználásával való hosszabb ideig tartó absztinencia esetén a gyógyulás helyreállhat.
Az absztinencia utáni itt leírt DAT-koncentrációk diszregulációja összhangban van a nem humán főemlősök korábbi jelentéseivel (Letchworth et al, 2001), amely szignifikáns emelkedést mutatott a DAT kötőhelyek sűrűségében mind a ventrális, mind a dorsalis striatumban. Bár nem kifejezetten tesztelték, úgy tűnik, hogy a hatóanyag-expozíció leállítása után a DAT kötőhely sűrűségének emelkedése legalább olyan nagyságrendű és szélesebb körben elterjedt a striatum régióiban, mint a visszavonási idő nélkül jelentettek.Letchworth et al, 2001). Hasonlóképpen, a D1 receptor kötőhelyek emelkedett koncentrációi, amelyeket itt az 30 absztinencia napok után észleltek, szintén összhangban vannak a korábbi vizsgálatokkal, amelyek a megnövekedett D1-szerű receptor kötődési sűrűségeket mutatták a nem humán főemlősök striatumában, akiket a kokain önmagában adtak be (Nader et al, 2002). Ezzel ellentétben nem tapasztaltak szignifikáns különbséget a D2-szerű receptor kötődési sűrűség szintjei között a kokain-kitett és kontroll állatok striatumában. A diszreguláció hiánya jelen volt, annak ellenére, hogy a D2 receptorok koncentrációi jelentősen csökkentek mindkét humán függőségben (Volkow et al, 1993) és a kokain önigazgatásának állati modelljei (Moore et al, 1998a, 1998b; Nader et al, 2002, 2006). A jelen adatok tehát arra utalnak, hogy gyorsabban normalizálódnak a szabályozási szintek ebben a rendszerben, mint a D1-szerű receptorok és a DAT. Összességében a DA receptorok és a DAT változásai egyértelműen azt mutatják, hogy a kokain önigazgatását közvetlenül követő időszak nagyon labilis, és a DA rendszer szabályozásában jelentős változások következnek be, de ezt követi az újraszabályozás. a rendszer közelebb kerül a DA receptorok és a DAT normálisabb eloszlásához hosszabb ideig tartó absztinencia után.
D1 Receptor megváltozik
A D1 receptorok sűrűségének széles körű emelkedése a kokainhasználat megszűnése után megfigyelhető, összhangban a D1 receptorok fokozott érzékenységével a visszavonás során. A D1 érzékenységének mérését egy Henry és White (1991)ahol a sejtmagok accumbens neuronjainak egy egységes felvételeit érzékenyebbnek találták a D1 receptor agonistára, az SKF 38393-re a krónikus napi injekciók után, a sóoldattal kezelt kontrollokhoz képest. Ez a hatás tartós volt, mivel a megnövekedett érzékenység az egy hónapig tartó felfüggesztésig nyilvánvaló volt. A szerzők feltételezték, hogy a D1 receptor szenzitizációja a D2 autoreceptor szenzitivitásnak köszönhető az A10 somatodendritikus területen, ezáltal csökkentve a gátló impulzusáramlást a mesoaccumbens DA rendszerben (Henry és White, 1991). A jelen vizsgálat adatai arra utalnak, hogy az absztinenciában a D1 receptorok kötődési helyei megnövekedtek, ami megmagyarázhatja a dopaminerg neuronok közvetlen érzékenységű D1 receptor agonista fokozott érzékenységét. Továbbá, az SKF 38393 fokozott hatása a nukleáris accumbens neuronokra nem volt látható két hónappal a visszavonás után, ami arra utal, hogy a D1 receptor érzékenysége helyreállt (Henry és White, 1991); az eredmény a D1 receptor sűrűségének helyreállításával összhangban van, amelyet a jelen vizsgálatban az 90 abstinenci napok után észleltek. Más jelentések szintén támogatják a D1 receptorok fontos szerepét a relapszusban. A D1 receptorok közvetlen stimulálása a magvak akumbensében képes helyreállítani a kokain-keresést absztinens rágcsálókban (Schmidt et al, 2006). A szakirodalom azonban némileg ellentmondásos abban, hogy mind a D1 agonisták, mind az antagonisták gyengíthetik a kokainprimek vagy a kokainhoz kapcsolódó ingerek által kiváltott hatóanyag-keresést (Alleweireldt et al, 2002; De Vries et al, 1999; Khroyan et al, 2000; Self et al, 1996; Fehér et al, 2001). Mostanában, Khroyan et al (2003) arról számoltak be, hogy a D1 agonisták és antagonisták csökkenti a relapszust a kokainkeresés nem humán prímmodelljében. Ezek a szerzők azt sugallták, hogy a kokainkereséshez szükség lehet a D1 receptor aktivitás kritikus tartományára, és hogy mind az antagonisták, mind az agonisták át tudják váltani az aktivitást ebből az ablakból. Az absztinenciával járó D1 receptorok megnövekedett koncentrációja megváltoztathatja ezt a tartományt, ami a rendszer érzékenységének megváltozását eredményezi. Egy másik megfontolás az, hogy a D1-aktivitás a D2-receptorok aktivitását modulálja (Nolan et al, 2007; Ruskin et al, 1999; Walters et al, 1987). A jelen adatok arra utalnak, hogy a D1 és a D2 receptorok aránya eltolódik az absztinencia során, és ezáltal megváltoztathatja a moduláció hatékonyságát.
Bár a jelenlegi adatokkal ellentétben, a krónikus kokain önadagolását követően a D1-receptorok szintjének csökkenését jelezték.Moore et al, 1998a), ezek között a vizsgálatokban jelentős különbségek vannak, mint például a kokain dózisa és az expozíció időtartama, a teljes bevitel és az összehasonlító kontroll csoportok. Összességében tehát a konvergáló bizonyítékok határozottan azt mutatják, hogy a D1 rendszer a krónikus kokain-adagolásból való kilépést követően jelentős mértékben változik.
Dopamin transzporter változások
A kábítószer-fogyasztás megszűnése után a kokain-expozíciós állatok striatumában a DAT koncentrációjának emelkedése meghaladja a korábbi vizsgálatok eredményeit, amelyek a nem-humán főemlősökben a kokain önadagolását kísérő DAT kötőhelyek növekedését mutatják. A jelen adatok azt mutatják, hogy ez a diszreguláció az absztinencia kezdeti fázisaiban is fennáll. Továbbá azt sugallják, hogy a kontroll szintekhez való visszanyerés viszonylag hosszú időtartamot követ (a jelen vizsgálatban 90 napig). Korábbi tanulmányainkban kimutattuk, hogy bár kezdetben csak a ventrális striatális régiókra korlátozódtak, a DAT kötőhelyek sűrűségében bekövetkezett változások kiterjedtek a striatum több hátsó és rostrális részének kiterjesztésére, hosszabb időtartamú kokain-expozícióval.Letchworth et al, 2001; Porrino et al, 2004). A jelen tanulmányban az absztinencia során a DAT-koncentrációk kontrollszintjeihez való visszatérés nagyobbnak és gyorsabbnak tűnt a dorzális striatumban, mint a ventrális striatumban, és így úgy tűnt, hogy a krónikus kokain-expozíció hatására fordított anatómiai pályát követett. .
A jelenlegi adatok összhangban vannak az emberi kokainhasználókkal kapcsolatos jelentésekkel is (Kicsit et al, 1999; Átok et al, 1998; Mash et al, 2002; Staley et al, 1994), amelyek a striatumban a DAT helyekhez kötődésének emelkedett szintjeit mutatják a kontrollokhoz képest, a legjelentősebb növekedés a ventrális striatumban található. A közelmúltban ezekről a emelkedésekről kimutatták, hogy jelentősen csökken a XIVUMX (VMAT2) vezikuláris monoamin transzporter kötődése (Kicsit et al, 2003), amely a DA neuronok tényleges veszteségére utal. A szerzők arra a következtetésre jutottak, hogy a megnövekedett DAT valószínűleg közvetlenül a kokain által a farmakológiai blokádra adott kompenzációs válasz miatt következett be, míg a VMAT2 csökkenése valószínűleg a DA metabolizmus általános változásait tükrözi, ami hypodopaminerg funkciót eredményezett.
A humán kokainfüggőkről számoltak be, hogy csökkentették a DA koncentrációit a ventrális striatumban, PET-vel mérve, válaszul a metilfenidát-kihívásra az egészséges kontrollokhoz képest.Volkow et al, 1997). Mostanában, Martinez et al (2007) beszámoltak arról, hogy a kokainhasználóknak a ventrális striatumban és a putamenben az amfetamin-kihívásokra elhomályos választ adott. Ezen túlmenően az amfetamin által kiváltott DA felszabadulás csökkenése összefüggésbe hozható a kokain választásával önálló önfenntartó üléseken, így azok a felhasználók, akiknek a legalacsonyabb mértékű DA felszabadulása volt az amfetaminra válaszolva, a legvalószínűbb, hogy egy kokainot választanak egy alternatív megerősítőben (Martinez et al, 2007). A kokainhasználat rágcsálómodelljeinek legújabb tanulmányai is támogatják ezt az elképzelést. Mateo et al (2005)például arról számoltak be, hogy a krónikus kokain önadagolásnak való kitettsége a DAT funkció megváltozásával jár. Ezek a kutatók azt mutatták, hogy az alapszintű DA-felvétel megnövekedett, ami a szinaptikus DA gyorsabb clearance-ét eredményezte, és ezért csökkent az extracelluláris DA vagy a hypodopaminerg állapot. Ezért valószínű, hogy a krónikus kokain önadagolásból való kivonulást követően a megnövekedett DAT-koncentrációk kompenzációs választ jelentenek, ami az extracelluláris DA alacsonyabb kiindulási szintjét eredményezi.
D2 Receptor megváltozik
A jelen vizsgálat egyik eredménye az volt, hogy a D2-receptor szintek a 30-napi absztinencia-napok után visszatértek a kontroll értékekhez, míg a visszavonási periódus nélküli állatokban megfigyelt jelentős csökkenés (Nader et al, 2002). A jelenlegi vizsgálattal ellentétben a humán képalkotó vizsgálatok általában azt találták, hogy a D2-receptor szintje alacsonyabb, mint a krónikus kokain-expozíciót követő hosszan tartó absztinenciával járó kontrolloké.Martinez et al, 2004; Volkow et al, 1993). A humán vizsgálatok és a jelenlegi nem humán prímás vizsgálatok közötti különbségek lehetséges magyarázatai közé tartoznak a kokain-bevitel mintázata és időtartama közötti különbségek, valamint a D2 receptorok alacsonyabb szintjének lehetősége az emberi függőkben.
Az utóbbi ötletnek megfelelően bizonyíték van arra, hogy az egészséges emberekben a D2 receptorok alacsonyabb bazális szintje megnöveli a stimulánsok, például methylphenidatés (Volkow et al, 1999), és a majmoknál hasonlóan a D2 receptorok alapszintje előrejelezte a kokain önadagolására való hajlamot.Morgan et al, 2002; Nader et al, 2006). Ezeknek a megállapításoknak a párhuzamos jellegével összhangban mind a fajok, mind az \ tVolkow et al, 1993) és nem humán főemlősök (Nader et al, 2006) a képalkotó vizsgálatok kimutatták, hogy alacsonyabb a D2-receptor elérhetősége a kokain-expozíciótól való tartózkodást követően. Különösen a kokain önadagolásának ütemezése az utóbbi kísérletben (Nader et al, 2006) hasonló volt a tanulmányban alkalmazott megerősítés ütemezéséhez. Így a két vizsgálat különbözõ eredményei valószínûleg nem voltak módszertani különbségek, mint például a kokain önadagolásának megerõsítése vagy kumulatív bevitele.
Egy valószínűbb magyarázat a DA rendszer funkcionális dinamikáját foglalja magában. A D2 receptor PET-vel való elérhetőségének méréseit „funkcionálisnak” nevezték, mivel a jel a fehérje mennyiségével (ebben az esetben a D2 receptorok sűrűségével) és a keringő neurotranszmitter szintjével függ össze. (Lásd: Laruelle, 2000; Nader és Czoty, 2008 további vitára). énn kontraszt, a receptor autoradiográfia nem szennyeződik a DA keringő szintjeivel. Tehát a jelen tanulmány a korábbi munkánkkal együtt arra utal, hogy a D2 receptor sűrűségét a kokain önadagolása csökkenti, de a receptor szintek az absztinencia idején helyreállnak. Hasonlóan végzett PET-vizsgálatban (Nader et al, 2006), az öt majomból háromban helyreállítást tapasztaltunk. A jelen eredmények arra engednek következtetni, hogy ezek a majmok valószínűleg nem különböztek a D2 receptor sűrűségétől, de talán a DA rendszer reakcióképessége (azaz a keringő DA szintje az absztinencia során) megkülönböztette a „visszanyert” és a „nem regenerált” alanyokat.
korlátozások
A jelenlegi vizsgálatok egyik fontos korlátozása, hogy tanulmányaink nem foglalkoznak a D1 és a D2 receptorok vagy a DAT funkcióival. Inkább csak a receptor fehérjék sűrűségének változásait vizsgáltuk. Bár az eredmények hatással vannak ezen rendszerek lehetséges szerepére, további vizsgálatokra lesz szükség az itt bemutatott változások viselkedési következményeinek megvilágításához. A jelen tanulmány további korlátozása az, hogy az autoradiográfiás ligandumok gyakran nem szétválnak a célpontok intracelluláris és citoplazmatikus helyei között, mivel a radioaktívan jelzett antagonisták gyakran membránáteresztő. Kicsit et al (2002) kimutatták, hogy a kokain krónikus expozíciója a membránfelületen a DAT szignifikáns emelkedését eredményezi, egyidejűleg az intracelluláris DAT koncentráció csökkenésével együtt transzfektált sejtekben. Mostanában, Samuvel et al (2008) hasonló eredményeket találtak patkány striatális szinaptoszóma készítményekben. Ezek az eredmények arra utalnak, hogy a jelen vizsgálatban megfigyelt DAT-eloszlás változásai a membránfelületen, nem pedig intracelluláris helyeken változhatnak.
Végül óvatossággal kell eljárni a hosszan tartó (90 nap) absztinencia vizsgálatának értelmezésében, mivel ezek az eredmények viszonylag kis állatcsoporton alapultak (N=3). Az alanyok kis száma ellenére az ebből a csoportból nyert adatok meglehetősen konzisztensek voltak, amint azt az 1. ábrán bemutatott szórási diagram mutatja ábra 2. A D1 receptor kötőhelyek koncentrációja a striatumon belül csak kis mértékben változott a csoportokon belül, ami arra utal, hogy ezek az eredmények megbízhatóak. Hasonló konzisztencia volt tapasztalható a D2 receptor és a DAT kötési vizsgálatok adataiban is. Bár óvatossággal kell eljárni, ezek az adatok határozottan arra utalnak, hogy a DAT és DA receptorok koncentrációjának helyreállítása a striatumban hosszabb ideig tartó absztinenciával fordulhat elő.
Ábra 2.
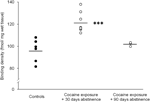 A D1 receptorok kötődési sűrűsége az egyes állatok esetében az egész striatumra átlagolva, a táplálék megerősítése után (kontroll), vagy 30 vagy 90 napok absztinenciája a krónikus kokain önadagolásától. A csoportokhoz tartozó eszközök fekete sávokkal vannak ábrázolva, ***p<0.001 az étellel megerősített kontrollokhoz képest.
A D1 receptorok kötődési sűrűsége az egyes állatok esetében az egész striatumra átlagolva, a táplálék megerősítése után (kontroll), vagy 30 vagy 90 napok absztinenciája a krónikus kokain önadagolásától. A csoportokhoz tartozó eszközök fekete sávokkal vannak ábrázolva, ***p<0.001 az étellel megerősített kontrollokhoz képest.
Következtetések
Összefoglalva, a kokain önbevezetése jelentős változásokat eredményezett a DA rendszerek szabályozásában, amelyek az absztinencia korai fázisaiban (első 30 nap) tartottak fenn. Ez leginkább a D1 receptorok és a DAT koncentrációjának szabályozásában volt nyilvánvaló, mind a változások nagysága, mind a topográfiai mértékük tekintetében. Ezzel ellentétben a kokain expozíciótól való hosszabb időtartamú normalizálódás bizonyult, mivel a DAT, D1 és D2 receptorok koncentrációja az 90 napok abstinenciája után nem különbözött a nem hatóanyaggal kezelt kontrolloktól. Tezek a rendszerek azonban nem feltétlenül követik ugyanazt az időbeli helyreállítási folyamatot, ami arra utal, hogy valószínűleg bizonyos fokú instabilitás van a DA szint szabályozásában, különösen az absztinencia korai szakaszában.. Ez a dopaminerg diszreguláció befolyásolhatja az absztinens kokainfüggőknek adott bármely lehetséges gyógyszeres kezelés hatékonyságát, különösen akkor, ha a gyógyszer hatásmechanizmusa a DA rendszeren alapul.
Megjegyzések
KÖZZÉTÉTEL/Érdekellentét
A szerzők nem jelentenek összeférhetetlenséget a nyilvánosságra hozatal érdekében.
Referenciák
- Alleweireldt AT, Weber SM, Kirschner KF, Bullock BL, Neisewander JL (2002). A D1 dopamin receptorok blokkolása vagy stimulálása gyengíti a kioltott kokain-kereső viselkedés visszaállítását patkányokban. Pszichofarmakológia (Berl) 159: 284–293. | Cikk | PubMed | ChemPort |
- Beveridge TJ, Smith HR, Daunais JB, Nader MA, Porrino LJ (2006). A krónikus kokain önadagolása a nem főemlősök időbeli lebenyében megváltozott funkcionális aktivitással jár. Eur J Neurosci 23: 3109–3118. | Cikk | PubMed |
- Canfield DR, Spealman RD, Kaufman MJ, Madras BK (1990). A kokainkötő helyek autoradiográfiás lokalizációja a [3H] CFT-vel ([3H] WIN 35428) a majom-agyban. Szinapszis 6: 189–195. | Cikk | PubMed | ChemPort |
- De Vries TJ, Schoffelmeer AN, Binnekade R, Vanderschuren LJ (1999). A kokain és a heroin keresésének ösztönzését közvetítő dopaminerg mechanizmusok a IV gyógyszer önadagolásának hosszú távú visszavonása után. Pszichofarmakológia (Berl) 143: 254–260. | Cikk | PubMed | ChemPort |
- Farfel GM, Kleven MS, Woolverton WL, Seiden LS, Perry BD (1992). A kokain ismételt injekcióinak hatása a katekolamin receptor kötőhelyekre, dopamin transzporter kötőhelyekre és viselkedésre rhesus majomban. Brain Res 578: 235–243. | Cikk | PubMed | ChemPort |
- Graham J, Porrino LJ (1995). A kokain önigazgatásának neuroanatómiai alapjai. CRC: Boca Raton, FL.
- Hemby SE, Co C, Koves TR, Smith JE, Dworkin SI (1997). Az extracelluláris dopaminkoncentrációk különbségei a sejtmagban a válaszfüggő és válaszfüggetlen kokain beadásakor patkányokban. Pszichofarmakológia (Berl) 133: 7–16. | Cikk | PubMed | ChemPort |
- Henry DJ, Fehér FJ (1991). Az ismétlődő kokain-adagolás a D1 dopamin receptor érzékenységének tartós javulását okozza a patkánymagokban. J Pharmacol Exp Ther 258: 882–890. | PubMed | ChemPort |
- Jacobsen LK, Staley JK, Malison RT, Zoghbi SS, Seibyl JP, Kosten TR et al (2000). Megnövekedett szerotonin transzporter kötődési képessége akut absztinens kokainfüggő betegeknél. J J Pszichiátria 157: 1134–1140. | Cikk | PubMed | ISI | ChemPort |
- Khroyan TV, Barrett-Larimore RL, Rowlett JK, Spealman RD (2000). Dopamin D1- és D2-szerű receptor mechanizmusok a kokain-kereső viselkedés relapszusában: szelektív antagonisták és agonisták hatása. J Pharmacol Exp Ther 294: 680–687. | PubMed | ISI | ChemPort |
- Khroyan TV, Platt DM, Rowlett JK, Spealman RD (2003). A dopamin D1 receptor agonisták és antagonisták által a nem humán főemlősökben lévő kokainra való visszaesés enyhítése. Pszichofarmakológia (Berl) 168: 124–131. | Cikk | PubMed | ChemPort |
- Laruelle M (2000). Szinaptikus neurotranszmisszió képalkotása in vivo kötelező érvényű verseny technikák: kritikus felülvizsgálat. J Cereb véráramlási metab 20: 423–451. | Cikk | PubMed | ISI | ChemPort |
- Letchworth SR, Nader MA, Smith HR, Friedman DP, Porrino LJ (2001). A dopamin transzporter kötőhelyének sűrűségében bekövetkező változások progressziója a kokain önadagolása következtében a rhesus majmoknál. J Neurosci 21: 2799–2807. | PubMed | ISI | ChemPort |
- Lidow MS, Goldman-Rakic PS, Gallager DW, Rakic P (1991). A dopaminerg receptorok eloszlása az elsődleges agykéregben: kvantitatív autoradiográfiás elemzés [3H] raclopride, [3H] spiperone és [3H] SCH 23390 alkalmazásával. Neuroscience 40: 657–671. | Cikk | PubMed | ChemPort |
- Kis KY, Elmer LW, Zhong H, Scheys JO, Zhang L (2002). A dopamin transzporter kereskedelme a plazma membránnal való kokainindukciója. Mol Pharmacol 61: 436–445. | Cikk | PubMed | ISI | ChemPort |
- Kis KY, Krolewski DM, Zhang L, Cassin BJ (2003). A striatális vezikuláris monoamin transzporter fehérje (VMAT2) elvesztése a humán kokainhasználókban. J J Pszichiátria 160: 47–55. | Cikk | PubMed |
- Kis KY, Zhang L, Desmond T, Frey KA, Dalack GW, Cassin BJ (1999). Striatális dopaminerg rendellenességek a humán kokainhasználóknál. J J Pszichiátria 156: 238–245. | PubMed | ChemPort |
- Malison RT, Best SE, van Dyck CH, McCance EF, Wallace EA, Laruelle M et al (1998). Fokozott striatális dopamin transzporterek az akut kokain absztinencia során [123I] béta-CIT SPECT-rel mérve. J J Pszichiátria 155: 832–834. | PubMed | ChemPort |
- Martinez D, Broft A, Foltin RW, Slifstein M, Hwang DR, Huang Y et al (2004). A kokainfüggőség és a d2 receptor rendelkezésre állása a striatum funkcionális alosztályaiban: kapcsolat a kokain-kereső viselkedéssel. Neuropsychop 29: 1190–1202. | Cikk | PubMed | ISI | ChemPort |
- Martinez D, Narendran R, Foltin RW, Slifstein M, Hwang DR, Broft A et al (2007). Az amfetamin által kiváltott dopamin felszabadulás: a kokainfüggőség jelentősen elhomályosodott, és előre jelzi a kokain önadagolásának választását. J J Pszichiátria 164: 622–629. | Cikk | PubMed | ISI |
- Mash DC, Pablo J, Ouyang Q, Hearn WL, Izenwasser S (2002). A kokainhasználóknál a dopamin transzportfunkciója megnövekedett. J Neurochem 81: 292–300. | Cikk | PubMed | ChemPort |
- Mateo Y, Lack CM, Morgan D, Roberts DC, Jones SR (2005). Csökkent dopamin terminálfunkció és a kokain miatt nem érzékeny a kokainfüggő önadagolás és a nélkülözés. Neuropsychop 30: 1455–1463. | Cikk | PubMed | ISI | ChemPort |
- Melega WP, Jorgensen MJ, Lacan G, Way BM, Pham J, Morton G et al (2008). Hosszú távú metamfetamin adagolás a vervet majom modellekben az emberi expozíció szempontjából: agyi neurotoxicitás és viselkedési profilok. Neuropsychop 33: 1441–1452. | Cikk | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998a). A kokain önadagolása a striatális dopamin D1 receptorokra rhesus majmokban. Szinapszis 28: 1–9. | Cikk | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998b). A kokain önadagolásának hatása a dopamin D2 receptorokra rhesus majmoknál. Szinapszis 30: 88–96. | Cikk | PubMed | ChemPort |
- Morgan D, Grant KA, Gage HD, Mach RH, Kaplan JR, Prioleau O et al (2002). Szociális dominancia a majmoknál: dopamin D2 receptorok és a kokain önadagolása. Nat Neurosci 5: 169–174. | Cikk | PubMed | ISI | ChemPort |
- Nader MA, Czoty PW (2008). Agyi képalkotás nem humán főemlősökben: a kábítószer-függőség betekintése. ILAR J 49: 89–102. | PubMed | ChemPort |
- Nader MA, Daunais JB, Moore T, Nader SH, Moore RJ, Smith HR et al (2002). A kokain önadagolásának hatása a striatális dopamin rendszerre rhesus majmoknál: kezdeti és krónikus expozíció. Neuropsychop 27: 35–46. | Cikk | PubMed | ISI | ChemPort |
- Nader MA, Morgan D, Gage HD, Nader SH, Calhoun TL, Buchheimer N et al (2006). A dopamin D2 receptorok PET-képalkotása a majmok krónikus kokain-önadagolása során. Nat Neurosci 9: 1050–1056. | Cikk | PubMed | ChemPort |
- Nolan EB, Harrison LM, Lahoste GJ, Ruskin DN (2007). A D (1) és a D (2) dopamin receptorok viselkedési szinergizmusa egerekben nem függ a réscsatlakozásoktól. Szinapszis 61: 279–287. | Cikk | PubMed | ChemPort |
- Porrino LJ, Lyons D, Miller MD, Smith HR, Friedman DP, Daunais JB et al (2002). A kokain hatásának metabolikus feltérképezése a nem humán főemlős önadagolás kezdeti fázisaiban. J Neurosci 22: 7687–7694. | PubMed | ChemPort |
- Porrino LJ, Lyons D, Smith HR, Daunais JB, Nader MA (2004). A kokain önadagolása progresszív limbikus, asszociációs és szenzitotor sztriatális domének bevonását eredményezi. J Neurosci 24: 3554–3562. | Cikk | PubMed | ISI | ChemPort |
- Ruskin DN, Bergstrom DA, Walters JR (1999). Multisecond oszcillációk az égési sebességben a globus pallidusban: D1 és D2 dopamin receptorok szinergikus modulációja. J Pharmacol Exp Ther 290: 1493–1501. | PubMed | ISI | ChemPort |
- Samuvel DJ, Jayanthi LD, Manohar S, Kaliyaperumal K, lásd RE, Ramamoorthy S (2008). A dopamin transzporterkereskedelem diszregulációja és a patkányokban a kokain önadagolásától való tartózkodás utáni működés: bizonyíték a caudate putamen és a nucleus accumbens differenciált szabályozására. J Pharmacol Exp Ther 325: 293–301. | Cikk | PubMed | ChemPort |
- Schmidt HD, Anderson SM, Pierce RC (2006). A D1-szerű vagy D2 dopamin receptorok stimulálása a sejtmagban, de nem a magban, a patkányokban helyreállítja a kokain-kereső viselkedést. Eur J Neurosci 23: 219–228. | Cikk | PubMed |
- Self DW, Barnhart WJ, Lehman DA, Nestler EJ (1996). A D1- és D2-szerű dopamin receptor agonisták a kokain-kereső magatartás modulációjával szemben. Tudomány 271: 1586–1589. | Cikk | PubMed | ISI | ChemPort |
- Staley JK, Hearn WL, Ruttenber AJ, Wetli CV, Mash DC (1994). A dopamin transzporter magas affinitású kokainfelismerő helyei emelkedtek a halálos kokain túladagolás áldozataiban. J Pharmacol Exp Ther 271: 1678–1685. | PubMed | ChemPort |
- Volkow ND, Fowler JS, Wang GJ, Hitzemann R, Logan J, Schlyer DJ et al (1993). A dopamin D2 receptorok csökkenésének csökkenése a kokainbántalmazók csökkent frontális metabolizmusával függ össze. Szinapszis 14: 169–177. | Cikk | PubMed | ISI | ChemPort |
- Volkow ND, Wang GJ, Fowler JS, Logan J, Gatley SJ, Gifford A et al (1999). Az agyi dopamin D2 receptor szintjei által a pszichostimulánsokra adott válaszok megerősítésének előrejelzése. J J Pszichiátria 156: 1440–1443. | PubMed | ISI | ChemPort |
- Volkow ND, Wang GJ, Fowler JS, Logan J, Gatley SJ, Hitzemann R et al (1997). Csökkent striatális dopaminerg reakció a méregtelenített kokainfüggő személyekben. Természet 386: 830–833. | Cikk | PubMed | ISI | ChemPort |
- Walters JR, Bergstrom DA, Carlson JH, Chase TN, Braun AR (1987). D1 dopamin receptor aktiválás szükséges a D2 agonista hatások posztszinaptikus expressziójához. Tudomány 236: 719–722. | Cikk | PubMed | ChemPort |
- Weiss F, Martin-Fardon R, Ciccocioppo R, Kerr TM, Smith DL, Ben-Shahar O (2001). Tartós ellenállás a kábítószerrel összefüggő jelek által kiváltott kokainkereső viselkedés kihalásához. Neuropsychop 25: 361–372. | Cikk | PubMed | ISI | ChemPort |
- Wong DF, Kuwabara H, Schretlen DJ, Bonson KR, Zhou Y, Nandi A et al (2006). A dopamin receptorok megnövekedett elfoglaltsága az emberi striatumban a cue-kiváltott kokain vágy során. Neuropsychop 31: 2716–2727. | Cikk | PubMed | ChemPort |
![1 táblázat - Az 30 vagy 90 absztinencia napok hatása a krónikus kokain önadagolás után [lsqb] sűrűségre 3H [rsqb] SCH 23390 kötődés a D1 receptorokhoz a Rhesus Monkeys előzetes sztriatumában - Sajnos nem tudunk hozzáférhető alternatív szöveget biztosítani ez. Ha segítségre van szüksége a kép eléréséhez, kérjük, lépjen kapcsolatba a help@nature.com címmel vagy a szerzővel](https://yourbrainonporn.com/wp-content/uploads/2020/01/table_thumb.gif)
