Megjegyzések: Ezt az áttekintést a NIDA vezetője, Nora Volkow és csapata készítette. Kevés kétséget nem hagy abban, hogy a kémiai és viselkedési függőségek ugyanazokat vagy hasonló mechanizmusokat és idegi áramkört mutatnak. Ennek tökéletes értelme van, mivel a kémiai függőségek eltérítik az idegi áramkört a kötéshez, a szexhez és az étkezéshez. Mivel a szex kétszer annyi dopamint szabadít fel, mint a kedvenc ételeid, és egy pornófelhasználó órákon át tarthatja emelt dopamint, őrült azt állítani, hogy a pornófüggőség nem létezhet.
Curr Top Behav Neurosci. 2011 okt. 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
forrás
Nemzeti Kábítószer-visszaélési Intézet, 6001 Executive Boulevard 6001, 5274 terem, Bethesda, MD, 20892, USA, [e-mail védett].
Absztrakt
Mind a kábítószer-függőség, mind az elhízás meghatározható olyan rendellenességekként, amelyekben az egyik jutalom (drogok és ételek) kedvezőbb értéke rendkívüli mértékben növekszik másokhoz viszonyítva és azok kárára. Ez a modell összhangban áll azzal a ténnyel, hogy mind a gyógyszereknek, mind az ételeknek erős erősítő hatása van - részben a limbikus rendszer dopamin-növekedésének közvetítésével -, amelyek bizonyos körülmények között vagy sebezhető egyéneknél el tudják keríteni az agy homeosztatikus kontrollmechanizmusait. Az ilyen párhuzamok jelentős érdeklődést váltottak ki a függőség és az elhízás közötti megosztott sebezhetőségek és pályák megértése iránt. Az agyi képalkotó felfedezések elkezdték felfedezni e két állapot közös vonásait, és körvonalazzák az átfedő agyi körzeteket, amelyek diszfunkciói magyarázhatják az emberi alanyok sztereotípiás és kapcsolódó viselkedési hiányát. TEzek az eredmények arra utalnak, hogy mind az elhízott, mind a drogfüggők egyaránt szenvednek a dopaminerg folyamatok károsodásából, amely az idegrendszert szabályozza, nemcsak a jutalomérzékenységgel és ösztönző motivációval, hanem a kondicionálással (memória / tanulás), az impulzusszabályozással (viselkedésgátlás), a stresszreaktivitással is. , és az intercepciós tudatosság. Itt integráljuk a túlnyomórészt pozitron emissziós tomográfiából származó eredményeket, amelyek világossá teszik a dopamin szerepét a kábítószer-függőségben és az elhízásban, és javaslatot teszünk egy frissített munkamodellre, amely segít meghatározni azokat a kezelési stratégiákat, amelyek mindkét állapot javát szolgálhatják.
1 Háttér
2 A dopamin szerepe a drogok és ételek akut jutalmában
3 Képkezelés DA a kábítószerekre és a függőségi kondicionált utalásokra adott válaszként
4 A diszfunkció hatása a gátló kontrollban
5 Motivációs áramkörök bevonása
6 Az intercepciós áramkör bevonása
7 Az idegenkedés áramköre
8 Patológiai gyógyszer- és élelmezési jutalom: Frissített működő modell
1 Háttér
A dopamint (DA) a természetes és gyógyszeres hasznok kiemelkedő hatásainak kulcsaként tekintik. A függőséggel és az elhízással összefüggő kontroll és kényszerítő magatartás elvesztésében betöltött szerepe azonban kevésbé egyértelmű. A PET-vizsgálatok döntő szerepet játszottak az agy DA-rendszerek függőségében (a gyógyszerjuttatásban betöltött szerepe mellett) és az elhízásban betöltött szerepének jellemzésében. Valójában az erőszakos gyógyszereket (beleértve az alkoholt) az emberek fogyasztják, vagy a laboratóriumi állatok saját maguk adják be, mert ezek eredendően jótékony hatásúak, és ezt a hatást a mezolimbikus rendszer DA-fokozó tulajdonságai közvetítik (Wise 2009). HDe függőség esetén a képalkotó vizsgálatok azt mutatták, hogy a rendellenesség nemcsak a DA jutalmazási áramkörét érinti, hanem a kondicionálás / szokások, a motiváció és a végrehajtó funkciók modulálásában részt vevő egyéb DA útvonalakat is (gátló kontroll, ösztönzés hozzárendelése és döntéshozatal). -készítés), és hogy a DA-hiányok szintén részt vehetnek a fokozott stressz-reakcióképességben és a függőséggel kapcsolatos interocepciós tudatosság megzavarásában. A preklinikai és klinikai vizsgálatok más neurotranszmittereket (és neuropeptideket) tártak fel, amelyek fontos szerepet játszanak a gyógyszer juttatásában és a függőségben (azaz kannabinoidok, opioidok), és szorosan részt vesznek az ismételt gyógyszerhasználatot követő neuroplasztikus változásokban (azaz glutamát, opioidok, GABA, kortikotropint felszabadító faktor). A glutamatergikus rendszer ebben a tekintetben különösen kiemelkedő, mivel közvetíti a hosszú távú potencírozás és a hosszú távú depresszió zavarait, amelyeket a krónikus gyógyszeradagolás állatmodelleiben megfigyelték. (Thomas et al. 2008). E kiegészítő rendszerekre vonatkozó vélemények másutt (Kalivas 2009; Koab 1992).
Mivel a gyógyszerek ugyanazokat a jutalmazási rendszereket aktiválják, mint amelyek az élelmezés alapjául szolgálnak, nem teljesen váratlan, hogy az agyi képalkotó vizsgálatok általában alátámasztják azt a felfogást, hogy a DA-modulált áramkörök károsodásai szerepet játszanak a patológiás, kényszeres étkezési viselkedésben is. Az élelmezési utalások, mint például a gyógyszerjelek, növelik a striatalis extracelluláris DA-t és motiválják az étel előállításához és elfogyasztásához szükséges magatartáshoz való motivációt, bizonyítékot szolgáltatva arra, hogy a DA szerepet játszik nemcsak az élelmezésben, hanem a nem hedonikus motivációban is. az ételek tulajdonságai (azaz a kalóriaigény) és a gátló szabályozás csökkenése a kényszeres túlaltatás során (Avena et al. 2008; Volkow et al. 2008a).
Itt áttekintjük a képalkotó vizsgálatok eredményeit, amelyek kifejezetten az agyi áramlások átfedéseire összpontosítanak, amelyek az elhízásban és a kábítószer-függőségben zavartak meg. Érdemes azonban megjegyezni, hogy az étkezési magatartás szabályozása sokkal összetettebb, mint a drogbevitel szabályozása. Ez utóbbit elsősorban a gyógyszerek jutalmazó hatásai közvetítik, míg az előbbit nemcsak jutalmazó hatásai (hedonikus tényezők), hanem több perifériás és központi tényező is modulálják, amelyek érzékelik a test tápanyagigényét a túléléshez (homeosztatikus tényezők). Érdekes, hogy egyre több bizonyíték van arra, hogy a homeosztatikus tényezők (pl. Inzulin, leptin, ghrelin) részben modulálják az ételek bevitelét azáltal, hogy növelik vagy csökkentik az agyi jutalomáramlási körök érzékenységét az élelmi stimulákra (Volkow et al. 2011a).
2 A dopamin szerepe a drogok és ételek akut jutalmában
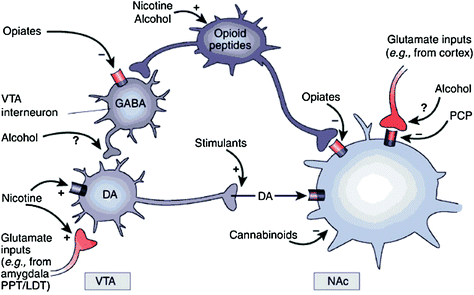
Közvetlenül vagy közvetetten, az összes addiktív gyógyszer képes megnöveli a DA mennyiségét a nucleus akumulbens-ben (NAc) a különböző molekuláris célpontokkal való specifikus kölcsönhatások révén (Nestler 2004) (Ábra. 1). A mezolimbikus DA út [DA sejtek a ventrális tegmentális területen (VTA), amely bejut a NAc-ba] kulcsfontosságúnak tűnik a gyógyszerjutalom szempontjából (Wise 2009). Az alábbiakban ismertetettek szerint azonban más DA útvonalak [mesostriatalis (DA sejtek a dermagiális striatumba kinyúló lényeges nigra) és a mezokortikális (a VTA DA sejtjei elülső cortexbe vetülnek]) szintén hozzájárulnak a gyógyszer juttatásához és a függőséghez (Wise 2009). Összességében úgy tűnik, hogy a gyógyszerek jutalmazó és kondicionáló hatásait döntően a DA fázisos sejtégetése okozza, ami nagy és átmeneti DA növekedéshez vezet. Ezzel szemben a függőségben bekövetkező, a végrehajtó funkcióban bekövetkező változások kapcsolódnak a tonikus DA-sejtek égetésének változásaihoz, és alacsonyabb, de stabilabb DA-szintet eredményeznek (Grace 2000; Wanat és mtsai. 2009). Ez viszont a D1 receptorokra (D1R) utal, amelyek alacsony affinitású DA receptorok, amelyek stimulálják a ciklikus AMP jelátvitelt, mivel mind az akut gyógyszerjuttatásban, mind a kondicionálásban részt vesznek, mivel ezek kapcsolódnak a szükséges magas DA koncentrációkhoz. a D1R stimulálására. Ezzel szemben a D2R-eket, amelyek gátolják a ciklikus AMP jelátvitelt, mind a fázisos, mind a tonikus DA stimulálja. Vegye figyelembe, hogy mivel a D1, D3, D4 és D5 típusú DA receptorok PET-leképezéséhez nem állnak rendelkezésre speciális rádiókeresők, az emberi agyban a visszaélés és a függőség kábítószereinek hatásairól szóló legtöbb vizsgálat a D2R-ekre összpontosított.
Ábra 1 Az erőszakos kábítószerek különféle mechanizmusokon keresztül hatnak a jutalom és a járulékos áramkörökre, mindazonáltal hasonló dopaminerg hatásokhoz vezetnek a VTA-ban és a NAc-ban. Így a stimulánsok közvetlenül fokozzák az acumbal DA-t, míg az opiumok ezt úgy teszik, hogy csökkentik a GABAergic interneuronok gátló hatását a DA jelzésén keresztül mind a VTA, mind az akkor a NAc-ben. Noha a többi bántalmazás mechanizmusa kevésbé egyértelmű, bizonyítékok arra utalnak, hogy a nikotin közvetlenül a nikotin acetilkolin receptoron (nAChR) keresztül aktiválhatja a VTA DA-t ezen idegsejteken, és közvetve a receptorok stimulálása révén a DA sejteket beidegző glutamaterg idegvégződéseken. Úgy tűnik, hogy az alkohol gátolja a VAB GABAerg terminálisait, ami a DA neuronok gátlásához vezet a VTA-ban. A kannabinoidok többek között a CB1 receptorok aktiválásával hatnak az NAc glutamáterg és GABAerg idegterminálisaira, és magukra a NAc idegsejtekre. A fenciklidin (PCP) úgy hathat, hogy gátolja a posztszinaptikus NMDA glutamát receptorokat a NAc-ban. Ezenkívül van néhány bizonyíték arra, hogy a nikotin és az alkohol kölcsönhatásba léphet endogén opioid és kannabinoid útvonalakkal (nem ábrázolva). PPT / LDT, peduncularis pontine tegmentum / laterális dorsal tegmentum. Engedéllyel újból nyomtatva Nestler (2005)
Emberekben a PET vizsgálatok kimutatták, hogy számos gyógyszer [stimulánsok (Drevets et al. 2001; Volkow et al. 1999b), nikotin (Brody et al. 2009), alkohol (Boileau et al. 2003) és marihuána (Bossong et al. 2009)] növeli a DA-t a háti és ventrális striatumban (ahol a NAc található). Ezek a tanulmányok számos rádiókeresőt használnak, mint például [11C] racloprid, amely kötődik a D2R-hez, de csak akkor, ha ezek nem kötődnek endogén DA-hoz (nem foglalt), amely alapállapotban megfelel a D85R striatális 90 – 2% -ának (Abi-Dargham et al. 1998). Így összehasonlítva a [11C] racloprid-kötés a placebo és a gyógyszer beadása után segíthet becsülni a D2R elérhetőségének a gyógyszer által kiváltott csökkenését (vagy más stimulusokat, amelyek növelik a DA-t). Ezek a csökkenések a [11A C] racloprid-kötés arányos a DA növekedésével (Breier et al. 1997). Ezek a tanulmányok kimutatták, hogy a gyógyszer által kiváltott DA növekedése a striatumban arányos az eufória szubjektív tapasztalatának intenzitásával vagy „magas” [lásd áttekintést (Volkow et al. 2009a)] (Ábra. 2).
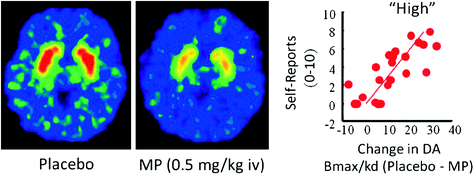
Ábra 2 Az intravénás metil-fenidát (MP) hatása a racloprid kötésében és a striatális DA közötti kapcsolat növekedése, amelyet az MP indukál a striatumban, és a „magas” önjelentések. Módosítva: Volkow et al. (1999b)
A PET-vizsgálatok egyértelmű, közvetlen összefüggést tártak fel a gyógyszer farmakokinetikai profilja (azaz az agyba való belépés és az agyból való távozás sebessége) és az erősítő hatások között is. Pontosabban: minél intenzívebb egy gyógyszer az agyban eléri a csúcsszintet, annál intenzívebb a „magas” (Volkow et al. 2009a). Például, ha az agyba elért ekvivalens szintű kokaint (a PET-en keresztül becsülve), amikor a kokain gyorsan belépett az agyba (füstölt vagy iv. Adagolás), akkor intenzívebb „magas” vált ki, mint amikor lassabban jutott be (szimatolt). (Volkow et al. 2000). Ez összhangban áll a preklinikai vizsgálatokkal, amelyek hasonló összefüggést mutatnak a gyógyszer farmakokinetikai profilja és erősítő tulajdonságai között (Balster és Schuster 1973). énésszerű feltételezni, hogy az ilyen hirtelen és nagy mértékű DA növekedés, amelyet a kábítószer-kábítószer vált ki, utánozhatja azt a gyors és nagy DA növekedést, amely a DA fázisos tüzelésének következménye, amely az agyban a jutalomra és a jótékonyságra vonatkozó információk feldolgozásával társult. (Schultz 2010). Az ilyen kábítószer-indukált DA emelkedés a NAc-ban szükség lehet a függőséghez, de az a tény, hogy ezek nem függő személyekben is előfordulnak, azt jelzi, hogy ezek nem elegendőek a függőség jellemző impulzív és kényszeres drogfogyasztásának magyarázatához.
Jelenleg bizonyítékok vannak arra, hogy az összehasonlítható dopaminerg reakciók összekapcsolódnak az élelmezési jutalommal, és hogy ezek a mechanizmusok valószínűleg szerepet játszanak a túlzott élelmezés-fogyasztásban és az elhízásban. Közismert, hogy egyes élelmiszerek, különösen a cukor - és zsírtartalmú élelmiszerek potenciálisan jótékony hatásúak (Lenoir et al. 2007). A magas kalóriatartalmú ételek elősegíthetik a túlsúlyos étkezést (az energetikai igényektől elválaszthatatlan étkezést), és kiválthatják az stimulus és a jutalom (kondicionálás) közötti megtanult összefüggéseket. Az evolúció szempontjából az ízletes ételeknek ez a tulajdonsága korábban előnyös volt olyan környezetben, ahol kevés az élelmiszer-forrás és / vagy nem volt megbízható, mivel biztosította az ételek fogyasztását, amikor rendelkezésre álltak, lehetővé téve az energia tárolását a testben (zsírként) a későbbi felhasználáshoz. . Sajnos az olyan társadalmakban, mint a miénk, ahol bőséges és folyamatosan elérhető az élelmiszer, ez az alkalmazkodás felelőssé vált.
Számos neurotranszmitter, például DA, kannabinoidok, opioidok és szerotonin, valamint az ételek homeosztatikus szabályozásában részt vevő hormonok és neuropeptidek, mint például az inzulin, orexin, leptin és ghrelin, szerepet játszanak az ételek jutalmazó hatásában (Atkinson 2008; Cason et al. 2010; Cota et al. 2006). Ezek közül a DA-t vizsgálták meg a legegyszerűbben, és a legjobban jellemzik. Rágcsálókkal végzett kísérletek azt mutatták, hogy az élelmezési juttatás első kitettségekor a DA neuronok kiürülése a VTA-ban növekszik, aminek eredményeként növekszik a DA felszabadulása NAc-ban (Norgren et al. 2006). Hasonlóképpen, egészséges, normál testtömegű emberekben kimutatták, hogy az ízletes ételek elnyelése révén a DA a hátsó striatumban felszabadul az étkezés kellemességének megítélésével arányosan (Small et al. 2003) (Ábra. 3). Amint azonban a kábítószer-visszaélésekkel végzett vizsgálatokból kitűnik, az élelmezés okozta striatális DA növekedés önmagában nem magyarázza a különbséget a normál táplálékfelvétel és a túlzott kényszeres ételfogyasztás között, mivel ezek olyan egészséges egyéneknél is előfordulnak, akik nem esznek túlzottan. Így, akárcsak a függőség esetében, a későbbi adaptációk valószínűleg befolyásolják az élelmiszer-bevitel ellenőrzésének elvesztését.
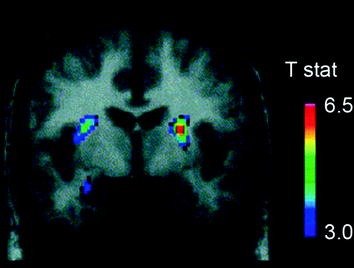
Ábra 3 A táplálás által indukált dopamin felszabadulás. A T-térkép koronális metszete a [11C] a racloprid kötési potenciálja (BP) etetés után. A színsáv a t statisztikai értékeket képviseli. (Engedélyével újra kinyomtatva. Small et al. 2003)
3 Képkezelés DA a kábítószerekre és a függőségi kondicionált utalásokra adott válaszként
A DA szerepe a megerősítésben összetettebb, mint csupán a jutalom kódolása önmagában (hedonikus öröm); például az olyan ingerek, amelyek gyors és nagy DA növekedést indukálnak, szintén kondicionált válaszokat váltanak ki, és ösztönző motivációt idéznek elő azok előállítására (Owesson-White et al. 2009). Ez azért fontos, mert a kondicionálás során a megerősítőhöz kapcsolt semleges ingerek (akár természetes, akár gyógyszererősítők) magukban képesek megszerezni a juttatás előrejelzésével a striatumban (beleértve a NAc-t is) DA növekedését, ezáltal erős motiváció a gyógyszer keresésére (Owesson-White et al. 2009). Ugyanakkor a jutalom és a kondicionáló mechanizmusok szétválasztása a kábítószer-függőség folyamatában sokkal nagyobb kihívást jelent, mint az élelmezés-fogyasztás, mivel a visszaélés elleni gyógyszerek farmakológiai hatásaik révén közvetlenül aktiválják a DA idegsejteket (azaz a nikotint) vagy növelik a DA felszabadulását (azaz amfetamin).
Az agyi képalkotó vizsgálatok, amelyekben összehasonlították a stimuláló szer metilfenidát (MP) vagy amfetamin (AMPH) által indukált DA növekedést a kokainfüggőségben szenvedő személyek és a kontroll között, az MP vagy AMPH által kiváltott DA emelkedésének szignifikáns mérséklődését mutatják a striatumban (az 50% alacsonyabb a méregtelenített bántalmazókban) és 80% az aktív bántalmazókban) és alacsonyabb önjelentések a gyógyszer jutalmazó hatásairól a droggal nem visszaélő kontrollokhoz viszonyítva (Martinez et al. 2007; Volkow et al. 1997) (Ábra. 4). Ez meglepő volt, mivel az MP és az AMPH farmakológiai szempontból hasonlóak a kokainhoz és a metamfetaminhoz, és a kábítószerrel visszaélők nem tudnak különbséget tenni közöttük, ha intravénásan adják be őket. Mivel a kábítószer által kiváltott DA növekedésének jelentős csökkenését megfigyelték, függetlenül attól, hogy a kokain-elhasználók méregtelenítették-e vagy sem, ez azt jelzi, hogy a megvonás állapota nem befolyásoló tényező (Volkow et al. 2011b). Ezek és a kapcsolódó eredmények (Volkow et al. 2009a) összhangban állnak azzal a hipotézissel, miszerint a hedonikus válasz hiányos lesz a drogfüggő egyéneknél, és tovább erősítik azt a felfogást, hogy a NAc gyógyszer akut farmakológiai DA-fokozó hatása önmagában nem magyarázza meg a fokozott motivációt a fogyasztásra.
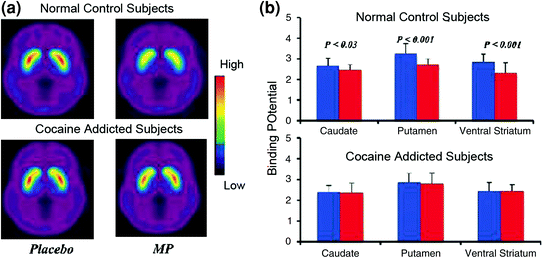
Ábra 4 Az intravénás MP által indukált DA változások a kontrollokban és az aktív kokainfüggős betegekben. egy átlagos, nem helyettesíthető bidáló potenciál (BPND) képe a [11C] racloprid aktív kokainfüggőségben szenvedő betegekben (n = 19) és kontrollokban (n = 24) placebó és iv. MP után. b D2R elérhetőség (BPND) caudates, putamen és ventrális striatumban a placebo (kék) és MP (vörös) után a kontrollokban és a kokainfüggő alanyokban. Az MP csökkentette a D2R-et a kontrollokban, de a kokaintól függő alanyokban nem. Ne feledje, hogy a kokainhasználók mind a striatalis D2R elérhetőségének csökkenését (placebo mérték), mind pedig a DA felszabadulásának csökkenését mutatják, amikor iv MP-t kapnak (a D2R elérhetőségének csökkenéseként mérve a kiindulási értékhez viszonyítva). Bár megkérdőjelezhető, hogy a kokainfüggőséggel küzdő betegek alacsony striatális D2R-elérhetősége korlátozza-e a további észlelési képesség észlelésének képességét az MP-től, az a tény, hogy a kokainfüggő alanyok a D2R-elérhetőség csökkenését mutatják, amikor kokain-jeleknek vannak kitéve, azt jelzi, hogy az enyhített hatások MP képviselője [11A C] racloprid kötődése tükrözi a DA csökkent kibocsátását. Engedéllyel újból nyomtatva (Volkow et al. 1997; Wang és mtsai. 2010)
A VTA DA idegsejtek reakciója a jutalmazó ingerekre megismétlődik az ismételt expozícióval.
Míg a DA-sejtek új jutalom első kitettségekor tűznek ki, addig az ismételt DA-expozíció miatt az idegsejtek abbahagyják a lövöldöződést jutalomfogyasztáskor, és tüzet okoznak, amikor azok a stimulusnak vannak kitéve, amelyek előrejelzik a jutalmat (Schultz et al. 1997). Ez valószínűleg alátámasztja a DA szerepét a tanulásban és a kondicionálásban. Valójában, a gyógyszer-indukált fázisos DA jelátvitel végül kiválthatja a kiegészítő áramkörök neuroadaptációit, amelyek a szokások kialakulásához és a viselkedés kondicionálásához kapcsolódnak. Tezeket a változásokat elsősorban a D1R jelátvitel és a szinaptikus változások váltják ki a glutamát-modulált NMDA és AMPA receptorokban (Luscher és Malenka 2011; Zweifel et al. 2009). Ezeknek a köröknek a felvétele jelentős a betegség előrehaladásában, mivel az ehhez kapcsolódó kondicionált válaszok megmagyarázzák a gyógyszer iránti igényt (vágy) és a kényszeres használatot, amely akkor fordul elő, amikor a függőségben részesült személyek gyógyszerrel összefüggő jeleknek vannak kitéve. Ez a hipotézis összhangban áll a független megfigyelésekkel (Volkow et al. 2006b; Wong és mtsai. 2006), amelyek megmutatják, hogy a kokainnal kapcsolatos dákó expozíció képes-e megemelni a DA szintet a hátsó striatumban, és ezzel együtt növelik a méregtelenített kokain elhasználók iránti vágy szubjektív tapasztalatait (2. 5). Mivel a háti striatum szerepet játszik a szokások tanulásában (Belin et al. 2009; Yin et al. 2004), az asszociáció valószínűleg tükrözi a szokások megerősödését, amikor a függőség krónikus jellege előrehalad. Ez arra utal, hogy a függőség alapvető zavara a DA által kiváltott kondicionált válaszokkal kapcsolatos, amelyek olyan szokásokat eredményeznek, amelyek intenzív vágyhoz és kényszeres drogfogyasztáshoz vezetnek. Érdekes, hogy a kokainfüggő alanyok aktív alkalmazásában a kondicionált útmutatások által kiváltott DA növekedés még nagyobbnak tűnik, mint maga a stimuláns hatóanyag, mivel azt két különálló alanycsoportban értékelték (Volkow et al. 2011b, 2006b), amely arra utal, hogy a kondicionált válaszok vezethetik a DA jelátvitelt, amely fenntartja a készítmény motivációját még akkor is, ha a farmakológiai hatása csökken. Tehát, bár a gyógyszerek kezdetben azonnali jutalom érzését válthatják ki a DA felszabadulása révén a ventrális striatumban, ismételt felhasználással, és a szokás kialakulásakor, úgy tűnik, hogy a gyógyszerről a kondicionált ingerre váltódik. A laboratóriumi állatokon végzett vizsgálatok szerint a prefrontalis cortexből és az amygdala-ból a VTA / SN-re és NAc-re mutató glutamaterg vetületek közvetítik ezeket a kondicionált válaszokat (Kalivas 2009). Ilyen módon a jutalom pusztán előrejelzése válhat olyan jutalommá, amely motiválja a drogok (vagy ételek) fogyasztásához szükséges viselkedést.
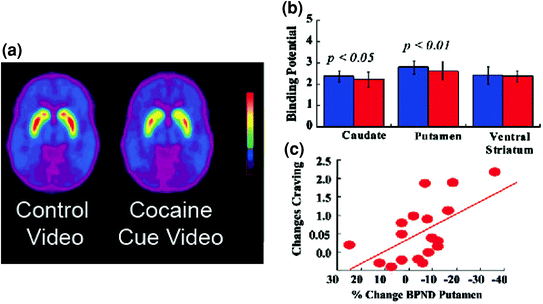
Ábra 5 A DA változásai, amelyeket kondicionált útmutatások indukálnak aktív kokain-függőségben szenvedő betegeknél. a kokainfüggőséggel küzdő alanyokban az [11C] racloprid átlagos nem cserélhető kötési potenciáljának (BPND) képei (n = 17), semleges videó (természeti jelenetek) és kokainjel-videó megtekintése közben (kokaint alkalmazó alanyok). b D2R elérhetőség (BPND) caudates, putamen és ventrális striatumban a semleges videóhoz (kék) és a kokain-cue videohoz (piros). A kokain dátumok csökkentették a D2R-t caudates és putamenben. c Összefüggések a D2R változásaiban (ami a DA növekedését tükrözi) és a kokain-dákó videó által kiváltott kokain-vágy önjelentései között. Módosítva a ref. (Volkow et al. 2006b)
IMeglepő módon, az ilyen típusú funkcionális „kapcsolóról” beszámoltak a természetes erősítőkről is, amelyek valószínűleg egyenértékű és fokozatos eltolódást indukálnak a DA növekedésében, a ventrális és a hátsóbb szakaszok között a striatumban, az átmenetileg az új stimulusról, amely eredendő jutalmazza azt a kapcsolódó jelzésekkel, amelyek azt jósolják. Ezt az átmenetet DA jelzés útján továbbítják, amely úgy tűnik, hogy kódolja a „jutalom előrejelzési hibát” (Schultz 2010). Az érzékszervi (sziget vagy elsődleges íztüregkéreg), homeosztatikus (hipotalamusz), jutalom (NAc), érzelmi (amygdala és hippokampusz), valamint multimodális (orbitofrontalis kéreg a megfigyelőképesség megítéléséhez) feldolgozásában részt vevő régiókból származó DA neuronok kiterjedt glutamáterikus afferensei , modulálják tevékenységüket a jutalmak és a kondicionált jelzések alapján (Geisler és Wise 2008). Pontosabban, az amygdala és az orbitofrontalis kéreg (OFC) előrejelzései DA neuronokra és NAc-re vetülnek az kondicionált reakciókkal az ételre (Petrovics 2010). A képalkotó vizsgálatok valóban azt mutatták, hogy amikor a nem elhízott férfi alanyokat arra kérték, hogy gátolják az étkezés iránti vágyaikat - miközben ételekkel vannak kitéve -, akkor metabolikus aktivitásuk csökkent az amygdalaban és az OFC-ben (valamint a hippokampuszban), az insula-ban és a striatumban, és hogy az OFC csökkenése az étkezési vágy csökkenésével jár (Wang et al. 2009). A metabolikus aktivitás hasonló gátlását az OFC-ben (és a NAc-ben is) figyelték meg a kokainhasználókkal szemben, amikor arra kérték őket, hogy gátolják a gyógyszereség vágyát a kokain-vonalaknak való kitettség során (Volkow et al. 2009b).
Ennek ellenére az ilyen erőteljesen kondicionált vágyak kialakulása, amelyek ételek esetén az egészséges egyéneknél is nem fordulnak el túl, nem túlságosan pusztítóak lennének, ha nem járnának együtt az agy rosszabbodó képességeivel, hogy gátolják a rosszindulatú viselkedést.
4 A diszfunkció hatása a gátló kontrollban
A prepotens válaszok gátlásának képessége hozzájárul az egyén azon képességéhez, hogy elkerülje a nem megfelelő magatartást, mint például drogfogyasztást vagy étkezési pontot meghaladó étkezést, és ezáltal növeli a függőség (vagy elhízás) iránti érzékenységét (Volkow és Fowler 2000; Volkow et al. 2008a).
A PET-vizsgálatok azt mutatták, hogy a D2R elérhetőségének jelentős csökkenése a rabja szenvedélybetegek striatumában, amelyek hónapokig is fennállnak az elhúzódó méregtelenítés után [áttekintve [Volkow et al. 2009a)]. Hasonlóképpen, a rágcsálókon és a főemlős állatokon végzett preklinikai vizsgálatok kimutatták, hogy az ismételt gyógyszeres expozíciók a striatális D2R szint csökkentésével járnak (Nader et al. 2006; Thanos és munkatársai. 2007; Volkow et al. 2001). A striatumban a D2R közvetíti a jelátvitelt a striatális közvetett útvonalon, amely modulálja a prefrontalis régiókat; és annak alsó szabályozása kimutatták, hogy fokozza az állati modellekben a gyógyszerek hatásainak szenzibilizációját (Ferguson et al. 2011). A drogoktól függõ emberekben a striatalis D2R csökkenése a prefrontalis régiók csökkent aktivitásával jár, amint ezt az OFC, az elülső cinguláris gyrus (ACC) és a dorsolateralis prefrontalis kéreg (DLPFC) az alapszint glükóz-metabolizmusának (az agyi funkció markerének) csökkenése bizonyítja. ) (Volkow et al. 2001, 1993, 2007) (Ábra. 6). Annak érdekében, hogy az OFC, az ACC és a DLPFC részt vegyen az érdeklődés-hozzárendelésben, a gátló kontroll / érzelmek szabályozásában és a döntéshozatalban, Azt feltételezik, hogy a D2R által közvetített DA jelzés által nem megfelelő szabályozás addiktív alanyokon alapul szolgálhat a drogok fokozott motivációs értékének viselkedésében és a kábítószer-bevitel feletti ellenőrzés elvesztésében (Volkow és Fowler 2000). Ezenkívül, mivel az OFC és az ACC károsodása kényszeres viselkedéshez és impulzivitáshoz kapcsolódik (Fineberg et al. 2009), A DA ezen régiók káros modulációja valószínűleg hozzájárul a függőségben tapasztalható kényszeres és impulzív drogbevitelhez (Goldstein és Volkow 2002). Valójában a metamfetamin-visszaélőkben az alacsony striatalis D2R-et impulsivitással társították (Lee et al. 2009), és előre jelezte a kényszer kokain beadását rágcsálókban is (Everitt et al. 2008). Fordított forgatókönyv, amelyben a droghasználat kezdeti sebezhetősége fennáll a prefrontalis régiókban, és amelyben az ismételt kábítószer-használat további csökkenést okoz a striatális D2R-ben. Valójában egy olyan alanyokkal végzett tanulmány, akik annak ellenére, hogy fennállnak az alkoholizmus magas kockázata (az alkoholizmus pozitív családi anamnézise), nem voltak alkoholisták, a normálnál magasabb striatális D2R rendelkezésre állást tárták fel, amelyet az OFC, ACC és DLPFC normál anyagcseréjével társítottak (Volkow) et al. 2006a). Ez arra utal, hogy ezekben az alkoholizmus kockázatának kitett alanyokban a normális prefrontalis funkció a fokozott striatális D2R jelátvitelhez kapcsolódott, ami viszont megvédte őket az alkoholfogyasztástól.
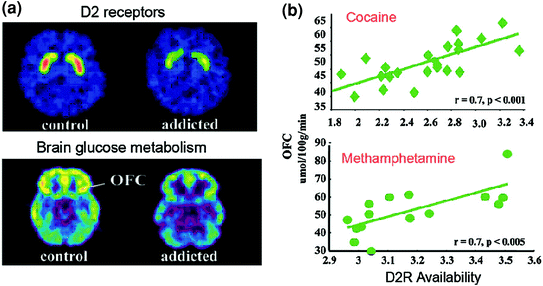
Ábra 6 Összefüggések a striatalis D2R rendelkezésre állása és az anyagcsere között a prefrontalis agyi régiókban. egy axiális agyi képeket a kontrollhoz és egy kokainfüggő személyt az alapképhez a D2R rendelkezésre állása striatumban (a következővel kapható:11C] racloprid) és az agy glükóz-metabolizmusa OFC-ben ([18FDG). b Összefüggések a striatalis D2R és az OFC metabolizmusa között kokainfüggő és metamfetaminfüggő személyekben. Újra nyomtatva Volkow et al. (2009a) Szerzői jog (2009), az Elsevier engedélyével
Előreláthatóan, hogy az elhízott egyének körében a kontroll körökben a szabályozás rendellenességeire is sor került. Mind a preklinikai, mind a klinikai vizsgálatok bizonyítékot mutattak a csökkentett striatalis D2R jelátvitelről, amely - amint fentebb már említettük - összefügg a jutalommal (NAc), hanem a szokások és rutinok kialakításával (hátsó striatum) az obesitban is.y (Geiger et al. 2009; Wang és mtsai. 2001). Fontos szempont, hogy a striatalis D2R csökkenő elérhetősége összefüggésben van az elhízott rágcsálók (Johnson és Kenny) kényszeres táplálékfelvételével. 2010), valamint elhízott emberekben az OFC és ACC csökkent metabolikus aktivitásával (Volkow et al. 2008b) (Ábra. 7a-c). Tekintettel arra, hogy az OFC és az ACC rendellenessége kompultivitást eredményez [lásd áttekintést (Fineberg et al. 2009)], ez lehet annak a mechanizmusnak a része, amellyel az alacsony striatalis D2R jelátvitel megkönnyíti a hiperfágiát (Davis et al. 2009). Ezen túlmenően, mivel a csökkent D2R-rel kapcsolatos jelátvitel valószínűleg csökkenti az egyéb természetes előnyök iránti érzékenységet, az elhízott egyéneknél ez a hiány szintén hozzájárulhat a kompenzációs túlaltatáshoz. (Geiger et al. 2008).
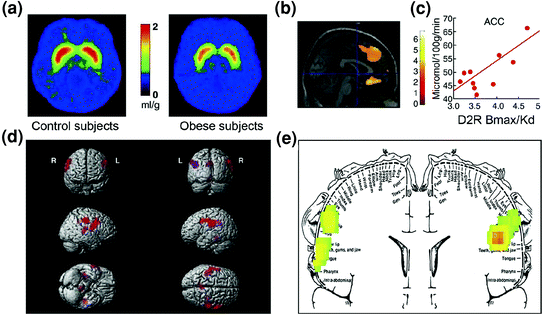
Ábra 7 A hiperfágia a gyengült jutalomáramlás kompenzálására irányuló törekvésből származhat (amelyet dopamin-szabályozott kortikosztriatális áramkörökön dolgoznak fel), fokozott ízű érzékenységgel kombinálva (a szomatoszenzoros kéregben részben feldolgozott ételek hedonikus tulajdonságai). Átlagolt képek a DA D2 receptor (D2R) elérhetőségéről a kontrollokban (n = 10) és kórosan elhízott alanyokban (n = 10). b Az (Statisztikai Parametrikus Mapping) SPM eredményei, amelyek azonosítják az agy azon területeit, ahol a D2R összefügg a glükóz metabolizmussal, ezek közé tartozott a mediális OFC, az ACC és a dorsolaterális PFC (a régió nem látható). c Regressziós meredekség a striatalis D2R és a metabolikus aktivitás között ACC-ben elhízott egyéneknél. d Háromdimenziós renderelt SPM képek, amelyek az elhízott, mint a sovány alanyoknál nagyobb anyagcserével rendelkező területeket mutatnak (P <0.003, nem korrigált). e A színkódolt SPM eredmények koronális síkban jelennek meg a szomatoszenzoros homunculus egymásra helyezett diagramjával. Az eredményeket (z érték) a szivárványskála segítségével mutatjuk be, ahol piros> sárga> zöld. A sovány alanyokkal összehasonlítva az elhízott alanyoknál magasabb volt az alapanyagcsere a szomatoszenzoros területeken, ahol a száj, az ajkak és a nyelv képviselteti magát, és amelyek részt vesznek az étel ízének feldolgozásában. Volkow és munkatársai engedélyével módosították. (2008a) (a – c) és Wang et al. (2002) (d, e)
Ez a hipotézis összhangban áll a preklinikai bizonyítékokkal, amelyek azt mutatják, hogy a csökkent VTA-DA aktivitás drasztikusan növeli a magas zsírtartalmú ételek fogyasztását (Stoeckel et al. 2008). Hasonlóképpen, a normál testtömegű egyénekkel összehasonlítva az elhízott egyének, akiknek magas kalóriatartalmú ételeket tartalmazó képeket mutattak be (ingerek, amelyekhez kondicionáltak), megnövekedett idegi aktivációt mutattak azokban a régiókban, amelyek a jutalom és a motivációs körök részét képezik (NAc, dorsalis striatum, OFC , ACC, amygdala, hippokampusz és sziget) (Killgore és Yurgelun-Todd 2005). Ezzel szemben a normál tömegű kontrollokban az ACC és OFC (az NAc-ba vető, az élelmezés megítélésében részt vevő régiók) aktiválása a magas kalóriatartalmú ételek bemutatása során negatív korrelációt mutatott testtömeg-indexükkel (BMI) ( Stice és mtsai. 2008b). Ez arra utal, hogy dinamikus kölcsönhatásra kerül az elfogyasztott ételek mennyisége (részben a BMI-ben tükröződve) és a jutalom régiók reakcióképessége a magas kalóriatartalmú ételekkel (tükröződik az OFC és az ACC aktivációjában) normál testtömegű egyénekben, amely elhízottság.
Meglepő módon az elhízott egyének kevésbé aktiválták a jutalomáramlást a tényleges élelmezés-fogyasztás alapján (úgynevezett tápláló élelmezési jutalom), mint a sovány egyének, míg azok a szomatoszenzoros kortikális régiók nagyobb aktiválódását mutatták, amelyek a fogyasztást várhatóan megkönnyítik (Stice et al. 2008b). Ez utóbbi megfigyelés megfelel azoknak a régióknak, ahol egy korábbi tanulmány kimutatta az elhízott alanyok fokozott aktivitását az alapvonalon (nem stimuláció) (Wang et al. 2002) (Ábra. 7d, e). Az ízletességet feldolgozó régiók fokozott tevékenysége arra késztetheti az elhízott alanyokat, hogy az ételeket más természetes erősítőkkel szemben támogassák, míg a dopaminerg célok csökkent aktiválása a tényleges élelmiszer-fogyasztás miatt túlfogyasztáshoz vezethet, mivel ez kompenzálja a D2R által közvetített jelátvitelt (Stice et al. 2008a). Az elhízott betegeknek a jutalomáramlásnak az élelmezés-fogyasztásra gyakorolt ilyen csökkentett reakciója emlékeztet arra, hogy a függőségben szenvedõ személyeknél a csökkent kábítószer-növekedés a drogfogyasztás által kiváltott, mint a nem függõ alanyoké.
A prefrontalis kéreg (PFC) kulcsfontosságú szerepet játszik a végrehajtó funkcióban, beleértve a gátló kontrollot (Miller és Cohen 2001). Ezeket a folyamatokat a D1R és a D2R modulálja (feltehetően D4R is), és így a PFC csökkent aktivitása, akár függőségben, akár elhízásban, valószínűleg hozzájárul a rossz irányításhoz és a magas kényszerképességhez. A D2R normálnál alacsonyabb szintű elérhetősége az elhízott egyének striatumában, amelyet a PFC és ACC csökkent aktivitása okozott (Volkow et al. 2008b) ezért valószínűleg hozzájárul az élelmiszer-bevitel hiányos ellenőrzéséhez. Valójában az elhízottan bejelentett negatív korreláció a BMI és a striatalis D2R között (Wang et al. 2001) és túlsúlyosak (Haltia et al. 2007a) az egyének támogatják ezt. Azoknak a mechanizmusoknak a jobb megértése, amelyek az elhízásban (vagy függőségben) a PFC-funkció károsodásához vezetnek, megkönnyítheti a kritikus kognitív területeken tapasztalható speciális károsodások enyhítésére, vagy akár visszafordítására irányuló stratégiák kidolgozását. Például a késleltetett diszkontálás, amely a jutalmat a kézbesítés időbeli késleltetése alapján csökkenti, ez az egyik legszélesebb körben vizsgált kognitív művelet az impulzivitással és a kényszereséggel kapcsolatos rendellenességekkel kapcsolatban. A késleltetett diszkontálást a legteljesebben azokban a kábítószer-visszaélésekben vizsgálták, akik túlzottan előnyben részesítik a kicsi, de azonnali, mint a nagy, de késleltetett jutalmakat (Bickel et al. 2007). Azonban néhány, az elhízott egyénekkel végzett tanulmány azt is fedezte fel, hogy a magas, azonnali jutalmat részesítik előnyben, annak ellenére, hogy megnövekedett esélye van a jövőbeni nagyobb veszteségek elszenvedésére (Brogan et al. 2010; Weller et al. 2008). És a közelmúltban egy másik tanulmány pozitív összefüggést talált a BMI és a hiperbolikus diszkontálás között, amely szerint a jövőbeli negatív kifizetések alacsonyabbak lesznek, mint a jövőbeni pozitív kifizetések (Ikeda et al. 2010). Érdekes módon úgy tűnik, hogy a késleltetett diszkontálás függ a ventrális striatum működésétől (Gregorios-Pippas et al. 2009) és a PFC, beleértve az oldalsó OFC-t (Bjork et al. 2009), és érzékeny a DA manipulációkra (Pine et al. 2010). Pontosabban, a DA jelzés javítása (L DOPA kezeléssel) növelte az impulzivitást és az időbeli diszkontáltságot.
5 Motivációs áramkörök bevonása
A dopaminerg jelzés szintén modulálja a motivációt. Az olyan viselkedési vonásokat, mint az életerő, kitartás és a cél elérésére irányuló folyamatos erőfeszítések befektetése, mind a DA célzott régiókon keresztül történő modulációjának kell alávetni, ideértve a NAc-t, ACC-t, OFC-t, DLPFC-t, amygdala-t, háti striatumot és ventrális pallidumot (Salamone et al. 2007). A diszregulált DA jelzés a fokozott kábítószer-beszerzési motivációval jár, ami a függőség egyik jellemzője, ezért a kábítószer-függők gyakran szélsőséges viselkedést mutatnak a drogok beszerzése érdekében, még akkor is, ha azok ismert súlyos és káros következményekkel járnak (Volkow és Li 2005). Mivel a kábítószer-fogyasztás a drogfüggőség fő motivációs hajtóerejévé válik (Volkow et al. 2003), a függőségeket szenvedő alanyokat felébresztik és motiválják a gyógyszer előállításának folyamata, de hajlamosak visszavonulni és apatikusak, amikor a droggal nem összefüggő tevékenységeknek vannak kitéve. Ezt a eltolódást úgy tanulmányozták, hogy összehasonlítottuk a kondicionált váladékoknak való kitettségnél bekövetkező agyi aktiválási mintákat az ilyen vonalak hiányában bekövetkező eseményekkel. A méregtelenített kokain-elhasználóknál észlelt prefrontalis aktivitás csökkenésével ellentétben, amikor nem stimulálják őket drogokkal vagy drogokkal [lásd áttekintést (Volkow et al. 2009a)], ezek a prefrontalis régiók aktiválódnak, amikor a kokainhasználók vágyát kiváltó ingereknek vannak kitéve (akár drogok, akár dákók) (Grant et al. 1996; Volkow et al. 1999a; Wang és mtsai. 1999). Ez az eredmény arra a megfigyelésre emlékeztet, hogy a kokainhasználók - röviddel a kokain-binging epizódja után - tanulmányozták az OFC és az ACC (szintén a hátsó striatum) metabolikus aktivitásának fokozódását, ami a vágyhoz társult (Volkow et al. 1991).
Ezen túlmenően, amikor összehasonlítják az iv MP-re adott válaszokat a kokainfüggő és a függőség nélküli egyének között, az előbbiek fokozott metabolizmussal reagáltak a ventrális ACC-ben és a mediális OFC-ben (a vágyhoz kapcsolódó hatás), míg az utóbbi ellentétes választ mutatott, azaz csökkent metabolizmus ezekben a régiókban (Volkow et al. 2005). Ez arra utal, hogy ezeknek a prefrontalis régióknak a gyógyszeres expozícióval történő aktiválása specifikus lehet a függőség szempontjából, és a gyógyszer iránti fokozott vágyhoz kapcsolódhat. Ezenkívül egy olyan vizsgálat, amely arra késztette a kokainfüggő alanyokat, hogy szándékosan gátolják a vágyat, amikor gyógyszeres jelzéseknek vannak kitéve, azt mutatták, hogy azoknál az alanyoknál, akik sikeresen gátolták a vágyot, csökkent metabolizmusa volt a mediális OFC (amely egy erősítő motivációs értékét dolgozza fel) és az NAc (amely előrejelzi jutalom) (Volkow et al. 2009b). Ezek az eredmények tovább erősítik az OFC, az ACC és a striatum szerepét a függőségben tapasztalt fokozott motivációban a drog beszerzésére.
Megjósolható módon az OFC-t szintén befolyásolták az élelmezés-változási értéknek az élelmiszerhez való hozzárendelésében (Grabenhorst et al. 2008; Rolls és McCabe 2007), segítve a várható kellemesség és ízlés felmérését a kontextus függvényében. Az FDG-vel végzett, az agy glükóz-anyagcseréjének mérésére normál súlyú egyénekben végzett PET-vizsgálatok azt jelentették, hogy az élelmezési útmutatásoknak való kitettség fokozta az anyagcsere-aktivitást az OFC-ben, ami az éhínség észlelésével és az étvágy iránti összefüggés (Wang et al. 2004). Az OFC fokozott aktivációja az élelmiszer-stimulációval valószínűleg tükrözi a downstream dopaminerg hatásokat és részt vesz a DA részvételében az élelmiszer-fogyasztás iránti törekvésben. Az OFC szerepet játszik az stimulus-erősítő asszociációk tanulásában és a kondicionálásban (Cox et al. 2005; Gallagher et al. 1999) támogatja a kondicionált dákó által kiváltott táplálkozást (Weingarten 1983), és valószínűleg hozzájárul a túlemeléshez, függetlenül az éhség jeleitől (Ogden és Wardle 1990). Az OFC diszfunkciója valóban a túlaltatáshoz kapcsolódik (Machado és Bachevalier 2007).
A tanulmányok némi ellentmondása ellenére az agyi képalkotó adatok azt a feltevést is alátámasztják, hogy az agyi régiók szerkezeti és funkcionális változásai, amelyek a végrehajtó funkcióval járnak (ideértve a gátló ellenőrzést is), az egyébként egészséges egyének magas BMI-jéhez vezethetnek. Például egy idős nőkben elvégzett MRI-vizsgálatban, voxel-alapú morfometria alkalmazásával, negatív korrelációt találtak a BMI és a szürkeanyag-mennyiségek (beleértve a frontális régiókat) között, amelyet az OFC-ben a végrehajtott funkció csökkent működése okozott (Walther et al. 2010). A PET-rel az agy glükóz-anyagcseréjének mérésére az egészséges kontrollokban negatív összefüggést jelentettünk a BMI és az anyagcsere-aktivitás között a DLPFC, OFC és ACC között. Ebben a tanulmányban a prefrontalis régiókban a metabolikus aktivitás előre jelezte az alanyok teljesítményét a végrehajtó funkció teszteiben (Volkow et al. 2009c). Hasonlóképpen, egy nukleáris mágneses rezonancia (NMR) spektroszkópiai vizsgálat egészséges középkorú és idős kontrollokban kimutatta, hogy a BMI negatív kapcsolatban van az N-acetil-aszpartát (a neuronális integritás jelzője) szintjével a frontális kéregben és az ACC-ben (Gazdzinski et al. 2008; Volkow et al. 2009c).
Az agyi képalkotó vizsgálatokban, amelyek az elhízott és sovány személyeket hasonlították össze, alacsonyabb szürkeanyag-sűrűségről számoltak be a frontális területeken (frontális operculum és középső frontális gyrus), valamint poszt-centrális gyrusban és putamenben (Pannacciulli et al. 2006). Egy másik tanulmány azonban nem talált különbséget az elhízott és sovány személyek szürketartalmában, pozitív korrelációt mutatott ki az agyi basalis struktúrák fehérjemennyisége és a derék és a csípő aránya között, ezt a tendenciát a diéta részben megfordította (Haltia et al. 2007b). Érdekes módon azt találták, hogy a kérgi területek, mint például a DPFC és az OFC, amelyek a gátló kontrollban vesznek részt, a sikeres étrendben aktiválódnak az étkezés fogyasztására adott válaszként (DelParigi et al. 2007), amely felhívja a figyelmet az esetleges viselkedési átképzésre az elhízás (és a függőség) kezelésében.
6 Az intercepciós áramkör bevonása
A neurokémiai tanulmányok kimutatták, hogy a középső szigetelés kritikus szerepet játszik az étel, a kokain és a cigaretta iránti vágyban (Bonson et al. 2002; Pelchat et al. 2004; Wang és mtsai. 2007). Az insula jelentőségét kiemelte egy olyan tanulmány, amely arról számolt be, hogy az ebben a régióban káros dohányosok (de nem az ellenőrző dohányzók, akik nem az izoláris sérülésekben szenvedtek el) képesek voltak abbahagyni a dohányzást anélkül, hogy sóvárgást vagy visszaesést tapasztaltak volna (Naqvi et al. . 2007). Az insula, különösen annak elülső régiói, kölcsönösen kapcsolódnak több limbikus régióhoz (pl. Ventromedialis prefrontalis cortex, amygdala és ventrális striatum), és úgy tűnik, hogy interocepciós funkcióval rendelkezik, amely az autonóm és a zsigeri információkat érzelmekkel és motivációval integrálja, így biztosítva e sürgető tudatosság (Naqvi és Bechara 2009). Az agyi léziók tanulmányai valóban azt sugallják, hogy a ventromedialis PFC és az insula az elosztott áramkörök szükséges alkotóelemei, amelyek támogatják az érzelmi döntéshozatalt (Clark et al. 2008). Ezzel a hipotézissel összhangban a képalkotó vizsgálatok következetesen megmutatják a szigetek differenciális aktiválását a vágy alatt (Brody et al. 2009; Goudriaan et al. 2010; Naqvi és Bechara 2009; Wang és mtsai. 1999). Ennek megfelelően ennek az agyi régiónak a reakcióképességét javasolták biomarkerként szolgálni a visszaesés előrejelzésében (Janes et al. 2010).
Az insula szintén elsődleges ízletes terület, amely részt vesz az étkezési magatartás sok szempontjában, például az ízlésben. Ezenkívül a rostral insula (kapcsolódva az elsődleges ízkéreghez) olyan információkat szolgáltat az OFC számára, amelyek befolyásolják a beérkező ételek kellemességének vagy jutalomértékének multimodális ábrázolását (Rolls 2008). Mivel az insula a test intercepciós értelemben vett szerepet játszik az érzelmi tudatosságban (Craig 2003), valamint a motivációban és az érzelmekben (Rolls 2008), az izolált károsodás hozzájárulása az elhízásban várható. Valójában a gyomor dissztenziója a hátsó szigetelődés aktiválódását eredményezi, amely valószínűleg tükrözi annak szerepét a testállapotok tudatában (ebben az esetben a teljességben) (Wang et al. 2008). Ezenkívül sovány, de elhízott betegeknél a gyomorkihúzás az amygdala aktiválását és az elülső szigetelés deaktiválását eredményezte (Tomasi et al. 2009). Az amygdala válasz hiánya az elhízott betegeknél tükrözheti a teltségérzettel (teljes gyomorral) kapcsolatos testi állapotok tompa interocepciós tudatosságát. Annak ellenére, hogy az DA szigetbeli aktivitásának modulációját kevésbé vizsgálták, elismert tény, hogy a DA részt vesz a szigeten keresztül közvetített ízletes ételek kóstolására adott válaszokban (Hajnal és Norgren 2005). Emberi képalkotó vizsgálatok kimutatták, hogy az ízletes ételek kóstolása aktiválta az insula és a középső agy területeket (DelParigi et al. 2005; Frank és munkatársai. 2008). A DA jelzésre azonban szükség lehet az élelmiszer kalóriatartalmának érzékeléséhez. Például, amikor a normál testtömegű nők kalóriával édesítőszert kóstoltak meg (szacharóz), akkor az insula és a dopaminerg középső agy területe is aktiválódik, míg a kalóriamentes édesítő (szukralóz) kóstolása csak az izolát aktiválta (Frank et al. 2008). Az elhízott alanyok nagyobb szigetbeli aktiválást mutatnak, mint a normál kontroll, ha cukorból és zsírból álló folyékony étkezés megkóstolása történik (DelParigi et al. 2005). Ezzel szemben az anorexia nervosa után felépült egyének kevesebb aktivációt mutatnak az izolátumban a szacharóz kóstolásakor, és a normál kontrollokban nem figyelhetők meg a kellemes érzések és az izolátus aktiválás összefüggései (Wagner et al. 2008). Ezek az eredmények együttesen valószínűsíthetik, hogy az inzulák íz-ingerekre adott válaszának rendellenessége befolyásolhatja a különféle étvágygerjesztő viselkedések csökkent szabályozását.
7 Az idegenkedés áramköre
Mint korábban említettem, a jutalmat előrejelző dákón történő edzés (kondicionálás) dopaminerg sejteknek a jutalom előrejelzésére válaszul történő kiégéshez vezet, nem pedig a jutalomhoz. Másrészt, és ezzel a logikával összhangban megfigyelték, hogy a dopaminerg sejtek a normálnál kevésbé fognak tűzni, ha a várt jutalom nem valósul meg (Schultz et al. 1997). Összesített bizonyítékok (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto és Hikosaka 2007; Nishikawa et al. 1986) rámutat arra, hogy a habenula az egyik olyan régió, amely szabályozza a VTA dopaminerg sejtjeinek égetésének csökkenését, amely a várt jutalom elmulasztásának következménye lehet (Kimura et al. 2007). Így a habenula fokozott érzékenysége, a krónikus gyógyszer-expozíció eredményeként, nagyobb reakcióképességen alapulhat a gyógyszerjelekkel szemben. Valójában a habenula aktiválását a kokaintól függő alanyokban a drogbevitel utáni viselkedés visszaesésével társították dákó expozíció során (Brown et al. 2011; Zhang és munkatársai. 2005). A nikotin esetében az α5 nikotinreceptorok a habenulában úgy mutatják, hogy modulálják a nikotin nagy dózisaival szembeni agresszív válaszokat (Fowler et al. 2011); és a habenula α5 és α2 receptorai nikotinkivonással járnak (Salas et al. 2009). Mivel a habenula ellentétesen reagál a DA idegsejtek jutalmazására (inaktiválására), és aktiválódása averzív ingereknek való kitettség miatt, akkor a habenula jelátvitelre utalunk, mint amely egy „antireward” bemenetet közvetít..
Úgy tűnik, hogy a habenula hasonló szerepet játszik az élelmezés szempontjából. Egy rendkívül ízletes élelmezési étrend elhízást válthat ki patkányokban, mivel a súly növekedése összefüggésben áll a μ-opioid peptid kötődésének növekedésével a bazolaterális és a basomedialis amygdalaban. Érdekes, hogy a mediális habenula szignifikánsan magasabb μ-opioid-peptid-kötődést mutat (kb. 40% -kal) az ízletes ételeknek való expozíció után patkányoknál, akik súlyt kaptak (azoknál, akik több táplálékot fogyasztottak), de nem azoknál, akik nem. (Smith et al. 2002). Ez arra utal, hogy a habenula ízletes ételek rendelkezésre állása esetén részt vehet a túlsúlyban. Ezenkívül a rostromedialis tegmentummagban az idegsejtek, amelyek jelentős bemenetet kapnak az oldalsó habenulákból, a VTA DA neuronokba kerülnek, és élelmezés nélkül aktiválódnak (Jhou et al. 2009). Ezek az eredmények összhangban vannak a habenula szerepével az olyan agresszív ingerekre vagy állapotokra adott válaszok közvetítésében, mint például azok, amelyek az étrend vagy a gyógyszer abbahagyásakor jelentkeznek.
A habenula, mint antireward csomópont bevonása az érzelmi hálózatokba összhangban van a korábbi addiktív elméleti modellekkel, amelyek szenzibilizált anti-jutalomválaszokat feltételeztek (amelyek az amygdala fokozott érzékenységén és a kortikotropin felszabadító tényezőn keresztüli fokozott jelzésen keresztül közvetítik), mint függőségfüggő drogbevitel. (Koob és Le Moal 2008). Hasonló visszaszorító reakciók hozzájárulhatnak az elhízásban bekövetkező túlzott ételfogyasztáshoz.
8 Patológiai gyógyszer- és élelmezési jutalom: Frissített működő modell
TAnnak ellenére, hogy képes ellenállni a kábítószer-fogyasztás vagy az étkezési ponton túli étkezés követelményének, a felülről lefelé történő irányításban részt vevő idegáramkörök megfelelő működéséhez szükség van az olyan kondicionált válaszok elleni fellépésre, amelyek előrejelzik az étel / gyógyszer bevételének jutalmát és a készítmény lenyelésének vágyát. élelmiszer / gyógyszer. Itt kiemeltük ezeknek a köröknek a hatát: jutalom / ösztönzés, kondicionálás / szokások, gátló kontroll / végrehajtó funkció, motiváció / motiváció, interocepció és az elkerülés elkerülése / stresszreaktivitás (5. ábra). 8). Az itt bemutatott képalkotó adatok alapján feltételezzük, hogy a gyógyszer / ételhatások (kondicionált válaszok) elvárása és a tompa neurofiziológiai hatások közötti eltérés tartja fenn a gyógyszerek fogyasztását vagy az ételek túlfogyasztását a várható jutalom. Ugyancsak, függetlenül attól, hogy korai vagy elhúzódó absztinencia / diétás időszakokban tesztelték, a rabja / elhízott alanyok alacsonyabb D2R-értéket mutatnak a striatumban (beleértve a NAc-t is), ami összefüggésben áll a kezdeti aktivitás csökkenésével az elülső agyi régiókban, melyeket az érzékenység meghatározása (orbitofrontalis cortex) okoz, és gátolja. vezérlés (ACC és DLPFC), amelynek megszakítása kényszereséget és impulzivitást eredményez. Fbelsőleg, bizonyítékok is felmerülnek az intercepciós és averzív áramkörök szerepéről a szisztémás egyensúlytalanságokban, amelyek akár gyógyszerek, akár ételek kényszeres fogyasztásához vezetnek.
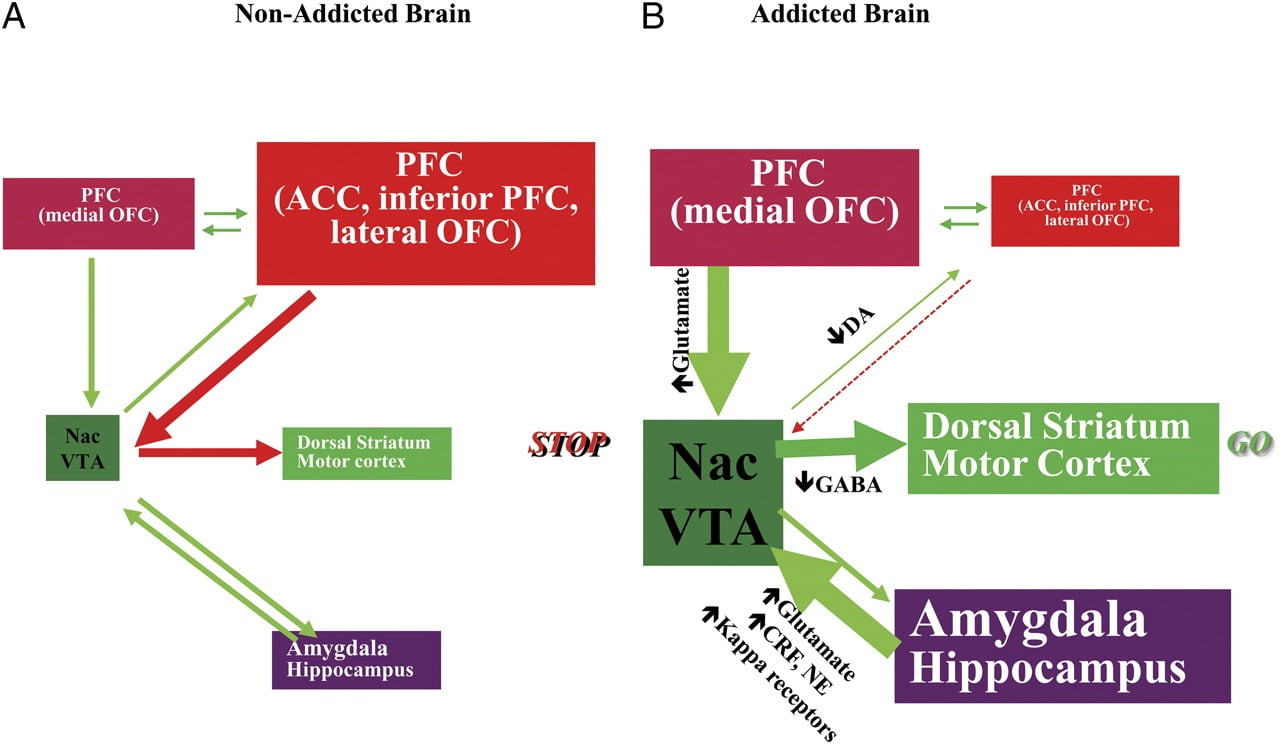
Ábra 8 Interaktív áramkörök hálózatát javasló modell, zavarok, amelyek hozzájárulnak a kábítószer-függőség és a krónikus túlaltatás alapjául szolgáló sztereotípiás magatartás komplex halmazához: jutalom (nucleus accumbens, VTA és ventrális pallidum), kondicionálás / memória (amygdala, medialis OFC az érzékenység hozzárendelésére, hippokampusz és hátsó striatum a szokásokhoz), végrehajtó kontroll (DLPFC, ACC, alsó frontális kéreg és laterális OFC), motiváció / hajtóerő (medialis OFC a só felvételéhez, ventrális ACC, VTA, SN, hátsó striatum és motoros kéreg). Nac, atommagok, interocepció (Insula és ACC) és elkerülés / elkerülés (Habenula). a Ha ezek az áramkörök kiegyensúlyozottak, ez megfelelő gátló ellenőrzést és döntéshozatalt eredményez. b A függőség során, amikor a jutalom, a motiváció és a memória körében a gyógyszer fokozott várakozási értéke felülmúlja a kontrolláramkört, előnyben részesíti a pozitív visszacsatolási hurkot, amelyet a gyógyszer fogyasztás kezdeményezett és a motiváció / motiváció fokozott aktiválása folyt. és memóriaáramkörök. Ezek az áramkörök kölcsönhatásba lépnek a hangulatszabályozásban részt vevő áramkörökkel, ideértve a stressz reakcióképességét (amely magában foglalja az amygdala, hipotalamust, habenulát) és az interocepciót (amely magában foglalja az insulát és az ACC-t, és hozzájárul a vágy tudatosításához). Számos neurotranszmitter vesz részt ezekben a neuroadaptációkban, köztük a glutamát, a GABA, a norepinefrin, a kortikotropint felszabadító faktor és az opioid receptorok. CRF, kortikotropint felszabadító faktor; NE, norepinefrin. Volkow et al. Engedélyével módosítva. (2011b)
Ezekben a körökben a szekvenciális zavarok következtében az egyének 1-et tapasztalhatnak megnövekedett motivációs értéket (a megtanult asszociációk a kondicionálás és a szokások révén) más erősítők rovására (a jutalmazási kör csökkent érzékenysége miatt) ), 2) csökkent képessége a szándékos (cél-célú) tevékenységek gátlására, amelyet kivált az erős kábítószer / étel iránti vágy (kiváltva a káros végrehajtó funkciót), amely kényszeres gyógyszer / étel bevitelt eredményez, és az 3) fokozott stressz-reakcióképességet és az averzív elkerülés, amely impulzív gyógyszeres szedést eredményez a riasztó állapot elkerülése érdekében.
Ez a modell egy hosszan tartó terápiás megközelítést javasol a függőséghez, amelynek célja a gyógyszer / élelmiszer erősítő tulajdonságainak csökkentése, a természetes erősítők juttató tulajdonságainak helyreállítása / javítása, a kondicionált tanulott társulások gátlása, a nem gyógyszerrel / élelmezéshez kapcsolódó tevékenységek motivációjának fokozása, a stresszreaktivitás csökkentése. , javítja a hangulatot, és erősíti az általános célú gátló ellenőrzést.
Köszönetnyilvánítás
A szerzők szeretnék köszönetet mondani a Nemzeti Egészségügyi Intézetek NIAAA intramural programjának támogatásának.
Referenciák