Tudományos jelentései kötet 9, Cikkszám: 16918 (2019)
Absztrakt
A túlzott szacharózfogyasztás addiktív vágyat vált ki, amely alátámaszthatja az elhízásos járványt. Az opioidok és a dopamin közvetítik a visszaélés elleni kábítószerek és az ingerek, például az ízletes ételek természetes nyereségeit. A szacharóz hatásait PET képalkotó módszerrel vizsgáltuk [11C] karfentanil (μ-opioid receptor agonista) és [11C] racloprid (dopamin D2 / 3 receptor antagonista) hét női érzéstelenített Göttingeni minitábban. Ezután a minipigákat egy órán át 12 egymást követő napon hozzáférést biztosítottuk a szacharóz oldathoz, és 24 órával a végső szacharóz hozzáférés után ismét képalkotást végeztünk. Öt miniatűrből álló kisebb mintában további [11C] karfentanil PET-munkamenet az első szacharóz-expozíció után. Kiszámítottuk a voxel-összefüggő kötési potenciálokat (BPND) a kisagyt, mint a nem kicserélhető kötődés régióját, elemezte a különbségeket statisztikai, nem paraméteres térképezéssel, és elvégzett egy regionális elemzést. 12 napos szacharóz hozzáférés után BPND mindkét nyomjelző szignifikánsan csökkent a striatumban, a nucleus carrbensben, a thalamusban, az amygdalaban, a cingulate cortexben és a prefrontalis cortexben, összhangban a receptor sűrűségének csökkentésével. Egyszeri szacharóz-expozíció után a [11C] karfentanil a magvagyonban és a cinguláris kéregben, összhangban az opioid felszabadulásával. Az opioid- és dopaminreceptorok alacsonyabb elérhetősége magyarázhatja a szacharóz bevitelével járó függőségi potenciált.
Bevezetés
A világ népességének öt százaléka klinikailag elhízott1. A metabolikus szindróma egyik jellemzőjeként az elhízás társul a 2. típusú cukorbetegséghez, szív- és érrendszeri betegségekhez, légzési problémákhoz, valamint a depresszió és esetleg demencia kockázatához.2. Az energia-sűrű ételek fokozott fogyasztásával eltúlzották az élelmezés-hiányt követő homeosztatikus éhség és a hedonikus éhség, vagy „nélkülözés” közötti élettani különbséget.3,4. Mivel önmagában a homeosztatikus szabályozás nem tudja figyelembe venni az elhízás jelenlegi növekedését, kötelezően meg kell vizsgálni a rendkívül ízletes ételek addiktív tulajdonságainak a jutalom és az öröm hatását az agy mechanizmusaira.
A szacharóz fogyasztása elhízással jár, és a szacharózt egyre inkább addiktív anyagnak tekintik5. Egyes megállapítások eltérnek ezen állítástól, mivel nehézségeket okoz a nem ízletes élelmiszer-fogyasztás elválasztása a hedonikus élelmezési válaszoktól, a feldolgozott ételek addiktív összetevőjének meghatározása, valamint az a különféle mechanizmusok, amelyek révén az élelmiszer megváltoztatja az agyi áramlást a természetes útvonalakon keresztül.6. Mindazonáltal, bizonyos összefüggésekben a szacharóz bevitele olyan jutalmat és vágyat vált ki, amely nagyságrenddel hasonló a addiktív gyógyszerek által indukáltakhoz, és ez túlfogyasztáshoz és esetleges elhízáshoz vezet.6,7.
Az éhség a „vágyalomhoz” kapcsolódik, amely szoros kapcsolatban áll a dopaminerg neurotranszmisszió hatásaival számos jutalom esetén.8, de továbbra sem világos, hogy a dopamin (DA) hatása hogyan változik a kényszeres étkezésre adott válaszként. Az ízletes ételek fogyasztása összekapcsolódik a „szeretettel”, amelyet elsősorban az endogén opioid rendszer, különösen a μ-opioid receptor (μOR) közvetít.9,10, amely a dereguláción keresztül elősegítheti a túlfogyasztást. Ebben a jelentésben teszteljük azt az állítást, miszerint a szacharóz opioid és dopamin felszabaduláshoz vezet, ami csökkenti a μOR és DA D2 / 3 receptorok elérhetőségét. A rendelkezésre állás a kiiktatásra kerülő receptorok számának indexeként szolgál, amelyek elérhetőek a nyomjelző kötéséhez, és elvben nem tesz különbséget a ligandum elfoglaltsága és a receptor sűrűsége között.11.
A kényszeres étkezés kezdete több tényezőtől függ, és az emberekkel kapcsolatos ok-okozati vizsgálatok etikai kérdéseket vetnek fel. Ezért a vizsgálatok nagy része a patkányok táplálkozási viselkedésére koncentrál12. Noha a patkányok „édesszájúak”, a testtömeg-növekedéshez, az anyagcseréhez és a zsírfelhalmozódáshoz fontos homeosztatikus mechanizmusuk jelentősen különbözik az emberekétől. A Göttingeni minipiga egy nagy mindenevő állat, fejlett gyrencephalis agyukkal, amely megfelelő felbontással képezhető fel. Jól definiált subkortikális és prefrontalis corticalis régiói13 lehetővé teszik az emberi agy működésének közvetlen közvetítését. Itt a pozitron emissziós tomográfia (PET) képalkotást használjuk a teszteléshez in vivo μOR és DA D2 / 3 elérhetőség egy szubkrónikus szacharóz expozíció minipig modelljében. Egy kisebb mintában megvizsgáltuk a μOR-kihasználtságra gyakorolt azonnali hatásokat az első szacharóz-expozíció után. Végül kipróbáltuk a két nyomjelző receptor hozzáférhetőségében bekövetkező változások kapcsolatát.
Eredmények
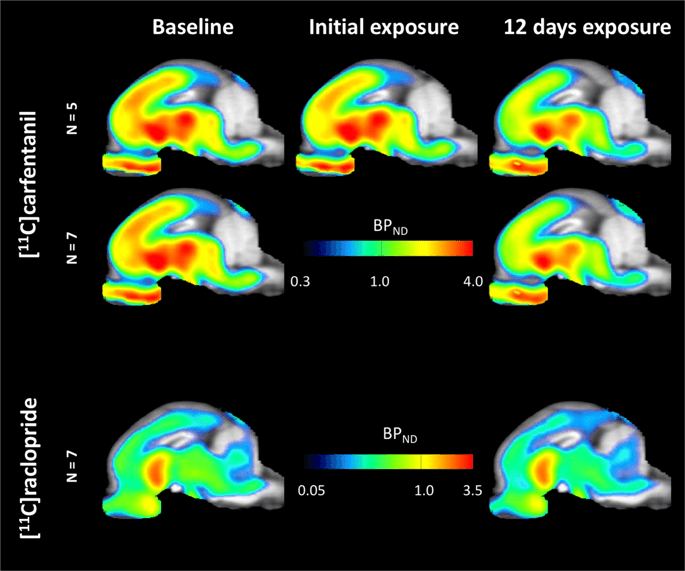
Átlagos parametrikus térképek11C] karfentanil és [11C] racloprid kötési potenciál (BPND) az XNUMX. ábrán látható. 1. Az első szacharóz-expozíciót követő változások elemzése öt minipigben, összehasonlítva a kiindulási értékkel, és egy nappal a 12th szacharóz hozzáférés hét minipigben az alapvonalhoz viszonyítva, permutációs elméletet és nem regionálisan korlátozott teljes agy elemzést alkalmaztunk, az ilyen méretű mintáknál az előnyben részesített módszer14.
Átlagos voxel-alapú, nem mozgatható kötési potenciál (BPND) térképeket helyeznek el az MRI képekre sagittális nézetben. Az adatok a következőkre vonatkoznak:11C] carfentanil BPND a kezdeti szacharóz-expozíció és 5 napos szacharóz-expozíció után (az első sorban) az 12 kezelt miniatűrből áll. [11C] carfentanil BPND mind a hét minipigéből, amelyek az alapvonalon vannak ábrázolva, és 7 napos szacharóz hozzáférés után kerülnek a középső sorba. [11C] raclopride BPND mind a hét minipigéből, amelyek a kiindulási állapotban vannak ábrázolva, és 7 napos szacharóz hozzáférés után látható az alsó sorban. Vegye figyelembe, hogy a színskála exponenciális a [11C] raclopride BPND extrastriatális régiókban.
Kezdeti szacharóz expozíció
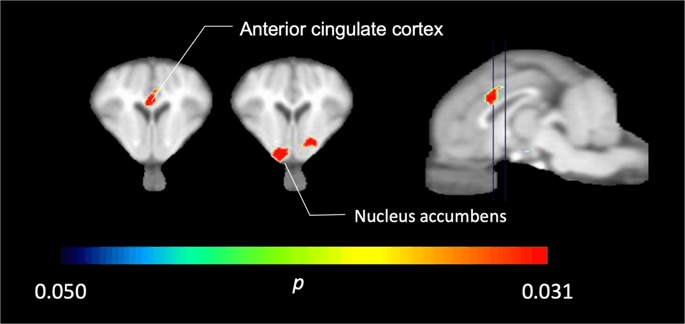
Az öt minipigben, amely a [11C] karfentanil a kiindulási pontban és közvetlenül az első szacharóz-expozíció után szignifikánsan csökkentette a nyomjelző kötődését az elülső cinguláris kéregben és a magban a szacharózra adott válaszként, a XNUMX. ábrán látható színtel. 2, jelezve p <0.05. A kiindulási értékhez képest mindkét területen 14% -kal csökkent nyomjelző kötődést észleltünk.
Jelentősen csökkent a [11C] carfentanil BPND az első szacharóz-víz expozíció után az alapértékhez képest (n = 5). Csak a (p <0.05) csökkenést mutatnak, amikor a T1 súlyozott MRI-re vetített színes területek az elülső cinguláris kéreg (bal) és a nucleus accumbens (középső) szintjén vannak kivetítve egy sztereotaxiás minipig agyatlaszból. Ne feledje, hogy az 5 állattal elérhető maximális szignifikanciaszint 2-5 ≈ 0.031 (lásd a színsávot). Az adatokat a sertés agyának koronális szakaszaira mutatjuk be, a szagittális képen feltüntetett szinteken (jobbra).
12 nap szacharóz hozzáférés
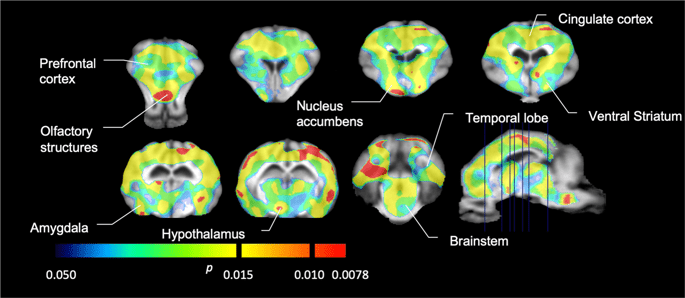
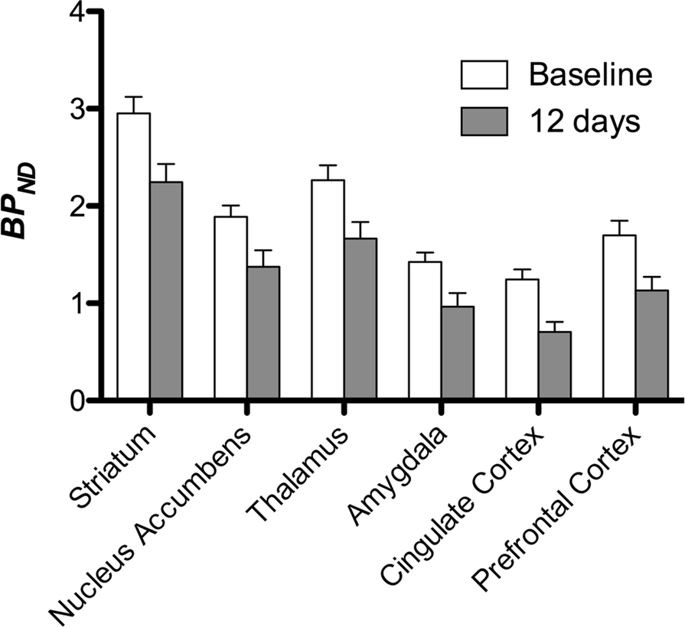
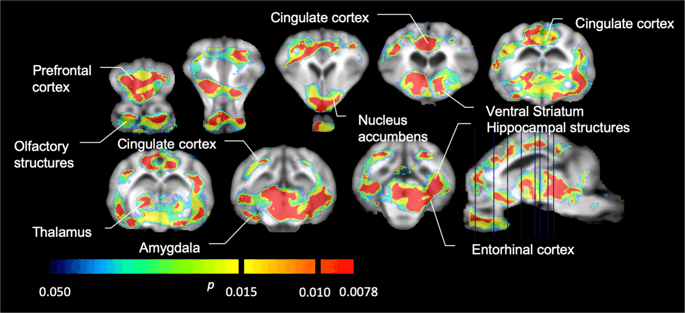
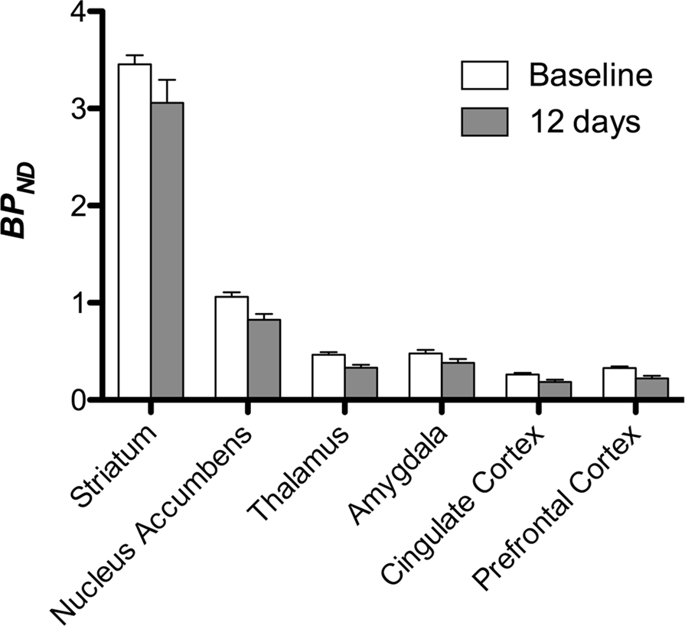
Ezután elvégeztük a hét minipig elemzését, a következőkkel:11C] karfentanil a kiindulási állapotban és 12 napos szacharóz hozzáférés után, és szignifikánsan csökkentette a nyomjelző kötődését a szacharózzal kitett állatokban az alapvonalhoz képest. A leginkább érintett régiók piros színűek a XNUMX. ábrán. 3 (p <0.01), és tartalmazzák a szaglási struktúrák egyes részeit, a nucleus accumbens / ventralis striatumot és a temporális kérget / lebenyt, majd sárga színnel jelölt területek (p <0.015), amelyek magukban foglalják a prefrontális kéreg, a cinguláris kéreg, az amygdala és az agytörzs részeit . A BP megszerzése érdekébenND értékeket és a százalékos változás becslését, regionális elemzést végeztünk, és az egyes régiókban átlagértékeket kaptunk a kiindulási és a szacharózfogyasztás után (XNUMX. ábra). 4).
Jelentősen csökkent a [11C] karfentanil kötési potenciál (BPND) az alapvonal és a 12 napos szacharózvíz expozíció után (n = 7). A voxelek jelentős (p <0.05) csökkenést mutatnak, amikor a T1 súlyozott MRI-re vetített színes területek egy sztereotaxiás minipig agyatlaszból származnak. Az adatokat a koronális agy metszeteiről mutatjuk be a sagittális képen (jobb alsó sarokban) jelzett szinteken. Vegye figyelembe, hogy a 7 állattal elérhető maximális szignifikanciaszint 2-7 ≈ 0.0078 (lásd a színsávot).
Használtuk [11C] racloprid, mint az DA D2 / 3 receptorok nyomjelzője a striatális és extrastriatális agyi régiókban a minipigéknél a kiindulási helyzetben és 12 napos szacharóz hozzáférés után (XNUMX. ábra). 1). Csökkent nyomjelző kötődést találtunk a szacharóznak kitett állatokban, összehasonlítva a legnagyobb hatású kiindulási ponttal (p <0.01) a prefrontális kéreg, a nucleus accumbens / ventralis striatum, a cinguláris kéreg, az amygdala, a thalamus, a mesencephalon, a hippocampalis régiók és a szagló területeken (Ábra. 5). A regionális elemzés adatait a XNUMX. ábra mutatja be. 6.
Jelentősen csökkent a [11C] racloprid kötési potenciál (BPND) az alapvonal és a 12 napos szacharózvíz expozíció után (n = 7). A voxelek jelentős (p <0.05) csökkenést mutatnak, amikor a T1 súlyozott MRI-re vetített színes területek egy sztereotaxiás minicsiga agyatlaszból származnak. Az adatokat a sertésagy koronális szakaszairól mutatjuk be a sagittális képen (jobb alsó sarokban) jelzett szinteken. Vegye figyelembe, hogy a 7 állattal elérhető maximális szignifikanciaszint 2-7 ≈ 0.0078 (lásd a színsávot).
Összefüggések a [11C] raclopride és [11C] karfentanil adatok
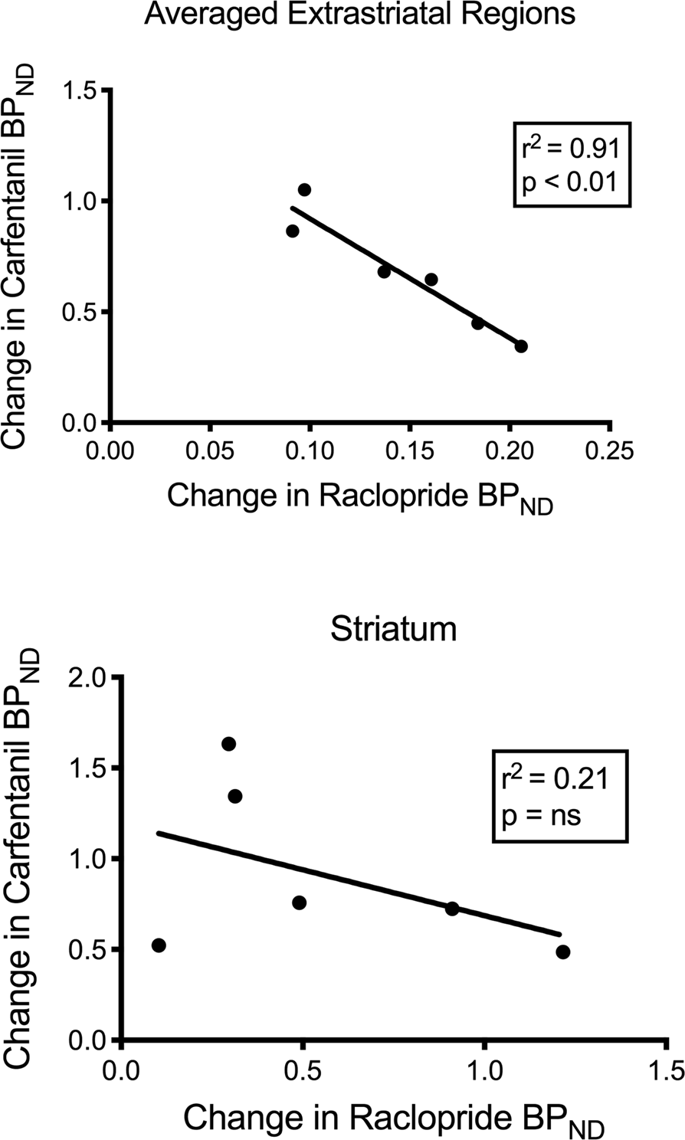
Kipróbáltuk a [11C] raclopride és [11C] a BP karfentanil-értékeiND a striatális és nem striatális régiókban a minipigéknél a kiindulási állapotban és a 12 napos szacharóz bevétel után, nem észleltek asszociációkat. Ezután megvizsgáltuk, hogy a nyomjelzőkötés csökkenése összefüggésben van-e, és összehasonlítottuk a BP változásaitND a [11C] raclopride a BP változásaivalND a [11C] karfentanil csak az alacsonyabb BP értékkel rendelkező minitűzekbenND mindkét nyomjelző szacharóz bevétele után (n = 6). Szignifikáns negatív összefüggéseket találtunk az átlagolt extrastriatalisban (r2 = 0.91, p <0.01), de nem striatális régiókban (ábra. 7).
Összefüggések a [11C] raclopride és [11C] karfentanil kötési potenciál (BPND) minipigékben, ahol a szacharóz bevétele után csökkent nyomjelzőkötés (n = 6). Az átlagolt extrastriatális régiók (felső) és a striatum (alsó) adatok kerülnek bemutatásra. A meghatározási együttható (r2) és a p értékeket mutatjuk be minden grafikonon.
Megbeszélés
Meghatároztuk a szacharózhoz való ismételt szakaszos hozzáférés hatását az opioid és DA neurotranszmisszióra az emlősök agyában. Hosszirányú in vivo A μOR és DA D2 / 3 receptorok PET-képalkotó vizsgálata során csökkent a receptorok elérhetősége a jutalmazási körben, ideértve a nucleus akumulációt, a prefrontalis cortexet és az elülső cingulate cortexet. Az eredmények egyértelműen bizonyítják, hogy a szacharóz a jutalmazási mechanizmusokat hasonló módon befolyásolja, mint a visszaélés elleni drogoké.
A szacharóz mint ízletes anyag bevétele ismert, hogy felszabadítja a DA-t és rágcsálók függőségét indukálja15, amikor a szacharóz a rágcsálók számára bizonyos körülmények között még kellemesebbnek bizonyul, mint a kokain. Így a rágcsálók intenzívebben dolgoznak szacharóz előállításánál, mint a kokain, még élelmezés nélkül5. A szacharóz hatásait azonban mind a homeosztatikus rendszer, mind a hedonikus jutalomáramkör szabályozza16,17 amelyek közvetíthetik a szacharóz hatás táplálkozási és hedonikus aspektusainak megkülönböztetését18. A „binging” előmozdítása érdekében napi egy órás ütemezést választottunk, mivel a patkányokkal végzett korábbi vizsgálatok azt mutatták, hogy a napi hozzáférés első órájában az időszakos ütemtervben magasabb a bevitel.15,19. Az ételek bevitelével kapcsolatos viselkedésbeli tanulmányok gyakran a korlátozott táplálkozású állatokat célozzák meg, de a felépítés nem feltétlenül tükrözi ugyanazokat az idegi mechanizmusokat, amelyek az elhízásban aktívak. A jelen vizsgálatban a sertések nem voltak korlátozottak élelmezésben, és a szacharózhoz való hozzáférés mellett a normál táplálkozásuk szokásos mennyiségét táplálták.
Az opioid receptorok (OR) széles körben expresszálódnak az agyban, különösen olyan szerkezetekben, amelyekről ismert, hogy modulálják az étkezési és jutalmazási folyamatokat20. A legkülső régiókról bebizonyosodott, hogy fontosak a kokain jutalmazó és megismétlődő hatásaiban21,22,23,24. A kötésben bekövetkező változások összefüggenek az étkezés homeosztatikus reakcióival és az ízletes ételekkel járó örömmel25. Különösen az étel kedvelése kapcsolódik az endogén opioid rendszerhez, különösen a μOR-hoz9,10 a magban a felhalmozódás és a ventrális pallidum26. Egy μOR-agonista infúziója a nucleus accumbens és a ventrális pallidum különálló részeibe erőteljesen fokozza a „kedvelő” viselkedést, beleértve a nyelv kiálló részét és a mancs nyalását, miután megnövekedett ízletes táplálékfelvétel27,28,29. Az opioid-jelzés további bizonyítéka a hedonikus szabályozás feldolgozásakor olyan μOR-antagonistákból származik, amelyek csökkentik az ízletes chow fogyasztását ad libitum- takarmányozott és élelmiszerrel korlátozott állatok, de korlátozottabb hatással vannak a nem ízletes standard pellet bevitelére30,31. Az emberekben a μOR antagonisták csökkentik a rövid távú táplálékfelvételt és csökkentik az ízletes ételek kellemességét32,33,34. Az opioid jelátvitel a bazolaterális amygdalaban szintén hozzájárul az étel „vágyához” a jutalomkeresés és az élelmiszer ösztönző értékének modulálásán keresztül35.
Val vel [11C] karfentanil, olyan nyomjelzőkötés képeit kaptunk, amelyek érzékenyek mind a μOR szintre, mind az endogén opioidok agyi felszabadítására.36,37. Az ÓOR rendelkezésre állásának azonnali veszteségét észleltük a nucleus activum és a cingulate cortulate elülső területein, a jutalmazási út specifikus agyi régióiban, miután öt széncukor kezeltük a szacharózt, összhangban az endogén opioid felszabadulással. Korábbi tanulmányok kimutatták, hogy az ízletes ételek örömérzethez vezethetnek38 az opioid felszabadulás stimulálásával. 12 napos szacharóz hozzáférés után csökkent [11C] karfentanil-kötés, amely számos lehetséges magyarázattal rendelkezik39 beleértve az endogén opioid-felszabadulást és a μOR-hoz való kötődést, az μOR-internalizációt a fokozott opioid-kötés eredményeként, valamint a fokozott DA D2 / 3 receptor aktiválást, ami μOR heterológ deszenzitizációjához vezet40.
A jelen megállapítások alátámasztására [11C] bulimia-ban szenvedő betegek karfentanil-vizsgálata41, elhízás42,43,44, és túlzott étkezési rendellenesség45, csökkent receptor elérhetőséget mutatnak. Ezek azonban krónikus állapotok, míg a minipigék csak 12 napig kaptak szacharózt. Az egészséges férfiak akut táplálkozási viselkedésének vizsgálatában az etetés robusztus és elterjedt endogén agyi opioid-felszabadulást eredményezett mind hedonia jelenlétében, mind hiányában, ami arra utal, hogy az opioid-felszabadulás tükrözi a metabolikus és homeosztatikus, valamint hedonikus válaszokat.25. Ez a tanulmány egy másik elemmel együtt, amely a betegeket csokoládé ízesítésű folyékony étkezés után ábrázolta44, közvetlenül kapcsolódik az öt minipig akut vizsgálatához az első szacharóz-expozíció után, de különbözik a szubkrónikus szacharóz-expozíciós vizsgálattól, amely 12 nap alatt zajlott le, ahol a csökkent receptúra-elérhetőség valószínűbben tükrözi az ismételt túlzott stimulációt és a μOR ezzel egyidejű csökkent szabályozását.
A prefrontalis cortex fontos a döntéshozatalban és az értékek hozzárendelésében, ezért a prefrontalis cortexben található μOR felelős lehet az élelmezés-változások megváltozott értékeléséért, ami növelheti az ételek addiktív potenciálját. A korábbi vizsgálatokkal összhangban csökkentett kötődést találtunk a prefrontalis kéregben, összhangban azzal, hogy a magas zsírtartalmú étrend csökkenti a prefrontalis cortex μOR mRNS szintjét46 és egy μOR-agonista infúziója a prefrontalis kéregben növeli az édes ételek bevitelét47. Ugyanakkor ismét felmerül a kérdés, vajon a magas zsírtartalmú étrend krónikusabb állapot-e, amely valószínűleg közvetíti a receptorcsökkentést, összehasonlítva a rövidebb ideig tartó szacharóz-táplálkozási tervvel, ami arra utal, hogy az endogén opioidok tartósan szabadulnak fel, amelyek kiszorítják a μOR-hoz kötött karfentanilt. , még 12 napos szacharóz után.
A DA szerepet játszik mind a kábítószerek, mind a viselkedés szempontjából. A krónikus kokainhasználat gátolta a DA jelátvitelt48. A DA D1 és D2 / 3 receptor szintet a sertés agyában a nikotin változtatja meg49, valamint olyan főemlős emlősökben, akiknél korábban volt kokainhasználat50, összhangban áll a D2 / 3 receptorok csökkent szabályozásával az emberi kokainfüggők agyában51,52. Ami a visszaélés elleni gyógyszereket illeti, kimutatták, hogy a szacharóz fokozza a DA D1 receptorok szabályozását19 és növeli a DA felszabadulását53, megerősítve a DA szerepét az ízletes ételekkel szembeni „vágyban”. A korábbi PET-vizsgálatok kimutatták, hogy a striatális DA D2 / 3 receptor elérhetőség csökken a morbid elhízásban az átlagtömeghez viszonyítva54,55, nagyságrendben hasonló a kábítószerfüggő betegek csökkenéséhez56, és az elhízás modelleivel rendelkező állatokban57. Rágcsálókon végzett vizsgálatokban a D2 / 3 receptor knockdown a striatumban elősegíti a patkányoknál kényszeres ételek kialakulását az ízletes ételekhez való hozzáféréssel57.
A sertés D2 / 3 receptor csökkenő elérhetőségével kapcsolatos megfigyeléseink megnövekedett DA szintet jelezhetnek a szacharóz bevitelével járó ösztönző kedvre reagálva, mivel a DA felszabadulása a visszaélés elleni gyógyszerek és más kellemes tevékenységek iránti igény részeként52,58,59,60. Mivel a sertéseket a képalkotás során érzéstelenítették és 24 órán belül nem kaptak szacharózt, a csökkent D2 / 3 BPND sokkal valószínűbben tükrözi a receptorok számának csökkenését a DA felszabadulásának megnövekedett növekedésére adott válaszként a szacharózhoz jutás 12 napjának mindegyikén. A csökkentés növeli az agyi jutalom küszöbértékeit, ami a striatális DA D2 receptorok alulszabályozásához kapcsolódik. Ez megmagyarázhatja a szacharózt túli patkányok korábbi vizsgálatokban tapasztalt fokozott érzékenységét a visszaélésekkel szemben, amelyek keresztirányú szenzibilizációhoz vezettek a kokainhoz, hiperaktivitás alacsony adag amfetamin után, megnövekedett alkoholfogyasztás, ha nem alkalmaznak szacharózt, és tolerancia az opiátok fájdalomcsillapító hatásaival szemben.6.
Az elhízás korábbi, a Göttingeni minipigben végzett tanulmánya az agyok egységes foton emissziós számításos tomográfiájával (SPECT) azonosította az agyi véráramlás csökkent mértékét a nucleus carrbens-ben, a ventrális tegmental területén (VTA) és a prefrontalis cortexben61. E megállapításokkal összhangban csökkentett DA D2 / 3 kötődést figyeltünk meg a nucleus akumulánokat tartalmazó ventroforebrain régióban és a prefrontalis kéregben. A szabadon mozgó patkányokon mikrotialízis alatt álló szacharóz bevétele után az extracelluláris DA szintje háromszorosára növekszik a nucleus activumban62. Szacharózfüggő állatokban az ismételt szacharózbevitel DA felszabadulást eredményezhet a nucleus akumulénok héjában63. A korlátozott étrendű, szacharózhoz korlátozottan táplált állatok alacsonyabb DA D2-receptorkötő képességgel rendelkeztek a nucleus carrbens héjában és a hátsó striatumban64. A korlátozott, magas zsírtartalmú és szacharóztartalmú étrend a D1 és D2 receptor mRNS tartós alulszabályozásához vezethet a nucleus accumbensben65. Az ízletes ételek mikrodialízis-tanulmánya felfedte a DA megnövekedett felszabadulását a nucleus accumbens-ben és a prefrontalis cortexben, amikor az ételt még mindig újnak tekintették; miután a patkányok megszokták az új táplálékot, a megnövekedett felszabadulás tompul a tompító magban, a prefrontalis kéregben azonban nem66. A szokásokhoz való eltérő hajlandóság és az aktivitás kondicionálása két régióban megmagyarázhatja a prefrontalis kéregben megfigyelt nagyobb növekedést, mint azokban a finom anyagoknak kitett minipigák magmaggyûjtõiben, amelyek tizenkét nap elteltével újdonságot veszítettek. Mivel azonban nem képeztünk minipiggeket a [11C] racloprid az első szacharóz-adagolás után, ez a magyarázat spekulatív.
A prefrontalis kéreg modulálja a végrehajtó funkciót, a döntéshozatalt és az önellenőrzést67. A prefrontalis cortex diszfunkcionális DA neurotranszmissziója rontja a jutalomfeldolgozás modulációját, ami arra utal, hogy az elhízott egyéneknél csökkent a végrehajtó funkció és a döntési képesség.68,69. Ezenkívül egy humán PET-vizsgálat korrelálta az elülső kéreg metabolizmusának csökkenését a striatális D2 kötődés csökkentésével az elhízásban70. Itt a D2 / 3 receptor csökkent elérhetőségét találjuk a prefrontalis kéregben, beleértve a szacharóz-kezeléssel kitett sertések orbitofrontalis kéregét is.
A VTA dopaminerg idegsejtjei előrejelzéseket küldenek a hippokampuszba és az amygdalaba, ahol támogatják a szokásos viselkedést71 és közvetíti a gyógyszerkészítmény előállításának kódolását és visszanyerését72,73 és ételjelzők74,75. Az emberi agy képalkotó vizsgálata hippokampusz aktiválást váltott ki az étkezésre való vágy és ízlés hatására76. Összhangban azzal a megállapítással, hogy a hippokampusz és az amygdalar D2 / 3 receptorok rendelkezésre állása csökkent a szacharózra adott válaszként, az emberi agy feltérképezése [18Az F] fallypride kokain dákó által kiváltott DA felszabadulást mutatott amygdalaban és hippokampuszban77. Rágcsáló agyban a kokain dákó expozíció DA felszabadulást váltott ki az amygdalaban78, és az amygdala DA szintjének változásai befolyásolták a cue-indukált kokain-kereső viselkedést79.
Az elhízott egyének vizsgálatában a D2 / 3 és a μOR elérhetőség közötti kapcsolat, amelyről ismert, hogy létezik a sovány egyének striatális régióiban, a ventrális striatumban80. Összehasonlítottuk a BP értékeitND a két nyomjelzőből, hogy teszteljék, vajon az adatok reprodukálják-e ezt a hatást. A sovány emberektől eltérően a sertések jelenlegi agyában nem volt korreláció a BP értékei közöttND a két jelölőanyagból a kiindulási helyzetben vagy a szacharóznak való kitettség után. Ezután megvizsgáltuk, hogy azokban az állatokban, amelyekben a tracer-racloprid-kötés a legkevésbé esik-e, a tracer-karfentanil-kötés szintén a legnagyobb mértékben csökken, ehelyett negatív korrelációt találtunk az átlagolt extrastriatális régiókban, arra utalva, hogy azok az állatok, amelyekben a A tracer raclopride a legalacsonyabb változást mutatta a trafcerfananil kötési potenciáljában. A változások közötti fordított kapcsolat azt sugallja, hogy a szacharóz bevitelének az adott receptorok elérhetőségére gyakorolt hatása ellentétes irányban van szabályozva. Ismeretes, hogy az ízletes ételek vagy drogok túlzott fogyasztását a vágy, szeretet, vagy mindkettő vezetheti be60,81. Lehetséges, hogy a dopamin által kiváltott vágy nagysága megsemmisíti az opioidok által kiváltott kedvelés mértékét, vagy fordítva. A legfrissebb bizonyítékok rámutattak a GABA szerepéreA receptorok a VTA-ban és a kolinerg terminálisok a striatumban és esetleg a cortexben, amelyek váltják a dopamin-függő és a dopamin-független opioid hatásmechanizmusokat82,83 ez magyarázhatja a dopamin és az opioid hatásainak viszonosságát az itt meghatározott sertés extrastriatális régiókban.
A PET hiánya, összehasonlítva a nagy állatokkal is, a tomográfia korlátozott térbeli felbontása, amely befolyásolja az ételekkel kapcsolatos viselkedésben részt vevő kicsi agyi régiók eredményeit. Ezen aggodalmak ellenére azonban [11A C] racloprid-kötődést korábban mind striatális, mind extrastriatális régiókban regisztrálták84,85,86,87. A ... haszna [11C] a racloprid ugyanazon típusú receptorok jelölésére nem vet fel aggodalmat a lehetséges affinitási különbségek miatt, amelyek befolyásolhatják ugyanazon receptorok különálló nyomjelzőinek alkalmazását a különböző régiókban. A legújabb tanulmányok a [11C] rakloprid. Alakurtti et al. jó megismételhetőséget találtak a striatális racloprid kötődési intézkedéseknek a striatumban, csak jó vagy közepes reprodukálhatósággal a cortexben85. Egy későbbi tanulmányban Svensson et al. megvitatták a [11C] racloprid mint az extrastriatális D2 / 3 receptorok markere egy egészséges ember vizsgálatában, ideértve a kéreg rossz reprodukálhatóságát és az elülső kéreg extrastriatális kötődésének korlátozott csökkenését egy D2 / 3 blokkoló szerre adott válaszként88. A teszt újravizsgálata során a striatumban 4–7%, a kérgi régióban pedig 13–59% variabilitást fedeztek fel, de a vizsgálatok közötti idő átlagosan 20 nap volt, ellentétben a legtöbb tanulmány informatív 1–2 napjával. Az alanyok életében számos tényezőnek volt ideje befolyásolni az eredményeket. Valójában itt megmutatjuk, hogy pusztán a szacharóz fogyasztása 12 napos reggeli rutinba történő beillesztése befolyásolhatja a két héttel később megkötött kötési intézkedéseket. Más olyan általános tényezők, mint a videojátékok, a vásárlás, az új romantikus kapcsolatok megkezdése és a szexuális aktivitás, a drogok használata vagy az étrend és a testmozgás megváltoztatása, befolyásolhatják az extrastriatális dopamin szintet, és nagymértékben változtathatják az adatkészleteket. A minipigisekkel végzett jelenlegi tanulmány egy jól kontrollált rendszert vezetett be, amelynek egyetlen változója a szacharóz hiánya vagy jelenléte az étrendben. Ebben az összefüggésben hét állat adatainak kellően alacsony variabilitása volt a releváns extrastriatális régiókban ahhoz, hogy a szacharózra adott válaszban a statisztikailag szignifikáns csökkenést lehessen azonosítani.
A jelenlegi vizsgálat korlátozása olyan érzéstelenítők használata, amelyek a mozgás közbeni mozgásmentesség biztosításához szükségesek in vivo állatok leképezése. A speciális érzéstelenítők hatása, valamint a gyógyszerekkel vagy más beavatkozásokkal való kölcsönhatásuk megzavarhatja a radioligandumok kötődését.89,90. A ketamin anti-glutamáterg gyógyszer, gyors antidepresszáns hatású al anesztézisekben91,92,93, amelyek nem csökkentik a striatást [11C] racloprid kötés emberben94. Megállapítást nyert azonban, hogy az S-ketamin csökkenti a dopamin D2 / 3 receptorok kötődési elérhetőségét tudatos nem főemlős állatok striatumában95. Az izoflurán általános érzéstelenítő az állati PET-ben. Korábbi vizsgálatokban a striatális felhalmozódást találtuk [11C] SCH23390, a dopamin D1 receptorok radioliganduma szignifikánsan magasabb az izofluránnal, mint a propofollal érzéstelenített minipigákban, ami arra utal, hogy a dopaminerg neurotranszmisszió érzékeny az érzéstelenítés hatására.96. A jelen tanulmányban az összes minipigát mindkét időpontban ketamin előkezelés és izoflurán érzéstelenítés alatt ábrázolták, így a jelen összehasonlítások érvényesek voltak.
Következtetés
Az ízletes ételek túlzott fogyasztása függőséget okozhat és annak következménye lehet, amely az elhízás közvetlen következményekkel jár az egészségre. Megvizsgáltuk azt az állítást, hogy az opioidok és a dopamin meditálják a jutalmakat, amelyek fontosak a túléléshez és a drogok visszaéléséhez. A szacharóz-oldathoz szakaszos hozzáféréssel rendelkező minipigák csökkent dopamin D12 / 2 és μ-opioid receptor-rendelkezésre állást mutattak a striatális és extrastriatális agyi régiókban, ami arra utal, hogy a szacharóztartalmú ételek hasonló módon befolyásolják az agyi jutalomáramlást, mint amit addiktív gyógyszereknél megfigyelték. fogyasztják. A szacharóz kezdeti egyszeri expozíciója megegyezett az opioid felszabadulással a jutalomban aktív agyi régiókban. Az opioidok és a dopamin elérhetőségének változásai magyarázzák a túlzottan fogyasztott szacharóz addiktív potenciálját.
Anyagok és módszerek
Állati etika
Ezt a tanulmányt a Dán Állatkísérleti Felügyelőség hagyta jóvá és szabályozta, és az összes kísérletet a tudományos célokra felhasznált állatok védelméről szóló 2010/63 / EU európai parlamenti és tanácsi irányelvnek és az ARRIVE iránymutatásoknak megfelelően végezték el. Hét tizennégy hónapos női Göttingeni minipigget használtunk (Ellegaard, Dalmose, Dánia). A minipigákat pellet táplálékkal táplálták (napi kétszer 6 dl, Special Diet Services, Aarhus, Dánia) rendelkezésre álló csapvízzel. ad libitum. A környezeti hőmérséklet 20–22 ° C, a relatív páratartalom 50–55%, a levegőt óránként nyolcszor cserélték.
Időszakos szacharózfogyasztás
Hét minigínt készítettünk a következőkkel:11C] raclopride és [11C] karfentanil a kiindulási helyzetben, és ismét egy nappal a szacharózvíz egymást követő 12 napja után. A szacharóz expozíció egy órás szacharóz (szacharóz, Dansukker, Koppenhága, Dánia) vízhozzáféréséből állt (500 gramm szacharóz 2 liter vízben) naponta 12 napos időszak alatt. Feljegyeztük a szacharóz bevitelének mennyiségét, és minden minipig-ot naponta 2 literre fogyasztottunk. Ugyanezen minipigákat öt is felvettünk a következőkkel:11C] karfentanil, az első szacharóz-hozzáférés után 30 perccel az akut opioid-felszabadulás tanulmányozása céljából.
A minicsírák átlagosan 13.6% testtömeget kaptak a kiindulási 25.4 kg-ról (± 0.73 SEM) 28.9 kg-ra (± 0.69 SEM) a 12 napos szacharóz-expozíció után, ami szignifikánsan magasabb volt (egyfarkú t-teszt, p < 0.001), mint a korábbi vizsgálatokban kapott kontroll minipigák mintájában megfigyelt növekedés, ahol a súlyok átlagosan csak 4.9% -kal nőttek ugyanabban a fejlődési időszakban.
Agy PET képalkotó
A sertéseket egy éjszakán át éheztettük, a víz felvétele előtt a képalkotás előtt. Előzetes gyógyszeres kezelést és érzéstelenítést végeztünk a korábban leírtak szerint97 lefektetve őket PET / CT készülékbe (Siemens Biograph 64 Truepoint PET). Minden egyes PET beszerzés előtt alacsony dózisú CT-vizsgálatot végeztünk a PET-kibocsátási adatok anatómiai meghatározása és csillapításának korrekciója céljából. Intravénásan adtunk be [11C] racloprid a kiindulási helyzetben (360 ± 18 MBq, fajlagos aktivitás 77 ± 76 GBq / μmol, befecskendezett tömeg 0.12 ± 0.08 μg / kg) és 12 napos szacharóz után (374 ± 54 MBq, fajlagos aktivitás 127 ± 85 GBq / μmol, injektált tömeg: 0.06 ± 0.05 μg / kg), és [11C] karfentanil a kiinduláskor (377 ± 43 MBq, fajlagos aktivitás 311 ± 195 GBq / μmol, befecskendezett tömeg 0.03 ± 0.02 μg / kg) és 12 napos szacharóz után (337 ± 71 MBq, fajlagos aktivitás 177 ± 157 GBq / μmol, injektált tömeg: 0.06 ± 0.08 μg / kg) fülvénán keresztül, 10 ml fiziológiás sóoldatban, a 90 perces vizsgálat első percében. A PET-adatokat rekonstruáltuk TrueX 3D OSEM (3 iteráció, 21 részhalmaz), 256 × 256 × 109 mátrix és 2 mm-es Gauss szűrő felhasználásával, 5 × 60, 3 × 300, 4 × 600 időkeret-struktúrával. , 2 × 900 másodperc (összesen 14 képkocka, 90 perc). A kiindulási állapotban és 12 napos szacharóz után a minipigákat mindkét nyomjelzővel legalább 100 perces intervallumban injektálták, a [11C] PET nyomjelzők. Az utolsó PET-munkamenet befejezése után mély érzéstelenítés alatt a minipigákat eutanizáltuk a pentobarbitál intravénás túladagolásával (100 mg / kg).
Mennyiségi elemzések és statisztikák
Az előfeldolgozási lépéseket a PMOD 3.7 alkalmazásával végeztük (PMOD Technologies Ltd, Zürich, Svájc). A sztereotaktikus transzformációs paraméterek meghatározásához az idő átlagolt PET képek alapján ligandusspecifikus sablonokat használtunk. A generált transzformációs mátrixokat és deformációs mezőket alkalmaztuk a megfelelő dinamikus PET-idősorokra. Generáltuk a következő paraméterképeket:11C] racloprid kötési potenciál (BPND) az Ichise és munkatársai multilineáris referenciaszövet módszerével98. Kialakítottuk a kisagy testreszabott maszkját, amely kizárta a vermust, hogy az agyi szövet radioaktivitása idővel elhanyagolható legyen a DA D2 / 3 receptor sűrűségű régióban. Generáltuk a következő paraméterképeket:11C] karfentanil a Logan referenciaszövet modell megvalósításával99,100 t * = 30 percig. Tanulmányai11C] A karfentanil kötődése az emberi agyban az okklitális kéreg mint referencia régió36; a sertésben azonban az időaktivitási görbék szerint a nem kicserélhető kötődés alacsonyabb volt a kisagyban, mint az okkipitalis kéregben, összhangban egy patkány autoradiográfiás vizsgálat eredményeivel101. Ezért a kisagyt választottuk referencia-régióként a jelen vizsgálatban.
Statisztikai analízis
A térképeket voxel szempontból elemeztük statisztikai nem paraméteres leképezéssel (SnPM v13.01, http://warwick.ac.uk/snpm) SPM eszközkészlet, amely a nem paraméteres permutációs elméletet használja fel a statisztikai következtetések kereteinek létrehozására; ez a megközelítés jól működik a kis minták esetében a hamis pozitív eredmények szigorú ellenőrzése miatt14 és alkalmazzuk a korábban leírtak szerint102. A sertés neuroanatómiájának szakértője (DO) összehasonlította a kapott képeket 5% -os szignifikancia szintre nagyfelbontású Göttingeni minipig-atlaszhoz103,104 a csökkent DA D2 / 3 és μOR BP régiók meghatározása és címkézéseND az alapvonaltól a poszacharóz állapotig. Ezután elvégeztük az érdeklődésre számot tartó régió (ROI) elemzést a BP kinyerése céljábólND az SnPM elemzés alapján érdekesnek talált azon régiók értékei, ideértve a striatumot, a nucleus akumbens-t, a talamust, az amygdala-t, a cingulate cortex-et és a prefrontal cortex-t. A ROI elemzéssel nem végeztek további statisztikákat, mivel ezeknek a régióknak az SnPM használatával már jelentősnek bizonyultak.
Referenciák
- 1.
Smyth, S. & Heron, A. Cukorbetegség és elhízás: az ikerjárványok. Nat Med 12, 75–80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Az elhízás prevalenciája és tendenciái az amerikai felnőttek körében, 1999–2008. JAMA 303, 235–241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, Kalifornia et al. Dopamin a „vágyókhoz” és az opioidok a „kedveléshez”: az elhízott felnőttek összehasonlítása étkezési evvel vagy anélkül. Elhízás (ezüst tavasz) 17, 1220–1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Elhízás és az élelmiszerkörnyezet: az étkezési energia sűrűsége és az étkezési költségek. A megelőző orvoslás amerikai folyóirat 27, 154–162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Az intenzív édesség meghaladja a kokain jutalmat. PLoS One 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. Idegtudomány a 21. században (szerk. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Az élelmiszer és a függőség neurobiológiájának további fejleményei: a tudomány állapotának frissítése. Táplálás 28, 341–343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Az agy élvezetei (szerk. Kringelbach, ML és Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ és Bullmore, ET Az ízhedonikától a motivációs indíttatásig: központi mu-opioid receptorok és falatozó viselkedés. Int. Neuropsychopharmacol 12, 995–1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Élelmiszer-jutalom: a vágy és szeretet agyi szubsztrátjai. Idegtudomány és biológiai viselkedés áttekintés 20, 1 – 25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. A neuroreceptorok feltérképezése a munkában: a kötődési potenciálok meghatározásáról és értelmezéséről 20 év előrehaladás után. Int Rev Neurobiol 63, 1–20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG A cukor- és zsírfogyasztás állatmodelljei: kapcsolat az ételfüggőséggel és a megnövekedett testtömeggel. Módszerek Mol Biol 829, 351–365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. A prefrontalis kéreg a Gottingen minipig agyában neurális vetítési kritériumok és citoarhitektúra alapján. Brain Res Bull 70, 322–336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE és Holmes, AP Nem paraméteres permutációs tesztek a funkcionális idegképalkotáshoz: primer példákkal. Hum Brain Mapp 15, 1 – 25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG A cukorfüggőség bizonyítékai: időszakos, túlzott cukorbevitel viselkedési és neurokémiai hatásai. Idegtudomány és biológiai viselkedés áttekintés 32, 20–39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Élelmezési jutalom rendszer: jelenlegi kilátások és jövőbeli kutatási igények. Nutr Rev 73, 296–307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. szacharóz önadagolás és központi idegrendszeri aktiváció patkányban. Am. J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. A cukor hedonikus és táplálkozási értékeit külön áramkörök kódolják. A természet idegtudománya 19, 465–470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. A túlzott cukorbevitel megváltoztatja az agy dopamin és mu-opioid receptorokhoz való kötődését. Neuroreport 12, 3549 – 3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiát receptor: autoradiográfiai lokalizáció patkány agyban. Proc Natl Acad Sci USA 73, 3729 – 3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Kokain jutalom és hiperaktivitás patkányokban: a mu opioid receptor moduláció helyei. Neuroscience 154, 1506–1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC A béta-funaltrexamin befolyásolja a kokain önadagolását patkányokban, amelyek a megerősítés progresszív arányú ütemtervére reagálnak. Farmakológia, biokémia és viselkedés 75, 301 – 307 (2003).
- 23.
Schroeder, JA et al. A mu opioid receptorok szerepe a kokain által kiváltott aktivitásban, szenzibilizációban és jutalomban patkányokban. Psychopharmacology 195, 265–272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW A kokain által kiváltott helyreállítás a mu-opioid receptorok endogén stimulálását igényli a ventrális pallidumban. Az idegtudomány folyóirat: az Idegtudományi Társaság hivatalos folyóirata 25, 4512–4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. Az etetés felszabadítja az endogén opioidokat az emberekben. J Neurosci 37, 8284–8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS és Berridge, KC Opioid limbikus áramkör a jutalomért: kölcsönhatás a nucleus accumbens és a ventrális pallidum hedonikus hotspotjai között. J Neurosci 27, 1594–1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC A nucleus accumbens héjában található opioid helyek közvetítik az étkezést és a táplálkozás hedonikus „tetszését”: a Fos mikroinjekción alapuló térkép. Brain Res 863, 71 – 86 (2000).
- 28.
Zhang, M. & Kelley, AE A szacharin-, só- és etanol-oldatok bevitelét megnöveli egy mu opioid agonista infúziója a nucleus accumbens-be. Psychopharmacology 159, 415–423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA és Kelley, AE A magas zsírtartalmú ételek bevitelét szelektíven fokozza a mu opioid receptor stimuláció a nucleus accumbens-ben. A farmakológiai és kísérleti terápiák lapja 285, 908 – 914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ A naloxon blokkolja az édes íz által vezérelt táplálkozás azon részét, amelynek élelmezésében korlátozott patkányok vannak. Am J Physiol 268, R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioidok és táplálékbevitel: elosztott funkcionális idegpályák? neuropeptidek 33, 360–368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Az opioid antagonista, a naltrexon, csökkenti az emberekben a szacharóz preferenciáját. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS A naltrexon hatása az ízfelismerési és felismerési küszöbre. Étvágy 32, 241–249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA A Naloxone, egy opiát blokkoló, csökkenti az édes, magas zsírtartalmú ételek fogyasztását elhízott és sovány női fogyasztóknál. Am J Clin Nutr 61, 1206 – 1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Különböző opioid áramkörök határozzák meg a jutalmazó események ízét és kívánatosságát. Proc Natl Acad Sci USA 106, 12512–12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Endogén opioid-felszabadulás az emberi agy jutalmazási rendszerében, akut amfetamin beadás által indukálva. Biol Psychiatry 72, 371–377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, én. et al. Az amfetamin indukálta az emberi agyban az endogén opioid-felszabadulást [11C] karfentanil PET-sel kimutatva: replikáció független kohortban. Int. Neuropsychopharmacol, 1–6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW opioid peptidek és az emberi lenyelés viselkedésének ellenőrzése. Idegtudomány és biológiai viselkedés áttekintés 26, 713 – 728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Mitől lehet tanulni in vivo opioidergikus agyi képalkotás? Eur J Fájdalom 9, 117–121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM és Cuntapay, M. Dopamin-opioid kölcsönhatások a patkány striatumában: a dopamin D1 receptorok moduláló szerepe a delta opioid receptor által közvetített szignál transzdukcióban. Neuropharmacology 39, 372 – 381 (2000).
- 41.
Bencherif, B. et al. A regionális mu-opioid receptorok kötődése az izolált kéregben csökken a bulimia nervosa esetében, és fordítva korrelál az éhgyomri viselkedéssel. A nukleáris orvoslás folyóirata: hivatalos kiadvány, Nukleáris Medicina Társaság 46, 1349 – 1351 (2005).
- 42.
Karlsson, HK et al. Az elhízás a mu-opioid csökkent, de változatlan dopamin D2-receptor hozzáférhetőségével jár az agyban. J Neurosci 35, 3959–3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. A bariatric műtét utáni fogyás normalizálja az agy opioid receptorjait morbid elhízásban. Mol Psychiatry 21, 1057–1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK endogén opioid mechanizmusai az emberek elhízásában és fogyásában jelentkeznek. J Clin Endocrinol Metab 100, 3193–3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Dopamin és opioid neurotranszmisszió viselkedési függőségekben: összehasonlító PET-vizsgálat patológiás szerencsejátékokkal és zsíros étkezésekkel kapcsolatban. Neuropsychop 42, 1169–1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM A krónikus, magas zsírtartalmú étrend a mu-opioid receptor postnatalis epigenetikus szabályozását hajtja végre az agyban. Neuropsychopharmacology: a Neuropsychopharmacology American College hivatalos kiadványa 36, 1199–1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Hyperphagia és szénhidrát bevitel indukálása mu-opioid receptor stimulációval a frontális kéreg körülírt régióiban. Az idegtudomány folyóirat: az Idegtudományi Társaság hivatalos folyóirata 31, 3249–3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. A krónikus kokain csillapítja a dopamin szignalizációt a kokain mérgezés során és egyensúlyhiányt okoz a D1 felett a D2 receptor szignálozással. Az idegtudomány folyóirat: az Idegtudományi Társaság hivatalos folyóirata 33, 15827–15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Az akut nikotin hatása a hemodinamikára és a [11C] racloprid kötődése a sertés agyában a dopamin D2,3 receptorokhoz. NeuroImage 19, 1127 – 1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP A kokain önadagolásának hatása a rhesus majmok dopamin D2 receptoraira. Szinapszis 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. A kokain dátuma és a dopamin a hátsó striatumban: a kokainfüggőség vágyának mechanizmusa. Az idegtudomány folyóirat: az Idegtudományi Társaság hivatalos folyóirata 26, 6583–6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. A dopaminreceptorok fokozott kihasználtsága az emberi striatumban dákó által kiváltott kokain-vágy során. Neuropsychop 31, 2716–2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP és Norgren, R. Az orális szacharózstimuláció növeli az akumbének dopaminját patkányban. Am. J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. A dopamin szerepének feltérképezése a kábítószerrel való visszaélésben és a függőségben. Neuropharmacology 56(1. készlet), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Agyi dopamin és elhízás. Gerely 357, 354 – 357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Az elhízás és a kábítószer-függőség közötti hasonlóság neurofunkcionális képalkotással értékelve: koncepció áttekintése. Függőleges betegségek naplója 23, 39–53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM és Kenny, PJ Dopamine D2 receptorok elhízott patkányok függőség-szerű jutalomzavarában és kényszeres étkezésében. A természet idegtudománya 13, 635–641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC és Kringelbach, ML Az öröm affektív idegtudománya: jutalom emberekben és állatokban. Psychopharmacology 199, 457–480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC és Kringelbach, ML Örömrendszerek az agyban. Neuron 86, 646–664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. A dopamin neuronok prediktív jutalomjele. J Neurophysiol 80, 1–27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Az agyi aktivitás változásai diéta okozta elhízás után. Elhízottság 19, 749–756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens dopaminmechanizmusai a szacharózbevitelben. Brain Res 904, 76 – 84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG A cukorral való mindennapos fogyasztás során ismételten dopamin szabadul fel az accumbens héjában. Neuroscience 134, 737–744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Ismételt szacharóz hozzáférés befolyásolja a dopamin D2 receptor sűrűségét a striatumban. Neuroreport 13, 1575 – 1578 (2002).
- 65.
Alsio, J. et al. A dopamin D1 receptor gén expressziója csökken a magzatban az ízletes ételek hosszú távú kitettsége esetén, és különbözik az étrend által kiváltott elhízás fenotípusától patkányokban. Neuroscience 171, 779–787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Az asszociatív és a nem asszociatív tanulási mechanizmusok differenciális hatása a prefrontális és accumbális dopamin-transzmisszió élelmiszer-ingerekre való reakciójára ad libitum táplált patkányokban. J Neurosci 17, 851 – 861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Kiegyensúlyozatlan idegsejtek az addikcióban. Curr Opin Neurobiol 23, 639–648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, bulimia és elhízás: megosztott döntéshozatali hiányosságok az Iowai Szerencsejáték Feladaton (IGT). J Int Neuropsychol Soc 16, 711–715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Döntéshozatali hiányok és túlfogyasztás: az elhízás kockázati modellje. Obes Res 12, 929–935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Az alacsony dopamin-striatális D2 receptorok elhízott egyének prefrontalis metabolizmusával járnak: lehetséges hozzájáruló tényezők. NeuroImage 42, 1537–1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, ÉNy & Balleine, BW Az Amygdala központi mag kölcsönhatásban van a dorsolateralis striatummal a szokások elsajátításának szabályozása érdekében. J Neurosci 32, 1073–1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al. A memória áramkörök aktiválása dákó által kiváltott kokain vágy során. Proc Natl Acad Sci USA 93, 12040 – 12045 (1996).
- 73.
Childress, AR et al. Limbikus aktiválás dákó által kiváltott kokain-vágy során. J J Pszichiátria 156, 11–18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV és Berridge, KC Mit és mikor kell „akarni”? Az ösztönző figyelem amygdala-alapú összpontosítása a cukorra és a szexre. Psychopharmacology 221, 407–426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF és Volkow, ND A szenvedélybetegség neurobiológiája: neurocircuitry analízis. Lancet pszichiátria 3, 760–773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Kortikális aktiváció a tiszta íz-ingerekre adott válaszként az éhség és a jóllakottság fiziológiai állapotaiban. NeuroImage 44, 1008–1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotos, A. et al. A kokain dákinnal kiváltott dopamin felszabadulása amygdalaban és hippokampuszban: nagy felbontású PET [(1) (8) F] fallypride vizsgálat kokainfüggő résztvevőkben. Neuropsychop 38, 1780–1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. A kokainkereső viselkedés ellenőrzése patkányokon keresztül a kábítószerrel összefüggő ingerekkel: az eloltott operáns-válaszreakció és az extracelluláris dopamin szint helyreállításának hatása az amygdalaban és a nucleus akumbensben. Proc Natl Acad Sci USA 97, 4321 – 4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamine D1 vagy D2 receptor antagonizmus a bazolaterális amygdalában eltérő módon változtatja meg a kokain-cue asszociációk megszerzését, amelyek szükségesek a kokainkeresés visszaindításához. Neuroscience 137, 699–706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Aberráns mezolimbikus dopamin-opiát kölcsönhatás az elhízásban. NeuroImage 122, 80–86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Viselkedési dopamin jelek. Trendek Neurosci 30, 203–210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR és van der Kooy, D. Az opiát-motiváció neurobiológiája. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. és Ford, CP a striatális dopamin D2-receptor által közvetített átvitel nikotin- és opioidreceptor-szabályozása. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. A dopamin D2 / 3 receptor elérhetőségének korfüggő csökkenése [C-11] raclopriddel mérve nem striatális emberi agyi régiókban: Négy módszer összehasonlítása. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. A striatális és extrastriatalia dopamin D2 / 3 receptorok kötődésének hosszú távú tesztelési megbízhatósága: tanulmány [(11) C] raclopriddel és nagy felbontású PET-rel. J Cereb véráramlási metab 35, 1199–1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ endogén dopamin felszabadulás a Parkinson-kór farmakológiai kihívásai után. Ann Neurol 53, 647–653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Kognitív hiány és striato-frontális dopamin felszabadulás Parkinson-kórban. Agy 131, 1294–1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Az extrastriatális [(11) C] racloprid-kötő mennyiségi meghatározás érvényessége és megbízhatósága az élő emberi agyban. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. Az izoflurán érzéstelenítés fokozza a kokain és a GBR12909 gátló hatásait a dopamin transzporterre: PET-vizsgálatok mikrodialízissel kombinálva a majom agyában. Brain Res 849, 85 – 96 (1999).
- 90.
Hassoun, W. et al. A [11C] racloprid-kötés PET-vizsgálata az ébren lévő macska sztriatumában: az érzéstelenítők hatásai és az agyi véráramlás szerepe. Európai nukleáris orvoslás és molekuláris képalkotó folyóirat 30, 141–148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. A ketamin szerepe a kezelés-rezisztens depresszióban: szisztematikus felülvizsgálat. Neuropharmacol Curr 12, 444–461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. A ketamin antidepresszáns hatásai depressziós betegekben. Biol Psychiatry 47, 351 – 354 (2000).
- 93.
Browne, CA és Lucki, I. A ketamin antidepresszáns hatásai: a gyors hatású új antidepresszánsok hátterében álló mechanizmusok. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. A ketamin nem csökkenti az ember striatális dopamin D2 receptor kötődését. Psychopharmacology 164, 401–406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. A dopamin D2 / 3 receptor kötődésének csökkentése a striatumban az esketamin egyszeri beadása után, de az R-ketamin nem: PET tanulmányozás tudatos majmokban. Eur Arch Pszichiátriai Clin Neurosci 267, 173–176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al. Az érzéstelenítés és a fajok hatása a radioligandumok felvételére vagy megkötésére in vivo a Gottingen minipigben. BioMed kutatás nemzetközi 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. A minipigák krónikus proteaszóma gátlásának longitudinális monoaminerg PET-leképezése. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Stratégiák a neuroreceptor paraméterek becslésének javítására lineáris regressziós analízissel. J Cereb véráramlási metab 22, 1271–1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Eloszlási térfogatarányok vérvétel nélkül, a PET-adatok grafikus elemzéséből. J Cereb véráramlási metab 16, 834–840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Az agyi mu-opioid receptorok mennyiségi meghatározása [11C] karfentanillal: referencia-szöveti módszerek. Nucl Med Biol 30, 177 – 186 (2003).
- 101.
Panksepp, J. & Bishop, P. A (3H) diprenorfin kötésének autoradiográfiai térképe patkányagyban: a társadalmi interakció hatásai. Brain Res Bull 7, 405 – 410 (1981).
- 102.
Landau, AM et al. Az elektrokonvulzív stimuláció differenciáltan befolyásolja az [(11) C] MDL100,907 kötődését a sertés agyában lévő kortikális és szubkortikális 5HT2A receptorokhoz. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH és Palomero-Gallagher, N. Agy szerkezete Funct 222, 2093–2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR A Gottingen minipig agy online szövettani atlasza. heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Köszönetnyilvánítás
A tanulmányt az AML egyik Aarhusi Egyetem által nyújtott „AU Ideas Project Development Grant” adta. Hálásak vagyunk az Aarhusi Egyetemi Kórház PET munkatársainak és az Aarhusi Egyetemi Tanszék munkatársainak az állatok kezelésével kapcsolatos technikai segítségéért. Köszönjük Morten Kringelbach professzornak, Jørgen Scheel-Kruger professzornak és Arne Møller egyetemi docensnek a segítségét e tanulmányok elindításában.
Etikai nyilatkozatok
Érdekütközés
A szerzők nem jelentenek versengő érdekeket.
További információ
A kiadó megjegyzése A Springer Nature semleges marad a közzétett térképek és intézményi kapcsolatok joghatósági igényeivel kapcsolatban.
Jogok és engedélyek
Open Access Ez a cikk a Creative Commons Attribution 4.0 Nemzetközi Licenc alapján kerül licencre, amely engedélyezi a felhasználást, megosztást, adaptálást, terjesztést és reprodukciót bármilyen médiumban vagy formátumban, feltéve, hogy megfelelő hitelt ad az eredeti szerző (k) nek és a forrásnak, linket a Creative Commons licencre, és jelezze, hogy történt-e változás. A cikk képeit vagy más, harmadik féltől származó anyagokat tartalmaz a cikk Creative Commons licence, hacsak az anyag hitelkerete másként nem rendelkezik. Ha az anyag nem szerepel a cikk Creative Commons licencében, és a rendeltetésszerű használatát törvényi előírások nem engedélyezik, vagy ha meghaladja az engedélyezett felhasználást, akkor közvetlenül a szerzői jog tulajdonosától kell engedélyt szereznie. A licenc másolatának megtekintéséhez keresse fel a következő webhelyet: http://creativecommons.org/licenses/by/4.0/.