Proc Natl Acad Sci US A. Jan 19, 2010; 107 (3): 1217 – 1222.
Megjelent online Dec 29, 2009. doi: 10.1073 / pnas.0911998107
PMCID: PMC2824263
Neuroscience
Yan Liu,a,b Brandon J. Aragona,c Kimberly A. Young,a,b David M. Dietz,b,d,e Mohamed Kabbaj,b,d Michelle Mazei-Robison,e Eric J. Nestler,e és a Zuoxin Wanga,b,1
Ez a cikk már idézett egyéb cikkek a PMC-ben.
Absztrakt
A préri vole (Microtus ochrogaster) egy társadalmilag monogamikus rágcsálófaj, amely párosítás után párkötést képez, olyan magatartás, amelyben a központi dopamin (DA) érintett. Itt a férfiak préri köpenyeit használtuk, hogy megvizsgáljuk a kábítószer-expozíció hatását a páros kötésre és a kapcsolódó neurális áramkörre. Első kísérletünkben az amfetamin (AMPH) motivált viselkedését egy feltételezett hely preferencia (CPP) paradigmával vizsgáltuk, és azt mutatták, hogy a D1-szerű DA receptorok aktiválása közvetíti. Ezután megvizsgáltuk az ismételt AMPH expozíció hatását a páros kötésre. Az intakt és sóoldattal kezelt kontroll férfiak párosítással indított partner preferenciákat mutattak, míg az AMPH-val előkezelt, a CPP-t kiváltó dózisokban előforduló férfiak nem mutattak párosodást okozó partner preferenciákat. Az ilyen AMPH-kezelés szintén fokozta a D1-et, de nem D2-et, DA-receptor expressziót a nukleáris accumbensben (NAcc). Továbbá a D1-szerű DA receptorok farmakológiai blokádja az NAcc-ben megmentette a párosodást okozó partner preferenciákat az AMPH-val kezelt férfiaknál. Adataink együttesen azt mutatják, hogy az ismételt AMPH expozíció az NAcc-ben egy DA receptor-specifikus mechanizmus révén szűkítheti a férfi prérikus völgyek viselkedési repertoárját, ami a pár kötésképződés károsodásához vezet.
Széles körben elfogadott, hogy a testmozgást elősegítő motivált és érzelmi viselkedést az agyi jutalmak szabályozzák, beleértve a mesolimbikus dopamin (DA) rendszert is.1, 2). Bár ez a rendszer gyakran kapcsolódik az étkezéshez és a szexuális viselkedéshez (3, 4) más természetesen előforduló motivált viselkedésekben is szerepet játszottak, mint például a fiatalkorúak közötti társadalmi játék és a szülő és az utódok közötti társadalmi kötés (5-9). Gyakran alulreprezentáltak a kutatásban a felnőtt társok, azaz a párkötések közötti társadalmi kötések. A közelmúltban végzett vizsgálat egy társadalmilag monogámos rágcsálófaj, a prériMicrotus ochrogaster) (10-12) azt mutatják, hogy a páros kötés kialakulásának és fenntartásának a neurális szabályozása nagy része a magmagban (NAcc) (13-15) —Mesolimbikus agyi régió, amely kritikus a motivált viselkedések közvetítésében (1, 2, 16).
Bár a motivációs áramkör úgy alakult, hogy elősegítse a fitnesz-javító magatartást, mint például a táplálkozás, a párzás és a társadalmi kötés (1, 17), ez sérülékeny a kábítószerrel való visszaélés mesterséges \ t8). Például a pszichostimuláns gyógyszerek, például a kokain és az amfetamin (AMPH) alkalmazása a mesolimbikus DA-aktivitás tartós megváltozását eredményezi (18, 19). Javasolták, hogy ezen és más addiktív gyógyszerek ezen áramkörre gyakorolt intenzív hatása csökkentsék a természetes ösztönzők észlelt értékét (20), beleértve a szociális természetűeket is.8). Bár ismert, hogy a kábítószer-függők rontott társadalmi viselkedést mutatnak (21) a kábítószer-tapasztalat és a társadalmi kötődés közötti kölcsönhatások idegi szabályozása rosszul érthető. Ez azért van így, mert az ilyen kölcsönhatásokat részben nehéz modellezni a hagyományos laboratóriumi rágcsálókban, amelyek nem mutatnak társas kötődést a felnőtt konspektusok között.
Az ilyen társadalmi kötődés neurobiológiáját, különösen a felnőttek közötti párosodást, a préri vole-ban széles körben tanulmányozták (10-12), és ez a faj a közelmúltban életképes modellnek bizonyult az AMPH motivációs értékének vizsgálatára (22). Ezenkívül a páros kötés kialakulását és az AMPH megerősítését legalább részben a DA-átvitel az NAcc-en belül közvetíti (14, 15, 23). Ezért a jelen tanulmány a préri vole modellt használta fel a viselkedési vizsgálat megállapítására, hogy megvizsgálja a kábítószer-expozíciónak a társadalmi kötődésre gyakorolt hatásait, és a NAcc DA jelzőrendszerre összpontosított, hogy feltárja az ezen viselkedési hatások mögött álló neurális mechanizmust.
Eredmények
Az AMPH által indukált kondicionált hely preferenciát (CPP) a DA közvetíti a Receptor-specifikus eszközben.
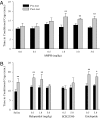
A CPP kialakulását az AMPH-párosított ketrecben töltött idő jelentős növekedése határozta meg a posttest alatt, az AMPH kondicionálás 3 napja után, az elővizsgálathoz viszonyítva. Sem a fiziológiás sóoldat, sem a sóoldat, amely az AMPH két legalacsonyabb dózisát (0.1 és 0.5 mg / kg) tartalmazta, megváltoztatta a ketrec-preferenciákat (Ábra 1A). Azonban az AMPH nagyobb dózisával kondicionált férfiak, beleértve az 1.0-et (t = 2.87, P <0.01), 3.0 (t = 3.63, P <0.01) vagy 5.0 mg / kg (t = 3.03, P <0.01), megjelenített CPP (Ábra 1A).
Mivel az AMPH szignifikánsan növeli a DA neurotranszmissziót a préri-völgyekben (24), és a DA közvetíti az AMPH megerősítését más fajokban (23), ezt követően megvizsgáltuk az DAPH receptor (DAR) szabályozását az AMPH által indukált CPP-ben a férfi prérákban. Az alanyokat a CPP-paradigmában vizsgálták, sóoldattal vagy sóoldattal kezeltük, amely az AMPH (1.0 mg / kg) injekciókat megelőzően a nem szelektív DAR-antagonista (haloperidol) különböző dózisait tartalmazza, és ezt követően tesztelték a CPP-t posttestben. Sóoldattal kezelt személyek (t = 2.69, P <0.01) vagy sóoldat, amely a haloperidol két legalacsonyabb dózisát (0.1 mg / kg; t = 3.62, P <0.01; 1.0 mg / kg; t = 3.89, P <0.01) az AMPH kondicionálás előtt az AMPH által indukált CPP volt látható, míg az 5.0 mg / kg haloperidol blokkolta az AMPH által indukált CPP-t, ami megmutatta a DAR-ok szerepét az AMPH viselkedési hatásaiban (Ábra 1B). Annak meghatározására, hogy melyik DAR altípus közvetíti az AMPH által indukált CPP-t, az AMPH injekciókat a kondicionálás előtt azután adtuk meg D1-szerű specifikus antagonistát (SCH23390) vagy egy D2-szerű specifikus antagonistát (eticlopride). A D2-szerű antagonizmus nem blokkolta az AMPH által indukált CPP-t (t = 3.15, P <0.01 0.5 mg / kg esetén és t = 2.60, P <0.05 5.0 mg / kg etiklopridhoz), de a D1-szerű receptorok blokkolása megszüntette az AMPH-indukálta CPP-t (Ábra 1B), amely bizonyítja, hogy az AMPH által indukált CPP-t a D1-szerű, de nem D2-szerű receptorok közvetítése közvetíti a férfi prérákban.
AMPH Tapasztalat A párosítás által indukált partner preferenciák kialakítását.
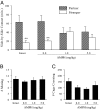
Bár az AMPH által indukált CPP a D1-szerű receptorok aktiválását igényelte (Ábra 1B), korábban kimutattuk, hogy a D1-szerű receptorok aktiválása megakadályozza a párosodás által kiváltott párkötésképződést (14). Ezért feltételeztük, hogy az AMPH előkezelés megzavarja a párosodás által kiváltott páros kötést a hím préri köpenyekben. A hímeket négy csoportra osztották, amelyek nem kaptak injekciót (sértetlen), sóoldat injekciót vagy 1.0 vagy 5.0 mg / kg AMPH injekciót 3 napokra (elegendő injekciós paradigma a CPP indukálásához). A negyedik napon minden férfit párosítottak egy szexuálisan fogadó nővel az 24 h-hez, majd a partner preferenciáit tesztelték. A korábbi vizsgálatokkal összhangban (14, 25-27), intakt férfiak és férfiak, akik sóoldat injekciót kaptak 3 napokra a párzást megelőzően, párosodást okozó partner preferenciákat (intakt férfiak; t = 3.05, P <0.01, sóoldattal injektált hímek; t = 3.21, P <0.01; Ábra 2A). Azonban a férfiak, akiket az AMPH egyik dózisával előkezeltek 3 nappal a párzás előtt, nem mutatott partner preferenciákat (Ábra 2A). Fontos, hogy az AMPH előkezelés nem befolyásolta a párosodási gyakoriságot az együttélési időszak alatt (F(3, 26) = 0.26, P = 0.85; Ábra 2B) vagy mozgásszervi aktivitás a partner preferencia teszt során (\ tF(3, 26)= 2.34, P = 0.10; Ábra 2C), jelezve, hogy az AMPH közvetlenül befolyásolta a párosodás által indukált partner preferenciákat.
Az AMPH tapasztalat növeli a D1 receptorokat az NAcc-ben.
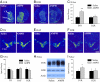
Tekintettel arra, hogy az AMPH előzetes expozíciója csökkentette a partner preferenciákat és mind az AMPH által indukált CPP-t (lásd fent), mind a páros kötést (14) a NAcc DA szabályozza, feltételeztük, hogy az AMPH jelentősen megváltoztatja a mesolimbikus DA áramköröket a férfi préri köpenyekben. A fent említett viselkedési kísérletben résztvevők alanyait feldolgoztuk DA marker mRNS-ek in situ jelölésére. Az AMPH-val kezelt férfiak (1.0 mg / kg) szignifikáns növekedést mutattak a D1 receptorban (D1R; t = 3.06, P <0.01), de nem a D2 receptor (D2R), az mRNS jelölése az NAcc-n belül, összehasonlítva a sós előkezelésben részesülő férfiakkal (Ábra 3 A-C). A tirozin-hidroxiláz (TH), a DA transzporter (DAT) vagy a D2R-ek mRNS-jelölésének sűrűségében azonban nem találtunk csoportbeli különbséget a ventralis tegmentalis területen (VTA) - az agy régiójában, amely az NAcc-hez elsődleges dopaminerg inputot biztosít (Ábra 3 D-G). A D1R-ek fokozott expresszióját a NAcc-ben tovább erősítették Western blottal (t = 1.90, P <0.05; Ábra 3 H és a I). Ezek az adatok együttesen azt mutatják, hogy az AMPH-expozíció a férfiak préri köpenyeinek mezolimbikus DA-rendszerében receptor- és helyspecifikus hatást fejt ki - növelve a D1R szintjét az NAcc-ben.
D1 Receptorok az NAcc-ben Közreműködnek a partner preferenciák AMPH értékvesztésében.
Korábban kimutattuk, hogy a férfi prérákban a D1R aktiválása az NAcc-ben megakadályozta a partner preferenciák kialakulását (14), és a jelenlegi tanulmány azt mutatja, hogy az AMPH expozíció szabályozza a D1R-ek \ tÁbra 3). Ezért teszteltük azt a hipotézist, hogy az AMPH által indukált partner preferenciák károsodását a D1R közvetíti az NAcc-ben. A férfiak sztereotaxiás kanületést kaptak, amelyek kétoldalú célt szolgálnak a NAcc héjban (Ábra 4A). Az AMPH-injekciókat (1 mg / kg) az 23390 kondicionálás napjaiban önmagában az önmagában vagy a D1.0-szerű receptor antagonistát, az SCH3-t tartalmazó különböző CSF-eket tartalmazó CSF-et injektáltuk az NAcc-be. Ezután az alanyokat párosították egy nővel az 24 h-hez, majd a partner preferenciáit tesztelték. A fenti kísérlethez hasonlóan (Ábra 2), Az AMPH expozíció megakadályozta a párosodást okozó partner preferenciákat olyan férfiaknál, akik a NAF-en belüli intravénás injekciót kaptak, vagy egy kis adag SCH23390-ot (Ábra 4B). Ugyanakkor a férfiaknak, akiknek nagy adag SCH23390-et (100 ng / kg) adtak be, a partnerek preferenciái (t = 2.55, P <0.05), jelezve, hogy az NAcc-ben a D1R blokád kiküszöbölte a partnerpreferencia kialakulásának AMPH-indukálta károsodását (Ábra 4B). Az együttélés vagy a mozgásszervi aktivitás során a párosítási gyakoriságban nem találtak különbséget a párosítási gyakoriságban a partner preferencia teszt során.
Megbeszélés
Ebben a tanulmányban megismételjük korábbi megállapításainkat, miszerint az AMPH expozíció a CPP-t hím prérikus völgyekben indukálja (22) és bizonyítják, hogy a D1R aktivációja az NAcc-ben szükséges ehhez a viselkedéshez, ami összhangban van más rágcsálófajokkal végzett vizsgálatokkal (28). Ez a megállapítás a korábbi tanulmányokkal együtt arra utal, hogy a NAcc-ben a különálló DAerg mechanizmusok szabályozzák az AMPH- és partner-motivált viselkedéseket: az AMPH-motivált viselkedést (CPP) a D1R közvetíti, míg a partner-motivált viselkedést (partner preferenciák) a D2R segíti. aktiválása és a D1R aktiválása az NAcc-ben (13-15). [Fontos megjegyezni, hogy a NAcc-ben a D2R aktiváció bizonyos körülmények között közvetíti a gyógyszer által indukált CPP-t (29) és a D1R aktiválása más, társadalmilag motivált viselkedésekben is részt vesz, mint például az utódok felé irányuló7, 30)].
A CPP és a partner preferenciák képződésének differenciált DAerg szabályozását leginkább az inger-kiváltott DA koncentráció különbségei eredményezik, amelyek különböző DAR altípusokat aktiválnak. A kötési affinitások különbségei miatt a DA-koncentráció erős emelkedése szükséges az alacsony affinitású D1R-ek aktiválásához, míg a DA-koncentrációk mérsékelt növekedése a nagy affinitású D2R-eket aktiválja (31). A préri kövekben az AMPH sokkal nagyobb mértékű növekedést idéz elő a DA koncentrációban (24) a párzás által kiváltotthoz képest15, 25). Ezek az adatok arra utalnak, hogy a DA-koncentráció viszonylag szerény növekedése a társadalmi interakciók során (15, 25) lehetővé teszik a nagy affinitású D2R-ek specifikus aktiválását és ezáltal megkönnyíti a páros kötés kialakulását. Ezzel szemben az AMPH beadását követő DA koncentráció erős növekedése valószínűleg elegendő az alacsony affinitású D1R-ek aktiválásához, ezáltal elősegítve az AMPH által indukált CPP-t.
A DA receptor-specifikus viselkedési szabályozása összhangban van az extracelluláris elektrofiziológiai vizsgálatokkal a szabadon mozgó patkányokban, amelyek azt mutatják, hogy a kábítószer és a természetes ingerek különálló neuronális populációkban dolgoznak az NAcc-ben (32). Bár az ilyen elektrofiziológiai vizsgálatok nem képesek azonosítani az egyes neuronokon expresszált DA receptorok altípusát, az anatómiai vizsgálatok azt mutatják, hogy az NAcc olyan kivetítő neuronokból áll, amelyek D1R-eket vagy D2R-eket expresszálnak nagyon kevés koexpresszióval (33). A pszichostimulánsok előnyösen aktiválják az intracelluláris jelátviteli útvonalakat a D1R-ektől lefelé (a jelátviteli molekulák fokozott foszforilációja alapján) (34) és korábban kimutattuk, hogy ezen jelátviteli utak fokozott aktiválása megakadályozza a partner preferenciák kialakulását (35). Tehát, bár a NAcc-en belüli DA-átvitel fontos szerepet játszik az AMPH-ra adott válaszban és a partner-preferenciák kialakításában, ezek a viselkedések valószínűleg különböző mikrocirkuláris áramkörökön keresztül közvetülnek, amelyek striatális vetítési rendszereket tartalmaznak (33, 36). Ez különösen érdekes, mert a páros kötés kialakulását D2R expresszáló neuronok aktiválása közvetíti, amelyek a ventrális pallidumra irányulnak (33), egy másik agyrégió fontos a párosításhoz (26).
Ebben a tanulmányban bizonyítékot szolgáltatunk arra vonatkozóan, hogy az AMPH tapasztalat megakadályozza a párosítás által indukált páros kötést. Mivel ezekben a kísérletekben a partner preferenciális teszteket az utolsó AMPH expozíció után 48 h-nél végeztük (azaz a gyógyszer teljesen metabolizálódott), ezek az adatok arra utalnak, hogy az AMPH a szociális kötődésre folyamatosan hat. Egy lehetséges mechanizmus, amely összhangban van az AMPH más fajokra gyakorolt hatásával (37, 38), amellyel az AMPH károsíthatja a páros kötést a D1R expresszió növelése révén az NAcc-ben. Ezt a fogalmat támogatja a NAcc D1R antagonista szerepe a partner preferenciák kialakításában (14, 24) és az AMPH-val kezelt állatokban a NAcc D1R-blokád által okozott párosodás által kiváltott partner preferenciák megmentését igazoló jelenlegi adatokkal (Ábra 4). Érdekes, hogy korábban kimutattuk, hogy a hím préri kölykökben a NAcc D1R-ek felzárkózása a páros kötés 2 hete után megkönnyíti a szelektív agressziót a különös idegenek felé, beleértve a szexuálisan fogékony nőstényeket is, ami azt sugallja, hogy ez a neurális plaszticitás fejlődött mechanizmus, amellyel a férfi köpeny fenntartani a már létrehozott párkötéseket (14). A jelenlegi vizsgálat azt sugallja, hogy az AMPH mesterségesen kiváltja ezt a neuroplasztikát, ami a páros kötés AMPH-károsodásához vezet. Az is lehetséges, hogy az AMPH-val kezelt férfiak társíthatják a nőstényt az AMPH visszavonásának averzív állapotával, és ezáltal ez a negatív összefüggés az AMPH károsodását okozhatja a páros kötésben. Egy korábbi vizsgálat kimutatta, hogy a d-amfetamin fokozatos dózis-menetrendjének visszavonása csökkent a szexuális viselkedést hím patkányokban (39). Vizsgálatunkban azonban a különböző kezelési csoportok köpenyei hasonló párosodást mutattak (Ábra 2B), ami azt jelzi, hogy valószínűleg nem álltak az amfetaminból. Mindazonáltal ez a lehetőség további vizsgálatot igényel.
Megállapították, hogy a kábítószer-indukált neurális plaszticitás alapvető fontosságú a kábítószer-függőség \ t40). A pszichostimulánsok drasztikusan megváltoztatják a mesolimbikus DA rendszer szerkezeti plaszticitását (41), és bizonyítékok arra utalnak, hogy az ilyen változások tartósabbak a D1 expresszáló neuronokban (37). Ezenkívül az elektrofiziológiai vizsgálatok kimutatták, hogy a kokainélmény csökkentheti az ezt követő neuroplasticitást az NAcc-ben (42). Valójában az NAcc gyógyszerindukált neurális átszervezése gyengíti a természetben előforduló neurális átszervezést az összetett környezetek új expozíciója után (43). Ezért, bár a kábítószer-függőség széles körben elismert a tanulás és a memória rendellenességeként (1, 40, 44), gyakran alábecsülik, hogy a kábítószer-indukált veszteség a mesolimbikus áramkörök további megváltozásának lehetőségében is lényeges lehet a függőség szempontjából. A plaszticitás ilyen csökkenése korlátozhatja a viselkedési repertoárt a kábítószer-keresésre. Ezért nem meglepő, hogy az AMPH-val kezelt vulkánok csökkent páros kötési viselkedést mutattak. Az AMPH expozíció jelenlegi hatásai a páros kötésre összhangban vannak a korábbi vizsgálatokkal, amelyek a pszichostimulánsok más társadalmi viselkedésre gyakorolt káros hatásait mutatják be, beleértve az anyai viselkedést is (45-47) és társadalmi játék (48-50). Az ilyen munka együttesen ígéretet tesz arra, hogy a kábítószer- és társadalmi ingerek az agyban való kölcsönhatásainak vizsgálata jelentősen megnövelheti a társadalmi viselkedés és az emberhasználat közötti erős kölcsönhatások megértését (21).
Anyagok és módszerek
Tantárgy.
Az alanyok szexuálisan naiv hím préri köpenyek egy laboratóriumi tenyésztő kolóniából. Az alanyokat 21-napokban elválasztottuk, és azonos nemű testvérpárokban helyeztük el műanyag ketrecekben (12 × 28 × 16 cm), ahol víz és táplálék volt ad libitum. Az összes ketrecet 14: 10 fény-sötét ciklus alatt tartottuk, és a hőmérséklet körülbelül 20 ° C volt. Valamennyi vizsgált személy körülbelül 90 napos volt. A sztereotaxiás kanülést és a DA-gyógyszerek helyspecifikus infúzióját másutt részletesen leírták (14).
Viselkedési tesztelés.
A CPP tesztet a korábban leírtak szerint végeztük (22) az alábbi kivételekkel. Az egyes alanyok kezdeti ketrec-preferenciáját 30-min-es próbával határoztuk meg az 1 napon. Az alanyokat ezután az 40 min-szekciók során kondicionáltuk AMPH-val a nem károsított ketrecbe és a sóoldatot az előnyben részesített ketrecbe (mind az AMPH-t, mind a sóoldatot ugyanazon a napon adtuk be, 6 h egymástól) 3 egymást követő napokon (2 – 4 nap). Ezután az alanyokat teszteltük (posttest) a CPP jelenlétére az 5-nál.
A partner preferenciák tesztelése a korábban leírtak szerint történt (14). Röviden, a vizsgálati berendezés egy központi ketrecből (12 × 28 × 16 cm) állt, amelyet üreges csövek (7.5 × 16 cm) és két párhuzamos, azonos stimuláló állatból álló ketrecbe helyeztek. Az ösztönző állatok az ismerős „partner” (a szubjektum női párja) és egy ismeretlen „idegen” (egy olyan nő, aki korábban nem találkozott a témával), amelyek lazán összekapcsolódtak a külön ketrecekben, anélkül, hogy közvetlen kapcsolatba kerültek egymással. Az 3-h teszt elindításakor az alanyokat a központi ketrecbe helyeztük, és szabadon mozogtuk a készülékben. A viselkedést időzített videofelvételrendszer segítségével rögzítették. A manipulációra vakok kísérletezői felülvizsgálták a szalagot és a felvett téma viselkedését. A partner preferenciát úgy definiálták, mint az a személy, aki jelentősen több időt tölt a partnerrel való kapcsolattartás során, mint az idegen, ahogy azt párosított minták jelzik t teszt (27).
In situ hibridizáció és Western Immunoblotting.
Speciális antiszensz riboprobák (Táblázat 1) D1R, D2R, TH és DAT in situ mRNS jelölésekhez használtuk. A címkézést a 35S-jelzett próbák és érzékelő mRNS-kontrollok minden DA-markerhez, amint azt korábban leírtuk (51). Western blot analízishez a DAR fehérjét a NAcc szövet lyukasztók felülúszójából extraháltuk, és az előzőekben leírt módon vizsgáltuk.52).
Az adatok mennyiségi meghatározása és elemzése.
A CPP és a partner preferenciákat párosított minták határozzák meg t tesztek. A partner-preferencia teszt során az első 6 h alatt a párosítási csoportban a párosítási csoportok közötti különbségeket ANOVA elemezte. A D1R és D2R mRNS címkézésének optikai sűrűségét az NAcc-ben, valamint a TH, a DAT és a D2R mRNS-jelölésekben a VTA-ban számszerűsítettük autoradiográfiákból számítógépes képprogrammal (NIH IMAGE 1.64). Az adatokat a fiziológiás sóoldat-kontroll csoport átlagának százalékos változása és a csoportkülönbségek elemzése alapján végeztük t tesztek. Végül a D1R és a D2R jelölések optikai sűrűségét a Western blot kísérletek röntgensugaras filmjein analizáltuk. t tesztek.
Kísérleti terv.
Az 1a kísérlet dózis-válasz görbét hozott létre az AMPH által indukált CPP-re. A vizsgálati alanyokat az 1 napján a CPP készülékben teszteltük, és véletlenszerűen hat kísérleti csoport egyikébe soroltuk, amelyek különböző koncentrációjú AMPH-t (0 (XNUMX)) kaptak.n = 12), 0.1 (n = 8), 0.5 (n = 9), 1.0 (n = 12), 3.0 (n = 12), vagy 5.0 mg / kg (n = 13)] az 3 napokban (2 – 4 nap), és a CPP-t tesztelték az 5 napján.
Az 1b kísérlet feltárta a DA receptorok szerepét az AMPH által indukált CPP-ben. Az alanyokat a CPP-berendezésben teszteltük, és nyolc kísérleti csoport egyikébe vontuk be véletlenszerűen a sóoldat sc (sc) injekcióját.n = 10) vagy fiziológiás sóoldat, amely nem-szelektív DA receptor antagonistát [haloperidol; 0.1 (n = 8), 1.0 (n = 8), vagy 5.0mg / kg (n = 8)] vagy D1-szerű specifikus (SCH23390; 0.5 (n = 7) vagy 5.0 mg / kg (n = 7)] vagy D2-szerű specifikus DA receptor antagonista [etikloprid; 0.5 (n = 8) vagy 5.0 mg / kg (n = 8)]. Harminc perccel később az AMPH kondicionáláshoz az AMPH (1.0mg / kg) küszöbértéket használtuk, amely az 1a kísérletben CPP-t indukált. Az AMPH-kondicionálás 3 napja után minden személy CPP utóvizsgálatot kapott.
Az 2 kísérlet azt vizsgálta, hogy az AMPH tapasztalat zavarja-e a páros kötést. Az alanyokat véletlenszerűen három kísérleti csoport egyikébe soroltuk be, amelyek ip-féle sóoldatot (n = 8) vagy 1.0 mg / kg-ot tartalmazó sóoldat (n = 8) vagy 5.0 mg / kg (n = 7) AMPH naponta egyszer 3 egymást követő napokon - olyan paradigma, amely a CPP-t hím prérikus völgyekben indukálta. A negyedik napon az alanyokat ösztrogénnel alapozott nővel párosítottuk 24 h-ra (14), majd 3-h partner preferencia tesztben tesztelték. Annak érdekében, hogy ellenőrizzék az injekciók lehetséges hatásait a páros kötődésre, egy negyedik kísérleti csoport ép férfiaknak, akik nem kaptak semmilyen injekciót (n = 6) az 24 h ösztrogénnel alapozott nőstényekkel párosították, majd a partner preferenciáit tesztelték. Minden viselkedési tesztet videofelvételeztek a párzás ellenőrzéséhez. A résztvevők és az idegenek egymás melletti kapcsolatának időtartama számszerűsített. Ezenkívül számszerűsítettük a párosítási ütemek gyakoriságát az 6-h partneri preferencia teszt során az első 3 h alatt a párosítási és mozgásszervi aktivitás során (amit ketrec-átkelés jelez). A partner preferencia teszt után az alanyokat azonnal megölték. Az összes agyat összegyűjtöttük, szárazjégen fagyasztottuk, és -80 ° C-on tároltuk a DA marker mRNS-ek in situ hibridizációs jelölésére.
Az 3 kísérlet azt vizsgálta, hogy az AMPH-károsodott párkötés a mesolimbikus DA-aktivitás változásaihoz köthető-e. A fiziológiás sóoldatot kapott alanyok ajkai (n = 8) vagy 1.0 mg / kg AMPH (n = 8) az 2-et egy kriosztátra vágtuk koronális szakaszokra (14 μm vastagság), amelyeket felolvasztottak Superfrost / plus lemezre (Fisher Scientific). Az 98-μm-es intervallumokon az agyszakaszokat D1R, D2R, TH és DAT mRNS-ek in situ hibridizációs jelölésére dolgoztuk fel. Mivel az 1.0 mg / kg AMPH-ban tapasztalt vulkánok a D1R, de nem a D2R növekedését mutatták, az NAcc-ben mRNS-jelölés történt, a sóoldattal beadott kontrollokhoz képest két további csoportot állítottak elő, amelyek sóoldatot kaptak (n = 6) vagy 1.0 mg / kg AMPH (n = 6), 24 h párosodás, majd a partner preferenciák tesztelése, a fent leírtak szerint. A résztvevőket dekapitáltuk, és az agyakat egy 300 μm vastagságú kriosztáton szeleteltük. A NAcc-ből kétoldalúan bevitt szöveti lyukasztókat D1R és D2R Western-blotolás céljából feldolgoztuk.
Az 4 kísérlet azt vizsgálta, hogy a D1-típusú receptorok aktiválása az NAcc-ben felelős-e a pár kötés AMPH-károsodásáért. Az alanyokat kétoldalú irányító kanülbe ültettük be, amely a NAcc héjra irányult. 3 napok után a véletlenszerűen három kísérleti csoportba sorolták be azokat, amelyekben a NAF intravénásán belüli intravénás injekciót kaptak (200 nL / side, n = 11) vagy 0.4-t tartalmazó CSF (n = 6) vagy 100 ng / oldal (n = 7) SCH23390. Harminc perccel később kaptak ip injekciókat 1.0 mg / kg AMPH-ra. Ezt az eljárást megismételtük az 3 egymást követő napokban. A negyedik napon az alanyokat ösztrogénnel alapozott nővel párosították az 24 h-hez, majd a partner preferenciáit tesztelték.
Köszönetnyilvánítás
A szerzők köszönetet mondanak Kyle Gobrogge-nak, Claudia Lieberwirthnek, Kelly Lei-nak és Melissa Martinnak, hogy kritikusan olvassák ezt a kéziratot. Ezt a munkát az MHR01-58616, DAR01-19627 és DAK02-23048 Nemzeti Egészségügyi Támogatási Intézetek támogatták ZW-hez
Lábjegyzetek
A szerzők nem jeleznek összeférhetetlenséget.
Ez a cikk egy PNAS közvetlen benyújtása.
Referenciák