KOMENTARZE: Jedno z nielicznych badań, w którym opisano, jak abstynencja wpływa na poziomy receptorów dopaminowych u naczelnych.
- Receptory D2 odbijają się dość szybko - mniej niż miesiąc
- Receptory D1 są zbyt wysokie w miesiącu, ale odbijają się w ciągu 90 dni.
- Wysokie lub niskie receptory D1 mogą być kluczem do ostrego odstawienia i pożądania
Thomas JR Beveridge1Hilary R. Smith1, Michael A Nader1 i Linda J Porrino1
1Katedra Fizjologii i Farmakologii, Centrum Badania Neurobiologicznego Nadużywania Narkotyków, Szkoła Medyczna Uniwersytetu Wake Forest, Winston-Salem, NC, USA
Korespondencja: Dr LJ Porrino, Katedra Fizjologii i Farmakologii, Centrum Neurobiologicznych Badań nad Narkomanią, Szkoła Medyczna Uniwersytetu Wake Forest, Centrum Medyczne Boulevard, Winston-Salem, NC 27157-1083, USA. Tel: + 1 336 716 8575; Faks: + 1 336 716 8501; E-mail: [email chroniony]
Otrzymano 29 kwietnia 2008 r .; Zmieniono 25 lipca 2008 r .; Przyjęto 30 lipca 2008 r .; Publikacja internetowa z dnia 3 września 2008 r.
Abstrakcyjny
Chociaż rozregulowanie w obrębie układu dopaminowego (DA) jest cechą charakterystyczną przewlekłej ekspozycji na kokainę, pytanie, czy te zmiany utrzymują się w abstynencji, pozostaje w dużej mierze bez odpowiedzi. Naczelne niebędące ludźmi reprezentują idealny model, w którym ocenia się wpływ abstynencji na układ DA po przewlekłej ekspozycji na kokainę. W tym badaniu samce kokainy samców małp rezus (0.3 mg/kg na zastrzyk, wzmocnienia 30 na sesję) w stałym odstępie 3-min schedule dla dni 100, po których następuje abstynencja 30 lub 90. Wykazano, że ten czas podawania kokainy samolubnie zmniejsza gęstość receptora podobnego do DA D2 i zwiększa poziom receptorów D1-podobnych i transporterów DA (DAT). Odpowiadanie małpom kontrolnym utrzymywano przez prezentację żywności według identycznego protokołu i tych samych okresów abstynencji. [3H]Wiązanie SCH 23390 do Receptory DA D1 po dniach abstynencji 30 były znacząco wyższe we wszystkich częściach prążkowia, w porównaniu ze zwierzętami kontrolnymi, podczas gdy [3H]wiązanie raclopridu do receptorów DA D2 nie różniło się między grupami. [3H]Wiązanie WIN 35 428 z DAT było również znacząco wyższe we wszystkich częściach prążkowia grzbietowego i brzusznego po dniach abstynencji 30. Jednak po dniach abstynencji 90 poziomy receptorów DA D1 i DAT nie różniły się od wartości kontrolnych. Chociaż wyniki te wskazują, że ostatecznie dochodzi do odzyskania oddzielnych elementów układu DA, podkreślają one także dynamiczną naturę tych składników podczas początkowych faz abstynencji od przewlekłego samopodawania kokainy.
Słowa kluczowe:
kokaina, dopamina, autoradiografia, abstynencja, prążkowie
WPROWADZENIE
Przewlekłe zażywanie kokainy wśród ludzi uzależnionych jest związane z neuroadaptacjami w systemie dopaminy (DA) (Malison i wsp, 1998; Volkow i wsp, 1993, 1997). Obejmują one wzrost gęstości transporterów DA (DAT) i zmniejszenie stężeń receptorów DA D2-podobnych (Mało i wsp, 1999; Zacier i wsp, 2002; Volkow i wsp, 1993). Ponadto zaobserwowano również zmiany w uwalnianiu DA. Na przykład badacze stosujący badania tomografii emisyjnej pozytronowej (PET) [11C]rakloprid i metylofenidat wykazały zmniejszenie uwalniania DA w prążkowiu osób przewlekle zażywających kokainę (Volkow i wsp, 1997; Wong i wsp, 2006). Problem polega jednak na tym, że często trudno jest wykluczyć wpływ innych czynników, takich jak stosowanie innych nielegalnych i legalnych narkotyków, różnice we wcześniejszych wzorach przyjmowania i stosowania leków oraz różnice w stylu życia. Różnice te, jak również istnienie warunków, które mogą poprzedzać zażywanie narkotyków, mogą ograniczać interpretację badań u ludzi.
Modele naczelnych nieludzkich, w których zmienne można systematycznie manipulować, stanowią alternatywne podejście do badania konsekwencji przewlekłego samopodawania kokainy i późniejszej abstynencji. Wcześniejsze badania wykazały, że przewlekłej ekspozycji na kokainę towarzyszy znaczące zmniejszenie stężenia receptorów DA D2, a także zwiększenie poziomów receptorów D1 i gęstości DAT (Letchworth i wsp, 2001; Moore i wsp, 1998a, 1998b; Nader i wsp, 2002, 2006). Efekty te odzwierciedlają te obserwowane u ludzi, co potwierdza użyteczność tych modeli ekspozycji na lek.
Chociaż istnieją znaczne dowody na rozregulowanie systemów DA, trudniej jest ocenić, czy istnieją jakiekolwiek dowody na powrót do zdrowia po zaprzestaniu zażywania narkotyków (Malison i wsp, 1998; Jacobsen i wsp, 2000; Volkow i wsp, 1993) lub czy zmiany te utrzymują się poza ramami czasowymi dalszego narażenia na kokainę. Ponownie, modele naczelnych nieludzkich mogą dostarczyć wglądu w tę fazę uzależnienia. Farfel i wsp (1992) zgłaszali zmniejszone stężenia receptorów DAT i D1-podobnych w prążkowiu małp po abstynencji od przewlekłej, niekonsekwentnej ekspozycji na kokainę. Jednak specyficzna rola abstynencji była trudna do określenia z powodu braku pomiarów w grupie bez okresu abstynencji. W podobny sposób, Melega i wsp (2008) zgłaszali znacząco obniżone poziomy DAT w prążkowiu małp vervet po tygodniach abstynencji 3 od narastającego reżimu metamfetaminy. Podawanie środków pobudzających w obu badaniach było jednak niekonsekwentne. Droga podania (warunkowa vs okazało się, że ma wpływ na mózg różnie w odniesieniu do obu uwalnianych DA (Hemby i wsp, 1997) i metabolizm glukozy (Graham i Porrino, 1995; Porrino i wsp, 2002). W związku z tym stosowanie samoopieki w niniejszym badaniu omija ten problem. Ponadto, efekty długotrwałego samopodawania kokainy na mózgowe układy DA były szeroko badane przy użyciu tego modelu samopodawania u małp rezus, dostarczając tym samym linii odniesienia, z której można ocenić neuroadaptacje, które występują podczas abstynencji.
Celem tych badań było zatem określenie, czy zmiany w stężeniach receptorów DAT i DA D1 i D2, które wykazano wcześniej u zwierząt narażonych na kokainę samopodawającą (Letchworth i wsp, 2001; Moore i wsp, 1998a, 1998b; Nader i wsp, 2002) byłby odwrócony po dłuższych okresach abstynencji. Na podstawie badań osób używających narkotyków (por Volkow i wsp, 1993), postawiliśmy hipotezę, że te zmiany w systemie DA utrzymają się nawet po miesiącach abstynencji 3. W tym celu małpy samodzielnie podawały kokainę na sesje 100 z całkowitą dawką 900 mg/kg, a następnie 30 lub 90 dni abstynencji od leku. Receptory DA D1 i D2, a także DAT, mierzono ilościowo in vitro autoradiografia receptora.
METODY
Tematy
W sumie 17 eksperymentalnie-naiwne dorosłe samce małp rezus (Macaca mulatta) ważenie między 7.7 a 13 kg (średnia ± SD, 10.2 ± 1.32) na początku badania służyły jako podmioty. Wszystkie procedury przeprowadzono zgodnie z ustalonymi praktykami opisanymi w Przewodnik National Institutes of Health dotyczący opieki i używania zwierząt laboratoryjnych. Ponadto wszystkie procedury zostały sprawdzone i zatwierdzone przez Komitet ds. Opieki nad Zwierzętami i Użytkowania Uniwersytetu Wake Forest. Małpy trzymano indywidualnie w klatkach ze stali nierdzewnej z wodą ad libitum; zwierzęta miały ze sobą kontakt fizyczny i wizualny. Ich masy ciała utrzymywano na poziomie około 90 – 95% ciężarków do karmienia za pomocą granulek o smaku bananów zdobytych podczas sesji eksperymentalnych i uzupełniającego karmienia Lab Diet Monkey Chow, pod warunkiem, że nie wcześniej niż 30 min po sesji. Ponadto podawano im świeże owoce lub orzeszki ziemne co najmniej trzy razy w tygodniu. Każda małpa była ważona raz w tygodniu, a jeśli to konieczne, ich dieta była dostosowywana, aby utrzymać stabilne wagi.
Aparat behawioralny
Sesje doświadczalne prowadzono w wentylowanych i tłumionych dźwiękiem komorach operacyjnych (1.5 × 0.74 × 0.76 m; Med Associates Inc., East Fairfield, VT) zaprojektowany, aby pomieścić krzesło naczelne (Model R001; Primate Products, Redwood City, CA). Komora zawierała panel inteligencji (48 × 69 cm), który składał się z dwóch chowanych dźwigni (5 cm szerokości) i trzy światła bodźców. Dźwignie były umieszczone w zasięgu ręki małpy siedzącej na krześle naczelnych. Granulki żywności o smaku bananowym (1 sol; Bio-Serv, Frenchtown, NJ) zostały dostarczone z podajnika umieszczonego na górze komory. Perystaltyczną pompę infuzyjną (7531-10; Cole-Parmer Co., Chicago, IL) zastosowano do dostarczania zastrzyków leku z szybkością około 1 ml na 10 s do tych zwierząt kokaina samopodawająca. Działanie komór i gromadzenie danych przeprowadzono za pomocą systemu komputerowego Power Macintosh z interfejsem (Med Associates Inc.).
Zabiegi chirurgiczne
Wszystkie małpy, w tym kontrolne, przygotowano chirurgicznie, w sterylnych warunkach, z założonymi na stałe cewnikami dożylnymi i portami dostępu naczyniowego (Model GPV; Access Technologies, Skokie, IL). Małpy znieczulono kombinacją ketaminy (15 mg/kg, im) i butorfanol (0.03 mg/kg, im) i wykonano nacięcie w pobliżu żyły udowej. Po tępym rozcięciu i izolacji żyły, proksymalny koniec cewnika wprowadzono do żyły na odległość obliczoną na zakończenie w żyle głównej dolnej. Dystalny koniec cewnika był przewleczony podskórnie do nacięcia wykonanego nieco poza linią środkową pleców. Naczyniowy port dostępu umieszczono w kieszeni utworzonej przez tępe rozcięcie w pobliżu tego nacięcia. Małpy otrzymały 24 – 48 h czas powrotu do zdrowia przed powrotem do odpowiedzi wzmocnionej pożywieniem. Około 5 dni przed zabiegiem końcowym każdej małpie implantowano chroniczny cewnik na stałe do sąsiedniej tętnicy udowej w celu pobrania próbek krwi tętniczej w określonym czasie. Procedury chirurgiczne były identyczne z opisanymi dla cewników żylnych. W dniu ostatniej sesji przeprowadzono końcowe badanie metabolizmu glukozy w mózgu, w którym małpom wstrzyknięto 2-[14C]deoksyglukoza (2-DG) około 2 min po zakończeniu sesji próbki krwi pobierano przez cewnik tętniczy na 45 okres min (patrz Beveridge i wsp, 2006 dla szczegółów). Dane dotyczące metabolizmu z tych badań nie zostały tutaj przedstawione.
Procedury samorządowe
Początkowo małpy były szkolone, aby odpowiadały na jedną z dwóch dźwigni, wzmacniając każdą odpowiedź na właściwej dźwigni granulatem żywności. W przybliżeniu w okresie 3-tygodniowym odstęp między dostępnością peletek żywności stopniowo zwiększano, aż do osiągnięcia przedziału 3-min (tj. Ustalonego przedziału 3-min harmonogramu zbrojenia; FI 3-min). W ostatecznych warunkach harmonogramu pierwsza reakcja na dźwignię po 3 min spowodowało dostarczenie granulatu spożywczego; sesje zakończyły się po prezentacjach żywności 30. Pod koniec każdej sesji dźwignie odpowiedzi zostały wycofane, światła domowe i światła bodźców zgasły, a zwierzęta pozostały w zaciemnionej komorze na około 30 min przed powrotem do klatek domowych. Wszystkie małpy odpowiedziały zgodnie z harmonogramem FI 3-min prezentacji żywności przez co najmniej sesje 20 i aż do uzyskania stabilnej wydajności (± 20% średniej z trzech kolejnych sesji, bez trendów wskaźników odpowiedzi). Gdy reakcja utrzymywana przez żywność była stabilna, karmnik był odłączony i efekty wygaszania podczas odpowiedzi były badane przez pięć kolejnych sesji, po których reakcja została przywrócona i utrzymana przez prezentację żywności.
Po ustaleniu wyjściowej wydajności wszystkie małpy zostały chirurgicznie przygotowane cewnikami żylnymi, jak opisano powyżej, i losowo przydzielono do jednej z trzech grup. Jedna grupa małp służyła jako kontrola i nadal odpowiadała w ramach harmonogramu prezentacji żywności FI 3-min w sumie sesji 100 (N=6). Pozostałe małpy 11 zostały przydzielone do grup samopodawających kokainę (0.3 mg/kg na zastrzyk). Ponieważ 0.3 mg/kg kokainy na wstrzyknięcie uznano za wysoką dawkę dla małp wcześniej nieleczonych kokainą, dla większości zwierząt dawkę tę osiągnięto w ciągu dwóch sesji, najpierw pozwalając małpce na samodzielne podanie 0.1 mg/kg kokainy. Po zabiegu chirurgicznym (w przybliżeniu 4 – 6 dni) pozwolono ustabilizować działanie podtrzymujące żywność przed rozpoczęciem sesji samodzielnego podawania kokainy. Przed każdą sesją eksperymentalną tył zwierzęcia był czyszczony za pomocą 95% do portu prowadzącego do cewnika żylnego wprowadzono peeling etanolowy i betadynowy oraz igiełkę Huber Point Needle 22 (model PG20-125), łącząc pompę infuzyjną zawierającą roztwór kokainy z cewnikiem. Przed rozpoczęciem sesji pompa pracowała w przybliżeniu na 3 s, wypełniając port dawką kokainy dostępną podczas sesji eksperymentalnej. Sesje zakończyły się po zastrzykach 30; jak w warunkach kontrolnych, małpy pozostawały w zaciemnionej komorze przez około 30 min. Pod koniec każdej sesji port wypełniono heparynizowanym roztworem soli (100 U/ml), aby zapobiec krzepnięciu.
Sesje eksperymentalne były prowadzone w przybliżeniu o tej samej porze każdego dnia i były kontynuowane przez całą sesję 100. Po zakończeniu sesji 100 wprowadzono okres abstynencji w dniach 30 lub 90, w którym to czasie cewniki przepłukano codziennie heparynizowaną solą fizjologiczną, ale nie przeprowadzono sesji samodzielnego podawania kokainy lub żywności. Dla grupy kontrolnej okresy abstynencji dni 30 zostały nałożone u czterech zwierząt, a dni 90 u dwóch innych. Dla grupy kokainy okresy abstynencji w dniach 30 zostały nałożone na osiem zwierząt i dni 90 na trzy zwierzęta. Pod koniec okresu abstynencji przeprowadzono jedną końcową sesję samorządu (kontrola żywności lub kokaina), a procedurę 2-DG rozpoczęto natychmiast po sesji. W dwóch grupach kontrolnych i czterech zwierzętach przyjmujących kokainę we własnym zakresie w grupie abstynencyjnej w dniu 30 nie otrzymywano kokainy podczas ostatniej sesji. Zwierzęta zabito humanitarnie przedawkowaniem pentobarbitalu (100 mg/kg, iv) na końcu 45 min okres pobierania znacznika.
Przetwarzanie tkanek
Po zabiciu mózgi natychmiast usuwano, blokowano i zamrażano w izopentanie w -35 do -55 ° C, a następnie przechowywano w -80 ° C. Bloki tkankowe zawierające prążkowie zostały następnie pocięte w kriostacie w -20 ° C w płaszczyźnie czołowej na 20 μskrawki m zebrano na szkiełka naładowane elektrostatycznie, wysuszono pod próżnią przez noc w 4 ° C, a następnie przechowywano w -80 ° C aż do przetworzenia na autoradiografię. Skrawki mózgu zebrano z części jądra ogoniastego, skorupy i jądra półleżącego, które leżą dziobowo do spoidła przedniego. Region ten nazywany jest prążkowiem przedkomórkowym. Ponadto wyznaczono poziomy dziobowe i ogonowe prążkowia przedkomórkowego w odniesieniu do jądra półleżącego. Dziobowe prążkowate prążkowate jest regionem, w którym jądro półleżące nie jest rozróżnione na odrębne skorupy i podkorony rdzenia. Ogonowe prążkowate ogonowe jest regionem przystającym do wyglądu skorupy i jądra półleżącego, które jest tylne od pojawienia się guzka węchowego. Dla każdego badania wiązania, pobrano dwie sąsiednie skrawki na każdym z pięciu poziomów (dwa dziobowe i trzy ogonowe) przez prążkowate przedkomórkowe w sumie przekroje 10 na zwierzę.
Wiązanie receptora D1
Określono gęstości miejsca wiązania receptora DA D1 za pomocą [3H]SCH 23390 (specyficzna aktywność - 85 Ci/mmol; PerkinElmer, Boston, MA) ilościowo in vitro autoradiografia receptora według procedur dostosowanych z Lidow i wsp (1991) i Nader i wsp (2002). Skrawki wstępnie inkubowano dla 20 min w buforze (50 mM Tris, 120 mM NaCl, 5 mM KCl, 2 mM CaCl2, 1 mM MgCl2, pH 7.4, 25 ° C) w celu usunięcia endogennej DA, kokainy i [14C] z procedury 2-DG. Skrawki inkubowano następnie dla 30 min w tym samym buforze, pH 7.4, 25 ° C, zawierający 1 mM kwas askorbinowy, 40 nM ketanserin i 1 nM [3H]SCH 23390. Po inkubacji skrawki płukano dwukrotnie dla 20 s w buforze zawierającym 1 mM kwas askorbinowy przy pH 7.4, 4 ° C, następnie zanurzono w wodzie destylowanej w 4 ° C i wysuszono pod strumieniem chłodnego powietrza. Wiązanie niespecyficzne zdefiniowano przez inkubację sąsiednich skrawków w roztworze inkubacyjnym w obecności 5 μM (+) -butaclamol. Sekcje wraz ze skalibrowanym [3H] standardy autoradiograficzne (Amersham, Piscataway, NJ), zastosowano do filmu Kodak Biomax MR (Fisher Scientific, Pittsburgh, PA) dla 6 tygodni.
Wiązanie receptora D2
Określono gęstość i rozmieszczenie miejsc wiązania receptora DA D2 za pomocą [3H]raclopridde (specyficzna aktywność, 87 Ci/mmol; PerkinElmer) zgodnie z procedurami dostosowanymi z Lidow i wsp (1991) i Nader i wsp (2002). Skrawki wstępnie inkubowano dla 20 min w buforze (50 mM Tris, 120 mM NaCl, 5 mM KCl, pH 7.4, 25 ° C) w celu usunięcia endogennej DA, kokainy i [14C] z procedury 2-DG. Szkiełka inkubowano następnie dla 30 min w tym samym buforze, zawierający 5 mM kwas askorbinowy i 2 nM [3H]racloprid. Skrawki przepłukano 3 × 2 min w buforze przy pH 7.4, 4 ° C, następnie zanurzono w wodzie destylowanej w 4 ° C i wysuszono pod strumieniem chłodnego powietrza. Wiązanie niespecyficzne zdefiniowano przez inkubację sąsiednich skrawków w roztworze inkubacyjnym w obecności 1 μM (+) –Butaclamol. Sekcje wraz ze skalibrowanym [3H] standardy autoradiograficzne nałożono na film Kodak Biomax MR dla 8 tygodni.
Wiązanie transportera dopaminy
Gęstość miejsc wiążących DAT określono za pomocą [3H]WIN 35,428 (specyficzna aktywność, 87 Ci/mmol; PerkinElmer) autoradiografia zgodnie z procedurami dostosowanymi z Canfield i wsp (1990) i Letchworth i wsp (2001). Skrawki tkanki wstępnie inkubowano w buforze (50 mM Tris, 100 mM NaCl, pH 7.4, 4 ° C) dla 20 min, aby usunąć resztki DA, kokainy i [14C] z procedury 2-DG. Skrawki inkubowano następnie dla 2 h w 4 ° C w tym samym buforze zawierającym 5 nM [3H]WIN 35 428. Sekcje zostały przepłukane w sumie dla 2 min w buforze w 4 ° C, następnie zanurzono w wodzie destylowanej w 4 ° C i wysuszono pod strumieniem zimnego powietrza. Wiązanie niespecyficzne zdefiniowano przez inkubację sąsiednich skrawków w roztworze inkubacyjnym w obecności 30 μM kokaina. Sekcje wraz ze skalibrowanym [3H] standardy autoradiograficzne nałożono na film Kodak Biomax MR dla 6 tygodni.
Densytometria i analiza danych
Filmy zostały opracowane przy użyciu wywoływacza Kodak GBX, stopbath i Rapid Fixer (VWR, West Chester, PA), a następnie spłukane. Analizę autoradiogramów przeprowadzono metodą densytometrii ilościowej z komputerowym systemem przetwarzania obrazu (MCID, Imaging Research; InterFocus Imaging Ltd, Cambridge, UK). Wartości gęstości optycznej zostały przekształcone na fmol/mg (tkanki mokrej masy) w odniesieniu do kalibrowanej [3H] standardy. Specyficzne wiązanie określono przez cyfrowe odjęcie obrazów niespecyficznego wiązania z nałożonych sąsiednich obrazów całkowitego wiązania. Struktury zidentyfikowano przez barwienie Nissla skrawków sąsiadujących z tymi analizowanymi pod kątem wiązania receptora. Dane z każdego testu analizowano niezależnie za pomocą jednokierunkowej analizy wariancji, a następnie najmniejszych kwadratów post hoc testy do wielokrotnych porównań. Każdy region składał się z oddzielnej analizy. Ponieważ dane wiązania uzyskane od zwierząt kontrolnych abstynujących dla dni 30 i 90 nie różniły się znacząco od siebie, podobnie jak w poprzednich badaniach (Nader i wsp, 2002) dane z grup kontrolnych zostały połączone. Ponadto nie było istotnych różnic między danymi od zwierząt, które otrzymały kokainę, a tymi, które nie uczestniczyły w końcowej sesji, więc dane z tych grup zostały również połączone.
WYNIKI
Skutki abstynencji od przewlekłej samo-administracji kokainą dla 30 Days
Stężenia [3H]Wiązanie SCH 23390 z receptorami DA D1 w prążkowiu przedkomórkowym przedstawiono w Tabela 1. Specyficzne wiązanie [3H]SCH 23390 stanowił więcej niż 90% całkowitego wiązania. Zgodnie z wcześniejszymi raportami (Moore i wsp, 1998a; Nader i wsp, 2002), wiązanie [3H]SCH 23390 do receptorów D1 u zwierząt kontrolnych nie eksponowanych na lek był heterogenny z znacznymi różnicami w stopniu wiązania między podregionami prążkowia. Etykietowanie było gęstsze w bardziej dziobowych i środkowych częściach prążkowia.
Po dniach abstynencji 30 od ekspozycji na kokainę, wiązanie z receptorami D1 charakteryzowało się rozległymi wzrostami w całym zakresie rostalno-ogonowym prążkowia przedporonowego, w porównaniu z gęstościami wiązania u zwierząt kontrolnych nieeksponowanych na lek (Tabela 1; Rysunek 1). W bardziej prążkowiu prążkowanym stężenia były znacznie wyższe w jądrze ogoniastym, w tym grzbietowo-bocznym (+27%), centralny (+27%), dorsomedial (+27%) i ventromedial (+23%) porcje, jak również w grzbietowej (+17%), centralny (+22%) i brzuszny (+23%) części skorupy, w porównaniu z gęstościami zwierząt kontrolnych nieeksponowanych na lek. Znaczące wzniesienia były również widoczne w jądrze półleżącym (+23%) na tym poziomie. Na poziomie prążkowia, gdzie rdzeń i skorupa jądra półleżącego są najbardziej zróżnicowane, gęstości receptorów podobnych do D1 były również znacznie wyższe w całym grzbietowo-bocznym (+31%), centralny (+29%), dorsomedial (+30%) i ventromedial (+18%) jądro ogoniaste, a także grzbietowe (+23%), centralny (+29%) i brzuszny (+28%) skorupa, w porównaniu z gęstościami kontroli nieeksponowanych na lek. Wewnątrz prążkowia brzusznego na tym poziomie stężenie D1 miejsca wiązania receptora były wyższe w jądrze półleżącym (+45%) i powłoki (+20%), jak również w guzku węchowym (+26%), w porównaniu do gęstości w kontrolach.
Rysunek 1.
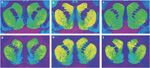 Reprezentatywne autoradiogramy [3H] SCH 23390 wiązanie z receptorami D1 (górny panel) i [3H]WIN 35428 wiąże się z transporterami dopaminy (dolny panel) w przekrojach czołowych prążkowia rezusa. (a, d) Kontroluj zwierzę odpowiadające na wzmocnienie pokarmu. (b, e) Zwierzęce samopodawanie kokainy z abstynencją 30. (c, f) Zwierzęce samopodawanie kokainy z abstynencją 90.
Reprezentatywne autoradiogramy [3H] SCH 23390 wiązanie z receptorami D1 (górny panel) i [3H]WIN 35428 wiąże się z transporterami dopaminy (dolny panel) w przekrojach czołowych prążkowia rezusa. (a, d) Kontroluj zwierzę odpowiadające na wzmocnienie pokarmu. (b, e) Zwierzęce samopodawanie kokainy z abstynencją 30. (c, f) Zwierzęce samopodawanie kokainy z abstynencją 90.
Stężenia [3H]wiązanie raclopridde do receptorów DA D2 w prążkowiu przedkomórkowym przedstawiono w Tabela 2. Specyficzne wiązanie z [3H]racloprid stanowił więcej niż 90% całkowitego wiązania. Dystrybucja [3H]wiązanie raclopridde do receptorów D2 było również niejednorodne w podregionach prążkowia grzbietowego i brzusznego, jak w poprzednich raportach (Moore i wsp, 1998b; Nader i wsp, 2002). W kontrolach nie eksponowanych na lek, wyższe stężenia miejsc wiążących D2 były obecne w grzbiecie w porównaniu z prążkowiem brzusznym. Ponadto istniał dowód gradientu przyśrodkowego do bocznego z wyższymi stężeniami miejsc wiążących obecnych w bardziej bocznych częściach prążkowia.
Po dniach abstynencji 30, poziomy wiązania receptora D2 u zwierząt eksponowanych na kokainę i zwierząt wzmocnionych pokarmem nie różniły się istotnie od siebie w większości regionów prążkowia. Wyższe stężenia miejsc wiążących zaobserwowano w brzusznym skorupie (+10%) i przednie jądro półleżące (+12%) w tkance małp narażonych na kokainę w porównaniu z grupą kontrolną. Nie odnotowano żadnych innych istotnych różnic.
Stężenia [3H]Wiązanie WIN 35428 z DAT w prążkowiu przedkomórkowym pokazano w Tabela 3. Zgodnie z wcześniejszymi raportami (Letchworth i wsp, 2001), wiązanie do miejsc DAT u zwierząt nie eksponowanych na lek było wyższe w grzbiecie w porównaniu z prążkowiem brzusznym. W jądrze półleżącym obserwowano wyższe gęstości w rdzeniu w porównaniu z podziałami skorupy. Wreszcie, niespecyficzne wiązanie stanowiło mniej niż 10% całkowitej.
Po dniach abstynencji 30 od ekspozycji na kokainę, wiązanie z DAT było istotnie wyższe w większości regionów prążkowia od strony spoidła przedniego w porównaniu z wiązaniem u zwierząt kontrolnych nieeksponowanych na lek (Rysunek 1). W szczególności stężenia miejsc wiążących DAT na poziomach rostralnych były znacznie wyższe w ośrodku (+22%), dorsomedial (+25%) i ventromedial (+28%) jądro ogoniaste i grzbietowe (+16%) i centralne (+23%) skorupa, w porównaniu do kontroli wzmocnionych żywnością. Ponadto, było również znacznie wyższe wiązanie z DAT w przednim jądrze półleżącym (+37%) w kokainie - w porównaniu do małp wzmocnionych żywnością. W bardziej ogonowych częściach prążkowia przedkomórkowego gęstości miejsc wiązania DAT były znacznie wyższe w centralnym jądrze ogoniastym (+21%) i skorupa, centralna (+20%) i brzuszny (+19%; Rysunek 1). Wewnątrz prążkowia brzusznego na tym poziomie wiązanie z DAT było istotnie wyższe w jądrze półleżącym (rdzeń półleżący) (+20%) i guzek węchowy (+24%) w tkance z kokainy- vs małpy wzmocnione żywnością.
Skutki abstynencji od przewlekłej samo-administracji kokainą dla 90 Days
W przeciwieństwie do powszechnych różnic w gęstości miejsc wiązania receptora D1 obserwowanych u zwierząt eksponowanych na kokainę po dniach abstynencji 30, po dniach abstynencji 90, nie było znaczących różnic w porównaniu z kontrolami wzmocnionymi przez żywność w jakiejkolwiek części przedkomisyjnej prążkowie (Tabela 1; Rysunek 1). Podobnie, stężenia [3H]wiązanie raclopopride do receptorów DA D2 w prążkowiu przedkomórkowym po dniach abstynencji 90 również nie różniło się istotnie od tych u zwierząt bez ekspozycji na lek (Tabela 2).
Stężenia [3H]Wiązanie WIN 35428 z DAT wykazywało podobny wzór do obserwowanego dla receptorów D1 i D2. Nie zaobserwowano istotnych różnic w gęstości DAT między małpami narażonymi na kokainę po dniach abstynencji 90 w porównaniu z poziomami w grupach kontrolnych nieeksponowanych na lek (Tabela 3; Rysunek 1), chociaż należy zauważyć, że istniał trend w kierunku wyższych poziomów wiązania w przednim jądrze półleżącym.
DYSKUSJA
Wcześniejsze badania z naszej grupy wykazały, że przewlekłemu narażeniu na samopodawanie kokainy towarzyszy znaczne rozregulowanie układu DA u naczelnych innych niż ludzie (Letchworth i wsp, 2001; Moore i wsp, 1998a, 1998b; Nader i wsp, 2002, 2006). Wyniki niniejszego badania pokazują, że ta dysregulacja pozostaje widoczna po zaprzestaniu ekspozycji na kokainę. Po dniach abstynencji 30, stężenia receptorów DA D1 i DAT były znacząco podwyższone w prążkowiu małp z historią przewlekłego samopodawania kokainy w porównaniu z kontrolami wzmocnionymi pokarmem. Jednakże niniejsze badanie dostarcza również wyraźnych dowodów na odzyskanie w obrębie układu DA po dłuższych okresach abstynencji (dni 90), o czym świadczy brak znaczących różnic między eksponowanymi na kokainę i kontrolującymi zwierzętami w tym punkcie czasowym. Dane te sugerują, że ekspozycja na kokainę może nie powodować trwałych zmian w układzie DA, ale może dojść do ożywienia przy przedłużającej się abstynencji od używania narkotyków.
Przedstawiona tu dysregulacja stężeń DAT jest zgodna z wcześniejszymi doniesieniami u naczelnych innych niż ludzie (Letchworth i wsp, 2001), który wykazał znaczne zwiększenie gęstości miejsc wiążących DAT zarówno w prążkowiu brzusznym, jak i grzbietowym. Chociaż nie zostało to dokładnie przetestowane, wydaje się, że po zaprzestaniu ekspozycji na lek podwyższenie gęstości miejsca wiązania DAT jest co najmniej tak samo duże i bardziej rozpowszechnione w regionach prążkowia niż te zgłaszane bez okresu karencji (Letchworth i wsp, 2001). Podobnie, podwyższone stężenia miejsc wiązania receptora D1 obserwowane tutaj po dniach abstynencji 30 są również zgodne z wcześniejszymi badaniami, które wykazały zwiększoną gęstość wiązania receptora podobnego do D1 w prążkowiu naczelnych innych niż ludzie narażonych na identyczny schemat podawania kokainy przez siebie (Nader i wsp, 2002). W przeciwieństwie do tego nie zaobserwowano istotnych różnic między poziomami gęstości wiązania receptora podobnego do D2 w prążkowiu zwierząt eksponowanych na kokainę i zwierząt kontrolnych. Ten brak rozregulowania był obecny, pomimo dużego spadku stężeń receptorów D2, które odnotowano u obu osób uzależnionych (Volkow i wsp, 1993) i zwierzęce modele kokainy samopodawającej (Moore i wsp, 1998a, 1998b; Nader i wsp, 2002, 2006). Obecne dane sugerują zatem szybszą normalizację do poziomów kontroli w tym systemie w porównaniu z receptorami podobnymi do D1 i DAT. Podsumowując, zmiany w receptorach DA i DAT wyraźnie pokazują, że okres bezpośrednio po zaprzestaniu samodzielnego podawania kokainy jest wysoce labilny, ze znacznymi zmianami w regulacji systemu DA, ale po tym następuje ponowna regulacja system zbliża się do bardziej normalnego rozkładu receptorów DA i DAT po dłuższej abstynencji.
Zmiany receptora D1
Obserwowane tutaj powszechne zwiększenie gęstości receptorów D1 po zaprzestaniu zażywania kokainy jest zgodne z doniesieniami wykazującymi zwiększoną wrażliwość receptorów D1 podczas odstawienia. Pomiar czułości D1 przeprowadzono w badaniu przez Henry and White (1991), w którym stwierdzono, że pojedyncze jednostki neuronów w jądrze półleżącym są bardziej wrażliwe na agonistę receptora D1 SKF 38393 po przewlekłych codziennych wstrzyknięciach kokainy w porównaniu z kontrolami traktowanymi solanką. Ten efekt był trwały, ponieważ zwiększona wrażliwość pozostawała widoczna do jednego miesiąca po odstawieniu. Autorzy postawili hipotezę, że uczulenie receptora D1 było spowodowane wrażliwością autoreceptora D2 w somatodendrytycznym obszarze A10, zmniejszając tym samym przepływ impulsów hamujących w układzie DA mesoaccumbens (Henry i biały, 1991). Dane z niniejszego badania sugerują zwiększenie miejsc wiązania receptora D1 w abstynencji, co mogłoby wyjaśnić tę zwiększoną wrażliwość neuronów dopaminergicznych na bezpośrednio działającego agonistę receptora D1. Ponadto, zwiększony wpływ SKF 38393 na neurony jądra półleżącego nie był widoczny dwa miesiące po odstawieniu, co sugeruje, że nastąpiło odzyskanie wrażliwości receptora D1 (Henry i biały, 1991); wynik zgodny z odzyskiwaniem gęstości receptora D1 odnotowany w niniejszym badaniu po dniach abstynencji 90. Inne doniesienia potwierdzają również ważną rolę receptorów D1 w nawrotach. Bezpośrednia stymulacja receptorów D1 w skorupie jądra półleżącego może przywrócić poszukiwanie kokainy u abstynentnych gryzoni (Schmidt i wsp, 2006). Jednakże literatura jest nieco niespójna w tym, że agoniści i antagoniści D1 mogą osłabiać poszukiwanie leków wywoływane przez bodźce kokainowe lub bodźce związane z kokainą (Alleweireldt i wsp, 2002; De Vries i wsp, 1999; Khroyan i wsp, 2000; Samego siebie i wsp, 1996; Biały i wsp, 2001). Niedawno, Khroyan i wsp (2003) donieśli, że agoniści i antagoniści D1 zmniejszają nawrót w nieludzkim modelu poszukiwania kokainy przez naczelnych. Autorzy ci zasugerowali, że może istnieć krytyczny zakres aktywności receptora D1 niezbędny do poszukiwania kokainy, i że zarówno antagoniści, jak i agoniści mogą przesunąć aktywność z tego okna. Zwiększone stężenia receptorów D1, które towarzyszą abstynencji, mogą modyfikować ten zakres, powodując zmianę czułości tego systemu. Inną kwestią jest to, że aktywność D1 może działać w celu modulowania aktywności w receptorach D2 (Nolan i wsp, 2007; Ruskin i wsp, 1999; Walters i wsp, 1987). Obecne dane sugerują, że stosunek D1 do receptorów D2 zmienia się w trakcie abstynencji i może w ten sposób zmieniać skuteczność tej modulacji.
Chociaż, w przeciwieństwie do obecnych danych, pojawiły się doniesienia o obniżonym poziomie receptorów D1 po przewlekłym samopodawaniu kokainy (Moore i wsp, 1998a) istnieją znaczne różnice między tymi badaniami, takie jak dawka i długość narażenia na kokainę, całkowite spożycie i porównawcze grupy kontrolne. Podsumowując, zbieżne dowody silnie wskazują, że system D1 podlega znacznym zmianom po wycofaniu się z chronicznego podawania kokainy.
Zmiany transportera dopaminy
Wyniki podwyższonych stężeń DAT w prążkowiu zwierząt narażonych na kokainę po zaprzestaniu zażywania narkotyków poszerzają te z naszych wcześniejszych badań wykazujących zwiększone poziomy miejsc wiążących DAT, które towarzyszą samopodawaniu kokainy u naczelnych innych niż ludzie. Obecne dane pokazują, że ta dysregulacja utrzymuje się w początkowych fazach abstynencji. Ponadto sugerują, że powrót do poziomów kontrolnych następuje po stosunkowo długim czasie (do 90 dni w niniejszym badaniu). W naszych poprzednich badaniach wykazaliśmy, że chociaż początkowo ograniczone do w większości brzusznych regionów prążkowia, zmiany w gęstości miejsc wiążących DAT rozszerzyły się, obejmując więcej grzbietowych i dziobowych części prążkowia z dłuższymi okresami ekspozycji na kokainę (Letchworth i wsp, 2001; Porrino i wsp, 2004). W niniejszym badaniu powrót do poziomów kontrolnych stężeń DAT podczas abstynencji okazał się większy i szybszy w prążkowiu grzbietowym niż w prążkowiu brzusznym, a zatem wydawał się podążać odwrotną trajektorią anatomiczną do wzorca efektów wywołanych przewlekłą ekspozycją na kokainę .
Obecne dane są również zgodne z raportami dotyczącymi osób używających kokainy (Mało i wsp, 1999; Malison i wsp, 1998; Zacier i wsp, 2002; Staley i wsp, 1994), które wykazały podwyższony poziom wiązania z miejscami DAT w prążkowiu w porównaniu z grupą kontrolną, przy czym najbardziej znaczący wzrost znajdował się w prążkowiu brzusznym. Ostatnio wykazano, że wzrostom tym towarzyszy znaczące zmniejszenie wiązania pęcherzykowego transportera monoamin 2 (VMAT2) (Mało i wsp, 2003), sugerując rzeczywistą utratę neuronów DA. Autorzy doszli do wniosku, że podwyższone DAT jest prawdopodobne bezpośrednio z powodu kompensacyjnej odpowiedzi na farmakologiczną blokadę kokainą, podczas gdy spadek VMAT2 bardziej odzwierciedlał ogólne zmiany w metabolizmie DA, co skutkowało funkcją hipodopaminergiczną.
Doniesiono, że osoby uzależnione od kokainy mają obniżone stężenia DA w prążkowiu brzusznym, jak zmierzono za pomocą PET, w odpowiedzi na prowokację metylofenidatem w porównaniu ze zdrowymi kontrolami (Volkow i wsp, 1997). Niedawno, Martinez i wsp (2007) stwierdzili, że osoby zażywające kokainę miały tępą reakcję na prowokację amfetaminą w prążkowiu brzusznym i skorupie. Co więcej, ten spadek uwalniania DA wywołanego przez amfetaminę był skorelowany z wyborem kokainy w oddzielnych sesjach samodzielnego podawania, tak że ci użytkownicy o najniższym stopniu uwalniania DA w odpowiedzi na amfetaminę najprawdopodobniej wybrali kokainę w porównaniu z alternatywnym wzmocnieniem (Martinez i wsp, 2007). Ostatnie badania nad modelami używania kokainy przez gryzonie potwierdzają ten pomysł. Mateo i wsp (2005)na przykład zgłosił, że ekspozycja na przewlekłe samopodawanie kokainy wiąże się ze zmianami w funkcji DAT. Ci badacze wykazali, że wyjściowy wychwyt DA był zwiększony, co skutkowało szybszym klirensem synaptycznej DA, a zatem zmniejszeniem podstawowych poziomów pozakomórkowej DA lub stanu hipodopaminergicznego. Zatem jest prawdopodobne, że zwiększone stężenia DAT po wycofaniu się z chronicznego samopodawania kokainy obserwowane w niniejszym badaniu stanowią odpowiedź kompensacyjną, co skutkuje niższymi wyjściowymi poziomami pozakomórkowej DA.
Zmiany receptora D2
Jednym z wyników niniejszego badania było to, że stężenia poziomów receptora D2 powróciły do wartości kontrolnych po dniach abstynencji 30, w porównaniu ze znaczącymi spadkami obserwowanymi u zwierząt bez okresu karencji (Nader i wsp, 2002). W przeciwieństwie do obecnego badania, badania obrazowe u ludzi ogólnie wykazały, że poziomy receptora D2 są niższe niż u osób kontrolnych po długotrwałej abstynencji od chronicznej ekspozycji na kokainę (Martinez i wsp, 2004; Volkow i wsp, 1993). Potencjalne wyjaśnienia różnic między tymi ludzkimi badaniami a obecnym nieludzkim badaniem naczelnych obejmują różnice we wzorze i czasie trwania przyjmowania kokainy, a także możliwość wcześniejszego obniżenia poziomów receptorów D2 u ludzi uzależnionych.
Zgodnie z tym ostatnim pomysłem istnieją dowody sugerujące, że niższe podstawowe poziomy receptorów D2 u zdrowych ludzi przewidują zwiększoną skuteczność wzmacniającą stymulantów, takich jak metylofenatiVolkow i wsp, 1999) i podobnie u małp, poziomy wyjściowe receptorów D2 przewidywały skłonność do samodzielnego podawania kokainy (Morgan i wsp, 2002; Nader i wsp, 2006). Zgodnie z równoległym charakterem tych odkryć w odniesieniu do różnych gatunków, zarówno ludzkich (Volkow i wsp, 1993) i naczelnych nieludzkich (Nader i wsp, 2006) badania obrazowe wykazały niższy poziom dostępności receptora D2 po abstynencji od ekspozycji na kokainę. Warto zauważyć, że harmonogram samodzielnego podawania kokainy w tym ostatnim eksperymencie (Nader i wsp, 2006) był podobny do harmonogramu wzmocnienia zastosowanego w tym badaniu. W związku z tym mało prawdopodobne jest, aby odmienne wyniki tych dwóch badań były spowodowane różnicami metodologicznymi, takimi jak harmonogram wzmocnienia lub skumulowane spożycie podczas samodzielnego podawania kokainy.
Bardziej prawdopodobne wyjaśnienie dotyczy dynamiki funkcjonalnej systemu DA. Miary dostępności receptora D2 z PET zostały opisane jako „funkcjonalne”, ponieważ sygnał jest związany z ilością białka (w tym przypadku gęstości receptorów D2) i poziomem krążącego neuroprzekaźnika (Patrz Laruelle, 2000; Nader i Czoty, 2008 do dalszej dyskusji). jaW przeciwieństwie do tego autoradiografia receptora nie jest zanieczyszczona przez krążące poziomy DA. Zatem niniejsze badanie, wraz z naszą wcześniejszą pracą, sugeruje, że gęstość receptora D2 jest zmniejszona przez samo-podawanie kokainy, ale poziomy receptorów wydają się odzyskiwać podczas abstynencji. W podobnie przeprowadzonym badaniu PET (Nader i wsp, 2006), odzyskiwanie odnotowano u trzech z pięciu małp. Obecne odkrycia sugerują, że te małpy prawdopodobnie nie różniły się gęstościami receptora D2, ale być może reakcja układu DA (tj. Poziomy krążącej DA podczas abstynencji) różnicowała między osobnikami „odzyskanymi” i „nieodkrytymi”.
Ograniczenia
Ważnym ograniczeniem obecnych badań jest to, że nasze badania nie mogą dotyczyć funkcjonalności receptorów D1 i D2 ani DAT. Zamiast tego zbadaliśmy tylko zmiany gęstości białek receptorowych. Chociaż wyniki mają implikacje dla potencjalnych ról tych systemów, konieczne będą dalsze badania, aby rzucić światło na konsekwencje behawioralne przedstawionych tu zmian. Innym ograniczeniem niniejszego badania jest to, że ligandy autoradiograficzne często nie dysocjują między wewnątrzkomórkowymi i cytoplazmatycznymi lokalizacjami swoich celów, ponieważ radioznakowani antagoniści są często przepuszczalni dla błon. Mało i wsp (2002) wykazali, że przewlekła ekspozycja na kokainę prowadzi do znacznego zwiększenia DAT na powierzchni błony, równocześnie ze zmniejszeniem wewnątrzkomórkowego stężenia DAT, w transfekowanych komórkach. Niedawno, Samuvel i wsp (2008) zgłaszali podobne odkrycie w preparatach synaptosomalnych prążkowia szczura. Wyniki te sugerują, że zmiany w rozkładzie DAT obserwowane w niniejszym badaniu mogą reprezentować zmiany na powierzchni błony, a nie miejsca wewnątrzkomórkowe.
Wreszcie, należy zachować ostrożność w interpretacji badań dotyczących przedłużonej abstynencji (dni 90), ponieważ wyniki te opierały się na stosunkowo małej grupie zwierząt (N=3). Pomimo niewielkiej liczby badanych dane uzyskane z tej grupy były raczej spójne, co widać na wykresie rozproszonym pokazanym w Rysunek 2. Stężenie miejsc wiązania receptora D1 w prążkowiu wykazało niewielką zmienność w obrębie grup, co sugeruje wiarygodność tych wyników. Podobna konsystencja była również widoczna w danych z testów wiązania D2 i DAT. Chociaż należy zachować ostrożność, dane te silnie sugerują, że przywrócenie stężeń receptorów DAT i DA w prążkowiu może wystąpić przy przedłużonej abstynencji.
Rysunek 2.
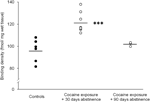 Gęstości wiązania receptorów D1 dla poszczególnych zwierząt uśredniano w całym prążkowiu po wzmocnieniu żywności (kontrole) lub abstynencji 30 lub 90 od przewlekłego samopodawania kokainy. Środki dla grup są przedstawione czarnymi paskami, ***p<0.001 w porównaniu z kontrolami wzmocnionymi żywnością.
Gęstości wiązania receptorów D1 dla poszczególnych zwierząt uśredniano w całym prążkowiu po wzmocnieniu żywności (kontrole) lub abstynencji 30 lub 90 od przewlekłego samopodawania kokainy. Środki dla grup są przedstawione czarnymi paskami, ***p<0.001 w porównaniu z kontrolami wzmocnionymi żywnością.
WNIOSKI
Podsumowując, ekspozycja na samopodawanie kokainy spowodowała znaczące zmiany w regulacji systemów DA, które utrzymywały się we wczesnych fazach (pierwszych dniach 30) abstynencji. Było to najbardziej widoczne w regulacji stężenia receptorów D1 i DAT, zarówno pod względem wielkości zmian, jak i zasięgu topograficznego. W przeciwieństwie do tego, istniały dowody na normalizację z dłuższymi okresami abstynencji od ekspozycji na kokainę, ponieważ stężenia receptorów DAT, D1 i D2 po dniach abstynencji 90 nie różniły się od tych dla kontroli nie eksponowanych na lek. TJednak systemy hese niekoniecznie podążają za tym samym kursem odzyskiwania, co sugeruje, że istnieje pewna niestabilność w regulacji poziomów DA szczególnie wcześnie w abstynencji. Ta dysregulacja dopaminergiczna może wpływać na skuteczność każdej potencjalnej farmakoterapii podawanej abstynentom uzależnionym od kokainy, zwłaszcza jeśli lek opiera się na systemie DA dla jego mechanizmu działania.
Referencje
- Alleweireldt AT, Weber SM, Kirschner KF, Bullock BL, Neisewander JL (2002). Blokada lub stymulacja receptorów dopaminowych D1 łagodzi przywrócenie wskazań wygaszonego zachowania poszukiwania kokainy u szczurów. Psychofarmakologia (Berl) 159: 284–293. | Artykuł | PubMed | ChemPort |
- Beveridge TJ, Smith HR, Daunais JB, Nader MA, Porrino LJ (2006). Przewlekłe samopodawanie kokainy wiąże się ze zmienioną aktywnością funkcjonalną płatów skroniowych naczelnych innych niż ludzie. Eur J Neurosci 23: 3109–3118. | Artykuł | PubMed |
- Canfield DR, Spealman RD, Kaufman MJ, Madras BK (1990). Autoradiograficzna lokalizacja miejsc wiązania kokainy przez [3H] CFT ([3H] WIN 35428) w mózgu małpy. Synapse 6: 189–195. | Artykuł | PubMed | ChemPort |
- De Vries TJ, Schoffelmeer AN, Binnekade R, Vanderschuren LJ (1999). Mechanizmy dopaminergiczne pośredniczące w zachęcaniu do poszukiwania kokainy i heroiny po długotrwałym odstawieniu leku dożylnego. Psychofarmakologia (Berl) 143: 254–260. | Artykuł | PubMed | ChemPort |
- Farfel GM, Kleven MS, Woolverton WL, Seiden LS, Perry BD (1992). Wpływ powtarzanych wstrzyknięć kokainy na miejsca wiązania receptora katecholaminowego, miejsca wiązania transportera dopaminy i zachowanie u małpy rezus. brain Res 578: 235–243. | Artykuł | PubMed | ChemPort |
- Graham J, Porrino LJ (1995). Substraty neuroanatomiczne samo-administracji kokainy. CRC: Boca Raton, FL.
- Hemby SE, Co C, Koves TR, Smith JE, Dworkin SI (1997). Różnice w pozakomórkowych stężeniach dopaminy w jądrze półleżącym podczas podawania kokainy zależnej od odpowiedzi i niezależnej od odpowiedzi u szczura. Psychofarmakologia (Berl) 133: 7–16. | Artykuł | PubMed | ChemPort |
- Henry DJ, White FJ (1991). Powtarzane podawanie kokainy powoduje trwałe zwiększenie wrażliwości receptora dopaminy D1 w jądrze półleżącym szczura. J Pharmacol Exp Ther 258: 882–890. | PubMed | ChemPort |
- Jacobsen LK, Staley JK, Malison RT, Zoghbi SS, Seibyl JP, Kosten TR i wsp (2000). Zwiększona dostępność wiązania centralnego transportera serotoniny u ostro abstynentnych pacjentów uzależnionych od kokainy. Am J Psychiatry 157: 1134–1140. | Artykuł | PubMed | ISI | ChemPort |
- Khroyan TV, Barrett-Larimore RL, Rowlett JK, Spealman RD (2000). Mechanizmy receptora dopaminowego D1 i D2-podobnego w nawrocie do zachowania poszukującego kokainy: działanie selektywnych antagonistów i agonistów. J Pharmacol Exp Ther 294: 680–687. | PubMed | ISI | ChemPort |
- Khroyan TV, Platt DM, Rowlett JK, Spealman RD (2003). Osłabienie nawrotu do poszukiwania kokainy przez agonistów i antagonistów receptora dopaminy D1 u naczelnych innych niż ludzie. Psychofarmakologia (Berl) 168: 124–131. | Artykuł | PubMed | ChemPort |
- Laruelle M (2000). Obrazowanie neurotransmisji synaptycznej za pomocą in vivo wiążące techniki konkursowe: przegląd krytyczny. J Cereb Blood Flow Metab 20: 423–451. | Artykuł | PubMed | ISI | ChemPort |
- Letchworth SR, Nader MA, Smith HR, Friedman DP, Porrino LJ (2001). Postęp zmian gęstości miejsca wiązania transportera dopaminy w wyniku samopodawania kokainy u małp rezus. J Neurosci 21: 2799–2807. | PubMed | ISI | ChemPort |
- Lidow MS, Goldman-Rakic PS, Gallager DW, Rakic P (1991). Dystrybucja receptorów dopaminergicznych w korze mózgowej naczelnych: ilościowa analiza autoradiograficzna z zastosowaniem [3H] raclopopride, [3H] spiperonu i [3H] SCH 23390. Neuroscience 40: 657–671. | Artykuł | PubMed | ChemPort |
- Little KY, Elmer LW, Zhong H, Scheys JO, Zhang L (2002). Indukcja kokainy w transporcie dopaminy do błony plazmatycznej. Mol Pharmacol 61: 436–445. | Artykuł | PubMed | ISI | ChemPort |
- Little KY, Królewski DM, Zhang L, Cassin BJ (2003). Utrata pęcherzykowego białka transportera monoaminowego prążkowia (VMAT2) u użytkowników kokainy ludzkiej. Am J Psychiatry 160: 47–55. | Artykuł | PubMed |
- Little KY, Zhang L, Desmond T, Frey KA, Dalack GW, Cassin BJ (1999). Zaburzenia dopaminergiczne prążkowia u osób zażywających kokainę u ludzi. Am J Psychiatry 156: 238–245. | PubMed | ChemPort |
- Malison RT, Best SE, van Dyck CH, McCance EF, Wallace EA, Laruelle M i wsp (1998). Podwyższony transporter dopaminy w prążkowiu podczas ostrej abstynencji kokainowej, mierzony za pomocą [123I] beta-CIT SPECT. Am J Psychiatry 155: 832–834. | PubMed | ChemPort |
- Martinez D, Broft A, Foltin RW, Slifstein M, Hwang DR, Huang Y i wsp (2004). Uzależnienie od kokainy i dostępność receptora d2 w podjednostkach funkcjonalnych prążkowia: związek z zachowaniem szukającym kokainy. Neuropsychopharmacology 29: 1190–1202. | Artykuł | PubMed | ISI | ChemPort |
- Martinez D, Narendran R, Foltin RW, Slifstein M, Hwang DR, Broft A i wsp (2007). Uwolnienie dopaminy wywołane przez amfetaminę: wyraźnie ograniczone w uzależnieniu od kokainy i przewidywanie wyboru samopodawania kokainy. Am J Psychiatry 164: 622–629. | Artykuł | PubMed | ISI |
- Mash DC, Pablo J, Ouyang Q, Hearn WL, Izenwasser S (2002). Funkcja transportu dopaminy jest podwyższona u osób zażywających kokainę. J. Neurochem 81: 292–300. | Artykuł | PubMed | ChemPort |
- Mateo Y, brak CM, Morgan D, Roberts DC, Jones SR (2005). Zmniejszona końcowa funkcja dopaminy i niewrażliwość na kokainę w następstwie samozaparcia i deprywacji kokainy. Neuropsychopharmacology 30: 1455–1463. | Artykuł | PubMed | ISI | ChemPort |
- Melega WP, Jorgensen MJ, Lacan G, Way BM, Pham J, Morton G i wsp (2008). Długotrwałe podawanie metamfetaminy w modelach małpiego aspektu narażenia człowieka: neurotoksyczność mózgu i profile behawioralne. Neuropsychopharmacology 33: 1441–1452. | Artykuł | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998a). Wpływ samopodawania kokainy na receptory dopaminy D1 w prążkowiu u małp rezus. Synapse 28: 1–9. | Artykuł | PubMed | ChemPort |
- Moore RJ, Vinsant SL, Nader MA, Porrino LJ, Friedman DP (1998b). Wpływ samopodawania kokainy na receptory dopaminy D2 u małp rezus. Synapse 30: 88–96. | Artykuł | PubMed | ChemPort |
- Morgan D, Grant KA, Gage HD, Mach RH, Kaplan JR, Prioleau O i wsp (2002). Dominacja społeczna u małp: receptory dopaminy D2 i kokaina samopodawanie. Nat Neurosci 5: 169–174. | Artykuł | PubMed | ISI | ChemPort |
- Nader MA, Czoty PW (2008). Obrazowanie mózgu u naczelnych innych niż ludzie: wgląd w uzależnienie od narkotyków. ILAR J 49: 89–102. | PubMed | ChemPort |
- Nader MA, Daunais JB, Moore T, Nader SH, Moore RJ, Smith HR i wsp (2002). Wpływ samopodawania kokainy na układy dopaminowe prążkowia u małp rezus: początkowe i przewlekłe narażenie. Neuropsychopharmacology 27: 35–46. | Artykuł | PubMed | ISI | ChemPort |
- Nader MA, Morgan D, Gage HD, Nader SH, Calhoun TL, Buchheimer N i wsp (2006). Obrazowanie PET receptorów dopaminy D2 podczas przewlekłego samopodawania kokainy u małp. Nat Neurosci 9: 1050–1056. | Artykuł | PubMed | ChemPort |
- Nolan EB, Harrison LM, Lahoste GJ, Ruskin DN (2007). Synergizm behawioralny między receptorami dopaminy D (1) i D (2) u myszy nie zależy od połączeń szczelinowych. Synapse 61: 279–287. | Artykuł | PubMed | ChemPort |
- Porrino LJ, Lyons D, Miller MD, Smith HR, Friedman DP, Daunais JB i wsp (2002). Mapowanie metaboliczne skutków kokainy w początkowych fazach samopodawania u naczelnych nie będących ludźmi. J Neurosci 22: 7687–7694. | PubMed | ChemPort |
- Porrino LJ, Lyons D, Smith HR, Daunais JB, Nader MA (2004). Samo podawanie kokainy powoduje postępujące zaangażowanie domen limbicznych, asocjacyjnych i sensomotorycznych prążkowia. J Neurosci 24: 3554–3562. | Artykuł | PubMed | ISI | ChemPort |
- Ruskin DN, Bergstrom DA, Walters JR (1999). Wielosekundowe oscylacje szybkości zapłonu w globusie bladym: modulacja synergiczna przez receptory dopaminy D1 i D2. J Pharmacol Exp Ther 290: 1493–1501. | PubMed | ISI | ChemPort |
- Samuvel DJ, Jayanthi LD, Manohar S, Kaliyaperumal K, Zobacz RE, Ramamoorthy S (2008). Deregulacja transportu transporterów dopaminy i funkcjonowanie po abstynencji od samokontroli kokainy u szczurów: dowody na różnicowanie regulacji w skorupie ogoniastej i jądrze półleżącym. J Pharmacol Exp Ther 325: 293–301. | Artykuł | PubMed | ChemPort |
- Schmidt HD, Anderson SM, Pierce RC (2006). Stymulacja receptorów dopaminowych podobnych do D1 lub D2 w skorupie, ale nie w rdzeniu jądra półleżącego, przywraca u szczurów zachowanie poszukiwania kokainy. Eur J Neurosci 23: 219–228. | Artykuł | PubMed |
- Self DW, Barnhart WJ, Lehman DA, Nestler EJ (1996). Przeciwna modulacja zachowania poszukiwania kokainy przez agonistów receptora dopaminy D1 i D2. nauka 271: 1586–1589. | Artykuł | PubMed | ISI | ChemPort |
- Staley JK, Hearn WL, Ruttenber AJ, Wetli CV, Mash DC (1994). Miejsca rozpoznawania kokainy o wysokim powinowactwie na transporcie dopaminy są podwyższone u ofiar śmiertelnego przedawkowania kokainy. J Pharmacol Exp Ther 271: 1678–1685. | PubMed | ChemPort |
- Volkow ND, Fowler JS, Wang GJ, Hitzemann R, Logan J, Schlyer DJ i wsp (1993). Zmniejszona dostępność receptora dopaminy D2 jest związana ze zmniejszonym metabolizmem czołowym u osób nadużywających kokainy. Synapse 14: 169–177. | Artykuł | PubMed | ISI | ChemPort |
- Volkow ND, Wang GJ, Fowler JS, Logan J, Gatley SJ, Gifford A i wsp (1999). Przewidywanie wzmocnienia reakcji na psychostymulanty u ludzi przez poziomy receptora dopaminy D2 w mózgu. Am J Psychiatry 156: 1440–1443. | PubMed | ISI | ChemPort |
- Volkow ND, Wang GJ, Fowler JS, Logan J, Gatley SJ, Hitzemann R i wsp (1997). Zmniejszona odpowiedź dopaminergiczna prążkowia u osobników uzależnionych od kokainy. Natura 386: 830–833. | Artykuł | PubMed | ISI | ChemPort |
- Walters JR, Bergstrom DA, Carlson JH, Chase TN, Braun AR (1987). Aktywacja receptora dopaminy D1 wymagana do postsynaptycznej ekspresji działania agonisty D2. nauka 236: 719–722. | Artykuł | PubMed | ChemPort |
- Weiss F, Martin-Fardon R, Ciccocioppo R, Kerr TM, Smith DL, Ben-Shahar O (2001). Trwała odporność na wygaszanie zachowań związanych z poszukiwaniem kokainy wywołanych sygnałami związanymi z narkotykami. Neuropsychopharmacology 25: 361–372. | Artykuł | PubMed | ISI | ChemPort |
- Wong DF, Kuwabara H, Schretlen DJ, Bonson KR, Zhou Y, Nandi A i wsp (2006). Zwiększone obłożenie receptorów dopaminowych w prążkowiu ludzkim podczas wywołanego przez cue pragnienia kokainy. Neuropsychopharmacology 31: 2716–2727. | Artykuł | PubMed | ChemPort |
![Tabela 1 - Wpływ dni abstynencji 30 lub 90 po przewlekłym samopodawaniu kokainy na gęstości [lsqb] 3H [rsqb] Wiązanie SCH 23390 do receptorów D1 w prążkowiu prekommissuralnym małp rezus - Niestety nie jesteśmy w stanie zapewnić dostępnego tekstu alternatywnego dla to. Jeśli potrzebujesz pomocy, aby uzyskać dostęp do tego obrazu, skontaktuj się z help@nature.com lub autorem](https://yourbrainonporn.com/wp-content/uploads/2020/01/table_thumb.gif)
