UWAGI: Doskonały przegląd prawie wszystkich istotnych badań dotyczących receptorów androgenowych, dopaminy i funkcji seksualnych. Fantastyczne rysowanie wzajemnych relacji między podwzgórzem a nagrodą.
Horm Behav. 2008 May; 53(5): 647-658.
Opublikowane online 2008 February 13. doi: 10.1016 / j.yhbeh.2008.01.010
Abstrakcyjny
Dorastanie wiąże się ze wzrostem zachowań poszukujących przyjemności, które z kolei są kształtowane przez dojrzewanie płciowe osi podwzgórze-przysadka-gonad. W zwierzęcych modelach naturalnie nagradzających zachowań, takich jak seks, androgeny jąder przyczyniają się do rozwoju i ekspresji zachowania u mężczyzn. Aby wywołać dojrzewanie behawioralne, mózg ulega znacznej przebudowie w okresie dojrzewania, a wiele zmian jest również wrażliwych na androgeny, przypuszczalnie działające poprzez receptory androgenowe (AR). Biorąc pod uwagę delikatną interakcję hormonów gonadalnych i rozwoju mózgu, nie jest niespodzianką, że zaburzenia poziomu hormonów w tym wrażliwym okresie znacząco zmieniają zachowania nastolatków i dorosłych. U samców chomików ekspozycja na testosteron w okresie dojrzewania jest wymagana do normalnego wyrażania dorosłych zachowań seksualnych. Samce pozbawione androgenów w okresie dojrzewania wykazują utrzymujące się niedobory w kryciu. I odwrotnie, same androgeny nie są wystarczające do wywołania krycia u samców przed okresem dojrzewania, nawet jeśli AR mózgu są obecne przed okresem dojrzewania. W tym kontekście szeroko rozpowszechnione stosowanie steroidów anaboliczno-androgennych (AAS) w okresie dojrzewania jest istotnym problemem. Nadużywanie AAS może zmienić zarówno czas, jak i poziom androgenów u nastolatków. U chomików ekspozycja młodzieży na AAS zwiększa agresję i powoduje trwałe zmiany w układach neuroprzekaźników. Ponadto AAS same się wzmacniają, czego dowodem jest samodzielne podawanie testosteronu i innych AAS. Jednak ostatnie dowody sugerują, że wzmacniające działanie androgenów może nie wymagać klasycznego AR. Dlatego też, dla lepszego zrozumienia nadużywania AAS, konieczne jest dalsze badanie interakcji między androgenami a zachowaniami nagradzającymi w mózgu nastolatka.
Przegląd
Dojrzewanie budzi mózg zarówno do przyjemności, jak i ryzyka. W ludzkich nastolatkach często przybiera to formę eksperymentowania z narkotykami i seksem. W Stanach Zjednoczonych średni wiek pierwszego stosunku u mężczyzn wynosi 16.4 lat, a 65% ma stosunek płciowy w klasie 12th (Kaiser Family Foundation, 2005). Podobnie ta populacja ma najwyższe wskaźniki nielegalnego zażywania narkotyków w Stanach Zjednoczonych. Według 2004 National Survey on Drug Use and Health, 38% mężczyzn w wieku 18 – 25 użył nielegalnego narkotyku w ubiegłym roku (SAMHSA / OAS, 2005). Ponadto 31% nastoletnich chłopców używał narkotyków lub alkoholu podczas ostatniego spotkania seksualnego (Kaiser Family Foundation, 2005). Ponadto okres dojrzewania jest kluczowym czasem w etiologii niektórych psychopatologii, takich jak depresja, lęk, zaburzenia jedzenia i zaburzenia zachowania. Zakładamy, że dojrzewanie płciowe hormonów gonadalnych, ich aktywacja receptorów steroidowych w mózgu oraz interakcja między hormonem a doświadczeniem w rozwoju mózgu nastolatków przyczyniają się do zmian behawioralnych obserwowanych w okresie dojrzewania.
Naszym celem jest dokonanie przeglądu dowodów na to, że androgeny gonadalne pośredniczą w dojrzewaniu młodzieży i osiągnięciach motywowanych zachowań u dorosłych, jak również w nagradzających właściwościach tych zachowań. Prezentujemy również dowody, że sam testosteron jest satysfakcjonujący, co prawdopodobnie przyczynia się do dojrzałych zmian zachowań motywowanych w okresie dojrzewania, kiedy poziom testosteronu wzrasta. W niniejszym artykule skupiono się na naszych badaniach obwodów nerwowych leżących u podstaw męskich zachowań seksualnych, zwłaszcza w chomiku syryjskim, ze szczególnym uwzględnieniem interakcji między testosteronem i dopaminą (DA). Proponujemy, aby androgeny płciowe miały zarówno przejściowy, jak i długoterminowy wpływ na obwody nagrody i zmotywowane zachowania. Dalej stawiamy hipotezę, że suplementacja egzogennymi androgenami w postaci steroidów anaboliczno-androgennych (AAS) zwiększa normalne wpływy dojrzewania androgenów, wpływając negatywnie na rozwój mózgu i zachowania nastolatków.
Dojrzewanie jako wrażliwy okres rozwoju mózgu
Ostatecznie mózg jest zarówno wyzwalaczem, jak i celem działania androgenów w okresie dojrzewania. U młodych chłopców (<12 lat) i młodych chomików (<28 dni) krążące androgeny i gonadotropiny są na poziomie podstawowym. Ponieważ wydzielanie hormonu luteinizującego z przedniego płata przysadki wzrasta w odpowiedzi na hormon uwalniający gonadotropiny w podwzgórzu, stężenie krążącego testosteronu znacznie wzrasta. Dzieje się tak u chłopców w stadium II / III Tannera (14 lat) i chomików w wieku 28 dni. Zanim chłopcy osiągną IV / V stadium Tannera (ok. 16 lat) lub gdy chomiki są w wieku 50–60 dni, poziom endogennego testosteronu jest w zakresie dorosłego mężczyzny. Wydzielanie hormonów w okresie dojrzewania przypada na okres dojrzewania, który u ludzi przypada od około 12 do 20 lat. Hormony dojrzewania oddziałują nie tylko na tkanki obwodowe, powodując pojawienie się drugorzędowych cech płciowych, które są jawnymi oznakami dojrzewania, ale działają również centralnie, wpływając zarówno na przebudowę mózgu nastolatka, jak i na dojrzewanie behawioralne. Co więcej, fizjologiczne i neurologiczne zmiany wywołane przez hormony dojrzewania prowadzą do znaczących zmian w doświadczeniach jednostki, które same w sobie mogą głęboko zmienić przebieg rozwoju mózgu. Zatem wzrost w okresie dojrzewania płciowych hormonów steroidowych, napędzany dojrzewaniem w czasie rozwojowej osi neuroendokrynnej rozrodczej, z kolei kształtuje rozwój behawioralny nastolatków poprzez bezpośredni i pośredni wpływ na układ nerwowy.
Ludzki okres dojrzewania jest obecnie uznawany za główny i dynamiczny okres rozwoju neuronów, podczas którego układy behawioralne są przebudowywane i udoskonalane. Chociaż mózg 5-letniego dziecka jest już 90% jego dorosłego rozmiaru (Dekaban, 1978), znaczna przebudowa jest jeszcze przed nami. Koncepcja ta została zapoczątkowana przez badania zarówno na ludziach, jak i zwierzętach, dokumentujące, że wiele podstawowych procesów rozwojowych zachodzących podczas rozwoju mózgu okołoporodowego jest podsumowywane w okresie dojrzewania. Procesy te obejmują neurogenezę (Eckenhoff i Rakic, 1988; On i Crews, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia i Guillamon, 2001; Rankin, Partlow, McCurdy, Giles i Fisher, 2003), Zaprogramowana śmierć komórki (Nunez, Lauschke i Juraska, 2001; Nunez, Sodhi i Juraska, 2002), opracowywanie i przycinanie arborizacji i synaps dendrytycznych (Andersen, Rutstein, Benzo, Hostetter i Teicher, 1997; Huttenlocher i Dabholkar, 1997; Lenroot i Giedd, 2006; Sowell, Thompson, Leonard, Welcome, Kan i Toga, 2004), mielinizacja (Benes, Turtle, Khan i Farol, 1994; Paus, Collins, Evans, Leonard, Pike i Zijdenbos, 2001; Sowell, Thompson, Tessner i Toga, 2001) i zróżnicowanie seksualne (Chung, De Vries i Swaab, 2002; Davis, Shryne i Gorski, 1996; Nunez i in., 2001). Tak więc trajektoria rozwojowa mózgu postnatalnego nie jest liniowa, ale charakteryzuje się gwałtownymi zmianami nastolatków i obejmuje zarówno wydarzenia progresywne, jak i regresywne. Jak wie każdy biolog rozwojowy, okresy szybkich zmian rozwojowych sygnalizują zwiększoną wrażliwość i podatność zarówno na zmianę zależną od doświadczenia, jak i na negatywne konsekwencje zaburzeń i zniewag, i nie ma powodu, by sądzić, że rozwój ludzkiego mózgu u nastolatków jest wyjątkiem (Andersen, 2003; Włócznia, 2000). Przewiduje się, że perturbacje w okresie dojrzewania hormonalnego dojrzewania na mózg nastolatka będą miały długotrwałe konsekwencje dla zachowania dorosłych.
Androgeny i obwody nerwowe dla zachowań motywowanych
Ponieważ dojrzewanie jest przejściową i dynamiczną fazą rozwoju, trudno byłoby ocenić mózg i zachowanie nastolatków w izolacji. Zamiast tego, aby docenić wyjątkowy charakter okresu dojrzewania, pomocne jest skontrastowanie go z mózgiem i zachowaniem dojrzałych dorosłych. Tak więc, skupiając się na tym artykule na męskim zachowaniu seksualnym i nagrodzie, ważne jest, aby wprowadzić obwody nerwowe do kopulacji i motywacji seksualnej u dorosłych mężczyzn, w tym rolę hormonów steroidowych gonad w aktywacji behawioralnej i dystrybucji receptorów dla androgenów (AR) i estrogeny (ER).
AR są obecne w grupach komórkowych, które tworzą obwody nerwowe pośredniczące w nagradzaniu zachowań społecznych, takich jak seks. Ponadto, mózgowe AR są wyrażane przed okresem dojrzewania u chomików i są zwiększone przez androgeny zarówno u młodych jak i dorosłych mężczyzn (Kashon, Hayes, Shek i Sisk, 1995; Meek, Romeo, Novak i Sisk, 1997). W mózgu gryzoni występuje znaczne nakładanie się AR i ER (Wood and Newman, 1995) i aromataza (Celotti, Negri-Cesi i Poletti, 1997), w tym formy α i β receptora estrogenowego (Shughrue, Lane i Merchenthaler, 1997). Po związaniu z ligandem „klasyczne” AR i ER funkcjonują jako czynniki transkrypcyjne do indukcji transkrypcji i syntezy nowych białek. Nic dziwnego, że efekty te następują stosunkowo wolno, z opóźnionym początkiem działania. Steroidowa stymulacja zachowań seksualnych chomika męskiego (Noble i Alsum, 1975) jest zgodny z działaniami poprzez klasyczne działania genomiczne. Na przykład, 2 tygodnie ekspozycji na steroidy są wymagane do przywrócenia krycia w długoterminowych kastratach. Nowsze badania na szczurach wykazały również szybkie działanie komórek androgenów w regionach mózgu, które mają niewiele klasycznych receptorów (Mermelstein, Becker i Surmeier, 1996). Uważa się, że w tych działaniach steroidowych pośredniczą receptory niegenomowe. Podczas gdy rozmieszczenie klasycznego AR i ER w mózgu chomika jest stosunkowo ograniczone (Wood and Swann, 1999) potencjalne cele mózgu dla niegenomowego działania androgenów są znacznie szersze.
Medyczny obszar preoptyczny (MPOA) odgrywa kluczową rolę w kopulacji u samców od złotych rybek do ludzi (przegląd w Hull, Wood i McKenna, 2006). Ponadto, MPOA chomika transdukuje gonadowe hormony steroidowe przez obfite AR i ER, a implanty testosteronowe w MPOA są wystarczające do przywrócenia aktywności seksualnej u długoterminowych kastratów (Wood and Swann, 1999). U samców szczurów steroidy gonadowe działają w MPOA, regulując podstawowe uwalnianie DA (Putnam, Sato i Hull, 2003) i stymuluj kojarzenie (Hull, Du, Lorrain i Matuszewich, 1995). Początkowo występuje niewielki wzrost DA, gdy kobieta jest prezentowana za ekranem. Podczas kopulacji DA MPOA zwiększa się dalej (+ 50% wartości wyjściowej), a ten efekt wymaga androgenów (Hull i wsp., 1995; Putnam i in., 2003). Nic dziwnego, że u kastrowanych samców, które nie łączą się w pary, DA nie zwiększa się (Hull i wsp., 1995). Trudno jest zinterpretować ten wynik, ponieważ brak uwalniania DA jest zaburzony przez brak aktywności seksualnej. Jednak uwalnianie DA w MPOA koreluje z utratą krycia w krótkotrwałych kastratach (Hull i wsp., 1995), oraz z przywróceniem aktywności seksualnej testosteronu w kastratach długoterminowych (Du, Lorrain i Hull, 1998; Putnam, Du, Sato i Hull, 2001).
W MPOA gryzoni androgenne i estrogenne metabolity testosteronu odgrywają szczególną rolę w regulacji kojarzenia (Putnam i in., 2003; Putnam, Sato, Riolo i Hull, 2005). Opóźnienie rozpoczęcia kopulacji (mount lub intromit) jest jedną z miar motywacji seksualnej. Opóźnienie aktywności seksualnej jest wrażliwe na estrogeny, dzięki utrzymaniu syntazy tlenku azotu MPOA, która z kolei utrzymuje podstawowe poziomy DA. Kastry poddane działaniu estrogenu wykazują wysokie podstawowe poziomy DA, które silnie korelują ze zdolnością do inicjowania kopulacji. Jednak nie wykazują one wzrostu uwalniania DA wywołanego przez kobiety i kopulację, co silnie koreluje z wydajnością seksualną. W związku z tym ich sprawność seksualna jest poniżej nienaruszonych poziomów. Z drugiej strony kastraty traktowane samym niearomatyzowanym androgenem nie wykazują podwyższonych podstawowych poziomów DA, i nie inicjują kopulacji. Dlatego dla normalnej sprawności seksualnej wymagane są zarówno estrogeny, jak i androgeny. Wydajność seksualna jest zwykle wyrażana jako miary częstości wierzchowców, intromisji i ejakulacji. Dopiero po zastąpieniu estrogenów i androgenów wykastrowane samce wykazują podwyższone poziomy DA (i krótsze miary latencji) oraz wzrost DA wywołany przez kobiety i kopulację (i miary zwiększonej częstotliwości). W ten sposób estrogeny w MPOA przyczyniają się do motywacji seksualnej, a estrogeny i androgeny do sprawności seksualnej.
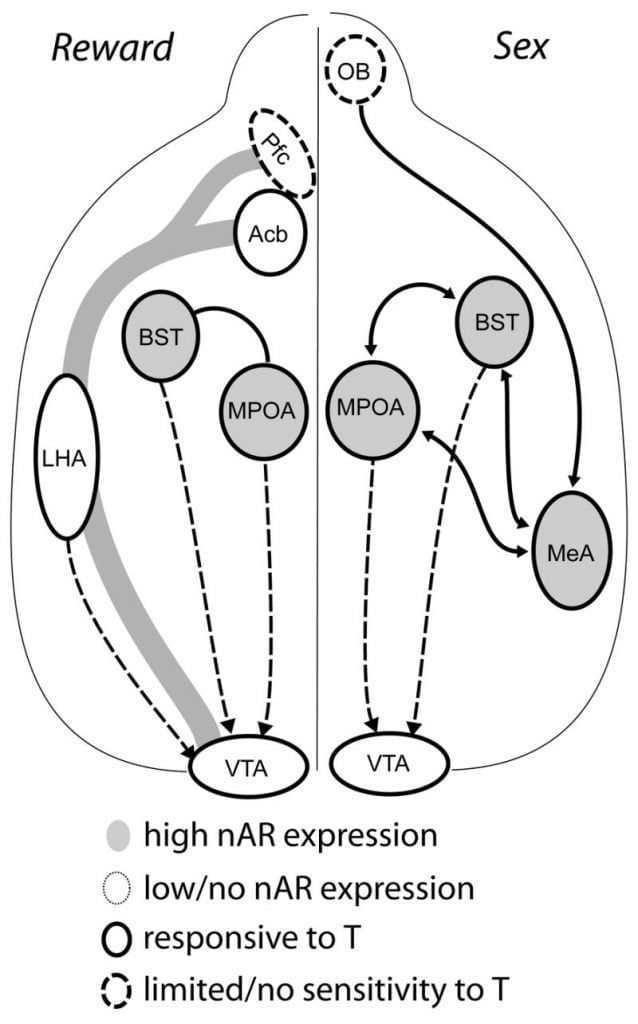
Chociaż testosteron jest niezbędny do uwalniania DA MPOA podczas zachowań kopulacyjnych u mężczyzn i do samego kojarzenia, ani testosteron ani sam krycie nie mogą wywołać DA w MPOA. Zamiast tego wymagane są także chemosensoryczne sygnały pochodzące od specyficznych samic do uwalniania DA w MPOA. U gryzoni bodźce chemosensoryczne są główną modalnością sensoryczną inicjującą męskie zachowania seksualne (Rys. 1). Wskaźniki chemosensoryczne są przenoszone z opuszek węchowych na MPOA przez przyśrodkowe jądro migdałowatego i jądro łożyska terminala, struktury z obfitym AR i ER (Wood and Swann, 1999). Aby określić rolę sygnałów chemosensorycznych w DA wywołanej krzyżowaniem, zmierzyliśmy DA MPOA podczas krycia u chomików płci męskiej nienaruszonych gonadami z jednostronną opuszką węchową (UBx, Triemstra, Nagatani i Wood, 2005). Chociaż obustronne usunięcie opuszek węchowych eliminuje aktywność seksualną i uwalnianie DA MPOA, jednostronna bulletektomia nie zakłóca krycia. W tym badaniu kopulacja indukowała uwalnianie DA MPOA, gdy mierzono ją przeciwlegle do uszkodzonej opuszki węchowej, ale nie w półkuli ipsilateralnej (Rys. 2). Podobne wyniki zaobserwowano u samców szczurów ze zmianami przyśrodkowego ciała migdałowatego (Dominguez, Riolo, Xu i Hull, 2001). W pokrewnym badaniu, chemiczna stymulacja przyśrodkowego ciała migdałowatego u szczurów indukowała uwalnianie DA MPOA równoważne temu podczas kopulacji (Dominguez i Hull, 2001). Podsumowując, dane te sugerują, że testosteron tworzy permisywne środowisko, które pozwala zewnętrznym bodźcom sensorycznym na osiągnięcie MPOA i indukowanie uwalniania DA podczas kopulacji.

Rys. 2
Ostatecznie zachowania seksualne i inne naturalne nagrody aktywują neuronalne ścieżki nagrody. Obwód mezokortykolimbiczny DA składa się z brzusznej strefy nakrywkowej (VTA), jądra półleżącego (Acb) i kory przedczołowej (Pfc). Ciała dopaminowe rezydujące w projekcie VTA rostrally do Acb i Pfc (Koob i Nestler, 1997). U szczurów DA jest uwalniany do Acb podczas seksu (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips i Fibiger, 1990). Wiele leków uzależniających działa również w mezolimbicznym układzie DA, zwiększając uwalnianie DA (amfetaminy) lub hamując wychwyt zwrotny DA (kokaina, Di Chiara i Imperato, 1988), wzmacniając tym samym ich właściwości uzależniające. W ten sposób testosteron ma potencjał, aby wpływać na uwalnianie DA w Acb zarówno poprzez wzmocnienie zachowań seksualnych, jak i poprzez jego działanie jako narkotyku (patrz poniżej).
Obecne dowody sugerują, że mezokortykolimbiczny układ DA dojrzewa w okresie dojrzewania. Gęstość włókien Acb DA gwałtownie wzrasta w okresie dojrzewania u myszoskoczków, co sugeruje, że znaczące dojrzewanie projekcji dopaminergicznych VTA w Acb następuje w okresie dojrzewania (Lesting, Neddens i Teuchert-Noodt, 2005). Ponadto dopaminergiczny wkład do komórek GABA (kwas γ-aminomasłowy) w komórkach kory przedczołowej szczura jest wzbogacony i modulowany przez układy serotonergiczne w okresie dojrzewania (Benes, Taylor i Cunningham, 2000), a manipulowanie androgenami u dorosłych szczurów prowadzi do zmian gęstości aksonów dopaminergicznych w korze przedczołowej (Kritzer, 2003). Pfc, Acb i VTA mają niewiele AR lub ER, chociaż ERβ jest obecny w VTA (Shughrue i in., 1997). Dlatego wydaje się prawdopodobne, że androgeny wpływają na układ mezokortykolimbiczny DA przez wrażliwe na androgeny aferentne lub przez ERβ w VTA jak w podwzgórzu (Handa i in., Ten problem). Nasze dane pokazują, że wrażliwe na androgeny komórki w chomikach męskich projektują do VTA ze struktur związanych z zachowaniami wrażliwymi na sterydy. Na przykład, zarówno MPOA, jak i jądro łóżka stria terminalis (BST) zawierają dużą liczbę komórek AR-pozytywnych, które rzutują na VTA (Sato i Wood, 2006). Brzuszna bladość, główny cel odprowadzający Acb (Zahm i Heimer, 1990), zawiera również wiele komórek AR-dodatnich, które rzutują na VTA. Projekcje te dają możliwość androgenów na modyfikację aktywności mezokortykolimbicznego układu DA.
Organizacja zachowań zależnych od steroidów w okresie dojrzewania
Tradycyjny pogląd na działanie hormonów na zachowanie nastolatków opiera się na aktywnym działaniu hormonów steroidowych, które odnoszą się do zdolności steroidów do ułatwiania zachowania w określonych kontekstach społecznych poprzez działanie w komórkach docelowych w zachowaniach obwodów nerwowych leżących u podstaw. Efekty aktywacyjne są przejściowe w tym sensie, że przychodzą i odchodzą wraz z obecnością i brakiem hormonu, i są zazwyczaj związane z ekspresją zachowania dorosłych. Natomiast efekty organizacyjne odnoszą się do zdolności sterydów do rzeźbienia struktury układu nerwowego podczas rozwoju. Organizacja strukturalna jest trwała, utrzymuje się poza okresem narażenia na hormon i określa reakcje neuronalne i behawioralne na sterydy w wieku dorosłym. Nasze zrozumienie związku rozwojowego między efektami organizacyjnymi i aktywacyjnymi hormonów steroidowych ewoluowało w ciągu ostatnich lat 50. Phoenix i jego współpracownicy zaproponowali po raz pierwszy, że dorosłe behawioralne reakcje na hormony steroidowe są programowane (organizowane) przez hormony steroidowe podczas maksymalnie wrażliwego okresu rozwoju okołoporodowego (Phoenix, Goy, Gerall i Young, 1959). Później Scott i jego współpracownicy położyli teoretyczne podstawy dla istnienia wielu wrażliwych okresów dla postępującej organizacji układu nerwowego i zauważyli, że wrażliwe okresy są najbardziej prawdopodobne w okresach szybkich zmian rozwojowych (1974). Następnie Arnold i Breedlove wskazali, że zależna od steroidów organizacja mózgu może wystąpić poza wrażliwymi okresami rozwoju (Arnold i Breedlove, 1985). W ciągu ostatnich lat 15 badania wykorzystujące różnorodne modele zwierzęce i systemy behawioralne jasno pokazują, że mózg nastolatka jest wrażliwy zarówno na działanie aktywizujące, jak i organizacyjne sterydów gonadowych (przegląd w Sisk and Zehr, 2005). I podobnie jak inne okresy szybkich zmian rozwojowych, dorastanie stanowi określone okno szans na remodeling mózgu zależny od sterydów.
Nasza praca przy użyciu chomika jako modelu zwierzęcego dostarcza dowodów, że męskie zachowania społeczne są modyfikowane przez steroidy w okresie dojrzewania (Schulz, Menard, Smith, Albers i Sisk, 2006; Schulz i Sisk, 2006). Przed okresem dojrzewania leczenie testosteronem nie może aktywować zachowań seksualnych u chomików, co sugeruje, że procesy dojrzewania, które czynią obwody nerwowe podatne na aktywację lub organizację przez hormony steroidowe, jeszcze nie wystąpiły (Meek i in., 1997; Romeo, Richardson i Sisk, 2002a). I odwrotnie, podczas gdy jawna ekspresja męskich zachowań reprodukcyjnych w wieku dorosłym nie wymaga bezwzględnie obecności sterydów gonad w okresie dojrzewania, maksymalna ekspresja zachowania tak. Porównując męskie zachowania reprodukcyjne u samców wykastrowanych przed okresem dojrzewania (NoT@P) lub po okresie dojrzewania (T@P), a następnie leczonych testosteronem w wieku dorosłym, kastraci NoT@P przed okresem dojrzewania mają co najmniej 50% deficyt w zachowaniach męskich w porównaniu z samcami wykastrowanymi po okresie dojrzewania (Rys. 3, Schulz, Richardson, Zehr, Osetek, Menard i Sisk, 2004). Co więcej, deficyty w zachowaniu reprodukcyjnym są długotrwałe i nie można ich pokonać ani przez przedłużone leczenie testosteronem, ani przez doświadczenia seksualne w wieku dorosłym (Schulz i in., 2004). Podobnie, po leczeniu estrogenem i progesteronem, samce NoT@P wykazują krótsze opóźnienia lordozy i dłuższy czas trwania lordozy niż samce wykastrowane jako dorosłe (Schulz i in., 2004), sugerując, że kastry przedpokwitaniowe są mniej defeminizowane niż samce narażone na testosteron płciowy.

Rys. 3
Możliwe, że samce NoT@P cierpią na obniżoną motywację seksualną. Jednym ze sposobów odpowiedzi na to pytanie jest porównanie latencji do zaangażowania się zarówno w badanie odbytu i narządów płciowych (AGI), jak i montaż między samcami poddanymi gonadektomii przed (NoT@P) i po okresie dojrzewania (T@P). Jeśli motywacja seksualna zależy od ekspozycji na hormony gonad w okresie dojrzewania, przewidywalibyśmy dłuższe opóźnienia w angażowaniu się w zachowania seksualne u mężczyzn NoT @ P. Rzeczywiście, przy wielokrotnym narażeniu na rujowe samice, samce NoT @ P potrzebują więcej czasu, aby rozpocząć AGI i wznieść się w porównaniu z samcami T @ P (Rys. 4). Tak więc, oprócz organizowania aspektów sprawności seksualnej, wydaje się, że hormony dojrzewania organizują również satysfakcjonujące aspekty zachowań seksualnych. Na poparcie tej możliwości centralne podawanie apomorfiny agonisty DA w wieku dorosłym przywraca zachowanie samców NoT @ P do poziomów typowych dla dorosłych, co sugeruje, że testosteron w okresie dojrzewania normalnie organizuje dopaminergiczne obwody nerwowe (Salas-Ramirez, Montalto i Sisk, 2006 ). Niemniej jednak pozostaje wiele interesujących pytań. Czy samiec NoT@P barpress dla samicy w okresie rui lub rozwinąłby uwarunkowaną preferencję miejsca dla miejsca krycia? Przyszłe badania zbadają rolę hormonów dojrzewania płciowego w organizacji motywacji seksualnej i sprawności seksualnej.

Rys. 4
Opóźnienia i czas trwania badania odbytowo-płciowego (AGI) wykazywane przez samce chomików poddanych gonadektomii przed okresem dojrzewania (NoT@P) lub po okresie dojrzewania (T@P). Wszystkie samce były szczepione testosteronem w wieku dorosłym 7 tygodni po gonadektomii i tydzień przed pierwszym testem behawioralnym. Samce A. T@P wykazywały podobne opóźnienia AGI w trzech testach z samicą w okresie rui, podczas gdy samce NoT@P zwiększały opóźnienia AGI podczas trzeciego testu z samicą w okresie rui. Samce B. T@P zmniejszyły opóźnienia montowania w trzech testach zachowania z rujową samicą, podczas gdy samce noT@P nie wykazały żadnych zmian w opóźnieniu montowania w trzech testach zachowania. Dane te sugerują, że dojrzewające hormony gonad mają trwały, ułatwiający wpływ na motywację dorosłego mężczyzny do angażowania się w zachowania seksualne z kobietą. (Niepublikowane dane od zwierząt w Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA i Sisk, CL, 2004).
Prepubertalne reakcje behawioralne na steroidy
Jedną z trwałych zagadek rozwoju zachowań nastolatków jest to, że aktywacja zachowań reprodukcyjnych w odpowiedzi na ekspozycję na steroidy jest osłabiona u samców chomików przed okresem dojrzewania. Jeśli niski poziom androgenów przed okresem dojrzewania ogranicza ekspresję męskich zachowań seksualnych u samców przed okresem dojrzewania, wówczas uzupełnianie endogennych androgenów u samców przed okresem dojrzewania powinno wywoływać kojarzenie. Okazuje się, że tak nie jest (Meek i in., 1997; Romeo, Cook-Wiens, Richardson i Sisk, 2001; Romeo, Wagner, Jansen, Diedrich i Sisk, 2002b), pomimo faktu, że liczba i rozmieszczenie AR i ER w całym obwodzie krycia są podobne w kastrach przedporodowych i dorosłych poddanych działaniu hormonów (Meek i in., 1997; Romeo, Diedrich i Sisk, 1999; Romeo i in., 2002a). Dlatego wydaje się, że androgeny i AR są konieczne, ale niewystarczające do wyrażania męskich zachowań seksualnych.
Wysiłki zmierzające do zidentyfikowania czynników ograniczających aktywność seksualną przed okresem dojrzewania były dotychczas mieszane. Odpowiedzi Fos na chemosensoryczne sygnały pochodzące od samic rujowych są podobne u chomików przed okresem dojrzewania i dorosłych samców (Romeo, Parfitt, Richardson i Sisk, 1998). Dane te pokazują, że mechanizmy transdukcji czuciowej są dojrzałe przed okresem dojrzewania. Tak więc, młode samce są w stanie wykryć chemosensoryczne sygnały od samic; gdzie różnią się od dorosłych, jak reagują na te sygnały. Jednym z potencjalnych wyjaśnień jest to, że samce przed okresem dojrzewania nie są zmotywowane do angażowania się w zachowania seksualne. Stwierdziliśmy, że samce chomików przed okresem dojrzewania nie wykazują zwiększonych odpowiedzi dopaminergicznych w MPOA w odpowiedzi na feromony żeńskie, podczas gdy dorosłe samce naiwne płciowo wykazują silne reakcje dopaminergiczne MPOA na te same bodźce (Rys. 5, Schulz, Richardson, Romeo, Morris, Lookingland i Sisk, 2003). Podobnie samce przed okresem dojrzewania nie wykazują typowego dla dorosłych wzrostu krążącego testosteronu po ekspozycji na feromony żeńskie (Parfitt, Thompson, Richardson, Romeo i Sisk, 1999). Zatem feromony żeńskie wydają się być bezwarunkowym bodźcem dla odpowiedzi neurochemicznych i neuroendokrynnych u dorosłych, ale nie w okresie przedpokwitaniowym mężczyzn, co sugeruje, że istotność tych społecznie istotnych bodźców zmysłowych zmienia się w okresie dojrzewania, prawdopodobnie związana z nabyciem właściwości nagradzających i motywacji seksualnej. Ponadto, chociaż testosteron ułatwia AGI samicy u samców przed okresem dojrzewania, efekt ten zależy od tego, czy mężczyzna miał wcześniej kontakt z żeńską kobietą. Być może zaskakująco, leczenie testosteronem zmniejsza opóźnienie i wydłuża czas trwania AGI tylko u seksualnie naiwnych samców przed okresem dojrzewania (Rys. 6). Co więcej, mężczyźni w okresie przedpokwitaniowym, którzy doświadczyli wcześniejszego doświadczenia z kobietą, wykazują znacznie dłuższe opóźnienia AGI i krótsze czasy trwania AGI niż mężczyźni po raz pierwszy wchodzący w interakcje z chłonnymi samicami (Rys. 6). Dane te sugerują, że interakcje z kobietą pochodzenia estrowego są raczej awersyjne niż satysfakcjonujące przed okresem dojrzewania, eliminując w ten sposób jakiekolwiek wspomagające działanie testosteronu na AGI podczas kolejnych interakcji z kobietą. Ciekawe byłoby wiedzieć, czy negatywne konsekwencje behawioralne wczesnej ekspozycji na runiowatą kobietę utrzymują się w okresie dojrzewania i dorosłości, zwłaszcza biorąc pod uwagę powtarzające się narażenie na rujne samice podczas dorastanie ogólnie ułatwia wyrażanie męskiego zachowania reprodukcyjnego (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto i Sisk, 2007).

Rys. 5
Przedpiersiowe i dorosłe samce obszaru przedostrego przyśrodka (MPOA) odpowiedzi dopaminergiczne na feromony żeńskie zawarte w wydzielinach pochwowych. Dorosłe samce wykazują wzrost aktywności dopaminergicznej MPOA z ekspozycją na wydzieliny pochwy żeńskiej, podczas gdy samce przed okresem dojrzewania nie wykazują zwiększonej odpowiedzi dopaminergicznej MPOA na feromony żeńskie. (Odrodzony z Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ i Sisk, CL, 2003).

Chociaż przedterminowa terapia androgenowa nie może wywoływać kopulacji, ostatnie prace z naszego laboratorium sugerują, że układ nerwowy chomika jest wrażliwy na organizujące działanie testosteronu na zachowania reprodukcyjne przed okresem dojrzewania (Schulz, Zehr, Salas-Ramirez i Sisk, 2007). Kastracja plus dni 19 ekspozycji na testosteron przed lub w okresie dojrzewania, ale nie po nim, ułatwiły zachowanie podczas testosteronu w wieku dorosłym. Mężczyźni narażeni na testosteron w okresie przedwczesnym również wykazywali więcej zaburzeń w dorosłości niż mężczyźni narażeni na testosteron podczas lub po okresie dojrzewania (Schulz i in., 2007). Dane te sugerują, że zdolność testosteronu do organizowania behawioralnych obwodów nerwowych zmniejsza się z wiekiem, a dojrzewanie oznacza koniec przedłużającego się okresu wrażliwości poporodowej na ekspozycję na testosteron.
Androgeny farmakologiczne
Poprzednie dane sugerują, że endogenne steroidy gonadalne zwiększają motywację do zachowań w okresie dojrzewania. Co się stanie, jeśli ktoś sam podaje androgeny na poziomie do normalnych stężeń fizjologicznych 100x? Jest to problem nadużywania steroidów anaboliczno-androgennych (przegląd w Brower, 2002; Clark i Henderson, 2003). Odpowiednia jest tu krótka dygresja: wszystkie AAS są pochodnymi testosteronu, wszystkie AAS mają szkielet węglowy ze stopionymi pierścieniami 4, większość ma węgiel 19. AAS są używane głównie do ich efektów anabolicznych (budowania mięśni). Jednak, jak sugeruje ich nazwa, AAS ma również właściwości androgenne. Testosteron jest logicznym wyborem w badaniach na zwierzętach do badania podstawowych mechanizmów nagrody androgenów. Pozostaje popularnym wyborem również dla użytkowników, najczęściej w postaci długo działających estrów testosteronu, takich jak propionian testosteronu. W 2006 testosteron był najbardziej rozpowszechnioną substancją zakazaną wykrywaną w testach moczu w laboratoriach akredytowanych przez WADA (WADA, 2006). Testosteron stanowił największą frakcję (34%) AAS-dodatnich testów moczu w 2000 Sydney Olympic Games (Van Eenoo i Delbeke, 2003). Podobnie, w badaniach moczu użytkowników AAS, 41% wykazał pozytywny wynik na testosteron (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). Przy dużych dawkach AAS powoduje znaczące zmiany behawioralne. W szczególności, ze względu na ich bliski związek z testosteronem, stosowanie AAS w latach młodzieńczych wydaje się zaburzać normalne środowisko sterydowe rozwijającego się ludzkiego układu nerwowego, w tym ilość, czas i rodzaj ekspozycji na steroidy.
Podobnie jak w przypadku innych nielegalnych narkotyków, nadużywanie ludzkiego AAS stanowi problem wieku dojrzewania. Według Krajowego Badania Gospodarstw Domowych 1994 na temat używania narkotyków (SAMHSA / OAS, 1996), stosowanie sterydów osiąga szczyt w późnym okresie dojrzewania w wieku 18. Ponadto w badaniu Monitoring the Future (Johnston, O'Malley i Bachman, 2003), częstość stosowania steroidów przez całe życie wśród seniorów w szkołach średnich (2.7%) była porównywalna do częstości występowania cracku (3.5%) lub heroiny (1.4%). Stosowanie sterydów jest coraz bardziej powszechne w młodszym wieku: 2.5% uczniów klasy 8th (13 – 14) używa sterydów, podobnych do częstości występowania pęknięć (2.5%) i używania heroiny (1.6%). Ta tendencja do stosowania AAS u nastolatków jest szczególnie niepokojąca ze względu na obawy 1), że nastolatki mogą być szczególnie podatne na nadużywanie AAS, a 2), że narażenie nastolatków na AAS na poziomie farmakologicznym może znacząco zmienić normalne dojrzewanie mózgu i zachowanie w celu uzyskania przesadnych odpowiedzi morfologicznych i behawioralnych, ostro i chronicznie.
Niewłaściwa agresja to reakcja behawioralna najczęściej związana z nadużywaniem AAS przez człowieka. W opublikowanych opisach przypadków stosowanie steroidów jest związane z kilkoma brutalnymi morderstwami (Conacher i Workman, 1989; Pope and Katz, 1990; Pope, Kouri, Powell, Campbell i Katz, 1996; Schulte, Hall i Boyer, 1993). W badaniach dotyczących obecnych użytkowników AAS podwyższona agresja i drażliwość były najczęstszymi behawioralnymi skutkami ubocznymi stosowania AAS (Bond, Choi i Pope, 1995; Galligani, Renck i Hansen, 1996; Midgley, Heather i Davies, 2001; Parrott, Choi i Davies, 1994; Perry, Kutscher, Lund, Yates, Holman i Demers, 2003). Jednakże, biorąc pod uwagę zakres ekspozycji na androgeny, różnorodność objawów psychiatrycznych i potencjał wcześniej istniejącej dysfunkcji psychiatrycznej, trudno jest określić dokładną rolę AAS w tych przypadkach agresji ludzkiej. Wyniki badań prospektywnych ochotników otrzymujących zastrzyki z AAS zostały zmieszane: Tricker i in. (1996) i O'Connor i in. (2004) nie odnotowano wzrostu zachowań wściekłych, podczas gdy w innych badaniach zaobserwowano zwiększoną agresję (Daly, Su, Schmidt, Pickar, Murphy i Rubinow, 2001; Hannan, Friedl, Zold, Kettler i Plymate, 1991; Kouri, Lukas, Pope i Oliva, 1995; Pope and Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz i Rubinow, 1993). Niemniej jednak ważne jest, aby pamiętać, że dawki podawane ochotnikom są znacznie niższe niż dawki zalecane na stronach internetowych dotyczących budowy ciała, a czas trwania leczenia jest na ogół krótki. Tak więc, w sumie, wydaje się słuszne wnioskować, że AAS mogą potencjalnie wzmacniać zachowanie agonistyczne, przynajmniej u osób podatnych. Pope i in. (1994) stwierdzili, że AAS wywołuje objawy psychiczne u osób podatnych na zagrożenia.
Badania na zwierzętach również dostarczyły przekonujących dowodów na agresję wywołaną AAS. Młodzieżowe chomiki leczone przewlekle wysokimi dawkami steroidów mają krótsze opóźnienia ataku i większą liczbę ataków i ugryzień w stosunku do męskiego intruza w porównaniu z nieleczonymi samcami (Harrison, Connor, Nowak, Nash i Melloni, 2000; Melloni, Connor, Hang, Harrison i Ferris, 1997). Podobnie łagodna prowokacja (uszczypnięcie ogona) powoduje stały wzrost agresji u młodych samców szczurów, w tym agresji wobec kobiet (Cunningham i McGinnis, 2006). Jeszcze bardziej niepokojący jest fakt, że narażenie młodzieży na AAS u chomików powoduje trwałe zwiększenie agonistycznego zachowania, które utrzymuje się po zaprzestaniu stosowania sterydów (Grimes i Melloni, 2006). Tym zmianom behawioralnym towarzyszy trwała przebudowa obwodów nerwowych w przednim podwzgórzu. W szczególności ekspozycja młodzieży na AAS u chomików wzmacnia wazopresynę argininową (AVP, Grimes i Melloni, 2006) i reguluje w dół serotoninę i receptory serotoninergiczne 5HT1A i 5HT1B (Ricci, Rasakham, Grimes i Melloni, 2006). Nie powinno dziwić, że AAS zmienia również poziom AR w mózgu. Przewlekła ekspozycja na testosteron lub nandrolon zwiększa poziom AR w komórkach męskich szczurów (Menard i Harlan, 1993; Wesson i McGinnis, 2006). Zatem istnieje możliwość, że AAS będzie wzmacniać zachowania zależne od androgenów, zarówno przez uzupełnianie endogennych androgenów, jak i przez zwiększoną reakcję androgenną poprzez zwiększoną ekspresję AR.
W porównaniu z zachowaniem agonistycznym, AAS ma mniej wyraźny wpływ na zachowanie krycia u męskich gryzoni, a odpowiedź zależy od konkretnego stosowanego sterydu (przegląd w Clark i Henderson, 2003). U samców chomików spożywających testosteron w roztworach doustnych wytrysk wzrastał w sposób zależny od dawki (Wood, 2002). Jednak ani testosteron, ani nandrolon nie poprawiały krycia u dorastających samców szczurów. Stanozolol, stosunkowo słabszy AAS o minimalnej aktywności androgennej, faktycznie hamował zarówno kojarzenie, jak i agresję (Farrell i McGinnis, 2003), przypuszczalnie przez zmniejszenie endogennych poziomów androgenów.
Szczególnie ważne jest, aby zauważyć, że dorastające i dorosłe chomiki mogą wykazywać różne reakcje behawioralne na ekspozycję na AAS. Podczas gdy AAS znacznie poprawiło zachowanie agonistyczne u dorastających samców, to samo leczenie w wieku dorosłym spowodowało jedynie niewielki wzrost zachowań agresywnych i znacząco zmniejszyło zachowania seksualne (Salas-Ramirez, Montaldo i Sisk, 2008). Jest to zgodne z koncepcją dorastania jako wrażliwego okresu na działanie androgenów. Ponadto, tak jak dorosłe samce chomików nabywają tolerancję na egzogenny testosteron (Peters and Wood, 2005), wierzymy, że rozwijające się samce nabywają tolerancję na testosteron w miarę dojrzewania. Tak więc wpływ zmiany AAS na rozwój młodzieży i ekspozycja na AAS u nastolatków może powodować nadmierne agresywne i seksualne wzorce zachowań, które mogą utrzymywać się w dorosłości.
Wzmacniające działanie androgenów
Kojarzenie i walka są satysfakcjonujące (przynajmniej jeśli wygrasz walkę). Samce szczurów naciskają kilkakrotnie dźwignię, aby kopulować z kobietą (Everitt i Stacey, 1987). Podobnie samce myszy i samice chomików utworzą warunkową preferencję miejsca (CPP) dla miejsc, w których wcześniej wygrywały walki (Martinez, Guillen-Salazar, Salvador i Simon, 1995; Meisel i Joppa, 1994). Jeśli AAS może zwiększyć satysfakcjonujące zachowania społeczne powyżej poziomu normalnie obserwowanego u samców nienaruszonych gonadami, logiczne jest oczekiwanie, że sam testosteron może być satysfakcjonujący. Zostało to przetestowane przy użyciu dwóch dobrze ugruntowanych modeli zwierzęcych dla nagradzania i wzmacniania: CPP i samo-administracja. Wyniki tych badań pokazują, że testosteron wzmacnia się w kontekście eksperymentalnym, w którym efekty anaboliczne i wyniki sportowe są nieistotne. W przypadku CPP badana substancja jest wielokrotnie łączona z unikalnym środowiskiem (na przykład z określoną komorą w aparacie badawczym). Gdy zwierzę kojarzy wzmacniającą substancję testową z tym środowiskiem, będzie szukać środowiska nawet bez nagrody. Pierwsze doniesienia o nagrodzie androgenowej u zwierząt laboratoryjnych wykorzystywały układowe zastrzyki testosteronu w celu wywołania CPP u samców myszy (Arnedo, Salvador, Martinez-Sanchis i Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis i Pellicer, 2002) i szczury (Alexander, Packard i Hines, 1994; de Beun, Jansen, Slangen i Van de Poll, 1992). Następnie nasze laboratorium stosowało samosterowanie testosteronem w celu wykazania wzmocnienia androgenowego (Johnson and Wood, 2001). Odkryliśmy, że samce chomików dobrowolnie spożywają doustne roztwory testosteronu, stosując zarówno testy wyboru butelek 2, jak i picie wywołane przez żywność. W późniejszych badaniach wykazaliśmy samo-podawanie iv u samców szczurów i chomików (Wood, Johnson, Chu, Schad i Self, 2004). Dostarczanie dożylne eliminuje potencjalne zakłócające działanie smaku lub wypełnienia jelita na spożycie androgenu.
W kontekście nadużywania AAS ważne jest rozróżnienie między centralnym i obwodowym działaniem androgenów. Ponieważ testosteron ma rozległe skutki w całym ciele, można argumentować, że nagroda i wzmocnienie układowymi zastrzykami z testosteronu jest drugorzędne w stosunku do układowych działań anabolicznych i androgennych testosteronu. Innymi słowy, może testosteron zmniejsza zmęczenie mięśni i poprawia funkcjonowanie stawów, tak że zwierzęta po prostu czuć lepszy. Rzeczywiście, to wyjaśnienie zostało użyte w literaturze klinicznej (aczkolwiek bez dowodów doświadczalnych), aby argumentować przeciwko możliwości uzależnienia i uzależnienia od AAS (DiPasquale, 1998). Jednak Packard i in. (Packard, Cornell i Alexander, 1997) wykazało, że wstrzyknięcia testosteronu bezpośrednio do mózgu szczura mogą wywołać CPP. Podobnie nasze laboratorium wykazało samoistne podanie testosteronu do komór mózgowych u samców chomików (Wood i in., 2004). Wewnątrzmózgowy CPP i samo-podawanie ICV z testosteronem przemawiają za centralnymi celami pośredniczącymi w wzmacnianiu androgenów.
Godne uwagi jest to, że wzmocnienie testosteronu niekoniecznie jest zgodne z wcześniejszymi mechanizmami ustalonymi dla wpływu steroidów na zachowania seksualne. Jak omówiono wcześniej, MPOA jest kluczowym miejscem organizacji zachowań seksualnych u gryzoni płci męskiej (Hull, Meisel i Sachs, 2002). U chomików MPOA zawiera liczne receptory steroidowe, a implanty testosteronu w MPOA przywracają aktywność seksualną u długoterminowych kastratów (Wood and Swann, 1999). Przebieg czasowy tych efektów steroidowych jest powolny: zachowanie wzrastające utrzymuje się przez kilka tygodni po orchidektomii, a przedłużona ekspozycja na steroidy jest niezbędna do przywrócenia krycia w długoterminowych kastratach (Noble i Alsum, 1975). Jednak zastrzyki testosteronu w MPOA u samców szczurów nie wywołują CPP (King, Packard i Alexander, 1999). Sugeruje to, że inne obszary mózgu są ważne dla wzmocnienia androgenów.
Natomiast samce szczurów utworzą CPP na zastrzyki testosteronu w Acb (Packard i in., 1997). Podobnie jak w przypadku innych narkotyków, DA może być kluczowym neuroprzekaźnikiem dla wzmocnienia testosteronu: CPP indukowany przez układowy zastrzyk testosteronu jest blokowany przez antagonistów receptora dopaminy D1 i D2 (Schroeder i Packard, 2000). Jednak w przeciwieństwie do innych nadużywanych leków, nasze badania u chomików sugerują, że testosteron nie indukuje uwalniania Acb DA (Triemstra, Sato i Wood, w prasie). Podobnie, badania samców szczurów wykazały, że androgeny nie mają wpływu na podstawowe poziomy DA ani uwalnianie DA stymulowane amfetaminą (Birgner, Kindlundh-Hogberg, Nyberg i Bergstrom, 2006; ale także zobacz Clark, Lindenfeld i Gibbons, 1996). Ponadto testosteron wywiera stosunkowo niewielki wpływ na poziomy tkanek Acb DA (Thiblin, Finn, Ross i Stenfors, 1999). Łącznie dane te sugerują, że chociaż wzmocnienie testosteronu może ostatecznie zmienić aktywność DA w Acb, mechanizmy mogą się różnić od mechanizmów kokainy lub innych stymulantów. W związku z tym ostatnie dane sugerują, że przewlekłe narażenie na AAS może zmieniać wrażliwość na DA poprzez zmianę metabolizmu DA (Kurling, Kankaanpaa, Ellermaa, Karila i Seppala, 2005), poziomy receptorów DA (Kindlundh, Lindblom, Bergstrom, Wikberg i Nyberg, 2001; Kindlundh, Lindblom i Nyberg, 2003) lub transporter DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom i Nyberg, 2002).
Obecnie nieznane są specyficzne sygnały steroidowe, receptory i miejsca działania mózgu dla wzmocnienia testosteronu. Na podstawie niedawnych badań nad chomikami z naszego laboratorium, wzmacniające działanie testosteronu wydaje się być mediowane zarówno przez androgeny, jak i estrogeny (DiMeo i Wood, 2006). Powszechnie nadużywane AAS obejmują zarówno androgeny aromatyzowalne, jak i niearomatyczne (Gallaway, 1997; WADA, 2006). Oznacza to, że zarówno AR, jak i ER mogą przekazywać bodźce steroidowe w zamian za nagrodę. Istnieje dodatkowa możliwość, że wzmocnienie testosteronu może odbywać się za pośrednictwem kombinacji klasycznych i niegenomowych receptorów.
Kilka linii dowodów wskazuje na działanie receptorów niegenomowych we wzmacniających efektach SAA. Oprócz rzadkiego rozkładu AR w Acb i VTA, czas trwania wzmocnienia androgenowego jest szybki (<30 min), a przetwarzanie sygnału przez klasyczny AR może nie być wystarczająco szybkie do wzmocnienia. W związku z tym, aby przetestować rolę niegenomowego AR we wzmocnieniu AAS, zastosowaliśmy dwie uzupełniające się techniki (Rys. 7). W jednym eksperymencie (Sato, Johansen, Jordan i Wood, 2006), pozwoliliśmy szczurom z mutacją feminizacji jąder (Tfm, zobacz ten problem) na samodzielne podawanie dihydrotestosteronu (DHT), niearomatyzującego androgenu. Mutacja Tfm znacznie zmniejsza wiązanie ligandów w AR. Niemniej jednak szczury Tfm i ich rodzeństwo typu dzikiego samodzielnie podawały mniej więcej taką samą ilość DHT. To przemawia za niegenomowymi efektami DHT. W kolejnym badaniu ustaliliśmy, czy samce chomików będą samodzielnie podawać DHT sprzężone z albuminą surowicy bydlęcej (BSA, Rys. 8, Sato i Wood, 2007). Koniugaty DHT-BSA są nieprzepuszczalne dla błon; zatem ich skutki są ograniczone do powierzchni komórki. Chomiki samodzielnie zarządzają DHT, jak wcześniej wykazano (DiMeo i Wood, 2006). Wykazali podobną preferencję dla koniugatów DHT-BSA, ale nie mogli samodzielnie podawać BSA.

Rys. 7

Rys. 8
Dane te wskazują na centralną rolę AR na powierzchni komórek we wzmacnianiu androgenów. Obecnie dokładna natura takich receptorów nie jest znana. Sugerowano, że androgeny mogą działać na powierzchni komórki poprzez wiązanie z dedykowaną błoną AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff i Doughty, 2006, zobacz także ten problem). Może to być w postaci pozajądrowej klasycznej AR, jak opisano w hipokampie (Sarkey i in., W tym numerze). Wcześniejsze badania opisywały również miejsca wiązania steroidów na innych układach neuroprzekaźników. W szczególności wiele hormonów steroidowych, w tym AAS, może allosterycznie modulować receptor GABA-A (Henderson, 2007; Lambert, Belelli, Peden, Vardy i Peters, 2003). Podobnie, siarczanowane neurosteroidy mogą modyfikować aktywność N-metyl-D-typy receptora asparaginianowego (Malayev, Gibbs i Farb, 2002) receptory. Jest to ważny obszar dla przyszłych badań.
Dlaczego powinna istnieć membrana AR? Jak omówiono wcześniej, istnieje ścisły związek między wydzielaniem androgenu a nagradzającymi zachowaniami społecznymi. Możemy spekulować, że wzrost wydzielania testosteronu następujący po kryciu lub walce służy wzmocnieniu zachowania. Jeśli tak, konieczne jest szybkie połączenie bodźca (zachowania) i nagrody (testosteronu). Można to najlepiej osiągnąć poprzez wiązanie z membraną AR. W związku z tym interesujące byłoby określenie, czy zaciśnięcie wydzielania androgenu podczas krycia zmniejsza nagradzające skutki zachowań seksualnych.
Podsumowanie
Tutaj przeglądamy dowody na to, że androgeny są silnymi mediatorami zachowań motywowanych dorosłymi, a ponadto, że czas narażenia na androgeny podczas programów rozwojowych jest zależny od androgenów w dorosłym życiu. Sterydy anaboliczne szybko stają się ulubionym narkotykiem nadużywanym przez młodzież w USA. Chociaż AAS może nie mieć uzależniającej mocy kokainy lub heroiny, dopiero zaczynamy rozumieć potencjał wzmacniania androgenów. W szczególności, gdy sporty młodzieżowe stają się bardziej konkurencyjne, rośnie presja na rozwój sportowców do stosowania sterydów, począwszy od młodszego wieku. Ten trend jest niepokojący z uwagi na nowe dowody na dojrzewanie neuronów wrażliwych na steroidy u młodzieży.
Pomimo zwiększonej świadomości zarówno społeczności publicznej, jak i naukowej na temat głębokich zmian neuronalnych towarzyszących dojrzewaniu, badania eksperymentalne neurobiologii rozwojowej dojrzewania zostały ograniczone. Modele zwierzęce rozwoju nastolatków są potrzebne do zbadania, w jaki sposób czas narażenia na hormony podczas rozwoju zwiększa indywidualne ryzyko dla psychopatologii i używania narkotyków oraz jakie rodzaje doświadczeń łagodzą lub wzmacniają behawioralne skutki odchyleń w czasie dojrzewania. Na przykład czynniki społeczne, takie jak wpływ rówieśników, pogarszają skutki okresu dojrzewania płciowego dla używania substancji i alkoholu (Biehl, Natsuaki i Ge, 2007; Patton, Novy, Lee i Hickok, 2004; Simons-Morton i Haynie, 2003; Wichstrom i Pedersen, 2001). Modele zwierzęce o okresie dojrzewania będą również informować o wysiłkach badawczych ludzi i potencjalnie prowadzić do skuteczniejszych interwencji terapeutycznych w okresie dojrzewania.
Podziękowanie
Dziękujemy Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisy Rogers i Pameli Montalto za pomoc w tych badaniach. Ta praca jest wspierana przez granty z NIH (DA12843 na RIW, MH68764 na CLS i MH070125 na KMS).
Przypisy
Zastrzeżenie wydawcy: Jest to plik PDF z nieedytowanym manuskryptem, który został zaakceptowany do publikacji. Jako usługa dla naszych klientów dostarczamy tę wczesną wersję manuskryptu. Rękopis zostanie poddany kopiowaniu, składowi i przeglądowi wynikowego dowodu, zanim zostanie opublikowany w ostatecznej formie cytowania. Należy pamiętać, że podczas procesu produkcyjnego mogą zostać wykryte błędy, które mogą wpłynąć na treść, a wszystkie zastrzeżenia prawne, które odnoszą się do czasopisma, dotyczą.
Referencje
- Alexander GM, Packard MG, Hines M. Testosteron ma satysfakcjonujące właściwości afektywne u samców szczurów: implikacje dla biologicznych podstaw motywacji seksualnej. Behawioralna neuronauka. 1994;108: 424-8. [PubMed]
- Andersen SL. Trajektorie rozwoju mózgu: punkt wrażliwości lub szansa? Neuroscience & Biobehavioral Reviews. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Różnice płci w nadprodukcji i eliminacji receptora dopaminy. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Nagradzające właściwości testosteronu u nietkniętych samców myszy: badanie pilotażowe. Farmakologia, biochemia i zachowanie. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Podobne nagradzające efekty testosteronu u myszy oceniono jako krótkie i długie opóźnienia ataku. Biologia uzależnień. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Organizacyjny i aktywizujący wpływ steroidów płciowych na mózg i zachowanie: reanaliza. Hormony i zachowanie. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Zbieżność i plastyczność układów monoaminergicznych w przyśrodkowej korze przedczołowej w okresie poporodowym: implikacje dla rozwoju psychopatologii. Kora mózgowa. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Mielinizacja kluczowej strefy przekaźnikowej w formacji hipokampa zachodzi w mózgu człowieka w dzieciństwie, okresie dojrzewania i dorosłości. Archiwa Psychiatrii Ogólnej. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Wpływ czasu dojrzewania na spożywanie alkoholu i ciężkie trajektorie picia. Journal of Youth and Adolescence. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Neuroscience Letters. 2006. Zmienione pozakomórkowe poziomy DOPAC i HVA w jądrze szczura accumbens w odpowiedzi na podchroniczne podawanie nandrolonu i późniejsze prowokowanie amfetaminą.
- Bond AJ, Choi PY, Papież HG., Jr Ocena nastawienia uwagi i nastroju u użytkowników i nieużytkujących sterydów anaboliczno-androgennych. Uzależnienie od narkotyków i alkoholu. 1995;37: 241-5. [PubMed]
- Brower KJ. Nadużywanie i uzależnienie od steroidów anabolicznych. Aktualne raporty psychiatryczne. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Ocena kliniczna i badanie moczu pod kątem nadużywania i uzależnienia od steroidów anaboliczno-androgennych. American Journal of Drug & Alcohol Abuse. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Metabolizm steroidów w mózgu ssaków: redukcja 5alpha i aromatyzacja. Brain Research Bulletin. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Różnicowanie płciowe jądra łóżkowego terminala u ludzi może rozciągać się na dorosłość. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Reakcje behawioralne i fizjologiczne na steroidy anaboliczno-androgenne. Neuroscience & Biobehavioral Reviews. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Sterydy anaboliczno-androgenne i nagroda za mózg. Farmakologia, biochemia i zachowanie. 1996;53: 741-5.
- Conacher GN, Workman DG. Gwałtowne przestępstwa związane prawdopodobnie z użyciem sterydów anabolicznych American Journal of Psychiatry. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Fizyczna prowokacja szczurów płci męskiej narażonych na dojrzewanie płciowe steroidów anaboliczno-androgennych wywołuje agresję wobec kobiet. Hormony i zachowanie. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Płyn mózgowo-rdzeniowy i zmiany behawioralne po podaniu metylotestosteronu: wstępne wyniki. Archiwa Psychiatrii Ogólnej. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Strukturalne dymorfizmy płciowe w przednio-centralnym jądrze okołokomorowym podwzgórza szczura są wrażliwe na sterydy gonadalne okołoporodowo, ale rozwijają się obwodowo. Neuroendokrynologia. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Testosteron jako bodziec apetyczny i dyskryminujący u szczurów: efekty zależne od płci i dawki. Fizjologia i zachowanie. 1992;52: 629-34. [PubMed]
- Dekaban AS. Zmiany w masie mózgu w okresie życia ludzkiego: stosunek wag mózgu do wysokości ciała i masy ciała. Annals of Neurology. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Leki nadużywane przez ludzi preferencyjnie zwiększają stężenia synaptycznej dopaminy w mezolimbicznym systemie swobodnie poruszających się szczurów. Postępowanie Narodowej Akademii Nauk Stanów Zjednoczonych Ameryki. 1988;85: 5274-8. [Artykuł bezpłatny PMC] [PubMed]
- DiMeo AN, Wood RI. Samo podawanie estrogenu i dihydrotestosteronu u samców chomików. Hormony i zachowanie. 2006;49: 519-26. [PubMed]
- DiPasquale M. Sterydy anaboliczne. W: Tarter RE, Ammerman RT, Ott PJ, redaktorzy. Podręcznik nadużywania substancji. Prasa plenum; NY: 1998. str. 547 – 565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Regulacja przez przyśrodkowe ciało migdałowate kopulacji i przyśrodkowe preoptyczne uwalnianie dopaminy. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stymulacja przyśrodkowego ciała migdałowatego zwiększa przyśrodkowe przedoptowe uwalnianie dopaminy: implikacje dla zachowań seksualnych samców szczura. Brain Research. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastracja zmniejsza pozakomórkową, ale zwiększa wewnątrzkomórkową dopaminę w środkowym obszarze przedbłonowym samców szczurów. Brain Research. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Natura i los komórek proliferacyjnych w zakręcie zębatym hipokampa w okresie życia małpy rezus. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Badania zachowania instrumentalnego ze wzmocnieniem seksualnym u samców szczurów (Rattus norvegicus): II. Skutki zmian przedrakowych, kastracji i testosteronu. Journal of Comparative Psychology. 1987;101: 407-19. [PubMed]
- Gallaway S. Biblia steroidowa. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Profil osobowości mężczyzn stosujących sterydy anaboliczno-androgenne. Hormony i zachowanie. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Przedłużone zmiany w układzie nerwowym serotoniny po ustaniu młodzieńczej anaboliczno-androgennej ekspozycji steroidowej u chomików (Mesocricetus auratus) Behawioralna neuronauka. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Zmiany psychiczne i kwas homowanilinowy w surowicy u mężczyzn, którym podawano steroidy androgenne. Psychoneuroendocrinology. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni Rh. Psychoneuroendocrinology. 2000;25: 317-38. [PubMed]
- He J, Crews FT. Neurogeneza zmniejsza się podczas dojrzewania mózgu od okresu dojrzewania do dorosłości. Farmakologia, biochemia i zachowanie. 2007;86: 327-33.
- Henderson LP. Modulacja steroidowa transmisji za pośrednictwem receptora GABAA w podwzgórzu: wpływ na funkcje rozrodcze. Neuropharmacology. 2007;52: 1439-53. [Artykuł bezpłatny PMC] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Pozakomórkowa dopamina w obszarze przyśrodkowym: implikacje dla motywacji seksualnej i hormonalnej kontroli kopulacji. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Męskie zachowania seksualne. W: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, redaktorzy. Hormony, mózg i zachowanie. Academic Press; Nowy Jork: 2002. str. 3 – 137.
- Hull EM, Wood RI, McKenna KE. Neurobiologia zachowań seksualnych mężczyzn. W: Neill JD, redaktor. Fizjologia reprodukcji. Vol. 1. Elsevier Press; Nowy Jork: 2006. str. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Regionalne różnice w synaptogenezie w korze mózgowej człowieka. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Samosterowanie doustnym testosteronem u samców chomików. Neuroendokrynologia. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Uczniowie szkół średnich (publikacja NIH nr 03 – 5375) I. Bethesda, MD: National Institute on Drug Abuse; 2003. Monitorowanie przyszłych wyników badań krajowych dotyczących zażywania narkotyków, 1975 – 2002.
- Kaiser Family Foundation. Aktywność seksualna nastolatków w USA. 2005. str. # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulacja immunoreaktywności receptora androgenowego w mózgu przez androgen u samców fretek przed okresem dojrzewania. Biologia reprodukcji. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminergiczne efekty po przewlekłym leczeniu nandrolonem uwidocznionym w mózgu szczura przez pozytronową tomografię emisyjną. Postęp w NeuroPsychopharmacology & Biological Psychiatry. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Anaboliczno-androgenny steroidowy dekanian nandrolonu wpływa na gęstość receptorów dopaminy w męskim mózgu szczura. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Przewlekłe podawanie dekanianu nandrolonu indukuje zmiany w zawartości transkryptu genu receptorów dopaminy D (1) i D (2) w mózgu szczura. Brain Research. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Właściwości afektywne zastrzyków testosteronu w obrębie śródśrodkowego obszaru przedbłonkowego u samców szczurów. Neuroscience Letters. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Neurobiologia uzależnienia od narkotyków. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Papież HG, Jr, Oliva PS. Zwiększona agresywna odpowiedź u ochotników płci męskiej po podaniu stopniowo rosnących dawek cypionianu testosteronu. Uzależnienie od narkotyków i alkoholu. 1995;40: 73-9. [PubMed]
- Kritzer MF. Długotrwała gonadektomia wpływa na gęstość aksonów hydroksylazy tyrozynowej, ale nie aksonów immunoreaktywnych na beta-hydroksylazę, dopaminę lub serotoninę w środkowej przedczołowej korze dorosłych samców szczurów. Kora mózgowa. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Wpływ leczenia przewlekłym dekanianem nandrolonu na układy neuronalne dopaminergiczne i serotoninergiczne w mózgach szczurów. Brain Research. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Modulacja neurosteroidowa receptorów GABAA. Postęp w neurobiologii. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Rozwój mózgu u dzieci i młodzieży: wnioski z anatomicznego obrazowania metodą rezonansu magnetycznego. Neuroscience & Biobehavioral Review. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogeneza unerwienia dopaminy w jądrze półleżącym myszoskoczków. Brain Research. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Hamowanie odpowiedzi NMDA przez siarczan pregnenolonu ujawnia selektywną modulację podtypów receptorów NMDA przez siarczanowane steroidy. British Journal of Pharmacology. 2002;135: 901-9. [Artykuł bezpłatny PMC] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Skuteczna agresja intermale i warunkowa preferencja miejsca u myszy. Fizjologia i zachowanie. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Działania testosteronu u samców chomika przed okresem dojrzewania i po urodzeniu: rozłączenie wpływu na zachowanie reprodukcyjne i immunoreaktywność receptora androgenowego w mózgu. Hormony i zachowania. 1997;31: 75-88.
- Meisel RL, Joppa MA. Warunkowe preferencje dotyczące miejsca u samic chomików po agresywnych lub seksualnych spotkaniach. Fizjologia i zachowanie. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Anaboliczne działanie androgenne steroidów w okresie dojrzewania i agresywne zachowanie u złotych chomików. Fizjologia i zachowanie. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Zwiększona regulacja immunoreaktywności receptora androgenowego w mózgu szczura przez sterydy androgenowo-anaboliczne. Brain Research. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiol zmniejsza prądy wapnia w neuronach prążkowia szczura przez receptor błonowy. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Poziom agresji wśród grupy użytkowników sterydów anaboliczno-androgennych. Medycyna, nauka i prawo. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Doświadczenie społeczne młodzieży przywraca zachowanie wytrysku u dorosłych chomików syryjskich pozbawionych dojrzewania testosteronu. Towarzystwo Neuroendokrynologii Behawioralnej; Pacific Grove, CA: 2007.
- Szlachetny RG, Alsum PB. Hormonalne zależne od płci dymorfizmy u złotego chomika (Mesocricetus auratus) Fizjologia i zachowanie. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Śmierć komórek w rozwoju kory tylnej u samców i samic szczurów. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Hormony jajników po urodzeniu 20 zmniejszają liczbę neuronów w pierwotnej korze wzrokowej szczura. Journal of Neurobiology. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Wpływ testosteronu na nastrój, agresję i zachowania seksualne u młodych mężczyzn: podwójnie ślepe, kontrolowane placebo, badanie krzyżowe. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Nagradzające właściwości afektywne zastrzyków testosteronu wewnątrz jądra półleżącego. Behawioralna neuronauka. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. MRNA GnRH zwiększa się wraz z dojrzewaniem w męskim mózgu chomika syryjskiego. Journal of Neuroendocrinology. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Stosowanie steroidów anabolicznych przez sportowców amatorów: wpływ na psychiczne stany nastroju. Journal of Sports Medicine & Physical Fitness. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Rozpoznanie i wynik rozrodczy po chirurgicznym leczeniu pełnej przegrodowej macicy, powielonej szyjki macicy i przegrody pochwy. American Journal of Obstetrics & Gynecology. 2004;190: 1669 – 75. 1675 – 8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Dojrzewanie istoty białej w mózgu człowieka: przegląd badań rezonansu magnetycznego. Brain Research Bulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Miary agresji i zmian nastroju u mężczyzn ciężarowców z androgennym sterydem anabolicznym i bez niego. Journal of Forensic Sciences. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Zależność androgenów u chomików: przedawkowanie, tolerancja i potencjalne mechanizmy opioidergiczne. Neuronauka. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Zachowania seksualne zwiększają centralną transmisję dopaminy u samca szczura. Brain Research. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC. Organizowanie działania prenatalnie podawanego propionianu testosteronu na tkanki, w których pośredniczy zachowanie krycia u samicy świnki morskiej. Endokrynologia. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Rozwój różnic płci w locus coeruleus szczura. Brain Research Bulletin. 2001;56: 73-8. [PubMed]
- Pope HG, Jr, Katz DL. Zabójstwa i bliskie zabójstwa użytkowników sterydów anabolicznych. [Patrz komentarz] Journal of Clinical Psychiatry. 1990;51: 28-31. [PubMed]
- Pope HG, Jr, Katz DL. Psychiatryczne i medyczne skutki stosowania sterydów anaboliczno-androgennych. Kontrolowane badanie sportowców 160. Archiwa Psychiatrii Ogólnej. 1994;51: 375-82. [PubMed]
- Pope HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Stosowanie anaboliczno-androgennych steroidów wśród więźniów 133. Kompleksowa psychiatria. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Przywrócenie testosteronu zachowania kopulacyjnego koreluje z przyśrodkowym preoptycznym uwalnianiem dopaminy u kastrowanych samców szczurów. Hormony i zachowanie. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Wpływ metabolitów testosteronu na kopulację i przyśrodkowe uwalnianie dopaminy u kastrowanych samców szczurów. Hormony i zachowanie. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Wpływ metabolitów testosteronu na kopulację, przyśrodkową dopaminę dopaminową i immunoreaktywność NOS u wykastrowanych samców szczurów. Hormony i zachowanie. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Po urodzeniu neurogeneza wazopresyny i jądra zawierającego oksytocynę podwzgórza świni. Brain Research. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Aktywność i ekspresja receptora Jr Serotoniny-1A modulują u chomików agresję anaboliczną / androgenną wywołaną steroidami u młodzieży. Farmakologia, biochemia i zachowanie. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosteron aktywuje zachowania seksualne u dorosłych samców chomików, ale nie u młodych osobników. Fizjologia i zachowanie. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Immunoreaktywność receptora estrogenowego u przedwczesnych i dorosłych samców chomików syryjskich. Neuroscience Letters. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromony wywołują równoważne poziomy immunoreaktywności Fos u przedwczesnych i dorosłych samców chomików syryjskich. Hormony i zachowanie. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Dojrzewanie i dojrzewanie męskiego mózgu i zachowania seksualne: przekształcenie potencjału behawioralnego. Neuroscience & Biobehavioral Reviews. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiol indukuje receptory progesteronu podwzgórza, ale nie aktywuje zachowania krycia u samców chomików (Mesocricetus auratus) przed okresem dojrzewania. Behawioralna neuronauka. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Sterydy anaboliczno-androgenne (AAS) różnie wpływają na zachowania społeczne u młodzieńców i dorosłych chomików syryjskich. Hormony i zachowanie. 2008 w prasie.
- SAMHSA / OAS. Publikacja DHHS nr (SMA) 1996. 1994 Krajowe badanie gospodarstw domowych na temat nadużywania narkotyków, główne ustalenia 1994; str. 96 – 3085.
- SAMHSA / OAS. Wyniki krajowego badania 2004 dotyczącego używania narkotyków i zdrowia: wyniki krajowe. 2005. Seria NSDUH H-28, publikacja DHHS nr SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Samo podawanie androgenów u szczurów Tfm. 10th Doroczne spotkanie Society for Behavioral Neuroendocrinology.2006.
- Sato SM, Wood RI. Samodzielne podawanie nieprzepuszczalnych dla błon steroidów anaboliczno-androgennych (aas) u chomików syryjskich. 11th Doroczne spotkanie Society of Behavioral Neuroendocrinology.2007.
- Schroeder JP, Packard MG. Rola podtypów receptora dopaminy w nabywaniu preferencji miejsca warunkowanej testosteronem u szczurów. Neuroscience Letters. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Przemoc domowa związana z nadużywaniem sterydów anabolicznych. American Journal of Psychiatry. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Ekspozycja na hormony jąder w okresie dojrzewania organizuje zachowanie oznakowania bocznego i wiązanie receptora wazopresyny w przegrodzie bocznej. Hormony i zachowanie. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. W okresie dojrzewania płciowego u samców chomika syryjskiego pojawiają się reakcje dopaminergiczne okolicy przedostrej przyśrodkowej na feromony żeńskie. Brain Research. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. W męskim chomiku syryjskim hormony gonadalne maskulinizują i rozmiękczają zachowania reprodukcyjne w okresie dojrzewania. Hormony i zachowanie. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Hormony dojrzewania, mózg młodzieńczy i dojrzewanie zachowań społecznych: Lekcje z chomika syryjskiego. Endokrynologia molekularna i komórkowa. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Neuroscience Meeting Planner. Sandiego, CA: Society for Neuroscience; 2007. Czy okres dojrzewania jest drugim wrażliwym okresem dla organizującego wpływu testosteronu na zachowanie reprodukcyjne dorosłych mężczyzn? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Krytyczne okresy w organizacji systemów. Psychobiologia rozwojowa. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Porównawczy rozkład receptora estrogenowego-alfa i-beta mRNA w centralnym układzie nerwowym szczura. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Psychospołeczne predyktory wzmożonej fazy palenia wśród szóstoklasistów. American Journal of Health Behavior. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Hormony dojrzewania organizują mózg i zachowanie nastolatków. Granice w neuroendokrynologii. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Welcome SE, Kan E, Toga AW. Mapowanie podłużne grubości korowej i wzrostu mózgu u normalnych dzieci. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Mapowanie kontynuacji wzrostu mózgu i redukcji gęstości istoty szarej w korze czołowej grzbietowej: odwrotne zależności podczas dojrzewania mózgu po urodzeniu. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spear LP. Młodzieżowy mózg i związane z wiekiem objawy behawioralne. Neuroscience & Biobehavioral Review. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neuropsychiatryczne działanie sterydów anabolicznych u mężczyzn zdrowych ochotników. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Zwiększone aktywności dopaminergiczne i 5-hydroksytryptaminergiczne w męskim mózgu szczura po długotrwałym leczeniu steroidami anaboliczno-androgennymi. British Journal of Pharmacology. 1999;126: 1301-6. [Artykuł bezpłatny PMC] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, estrogeny i androgeny sprzężone z białkami G w gonadach ryb. Steroidy. 2006;71: 310-6. [PubMed]
- Tricker R., Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Sygnały chemosensoryczne są niezbędne do wywołanego parowania uwalniania dopaminy w MPOA samców chomików syryjskich. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testosteron i jądro nabierają dopaminy w męskim chomiku syryjskim. Psychoneuroendocrinology (w prasie)
- Van Eenoo P, Delbeke FT. Rozpowszechnienie dopingu we Flandrii w porównaniu z rozpowszechnieniem dopingu w sportach międzynarodowych. International Journal of Sports Medicine. 2003;24: 565-570. [PubMed]
- WADA. Niekorzystne wyniki analityczne zgłoszone przez akredytowane laboratoria. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Układanie steroidów anaboliczno-androgennych (AAS) w okresie dojrzewania u szczurów: ocena neuroendokrynna i behawioralna. Farmakologia, biochemia i zachowanie. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Stosowanie sterydów anaboliczno-androgennych w okresie dojrzewania: wygrywanie, wyglądanie dobrze lub bycie złym? Journal of Studies on Alcohol. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Wzmocnienie testosteronu: samopodawanie dożylne i do komór mózgowych samców szczurów i chomików. Psychofarmakologia. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Receptory androgenów i estrogenów współistnieją z poszczególnymi neuronami w mózgu chomika syryjskiego. Neuroendokrynologia. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Integracja neuronalna sygnałów chemosensorycznych i hormonalnych, które kontrolują męskie zachowania seksualne. W: Wallen K, Schneider JS, redaktorzy. Reprodukcja w kontekście. MIT Press; Cambridge: 1999. str. 423 – 444.
- Zahm DS, Heimer L. Dwa transpallidalne szlaki pochodzące z jądra półleżącego szczura. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]