- 1Wydział Nauk Biomedycznych, Sekcja Neurobiologii i Farmakologii Klinicznej oraz Centrum Doskonałości Neurobiologii Uzależnień, Uniwersytet w Cagliari, Cagliari, Włochy
- 2Wydział Nauk Przyrodniczych i Środowiskowych, Sekcja Nauk Farmaceutycznych, Farmakologicznych i Odżywczych, Uniwersytet w Cagliari, Cagliari, Włochy
- 3Institute of Neuroscience, National Research Council, Sekcja Cagliari, Cittadella Universitaria, Cagliari, Włochy
Szczury spokrewnione z Roman High- (RHA) i Low-Avoidance (RLA), które różnią się odpowiednio szybkim i słabym nabyciem aktywnej odpowiedzi unikania w skrzynce wahadłowej, wykazują różnice w aktywności seksualnej, gdy są umieszczone w obecności seksualnie otwarta samica szczura. Rzeczywiście, szczury RHA wykazują wyższy poziom motywacji seksualnej i wydajności kopulacyjnej niż szczury RLA, które utrzymują się również po wielokrotnej aktywności seksualnej. Różnice te zostały skorelowane z wyższym napięciem mezolimbicznego układu dopaminergicznego szczurów RHA w porównaniu ze szczurami RLA, co objawiło się wyższym wzrostem dopaminy stwierdzonym w dializacie uzyskanym z jądra półleżącego RHA niż szczurów RLA podczas aktywności seksualnej. Ta praca pokazuje, że zewnątrzkomórkowa dopamina i noradrenalina (NA) również zwiększają dializat z przyśrodkowej kory przedczołowej (mPFC) samców szczurów RHA i RLA w obecności niedostępnej samicy szczura i bardziej wyraźnie podczas bezpośredniej interakcji seksualnej. Takie wzrosty dopaminy (i jej głównego metabolitu, kwasu 3,4-dihydroksyfenylooctowego, DOPAC) i NA stwierdzono zarówno u zwierząt naiwnych, jak i doświadczonych seksualnie, ale były wyższe: (i) u szczurów RHA niż u szczurów RLA; oraz (ii) u doświadczonych seksualnie szczurów RHA i RLA niż u ich naiwnych odpowiedników. Wreszcie różnice w dopaminie i NA w mPFC występowały jednocześnie z tymi w aktywności seksualnej, ponieważ szczury RHA wykazywały wyższy poziom motywacji seksualnej i wydajności kopulacyjnej niż szczury RLA zarówno w warunkach naiwnych seksualnie, jak i doświadczonych. Wyniki te sugerują, że wyższy ton dopaminergiczny występuje również w mPFC, wraz ze zwiększonym tonem noradrenergicznym, który może być zaangażowany w różne wzorce kopulacyjne występujące u szczurów RHA i RLA, jak sugerowano dla mezolimbicznego układu dopaminergicznego.
Wprowadzenie
Rzymskie linie szczurów o wysokim (RHA) i niskim unikaniu (RLA), pierwotnie wybrane do odpowiednio szybkiego i słabego nabywania aktywnej odpowiedzi unikania w skrzynce wahadłowej (Bignami, 1965; Broadhurst i Bignami, 1965; Driscoll i Battig, 1982; Fernández-Teruel i in., 2002; Giorgi i in., 2007) wykazują znaczące różnice w aktywności seksualnej w obecności samicy szczura podatnej na seks. Rzeczywiście, szczury RHA wykazują wyższy poziom motywacji seksualnej niż szczury RLA, o czym świadczy większa liczba bezkontaktowych erekcji prącia wykazywanych przez te szczury, gdy są umieszczone w obecności niedostępnej receptywnej samicy, oraz lepsze wyniki kopulacyjne niż szczury RLA, co ujawniają znaczące różnice w wielu parametrach kopulacyjnych stwierdzone głównie w pierwszym teście kopulacyjnym między dwiema liniami szczurów, ale także po pięciu testach kopulacyjnych, chociaż są osłabione (Sanna i in., 2014a). Wśród najbardziej wyraźnych różnic stwierdzonych między szczurami RHA i RLA jest odsetek szczurów, które inicjują dosiadanie i intromitowanie oraz które wytryskują w pierwszym teście kopulacyjnym, odpowiednio 80% szczurów RHA i 40% szczurów RLA (Sanna i in., 2014a). Wiele dowodów eksperymentalnych sugeruje, że funkcjonalnie odmienny ton dopaminergiczny jest zaangażowany w różnice w kopulacji między szczurami RHA i RLA. W rzeczywistości stwierdzono, że różne wzorce kopulacyjne szczurów RHA i RLA są różnie modyfikowane przez apomorfinę, mieszanego agonistę receptora dopaminy D1/D2, podawanego w dawkach ułatwiających zachowania seksualne, oraz przez haloperidol, antagonistę receptora dopaminy D2, podawanego w niskich dawkach, które hamują zachowania seksualne.Sanna i in., 2014b). W związku z tym stwierdzono, że szczury RLA są bardziej wrażliwe na ułatwianie i hamowanie zachowań seksualnych wywołanych odpowiednio apomorfiną i haloperidolem, co wykazano przez większe modyfikacje wywołane przez te dwa leki, głównie przy podawaniu w niższych dawkach w różnych parametrach kopulacyjnych u szczurów RLA w odniesieniu do szczurów RHA (Sanna i in., 2014b). Być może ważniejsze dla tego badania, różne wzorce kopulacyjne szczurów RHA i RLA są również związane z różnicami w aktywności mezolimbicznych neuronów dopaminergicznych, o których wiadomo, że aktywność wzrasta podczas zachowań seksualnych.Pfaus i wsp., 1990; Pleim i wsp., 1990; Pfaus i Phillips, 1991; Damsma i wsp., 1992; Wenkstern i wsp., 1993; Balfour i wsp., 2004; Pitchers i wsp., 2010, 2013; Beloate i in., 2016). Rzeczywiście, pomimo faktu, że naiwne seksualnie i doświadczone seksualnie szczury RHA i RLA mają podobne podstawowe wartości zewnątrzkomórkowej dopaminy w dializacie z jądra półleżącego, stwierdzono, że stężenia pozakomórkowej dopaminy i kwasu 3,4-dihydroksyfenylooctowego (DOPAC, jeden z jego głównych metabolitów) wzrastają w różny sposób w dializatach uzyskanych z jądra półleżącego skorupy RHA i RLA naiwnych i doświadczonych seksualnie szczury zarówno w fazie przewidywania, jak i konsumpcyjnej zachowań seksualnych. Powyższe różnice były bardziej wyraźne między naiwnymi seksualnie szczurami RHA i RLA, ale utrzymywały się między doświadczonymi seksualnie szczurami RHA i RLA, chociaż miały tendencję do zmniejszania się u tych szczurów, co stwierdzono w przypadku różnic w zachowaniach seksualnych (Sanna i in., 2015).
Funkcjonalna rola wzrostu aktywności dopaminergicznej w jądrze półleżącym obserwowana podczas aktywności seksualnej (zarówno w fazach apetycznych, jak i konsumpcyjnych zachowań seksualnych) jest nadal przedmiotem dyskusji, podobnie jak ta obserwowana podczas karmienia, które podobnie jak aktywność seksualna ma silną motywacyjną wartościowość. Tak więc, chociaż dopamina w jądrze półleżącym jest zaangażowana w motywację, a mezolimbiczne neurony dopaminergiczne są zwykle określane jako nagradzające neurony, w ciągu ostatnich 15 lat ostatnie badania potwierdzają hipotezę, że dopamina mezolimbiczna nie jest zaangażowana w pierwotną ekspresję motywowanych lub nagradzających zachowań, ale raczej w uczenie się i zapamiętywanie skojarzeń bodziec-nagroda.Agmo i in., 1995; Berridge i Robinson, 1998; Ikemoto i Panksepp, 1999; Pitchers i wsp., 2013, 2014; Beloate i in., 2016; Salamone i wsp., 2016). Zgodnie z tą hipotezą niedawno odkryto, że blokada receptorów dopaminy w jądrze półleżącym lub inaktywacja neuronów dopaminergicznych w brzusznym obszarze nakrywkowym nie jest w stanie zmienić ekspresji apetytowych i konsumpcyjnych aspektów zachowania kopulacyjnego u samców szczurów.Pitchers i wsp., 2013, 2014; Beloate i in., 2016).
Nie można jednak wykluczyć roli innych obszarów mózgu zawierających dopaminę w powyższych różnicach w zachowaniach seksualnych między szczurami RHA i RLA. W związku z tym dobrze wiadomo, że dopamina wywiera działanie ułatwiające na antycypacyjne i konsumpcyjne fazy zachowań seksualnych u zwierząt laboratoryjnych, a także u ludzi, nie tylko w jądrze półleżącym.Everitt, 1990; Pfaus i wsp., 1990; Hull i wsp., 1991; Pfaus i Everitt, 1995; Melis i Argiolas, 2011), ale także w innych obszarach mózgu, takich jak przyśrodkowy obszar przedwzrokowy, podwzgórze i jego jądra (tj. jądro przykomorowe (PVN); Pfaus i Phillips, 1991; Argiolas i Melis, 1995, 2005, 2013; Hull i wsp., 1995, 1999; Melis i Argiolas, 1995; Melis i in., 2003; Succu i in., 2007; Pfaus, 2010). Innym obszarem, który zawiera dopaminę i może odgrywać rolę w zachowaniach seksualnych, jest przyśrodkowa kora przedczołowa (mPFC; Fernández-Guasti i in., 1994; Agmo i Villalpando, 1995; Agmo i in., 1995; Hernández-Gonzáles i in., 1998, 2007; Kakeyama i in., 2003; Balfour i wsp., 2006; Afonso i in., 2007; Davis i wsp., 2010; Febo, 2011). W rzeczywistości w tym obszarze mózgu znajdują się zakończenia nerwowe mezokortykalnych neuronów dopaminowych, z ich ciałami komórkowymi zlokalizowanymi w brzusznym obszarze nakrywki jako mezolimbiczne neurony dopaminowe. Jeśli chodzi o jądro półleżące, dokładna rola tego obszaru mózgu w zachowaniach seksualnych jest daleka od jasności. Rzeczywiście, uszkodzenia mPFC zwykle nie są w stanie zmienić zachowań seksualnych samców szczurów z samicą podatną na seks (Fernández-Guasti i in., 1994; Agmo i Villalpando, 1995; Agmo i in., 1995; Hernández-Gonzáles i in., 1998, 2007; Kakeyama i in., 2003; Balfour i wsp., 2006; Afonso i in., 2007), ani wyrażanie warunkowej preferencji miejsca dla nagrody seksualnej (Davis i wsp., 2010). Jednak zmiany mPFC, które nie zmieniły wyglądu uwarunkowanej preferencji miejsca dla nagrody seksualnej, zniosły u tych samych zwierząt zdolność do tworzenia warunkowej niechęci do aktywności seksualnej w połączeniu z bodźcami awersyjnymi (Davis i wsp., 2010) i selektywne odpalanie komórek podczas zbliżania się samca szczura do niedostępnej samicy podatnej na seks zostały zmierzone w mPFC samców szczurów (Febo, 2011). Odkrycia te doprowadziły do sugestii, że aktywacja mPFC podczas zachowań seksualnych odgrywa rolę w integracji informacji zewnętrznych i wewnętrznych w celu wykonania i kontroli zachowań ukierunkowanych na cel, a nie w wyrażaniu wrodzonych odpowiedzi na naturalne wzmocnienia (zob. Goto and Grace, 2005). W związku z tym, wraz z jądrem półleżącym, mPFC jest częścią złożonego układu nerwowego zaangażowanego w modulację zachowania motywowanego (zachowanie ukierunkowane na cel), co wymaga integracji informacji poznawczych z mPFC, informacji emocjonalnych z ciała migdałowatego i informacji związanych z kontekstem z hipokampu w jądrze półleżącym (Goto and Grace, 2005).
Dowody eksperymentalne sugerują, że uwalnianie dopaminy w mPFC jest zaangażowane w adaptacyjną regulację motywowanego zachowania i uważa się, że deregulacja tych mechanizmów odgrywa rolę w stanach patologicznych lub nieprzystosowawczych, takich jak zaburzenia psychiczne, takie jak schizofrenia, deficyt uwagi i zaburzenia nadpobudliwości (ADHD), depresja (XNUMX).Dunlop i Nemeroff, 2007; Masana i in., 2011) lub nadużywanie substancji i hazard (Everitt i Robbins, 2005). Co ciekawe, na aktywność dopaminy uwalnianej w mPFC może wpływać noradrenalina (NA), która jest obecna w mPFC na wyższym poziomie niż dopamina, a w szczególności transporter NA (NET), który jest nie tylko liczniejszy niż transporter dopaminy (DAT) w mPFC (Carboni i in., 1990, 2006; Gresch i in., 1995; Westernik i in., 1998), ale także wykazuje powinowactwo do dopaminy nawet większe niż do NA (Róg, 1973). Ponieważ dopamina i NA często współpracują w wielu funkcjach mPFC, od pamięci roboczej i tworzenia zestawu uwagi i przesunięcia do odwrotnego uczenia się, hamowania odpowiedzi i odpowiedzi na stres (zob. Robbins i Arnsten, 2009), stwarza to możliwość, że dopamina, sama lub razem z NA, w mPFC może również odgrywać rolę w różnicach behawioralnych między szczurami RHA i RLA, w tym w zachowaniach seksualnych.
Aby przetestować tę hipotezę, badano aktywność mezokortykalnego układu dopaminergicznego i układu noradrenergicznego w mPFC w dwóch liniach szczurów RHA i RLA za pomocą mikrodializy wewnątrzmózgowej. W skrócie, dopaminę (i jej główny metabolit DOPAC) i NA mierzono w dializatach uzyskanych z przedziałów prelimbicznych (PrL) i infralimbicznych (IL) mPFC naiwnych seksualnie (np. wysokociśnieniowa chromatografia cieczowa sprzężona z detekcją elektrochemiczną (HPLC-ECD).
Materiały i Metody
Zwierzęta
Niewsobne samce szczurów RHA i RLA (N = 30 dla każdej linii, ważące ≈300 g na początku pracy eksperymentalnej) pochodziły z kolonii założonej w 1998 roku na Uniwersytecie w Cagliari we Włoszech (Giorgi i in., 2007). Procedury stosowane do selektywnej hodowli kolonii Sardynii zostały już szczegółowo opisane (Giorgi i in., 2005).
Samice szczurów SD z wyciętymi jajnikami (250–300 g na początku pracy eksperymentalnej) użyte we wszystkich eksperymentach uzyskano z Envigo (San Pietro al Natisone, Włochy). Zwierzęta aklimatyzowano po cztery na klatkę (38 cm × 60 cm × 20 cm) w pomieszczeniach mieszkalnych Wydziału Nauk Biomedycznych Uniwersytetu w Cagliari przez co najmniej 10 dni przed rozpoczęciem eksperymentów, w 24 ° C, wilgotność 60%, odwrócony 12-godzinny cykl światło / ciemność (światła wyłączone od 08:00 do 20:00), wodę i standardową żywność laboratoryjną ad libitum. Zwierzęta codziennie dotykano przez 1–2 minuty przez cały okres przyzwyczajania, aby ograniczyć stres związany z manipulacją podczas eksperymentów; ponadto kontakt z personelem utrzymania zwierząt był ograniczony do jednego opiekuna, a ściółka w klatkach domowych nigdy nie była zmieniana ani w przeddzień, ani w dniu eksperymentów. Wszystkie eksperymenty przeprowadzono w godzinach od 10:00 do 18:00. Niniejsze opracowanie zostało przeprowadzone zgodnie z zaleceniami wytycznych Wspólnot Europejskich, Dyrektywy z dnia 22 września 2010 r. (2010/63/UE) oraz Ustawodawstwa Włoskiego (DL 4 marca 2014 r., nr 26). Protokół został zatwierdzony przez Komisję Etyczną ds. Doświadczeń na Zwierzętach Uniwersytetu w Cagliari (Upoważnienie nr 361/2016-PR, 08 kwietnia 2016 r. do FS).
Grupy Eksperymentalne
Użyto seksualnie naiwnych i doświadczonych seksualnie samców szczurów RHA i RLA. Szczury naiwne seksualnie były szczurami, które nigdy nie miały kontaktu z samicą z wyciętymi jajnikami i estradiolem + progesteronem; szczury doświadczone seksualnie to szczury, które przeszły już pięć kolejnych testów kopulacji trwających 60 minut w odstępach 3 dni z receptywną samicą (Sanna i in., 2014a,b). Samice wywołano ruję przez podanie podskórnie benzoesanu estradiolu (200 μg/szczura w oleju arachidowym) i progesteronu (0.5 mg/szczura w oleju arachidowym), odpowiednio 48 godzin i 6 godzin przed testami kopulacji. Ruję weryfikowano za pomocą barwienia May-Grunwald-Giemsa i badania mikroskopowego wymazów z pochwy na 1 godzinę przed doświadczeniem. Zgodnie z poprzednimi badaniami (Sanna i in., 2014a,b, 2015) pięć wstępnych testów kopulacji okazało się wystarczających, aby samce szczurów rzymskich obu linii wykazywały stały poziom aktywności kopulacyjnej: np. doświadczone seksualnie szczury RHA i RLA spełniły kryterium co najmniej jednego wytrysku osiągniętego w każdym z ostatnich dwóch testów (jeden szczur RHA i dwa szczury RLA, które nie spełniły tego kryterium, zostały odrzucone w tej fazie). Dwa dni po tych wstępnych testach kopulacyjnych, doświadczone seksualnie szczury rzymskie przeszły operację stereotaktyczną w celu wszczepienia sondy do mikrodializy w mPFC, jak opisano poniżej (Sanna i in., 2015).
Mikrodializa w mPFC podczas zachowań seksualnych
Dzień przed mikrodializą naiwne seksualnie lub doświadczone szczury RHA i RLA umieszczono w aparacie stereotaktycznym (Stoelting Co., Wood Dale, IL, USA) w znieczuleniu izofluranem (1.5, 2% –3%; Harvard Apparatus, Holliston, MA, USA) i wszczepiono pionową sondę do mikrodializy domowej roboty (membrana dializacyjna ≈XNUMX mm wolnej powierzchni; Melis i in., 2003) i skierowany jednostronnie na przedziały mPFC, PrL i IL (współrzędne: 3.0 mm z przodu i 0.7 mm z boku do bregma i 5.5 mm brzusznie do opony twardej; Paxinos i Watson, 2004). W dniu eksperymentu zwierzęta przenoszono podczas ciemnej fazy cyklu do klatki godowej (45 cm × 30 cm × 24 cm), która znajdowała się w dźwiękoszczelnym pomieszczeniu oświetlonym przyćmionym czerwonym światłem i zawierała wewnątrz kolejną małą klatkę z pleksiglasu (15 cm × 15 cm × 15 cm) z 25 otworami (Ø 2 mm) w pionowych ścianach, aby umożliwić interakcję wzrokową, węchową i akustyczną, ale nie bezpośrednią. Po okresie przyzwyczajenia trwającym 2 godziny sondę do mikrodializy podłączono do pompy mikroinfuzyjnej CMA/100 (Harvard Apparatus, Holliston, MA, USA) za pomocą rurek polietylenowych i poddano perfuzji roztworem Ringera (147 mM NaCl, 3 mM KCl i 1.2 mM CaCl2, pH 6.5), przy szybkości przepływu 2.5 μl/min. Po 2-godzinnym okresie równoważenia pożywki perfuzyjnej z płynem pozakomórkowym, co 37.5 minut podczas eksperymentu zbierano porcje dializatu po 15 μl w chłodzonych lodem probówkach polietylenowych do pomiaru stężenia dopaminy, DOPAC i NA, jak opisano poniżej. Po zebraniu co najmniej czterech porcji dializatu, receptywną samicę szczura wprowadzono do małej klatki znajdującej się wewnątrz klatki do krycia na 30 minut. W ciągu tych 30 minut zebrano kolejne dwie porcje dializatu. W tych warunkach samce szczurów nie mogą bezpośrednio wchodzić w interakcje z samicami, ale wykazują erekcję bezkontaktową (patrz poniżej). Po tym okresie usunięto małą klatkę, pozwolono na kopulację przez 75 minut i zebrano kolejne pięć podwielokrotności dializatu. Pod koniec tego okresu samicę usunięto z klatki do krycia i pobrano dodatkową porcję dializatu (Pfaus i Everitt, 1995; Melis i in., 2003; Sanna i in., 2015). Parametry seksualne związane z przewidywanymi i konsumpcyjnymi fazami zachowań seksualnych były rejestrowane podczas całego eksperymentu (patrz poniżej).
Zachowanie seksualne
Kilka parametrów motywacji seksualnej i wydajności kopulacyjnej związanych z antycypacyjnymi i konsumpcyjnymi fazami zachowań seksualnych zostało zarejestrowanych podczas całego eksperymentu przez obserwatora, który nie był świadomy specyficznych warunków eksperymentu, np. który nie znał linii i poziomu doświadczenia seksualnego zwierząt użytych w tym eksperymencie (patrz poniżej). W skrócie, zarejestrowano opóźnienie do pierwszej bezkontaktowej erekcji (NCPEL, liczone od czasu wprowadzenia receptywnej samicy do wewnętrznej małej klatki) i ich częstotliwość (NCPEF, liczba bezkontaktowych erekcji prącia, które występują w okresie, w którym samica jest obecna w wewnętrznej klatce). Te erekcje prącia, w których pośredniczą feromony, które występują u silnych seksualnie samców szczurów w obecności niedostępnej receptywnej samicy, są uważane za ważny wskaźnik podniecenia seksualnego.Sachs i in., 1994; Sachs, 2000; Melis i in., 2003). Kiedy interakcja seksualna była dozwolona, np. podczas kopulacji, opóźnienie do dosiadania i intromisji (ML i IL, czas od usunięcia wewnętrznej małej klatki do odpowiednio pierwszego wierzchowca lub pierwszej intromisji); częstotliwość dosiadania i intromisji (MF i IF, odpowiednio liczba wierzchowców i intromisji w pierwszej serii aktywności kopulacyjnej iw całym okresie kopulacji); latencja do wytrysku (EL, czas od pierwszego wprowadzenia pierwszej serii do wytrysku); zarejestrowano częstotliwość wytrysku (EF, całkowita liczba wytrysków podczas testu kopulacji) i odstęp po wytrysku (PEI, liczony od pierwszego wytrysku do następnego intromisji). Ponadto obliczono również skuteczność kopulacyjną (CE; liczba intromisji danej serii podzielona przez sumę liczby wierzchowców i intromisji w tej samej serii) oraz odstęp między intromisjami (III; stosunek między opóźnieniem wytrysku danej serii a liczbą intromisji w tej serii) dla pierwszej serii aktywności kopulacyjnej (Sachs i Barfield, 1976; Meisel i Sachs, 1994; Melis i in., 2003; Sanna i in., 2014a,b, 2015).
Oznaczanie stężeń dopaminy, DOPAC i noradrenaliny w dializacie z mPFC
Stężenia dopaminy, DOPAC i NA mierzono w 20 μl tej samej porcji dializatu z mPFC za pomocą wysokociśnieniowej chromatografii cieczowej (HPLC) połączonej z wykrywaniem elektrochemicznym przy użyciu podwójnej celi 4011 (Coulochem II, ESA, Cambridge, MA, USA), jak już opisano (Melis i in., 2003). Detekcję przeprowadzono w trybie redukcji przy +350 i -180 mV. HPLC wyposażono w kolumnę Supelcosil C18 (7.5 cm x 3.0 mm id, 3 μm wielkość cząstek; Supelco, Supelchem, Mediolan, Włochy), eluowaną 0.06 M cytrynianem/octanem pH 4.2, zawierającym 20% obj./obj. fazy, przy szybkości przepływu 0.1 ml/min i temperaturze pokojowej. Czułość testu wynosiła 1 pg dla dopaminy, 0.03 pg dla DOPAC i 0.6 pg dla NA.
Histologia
Pod koniec eksperymentów szczury zabijano przez dekapitację, mózgi natychmiast usuwano z czaszki i zanurzano w 4% wodnym roztworze formaldehydu na 12–15 dni. Po tym okresie za pomocą mikrotomu zamrażającego przygotowano skrawki mózgu o grubości 40 μm, barwiono czerwienią neutralną i oglądano pod mikroskopem z kontrastem fazowym. Pozycja końcówki sondy została następnie zlokalizowana w mPFC, podążając za przewodem sondy przez szereg skrawków mózgu (patrz ryc. 1). Do statystycznej oceny wyników wzięto pod uwagę tylko szczury, u których stwierdzono, że aktywna część membrany dializacyjnej jest prawidłowo umieszczona w przedziałach PrL i IL mPFC (jeden szczur z każdej grupy eksperymentalnej został odrzucony w tej fazie).
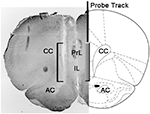 Rysunek 1. Schematyczne przedstawienie koronowego przekroju mózgu szczura pokazujące ścieżkę sondy do mikrodializy w częściach PrL i IL przyśrodkowej kory przedczołowej (mPFC; Paxinos i Watson, 2004). Kwadratowy nawias na mikrofotografii wskazuje część wycinka wybarwionego na czerwień neutralną, przedstawiającą aktywną część membrany dializacyjnej sondy do mikrodializy. Skróty: PrL, obszar prelimbiczny; IL, obszar podlimbiczny; AC, komisura przednia; CC, ciało modzelowate.
Rysunek 1. Schematyczne przedstawienie koronowego przekroju mózgu szczura pokazujące ścieżkę sondy do mikrodializy w częściach PrL i IL przyśrodkowej kory przedczołowej (mPFC; Paxinos i Watson, 2004). Kwadratowy nawias na mikrofotografii wskazuje część wycinka wybarwionego na czerwień neutralną, przedstawiającą aktywną część membrany dializacyjnej sondy do mikrodializy. Skróty: PrL, obszar prelimbiczny; IL, obszar podlimbiczny; AC, komisura przednia; CC, ciało modzelowate.
Statistics
Analizy statystyczne danych biochemicznych (dopamina, DOPAC i NA) i behawioralnych (NCPEL i NCPEF, ML, IL i EL, MF, IF i EF oraz PEI) przeprowadzono z uwzględnieniem wszystkich osobników eksperymentalnych (jak tradycyjnie robiono w badaniach zachowania kopulacyjnego samców szczurów) lub z wyłączeniem osobników, którzy nie kopulowali do wytrysku podczas eksperymentu z mikrodializą. W pierwszym przypadku, gdy do analiz włączono wszystkie zwierzęta, zwierzętom, które nie wykazywały NCPE w czasie, gdy samica była niedostępna lub nie dosiadały, nie intromitowały ani nie wytryskiwały z dostępną samicą, przypisywano odpowiednie wyniki pełnego zakresu: 1800 s, jeśli samiec nie wykazywał NCPE w ciągu 30 minut, w których samica była niedostępna; 900 s dla ML i IL, jeśli samiec nie dosiadł lub nie intromitował z dostępną samicą; 1800 s dla EL, jeśli mężczyzna nie osiągnął wytrysku i 600 s dla PEI, jeśli mężczyzna nie intromitował po pierwszym wytrysku. W drugim przypadku z analiz wykluczono te zwierzęta, które nie kopulowały do wytrysku. Dokonano tego w celu oceny, czy różnice w zachowaniach seksualnych mogą być skorelowane z różnicami w stężeniach pozakomórkowej dopaminy, DOPAC i NA w mPFC linii szczurów rzymskich podczas dwóch faz aktywności seksualnej, wykluczając możliwe zakłócenia mylące z powodu włączenia osób, które nie wykazywały zachowań seksualnych, przypisując im stałe wartości dla analizowanych parametrów seksualnych.
Przeprowadzono kilka analiz statystycznych za pomocą ANOVA w celu wykrycia i lepszego scharakteryzowania możliwych różnic między zastosowanymi warunkami eksperymentalnymi. Przed wykonaniem ANOVA, zestawy danych dla każdej z różnych zmiennych eksperymentalnych zostały sprawdzone pod kątem jednorodności wariancji między czterema grupami eksperymentalnymi (wykonane ze wszystkimi zwierzętami lub ze szczurami kopulującymi tylko do wytrysku) z testem Bartletta lub Levine'a, w zależności od przypadku. Gdy stwierdzono znaczące różnice w wariancjach, zbiory danych transformowano logarytmicznie (tj. eksperymentalne wartości Y zmieniono na wartości log Y), ponownie sprawdzano pod kątem jednorodności wariancji, a następnie analizowano za pomocą ANOVA. W skrócie, parametry behawioralne uzyskane przed (np. Z niedostępną samicą) i podczas pierwszej serii aktywności kopulacyjnej (od pierwszego wierzchowca / wejścia do pierwszego wierzchowca / wejścia po pierwszym wytrysku) naiwnych i doświadczonych seksualnie samców szczurów RHA i RLA podczas mikrodializy analizowano za pomocą dwukierunkowej ANOVA, stosując linię szczura i poziom doświadczenia seksualnego między czynnikami osobników (średnie wartości parametrów behawioralnych podano w tabeli 1 oraz F wartości i poziomy istotności analiz ANOVA w tabeli 2).
 Tabela 1. Parametry kopulacyjne mierzone w pierwszej serii aktywności kopulacyjnej (która rozpoczyna się wraz z pierwszym wejściem/wprowadzeniem, gdy samica jest udostępniana samcowi, a kończy się po okresie po wytrysku z pierwszym wejściem/wprowadzeniem drugiej serii) oraz bezkontaktowymi erekcjami prącia naiwnych seksualnie i doświadczonych szczurów RHA i RLA.
Tabela 1. Parametry kopulacyjne mierzone w pierwszej serii aktywności kopulacyjnej (która rozpoczyna się wraz z pierwszym wejściem/wprowadzeniem, gdy samica jest udostępniana samcowi, a kończy się po okresie po wytrysku z pierwszym wejściem/wprowadzeniem drugiej serii) oraz bezkontaktowymi erekcjami prącia naiwnych seksualnie i doświadczonych szczurów RHA i RLA.
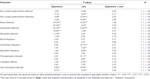 Tabela 2. F wartości i poziomy istotności dwukierunkowej analizy ANOVA przeprowadzonej na danych przedstawionych w tabeli 1 używając linii szczurów (RHA vs. RLA) i poziomu doświadczenia seksualnego (naiwny vs. doświadczony) jako między czynnikami badanych.
Tabela 2. F wartości i poziomy istotności dwukierunkowej analizy ANOVA przeprowadzonej na danych przedstawionych w tabeli 1 używając linii szczurów (RHA vs. RLA) i poziomu doświadczenia seksualnego (naiwny vs. doświadczony) jako między czynnikami badanych.
Ponadto przeprowadzono ogólną analizę danych uzyskanych od każdego szczura podczas mikrodializy, obliczając najpierw AUC uzyskane przez wykreślenie wartości stężeń dopaminy, DOPAC lub NA lub liczby bezkontaktowych erekcji, wierzchowców, intromisji i wytrysków w funkcji czasu (począwszy od 1 godziny po wprowadzeniu samca szczura do klatki godowej do końca eksperymentu -180 min podzielone na ułamki 15 min dla wartości neurochemicznych - lub w czasie, gdy samica została wprowadzona do klatki godowej dla parametrów behawioralnych), a następnie przez porównanie obliczonych wartości za pomocą dwukierunkowej ANOVA przy użyciu linii szczura i poziomu doświadczenia seksualnego między czynnikami osobników (średnie wartości AUC parametrów neurochemicznych i behawioralnych przedstawiono w tabeli 4 oraz F wartości i poziomy istotności analiz ANOVA w tabeli 5). Wreszcie, przeprowadzono bardziej szczegółową analizę punktową każdego zestawu danych (tj. wartości stężeń dopaminy, DOPAC, NA oraz liczby bezkontaktowych erekcji, wierzchowców, intromisji i wytrysków w funkcji czasu) za pomocą czynnikowych ANOVA dla powtarzanych pomiarów, stosując linię szczura i poziom doświadczenia seksualnego między czynnikami podmiotowymi a czasem (tj. frakcjami dializatu) w ramach czynnika podmiotowego ( F wartości i poziomy istotności tych analiz ANOVA przedstawiono w tabeli 6). Podobne analizy przeprowadzono również biorąc pod uwagę tylko podstawowe wartości parametrów neurochemicznych (ostatnie cztery porcje dializatu pobrane przed wprowadzeniem do klatki krycia samicy receptywnej), których średnie wartości przedstawiono w tabeli 3. Jako interakcje pierwszego, ale nie drugiego rzędu stwierdzono podczas wykonywania ogólnych ANOVA czynnikowych dla powtarzanych pomiarów, w szczególności interakcji Linia × Czas i Doświadczenie × Czas dla parametrów neurochemicznych (patrz Tabela 6), dwukierunkowe ANOVA z linią lub poziomem doświadczenia seksualnego między czynnikiem badanym a czasem w ramach czynnika badanego przeprowadzono na tych zestawach danych, bezpośrednio porównując naiwne seksualnie lub doświadczone szczury RHA z RLA lub doświadczone seksualnie vs. naiwne szczury RHA lub doświadczone seksualnie vs naiwne szczury RLA. Wyniki post hoc kontrasty parami wykonane za pomocą testu HSD Tukeya na znaczących interakcjach ujawnionych przez te dwukierunkowe ANOVA przedstawiono na rysunku 2. We wszystkich innych przypadkach post hoc porównania nie zostały zgłoszone, ponieważ ANOVA nie ujawniły żadnej znaczącej interakcji między linią szczurów, poziomem doświadczenia seksualnego i czasem. Wszystkie analizy statystyczne przeprowadzono za pomocą Graph Pad 5 (PRISM, San Diego, CA, USA) i STATISTICA 12 (Statsoft, Tulsa, OK, USA) z poziomem istotności ustalonym na P <0.05.
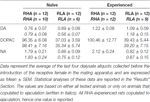 Tabela 3. Podstawowe stężenia dopaminy (DA), kwasu 3,4-dihydroksyfenylooctowego (DOPAC) i noradrenaliny (NA) (nM) w dializacie z przyśrodkowej kory przedczołowej (mPFC) seksualnie naiwnych i doświadczonych szczurów RHA i RLA.
Tabela 3. Podstawowe stężenia dopaminy (DA), kwasu 3,4-dihydroksyfenylooctowego (DOPAC) i noradrenaliny (NA) (nM) w dializacie z przyśrodkowej kory przedczołowej (mPFC) seksualnie naiwnych i doświadczonych szczurów RHA i RLA.
 Tabela 4. Ogólna ocena różnic w stężeniach DA, DOPAC i NA oraz w zachowaniach seksualnych między naiwnymi seksualnie i doświadczonymi szczurami RHA i RLA poprzez analizę uśrednionych AUC uzyskanych z wyników przedstawionych na rycinach 2 i 3.
Tabela 4. Ogólna ocena różnic w stężeniach DA, DOPAC i NA oraz w zachowaniach seksualnych między naiwnymi seksualnie i doświadczonymi szczurami RHA i RLA poprzez analizę uśrednionych AUC uzyskanych z wyników przedstawionych na rycinach 2 i 3.
 Tabela 5. F wartości i poziomy istotności dwukierunkowych ANOVA przeprowadzonych na danych przedstawionych w tabeli 4 używając linii szczurów (RHA vs. RLA) i poziomu doświadczenia seksualnego (naiwny vs. doświadczony) jako między czynnikami badanych.
Tabela 5. F wartości i poziomy istotności dwukierunkowych ANOVA przeprowadzonych na danych przedstawionych w tabeli 4 używając linii szczurów (RHA vs. RLA) i poziomu doświadczenia seksualnego (naiwny vs. doświadczony) jako między czynnikami badanych.
 Tabela 6. F wartości i poziomy istotności ogólnych ANOVA czynnikowych dla powtarzanych pomiarów przeprowadzonych na wynikach przedstawionych na rysunkach 2 i 3 stosując linię szczurów (L; RHA vs. RLA) i poziom doświadczenia seksualnego (E) (naiwny vs. doświadczony) pomiędzy czynnikami osobniczymi i czasem (T) (frakcje dializatu) jak w obrębie czynnika osobniczego.
Tabela 6. F wartości i poziomy istotności ogólnych ANOVA czynnikowych dla powtarzanych pomiarów przeprowadzonych na wynikach przedstawionych na rysunkach 2 i 3 stosując linię szczurów (L; RHA vs. RLA) i poziom doświadczenia seksualnego (E) (naiwny vs. doświadczony) pomiędzy czynnikami osobniczymi i czasem (T) (frakcje dializatu) jak w obrębie czynnika osobniczego.
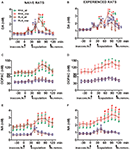 Rysunek 2. Stężenia dopaminy (DA), DOPAC i noradrenaliny (NA) w dializatach mPFC od osób naiwnych seksualnie (AS) oraz doświadczone samce szczurów RHA i RLA (B, D, K) podczas aktywności seksualnej z receptywną kobietą. Naiwni seksualnie (tj. nigdy wcześniej nie narażeni na seksualnie otwartą samicę) i doświadczeni seksualnie (którzy przeszli pięć testów kopulacji) z obu linii z sondą do mikrodializy wszczepioną stereotaktycznie w mPFC, umieszczano indywidualnie w klatkach do krycia. Sonda do mikrodializy była perfundowana buforem do dializy, jak opisano w części „Materiały i metody”. Po zebraniu czterech podwielokrotności dializatu w celu określenia wartości podstawowych, niedostępną receptywną samicę umieszczono następnie w małej klatce aparatu do krycia (czas = 0, inaccess.fe). Po 30 minutach usunięto małą klatkę i pozwolono na kopulację przez 75 minut (kopulacja), po czym samicę usunięto z klatki do krycia (fe.remov). Podczas eksperymentu mierzono erekcje bezkontaktowe i parametry kopulacyjne, a porcje dializatu zbierano co 15 minut i analizowano pod kątem dopaminy, DOPAC i NA, jak opisano w sekcji „Materiały i metody”. Wartości są średnimi ± SEM wartości uzyskanych przez wszystkie 12 szczurów na grupę (RHA_all = ciągłe zielone linie, RLA_all = ciągłe brązowe linie) lub te, które kopulowały tylko do wytrysku (RHA_cop = przerywane czerwone linie; RLA_cop = przerywane niebieskie linie). U doświadczonych szczurów RHA wszystkie zwierzęta osiągnęły kopulację i wartości są identyczne. *P < 0.05 w odniesieniu do wartości podstawowych (bez kobiet) grupy (zielony dla RHA_all; czerwony dla RHA_cop, brązowy dla RLA_all, niebieski dla RLA_cop); #P < 0.05 w odniesieniu do odpowiednich wartości grupy RLA (czerwony, RHA_all vs. RLA_all; zielony, RHA_cop vs. RLA_cop); §P <0.05 w odniesieniu do dopasowanych czasowo wartości seksualnie naiwnych szczurów (zielone, doświadczone RHA_all vs. naiwne RHA_all; czerwone, doświadczone RHA_cop vs. naiwne RHA_cop; brązowe, doświadczone RLA_all vs. naiwne RLA_all; niebieskie, doświadczone RLA_cop vs. naiwne RLA_cop) (dwukierunkowe ANOVA wykonane na pokazanych danych po ich transformacji logarytmicznej , jak wyjaśniono w podrozdziale „Materiały i metody”, podrozdział „Statystyka”, a następnie testy HSD Tukeya).
Rysunek 2. Stężenia dopaminy (DA), DOPAC i noradrenaliny (NA) w dializatach mPFC od osób naiwnych seksualnie (AS) oraz doświadczone samce szczurów RHA i RLA (B, D, K) podczas aktywności seksualnej z receptywną kobietą. Naiwni seksualnie (tj. nigdy wcześniej nie narażeni na seksualnie otwartą samicę) i doświadczeni seksualnie (którzy przeszli pięć testów kopulacji) z obu linii z sondą do mikrodializy wszczepioną stereotaktycznie w mPFC, umieszczano indywidualnie w klatkach do krycia. Sonda do mikrodializy była perfundowana buforem do dializy, jak opisano w części „Materiały i metody”. Po zebraniu czterech podwielokrotności dializatu w celu określenia wartości podstawowych, niedostępną receptywną samicę umieszczono następnie w małej klatce aparatu do krycia (czas = 0, inaccess.fe). Po 30 minutach usunięto małą klatkę i pozwolono na kopulację przez 75 minut (kopulacja), po czym samicę usunięto z klatki do krycia (fe.remov). Podczas eksperymentu mierzono erekcje bezkontaktowe i parametry kopulacyjne, a porcje dializatu zbierano co 15 minut i analizowano pod kątem dopaminy, DOPAC i NA, jak opisano w sekcji „Materiały i metody”. Wartości są średnimi ± SEM wartości uzyskanych przez wszystkie 12 szczurów na grupę (RHA_all = ciągłe zielone linie, RLA_all = ciągłe brązowe linie) lub te, które kopulowały tylko do wytrysku (RHA_cop = przerywane czerwone linie; RLA_cop = przerywane niebieskie linie). U doświadczonych szczurów RHA wszystkie zwierzęta osiągnęły kopulację i wartości są identyczne. *P < 0.05 w odniesieniu do wartości podstawowych (bez kobiet) grupy (zielony dla RHA_all; czerwony dla RHA_cop, brązowy dla RLA_all, niebieski dla RLA_cop); #P < 0.05 w odniesieniu do odpowiednich wartości grupy RLA (czerwony, RHA_all vs. RLA_all; zielony, RHA_cop vs. RLA_cop); §P <0.05 w odniesieniu do dopasowanych czasowo wartości seksualnie naiwnych szczurów (zielone, doświadczone RHA_all vs. naiwne RHA_all; czerwone, doświadczone RHA_cop vs. naiwne RHA_cop; brązowe, doświadczone RLA_all vs. naiwne RLA_all; niebieskie, doświadczone RLA_cop vs. naiwne RLA_cop) (dwukierunkowe ANOVA wykonane na pokazanych danych po ich transformacji logarytmicznej , jak wyjaśniono w podrozdziale „Materiały i metody”, podrozdział „Statystyka”, a następnie testy HSD Tukeya).
Efekt
Szczury RHA i RLA wykazują różną liczbę erekcji bezkontaktowych i różne wzorce zachowań kopulacyjnych
Zgodnie z wcześniejszymi badaniami (Sanna i in., 2014a,b, 2015), inna liczba seksualnie naiwnych samców szczurów RHA i RLA zaangażowała się w aktywność seksualną, gdy zostały połączone z receptywną samicą podczas pobierania porcji dializatu z mPFC przez mikrodializę domózgową. W skrócie, w tym badaniu 10 z 12 samców szczurów RHA naiwnych seksualnie (83%) kopulowało do wytrysku w swoim pierwszym teście kopulacyjnym, w porównaniu tylko z 6 z 12 naiwnych szczurów RLA (50%) podczas eksperymentu z mikrodializą. Tę różnicę stwierdzono również u doświadczonych seksualnie samców szczurów RHA i RLA (po pięciu testach kopulacyjnych), chociaż była osłabiona, przy czym wszystkie 12 szczurów RHA osiągnęło wytrysk w porównaniu z 9 z 12 szczurów RLA podczas mikrodializy. Zawsze w zgodzie z poprzednimi badaniami, również w tym badaniu, dwie rzymskie linie szczurów wykazywały różne opóźnienia i częstotliwości bezkontaktowych erekcji prącia po wystawieniu na niedostępną receptywną samicę, a także różne wzorce zachowań kopulacyjnych podczas interakcji seksualnych. Różnice te stwierdzano albo biorąc pod uwagę dane wszystkich zwierząt doświadczalnych z danej grupy, niezależnie od tego, czy kopulowały one z wytryskiem, czy nie (np. przypisując pełne wyniki tym zwierzętom, które nie wykazywały tego zachowania, czyli szczurom, które nie kopulowały z wytryskiem) lub biorąc pod uwagę dane zwierząt, które wykazywały zachowanie tylko z danej grupy (np. zwierzęta, które kopulowały z wytryskiem; Tabela 1). W związku z tym analizy statystyczne wartości erekcji bezkontaktowych (NCPE) i parametrów kopulacyjnych mierzonych w pierwszej serii aktywności kopulacyjnej za pomocą dwukierunkowych ANOVA ujawniły znaczące różnice między dwiema liniami szczurów albo przy uwzględnieniu wszystkich szczurów doświadczalnych, albo szczurów kopulujących tylko w czterech grupach eksperymentalnych (patrz Tabela 2). W rzeczywistości, gdy uwzględniono dane uzyskane od wszystkich zwierząt doświadczalnych, liczba erekcji bezkontaktowych była wyższa, a NCPEL, ML, IL i PEI były znacznie krótsze u szczurów RHA w porównaniu ze szczurami RLA. Ponadto EF i CE były wyższe, podczas gdy III było znacznie krótsze u szczurów RHA w porównaniu ze szczurami RLA. Niektóre z powyższych różnic między dwiema liniami rzymskich szczurów miały tendencję do zmniejszania się lub zanikania wraz z powtarzanymi testami kopulacyjnymi. Niemniej jednak niektóre z tych różnic były nadal obecne po ustabilizowaniu się zachowań seksualnych przez powtarzane doświadczenia seksualne. Podobne wyniki uzyskano, biorąc pod uwagę tylko wartości zwierząt z czterech grup eksperymentalnych, które kopulowały do wytrysku, z wyjątkiem EF (patrz tabele 1, 2).
Podstawowe stężenia zewnątrzkomórkowej dopaminy, DOPAC i noradrenaliny w dializatach mPFC pochodzących od seksualnie naiwnych i doświadczonych szczurów RHA i RLA
W obecnych warunkach eksperymentalnych ilości dopaminy, DOPAC i NA w dializatach uzyskanych z mPFC wszystkich (np. niezależnie od tego, czy kopulowały do wytrysku, czy nie) naiwnych seksualnie szczurów RHA i RLA wynosiły 2.32 pg i 2.11 pg dla dopaminy, 322.56 pg i 124.42 pg dla DOPAC i 6.05 pg i 2.24 pg dla NA, odpowiednio w 20 μl dializatu. Podobne ilości zmierzono w dializatach uzyskanych z mPFC doświadczonych seksualnie szczurów RHA i RLA (dopamina: 3.73 pg i 3.33 pg, DOPAC: 353.62 pg i 133.32 pg, NA: 7.17 pg i 2.78 pg odpowiednio u szczurów RHA i RLA). Wartości te wskazują stężenie odpowiednio ≅0.8–1.2 nM i ≅95–100 nM dla zewnątrzkomórkowej dopaminy i DOPAC oraz ≅1.8–2.2 nM dla zewnątrzkomórkowej NA w mPFC szczurów RHA oraz stężenie ≅0.8–1.2 nM i ≅35–40 nM odpowiednio dla zewnątrzkomórkowej dopaminy i DOPAC oraz ≅0.6 –0.9, XNUMX nM dla zewnątrzkomórkowego NA, w mPFC szczurów RLA (Tabela 3). Powyższe wartości uzyskano po 2-godzinnym okresie równoważenia buforu do dializy z płynem zewnątrzkomórkowym mPFC. Ponieważ oszacowano, że odzyskiwanie autentycznej dopaminy, DOPAC i NA z sond dializacyjnych było bliskie 20%, pozakomórkowe stężenia dopaminy, DOPAC i NA można oszacować na bliskie ≅ 4–5 nM w obu liniach dla dopaminy, ≅ 500 i ≅ 200 nM dla DOPAC oraz ≅ 10 i ≅ 4 nM dla NA odpowiednio w mPFC szczurów RHA i RLA. Czynnikowe ANOVA dla powtarzanych pomiarów wykonanych na powyższych wartościach po transformacji logarytmu ujawniły znaczące różnice w podstawowych poziomach dopaminy między szczurami naiwnymi seksualnie i doświadczonymi seksualnie (F(1,44,132) = 26.05, P < 0.001) oraz na poziomach podstawowych DOPAC (F(1,44,132) = 63.36, P < 0.001) i NA (F(1,44,132) = 42.14, P < 0.001) między szczurami RHA i RLA (ostatnie cztery próbki pobrane przed wprowadzeniem samicy do małej klatki). Podobne wartości stwierdzono, biorąc pod uwagę tylko szczury, które kopulowały do wytrysku podczas eksperymentu z mikrodializą (Tabela 3). Również w tym przypadku ANOVA czynnikowe dla powtarzanych pomiarów przeprowadzonych na wartościach po transformacji logarytmu ujawniły znaczące różnice w podstawowych poziomach dopaminy między szczurami naiwnymi seksualnie i doświadczonymi seksualnie (F(1,33,99) = 26.97, P < 0.001) oraz na poziomach podstawowych DOPAC (F(1,33,99) = 42.95, P < 0.001) i NA (F(1,33,99) = 27.63, P <0.001) między szczurami RHA i RLA.
Stężenia pozakomórkowej dopaminy, DOPAC i noradrenaliny w dializatach mPFC pochodzących od seksualnie naiwnych i doświadczonych szczurów RHA i RLA zmieniają się w różny sposób podczas aktywności seksualnej
Obecność niedostępnej receptywnej samicy w wewnętrznej małej klatce i późniejsza bezpośrednia interakcja seksualna zwiększyły stężenia zewnątrzkomórkowej dopaminy, DOPAC i NA w dializatach mPFC uzyskanych zarówno od seksualnie naiwnych, jak i doświadczonych samców szczurów RHA i RLA, chociaż ze znacznymi różnicami między dwiema liniami szczurów i warunkami poziomu doświadczenia, albo biorąc pod uwagę wszystkie zwierzęta doświadczalne, albo tylko te, które kopulowały do wytrysku (ryc. 2). W rzeczywistości dwukierunkowe ANOVA AUC stężeń dopaminy, DOPAC i NA wykazały, że ogólna zawartość dopaminy, DOPAC i NA w całym teście była znacznie wyższa u szczurów RHA w porównaniu ze szczurami RLA oraz u doświadczonych seksualnie szczurów w porównaniu ze szczurami naiwnymi (patrz tabela 4 dla wartości AUC i tabeli 5 dla F wartości i poziom istotności). Różnice te zostały dodatkowo potwierdzone przez ANOVA czynnikowe punkt-punkt dla powtarzanych pomiarów ilości dopaminy, DOPAC i NA dwóch seksualnie naiwnych i doświadczonych linii szczurów wzdłuż eksperymentu, które ujawniły znaczące główne efekty linii, doświadczenia, czasu i znaczące interakcje pierwszego rzędu linii × czas i doświadczenie × czas (patrz tabela 6 dla F wartości i poziom istotności).
Stężenia zewnątrzkomórkowej dopaminy, DOPAC i noradrenaliny w dializatach mPFC uzyskanych od seksualnie naiwnych szczurów RHA i RLA zmieniają się w różny sposób podczas aktywności seksualnej
U seksualnie naiwnych szczurów RHA i RLA pozakomórkowa dopamina, ale nie DOPAC, wzrastała najpierw, gdy była umieszczona w obecności niedostępnej samicy, podczas gdy NA wzrastała tylko u szczurów RHA. U naiwnych szczurów RHA zewnątrzkomórkowa dopamina dalej wzrastała w ciągu pierwszych 15 minut interakcji seksualnej, jak stwierdzono w przypadku DOPAC i NA. Przyrosty pozakomórkowej dopaminy, DOPAC i NA trwały przez cały czas kopulacji, przy czym dopamina, DOPAC i NA osiągały wartość szczytową odpowiednio po 60 min, 75 min i 75 min, następnie zewnątrzkomórkowa dopamina i, w mniejszym stopniu DOPAC i NA, zmniejszyły się do wartości podobnych do podstawowych po usunięciu samicy.
Z drugiej strony, pierwszy znaczący wzrost i wartość szczytowa zewnątrzkomórkowej dopaminy, DOPAC i NA wystąpiły u naiwnych szczurów RLA podczas pierwszych 15 minut kopulacji. Jednak w przeciwieństwie do szczurów RHA, u szczurów RLA zewnątrzkomórkowa dopamina, DOPAC i NA miały tendencję do powrotu do wartości podobnych do podstawowych w ciągu pierwszych 30 minut bezpośredniej interakcji z samicą (patrz ryc. 2A, C, E).
Wreszcie, podczas kopulacji, przyrosty pozakomórkowej dopaminy były większe i bardziej trwałe u naiwnych seksualnie szczurów RHA niż u szczurów RLA (patrz ryc. 2A), podczas gdy pod nieobecność samicy ich stężenia były podobne, chociaż nie identyczne, w obu liniach szczurów (patrz powyżej i tabela 3). Co ciekawe, chociaż nie stwierdzono różnicy między dwiema liniami rzymskimi w procentowym wzroście DOPAC i, w mniejszym stopniu, stężeń NA podczas obecności receptywnej samicy, zaobserwowano ponad dwukrotną różnicę w wartościach bezwzględnych stężeń DOPAC i NA między dwiema liniami szczurów, zarówno w warunkach podstawowych (patrz tabela 3) i przez cały test z receptywną samicą (patrz Ryc 2C, E).
Stężenia zewnątrzkomórkowej dopaminy, DOPAC i noradrenaliny w dializatach mPFC uzyskanych od doświadczonych seksualnie szczurów RHA i RLA zmieniają się w różny sposób podczas aktywności seksualnej
Jak stwierdzono u naiwnych seksualnie szczurów RHA i RLA, obecność niedostępnej samicy i późniejsza bezpośrednia interakcja seksualna doprowadziły do wzrostu pozakomórkowej dopaminy i DOPAC w dializacie mPFC uzyskanym od doświadczonych seksualnie samców szczurów RHA i RLA. Jednak również w tym przypadku stwierdzono różnice związane z linią szczurów, biorąc pod uwagę wszystkie zwierzęta doświadczalne lub, w mniejszym stopniu, tylko te, które kopulowały do wytrysku (ryc. 2). U doświadczonych seksualnie szczurów RHA i RLA pierwszy wzrost zewnątrzkomórkowej dopaminy wystąpił u niedostępnej samicy. Następnie stężenia dopaminy wzrosły podczas kopulacji w obu liniach szczurów. Stężenia dopaminy osiągały wartości szczytowe po 45–60 minutach kopulacji i powoli spadały do wartości podstawowych pod koniec testu kopulacyjnego (patrz ryc. 2B). Podobnie jak u szczurów naiwnych seksualnie, pozakomórkowe stężenia dopaminy były wyższe u doświadczonych seksualnie szczurów RHA w porównaniu ze szczurami RLA, głównie w porcjach dializatu pobranych podczas centralnej części fazy kopulacji (po 30–45 minutach kopulacji). Stężenia DOPAC wzrastały w obecności niedostępnej samicy tylko u szczurów RHA, podczas gdy wzrastały w podobnym stopniu u obu linii szczurów podczas kopulacji (wartości szczytowe w 75–90 minucie) i miały tendencję do powrotu do wartości podstawowych pod koniec testu kopulacyjnego (patrz ryc. 2D). Stężenia NA również wzrosły w obu liniach szczurów doświadczonych seksualnie po wprowadzeniu samicy, osiągając wartości szczytowe po 90 minutach u szczurów RHA i po 45 minutach u szczurów RLA (patrz ryc. 2F). W przeciwieństwie do dopaminy (patrz powyżej), podobną różnicę stwierdzono we wzroście stężeń DOPAC i NA u doświadczonych seksualnie szczurów z obu linii, biorąc pod uwagę wszystkie zwierzęta w porównaniu ze zwierzętami, które osiągnęły tylko wytrysk. Jednak, jak stwierdzono u szczurów naiwnych seksualnie, chociaż procentowy wzrost stężeń DOPAC i NA był podobny, stwierdzono znaczące różnice w bezwzględnych wartościach DOPAC i NA między doświadczonymi seksualnie szczurami RHA i RLA w trakcie całego testu (tj. 3 dla wartości podstawowych i liczb 2D, F dla wartości w całym teście).
Doświadczenie seksualne wpływa na zmiany stężenia dopaminy i noradrenaliny w dializatach mPFC uzyskanych od szczurów RHA i RLA podczas aktywności seksualnej
Porównanie stężeń pozakomórkowej dopaminy i NA u seksualnie naiwnych i doświadczonych szczurów RHA i RLA wykazało, że doświadczenie seksualne zmieniło stężenie zewnątrzkomórkowej dopaminy i, w mniejszym stopniu, NA w obu liniach szczurów, albo biorąc pod uwagę wszystkie zwierzęta doświadczalne lub te, które kopulowały tylko do wytrysku (ryc. 2A, B, E, F). W związku z tym wystąpiły znaczące różnice w podstawowych wartościach dopaminy między seksualnie naiwnymi i doświadczonymi szczurami obu linii (patrz Tabela 3), a wartości dopaminy podczas aktywności kopulacyjnej były na ogół wyższe u doświadczonych seksualnie szczurów RHA i RLA w porównaniu z ich naiwnymi odpowiednikami (patrz ryc. 2B). Co więcej, u doświadczonych seksualnie szczurów RHA, chociaż wzrost dopaminy stwierdzony podczas obecności niedostępnej samicy przebiegał według tego samego wzorca czasowego, co u szczurów naiwnych seksualnie, podczas kopulacji stwierdzono różnice we wzorcu czasowym. W rzeczywistości w tym przypadku, w przeciwieństwie do tego, co zaobserwowano u seksualnie naiwnych szczurów RHA (jeden główny szczyt po 60 minutach), znaleziono dwa główne szczyty, pierwszy po 15 minutach, a drugi po 45 minutach kopulacji. Po tym ostatnim wzroście wartości dopaminy miały tendencję do powrotu do wartości podstawowych (patrz ryc 2B).
Podobny obraz stwierdzono u seksualnie naiwnych i doświadczonych szczurów RLA. W rzeczywistości, podobnie jak u szczurów RHA, również u doświadczonych szczurów RLA stwierdzono wzorzec czasowy charakteryzujący się trzema głównymi wzrostami pozakomórkowej dopaminy: pierwszy z niedostępną samicą, a dwa pozostałe podczas kopulacji, tj. po 15 minutach i 60 minutach kopulacji (patrz ryc. 2A, B). Ogólnie rzecz biorąc, doświadczenia seksualne wydają się powodować bardziej długotrwałe zmiany w czasowym wzorcu uwalniania dopaminy u obu linii szczurów, gdy przechodzi się od stanu naiwności seksualnej do stanu doświadczonego.
Jak pokazano na rysunkach 2C – F, wykryto tylko niewielkie różnice w stężeniu DOPAC i NA między naiwnymi i doświadczonymi szczurami obu linii. Jednak nieistotny trend zewnątrzkomórkowej NA w kierunku wyższych wartości u doświadczonych szczurów w porównaniu z naiwnymi zaobserwowano w podstawowej (przed wprowadzeniem receptywnej samicy, patrz Tabela 3) oraz w całkowitych ilościach NA, jak wykazały wartości AUC (patrz Tabela 4) obliczono na podstawie stężeń pozakomórkowych uzyskanych z całego testu (przed iw obecności receptywnej samicy). Wreszcie, czasowy wzorzec stężeń NA był bardzo podobny, gdy porównano doświadczone szczury obu linii szczurów z ich naiwnymi odpowiednikami, co wskazuje, że doświadczenie seksualne może prowadzić raczej do ogólnego wzrostu pozakomórkowego NA niż do zmian we wzorcu jego wzrostu (patrz ryciny 2E, F).
Zmiany stężeń pozakomórkowej dopaminy i noradrenaliny w dializatach mPFC uzyskanych od naiwnych seksualnie i doświadczonych szczurów RHA i RLA występują jednocześnie ze zmianami zachowań seksualnych
Różnice w stężeniach zewnątrzkomórkowej dopaminy, DOPAC i NA w dializatach uzyskanych z mPFC stwierdzono zarówno u seksualnie naiwnych, jak i doświadczonych szczurów RHA i RLA podczas testu (ryc. 2) wystąpiły wraz z modyfikacjami różnych parametrów seksualnych mierzonych podczas dwóch głównych faz eksperymentów (tj. odpowiednio kobiety niedostępnej i dostępnej dla mężczyzny), które obejmują między innymi bezkontaktowe erekcje prącia (ryc. 3A, B), wierzchowce (rysunki 3C, D), wstępy (ryc 3E, F) i wytryski (ryc 3G, H). Różnice te stwierdzono albo przy uwzględnieniu wszystkich zwierząt doświadczalnych, albo tych, które kopulowały tylko do wytrysku. W rzeczywistości wstępna analiza wartości AUC tych parametrów za pomocą dwukierunkowych ANOVA (patrz Tabela 4 dla wartości AUC i tabeli 5 dla F wartości i poziom istotności), po której nastąpiła punktowa analiza wartości tych parametrów wzdłuż eksperymentu za pomocą czynnikowej ANOVA dla powtarzanych pomiarów, która ujawniła istotne efekty główne linii, doświadczenia, czasu, znaczące interakcje linii × czas pierwszego rzędu i doświadczenie × czas oraz znaczącą interakcję drugiego rzędu dla wierzchowców (patrz tabela 6 dla F wartości i poziom istotności). W związku z tym, zgodnie z wcześniejszymi badaniami (Sanna i in., 2015): (i) seksualnie naiwne szczury RHA wykazywały więcej bezkontaktowych erekcji prącia, wierzchowców, intromisji i wytrysków niż ich odpowiedniki RLA; (ii) doświadczone seksualnie szczury RHA wykazywały większą liczbę bezkontaktowych erekcji prącia, intromisji i wytrysków niż ich odpowiedniki RLA; oraz (iii) doświadczone seksualnie szczury obu linii, aw szczególności szczury RLA, wykazywały więcej bezkontaktowych erekcji prącia, intromisji i wytrysków niż ich naiwne seksualnie odpowiedniki. W rzeczywistości, podczas gdy u szczurów RHA większość zmian spowodowanych doświadczeniem seksualnym zachodziła w czasie, a nie w częstotliwości parametrów behawioralnych (np. doświadczone szczury kopulowały głównie w pierwszej połowie testu, podczas gdy szczury naiwne wykazywały podobny trend kopulacyjny przez cały czas testu), u szczurów RLA bardziej wyraźna ogólna poprawa zachowań seksualnych, głównie w sprawności seksualnej, była spowodowana doświadczeniem seksualnym, jak wykazały zmiany wartości parametrów kopulacyjnych u doświadczonych szczurów RLA w porównaniu z ich naiwnymi odpowiednikami s.
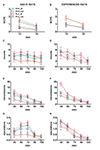 Rysunek 3. Zmiany w liczbie bezkontaktowych erekcji prącia (NCPE), wierzchowców, intromisji i wytrysków zarejestrowanych u naiwnych seksualnie (A, C, E, G) oraz doświadczone szczury RHA i RLA (B, D, P, H) podczas eksperymentów mikrodializy przedstawionych na rycinie 2. Wszystkie warunki doświadczalne były identyczne z tymi opisanymi w legendzie do rysunku 2. Wartości są średnimi ± SEM wartości uzyskanych przez wszystkie 12 szczurów na grupę (w tym te, którym przypisano wyniki w pełnym wymiarze godzin; RHA = ciągłe zielone linie, RLA = ciągłe brązowe linie) lub te, które kopulowały tylko do wytrysku (RHA = przerywane czerwone linie; RLA = przerywane niebieskie linie). U doświadczonych szczurów RHA wszystkie zwierzęta osiągnęły kopulację i wartości są identyczne. Ponieważ nie stwierdzono znaczących interakcji między czynnikiem linii szczurów (RHA vs. RLA), czynnikiem poziomu doświadczenia seksualnego (naiwny vs. doświadczony) i czasem, analizując dane za pomocą dwukierunkowych ANOVA, jak pokazano w tabeli 6, post hoc porównania nie zostały zgłoszone, jak wyjaśniono w podsekcji „Materiały i metody”, „Statystyka”.
Rysunek 3. Zmiany w liczbie bezkontaktowych erekcji prącia (NCPE), wierzchowców, intromisji i wytrysków zarejestrowanych u naiwnych seksualnie (A, C, E, G) oraz doświadczone szczury RHA i RLA (B, D, P, H) podczas eksperymentów mikrodializy przedstawionych na rycinie 2. Wszystkie warunki doświadczalne były identyczne z tymi opisanymi w legendzie do rysunku 2. Wartości są średnimi ± SEM wartości uzyskanych przez wszystkie 12 szczurów na grupę (w tym te, którym przypisano wyniki w pełnym wymiarze godzin; RHA = ciągłe zielone linie, RLA = ciągłe brązowe linie) lub te, które kopulowały tylko do wytrysku (RHA = przerywane czerwone linie; RLA = przerywane niebieskie linie). U doświadczonych szczurów RHA wszystkie zwierzęta osiągnęły kopulację i wartości są identyczne. Ponieważ nie stwierdzono znaczących interakcji między czynnikiem linii szczurów (RHA vs. RLA), czynnikiem poziomu doświadczenia seksualnego (naiwny vs. doświadczony) i czasem, analizując dane za pomocą dwukierunkowych ANOVA, jak pokazano w tabeli 6, post hoc porównania nie zostały zgłoszone, jak wyjaśniono w podsekcji „Materiały i metody”, „Statystyka”.
Dyskusja
To badanie potwierdza i rozszerza wyniki poprzednich badań pokazujących, że szczury RHA i RLA, które wykazują wyraźnie różne style radzenia sobie w odpowiedzi na awersyjne warunki (Driscoll i Battig, 1982; Giorgi i in., 2003a; Steimer i Driscoll, 2003), wykazują wyraźne wzorce zachowań w obecności niedostępnej receptywnej samicy oraz podczas klasycznych testów kopulacyjnych (Sanna i in., 2014a,b, 2015). W związku z tym również to badanie pokazuje, że szczury RHA naiwne seksualnie (nigdy wcześniej nie narażone na receptywną samicę) wykazywały wyższą motywację seksualną i lepszą sprawność seksualną w porównaniu z naiwnymi seksualnie szczurami RLA, np. Sachs i in., 1994; Sachs, 2000) i różne zmiany proseksualne w kilku parametrach kopulacyjnych, jak stwierdzono w poprzednich badaniach (Sanna i in., 2014a,b, 2015). Różnice te nadal utrzymywały się w obu liniach szczurów rzymskich po nabyciu doświadczenia seksualnego, to jest po ustabilizowaniu się zachowań seksualnych po pięciu ekspozycjach i testach kopulacyjnych z receptywną samicą. Badanie to pokazuje również po raz pierwszy, że zarówno w liniach szczurów RHA, jak i RLA, zarówno w stanie naiwnym, jak i doświadczonym, bezkontaktowe erekcje prącia i interakcje seksualne wystąpiły jednocześnie ze wzrostem stężenia zewnątrzkomórkowej dopaminy (i jej głównego metabolitu DOPAC) i NA w dializatach uzyskanych za pomocą mikrodializy wewnątrzmózgowej z mPFC obu rzymskich linii szczurów. Co ciekawe, te wzrosty pozakomórkowej dopaminy i NA w mPFC wydają się być związane z różnicami w fenotypie szczura lub w poziomie doświadczenia seksualnego. W związku z tym, jak obszernie pokazano w sekcji Wyniki, zarówno seksualnie naiwne, jak i doświadczone szczury RHA wykazywały wyższy i długotrwały wzrost pozakomórkowej dopaminy i NA w porównaniu z ich odpowiednikami RLA zarówno w fazie apetycznej, jak i konsumpcyjnej zachowań seksualnych. Co więcej, doświadczone seksualnie szczury z obu linii rzymskich wykazywały wyższy i długotrwały wzrost pozakomórkowej dopaminy i NA w mPFC w obu fazach zachowań seksualnych w porównaniu z ich naiwnymi odpowiednikami. Wreszcie, wszystkie powyższe różnice w zewnątrzkomórkowej dopaminie i NA w mPFC były najwyraźniej związane z różnicami w parametrach behawioralnych zachowań seksualnych, np. Doświadczone seksualnie szczury obu linii rzymskich wykazywały wyższą motywację seksualną i lepsze wyniki kopulacyjne w porównaniu z ich naiwnymi odpowiednikami oraz seksualnie naiwnymi i doświadczonymi szczurami RHA wykazywały wyższą motywację seksualną i lepsze wyniki kopulacyjne w porównaniu z ich naiwnymi seksualnie i doświadczonymi odpowiednikami RLA.
Jeśli chodzi o wzrosty zewnątrzkomórkowej dopaminy stwierdzone w dializacie mPFC podczas aktywności seksualnej, pierwszy wzrost wystąpił w pierwszych 15 minutach po wprowadzeniu receptywnej seksualnie samicy do aparatu godowego, kiedy samica była niedostępna dla samca, co zwykle objawia się w tym stanie bezkontaktowymi erekcjami prącia. Drugi i większy wzrost pozakomórkowej dopaminy wystąpił w ciągu pierwszych 15 minut po tym, jak samica została udostępniona samcowi do kopulacji. Co ciekawe, podczas gdy w stanie naiwnym zewnątrzkomórkowa dopamina wzrastała głównie w pierwszej części testu z dostępną samicą z tendencją do powrotu do wartości podstawowych w drugiej części, w stanie doświadczanym seksualnie dopamina pozostawała podwyższona przez cały czas testu, osiągając wartości szczytowe po 45–60 minutach kopulacji u obu linii szczurów rzymskich.
Oprócz powyższych różnic w zewnątrzkomórkowej dopaminie podczas różnych faz aktywności seksualnej między szczurami RHA i RLA w stanie seksualnie naiwnym i doświadczonym, badanie to pokazuje również nieoczekiwane ważne i bardzo znaczące różnice w zewnątrzkomórkowym stężeniu DOPAC między dwiema rzymskimi liniami szczurów przed (tj. Wartości podstawowe) i po wprowadzeniu receptywnej samicy do aparatu do krycia. W związku z tym podstawowe wartości zewnątrzkomórkowego DOPAC w dializacie mPFC stwierdzono u szczurów RHA jako około 2.6-krotnie wyższe niż u szczurów RLA. Ta różnica między szczurami RHA i RLA występowała i utrzymywała się w warunkach seksualnie naiwnych i doświadczonych, pomimo bardzo niewielkich różnic w podstawowych wartościach pozakomórkowej dopaminy w dializatach mPFC uzyskanych z dwóch rzymskich linii szczurów w tych warunkach eksperymentalnych. Podsumowując, różnice te mogą wskazywać na inny obrót dopaminy na poziomie mPFC między dwiema liniami rzymskich szczurów. Odpowiednio, stężenia DOPAC zwykle odzwierciedlają ilość dopaminy uwolnionej, a następnie ponownie wychwytywanej przez zakończenia nerwów dopaminergicznych i przekształcanej w DOPAC przez monoaminooksydazę (MAO; Carlsson, 1975). Stąd wyższe podstawowe stężenia DOPAC stwierdzone u szczurów RHA sugerują, że większe ilości dopaminy są uwalniane i ponownie wychwytywane przez dopaminergiczne zakończenia nerwowe w mPFC szczurów RHA, np. Wyższa podstawowa aktywność mezokortykalnego układu dopaminergicznego szczurów RHA w porównaniu ze szczurami RLA. Wyższy mezokortykalny ton dopaminergiczny u szczurów RHA niż u szczurów RLA jest również wspierany przez wyższe pozakomórkowe stężenia dopaminy stwierdzone podczas aktywności seksualnej w dializacie mPFC zarówno od naiwnych seksualnie, jak i doświadczonych szczurów RHA w odniesieniu do ich odpowiedników RLA. W związku z tym należy przypomnieć, że wyższy ton dopaminergiczny jest uważany za odpowiedzialny, przynajmniej częściowo, za wiele różnych, a nawet przeciwstawnych cech behawioralnych obecnych u szczurów RHA i RLA. W związku z tym szczury RHA są aktywnymi gliniarzami, wysoce impulsywnymi, poszukiwaczami nowości i wrażeń oraz mają skłonność do przyjmowania i nadużywania kilku klas uzależnień, podczas gdy szczury RLA są reaktywnymi miedziakami, hiperemocjonalnymi i mają skłonność do rozwijania objawów podobnych do depresji (Zeier i in., 1978; Giorgi i in., 1994, 2003b, 2007; Corda i in., 1997, 2014; Escorihuela i in., 1999; Steimer i Driscoll, 2003; Lecca i in., 2004; Giménez-Llort i in., 2005; Carrasco i in., 2008; Fattore i in., 2009; Moreno i in., 2010; Coppens i in., 2012; Díaz-Morán i in., 2012; Sabariego i in., 2013; Manzo i in., 2014a,b; Oliveras i in., 2015), w tym wyższą motywację seksualną i lepszą wydajność kopulacyjną naiwnych seksualnie i doświadczonych szczurów RHA w porównaniu ze szczurami RHA (Sanna i in., 2015). Wyższy wzrost stężenia pozakomórkowej dopaminy stwierdzony w dializacie z mPFC seksualnie naiwnych i doświadczonych szczurów RHA przypomina wyższe zewnątrzkomórkowe stężenia dopaminy stwierdzone w dializacie z jądra półleżącego seksualnie naiwnych i doświadczonych szczurów RHA w odniesieniu do ich odpowiedników RLA (Sanna i in., 2015). Jednak w przeciwieństwie do mPFC, podstawowe poziomy zewnątrzkomórkowej dopaminy i DOPAC w dializacie z jądra półleżącego zarówno naiwnych seksualnie, jak i doświadczonych szczurów RHA i RLA nie różniły się znacząco (Sanna i in., 2015). Zatem wyższy mezolimbiczny ton dopaminergiczny w jądrze półleżącym naiwnych seksualnie i doświadczonych szczurów RHA można wywnioskować jedynie na podstawie wyższych pozakomórkowych stężeń dopaminy stwierdzonych w dializatach z jądra półleżącego szczurów RHA w porównaniu z odpowiednikami RLA w obecności receptywnej samicy, a nie na podstawie innej podstawowej aktywności dopaminergicznej ujawnionej przez wyższe i niższe podstawowe poziomy stężenia DOPAC u szczurów RHA i szczurów RLA, odpowiednio, jak stwierdzono w mPFC w tym badaniu. Jest to również zgodne z wynikami wcześniejszych doniesień wykazujących, że pozakomórkowe poziomy dopaminy w dializacie z mPFC szczurów RHA były wyższe niż u szczurów RLA, podczas gdy podobne poziomy dopaminy stwierdzono w dializacie z powłoki jądra półleżącego szczurów RHA i RLA w różnych warunkach eksperymentalnych (D'Angio i in., 1988; Scatton i in., 1988; Willig i in., 1991; Giorgi i in., 2003a, 2007). Pomimo powyższych różnic między mPFC a jądrem półleżącym, doświadczenie seksualne wydaje się powodować w mPFC dłuższe wzrosty czasowego wzorca uwalniania dopaminy u obu rzymskich linii szczurów podczas przechodzenia od stanu naiwnego seksualnie do stanu doświadczonego, chociaż takie wzrosty były zwykle wyższe u szczurów RHA niż szczurów RLA. Różni się to nieco od tego, co stwierdzono w jądrze półleżącym, gdzie doświadczenie seksualne miało tendencję do przesuwania pozakomórkowych wzrostów dopaminy do pierwszej części testu kopulacyjnego u szczurów RHA, podczas gdy zwiększało go podczas całego testu kopulacyjnego u szczurów RLA (Sanna i in., 2015).
Zgodnie z naszą wiedzą, badanie to pokazuje również po raz pierwszy, że nie tylko zewnątrzkomórkowa dopamina, ale także zewnątrzkomórkowa NA wzrasta podczas aktywności seksualnej w dializacie z mPFC zarówno szczurów RHA, jak i RLA, jak stwierdzono w przypadku dopaminy, ale także w tym przypadku z różnicami związanymi z linią szczurów rzymskich i doświadczeniami seksualnymi. W szczególności, w przeciwieństwie do podstawowych poziomów dopaminy, które stwierdzono bardzo podobnie w dializacie z mPFC zarówno szczurów RHA, jak i RLA, podstawowe poziomy NA zewnątrzkomórkowego w dializacie z mPFC szczurów RHA były znacząco wyższe (około 2,5-krotnie) niż u szczurów RLA. Przyczyny tych różnic są nieznane, ale jak omówiono powyżej dla dopaminy i DOPAC, wyniki te mogą wskazywać, że istnieje wyższy podstawowy ton noradrenergiczny przynajmniej w korze mPFC szczurów RHA w porównaniu ze szczurami RLA. Taki wyższy ton noradrenergiczny może być również zaangażowany w różne i często przeciwne cechy behawioralne obecne u szczurów RHA i RLA, jak omówiono powyżej dla dopaminy. Dalsze wsparcie dla wyższego tonu noradrenergicznego u szczurów RHA niż u szczurów RLA w mPFC pochodzi z wyników pokazujących, że różnice w podstawowych zewnątrzkomórkowych poziomach NA utrzymywały się również podczas aktywności seksualnej zarówno w warunkach naiwnych seksualnie, jak i doświadczonych, np. zewnątrzkomórkowe poziomy NA wzrosły w dializacie mPFC u szczurów RHA po ekspozycji na niedostępną samicę i podczas całego okresu kopulacji znacznie bardziej niż u szczurów RLA, u których poziomy NA wzrosły tylko w ciągu pierwszych 15 minut okres kopulacji, po którym poziomy NA powróciły do wartości podstawowych. Te zmiany w zewnątrzkomórkowych poziomach NA były widoczne zarówno u naiwnych seksualnie, jak i doświadczonych, ale wzrosty poziomów NA były wyższe u doświadczonych seksualnie szczurów RHA i RLA w porównaniu z ich naiwnymi seksualnie odpowiednikami. Zatem doświadczenie seksualne najwyraźniej indukuje dalsze nasilenie aktywności noradrenergicznej w mPFC szczurów RHA i, w mniejszym stopniu, szczurów RLA, jak już omówiono dla dopaminy. Jednoczesne wyższe tony noradrenergiczne i dopaminergiczne w mPFC szczurów RHA w porównaniu ze szczurami RLA zasługują na komentarz. W rzeczywistości doniesiono, że aktywność noradrenergiczna w mPFC może wpływać na uwalnianie dopaminy poprzez różne mechanizmy (na przykład patrz Carboni i in., 1990, 2006; Gresch i in., 1995; Westernik i in., 1998 i odniesienia w nich). Jeden z nich jest związany z aktywnością NET, która, jak wykazano, wiąże dopaminę z powinowactwem nawet wyższym niż powinowactwo do NA w synaptosomach uzyskanych z homogenatów PFC (Róg, 1973). Gdyby tak się stało w mPFC in vivo, dopamina uwolniona w mPFC może zostać odzyskana nie tylko przez dopaminergiczne, ale także noradrenergiczne zakończenia nerwowe z prędkością nawet wyższą niż NA. To z kolei może powodować wzrost uwalniania dopaminy z zakończeń dopaminergicznych (np. zwiększony ton dopaminergiczny) w celu skompensowania ilości dopaminy usuniętej ze szczeliny synaptycznej; zatem wyższy ton noradrenergiczny stwierdzony u szczurów RHA mógł przynajmniej częściowo przyczynić się do wyższego tonu dopaminergicznego stwierdzonego w mPFC szczurów RHA w porównaniu ze szczurami RLA. Konieczne są dalsze badania, aby zweryfikować tę możliwość. Warto zauważyć, że różnica w aktywności noradrenergicznej zidentyfikowana w tym badaniu w mPFC między szczurami RHA i RLA może również odgrywać rolę w ich różnej odpowiedzi na leczenie przeciwdepresyjne. W rzeczywistości szczury RHA są uważane za model odporności, a szczury RLA za model podatności na depresję. W związku z tym ostre lub przewlekłe leczenie lekami przeciwdepresyjnymi, takimi jak dezypramina, fluoksetyna i chlorimipramina, znacząco poprawiło reakcje behawioralne w teście wymuszonego pływania u szczurów RLA bez wpływu na reakcje szczurów RHA.Piras i in., 2010, 2014).
Wreszcie, to badanie potwierdza i rozszerza wcześniejsze ustalenia pokazujące, że mPFC jest zaangażowany w kontrolę zachowań seksualnych, chociaż dokładna rola tego obszaru mózgu w zachowaniach seksualnych jest daleka od jasności (Fernández-Guasti i in., 1994; Agmo i Villalpando, 1995; Agmo i in., 1995; Hernández-Gonzáles i in., 1998, 2007; Kakeyama i in., 2003; Balfour i wsp., 2006; Afonso i in., 2007; Davis i wsp., 2010; Febo, 2011). Niedawno wykazano selektywne odpalanie komórek w mPFC podczas zbliżających się zachowań samca szczura w kierunku niedostępnej samicy podatnej na seks przy użyciu paradygmatu rejestracji odpalania pojedynczej komórki (Febo, 2011). Co ciekawe, neurony, które nie reagowały podczas pierwszej ekspozycji samca na niedostępną receptywną samicę, uaktywniają się podczas drugiej ekspozycji, tak jakby poprzednie doświadczenie było w stanie wywołać zmiany plastyczne prowadzące do zróżnicowania reakcji behawioralnych. Niemniej jednak stwierdzono, że zmiany z kwasem ibotenowym mPFC nie są w stanie zmienić zachowań seksualnych samców szczurów z samicą podatną seksualnie, ani ekspresji uwarunkowanej preferencji miejsca dla nagrody seksualnej. Jednak zdolność do tworzenia warunkowej niechęci do aktywności seksualnej w połączeniu z bodźcami awersyjnymi została całkowicie zniesiona u tych uszkodzonych zwierząt (Davis i wsp., 2010). Sugeruje to, że aktywacja mPFC podczas zachowań seksualnych odgrywa rolę w integracji informacji zewnętrznych i wewnętrznych w celu wykonania i kontroli zachowań ukierunkowanych na cel, a nie w wyrażaniu wrodzonych odpowiedzi na naturalne wzmocnienia (zob. Goto and Grace, 2005). Co ważniejsze dla tej pracy, kilka badań wykazało, że obszary mózgu zaangażowane w motywację seksualną i zachowania seksualne, takie jak jądro półleżące, brzuszny obszar nakrywkowy, przyśrodkowy obszar przedwzrokowy, jądro łożyskowe prążkowia końcowego, ciało migdałowate podstawno-boczne i okołokomórkowe podpęczkowe jądro wzgórza otrzymują dane wejściowe z mPFC podczas aktywności seksualnej (patrz Balfour i wsp., 2006). Wiele z tych obszarów mózgu uczestniczy w złożonych obwodach neuronalnych zaangażowanych w kontrolę zachowań seksualnych, od motywacji seksualnej i nagrody po sprawność seksualną. Obwód ten obejmuje neurony oksytocynergiczne, które pochodzą z PVN podwzgórza (PVN) i wystają do brzusznego obszaru nakrywki, jądra półleżącego, hipokampa, ciała migdałowatego, PFC, jądra łożyskowego prążkowia końcowego, rdzenia przedłużonego i rdzenia kręgowego, mezolimbiczne / mezokortykalne neurony dopaminergiczne wystające z brzusznego obszaru nakrywki do jądra półleżącego i PFC , neurony dopaminergiczne wewnątrz podwzgórza i neurony glutaminergiczne, które uczestniczą na poziomie lokalnym i systemowym w kilku obszarach obwodu (patrz Melis i Argiolas, 1995, 2011; Melis i in., 2003, 2007, 2009, 2010; Succu i in., 2007, 2008, 2011). Zatem wzrost zewnątrzkomórkowej dopaminy (ale także NA) w dializatach z mPFC obserwowany podczas aktywności seksualnej może wskazywać, że mPFC jest aktywną częścią tego obwodu, to znaczy mezokortykalne neurony dopaminergiczne uczestniczą w kontroli aktywności seksualnej razem z neuronami noradrenergicznymi, mezolimbicznymi dopaminergicznymi, oksytocynergicznymi i glutaminergicznymi, chociaż nie wydaje się to bezwzględnie konieczne do wyrażania zachowań seksualnych (Davis i wsp., 2010). Zgodnie z tą hipotezą, badanie to pokazuje, że różnice w uwalnianiu dopaminy i NA w mPFC podczas aktywności seksualnej występowały jednocześnie z różnicami w liczbie bezkontaktowych erekcji prącia i zmianami parametrów kopulacyjnych, z wyższym uwalnianiem dopaminy i NA podczas faz apetycznych i konsumpcyjnych związanych z wyższą motywacją seksualną i lepszymi wynikami kopulacyjnymi w obu liniach szczurów rzymskich oraz zarówno w warunkach naiwnych seksualnie, jak i doświadczonych.
Powyższe omówienie opiera się głównie na dobrze znanym wzroście pozakomórkowej dopaminy, który występuje w jądrze półleżącym samców szczurów podczas aktywności seksualnej (Pfaus i wsp., 1990; Pleim i wsp., 1990; Pfaus i Phillips, 1991; Damsma i wsp., 1992; Wenkstern i wsp., 1993). Jednak dopamina i inne neuroprzekaźniki mogą być uwalniane w mPFC (i w jądrze półleżącym) w innych warunkach eksperymentalnych, takich jak stres lub radzenie sobie z nim (Thierry i in., 1976; Fadda i in., 1978), które nie są ściśle związane z zachowaniami seksualnymi. Tak więc można argumentować, że wzrost dopaminy stwierdzony w pozakomórkowej dopaminie w mPFC (to badanie) lub w jądrze półleżącym (Sanna i in., 2015) jest bardziej związany ze stresem wtórnym lub radzeniem sobie z obecnością i/lub interakcją z seksualnie otwartą kobietą niż z aktywnością seksualną. Może to mieć pewne znaczenie u szczurów RHA i RLA, które wykazują wyraźnie różne style radzenia sobie i różną aktywację osi podwzgórze-przysadka-nadnercza w odpowiedzi na warunki awersyjne (szczury RLA wykazują znacznie wyższą aktywację tej osi niż szczury RHA; zob. Carrasco i in., 2008; Díaz-Morán i in., 2012). Rodzi to również możliwość, że hormony stresu (tj. kortykosteroidy) mogą wpływać na aktywność dopaminergiczną w mPFC i innych obszarach mózgu. Rzeczywiście, szczury RLA są reaktywnymi koperami i wykazują hiperemocjonalne zachowania charakteryzujące się hiporuchliwością i zastygnięciem, podczas gdy szczury RHA wykazują proaktywne zachowanie radzenia sobie mające na celu uzyskanie kontroli nad stresorem (Driscoll i Battig, 1982; Willig i in., 1991; Escorihuela i in., 1999; Steimer i Driscoll, 2003; Giorgi i in., 2007). Chociaż nie można całkowicie wykluczyć, że może to wystąpić u naiwnych seksualnie szczurów (które nigdy wcześniej nie wchodziły w interakcje z otwartą samicą), aw szczególności u naiwnych seksualnie szczurów RLA (patrz wyżej), jest to mało prawdopodobne. W naszych warunkach eksperymentalnych robi się wszystko, co możliwe, aby uniknąć wszelkiego rodzaju stresu (patrz rozdział „Materiały i metody”), a eksperymenty są zorganizowane w taki sposób, aby samce nie wchodziły w interakcję z samicą od razu, ale dopiero po 30 minutach kontaktu z nią, podczas którego zmierzony wzrost dopaminy jest znacznie niższy niż ten występujący podczas interakcji seksualnej. Jeśli wzrost dopaminy stwierdzony w mPFC (i w jądrze półleżącym) rzymskich szczurów (naiwne seksualnie szczury RHA i RLA mają podstawowe poziomy zewnątrzkomórkowej dopaminy w dializacie z mPFC i jądra półleżącego, bardzo podobne) były naprawdę drugorzędne w stosunku do stresu spowodowanego lub radzenia sobie z obecnością/interakcją z samicą: (i) wzrost dopaminy byłby znacznie wyższy w pierwszym okresie, kiedy samce są umieszczane w obecność samicy, a nie później, jak stwierdzono podczas kopulacji; oraz (ii) oczekuje się, że wzrost dopaminy zaniknie lub zostanie silnie zmniejszony po nabyciu stabilnej aktywności seksualnej, to znaczy, gdy procesy uczenia się (w tym radzenia sobie z nowością) zostały zakończone i odgrywają niewielką rolę w wykonywaniu czynności seksualnej, podczas gdy przeciwnie, nadal występuje, gdy aktywność seksualna jest powtarzana. Innymi słowy, zewnątrzkomórkowa dopamina w mPFC (oraz w jądrze półleżącym) zawsze wzrasta podczas kopulacji, nawet po nauczeniu się zachowań seksualnych. Konieczne są dalsze badania w celu wyjaśnienia funkcjonalnej roli tego wzrostu aktywności dopaminy w mPFC (oraz w jądrze półleżącym; patrz tam sekcja „Wprowadzenie i odniesienia”).
Podsumowując, badanie to pokazuje po raz pierwszy, że obecność, a nawet więcej, interakcji z seksualnie otwartą samicą prowadzi do wzrostu zewnątrzkomórkowej dopaminy i NA w dializacie z mPFC naiwnych seksualnie (nigdy nie narażonych na bodźce seksualne) i doświadczonych seksualnie (które przeszły pięć wstępnych testów kopulacyjnych i wykazują stabilne sprawności seksualne) szczurów RHA i RLA, które wykazują wyraźnie różne style radzenia sobie w odpowiedzi na warunki awersyjne i różne wzorce zachowań kopulacyjnych z również seksualnie otwarta kobieta. W związku z tym stężenia dopaminy i NA stwierdzono wyższe w dializacie od naiwnych seksualnie i doświadczonych szczurów RHA w porównaniu z ich odpowiednikami RLA zarówno podczas fazy przewidywania, jak i konsumowania aktywności seksualnej. Wyniki te mogą być częściowo spowodowane tonem dopaminergicznym i noradrenergicznym w mPFC szczurów RHA wyższym niż u szczurów RLA, jak podano dla dopaminy w jądrze półleżącym (Sanna i in., 2015). Co więcej, zewnątrzkomórkowa dopamina mPFC i NA były również wyższe u doświadczanych seksualnie szczurów RHA i, w mniejszym stopniu, szczurów RLA w porównaniu z ich naiwnymi seksualnie odpowiednikami w warunkach podstawowych, jak również podczas apetycznych i konsumpcyjnych faz zachowań seksualnych. Sugeruje to, że doświadczenie seksualne indukuje procesy plastyczne, które dodatkowo wzmacniają neuroprzekaźnictwo dopaminy i NA w mPFC, jak stwierdzono dla dopaminy w jądrze półleżącym obu linii szczurów rzymskich (Sanna i in., 2015). Powyższe różnice w neuroprzekaźnictwie dopaminergicznym i noradrenergicznym w mPFC dwóch linii rzymskich mogą odgrywać rolę nie tylko w różnych wzorcach zachowań seksualnych, ale także w różnych i często przeciwstawnych cechach behawioralnych, które charakteryzują te dwie linie szczurów.
Autorskie Wkłady
FS, AA, MRM, OG i MGC zaprojektowali projekt. FS i JB zaprojektowali, przeprowadzili i przeanalizowali dane z eksperymentów dotyczących zachowań seksualnych i mikrodializy. MAP, OG i MGC wyselekcjonowały i wyhodowały rzymskie szczury. Badanie nadzorowali FS, AA, MRM, OG i MGC. Manuskrypt napisali FS, AA, MRM, OG i MGC. Wszyscy autorzy omówili wyniki i skomentowali manuskrypt.
Finansowanie
Ta praca była częściowo wspierana przez granty z włoskiego Ministerstwa Uniwersytetu i Badań Naukowych (MIUR) (Niezależność naukowa młodych naukowców, SIR 2014, kod nr RBSI14IUX7) dla FS, z Autonomicznego Regionu Sardynii (ARS) (LR 7/2007, „Promocja badań naukowych i innowacji technologicznych na Sardynii”, Europejski Fundusz Społeczny, 2007–2013, kod projektu CRP-59842) do OG oraz z University of Cagliari do AA, MRM, FS, OG i MGC.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek powiązań handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowanie
Dr Barbara Tuveri, Uniwersytet w Cagliari, za trzymanie i opiekę nad zwierzętami.
Referencje
Afonso, VM, Sison, M., Lovic, V. i Fleming, AS (2007). Uszkodzenia przyśrodkowej kory przedczołowej u samic szczura wpływają na zachowania seksualne i matczyne oraz ich sekwencyjną organizację. Behav. Neurosci. 121, 515-526. doi: 10.1037 / 0735-7044.121.3.515
Agmo, A. i Villalpando, A. (1995). Stymulatory ośrodkowego układu nerwowego ułatwiają zachowania seksualne u samców szczurów z uszkodzeniami przyśrodkowej kory przedczołowej. Brain Res. 696, 187–193. doi: 10.1016/0006-8993(95)00853-i
Agmo, A., Villalpando, A., Picker, Z. i Fernández, H. (1995). Uszkodzenia przyśrodkowej kory przedczołowej i zachowania seksualne u samca szczura. Brain Res. 696, 177–186. doi: 10.1016/0006-8993(95)00852-h
Argiolas, A. i Melis, MR (1995). Neuromodulacja erekcji prącia: przegląd roli neuroprzekaźników i neuropeptydów. Wałówka. Neurobiol. 47, 235–255. doi: 10.1016/0301-0082(95)00020-8
Argiolas, A. i Melis, MR (2005). Centralna kontrola erekcji prącia: rola jądra przykomorowego podwzgórza. Wałówka. Neurobiol. 76, 1-21. doi: 10.1016 / j.pneurobio.2005.06.002
Argiolas, A. i Melis, MR (2013). Neuropeptydy i centralna kontrola zachowań seksualnych od przeszłości do teraźniejszości: przegląd. Wałówka. Neurobiol. 108, 80-107. doi: 10.1016 / j.pneurobio.2013.06.006
Balfour, ME, Brown, JL, Yu, L. i Coolen, LM (2006). Potencjalny wkład eferentów z przyśrodkowej kory przedczołowej w aktywację neuronów po zachowaniach seksualnych u samca szczura. Neuroscience 137, 1259 – 1276. doi: 10.1016 / j.neuroscience.2005.11.013
Balfour, ME, Yu, L. i Coolen, LM (2004). Zachowania seksualne i sygnały środowiskowe związane z płcią aktywują układ mezolimbiczny u samców szczurów. Neuropsychopharmacology 29, 718-730. doi: 10.1038 / sj.npp.1300350
Beloate, LN, Omrani, A., Adan, RA, Webb, IC i Coolen, LM (2016). Aktywacja komórek dopaminowych obszaru brzusznego nakrywki podczas zachowań seksualnych samców szczurów reguluje neuroplastyczność i uczulenie krzyżowe na d-amfetaminę po abstynencji seksualnej. J. Neurosci. 36, 9949 – 9961. doi: 10.1523 / JNEUROSCI.0937-16.2016
Berridge, K. i Robinson, T. (1998). Jaka jest rola dopaminy w nagrodzie: wpływ hedoniczny, nauka nagrody lub zachęta? Brain Res. Obrót silnika. 28, 309–369. doi: 10.1016/s0165-0173(98)00019-8
Bignami, G. (1965). Selekcja pod kątem wysokich i niskich wskaźników warunkowania unikania u szczura. Anim. Behav. 13, 221–227. doi: 10.1016/0003-3472(65)90038-2
Broadhurst, PL i Bignami, G. (1965). Korelacyjne efekty selekcji psychogenetycznej: badanie rzymskich szczepów szczurów o wysokim i niskim unikaniu. Behav. Res. Ther. 3, 273–280. doi: 10.1016/0005-7967(64)90033-6
Carboni, E., Silvagni, A., Vacca, C. i Di Chiara, G. (2006). Skumulowany wpływ blokady nośnika noradrenaliny i dopaminy na pozakomórkowy wzrost dopaminy w powłoce jądra półleżącego, jądrze łożyska prążkowia końcowego i korze przedczołowej. J. Neurochem. 96, 473-481. doi: 10.1111 / j.1471-4159.2005.03556.x
Carboni, E., Tanda, GL, Frau, R. i Di Chiara, G. (1990). Blokada nośnika noradrenaliny zwiększa zewnątrzkomórkowe stężenie dopaminy w korze przedczołowej: dowód na to, że dopamina jest wchłaniana in vivo przez terminale noradrenergiczne. J. Neurochem. 55, 1067–1070. doi: 10.1111/j.1471-4159.1990.tb04599.x
Carlsson, A. (1975). „Kontrola metabolizmu dopaminy za pośrednictwem receptorów”, w Receptory przed- i postsynaptyczne, red. E. Usdin i WE Bunney (Nowy Jork, NY: Marcel Deker), 49–65.
Carrasco, J., Márquez, C., Nadal, R., Tobeña, A., Fernández-Teruel, A. i Armario, A. (2008). Charakterystyka centralnych i obwodowych elementów osi podwzgórze-przysadka-nadnercza u wsobnych szczepów szczurów rzymskich. Psychoneuroendocrinology 33, 437 – 445. doi: 10.1016 / j.psyneuen.2008.01.001
Coppens, CM, de Boer, SF, Steimer, T. i Koolhaas, JM (2012). Impulsywność i agresywne zachowanie u rzymskich szczurów o wysokim i niskim unikaniu: różnice wyjściowe i zmiany wywołane stresem społecznym nastolatków. Physiol. Behav. 105, 1156 – 1160. doi: 10.1016 / j.physbeh.2011.12.013
Corda, MG, Lecca, D., Piras, G., Di Chiara, G. i Giorgi, O. (1997). Parametry biochemiczne neuroprzekaźnictwa dopaminergicznego i GABAergicznego w OUN rzymskich szczurów o wysokim unikaniu i rzymskich szczurach o niskim unikaniu. Behav Genet 27, 527 – 536. doi: 10.1023 / A: 1021452814574
Corda, MG, Piras, G., Piludu, MA i Giorgi, O. (2014). Zróżnicowane skutki dobrowolnego spożycia etanolu na wytwarzanie dopaminy w jądrze półleżącym szczurów rzymskich o wysokim i niskim unikaniu: badanie mikrodializy behawioralnej i mózgowej. Świat J. Neurosci. 4, 279–292. doi: 10.4236/wjns.2014.43031
Dahlstrom, A. i Fuxe, K. (1964). Dowody na istnienie neuronów zawierających monoaminy w ośrodkowym układzie nerwowym. I. Demonstracja monoamin w ciałach komórkowych neuronów pnia mózgu. Acta Physiol. Skanuj. Dodatek 62, 1-54.
Damsma, G., Pfaus, J., Wenkstern, D., Phillips, A. i Fibiger, H. (1992). Zachowania seksualne zwiększają transmisję dopaminy w jądrze półleżącym i prążkowiu samców szczurów: porównanie z nowością i lokomocją. Behav. Neurosci. 106, 181-191. doi: 10.1037 / 0735-7044.106.1.181
D'Angio, M., Serrano, A., Driscoll, P. i Scatton, B. (1988). Stresujące bodźce środowiskowe zwiększają pozakomórkowe poziomy DOPAC w korze przedczołowej szczurów hipoemocjonalnych (rzymskie wysokie unikanie), ale nie hiperemocjonalnych (rzymskie niskie unikanie). jakiś in vivo badanie woltamperometryczne. Brain Res. 451, 237–247. doi: 10.1016/0006-8993(88)90768-8
Davis, JF, Loos, M., Di Sebastiano, AR, Brown, JL, Lehman, MN i Coolen, LM (2010). Uszkodzenia przyśrodkowej kory przedczołowej powodują nieprzystosowawcze zachowania seksualne u samców szczurów. Biol. Psychiatria 67, 1199-1204. doi: 10.1016 / j.biopsych.2009.12.029
Díaz-Morán, S., Palència, M., Mont-Cardona, C., Cañete, T., Blázquez, G., Martínez-Membrives, E., et al. (2012). Styl radzenia sobie i reakcje hormonów stresu u genetycznie heterogenicznych szczurów: porównanie ze szczepami szczurów rzymskich. Behav. Brain Res. 228, 203 – 210. doi: 10.1016 / j.bbr.2011.12.002
Driscoll, P. i Battig, K. (1982). „Profile behawioralne, emocjonalne i neurochemiczne szczurów wybranych pod kątem ekstremalnych różnic w aktywnym, dwukierunkowym unikaniu”, w: Genetyka mózgu, wyd. I. Lieblich (Amsterdam: Elsevier), 95–123.
Dunlop, BW i Nemeroff, CB (2007). Rola dopaminy w patofizjologii depresji. Łuk. Gen. Psychiatry 64, 327-337. doi: 10.1001 / archpsyc.64.3.327
Escorihuela, RM, Fernández-Teruel, A., Gil, L., Aguilar, R., Tobeña, A. i Driscoll, P. (1999). Wsobne rzymskie szczury o wysokim i niskim unikaniu: różnice w zachowaniach związanych z lękiem, poszukiwaniem nowości i wahadłowcem. Physiol. Behav. 67, 19–26. doi: 10.1016/S0031-9384(99)00064-5
Everitt, BJ (1990). Motywacja seksualna: neuronalna i behawioralna analiza mechanizmów leżących u podstaw reakcji apetycznych i kopulacyjnych samców szczurów. Neurosci. Biobehav. Obrót silnika. 14, 217–232. doi: 10.1016/s0149-7634(05)80222-2
Everitt, BJ i Robbins, TW (2005). Neuronowe systemy wzmacniania uzależnienia od narkotyków: od działań po przyzwyczajenia. Nat. Neurosci. 8, 1481 – 1489. doi: 10.1038 / nn1579
Fadda, F., Argiolas, A., Melis, MR, Tissari, AH, Onali, PL i Gessa, GL (1978). Wywołany stresem wzrost poziomu kwasu 3,4-dihydroksyfenylooctowego (DOPAC) w korze mózgowej i n.acumbens: odwrócenie przez diazepam. Life Sci. 23, 2219–2224. doi: 10.1016/b978-0-08-023768-8.51934-4
Fattore, L., Piras, G., Corda, MG i Giorgi, O. (2009). Rzymskie linie szczurów o wysokim i niskim unikaniu różnią się pod względem nabywania, utrzymywania, wymierania i przywracania dożylnego samodzielnego podawania kokainy. Neuropsychopharmacology 34, 1091 – 1101. doi: 10.1038 / npp.2008.43
Febo, M. (2011). Wypalanie komórek przedczołowych u samców szczurów podczas zbliżania się do samicy podatnej seksualnie: interakcje z kokainą. Synapse 65, 271 – 277. doi: 10.1002 / syn.20843
Fernández-Guasti, A., Omaña-Zapata, I., Luján, M. i Condés-Lara, M. (1994). Działania ligatury nerwu kulszowego na zachowania seksualne doświadczonych seksualnie i niedoświadczonych samców szczurów: skutki obłuszczenia przedniego bieguna. Physiol. Behav. 55, 577–581. doi: 10.1016/0031-9384(94)90119-8
Fernández-Teruel, A., Driscoll, P., Gil, L., Aguilar, R., Tobeña, A. i Escorihuela, RM (2002). Trwały wpływ wzbogacenia środowiska na poszukiwanie nowości, spożycie sacharyny i etanolu w dwóch liniach szczurów (RHA / Verh i RLA / Verh) różniących się zachowaniem związanym z poszukiwaniem zachęt. Pharmacol. Biochem. Behav. 73, 225–231. doi: 10.1016/s0091-3057(02)00784-0
Giménez-Llort, L., Cañete, T., Guitart-Masip, M., Fernández-Teruel, A. i Tobeña, A. (2005). Dwa charakterystyczne fenotypy indukowane apomorfiną u rzymskich szczurów o wysokim i niskim unikaniu. Physiol. Behav. 86, 458 – 466. doi: 10.1016 / j.physbeh.2005.07.021
Giorgi, O., Lecca, D., Piras, G. i Corda, MG (2005). Różnicowa aktywacja uwalniania dopaminy w rdzeniu i powłoce jądra półleżącego po ostrych lub powtarzanych zastrzykach amfetaminy: badanie porównawcze rzymskich linii szczurów o wysokim i niskim unikaniu. Neuroscience 135, 987 – 998. doi: 10.1016 / j.neuroscience.2005.06.075
Giorgi, O., Lecca, D., Piras, G., Driscoll, P. i Corda, MG (2003a). Dysocjacja między mezokortykalnym uwalnianiem dopaminy a zachowaniami związanymi ze strachem u dwóch psychogenetycznie wybranych linii szczurów, które różnią się strategiami radzenia sobie z warunkami awersyjnymi. Eur. J. Neurosci. 17, 2716-2726. doi: 10.1046 / j.1460-9568.2003.02689.x
Giorgi, O., Piras, G., Lecca, D., Hansson, S., Driscoll, P. i Corda, MG (2003b). Różnicowe właściwości neurochemiczne centralnej transmisji serotonergicznej u rzymskich szczurów o wysokim i niskim unikaniu. J. Neurochem. 86, 422-431. doi: 10.1046 / j.1471-4159.2003.01845.x
Giorgi, O., Orlandi, M., Escorihuela, RM, Driscoll, P., Lecca, D. i Corda, MG (1994). Transmisja GABAergiczna i dopaminergiczna w mózgu rzymskich szczurów o wysokim unikaniu i rzymskich szczurach o niskim unikaniu. Brain Res. 638, 133–138. doi: 10.1016/0006-8993(94)90642-4
Giorgi, O., Piras, G. i Corda, MG (2007). Psychogenetycznie wybrane rzymskie linie szczurów o wysokim i niskim unikaniu: model do badania indywidualnej podatności na uzależnienie od narkotyków. Neurosci. Biobehav. Obrót silnika. 31, 148-163. doi: 10.1016 / j.neubiorev.2006.07.008
Goto, Y. i Grace, AA (2005). Dopaminergiczna modulacja układu limbicznego i korowego jądra półleżącego zachowania ukierunkowanego na cel. Nat. Neurosci. 8, 805 – 812. doi: 10.1038 / nn1471
Gresch, PJ, Sved, AF, Zigmond, MJ i Finlay, JM (1995). Lokalny wpływ endogennej noradrenaliny na pozakomórkową dopaminę w przyśrodkowej korze przedczołowej szczura. J. Neurochem. 65, 111-116. doi: 10.1046 / j.1471-4159.1995.65010111.x
Hernández-Gonzáles, M., Guevara, MA, Cervantes, M., Morali, G. i Corsi-Cabrera, M. (1998). Charakterystyczne pasma częstotliwości korowo-czołowego EEG podczas interakcji płciowej samca szczura w wyniku analizy czynnikowej. J. Fizjologia 92, 43–50. doi: 10.1016/s0928-4257(98)80022-3
Hernández-Gonzáles, M., Prieto-Beracoechea, CA, Arteaga-Silva, M. i Guevara, MA (2007). Różna funkcjonalność przyśrodkowej i oczodołowej kory przedczołowej podczas zadania motywowanego seksualnie u szczurów. Physiol. Behav. 90, 450 – 458. doi: 10.1016 / j.physbeh.2006.10.006
Róg, AS (1973). Relacje struktura-aktywność dla hamowania wychwytu katecholamin do synaptosomów z neuronów noradrenergicznych i dopaminergicznych w homogenatach mózgu szczura. Br. J. Pharmacol. 47, 332–338. doi: 10.1111/j.1476-5381.1973.tb08331.x
Hull, EM, Du, J., Lorrain, DS i Matuszewich, L. (1995). Pozakomórkowa dopamina w przyśrodkowym obszarze preoptycznym: implikacje dla motywacji seksualnej i hormonalnej kontroli kopulacji. J. Neurosci. 15, 7465-7471.
Hull, EM, Lorrain, DS, Du, J., Matuszewich, L., Lumley, LA, Putnam, SK i in. (1999). Interakcje hormon-neuroprzekaźnik w kontroli zachowań seksualnych. Behav. Brain Res. 105, 105–116. doi: 10.1016/s0166-4328(99)00086-8
Hull, EM, Weber, MS, Eaton, RC, Dua, R., Markowski, VP, Lumley, L., et al. (1991). Receptory dopaminy w brzusznym obszarze nakrywki wpływają na motoryczne, ale nie motywacyjne lub odruchowe, elementy kopulacji u samców szczurów. Brain Res. 554, 72–76. doi: 10.1016/0006-8993(91)90173-S
Ikemoto, S. i Panksepp, J. (1999). Rola jądra półleżącego dopaminy w zmotywowanym zachowaniu: jednocząca interpretacja ze szczególnym odniesieniem do poszukiwania nagrody. Brain Res. Obrót silnika. 31, 6–41. doi: 10.1016/S0165-0173(99)00023-5
Kakeyama, M., Sone, H., Miyabara, Y. i Tohyama, C. (2003). Okołoporodowa ekspozycja na 2,3,7,8-tetrachlorodibenzo-p-dioksynę zmienia zależną od aktywności ekspresję mRNA BDNF w korze nowej i zachowania seksualne samców szczurów w wieku dorosłym. Neurotoksykologia 24, 207–217. doi: 10.1016/S0161-813x(02)00214-0
Lecca, D., Piras, G., Driscoll, P., Giorgi, O. i Corda, MG (2004). Zróżnicowana aktywacja wydzielania dopaminy w powłoce i rdzeniu jądra półleżącego jest związana z reakcjami motorycznymi na uzależniające leki: badanie dializy mózgu u rzymskich szczurów o wysokim i niskim unikaniu. Neuropharmacology 46, 688 – 699. doi: 10.1016 / j.neuropharm.2003.11.011
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, Donaire, R., Sabariego, M., Fernández-Teruel, A., et al. (2014a). Związek między preferencjami etanolu a poszukiwaniem sensacji/nowości. Physiol. Behav. 133, 53 – 60. doi: 10.1016 / j.physbeh.2014.05.003
Manzo, L., Gómez, MJ, Callejas-Aguilera, JE, Fernández-Teruel, A., Papini, MR i Torres, C. (2014b). Samoleczenie przeciwlękowe wywołane utratą motywacji u szczurów. Physiol. Behav. 123, 86 – 92. doi: 10.1016 / j.physbeh.2013.10.002
Masana, M., Bortolozzi, A. i Artigas, F. (2011). Selektywne wzmocnienie mezokortykalnego przekaźnictwa dopaminergicznego przez leki noradrenergiczne: możliwości terapeutyczne w schizofrenii. Int. J. Neuropsychopharmacol. 14, 53 – 68. doi: 10.1017 / s1461145710000908
Meisel, RL i Sachs, BD (1994). „Fizjologia męskich zachowań seksualnych”, w Fizjologia reprodukcji, Tom. 2, wyd. 2, red. E. Knobil i J. Neil (New York, NY: Raven Press), 3–96.
Melis, MR i Argiolas, A. (1995). Dopamina i zachowania seksualne. Neurosci. Biobehav. Obrót silnika. 19, 19–38. doi: 10.1016/0149-7634(94)00020-2
Melis, MR i Argiolas, A. (2011). Centralna kontrola erekcji prącia: ponowna wizyta w roli oksytocyny i jej interakcji z dopaminą i kwasem glutaminowym u samców szczurów. Neurosci. Biobehav. Obrót silnika. 35, 939-955. doi: 10.1016 / j.neubiorev.2010.10.014
Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., et al. (2007). Oksytocyna wstrzyknięta w obszar brzusznej nakrywki wywołuje erekcję prącia i zwiększa pozakomórkową dopaminę w jądrze półleżącym i jądrze przykomorowym podwzgórza samców szczurów. Eur. J. Neurosci. 26, 1026-1035. doi: 10.1111 / j.1460-9568.2007.05721.x
Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., i in. (2010). Oksytocyna wywołuje erekcję prącia po wstrzyknięciu do podbrzusza brzusznego: rola tlenku azotu i kwasu glutaminowego. Neuropharmacology 58, 1153 – 1160. doi: 10.1016 / j.neuropharm.2010.02.008
Melis, MR, Succu, S., Mascia, MS, Cortis, L. i Argiolas, A. (2003). Pozakomórkowa dopamina wzrasta w jądrze przykomorowym samców szczurów podczas aktywności seksualnej. Eur. J. Neurosci. 17, 1266-1272. doi: 10.1046 / j.1460-9568.2003.02558.x
Melis, MR, Succu, S., Sanna, F., Boi, A. i Argiolas, A. (2009). Oksytocyna wstrzyknięta do podbrzusza brzusznego lub tylno-przyśrodkowego jądra korowego ciała migdałowatego wywołuje erekcję prącia i zwiększa pozakomórkowe poziomy dopaminy w jądrze półleżącym samców szczurów. Eur. J. Neurosci. 30, 1349-1357. doi: 10.1111 / j.1460-9568.2009.06912.x
M. Moreno, D. Cardona, MJ Gómez, F. Sánchez-Santed, A. Tobeña, A. Fernández-Teruel i in. (2010). Charakterystyka impulsywności u rzymskich szczepów szczurów o wysokim i niskim unikaniu: różnice behawioralne i neurochemiczne. Neuropsychopharmacology 35, 1198 – 1208. doi: 10.1038 / npp.2009.224
Oliveras, I., Río-Álamos, C., Cañete, T., Blázquez, G., Martínez-Membrives, E., Giorgi, O., et al. (2015). Hamowanie przedimpulsowe przewiduje przestrzenną wydajność pamięci roboczej u wsobnych rzymskich szczurów o wysokim i niskim unikaniu oraz u genetycznie heterogenicznych szczurów NIH-HS: znaczenie dla badania anomalii przeduważnych i poznawczych w schizofrenii. Z przodu. Behav. Neurosci. 9: 213. doi: 10.3389 / fnbeh.2015.00213
Paxinos, G. i Watson, C. (2004). Mózg szczura w współrzędnych stereotaktycznych, 4th Edn, Nowy Jork: Academic Press.
Pfaus, JG (2010). Dopamina: pomaganie samcom w kopulacji przez co najmniej 200 milionów lat: komentarz teoretyczny do Kleitz-Nelson i in. (2010). Behav. Neurosci. 124, 877 – 880. doi: 10.1037 / a0021823
Pfaus, JG, Damsma, G., Nomikos, GG, Wenkstern, DG, Blaha, CD, Phillips, AG i in. (1990). Zachowania seksualne zwiększają centralną transmisję dopaminy u samca szczura. Brain Res. 530, 345–348. doi: 10.1016/0006-8993(90)91309-5
Pfaus, JG i Everitt, BJ (1995). „Psychofarmakologia zachowań seksualnych”, w Psychofarmakologia: czwarta generacja postępu, red. FE Bloom i DJ Kupfer (Nowy Jork, NY: Raven Press), 742–758.
Pfaus, JG i Phillips, AG (1991). Rola dopaminy w antycypacyjnych i konsumpcyjnych aspektach zachowań seksualnych u samców szczurów. Behav. Neurosci. 105, 727-747. doi: 10.1037 / 0735-7044.105.5.727
Piras, G., Giorgi, O. i Corda, MG (2010). Wpływ leków przeciwdepresyjnych na wyniki w teście wymuszonego pływania dwóch psychogenetycznie wybranych linii szczurów różniących się strategiami radzenia sobie z warunkami awersyjnymi. Psychopharmacology 211, 403–414. doi: 10.1007/s00213-010-1904-x
Piras, G., Piludu, MA, Giorgi, O. i Corda, MG (2014). Skutki przewlekłego leczenia przeciwdepresyjnego w domniemanym modelu genetycznym podatności (rzymskie szczury o niskim unikaniu) i odporności (rzymskie szczury o wysokim unikaniu) na depresję wywołaną stresem. Psychopharmacology 231, 43–53. doi: 10.1007/s00213-013-3205-7
Pitchers, KK, Frohmader, KS, Vialou, V., Mouzon, K., Nestler, EJ, Lehman, MN i in. (2010). ΔFosB w jądrze półleżącym ma kluczowe znaczenie dla wzmocnienia efektów nagrody seksualnej. Genes Brain Behav. 9, 831–840. doi: 10.1111/j.1601-183X.2010.00621.x
Pitchers, KK, Coppens, CM, Beloate, LN, Fuller, J., Van, S., Frohmader, KS i in. (2014). Endogenna indukowana opioidami neuroplastyczność neuronów dopaminergicznych w brzusznym obszarze nakrywkowym wpływa na nagrodę naturalną i opiatową. J. Neurosci. 34, 8825 – 8836. doi: 10.1523 / JNEUROSCI.0133-14.2014
Miotacze, KK, Vialou, V., Nestler, EJ, Laviolette, SR, Lehman, MN i Coolen, LM (2013). Nagrody naturalne i narkotykowe działają na wspólne mechanizmy plastyczności neuronów z ΔFosB jako kluczowym mediatorem. J. Neurosci. 33, 3434 – 3442. doi: 10.1523 / JNEUROSCI.4881-12.2013
E. Pleim, J. Matochik, R. Barfield i S. Auerbach (1990). Korelacja uwalniania dopaminy w jądrze półleżącym z męskimi zachowaniami seksualnymi u szczurów. Brain Res. 524, 160–163. doi: 10.1016/0006-8993(90)90507-8
Robbins, TW i Arnsten, AFT (2009). Neuropsychofarmakologia funkcji czołowo-wykonawczej: modulacja monoaminergiczna. Ann. Wielebny Neurosci. 32, 267 – 287. doi: 10.1146 / annurev.neuro.051508.135535
Sabariego, M., Morón, I., Gómez, MJ, Donaire, R., Tobeña, A., Fernández-Teruel, A., et al. (2013). Utrata motywacji i ekspresja genów hipokampa u wsobnych szczurów unikających rzymskiego wysokiego (RHA-I) i rzymskiego niskiego (RLA-I). Behav. Brain Res. 257, 62 – 70. doi: 10.1016 / j.bbr.2013.09.025
Sachs, BD (2000). Kontekstowe podejścia do fizjologii i klasyfikacji funkcji erekcji, zaburzeń erekcji i podniecenia seksualnego. Neurosci. Biobehav. Obrót silnika. 24, 541–560. doi: 10.1016/S0149-7634(00)00022-1
Sachs, BD, Akasofu, K., Citro, JK, Daniels, SB i Natoli, JH (1994). Bezkontaktowa stymulacja samic w okresie rui wywołuje erekcję prącia u szczurów. Physiol. Behav. 55, 1073–1079. doi: 10.1016/0031-9384(94)90390-5
Sachs, BD i Barfield, RJ (1976). Analiza funkcjonalna męskich zachowań kopulacyjnych u szczura. adw. Stadnina. Zachowanie 7, 91–154. doi: 10.1016/s0065-3454(08)60166-7
Salamone, JD, Pardo, M., Yohn, SE, López-Cruz, L., San Miguel, N. i Correa, M. (2016). Mezolimbiczna dopamina i regulacja motywowanego zachowania. Curr. Top. Behav. Neurosci. 27, 231–257. doi: 10.1007/7854_2015_383
Sanna, F., Corda, MG, Melis, MR, Piludu, MA, Giorgi, O. i Argiolas, A. (2014a). Samce szczurów rzymskich o wysokim i niskim stopniu unikania wykazują różne wzorce zachowań kopulacyjnych: porównanie ze szczurami rasy Sprague Dawley. Physiol. Behav. 127, 27 – 36. doi: 10.1016 / j.physbeh.2014.01.002
Sanna, F., Piludu, MA, Corda, MG, Argiolas, A., Giorgi, O. i Melis, MR (2014b). Dopamina jest zaangażowana w różne wzorce zachowań kopulacyjnych rzymskich szczurów o wysokim i niskim unikaniu: badania z apomorfiną i haloperidolem. Pharmacol. Biochem. Behav. 124, 211 – 219. doi: 10.1016 / j.pbb.2014.06.012
Sanna, F., Piludu, MA, Corda, MG, Melis, MR, Giorgi, O. i Argiolas, A. (2015). Zaangażowanie dopaminy w różnice w zachowaniach seksualnych między rzymskimi szczurami o wysokim i niskim unikaniu: badanie mikrodializy wewnątrzmózgowej. Behav. Brain Res. 281, 177 – 186. doi: 10.1016 / j.bbr.2014.12.009
Scatton, B., D'Angio, M., Driscoll, P. i Serrano, A. (1988). Jakiś in vivo woltamperometryczne badanie odpowiedzi mezokortykalnych i półleżących neuronów dopaminergicznych na bodźce środowiskowe u szczepów szczurów o różnym poziomie emocjonalności. Ann. NY Acad. nauka 537, 124–137. doi: 10.1111/j.1749-6632.1988.tb42101.x
Steimer, T. i Driscoll, P. (2003). Rozbieżne reakcje na stres i style radzenia sobie u psychogenetycznie wybranych rzymskich szczurów o wysokim (RHA) i niskim (RLA) unikaniu: aspekty behawioralne, neuroendokrynne i rozwojowe. Napięcia 6, 87-100. doi: 10.1080 / 1025389031000111320
Succu, S., Sanna, F., Argiolas, A. i Melis, MR (2011). Oksytocyna wstrzyknięta do hipokampa brzusznego subiculum indukuje erekcję prącia u samców szczurów poprzez zwiększenie neuroprzekaźnictwa glutaminergicznego w brzusznym obszarze nakrywkowym. Neuropharmacology 61, 181 – 188. doi: 10.1016 / j.neuropharm.2011.03.026
Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, i in. (2008). Oksytocyna wywołuje erekcję prącia po wstrzyknięciu do brzusznej części nakrywki samców szczurów: rola tlenku azotu i cyklicznego GMP. Eur. J. Neurosci. 28, 813-821. doi: 10.1111 / j.1460-9568.2008.06385.x
Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A. i Melis, MR (2007). Stymulacja receptorów dopaminy w jądrze przykomorowym podwzgórza samców szczurów wywołuje erekcję prącia i zwiększa zewnątrzkomórkową dopaminę w jądrze półleżącym: zaangażowanie centralnej oksytocyny. Neuropharmacology 52, 1034 – 1043. doi: 10.1016 / j.neuropharm.2006.10.019
Thierry, AM, Tassin, JP, Blanc, G. i Glowinski, J. (1976). Selektywna aktywacja mezokortykalnego systemu DA przez stres. Natura 263, 242 – 244. doi: 10.1038 / 263242a0
Wenkstern, D., Pfaus, J. i Fibiger, H. (1993). Transmisja dopaminy wzrasta w jądrze półleżącym samców szczurów podczas ich pierwszej ekspozycji na samice szczurów wrażliwych seksualnie. Brain Res. 618, 41–46. doi: 10.1016/0006-8993(93)90426-N
Westernik, BHC, De Boer, P., De Vries, JB i Long, S. (1998). Leki przeciwpsychotyczne wywołują podobny wpływ na uwalnianie dopaminy i noradrenaliny w przyśrodkowej korze przedczołowej mózgu szczura. Eur. J. Pharmacol. 361, 27–33. doi: 10.1016/s0014-2999(98)00711-0
Willig, F., M'Harzi, M., Bardelay, C., Viet, D. i Delacour, J. (1991). Szczepy rzymskie jako model psychogenetyczny do badania pamięci roboczej: dane behawioralne i biochemiczne. Pharmacol. Biochem. Behav. 40, 7–16. doi: 10.1016/0091-3057(91)90313-q
Słowa kluczowe: zachowania seksualne, dopamina, noradrenalina, mPFC, mikrodializa, szczury RHA i RLA
Cytowanie: Sanna F, Bratzu J, Piludu MA, Corda MG, Melis MR, Giorgi O i Argiolas A (2017) Dopamina, noradrenalina i różnice w zachowaniach seksualnych między rzymskimi szczurami o wysokim i niskim unikaniu: badanie mikrodializy w przyśrodkowej korze przedczołowej. Przód. Zachowanie Neuronauka. 11:108. doi: 10.3389/fnbeh.2017.00108
Otrzymano: 22 grudnia 2016 r.; Przyjęto: 19 maja 2017 r.;
Opublikowane: 07 June 2017.
 Fabrycy Sanna
Fabrycy Sanna Jessica Bratzu
Jessica Bratzu Marii A. Piludu
Marii A. Piludu Marii G. Cordy
Marii G. Cordy Marii R. Melis
Marii R. Melis Osvaldo Giorgiego
Osvaldo Giorgiego Antonio Argiolasa
Antonio Argiolasa