Komentarze: Ta recenzja została opracowana przez szefa NIDA, Nora Volkow i jej zespół. Nie pozostawia wątpliwości, że uzależnienia chemiczne i uzależnienia behawioralne mają takie same lub podobne mechanizmy i obwody nerwowe. Ma to sens, ponieważ uzależnienia chemiczne przejmują układ nerwowy w celu połączenia, seksu i jedzenia. Ponieważ seks uwalnia dwa razy więcej dopaminy niż jedzenia twojego ulubionego jedzenia, a użytkownik pornografii może utrzymać dopaminę przez wiele godzin, to szaleństwem jest proponowanie, że uzależnienie od porno nie może istnieć.
Curr Top Behav Neurosci. 2011 Oct 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
Źródło
National Institute on Drug Abuse, 6001 Executive Boulevard 6001, Room 5274, Bethesda, MD, 20892, USA, [email chroniony].
Abstrakcyjny
Zarówno uzależnienie od narkotyków, jak i otyłość można zdefiniować jako zaburzenia, w których wartość istotności jednego rodzaju nagrody (odpowiednio narkotyków i żywności) staje się nienormalnie zwiększona w stosunku do i kosztem innych. Model ten jest zgodny z faktem, że zarówno leki, jak i żywność mają silne działanie wzmacniające - częściowo za pośrednictwem wzrostu dopaminy w układzie limbicznym - które w pewnych okolicznościach lub u osób wrażliwych mogą osłabić homeostatyczne mechanizmy kontrolne mózgu. Takie podobieństwa wzbudziły znaczne zainteresowanie zrozumieniem wspólnych słabych punktów i trajektorii między uzależnieniem a otyłością. Obecnie, odkrycia obrazowania mózgu zaczęły odkrywać wspólne cechy między tymi dwoma stanami i nakreślić niektóre nakładające się obwody mózgu, których dysfunkcje mogą wyjaśniać stereotypowe i pokrewne deficyty behawioralne u ludzi. TWyniki hese sugerują, że zarówno osoby otyłe, jak i uzależnione od narkotyków cierpią na upośledzenie szlaków dopaminergicznych, które regulują układy neuronalne związane nie tylko z wrażliwością na nagrody i motywacją motywacyjną, ale także z kondycjonowaniem (pamięć / uczenie się), kontrolą impulsów (hamowanie behawioralne), reaktywnością stresową i świadomość interoceptywna. Tutaj integrujemy wyniki przeważnie pochodzące z pozytronowej tomografii emisyjnej, które rzucają światło na rolę dopaminy w uzależnieniu od narkotyków i otyłości oraz proponują zaktualizowany model pracy, który pomoże zidentyfikować strategie leczenia, które mogą przynieść korzyści obu tym warunkom.
1 Tło
2 Rola dopaminy w ostrej nagrodzie dla narkotyków i żywności
3 Obrazowanie DA w odpowiedzi na leki i uwarunkowane wskazówki w uzależnieniu
4 Wpływ zaburzeń w kontroli hamowania
5 Zaangażowanie obwodów motywacyjnych
6 Zaangażowanie Interoceptive Circuitry
7 Obwód awersji
8 Nagroda za patologiczny narkotyk i żywność: zaktualizowany model roboczy
1 Tło
Dopamina (DA) jest uważana za klucz do satysfakcjonujących efektów nagród naturalnych i leków. Jednak jego rola w utracie kontroli i kompulsywnych zachowań związanych z uzależnieniem i otyłością jest znacznie mniej jasna. Badania PET odegrały kluczową rolę w scharakteryzowaniu roli układów DA mózgu w uzależnieniu (oprócz jego roli w nagradzaniu leków) i otyłości. Rzeczywiście, narkotyki (w tym alkohol) są spożywane przez ludzi lub samodzielnie podawane przez zwierzęta laboratoryjne, ponieważ są one z natury nagradzające, efekt, który jest mediowany przez ich właściwości wzmacniające DA w układzie mezolimbicznym (Mądry 2009). Hjednak w przypadku uzależnienia badania obrazowe ujawniły, że zaburzenie wpływa nie tylko na obwód nagrody DA, ale także na inne szlaki DA zaangażowane w modulację warunkowania / przyzwyczajeń, motywację i funkcje wykonawcze (kontrola hamowania, przypisywanie salience i decyzja - i że deficyty DA mogą również uczestniczyć w zwiększonej reaktywności stresowej i zaburzeniu świadomości interoceptywnej związanej z uzależnieniem. Badania przedkliniczne i kliniczne ujawniły również inne neuroprzekaźniki (i neuropeptydy), które odgrywają ważną rolę w nagradzaniu leków i uzależnieniach (tj. kanabinoidy, opioidy) i są ściśle zaangażowani w zmiany neuroplastyczne, które następują po wielokrotnym stosowaniu leku (tj. glutaminian, opioidy, GABA, czynnik uwalniający kortykotropinę). Układ glutaminergiczny jest szczególnie ważny w tym względzie, ponieważ pośredniczy w zaburzeniach zarówno długotrwałego wzmocnienia, jak i długotrwałej depresji, które zaobserwowano w modelach zwierzęcych przewlekłego podawania leków (Thomas i in. 2008). Przeglądy dotyczące tych dodatkowych systemów można znaleźć gdzie indziej (Kalivas 2009; Koob 1992).
Ponieważ leki aktywują te same systemy nagród, które leżą u podstaw nagrody żywnościowej, nie jest całkowicie nieoczekiwane, że ogólnie badania obrazowania mózgu potwierdziły pogląd, że upośledzenie obwodów modulowanych DA jest również związane z patologicznymi, kompulsywnymi zachowaniami żywieniowymi. Sygnały żywnościowe, takie jak sygnały leków, zwiększają pozakomórkową DA prążkowia i pobudzają motywację do angażowania się w zachowania, które są niezbędne do zdobycia i zjedzenia pożywienia, dostarczając dowodów na zaangażowanie DA nie tylko w nagrodę pokarmową, ale także w nie-hedonistyczne motywacyjne właściwości pożywienia (tj. wymagania kaloryczne) i zmniejszenie kontroli hamowania obserwowane w kompulsywnym przejadaniu się (Avena i in. 2008; Volkow i in. 2008).
Tutaj dokonujemy przeglądu wyników badań obrazowych, które koncentrują się na nakładaniu się obwodów mózgu, które są zaburzone w otyłości i narkomanii. Warto jednak pamiętać, że regulacja zachowań żywieniowych jest znacznie bardziej złożona niż regulacja przyjmowania leków. Ten ostatni jest głównie mediowany przez nagradzające efekty leków, podczas gdy pierwszy jest modulowany nie tylko przez jego efekty nagradzające (czynniki hedoniczne), ale także przez wiele czynników obwodowych i centralnych, które wyczuwają zapotrzebowanie składników odżywczych w organizmie niezbędne do przeżycia (czynniki homeostatyczne). Co ciekawe, istnieje coraz więcej dowodów na to, że czynniki homeostatyczne (np. Insulina, leptyna, grelina) częściowo modulują przyjmowanie pokarmu, zwiększając lub zmniejszając wrażliwość obwodów nagrody mózgowej na bodźce pokarmowe (Volkow i in. 2011).
2 Rola dopaminy w ostrej nagrodzie dla narkotyków i żywności
Czy to bezpośrednio, czy pośrednio, wszystkie uzależniające leki wykazują zdolność do zwiększania DA w jądrze półleżącym (NAc) poprzez specyficzne interakcje z różnymi celami molekularnymi (Nestler 2004) (Figa. 1). Mezolimbiczny szlak DA [komórki DA w brzusznym obszarze nakrywkowym (VTA), który projektuje do NAc] wydaje się być kluczowy dla nagrody za lek (Wise 2009). Jednakże, jak opisano poniżej, inne szlaki DA [mezostriatalne (komórki DA w istocie czarnej wystające do prążkowia grzbietowego) i mezokortykalne (komórki DA w VTA wystające do kory czołowej)] również przyczyniają się do nagrody i uzależnienia od narkotyków (Mądry 2009). Ogólnie wydaje się, że efekt nagradzania i kondycjonowania leków jest głównie napędzany przez fazowe wypalanie komórek DA, co prowadzi do dużych i przejściowych wzrostów DA. W przeciwieństwie do tego, zmiany w funkcji wykonawczej występujące w uzależnieniu są związane ze zmianami w tonicznym wypalaniu komórek DA i skutkują niższymi, ale bardziej stabilnymi poziomami DA (Grace 2000; Wanat i in. 2009). To z kolei wskazuje na receptory D1 (D1R), które są receptorami DA o niskim powinowactwie, które stymulują sygnalizację cyklicznego AMP, jako zaangażowane zarówno w ostrej nagradzaniu lekiem, jak iw kondycjonowaniu, ponieważ są one związane z wysokimi wymaganymi stężeniami DA stymulować D1R. Przeciwnie, D2R, które hamują cykliczną sygnalizację AMP, są stymulowane zarówno przez fazowe, jak i toniczne DA. Należy zauważyć, że ze względu na brak specyficznych wskaźników promieniotwórczych do obrazowania PET receptorów DA w typach D1, D3, D4 i D5, większość badań nad wpływem narkotyków i uzależnień w ludzkim mózgu skupia się na D2R.
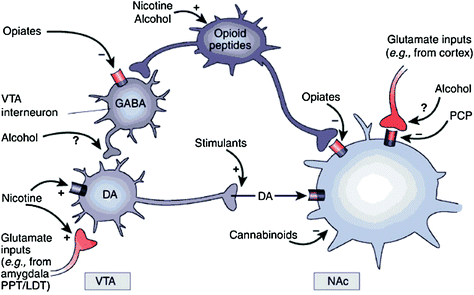
Rys. 1 Narkotyki działają na obwody nagrody i pomocnicze poprzez różne mechanizmy, jednak wszystkie one prowadzą do podobnych efektów dopaminergicznych w VTA i NAc. Tak więc stymulanty pobudzają bezpośrednio acumbal DA, podczas gdy opiaty robią to obniżając hamujący ton interneuronów GABAergicznych na sygnalizację DA, zarówno w VTA, jak i w NAc. Podczas gdy mechanizmy innych narkotyków są mniej jasne, istnieją dowody sugerujące, że nikotyna może aktywować DA VTA bezpośrednio przez nikotynowy receptor acetylocholiny (nAChR) na tych neuronach i pośrednio przez stymulację jej receptorów na końcówkach nerwów glutaminergicznych, które unerwiają komórki DA. Alkohol wydaje się hamować terminale GABAergiczne w VTA, prowadząc do odhamowania neuronów DA w VTA. Kanabinoidy działają między innymi poprzez aktywację receptorów CB1 na końcówkach nerwów glutaminergicznych i GABAergicznych w NAc i na samych neuronach NAc. Fencyklidyna (PCP) może działać poprzez hamowanie postsynaptycznych receptorów glutaminianu NMDA w NAc. Ponadto istnieją pewne dowody sugerujące, że nikotyna i alkohol mogą również wchodzić w interakcje z endogennymi szlakami opioidowymi i kannabinoidowymi (nie pokazano). PPT / LDT, szypułkowa kostka mostkowa / boczna nakrywka grzbietowa. Przedruk z pozwoleniem Nestler (2005)
U ludzi badania PET wykazały, że kilka leków [stymulantów (Drevets i in. 2001; Volkow i in. 1999b), nikotyna (Brody i in. 2009), alkohol (Boileau i in. 2003) i marihuana (Bossong i in. 2009)] zwiększ DA w prążkowiu grzbietowym i brzusznym (gdzie znajduje się NAc). Badania te wykorzystują kilka wskaźników radiowych, takich jak [11C] racloprid, który wiąże się z D2R, ale tylko wtedy, gdy nie są one wiążące endogenne DA (niezajęte), co w warunkach wyjściowych odpowiada 85-90% prążkowia D2R (Abi-Dargham i in. 1998). Zatem porównanie [11C] wiązanie raclopridde po placebo i po podaniu leku może pomóc nam oszacować spadek dostępności D2R indukowany przez lek (lub inne bodźce, które mogą zwiększać DA). Zmniejsza się w [11C] wiązanie raclopopride jest proporcjonalne do wzrostu DA (Breier i in. 1997). Badania te wykazały, że indukowane lekiem zwiększenie DA w prążkowiu jest proporcjonalne do intensywności subiektywnego doświadczenia euforii lub „wysokiego” [patrz przegląd (Volkow i in. 2009)] (Figa. 2).
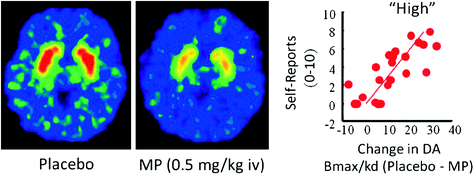
Rys. 2 Wpływ dożylnego metylofenidatu (MP) na wiązanie racloprydu i związek między wzrostami DA prążkowia indukowanymi przez MP w prążkowiu a raportami „wysokim”. Zmodyfikowany z Volkow i in. (1999b)
Badania PET ujawniły również wyraźną, bezpośrednią zależność między profilem farmakokinetycznym leku (tj. Prędkością, z jaką wchodzi i opuszcza mózg) i jego efektami wzmacniającymi. Dokładniej, im szybciej lek osiąga szczytowe poziomy w mózgu, tym bardziej intensywny jest „wysoki” (Volkow i in. 2009). Na przykład, dla równoważnego poziomu kokainy docierającej do mózgu (ocenianego za pomocą PET), gdy kokaina dostała się do mózgu szybko (wędzona lub dożylna), wywołała bardziej intensywny „wysoki” niż wtedy, gdy wchodził wolniej (prychnął) (Volkow i in. 2000). Jest to zgodne z przedklinicznymi badaniami wykazującymi podobną korelację między profilem farmakokinetycznym leku a jego właściwościami wzmacniającymi (Balster i Schuster 1973). jaRozsądne wydaje się postawienie hipotezy, że takie gwałtowne i duże wzrosty DA wywołane przez narkotyki mogą naśladować szybki i duży wzrost DA wynikający ze strzelania fazowego DA, które zostało powiązane w mózgu z przetwarzaniem informacji o nagrodzie i istotności (Schultz 2010). Taki indukowany lekiem wzrost DA w NAc może być konieczny do uzależnienia, ale fakt, że występują również u osób nieuzależnionych, wskazuje, że są one niewystarczające do wyjaśnienia impulsywnego i kompulsywnego używania narkotyków charakterystycznego dla uzależnienia.
Istnieją obecnie dowody na to, że porównywalne reakcje dopaminergiczne są powiązane z nagrodami pokarmowymi i że mechanizmy te mogą również odgrywać rolę w nadmiernym spożyciu żywności i otyłości. Wiadomo, że niektóre pokarmy, szczególnie te bogate w cukry i tłuszcze, są bardzo satysfakcjonujące (Lenoir i in. 2007). Pokarmy wysokokaloryczne mogą sprzyjać nadmiernemu jedzeniu (odżywianiu, które nie jest związane z potrzebami energetycznymi) i wywoływać wyuczone skojarzenia między bodźcem a nagrodą (uwarunkowanie). W kategoriach ewolucyjnych ta właściwość smacznej żywności była korzystna w środowiskach, w których źródła żywności były rzadkie i / lub niewiarygodne, ponieważ zapewniała, że żywność była spożywana, gdy była dostępna, umożliwiając przechowywanie energii w organizmie (w postaci tłuszczu) do wykorzystania w przyszłości . Niestety, w społeczeństwach takich jak nasze, gdzie żywność jest obfita i stale dostępna, ta adaptacja stała się odpowiedzialnością.
Kilka neuroprzekaźników, w tym DA, kannabinoidy, opioidy i serotonina, a także hormony i neuropeptydy zaangażowane w homeostatyczną regulację przyjmowania pokarmu, takie jak insulina, oreksyna, leptyna i grelina, odgrywają rolę w nagradzających efektach jedzenia (Atkinson 2008; Cason i in. 2010; Cota i in. 2006). Spośród nich DA został najbardziej dokładnie zbadany i jest najlepiej scharakteryzowany. Eksperymenty na gryzoniach wykazały, że po pierwszej ekspozycji na nagrodę pokarmową odpalanie neuronów DA w VTA wzrasta wraz z wynikającym z tego zwiększeniem uwalniania DA w NAc (Norgren i in. 2006). Podobnie, u zdrowych, zdrowych ludzi, spożycie smacznego pokarmu wykazało uwalnianie DA w prążkowiu grzbietowym proporcjonalnie do oceny przyjemności posiłku (Small et al. 2003) (Figa. 3). Jednakże, jak widać w badaniach z osobami nadużywającymi narkotyków, wzrost indukowanej pokarmem samej prążkowia DA nie może wyjaśnić różnicy między normalnym przyjmowaniem pokarmu a nadmiernym kompulsywnym spożywaniem pokarmu, ponieważ występują one również u zdrowych osób, które nie jedzą nadmiernie. Tak więc, podobnie jak w przypadku uzależnienia, adaptacje niższego szczebla prawdopodobnie będą zaangażowane w utratę kontroli nad spożyciem żywności.
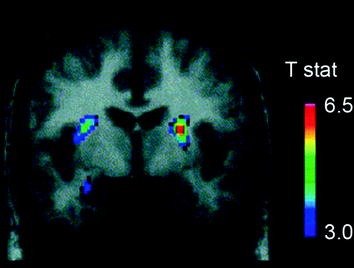
Rys. 3 Uwalnianie dopaminy indukowane przez karmienie. Sekcja koronalna z mapy T statystycznie znaczących redukcji w [11C] potencjał wiązania raklopridu (BP) po karmieniu. Pasek kolorów reprezentuje t wartości statystyki. (Przedruk za zgodą Small et al. 2003)
3 Obrazowanie DA w odpowiedzi na leki i uwarunkowane wskazówki w uzależnieniu
Rola DA we wzmacnianiu jest bardziej złożona niż tylko kodowanie nagrody per se (hedoniczna przyjemność); na przykład bodźce, które indukują szybki i duży wzrost DA, również wywołują uwarunkowane odpowiedzi i wywołują motywację motywującą do ich uzyskania (Owesson-White i in. 2009). Jest to ważne, ponieważ poprzez proces uwarunkowań bodźce neutralne, które są powiązane ze wzmocnieniem (niezależnie od tego, czy są to wzmacniacze naturalne, czy narkotykowe), same zyskują zdolność do zwiększania DA w prążkowiu (w tym NAc) w oczekiwaniu na nagrodę, w ten sposób wywołując silna motywacja do poszukiwania leku (Owesson-White i in. 2009). Oddzielenie mechanizmów nagradzania i warunkowania w procesie uzależnienia od narkotyków jest jednak trudniejsze niż w przypadku spożycia żywności, ponieważ nadużywanie narkotyków, poprzez ich działanie farmakologiczne, bezpośrednio aktywuje neurony DA (tj. Nikotynę) lub zwiększa uwalnianie DA (tj. Amfetaminy).
Badania obrazowania mózgu, w których porównano wzrost DA wywołany przez lek stymulujący metylofenidat (MP) lub amfetaminę (AMPH) wśród osób uzależnionych od kokainy w porównaniu z grupą kontrolną, wykazały wyraźne osłabienie wzrostu DA w prążkowiu indukowanego MP lub AMPH (50% niższy u detoksyfikowanych osób nadużywających i 80% w czynnych nadużywających) oraz niższe raporty o samozadowoleniu dotyczące efektów nagradzania leku w stosunku do kontroli nadużywających narkotyków (Martinez i in. 2007; Volkow i in. 1997) (Figa. 4). Było to zaskakujące, ponieważ MP i AMPH są farmakologicznie podobne do kokainy i metamfetaminy, a osoby nadużywające narkotyków nie mogą ich rozróżnić, gdy są podawane dożylnie. Ponieważ wyraźne zmniejszenie indukowanych lekiem wzrostów DA zaobserwowano niezależnie od tego, czy osoby nadużywające kokainy zostały odtruwane, czy nie, wskazuje to, że stan odstawienia nie jest czynnikiem zakłócającym (Volkow i in. 2011b). Te i podobne wyniki (Volkow i in. 2009) są zgodne z hipotezą, że odpowiedź hedoniczna staje się niedostateczna u osób uzależnionych od narkotyków i dodatkowo wzmacnia pogląd, że ostre farmakologiczne działanie zwiększające DA w leku nie może same wyjaśnić zwiększonej motywacji do ich spożywania.
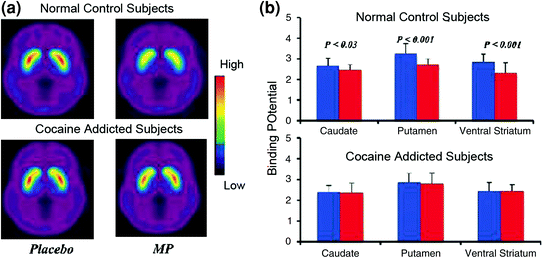
Rys. 4 Zmiany DA indukowane przez iv MP u osób kontrolnych i u aktywnych osób uzależnionych od kokainy. a Średnie obrazy niedopuszczalnego potencjału tnącego (BPND) [11C] raclopopride u osób uzależnionych od aktywnego kokainy (n = 19) oraz w grupie kontrolnej (n = 24) testowanej po placebo i po iv MP. b Dostępność D2R (BPND) w jądrze ogoniastym, skorupie i prążkowiu brzusznym po placebo (niebieski) i po MP (czerwony) w grupie kontrolnej iu osób uzależnionych od kokainy. MP zmniejszył D2R w grupie kontrolnej, ale nie u osób uzależnionych od kokainy. Należy zauważyć, że osoby nadużywające kokainy wykazują zarówno zmniejszenie podstawowej dostępności prążkowia D2R (miara placebo), jak i zmniejszenie uwalniania DA po podaniu iv MP (mierzone jako zmniejszenie dostępności D2R od wartości wyjściowej). Chociaż można kwestionować zakres, w jakim dostępność D2R w niskim prążkowiu u osób uzależnionych od kokainy ogranicza zdolność do wykrywania dalszych spadków od MP, fakt, że osoby uzależnione od kokainy wykazują zmniejszenie dostępności D2R po wystawieniu na działanie kokainy wskazuje, że osłabione efekty MP na [11C] wiązanie raclopridu odzwierciedla zmniejszone uwalnianie DA. Przedruk za zgodą (Volkow i in. 1997; Wang i in. 2010)
Odpowiedź neuronów VTA DA na nagradzające bodźce zmienia się wraz z powtarzaną ekspozycją.
Podczas gdy komórki DA wystrzeliwują po pierwszej ekspozycji na nową nagrodę, powtarzana ekspozycja na DA powoduje, że neurony przestają strzelać po zużyciu nagrody i ognia, gdy są narażone na bodźce, które przewidują nagrodę (Schultz i in. 1997). Prawdopodobnie będzie to podstawą roli DA w uczeniu się i warunkowaniu. Rzeczywiście indukowana lekiem sygnalizacja fazowa DA może ostatecznie wywołać neuroadaptacje w obwodach pomocniczych, które są związane z tworzeniem nawyków i warunkowaniem behawioralnym. Tzmiany te są głównie indukowane przez sygnalizację D1R i zmiany synaptyczne w modulowanych glutaminianem receptorach NMDA i AMPA (Luscher i Malenka 2011; Zweifel i in. 2009). Rekrutacja tych obwodów jest istotna w postępie choroby, ponieważ wynikające z tego uwarunkowane odpowiedzi pomagają wyjaśnić intensywne pragnienie leku (głód) i kompulsywne stosowanie, które występuje, gdy uzależnieni osobnicy są narażeni na sygnały związane z narkotykami. Ta hipoteza jest zgodna z niezależnymi obserwacjami (Volkow i in. 2006b; Wong i in. 2006), które pokazują moc ekspozycji cue związanej z kokainą w celu podniesienia poziomów DA w prążkowiu grzbietowym i wywołania jednoczesnego wzrostu subiektywnego odczucia głodu u detoksyfikowanych osób nadużywających kokainy (ryc. 5). Ponieważ prążkowie grzbietowe odgrywa rolę w uczeniu się nawyków (Belin i in. 2009; Yin i in. 2004) stowarzyszenie prawdopodobnie odzwierciedla wzmocnienie nawyków w miarę postępów uzależnienia. Sugeruje to, że podstawowe zakłócenie uzależnienia może odnosić się do uwarunkowanych DA wywołanych reakcji, które prowadzą do nawyków prowadzących do intensywnego głodu i kompulsywnego spożywania narkotyków. Co ciekawe, w aktywnym stosowaniu osób uzależnionych od kokainy, wzrost DA wywoływany przez uwarunkowane sygnały wydaje się być nawet większy niż te wytwarzane przez sam środek pobudzający, jak oceniono w dwóch oddzielnych grupach pacjentów (Volkow i in. 2011b, 2006b), sugerując, że uwarunkowane reakcje mogą napędzać sygnalizację DA, która utrzymuje motywację do przyjmowania leku, nawet jeśli wydaje się, że jego efekty farmakologiczne są zmniejszone. Tak więc, chociaż leki mogą początkowo wywoływać uczucie natychmiastowej nagrody poprzez uwalnianie DA w prążkowiu brzusznym, przy wielokrotnym stosowaniu, a wraz z rozwojem nawyku, wydaje się, że następuje przejście od leku do warunkowego bodźca. Według badań na zwierzętach laboratoryjnych, projekcje glutaminergiczne z kory przedczołowej i z ciała migdałowatego do VTA / SN i NAc pośredniczą w tych uwarunkowanych odpowiedziach (Kalivas 2009). W ten sposób zwykłe przewidywanie nagrody może ostatecznie stać się nagrodą, która motywuje zachowanie niezbędne do konsumpcji narkotyków (lub żywności).
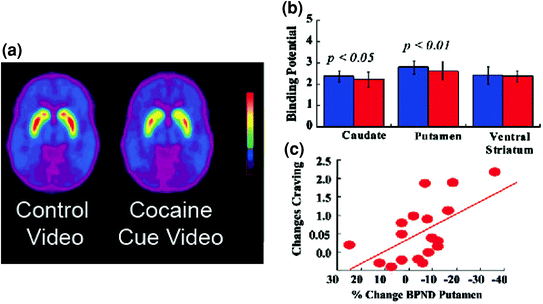
Rys. 5 Zmiany DA indukowane przez uwarunkowane sygnały u osób uzależnionych od aktywnego kokainy. a Średnie niedopuszczalne obrazy potencjału wiązania (BPND) racloprydu [11C] u osób uzależnionych od kokainy (n = 17) testowane podczas oglądania neutralnego wideo (sceny natury) i oglądania wideo z kokainą (osoby podające kokainę). b Dostępność D2R (BPND) w jądrze ogoniastym, skorupie i prążkowiu brzusznym dla neutralnego wideo (niebieski) i wideo z kokainą (czerwony). Wskaźniki kokainy zmniejszyły D2R w jądrze ogoniastym i skorupie. c Korelacje między zmianami D2R (odzwierciedlającymi wzrost DA) a samo-zgłaszaniem głodu kokainowego wywołanego przez wideo związane z kokainą. Zmodyfikowano z ref. (Volkow i in. 2006b)
Ico ciekawe, ten rodzaj funkcjonalnego „przełącznika” odnotowano również w przypadku naturalnych wzmacniaczy, które prawdopodobnie wywołują równoważne i stopniowe przesunięcie wzrostu DA, z brzusznych do bardziej grzbietowych obszarów prążkowia podczas przejścia z nowego bodźca, który jest z natury nagradzanie za powiązane sygnały, które go przewidują. To przejście jest przekazywane przez sygnalizację DA, która wydaje się kodować „błąd przewidywania nagrody” (Schultz 2010). Rozległe glutamatergiczne związki doprowadzające do neuronów DA z regionów biorących udział w przetwarzaniu czuciowych (wyspa lub pierwotna kora smakowa), homeostatycznych (podwzgórze), nagrody (NAc), emocjonalnych (ciało migdałowate i hipokamp) oraz informacji multimodalnych (kora oczodołowo-czołowa dla atrybucji salience) , moduluj ich aktywność w odpowiedzi na nagrody i uwarunkowane sygnały (Geisler i Wise 2008). Dokładniej, projekcje z ciała migdałowatego i kory oczodołowo-czołowej (OFC) do neuronów DA i NAc biorą udział w uwarunkowanych odpowiedziach na pokarm (Petrovich 2010). Rzeczywiście, badania obrazowe wykazały, że gdy nieotyłych osobników płci męskiej poproszono o zahamowanie głodu pokarmowego - podczas ekspozycji na sygnały pokarmowe - wykazywały one zmniejszoną aktywność metaboliczną w ciele migdałowatym i OFC (jak również w hipokampie), wyspie i prążkowiu, oraz że spadek OFC był związany ze zmniejszeniem głodu pokarmowego (Wang i in. 2009). Podobne hamowanie aktywności metabolicznej w OFC (a także w NAc) zaobserwowano u osób nadużywających kokainy, gdy poproszono ich o zahamowanie głodu narkotykowego po ekspozycji na sygnały kokainowe (Volkow i in. 2009b).
Niemniej jednak pojawienie się tak silnie uwarunkowanych pragnień, które występują również u zdrowych osób, które nie przejadały się, nie byłoby tak niszczycielskie, gdyby nie towarzyszyły im rosnące deficyty w zdolności mózgu do hamowania zachowań nieprzystosowawczych.
4 Wpływ zaburzeń w kontroli hamowania
Zdolność do powstrzymywania reakcji prepotentnych z pewnością przyczyni się do zdolności jednostki do unikania niewłaściwych zachowań, takich jak zażywanie narkotyków lub jedzenie poza punktem sytości, a tym samym zwiększenie jego / jej podatności na uzależnienie (lub otyłość) (Volkow i Fowler 2000; Volkow i in. 2008).
Badania PET ujawniły znaczące zmniejszenie dostępności D2R w prążkowiu osób uzależnionych, które utrzymują się przez wiele miesięcy po długotrwałej detoksykacji [przegląd w (Volkow i in. 2009)]. Podobnie, badania przedkliniczne na gryzoniach i naczelnych wykazały, że powtarzane ekspozycje na leki są związane ze zmniejszeniem poziomów prążkowia D2R (Nader i in. 2006; Thanos i in. 2007; Volkow i in. 2001). W prążkowiu D2R pośredniczą w sygnalizacji w pośrednim szlaku prążkowia, który moduluje regiony przedczołowe; wykazano, że jego obniżenie poziomu zwiększa uczulenie na działanie leków w modelach zwierzęcych (Ferguson i in. 2011). U ludzi uzależnionych od leków zmniejszenie prążkowia D2R jest związane ze zmniejszoną aktywnością regionów przedczołowych, o czym świadczy spadek wyjściowego metabolizmu glukozy (marker funkcji mózgu) w OFC, zakręcie obręczy przedniej (ACC) i grzbietowo-bocznej korze przedczołowej (DLPFC) ) (Volkow i in. 2001, 1993, 2007) (Figa. 6). Ponieważ OFC, ACC i DLPFC są zaangażowane odpowiednio w przypisywanie salience, kontrolę hamowania / regulację emocji i podejmowanie decyzji, postulowano, że ich niewłaściwa regulacja przez zależną od D2R sygnalizację DA u osób uzależnionych może leżeć u podstaw zwiększonej wartości motywacyjnej leków w ich zachowaniu i utracie kontroli nad przyjmowaniem leków (Volkow i Fowler 2000). Ponadto, ponieważ upośledzenia w OFC i ACC są związane z zachowaniami kompulsywnymi i impulsywnością (Fineberg i in. 2009), Osłabiona modulacja DA w tych regionach prawdopodobnie przyczyni się do kompulsywnego i impulsywnego przyjmowania narkotyków obserwowanego w uzależnieniu (Goldstein i Volkow 2002). Rzeczywiście, u osób nadużywających metamfetaminy niski prążkowia D2R był związany z impulsywnością (Lee i in. 2009), a także przewidywał kompulsywne podawanie kokainy u gryzoni (Everitt i in. 2008). Możliwy jest również odwrotny scenariusz, w którym początkowa podatność na preretystykę używania narkotyków w regionach przedczołowych i przy której powtarzane zażywanie narkotyków powoduje dalsze zmniejszenie prążkowia D2R. Rzeczywiście, badanie przeprowadzone na osobach, które pomimo wysokiego ryzyka alkoholizmu (dodatni wywiad rodzinny dotyczący alkoholizmu) nie były alkoholikami, ujawniło wyższą niż normalna dostępność prążkowia D2R, która była związana z prawidłowym metabolizmem w OFC, ACC i DLPFC (Volkow et al. 2006). Sugeruje to, że u tych osób zagrożonych alkoholizmem normalna funkcja przedczołowa była związana ze wzmocnioną sygnalizacją prążkowia D2R, co z kolei mogło ochronić je przed nadużywaniem alkoholu.
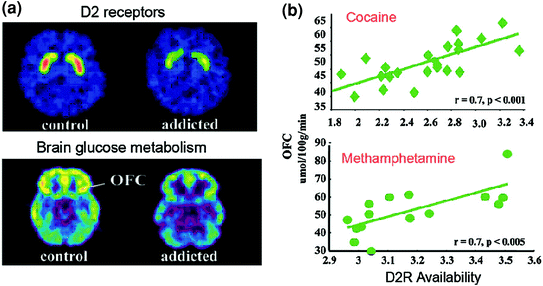
Rys. 6 Korelacje między dostępnością D2R w prążkowiu a metabolizmem w przedczołowych obszarach mózgu. a Obrazy mózgu osiowego dla kontroli i dla uzależnionego od kokainy obiektu dla obrazów podstawowych dostępności D2R w prążkowiu (uzyskane za pomocą [11C] raclopopride) i metabolizmu glukozy w mózgu w OFC (uzyskane za pomocą [18FDG). b Korelacje między prążkowiem D2R a metabolizmem w OFC u osób uzależnionych od kokainy i uzależnionych od metamfetaminy. Przedruk z Volkow i in. (2009) Prawa autorskie (2009), za zgodą Elsevier
Przewidywalnie, dowody na rozregulowanie obwodów kontrolnych stwierdzono również u osób otyłych. Zarówno badania przedkliniczne, jak i kliniczne dostarczyły dowodów na zmniejszoną sygnalizację D2R prążkowia, która, jak wspomniano powyżej, jest powiązana z nagrodą (NAc), ale także z ustaleniem nawyków i procedur (prążkowia grzbietowego) w otyłościy (Geiger i in. 2009; Wang i in. 2001). Co ważne, zmniejszona dostępność D2R w prążkowiu została powiązana z kompulsywnym przyjmowaniem pokarmu u otyłych gryzoni (Johnson i Kenny 2010) i ze zmniejszoną aktywnością metaboliczną w OFC i ACC u otyłych ludzi (Volkow i in. 2008b) (Figa. 7a – c). Biorąc pod uwagę, że dysfunkcja w OFC i ACC powoduje kompulsywność [patrz przegląd (Fineberg i in. 2009)], może to być częścią mechanizmu, dzięki któremu sygnalizacja D2R o niskiej prążkowiu ułatwia hiperfagię (Davis i in. 2009). Ponadto, ponieważ zmniejszenie sygnalizacji związanej z D2R może również zmniejszyć wrażliwość na inne nagrody naturalne, deficyt ten u osób otyłych może również przyczynić się do przejadania się kompensacyjnego (Geiger i in. 2008).
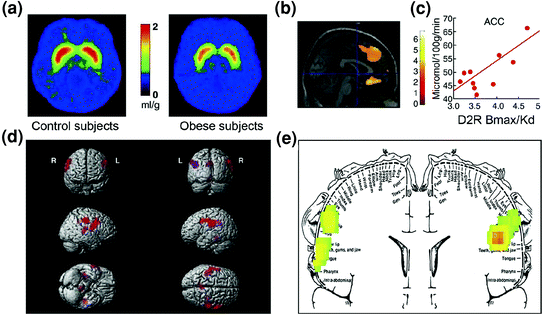
Rys. 7 Hiperfagia może wynikać z dążenia do skompensowania osłabionego obwodu nagrody (przetworzonego przez regulowane dopaminą obwody kortykostriatalne) w połączeniu ze zwiększoną wrażliwością na smakowitość (hedoniczne właściwości żywności przetwarzanej częściowo przez korę somatosensoryczną). a Uśrednione obrazy dostępności receptora DA D2 (D2R) u osób kontrolnych (n = 10) i osób z chorobliwą otyłością (n = 10). b Wyniki z (statystycznego mapowania parametrycznego) SPM identyfikujące obszary w mózgu, w których D2R było związane z metabolizmem glukozy, obejmowały one przyśrodkową OFC, ACC i grzbietowo-boczną PFC (obszar niepokazany). c Nachylenie regresji między D2R w prążkowiu a aktywnością metaboliczną w ACC u osób otyłych. d Trójwymiarowe obrazy SPM przedstawiające obszary o wyższym metabolizmie u osób otyłych niż szczupłych (P <0.003, nieskorygowane). e Wyniki SPM oznaczone kolorami wyświetlane w płaszczyźnie czołowej z nałożonym diagramem homunkulusa somatosensorycznego. Wyniki (wartość z) przedstawiono za pomocą skali tęczowej, gdzie czerwony> żółty> zielony. W porównaniu z osobami szczupłymi, osoby otyłe miały wyższy wyjściowy metabolizm w obszarach somatosensorycznych, w których reprezentowane są usta, usta i język, które są zaangażowane w przetwarzanie smakowitości żywności. Zmodyfikowane, za zgodą, z Volkow et al. (2008) (a – c) i Wang et al. (2002) (d, e)
Ta hipoteza jest zgodna z przedklinicznymi dowodami wskazującymi, że zmniejszona aktywność DA w VTA powoduje dramatyczny wzrost spożycia wysokotłuszczowej żywności (Stoeckel i in. 2008). Podobnie, w porównaniu z osobami o prawidłowej masie ciała, osoby otyłe, którym przedstawiono zdjęcia wysokokalorycznej żywności (bodźce, do których są kondycjonowane), wykazały zwiększoną aktywację nerwową w regionach, które są częścią obwodów nagrody i motywacji (NAc, prążkowie grzbietowe, OFC , ACC, ciało migdałowate, hipokamp i wyspa) (Killgore i Yurgelun-Todd 2005). W przeciwieństwie do tego, w kontrolach z prawidłową masą ciała, aktywacja ACC i OFC (regiony zaangażowane w przypisanie salience projektu do NAc) podczas prezentacji wysokokalorycznej żywności okazała się być ujemnie skorelowana z ich indeksem masy ciała (BMI) ( Stice i in. 2008b). Sugeruje to dynamiczną interakcję między ilością spożywanego pokarmu (odzwierciedloną częściowo w BMI) a reaktywnością regionów nagrody na wysokokaloryczne jedzenie (odzwierciedlone w aktywacji OFC i ACC) u osób o normalnej masie ciała, które giną w otyłość.
Co zaskakujące, osoby otyłe wykazywały mniejszą aktywację obwodów nagrody od rzeczywistej konsumpcji żywności (określanej jako konsumpcyjna nagroda za żywność) niż szczupłe osobniki, podczas gdy wykazywały one większą aktywację somatosensorycznych regionów korowych, które przetwarzają smakowitość, gdy przewidywały konsumpcję (Stice i in. 2008b). Ta ostatnia obserwacja odpowiadała regionom, w których poprzednie badanie ujawniło zwiększoną aktywność u otyłych osób badanych na początku badania (bez stymulacji) (Wang i in. 2002) (Figa. 7d, e). Zwiększona aktywność regionów, które przetwarzają smakowitość, może sprawić, że osoby otyłe faworyzują żywność w stosunku do innych naturalnych wzmacniaczy, podczas gdy zmniejszona aktywacja celów dopaminergicznych przez rzeczywiste spożycie pokarmu może prowadzić do nadmiernej konsumpcji jako środka kompensującego słabe przekazywanie sygnałów za pośrednictwem D2R (Stice i in. 2008). Ta zmniejszona odpowiedź układu nagrody na spożycie pokarmu u osób otyłych przypomina zmniejszone zwiększenie DA wywołane przez konsumpcję leku u uzależnionych osób w porównaniu z osobami nieuzależnionymi.
Kora przedczołowa (PFC) odgrywa kluczową rolę w funkcji wykonawczej, w tym kontroli hamowania (Miller i Cohen 2001). Procesy te są modulowane przez D1R i D2R (przypuszczalnie również D4R), a zatem zmniejszona aktywność w PFC, zarówno w uzależnieniu, jak iw otyłości, prawdopodobnie przyczyni się do słabej kontroli i dużej kompulsywności. Niższa niż normalnie dostępność D2R w prążkowiu osób otyłych, związana ze zmniejszoną aktywnością w PFC i ACC (Volkow i in. 2008b) może zatem przyczynić się do ich niedostatecznej kontroli nad spożyciem żywności. Rzeczywiście, ujemna korelacja między BMI a prążkowiem D2R podawana była u otyłych (Wang i in. 2001) i nadwagą (Haltia i in. 2007) osoby to popierają. Lepsze zrozumienie mechanizmów prowadzących do upośledzenia funkcji PFC w otyłości (lub nałogu) mogłoby ułatwić opracowanie strategii łagodzenia, a może nawet odwracania, specyficznych zaburzeń w kluczowych domenach poznawczych. Na przykład, dyskontowanie opóźnienia, które jest tendencją do dewaluacji nagrody jako funkcji czasowego opóźnienia jej dostarczenia, jest jedną z najbardziej szczegółowo badanych operacji poznawczych w odniesieniu do zaburzeń związanych z impulsywnością i kompulsywnością. Dyskontowanie opóźnień zostało najdokładniej zbadane u osób nadużywających narkotyków, które wykazują przesadną preferencję do małych, ale natychmiastowych nagród, ale opóźnionych (Bickel i in. 2007). Jednak nieliczne badania przeprowadzone na osobach otyłych ujawniły również dowody na preferencje dotyczące wysokich, natychmiastowych nagród, pomimo zwiększonej szansy na większe straty w przyszłości (Brogan i in. 2010; Weller i in. 2008). Niedawno inne badanie wykazało dodatnią korelację między BMI a dyskontowaniem hiperbolicznym, przy czym przyszłe ujemne wypłaty są dyskontowane mniej niż przyszłe wypłaty dodatnie (Ikeda i in. 2010). Co ciekawe, zdyskontowanie opóźnienia wydaje się zależeć od funkcji prążkowia brzusznego (Gregorios-Pippas i in. 2009) i PFC, w tym boczny OFC (Bjork i in. 2009) i jest wrażliwy na manipulacje DA (Pine i in. 2010). W szczególności, wzmocnienie sygnalizacji DA (z leczeniem L DOPA) zwiększyło impulsywność i dyskontowanie czasowe.
5 Zaangażowanie obwodów motywacyjnych
Sygnalizacja dopaminergiczna moduluje również motywację. Cechy behawioralne, takie jak wigor, wytrwałość i inwestowanie ciągłego wysiłku w osiągnięcie celu, podlegają modulacji przez DA działającej poprzez kilka docelowych regionów, w tym NAc, ACC, OFC, DLPFC, ciało migdałowate, prążkowie prążkowane i bladość brzuszna (Salamone i in. 2007). Rozregulowana sygnalizacja DA jest związana ze zwiększoną motywacją do nabywania leków, cechą uzależnienia, dlatego osoby uzależnione od narkotyków często angażują się w skrajne zachowania, aby uzyskać leki, nawet jeśli pociągają za sobą znane poważne i niekorzystne konsekwencje (Volkow i Li 2005). Ponieważ zażywanie narkotyków staje się głównym motorem motywacji do uzależnienia od narkotyków (Volkow i in. 2003) uzależnieni są pobudzani i motywowani przez proces uzyskiwania leku, ale stają się wycofani i apatyczni, gdy są narażeni na działania niezwiązane z narkotykami. Ta zmiana została zbadana przez porównanie wzorców aktywacji mózgu występujących przy ekspozycji na uwarunkowane sygnały z tymi występującymi przy braku takich sygnałów. W przeciwieństwie do spadku aktywności przedczołowej odnotowanego u detoksyfikowanych osób nadużywających kokainy, gdy nie stymulowano ich za pomocą leków lub leków [patrz przegląd (Volkow i in. 2009)], te obszary przedczołowe stają się aktywne, gdy osoby nadużywające kokainy są narażone na bodźce wywołujące głód (narkotyki lub sygnały) (Grant i in. 1996; Volkow i in. 1999; Wang i in. 1999). Wynik ten przypomina obserwację, że osoby nadużywające kokainy, badane wkrótce po epizodzie łaknienia kokainy, wykazały wzrost aktywności metabolicznej w OFC i ACC (również prążkowiu grzbietowym), które było związane z głodem (Volkow i in. 1991).
Co więcej, gdy odpowiedzi na iv MP są porównywane między osobami uzależnionymi od kokainy i nie uzależnionymi, te pierwsze odpowiedziały zwiększonym metabolizmem w brzusznym ACC i środkowym OFC (efekt związany z głodem), podczas gdy te drugie wykazały odwrotną odpowiedź, mianowicie zmniejszoną metabolizm w tych regionach (Volkow i in. 2005). Sugeruje to, że aktywacja tych obszarów przedczołowych z ekspozycją na lek może być specyficzna dla uzależnienia i związana ze zwiększonym pożądaniem leku. Ponadto badanie, które skłoniło osoby uzależnione od kokainy do celowego zahamowania głodu alkoholu, gdy były narażone na sygnały leków, pokazało, że osoby, którym udało się powstrzymać głód, wykazywały zmniejszony metabolizm w środkowym OFC (który przetwarza wartość motywacyjną wzmacniacza) i NAc (co przewiduje nagroda) (Volkow i in. 2009b). Odkrycia te potwierdzają zaangażowanie OFC, ACC i prążkowia w zwiększoną motywację do nabywania narkotyków obserwowanych w uzależnieniu.
Przewidywalnie, OFC ma również związek z przypisywaniem wartości istotności pożywieniu (Grabenhorst i in. 2008; Rolls i McCabe 2007), pomagając ocenić jego oczekiwaną przyjemność i smakowitość jako funkcję kontekstu. Badania PET z użyciem FDG w celu pomiaru metabolizmu glukozy w mózgu u osób o prawidłowej masie ciała wykazały, że ekspozycja na sygnały pokarmowe zwiększa aktywność metaboliczną w OFC, co jest efektem związanym z postrzeganiem głodu i pragnieniem pożywienia (Wang i in. 2004). Zwiększona aktywacja OFC przez stymulację pokarmu prawdopodobnie odzwierciedla dalsze działania dopaminergiczne i bierze udział w zaangażowaniu DA w dążenie do konsumpcji żywności. OFC odgrywa rolę w uczeniu się powiązań i uwarunkowań wzmocnienia bodźców (Cox i in. 2005; Gallagher i in. 1999), wspiera warunkowane karmienie wywołane (Weingarten 1983) i prawdopodobnie przyczynia się do przejadania się niezależnie od sygnałów głodu (Ogden i Wardle 1990). Rzeczywiście, dysfunkcja OFC została powiązana z przejadaniem się (Machado i Bachevalier 2007).
Pomimo pewnych niespójności między badaniami, dane obrazowania mózgu potwierdzają tezę, że strukturalne i funkcjonalne zmiany w obszarach mózgu zaangażowanych w funkcje wykonawcze (w tym kontrolę hamowania) mogą być związane z wysokim BMI u osób zdrowych w inny sposób. Na przykład badanie MRI wykonane u starszych kobiet, z wykorzystaniem morfometrii opartej na wokselu, wykazało ujemną korelację między BMI a objętościami istoty szarej (w tym regionami czołowymi), która w OFC była związana z upośledzoną funkcją wykonawczą (Walther i in. 2010). Stosując PET do pomiaru metabolizmu glukozy w mózgu u zdrowych osób kontrolnych, odnotowaliśmy ujemną korelację między BMI a aktywnością metaboliczną w DLPFC, OFC i ACC. W tym badaniu aktywność metaboliczna w regionach przedczołowych przewidywała wydajność osobników w testach funkcji wykonawczych (Volkow i in. 2009c). Podobnie, badanie spektroskopowe magnetycznego rezonansu jądrowego (NMR) w zdrowych grupach kontrolnych w wieku średnim i starszych wykazało, że BMI był ujemnie związany z poziomami N-acetylo-asparaginianu (markera integralności neuronów) w korze czołowej i ACC (Gazdzinski i in. 2008; Volkow i in. 2009c).
Badania obrazowania mózgu porównujące osoby otyłe i szczupłe wykazały również niższą gęstość istoty szarej w obszarach czołowych (czołowa operculum i środkowy czołowy zakręt) oraz w post-central zakręcie i skorupie (Pannacciulli i in. 2006). Inne badanie nie wykazało jednak różnic w objętości istoty szarej między osobami otyłymi i szczupłymi, odnotowano dodatnią korelację między objętością istoty białej w podstawowych strukturach mózgu a stosunkiem talii do bioder, trendu, który został częściowo odwrócony przez dietę (Haltia i in. 2007b). Co ciekawe, odkryto, że obszary korowe, takie jak DPFC i OFC, które są zaangażowane w kontrolę hamowania, ulegają aktywacji w skutecznych dieterach w odpowiedzi na spożycie posiłku (DelParigi i in. 2007), sugerując potencjalny cel przekwalifikowania behawioralnego w leczeniu otyłości (a także uzależnienia).
6 Zaangażowanie Interoceptive Circuitry
Badania neuroobrazowe wykazały, że wyspa środkowa odgrywa kluczową rolę w zachciankach na żywność, kokainę i papierosy (Bonson i in. 2002; Pelchat i in. 2004; Wang i in. 2007). Znaczenie wyspy zostało podkreślone w badaniu, które wykazało, że palacze z uszkodzeniem tego regionu (ale nie kontrolujący palaczy, którzy doznali zmian pozamałżeńskich) byli w stanie łatwo rzucić palenie i nie doświadczyli ani głodu, ani nawrotu (Naqvi i in. . 2007). Wyspa, zwłaszcza jej bardziej przednie obszary, jest wzajemnie połączona z kilkoma obszarami limbicznymi (np. Brzuszno-przyśrodkowa kora przedczołowa, ciało migdałowate i prążkowia brzuszne) i wydaje się, że ma funkcję interoceptywną, integrując informacje autonomiczne i trzewne z emocją i motywacją, zapewniając tym samym świadoma świadomość tych pragnień (Naqvi i Bechara 2009). Rzeczywiście, badania uszkodzeń mózgu sugerują, że brzuszno-przyśrodkowa PFC i wyspa są niezbędnymi składnikami obwodów rozproszonych, które wspierają podejmowanie decyzji emocjonalnych (Clark i in. 2008). Zgodnie z tą hipotezą badania obrazowe konsekwentnie wykazują zróżnicowaną aktywację wyspy podczas głodu (Brody i in. 2009; Goudriaan i in. 2010; Naqvi i Bechara 2009; Wang i in. 1999). W związku z tym zasugerowano, że reaktywność tego regionu mózgu służy jako biomarker pomagający przewidzieć nawrót choroby (Janes i in. 2010).
Wyspa jest również głównym obszarem smakowym, który bierze udział w wielu aspektach zachowań żywieniowych, takich jak smak. Ponadto, dziobowa wyspa (połączona z pierwotną korą smakową) dostarcza informacji do OFC, która wpływa na jej multimodalną reprezentację przyjemności lub wartości nagrody przychodzącej żywności (Rolls 2008). Ze względu na udział wyspy w interoceptywnym sensie ciała, w świadomości emocjonalnej (Craig 2003) oraz w motywacji i emocjach (Rolls 2008), można oczekiwać wkładu upośledzenia wyspowego w otyłość. Rzeczywiście, rozdęcie żołądka powoduje aktywację tylnej wyspy, co prawdopodobnie odzwierciedla jej rolę w świadomości stanów ciała (w tym przypadku pełni) (Wang i in. 2008). Ponadto u osób szczupłych, ale nie otyłych, rozdęcie żołądka powodowało aktywację ciała migdałowatego i dezaktywację przedniej wyspy (Tomasi i in. 2009). Brak odpowiedzi ciała migdałowatego u osób otyłych może odzwierciedlać tępą interoceptywną świadomość stanów cielesnych związanych z sytością (pełny żołądek). Chociaż modulacja aktywności wyspowej przez DA została słabo zbadana, uznaje się, że DA bierze udział w odpowiedziach na smak smacznych pokarmów, w których pośredniczy insula (Hajnal i Norgren 2005). Badania obrazowania na ludziach wykazały, że smakowanie smacznych potraw aktywowało obszary wyspy i śródmózgowia (DelParigi i in. 2005; Frank i in. 2008). Jednak sygnalizacja DA może być również konieczna do wykrywania zawartości kalorii w żywności. Na przykład, gdy kobiety o normalnej wadze smakowały słodzik z kaloriami (sacharoza), zarówno obszar wyspy, jak i dopaminergiczny śródmózgowia uaktywniły się, podczas gdy degustacja bezkalorycznego słodzika (sukralozy) aktywowała tylko wyspę (Frank i in. 2008). Osoby otyłe wykazują większą aktywację wyspową niż normalne kontrole podczas degustacji płynnego posiłku, który składa się z cukru i tłuszczu (DelParigi i in. 2005). W przeciwieństwie do tego, osoby, które wyzdrowiały z jadłowstrętu psychicznego wykazują mniejszą aktywację w wyspie, gdy smakują sacharozę i brak związku przyjemności z aktywacją wyspową, jak zaobserwowano w normalnych kontrolach (Wagner i in. 2008). Po połączeniu wyniki te prawdopodobnie powodują, że rozregulowanie wyspy w odpowiedzi na bodźce smakowe może być związane z upośledzoną kontrolą różnych zachowań apetycznych.
7 Obwód awersji
Jak wspomniano wcześniej, trening (warunkowanie) na wskazówce przewidującej nagrodę prowadzi do odpalenia komórek dopaminergicznych w odpowiedzi na przewidywanie nagrody, a nie do samej nagrody. Z drugiej strony i zgodnie z tą logiką zaobserwowano, że komórki dopaminergiczne będą strzelać mniej niż normalnie, jeśli oczekiwana nagroda nie materializuje się (Schultz et al. 1997). Zbiorcze dowody (Christoph i in. 1986; Lisoprawski i in. 1980; Matsumoto i Hikosaka 2007; Nishikawa i in. 1986) wskazuje na habenula jako jeden z regionów, który kontroluje spadki odpalania komórek dopaminergicznych w VTA, które mogą wynikać z braku otrzymania oczekiwanej nagrody (Kimura i in. 2007). Tak więc zwiększona wrażliwość habenula, w wyniku przewlekłego narażenia na leki, może stanowić podstawę większej reaktywności na sygnały leków. Rzeczywiście, aktywacja habenula u osób uzależnionych od kokainy była związana z nawrotem behawioralnym do przyjmowania leków po ekspozycji na sygnał (Brown i in. 2011; Zhang i in. 2005). W przypadku nikotyny receptory nikotynowe α5 w habenula wydają się modulować odpowiedzi awersyjne na duże dawki nikotyny (Fowler i in. 2011); a receptory α5 i α2 w habenuli biorą udział w odstawieniu nikotyny (Salas i in. 2009). Z powodu przeciwnej odpowiedzi habenuli na reakcję neuronów DA na nagradzanie (dezaktywację) i jej aktywację po ekspozycji na bodźce awersyjne, odwołujemy się tutaj do sygnalizacji habenula jako przekazującej dane wejściowe „antireward”.
Habenula wydaje się odgrywać podobną rolę w odniesieniu do nagrody żywnościowej. Wysoce smaczna dieta pokarmowa może wywoływać otyłość u szczurów, przy czym wzrost masy ciała koreluje ze wzrostem wiązania peptydu opioidowego μ w ciele migdałowatym podstawno-bocznym i podstawnokomórkowym. Co ciekawe, przyśrodkowa habenula wykazywała istotnie wyższe wiązanie peptydu opioidowego μ (o około 40%) po ekspozycji na smaczny pokarm u szczurów, które przybrały na wadze (tych, które spożywały więcej pożywienia), ale nie w tych, które nie przybrały na wadze (Smith i in. 2002). Sugeruje to, że habenula może być zaangażowana w przejadanie się w warunkach dostępności smacznego jedzenia. Co więcej, neurony w jądrze rostromedialu nakrywkowego, które otrzymują główny wkład z bocznego habenula, rzutują na neurony VTA DA i są aktywowane po pozbawieniu pokarmu (Jhou i in. 2009). Odkrycia te są zgodne z rolą habenula w pośredniczeniu w reakcjach na bodźce lub stany awersyjne, takie jak te, które występują podczas diety lub odstawienia narkotyków.
Zaangażowanie habenula jako centrum antyrewardyjnego w sieciach emocjonalnych jest zgodne z wcześniejszymi teoretycznymi modelami uzależnienia, które postulowały uczulone reakcje przeciwdziałające nagradzaniu (pośredniczone przez zwiększoną wrażliwość ciała migdałowatego i zwiększoną sygnalizację przez czynnik uwalniający kortykotropinę) jako narkotyku napędzającego uzależnienie (Koob i Le Moal 2008). Podobne reakcje antyrendalne mogą również przyczyniać się do nadmiernego spożycia żywności w otyłości.
8 Nagroda za patologiczny narkotyk i żywność: zaktualizowany model roboczy
Tumiejętność przeciwstawiania się chęci używania narkotyków lub jedzenia poza punktem sytości wymaga prawidłowego funkcjonowania obwodów neuronalnych zaangażowanych w kontrolę odgórną, aby przeciwstawić się warunkowym reakcjom, które przewidują nagrodę z pożywienia / leku i pragnienie spożycia jedzenie / lek. W tym miejscu wyróżniliśmy sześć z tych obwodów: nagroda / istotność, uwarunkowania / nawyki, hamująca kontrola / funkcja wykonawcza, motywacja / popęd, interocepcja i unikanie awersji / reaktywność stresowa (ryc. 8). Opierając się na przedstawionych tutaj danych obrazowania, postulujemy, że to rozbieżność między oczekiwaniem na efekty leku / żywności (reakcje warunkowe) a tępymi efektami neurofizjologicznymi, które utrzymują przyjmowanie narkotyków lub nadmierną konsumpcję żywności w celu osiągnięcia oczekiwana nagroda. Ponadto, niezależnie od tego, czy testowano go we wczesnych czy przedłużających się okresach abstynencji / diety, osoby uzależnione / otyłe wykazują niższy poziom D2R w prążkowiu (w tym NAc), co wiąże się ze spadkiem aktywności podstawowej w czołowych obszarach mózgu zaangażowanych w przypisywanie salience (kora oczodołowo-czołowa) i hamowanie kontrola (ACC i DLPFC), których zakłócenie powoduje kompulsywność i impulsywność. faw gruncie rzeczy pojawiają się również dowody na rolę interoceptywnych i awersyjnych obwodów w układowych zaburzeniach równowagi, które powodują kompulsywne spożywanie narkotyków lub żywności.
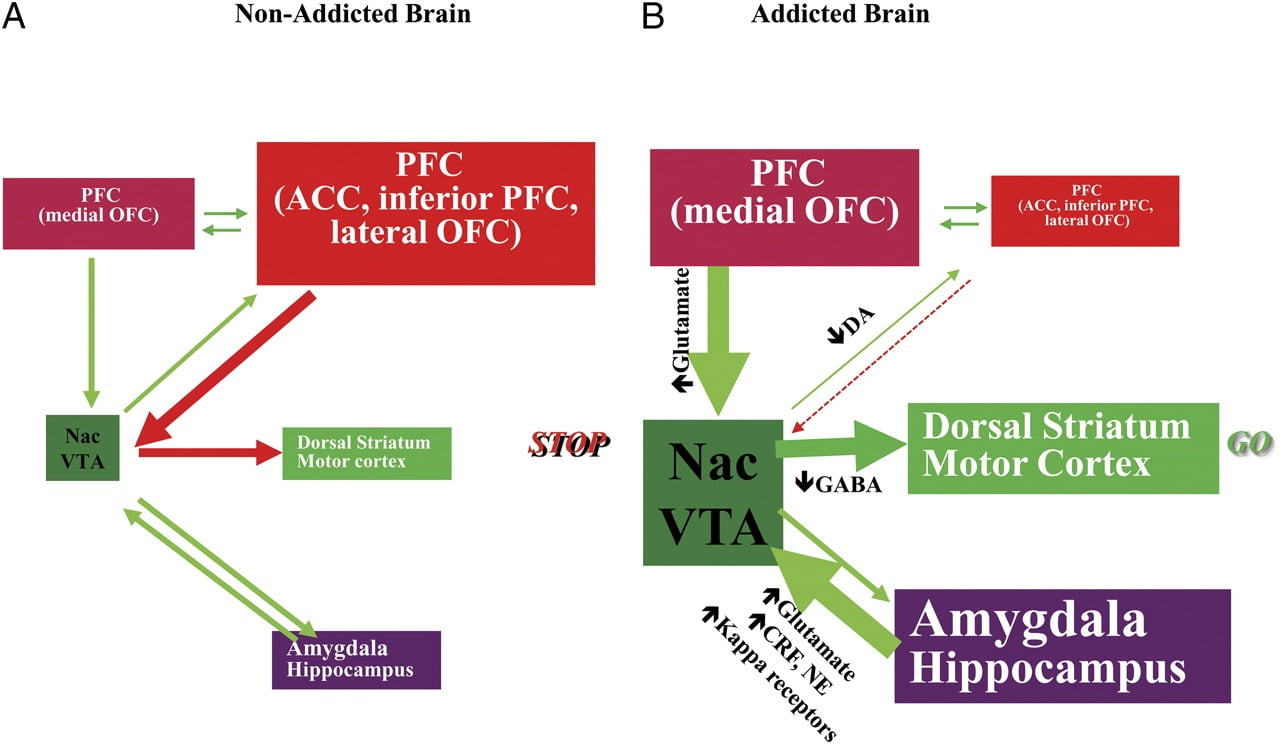
Rys. 8 Model proponujący sieć wzajemnie oddziałujących obwodów, zakłócenia, które przyczyniają się do złożonego zestawu stereotypowych zachowań leżących u podstaw uzależnienia od narkotyków i przewlekłego przejadania się: nagroda (jądro półleżące, VTA i bladość brzuszna), uwarunkowanie / pamięć (ciało migdałowate, przyśrodkowe OFC do przypisania upośledzenia, hipokamp i prążkowate grzbietowe dla przyzwyczajeń), kontrola wykonawcza (DLPFC, ACC, kora czołowa dolna i boczna OFC), motywacja / popęd (przyśrodkowy OFC do przypisania istotności, brzuszny ACC, VTA, SN, prążkowie prążkowane i kora ruchowa). Nac, jądro półleżące, interocepcja (Insula i ACC) oraz awersja / unikanie (Habenula). a Gdy obwody te są zrównoważone, powoduje to odpowiednią kontrolę hamowania i podejmowanie decyzji. b Podczas uzależnienia, gdy zwiększona wartość oczekiwana leku w nagrodzie, motywacji i obwodach pamięci pokonuje obwód kontrolny, faworyzując pętlę sprzężenia zwrotnego zainicjowaną przez konsumpcję leku i utrwaloną przez zwiększoną aktywację motywacji / popędu i obwody pamięci. Obwody te współdziałają również z obwodami zaangażowanymi w regulację nastroju, w tym z reaktywnością stresową (która obejmuje ciało migdałowate, podwzgórze, habenula) i interocepcją (która obejmuje wyspę i ACC oraz przyczynia się do świadomości głodu). W neuroadaptacje zaangażowanych jest kilka neuroprzekaźników, w tym glutaminian, GABA, norepinefryna, czynnik uwalniający kortykotropinę i receptory opioidowe. CRF, czynnik uwalniający kortykotropinę; NE, noradrenalina. Zmodyfikowany za zgodą Volkow et al. (2011b)
W konsekwencji sekwencyjnego zakłócenia w tych obwodach, osoby mogą doświadczyć 1) zwiększonej wartości motywacyjnej leku / pożywienia (wtórnej do wyuczonych skojarzeń poprzez uwarunkowania i nawyki) kosztem innych wzmacniaczy (wtórne do zmniejszonej wrażliwości obwodu nagrody) ), 2) upośledzona zdolność do hamowania celowych (ukierunkowanych na cel) działań wywołanych silnym pragnieniem zażywania leku / pokarmu (wtórnego do upośledzonej funkcji wykonawczej), które powodują kompulsywne przyjmowanie leków / żywności, oraz 3) zwiększoną reaktywność na stres i awersyjne unikanie, które skutkuje impulsywnym przyjmowaniem narkotyków, aby uniknąć stanu awersji.
Model ten sugeruje wieloczęściowe podejście terapeutyczne do uzależnienia mające na celu zmniejszenie wzmacniających właściwości leku / żywności, przywrócenie / wzmocnienie nagradzających właściwości naturalnych wzmacniaczy, zahamowanie uwarunkowanych skojarzeń, zwiększenie motywacji do działań niezwiązanych z lekami / żywnością, zmniejszenie reaktywności stresowej poprawić samopoczucie i wzmocnić ogólną kontrolę hamowania.
Podziękowanie
Autorzy pragną podziękować wsparciu wewnętrznego programu NIAAA Narodowego Instytutu Zdrowia.
Referencje