UWAGI: recenzja czołowego naukowca na temat otyłości i uzależnienia od jedzenia.
Tom 69, Issue 4, 24 February 2011, Pages 664 – 679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Review
Paul J. Kenny1, ,
1 Laboratorium Neurobiologii Behawioralnej i Molekularnej, Zakład Terapii Molekularnej, The Scripps Research Institute, Jupiter, FL 33458, USA
________________________________________
Żywność jest spożywana w celu utrzymania równowagi energetycznej na poziomie homeostazy. Ponadto smaczna żywność jest również spożywana ze względu na jej właściwości hedoniczne niezależnie od statusu energetycznego. Taka konsumpcja związana z nagrodami może spowodować przekroczenie zapotrzebowania kalorycznego i jest uważana za głównego sprawcę szybko rosnącej liczby otyłości w krajach rozwiniętych. W porównaniu z homeostatycznymi mechanizmami żywienia, znacznie mniej wiadomo o tym, w jaki sposób systemy hedonistyczne w mózgu wpływają na przyjmowanie pokarmu. Intrygujące, nadmierne spożywanie smacznego jedzenia może wyzwalać reakcje neuroadaptacyjne w obwodach nagród mózgu podobnych do narkotyków. Ponadto podobne podatności genetyczne w systemach nagradzania mózgu mogą zwiększać predyspozycje do uzależnienia od narkotyków i otyłości. W tym miejscu dokonamy przeglądu najnowszych postępów w poznawaniu obwodów mózgu regulujących hedoniczne aspekty zachowania żywieniowego. Ponadto zostaną wzięte pod uwagę pojawiające się dowody sugerujące, że otyłość i narkomania mogą dzielić wspólne mechanizmy hedonistyczne.
________________________________________
Tekst główny
„Nie ma bardziej szczerej miłości niż miłość do jedzenia”.
—George Bernard Shaw
Wprowadzenie
Otyłość, definiowana jako wskaźnik masy ciała (BMI)> 30, jest stanem, w którym otyłość jest nienormalnie wysoka i może wynikać z hiperfagii lub zmniejszonego tempa metabolizmu (O'Rahilly, 2009). Nadmierna otyłość jest głównym czynnikiem ryzyka chorób układu krążenia, raka, cukrzycy typu 2 i zaburzeń związanych z nastrojem, a osoby otyłe często cierpią na stygmatyzację społeczną ([Bean i in., 2008], [Centers for Disease Control and Prevention, 2009] i [Luppino i in., 2010]). Według Center for Disease Control (CDC), wydatki na opiekę zdrowotną związane z otyłością w Stanach Zjednoczonych w latach 1998-2000 wyniosły około 213 miliardów dolarów. Co więcej, 300,000 1999 zgonów w Stanach Zjednoczonych każdego roku można przypisać chorobom związanym z nadwagą i otyłością (Allison i wsp., 30), przy czym otyłość jest drugą najczęstszą przyczyną zgonów, którym można zapobiec, po paleniu tytoniu. Niemniej jednak częstość występowania otyłości w społeczeństwach zachodnich nadal dramatycznie rośnie, a obecne szacunki wskazują, że ponad 2010% dorosłych w Stanach Zjednoczonych jest otyłych (Flegal i in., XNUMX).
Większość konceptualizacji regulacji żywienia proponuje, aby dwa równoległe systemy oddziaływały, wpływając na przyjmowanie pokarmu ([Hommel i in., 2006], [Lutter i Nestler, 2009] oraz [Morton i in., 2006]). System homeostatyczny obejmuje hormonalne regulatory głodu, sytości i poziomu otyłości, takie jak leptyna, grelina i insulina, które działają na obwody podwzgórza i pnia mózgu, aby stymulować lub hamować karmienie w celu utrzymania odpowiedniego poziomu równowagi energetycznej. Dysfunkcje w elementach układu homeostatycznego, takie jak wrodzony niedobór leptyny, mogą powodować utrzymujący się stan dodatniego bilansu energetycznego i rozwój otyłości ([Campfield i in., 1995], [Halaas i in., 1995] i [Pelleymounter et al., 1995]). Mechanizmy, za pomocą których hormonalne regulatory głodu i sytości działają na obwody podwzgórza i pnia mózgu, w celu utrzymania homeostazy energii, zostały szczegółowo opisane w innym miejscu, a czytelnicy zainteresowani tym tematem odnoszą się do wielu doskonałych recenzji na ten temat (na przykład [Abizaid et al., 2006a] i [Gao i Horvath, 2007]).
Oprócz systemów metabolicznych, mózgowe systemy nagrody również odgrywają ważną rolę w zachowaniach żywieniowych ([Lutter i Nestler, 2009] i [Saper i in., 2002]). Ogólnie rzecz biorąc, mdłe w smaku potrawy nie są spożywane w nadmiarze, podczas gdy smaczne potrawy są często spożywane nawet po spełnieniu wymagań energetycznych. Łatwość dostępu do smacznej, bogatej w energię żywności jest uważana za główny czynnik środowiskowy ryzyka otyłości (Volkow i Wise, 2005), a nadmierne spożycie smacznej żywności jest uważane za główny czynnik przyczyniający się do niedawnego wzrostu otyłości ([Finkelstein i in., 2005], [Hill i in., 2003] i [Swinburn i in., 2009]). Rzeczywiście, uzyskanie przyjemnych efektów smacznego jedzenia jest potężną siłą motywującą, która u niektórych osób może unieważnić sygnały homeostatyczne ([Shomaker i in., 2010], [Sunday i in., 1983] oraz [Zheng i in., 2009]). . Po dokonaniu wyboru szczury zdecydowanie wolą spożywać bezkaloryczny roztwór sacharyny niż samodzielnie dożylne wlewy kokainy (Lenoir i in., 2007). Ponadto dobrze odżywione szczury dobrowolnie narażą się na ekstremalne zimno (-15 ° C), szkodliwy ból spowodowany gorącem lub nieprzyjemny wstrząs, aby uzyskać smaczne produkty spożywcze, takie jak ciasto kruche, pasztet mięsny, masło orzechowe, Coca-Cola, cukierki M&M, czekolada chipsy lub jogurtowe krople, nawet jeśli mniej smaczne standardowe jedzenie jest dostępne bezpłatnie ([Cabanac i Johnson, 1983], [Foo i Mason, 2005] oraz [Oswald i in., 2010]). Odkrycia te podkreślają, jak intensywnie makroskładniki odżywcze w smacznej żywności mogą stymulować układy nagrody w mózgu niezależnie od ich wartości kalorycznej ([Wang i in., 2004a] i [Wang i in., 2004b]) oraz jak wysoka może być motywacja do spożywania smacznego pożywienia nawet przy braku homeostatycznych wymagań energetycznych. Narkotyki, takie jak kokaina lub nikotyna, mogą podobnie wywoływać wysoki poziom zachowań konsumujących, nawet jeśli są pozbawione wartości kalorycznej lub odżywczej. W rzeczywistości, ze względu na wiele podobieństw między przejadaniem się w otyłości a nadmiernym używaniem narkotyków w nałogu (Volkow i Wise, 2005), argumentowano, że otyłość należy uznać za zaburzenie mózgu i włączyć jako kategorię diagnostyczną w nadchodzącej piątej edycji. of the Diagnostic and Statistical Manual of Mental Disorders (DSM-V) ([Devlin, 2007] i [Volkow and O'Brien, 2007]). W porównaniu z homeostatycznymi mechanizmami zachowań żywieniowych znacznie mniej wiadomo o tym, jak dokładnie systemy hedoniczne wpływają na przyjmowanie pokarmu. Podobnie pozostaje niejasny wpływ wewnętrznych lub wywołanych dietą zmian na reaktywność mózgowych układów nagrody oraz sposób, w jaki te skutki przyczyniają się do przejadania się i otyłości. Poniżej podsumowano najnowsze dane podkreślające postęp w naszym zrozumieniu hedonicznych mechanizmów jedzenia i wywołanych dietą zmian w aktywności nagrody mózgu, które mogą przyczyniać się do rozwoju otyłości
Aktywacja systemów nagród za mózg w odpowiedzi na smaczną żywność: interakcje z hormonalnymi regulatorami bilansu energetycznego
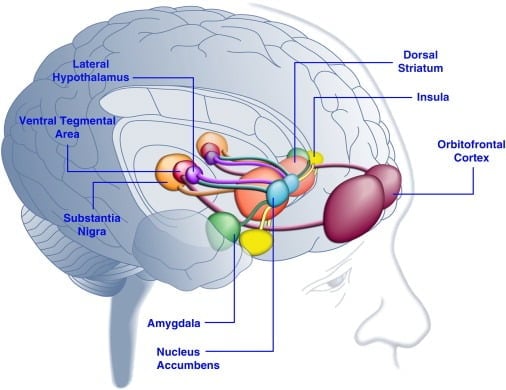
Spożycie smacznego pokarmu może poprawić nastrój u ludzi ([Dallman i in., 2003] i [Macht i Mueller, 2007]) i wspierać ustanowienie warunkowej preferencji miejsca u zwierząt laboratoryjnych ([Imaizumi i in., 2001] i [ Sclafani i in., 1998]). Efekty te są prawdopodobnie związane ze stymulacją mózgowych systemów nagradzania smacznym jedzeniem (rysunek 1). Rzeczywiście, badania obrazowania ludzkiego mózgu wykazały, że pokarmowe i związane z żywnością wskazówki wzrokowe lub węchowe mogą aktywować kortykolimbiczne i mezo obwodowe obwody mózgu biorące udział w nagradzaniu, zwłaszcza kora oczodołowo-czołowa (OFC), wyspa, obszar ciała migdałowatego, podwzgórza, prążkowia i śródmózgowia w tym brzuszny obszar nakrywkowy (VTA) i istota czarna (SN) ([Bragulat i in., 2010], [Pelchat i in., 2004], [Schur i in., 2009] i [Simmons i in., 2005] ). Prążkowie, wyspa, kora obręczy przedniej i struktury śródmózgowia kodują subiektywną wartość nagród bez względu na ich rodzaj (np. Pokarm, płeć, nagrody pieniężne), zgodnie z rolą tej sieci neuronowej w ogólnej reprezentacji hedonicznej (Sescousse i in. , 2010). W przeciwieństwie do tego, OFC wydaje się odgrywać szczególnie znaczącą rolę w reprezentacjach związanych z wartością konkretnych rodzajów nagród, w tym smacznych potraw ([Man i in., 2009], [Rolls, 2008] i [Sescousse et al., 2010] ). Głód może poprawiać smaczną, indukowaną przez żywność aktywację regionów kortykolimbicznych i śródmózgowia u ludzi (LaBar i in., 2001). Na przykład intensywność aktywacji prążkowia brzusznego, ciała migdałowatego, wyspy i OFC w odpowiedzi na wysokokaloryczne smaczne jedzenie była znacznie większa, gdy ludzie byli głodni niż dobrze odżywieni (Goldstone i in., 2009). Jest to zgodne z faktem, że okresy głodu i diety zwiększają samoocenę ocen „mocy” smacznego jedzenia i pragnienia „kuszącej” żywności ([Hofmann i in., 2010] i [Rolls et al., 1983] ). Odwrotnie, przekarmienie może zmniejszyć reakcje neuronalne na smaczny pokarm, zwłaszcza w korze wyspowej i podwzgórzu (Cornier i in., 2009). Zatem na wartość hedoniczną pokarmu ma wpływ stan metaboliczny, co sugeruje, że regulatory metabolizmu, takie jak leptyna i grelina, mogą wpływać na aktywność systemów hedonicznych w mózgu. Zgodnie z tym poglądem, pacjenci leczeni leptyną lub pochodzącym z jelita peptydem czynnika poposiłkowego YY3-36 (PYY) ([Batterham i in., 2007] i [Farooqi i in., 2007]) lub tymi, którzy przeszli rozdęcie żołądka naśladowanie spożycia posiłku (Wang i wsp., 2008), miało zmniejszoną aktywność w regionach mózgu związanych z nagrodami. Odwrotnie, hiperfagiczni pacjenci ludzcy z wrodzonym niedoborem leptyny wykazują zwiększoną aktywność w korze wyspowej i prążkowiu w odpowiedzi na obrazy żywności ([Baicy i in., 2007] i [Farooqi i in., 2007]). U tych osób terapia zastępcza leptyną złagodziła wzmożoną aktywność wyspową i prążkowia oraz zmniejszyła samoocenę upodobania do jedzenia ([Baicy i in., 2007] i [Farooqi i in., 2007]). Leczenie leptyną blokuje również nagradzające właściwości sacharozy u szczurów z ograniczoną żywnością, podobne do antagonisty receptora dopaminy α-flupentiksol (Figlewicz i in., 2001). Ponadto receptory leptyny ulegają ekspresji na neuronach dopaminowych śródmózgowia w VTA i SN (Figlewicz i wsp., 2003), co sugeruje, że leptyna może wpływać na hedoniczne aspekty zachowania żywieniowego poprzez modulację mezostriatalnej transmisji dopaminy. Potwierdzając tę możliwość, wlewy leptyny do VTA hamowały aktywność neuronów dopaminowych i zmniejszały przyjmowanie pokarmu u szczurów (Hommel i in., 2006; patrz także Krügel i in., 2003). I odwrotnie, knockdown receptorów leptyny w VTA zwiększył przyjmowanie pokarmu, zwiększył aktywność lokomotoryczną i zwiększył preferencję do smacznego jedzenia u szczurów (Hommel i in., 2006). Leptyna wywiera zatem hamujący wpływ na transmisję dopaminy mesoaccumbens, układ neuroprzekaźników, który jest silnie związany z nagrodą i motywacją, ale mniej w homeostazie energii ([de Araujo i in., 2010] i [Vucetic i Reyes, 2010]). Ostatnio wykazano, że hormonalna grelina związana z głodem ([Kojima i in., 1999] i [Nakazato i in., 2001]) wzmaga aktywację systemów hedonicznych w mózgu w odpowiedzi na sygnały pokarmowe (Malik i in. , 2008). W szczególności grelina zwiększyła aktywację OFC, ciała migdałowatego, wyspy, prążkowia, VTA i SN w odpowiedzi na zdjęcia bardzo smacznego pokarmu u osób otyłych (Malik i wsp., 2008). U szczurów grelina wywiera stymulujący wpływ na układ dopaminowy śródmózgowia ([Abizaid i in., 2006b], [Jerlhag i in., 2006] oraz [Jerlhag i in., 2007]) i zwiększa satysfakcjonującą wartość smacznego jedzenia (Perello et al., 2010).
Rysunek 1. Obszary ludzkiego mózgu aktywowane w odpowiedzi na smaczne jedzenie lub bodźce związane z jedzeniem. Uważa się, że kora oczodołowo-czołowa i ciało migdałowate kodują informacje związane z wartością nagrody pożywienia ([Baxter i Murray, 2002], [Holland i Gallagher, 2004], [Kringelbach et al., 2003], [O'Doherty et al. , 2002] i [Rolls, 2010]). Wyspa przetwarza informacje związane ze smakiem żywności i jej hedoniczną wyceną ([Balleine i Dickinson, 2000] i [Small, 2010]). Jądro półleżące i prążkowia grzbietowa, które otrzymują dopaminergiczny sygnał z brzusznego obszaru nakrywki i istoty czarnej, regulują motywacyjne i pobudzające właściwości pożywienia ([Baicy et al., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi i in., 2007], [Malik i in., 2008] oraz [Söderpalm and Berridge, 2000]). Podwzgórze boczne może regulować satysfakcjonujące reakcje na smaczny pokarm i napędzać zachowania związane z poszukiwaniem pożywienia (Kelley i in., 1996). Te struktury mózgowe działają w skoordynowany sposób, aby regulować uczenie się o hedonicznych właściwościach pożywienia, przenosząc uwagę i wysiłek w kierunku uzyskania nagrody pożywienia oraz regulując wartość motywacyjną bodźców środowiskowych, które przewidują dostępność nagrody pożywienia (Dagher, 2009). Ze względu na przejrzystość nie pokazano wszystkich połączeń między tymi strukturami.
Podobne regiony mózgu są aktywowane przez smaczny pokarm w mózgu szczura, jak te aktywowane u ludzi, jak zmierzono przez ekspresję bezpośrednich wczesnych genów (IEG), takich jak c-fos, łuk lub zif268. Rzeczywiście, smaczny pokarm aktywuje grzbietowe i brzuszne prążkowie, VTA, boczne podwzgórze (LH) oraz centralne i podstawno-boczne jądra ciała migdałowatego i związane z nagrodami struktury korowe u szczurów ([Angeles-Castellanos i in., 2007], [Park and Carr, 1998] i [Schiltz i in., 2007]). Co ciekawe, immunoreaktywność Fos była faktycznie zmniejszona w bocznym i przyśrodkowym habenula u szczurów po spożyciu smacznego pokarmu (LHb) (Park i Carr, 1998). U naczelnych niebędących ludźmi LHb jest aktywowany przez awersyjne bodźce lub pominięcie oczekiwanych nagród i zahamowany przez dostarczenie smacznej nagrody sokowej (Matsumoto i Hikosaka, 2007). Ponadto, aktywność LHb hamuje związane z nagrodami neurony zawierające mezoaccumbens dopaminę poprzez pośredni szlak obejmujący jądro rostromedialne nakrywkowe (RMTg) (Jhou i in., 2009). Aktywność hormonalna jest zatem odwrotnie proporcjonalna do hedoniki żywności, co sugeruje, że kompleks habitenalny może wpływać na jedzenie niehomeostatyczne. W rzeczywistości wykazano, że aktywacja LHb zmniejsza spożycie sacharozy u szczurów, podczas gdy zmiany LHb zwiększają zachowanie poszukujące sacharozy (Friedman i in., 2011). Biorąc pod uwagę, że kompleks habitenalny jest niewielki i trudny do zidentyfikowania i funkcjonalnego obrazu u ludzi (Salas i in., 2010), może to wyjaśniać, dlaczego zmiany w aktywności siedliskowej nie były zgłaszane w badaniach obrazowania u ludzi w odpowiedzi na smaczne jedzenie.
Obwody mózgu, które regulują jedzenie hedoniczne: systemy dopaminowe Midbrain
Szlak dopaminy w mezoakumbensach jest aktywowany u ludzi i zwierząt laboratoryjnych w odpowiedzi na smaczne pokarmy lub bodźce związane z apetytem, a leptyna, grelina i inne regulatory apetytu wpływają na aktywność tego układu. Sugeruje to, że układy dopaminy w śródmózgowiu odgrywają ważną rolę w smacznym spożyciu żywności. Być może najbardziej wyraźnym wskazaniem, że przenoszenie dopaminy w śródmózgowiu wpływa na spożycie smacznego pokarmu u ludzi, jest fakt, że pacjenci z chorobą Parkinsona (PD), u których występuje zwyrodnienie neuronów zawierających dopaminę w śródmózgowiu, mają tendencję do spożywania mniejszej ilości pożywienia niż osoby zdrowe (Nirenberg i Wody, 2006). Ponadto leczenie pacjentów z chorobą Parkinsona za pomocą agonistów receptora dopaminy może wywołać kompulsywne spożywanie smacznego pożywienia ([Dagher i Robbins, 2009] oraz [Nirenberg i Waters, 2006]). W rzeczywistości agoniści receptora dopaminy mogą wywoływać hedoniczne przejadanie się nawet u osób bez PD (Cornelius et al., 2010). U zwierząt smaczne roztwory sacharozy stymulują transmisję dopaminy w NAc (Hernandez i Hoebel, 1988), co jest efektem zgodnym z badaniami obrazowania ludzkiego mózgu (Small i in., 2003). Korzystając z szybkiej cyklicznej woltamperometrii wykazano, że sygnały przewidujące dostarczenie nagrody za sacharozę lub nieoczekiwane dostarczenie sacharozy wywołały transmisję dopaminy w NAc ([Roitman i in., 2004] i [Roitman i in., 2008]). Ponadto nieoczekiwane dostarczenie szkodliwych roztworów chininy miało odwrotny skutek, zmniejszając przenoszenie dopaminy w pozycji leżącej (Roitman i in., 2008). Wreszcie, myszy, u których dezaktywowano enzym hydroksylazę tyrozynową (TH), powodując niedobór dopaminy, nadal wykazują wyraźne preferencje dla roztworów sacharozy (lub sacharyny) w porównaniu z wodą, ale spożywają mniejszą całkowitą ilość sacharozy niż myszy kontrolne ( Cannon and Palmiter, 2003). Sugeruje to, że myszy z niedoborem dopaminy mogą nadal wykrywać smakowitość sacharozy i wolą te roztwory od wody, ale nie są w stanie wytrzymać spożycia smacznych roztworów. W związku z tym zaproponowano, że przenoszenie dopaminy w mezoakumbens reguluje motywacyjne aspekty zachowań żywieniowych, które są zaangażowane w pozyskiwanie pożywienia, oraz że inne systemy neuroprzekaźników prawdopodobnie regulują hedoniczne aspekty spożywania smacznej żywności.
Obwody mózgu, które regulują jedzenie hedoniczne: układy prążkowato-podwzgórzowe
Wlew agonistów receptorów opioidowych μ, takich jak [D-Ala2-N-Me-Phe4-gly-ol5] -enkephalin (DAMGO) do NAc stymuluje zachowania żywieniowe u szczurów z dostępem ad libitum do pożywienia (tj. Żywieniem niehomostostatycznym) ( [Peciña and Berridge, 2005] i [Zhang et al., 1998]). Przeciwnie, antagoniści receptora opioidowego wlewani do NAc zmniejszają spożycie korzystnego pokarmu bez wpływu na przyjmowanie mniej smacznych alternatyw (Kelley i wsp., 1996). Dane te są zgodne z poglądem, że systemy opioidowe prążkowia regulują hedoniczne właściwości smacznego pożywienia. Region powłoki NAc, aw szczególności hedoniczne „gorące punkty” w regionie rostrodorsalnym skorupy przyśrodkowej ([Peciña i Berridge, 2005] i [Peciña i in., 2006b]) odgrywa szczególnie ważną rolę w żywieniu niehomeostatycznym. Ponieważ aktywacja receptora opioidowego μ powoduje zahamowanie średniej aktywności neuronów kolczystych w NAc, zaproponowano, że powłoka NAc wywiera toniczny wpływ hamujący na smaczne spożywanie żywności (Kelley i in., 2005). Zgodnie z tym poglądem, stymulacja hamujących receptorów GABAA lub GABAB ([Basso i Kelley, 1999] i [Stratford and Kelley, 1997]) lub blokada pobudzających jonotropowych receptorów glutaminianu (Maldonado-Irizarry i in., 1995) w powłoce NAc zwiększa spożycie żywności. Podobnie, ekscytotoksyczne uszkodzenie powłoki NAc również zwiększa spożycie żywności i zwiększa wrażliwość na nagrodę pokarmową ([Johnson i in., 1996] i [Maldonado-Irizarry i Kelley, 1995]). W szczególności takie manipulacje preferencyjnie wywołują spożywanie gęstej, smacznej żywności ([Basso i Kelley, 1999], [Kelley i in., 2005] i [Zhang i in., 1998]).
Biorąc pod uwagę duży wpływ sygnalizacji półleżącej na żywienie hedoniczne, Thompson i Swanson (2010) zastosowali procedurę śledzenia obwodów, aby dokładnie zidentyfikować precyzyjne sieci anatomiczne, poprzez które NAc może wpływać na smaczne spożywanie żywności. W tych eleganckich badaniach szczury otrzymały dwa nienakładające się wstrzyknięcia znaczników anterogradowych / wstecznych (określanych jako COIN) do miejsc skorupy NAc, które silnie wpływają na smaczne spożywanie pokarmu i zidentyfikowano połączenia doprowadzające / odprowadzające. Wykazano, że miejsca związane z karmieniem w NAc wydłużają projekcje hamujące głównie do przedniego LH i brzusznej blady (VP) (Thompson i Swanson, 2010). W przeciwieństwie do reszty NAc, która rzuca się gęsto na VTA, związane z żywnością hedoniczne gorące punkty w projekcie powłoki NAc do jądra międzyfazowego (IFN), struktury znajdującej się w sąsiedztwie VTA, rozszerzają projekcje dopaminergiczne w sposób odwrotny do Powłoka NAc (Thompson i Swanson, 2010). Ponadto, przedni LH rzutuje na LHb (Thompson i Swanson, 2010), ponownie sugerując, że kompleks habitenularny może odgrywać rolę w hedonice żywności (Friedman i in., 2011).
Powyższe dane pokazują, że LH otrzymuje wyraźny wkład hamujący z miejsc w NAc, które wywierają toniczny wpływ hamujący na smaczne spożycie żywności. LH ma także funkcjonalną łączność z innymi korowymi i limbicznymi miejscami mózgu zaangażowanymi w organizowanie i kierowanie zachowaniem w kierunku uzyskania smacznego jedzenia (rysunek 1), takiego jak OFC, wyspa i ciało migdałowate. Co ważne, inaktywacja LH znosi stymulujące działanie manipulacji NAc na przyjmowanie pokarmu ([Maldonado-Irizarry i in., 1995] i [Will i in., 2003]). Ponadto, inaktywacja powłoki NAc zwiększa aktywność LH, zwłaszcza neuronów LH, które syntetyzują hipokretynę neuropeptydu (znaną również jako oreksyna), jak zmierzono za pomocą immunoreaktywności Fos ([Baldo i in., 2004] i [Stratford and Kelley, 1999 ]). Rzeczywiście, infuzja agonisty receptora opioidowego µ DAMGO do powłoki NAc aktywuje neurony zawierające hipokretynę w podwzgórzu (Zheng i wsp., 2007), a zakłócenie transmisji hipokretyny w VTA znosi smaczne przyjmowanie pokarmu wywołane przez wlewy DAMGO wewnątrz NAc (Zheng i in., 2007). Zatem hedoniczne gorące punkty w powłoce NAc wywierają toniczny wpływ hamujący na neurony LH, aw szczególności neurony zawierające hipokretynę (Louis i in., 2010), ograniczając w ten sposób spożycie smacznego pożywienia. Zakłócenie tego „sygnału zatrzymania”, na przykład poprzez zwiększenie sygnalizacji receptora opioidowego, skutkuje zwiększoną aktywnością LH, która napędza niehomeostatyczne spożycie smacznego pokarmu (rysunek 2).
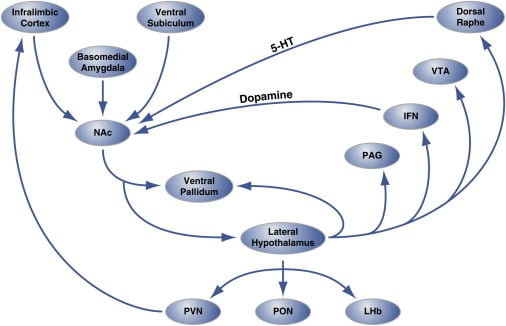
Rysunek 2. Organizacja Hedonic „Hot Spots” na poziomie obwodu w powłoce Nucleus Accumbens, która reguluje Hedonic Eating
Region skorupy jądra półleżącego (NAc) otrzymuje unerwienie z korowych i limbicznych miejsc mózgu i rzutuje na boczne podwzgórze i bladość brzuszną. Z kolei boczne podwzgórze również rzutuje na bladość brzuszną, a także na jądro PAG, IFN, VTA i grzbietowe. IFN i grzbietowy grzbiet rozciągają odpowiednio projekcje dopaminergiczne i serotoninergiczne z powrotem do NAc. Boczne podwzgórze unerwia również struktury wzgórza (PVN i PON) i epitalamiczne (LHb). Nie pokazano mniejszych rzutów od bocznego podwzgórza do przegrodowych obszarów mózgu. 5-HT, serotonina; IFN, jądro międzyosiowe; LHb, boczne habenula; PON, jądro preoptyczne; PVN, paraventricular jądro wzgórza; VTA, brzuszny obszar nakrywkowy. Rysunek został zaadaptowany za zgodą Thompsona i Swansona (2010).
Obwody mózgu, które regulują jedzenie hedoniczne: układy striatopallidalne
Oprócz LH, neurony powłokowe NAc również rzutują na VP (Rysunek 2). W interesującej serii eksperymentów wykazano, że projekcje półleżące do VP i LH mogą regulować dysocjujące aspekty jedzenia niehomeostatycznego (Smith i Berridge, 2007). Wlewy DAMGO do powłoki NAc lub VP zwiększyły reakcje twarzoczaszki na roztwory sacharozy, hipotetycznie odzwierciedlające reakcje „lubienia” u szczurów (tj. Odpowiedź smakową), a także zwiększone spożycie żywności (Smith i Berridge, 2007). Wlewy naloksonu do NAc lub VP zmniejszyły reakcje na podobieństwo twarzy do sacharozy, co sugeruje, że zsynchronizowana transmisja opioidów w NAc i VP jest konieczna do przetwarzania informacji o smaku żywności związanej z informacjami. Jednakże nalokson podawano do NAc, ale nie do VP, zmniejszając niehomeostatyczne jedzenie (Smith i Berridge, 2007), sugerując, że niehomeostatyczne jedzenie występuje niezależnie od tego połączenia NAc → VP i zamiast tego prawdopodobnie opiera się na szlaku NAc → LH ([Smith i Berridge, 2007] i [Taha et al., 2009]). Zgodnie z poglądem, że aspekty niehomeostatycznego jedzenia można oddzielić, zapisy pojedynczych jednostek wykazały, że populacja neuronów NAc wydaje się selektywnie kodować informacje związane ze względnymi właściwościami wzmacniającymi żywności (tj. Smakowitość) (Taha i Fields, 2005) . U tych samych szczurów zmiany aktywności drugiej populacji neuronów NAc wydawały się zbiegać z inicjacją zachowania żywieniowego (Taha i Fields, 2005).
Obwody mózgu, które regulują hedoniczne jedzenie: systemy Amygdalar
Dalej popierając pogląd, że aspekty jedzenia niehomeostatycznego są dysocjowalne, napary naloksonu do powłoki NAc lub VP, ale nie podstawno-boczne ciało migdałowate (BLA), zmniejszały smakowitość roztworów sacharozy (Wassum i in., 2009). Jednakże, gdy antagoniści receptora opioidowego μ, nalokson lub CTOP, wlewali do BLA, ale nie do powłoki NAc lub VP, występowało wyraźne osłabienie zwiększonej motywacji do odpowiedzi na roztwory sacharozy typowo obserwowane w stanie głodu ([Wassum i in. ., 2011] i [Wassum i in., 2009]). Sugeruje to, że właściwości motywacyjne sacharozy są regulowane przez obwody amigdalarne. Podsumowując, powyższe odkrycia pokazują, że różne aspekty jedzenia hedonicznego, takie jak przetwarzanie informacji związanych ze smakowitością żywności, zachowaniami podejścia i wzrostem wartości motywacyjnej smacznego jedzenia u głodnych zwierząt, są regulowane w różny sposób przez dyskretne mikroukłady w kontekście większy obwód kortykolimbiczno-prążkowiowo-ogonowy-podwzgórzowo-wzgórzowo-korowy (rysunek 2).
Czy adaptacje w obwodach mózgu Hedonic napędzają kompulsywne jedzenie?
Znaczenie funkcjonalne hedonicznych punktów aktywnych w powłoce NAc i ich wpływ na szersze obwody związane z żywieniem w mózgu zostały rozważone przez Kelley i in. (2005). Zakładają, że szlak NAc → szlak LH, wraz z górnymi i dolnymi regionami regulacyjnymi mózgu (Rycina 2), służy celowi „wartownika” (Kelley i in., 2005). W szczególności sugerują, że nawet u głodnych zwierząt, gdy dążenie do jedzenia jest silne, należy zachować zdolność do zaprzestania karmienia w przypadku zagrożeń ze strony środowiska (Kelley i in., 2005). W związku z tym aktywacja neuronów powłoki NAc i jednoczesne hamowanie neuronów LH może zakłócać ciągłe karmienie i ułatwiać zmianę zachowania na bardziej odpowiednie odpowiedzi adaptacyjne, takie jak zamrażanie lub ucieczka (Kelley i in., 2005). Jeśli rzeczywiście tak jest, ważne będzie zbadanie, czy ta powłoka NAc → szlak kontroli LH jest zagrożona przez nadmierne spożycie smacznego pokarmu lub czynniki genetyczne, które wpływają na podatność na otyłość. Mając to na uwadze, nasze laboratorium i inni ostatnio donieśli, że nadmierne spożycie smacznego pokarmu o dużej kaloryczności jest związane z pojawieniem się kompulsywnych zachowań żywieniowych u szczurów ([Johnson and Kenny, 2010], [Latagliata et al., 2010] i [Oswald i in., 2010]). W szczególności stwierdziliśmy, że smaczne spożywanie pokarmu u otyłych szczurów było odporne na zakłócenie przez awersyjny bodziec warunkowy, który przewidywał negatywny wynik (elektryczny szok) (Johnson i Kenny, 2010). Dlatego ważne będzie zbadanie, czy deficyty w powłoce NAc → szlaku kontrolnego LH wyzwalane przez przejadanie się przynajmniej częściowo przyczyniają się do wyraźnego niepowodzenia osób z nadwagą i otyłych w wykorzystywaniu informacji dotyczących szkodliwych konsekwencji ich konsumpcyjnego zachowania w celu moderowania przyjmowania pokarmu .
Zmieniona aktywność nagradzania mózgu w otyłości: badania obrazowania mózgu człowieka
Uzyskanie stymulujących efektów smacznego jedzenia w układach nagrody mózgowej jest uważane za ważny czynnik motywacyjny przyczyniający się do przejadania się. Dlatego ważne jest pytanie, czy zmiany w funkcji nagrody w mózgu mogą przyczynić się do rozwoju otyłości. Intuicyjna prognoza zakłada, że zwiększona konstytutywna reakcja mózgowych systemów nagradzania na smaczne jedzenie spowodowałaby przejadanie się i przyrost masy ciała. Zgodnie z tą hipotezą, osoby z wysokim poziomem wrażliwości na nagrody cechują się zwiększoną aktywnością w obszarach mózgu zaangażowanych w nagrodę pokarmową, w tym NAc, ciało migdałowate, OFC i VP, po ekspozycji na smaczne jedzenie, takie jak ciasto czekoladowe i pizza (Beaver et al. , 2006). Osoby otyłe podobnie wykazują zwiększoną aktywację obwodów nagrody mózgowej w odpowiedzi na smaczne jedzenie lub sygnały związane z jedzeniem w porównaniu z chudymi kontrolami ([Gautier i in., 2000], [Karhunen i in., 1997] i [Rothemund i in., 2007 ]). Wysokie poziomy wrażliwości na cechy były również skorelowane ze zwiększoną masą ciała u ludzi ([Davis i in., 2004] i [Franken i Muris, 2005]). Jednak co ważne, otyłe kobiety (BMI> 30) miały wyższy poziom anhedonii (tj. Zmniejszoną wyjściową wrażliwość na nagrodę) niż kobiety z nadwagą (BMI> 25 <30) (Davis i in., 2004). Podobnie, Stice i współpracownicy (2008b) wykazali, że otyłe nastolatki miały zwiększoną aktywację wyspy i innych korowych obszarów mózgu w odpowiedzi na smaczne jedzenie lub sygnały związane z jedzeniem w porównaniu z chudymi osobami kontrolnymi, ale ta aktywacja obszaru ogoniastego prążkowie w odpowiedzi na smaczne jedzenie było odwrotnie skorelowane z BMI u osób otyłych. Co więcej, kobiety, które przybrały na wadze w okresie 6 miały wyraźny spadek aktywności prążkowia w odpowiedzi na smaczny pokarm w tym okresie w porównaniu z kobietami, które nie przybrały na wadze (Stice i in., 2010a). Biorąc to wszystko razem, wydaje się, że nadwrażliwość obwodów nagrody może predysponować jednostkę do przejadania się i przyrostu masy ciała (Stice i in., 2010b). Jednak wraz ze wzrostem przyrostu masy ciała mogą pojawić się deficyty aktywności określonych składników systemu nagrody mózgu, zwłaszcza prążkowia. Zaproponowano, że pojawienie się tego stanu niedostatecznej nagrody może utrwalić nadmierną konsumpcję smacznego pożywienia w celu przezwyciężenia takich deficytów nagrody ([Stice i in., 2008a] i [Wang i in., 2002]). Stąd zbyt mała lub zbyt duża nagroda za żywność wydaje się zwiększać podatność na przejadanie się i otyłość (Stoeckel, 2010). Atrakcyjne ramy koncepcyjne dla pogodzenia tych pozornie sprzecznych punktów widzenia są takie, że obszary kortykolimbiczne zaangażowane w organizowanie zachowań w celu uzyskania nagród żywieniowych i przewidywanie przewidywanej przyszłej nagrody żywnościowej mogą stać się nadpobudliwe u osób z nadwagą i osób predysponowanych do otyłości. Odwrotnie, miejsca mózgu prążkowia, które przetwarzają rzeczywiste doznanie przyjemności z jedzenia hedonicznego, mogą stać się stopniowo mniej funkcjonalne u tych samych osób. Oczekuje się zatem, że względna wartość motywacyjna smacznego pokarmu wzrośnie podczas rozwoju otyłości w tym samym czasie, w którym wartość hedoniczna uzyskana ze spożywania smacznych pokarmów maleje.
Zmieniona aktywność nagradzania mózgu w otyłości: badania nad gryzoniami
Wpływ spożywania smacznego pokarmu na układy nagrody mózgowej oceniano bezpośrednio u zwierząt laboratoryjnych, stosując procedurę nagrody za stymulację mózgu (BSR). Powszechnie wiadomo, że stymulacja elektryczna LH, która otrzymuje toniczny wkład hamujący z półleżących hedonicznych gorących punktów (rysunek 2), jest wysoce satysfakcjonująca i szczury będą ciężko pracować, aby samodzielnie stymulować ten region mózgu, np. (Markou i Frank, 1987 ). Oprócz wspomagania zachowań autostymulacyjnych, stymulacja elektryczna LH może również wywoływać intensywne nawyki zachowania żywieniowego (Margules i Olds, 1962) i zaproponowano, że nagradzające właściwości stymulacji LH mogą być związane z wewnętrzną rolą tego zachowania. strona mózgu w apetycznych i motywujących właściwościach żywności (Margules i Olds, 1962). Zgodnie z tym poglądem, głód i utrata masy ciała zwiększają wrażliwość szczurów na satysfakcjonującą wartość samostymulacji LH ([Blundell i Herberg, 1968], [Carr i Simon, 1984] oraz [Margules i Olds, 1962]), efekt które mogą być blokowane przez infuzję leptyny do komór mózgowych (Fulton i in., 2000). I odwrotnie, elektryczna stymulacja LH jest hamowana u zwierząt nasyconych (Wilkinson i Peele, 1962). Rzeczywiście, nadmierne karmienie szczurów przez dożołądkową rurkę do karmienia (Hoebel i Teitelbaum, 1962), rozdęcie żołądka lub dożylny wlew glukagonu naśladujący poposiłkowe uczucie sytości ([Hoebel, 1969], [Hoebel i Balagura, 1967] i [Mount and Hoebel, 1967] ), wszystkie osłabiają odpowiedź na stymulację LH. W rzeczywistości szczury, które wcześniej reagowały energicznie na nagradzanie stymulacji LH, zareagują tak, jakby ta stymulacja była niepożądana po spożyciu pokarmu lub rozwoju otyłości (Hoebel i Thompson, 1969). W związku z tym chroniczne ograniczenie jedzenia i utrata masy ciała zwiększa się, podczas gdy przekarmienie zmniejsza się, wrażliwość miejsc związanych z nagrodami w LH. Wrażliwość neuronów LH na nagradzanie samostymulacji elektrycznej może zatem dostarczyć ważnych informacji na temat funkcjonowania obwodów mózgu, które regulują hedoniczne reakcje na żywność.
Ponieważ łatwość dostępu do gęstej, smacznej żywności i wynikająca z tego nadmierna konsumpcja jest uważana za główny czynnik środowiskowy przyczyniający się do otyłości (Volkow i Wise, 2005), nasze laboratorium niedawno wykorzystało procedurę BSR do oceny aktywności nagrody mózgowej u szczurów z rozszerzonym dostępem do smacznego jedzenia . W szczególności odnotowaliśmy reakcje na stymulację elektryczną LH u szczurów, które miały dostęp ad libitum do karmy sam lub karmy w połączeniu z codziennym dostępem do smacznej diety 18-23. Ta dieta składała się z sernika, bekonu, kiełbasy i innych apetycznych produktów spożywczych (Johnson and Kenny, 2010). Stwierdziliśmy, że szczury o rozszerzonym dostępie do smacznego jedzenia szybko zyskały znaczną masę ciała i wykazywały stopniowo pogarszający się deficyt nagrody w mózgu (odzwierciedlone jako zmniejszona reakcja na satysfakcjonującą stymulację LH) (Johnson i Kenny, 2010; Rysunek 3). Sugeruje to, że rozwój otyłości indukowanej dietą wiąże się ze stopniowym zmniejszaniem się reaktywności miejsc nagrody w LH (Johnson i Kenny, 2010). Deficyty w sygnalizowaniu nagrody odnotowano również u dorosłych szczurów, które wcześniej miały nieograniczony dostęp do sacharozy lub wysokotłuszczowej żywności w okresie dojrzewania ([Teegarden i in., 2009], [Vendruscolo i in., 2010a] i [Vendruscolo i in., 2010b]). Te efekty u szczurów przypominają zmniejszoną aktywację prążkowia w odpowiedzi na nagrodę pokarmową opisaną powyżej u ludzi, ponieważ przybierały na wadze w okresie 6 (Stice i in., 2010a; patrz Figura 4). Takie wywołane dietą deficyty nagradzania u szczurów z nadwagą i być może u ludzi, którzy przybierają na wadze, prawdopodobnie odzwierciedlają reakcję antyadaptacyjną w obwodach nagradzania pokarmem, aby przeciwstawić się ich nadmiernej stymulacji smacznym jedzeniem (Johnson i Kenny, 2010). Ważnym aspektem tego odkrycia jest to, że podobne deficyty w funkcji nagrody są również wykrywane u szczurów, które nadużywają kokainy lub heroiny ([Ahmed i in., 2002], [Kenny i in., 2006] oraz [Markou i Koob, 1991]; Rysunek 3). W rzeczywistości wysunięto hipotezę, że dysfunkcja nagrody wywołana lekami może przyczynić się do przejścia od kontrolowanego do niekontrolowanego zażywania narkotyków poprzez dostarczenie nowego źródła motywacji do spożywania leku w celu złagodzenia uporczywego stanu zmniejszonej nagrody ([Ahmed i Koob , 2005] i [Koob and Le Moal, 2008]). Dlatego możliwe jest, że deficyty wrażliwości miejsc nagrody w LH wywołane przez przejadanie się mogą zwiększyć długoterminowe utrzymywanie się smacznego spożycia pokarmu u szczurów z nadwagą poprzez przesunięcie preferencji żywieniowych w kierunku pokarmu o wyższym oddziaływaniu hedonicznym, aby złagodzić trwały stan negatywny nagroda.
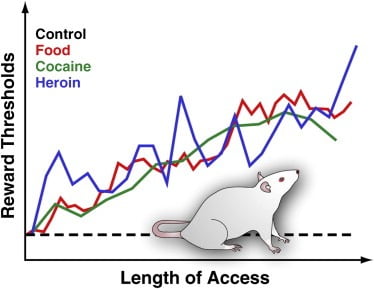
Rysunek 3. Progi nagród na szczurach z rozszerzonym dziennym dostępem do smacznych potraw, kokainy lub heroiny
Aby zmierzyć progi nagród, chirurgicznie wszczepia się elektrodę stymulującą do bocznego podwzgórza szczurów, regionu, w którym stymulacja elektryczna jest bardzo satysfakcjonująca i może wywoływać intensywne napady zachowań żywieniowych. Po wyzdrowieniu zwierzęta mogą samodzielnie stymulować ten region, obracając koło. Po ustaleniu stabilnego zachowania autostymulacji określa się minimalną intensywność stymulacji, która utrzymywała zachowanie autostymulacji (tj. Próg nagrody). Ten próg nagrody stanowi operacyjną miarę aktywności systemu nagród. Progi nagród pozostają stabilne i niezmienione u szczurów kontrolnych, które mają dostęp do standardowej karmy laboratoryjnej i które pozostają naiwne. Jednak progi stopniowo zwiększają się u szczurów z rozszerzonym codziennym dostępem do gęstej, smacznej diety składającej się ze smacznych produktów spożywczych (np. Sernik, bekon, czekolada itp.). Podobnie progi nagromadzenia progresywnie wzrastały u szczurów, które mają codzienny dostęp do dożylnych wlewów kokainy lub heroiny. Podwyższony próg nagród jest interpretowany w celu odzwierciedlenia zmniejszonej wrażliwości systemu nagród mózgu. Efekty te sugerują, że nadmierne spożycie smacznego pokarmu i związany z nim przyrost masy ciała mogą wywołać głęboki deficyt nagród w mózgu podobny do tych wywołanych nadmiernym spożyciem uzależniającego leku
Rysunek 4. Plastyczność prążkowia w otyłości Przyrost masy ciała jest związany ze zmniejszoną aktywacją prążkowia w odpowiedzi na smaczny pokarm, mierzony za pomocą fMRI, oraz niższym poziomem dostępności receptora dopaminy D2 w prążkowiu (D2R) u ludzi (szczegóły w tekście).
Niedobór sygnału receptora dopaminy D2 w otyłości
Kilka ostatnich doniesień ujawniło potencjalne mechanizmy, za pośrednictwem których mogą pojawić się deficyty wynagrodzeń w odpowiedzi na nadmierną konsumpcję smacznego jedzenia podczas rozwoju otyłości. Jak wspomniano powyżej, kobiety, które przybrały na wadze w okresie 6 miały wyraźny spadek aktywności prążkowia w odpowiedzi na smaczny pokarm w tym okresie w porównaniu z kobietami, które nie przybrały na wadze (Stice i in., 2010a; Figura 4). Osoby na czczo, które mogły spożywać swój ulubiony posiłek do sytości, miały niższy poziom wiązania antagonisty receptora dopaminy D2 (D2R), racloprydu w ciele prążkowanym (Small i wsp., 2003), co sugeruje, że sygnalizacja D2R zmniejsza się w odpowiedzi na smaczne spożycie żywności. Istotnie, osoby otyłe mają niższy poziom dostępności prążkowia D2R w porównaniu z kontrolami szczupłymi ([Barnard i in., 2009], [Stice i in., 2008a] i [Wang i in., 2001]; Figura 4), podczas gdy utrata masy ciała u pacjentów otyłych wiąże się ze zwiększoną gęstością prążkowia D2R (Wang i wsp., 2008). Biorąc pod uwagę, że transmisja dopaminy w prążkowiu odgrywa kluczową rolę w regulacji jedzenia hedonicznego, adaptacyjne spadki w sygnalizacji D2R mogą przyczynić się do zmniejszenia reaktywności prążkowia do smacznego jedzenia u osób otyłych. Aby przetestować tę możliwość, mali i współpracownicy badali aktywność w obwodach nagradzania mózgu w odpowiedzi na smaczny koktajl mleczny u osób kontrolnych i osób noszących allel TaqIA A1 (Felsted i in., 2010). Polimorfizm długości fragmentu restrykcyjnego TaqIA znajduje się poniżej genu D2R (Neville i wsp., 2004), a osobniki niosące allel A1 polimorfizmu mają między 30% -40% mniej prążkowia D2R w porównaniu z osobami nie przenoszącymi allelu ([Jönsson i wsp., 1999], [Ritchie and Noble, 2003] i [Stice et al., 2010b]). Ponadto nosiciele alleli A1 mają również zmniejszony metabolizm glukozy w obszarach mózgu prążkowia i korowych zaangażowanych w odpowiedzi hedoniczne na pokarm (Jönsson i in., 1999). Osoby niosące allel TaqIA A1 są nadreprezentowane w otyłych populacjach ([Barnard i in., 2009], [Stice i in., 2008a] i [Wang i in., 2001]). Ponadto allel A1 zwiększa również podatność na alkohol, opioidy i uzależnienie od stymulatorów psychomotorycznych ([Lawford i in., 2000], [Noble i in., 1993] i [Noble i in., 2000]). Stwierdzono, że obszary śródmózgowia, w tym prawdopodobnie VTA i SN, które zapewniają dopaminergiczny wkład do prążkowia, zostały aktywowane w odpowiedzi na smaczny koktajl mleczny u osobników kontrolnych (Felsted i wsp., 2010). Odwrotnie, aktywność w tych miejscach mózgu była faktycznie zmniejszona w odpowiedzi na nagrodę pokarmową u nosicieli allelu A1 (Felsted i in., 2010). Podobne odwrotne odpowiedzi w aktywacji mózgu między allelicznymi nosicielami A1 i nie-nosicielami wykryto również w wzgórzowych i korowych miejscach mózgu (Felsted i in., 2010). Dane te są bardzo spójne z kluczową rolą D2R w regulowaniu odpowiedzi mezostriatalnej na smaczny pokarm. Stice i współpracownicy (2008a) stwierdzili odwrotną korelację między BMI a aktywacją prążkowia (jądra ogoniastego i skorupy) w odpowiedzi na smaczny mleczny koktajl czekoladowy u ludzi. Ponadto ta odwrotna zależność była najbardziej widoczna u osób niosących allel TaqIA A1 (Stice i in., 2008a). Przyszły przyrost masy ciała u tych osób, mierzony 1 rok po początkowym obrazowaniu mózgu, wykazał, że wielkość aktywacji prążkowia w odpowiedzi na smaczny pokarm była ujemnie skorelowana z przyrostem masy ciała u osób z allelem A1 i dodatnio skorelowana u pacjentów z allelem innym niż A1 ( Stice i in., 2008a). W badaniu kontrolnym stwierdzono, że wielkość aktywacji prążkowia w odpowiedzi na wyobrażone jedzenie smacznego jedzenia, w przeciwieństwie do jego rzeczywistego spożycia, była odwrotnie skorelowana z przyrostem masy ciała w następnym roku u pacjentów z allelem A1, ale dodatnio korelowane u osób z allelem innym niż A1 (Stice i in., 2010b). Te odkrycia sugerują, że D2R regulują odpowiedź prążkowia na smaczny pokarm i że zmniejszona sygnalizacja D2R indukowana przez przyrost masy ciała lub czynniki genetyczne może zwiększyć podatność na otyłość.
Niewystarczająca sygnalizacja D2R przyczynia się do nagradzania niedoborów w otyłości
Podobnie do obniżonych poziomów prążkowia D2R u otyłych osobników ludzkich, poziomy D2R są również obniżone u myszy i szczurów karmionych smaczną dietą (np. [Colantuoni i in., 2001], [Geiger i in., 2009] i [Johnson and Kenny , 2010]) i u szczurów genetycznie predysponowanych do otyłości (szczury Zucker) (Thanos i in., 2008). Nasze laboratorium bezpośrednio zbadało rolę zakłóconej transmisji dopaminy w prążkowiu w ogóle, aw szczególności zmniejsza sygnalizację D2R w deficytowych uzależnieniach związanych z uzależnieniem, które pojawiają się u szczurów podczas rozwoju otyłości (patrz rysunek 5). W szczególności zbadaliśmy wpływ zmniejszenia ekspresji prążkowia D2R u szczurów za pomocą interferencji RNA za pośrednictwem wirusów, a następnie oceny progów BSR, gdy szczury miały dostęp tylko do karmy lub karmy w połączeniu z 18 – 23 hr codzienny dostęp do smacznych, wysokoenergetycznych dieta (tj. dieta stołowa) (Johnson i Kenny, 2010). Odkryliśmy, że reakcja na nagradzającą stymulację LH zaczęła się zmniejszać niemal natychmiast po ekspozycji na dietę bufetową u szczurów D2R knockdown (Johnson i Kenny, 2010; Figura 5). Zmniejszenie poziomów D2R w prążkowiu szybko przyspiesza zatem pojawienie się hipofunkcjonalności nagrody u szczurów z wydłużonym dostępem do bardzo smacznego pokarmu, co zwykle trwa wiele tygodni, zanim u szczurów kontrolnych nastąpi wydłużony dostęp do smacznej diety. Jednak nokaut prążkowia D2R u szczurów z dostępem tylko do karmy nie zmienił odpowiedzi na nagradzającą stymulację LH, co sugeruje, że zmniejszona sygnalizacja D2R prążkowia oddziałuje z innymi reakcjami adaptacyjnymi indukowanymi dietą w obwodach nagradzania mózgu w celu wywołania nadwrażliwości nagrody. Oprócz obniżonych poziomów D2R, inne aspekty transmisji dopaminergicznej prążkowia są również zmienione w mózgach otyłych szczurów. Na przykład, szczury Sprague-Dawley wyhodowały selektywność, aby szybko przybrać na wadze na diecie wysokoenergetycznej (szczury podatne na otyłość) mają niższe poziomy podstawowe i wywołane poziomy dopaminy w NAc niż szczury, które są odporne na przyrost masy ciała (szczury odporne na otyłość) (Geiger et al., 2008, patrz także Rada i in., 2010). Szczury ze skłonnością do otyłości mają również obniżony poziom maszyn biosyntezy dopaminy i przechowywania, co sugeruje, że niepowodzenie w wytwarzaniu i uwalnianiu dopaminy przyczynia się do deficytu transmisji dopaminy w prążkowiu u otyłych szczurów (Geiger i wsp., 2008). Szczury, które rozwinęły otyłość w wyniku nadmiernego spożycia smacznej diety wysokoenergetycznej, również miały niższe poziomy podstawowe i wywołane poziomy dopaminy w NAc w porównaniu ze szczurami, które miały dostęp tylko do standardowej karmy ([Davis i in., 2008] i [Geiger i in., 2009]). Co ważne, posiłek ze standardowej karmy był wystarczający, aby zwiększyć poziom dopaminy w NAc szczurów kontrolnych, podczas gdy tylko bardzo smaczne produkty żywnościowe były wystarczające, aby wywołać akumulację dopaminy u otyłych szczurów, które miały długą historię dostępu do smacznego jedzenia (Geiger i in., 2009). Te odkrycia pokazują, że rozwój otyłości u szczurów jest związany z dysfunkcją mezostriatalnej transmisji dopaminy, najbardziej widoczną w prążkowiu D2R, i że niedobór sygnalizacji D2R przyczynia się do pojawienia się deficytów nagrody podczas rozwoju otyłości u szczurów. Jest to zgodne z faktem, że obniżenie poziomu prążkowia D2R jest godną uwagi neuroadaptacyjną odpowiedzią na przyrost masy ciała u ludzi ([Barnard i in., 2009], [Stice i in., 2008a] i [Wang i wsp., 2001]), i że niedostateczna sygnalizacja D2R prążkowia może tępić odpowiedzi prążkowia na hedoniczną żywność u ludzi, predysponując jednostkę do przyszłego przyrostu masy ciała ([Stice i in., 2008a] i [Wang i wsp., 2001]).
Rycina 5. Receptory dopaminy D2, dysfunkcja nagród i kompulsywność w otyłości - knockdown receptorów dopaminy D2 (D2R) w prążkowiu szczura przyspiesza pojawienie się dysfunkcji nagrody i kompulsywnego jedzenia u szczurów z rozszerzonym dostępem do smacznego pokarmu.
Niewystarczająca sygnalizacja D2R może wywołać kompulsywne jedzenie w otyłości
Otyłość charakteryzuje się przejadaniem, które utrzymuje się pomimo wyrażonego pragnienia ograniczenia konsumpcji i wiedzy o głębokich negatywnych konsekwencjach zdrowotnych i społecznych dalszego nadmiernego spożycia ([Booth i in., 2008], [Delin i in., 1997] i [Puhl et al., 2008]). Przykładem tego jest fakt, że wielu otyłych pacjentów zostanie poddanych potencjalnie niebezpiecznej operacji bariatrycznej (bypass żołądka) w celu kontrolowania masy ciała (Yurcisin i in., 2009), ale często nawraca do przejadania się, mimo że operacja zmniejsza subiektywne oceny głodu i zmniejsza zdolność do spożywania dużych ilości żywności ([Kalarchian i in., 2002] i [Saunders, 2001]). Uzależnienie od narkotyków jest podobnie definiowane jako utrata kontroli nad zażywaniem narkotyków i utrwaleniem nawyku pomimo świadomości potencjalnie niszczących konsekwencji zdrowotnych, społecznych lub finansowych (DSM-IV; Amerykańskie Stowarzyszenie Psychiatryczne, 1994). Jako takie, otyłość i uzależnienie od narkotyków mają wspólne cechy kompulsywnych zaburzeń, ponieważ istnieje wyraźne niepowodzenie w wykorzystywaniu informacji dotyczących przyszłych szkodliwych konsekwencji dla umiarkowanej konsumpcji i trwałości konsumpcji pomimo dostępności mniej szkodliwych alternatywnych zachowań.
Kompulsywne zażywanie narkotyków zostało operacyjnie zdefiniowane u gryzoni jako spożycie oporne na tłumienie przez karę lub bodźce środowiskowe przewidujące karę ([Pelloux i in., 2007] i [Vanderschuren and Everitt, 2004]). Okresy rozszerzonego dostępu do kokainy i innych narkotyków mogą prowadzić do pojawienia się kompulsywnych zachowań związanych z przyjmowaniem narkotyków u szczurów ([Ahmed i Koob, 1998], [Deroche-Gamonet i in., 2004] i [Vanderschuren and Everitt, 2004] ). Rzeczywiście, szczury z historią rozległego spożycia kokainy wykazują spożycie, które jest odporne na zakłócenia przez awersyjny bodziec warunkowy (CS) przewidujący negatywny wynik (tj. Światło ostrzegawcze, które przewiduje dostarczanie awersyjnego wstrząsu) ([Belin i in., 2008] oraz [Vanderschuren i Everitt, 2004]). I odwrotnie, ten sam awersyjny CS może znacznie obniżyć odpowiedź na leki u szczurów o stosunkowo ograniczonym dostępie do leku. Biorąc pod uwagę podobieństwa między kompulsywnym zażywaniem narkotyków w uzależnieniu a przejadaniem się w otyłości, niedawno zbadaliśmy, czy otyłe szczury spożywają smaczne jedzenie w sposób kompulsywnie lubiany i czy prążkowia D2R odgrywają rolę w tym procesie (Johnson i Kenny, 2010). Stwierdziliśmy, że otyłe szczury z historią przedłużonego dostępu do smacznego jedzenia nadal jedzą smaczne jedzenie, nawet w obecności szkodliwego CS (lekkiego sygnału), który przewidywał dostarczenie awersyjnego wstrząsu (Johnson i Kenny, 2010). W przeciwieństwie do tego, ten sam awersyjny CS zakłócał smakowitą konsumpcję pokarmu u szczupłych szczurów z bardzo ograniczoną ekspozycją na gęsty, smaczny pokarm. Smakowite spożycie żywności może zatem stać się kompulsywne u otyłych szczurów w taki sam sposób, w jaki spożycie kokainy może stać się kompulsywne. Zgodnie z tą interpretacją danych myszy, które wcześniej miały dostęp do smacznej wysokotłuszczowej diety, spędzały więcej czasu w awersyjnym środowisku (jasno oświetlone), aby uzyskać smaczny pokarm niż myszy, które nie miały wcześniejszego doświadczenia z dietą (Teegarden i Bale , 2007). Ze względu na strach przed drapieżnikami, jasno oświetlone otwarte przestrzenie są bardzo niechętne dla myszy (Suarez i Gallup, 1981). Myszy stają się zatem odporne na potencjalnie negatywne konsekwencje ich żerowania i ryzykują drapieżnictwo, aby uzyskać smaczny pokarm, nawet jeśli mniej smaczne jedzenie jest dostępne przy znacznie niższym ryzyku.
Co ciekawe, allel A1 polimorfizmu TaqIA, który powoduje obniżoną gęstość D2R prążkowia (Noble, 2000) i stępioną aktywację prążkowia w odpowiedzi na smaczny pokarm (Stice i in., 2008a), jest również związany z deficytami w uczeniu się, aby uniknąć działań, które mają negatywne konsekwencje (Klein i in., 2007). To właśnie ten typ niewykorzystywania informacji związanych z przyszłymi negatywnymi konsekwencjami przejadania się może przyczynić się do rozwoju kompulsywnego jedzenia u osób otyłych. Odkryliśmy, że pojawienie się kompulsywnego jedzenia u szczurów z dostępem do smacznych potraw zostało dramatycznie przyspieszone po prążkowiu D2R knockdown (Johnson i Kenny, 2010). W rzeczywistości, szczury z prążkowia nokautem D2R, które wcześniej miały tylko 14 dni przedłużonego dostępu do gęstej, smacznej żywności, wykazywały smaczne spożycie żywności, które było odporne na zakłócenia przez awersyjny CS (Johnson i Kenny, 2010; Rysunek 5). Jednak ten okres 14 o ograniczonej ekspozycji na smaczny pokarm nie był wystarczający do wywołania kompulsywnego jedzenia u kontrolnych szczurów (Johnson i Kenny, 2010). Odkrycia te sugerują, że u otyłych szczurów może pojawić się uzależniające, uzależniające spożycie smacznego pokarmu. Ponadto, niedostateczna sygnalizacja D2R prążkowia, która przyspiesza pojawienie się nadwrażliwości nagrody w odpowiedzi na smaczną nadkonsumpcję pokarmu, również przyspiesza pojawienie się kompulsywnego jedzenia (Figura 5).
Interakcje między D2R a hormonalnymi regulatorami bilansu energetycznego w otyłości
Egzogenna leptyna podawana do VTA hamuje transmisję i karmienie mesoaccumbens dopaminą ([Hommel i in., 2006] i [Krügel i in., 2003]). Oprócz ostrego działania hamującego na układ dopaminowy śródmózgowia, istnieje coraz więcej dowodów na to, że toniczna sygnalizacja leptyny może być również konieczna do utrzymania odpowiedniego poziomu mezostriatalnej sygnalizacji dopaminy. Flier i współpracownicy odkryli, że myszy ob / ob miały niższy poziom hydroksylazy tyrozynowej w neuronach dopaminowych śródmózgowia, kluczowego enzymu w biosyntezie dopaminy (Fulton i in., 2006). Ponadto myszy ob / ob zmniejszyły wywołane uwalnianie dopaminy do NAc (Fulton i wsp., 2006) i zmniejszyły somatodendrytyczne pęcherzykowe zapasy dopaminy w VTA i SN (Roseberry i in., 2007). Te braki w wytwarzaniu dopaminy i maszynerii transdukcji sygnału u myszy ob / ob korygowano przez leczenie leptyną ([Fulton i in., 2006] i [Pfaffly i in., 2010]). W rzeczywistości leptyna podawana tylko do LH była wystarczająca do skorygowania dysfunkcyjnej transmisji dopaminy u myszy ob / ob (Leinninger i in., 2009), sugerując, że komórki wyrażające receptor leptyny w LH działają w celu utrzymania odpowiedniego poziomu sygnalizacji dopaminy. Oprócz zmniejszenia produkcji i uwalniania dopaminy, myszy ob / ob miały również tendencję do niższego poziomu ekspresji D2R w prążkowiu (Pfaffly i in., 2010). Ponadto, egzogenne leczenie leptyną według schematu, który powoduje rozwój niewrażliwości na sygnalizację leptyny (tj. Oporność na leptynę) znacząco obniżyło poziomy prążkowia D2R u myszy typu dzikiego (Pfaffly i wsp., 2010). Otyłe szczury rozwijają oporność na leptynę w VTA ([Matheny i in., 2011] i [Scarpace i in., 2010]), a także mają niższe poziomy TH w VTA, zmniejszone uwalnianie dopaminy w prążkowiu i zmniejszone poziomy prążkowia D2R (Geiger et al., 2008). Podsumowując, dane te pokazują, że leptyna ma złożone działania na układy dopaminowe śródmózgowia. Z jednej strony ostra aktywacja receptorów leptyny w VTA wywiera hamujący wpływ na transmisję dopaminy mesoaccumbens i może hamować zachowanie żywieniowe ([Hommel i in., 2006] i [Krügel i in., 2003]). Z drugiej strony, sygnalizacja leptyny w śródmózgowiu jest konieczna do utrzymania odpowiedniej produkcji dopaminy i transmisji sygnału, a deficyty genetyczne w sygnalizacji leptyny lub rozwój oporności na leptynę w otyłości głęboko zakłócają systemy dopaminowe mesoaccumbens. W związku z tym interesujące jest, że rozwój oporności na leptynę w neuronach dopaminergicznych śródmózgowia podczas rozwoju otyłości może odgrywać główną rolę w zakłóceniu przekazywania sygnałów D2R w prążkowiu, które wydaje się napędzać pojawienie się dysfunkcji nagrody podobnej do uzależnienia i kompulsywnego przejadania się (Rysunek 5) u otyłych szczurów.
Oprócz złożonego wpływu sygnalizacji leptyny na transmisję dopaminergiczną mezostriatalną, gromadzą się dowody, że D2R mogą z kolei regulować sygnalizację leptyny. Bromokryptyna, agonista D2R, obniża poziomy leptyny w krążeniu ([Doknic i in., 2002], [Kok i in., 2006] i [Mastronardi i in., 2001]), sugerując, że D2R wywierają hamujący wpływ na poziomy leptyny. Ponadto, myszy z mutacją zerową w genie D2R mają wzmocnioną sygnalizację leptyny w podwzgórzu i są bardziej wrażliwe na anorektyczne działanie leptyny (Kim i in., 2010). Powszechnie wiadomo, że poziom leptyny zwiększa się podczas rozwoju otyłości (hiperleptinemia), jednak jednocześnie występuje zmniejszenie wrażliwości na sygnalizację leptyny (tj. Oporność na leptynę) (Hamilton i in., 1995). Zatem jest interesującą możliwością, że zmniejszenie sygnalizacji D2R w prążkowiu podczas rozwoju otyłości może stanowić kompensacyjną odpowiedź na nadmierne spożycie smacznego pokarmu i przyrost masy ciała, który zwiększa poziomy leptyny w krążeniu i zwiększa jej skuteczność sygnalizacyjną w celu przezwyciężenia rozwoju oporności na leptynę. Takie działanie może zwiększyć hamujące działanie leptyny na układy prążkowia, które regulują reakcję na smaczny pokarm ([Farooqi i in., 2007], [Fulton i in., 2006] i [Hommel i in., 2006]), tym samym działając złagodzić hedoniczne reakcje na smaczne jedzenie. Biorąc to pod uwagę wraz z opisaną powyżej regulacyjną rolą leptyny na D2R, wydaje się, że sygnalizacja leptyną i D2R może być sprzężona w sposób wzajemny, aby regulować homeostatyczne i hedoniczne aspekty zachowania żywieniowego.
Dysregulowane systemy stresu mózgowego w otyłości
Sygnalizacja leptyny w śródmózgowiu reguluje transmisję dopaminy mesoaccumbens i reakcję na żywność hedoniczną. Jednak neurony w VTA, które wyrażają receptory leptyny, wystrzeliwują rzadko do NAc, a zamiast tego demonstrują bardziej widoczne projekcje do jądra centralnego ciała migdałowatego (CeA) (Leshan i in., 2010). W kontekście zachowania żywieniowego wiadomo, że CeA reguluje hamujące działanie szkodliwych bodźców środowiskowych na spożycie żywności (Petrovich i in., 2009). W szczególności, zmiany CeA, ale nie podstawno-boczne ciało migdałowate (BLA), znoszą hamujący wpływ warunkowanego stopą warunkowanego bodźca na karmienie, co sugeruje, że CeA jest krytyczny dla hamowania kontroli nad sposobem żywienia w odpowiedzi na sygnały środowiskowe przewidujące negatywny wynik ( Petrovich i in., 2009). Otyłe szczury lub nieotyłe szczury z prążkowatym powaleniem D2R i dostępem do smacznego jedzenia nadal spożywają smaczne jedzenie w sposób kompulsywny w obecności awersyjnego CS. Efekty te są uderzająco podobne do zakłócenia reaktywności na awersyjny CS u szczurów z uszkodzeniem CeA (Petrovich i in., 2009). Dlatego ważne będzie określenie, czy zmiany aktywności CeA, być może w wyniku obniżenia poziomu prążkowia D2R lub rozwoju oporności na leptynę w śródmózgowiu, przyczyniają się do pojawienia się kompulsywnego jedzenia u otyłych szczurów.
Oprócz regulowania wpływu szkodliwych bodźców środowiskowych na zachowania żywieniowe, CeA może również odgrywać kluczową rolę w hedonicznym jedzeniu związanym ze stresem. U ludzi stres silnie motywuje do wyboru i spożycia wysokokalorycznej, smacznej żywności o dużej zawartości energii ([Gluck i in., 2004], [Kandiah i in., 2006] oraz [O'Connor i in., 2008]) , a otyłość jest związana z podwyższonym wydzielaniem glukokortykoidów związanym ze stresem ([Björntorp i Rosmond, 2000] i [la Fleur, 2006]). Stresory środowiskowe i społeczne również wywołują hiperfagię gęstego energetycznie smacznego pożywienia u gryzoni i małp, przy smacznym spożyciu pokarmu potencjalnie łagodzącym niekorzystne skutki stresu ([Dallman et al., 2003], [Dallman et al., 2006], [Pecoraro et in., 2004] i [Wilson i in., 2008]). Co więcej, wywołujący stres lek johimbina może przywrócić wcześniej wygaszone reakcje w poszukiwaniu smacznego pożywienia (naciskanie dźwigni) u szczurów, efekt osłabiany przez antalarminę, antagonistę receptora czynnika uwalniającego kortykotropinę-1 (CRF-1) (Ghitza i in., 2006 ). Należy zwrócić uwagę, że dokładny wpływ stresu na spożycie żywności u ludzi i zwierząt laboratoryjnych zależy od charakteru i wielkości stresora, rodzaju żywności dostępnej do spożycia (smaczna kontra mdła), masy ciała i płci (Dallman , 2010).
Myszy o rozszerzonym dostępie do smacznej wysokotłuszczowej diety miały obniżoną ekspresję hormonu stresu CRF w CeA (Teegarden i Bale, 2007). I odwrotnie, myszy poddane „wycofaniu” z smacznej diety zwiększyły ekspresję CRF w CeA (Teegarden i Bale, 2007). Ten ostatni efekt jest bardzo podobny do zwiększonej ekspresji CRF w CeA wykrytej u szczurów przechodzących odstawienie od wszystkich głównych leków nadużywających (Koob, 2010). Ponieważ dalsze stosowanie leków może znormalizować tę awersyjną odpowiedź neurobiologiczną na odstawienie leku, wysunięto hipotezę, że hiperaktywna transmisja CRF w CeA i innych strukturach limbicznych może ułatwiać rozwój kompulsywnego zażywania narkotyków (Koob i Zorrilla, 2010). Zgodnie z tym poglądem, myszy poddające się wycofaniu z smacznego pokarmu o dużej gęstości energii, które miały podwyższony poziom CRF w CeA, spędzały znacznie więcej czasu w środowisku awersyjnym (jasno oświetlonym), aby uzyskać smaczny pokarm niż myszy bez wcześniejszego doświadczenia z jedzeniem, nawet choć mniej smaczny był dostępny w środowisku nieoświetlonym (ciemno oświetlone) (Teegarden i Bale, 2007). Myszy stają się zatem odporne na potencjalnie negatywne konsekwencje ich żerowania i ryzykują drapieżnictwo w celu uzyskania smacznego jedzenia, nawet jeśli mniej smaczne jedzenie jest dostępne przy znacznie niższym ryzyku, częściowo w celu złagodzenia transmisji CRF w CeA (Teegarden i Bale, 2007). Kilka innych dowodów potwierdza rolę transmisji CRF w kompulsywnym jedzeniu. W szczególności, ostatnie badanie oceniało wpływ antagonisty receptora CRF-1, R121919, na spożycie pokarmu u szczurów przechodzących cykliczne zmiany w diecie, w których mieli oni dostęp do standardowych chow 5 dni w tygodniu i dostęp do smacznej diety cukrowej 2 dni na tydzień (Cottone i in., 2009). Po tygodniach 7 tej cyklicznej zmienności w diecie, R121919 osłabił nadmierne spożycie bardzo smacznej diety i zwiększone spożycie słodkiej karmy (Cottone i in., 2009). Ponadto, poziomy ekspresji CRF w CeA były zwiększone u cyklicznie szczurów podczas wycofywania z diety smacznej, ale powróciły do poziomów wyjściowych po ponownej ekspozycji na smaczną dietę (Cottone i in., 2009). Ostatecznie, regulacja CRF transmisji GABAergicznej w CeA była wzmocniona u szczurów poddawanych cyklicznemu odstawianiu z diety smacznej w porównaniu ze szczurami kontrolnymi, które wcześniej miały dostęp tylko do łagodnej karmy, odzwierciedlone w fakcie, że R121919 zakłócał wywołane hamujące GABAergiczne potynaptyczne możliwości CeA skrawki od cyklicznie szczurów w stężeniu, które nie zmieniało transmisji w skrawkach od szczurów kontrolnych (Cottone i wsp., 2009). Co ciekawe, podobny efekt CRF na transmisję GABAergiczną w CeA zaobserwowano również u szczurów przechodzących odstawienie od chronicznej ekspozycji na etanol (Roberto i in., 2010). Wreszcie, CeA, jądro łóżkowe w terminalnej błonie śluzowej (BNST) i powłoka NAc stanowią większą ciągłą strukturę nazywaną „rozszerzonym ciałem migdałowatym”. Infuzja CRF do powłoki NAc w miejscach, które stymulują jedzenie hedoniczne, zwiększa motywacyjne znaczenie środowiska sygnał, który wcześniej był połączony z dostępnością smacznego jedzenia (Peciña i in., 2006a). Stres może zatem zwiększać istotność sygnałów środowiskowych sparowanych przez żywność poprzez modulowanie aktywności neuronów powłoki NAc. Podsumowując, odkrycia te sugerują, że spożywanie smacznych potraw lub nadużywanie nadmiernej konsumpcji może wywoływać podobne reakcje neuroadaptacyjne w szlakach stresu pozapodstawowego w mózgu, co może przyczyniać się do kompulsywnych zachowań konsumpcyjnych.
wnioski
Ostatnio poczyniono znaczne postępy w identyfikacji układów mózgowych zaangażowanych w hedoniczne działanie smacznego pożywienia i adaptacji zachodzących w tych obwodach w odpowiedzi na nadmierne spożycie smacznego pożywienia i przyrost masy ciała. Uderzające jest to, że podobne systemy mózgowe i wspólne reakcje adaptacyjne są wyzwalane w odpowiedzi na spożycie zarówno smacznej żywności, jak i uzależniających narkotyków. W szczególności nadmierne spożycie smacznego pożywienia lub narkotyków wywołuje podobne deficyty w odpowiedzi mózgowych układów nagrody. Smakowite jedzenie i uzależniające leki powodują deficyty w przenoszeniu dopaminy w prążkowiu i ekspresji D2R w prążkowiu. Smakowite jedzenie i uzależniające narkotyki powodują również pojawienie się kompulsywnych zachowań konsumujących u gryzoni i wywołują pozawzgórze odpowiedzi na stres. Wreszcie, powszechne genetyczne słabości w mózgowych układach nagrody mogą predysponować jednostki do przejadania się i otyłości, a także do używania narkotyków i uzależnienia. W rzeczywistości, na podstawie tych i innych podobieństw między otyłością a uzależnieniem od narkotyków, argumentowano, że otyłość powinna zostać uwzględniona jako kategoria diagnostyczna w nadchodzącym DSM-V ([Devlin, 2007] i [Volkow i O'Brien, 2007] ). Mając to na uwadze, kluczowe obszary przyszłych badań będą obejmować dalsze badanie potencjalnych neurobiologicznych pokryć się kompulsywnego przejadania się i używania narkotyków. Na przykład ważne będzie zbadanie, czy otyłość jest związana z rozwojem zachowań konsumpcyjnych podobnych do nawyków wynikających z plastyczności prążkowia grzbietowego w taki sam sposób, w jaki uzależnienie od narkotyków może być związane z przebudową prążkowia i pojawieniem się nawykowego poszukiwania narkotyków zachowania ([Everitt i Robbins, 2005], [Hollander i in., 2010] oraz [Kasanetz i in., 2010]). Również korowe regiony mózgu zaangażowane w kontrolę wykonawczą i podejmowanie decyzji (tj. Kora przedczołowa) oraz w przetwarzanie interoceptywne (kora wyspowa) są silnie zaangażowane w uzależnienie od narkotyków ([Everitt i in., 2008], [Fineberg i in., 2010 ], [Koob i Volkow, 2010] oraz [Naqvi i Bechara, 2009]), jednak niewiele wiadomo na temat ich dokładnej roli w kompulsywnym jedzeniu i otyłości, np. ([Nair et al., 2011] i [Volkow et al. , 2009]). Podsumowując, przeanalizowane powyżej dane potwierdzają pogląd, że otyłość i uzależnienie od narkotyków mogą wynikać z podobnych reakcji neuroadaptacyjnych w obwodach nagrody w mózgu, i sugerują, że znane mechanizmy uzależnienia mogą stanowić heurystyczne ramy dla zrozumienia otyłości.
Podziękowanie
Autor jest wspierany przez granty z Narodowego Instytutu Narkotyków (NIDA). Autor jest wdzięczny Paulowi Johnsonowi i Christie Fowler za cenne spostrzeżenia i komentarze do manuskryptu. To numer manuskryptu 21042 z The Scripps Research Institute.
Referencje
1.
o Abizaid i in., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Myśli o pożywieniu: mechanizmy mózgu i bilans energii obwodowej
o Neuron, 51 (2006), str. 691 – 702
o
2.
o Abizaid i in., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp i in.
o Grelina moduluje aktywność i synaptyczną organizację wprowadzania neuronów dopaminowych śródmózgowia, jednocześnie promując apetyt
o J. Clin. Invest., 116 (2006), str. 3229 – 3239
o
3.
o Ahmed i Koob, 1998
o SH Ahmed, GF Koob
o Przejście od umiarkowanego do nadmiernego przyjmowania leków: zmiana wartości hedonicznej
o Science, 282 (1998), str. 298 – 300
o
4.
o Ahmed i Koob, 2005
o SH Ahmed, GF Koob
o Przejście do narkomanii: negatywny model wzmacniania oparty na allostatycznym zmniejszeniu funkcji nagrody
o Psychopharmacology (Berl.), 180 (2005), str. 473 – 490
o
5.
o Ahmed i in., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Dowody neurobiologiczne na allostazę hedoniczną związaną z nasilającym się zażywaniem kokainy
o Nat. Neurosci., 5 (2002), str. 625 – 626
o
6.
o Allison i in., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItallie
o Roczne zgony związane z otyłością w Stanach Zjednoczonych
o JAMA, 282 (1999), str. 1530 – 1538
o
7.
o Amerykańskie Stowarzyszenie Psychiatryczne, 1994
o Amerykańskie Stowarzyszenie Psychiatryczne
o Podręcznik diagnostyczny i statystyczny zaburzeń psychicznych
o (czwarta edycja) American Psychiatric Association, Washington, DC (1994)
o
8.
o Angeles-Castellanos i in., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Ograniczone harmonogramy karmienia zmiany rytmu dziennego rytmu immunoreaktywności c-Fos i białka Per1 w regionach kortykolimbicznych u szczurów
o Neuroscience, 144 (2007), str. 344 – 355
o
9.
o Baicy i in., 2007
o K. Baicy, ED London, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
o Zastępowanie leptyny zmienia odpowiedź mózgu na sygnały pokarmowe u dorosłych z niedoborem leptyny
o Proc. Natl. Acad. Sci. USA, 104 (2007), str. 18276 – 18279
o
10.
o Baldo i in., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Aktywacja subpopulacji neuronów podwzgórza zawierających oreksynę / hipokretynę za pośrednictwem hamowania za pośrednictwem receptora GABAA jądra półleżącego, ale nie poprzez ekspozycję na nowe środowisko
o Eur. J. Neurosci., 19 (2004), str. 376 – 386
o
11.
o Balleine i Dickinson, 2000
o BW Balleine, A. Dickinson
o Wpływ uszkodzeń kory wyspowej na uwarunkowania instrumentalne: dowody na rolę w pamięci motywacyjnej
o J. Neurosci., 20 (2000), str. 8954 – 8964
o
12.
o Barnard i in., 2009
o ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o Polimorfizm D2 receptora dopaminy Taq1A, masa ciała i spożycie w cukrzycy typu 2
o Odżywianie, 25 (2009), str. 58 – 65
o
13.
o Basso i Kelley, 1999
o AM Basso, AE Kelley
o Karmienie indukowane przez stymulację receptora GABA (A) w jądrze półleżącym: regionalne mapowanie i charakterystyka preferencji makroskładników i smaku
o Behav. Neurosci., 113 (1999), str. 324 – 336
o
14.
o Batterham i in., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
o Modulacja PYY obszarów mózgu korowych i podwzgórzowych przewiduje zachowania żywieniowe u ludzi
o Nature, 450 (2007), str. 106 – 109
o
15.
o Baxter i Murray, 2002
o MG Baxter, EA Murray
o Ciało migdałowate i nagroda
o Nat. Rev. Neurosci., 3 (2002), str. 563 – 573
o
16.
o Bean i in., 2008
o MK Bean, K. Stewart, ME Olbrisch
o Otyłość w Ameryce: implikacje dla psychologów klinicznych i zdrowotnych
o J. Clin. Psychol. Med. Ustawienia, 15 (2008), str. 214 – 224
o
17.
o Beaver i in., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Różnice indywidualne w nagradzaniu przewidują reakcje neuronalne na obrazy żywności
o J. Neurosci., 26 (2006), str. 5160 – 5166
o
18.
o Belin i in., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Wysoka impulsywność przewiduje zmianę na kompulsywne przyjmowanie kokainy
o Science, 320 (2008), str. 1352 – 1355
o
19.
o Berridge, 1996
o KC Berridge
o Nagroda żywieniowa: substraty mózgowe o chęci i sympatii
o Neurosci. Biobehav. Rev., 20 (1996), str. 1 – 25
o
20.
o Berridge, 2009
o KC Berridge
o „Lubienie” i „pragnienie” nagrody żywnościowej: substraty mózgowe i role w zaburzeniach odżywiania
o Physiol. Behav., 97 (2009), str. 537 – 550
o
21.
o Björntorp i Rosmond, 2000
o P. Björntorp, R. Rosmond
o Otyłość i kortyzol
o Odżywianie, 16 (2000), str. 924 – 936
o
22.
o Blundell i Herberg, 1968
o JE Blundell, LJ Herberg
o Względny wpływ deficytu żywieniowego i okresu deprywacji na szybkość samo-stymulacji elektrycznej podwzgórza bocznego
o Nature, 219 (1968), str. 627 – 628
o
23.
o Booth i in., 2008
o ML Booth, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Postrzeganie młodzieży z nadwagą i otyłością: waga badania opinii
o J. Paediatr. Zdrowie dzieci, 44 (2008), str. 248 – 252
o
24.
o Bragulat i in., 2010
o V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Związane z żywnością sondy zapachowe układów mózgowych podczas głodu: pilotażowe badanie fMRI
o Otyłość, Silver Spring, MD (2010)
o
25.
o Cabanac i Johnson, 1983
o M. Cabanac, KG Johnson
o Analiza konfliktu między smakowitością a ekspozycją na zimno u szczurów
o Physiol. Behav., 31 (1983), str. 249 – 253
o
26.
o Campfield i in., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Rekombinowane mysie białko OB: dowód na obwodowy sygnał łączący otyłość i centralne sieci neuronowe
o Science, 269 (1995), str. 546 – 549
o
27.
o Cannon i Palmiter, 2003
o CM Cannon, RD Palmiter
o Nagroda bez dopaminy
o J. Neurosci., 23 (2003), str. 10827 – 10831
o
28.
o Carr i Simon, 1984
o KD Carr, EJ Simon
o Potencjał nagrody przez głód to mediacja opioidowa
o Brain Res., 297 (1984), str. 369 – 373
o
29.
o Centra kontroli i zapobiegania chorobom, 2009
o Centra kontroli i zapobiegania chorobom (2009). Trendy w otyłości w USA (Atlanta: Centres for Disease Control and Prevention).
o
30.
o Colantuoni i in., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Nadmierne spożycie cukru zmienia wiązanie z dopaminą i receptorami opioidowymi mu w mózgu
o Neuroreport, 12 (2001), str. 3549 – 3552
o
31.
o Cornelius i in., 2010
o JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o Zaburzenia kontroli impulsów z zastosowaniem środków dopaminergicznych w zespole niespokojnych nóg: badanie kliniczno-kontrolne
o Sleep, 33 (2010), str. 81 – 87
o
32.
o Cornier i in., 2009
o MA Cornier, AK Salzberg, DC Endly, DH Bessesen, DC Rojas, JR Tregellas
o Wpływ przekarmienia na odpowiedź neuronalną na wizualne sygnały pokarmowe u osób cienkich i otyłych
o PLoS ONE, 4 (2009), str. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone i in., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis i in.
o Rekrutacja systemu CRF pośredniczy w ciemnej stronie kompulsywnego jedzenia
o Proc. Natl. Acad. Sci. USA, 106 (2009), str. 20016 – 20020
o
34.
o Dagher, 2009
o A. Dagher
o Neurobiologia apetytu: głód jako uzależnienie
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), str. S30 – S33
o
35.
o Dagher i Robbins, 2009
o A. Dagher, TW Robbins
o Osobowość, uzależnienie, dopamina: spostrzeżenia z choroby Parkinsona
o Neuron, 61 (2009), str. 502 – 510
o
36.
o Dallman, 2010
o MF Dallman
o Otyłość wywołana stresem i emocjonalny układ nerwowy
o Trendy Endocrinol. Metab., 21 (2010), str. 159 – 165
o
37.
o Dallman i in., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Chroniczny stres i otyłość: nowe spojrzenie na „żywność komfortową”
o Proc. Natl. Acad. Sci. USA, 100 (2003), str. 11696 – 11701
o
38.
o Dallman i in., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Glukokortykoidy, przewlekły stres i otyłość
o Prog. Brain Res., 153 (2006), str. 75 – 105
o
39.
o Davis i in., 2004
o C. Davis, S. Strachan, M. Berkson
o Wrażliwość na nagrodę: konsekwencje dla przejadania się i nadwagi
o Apetyt, 42 (2004), str. 131 – 138
o
40.
o Davis i in., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Narażenie na podwyższone poziomy tłuszczu w diecie osłabia nagrodę psychostymulującą i mezolimbiczny obrót dopaminy u szczurów
o Behav. Neurosci., 122 (2008), str. 1257 – 1263
o
41.
o de Araujo i in., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Wykrywanie metaboliczne w układach dopaminowych mózgu
o Probl wyników. Cell Differ., 52 (2010), str. 69 – 86
o
42.
o Delin i in., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o Zachowanie żywieniowe i doświadczenie głodu po operacji pomostowania żołądka z powodu chorobliwej otyłości
o Obes. Surg., 7 (1997), str. 405 – 413
o
43.
o Deroche-Gamonet i in., 2004
o V. Deroche-Gamonet, D. Belin, PV Piazza
o Dowody na zachowanie podobne do uzależnienia u szczura
o Science, 305 (2004), str. 1014 – 1017
o
44.
o Devlin, 2007
o MJ Devlin
o Czy w DSM-V jest miejsce na otyłość?
o Int. J. Jedz. Disord., 40 (Suppl) (2007), str. S83 – S88
o
45.
o Doknic i in., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
o Ton dopaminergiczny i otyłość: wgląd z prolactinomas leczonych bromokryptyną
o Eur. J. Endocrinol., 147 (2002), str. 77 – 84
o
46.
o Everitt i Robbins, 2005
o BJ Everitt, TW Robbins
o Neuronowe systemy wzmacniania uzależnienia od narkotyków: od działań do nawyków do przymusu
o Nat. Neurosci., 8 (2005), str. 1481 – 1489
o
47.
o Everitt i in., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Przegląd. Mechanizmy neuronalne leżące u podstaw podatności na rozwój kompulsywnych nawyków i uzależnienia od narkotyków
o Filos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), str. 3125 – 3135
o
48.
o Farooqi i in., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o Leptyna reguluje regiony prążkowia i zachowania żywieniowe człowieka
o Science, 317 (2007), s. 1355
o
49.
o Felsted i in., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Small
o Genetycznie określone różnice w odpowiedzi mózgu na główną nagrodę pokarmową
o J. Neurosci., 30 (2010), str. 2428 – 2432
o
50.
o Figlewicz i in., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
o Leptyna odwraca preferencje miejsca uwarunkowane sacharozą u szczurów z ograniczoną żywnością
o Physiol. Behav., 73 (2001), str. 229 – 234
o
51.
o Figlewicz i in., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Ekspresja receptorów insuliny i leptyny w brzusznym obszarze nakrywkowym / istocie czarnej (VTA / SN) szczura
o Brain Res., 964 (2003), str. 107 – 115
o
52.
o Fineberg i in., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o Sondowanie kompulsywnych i impulsywnych zachowań, od modeli zwierzęcych po endofenotypy: przegląd narracyjny
o Neuropsychofarmakologia, 35 (2010), str. 591 – 604
o
53.
o Finkelstein i in., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
o Przyczyny ekonomiczne i konsekwencje otyłości
o Annu. Rev. Public Health, 26 (2005), str. 239 – 257
o
54.
o Flegal i in., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Częstość występowania i tendencje w otyłości wśród dorosłych w USA, 1999-2008
o JAMA, 303 (2010), str. 235 – 241
o
55.
o Foo i Mason, 2005
o H. Foo, P. Mason
o Tłumienie sensoryczne podczas karmienia
o Proc. Natl. Acad. Sci. USA, 102 (2005), str. 16865 – 16869
o
56.
o Franken i Muris, 2005
o IH Franken, P. Muris
o Indywidualne różnice w wrażliwości na nagrody są związane z głodem żywności i względną masą ciała u zdrowych kobiet
o Apetyt, 45 (2005), str. 198 – 201
o
57.
o Friedman i in., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o Elektryczna stymulacja bocznego habenula wywołuje efekt hamujący samopodawanie sacharozy
o Neuropharmakologia, 60 (2011), str. 381 – 387
o
58.
o Fulton i in., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modulacja mózgowego obwodu nagrody przez leptynę
o Science, 287 (2000), str. 125 – 128
o
59.
o Fulton i in., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Regulacja leptyny szlaku dopaminowego mesoaccumbens
o Neuron, 51 (2006), str. 811 – 822
o
60.
o Gao i Horvath, 2007
o Q. Gao, TL Horvath
o Neurobiologia wydatkowania pokarmu i energii
o Annu. Rev. Neurosci., 30 (2007), str. 367 – 398
o
61.
o Gautier i in., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
o Różnicowe reakcje mózgu na nasycenie u otyłych i chudych mężczyzn
o Cukrzyca, 49 (2000), str. 838 – 846
o
62.
o Geiger i in., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Dowody na wadliwą mezolimbiczną egzocytozę dopaminy u szczurów podatnych na otyłość
o FASEB J., 22 (2008), str. 2740 – 2746
o
63.
o Geiger i in., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Deficyty mezolimbicznej neurotransmisji dopaminy w otyłości dietetycznej u szczurów
o Neuroscience, 159 (2009), str. 1193 – 1199
o
64.
o Ghitza i in., 2006
o UE Ghitza, SM Gray, DH Epstein, KC Rice, Y. Shaham
o Neuropsychofarmakologia
o Anksjogenny lek Johimbina przywraca smakowite pożywienie w modelu nawrotu u szczurów: rola receptorów CRF (1), 33 (2006), str. 2188 – 2196
o
65.
o Gluck i in., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Kortyzol, głód i chęć do objadania się po zimnym teście stresowym u otyłych kobiet z zaburzeniami objadania się
o Psychosom. Med., 66 (2004), str. 876 – 881
o
66.
o Goldstone i in., 2009
o AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
o Post wpływa na system nagradzania mózgu w kierunku wysokokalorycznych pokarmów
o Eur. J. Neurosci., 30 (2009), str. 1625 – 1635
o
67.
o Halaas i in., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Obniżające masę działanie białka osocza kodowanego przez gen otyłości
o Science, 269 (1995), str. 543 – 546
o
68.
o Hamilton i in., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Zwiększona ekspresja otyłego mRNA w komórkach tłuszczowych ominalnych u ludzi masywnie otyłych
o Nat. Med., 1 (1995), str. 953 – 956
o
69.
o Hernandez i Hoebel, 1988
o L. Hernandez, BG Hoebel
o Nagroda pokarmowa i kokaina zwiększają pozakomórkową dopaminę w jądrze półleżącym, jak zmierzono metodą mikrodializy
o Life Sci., 42 (1988), str. 1705 – 1712
o
70.
o Hill i in., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Otyłość i środowisko: skąd idziemy?
o Science, 299 (2003), str. 853 – 855
o
71.
o Hoebel, 1969
o BG Hoebel
o Karmienie i autostymulacja
o Ann. NY Acad. Sci., 157 (1969), str. 758 – 778
o
72.
o Hoebel i Balagura, 1967
o BG Hoebel, S. Balagura
o Samostymulacja bocznego podwzgórza zmodyfikowanego insuliną i glukagonem
o Physiol. Behav., 2 (1967), str. 337 – 340
o
73.
o Hoebel i Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Niedoczynna kontrola żywienia i stymulacji własnej
o Science, 135 (1962), str. 375 – 377
o
74.
o Hoebel i Thompson, 1969
o BG Hoebel, RD Thompson
o Niechęć do pobudzenia bocznego podwzgórza spowodowanego przez żywienie wewnątrzżołądkowe lub otyłość
o J. Comp. Physiol. Psychol., 68 (1969), str. 536 – 543
o
75.
o Hofmann i in., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o W miarę przyjemności: hedoniczne reakcje na kuszące jedzenie
o Psychol. Sci., 21 (2010), str. 1863 – 1870
o
76.
o Holland i Gallagher, 2004
o PC Holland, M. Gallagher
o Interakcje ammydalno-czołowe i oczekiwanie nagrody
o Curr. Opin. Neurobiol., 14 (2004), str. 148 – 155
o
77.
o Hollander i in., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o Striatal microRNA kontroluje spożycie kokainy poprzez sygnalizację CREB
o Nature, 466 (2010), str. 197 – 202
o
78.
o Hommel i in., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o Sygnalizacja receptora leptyny w neuronach dopaminowych śródmózgowia reguluje karmienie
o Neuron, 51 (2006), str. 801 – 810
o
79.
o Imaizumi i in., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Preferowanie wysokotłuszczowej żywności u myszy: Smażone ziemniaki w porównaniu z gotowanymi ziemniakami
o Apetyt, 36 (2001), str. 237 – 238
o
80.
o Jerlhag i in., 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Grelina stymuluje aktywność lokomotoryczną i akumulację dopaminy w ośrodkowym układzie nerwowym przez centralne układy cholinergiczne u myszy: implikacje dla jej udziału w nagradzaniu mózgu
o Uzależniony. Biol., 11 (2006), str. 45 – 54
o
81.
o Jerlhag i in., 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o Podawanie greliny w obszary nakrywkowe stymuluje aktywność lokomotoryczną i zwiększa pozakomórkowe stężenie dopaminy w jądrze półleżącym
o Uzależniony. Biol., 12 (2007), str. 6 – 16
o
82.
o Jhou i in., 2009
o TC Jhou, HL Fields, MG Baxter, CB Saper, PC Holland
o Rostromedialne jądro nakrywkowe (RMTg), doprowadzające GABAergiczne neurony dopaminowe śródmózgowia, koduje bodźce awersyjne i hamuje reakcje ruchowe
o Neuron, 61 (2009), str. 786 – 800
o
83.
o Johnson i Kenny, 2010
o PM Johnson, PJ Kenny
o Receptory dopaminy D2 w dysfunkcji nagradzania podobnej do uzależnienia i kompulsywnym jedzeniu u otyłych szczurów
o Nat. Neurosci., 13 (2010), str. 635 – 641
o
84.
o Johnson i in., 1996
o PI Johnson, MA Parente, JR Stellar
o Zmiany wywołane przez NMDA jądra półleżącego lub bladej części brzusznej zwiększają skuteczność nagradzania pokarmu dla pozbawionych szczurów
o Brain Res., 722 (1996), str. 109 – 117
o
85.
o Jönsson i in., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polimorfizmy w genie receptora dopaminy D2 i ich związki z gęstością receptora dopaminy w prążkowiu zdrowych ochotników
o Mol. Psychiatria, 4 (1999), str. 290 – 296
o
86.
o Kalarchian i in., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Obżarstwo u pacjentów z pomostowaniem żołądka w długoterminowej obserwacji
o Obes. Surg., 12 (2002), str. 270 – 275
o
87.
o Kandiah i in., 2006
o J. Kandiah, M. Yake, J. Jones, M. Meyer
o Stres wpływa na apetyt i komfort jedzenia u kobiet w college'u
o Nutr. Res., 26 (2006), str. 118 – 123
o
88.
o Karhunen i in., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o Regionalny przepływ krwi mózgowej podczas ekspozycji na pokarm u otyłych i kobiet o normalnej wadze
o Mózg, 120 (1997), str. 1675 – 1684
o
89.
o Kasanetz i in., 2010
o F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o Przejście na uzależnienie wiąże się z uporczywym upośledzeniem plastyczności synaptycznej
o Science, 328 (2010), str. 1709 – 1712
o
90.
o Kelley i in., 1996
o AE Kelley, EP Bless, CJ Swanson
o Badanie wpływu antagonistów opiatów wlewanych do jądra półleżącego podczas karmienia i sacharozy pijącej u szczurów
o J. Pharmacol. Exp. Ther., 278 (1996), str. 1499 – 1507
o
91.
o Kelley i in., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Obwody korowo-prążkowato-podwzgórzowe i motywacja pokarmowa: integracja energii, działania i nagrody
o Physiol. Behav., 86 (2005), str. 773 – 795
o
92.
o Kenny i in., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Warunkowe wycofanie napędza konsumpcję heroiny i zmniejsza wrażliwość na nagrody
o J. Neurosci., 26 (2006), str. 5894 – 5900
o
93.
o Kim i in., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Ulepszona sygnalizacja leptyny podwzgórza u myszy bez receptorów dopaminy D2
o J. Biol. Chem., 285 (2010), str. 8905 – 8917
o
94.
o Klein i in., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Genetycznie określone różnice w uczeniu się na błędach
o Science, 318 (2007), str. 1642 – 1645
o
95.
o Kojima i in., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o Grelina jest acylowanym peptydem uwalniającym hormon wzrostu z żołądka
o Nature, 402 (1999), str. 656 – 660
o
96.
o Kok i in., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o Aktywacja receptorów dopaminergicznych D2 obniża dobowe stężenia leptyny u otyłych kobiet
o J. Clin. Endokrynol. Metab., 91 (2006), str. 3236 – 3240
o
97.
o Koob, 2010
o GF Koob
o Rola CRF i peptydów związanych z CRF w ciemnej stronie uzależnienia
o Brain Res., 1314 (2010), str. 3 – 14
o
98.
o Koob i Le Moal, 2008
o GF Koob, M. Le Moal
o Uzależnienie i system antireward mózgu
o Annu. Rev. Psychol., 59 (2008), str. 29 – 53
o
99.
o Koob i Volkow, 2010
o GF Koob, ND Volkow
o Neurocircuitry uzależnienia
o Neuropsychofarmakologia, 35 (2010), str. 217 – 238
o
100.
o Koob i Zorrilla, 2010
o GF Koob, EP Zorrilla
o Neurobiologiczne mechanizmy uzależnienia: skupienie się na czynniku uwalniającym kortykotropinę
o Curr. Opin. Zainwestuj. Drugs, 11 (2010), str. 63 – 71
o
101.
o Kringelbach i in., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o Aktywacja ludzkiej kory oczodołowo-czołowej do płynnego bodźca pokarmowego jest skorelowana z jej subiektywną przyjemnością
o Cereb. Kora, 13 (2003), str. 1064 – 1071
o
102.
o Krügel i in., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o Leptyna powoduje obniżenie uwalniania dopaminy w jądrze półleżącym u szczurów półleżących
o Eur. J. Pharmacol., 482 (2003), str. 185 – 187
o
103.
o la Fleur, 2006
o SE la Fleur
o Wpływ glukokortykoidów na zachowanie żywieniowe u szczurów
o Physiol. Behav., 89 (2006), str. 110 – 114
o
104.
o LaBar i in., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o Głód selektywnie moduluje aktywację kortykolimbiczną na bodźce pokarmowe u ludzi
o Behav. Neurosci., 115 (2001), str. 493 – 500
o
105.
o Latagliata i in., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o Poszukiwanie pożywienia pomimo szkodliwych konsekwencji odbywa się pod przedczołową korową kontrolą noradrenergiczną
o BMC Neurosci., 11 (2010), s. 15
o
106.
o Lawford i in., 2000
o BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o Allel receptora dopaminy D (2) A (1) i uzależnienie od opioidów: związek z używaniem heroiny i reakcja na leczenie metadonem
o Am. J. Med. Genet., 96 (2000), str. 592 – 598
o
107.
o Leinninger i in., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong i in.
o Leptyna działa poprzez wyrażające receptory leptyny boczne neurony podwzgórza w celu modulowania mezolimbicznego układu dopaminowego i tłumienia karmienia
o Cell Metab., 10 (2009), str. 89 – 98
o
108.
o Lenoir i in., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Intensywna słodycz przewyższa nagrodę kokainową
o PLoS ONE, 2 (2007), str. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan i in., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Neurony receptora leptyny w okolicy brzusznej nakrywki specyficznie projektują i regulują regulowane kokainą i amfetaminą neurony transkrypcyjne rozszerzonego centralnego ciała migdałowatego
o J. Neurosci., 30 (2010), str. 5713 – 5723
o
110.
o Louis i in., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Bezpośrednie unerwienie i modulacja neuronów oreksynowych przez boczne podwzgórzowe neurony LepRb
o J. Neurosci., 30 (2010), str. 11278 – 11287
o
111.
o Luppino i in., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Nadwaga, otyłość i depresja: przegląd systematyczny i metaanaliza badań podłużnych
o Arch. Gen. Psychiatry, 67 (2010), str. 220 – 229
o
112.
o Lutter i Nestler, 2009
o M. Lutter, EJ Nestler
o Sygnały homeostatyczne i hedoniczne współdziałają w regulacji spożycia żywności
o J. Nutr., 139 (2009), str. 629 – 632
o
113.
o Macht i Mueller, 2007
o M. Macht, J. Mueller
o Natychmiastowe działanie czekolady na eksperymentalnie wywołane stany nastroju
o Apetyt, 49 (2007), str. 667 – 674
o
114.
o Maldonado-Irizarry i Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Ekscytotoksyczne uszkodzenia podregionów jądra i skorupy jądra półleżącego różnie zaburzają regulację masy ciała i aktywność motoryczną u szczurów
o Brain Res. Bull., 38 (1995), str. 551 – 559
o
115.
o Maldonado-Irizarry i in., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Receptory glutaminianowe w powłoce jądra półleżącego kontrolują zachowanie żywieniowe poprzez boczne podwzgórze
o J. Neurosci., 15 (1995), str. 6779 – 6788
o
116.
o Malik i in., 2008
o S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o Grelina moduluje aktywność mózgu w obszarach kontrolujących zachowania apetyczne
o Cell Metab., 7 (2008), str. 400 – 409
o
117.
o Man i in., 2009
o MS Man, HF Clarke, AC Roberts
o Rola kory oczodołowo-czołowej i prążkowia przyśrodkowego w regulowaniu reakcji preotencyjnych na nagrody pokarmowe
o Cereb. Kora, 19 (2009), str. 899 – 906
o
118.
o Margules i Olds, 1962
o DL Margules, J. Olds
o Identyczne systemy „karmienia” i „nagradzania” w bocznym podwzgórzu szczurów
o Science, 135 (1962), str. 374 – 375
o
119.
o Markou i Frank, 1987
o A. Markou, RA Frank
o Efekt umieszczenia operanta i elektrody na funkcjach samowyzwalającego czasu trwania pociągu
o Physiol. Behav., 41 (1987), str. 303 – 308
o
120.
o Markou i Koob, 1991
o A. Markou, GF Koob
o Anhedonia postkokainowa. Zwierzęcy model odstawienia kokainy
o Neuropsychofarmakologia, 4 (1991), str. 17 – 26
o
121.
o Mastronardi i in., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Wywołane lipopolisacharydem uwalnianie leptyny jest kontrolowane neurologicznie
o Proc. Natl. Acad. Sci. USA, 98 (2001), str. 14720 – 14725
o
122.
o Matheny i in., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Oporność na leptynę komórkową wywołaną dietą specyficzną dla regionu i indukowaną leptyną obejmuje brzuszną powierzchnię nakrywkową u szczurów
o Neuropharmacology (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 w prasie. Opublikowane online listopad 5, 2010
o
123.
o Matsumoto i Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Boczna habenula jako źródło negatywnych sygnałów nagrody w neuronach dopaminowych
o Nature, 447 (2007), str. 1111 – 1115
o
124.
o Morton i in., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
o Kontrola przyjmowania pokarmu i masy ciała przez centralny układ nerwowy
o Nature, 443 (2006), str. 289 – 295
o
125.
o Zamontuj i Hoebel, 1967
o G. Mount, BG Hoebel
o Boczna samoistna stymulacja podwzgórza: samookreślony próg zwiększony przez spożycie pokarmu
o Psychon. Sci., 9 (1967), str. 265 – 266
o
126.
o Nair i in., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Rola receptorów dopaminy D1 z rodziny grzbietowej przyśrodkowej kory przedczołowej w nawrotach do poszukiwania pożywienia wysokotłuszczowego wywołanego lekiem anksjogennym johimbiną
o Neuropsychofarmakologia, 36 (2011), str. 497 – 510
o
127.
o Nakazato i in., 2001
o M. Nakazato, N. Murakami, Y. Date, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Rola greliny w centralnej regulacji żywienia
o Nature, 409 (2001), str. 194 – 198
o
128.
o Naqvi i Bechara, 2009
o NH Naqvi, A. Bechara
o Ukryta wyspa uzależnienia: Wyspa
o Trendy Neurosci., 32 (2009), str. 56 – 67
o
129.
o Neville i in., 2004
o MJ Neville, EC Johnstone, RT Walton
o Identyfikacja i charakterystyka ANKK1: nowy gen kinazy blisko związany z DRD2 na paśmie chromosomów 11q23.1
o Hum. Mutat., 23 (2004), str. 540 – 545
o
130.
o Nirenberg i Waters, 2006
o MJ Nirenberg, C. Waters
o Kompulsywne jedzenie i przyrost masy ciała związany z używaniem agonistów dopaminy
o Mov. Disord., 21 (2006), str. 524 – 529
o
131.
o Noble, 2000
o EP Noble
o Uzależnienie i jego proces nagradzania poprzez polimorfizmy genu receptora dopaminy D2: przegląd
o Eur. Psychiatria, 15 (2000), str. 79 – 89
o
132.
o Noble i in., 1993
o EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin i in.
o Powiązanie alleliczne genu receptora dopaminy D2 z uzależnieniem od kokainy
o Drug Alcohol Depend., 33 (1993), str. 271 – 285
o
133.
o Noble i in., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotypy w locus DRD2 i ciężki alkoholizm
o Am. J. Med. Genet., 96 (2000), str. 622 – 631
o
134.
o O'Connor i in., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Wpływ codziennych kłopotów i stylu jedzenia na zachowania żywieniowe
o Psychol zdrowia., 27 (1, Suppl) (2008), str. S20 – S31
o
135.
o O'Doherty i in., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Odpowiedzi neuronowe podczas oczekiwania na główną nagrodę smakową
o Neuron, 33 (2002), str. 815 – 826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o Genetyka człowieka oświetla ścieżki do choroby metabolicznej
o Nature, 462 (2009), str. 307 – 314
o
137.
o Oswald i in., 2010
o KD Oswald, DL Murdaugh, VL King, MM Boggiano
o Motywacja do smacznego jedzenia pomimo konsekwencji w zwierzęcym modelu objadania się
o Int. J. Jedz. Nieład. (2010) http://dx.doi.org/10.1002/eat.20808 w prasie. Opublikowane online Luty 22, 2010
o
138.
o Park i Carr, 1998
o TH Park, KD Carr
o Neuroanatomiczne wzorce immunoreaktywności fosopodobnej indukowanej przez smaczny posiłek i środowisko sparowane posiłkiem u szczurów traktowanych solą fizjologiczną i naltreksonem
o Brain Res., 805 (1998), str. 169 – 180
o
139.
o Peciña i Berridge, 2005
o S. Peciña, KC Berridge
o Hedoniczny gorący punkt w jądrze półleżącym: gdzie opioidy mu-powodują zwiększony hedoniczny wpływ słodyczy?
o J. Neurosci., 25 (2005), str. 11777 – 11786
o
140.
o Peciña i in., 2006a
o S. Peciña, J. Schulkin, KC Berridge
o Jądro półleżące czynnik uwalniający kortykotropinę zwiększa motywację wywoływaną przez cue do nagrody sacharozy: Paradoksalne pozytywne efekty zachęty w stresie?
o BMC Biol., 4 (2006), s. 8
o
141.
o Peciña i in., 2006b
o S. Peciña, KS Smith, KC Berridge
o Hedoniczne gorące punkty w mózgu
o Neurobiolog, 12 (2006), str. 500 – 511
o
142.
o Pecoraro i in., 2004
o N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
o Chroniczny stres sprzyja smacznemu karmieniu, co zmniejsza oznaki stresu: sprzężenie zwrotne i sprzężenie zwrotne przewlekłego stresu
o Endokrynologia, 145 (2004), str. 3754 – 3762
o
143.
o Pelchat i in., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Obrazy pożądania: aktywacja pożądania pokarmu podczas fMRI
o Neuroimage, 23 (2004), str. 1486 – 1493
o
144.
o Pelleymounter i in., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Wpływ produktu genu otyłego na regulację masy ciała u myszy ob / ob
o Science, 269 (1995), str. 540 – 543
o
145.
o Pelloux i in., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Kompulsywne poszukiwanie narkotyków przez szczury pod karą: skutki historii zażywania narkotyków
o Psychopharmacology (Berl.), 194 (2007), str. 127 – 137
o
146.
o Perello i in., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Wołoszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Grelina zwiększa wartość nagrody diety wysokotłuszczowej w sposób zależny od oreksyny
o Biol. Psychiatria, 67 (2010), str. 880 – 886
o
147.
o Petrovich i in., 2009
o GD Petrovich, CA Ross, P. Mody, PC Holland, M. Gallagher
o Środkowe, ale nie bazolateralne ciało migdałowate ma kluczowe znaczenie dla kontroli karmienia przez awersyjne uczone sygnały
o J. Neurosci., 29 (2009), str. 15205 – 15212
o
148.
o Pfaffly i in., 2010
o J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Leptyna zwiększa wiązanie receptora dopaminy D2 w prążkowiu u myszy z otyłością z niedoborem leptyny (ob / ob)
o Synapse, 64 (2010), str. 503 – 510
o
149.
o Puhl i in., 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
o Stygmatyzacja wagi i redukcja uprzedzeń: perspektywy dorosłych z nadwagą i otyłych
o Zdrowie Educ. Res., 23 (2008), str. 347 – 358
o
150.
Rada i in., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Zmniejszona półleżąca dopamina u szczurów Sprague-Dawley podatnych na przejadanie się dietą bogatą w tłuszcze
o Physiol. Behav., 101 (2010), str. 394 – 400
o
151.
o Ritchie and Noble, 2003
o T. Ritchie, EP Noble
o Powiązanie siedmiu polimorfizmów genu receptora dopaminy D2 z właściwościami wiązania receptora mózgu
o Neurochem. Res., 28 (2003), str. 73 – 82
o
152.
o Roberto i in., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla i in.
o Uwalnianie czynnika gamma-aminomasłowego wywołane czynnikiem uwalniającym kortykotropinę odgrywa kluczową rolę w uzależnieniu od alkoholu
o Biol. Psychiatria, 67 (2010), str. 831 – 839
o
153.
o Roitman i in., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o Dopamina działa jako drugi modulator poszukiwania pożywienia
o J. Neurosci., 24 (2004), str. 1265 – 1271
o
154.
o Roitman i in., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Reakcje chemiczne w czasie rzeczywistym w jądrze półleżącym różnicują bodźce nagradzające i awersyjne
o Nat. Neurosci., 11 (2008), str. 1376 – 1377
o
155.
o Rolki, 2008
o Rolls ET
o Funkcje kory oczodołowo-czołowej i pregenualnej zakrętu obręczy w smaku, węchu, apetycie i emocjach
o Acta Physiol. Hung., 95 (2008), str. 131 – 164
o
156.
o Rolki, 2010
o Rolls ET
o Nagroda za smak, zapach i teksturę żywności w mózgu i otyłości
o Int. J. Obes. (Lond.) (2010) http://dx.doi.org/10.1038/ijo.2010.155 w prasie. Opublikowano online Sierpień 3, 2010
o
157.
o Rolls i in., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Sytość specyficzna dla zmysłów i motywacji dla wzroku i smaku żywności i wody u człowieka
o Physiol. Behav., 30 (1983), str. 185 – 192
o
158.
o Roseberry i in., 2007
o AG Roseberry, T. Painter, GP Mark, JT Williams
o Zmniejszone pęcherzykowe zapasy somatodendrytyczne dopaminy u myszy z niedoborem leptyny
o J. Neurosci., 27 (2007), str. 7021 – 7027
o
159.
o Rothemund i in., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Różnicowa aktywacja prążkowia grzbietowego przez wysokokaloryczne bodźce wzrokowe u osób otyłych
o Neuroimage, 37 (2007), str. 410 – 421
o
160.
o Salas i in., 2010
o R. Salas, P. Baldwin, M. de Biasi, PR Montague
o BOLD odpowiedzi na negatywne błędy prognozowania nagród w ludzkim habenula
o Przód. Szum. Neurosci., 4 (2010), str. 36
o
161.
o Saper i in., 2002
o CB Saper, TC Chou, JK Elmquist
o Potrzeba żywienia: homeostatyczna i hedoniczna kontrola jedzenia
o Neuron, 36 (2002), str. 199 – 211
o
162.
o Saunders, 2001
o R. Saunders
o Kompulsywne jedzenie i operacja pomostowania żołądka: Co ma z tym wspólnego głód?
o Obes. Surg., 11 (2001), str. 757 – 761
o
163.
o Scarpace i in., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o Prowadzenie kół eliminuje preferencje związane z wysoką zawartością tłuszczu i wzmacnia sygnalizację leptyny w brzusznej okolicy nakrywki
o Physiol. Behav., 100 (2010), str. 173 – 179
o
164.
o Schiltz i in., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Sygnały związane z żywnością zmieniają łączność funkcjonalną przodomózgowia zgodnie z oceną natychmiastowej wczesnej ekspresji genu i proenkefaliny
o BMC Biol., 5 (2007), s. 16
o
165.
o Schur i in., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Aktywacja w regulacji energii mózgu i ośrodkach nagrody za pomocą sygnałów żywnościowych różni się w zależności od wyboru bodźca wzrokowego
o Int. J. Obes. (Lond.), 33 (2009), str. 653 – 661
o
166.
o Sclafani i in., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Farmakologia preferencji warunkujących żywność
o Apetyt, 31 (1998), str. 406
o
167.
o Sescousse i in., 2010
o G. Sescousse, J. Redouté, JC Dreher
o Architektura kodowania wartości nagrody w ludzkiej korze oczodołowo-czołowej
o J. Neurosci., 30 (2010), str. 13095 – 13104
o
168.
o Shomaker i in., 2010
o LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali i in.
o Jedzenie pod nieobecność głodu u młodzieży: spożycie po posiłku wielkogabarytowym w porównaniu z posiłkiem po standardowym posiłku
o Am. J. Clin. Nutr., 92 (2010), str. 697 – 703
o
169.
o Simmons i in., 2005
o WK Simmons, A. Martin, LW Barsalou
o Zdjęcia apetycznych potraw aktywują kory smakowe dla smaku i nagrody
o Cereb. Kora, 15 (2005), str. 1602 – 1608
o
170.
o Mały, 2010
o DM Mały
o Reprezentacja smaku w ludzkiej wyspie
o Strukturę mózgu. Funkcje, 214 (2010), str. 551 – 561
o
171.
o Small i in., 2003
o DM Small, M. Jones-Gotman, A. Dagher
o Wywołane żywieniem uwalnianie dopaminy w prążkowiu grzbietowym koreluje z ocenami przyjemności posiłku u zdrowych ochotników ludzkich
o Neuroimage, 19 (2003), str. 1709 – 1715
o
172.
o Smith i Berridge, 2007
o KS Smith, KC Berridge
o Opioidowy obwód limbiczny dla nagrody: interakcja między hedonicznymi punktami zapalnym jądra półleżącego a brzuszną bladą
o J. Neurosci., 27 (2007), str. 1594 – 1605
o
173.
o Söderpalm i Berridge, 2000
o AH Söderpalm, KC Berridge
o Spożycie pokarmu po diazepamie, morfinie lub muscimolu: mikrowstrzyknięcia w jądrze półleżącym
o Pharmacol. Biochem. Behav., 66 (2000), str. 429 – 434
o
174.
o Stice i in., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o Relacja między otyłością a osłabioną odpowiedzią prążkowia na pokarm jest moderowana przez allel TaqIA A1
o Science, 322 (2008), str. 449 – 452
o
175.
o Stice i in., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Relacja nagrody od spożycia pokarmu i przewidywanego spożycia pokarmu do otyłości: funkcjonalne badanie obrazowania metodą rezonansu magnetycznego
o J. Abnorm. Psychol., 117 (2008), str. 924 – 935
o
176.
o Stice i in., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o Przyrost masy ciała jest związany ze zmniejszoną odpowiedzią prążkowia na smaczny pokarm
o J. Neurosci., 30 (2010), str. 13105 – 13109
o
177.
o Stice i in., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Reakcja obwodów nagród na żywność przewiduje przyszły wzrost masy ciała: Umiarkowane efekty DRD2 i DRD4
o Neuroimage, 50 (2010), str. 1618 – 1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Zasada otyłości Złotowłosa. Amerykański naukowiec. Czerwiec 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford i Kelley, 1997
o TR Stratford, AE Kelley
o GABA w jądrze półleżącym uczestniczy w centralnej regulacji zachowania żywieniowego
o J. Neurosci., 17 (1997), str. 4434 – 4440
o
180.
o Stratford i Kelley, 1999
o TR Stratford, AE Kelley
o Dowody na funkcjonalną zależność między jądrem półleżącym a bocznym podwzgórzem, podtrzymujące kontrolę zachowania żywieniowego
o J. Neurosci., 19 (1999), str. 11040 – 11048
o
181.
o Suarez i Gallup, 1981
o SD Suarez, GGJ Gallup
o Analiza etologiczna zachowania na otwartym polu u szczurów i myszy
o Ucz się. Motyw., 12 (1981), str. 342 – 363
o
182.
o Sunday i in., 1983
o SR Sunday, SA Sanders, G. Collier
o Smakowność i wzory posiłków
o Physiol. Behav., 30 (1983), str. 915 – 918
o
183.
o Swinburn i in., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o Zwiększone dostawy energii do żywności są więcej niż wystarczające, aby wyjaśnić amerykańską epidemię otyłości
o Am. J. Clin. Nutr., 90 (2009), str. 1453 – 1456
o
184.
o Taha i Fields, 2005
o SA Taha, HL Fields
o Kodowanie smakowitości i zachowań apetycznych przez różne populacje neuronalne w jądrze półleżącym
o J. Neurosci., 25 (2005), str. 1193 – 1202
o
185.
o Taha i in., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
o Obwody zbieżne, nie seryjne, prążkowate i palidalne regulują pobór pokarmu przez opioidy
o Neuroscience, 161 (2009), str. 718 – 733
o
186.
o Teegarden i Bale, 2007
o SL Teegarden, TL Bale
o Zmniejszenie preferencji żywieniowych powoduje wzrost emocjonalności i ryzyka nawrotu diety
o Biol. Psychiatria, 61 (2007), str. 1021 – 1029
o
187.
o Teegarden i in., 2009
o SL Teegarden, AN Scott, TL Bale
o Wczesna ekspozycja na dietę wysokotłuszczową sprzyja długoterminowym zmianom w preferencjach żywieniowych i centralnym sygnalizowaniu nagrody
o Neuroscience, 162 (2009), str. 924 – 932
o
188.
o Thanos i in., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Ograniczenie pokarmu znacznie zwiększa receptor dopaminy D2 (D2R) w szczurzym modelu otyłości, co oceniono za pomocą obrazowania muPET in vivo ([11C] raclopopride) i in vitro ([3H] spiperone) autoradiografii
o Synapse, 62 (2008), str. 50 – 61
o
189.
o Thompson i Swanson, 2010
o RH Thompson, LW Swanson
o Analiza powiązań strukturalnych oparta na hipotezach wspiera sieć nad hierarchicznym modelem architektury mózgu
o Proc. Natl. Acad. Sci. USA, 107 (2010), str. 15235 – 15239
o
190.
o Vanderschuren i Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o Poszukiwanie narkotyków staje się kompulsywne po długotrwałym zażywaniu kokainy
o Science, 305 (2004), str. 1017 – 1019
o
191.
o Vendruscolo i in., 2010a
o LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o Nadmierne spożycie cukru w okresie dojrzewania selektywnie zmienia motywację i funkcję nagrody u dorosłych szczurów
o PLoS ONE, 5 (2010), str. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo i in., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Zmniejszone spożycie alkoholu u dorosłych szczurów narażonych na sacharozę w okresie dojrzewania
o Neuropharmakologia, 59 (2010), str. 388 – 394
o
193.
o Volkow i O'Brien, 2007
o ND Volkow, CP O'Brien
o Zagadnienia związane z DSM-V: Czy otyłość należy zaliczyć do zaburzeń mózgu?
o Am. J. Psychiatry, 164 (2007), str. 708 – 710
o
194.
o Volkow i Wise, 2005
o ND Volkow, RA Wise
o Jak uzależnienie od narkotyków może pomóc nam zrozumieć otyłość?
o Nat. Neurosci., 8 (2005), str. 555 – 560
o
195.
o Volkow i in., 2009
o ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Odwrotny związek między BMI a aktywnością metaboliczną przedczołową u zdrowych dorosłych
o Otyłość (Silver Spring), 17 (2009), str. 60 – 65
o
196.
o Vucetic i Reyes, 2010
o Z. Vucetic, TM Reyes
o Centralne obwody dopaminergiczne kontrolujące przyjmowanie pokarmu i nagrody: implikacje dla regulacji otyłości
o Wiley Interdiscip. Ks. Syst. Biol. Med., 2 (2010), str. 577 – 593
o
197.
o Wang i in., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Mózgowa dopamina i otyłość
o Lancet, 357 (2001), str. 354 – 357
o
198.
o Wang i in., 2002
o GJ Wang, ND Volkow, JS Fowler
o Rola dopaminy w motywacji do pokarmu u ludzi: implikacje dla otyłości
o Expert Opin. Ther. Cele, 6 (2002), str. 601 – 609
o
199.
o Wang i in., 2004a
o GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Ekspozycja na apetyczne bodźce pokarmowe znacznie aktywuje ludzki mózg
o Neuroimage, 21 (2004), str. 1790 – 1797
o
200.
o Wang i in., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Podobieństwo między otyłością a uzależnieniem od narkotyków oceniane na podstawie obrazowania neurofunkcjonalnego: przegląd koncepcji
o J. Addict. Dis., 23 (2004), str. 39 – 53
o
201.
o Wang i in., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Rozdęcie żołądka aktywuje obwód sytości w ludzkim mózgu
o Neuroimage, 39 (2008), str. 1824 – 1831
o
202.
o Wassum i in., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Wyraźne obwody opioidowe określają smakowitość i celowość nagradzania wydarzeń
o Proc. Natl. Acad. Sci. USA, 106 (2009), str. 12512 – 12517
o
203.
o Wassum i in., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
Aktywacja receptora opioidowego μ w bazolateralnym ciele migdałowatym pośredniczy w uczeniu się wzrostu, ale nie zmniejsza wartości motywacyjnej nagrody żywnościowej
o J. Neurosci., 31 (2011), str. 1591 – 1599
o
204.
o Wilkinson i Peele, 1962
o HA Wilkinson, TL Peele
o Modyfikacja samo-stymulacji wewnątrzczaszkowej przez sytość głodu
o Am. J. Physiol., 203 (1962), str. 537 – 540
o
205.
o Will i in., 2003
o MJ Will, EB Franzblau, AE Kelley
o Nukleusowe opioidy mu-opioidowe regulują spożycie wysokotłuszczowej diety poprzez aktywację rozproszonej sieci mózgowej
o J. Neurosci., 23 (2003), str. 2882 – 2888
o
206.
o Wilson i in., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Określenie ilości spożywanego pokarmu u małp społecznych: wpływ statusu społecznego na konsumpcję kalorii
o Physiol. Behav., 94 (2008), str. 586 – 594
o Artykuł | PDF (553 K) |
Zobacz rekord w Scopus
| Cytowane przez in Scopus (22)
207.
o Yurcisin i in., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Otyłość i chirurgia bariatryczna
o Clin. Chest Med., 30 (2009), str. 539 – 553, ix
o
208.
o Zhang i in., 1998
o M. Zhang, BA Gosnell, AE Kelley
o Spożycie wysokotłuszczowej żywności jest selektywnie wzmacniane przez stymulację receptora opioidowego mu w jądrze półleżącym
o J. Pharmacol. Exp. Ther., 285 (1998), str. 908 – 914
o Zobacz rekord w Scopus
| Cytowane przez in Scopus (148)
209.
o Zheng i in., 2007
o H. Zheng, LM Patterson, HR Berthoud
o Sygnalizacja Oreksyny w brzusznym obszarze nakrywkowym jest wymagana dla apetytu o dużej zawartości tłuszczu wywołanego przez stymulację opioidową jądra półleżącego
o J. Neurosci., 27 (2007), str. 11075 – 11082
o Zobacz rekord w Scopus
| Cytowane przez in Scopus (64)
210.
o Zheng i in., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Kontrola apetytu i regulacja bilansu energetycznego we współczesnym świecie: mózg sterowany nagrodami zastępuje sygnały replikacji
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), str. S8 – S13
o Zobacz rekord w Scopus
| Cytowane przez in Scopus (34)