Neurosci Biobehav Rev. 2011 Jan; 35 (3): 939-55. doi: 10.1016 / j.neubiorev.2010.10.014. Epub 2010 Nov 2.
- 1Bernard B. Brodie Katedra Neurologii, Uniwersytet Cagliari, Cittadella Universitaria, 09042 Monserrato, CA, Włochy. [email chroniony]
ABSTRAKCYJNY
Oksytocyna jest silnym induktorem erekcji prącia po wstrzyknięciu do ośrodkowego układu nerwowego. U samców szczurów najbardziej wrażliwym obszarem mózgu na pro-erekcyjny efekt oksytocyny jest jądro przykomorowe podwzgórza. Ten jądro i otaczające regiony zawierają ciała komórkowe wszystkich neuronów oksytocynergicznych skierowanych na zewnątrz podwzgórzowe obszary mózgu i rdzeń kręgowy. Ten przegląd pokazuje, że oksytocyna indukuje erekcję prącia również po wstrzyknięciu w niektóre z tych obszarów (np. Brzuszny obszar nakrywki, brzuszny obszar podpony hipokampa, tylno-przyśrodkowe jądro jądra migdałowatego i odcinek piersiowo-lędźwiowy rdzenia kręgowego). Badania mikroiniekcji w połączeniu z mikrodializą wewnątrzmózgową i podwójnymi testami immunofluorescencyjnymi sugerują, że oksytocyna w tych obszarach aktywuje bezpośrednio lub pośrednio (głównie poprzez kwas glutaminowy) mezolimbiczne neurony dopaminergiczne. Dopamina uwalniana w jądrze półleżącym z kolei aktywuje szlaki nerwowe prowadzące do aktywacji neuronów dopaminergicznych dostarczanych przez podwzgórze w jądrze przykomorowym. To aktywuje nie tylko oksytocynergiczne neurony wystające do rdzenia kręgowego i pośredniczące w erekcji prącia, ale także te, które rzutują na powyższe obszary poza podwzgórza, modulując bezpośrednio lub pośrednio (poprzez kwas glutaminowy) aktywność neuronów dopaminergicznych mezolimbicznych kontrolujących motywację i nagrodę. Te szlaki nerwowe razem mogą stanowić złożony hipotetyczny obwód, który odgrywa rolę nie tylko w fazie konsumpcji seksualnej (funkcji erekcji i kopulacji), ale także w motywacyjnych i satysfakcjonujących aspektach przewidywanej fazy zachowań seksualnych.
1.Introduction
Wzmocnienie prącia jest męską odpowiedzią seksualną, która odgrywa kluczową rolę w rozmnażaniu ssaków, w tym człowieka, i można to zaobserwować w kontekstach innych niż ściśle związane z rozmnażaniem. W zależności od kontekstu, w jakim występuje erekcja prącia, w jego regulacji uczestniczą różne ośrodkowe i obwodowe mechanizmy nerwowe i / lub humoralne (patrz Meisel i Sachs, 1994, Argiolas i Melis, 1995, 2004, 2005, Sachs, 2000, 2007, McKenna, 2000, Giuliano i Rampin, 2000, 2004, Andersson, 2001, Melis i Argiolas, 1995a, 2003, Hull i wsp., 2002). Wśród centralnych neurotransmiterów i neuropeptydów, które kontrolują erekcję prącia, najbardziej znane są dopamina, serotonina, aminokwasy pobudzające, tlenek azotu, adrenokortykotropina, oksytocyna i peptydy opioidowe. Mogą ułatwiać lub hamować wzwód prącia poprzez działanie w kilku obszarach mózgu, tj. przyśrodkowy obszar przedwzrokowy, jądro przykomorowe podwzgórza, brzuszny obszar nakrywki, hipokamp, jądro migdałowate, jądro łożyska śluzówki ogonowej, jądro półleżące, rdzeń przedłużony i rdzeń kręgowy (Tabela 1) (patrz Meisel i Sachs, 1994, Witt i Insel, 1994, Stancampiano i wsp., 1994, Argiolas i Melis, 1995, 2005, Argiolas, 1999, Bancila i wsp., 2002, Giuliano i Rampin, 2000, McKenna, 2000, Andersson, 2001, Hull i wsp., 2002, Coolen i wsp., 2004).
Oksytocyna, peptyd neurohypofizyczny, dobrze znany ze swojej roli hormonalnej w laktacji i porodzie, występuje u kobiet i mężczyzn, nie tylko w neuronach z ciałami komórkowymi zlokalizowanymi w jądrach przykomorowych i nadwzrocznych podwzgórza wysuwających się do neurohypofizy, ale także w projekcjach neuronów. od jądra przysionkowo-komorowego i struktur otaczających do pozapłucnych obszarów mózgu (tj. przegrody, brzusznej części nakrywki, hipokampa, ciała migdałowatego, rdzenia przedłużonego i rdzenia kręgowego). Uważa się, że neurony te biorą udział w wielu centralnych funkcjach, takich jak pamięć, uczenie się, zachowania afektywne i społeczno-seksualne, w tym erekcja prącia i zachowanie kopulacyjne (patrz Buijs, 1978, Sofroniew, 1983, Argiolas i Gessa, 1991, Pedersen i wsp. 1992, Carter, 1992, Wagner i Clemens, 1993, Ivell i Russel, 1995, Carter i wsp., 1997, Tang i wsp., 1998, Veronneau-Longueville i wsp., 1999). Rzeczywiście, oksytocyna ułatwia funkcje erekcyjne i zachowania seksualne mężczyzn u myszy, szczurów, królików i małp (patrz Argiolas i Gessa, 1991, Carter, 1992, Pedersen i wsp., 1992, Argiolas i Melis, 1995, 2004, Argiolas, 1999). Może się to również zdarzyć u ludzi, ponieważ osoczowa oksytocyna jest zwiększana przez bodźce seksualne, zwłaszcza w wytrysku (Carmichael i wsp., 1987, Murphy i wsp., 1987) oraz przez manipulację piersiami i narządami płciowymi, które zwykle występują podczas seksu. stosunek (Tindall, 1974).
Usprawniający wpływ oksytocyny na zachowania seksualne mężczyzn po raz pierwszy wykazał zdolność dożylnej oksytocyny, która zmniejszyła opóźnienie pierwszego wytrysku i opóźniła seksualne wyczerpanie męskich królików w połączeniu z receptywnymi samicami (Melin i Kihlstrom, 1963). Jednak skutki seksualne oksytocyny zostały definitywnie rozpoznane dopiero w latach osiemdziesiątych. Oksytocyna podawana centralnie w ilościach nanogramów okazała się zdolna do indukowania erekcji prącia (Argiolas i wsp., 1985, 1986) i polepszenia zachowania kopulacyjnego (Arletti i wsp., 1985) u samców szczurów i zwiększenia lordozy u samic szczurów (Arletti i Bertolini, 1985, Caldwell i wsp., 1986), najwyraźniej działając na receptory oksytocynergiczne typu macicy (patrz Argiolas and Melis, 1995, 2004, Argiolas, 1999, Melis i Argiolas, 2003 oraz odnośniki w nim). Oksytocyna poprawia zachowania seksualne nie tylko u seksualnie silnych samców szczurów (Arletti i wsp., 1985), ale także u starszych samców szczurów (Arletti i in., 1990), oraz u dominujących, ale nie u podrzędnych, małp wiewiórych (Winslow i Insel , 1991).
Pro-erekcyjny efekt oksytocyny jest zależny od testosteronu, ponieważ jest on zniesiony przez wycięcie i kastrację oraz przywrócony przez suplementację testosteronem lub jego metabolitami, estradiolem i 5_-dihydrotestremonem, podawanymi razem (Melis i wsp., 1994a). Najbardziej wrażliwym obszarem mózgu do indukcji wzwodu prącia przez oksytocynę jest jądro przykomorowe podwzgórza (Melis i wsp., 1986), z którego pochodzą wszystkie poza podwzgórza projekcje oksytocynergiczne (patrz powyżej). Stwierdzono, że oksytocyna jest w stanie wywołać erekcję prącia (i ziewanie) po wstrzyknięciu w dawkach tak niskich jak 3 pmol (patrz punkt 2.1 poniżej). Oksytocyna wzmagała erekcję prącia również po wstrzyknięciu obustronnym do pola CA1 hipokampa, ale nie w grzbiecie grzbietowym (patrz sekcja 2.3 poniżej), przegrodzie bocznej, jądrze ogoniastym, przyśrodkowym obszarze przedwzrokowym, jądrze brzuszno-przyśrodkowym podwzgórza i jądro supraoptyczne (Melis i wsp., 1986). Jeśli chodzi o mechanizm działania oksytocyny w jądrze przykomorowym w celu wywołania tej reakcji seksualnej, liczne badania sugerują, że oksytocyna aktywuje własne neurony. Zgodnie z tą hipotezą, interakcja seksualna zwiększa FOS, produkt genu natychmiastowego wczesnego genu c-fos w okołomotorowych neuronach oksytocynergicznych wystających do rdzenia kręgowego, które biorą udział w kontrolowaniu erekcji prącia (patrz Witt and Insel, 1994 i odniesienia w tym miejscu), a impotencja seksualna (np. niezdolność dorosłego szczura płci męskiej do kopulacji z kobietą z receptorem β-estrogenowo-progesteronowo-progesteronowym) była związana u samca szczura z niskim poziomem mRNA oksytocyny w jądrze przykomorowym podwzgórza (Arletti et al., 1997).
Nie wiadomo, czy oksytocyna wpływa na fazę przewidywania, czy fazę konsumpcji seksualnej. Ponieważ oksytocyna indukuje erekcję prącia, a głównym efektem oksytocyny na zachowanie kopulacyjne jest zmniejszenie interakcji po wytrysku u samców szczurów (Arletti i wsp., 1985), rozsądne jest założenie, że peptyd poprawia sprawność seksualną. Jednakże, ponieważ oksytocyna zwiększa również interakcje społeczno-seksualne (patrz Pedersen i wsp., 1992, Carter i wsp., 1997, Ivell i Russel, 1995) i antagoniści receptora oksytocynowego, zapobiegają bezkontaktowym erekcjom (Melis i wsp., 1999a), które są uważane za wskaźnik podniecenia seksualnego (patrz Sachs, 1997, 2000, 2007, Melis i wsp., 1998, 1999b i zawarte w nim odniesienia), nie można wykluczyć możliwej roli oksytocyny w pobudzeniu seksualnym i motywacji seksualnej.
Ta recenzja podsumowuje opublikowane i niepublikowane wyniki ostatnich badań, które pokazują, że oksytocyna wywołuje erekcję prącia nie tylko po wstrzyknięciu do jądra przykomorowego podwzgórza, ale także w innych pozapłaskich obszarach mózgu, takich jak brzuszny obszar nakrywowy (Melis i wsp., 2007, 2009a, Succu i wsp., 2008), ton brzuszny subikulum hipokampa i tylny jądro migdałowate (Melis i wsp., 2009b, 2010), które są ważnymi składnikami układu limbicznego i uważa się, że odgrywają kluczową rolę w procesach motywacji i nagradzania. Badania te wykazują, że oksytocyna uczestniczy w obwodach nerwowych, które obejmują inne neuroprzekaźniki, takie jak dopamina i kwas glutaminowy, oraz inne obszary mózgu inne niż jądro przykomorowe, np. Brzuszny obszar nakrywki, jądro półleżące, hipokamp i obszary, które jeszcze należy zidentyfikowane. Obwody te prawdopodobnie będą pośredniczyć w interakcji pomiędzy układem dopaminergicznym mezolimbicznym i dopaminergicznym, i będą odgrywać rolę nie tylko w fazie konsumpcyjnej zachowań seksualnych mężczyzn (np. Erekcja prącia i kopulacja), ale także w motywacji seksualnej i seksualnej. podniecenia, a więc dostarczenia podłoża neuronowego do wyjaśnienia motywacyjnych i satysfakcjonujących właściwości aktywności seksualnej.
2. Oksytocyna wpływa na erekcję prącia, działając w różnych obszarach mózgu
2.1. Jądro przykomorowe podwzgórza
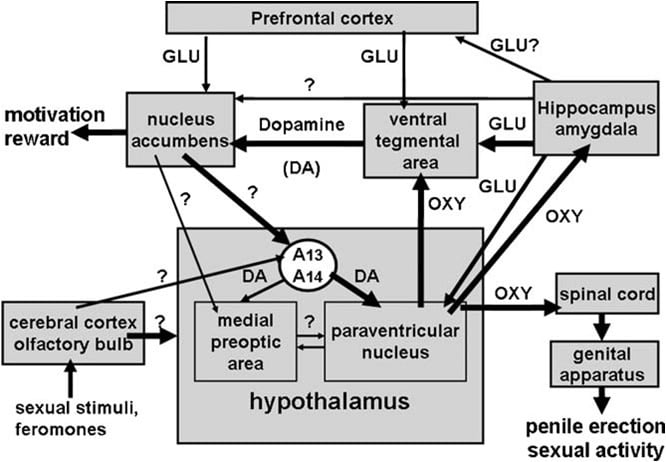
Jak przypomnieliśmy powyżej, jądro przykomorowe podwzgórza zostało wkrótce zidentyfikowane jako obszar mózgu najbardziej wrażliwy na pro-erekcyjny efekt oksytocyny. Po jednostronnym wstrzyknięciu w tym jądrze stwierdzono, że oksytocyna jest aktywna w dawkach tak niskich jak 3 ng (3 pmol) (Melis i wsp., 1986). Badania zależności struktura-aktywność ujawniły, że erekcja prącia wywołana przez oksytocynę była mediowana przez receptory oksytocynowe macicy, sprzężone z napływem Ca2 + do ciał komórek neuronów oksytocynergicznych rzutujących na pozaszpitalne obszary mózgu i do aktywacji syntazy tlenku azotu. Tlenek azotu z kolei działając jako wewnątrzkomórkowy przekaźnik o jeszcze nieznanym mechanizmie (nie obejmującym cyklazy guanylanowej) prowadzi do aktywacji neuronów oksytocynergicznych wystających w okolice rdzenia kręgowego i poza podwzgórzowych obszarów mózgu, wywołując erekcję prącia (Ryc. 1) (patrz poniżej oraz Argiolas i Melis, 1995, 2004, 2005 i zawarte w nim odniesienia). Zdolność oksytocyny do aktywowania własnych neuronów
Rys. 1. (MISSING) Schematyczne przedstawienie neuronów oksytocynergicznych, które pochodzą z jądra przykomorowego podwzgórza i rzutują się na zewnątrz podwzgórzowe obszary mózgu, takie jak rdzeń kręgowy, VTA, hipokamp, ciało migdałowate itd. Aktywacja tych neuronów przez dopamina, aminokwasy pobudzające, sama oksytocyna, peptydy analogu heksareliny i peptydy pochodne VGF prowadzą do erekcji prącia, którą można zmniejszyć i / lub zlikwidować przez stymulację receptorów CB1 GABAergicznego, opioidowego i kannabinoidowego. Aktywacja neuronów oksytocynergicznych jest wtórna do aktywacji syntazy tlenku azotu obecnej w tych neuronach. Rzeczywiście, endogenny tlenek azotu powstały w wyniku stymulacji receptorów dopaminowych, aminokwasów pobudzających lub receptorów oksytocynowych lub egzogennego tlenku azotu, ponieważ ten pochodzący od donorów tlenku azotu, podawanych bezpośrednio do jądra przykomorowego, aktywuje neurony oksytocynowe za pomocą jeszcze niezidentyfikowanego mechanizmu, najwyraźniej niezwiązanego z stymulacja cyklazy guanylanowej. Powoduje to z kolei uwalnianie oksytocyny w rdzeniu kręgowym i poza podwzgórzaczowych obszarach mózgu. Niektóre szczegóły na temat mechanizmów, za pomocą których oksytocyna wywołuje erekcję prącia po uwolnieniu w tych obszarach, np. VTA, brzuszne podposiłki i jądro migdałowate opisano w odpowiednich sekcjach obszaru mózgu. Tutaj oksytocyna działa na własne receptory i zwiększa produkcję NO, co prowadzi do erekcji prącia, jak stwierdzono w PVN. Jednak w przeciwieństwie do PVN, w ogonie VTA NO aktywuje cyklazę guanylanową. Powoduje to wzrost stężenia cGMP prowadzący do aktywacji mezolimbicznych neuronów dopaminergicznych i erekcji prącia. W VS NO aktywuje neurony glutaminergiczne wystające do obszarów pozapokładowych, w tym do VTA. Kwas glutaminowy w VTA aktywuje z kolei mezolimbiczne neurony dopaminergiczne, jakie znaleziono w oksytocynie. Mechanizmy podobne do opisanych powyżej mogą działać również wtedy, gdy erekcja prącia ma miejsce w kontekście fizjologicznym, mianowicie gdy samce szczurów są umieszczane w obecności niedostępnej receptywnej samicy (np. Bezstykowe erekcje) lub podczas kopulacji.
w jądrze przykomorowym wspierały badania pokazujące, że: (1) receptory oksytocynowe są obecne w tym podwzgórzowym jądrze (Freund-Mercier i wsp., 1987, Freund-Mercier i Stoeckel, 1995); (2) oksytocyna ułatwia jego własne uwalnianie in vitro i in vivo (Freund-Mercier i Richard, 1981, 1984, Moos i wsp., 1984); i (3) Oksytocyna pobudza własne neurony, działając w jądrze przykomorowym (Yamashita i wsp., 1987). Co więcej, zidentyfikowano synapsy oksytocynowe wpływające na ciała komórkowe wielkokomórkowych neuronów oksytocynergicznych w jądrze przykomorowym i nadprzewodnikowym podwzgórza (Theodosis, 1985). W końcu, zniszczenie centralnych neuronów oksytocynergicznych przez elektrolityczne lub chemicznie ekscytotoksyczne uszkodzenia jądra przykomorowego, które całkowicie zmniejsza zawartość oksytocyny w ośrodkowym układzie nerwowym i rdzeniu kręgowym, znosi nie tylko pro-erekcyjny efekt oksytocyny, ale także upośledza indukowane lekami erekcje prącia i erekcji bezkontaktowe (patrz poniżej i Argiolas i wsp., 1987a, b; Liu i wsp., 1997 i odnośniki w nim). Wyniki podobne do tych, które stwierdzono w uszkodzeniach jądra przykomorkowego, stwierdzono za pomocą silnych i selektywnych antagonistów receptora oksytocyny. Rzeczywiście, te związki wstrzykiwane do jądra przykomorowego w nanogramach zapobiegały całkowicie erekcjom prącia wywołanym przez oksytocynę, podczas gdy w bocznych komorach zapobiegały erekcjom prącia indukowanym samą oksytocyną, ale także erekcjom prącia indukowanym przez lek (patrz sekcja 3 poniżej oraz Argiolas i Melis, 1995, 2004, 2005 i zawarte w nich odniesienia) oraz bezkontaktowe erekcje (Melis i wsp., 1999a), a ponadto były niezwykle skuteczne w zaburzaniu zachowania kopulacyjnego seksualnie silnych samców szczurów (Argiolas i wsp., 1988). Ponadto, interakcja seksualna zwiększa FOS, produkt genu natychmiastowego wczesnego genu c-fos w okołomotorowych neuronach oksytocynergicznych wystających do rdzenia kręgowego zaangażowanego w kontrolę wzwodu prącia (patrz Witt and Insel, 1994 i odnośniki w nim). Wreszcie, impotencja seksualna (np. niezdolność dorosłego szczura płci męskiej do kopulacji z samicą receptywną estrogenowo-progesteronową) hjak również były związane u samca szczura z niskim poziomem mRNA oksytocyny i syntazy tlenku azotu w jądrze przykomorowym podwzgórza (Benelli i wsp., 1995, Arletti i wsp., 1997) (obszerny przegląd tych badań można znaleźć w Argiolas, 1999, Argiolas and Melis, 2004, 2005).
2.2. Brzuszna część nakrywkowa
Boczna część nakrywkowa została niedawno odkryta jako miejsce w mózgu, w którym oksytocyna wywołuje erekcję prącia. Obszar ten zawiera zakończenia nerwu oksytocynowego pochodzące z jądra przykomorowego i receptorów oksytocynowych (Freund-Mercier i wsp., 1987, Vaccari i wsp., 1998). Dokładniej, stwierdzono, że oksytocyna jest zdolna donducing penind erection po wstrzyknięciu jednostronnie do ogona, ale nie w rdzeń brzusznej części nakrywkowej w sposób zależny od dawki (Melis i wsp., 2007). Aktywne dawki były wyższe niż te wymagane po wstrzyknięciu do jądra przykomorowego i podobne do tych, które wywołują erekcję prącia po wstrzyknięciu do przedsionka brzusznego hipokampa lub do tylno-przyśrodkowego jądra jądra migdałowatego (patrz poniżej). Najwyraźniej w efekcie erekcyjnym pośredniczy aktywacja neuronów dopaminergicznych mezolimbicznych wystających w powłokę jądra półleżącego, co z kolei aktywuje jeszcze nieznane szlaki neuronowe wystające do neuronów dopaminergicznych dostarczających neuronów dopaminergicznych, uderzając w okołotworowe neurony oksytocynergiczne pośredniczące w wzwodzie prącia (Melis i wsp., 2007, 2009a).
Jeśli chodzi o mechanizm, dzięki któremu oksytocyna aktywuje neurotransmisję dopaminergiczną w obszarze nakrywkowym brzucha, dostępne dane sugerują, że oksytocyna stymuluje receptory oksytocynergiczne zlokalizowane w ciałach komórkowych mezolimbicznych neuronów dopaminergicznych. Zwiększa to dopływ Ca2 + do ciał komórek neuronów dopaminergicznych, tym samym aktywując syntezę tlenku azotu (Succu i wsp., 2008). W odróżnieniu od jądra okołokomorowego (patrz punkt 3 poniżej), tlenek azotu z kolei aktywuje cyklazę guanylanową, zwiększając tym samym stężenie cyklicznej GMP. Zgodnie z tym mechanizmem, d (CH2) 5Tyr (Me) 2-Orn8-vasotocin, silny antagonista oksytocyny, lub S-metylo-tio-1-cytrulina, silny inhibitor neuronalnej syntazy tlenku azotu, wstrzyknięty do ogonowa brzuszna część nakrywkowa przed oksytocyną, zniesiona erekcja prącia i wzrost zewnątrzkomórkowego stężenia dopaminy w otoczce jądra półleżącego indukowanej przez oksytocynę. Ponadto, X-BUM-Bromocykliczny GMP, aktywny fosfodiesterazy, cykliczny analog GMP, indukuje erekcję prącia po wstrzyknięciu do jądra ogoniastego i zwiększa zewnątrzkomórkowe stężenie dopaminy w otoczce jądra półleżącego, jak stwierdzono przy oksytocynie wstrzykniętej do ogoniasty brzuszny obszar nakrywowy (Succu i wsp., 8, Melis i wsp., 2008a) (patrz także fig. 2009).
Zawsze zgodnie z tym mechanizmem, haloperidol, silny antagonista receptora D2 dopaminy, wstrzyknięty do otoczki jądra półleżącego, zmniejsza erekcję prącia indukowaną przez oksytocynę wstrzykniętą do brzusznej okolicy nakrywkowej (Melis i wsp., 2007). Powyższy mechanizm jest również wspierany przez podwójne badania immuno-fluorescencji, pokazujące, że włókna oksytocyny uderzają w ciałka komórek neuronów dopaminergicznych w ogonowym brzusznym obszarze nakrywkowym, które wcześniej były znakowane przez śledzący znacznik Fluorogold wstrzykiwany do skorupy jądra półleżącego ( Melis i wsp., 2007, Succu i wsp., 2008). Aktywacje tych neuronów dopaminergicznych i receptorów dopaminy w jądrze półleżącym prowadzą z kolei do aktywacji szlaków nerwowych, które dopiero mają zostać zidentyfikowane, które pobudzają neurony dopaminergiczne do neuronów dopaminergicznych do uwalniania dopaminy w jądrze przykomorowym, tym samym aktywując neurony oksytocynowe wystające do rdzeń kręgowy i pośredniczenie w erekcji prącia (patrz powyżej i Melis i wsp., 2007, Succu i wsp., 2007, 2008). Rzeczywiście, oksytocyna wstrzyknięta do ogonowej brzusznej części nakrywki w dawce, która indukowała erekcję prącia, zwiększyła pozakomórkowe stężenie dopaminy w dializacie uzyskanym nie tylko z jądra półleżącego, ale także z jądra przykomorowego (Succu i wsp., 2007).
2.3. Hipokamp
Pole CA1 hipokampa było drugim obszarem mózgu bogatym w włókna oksytocynowe oraz receptory zidentyfikowane we wcześniejszych badaniach, w których wstrzyknięcie oksytocyny wywołało erekcję prącia (patrz Bujis, 1978, Sofroniew, 1983). Jednakże, w przeciwieństwie do jądra przykomorowego, stwierdzono, że oksytocyna jest zdolna do indukowania erekcji prącia tylko wtedy, gdy wstrzykuje się ją obustronnie i w wyższych dawkach niż te, które są aktywne w jądrze przykomorowym (Melis i wsp., 1986, Chen i wsp., 1992). Zastrzyki z oksytocyny do podskładki okazały się nieaktywne w tych wcześniejszych badaniach. Jednak ostatnie i bardziej ostrożne badania mikroiniekcji prowadzą do identyfikacji a region brzusznego podkowca w którym wstrzyknięcie oksytocyny było zdolne do indukowania erekcji prącia w sposób zależny od dawki (Melis i wsp., 2009b). Pro-erekcyjny efekt oksytocyny wstrzykniętej do tego obszaru mózgu obserwowano przy dawkach podobnych do tych stwierdzanych w obszarze brzusznej zastawki po jednostronnym wstrzyknięciu (Melis i wsp., 2007), jak stwierdzono w jądrze przykomorowym. Najwyraźniej oksytocyna wstrzyknięta do podskładki brzusznej wywołuje erekcję prącia poprzez aktywację receptorów oksytocynergicznych w neuronach zawierających syntazę tlenku azotu, co powoduje wzrost produkcji tlenku azotu. Tlenek azotu z kolei działając jako komunikator międzykomórkowy aktywuje neurotransmisję kwasu glutaminowego, prowadząc do erekcji prącia, prawdopodobnie przez neuronowe (glutamatergiczne) odprowadzające projekcje z brzusznego podkowca do obszarów mózgu o nadhipokampie modulujących aktywność neuronów dopaminergicznych mezolimbicznych (np. brzuszny obszar nakrywowy, kora przedczołowa, jądro przykomorowe) (patrz poniżej i Melis, 2007, 2009b, Succu i wsp., 2008).
Ten mechanizm działania jest wspierany przez eksperymenty mikrodializ wewnątrzmózgowe, które pokazują, że oksytocyna jest wstrzykiwana do przedsionka brzusznego w dawkach, które indukują wzwód prącia, zwiększa wytwarzanie tlenku azotu i pozakomórkowe stężenie kwasu glutaminowego w dializacie z brzusznego podkowca (Melis et al. 2010) i zewnątrzkomórkowej dopaminy w jądrze półleżącym (Melis i wsp., 2007). Odpowiedzi te były antagonizowane nie tylko przez antagonistę receptora oksytocyny d (CH2) 5Tyr (Me) 2-Orn8-vasotocin, ale także przez neuronalny inhibitor syntazy tlenku azotu S-methylthio-litrulline i przez hemoglobinę wymiatacza tlenku azotu do przedsionka brzusznego kilka minut przed oksytocyną (Melis i wsp., 2010).
Ponadto, zgodnie z tym mechanizmem działania, aktywacja neurotransmisji glutaminergicznej przez NMDA wstrzyknięta do podskładki brzusznej wywołuje erekcję prącia (Melis i wsp., 2010). Fenotyp projekcji odprowadzających z brzusznego podkowca, które powodują aktywację mezolimbicznych neuronów dopaminergicznych i wzrost zewnątrzkomórkowej dopaminy w jądrze półleżącym, jest obecnie nieznany. Jednakże, ponieważ erekcja prącia indukowana przez oksytocynę wstrzykniętą do przedsionka brzusznego występuje jednocześnie ze zwiększeniem zewnątrzkomórkowego kwasu glutaminowego w dializacie z brzusznego obszaru nakrywki, ale nie z jądra półleżącego i jest antagonizowana przez (+) MK-801, silny niekompetycyjny antagonista receptorów pobudzających aminokwasów podtypu NMDA (Woodruff i wsp., 1987), wstrzyknięty do brzusznej okolicy nakrywki, ale nie w jądrze półleżącym (patrz Fig. 2 i Melis i wsp., 2009b) , jest prawdopodobne, że te projekcje prowadzą do aktywacji neurotransmisji glutaminergicznej w brzusznym obszarze nakrywowym, która z kolei aktywuje neurony dopaminergiczne mezolimbiczne wystające do jądra półleżącego. To, czy zwiększona koncentracja kwasu glutaminowego znajdująca się w brzusznym obszarze nakrywowym po wstrzyknięciu oksytocyny do brzusznego stawu jest uwalniana z neuronów pochodzących z subicyli lub innych obszarów mózgu (np. Kora przedczołowa) jest obecnie nieznana. Niemniej jednak, powoduje to aktywację mezolimbicznych neuronów dopaminergicznych i zwiększone uwalnianie dopaminy w jądrze półleżącym. Aktywacja receptorów dopaminowych prowadzi tutaj do aktywacji neuronów dopaminergicznych dostarczających dopaminergię, uwalniając dopaminę w jądrze przykomorowym, tym samym aktywując neurony oksytocynowe wystające do rdzenia kręgowego i pośrednicząc w wzwodzie prącia (patrz powyżej i Melis i wsp., 2007, 2009a, Succu i wsp., 2008).
2.4. Ciało migdałowate
Ciało migdałowate jest innym obszarem mózgu bogatym w włókna i receptory oksytocyny (patrz Freund-Mercier i wsp., 1987, Vaccari i wsp., 1998, Uhl-Bronner i wsp., 2005). Uważa się, że oksytocyna bierze udział w różnych funkcjach, od anksjolizy, pamięci społecznej i poznania, w uczeniu się wspomaganym społecznie, empatii emocjonalnej, przetwarzaniu emocjonalnych twarzy i lęku u ludzi po funkcje erekcyjne i zachowania seksualne (patrz Kondo i wsp., 1998; Dominguez et al., 2001, Ebner i wsp., 2005, Huber i wsp., 2005, Domes i wsp., 2007, Petrovic i wsp., 2008, Lee i wsp., 2009, Donaldson and Young, 2009, Hurlemann i in. , 2010). Jednakże zdolność oksytocyny do indukowania erekcji prącia u samców szczurów po indukcji w tylno-przyśrodkowym jądrze jądra migdałowatego odkryto dopiero niedawno (Melis i wsp., 2009b). Ta odpowiedź wystąpiła równocześnie ze wzrostem pozakomórkowego stężenia dopaminy w dializacie otrzymanym z otoczki jądra półleżącego, jak stwierdzono po wstrzyknięciu oksytocyny do brzusznego podpołytu (Melis i wsp., 2009b). Mechanizm, dzięki któremu oksytocyna wstrzyknięta do tylno-przyśrodkowego jądra jądra migdałowatego indukuje erekcję prącia, nie jest obecnie znana. Dostępne dane pokazują, że zarówno wzwód prącia, jak i wzrost zewnątrzkomórkowego stężenia dopaminy w dializacie uzyskanym z jądra półleżącego są mediowane przez aktywację receptorów oksytocynergicznych, ponieważ obie odpowiedzi zostały zniesione przez antagonistę receptora oksytocynowego d (CH2) 5Tyr ( Me) 2-Orn8-vasotocin wstrzyknięty do jądra migdałowatego kilka minut przed oksytocyną (Melis i wsp., 2009b).
Jakikolwiek mechanizm aktywuje oksytocynę w tylno-przyśrodkowym jądrze jądra migdałowatego, odpowiedź seksualna indukowana przez peptyd jest zniesiona przez blokadę wszystkich receptorów dopaminergicznych cis-flupenthiksolem wstrzykniętym do otoczki jądra półleżącego i przez blokadę receptorów NMDA za pomocą ( +) MK-801 wstrzyknięto do brzusznego obszaru nakrywkowego, ale nie do jądra półleżącego, jak stwierdzono w przypadku erekcji prącia indukowanej przez oksytocynę wstrzykniętą do podskładki brzusznej (Melis i wsp., 2009b). Sugeruje to, że oksytocyna wstrzyknięta do tylno-łożyskowego jądra migdałowatego aktywuje neurotransmisję kwasu glutaminowego w brzusznym obszarze nakrywowym. To z kolei powoduje aktywację mezolimbicznych neuronów dopaminergicznych, prowadząc do erekcji prącia. W świetle badań pokazujących szlaki nerwowe łączące to jądro ciała migdałowatego z brzusznym podgardlem (Canteras i wsp., 1995, French i Totterdell, 2003), odkrycia te stwarzają możliwość interakcji między tymi dwoma obszarami mózgu, chociaż zostały opisane szlaki od jądra migdałowatego do jądra półleżącego lub brzusznej części nakrywki (Kelley i Domesick, 1982, Witter, 2006).
2.5. Rdzeń kręgowy
Rdzeń kręgowy jest innym obszarem ośrodkowego układu nerwowego, który zawiera włókna i receptory oksytocynowe (Freund-Mercier i wsp., 1987, Uhl-Bronner i wsp., 2005), w których oksytocyna indukuje erekcję prącia (Tang i wsp., 1998 Veronneau-Longueville i wsp., 1999, Giuliano i Rampin, 2000, Giuliano i wsp., 2001). Jak wspomniano powyżej, te oksytocynergiczne włókna pochodzą z jądra przykomorowego podwzgórza i przyczyniają się do schodzenia ścieżek kontrolujących rdzeniowe neurony autonomiczne pośredniczące w erekcji prącia. Rzeczywiście, włókna te powodują kontakty synaptyczne w rogówce grzbietowej przedzwojowych współczulnych i przywspółczulnych kolumnach komórkowych w odcinku piersiowo-lędźwiowym i lędźwiowo-krzyżowym z neuronami rdzeniowymi unerwiającymi prącia przepastnych ciał (Marson i McKenna, 1996, Giuliano i Rampin, 2000, Giuliano i in. , 2001). Te kontakty synaptyczne zostały wykazane przez znakowanie neuronów rdzeniowych pochodzących z penisa i docieranie do rdzenia kręgowego za pomocą specyficznych znaczników wstecznych wstrzykniętych do ciał jamistych, w połączeniu z podwójnymi badaniami immuno-fluorescencyjnymi i konfokalnym skanowaniem laserowym (Tang i wsp., 1998; Veronneau-Longueville i wsp., 1999). Zgodnie z tymi badaniami u znieczulonych samców szczurów dooponowe wstrzyknięcie skumulowanych dawek oksytocyny w okolicy lędźwiowo-krzyżowej, ale nie na poziomie piersiowo-lędźwiowym, wywołane ciśnienie wewnątrznaczyniowe wzrasta w sposób zależny od dawki. Efekty te zostały zniesione przez blokadę receptora oksytocynergicznego za pomocą d (CH2) 5Tyr (Me) 2-Orn8-vasotocin i przez wycięcie nerwów miednicy (Giuliano i Rampin, 2000, Giuliano i wsp., 2001). Wyniki te dowodzą, że oksytocyna działająca w rdzeniu kręgowym lędźwiowo-krzyżowym zwiększa ciśnienie śródbłonka i sugeruje, że oksytocyna uwalniana podczas fizjologicznej aktywacji jądra przykomorowego jest silnym aktywatorem neuronów kręgosłupa pro-erekcyjnego wystających do ciał jamistych. Co ciekawe, te pro-erekcyjne neurony rdzeniowe, na których działanie oksytocyny wywiera swój efekt pro-erekcji, również otrzymują kontakty synaptyczne z neuronów serotoninergicznych pochodzących z jądra paragigantocellularis siatkowatego tworzenia rdzenia przedłużonego (Marson i McKenna, 1992; Tang i wsp. ., 1998). Zniszczenie tych neuronów serotoninergicznych ułatwia ejakulację i odruchy prącia u samców szczurów (Marson i McKenna, 1992, Yells i wsp., 1992). Ponieważ leki stymulujące receptory 5HT2C ułatwiają erekcję prącia, gdy są podawane do komór mózgowo-rdzeniowych, ale nie w jądro przykomorowe, a leki blokujące receptory 5HT2C zmniejszają także agonistę dopaminy i indukowaną oksytocyną erekcję prącia, podczas gdy antagoniści dopaminy nie zmniejszają eukcji prącia wywołanej przez agonistę 5HT2C ( patrz Stancampiano i wsp., 1994 i odnośniki w nim), zasugerowano również, że oksytocyna ułatwia działanie pro-erekcyjnych receptorów 5HT2C na poziomie lędźwiowo-krzyżowego rdzenia kręgowego (Stancampiano i wsp., 1994). Alternatywnie, oksytocyna może wpływać na aktywność neuronów serotoninergicznych w rdzeniu kręgowym, działając bezpośrednio w jądrze paragigantocellularis, z którego pochodzą te neurony (patrz Stancampiano i wsp., 1994).
3. Interakcje między oksytocyną, dopaminą i kwasem glutaminowym w ośrodkowym układzie nerwowym i erekcją prącia
Jak wspomniano w części 1, wszystkie neurony oksytocynowe obecne w ośrodkowym układzie nerwowym pochodzą z jądra przykomorowego i otaczających struktur. Aktywność tych neuronów jest pod kontrolą różnych neuroprzekaźników i / lub neuropeptydów. Do najbardziej zbadanych na poziomie okołokorzeniowym należą: dopamina, kwas glutaminowy, kwas gamma-aminomasłowy (GABA), tlenek azotu, endokanabinoidy, peptydy opioidowe, peptydy uwalniające hormon wzrostu, peptydy związane z VGF i sama oksytocyna. Dopamina, kwas glutaminowy, peptydy uwalniające hormon wzrostu, peptydy pochodzące z VGF i oksytocyna są stymulujące, np. Te związki i ich agoniści ułatwiają wzwód prącia po wstrzyknięciu do jądra przykomorowego, podczas gdy GABA, peptydy opioidowe i endokannabinoidy są hamujące, np. Te związki lub ich agoniści hamują erekcję prącia (patrz Meisel i Sachs, 1994, Witt i Insel, 1994, Argiolas i Melis, 1995, 2004, 2005, Giuliano i Rampin, 2000, 2004, McKenna, 2000, Andersson, 2001, Hull i wsp., 2002).
Kilka linii eksperymentalnych dowodów sugeruje, że te oksytocynergiczne neurony i powyższe neuroprzekaźniki i neuropeptydy są zaangażowane w kontrolę erekcji i zachowanie seksualne w różnych kontekstach fizjologicznych. Ponadto, oksytocyna uwalniana w zewnątrz podwzgórzowych obszarach mózgu, takich jak brzuszny obszar nakrywowy, hipokamp i jego regiony, jądro migdałowate i rdzeń kręgowy mogą wpływać na aktywność tych neuronów, na które wpływają synaps oksytocynergiczne. W tej chwili jedynymi neuronami ważnymi dla wzwodu prącia, z którymi utrudnione są synapsy oksytocynowe, zidentyfikowane z pewnością, są ciałka komórkowe mezolimbicznych neuronów dopaminergicznych w okolicy ogonowej brzusznej nakrywki wystającej do powłoki jądra półleżącego (Melis i wsp., 2007 , Succu i wsp., 2008), oraz pro-erekcji neuronów rdzeniowych rzutowanych z układu lędźwiowo-krzyżowego do ciał jamistych (patrz Giuliano i Rampin, 2000, Giuliano i wsp., 2001) (patrz także sekcje 2.2 i 2.5) . Rzeczywiście, mimo że synokrety i receptory oksytocynergiczne zostały również zidentyfikowane w przedsionku brzusznym, jądro migdałowate i rdzeń kręgowy, obszary, które są ważne dla wzwodu prącia (patrz wyżej), w tych obszarach rodzaj neuroprzekaźnika / ów obecny w neuronach na które uderzają zakończenia nerwów oksytocynergicznych, są wciąż nieznane.
Ta część przeglądu podsumowuje krótko najnowszą literaturę dotyczącą mechanizmów leżących u podstaw pro-erekcyjnego działania oksytocyny wstrzykniętej do ogonowej brzusznej części nakrywki, brzusznej części podskokowej hipokampa i rdzenia kręgowego. Szczególną uwagę poświęcono interakcji peptydu z dopaminą i kwasem glutaminowym w tych obszarach oraz roli, jaką ta interakcja może odgrywać w centralnej kontroli funkcji erekcji. Krótkie podsumowanie wpływu dopaminy i kwasu glutaminowego na neurony oksytocynergiczne w jądrze przykomorowym, które również odgrywają kluczową rolę w funkcji erekcji, podano najpierw, aby uświadomić czytelnikowi wczesny stan badań w tej dziedzinie, jako badania te zostały już obszernie przejrzane (patrz Argiolas and Melis, 1995, 2004, 2005, Melis i Argiolas, 2003). Również w tym przypadku szczególną uwagę poświęcono najnowszym wynikom, które sugerują ważną rolę zarówno dla związku dopaminy-oksytocyny, jak i związku glutaminowo-oksytocynowego nie tylko w zakresie sprawności seksualnej (wzwód prącia i kopulacji), ale także w pobudzenie i motywacja seksualna.
3.1. Interakcja dopaminy z oksytocyną w jądrze przykomorowym
Połączenia zdolność agonistów dopaminy do indukowania erekcji prącia poprzez aktywację centralnych neuronów oksytocynergicznych zasugerowano natychmiast po odkryciu, że apomorfina indukuje erekcję prącia po wstrzyknięciu do jądra przykomorowego (Melis i wsp., 1987), gdy znaleziono antagonistę receptora oksytocynowego d (CH2) 5Tyr (Me) 2-Orn8-vasotocin wstrzykniętego do komór mózgowo-rdzeniowych (icv) jest w stanie zmniejszyć niemal całkowicie wzwód prącia indukowany nie tylko przez oksytocynę podawaną przez icv, ale także przez apomorfinę, podskórnie (Argiolas i wsp., 1987b). Wyniki te zostały uzupełnione wynikami innych badań wykazujących podobne wyniki, gdy d (CH2) 5Tyr (Me) 2-Orn8-vasotocin podano icv, a apomorfinę podano bezpośrednio do jądra okołokomorowego (Melis i wsp., 1989b), 1sugerując, że agoniści dopaminy wywołują erekcję prącia poprzez aktywację okołoturbinowych neuronów oksytocynergicznych rzutowanych na zewnątrz podwzgórzowe obszary mózgu, aw szczególności na rdzeń kręgowy (patrz Argiolas and Melis, 1995, 2004, 2005). Zgodnie z tą hipotezą, u znieczulonych szczurów niedawno znaleziono blokowanie receptorów oksytocynergicznych Lumbo-Sacral przez niepeptydowego antagonistę receptora oksytocynowego, zdolnego do zniesienia indukowanych apomorfiną podwyżek ciśnienia wewnątrz macicy wywołanych przez agonistę dopaminy apomorfinę, dostarczając dowodów na szlak okrężnotryczno-rdzeniowy i oksytocynowy zaangażowany w erekcję prącia (Baskerville i wsp., 2009).
Studia skierowane do identyfikacja receptora dopaminy odpowiedzialnego za indukcję erekcji prącia ujawniła, że również w jądrze przykomorowym agoniści receptorów dopaminowych indukują erekcję prącia przez działanie na receptory dopaminy z rodziny D2, jak stwierdzono dla agonistów receptora dopaminy podawanych układowo (patrz Melis i wsp., 1987, Eaton i wsp., 1991, Melis i Argiolas, 1995a). Odpowiednio, okazało się, że apomorfina, silny mieszany agonista receptora D1 / D2 i chinpirol, silny selektywny agonista receptora D2, ale nie SKF 38393, selektywny agonista receptora D1, wstrzyknięty do tego podwzgórzowego jądra, może indukować erekcję prącia w sposób zależny od dawki. , a odpowiedź seksualna indukowana przez tych agonistów receptora D2 została zniesiona przez antagonistów receptora D2, takich jak haloperidol i l-sulpiryd, ale nie przez SCH 23390, selektywnego antagonistę receptora D1 (Melis i wsp., 1987). Zdolność apomorfiny do indukowania erekcji prącia po wstrzyknięciu do jądra przykomorowego została również potwierdzona w badaniach telemetrycznych pokazujących, że agonista dopaminy podawany do jądra przykomorowego jest w stanie zwiększyć ciśnienie wewnątrznaczyniowe u obudzonych samców szczurów bez modyfikowania systemowego ciśnienia krwi (Chen i in. , 1999, Giuliano i Allard, 2001), jak stwierdzono po wstrzyknięciu ogólnoustrojowym (Bernabè i wsp., 1999). Te badania również potwierdziły główną rolę receptorów D2, ponieważ agoniści receptora D1 zwykle nie byli w stanie zwiększyć ciśnienia śródbłonka po wstrzyknięciu do jądra przykomorowego (Chen i wsp., 1999).
Dostępnych było wówczas kilka linii eksperymentalnych dowodów sugerujących, że paramterokomórkowe receptory D2, których stymulacja wywołuje erekcję prącia, znajdują się w ciałach komórkowych neuronów oksytocynergicznych. Po pierwsze, jądro przykomorowe zawiera terminale dopaminergiczne, które należą do tzw. Neuronów dopaminergicznych. Ciała komórkowe tych neuronów znajdują się w grupie A13 i A14 Dahlstrom i Fuxe (1964), rozlegle otaczają i unerwiają kilka struktur podwzgórzowych, w tym okołomokręgowe neurony oksytocynergiczne, wystające do neurofauzy i / lub pozawązłowych obszarów mózgu (Buijs i wsp., 1984, Lindvall i wsp., 1984).
Zaangażowanie neuronów dopaminergicznych na poziomie okołokorzeniowym w kontrolę wzwodu prącia i kopulacji jest potwierdzone przez badania mikrodializacyjne wskazujące, że stężenia pozakomórkowej dopaminy i kwasu 3,4-dihydroksyfenylooctowego (DOPAC), jego głównego metabolitu, są zwiększone w dializacie uzyskanym z jądro przykomorowe silnych płciowo samców szczurów wykazujących bezstykowe erekcje, gdy są umieszczone w obecności niedostępnej owczej wyciętej estrogenowo + progesteronowej, wczepionej samicy (Melis i wsp., 2003).
Wzrost stężenia dopaminy i DOPAC był nawet wyższy, gdy pozwolono na kopulację z receptywną samicą (Melis i wsp., 2003), jak stwierdzono w przyśrodkowej strefie przedwzrokowej (Hull i wsp., 1995) oraz w jądrze półleżącym (Pfaus). i Everitt, 1995). Po drugie, w kilku badaniach wykazano, że erekcja prącia indukowana przez stymulację parokomórkowych receptorów D2 jest mediowana przez oksytocynę uwalnianą w tych obszarach. Odpowiednio, stwierdzono, że apomorfina podawana w dawkach, które indukują erekcję prącia, może zwiększać stężenie oksytocyny, nie tylko w osoczu szczurów i małp (Melis i wsp., 1989a, Cameron i wsp., 1992), ale także w mózgu poza podwzgórzaczem obszary, takie jak hipokamp (Melis i wsp., 1990). Zgodnie z tymi wynikami, ostatnio wykazano, że apomorfina wstrzykiwana do jądra przykomorowego w dawce powodującej erekcję prącia jest w stanie zwiększyć również pozakomórkowe stężenie dopaminy w jądrze półleżącym, efekt zmniejszony przez antagonistę receptora oksytocynowego d (CH2) 5Tyr (Me) 2-Orn8-vasotocin wstrzyknięty do brzusznego obszaru nakrywkowego (Succu i wsp., 2007, Melis i wsp., 2009a) (patrz także Rozdział 4). Po trzecie, obustronne uszkodzenia elektrolityczne jądra przykomorowego, które prawie całkowicie eliminują oksytocynę z podwzgórzowych obszarów mózgu (Hawthorn i wsp., 1985), znoszą apomorficzną erekcję prącia (Argiolas i wsp., 1987a) i selektywnych antagonistów receptora oksytocyny podawana do bocznych komór, ale nie do jądra przykomorowego, zmniejsza zależną od dawki apomorfinową erekcję prącia o sile działania równoległej do tej dla tych związków w blokowaniu receptorów oksytocyny (Melis i wsp., 1989b). Antagoniści receptora oksytocynowego są również bardzo silni w zmniejszaniu ułatwiania męskich zachowań seksualnych indukowanych nie tylko przez oksytocynę, ale także przez apomorfinę (Argiolas i wsp., 1988, 1989).
Jeśli chodzi o mechanizm, w którym receptory D2 aktywowane przez dopaminę lub agonistów receptora dopaminy, zwiększają aktywność neuronów oksytocynergicznych, uwalniając tym samym oksytocynę w pozapłucnowych obszarach mózgu iw rdzeniu kręgowym, liczne dane eksperymentalne sprzywołują hipotezę, że stymulacja receptorów D2 zwiększa stężenie wewnątrzkomórkowych jonów Ca2 + w ciałach komórkowych neuronów oksytocynergicznych, prowadząc do aktywacji syntazy tlenku azotu, enzym zależny od Ca2 + -kalmoduliny, który jest obecny w tych ciałach komórkowych (Vincent i Kimura, 1992, Torres i wsp., 1993, Sanchez i wsp., 1994, Sato-Suzuki i wsp., 1998). Zwiększona produkcja tlenku azotu powoduje z kolei aktywację neuronów oksytocynergicznych. W związku z tym (1), erekcja prącia wywołana przez apomorfinę była zapobiegana przez organiczne blokery kanałów wapniowych i przez α-konotoksynę GVIA, silny i selektywny bloker zależnych od napięcia kanałów Ca2 + typu N (McCleskey i wsp., 1987), podawany do okołotworowej jądro (patrz Argiolas i wsp., 1990, i odnośniki w nim); (2) zapobiegał indukcji apomorfiny prącia przez inhibitory syntezy tlenku azotu podawane do jądra okołokomorowego (Melis i wsp., 1994c); i (3) agomisty apomorfiny i innych agonistów receptora D2 podawanych w dawkach, które wywołują erekcję prącia, zwiększają wytwarzanie tlenku azotu w dializacie śródkomorowym uzyskanym przez mikrodializę wewnątrzmózgową, wzrost ten został zmniejszony przez inhibitory parostatkowej syntazy tlenku azotu podawanej w dawkach, które zmniejszają Adenowrażanie prącia wywołane przez receptor D2 (Melis i wsp., 1996). Mechanizm za pomocą którego tlenek azotu aktywuje okołomorowe neurony oksytocynergiczne, jest wciąż nieznany, chociaż dostępne dane sugerują, że tlenek azotu działa jako wewnątrzkomórkowy przekaźnik i że nie uczestniczy w nim cyklaza guanylanowa. Istotnie, stwierdzono, że aktywny analog fosfodiestrotresoraz cyklicznej GMP, 8-bromocykliczny GMP, nie jest zdolny do wywołania erekcji prącia, gdy jest podany do jądra przykomorowego (Fig. 2) (patrz Melis i Argiolas, 1995b i odnośniki w nim).
Powyższą interpretację często uważano za mało przekonującą, głównie dlatego, że stymulacja receptorów dopaminowych D2 jest zazwyczaj sprzężona raczej z hamowaniem niż z pobudzaniem ciał komórkowych neuronów zawierających te receptory poprzez różne mechanizmy sprzężone z białkiem G (patrz Sokoloff i Schwartz, 1995). Jednak możliwe wyjaśnienie tej rozbieżności, która jest zgodna z bezpośrednią stymulacją okołoturbinowych neuronów oksytocynergicznych przez dopaminę, sugeruje ostatnio odkrycie D4 sprzężony z białkiem G receptor, członek rodziny receptorów D2 (D2, D3 i D4), którego stymulacja zwiększa dopływ Ca2 + w preparatach komórkowych zawierających sklonowaną wersję tego podtypu receptora (Moreland i wsp., 2004). Co ważniejsze, stwierdzono, że selektywny agonista receptora D4 (np. ABT 724) (maleinian N-metylo-4- (2-cyjanofenylo) piperazynil-3metylobenzamid) zdolny do wywoływania erekcji prącia u samców szczurów, gdy podaje się je układowo (Brioni i in., 2004). Efekt ten nie został stwierdzony dla selektywnego agonisty podtypu receptora D2 PNU-95666E (R-5,6-dihydro-N, N-dimetylo-4Himidazo [4,5,1-i] chinolin-5-amina) (Hsieh i wsp., 2004), który nie był również w stanie zwiększyć napływu Ca2 + w preparatach komórkowych zawierających sklonowaną wersję podtypu receptora D4 (Brioni i wsp., 2004, Moreland i wsp., 2004). Zgodnie z powyższą hipotezą i ustaleniami, PD 168,077 (maleinian N-metylo-4- (2-cyjanofenylo) piperazynil-3metylobenzamid), PIP-3EA (2- [4- (2-metoksyfenylo) piperazyn-1-ylmetylo] imidazo [1,2-a] pirydyna) i innych selektywnych agonistów receptora D4 (Heier i wsp., 1997, Melis i wsp., 2006b, Löber i wsp., 2009), stwierdzono, że mogą indukować erekcję prącia po wstrzyknięciu układowym, icv i do jądro przykomorowe, chociaż mniej skuteczne niż apomorfina. Efektowi erekcji tych agonistów receptora D4 zapobiegał L-745,870 (trichlorowodorek 3- (4- [chlorofenylo] piperazyn-1-yl) -metylo-1H-pirolo [2,3-B] pirydyny), selektywny receptor D4 antagonista (Patel i wsp., 1997, Melis i wsp., 2005, 2006b, Löber i wsp., 2009).
Ostatecznie, działanie pro-erekcyjne powyższych agonistów receptora D4 zostało również zmniejszone przez inhibitory syntazy tlenku azotu, podawane do jądra przykomorowego, oraz przez d (CH2) 5Tyr (Me) 2-Orn8-vasotocin, selektywnego antagonistę receptora oksytocyny dany ICV, ale nie w jądrze przykomorowym. Wyniki te są zgodne z hipotezą, że agoniści receptora D4 stymulują również neurony oksytocynowe przez aktywację syntazy tlenku azotu i uwalnianie oksytocyny w pozapłucnowych obszarach mózgu, co z kolei ułatwia erekcję penisa, jak pokazano dla apomorfiny i klasycznych agonistów D2 (Melis i in. , 2005, 2006b, Löber i wsp., 2009).
Powyższe wyniki potwierdzają również hipotezę, że dopamina indukuje erekcję prącia, działając na receptory D4 zlokalizowane na ciałach komórkowych okołomokręgowych neuronów oksytocynergicznych, i które powodują zwiększony napływ Ca2 + do ciał komórkowych neuronów oksytocynergicznych, prowadząc do zwiększonego wytwarzania tlenku azotu. Tlenek azotu z kolei aktywuje neurony oksytocynowe, aby uwolnić oksytocynę w zewnątrz podwzgórzowych obszarach mózgu iw rdzeniu kręgowym, jak już omówiono. Pod tym względem, Warto zauważyć, że receptory dopaminergiczne zostały zidentyfikowane w ciałach komórkowych neuronów oksytocynergicznych w jądrze przykomorowym dopiero niedawno przez podwójne badania immuno-fluorescencji z wysokoprecyzyjnymi przeciwciałami receptora D2, D3 i D4 oraz przeciwciałami oksytocyny. Badania te wykazały ekspresję wszystkich trzech podtypów receptora D2 (D2, D3 i D4), które są zlokalizowane oddzielnie w ciałach komórkowych neuronów oksytocynergicznych w jądrze przykomorowym (a także w jądrze nadoczodkowym i przyśrodkowym obszarze przedwzrocznym) (Baskerville) i Douglas, 2008, Baskerville i wsp., 2009).
Zapewnia to silne poparcie neuroanatomiczne możliwości, że agoniści receptora dopaminy i dopaminy typu D2 indukują erekcję prącia poprzez aktywację bezpośrednio neuronów oksytocynergicznych rzutujących na pozapłucne obszary mózgu wspomniane powyżejnp. rdzeń kręgowy, brzuszny obszar nakrywki, hipokamp i ciało migdałowate. Jednak odkrycia te nie zapewniają żadnej pomocy w identyfikacji podtypu / receptorów receptora D2, którego stymulacja powoduje odpowiedź erekcyjną. Niestety, nie można uzyskać żadnej pomocy nawet z badań mających na celu identyfikację neuronów oksytocynergicznych aktywowanych przez agonistów receptora dopaminy w jądrze przykomorowym. Rzeczywiście, pomimo różnej aktywności różnych podtypów receptorów dopaminy, albo mieszani agoniści receptora dopaminy (np. Apomorfina), albo selektywni agoniści receptora D2 (np. Chinpirol, który działa na wszystkie podtypy receptora D2) lub selektywni agoniści receptora D4 aktywacja neuronów oksytocynergicznych, mierzona wzrostem białka FOS w parokomórkowych neuronach oksytocynergicznych jądra przykomorowego (Bitner i wsp., 2006). Jednak odkrycie to zostało ostatnio zakwestionowane, ponieważ wzrost białka FOS w okołomotorowych neuronach oksytocynergicznych stwierdzono tylko wtedy, gdy erekcja prącia była indukowana przez chinolinolan, który działa głównie na podtypy receptorów D2 i D3, ale nie przez PD 168077, agonistę receptora D4, pomimo zdolności obu związków do indukowania odpowiedzi seksualnej (Baskerville i wsp., 2009).
Dalsze eksperymenty z selektywnymi agonistami innych podtypów receptora D2 (głównie D2 i D3) są następnie konieczne do zidentyfikowania dokładnej roli każdego podtypu receptora dopaminy w kontrolowaniu funkcji erekcji na poziomie okołokorzeniowym. W związku z tym, jak już wspominano wcześniej, apomorfina, która działa silnie na wszystkie podtypy receptorów dopaminowych (patrz Brioni i wsp., 2004, i odnośniki tam zawarte), jest o wiele bardziej skuteczna niż agoniści receptora D4 w indukowaniu erekcji prącia po wstrzyknięciu do parostatku jądro. Można to wytłumaczyć wyższym powinowactwem apomorfiny do receptorów D4 w porównaniu z agonistami testowanego receptora D4 lub alternatywnie agoniści receptora D4 mogą działać jako częściowi agoniści receptora D4 lub współistniejąca aktywacja różnych podtypów receptora dopaminy przez apomorfinę może wytwarzają wyższą aktywację neuronów oksytocynergicznych pośredniczących w eukcji prącia niż aktywację agonistami receptora D2 tylko podtypu receptora D4.
Interakcje między receptorami dopaminy D1 i D2 zostały już opisane w kontroli zachowań seksualnych na poziomie przyśrodkowego obszaru przedwzrocznego (patrz Hull i wsp., 1989). W przypadku, gdy niezdolność selektywnych agonistów receptora D2 do indukowania erekcji prącia (Hsieh i wsp., 2004) zostanie potwierdzona (ale zobacz Depoortère i wsp., 2009), na przykład nawet po wstrzyknięciu tych związków do jądra przykomorowego , główna rola receptorów D3 osobno lub razem z receptorami D4 w aktywacji neuronów oksytocynergicznych pośredniczących w erekcji prącia powinna być szczegółowo przeanalizowana (patrz Baskerville i wsp., 2009). Niestety, selektywni agoniści receptora D2 i D3 (np. Różniące się powinowactwem do tych dwóch podtypów receptorów przez co najmniej cztery / pięć rzędów wielkości in vitro) nie są obecnie dostępni. Z tego powodu ostatnia sugestia, że receptory D3 pośredniczą w erekcji prącia indukowanej przez klasycznych agonistów receptora D2, która opiera się głównie na zdolności przypuszczalnego antagonisty receptora D3 scharakteryzowanego w doświadczeniach in vitro, w celu zmniejszenia erekcji prącia indukowanej przez klasycznych agonistów D2, takich jak apomorfina, chinpirol i pramipeksol, które aktywnie aktywują wszystkie podtypy receptora D2 dopaminy (Collins i wsp., 2009), z pewnością wymagają walidacji z innymi eksperymentami. Ta walidacja jest konieczna również dlatego, że w tym badaniu nie stwierdzono działania agonistów receptora D4 na erekcję prącia, co jest uderzającym kontrastem z wynikami cytowanych powyżej badań, które demonstrują pro-erekcyjny efekt agonistów receptora D4. Rzeczywiście, nawet zdolność apomorfiny do indukowania erekcji prącia (i ziewania) u myszy z nokautem receptora D4 z siłą identyczną z tą obserwowaną u dzikich myszy z nokautem receptora D4 i ze zdolności antagonistów receptora D3 do zniesienia odpowiedzi apomorfiny u tych zwierząt ( Collins i wsp., 2009) nie można uznać za ostateczny dowód na selektywną rolę podtypu receptora D3 w erekcji prącia wywołanej przez agonistę receptora D2. Różnice między gatunkami, badania dotyczące ablacji genów receptorów neurotransmiterów / neuropeptydów i / lub neuroprzekaźników (neuroprzekaźniki / neuropeptyd i / lub neuroprzekaźnikowe receptory neuropeptydowe) zwykle powodują dalsze zamieszanie i komplikacje w potwierdzeniu domniemanej roli seksualnej neuroprzekaźników i / lub neuropeptydy i ich receptory. Mianowicie, ablacja genu oksytocyny wytwarza myszy z nokautem oksytocyny, które normalnie się kojarzą i kopulują, tak jakby oksytocyna nie była potrzebna do krycia i kopulacji. Również homozygotyczne myszy z nokautem oksytocyny wykazują normalne kojarzenie i poród, chociaż z wyraźnym upośledzeniem spuszczania mleka (Nishimori i wsp., 1996, Young i wsp., 1996). W wyniku ablacji genu kodującego neuronalną syntazę tlenku azotu, powstają również myszy z nokautem syntazy tlenku azotu, które normalnie łączą się i kopulują (Huang i wsp., 1993). Jednak wyniki te prawdopodobnie wskazują na ważną cechę fizjologii reprodukcyjnej, tj. Nadmiarowość systemów zaangażowanych w jej kontrolę na poziomie centralnym i obwodowym.
Taka nadmiarowość z pewnością ma pochodzenie ewolucyjne, ponieważ gwarantuje przejście genów do następnego pokolenia w celu przetrwania gatunku. Dlatego fakt, że ablacja genu receptora D4 nie zmienia efektu erekcji u apomorfiny, sugeruje, że receptory D4, takie jak oksytocyna i tlenek azotu, są tylko kilkoma mediatorami pracującymi w układach kontrolujących erekcję, niż sugerując, że nie ma żadnej roli dla tych receptorów w kontrolowaniu erekcji prącia i zachowań seksualnych. Niepowodzenie agonistów D4 w indukowaniu erekcji prącia, gdy podano ją systematycznie samcom szczurów różnych szczepów, ostatnio zgłoszono w innym badaniu (Depoortère i wsp., 2009). Jednak w przeciwieństwie do pracy Collinsa i in. (2009), i aby obraz roli różnych podtypów receptora D2 w kontroli wzwodu prącia był jeszcze bardziej zagadkowy, to badanie to pokazuje również, że przypuszczalnie selektywni antagoniści receptora D3 podawani układowo nie byli w stanie zmniejszyć erekcji prącia wywołanej przez apomorfinę w samce szczurów bardziej wrażliwe na pro-erekcyjne działanie apomorfiny, podczas gdy odpowiedź seksualna (i ziewanie) była antagonizowana przez selektywnego antagonistę D2 L-741,626 (3 - [[4- (4-chlorofenylo) -4-hydroksypiperydyna -1-ylo] metylo-1H-indol), prowadząc autorów do sugestii, że receptory D2, a nie receptory D3 i D4, odgrywają główną rolę w indukowanym przez agonistę D2 wzwodzie prącia (Depoortère i wsp., 2009). Wreszcie, możliwość, że pobudzający wpływ agonistów receptora dopaminy na neurony oksytocynergiczne pośredniczące w erekcji prącia, przynajmniej w części, jest pośredni, a nie bezpośredni, np. Zależny lub zależny od zmian w aktywności innych neuroprzekaźników neuroprzekaźników zdolnych do modulowania aktywności neurony oksytocynowe w jądrze przykomorowym nie mogą być całkowicie wykluczone.
3.2. Oddziaływanie kwasu glutaminowego i oksytocyny w jądrze przykomorowym
Jądro przykomorowe podwzgórza jest bardzo bogate w synapsy zawierające aminokwas pobudzający jako neuroprzekaźnik (np. Kwas glutaminowy i kwas asparaginowy) (Van Den Pol, 1991). Aminokwasy pobudzające w tym jądrze odgrywają liczne funkcje, w tym erekcję prącia i zachowania seksualne (Roeling i wsp., 1991, Melis i wsp., 1994b, 2000, 2004b). Odpowiednio, kwas N-metylo-d-asparaginowy (NMDA), selektywny agonista podtypu receptora NMDA, ale nie kwas (±) -_-amino-3-hydroksy-5-metylo-izoksazol-4-propionowy (AMPA) stwierdzono selektywnego agonistę podtypu receptora AMPA lub kwasu (±) -trans (1) -amino-1,3-cyklopentanodikarboksylowego (ACPD), selektywnego agonistę podtypu receptora metabotropowego, zdolnego do indukowania erekcji prącia po wstrzyknięciu do jądro przykomorowe swobodnie poruszających się szczurów (Melis i wsp., 1994b). Pro-erekcyjny efekt 948 MR Melis, A. Argiolas / Neuroscience i Biobehavioral Reviews 35 (2011) 939-955 NMDA został powstrzymany przez (+) MK-801, niekonkurencyjny antagonista receptora NMDA (Woodruff i wsp., 1987 ), wstrzyknięto do jądra okołokomorowego (Melis i wsp., 1994b). Zgodnie z tymi wynikami, w badaniach telemetrycznych mających na celu monitorowanie ciśnienia wewnątrznaczyniowego, stwierdzono, że NMDA jest znacznie bardziej aktywna niż agoniści innych podtypów receptora pobudzającego aminokwasu po wstrzyknięciu do jądra przykomorowego w zwiększaniu ciśnienia śródbłonkowego u obudzonych lub znieczulonych samców szczurów (Zahran i in. al., 2000, Chen i Chang, 2003).
Jak sugerowano powyżej dla oksytocyny i dopaminy, prawdopodobne jest, że receptory NMDA pośredniczące w erekcji prącia znajdują się w ciałach komórkowych neuronów oksytocynergicznych, ponieważ zakończenia nerwów aminokwasów pobudzających uderzają w komórki oksytocynergiczne w jądrze przykomorowym (Van Den Pol, 1991). Analogicznie do tego, co stwierdzono za pomocą agonistów receptora dopaminy, pro-ektylenowy efekt NMDA najwyraźniej pośredniczy w aktywacji neurotransmisji oksytocynergicznej, znoszonej przez antagonistę oksytocyny d (CH2) 5Tyr (Me) 2-Orn8-vasotocin podany icv, ale nie w jądro przykomorowe (patrz Argiolas and Melis, 1995, 2004, 2005 i zawarte w nim odniesienia). Podobnie indukowana przez NMDA aktywacja neurotransmisji oksytocynergicznej jest również drugorzędna w stosunku do aktywacji syntazy tlenku azotu, ponieważ zapobiegawczo indukowana przez NMDA erekcja prącia jest zapobiegana przez inhibitory syntazy tlenku azotu (ester metylowy N-Nitro-N-metylo-argininy i N- metylo-tio-l-cytrulina) podawana do jądra przykomorowego, a NMDA wstrzykiwana do jądra przykomorowego w dawkach, które indukują erekcję prącia, zwiększa wytwarzanie tlenku azotu w jądrze podwzgórzowym (patrz Argiolas and Melis, 1995, 2004, 2005 i odnośniki do niego). ). Jeśli chodzi o agonistów receptora dopaminy, indukowana przez NMDA aktywacja tlenku azotu może być również wtórna do zwiększonego napływu Ca2 + w oksytocynergicznych ciałach komórkowych poprzez kanały NMDA sprzężone z kanałem +, jak pokazano w kilku preparatach neuronowych (przegląd patrz Snyder, 2; Southam i Garthwaite, 1992, Schuman i Madison, 1993 i odnośniki w nim). Tlenek azotu z kolei aktywuje neurotransmisję oksytocynergiczną (patrz wyżej). Pochodzenie glutaminergicznych projekcji aktywujących okołoturbinowe neurony oksytocynergiczne pośredniczące w erekcji prącia jest nieznane, chociaż niektóre dowody neuroanatomiczne i elektrofizjologiczne sugerują, że mogą one pochodzić, przynajmniej częściowo, z hipokampa (Saphier i Feldman, 1987, Chen i wsp., 1992) . Chociaż konieczne są dalsze prace, aby lepiej scharakteryzować pochodzenie projekcji glutaminergicznych w jądrze przykomorowym, zaangażowanie badań nad kwasem glutaminowym w jądrze przykomorowym w kontroli erekcji prącia i zachowań seksualnych jest wyraźnie potwierdzone w badaniach mikrodializy. Odpowiednio, pozakomórkowe stężenia kwasu glutaminowego i kwasu asparaginowego były zwiększone w dializacie uzyskanym z jądra przykomorowego samców szczurów wykazujących bezstykowe erekcje, gdy umieszczono je w obecności niedostępnych szczurów z receptorami estrogenowo-progesteronowymi (Melis et al., 2004b), erekcje prącia, w których pośredniczy również aktywacja centralnej transmisji oksytocynowej (Melis i wsp., 1999a, b). Takie wzrosty stwierdzono jeszcze wyżej, gdy pozwolono na kopulację z receptywną samicą (Melis i wsp., 2004a). Zgodnie z hipotezą, że podwyższona aktywność aminokwasów pobudzających występuje w jądrze przykomorowym podczas wzwodu prącia i kopulacji, zarówno erekcje bezkontaktowe, jak i zachowanie kopulacyjne (podczas których występują kopulacyjne erekcje prącia) są zmniejszane przez blokadę receptorów NMDA w jądrze przykomorowym , a po tej redukcji następuje zmniejszenie wzrostu wytwarzania tlenku azotu, który występuje w tym podwzgórzowym jądrze w tych kontekstach fizjologicznych (Melis i wsp., 2000). Zwiększenie pozakomórkowego stężenia kwasu glutaminowego w następstwie zmniejszonego uwalniania GABA z zakończeń nerwów GABAergicznych, uderzających w pobudzające synapsy aminokwasowe zestawione z ciałami komórek oksytocynergicznych, znaleziono również w jądrze przykomorowym po zablokowaniu receptorów kannabinoidowych CB1 przez antagonistę CB1 SR 141761A, podawana do bocznych komór lub bezpośrednio do jądra przykomorowego w dawkach, które indukują erekcję prącia (patrz Succu i wsp., 2006, Castelli i wsp., 2007). Taki wzrost doprowadził do aktywacji syntazy tlenku azotu w ciałach komórkowych neuronów oksytocynergicznych, zwiększając produkcję tlenku azotu. Tlenek azotu z kolei aktywuje neurony oksytocynergiczne pośredniczące w erekcji prącia, jak opisano powyżej. Zgodnie z takim mechanizmem, indukowana przez SR 141761A erekcja prącia była zmniejszona przez blokadę receptorów NMDA i przez inhibitory syntezy tlenku azotu, ale nie przez blokadę receptorów dopaminy lub oksytocyny w jądrze przykomorowym, podczas gdy zapobiegała temu blokada centralne receptory oksytocynowe przez antagonistów receptora oksytocynowego, podane jako icv
3.3. Interakcja oksytocyny z dopaminą w obszarze brzusznym nakrywki
Oksytocyna indukuje erekcję prącia po wstrzyknięciu do części ogonowej brzusznej części nakrywki w sposób zależny od dawki (Melis i wsp., 2007). Najniższą aktywną dawką wstrzykiwaną jednostronnie była 20 ng, podczas gdy najwyższą badaną dawką był 100 ng. W efekcie oksytocyny pośredniczy aktywacja receptorów oksytocynergicznych, ponieważ odpowiedź seksualna jest znoszona przez wcześniejsze wstrzyknięcie antagonisty oksytocyny d (CH2) 5Tyr (Me) 2-Orn8-vasotocin w ogonowej brzusznej części nakrywkowej. Receptory te są zlokalizowane w ciałach komórkowych neuronów dopaminergicznych, które kierują się głównie do powłoki jądra półleżącego. W związku z tym, podwójne badania immunofluorescencyjne (1) pokazują, że w odcinku ogonowym brzusznym obszarze nakrywowym włókna oksytocynowe są w bliskim kontakcie z ciałkami komórkowymi neuronów dopaminergicznych, z których większość została pozytywnie wyznakowana dla hydroksylazy tyrozynowej i zawierała znacznik retrogradacyjny Fluorogold poprzednio wstrzyknięty do otoczki jądra półleżącego (Melis i wsp., 2007) i (2) brzuszny obszar nakrywowy wywołany oksytocyną wzwód prącia występuje jednocześnie ze wzrostem stężenia pozakomórkowej dopaminy w dializacie otrzymanym z otoczki jądro półleżące (Melis i wsp., 2007). Oksytocyna wzwodu prącia występuje również wraz ze wzrostem wytwarzania tlenku azotu w brzusznym obszarze nakrywkowym, przy czym obie odpowiedzi są antagonizowane nie tylko przez d (CH2) 5Tyr (Me) 2-Orn8-vasotocin i przez inhibitor syntazy tlenku azotu S- metylo-tio-1-cytrulina, ale także przez _-conotoxin, zależny od napięcia bloker kanałów Ca2 + oraz ODQ (1H- [1,2,4] oksadiazol [4,3-a] chinoksalina-1-jeden), silny inhibitor guanylanu cyklaza, wszystkie podawane w ogonowej brzusznej strefie nakrywkowej przed oksytocyną (Succu i wsp., 2008). Ponieważ wiele ciałek komórek dopaminergicznych wyznakowanych Fluorogoldem, z którymi kontaktowały się włókna oksytocynowe, które okazały się dodatnie dla hydroksylazy tyrozynowej w ogonowym brzusznym obszarze nakrywkowym, zostały również pozytywnie wyznakowane dla syntazy tlenku azotu i cyklazy guanylowej (Succu i wsp., 2008), oksytocyny - w wyniku erekcji prącia może pośredniczyć następujący mechanizm. Aktywacja receptorów oksytocynergicznych w ciałkach dopaminergicznych przez peptyd zwiększa dopływ Ca2 + do ciał komórek neuronów dopaminergicznych. Uaktywnia to syntezę tlenku azotu, enzym zależny od Ca2 + i kalmoduliny, zwiększając w ten sposób wytwarzanie tlenku azotu. Tlenek azotu z kolei aktywuje cyklazę guanylanową, prowadząc do zwiększonego stężenia cyklicznej GMP. Cykliczna GMP aktywuje neurony dopaminergiczne wystające do jądra półleżącego. Rola cyklicznej GMP w wzwodzie prącia wywołanej przez oksytocynę wstrzykniętą w ogonową brzuszną część nakrywkową jest również potwierdzona przez zdolność 8-bromo-cyklicznego GMP, aktywnego opornego fosfodiesterazy analogu cyklicznej GMP, do indukowania erekcji prącia po wstrzyknięciu do ogoniasty brzuszny obszar nakrywowy, oraz w celu zwiększenia pozakomórkowej dopaminy w dializacie z jądra półleżącego (Succu i wsp., 2008, Melis i wsp., 2009a). Jest to niezgodne z mechanizmem, w którym tlenek azotu aktywuje neurony oksytocynergiczne w jądrze przykomorowym, przy czym GMP 8-bromocykliczny nie jest w stanie wywołać erekcji prącia po wstrzyknięciu do tego jądra (Melis i Argiolas, 1995b) (ryc. 2). Jeśli chodzi o szlaki nerwowe aktywowane przez dopaminę w jądrze półleżącym prowadzącym do erekcji prącia, są one nadal nieznane. Jednak dostępne dane sugerują, że te szlaki aktywują neurotransmisję dopaminy w jądrze przykomorowym podwzgórza. W związku z tym wzwód prącia wywołany oksytocyną występuje jednocześnie ze zwiększeniem pozakomórkowej dopaminy nie tylko w jądro półleżące, ale także w jądrze przykomorowym, i jest antagonizowane przez antagonistę receptora dopaminy haloperidol wstrzykiwany do jądra przykomorowego (Melis i wsp., 2007). ZAW sumie wyniki te potwierdzają pogląd, że neurony oksytocynowe pochodzące z jądra przykomorowego i wystające do ogona brzusznego obszaru nakrywki, gdy aktywowane uwalnianie oksytocyny w tym obszarze, aktywują w ten sposób system sygnalizacji GMP o cyklu NO, co z kolei aktywuje mezolimbiczne neurony dopaminergiczne (Melis i wsp., 2007, 2009a, Succu i wsp., 2008). Dopamina uwalniana w jądrze półleżącym z kolei aktywuje szlaki neuronowe prowadzące do aktywacji neuronów dopaminergicznych, które stymulują okołostawowe neurony oksytocynergiczne wystające do erekcji prącia pośredniczącej w rdzeniu kręgowym. W tym samym czasie uwalniana dopamina w jądrze przykomorowym może również aktywować neurony oksytocynowe rzutowane na zewnątrz podwzgórzowe obszary mózgu, takie jak brzuszny obszar nakrywowy, hipokamp, ciało migdałowate i być może inne obszary mózgu.
Jak wspomniano powyżej, zgodnie z tą hipotezą, apomorfina wstrzyknięta do jądra przykomorowego w dawce, która indukuje erekcję prącia, zwiększa także pozakomórkowe stężenie dopaminy w jądrze półleżącym, efekt zmniejszany przez antagonistę receptora oksytocynowego d (CH2) 5Tyr (Me ) 2-Orn8-vasotocin wstrzyknięty do brzusznego obszaru nakrywkowego (Succu i wsp., 2007, Melis i wsp., 2009a). Łącznie powyższe ścieżki nerwowe mogą stanowić hipotetyczny układ nerwowy obejmujący dopaminę, oksytocynę i inne neuroprzekaźniki (np. Kwas glutaminowy, patrz poniżej) wpływające nie tylko na sprawność seksualną, ale także na motywację seksualną i satysfakcję seksualną (patrz rozdział 4).
3.4. Interakcja oksytocynowo-glutaminowa w przedsionku brzusznym hipokampa
Oksytocyna indukuje erekcję prącia po wstrzyknięciu do brzusznej części pleców, ale nie w grzbietowy podskór, w sposób zależny od dawki (Melis i wsp., 2009b). W odpowiedzi seksualnej pośredniczy stymulacja receptorów oksytocyny, która została zniesiona przez wcześniejsze wstrzyknięcie dazonu (X) 2Tyr (Me) 5-Orn2-vasotocin podanego w tym samym miejscu oksytocyny, co stwierdzono w innych obszarach mózgu (patrz powyżej). . Jeśli chodzi o lokalizację tych receptorów, dostępne dane sugerują, że są zlokalizowane w ciałach komórkowych neuronów bogatych w syntazę tlenku azotu.
W związku z tym, badania mikrodializy pokazują, że erekcja prącia wywołana przez oksytocynę występuje jednocześnie ze wzrostem produkcji tlenku azotu w podskórnym brzusznym, a wzrost ten jest znoszony nie tylko przez wcześniejsze wstrzyknięcie inhibitora tlenku azotu S-metylo-tio-1-cytruliny. i przez hemoglobinę zmiataczem tlenku azotu, ale także przez d (CH2) 5Tyr (Me) 2-Orn8-vasotocin, wszystkie podane w tym samym miejscu oksytocyny w dawkach, które antagonizują wzwód prącia (Melis i wsp., 2010). Co ważniejsze, wzwód prącia indukowany oksytocyną występuje również wraz ze wzrostem stężenia pozakomórkowego kwasu glutaminowego w podskładce brzusznej, który jest tylko częściowo antagonizowany przez niekonkurencyjnego antagonistę receptora NMDA (+) MK-801 podawanego do brzuszne subiculum (Melis i wsp., 2010). Łącznie wyniki te sugerują, że nowo powstały tlenek azotu, działając jako międzykomórkowy przekaźnik, aktywuje neurotransmisję kwasu glutaminowego prowadzącą do erekcji prącia, prawdopodobnie przez neuronalne projekcje odprowadzające z brzusznej subiculum do dodatkowych obszarów mózgu hipokampa. Zgodnie z tą hipotezą, NMDA wstrzyknięte do podskładnicy brzusznej indukuje erekcję prącia w sposób zależny od dawki, a efekt ten jest całkowicie antagonizowany przez wcześniejsze wstrzyknięcie do tego samego miejsca (+) MK-801, ale nie przez S-metylo-tio-1-cytrulinę hemoglobina lub d (CH2) 5Tyr (Me) 2-Orn8-vasotocin (Melis i wsp., 2010). Jeśli chodzi o neuroprzekaźnikowe szlaki odprowadzające skierowane na obszary mózgu w hipokampie pobudzone przez aminokwasy pobudzające (tj. Kwas glutaminowy) w obrębie brzusznego podkowca, jest prawdopodobne, że są to glutamatergiczne, podobnie jak większość projekcji eferentnych hipokampa. W tej chwili można tylko zasugerować, że te projekcje modulują aktywność neuronów dopaminergicznych mezolimbicznych, które z kolei modulują aktywność neuronów dopaminergicznych zewnątrzortalamowych w jądrze przykomorowym, prowadząc do aktywacji neuronów oksytocynergicznych pośredniczenie w erekcji prącia, jak już omówiono (patrz wyżej).
Odpowiednio, wzwód prącia indukowany przez brzuszny podskok oksytocyny występuje równocześnie ze wzrostem stężenia pozakomórkowej dopaminy w powłoce jądra półleżącego, i ten wzrost, podobnie jak erekcja prącia, jest zniesiony przez d (CH2) 5Tyr (Me) 2- Orn8-vasotocin podawany do przedsionka brzusznego przed oksytocyną (Melis i wsp., 2009b). Ponadto, ponieważ brzuszny podskok oksytocyna indukował erekcję prącia jest również zmniejszona przez (+) MK-801 wstrzyknięty do brzusznego obszaru nakrywkowego, ale nie do jądra półleżącego (Melis i wsp., 2009b) i występuje równocześnie ze zwiększeniem zewnątrzkomórkowego kwas glutaminowy w brzusznym obszarze nakrywowym, ale nie w jądrze półleżącym, będącym obydwoma odpowiedziami zniesionymi przez d (CH2) 5Tyr (Me) -Orn8-vasotocin, wstrzyknięte do przedsionka brzusznego przed oksytocyną (patrz Fig. 3), jest prawdopodobne, że aktywacja mezolimbicznych neuronów dopaminergicznych jest wtórna do zwiększonej neurotransmisji glutaminergicznej w brzusznym obszarze nakrywowym. Sugeruje to, że interakcja między glutaminą i dopaminą, która kontroluje erekcję prącia, występuje w brzusznym obszarze nakrywowym. Konieczne są dalsze badania, aby ustalić, czy pro-erekcyjne odprowadzeniowe drogi glutametergiczne od podskładnika do brzusznego obszaru nakrywkowego są bezpośrednie lub pośrednie, tj. Przez korę przedczołową lub inne obszary mózgu (patrz Melis i wsp., 2009b i odnośniki w nim). Ponieważ jądro przykomorowe również otrzymuje projekcje glutaminergiczne od hipokampa (patrz wyżej i Saphier i Feldman, 1987), i Kwas glutaminowy aktywuje okołonookresowe neurony oksytocynergiczne, w tym te skierowane na brzuszny obszar nakrywowy (patrz Argiolas and Melis, 2005 i zawarte w nim odniesienia), oraz oksytocyna w obszarze brzusznym nakłucia indukuje erekcję prącia i zwiększa aktywność neuronów dopaminergicznych mezolimbicznychs (patrz wyżej), kusi spekulować, że sokrężno-okrężne neurony oksytocynowe mogą być również zaangażowane, przynajmniej częściowo, w aktywację mezolimbicznych neuronów dopaminergicznych przez oksytocynę wstrzykniętą do podskładnicy brzusznej (patrz rozdział 4).
4. Uwagi końcowe
Powyższe badania potwierdzają i rozszerzają wczesne wyniki, z których wynika, że u samców szczurów oksytocyna odgrywa kluczową rolę w centralnej kontroli wzwodu prącia na poziomie jądra przykomorowego podwzgórza i rdzenia kręgowego. W szczególności najbardziej reCentowe badania pokazują, że oksytocyna wpływa na erekcję prącia także poprzez działanie w innych obszarach mózgu, tj. brzusznej części nakrywkowej, brzusznym podglebie i tylno-przyśrodkowym jądrze jądra migdałowatego..
Na poziomie okołokorzeniowym najważniejszym nowym odkryciem jest prawdopodobnie odkrycie ekspresji wszystkich receptorów dopaminowych z rodziny D2 (D2, D3 i D4) w ciałach komórkowych neuronów oksytocynergicznych w jądrze przykomorowym (oraz w jądrze nadpłytkowym i przyśrodkowy obszar przedwzrokowy) (Baskerville i Douglas, 2008, Baskerville i wsp., 2009). Zapewnia to silny neuroanatomiczny popierają hipotezę, że agoniści receptorów dopaminowych i dopaminowych mogą aktywować bezpośrednio neurony oksytocynergiczne zaangażowane w proces erekcji i rzutować nie tylko na rdzeń kręgowy, ale także na pozahurtaliczne obszary mózgu. W związku z tym ważne jest również odkrycie, że indukowany przez agonistę dopaminę dopaminę wzrost ciśnienia wewnątrznaczyniowego jest zmniejszony przez blokadę receptorów oksytocynergicznych w rdzeniu kręgowym lędźwiowo-krzyżowym (Baskerville i wsp., 2009). Rzeczywiście, chociaż takie dowody uzyskano u znieczulonych samców szczurów, odkrycie potwierdza aktywację szlaku zstępującego okrężno-rdzeniowo-rdzeniowego oksytocynergicznego zaangażowanego w erekcję prącia wywołaną przez agonistę receptora dopaminy. Hniemniej jednak należy jeszcze sprawdzić, czy wzwód prącia wywołany przez stymulację receptorów dopaminy obecnych w ciałach komórek oksytocynergicznych jest drugorzędny w stosunku do aktywacji specyficznego podtypu receptora dopaminy z rodziny D2 (D2, D3 lub D4) lub jeśli te podtypy receptorów współdziałają w modulowaniu odpowiedzi erekcyjnej, możliwie w różny sposób w zależności od kontekstu, w którym występuje erekcja prącia (patrz Moreland i wsp., 2004, Enguehard-Gueiffier i wsp., 2006, Melis i wsp., 2006a, b; Löber i wsp., 2009, Collins i wsp., 2009, Depoortère i wsp., 2009, Baskerville i wsp., 2009).
Innym ważnym nowym odkryciem jest to, że oksytocyna indukuje erekcję prącia po wstrzyknięciu nie tylko do jądra przykomorkowego lub pola CA1 hipokampa, ale także do brzusznej części nakrywki, brzusznej podstawy i tylno-przyśrodkowego jądra jądra migdałowatego. Te obszary mózgu nie były testowane we wcześniejszych badaniach pokazujących, że oksytocyna zwiększała spontaniczne epizody erekcji prącia u samców szczurów, chociaż otrzymują one podobne okrężno-sakralne projekcje oksytocynergiczne rdzenia kręgowego z jądra przykomorowego. Oksytocyna rzeczywiście okazała się zdolna do zwiększania spontanicznych epizodów wzwodu prącia, które występują u dorosłych samców szczurów w nieobecności jakichkolwiek bodźców seksualnych, takich jak te, które pochodzą z obecności dostępnego lub niedostępnego samicy szczura z wyciętymi jajnikami z receptorem (estrogen-progesteron) manipulowanie genitaliami, po wszczepieniu do jądra przykomorowego i pola CA1 hipokampa, ale nie w grzbiecie grzbietowym, przegrodzie bocznej, jądrze ogoniastym, przyśrodkowym obszarze przedwzrocznym, jądrze brzuszno-przyśrodkowym i jądrze nadpktycznym (Melis et al. , 1986). We wszystkich tych badaniach erekcja prącia była zwykle liczona, gdy penis wyłonił się z pochwy penisa przez obserwatora, który nie był świadomy danych zabiegów bezpośrednio podczas eksperymentu lub później, obserwując eksperyment zarejestrowany na taśmie wideo za pomocą kamery wideo. Każdy epizod wzwodu prącia trwa przez 0.5-1 min i zwykle towarzyszy mu uwodzenie prącia i / lub zgięcia bioder. Zwykle u szczurów nie przeprowadza się żadnego eksperymentu, aby ustalić wpływ doświadczenia seksualnego, wieku lub, czy te szczury można podzielić na nisko lub wysoko reagujących na pro-erekcyjny efekt oksytocyny wstrzykniętej do różnych obszarów mózgu. Odnosi się to również do większości badań nad pro-erekcyjnym działaniem innych neuropeptydów i leków, które zwiększają spontaniczne epizody wzwodu prącia, w tym agonistów dopaminy, aminokwasów pobudzających, ACTH-MSH, heksareliny i peptydów VGF. Jednak efekt erekcji tych związków został wielokrotnie potwierdzony metodami telemetrycznymi, które determinują występowanie erekcji prącia przez wzrost ciśnienia wewnątrznaczyniowego, który pojawia się spontanicznie lub po podaniu tych związków różnymi drogami, tj. Układowo, do komór mózgowo-rdzeniowych lub bezpośrednio do określonych jąder mózgu, po wszczepieniu mikrociera- nia ciśnieniowego bezpośrednio do ciał jamistych (patrz Bernabè i wsp., 1999). W brzusznym obszarze nakrywkowym, brzusznym podglebie i tylno-przyśrodkowym jądrze migdałowatym również oksytocyna indukuje erekcję prącia przez działanie na receptory oksytocynergiczne. Prowadzi to do aktywacji mezolimbicznych neuronów dopaminergicznych pochodzących z brzusznej części nakrywki i wystających do powłoki jądra półleżącego, mierzone wzrostem pozakomórkowego stężenia dopaminy w dializacie uzyskanym ze skorupy jądra półleżącego i zmniejszeniem odpowiedzi erekcyjnej wywołanej przez peptyd wstrzyknięty do tych dodatkowych obszarów podwzgórzowych, stwierdzonych po zablokowaniu receptorów dopaminergicznych w jądro półleżowe (patrz poniżej). Jeśli chodzi o mechanizmy aktywowane przez stymulację receptorów oksytocynergicznych w tych obszarach mózgu, które prowadzą do aktywacji mezolimbicznych neuronów dopaminergicznych i erekcji prącia, najlepiej wyjaśnione są te, które występują w ogonowej części brzusznej nakrywki. Rzeczywiście, tutaj wyniki farmakologiczne i immunofluorescencji pokazują, że zakończenia nerwów oksytocyny uderzają w ciałka komórek neuronów dopaminergicznych wystających do otoczki jądra półleżącego (Melis i wsp., 2007, 2009a, Succu i wsp., 2008). Wiele z tych neuronów jest bogatych w syntazę tlenku azotu i cyklazę guanylanową. Stymulacja receptorów oksytocynergicznych w ciałach komórkowych tych neuronów dopaminergicznych powoduje aktywację syntazy tlenku azotu, co prowadzi do zwiększonego wytwarzania tlenku azotu. Tlenek azotu z kolei aktywuje cyklazę guanylanową, zwiększając w ten sposób stężenie cyklicznej GMP, co prowadzi do aktywacji mezolimbicznych neuronów dopaminergicznych i do uwalniania dopaminy w jądrze półleżącym, jak zmierzono przez zwiększenie zewnątrzkomórkowej dopaminy w dializacie z jądra półleżącego uzyskanego przez mikrodializę wewnątrzmózgową (Succu i wsp., 2008 ). Dopamina uwalniana w jądrze półleżącym z kolei aktywuje szlaki nerwowe prowadzące do erekcji prącia. Jest to wspierane przez zdolność antagonistów receptora dopaminy, haloperidolu i / lub cis-flupentiksolu, wstrzykiwanych do jądra półleżącego w celu zmniejszenia brzusznej ektresji prącia indukowanej oksytocyną (Succu i wsp., 2008). Jeden ze szlaków pro-erekcyjnych wydaje się aktywować neurony dopaminergiczne z wewnątrz-podwzgórzowej, w szczególności te, które wysyłają się do ciał komórkowych okołomokręgowych neuronów oksytocynergicznych. Istotnie, oksytocyna wstrzyknięta do ogonowej brzusznej części nakrywki zwiększa pozakomórkową dopaminę nie tylko w jądrze półleżącym, ale także w jądrze przykomorowym, a blokada receptorów dopaminowych w jądrze przykomorowym zmniejsza istotnie brzuszny obszar naklejenia wywołany oksytocyną wzwodu prącia (Succu et al. 2007, 2008, Melis i wsp., 2007, 2009a). Istnienie tego jądra accumbens dopaminowo-przynaczyniowo-dopamino-przykomorowo oksytocynowo-brzuszny obszar nakleju oksytocyna-dopamina jest również zasugerowana przez zdolność pro-erekcyjnej dawki apomorfiny i agonisty receptora D4 PD 168077 wstrzykniętego do jądra przykomorowego w celu zwiększenia pozakomórkowej dopaminy w otoczce jądra półleżącego (Succu i wsp., 2007), odpowiedź który jest znoszony przez d (CH2) 5Tyr (Me) -Orn8-vasotocin podawany do brzusznej okolicy nakrywkowej (Melis i wsp., 2009a, patrz również poniżej). Konieczne są jednak dalsze prace, aby zidentyfikować szlaki nerwowe łączące jądro półleżące z układem dopaminergicznym.
Mechanizm, za pomocą którego oksytocyna wywołuje erekcję prącia i aktywuje neurony dopaminergiczne mezolimbiny po wstrzyknięciu do przedsionka brzusznego lub do łożyskowej części jądra migdałowatego, jest obecnie tylko częściowo zrozumiały. Również w tych obszarach oksytocyna aktywuje własne receptory, które prowadzą do aktywacji syntazy tlenku azotu, co zwiększa produkcję tlenku azotu. Tlenek azotu z kolei aktywuje nieznane projekcje eferentne, które najwyraźniej zwiększają neuroprzekaźnictwo glutaminergiczne w brzusznym obszarze nakrywkowym. Kwas glutaminowy pobudza następnie mezolimbiczne neurony dopaminergiczne prowadzące do erekcji prącia. Hipoteza ta jest wspierana głównie przez zdolność oksytocyny wstrzykniętej do podskładki brzusznej w celu zwiększenia pozakomórkowego kwasu glutaminowego w brzusznym obszarze nakrywkowym (ryc. 3) i niekonkurencyjnego antagonisty receptora NMDA (+) MK-801 wstrzykniętego do brzusznej okolicy nakrywki, ale nie w jądrze półleżącym, w celu zmniejszenia erekcji prącia indukowanej przez oksytocynę wstrzykniętą albo do przedsionka brzusznego albo do jądra boczno-przyśrodkowego ciała migdałowatego (Melis i wsp., 2009b). W tej chwili dostępnych jest więcej szczegółów na temat wzwodu prącia wywołanego przez okostny brzuszne. Tutaj erekcja prącia wywołana przez oksytocynę wydaje się drugorzędna w stosunku do aktywacji receptorów oksytocynergicznych znajdujących się w ciałach komórkowych neuronów zawierających syntazę tlenku azotu. To powoduje wzrost produkcji tlenku azotu, który aktywuje neurotransmisję glutaminergiczną, działając jako komunikator międzykomórkowy z mechanizmem podobnym do opisanego dla długotrwałego wzmacniania (patrz Snyder, 1992, Southam i Garthwaite, 1993, Schuman i Madison, 2004) . Zgodnie z tą hipotezą wzwód prącia wywołany przez oksytocynę występuje jednocześnie ze zwiększeniem pozakomórkowego kwasu glutaminowego w dializacie z brzusznego podkowca, a stymulacja pobudzających receptorów aminokwasów w przedsionku brzusznym przez NMDA indukuje erekcję prącia. Kwas glutaminowy z kolei aktywuje neuronalne projekcje odprowadzające, które prowadzą do aktywacji mezolimbicznych neuronów dopaminergicznych w brzusznym obszarze nakrywkowym, jak podano powyżej. Jeśli te mechanizmy działają również w jądrze tylno-przyśrodkowym ciała migdałowatego, obecnie nie jest znane. Co więcej, konieczne są dalsze badania, aby udowodnić, że zakończenia nerwowe i receptory nerwów oksytocynergicznych (1) w przedsionku brzusznym iw tylnym jądrze migdałowatym są zlokalizowane w ciałach komórkowych neuronów zawierających syntazę tlenku azotu (2), jeśli te neurony są ostatecznie pod kontrolą synaps pobudzających aminokwasów (glutaminergicznych) i (3) w celu identyfikacji układu sygnałowego aktywowanego przez tlenek azotu. W związku z tym warto zauważyć, że zdolność oksytocyny do zwiększania aktywności syntezy tlenku azotu w ciałach komórkowych neuronów dopaminergicznych w ogonowej brzusznej części nakrywki i wciąż nieznanych neuronów w przedsionku brzusznym i łożyskowej części jądra migdałowatego przypomina zdolność oksytocyny do aktywowania syntazy tlenku azotu w ciałach komórkowych neuronów oksytocynergicznych w jądrze przykomorowym (Melis i wsp., 1997). Jednakże, podczas gdy w brzusznej strefie nakrywkowej zwiększona produkcja tlenku azotu w ciałach komórkowych neuronów dopaminergicznych prowadzi do aktywacji tych neuronów przez aktywację cyklazy guanylanowej i zwiększanie cyklicznej GMP, nie występuje to w jądrze przykomorowym. Odpowiednio, GMP 8-B-cykliczny wstrzyknięty do jądra przykomorowego nie wywołuje erekcji prącia, natomiast robi to po wstrzyknięciu do brzusznej części nakrywki. Inny szlak sygnałowy, inny niż azotowy, oksycykliczny układ GMP, jest następnie zaangażowany na poziomie okołomokręgowym w aktywacji neuronów oksytocynergicznych pośredniczących w erekcji prącia przez endogenny i / lub egzogenny tlenek azotu (Melis i Argiolas, 1995b, Melis i wsp., 1997) (Fig. . 1). Z drugiej strony wydaje się, że cykliczna GMP w brzusznym obszarze nakrywkowym odgrywa również kluczową rolę w aktywacji neuronów dopaminergicznych mezolimbicznych i w zwiększaniu pozakomórkowej dopaminy występującej w dializacie uzyskanym ze skorupy jądra półleżącego samców szczura. wybrane do pokazania lub nie pokazania bezkontaktowych erekcji prącia, gdy są umieszczone w obecności nieotwieranego samicy szczura, którym podawano owariektomię (estrogen + progesteron). W tych warunkach eksperymentalnych, u samców szczurów wykazujących bezkontaktowe erekcje prącia, stwierdzono wzrost zewnątrzkomórkowego stężenia dopaminy, zgodnie z oczekiwaniami, i ten wzrost jest dalej zwiększany, chociaż tylko nieznacznie, przez inhibitory fosfodiesterazy podawane w ogonowej części brzusznej nakrywki (Sanna et al., 2009).
Zdolność oksytocyny wstrzykniętej do brzusznej części nakrywki, w przedsionku brzusznym iw tylno-przyśrodkowym jądrze jądra migdałowatego, razem z agonistami dopaminy wstrzykniętymi do jądra przykomorowego, w celu indukcji erekcji prącia i aktywacji neuronów dopaminergicznych mezolimbicznych zasługuje na komentarz . Po pierwsze, mechanizmy podobne do tych przywołanych powyżej mogą działać, gdy erekcja prącia ma miejsce w kontekście fizjologicznym, na przykład podczas kopulacji (kiedy w kopulnej erekcji prącia występują) lub podczas bezdotykowej erekcji prącia. Te erekcje to eukcje prącia wywołane przez feromony, których nie można odróżnić od eukcji wywołanych przez leki lub oksytocynę, które występują, gdy seksualnie silne samce szczurów są wystawione na obecność niedostatecznie dostępnego samic szczura receptywnego (wyciętego jajnikiem estrogenowo-progesteronowego) i są uważane za wskaźnik seksualności. pobudzenie (Sachs, 1997, 2007). Rzeczywiście, chociaż wyniki te nie wykazują, że oksytocyna na tych obszarach odgrywa rolę w wzwodzie prącia występującym w kontekście fizjologicznym lub po podaniu leku, dodają one dalszej siły wczesnym odkryciom sugerującym, że te obszary mózgu należą do tych, w których oksytocyna podawana centralnie działa w celu zwiększenia nie tylko spontaniczne epizody wzwodu prącia obserwowane po lekach pro-erekcyjnych, ale także w celu poprawy zachowań seksualnych mężczyzn (i kobiet) (patrz Argiolas and Melis, 2004 i odnośniki w nim). Zgodnie z powyższym, stężenie oksytocyny wzrasta w hipokampie samców szczurów leczonych prowokująco dawką apomorfiny, klasycznego agonisty dopaminy (Melis i wsp., 1990) i d (CH2) 5Tyr (Me) -Orn8-vasotocin, który blokuje oksytocynę. receptory, jest niezwykle skuteczny nie tylko w zaburzeniu zachowania kopulacyjnego (Argiolas i wsp., 1987a), ale także w działaniu wspomagającym apomorfiny na męskie zachowania kopulacyjne (Argiolas i wsp., 1987b) u seksualnie silnych samców szczurów, podczas których w kopulnym wzwodzie prącia pojawić się. d (CH2) 5Tyr (Me) -Orn8-vasotocin jest również bardzo skuteczny w zmniejszaniu bezstykowej erekcji u seksualnie silnych samców szczurów, gdy podaje się go w nanogramach do bocznych komór, ale nie do PVN (Melis i wsp., 1999a).
Po drugie, mezolimbiczne neurony dopaminergiczne odgrywają kluczową rolę w motywacyjnych i nagradzających właściwościach naturalnych bodźców wzmacniających, takich jak jedzenie, woda i aktywność seksualna (Fibiger i Phillips, 1988, Wise i Rompre, 1989, Everitt, 1990). W szczególności wydaje się, że dopamina uwalniana z tych neuronów pośredniczy w transpozycji motywacyjnych aspektów naturalnych bodźców do zachowań ukierunkowanych na cel, na przykład w przypadku aktywności seksualnej, poszukiwania partnera seksualnego i stosunku płciowego, aby osiągnąć nagrodę i satysfakcję. (Goto and Grace, 2005). Zgodnie z powyższym, pozakomórkowe stężenie dopaminy zwiększa się w dializacie z jądra półleżącego u samców szczurów o seksualnie silnym działaniu, podczas ekspozycji na niedostępną szczurową samicę szczurów z niedoborem estrogenów i prekursorów progesteronu, i taki wzrost był nawet wyższy, gdy szczurowi pozwolono kopulować z receptywną samicą. (Pfaus i Everitt, 1995).
Po trzecie, niniejsze wyniki potwierdzają hipotezę, że obwód nerwowy łączy jądro przykomorowe z brzusznym obszarem nakrywkowym bezpośrednio lub pośrednio (przez przedsionek brzuszny i / lub tylno-przyśrodkowe jądro jądra migdałowatego) i jądro półleżące, a stąd przez nieznane wraca do jądra przykomorowego, aby kontrolować aktywność neuronów oksytocynergicznych rzutujących na rdzeniowy rdzeń kręgowy, który pośredniczy w erekcji prącia i neuronów oksytocynergicznych wystających na brzuszny obszar nakrywowy, brzuszny obszar podskórny i tylno-przyśrodkowe jądro jądra migdałowatego, modulując w ten sposób aktywność neuronów dopaminergicznych mezolimbicznych (ryc. 4). Ten złożony obwód nerwowy może odgrywać rolę w integracji czynności neuronalnych zaangażowanych w kontrolę aspektów konsumpcyjnych (erekcyjne wytrysku) i wyprzedzających (motywacyjnych i nagradzających) męskich zachowań seksualnych w kontekstach fizjologicznych. W rzeczywistości zewnątrzkomórkowa dopamina wzrasta w jądrze półleżącym (Pfaus i Everitt, 1995) oraz w jądrze przykomorowym seksualnie silnych samców szczurów podczas ekspozycji na niedostępną szczękę receptywną, gdy występują bezstykowe erekcje, a nawet więcej, gdy kopulacja jest dozwolona, np. gdy w kopulacie pojawiają się erekcje prącia (Melis i wsp., 2003). Tak więc, chociaż konieczne są dalsze badania w celu wyjaśnienia roli endogennej oksytocyny w brzusznej części nakrywki, brzusznym podglebie i ciele migdałowatym podczas bezkontaktowych erekcji i zachowań seksualnych, rozsądne może być założenie, że ten hipotetyczny obwód nerwowy, przyczyniając się do Konsumujące aspekty zachowań seksualnych, w tym samym czasie mogą również aktywować mezolimbiczny układ dopaminergiczny dostarczający neuronowego substratu do wyjaśnienia satysfakcjonujących właściwości aktywności seksualnej (Everitt, 1990, Pfaus i Everitt, 1995). W związku z tym należy zauważyć, że mezolimbiczny układ dopaminergiczny aktywowany przez oksytocynę wstrzykniętą do brzusznej okolicy nakrywkowej jest taki sam aktywowany przez leki nadużywające, takie jak opiaty, kanabinoidy, amfetamina, kokaina i alkohol (Tanda i wsp., 1997), i stwierdzono, że oksytocyna może zmniejszać tolerancję i uzależnienie od kokainy, morfiny, alkoholu i kanabinoidów (Kovacs i wsp., 1998, Cui i wsp., 2001). Podsumowując, wydaje się, że oksytocyna uwalniana nie tylko w brzusznym obszarze nakrywkowym, ale także w przedsionku brzusznym i tylno-przyśrodkowym jądrze jądra migdałowatego, może aktywować neurony dopaminergiczne mezolimbiczne, które mogą brać udział w apetytach i satysfakcjonujących skutkach aktywności seksualnej. . Aktywacja neuronów dopaminergicznych mezolimbicznych może być bezpośrednia, poprzez receptory oksytocynergiczne w ciałach komórkowych neuronów dopaminergicznych mezolimbicznych lub pośrednio poprzez aktywację neurotransmisji kwasu glutaminowego w brzusznym obszarze nakrywowym.
Dopamina uwalniana w powłoce jądra półleżącego moduluje z kolei aktywność neuronów dopaminergicznych zewnątrzortalamicznych w jądrze przykomorowym, powodując albo wzwód prącia (poprzez aktywację neuronów oksytocynowych wystających do rdzenia kręgowego), albo motywację seksualną i nagrodę (poprzez aktywację oksytocynergiczną neurony wystające do brzusznej części nakrywkowej, brzusznej podpory lub tylno-przyśrodkowego jądra jądra migdałowatego). Ponieważ dopamina jest również uwalniana w jądrze półleżącym jądra i jądrze przykomorowym, gdy występuje wzwód prącia w warunkach fizjologicznych (np. Bezkontaktowe erekcje i kopulacja) (Succu i wsp., 2007, Melis i wsp., 2003, 2007), jest to prawdopodobnie centralne neurony oksytocynergiczne uczestniczą w obwodach nerwowych pośredniczących w interakcji między układem dopaminergicznym do mezolimbiny i dopęcherzykowym. Te obwody neuronalne mogą odgrywać rolę nie tylko w fazach konsumpcyjnych zachowań seksualnych (np. Erekcja prącia i kopulacja), ale także w motywacji seksualnej, podnieceniu seksualnym i nagrodach seksualnych.
Schematyczne przedstawienie hipotetycznego układu nerwowego z udziałem oksytocyny wpływającego na motywację seksualną, satysfakcję i sprawność seksualną, jak sugerują wyniki tego rozdziału i poprzednie raporty. Neurony oksytocynowe pochodzące z jądra przykomorowego i wystające do rdzenia kręgowego, gdy są aktywowane na przykład przez dopaminę i kwas glutaminowy (ale także przez inne neuroprzekaźniki i / lub neuropeptydy), ułatwiają erekcję prącia i sprawność seksualną poprzez aktywację neuronów oksytocynergicznych wystających do rdzenia kręgowego. Dopamina i kwas glutaminowy (ale także neuroprzekaźniki i neuropeptydy) w jądrze przykomorowym także aktywują neurony oksytocynergiczne wystające do brzusznej części nakrywkowej, aktywując w ten sposób neurony dopaminergiczne mezolimbiny wystające do jądra półleżącego, modulując motywację seksualną i nagrodę. Dopamina uwalniana w jądrze półleżącym (NA) aktywuje z kolei wciąż nieznane szlaki neuronowe, które zwiększają aktywność neuronów dopaminergicznych dostarczanych przez podwzgórze (pochodzące z grup A13-A14 z Dahlstrom i Fuxe) uderzając w inne neurony oksytocynowe, w tym te, które projektują rdzeń kręgowy, prowadzący do erekcji prącia. Ten zespół obwodów elektrycznych może być również aktywowany przez oksytocynę, którą wstrzykuje się nie tylko do ogonowej brzusznej części nakrywki, ale także w brzusznym podglebie oraz w ciele migdałowatym, które również otrzymują oksytocynergiczne unerwienie z jądra przykomorowego, prawdopodobnie przez bezpośredni lub pośredni czynnik odprowadzający glutaminę do brzusznej części ciała. obszar nakrywowy, prowadzący do modulacji zarówno motywacji seksualnej, jak i erekcji prącia. Wreszcie, powyższy zespół obwodów elektrycznych może być również aktywowany przez bodźce seksualne i feromony, ponieważ zewnątrzkomórkowa dopamina i kwas glutaminowy zwiększają się w jądrze przykomorowym (oraz w przyśrodkowym obszarze przedwzrokowym) podczas e-akcji bezkontaktowych i kopulacji za pośrednictwem feromonów (odpowiednie odniesienia znajdują się w Lista referencyjna).
Podziękowania Ta praca została częściowo wsparta dotacją z włoskiego Ministerstwa Uniwersytetu i Badań na AA i MRM
Referencje
Andersson, KE, 2001. Farmakologia wzwodu prącia. Pharmacol. Rev 53, 417-450. Argiolas, A., 1994. Tlenek azotu jest centralnym mediatorem erekcji prącia. Neuropharmacology 33, 1339-1344. Argiolas, A., 1999. Neuropeptydy i zachowania seksualne. Neurosci. Biobehav. Rev 23, 1127-1142. Argiolas, A., Gessa, GL, 1991. Centralne funkcje oksytocyny. Neurosci. Biobehav. Rev 15, 217-231. Argiolas, A., Melis, MR, 1995. Neuromodulacja budowy prącia: przegląd roli neuroprzekaźników i neuropeptydów. Wałówka. Neurobiol. 47, 235-255. Argiolas, A., Melis, MR, 2004. Rola oksytocyny i jądra okołokomorowego w zachowaniach seksualnych ssaków płci męskiej. Physiol. Behav. 83, 309-317. Argiolas, A., Melis, MR, 2005. Centralna kontrola wzwodu prącia: rola jądra przykomorowego podwzgórza. Wałówka. Neurobiol. 76, 1-21. Argiolas, A., Collu, M., Gessa, GL, Melis, MR, Serra, G., 1988. Antagonista oksytocynowy d (CH2) 5Tyr (Me) -Orn8-vasotocin antagonizuje zachowania kopulacyjne samców u szczurów. E. J. Pharmacol. 149, 389-392. Argiolas, A., Collu, M., D'Aquila, P., Gessa, GL, Melis, MR, Serra, G., 1989. Stymulację apomorfiny męskiego zachowania kopulacyjnego zapobiega antagonista oksytocyny d (CH2) 5Tyr (Me) -Orn8-vasotocin u szczurów. Pharmacol. Biochem. Behav. 33, 81-83. Argiolas, A., Melis, MR, Gessa, GL, 1985. Okomorokortyna wewnątrzkomorowa wywołuje ziewanie i wzwód prącia u szczurów. E. J. Pharmacol. 117, 395-396. Argiolas, A., Melis, MR, Gessa, GL, 1986. Oksytocyna: niezwykle silny induktor wzwodu prącia i ziewania u samców szczura. E. J. Pharmacol. 130, 265-272. Argiolas, A., Melis, MR, Mauri, A., Gessa, GL, 1987a. Jądrowe uszkodzenie jądra zapobiega ziewaniu i erekcji prącia indukowanej przez apomorfinę i oksytocynę, ale nie przez ACTH u szczurów. Brain Res. 421, 349-352. Argiolas, A., Melis, MR, Vargiu, L., Mauri, A., Gessa, GL, 1987b. d (CH2) 5Tyr (Me) -Orn8-vasotocin, silny antagonista oksytocyny, antagonizuje erekcję prącia i ziewanie indukowane przez oksytocynę i apomorfinę, ale nie przez ACTH 1-24. E. J. Pharmacol. 134, 221-224. Argiolas, A., Melis, MR, Stancampiano, R., Gessa, GL, 1990. _-Conotoxin zapobiega erekcjom prącia wywołanym apomorfiną i oksytocyną oraz ziewaniu u samców szczura. Pharmacol. Biochem. Behav. 37, 253-257. Arletti, R., Bertolini, A., 1985. Oksytocyna stymuluje zachowanie lordozy u samic szczura. Neuropeptydy 6, 247-255. Arletti, R., Bazzani, C., Castelli, M., Bertolini, A., 1985. Oksytocyna poprawia męskie zdolności kopulacyjne u szczurów. Horm. Behav. 19, 14-20. Arletti, R., Benelli, A., Bertolini, A., 1990. Zachowanie seksualne starzejących się samców szczurów jest stymulowane przez oksytocynę. E. J. Pharmacol. 179, 377-382. Arletti, R., Calzà, L., Giardino, L., Benelli, A., Cavazzutti, E., Bertolini, A., 1997. Impotencja seksualna jest związana ze zmniejszoną produkcją oksytocyny i zwiększonym wytwarzaniem peptydów opioidowych w jądrze przykomorowym podwzgórza. Neurosci. Łotysz. 233, 65-68. Bancila, M., Giuliano, F., Rampin, O., Mailly, P., Brisorgueil, MJ, Clas, A., Verge, D., 2002. Dowody na bezpośrednią projekcję z jądra przykomorowego podwzgórza do przypuszczalnych neuronów serotoninergicznych jądra paragigantocellularis zaangażowanych w kontrolę wzwodu u szczurów. E. J. Neurosci. 16, 1240-1249. Burnett, AL, Lowenstein, CJ, Bredt, DS, Chang, TSK, Snyder, SH, 1992. Tlenek azotu: fizjologiczny mediator wzwodu prącia. Nauka 257, 401-403. Baskerville, TA, Douglas, AJ, 2008. Interakcje między dopaminą i oksytocyną w kontrolowaniu zachowań seksualnych. Wałówka. Brain Res. 170, 277-289. Baskerville, TA, Allard, J., Wayman, C., Douglas, AJ, 2009. Interakcja dopaminy i oksytocyny w erekcji prącia. E. J. Neurosci. 30, 2151-2164. Benelli, A., Bertolini, A., Poggioli, R., Cavazzutti, E., Calzà, L., Giardino, L., Arletti, R., 1995. Tlenek azotu bierze udział w zachowaniu seksualnym samców szczurów. E. J. Pharmacol. 294, 505-510. Bernabè, J., Rampin, O., Sachs, BD, Giuliano, F., 1999. Ciśnienie wewnątrzbrzuszne podczas wzwodu u szczurów: podejście integracyjne oparte na zapisie telemetrycznym. Am. J. Physiol. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. Sygnalizacja receptora dopaminowego D4 w jądrze podwzgórzowym szczura: dowody na naturalne sprzężenie obejmujące natychmiastowe wczesne indukowanie genów i fosforylację kinazy aktywowanej mitogenem. Neuropharmacology 50, 521-531. Brioni, JD, Moreland, RB, Cowart, M., Hsieh, GC, Stewart, AO, Hedlund, P., Donnelly-Roberts, DL, Nakane, M., Lynch 3rd., J., Kolasa, T., Polakowski , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. Aktywacja receptorów dopaminy D4 przez ABT-724 indukuje erekcję prącia u szczurów. Proc. Natl. Acad. Sci. USA 101, 6758-6763. Buijs, RM, 1978. Wewnątrzoponowe i zewnątrz podwzgórza szlaki wazopresyny i oksytocyny u szczurów. Cell Tissue Res. 192, 423-435. Buijs, RM, Geffard, M., Pool, CW, Hoorneman, EMD, 1984. Nerwowo-dopaminergiczne jądro supraoptyczne i przykomorowe. Badanie światłem i mikroskopem elektronowym. Brain Res. 323, 65-72. Caldwell, JD, Prange, AJ, Pedersen, CA, 1986. Oksytocyna ułatwia otyłość seksualną samic szczurów leczonych estrogenem. Neuropeptydy 7, 175-189. Cameron, JL, Pomerantz, SM, Layden, LM, Amico, JA, 1992. Dopaminergiczna stymulacja stężenia oksytocyny w osoczu męskich i żeńskich małp przez apomorfinę i agonistę receptora D2. J. Clin. Endocrinol. Metab. 75, 855-860. Canteras, NS, Simerly, RB, Swanson, LW, 1995. Organizacja projekcji z jądra środkowego ciała migdałowatego: badanie PHAL u szczura. J. Comp. Neurol. 360, 213-245. Carmichael, MS, Humbert, R., Dixen, J., Palmisano, G., Greeleaf, W., Davidson, JM, 1987. Osoczowy oksytocyna zwiększa ludzką odpowiedź seksualną. J. Clin. Endocrinol. Metab. 64, 27-31. Carter, CS, 1992. Oksytocyna i zachowania seksualne. Neurosci. Biobehav. Rev 16, 131-144. Carter, CS, Lederhendler, II, Kirkpatrick, B., 1997. Interaktywna neurobiologia afiliacji, Annals of New York Academy of Sciences, vol. 807. The New York Academy of Sciences, Nowy Jork. Castelli, MP, Piras, AP, Melis, T., Succu, S., Sanna, F., Melis, MR, Collu, S., Ennas, MG, Diaz, G., Mackie, K., Argiolas, A. , 2007. Receptory kannabinoidowe CB1 w jądrze przykomorowym i centralna kontrola wzwodu prącia: immunocytochemia, autoradiografia i badania behawioralne. Neuroscience 147, 197-206. Chen, KK, Chang, LS, 2003. Wpływ agonistów receptora pobudzającego aminokwasowego na erekcję prącia po podaniu do jądra przykomorowego podwzgórza u szczurów. J. Uroi. 62, 575-580. Chen, KK, Chan, JYH, Chang, LS, Chen, MT, Chang, SHH, 1992. Pobudzenie wzwodu prącia po aktywacji tworzenia się hipokampa u szczura. Neurosci. Łotysz. 141, 218-222. Chen, KK, Chan, JYH, Chang, LS, 1999. Neurotransmisja dopaminergiczna w jądrze przykomorowym podwzgórza w centralnej regulacji wzwodu prącia u szczura. J. Uroi. 162, 237-242. Collins, GT, Truccone, A., Haji-Abdi, F., Newman, AH, Grundt, P., Rice, KC, Mężowie, SM, Greedy, BM, Enguehard-Gueiffer, C., Gueiffer, A., Chen , J., Wang, S., Katz, JL, Grandy, DK, Sunahara, RK, Woods, JH, 2009. Pro-erekcyjne działanie agonistów dopaminyD2-podobnych zachodzi za pośrednictwem receptora D3 u szczurów i myszy. J. Pharmacol. Exp. Ther. 329, 210-217. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. Centralna regulacja wytrysku. Physiol. Behav. 83, 203-215. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., 2001. Zapobieganie syndromowi odstawienia kanabinoidów przez lit: zaangażowanie oksytocynergicznej aktywacji neuronów. J. Neurosci. 21, 9867-9876. Dahlstrom, A., Fuxe, K., 1964. Dowody na istnienie neuronów zawierających monoaminę w ośrodkowym układzie nerwowym. I. Demonstracja monoamin w ciałach komórek neuronów pnia mózgu. Acta Physiol. Scand. 62 (Suppl. 232), 1-54. Depoortère, R., Bardin, L., Rodrigues, M., Abrial, E., Aliaga, M., Newman-Tancredi, A., 2009. Wzmocnienie i ziewanie prącia indukowane przez dopaminowe agonisty receptora D2-podobnego u szczurów: wpływ szczepu i wkład dopaminy D2, ale nie receptorów D3 i D4. Behav. Pharmacol. 20, 303-311. Domes, G., Heinrichs, M., Buchel, C., Braus, DF, Herpertz, SC, 2007. Oksytocyna łagodzi reakcje migdałowate na twarze emocjonalne, niezależnie od wartościowości. Biol. Psychiatria 62, 11871190. Dominguez, J., Riolo, JV, Xu, Z., Hull, ME, 2001. Regulacja za pomocą środkowego ciała migdałowatego kopulacji i medialnego preoptycznego uwalniania dopaminy. J. Neurosci. 21, 349-355. Donaldson, ZR, Young, LJ, 2009. Oksytocyna, wazopresyna i neurogenetyka społeczna. Nauka 322, 900-904. Eaton, RG, Markowski, VF, Lumley, LA, Thompson, JT, Moses, J., Hull, EM, 1991. Receptory D2 w jądrze przykomorowym regulują odpowiedź narządów płciowych i kopulację u samców szczura. Pharmacol. Biochem. Behav. 39, 177-181. Ebner, K., Bosch, OJ, Krömer, SA, Singewald, N., Neumann, ID, 2005. Uwalnianie oksytocyny w centralnej części ciała migdałowatego szczurów moduluje zachowanie związane ze stresem i uwalnianie aminokwasów pobudzających. Neuropsychofarmakologia 30, 223-230. Enguehard-Gueiffier, C., Hübner, H., El Hakmaoui, A., Allouchi, H., Gmeiner, P., Argiolas, A., Melis, MR, Gueiffier, A., 2006. 2 - [(4-Phenylpiperazin-1-ylo) metylo] imidazo (di) azyn jako selektywnych ligandów D4. Indukcja wzwodu prącia przez 2- [4- (2-metoksyfenylo) piperazyn-1-ylometylo] imidazo [1,2-a] pirydynę (PIP3EA), silnego i selektywnego agonistę D4. J. Med. Chem. 49, 3938-3947. Everitt, BJ, 1990. Motywacja seksualna: neuronowa i behawioralna analiza mechanizmów leżących u podstaw odpowiedzi na apetyty i kopulacje samców szczurów. Neurosci. Biobehav. Rev 14, 217-232. Fibiger, HC, Phillips, AG, 1988. Mezokortykolimbiczny układ dopaminy i nagroda. Ann. N. Y. Acad. Sci. 5, 206-215. Francuski, SJ, Totterdell, S., 2003. Indywidualne neurony projekcyjne oparte na jądrze półleżącym przyjmują zarówno podstawno-boczne jądro migdałowate, jak i brzuszny podnóżek aferentny u szczurów. Neuroscience 119, 19-31. 954 MR Melis, A. Argiolas / Neuroscience and Biobehavioral Reviews 35 (2011) 939-955 Freund-Mercier, MJ, Richard, P., 1981. Podniecające działanie dokomorowych zastrzyków oksytocyny na odruch wyrzutu mleka u szczura. Neurosci. Łotysz. 23, 193-198. Freund-Mercier, MJ, Richard, P., 1984. Elektrofizjologiczne dowody ułatwiające kontrolę neuronów oksytocyny przez oksytocynę podczas ssania u szczura. J. Physiol. (Lond.) 352, 447-466. Freund-Mercier, MJ, Stoeckel, ME, 1995. Autoreceptory somatodendrytów na neuronach oksytocyny. W: Ivell, R., Russel, JA (Red.), Oksytocyna, podejście komórkowe i molekularne w medycynie i badaniach. Adv. Exp. Med. Biol., 365. Plenum Press, New York and London, pp. 185-194. Freund-Mercier, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, Richard, PH, Porte, A., 1987. Właściwości farmakologiczne i rozmieszczenie anatomiczne miejsc wiązania oksytocyny 3H w mózgu szczura Wistar zbadane autoradiografią. Neuroscience 20, 599-614. Giuliano, F., Rampin, O., 2000. Centralna kontrola wzwodu prącia. Neurosci. Biobehav. Rev 24, 517-533. Giuliano, F., Allard, J., 2001. Dopamina i funkcje seksualne. Int. J. Impotence Res. 13 (Suppl. 3), 18-28. Giuliano, F., Rampin, O., 2004. Kontrola neuronalna erekcji. Physiol. Behav. 83, 189-201. Giuliano, F., Bernabè, J., McKenna, KE, Longueville, F., Rampin, O., 2001. Rdzeniowe prorektylne działanie oksytocyny u znieczulonych szczurów. Am J. Physiol. Regul. Integ. Comp. Physiol. 280, R1870-R1877. Goto, Y., Grace, AA, 2005. Modulacja dopaminergiczna limbicznego i korowego napędu jądra półleżącego w zachowaniu ukierunkowanym. Nat. Neurosci. 8, 805-812. Hawthorn, J., Ang, VT, Jenkins, JS, 1985. Wpływ zmian w podwzgórzowych, okołostawowych, ponadoptycznych i nadskrzyżujcych jądrach na wazopresynie i oksytocynie w mózgu szczura i rdzenia kręgowego. Brain Res. 346, 51-57. Heier, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, Martin, LJ, Mauragis, MA, Piercey, MF, Nichols, NF, Schreur, PJ, Smith, MW, Księżyc, MW, 1997. Synteza i aktywności biologiczne (R) -5,6-dihydro-N, N-dimetylo-4H-imidazo [4,5,1-ij] chinolin-5-amina) i jego metabolity. J. Med. Chem. 40, 639-646. Hsieh, GC, Hollingsworth, PR, Martino, B., Chang, R., Terranova, MA, O'Neill, AB, Lynch, JJ, Moreland, RB, Donnelly-Roberts, DL, Kolasa, T., Mikusa, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004. Centralne mechanizmy regulujące wzwód prącia u przytomnych szczurów: układy dopaminergiczne związane z prorektalnym działaniem apomorfiny. J. Pharmacol. Exp. Ther. 308, 330-338. Huang, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, 1993. Ukierunkowane zakłócenie neuronalnego genu syntazy tlenku azotu. Komórka 75, 1273-1286. Huber, D., Veinante, P., Stoop, R., 2005. Wazopresyna i oksytocyna wzbudzają wyraźne populacje neuronów w centralnej części ciała migdałowatego. Nauka 308, 245-248. Hull, EM, Warner, RK, Bazzett, TJ, Eaton, RC, Thompson, JT, 1989. Stosunek D2 / D1 w środkowej części przedwzrokowej wpływa na kopulację samców szczura. J. Pharmacol. Exp. Ther. 251, 422-427. Hull, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. Dodatkowa komórkowa dopamina w środkowej części przedwzrostowej: implikacje dla motywacji seksualnej i hormonalnej kontroli kopulacji. J. Neurosci. 15, 7465-7471. Hull, EM, Meisel, RL, Sachs, BD, 2002. Męskie zachowania seksualne. W: Pfaff, DW, Arnold, AP, Etgen, AM, Fahrbach, SE, Rubin, RT (Red.), Hormony, mózg i zachowanie. Academic Press, New York, pp. 3-137. Hurlemann, R., Patin, A., Onur, OA, Cohen, MX, Baumgartner, T., Metzler, S., Dziobek, I., Gallinat, J., Wagner, M., Maier, W., Kendrick, KM, 2010. Oksytocyna wzmaga zależne od migdałowców, wzmocnione społecznie uczenie się i emocjonalną empatię u ludzi. J. Neurosci. 30, 4999-5007. Ivell, R., Russel, JA, 1995. Oksytocyna: Podejścia komórkowe i molekularne w medycynie i badaniach. Postępy w medycynie eksperymentalnej i biologii, tom. 395. Plenum Press, Nowy Jork. Kelley, AE, Domesick, VB, 1982. Rozkład projekcji od formacji hipokampa do jądra półleżącego u szczura: badanie peroksydazy chrzanowo-przedniej i wstecznej. Neuroscience 7, 2321-2335. Kimura, Y., Naitou, Y., Wanibuchi, F., Yamaguchi, T., 2008. Aktywacja receptora 5-HT (2C) jest powszechnym mechanizmem proergetycznego działania apomorfiny, oksytocyny i melanotanu II u szczurów. E. J. Pharmacol. 589, 157-162. Kondo, Y., Sachs, BD, Sakuma, Y., 1998. Znaczenie przyśrodkowego ciała migdałowatego w wzwodzie prącia szczura wywołanego przez odległe bodźce z kobiet płciowych. Behav. Brain Res. 91, 215-222. Kovacs, GL, Sarnyai, Z., Szabo, G., 1998. Oksytocyna i uzależnienie: recenzja. Psychoneuroendocrinology 23, 945-962. Lee, HJ, Macbeth, AH, Pagani, JH, Scott Young 3rd, W., 2009. Oksytocyna: wielki animator życia. Wałówka. Neurobiol. 88, 127-151. Lindvall, O., Bjorklund, A., Skagerberg, G., 1984. Selektywna istochemiczna demonstracja dopaminowych układów końcowych w diuretanie i teleencefalonie szczura: nowe dowody na unerwienie dopaminergiczne podwzgórzowych jąder neurosekrecyjnych. Brain Res. 306, 19-30. Liu, YC, Salamone, JD, Sachs, BD, 1997. Upośledzona odpowiedź seksualna po uszkodzeniach jądra przykomorowego podwzgórza u samców szczura. Behav. Neurosci. 111, 1361-1367. Löber, S., Tschammer, N., Hübner, H., Melis, MR, Argiolas, A., Gmeiner, P., 2009. Azulenowy szkielet jako nowy bioizoster: konstrukcja silnych ligandów receptora D4 dopaminy indukujących erekcję prącia. Chem. Med. Chem. 4, 325-328. McCleskey, EW, Fox, AP, Feldman, DH, Cruz, LJ, Olivera, BM, Tsien, RW, Yoshikami, D., 1987. _-Conotoxin: bezpośrednia i trwała blokada określonych typów kanałów wapniowych w neuronach, ale nie mięśni. Prot. Nat. Acad. Sci. USA 84, 4327-4331. McKenna, KE, 2000. Niektóre propozycje dotyczące organizacji kontroli ośrodkowego układu nerwowego w erekcji prącia. Neurosci. Biobehav. Rev 24, 535-540. Marson, L., McKenna, KE, 1992. Rola 5-hydroksytryptaminy w zmniejszaniu zahamowania odruchów seksualnych kręgosłupa. Exp. Brain Res. 88, 313-318. Marson, L., McKenna, KE, 1996. Grupy komórek OUN zaangażowane w kontrolę mięśni kulszowo-trzustkowych i bulwiastych: badanie transneuronalne z wykorzystaniem wirusa pseudowścieklizny. J. Comp. Neurol. 374, 161-179. Meisel, RL, Sachs, BD, 1994. Fizjologia męskich zachowań seksualnych. W: Knobil, E., Neil, J. (Red.), The Physiology of Reproduction, vol. 2, druga edycja. Raven Press, New York, pp. 3-96. Melin, P., Kihlstrom, JE, 1963. Wpływ oksytocyny na zachowania seksualne u samców królika. Endokrynologia 73, 433-435. Melis, MR, Argiolas, A., 1995a. Dopamina i zachowania seksualne. Neurosci. Biobehav. Rev 19, 19-38. Melis, MR, Argiolas, A., 1995b. Dawcy tlenku azotu indukują erekcję prącia i ziewanie po wstrzyknięciu do ośrodkowego układu nerwowego samców szczura. E. J. Pharmacol. 294, 1-9. Melis, MR, Argiolas, A., 2003. Centralna neurotransmisja oksytocynowa: cel leku w terapii psycogennych zaburzeń erekcji. Curr. Drug Targets 4, 55-66. Melis, MR, Argiolas, A., Gessa, GL, 1986. Oziębiony przez oksytocynę ziewanie i erekcja prącia: miejsce działania w mózgu. Brain Res. 398, 259-265. Melis, MR, Argiolas, A., Gessa, GL, 1987. Ziewanie wywołane apomorfiną i erekcja prącia: miejsce działania w mózgu. Brain Res. 415, 98-104. Melis, MR, Argiolas, A., Gessa, GL, 1989a. Apomorfina zwiększa poziomy oksytocyny w osoczu u szczurów. Neurosci. Łotysz. 98, 351-355. Melis, MR, Argiolas, A., Gessa, GL, 1989b. Dowody na to, że apomorfina wywołuje erekcję prącia i ziewanie poprzez uwalnianie oksytocyny w ośrodkowym układzie nerwowym. E. J. Phamacol. 164, 565-570. Melis, MR, Argiolas, A., Stancampiano, R., Gessa, GL, 1990. Wpływ apomorfiny na stężenie oksytocyny w różnych obszarach mózgu i osoczu samców szczurów. E. J. Pharmacol. 182, 101-107. Melis, MR, Mauri, A., Argiolas, A., 1994a. Wzmocnienie prącia wywołane przez apomorfinę i oksytocynę oraz ziewanie u nienaruszonych i wykastrowanych samców szczurów: wpływ sterydów płciowych. Neuroendokrynologia 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, A., 1994b. Erekcja prącia i ziewanie indukowane przez zastrzyki NMDA w części śródkomorowej są mediowane przez oksytocynę. Pharmacol. Biochem. Behav. 48, 203-207. Melis, MR, Stancampiano, R., Argiolas, A., 1994c. Zapobieganie za pomocą estru metylowego NG-nitro-l-argininy, wywołanej przez apomorfinę i oksytocynę, erekcji prącia i ziewanie: miejsce działania w mózgu. Pharmacol. Biochem. Behav. 48, 799-804. Melis, MR, Succu, S., Argiolas, A., 1996. Agoniści dopaminy zwiększają produkcję tlenku azotu w jądrze przykomorowym podwzgórza: korelację z erekcją prącia i ziewaniem. E. J. Neurosci. 8, 2056-2063. Melis, MR, Succu, S., Iannucci, U., Argiolas, A., 1997. Oksytocyna zwiększa produkcję tlenku azotu w jądrze przykomorowym podwzgórza: korelację z erekcją prącia i ziewaniem. Reg. Peptydy 69, 105-112. Melis, MR, Succu, S., Mauri, A., Argiolas, A., 1998. Wytwarzanie tlenku azotu wzrasta w jądrze przykomorowym podwzgórza samców szczura podczas bezdotykowego erekcji penisa i kopulacji. E. J. Neurosci. 10, 1968-1974. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 1999a. Antagonista oksytocynowy d (CH2) 5Tyr (Me) 2-Orn8-vasotocin zmniejsza bezdotykowe erekcje prącia u samców szczurów. Neurosci. Łotysz. 265, 171-174. Melis, MR, Succu, S., Spano, MS, Argiolas, A., 1999b. Morfina wstrzyknięta do jądra przykomorowego podwzgórza zapobiega nie-kontaktowym erekcjom i upośledza kopulację: zaangażowanie tlenku azotu. E. J. Neurosci. 11, 1857-1864. Melis, MR, Spano, MS, Succu, S., Argiolas, A., 2000. Wpływ antagonistów receptorów aminokwasowych pobudzających, dopaminowych i oksytocynowych na erekcje prącia bezkontaktowego i parostatniczną produkcję tlenku azotu u samców szczurów. Behav. Neurosci. 114, 849-857. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2003. Dodatkowa komórkowa dopamina wzrasta w jądrze przykomorowym samców szczura podczas aktywności seksualnej. E. J. Neurosci. 17, 1266-1272. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2004a. Antagonizm kannabinoidowych receptorów CB1 w jądrze przykomorowym samców szczura powoduje erekcję prącia. Neurosci. Łotysz. 359, 17-20. Melis, MR, Succu, S., Mascia, MS, Cortis, L., Argiolas, A., 2004b. Aminokwasy pobudzające zewnątrzkomórkowe wzrastają w jądrze przykomorowym samców szczura podczas aktywności seksualnej: główna rola receptorów NMR w erekcji. E. J. Neurosci. 19, 2569-2575. Melis, MR, Succu, S., Mascia, MS, Argiolas, A., 2005. PD-168,077, selektywny agonista receptora dopaminy D4, indukuje erekcję prącia po wstrzyknięciu do jądra przykomorowego samców szczura. Neurosci. Łotysz. 379, 59-62. Melis, MR, Succu, S., Mascia, MS, Sanna, F., Melis, T., Succu, S., Castelli, MP, Argiolas, A., 2006a. Wywoływane przez SR 141716A wzwody prącia u samców szczurów: zajęcie parapokularnego kwasu glutaminowego i tlenku azotu. Neuropharmacology 50, 219-228. Melis, MR, Succu, S., Sanna, F., Mascia, MS, Melis, T., Enguehard-Gueiffier, C., Hubner, H., Gmenier, P., Gueiffier, A., Argiolas, A., 2006b. PIP3EA i PD168077, dwaj selektywni agoniści receptora dopaminy D4, powodują erekcję prącia u samców szczura: miejsce i mechanizm działania w mózgu. E. J. Neurosci. 24, 2021-2030. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, A., Ferri, GL, Argiolas, A., 2007. Oksytocyna wstrzyknięta do brzusznej części nakrywki indukuje erekcję prącia i zwiększa zewnątrzkomórkową dopaminę w jądrze półleżącym MR Melis, A. Argiolas / Neuroscience and Biobehavioral Reviews 35 (2011) 939-955 955 i jądro przykomorowe podwzgórza samców szczurów. E. J. Neurosci. 26, 1026-1035. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, A., Argiolas, A., 2009a. Rola oksytocyny w fazach wyprzedzających i konsumpcyjnych zachowań seksualnych samca szczura. W: Jastrow, H., Feuerbach, D. (Eds.), Handbook of Oxytocin Research: Synthesis, Storage and Release, Actions and Drug forms. Nova Publishers Inc, New York, USA, pp. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, A., Argiolas, A., 2009b. Oksytocyna wstrzyknięta do przedsionka brzusznego lub tylno-przyśrodkowe jądro ciałka migdałowatego indukuje erekcję prącia i zwiększa pozakomórkową dopaminę w jądrze półleżącym samców szczurów. E. J. Neurosci. 30, 1349-1357. Melis, MR, Succu, S., Cocco, C., Caboni, E., Sanna, F., Boi, A., Ferri, GL, Argiolas, A., 2010. Oksytocyna wywołuje erekcję prącia po wstrzyknięciu do przedsionka brzusznego: rola tlenku azotu i kwasu glutaminowego. Neuropharmacology 58, 1153-1160. Moreland, RB, Nakane, M., Donnelly-Roberts, DL, Miller, LN, Chang, R., Uchic, ME, Terranova, MA, Gubbins, EJ, Helfrich, RJ, Namovic, MT, El-Kouhen, OF, Masters, JN, Brioni, JD, 2004. Porównawcza farmakologia ludzkich linii komórek dopaminowych D (2) podobnych do receptorów sprzężonych z przepływem wapnia przez Galpha (qo5). Biochem. Pharmacol. 68, 761-772. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, Richard, P., 1984. Uwalnianie oksytocyny i wazopresyny przez jądra wielkokomórkowe in vitro: specyficzne działanie ułatwiające oksytocynę we własnym uwalnianiu. J. Endocrinol. 102, 63-72. Murphy, MR, Seckl, JR, Burton, S., Checkley, SA, Lightman, SL, 1987. Zmiany w wydzielaniu oksytocyny i wazopresyny podczas aktywności seksualnej u mężczyzn. J. Clin. Endocrinol. Metab. 65, 738-741. Nishimori, K., Young, LJ, Guo, Q., Wang, Z., Insel, TR, Matzuk, MM, 1996. Oksytocyna jest wymagana do pielęgnacji, ale nie jest niezbędna do porodu lub zachowania reprodukcyjnego. Proc. Natl. Acad. Sci. USA 93, 11699-11704. Patel, S., Freedman, S., Chapman, KL, Emms, F., Fletcher, AE, Knowles, M., Marwood, R., Mccallister, G., Myers, J., Curtis, J., Kulagowski, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. Profil biologiczny L 745,870, selektywnego antagonisty o wysokim powinowactwie do receptora D4 dopaminy. J. Pharmacol. Exp. Ther. 283, 636-647. Pedersen, Kalifornia, Caldwell, JD, Jirikowski, GF, Insel, TR, 1992. Oksytocyna w zachowaniu macierzyńskim, seksualnym i społecznym, Annals of New York Academy of Sciences, vol. 652. The New York Academy of Sciences, Nowy Jork. Petrovic, P., Kalisch, R., Singer, T., Dolan, RJ, 2008. Oksytocyna łagodzi oceny afektywne kondycjonowanych twarzy i aktywności migdałowatej. J. Neurosci. 28, 6607-6615. Pfaus, JG, Everitt, BJ, 1995. Psychofarmakologia zachowań seksualnych. W: Knobil, FE, Kupfer, DJ (Red.), Psychopharmacology: The Fourth Generation of Progress. Raven Press, New York, pp. 742-758. Rajfer, J., Aronson, WJ, Bush, PA, Dorey, FJ, Ignarro, LJ, 1992. Tlenek azotu jako mediator relaksacji ciała jamistego w odpowiedzi na nonadrenergiczną, nie-cholinergiczną neurotransmisję. N. Engl. J. Med. 326, 90-94. Roeling, TAP, Van Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. Efekty behawioralne NMDA wstrzyknięte do podwzgórzowego jądra przykomorowego szczura. Brain Res. 550, 220-224. Sachs, BD, 1997. Erekcja wywołana u samców szczurów w powietrzu z kobiecych samic. Physiol. Behav. 62, 921-924. Sachs, BD, 2000. Kontekstowe podejście do fizjologii i klasyfikacji funkcji erekcji, zaburzeń erekcji i podniecenia seksualnego. Neurosci. Biobehav. Rev 24, 541-560. Sachs, BD, 2007. Kontekstowa definicja męskiego podniecenia seksualnego. Horm. Behav. 51, 569-578. Sanchez, F., Alonso, JR, Arevalo, R., Blanco, E., Aijon, J., Vazquez, R., 1994. Współistnienie NADPH-diaforyzy z wazopresyną i oksytocyną w podwzgórzowych, wielkokomórkowych jądrach nerwowo-rdzeniowych szczura. Cell Tissue Res. 276, 31-34. Sanna, F., Succu, S., Boi, A., Melis, MR, Argiolas, A., 2009. Inhibitory fosfodiesteraz typu 5 ułatwiają bezdotykowe erekcje u samców szczura: miejsce działania w mózgu i mechanizm działania. J. Seks. Med. 6, 2680-2689. Saphier, D., Feldman, S., 1987. Wpływ bodźców przegrody i hipokampa na neurony jądra przykomorowego. Neuroscience 20, 749-755. Sato-Suzuki, I., Kita, I., Oguri, M., Arita, H., 1998. Stereotypowane reakcje ziewania indukowane przez elektryczną i chemiczną stymulację jądra przykomorowego szczura. J. Neurophysiol. 80, 2765-2775. Schuman, EM, Madison, DV, 1994. Tlenek azotu i funkcja synaptyczna. Ann. Rev Neurosci. 17, 153-183. Snyder, SH, 1992. Tlenek azotu: pierwszy w nowej klasie neuroprzekaźników? Nauka 254, 494-496. Sofroniew, MV, 1983. Wazopresyna i oksytocyna w mózgu ssaka i rdzeniu kręgowym. Trendy Neurosci. 6, 467-472. Sokoloff, P., Schwartz, JC, 1995. Nowe receptory dopaminy pół dekady później. Trendy Pharmacol. Sci. 16, 270-275. Southam, E., Garthwaite, J., 1993. Szlak sygnalizacji GMP cyklicznej tlenku azotu w mózgu szczura. Neuropharmacology 32, 1267-1277. Stancampiano, R., Melis, MR, Argiolas, A., 1994. Wzmocnienie prącia i ziewanie indukowane przez agonistów 5-HT1c u samców szczurów: związek z transmisją dopaminergiczną i oksytocynową. E. J. Pharmacol. 261, 149-155. Succu, S., Mascia, MS, Sanna, F., Melis, T., Argiolas, A., Melis, MR, 2006. Antagonista receptora kannabinoidowego CB1 SR 141716A indukuje erekcję prącia poprzez zwiększenie pozakomórkowego kwasu glutaminowego w jądrze przykomorowym samców szczura. Behav. Brain Res. 169, 274-281. Succu, S., Sanna, F., Melis, T., Boi, A., Argiolas, A., Melis, MR, 2007. Stymulacja receptorów dopaminy w jądrze przykomorowym podwzgórza samców szczura powoduje erekcję prącia i zwiększa zewnątrzkomórkową dopaminę w jądrze półleżącym: zajęcie centralnej oksytocyny. Neuropharmacology 52, 1034-1043. Succu, S., Sanna, F., Cocco, C., Melis, T., Boi, A., Ferri, GL, Argiolas, A., Melis, MR, 2008. Oksytocyna indukuje erekcję prącia po wstrzyknięciu do brzusznej części nakrywkowej samców szczura: rola tlenku azotu i cyklicznej GMP. E. J. Neurosci. 28, 813-821. Tanda, G., Pontieri, FE, Di Chiara, G., 1997. Aktywacja kannabinoidów i heroiny w przekaźnictwie mezolimbicznym dopaminy za pomocą wspólnego mechanizmu receptora opioidowego mu1. Nauka 276, 2048-2050. Tang, Y., Rampin, O., Calas, A., Facchinetti, P., Giuliano, F., 1998. Oksytocynergiczne i serotoninergiczne unerwienie zidentyfikowanych zarodków lędźwiowych kontrolujących erekcję prącia u samca szczura. Neuroscience 82, 241-254. Theodosis, DT, 1985. Oksytocyna-immunoreaktywne terminale synaps na neuronach oksytocyny w jądrach supraoptycznych. Nature (London) 313, 682-684. Tindall, JS, 1974. Bodźce powodujące uwalnianie oksytocyny. W: Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (Eds.), Handbook of Physiology. Sekta. 7, Endocrinology, tom. IV. American Physiology Society, Washington DC, str. 257-267. Torres, G., Lee, S., Rivier, C., 1993. Ontogeny szczurzej podwzgórzowej syntazy tlenku azotu i kolokalizacji z neuropeptydami. Mol. Komórka. Neurosci. 4, 155-163. Uhl-Bronner, S., Waltisperger, E., Martinez-Lorenzana, G., Condes, LM, Freund-Mercier, MJ, 2005. Dwoisto-płciowa ekspresja miejsc wiązania oksytocyny w przodomózgowiu i rdzeniu kręgowym szczura. Neuroscience 135, 147-154. Vaccari, C., Lolait, SJ, Ostrowski, NL, 1998. Porównywalne rozmieszczenie wazopresyny V1b i kwasów rybonukleinowych receptora oksytocynowego w mózgu. Endokrynologia 139, 5015-5033. Van Den Pol, A., 1991. Immunoreaktywność glutaminianu i asparaginianu w podwzgórzowych aksonach presynaptycznych. J. Neurosci. 11, 2087-2101. Veronneau-Longueville, F., Rampin, O., Freund-Mercier, MJ, Tang, Y., Calas, A., Marson, L., McKenna, KE, Stoeckel, ME, Benoit, G., Giuliano, F. , 1999. Oksytocynergiczne unerwienie autonomicznych jąder kontrolujących wzwód prącia u szczura. Neuroscience 93, 1437-1447. Vincent, SR, Kimura, H., 1992. Histochemiczne odwzorowanie syntazy tlenku azotu w mózgu szczura. Neuroscience 46, 755-784. Wagner, CK, Clemens, LG, 1993. Szlak zawierający neurofizynę od jądra przykomorowego podwzgórza do dymorficznego jądra motorycznego w odcinku lędźwiowym rdzenia kręgowego. J. Comp. Neurol. 336, 106-116. Winslow, JT, Insel, TR, 1991. Status społeczny w parach małp wiewiórek określa behawioralną odpowiedź na centralne podanie oksytocyny. J. Neurosci. 11, 2032-2038. Mądry, RA, Rompre, P.-P., 1989. Mózg dopaminy i nagrody. Ann. Rev Psychol. 40, 191-225. Witt, DM, Insel, TR, 1994. Męskie zachowania seksualne aktywują białko podobne do c-fos w neuronach oksytocyny w jądrze przykomorowym podwzgórza. J. Neuroendocrinol. 6, 13-18. Witter, MP, 2006. Połączenia podpory szczura: topografia w odniesieniu do organizacji kolumnowej i laminarnej. Behav Brain Res. 174, 251-264. Woodruff, GN, Foster, AC, Gill, R., Kemp, JA, Wong, EH, Iversen, LL, 1987. Interakcja między MK-801 a receptorami dla N-metylo-D-asparaginian: konsekwencje funkcjonalne. Neuropharmacology 26, 903-909. Yamashita, H., Shigeru, O., Inenaga, K., Kasai, M., Uesugi, S., Kannan, H., Kaneko, T., 1987. Oksytocyna w przeważającej mierze pobudza przypuszczalne neurony oksytocyny w jądrze nadrdzeniowym szczura in vitro. Brain Res. 416, 364-368. Yells, DP, Hendricks, SE, Prendergast, MA, 1992. Zmiany jądra paragigantocellularis: wpływ na zachowanie godowe u samców szczura. Brain Res. 596, 73-79. Young, WS, Shepard, E., Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. Niedobór oksytocyny u myszy zapobiega wyrzucaniu mleka, ale nie płodności ani porodowi. J. Neuroendocrinol. 8, 847-854. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. Wzrost ciśnienia wewnątrznaczyniowego prącia po zastrzykach agonistów receptora pobudzającego aminokwas w podwzgórzowym jądrze przykomorowym znieczulonych szczurów. J. Uroi.