OBSERVAȚII: Revizuirea excelentă a aproape tuturor cercetărilor relevante privind receptorii androgeni, dopamina și funcția sexuală. Descoperirea fantastică a interrelațiilor circuitului de recompensare a hipotalamusului.
Hormonul Behav. 2008 Mai; 53(5): 647-658.
Publicat online 2008 Februarie 13. doi: 10.1016 / j.yhbeh.2008.01.010
Abstract
Adolescența este asociată cu creșterea comportamentelor de căutare a plăcerii, care, la rândul lor, sunt influențate de activarea pubertală a axei hipotalamo-hipofizo-gonadale. La modelele animale cu comportamente naturale recompensatoare, cum ar fi sexul, androgenii testiculari contribuie la dezvoltarea și exprimarea comportamentului la bărbați. Pentru a realiza maturizarea comportamentala, creierul sufera remodelarea semnificativa in timpul adolescentei, iar multe dintre schimbari sunt de asemenea sensibile la androgeni, probabil acționând prin intermediul receptorilor androgeni (AR). Având în vedere interacțiunea delicată a hormonilor gonadali și a dezvoltării creierului, nu este deloc surprinzător faptul că întreruperea nivelului de hormoni în timpul acestei perioade sensibile modifică semnificativ comportamentele adolescenților și adulților. La hamsteri de sex masculin, expunerea la testosteron în timpul adolescenței este necesară pentru exprimarea normală a comportamentului sexual adult. Bărbații privați de androgeni în timpul pubertății prezintă deficite susținute în împerechere. În schimb, androgenii singuri nu sunt suficienți pentru a induce împerecherea la bărbații prepubertali, chiar dacă brațul AR este prezent înaintea pubertății. În acest context, utilizarea pe scară largă a steroizilor anabolico-androgeni (AAS) în timpul adolescenței este o preocupare semnificativă. Abuzul AAS are potențialul de a modifica atât timpul și nivelurile de androgeni la bărbații adolescenți. La hamsteri, expunerea adolescentului AAS crește agresivitatea și provoacă modificări de durată în sistemele neurotransmițătoare. În plus, AAS sunt ele însele consolidate, după cum demonstrează autoadministrarea testosteronului și a altor AAS. Cu toate acestea, dovezile recente sugerează că efectele de întărire ale androgenilor nu pot necesita AR clasic. Prin urmare, este necesară o examinare suplimentară a interacțiunilor dintre androgeni și a comportamentelor satisfacatoare în creierul adolescent pentru o mai bună înțelegere a abuzului de AAS.
Descriere
Adolescența trezește creierul atât pentru plăcere cât și pentru risc. La adolescenții umani, acest lucru ia în mod frecvent forma experimentării cu droguri și sex. În Statele Unite, vârsta medie pentru primul act sexual la bărbați este de ani 16.4, iar 65% au avut relații sexuale cu gradul 12th (Kaiser Family Foundation, 2005). De asemenea, această populație are cele mai mari rate de consum ilicit de droguri în Statele Unite. Conform studiului național 2004 privind consumul de stupefiante și sănătate, 38% din vârstele bărbaților 18-25 au consumat un drog ilegal în ultimul an (SAMHSA / OAS, 2005). Mai mult, 31% dintre băieții adolescenți au consumat droguri sau alcool în timpul ultimei întâlniri sexuale (Kaiser Family Foundation, 2005). În plus, adolescența este un moment esențial în etiologia anumitor psihopatologii, cum ar fi depresia, anxietatea, mâncarea dezordonată și tulburarea de comportament. Considerăm că secreția pubertală a hormonilor gonadali, activarea receptorilor steroizi în creier și interacțiunea dintre hormoni și experiența dezvoltării creierului adolescent contribuie la schimbările comportamentale observate în timpul adolescenței.
Scopul nostru este de a examina dovezile că androgensul gonadal mediază maturizarea adolescentului și performanța adultă a comportamentelor motivaționale, precum și proprietățile recompensatoare ale acestor comportamente. De asemenea, prezentăm dovezi că testosteronul în sine este recompensator, ceea ce contribuie probabil la schimbările maturale în comportamentele motivaționale în timpul adolescenței, când nivelul de testosteron crește. Accentul acestei lucrări se referă la studiile noastre privind circuitele neuronale care stau la baza comportamentului sexual masculin, în special la hamsterul sirian, cu un accent deosebit pe interacțiunea dintre testosteron și dopamină (DA). Propunem ca androgenii pubertali să aibă atât efecte tranzitorii, cât și pe termen lung asupra circuitelor de recompensă și comportamentului motivat. Continuăm să presupunem că suplimentarea cu androgeni exogeni sub formă de steroizi anabolico-androgenici (AAS) mărește influențele normale ale androgenelor pubertale, afectând în consecință dezvoltarea adolescentului a creierului și a comportamentului.
Adolescența ca o perioadă sensibilă pentru dezvoltarea creierului
În cele din urmă, creierul este atât un factor declanșator, cât și o țintă pentru acțiunea androgenă în timpul adolescenței. La băieții tineri (<12 ani) și hamsterii tineri (cu vârsta <28 de zile), androgenii circulanți și gonadotropinele se află la niveluri bazale. Pe măsură ce secreția hormonului luteinizant din hipofiza anterioară crește ca răspuns la hormonul hipotalamic care eliberează gonadotropina, concentrațiile circulante de testosteron cresc semnificativ. Acest lucru apare în stadiul Tanner II / III (14 ani) la băieți și la vârsta de 28 de zile la hamsteri. Până când băieții ating stadiul IV / V Tanner (aproximativ 16 ani) sau când hamsterii au vârsta cuprinsă între 50 și 60 de zile, testosteronul endogen se încadrează în domeniul masculin adult. Secreția de hormon pubertar coincide cu perioada adolescenței, care are loc la aproximativ 12-20 de ani la om. Hormonii puberali acționează nu numai asupra țesuturilor periferice pentru a provoca apariția caracteristicilor sexuale secundare care sunt semnele evidente ale pubertății, dar acționează și central pentru a influența atât remodelarea creierului adolescentului, cât și maturizarea comportamentală. Mai mult, schimbările fiziologice și neurologice provocate de hormonii pubertari duc la schimbări semnificative în experiența unui individ, care poate modifica în sine profund cursul dezvoltării creierului. Astfel, creșterea pubertară a hormonilor steroizi sexuali, determinată de maturarea temporală a dezvoltării axei neuroendocrine reproductive, modelează la rândul său dezvoltarea comportamentală a adolescenților, atât prin influențe directe, cât și indirecte asupra sistemului nervos.
Adolescența adolescentă este acum recunoscută ca o perioadă majoră și dinamică de dezvoltare neuronală în care circuitele comportamentale sunt remodelate și rafinate. Deși creierul unui copil în vârstă de 5 este deja 90% din dimensiunea adultă (Dekaban, 1978), remodelarea semnificativă urmează să vină. Acest concept a fost aprins prin cercetări atât la oameni, cât și la animale, documentând că multe dintre procesele de dezvoltare de bază care apar în timpul dezvoltării creierului perinatal sunt recapitulate în timpul adolescenței. Aceste procese includ neurogenesis (Eckenhoff și Rakic, 1988; El și echipajele, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia și Guillamon, 2001; Rankin, Partlow, McCurdy, Giles și Fisher, 2003), moartea programată a celulelor (Nunez, Lauschke și Juraska, 2001; Nunez, Sodhi și Juraska, 2002), elaborarea și tăierea arborizărilor și sinapselor dendritice (Andersen, Rutstein, Benzo, Hostetter și Teicher, 1997; Huttenlocher și Dabholkar, 1997; Lenroot și Giedd, 2006; Sowell, Thompson, Leonard, Bun venit, Kan și Toga, 2004), mielinizarea (Benes, Turtle, Khan și Farol, 1994; Paus, Collins, Evans, Leonard, Pike și Zijdenbos, 2001; Sowell, Thompson, Tessner și Toga, 2001) și diferențierea sexuală (Chung, De Vries și Swaab, 2002; Davis, Shryne și Gorski, 1996; Nunez și colab., 2001). Astfel, traiectoria de dezvoltare a creierului postnatal nu este liniară, ci este caracterizată de o explozie adolescentă de schimbare rapidă și implică atât evenimente progresive, cât și regresive. După cum știe biologul de dezvoltare, perioadele de schimbare rapidă a evoluției semnalului au sporit sensibilitatea și vulnerabilitatea atât la schimbarea dependentă de experiență, cât și la consecințele negative ale perturbării și insultei și nu există niciun motiv să se creadă că dezvoltarea creierului adolescent uman este o excepție (Andersen, 2003; Spear, 2000). Astfel, perturbațiile în timpul influenței hormonului pubertal asupra creierului adolescentului ar fi prezis că vor avea consecințe de lungă durată pentru comportamentul adulților.
Androgenii și circuitele neuronale pentru comportamentul motivat
Deoarece adolescența este o fază tranzitorie și dinamică a dezvoltării, ar fi dificilă evaluarea izolată a creierului și a comportamentului adolescentului. În schimb, pentru a aprecia caracterul unic al adolescenței, este util să îl contrastăm cu creierul și comportamentul adulților maturi. Astfel, cu accentul pe această lucrare asupra comportamentului sexual masculin și recompensării, este important să introducem circuitele neurale pentru copulație și motivație sexuală la bărbații adulți, incluzând rolul hormonilor steroizi gonadali în activarea comportamentală și distribuția receptorilor pentru androgeni (AR) și estrogeni (ER).
AR sunt prezente în grupurile celulare care formează circuitele neuronale care mediază comportamentele sociale recompensatoare, cum ar fi sexul. Mai mult, AR creierului sunt exprimate înainte de pubertate la hamsteri și sunt reglate de către androgeni atât la bărbații minori, cât și la cei adulți (Kashon, Hayes, Shek și Sisk, 1995; Meek, Romeo, Novak și Sisk, 1997). În creierul rozătoarelor, există o suprapunere substanțială în distribuția AR și ER (Lemn și Newman, 1995) și aromataza (Celotti, Negri-Cesi și Poletti, 1997), incluzând atât formele α și β ale receptorului de estrogen (Shughrue, Lane și Merchenthaler, 1997). După legarea la ligand, AR și ER "clasice" funcționează ca factori de transcripție pentru a induce transcripția și sinteza proteinelor noi. Nu este surprinzător că aceste efecte au un curs de timp relativ lent, cu un debut întârziat al acțiunii. Stimularea steroidului a comportamentului sexual de hamster de sex masculin (Noble și Alsum, 1975) este în concordanță cu acțiunile prin acțiuni genomice clasice. De exemplu, săptămânile 2 de expunere la steroizi sunt necesare pentru a restabili împerecherea în castramele pe termen lung. Studiile mai recente la șobolani au demonstrat, de asemenea, efecte celulare rapide ale androgenelor în regiunile creierului care posedă puțini receptori clasici (Mermelstein, Becker și Surmeier, 1996). Aceste acțiuni ale steroizilor sunt considerate a fi mediate de receptori non-genomi. Întrucât distribuția AR și ER clasice în creierul de hamster este relativ limitată (Wood și Swann, 1999), țintele potențiale ale creierului pentru acțiunea non-genomică androgen sunt mult mai largi.
Suprafața preoptică mediană (MPOA) joacă un rol central în copularea la bărbați, de la "goldfish to humans" (revizuită în Hull, Wood și McKenna, 2006). Mai mult, hamsterul MPOA transduce hormoni steroizi gonadali prin AR și ER abundent și implanturile de testosteron în MPOA sunt suficiente pentru a restabili activitatea sexuală în castrații de lungă durată (Wood și Swann, 1999). La șobolanii masculi, steroizii gonadali acționează în MPOA pentru a reglementa eliberarea bazală a DA (Putnam, Sato și Hull, 2003) și stimularea împerecherii (Hull, Du, Lorrain și Matuszewich, 1995). Inițial, există o creștere modestă a DA atunci când o femeie este prezentată în spatele unui ecran. În timpul copulației, MPOA DA crește și mai mult (+ 50% din valoarea inițială), iar acest efect necesită androgeni (Hull și colab., 1995; Putnam și colab., 2003). Nu este surprinzător că, la bărbații castrați care nu se împerechează, MPOA DA nu crește (Hull și colab., 1995). Este oarecum dificil de interpretat acest rezultat, deoarece lipsa eliberării DA este confundată de absența activității sexuale. Totuși, eliberarea DA în MPOA se corelează cu pierderea împerecherii în castrații pe termen scurt (Hull și colab., 1995) și cu restabilirea indusă de testosteron a activității sexuale în castrații pe termen lung (Du, Lorrain și Hull, 1998; Putnam, Du, Sato și Hull, 2001).
În cadrul MPOA pentru rozătoare, metaboliții androgeni și estrogenici ai testosteronului joacă roluri specifice în reglementarea împerecherii (Putnam și colab., 2003; Putnam, Sato, Riolo și Hull, 2005). Latența de inițiere a copulației (mount sau intromit) este o măsură a motivației sexuale. Latența la activitatea sexuală este sensibilă la estrogeni, prin întreținerea sintetazei de oxid nitric MPOA, care, la rândul său, menține nivelele bazale DA. Castrații tratați cu estrogen prezintă niveluri ridicate de DA bazale, care corelează puternic cu capacitatea de inițiere a copulației. Cu toate acestea, ele nu demonstrează creșteri induse de sex feminin și de colație în eliberarea DA, care se corelează puternic cu performanța sexuală. În consecință, performanța lor sexuală este sub nivele intacte. Pe de altă parte, castrații tratați numai cu androgen non-aromatizabil nu prezintă niveluri ridicate de DA și nu reușesc să inițieze copulația. Pentru performanța sexuală normală, prin urmare, atât estrogeni cât și androgeni sunt necesare. Performanța sexuală este de obicei exprimată ca măsurătoare de frecvență a monturilor, intromiselor și ejaculărilor. Numai atunci când ambele estrogeni și androgeni sunt înlocuiți, bărbații castrați prezintă niveluri crescute de DA (și măsuri de latență mai scurte) și creșteri DA induse de femele și de colaboare (și măsuri de frecvență crescute). În acest mod, estrogenii din MPOA contribuie la motivația sexuală și atât estrogenii, cât și androgenii la performanța sexuală.
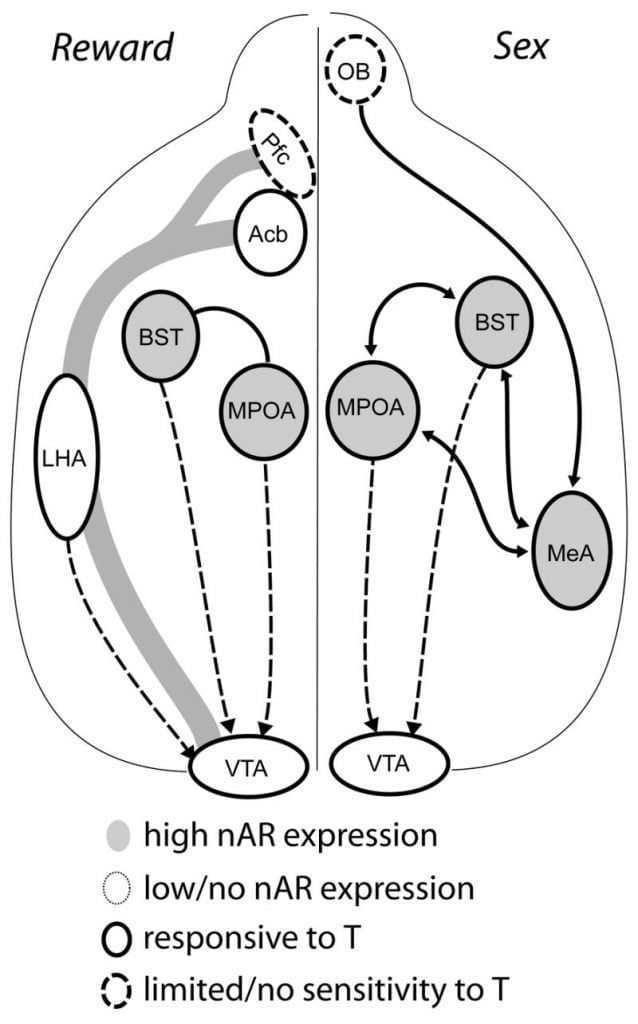
Deși testosteronul este necesar pentru eliberarea MPOA DA în timpul comportamentului de copulație masculină și pentru împerecherea în sine, nici testosteronul, nici împerecherea în monoterapie nu pot provoca DA în MPOA. În schimb, indicațiile chemosenzoriale ale femelelor conspecifice sunt de asemenea necesare pentru eliberarea DA în MPOA. La rozătoare, stimulii chemosenzori sunt modalitatea principală senzorială de inițiere a comportamentului sexual masculin (Fig. 1). Semnalele chimosensorii sunt transmise de la bulbii olfactivi la MPOA prin nucleul amigdaloid medial și nucleul patului stria terminalis, structuri cu AR și ER abundente (Wood și Swann, 1999). Pentru a determina rolul indicațiilor chemosenzoriale în AD indus de împerechere, am măsurat MPOA DA în timpul împerecherii în hamsteri de sex masculin gonad-intaci cu bulbectomie olfactivă unilaterală (UBx, Triemstra, Nagatani și Wood, 2005). Deși eliminarea bilaterală a bulbilor olfactivi elimină activitatea sexuală și eliberarea MPOA DA, bulbectomia unilaterală nu interferează cu împerecherea. În acest studiu, copularea a indus eliberarea MPOA DA atunci când a fost măsurată contralateral cu bulbul olfactiv lezat, dar nu în emisfera ipsilaterală (Fig. 2). Rezultate similare au fost observate la șobolanii masculi cu leziuni ale amigdalei medii (Dominguez, Riolo, Xu și Hull, 2001). Într-un studiu asociat, stimularea chimică a amigdalei mediane la șobolani a indus eliberarea MPOA DA echivalentă cu cea din timpul copulației (Dominguez și Hull, 2001). Luate impreuna, aceste date sugereaza ca testosteronul creeaza un mediu permisiv care permite stimulilor senzoriali externi sa ajunga la MPOA si sa induca eliberarea DA in timpul copulatiei.

Fig. 2
În cele din urmă, comportamentul sexual și alte recompense naturale activează căile de recompensă neurală. Circuitul mezocorticolimbic DA constă în zona tegmentală ventrală (VTA), nucleul accumbens (Acb) și cortexul prefrontal (Pfc). Organismele de celule dopamice care locuiesc în proiectul VTA în mod roșu la Acb și Pfc (Koob și Nestler, 1997). La șobolani, DA este eliberat în Acb în timpul sexului (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips și Fibiger, 1990). Multe medicamente de abuz de asemenea acționează în sistemul DA mezolimbic pentru a crește eliberarea DA (amfetamine) sau pentru a inhiba recaptarea DA (cocaina, Di Chiara și Imperato, 1988), consolidând astfel proprietățile lor de dependență. În acest mod, testosteronul are potențialul de a afecta eliberarea DA în Acb atât prin creșterea comportamentului sexual cât și prin acțiunile sale ca medicament de abuz (a se vedea mai jos).
Dovezile actuale sugerează că sistemul DA mezocorticolimbic se maturizează în timpul adolescenței. Densitățile fibrelor de densitate acb din DA cresc dramatic în timpul adolescenței în gerbili, sugerând că maturizarea semnificativă a proiecțiilor dopaminergice VTA la Acb apare în perioada adolescentă (Lesting, Neddens și Teuchert-Noodt, 2005). Mai mult, contribuția dopaminergică la celulele -ergice GABA (acidul y-aminobutiric) în cortexul prefrontal medial de șobolan este îmbogățită și modulată de sistemele serotoninergice în timpul dezvoltării pubertății (Benes, Taylor și Cunningham, 2000) și manipularea androgenilor la șobolanii adulți duce la modificări ale densității axonului dopaminergic în cortexul prefrontal (Kritzer, 2003). Pfc, Acb și VTA au puține AR sau ER, deși ERβ este prezent în VTA (Shughrue și colab., 1997). Prin urmare, este posibil ca androgenii să afecteze sistemul DA mezocorticolimbic prin aferene sensibile la androgeni sau prin ERβ în VTA ca în hipotalamus (Handa și colab., Această problemă). Datele noastre arată că celulele sensibile la androgeni din hamsteri de sex masculin se adresează VTA din structurile asociate comportamentelor sensibile la steroizi. De exemplu, atât MPOA cât și nucleul patului stria terminalis (BST) conțin un număr mare de celule AR-pozitive care se proiectează la VTA (Sato și lemn, 2006). Pallidum ventral, ținta majoră acribilă Acb (Zahm și Heimer, 1990), conține, de asemenea, multe celule AR-pozitive proiectate la VTA. Aceste proiecții oferă o oportunitate androgenilor de a modifica activitatea sistemului DA mezocorticolimbic.
Organizarea comportamentului dependent de steroizi în timpul adolescenței
Vederea tradițională a acțiunii hormonale asupra comportamentului adolescentului se bazează pe efectele activării hormonilor steroidieni, care se referă la capacitatea steroizilor de a facilita comportamentul în contexte sociale specifice prin acțiunea în interiorul celulelor țintă din circuitele neuronale care comportă comportamentul. Efectele activationale sunt tranzitorii in sensul ca vin si ies cu prezenta si absenta hormonului si sunt de obicei asociate cu expresia comportamentului adult. În schimb, efectele organizaționale se referă la capacitatea steroizilor de a sculpta structura sistemului nervos în timpul dezvoltării. Organizarea structurală este permanentă, persistă dincolo de perioada de expunere la hormon și determină răspunsurile neuronale și comportamentale la steroizi la vârsta adultă. Intelegerea noastra a relatiei de dezvoltare intre efectele organizatorice si activationale ale hormonilor steroizi a evoluat in ultimii ani 50. Phoenix și colegii au propus pentru prima dată că reacțiile comportamentale (activationale) ale adulților la hormoni steroizi sunt programate (organizate) de hormoni steroizi în timpul unei perioade extrem de sensibile de dezvoltare perinatală (Phoenix, Goy, Gerall și Young, 1959). Mai târziu, Scott și colegii au pus bazele teoretice pentru existența mai multor perioade sensibile pentru organizarea progresivă a sistemului nervos și au menționat că perioadele sensibile sunt foarte probabil să apară în perioadele de schimbare rapidă a dezvoltării (1974). Ulterior, Arnold și Breedlove au subliniat că organizarea creierului dependentă de steroizi poate să apară în afara perioadelor sensibile de dezvoltare (Arnold și Breedlove, 1985). În ultimii ani 15, cercetările care utilizează o varietate de modele animale și sisteme comportamentale clarifică faptul că creierul adolescent este sensibil atât la efectele activationale cât și la cele ale organizării steroizilor gonadali (revizuită în Sisk și Zehr, 2005). Și, ca și alte perioade de schimbare rapidă a evoluției, adolescența reprezintă o fereastră definită de oportunitate pentru remodelarea cerebrală dependentă de steroizi.
Munca noastră folosind hamsterul ca model animal oferă dovezi că comportamentele sociale masculine sunt modificate de steroizi în timpul adolescenței (Schulz, Menard, Smith, Albers și Sisk, 2006; Schulz și Sisk, 2006). Înainte de pubertate, tratamentul cu testosteron nu poate activa comportamentul sexual la hamsteri, sugerând că procesele de maturare care fac circuite neuronale susceptibile de activare sau de organizare de către hormonii steroizi nu au apărut încă (Meek și colab., 1997; Romeo, Richardson și Sisk, 2002a). În schimb, în timp ce exprimarea fățișă a comportamentului reproductiv masculin la vârsta adultă nu necesită absolut prezența steroizilor gonadici în timpul adolescenței, expresia maximă a comportamentului o face. Comparând comportamentul reproductiv masculin la bărbații castrați fie prepubertal (NoT@P) fie postpubertal (T@P) și apoi tratați cu testosteron la vârsta adultă, castrații prepubertali NoT@P au un deficit de cel puțin 50% în comportamentul masculin în comparație cu bărbații castrați după adolescență. (Fig. 3, Schulz, Richardson, Zehr, Osetek, Menard și Sisk, 2004). Mai mult, deficitele comportamentului reproductiv sunt de lungă durată și nu pot fi depășite fie prin tratamentul prelungit cu testosteron, fie prin experiența sexuală la vârsta adultă (Schulz și colab., 2004). În mod similar, după tratamentul cu estrogen și progesteron, bărbații NoT@P prezintă latențe de lordoză mai scurte și durate mai lungi de lordoză decât bărbații castrați ca adulți (Schulz și colab., 2004), sugerând că castraturile prepubertale sunt mai puțin defeminizate decât bărbații expuși testosteronului pubertal.

Fig. 3
Este posibil ca bărbații NoT@P să sufere de o motivație sexuală scăzută. O modalitate de a aborda această întrebare este de a compara latențele de angajare atât în investigația ano-genitală (AGI) cât și în montarea între bărbații gonadectomizați înainte (NoT@P) și după pubertate (T@P). Dacă motivația sexuală depinde de expunerea la hormoni gonadici în timpul adolescenței, am prezice latențe mai lungi pentru a se angaja în comportament sexual la bărbații NoT@P. Într-adevăr, cu expunerea repetată la femelele în estro, masculii NoT@P au nevoie de mai mult timp pentru a începe AGI și montarea în comparație cu masculii T@P (Fig. 4). Astfel, pe lângă organizarea aspectelor legate de performanța sexuală, se pare că hormonii pubertarii organizează și aspectele pline de satisfacție ale comportamentului sexual. În sprijinul acestei posibilități, administrarea centrală a apomorfinei agoniste DA la vârsta adultă restabilește comportamentul crescător al bărbaților NoT@P la niveluri tipice pentru adulți, sugerând că testosteronul în timpul adolescenței organizează în mod normal circuitele neuronale dopaminergice (Salas-Ramirez, Montalto și Sisk, 2006). ). Cu toate acestea, rămân multe întrebări interesante. Un mascul NoT@P ar apăsa o femelă în estro sau ar dezvolta o preferință de loc condiționat pentru o locație de împerechere? Cercetările viitoare vor explora rolul hormonilor pubertali în organizarea motivației sexuale și a performanței sexuale.

Fig. 4
Latențe și durate ale investigației anogenitale (AGI) manifestate de hamsterii masculi gonadectomizați înainte de pubertate (NoT@P) sau după pubertate (T@P). Toți bărbații au fost amorsați cu testosteron la vârsta adultă 7 săptămâni după gonadectomie și cu o săptămână înainte de primul test de comportament. Bărbații A. T@P au prezentat latențe AGI similare la cele trei teste cu o femeie estrală, în timp ce bărbații NoT@P au crescut latența AGI în timpul celui de-al treilea test cu o femeie estrală. B. Masculii T@P au scăzut latența monturii în cele trei teste de comportament cu o femelă estrală, în timp ce bărbații noT@P nu au prezentat nicio schimbare în latența monturii în cele trei teste de comportament. Aceste date sugerează că hormonii gonadici pubertali au efecte de durată, facilitatoare, asupra motivației bărbaților adulți de a se angaja în comportament sexual cu o femeie. (Date nepublicate de la subiecți animale în Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA și Sisk, CL, 2004).
Răspunsuri comportamentale prepubertale la steroizi
Unul dintre puzzle-urile durabile ale dezvoltării comportamentale a adolescenților este motivul pentru care activarea comportamentului reproductiv ca răspuns la expunerea la steroizi este atenuată la hamsterii de sex masculin prepubertali. Dacă nivelele scăzute de androgeni înainte de pubertate limitează expresia comportamentului sexual masculin la bărbații prepubertali, atunci suplimentele de androgeni endogeni la bărbații prepubertali ar trebui să provoace împerecherea. Acest lucru se dovedește a nu fi cazul (Meek și colab., 1997; Romeo, Cook-Wiens, Richardson și Sisk, 2001; Romeo, Wagner, Jansen, Diedrich și Sisk, 2002b), în ciuda faptului că numărul și distribuția AR și ER pe parcursul circuitului de împerechere sunt similare în castrații prepubertali și castrați adulți tratați cu hormoni (Meek și colab., 1997; Romeo, Diedrich și Sisk, 1999; Romeo și colab., 2002a). Prin urmare, se pare că androgenii și AR sunt necesari, dar nu suficienți pentru exprimarea comportamentului sexual masculin.
Eforturile de identificare a factorilor care limitează activitatea sexuală înainte de pubertate au fost până acum amestecate. Reacțiile Fos la indicii chemosenzoriale de la femelele estrogen sunt similare la hamsterii de sex masculin prepubertali și adulți (Romeo, Parfitt, Richardson și Sisk, 1998). Aceste date demonstrează că mecanismele de transducție senzoriale sunt mature înainte de pubertate. Astfel, masculii minori sunt capabili să detecteze semnale chemosenzoriale de la femei; în care diferă de adulți, este modul în care răspund la acele indicii. O posibilă explicație este că bărbații prepubertali nu sunt motivați să se implice în comportamentul sexual. Am constatat că hamsterii de sex masculin prepubertali nu prezintă răspunsuri dopaminergice sporite în MPOA ca răspuns la feromonii feminini, în timp ce bărbații adulți naivi sexuali prezintă reacții dopaminergice robuste MPOA la aceiasi stimuli (Fig. 5, Schulz, Richardson, Romeo, Morris, Lookingland și Sisk, 2003). În mod similar, bărbații prepubertali nu reușesc să arate creșterea tipică de adult a testosteronului circulant după expunerea la feromoni feminini (Parfitt, Thompson, Richardson, Romeo și Sisk, 1999). Astfel, feromonii de sex feminin par a fi un stimul necondiționat pentru răspunsurile neurochimice și neuroendocrine la bărbații adulți, dar nu prepubertali, ceea ce sugerează că variația acestor stimuli senzoriali relevanți sociali se schimbă asupra dezvoltării pubertății, posibil legată de achiziționarea de proprietăți pline de satisfacții și de motivația sexuală. În plus, deși testosteronul nu facilitează AGI a unei femei la bărbați prepubertali, acest efect depinde de faptul dacă bărbatul a avut sau nu o expunere anterioară la o femeie estroasă. Poate că, în mod surprinzător, tratamentul cu testosteron scade latența și crește durata AGI numai la bărbații prepubertali naivi sexuali (Fig. 6). Mai mult decât atât, bărbații prepubertali care au avut o experiență anterioară cu o femeie afișează mai mult timp latențe AGI și durate mai scurte de AGI decât bărbații interacționând cu femele receptive pentru prima dată (Fig. 6). Aceste date sugerează că interacțiunile cu o femeie estroasă sunt mai degrabă aversive decît recompensă înainte de pubertate, eliminând astfel orice efecte de facilitare a testosteronului asupra AGI în timpul interacțiunilor ulterioare cu o femeie. Ar fi interesant să aflăm dacă consecințele negative ale comportamentului expunerii precoce la o femeie estroasă persistă în adolescență și maturitate, în special dat fiind faptul că expunerea repetată la femele estroase în timpul adolescența facilitează, în general, exprimarea comportamentului reproductiv masculin (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto și Sisk, 2007).

Fig. 5
Reacțiile dopaminergice din zona preoptică mediană masculină preeptică și adultă (MPOA) la feromoni feminini conținute în secrețiile vaginale. Bărbații adulți prezintă creșteri ale activității dopaminergice MPO cu expunere la secrețiile vaginale feminine, în timp ce bărbații prepubertali nu prezintă răspunsuri dopaminergice MMPA crescute la feromonii feminini. (Redrawn din Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ și Sisk, CL, 2003).

Deși tratamentul cu androgen prepubertal nu poate induce copularea, munca recentă din laboratorul nostru sugerează că sistemul nervos de hamster este sensibil la acțiunile de organizare a testosteronului asupra comportamentului reproductiv înainte de adolescență (Schulz, Zehr, Salas-Ramirez și Sisk, 2007). Castrarea plus 19 zile de expunere la testosteron înainte sau în timpul, dar nu după adolescență a facilitat comportamentul de montare atunci când testosteronul a fost înlocuit la maturitate. Masculii expuși la testosteron prepubertal au prezentat, de asemenea, mai multe intromisiuni la maturitate decât bărbații expuși la testosteron în timpul sau după pubertate (Schulz și colab., 2007). Aceste date sugerează că capacitatea testosteronului de a organiza circuite neuronale comportamentale scade odată cu vârsta și că adolescența marchează sfârșitul unei perioade prelungite postnatale prelungite pentru expunerea la testosteron.
Androgeni farmacologici
Datele precedente sugerează că steroizii endogeni gonadali sporesc comportamentele motivaționale în timpul adolescenței. Acum, ce se întâmplă dacă unul se administrează pe bază de androgeni la nivele până la concentrații fiziologice normale 100x? Aceasta este problema abuzului anabolic-androgenic al steroizilor (AAS) (revizuit în Brower, 2002; Clark și Henderson, 2003). O scurtă deviere este potrivită aici: toate AAS sunt derivate ale testosteronului, toate AAS au un schelet de carbon cu inele condensate 4, cele mai multe au carbon 19. AAS sunt folosite în principal pentru efectele anabolice (construirea mușchilor). Cu toate acestea, așa cum sugerează și numele lor, AAS au și proprietăți androgenice. Testosteronul este o alegere logică în studiile pe animale pentru a explora mecanismele fundamentale ale recompensei androgene. Rămâne o alegere populară și pentru utilizatorii umani, cel mai adesea sub formă de esteri de testosteron cu durată lungă de acțiune, cum ar fi propionat de testosteron. În 2006, testosteronul a fost cea mai comună substanță interzisă detectată în testele de urină la laboratoarele acreditate de WADA (WADA, 2006). Testosteronul a reprezentat cea mai mare parte (34%) a testelor de urină pozitivă pentru AAS la Jocurile Olimpice 2000 din Sydney (Van Eenoo și Delbeke, 2003). De asemenea, în testele de urină ale utilizatorilor AAS, 41% a fost testat pozitiv pentru testosteron (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). La doze mari, AAS produce modificări comportamentale semnificative. În special, din cauza relației lor strânse cu testosteronul, utilizarea AAS în anii adolescentei pare să perturbă mediul steroid normal al sistemului nervos adolescent în dezvoltare, inclusiv cantitatea, calendarul și tipul expunerii la steroizi.
Ca și în cazul altor droguri ilicite, abuzul de AAS uman este o problemă de adolescență. Potrivit 1994 Studiul National de uz casnic privind consumul de droguri (SAMHSA / OAS, 1996), vârfurile de utilizare a steroizilor la adolescenta târzie la vârsta de 18. În plus, în cadrul studiului "Monitorizarea viitorului" (Johnston, O'Malley și Bachman, 2003), incidența pe parcursul vieții a consumului de steroizi în rândul persoanelor vârstnice (2.7%) a fost comparabilă cu cea pentru crack cocaina (3.5%) sau heroina (1.4%). Utilizarea steroizilor este, de asemenea, din ce în ce mai frecventă la vârste mai tinere: 2.5% din elevii de clasa 8th (ani 13-14) au utilizat steroizi, similar cu incidența utilizării crăpăturii (2.5%) și a consumului de heroină (1.6%). Această tendință spre utilizarea AAS la adolescenți timpuriu este deosebit de îngrijorătoare în ceea ce privește preocupările privind faptul că adolescenții pot fi deosebit de vulnerabili la abuzul AAS și 1) că expunerea adolescentului la AAS la nivele farmacologice are potențialul de a altera substanțial maturarea normală a creierului și comportament pentru a produce răspunsuri morfologice și comportamentale exagerate, acute și cronice.
Agresiunea necorespunzătoare este răspunsul comportamental asociat cel mai adesea cu abuzul AAS uman. În rapoartele publicate, utilizarea steroizilor a fost implicată în mai multe crime violente (Conacher și Workman, 1989; Papa și Katz, 1990; Papa, Kouri, Powell, Campbell și Katz, 1996; Schulte, Hall și Boyer, 1993). În studiile efectuate asupra utilizatorilor actuali AAS, agresivitatea și iritabilitatea ridicată au fost cele mai frecvente efecte secundare comportamentale ale utilizării AAS (Bond, Choi și Papa, 1995; Galligani, Renck și Hansen, 1996; Midgley, Heather și Davies, 2001; Parrott, Choi și Davies, 1994; Perry, Kutscher, Lund, Yates, Holman și Demers, 2003). Cu toate acestea, având în vedere gama expunerilor androgenice, varietatea simptomelor psihiatrice și potențialul de disfuncție psihică preexistentă, este dificil să se determine rolul precis al AAS în aceste cazuri de agresiune umană. Rezultatele studiilor prospective ale voluntarilor umani care au primit injecții cu AAS au fost amestecate: Tricker și colab. (1996) și O'Connor și colab. (2004) nu au raportat creșteri ale comportamentului furios, în timp ce alte studii au observat agresivitate crescută (Daly, Su, Schmidt, Pickar, Murphy și Rubinow, 2001; Hannan, Friedl, Zold, Kettler și Plymate, 1991; Kouri, Lukas, Papa și Oliva, 1995; Papa și Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz și Rubinow, 1993). Cu toate acestea, este important să rețineți că dozele administrate voluntarilor umani sunt mult mai mici decât dozele recomandate pe site-urile web pentru construirea corpului, iar durata tratamentului este, în general, scurtă. Astfel, în mod echilibrat, pare corect să se concluzioneze că AAS au potențialul de a spori comportamentul agonist, cel puțin la persoanele susceptibile. Pope și colaboratorii (1994) a constatat că AAS provoacă simptome psihiatrice la persoanele vulnerabile.
Studiile la animale au furnizat, de asemenea, dovezi convingătoare pentru agresiunea indusă de AAS. Adulții de hamsteri de sex masculin tratați cronic cu steroizi în doze mari au o latență de atac mai scurtă și un număr mai mare de atacuri și mușcături împotriva unui intrus masculin comparativ cu bărbații netratați (Harrison, Connor, Nowak, Nash și Melloni, 2000; Melloni, Connor, Hang, Harrison și Ferris, 1997). În mod similar, o provocare ușoară (cocoloșă) produce o creștere persistentă a agresiunii la șobolanii adolescenți de sex masculin, incluzând agresivitatea față de femele (Cunningham și McGinnis, 2006). De o preocupare și mai mare, expunerea adolescentului la AAS la hamsteri determină creșteri de durată ale comportamentului agonist care persistă după întreruperea utilizării steroizilor (Grimes și Melloni, 2006). Aceste modificări comportamentale sunt însoțite de remodelarea durabilă a circuitelor neuronale în hipotalamusul anterior. În special, expunerea adolescentului AAS la hamsteri îmbunătățește vasopresina arginină (AVP, Grimes și Melloni, 2006) și reduce reglarea serotoninei și a receptorilor serotoninergici 5HT1A și 5HT1B (Ricci, Rasakham, Grimes și Melloni, 2006). Ar trebui sa nu fie o surpriza faptul ca AAS modifica nivelul creierului de AR, de asemenea. Expunerea cronică fie la testosteron, fie la nandrolon, reglează AR nucleară celulară la șobolani masculi (Menard și Harlan, 1993; Wesson și McGinnis, 2006). Astfel, există potențialul pentru AAS de a spori comportamentele dependente de androgen atât prin completarea androgenilor endogeni și prin creșterea receptivității androgenice prin creșterea expresiei AR.
În comparație cu comportamentul agonist, AAS au un efect mai puțin pronunțat asupra comportamentului de împerechere la rozătoarele masculilor, iar răspunsul depinde de steroidul special utilizat (revizuit în Clark și Henderson, 2003). La hamsterii masculi care consumă testosteron în soluții orale, ejacularea a crescut într-o manieră dependentă de doză (Wood, 2002). Cu toate acestea, nici testosteronul, nici nandrolonul nu au îmbunătățit împerecherea la șobolanii masculi adolescenți. Stanozolol, un AAS relativ mai puțin puternic, cu activitate androgenetică minimă, a inhibat efectiv atât împerecherea, cât și agresiunea (Farrell și McGinnis, 2003), probabil prin reducerea nivelurilor endogenice de androgeni.
Este deosebit de important de observat că hamsterii adolescenți și adulți pot prezenta răspunsuri comportamentale diferite la expunerea AAS. Deși AAS a sporit considerabil comportamentul agonist la bărbații adolescenți, același tratament la adulți a produs doar o creștere modestă a comportamentului agresiv și a unui comportament sexual scăzut semnificativ (Salas-Ramirez, Montaldo și Sisk, 2008). Acest lucru este în concordanță cu conceptul de adolescență ca o perioadă sensibilă pentru acțiunea androgenică. Mai mult, la fel cum hamsterii adulți de sex masculin dobândesc toleranță la testosteron exogen (Peters și Wood, 2005), credem că bărbații în curs de dezvoltare dobândesc toleranță la testosteron pe măsură ce se maturizează. Astfel, efectele AAS se schimbă de-a lungul dezvoltării adolescenților, iar expunerea adolescentului AAS poate determina modele exagerate de comportament agresiv și sexual care pot persista până la maturitate.
Efectele de întărire ale androgenelor
Împerecherea și lupta sunt reciproc avantajoase (cel puțin dacă câștigi lupta). Șobolanii de sex masculin vor apăsa repetat o pârghie pentru a copula cu o femeie (Everitt și Stacey, 1987). În mod similar, șoarecii masculi și hamsterii de sex feminin vor forma o preferință a locului condiționat (CPP) pentru locațiile în care au câștigat anterior lupte (Martinez, Guillen-Salazar, Salvador și Simon, 1995; Meisel și Joppa, 1994). Dacă AAS poate îmbunătăți comportamentele sociale pline de satisfacție peste nivelurile observate în mod obișnuit la bărbații gonad-intacți, este logic să se aștepte ca testosteronul în sine ar putea fi recompensant. Acest lucru a fost testat folosind două modele bine stabilite pentru animale pentru recompensă și armare: CPP și auto-administrare. Rezultatele acestor studii demonstrează că testosteronul se consolidează într-un context experimental în care efectele anabolice și performanțele atletice sunt irelevante. Cu CPP, substanța de testat este asociată în mod repetat cu un mediu unic (de exemplu, o cameră specială în aparatul de testare). Odată ce animalul asociază substanța de testare cu acel mediu, el va căuta mediul înconjurător chiar și în absența recompensei. Primele rapoarte privind recompensa androgenă la animalele de laborator au utilizat injectări sistemice de testosteron pentru a induce CPP la șoareci masculi (Arnedo, Salvador, Martinez-Sanchis și Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis și Pellicer, 2002) și șobolani (Alexander, Packard și Hines, 1994; de Beun, Jansen, Slangen și Van de Poll, 1992). Ulterior, laboratorul nostru a utilizat autoadministrarea testosteronului pentru a demonstra armarea cu androgeni (Johnson și Wood, 2001). Am constatat că hamsterii de sex masculin vor consuma în mod voluntar soluții orale de testosteron utilizând atât teste alegerii sticlelor 2, cât și băuturi induse de alimente. În studiile ulterioare, am demonstrat administrarea intravenoasă la șobolani masculi și hamsteri (Lemn, Johnson, Chu, Schad și Sine, 2004). Administrarea intravenoasă elimină posibilele efecte de confuzie ale gustului sau intestinului umplerea aportului androgen.
În contextul abuzului de AAS, este important să se facă diferența între efectele centrale și periferice ale androgenelor. Deoarece testosteronul are efecte răspândite pe tot corpul, ar putea fi susținut că recompensa și armarea cu injecții sistemice de testosteron sunt secundare acțiunilor sistemice anabolice și androgenice ale testosteronului. Cu alte cuvinte, testosteronul poate reduce oboseala musculara si imbunatateste functia articulatiei, astfel incat animalele doar simţi mai bine. Într-adevăr, această explicație a fost utilizată în literatura clinică (deși fără dovezi experimentale) pentru a contrazice potențialul de dependență și dependență de AAS (DiPasquale, 1998). Totuși, Packard și colab. (Packard, Cornell și Alexander, 1997) a arătat că injecțiile de testosteron direct în creierul de șobolan pot induce CPP. De asemenea, laboratorul nostru a demonstrat auto-administrarea testosteronului intracerebroventricular (icv) la hamsteri de sex masculin (Wood și colab., 2004). CPP intracerebrală și autoadministrarea icv cu testosteron susțin țintele centrale care mediază armarea androgenului.
Este important ca armarea testosteronului să nu urmeze neapărat aceleași mecanisme stabilite anterior pentru efectele steroidului asupra comportamentului sexual. După cum sa discutat anterior, MPOA este un sit-cheie pentru organizarea comportamentului sexual al rozătoarelor de sex masculin (Hull, Meisel și Sachs, 2002). La hamsteri, MPOA are receptori steroizi abundenți, iar implanturile de testosteron din MPOA restabilește activitatea sexuală în castrații pe termen lung (Wood și Swann, 1999). Cursul de timp al acestor efecte de steroizi este lent: comportamentul de menținere persistă după săptămâni după orchidectomie și este necesară o expunere prelungită la steroizi pentru a restabili împerecherea în castramele de lungă durată (Noble și Alsum, 1975). Cu toate acestea, injecțiile de testosteron în MPOA la șobolani masculi nu reușesc să inducă CPP (Regele, Packard și Alexander, 1999). Acest lucru sugerează că alte regiuni ale creierului sunt importante pentru întărirea androgenului.
Dimpotrivă, șobolanii masculi vor forma un CPP la injecții cu testosteron în Acb (Packard și colab., 1997). Ca și în cazul altor medicamente de abuz, DA este probabil un neurotransmițător cheie pentru armarea testosteronului: CPP indus de injectarea sistemică a testosteronului este blocat de antagoniștii receptorilor de dopamină D1 și D2 (Schroeder și Packard, 2000). Cu toate acestea, spre deosebire de alte medicamente de abuz, studiile noastre la hamsteri sugerează că testosteronul nu induce eliberarea Acb DA (Triemstra, Sato și Wood, in presa). De asemenea, studiile efectuate la șobolanii masculari arată că androgenii nu au niciun efect asupra nivelurilor DA de bază sau asupra eliberării DA amfetamino-stimulate (Birgner, Kindlundh-Hogberg, Nyberg și Bergstrom, 2006; dar, de asemenea, a se vedea Clark, Lindenfeld și Gibbons, 1996). În plus, testosteronul exercită o influență relativ minoră asupra nivelelor tisulare de Acb DA (Thiblin, Finn, Ross și Stenfors, 1999). Împreună, aceste date sugerează că, deși armarea testosteronului poate modifica în cele din urmă activitatea DA în Acb, mecanismele pot fi distincte de cele ale cocainelor sau ale altor stimulente. În acest sens, datele recente sugerează că expunerea cronică la AAS poate altera sensibilitatea la DA prin modificarea metabolismului DA (Kurling, Kankaanpaa, Ellermaa, Karila și Seppala, 2005), nivelurile de receptori DA (Kindlundh, Lindblom, Bergstrom, Wikberg și Nyberg, 2001; Kindlundh, Lindblom și Nyberg, 2003) sau transportatorul DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom și Nyberg, 2002).
În prezent, semnalele steroid specifice, receptorii și punctele de acțiune ale creierului pentru armarea testosteronului nu sunt cunoscute. Bazat pe un studiu recent al hamsterilor din laboratorul nostru, efectele de întărire ale testosteronului par a fi mediate atât de androgeni, cât și de estrogeni (DiMeo și Wood, 2006). Common AAS abuzat în mod obișnuit includ atât și androgenii aromatizabili, cât și cei care nu pot fi aromatizați (Gallaway, 1997; WADA, 2006). Acest lucru implică faptul că AR și ER pot transduce stimuli steroizi pentru recompensă. Există posibilitatea suplimentară ca armarea testosteronului să poată fi mediată de o combinație de receptori clasici și non-genomici.
Mai multe linii de dovezi indică acțiunile receptorilor non-genomici în efectele întăritoare ale AAS. În plus față de distribuția redusă a AR în Acb și VTA, cursul de întărire a androgenilor este rapid (<30 min), iar procesarea semnalului prin AR clasică poate să nu fie suficient de rapidă pentru întărire. În consecință, pentru a testa rolul AR non-genomic în întărirea AAS, am utilizat două tehnici complementare (Fig. 7). Într-un experiment (Sato, Johansen, Jordan și Wood, 2006), am permis șobolanilor cu mutație feminizantă testiculară (Tfm, vezi această problemă) să se autoadministreze dihidrotestosteronul (DHT), un androgen ne-aromatizabil. Mutația Tfm diminuează în mod semnificativ legarea ligandului la AR. Cu toate acestea, șobolanii Tfm și frații lor de sex masculin de tip sălbatic au administrat aproximativ aceeași cantitate de DHT. Aceasta susține efectele non-genomice ale DHT. Într-un studiu ulterior, am determinat dacă hamsterii masculi ar autoadministra DHT conjugat cu albumină serică bovină (BSA, Fig. 8, Sato și lemn, 2007). Conjugatele DHT-BSA sunt impermeabile la membrană; astfel, efectele lor sunt limitate la suprafața celulei. Hamsterii autoadministrați DHT, așa cum a fost demonstrat anterior (DiMeo și Wood, 2006). Ei au arătat o preferință similară pentru conjugatele DHT-BSA, dar nu au reușit să-și administreze singur BSA.

Fig. 7

Fig. 8
Aceste date indică un rol central pentru AR suprafețele celulare în armarea androgenului. În prezent, natura exactă a acestor receptori nu este cunoscută. S-a sugerat că androgenii pot acționa la suprafața celulei prin legarea la membrana specifică AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff și Doughty, 2006, vezi și această problemă). Aceasta poate fi sub formă de AR clasic extra-nuclear așa cum este raportat în hipocampus (Sarkey și colab., În această ediție). În mod alternativ, studii anterioare au descris, de asemenea, situsuri de legare a steroizilor pe alte sisteme neurotransmițătoare. În mod specific, o varietate de hormoni steroizi incluzând AAS pot modula allosteric receptorul GABA-A (Henderson, 2007; Lambert, Belelli, Peden, Vardy și Peters, 2003). De asemenea, neurosteroizii sulfați pot modifica activitatea N-metil-D- subtipurile receptorilor aspartați (Malayev, Gibbs și Farb, 2002) receptori. Acesta este un domeniu important pentru cercetarea viitoare.
De ce ar trebui să existe o membrană AR? După cum sa discutat anterior, există o asociere strânsă între secreția de androgeni și recompensarea comportamentelor sociale. Putem specula că creșterea secreției de testosteron care urmează împerecherii sau luptei servește la întărirea comportamentului. Dacă este așa, este necesar să aveți o cuplare rapidă a stimulului (comportamentului) și a recompensării (testosteron). Acest lucru poate fi realizat cel mai bine prin legarea membranei AR. În acest sens, ar fi interesant să se stabilească dacă strângerea secreției de androgen în timpul împerecherii reduce efectele recompensatoare ale comportamentului sexual.
Rezumat
Aici revedem dovezile că androgenii sunt mediatori potențiali ai comportamentelor motivate pentru adulți și, în plus, că timpul de expunere la androgeni în timpul programelor de dezvoltare și un comportament motivațional dependent de androgeni la vârsta adultă. Steroizii anabolizanți devin rapid un medicament favorizat de abuz de către adolescenți din SUA. În timp ce AAS poate să nu aibă potențialul de dependență de cocaină sau heroină, începem doar să înțelegem potențialul de întărire și dependență de androgeni. În special, deoarece sportul pentru tineret devine mai competitiv, există o presiune din ce în ce mai mare asupra dezvoltării sportivilor care utilizează steroizi, începând cu vârstele mai tinere. Această tendință este îngrijorătoare în perspectiva unor noi dovezi privind maturizarea neuronală sensibilă la steroizi la adolescenți.
În ciuda creșterii gradului de conștientizare a comunității publice și a științifică a schimbărilor profunde neurale care însoțesc adolescența, studiul experimental al neurobiologiei de dezvoltare a pubertății a fost limitat. Sunt necesare modele animale de dezvoltare a adolescenților pentru a investiga modul în care calendarul expunerii hormonale în timpul dezvoltării crește riscul unui individ de a trata psihopatologia și consumul de droguri și ce tipuri de experiențe atenuează sau amplifică efectele comportamentale ale abaterilor în momentul pubertal. De exemplu, factorii sociali, cum ar fi influența colegilor, exacerbează efectele calendarului pubertal pentru consumul de substanțe și alcool (Biehl, Natsuaki și Ge, 2007; Patton, Novy, Lee și Hickok, 2004; Simons-Morton și Haynie, 2003; Wichstrom și Pedersen, 2001). Modelele animale de sincronizare pubertală vor informa, de asemenea, eforturile de cercetare umană și, eventual, vor conduce la intervenții terapeutice mai eficiente în timpul adolescenței.
recunoasteri
Îi mulțumim pe Eleni Antzoulatos, pe Cortney Ballard, pe Lucy Chu, pe Kelly Peters, pe Jennifer Triemstra, pe Jane Venier, pe Lisa Rogers și pe Pamela Montalto pentru asistență pentru aceste studii. Această lucrare este susținută de granturi de la NIH (DA12843 la RIW, MH68764 la CLS și MH070125 la KMS).
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris needitat care a fost acceptat pentru publicare. Ca serviciu pentru clienții noștri oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, tipăririi și revizuirii probelor rezultate înainte de a fi publicat în forma sa finală. Rețineți că în timpul procesului de producție pot fi descoperite erori care ar putea afecta conținutul și toate denunțările legale care se referă la jurnal.
Referinte
- Alexander GM, Packard MG, Hines M. Testosteronul are proprietăți afective de recompensare la șobolanii masculi: implicații pentru baza biologică a motivației sexuale. Neuroștiințe comportamentale. 1994;108: 424-8. [PubMed]
- Andersen SL. Traiectoriile dezvoltării creierului: punct de vulnerabilitate sau fereastră de oportunitate? Neuroștiințe și recenzii bio-comportamentale. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Diferențele sexuale în supraproducția și eliminarea receptorilor dopaminergici. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Proprietățile satisfacatoare ale testosteronului la șoarecii intacți masculi: un studiu pilot. Farmacologie, biochimie și comportament. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Efectele similare de recompensare ale testosteronului la șoarecii evaluați ca indivizi latenți de atac scurt și lung. Addiction Biology. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Efectele organizatorice și activationale ale steroizilor sexuali asupra creierului și comportamentului: o reanaliză. Hormoni și comportament. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Convergența și plasticitatea sistemelor monoaminergice în cortexul prefrontal medial în perioada postnatală: implicații pentru dezvoltarea psihopatologiei. Cortex cerebral. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Mielinizarea unei zone cu releu cheie în formarea hipocampului are loc în creierul uman în timpul copilariei, adolescenței și maturității. Arhivele de psihiatrie generală. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Influența timerului pubertal asupra consumului de alcool și a traiectoriilor grele de băut. Jurnalul de tineret și adolescență. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Scrisori de neuroștiințe. 2006. Niveluri extracelulare modificate de DOPAC și HVA în coaja nucleului accumbens de șobolan ca răspuns la administrarea sub-cronică de nandrolon și la o provocare ulterioară a amfetaminei.
- Bond AJ, Choi PY, Pope HG., Jr Evaluarea părtinirei atenționale și a dispoziției la utilizatorii și utilizatorii de steroizi anabolico-androgenici. Dependența de droguri și alcool. 1995;37: 241-5. [PubMed]
- Brower KJ. Anabolism și dependență de steroizi anabolizanți. Rapoartele actuale de psihiatrie. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Analiza clinică și testarea urinei pentru abuzul și dependența de steroizi anabolico-androgenici. American Journal of Drug & Alcohol Abuse. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Metabolizarea steroizilor în creierul mamiferelor: reducerea și aromatizarea 5alpha. Brain Research Bulletin. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Diferențierea sexuală a nucleului patului la stria terminalis la om poate să se extindă până la maturitate. Revista de Neuroștiințe. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Răspunsuri comportamentale și fiziologice la steroizi anabolico-androgenici. Neuroștiințe și recenzii bio-comportamentale. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Steroizi anabolico-androgeni și recompensa creierului. Farmacologie, biochimie și comportament. 1996;53: 741-5.
- Conacher GN, DG Workman. Criminalitate violentă posibil asociată cu utilizarea steroizilor anabolizanți. Jurnalul American de Psihiatrie. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Provocarea fizică a șobolanilor masculi expuși la steroizi anabolizanți anabolizanți androgenici provoacă agresivitate față de femei. Hormoni și comportament. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Lupta lichidului cefalorahidian și modificările comportamentale după administrarea metiltestosteronului: concluzii preliminare. Arhivele de psihiatrie generală. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Dimorfismele sexuale structurale în nucleul periventricular anteroventral al hipotalamusului de șobolan sunt sensibile la steroizi gonadali perinatal, dar se dezvoltă peripubertal. Neuroendocrinologie. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Testosteronul ca stimulent apetit și discriminativ la șobolani: efecte dependente de sex și doză. Fiziologie și comportament. 1992;52: 629-34. [PubMed]
- Dekaban AS. Modificări ale greutății creierului în timpul vieții umane: relația dintre greutățile creierului și înălțimile corporale și greutățile corporale. Analele Neurologiei. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Medicamentele abuzate de oameni cresc preferențial concentrațiile de dopamină sinaptică în sistemul mesolimbic al șobolanilor în mișcare liberă. Proceedings of the National Academy of Sciences din Statele Unite ale Americii. 1988;85: 5274-8. [Articol gratuit PMC] [PubMed]
- DiMeo AN, Wood RI. Auto-administrarea de estrogen și dihidrotestosteron la hamsteri de sex masculin. Hormoni și comportament. 2006;49: 519-26. [PubMed]
- DiPasquale M. Steroizi anabolizanți. In: Tarter RE, Ammerman RT, Ott PJ, editori. Manual privind abuzul de substanțe. Plenum Press; NY: 1998. pp. 547-565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Reglarea prin amigdala mediană a copulației și eliberarea dopaminei preoptice mediale. Revista de Neuroștiințe. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stimularea amigdalei mediale sporește eliberarea dopaminei preoptice medii: implicații pentru comportamentul sexual al șobolanilor masculi. Cercetarea creierului. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Castrarea scade extracelulare, dar crește intracelular, dopamina în zona preoptică mediană a șobolanilor masculi. Cercetarea creierului. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Natura și soarta celulelor proliferative în gyrusul dentat hipocampal pe durata de viață a maimuței rhesus. Revista de Neuroștiințe. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Studii de comportament instrumental cu armare sexuală la șobolani masculi (Rattus norvegicus): II. Efectele leziunilor din zona preoptică, castrarea și testosteronul. Jurnalul de Psihologie Comparativa. 1987;101: 407-19. [PubMed]
- Gallaway S. Biblia steroidă. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Profilul de personalitate al bărbaților care utilizează steroizi anabolizanți androgenici. Hormoni și comportament. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Modificări prelungite ale sistemului neuronal serotonin în urma încetării expunerii steroizilor anabolizo-androgenici adolescenți la hamsteri (Mesocricetus auratus) Neuroștiințe comportamentale. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Schimbări ale acidului homovanilic psihologic și seric la bărbații cărora li s-au administrat steroizi androgenici. Psychoneuroendocrinology. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH. Jr Tratamentul cronologic cu steroizi anabolico-androgeni în timpul adolescenței crește vasopresina hipotalamică anterioară și agresivitatea hamsterilor intacți. Psychoneuroendocrinology. 2000;25: 317-38. [PubMed]
- El J, Crews FT. Neurogenesisul scade în timpul maturării creierului de la adolescență până la maturitate. Farmacologie, biochimie și comportament. 2007;86: 327-33.
- Henderson LP. Modularea steroidică a transmisiei mediate de receptorul GABAA în hipotalamus: efecte asupra funcției de reproducere. Neuropharmacology. 2007;52: 1439-53. [Articol gratuit PMC] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Dopamina extracelulară în zona preoptică mediană: implicații pentru motivația sexuală și controlul hormonal al copulației. Revista de Neuroștiințe. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Comportamentul sexual al bărbatului. In: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, editori. Hormoni, creier și comportament. Academic Press; New York: 2002. pp. 3-137.
- Hull EM, Wood RI, McKenna KE. Neurobiologia comportamentului sexual masculin. În: Neill JD, redactor. Fiziologia reproducerii. Voi. 1. Elsevier Press; New York: 2006. pp. 1729-1824.
- Huttenlocher PR, Dabholkar AS. Diferențe regionale în sinaptogenesis în cortexul cerebral uman. Jurnalul de Neurologie Comparativă. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Administrarea orală a testosteronului la hamsteri de sex masculin. Neuroendocrinologie. 2001;73: 285-92. [PubMed]
- Johnston LD, premierul O'Malley, Bachman JG. Elevii școlii secundare (publicația NIH nr. 03-5375) I. Bethesda, MD: Institutul Național pentru Abuzul de Droguri; 2003. Monitorizarea rezultatelor viitoare ale sondajului național privind consumul de droguri, 1975-2002.
- Kaiser Family Foundation. Activitatea sexuală a adolescenților americani. 2005. pp. # 3040-02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Reglarea imunoreactivității receptorilor androgenici ai creierului de androgen în dihorii prepuberali masculi. Biologia reproducerii. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Efectele dopaminergice după tratamentul cronic cu nandrolon vizualizat în creierul de șobolan prin tomografie cu emisie de pozitroni. Progrese în NeuroPsihofarmacologie și Psihiatrie Biologică. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Decanatul anabolic-androgenic nandrolon decanoat afectează densitatea receptorilor de dopamină la creierul de șobolan masculin. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Administrarea cronică cu decanoat de nandrolon induce modificări în conținutul de transcripție genetică a receptorilor de dopamină D (1) și D (2) în creierul șobolanului. Cercetarea creierului. 2003;979: 37-42. [PubMed]
- Rege BE, Packard MG, Alexander GM. Proprietățile afective ale injectărilor de testosteron din zona preoptică intra-mediană la șobolanii masculi. Scrisori de neuroștiințe. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Neurobiologia dependenței de droguri. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Papa HG, Jr, Oliva PS. A crescut reacția agresivă la voluntarii de sex masculin după administrarea de doze crescătoare treptate de cipionat de testosteron. Dependența de droguri și alcool. 1995;40: 73-9. [PubMed]
- Kritzer MF. Gonadectomia pe termen lung afectează densitatea hidroxilazei tirozin-dar nu a dopaminei-beta-hidroxilază-, axonilor de colină acetiltransferază sau serotonin-imunoreactivi în cortexul prefrontal medial al șobolanilor masculi adulți. Cortex cerebral. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Efectul tratamentului sub-cronic cu nandrolon decanoat asupra sistemelor neuronale dopaminergice și serotoninergice în creierul șobolanilor. Cercetarea creierului. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Modularea neurostiroidică a receptorilor GABAA. Progrese în neurobiologie. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Dezvoltarea creierului la copii și adolescenți: informații despre imagistica prin rezonanță magnetică anatomică. Neuroștiință și revizuire bio-comportamentală. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogeneza inervării dopaminei în nucleul accumbens al gerbililor. Cercetarea creierului. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Inhibarea răspunsului NMDA de către sulfat de pregnenolonă evidențiază modularea selectivă subtipică a receptorilor NMDA prin steroizi sulfați. British Journal of Pharmacology. 2002;135: 901-9. [Articol gratuit PMC] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Agresivitatea intermală de succes și preferința locului condiționat la șoareci. Fiziologie și comportament. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Acțiunile testosteronului la hamsteri de sex masculin prepubertal și postpubertal: disocierea efectelor asupra comportamentului reproductiv și a imunoreactivității receptorilor androgenici ai creierului. Hormoni și comportamente. 1997;31: 75-88.
- Meisel RL, Joppa MA. Preferința locului preferat la hamsterii de sex feminin, în urma unor întâlniri agresive sau sexuale. Fiziologie și comportament. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Examenul steroizi anabolico-androgenic în timpul adolescenței și comportamentul agresiv la hamsterii de aur. Fiziologie și comportament. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Reglarea în sus a imunoreactivității receptorilor androgenici în creierul de șobolan prin steroizi androgen-anabolizanți. Cercetarea creierului. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiolul reduce curenții de calciu la neuronii neostriatali de șobolan prin intermediul unui receptor de membrană. Revista de Neuroștiințe. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Nivelurile de agresiune în rândul unui grup de utilizatori de steroizi anabolico-androgenici. Medicină, știință și drept. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Experiența socială a adolescenților restabilește comportamentul ejaculator adult la hamsteri de sex masculin din Siria fără testosteron pubertal. Societatea pentru neuroendocrinologie comportamentală; Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Diformisme sexuale dependente de hormoni la hamsterul de aur (Mesocricetus auratus) Fiziologie și comportament. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Moartea celulelor în dezvoltarea cortexului posterior la șobolani masculi și femele. Jurnalul de Neurologie Comparativă. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Hormonii ovarieni după ziua postnatală 20 reduc numărul neuronilor în cortexul vizual primar de șobolan. Jurnalul de Neurobiologie. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Efectele testosteronului asupra stării de spirit, agresivității și comportamentului sexual la bărbații tineri: un studiu dublu-orb, controlat cu placebo, încrucișat. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Recompensarea proprietăților afective ale injectărilor de testosteron intra-nucleu accumbens. Neuroștiințe comportamentale. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH mARN crește odată cu pubertatea la creierul de hamster sirian masculin. Jurnalul de Neuroendocrinologie. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Utilizarea steroizi anabolici de către sportivii amatori: efecte asupra stărilor de stare psihică. Journal of Sports Medicine & Physical Fitness. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Diagnosticul și rezultatul reproducerii după tratamentul chirurgical al uterului complet septat, al cervixului dublu și al septului vaginal. Revista Americană de Obstetrică și Ginecologie. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Maturarea materiei albe în creierul uman: o analiză a studiilor de rezonanță magnetică. Brain Research Bulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Măsuri de agresivitate și modificări ale dispoziției la halterofilii de sex masculin cu și fără utilizare steroizi anabolizanți androgenici. Oficial al științelor criminalistice. 2003;48: 646-51. [PubMed]
- Peters KD, Lemn RI. Androgen dependența de hamsteri: supradozaj, toleranță și potențiale mecanisme opioidergice. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, CD Blaha, Phillips AG, Fibiger HC. Comportamentul sexual amplifică transmiterea centrală a dopaminei la șobolanul mascul. Cercetarea creierului. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Tineri WC. Organizarea acțiunii propionatului de testosteron administrate prenatal pe țesuturile care mediază comportamentul de împerechere la cobaiul de sex feminin. Endocrinologie. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Dezvoltarea diferențelor sexuale în locus coeruleus a șobolanului. Brain Research Bulletin. 2001;56: 73-8. [PubMed]
- Papa HG, Jr, Katz DL. Omuciderea și omorurile apropiate de utilizatorii de steroizi anabolizanți [vezi comentariul] Jurnalul Clinic de Psihiatrie. 1990;51: 28-31. [PubMed]
- Papa HG, Jr, Katz DL. Efectele psihiatrice și medicale ale utilizării steroizilor anabolico-androgenici. Un studiu controlat al sportivilor 160. Arhivele de psihiatrie generală. 1994;51: 375-82. [PubMed]
- Papa HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Utilizarea steroizilor anabolico-androgenici printre prizonierii 133. Comprehensive Psychiatry. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Refacerea testosteronului a comportamentului copulator se corelează cu eliberarea dopaminei medii preoptice la șobolanii masculi castrați. Hormoni și comportament. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Efectele metaboliților de testosteron asupra copulației și eliberării dopaminei preoptice medii la șobolanii masculi castrați. Hormoni și comportament. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Efectele metaboliților de testosteron asupra copulației, dopaminei mediami medii și imunoreactivității NOS la șobolanii masculi castrați. Hormoni și comportament. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Neurogenesa postnatală în nucleul conținând vasopresină și oxitocină a hipotalamusului porcului. Cercetarea creierului. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH, Jr Activitatea și expresia receptorului serotonin-1A modulează agresivitatea indusă de steroizi anabolici / androgenici adolescenți la hamsteri. Farmacologie, biochimie și comportament. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihidrotestosteronul activează comportamentul sexual la hamsterii masculi adulți, dar nu la tinerii. Fiziologie și comportament. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Imunoreactivitatea receptorilor estrogenici la hamsteri sirieni de sex masculin prepubertali și adulți. Scrisori de neuroștiințe. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromonii eliberează nivele echivalente de imunoreactivitate Fos la hamsteri de sex masculin preprimați și adulți masculi din Siria. Hormoni și comportament. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Pubertatul și maturarea creierului masculin și a comportamentului sexual: reformarea unui potențial de comportament. Neuroștiințe și recenzii bio-comportamentale. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiolul induce receptorii hipotalamici de progesteron, dar nu activează comportamentul de împerechere la hamsterii masculi (Mesocricetus auratus) înainte de pubertate. Neuroștiințe comportamentale. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Steroizii androgeni anabolizanți (AAS) afectează diferențiat comportamentele sociale la adolescenți și la adulții de hamsteri sirieni masculi. Hormoni și comportament. 2008 in presa.
- SAMHSA / OAS. Publicația nr. DHHS (SMA) 1996. 1994 Studiul național privind consumul de droguri privind consumul de droguri, principalele constatări 1994; pp. 96-3085.
- SAMHSA / OAS. Rezultatele studiului național 2004 privind consumul de droguri și sănătatea: constatări naționale. 2005. Seria NSDUH H-28, publicație DHHS nr. SMA 05-4062.
- Sato SM, Johansen J, Iordania CL, Wood RI. Androgenul de autoadministrare la șobolani Tfm. 10th reuniunea anuala a Societatii pentru neuroendocrinologie comportament.2006.
- Sato SM, Wood RI. Administrarea automată a steroizilor anabolico-androgenici impermeabili la membrană (aas) în hamsterile din Syrian. 11th Reuniunea anuală a Societății de neuroendocrinologie comportamentală.2007.
- Schroeder JP, Packard MG. Rolul subtipurilor de receptori ai dopaminei în obținerea unei preferințe de localizare condiționată de testosteron la șobolani. Scrisori de neuroștiințe. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Violența domestică asociată cu abuzul de steroizi anabolizanți. Jurnalul American de Psihiatrie. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Expunerea hormonului testicular în timpul adolescenței organizează comportamentul de marcare a flancului și legarea receptorului de vasopresină în septul lateral. Hormoni și comportament. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Reacțiile dopaminergice din zona preoptică mediană la feromonii feminini se dezvoltă în timpul pubertății la hamsterul masculin sirian. Cercetarea creierului. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadalii hormoni masculinizează și defeminizează comportamentele reproductive în timpul pubertății la hamsterul sirian masculin. Hormoni și comportament. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Hormonii pubertali, creierul adolescent și maturarea comportamentelor sociale: Lecții de la hamsterul sirian. Endocrinologie moleculară și celulară. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Planificatorul întâlnirilor cu neuroștiințe. Sandiego, CA: Societatea pentru Neuroștiințe; 2007. Este adolescența o a doua perioadă sensibilă pentru efectele organizatorice ale testosteronului asupra comportamentului reproductiv masculin adult? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Perioade critice în organizarea sistemelor. Psihologia dezvoltării. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Distribuția comparativă a receptorului de estrogen-alfa și -beta mRNA în sistemul nervos central al șobolanului. Jurnalul de Neurologie Comparativă. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Predictorii psihosociali ai fazei de fumat au crescut în rândul elevilor de clasa a șasea. Revista americană a comportamentului sănătății. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Hormonii pubertali organizează creierul și comportamentul adolescentului. Frontiere în neuroendocrinologie. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Bine ati venit SE, Kan E, Toga AW. Cartografierea longitudinală a grosimii corticale și a creșterii creierului la copii normali. Revista de Neuroștiințe. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Maparea creșterii creșterii creierului și reducerea densității materiei cenușii în cortexul frontal dorsal: relații inverse în timpul maturării creierului postadolescent. Revista de Neuroștiințe. 2001;21: 8819-29. [PubMed]
- Spear LP. Creierul adolescent și manifestările comportamentale legate de vârstă. Neuroștiință și revizuire bio-comportamentală. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Efectele neuropsihiatrice ale steroizilor anabolizanți la voluntarii normali de sex masculin. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Creșterea activităților dopaminergice și 5-hidroxitriptaminergice la creierul de șobolan mascul după tratamentul pe termen lung cu steroizi anabolizanți androgenici. British Journal of Pharmacology. 1999;126: 1301-6. [Articol gratuit PMC] [PubMed]
- Thomas P, dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, receptori cuplați de estrogeni și androgeni G-proteină în gonade de pește. Steroizi. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Efectele dozelor suprafiziologice de testosteron asupra comportamentului supărat la bărbații sănătoși eugonadali - un studiu al centrului de cercetare clinică. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Semnele chimosenzoriale sunt esențiale pentru eliberarea de dopamină indusă de împerechere în MPOA de hamsteri masculi sirieni. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, lemn RI. Testosteronul și nucleul accumbens dopamină la hamsterul sirian masculin. Psychoneuroendocrinology (in presa)
- Van Eenoo P, Delbeke FT. Prevalența dopajului în Flandra în comparație cu prevalența dopajului în sporturile internaționale. Jurnalul Internațional de Medicină Sportivă. 2003;24: 565-570. [PubMed]
- WADA. Constatări analitice adverse raportate de laboratoarele acreditate. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Stabilirea steroizilor androgeni anabolizanți (AAS) în timpul pubertății la șobolani: o evaluare neuroendocrină și comportamentală. Farmacologie, biochimie și comportament. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Utilizarea steroizilor anabolico-androgenici în adolescență: câștigătoare, arătând bine sau rău? Oficial al studiilor privind alcoolul. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Analiza testosteronului: administrare intravenoasă și intracerebroventriculară la șobolani și hamsteri de sex masculin. Psychopharmacology. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Androgenii și receptorii de estrogen coexistă cu neuronii individuali din creierul hamsterului sirian. Neuroendocrinologie. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Integrarea neuronală a semnalelor chemosenzoriale și hormonale care controlează comportamentul sexual masculin. În: Wallen K, Schneider JS, editori. Reproducere în context. MIT Press; Cambridge: 1999. pp. 423-444.
- Zahm DS, Heimer L. Două cai transpalidice originare din nucleul accumbens de șobolan. Jurnalul de Neurologie Comparativă. 1990;302: 437-46. [PubMed]