OBSERVAȚII: o revizuire a cercetătorului de top privind obezitatea și dependența de alimente.
Volumul 69, Numărul 4, 24 Februarie 2011, Paginile 664-679
http://dx.doi.org/10.1016/j.neuron.2011.02.016,
Recenzie
Paul J. Kenny1, ,
1 Laboratorul de Neuroștiințe comportamentale și moleculare, Departamentul de Terapie Moleculară, Institutul de Cercetări Scripps, Jupiter, FL 33458, SUA
________________________________________
Alimentele sunt consumate pentru a menține echilibrul energetic la nivel homeostatic. În plus, alimentele gustoase sunt, de asemenea, consumate pentru proprietățile sale hedonice, indiferent de starea energetică. Un astfel de consum de recompensă poate duce la depășirea cerințelor de admisie calorică și este considerat un vinovat major în creșterea rapidă a ratei obezității în țările dezvoltate. În comparație cu mecanismele homeostatice de hrănire, se știe mult mai puțin despre modul în care sistemele hedonice din creier influențează consumul de alimente. Intrigant, consumul excesiv de alimente gustoase poate declansa raspunsuri neuroadaptive in circuitele de recompensare a creierului similare cu medicamentele de abuz. În plus, vulnerabilitățile genetice similare în sistemele de recompensare a creierului pot spori predispoziția la dependența de droguri și obezitatea. Aici, vor fi revizuite progresele recente în înțelegerea circuitelor creierului care reglementează aspectele hedonice ale comportamentului alimentar. De asemenea, vor fi luate în considerare și dovezi noi care sugerează că obezitatea și dependența de droguri ar putea avea mecanisme hedonice comune.
________________________________________
Textul principal
"Nu există iubire sinceră decât iubirea de mâncare".
-George Bernard Shaw
Introducere
Obezitatea, definită ca un indice de masă corporală (IMC)> 30, este o afecțiune în care adipozitatea este anormal de mare și poate rezulta din hiperfagie sau scăderea ratei metabolice (O'Rahilly, 2009). Adipozitatea excesivă este un factor de risc major pentru bolile cardiovasculare, cancerul, diabetul de tip 2 și tulburările legate de dispoziție, persoanele obeze suferind adesea de stigmatizare socială ([Bean și colab., 2008], [Centers for Disease Control and Prevention, 2009] și [Luppino și colab., 2010]). Potrivit Centrului pentru Controlul Bolilor (CDC), cheltuielile legate de obezitate pentru îngrijirea sănătății în Statele Unite între 1998 și 2000 au fost de aproximativ 213 miliarde de dolari. Mai mult, 300,000 de decese în Statele Unite în fiecare an pot fi atribuite bolilor legate de supraponderalitate și obezitate (Allison și colab., 1999), obezitatea fiind a doua cauză principală de deces prevenibil în spatele consumului de tutun. Cu toate acestea, prevalența obezității în societățile occidentale continuă să crească dramatic, estimările actuale sugerând că mai mult de 30% dintre adulții din Statele Unite sunt obezi (Flegal și colab., 2010).
Cele mai multe conceptualizări ale regulării hrănirii sugerează că două sisteme paralele interacționează pentru a influența aportul alimentar (Hommel și colab., 2006], [Lutter și Nestler, 2009] și [Morton et al., 2006]). Sistemul homeostatic cuprinde regulatori hormonali ai nivelurilor de foame, satietate și adipozitate, cum ar fi leptina, ghrelinul și insulina, care acționează asupra circuitelor hipotalamice și ale brațului pentru a stimula sau inhiba hrănirea pentru a menține un nivel adecvat al echilibrului energetic. Disfuncția în componentele sistemului homeostatic, cum ar fi deficiența congenitală de leptină, poate duce la o stare persistentă de echilibru energetic pozitiv și la dezvoltarea obezității ([Campfield și colab., 1995], [Halaas și colab., 1995] și [Pelleymounter și colab., 1995]). Mecanismele prin care regulatorii hormonali ai foametei și sațietății acționează asupra circuitelor hipotalamice și a tulpinilor cerebrale pentru a menține homeostazia energetică au fost descrise în detaliu în altă parte, iar cititorii interesați de acest subiect se referă la numeroasele recenzii excelente pe această temă (de exemplu, [Abizaid și alții, 2006a] și [Gao și Horvath, 2007]).
În plus față de sistemele metabolice, sistemele de recompensare a creierului joacă, de asemenea, un rol important în comportamentul de hrănire ([Lutter și Nestler, 2009] și [Saper și colab., 2002]). În general, alimentele cu gust bland nu sunt consumate în exces, în timp ce alimentele gustoase sunt adesea consumate chiar și după ce au fost îndeplinite cerințele de energie. Accesul ușor la alimente gustoase cu energie este considerat un factor major de risc de mediu pentru obezitate (Volkow și Wise, 2005), iar consumul excesiv de alimente gustoase este considerat un factor major care contribuie la creșterea recentă a obezității ([Finkelstein și colab., 2005], [Hill și colab., 2003] și [Swinburn și colab., 2009]). Într-adevăr, obținerea efectelor plăcute ale alimentelor gustative este o forță puternică de motivare care, la anumite persoane, poate suprascrie semnalele homeostatice ([Shomaker și colab., 2010], [duminică și colab., 1983] și [Zheng și colab., 2009]) . Atunci când li se oferă o alegere, șobolanii preferă în mod covârșitor să consume o soluție de zaharină fără calorii decât să se autoadministreze perfuzii intravenoase de cocaină (Lenoir și colab., 2007). Mai mult, șobolanii bine hrăniți se vor expune voluntar la frig extrem (-15 ° C), dureri de căldură nocive sau șocuri aversive pentru a obține produse alimentare plăcute, cum ar fi shortcake, pate de carne, unt de arahide, Coca-Cola, bomboane M&M, ciocolată chipsuri, sau picături de iaurt, chiar și atunci când este disponibil liber un chow standard mai puțin plăcut ([Cabanac și Johnson, 1983], [Foo și Mason, 2005] și [Oswald și colab., 2010]). Aceste descoperiri evidențiază cât de intens pot fi macronutrienții din alimentele gustabile care pot stimula sistemele de recompensare a creierului, independent de valoarea lor calorică ([Wang și colab., 2004a] și [Wang și colab., 2004b]) și cât de mare poate fi motivația de a consuma alimente gustabile. chiar și în absența unor cerințe de energie homeostatică. Medicamentele abuzive, cum ar fi cocaina sau nicotina, pot induce în mod similar niveluri ridicate de comportament consumatoriu, chiar dacă sunt lipsite de valoare calorică sau nutritivă. De fapt, datorită numeroaselor similitudini dintre consumul excesiv de obezitate și consumul excesiv de droguri în dependență (Volkow și Wise, 2005), s-a susținut că obezitatea ar trebui considerată ca o tulburare a creierului și inclusă ca categorie de diagnostic în viitoarea ediție a cincea din Manualul de diagnostic și statistic al tulburărilor mentale (DSM-V) ([Devlin, 2007] și [Volkow și O'Brien, 2007]). În comparație cu mecanismele homeostatice ale comportamentului alimentar, se știe mult mai puțin despre modul în care sistemele hedonice influențează consumul de alimente. În mod similar, rămâne neclară influența modificărilor intrinseci sau induse de dietă asupra capacității de reacție a sistemelor de recompensare a creierului și a modului în care aceste efecte contribuie la supraalimentarea și obezitatea. Rezumate mai jos sunt date recente care evidențiază progresele în înțelegerea mecanismelor hedonice ale alimentației și a modificărilor induse de dietă în activitatea de recompensare a creierului care pot contribui la dezvoltarea obezității.
Activarea sistemelor de recompensare a creierului ca răspuns la alimentele palatabile: interacțiunile cu regulatorii hormonali ai echilibrului energetic
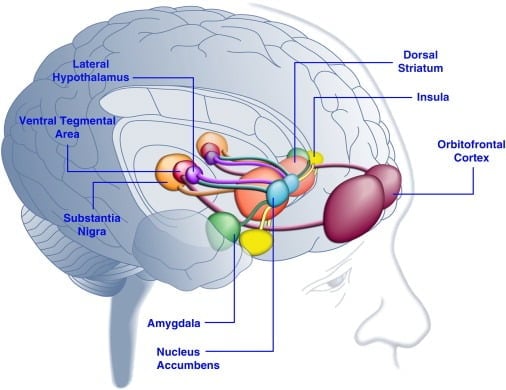
Consumul de alimente gustoase poate îmbunătăți starea de spirit la om ([Dallman și colab., 2003] și [Macht și Mueller, 2007]) și sprijină stabilirea unei preferințe de locație condiționată la animale de laborator ([Imaizumi et al., 2001] Sclafani și colab., 1998]). Aceste efecte sunt probabil legate de stimularea sistemelor de recompensare a creierului prin alimente gustoase (Figura 1). Într-adevăr, studiile privind imagistica creierului uman au arătat că indiciile alimentare și legate de alimentație vizuală sau olfactivă pot activa circuite creier corticolimbice și meso accumbens implicate în recompensă, în special cortexul orbitofrontal (OFC), insula, amigdala, hipotalamus, striatum și midbrain regions inclusiv în zona tegmentală ventrală (VTA) și substanția nigra (SN) ([Bragulat și colab., 2010], [Pelchat și colab., 2004], [Schur și colab., 2009] și [Simmons și colab. ). Stratul, insula, cortexul cingular anterior și structurile midbrain codifică valoarea subiectivă a recompensei indiferent de tipul lor (de exemplu, alimente, sex, recompense monetare), în concordanță cu rolul acestei rețele neuronale în reprezentarea generală hedonică (Sescousse et al. , 2010). În contrast, OFC pare să joace un rol deosebit de important în reprezentările legate de valoarea anumitor tipuri de recompense, inclusiv alimentele gustoase [Man et al., 2009], [Rolls, 2008] și [Sescousse et al., 2010] ). Foamea poate îmbunătăți activarea gastrică indusă de alimente a regiunilor corticolimbice și midbrain la om (LaBar și colab., 2001). De exemplu, intensitatea activării striatumului ventral, a amigdalei, a insulei și OFC ca răspuns la alimentele gustoase cu calorii înalte a fost mult mai mare atunci când subiecții umani erau mai degrabă foame decât bine hraniți (Goldstone et al., 2009). Acest lucru este în concordanță cu faptul că perioadele de foame și de dietă cresc în mod automat raportările privind "puterea" alimentelor gustoase și dorința de a-și "tenta" alimentele ([Hofmann et al., 2010] și [Rolls et al., 1983] ). Dimpotrivă, suprapunerea poate reduce răspunsurile neuronale la alimentele gustoase, în special în cortexul insular și hipotalamus (Cornier și colab., 2009). Prin urmare, valoarea hedonică a alimentelor este influențată de starea metabolică, sugerând că regulatorii metabolismului, cum ar fi leptina și ghrelinul, pot influența activitatea sistemelor hedonice din creier. În concordanță cu această viziune, subiecții umani tratați cu leptină sau peptida factorului postprandial derivat din intestinul subțire YY3-36 (PYY) ([Batterham și colab., 2007] și [Farooqi și colab., 2007]) sau cei care au suferit distensie gastrică imitarea ingestiei de mâncare (Wang și colab., 2008), a avut activitate redusă în regiunile cerebrale legate de recompensă. În schimb, pacienții cu hiperfagie umană cu deficiență congenitală de leptină demonstrează o activitate crescută în cortexul insular și striatum ca răspuns la imaginile alimentelor [Baicy et al., 2007] și [Farooqi et al., 2007]). La acești indivizi, terapia de substituție cu leptină atenuează activitatea insulară și striatală îmbunătățită și scăderea calității raportate de alimente [Baicy et al., 2007] și [Farooqi și colab., 2007]). Tratamentul cu leptină blochează, de asemenea, proprietățile satisfacatoare ale sucrozei la șobolanii cu restricție la alimentație similar cu antagonistul receptorului de dopamină α-flupentixol (Figlewicz și colab., 2001). Mai mult, receptorii de leptină sunt exprimați pe neuronii dopaminei midbrain în VTA și SN (Figlewicz și colab., 2003), sugerând că leptina poate influența aspectele hedonice ale comportamentului alimentar prin modularea transmisiei mesostriatale a dopaminei. Confirmând această posibilitate, infuziile cu leptină în VTA au inhibat activitatea neuronilor dopaminergici și a scăzut aportul de alimente la șobolani (Hommel și colab., 2006, vezi de asemenea Krügel și colab., 2003). În schimb, scăderea receptorilor de leptină din VTA a dus la creșterea consumului de alimente, o activitate locomotorie îmbunătățită și o preferință crescută pentru alimentele gustoase la șobolani (Hommel și colab., 2006). Prin urmare, leptina exercită o influență inhibitoare asupra transmisiei mezoaccumbens de dopamină, un sistem neurotransmițător care a fost puternic implicat în recompensă și motivație, dar mai puțin în homeostazia energetică [de Araujo et al., 2010] și [Vucetic and Reyes, 2010]). Mai recent, s-a demonstrat că ghrelinul hormonal asociat foamei ([Kojima et al., 1999] și [Nakazato și colab., 2001]) potențează activarea sistemelor hedonice în creier ca răspuns la indicațiile alimentare (Malik și colab. , 2008). În mod specific, ghrelinul a îmbunătățit activarea OFC, amigdala, insula, striatum, VTA și SN ca răspuns la imaginile de hrană foarte gustoasă la indivizii obezi (Malik și colab., 2008). La șobolani, ghrelin exercită un efect stimulativ asupra sistemelor de dopamină midbrain ([Abizaid et al., 2006b], [Jerlhag și colab., 2006] și [Jerlhag et al., 2007]) și crește valoarea satisfacatoare a alimentelor gustoase și colab., 2010).
Figura 1. Zonele creierului uman activate ca răspuns la alimentele plăcute sau la indicii asociate alimentelor. Se consideră că cortexul orbitofrontal și amigdala codifică informații legate de valoarea recompensei alimentelor ([Baxter și Murray, 2002], [Holland și Gallagher, 2004], [Kringelbach și colab., 2003], [O'Doherty și colab. , 2002] și [Rolls, 2010]). Insula procesează informații legate de gustul alimentelor și de evaluarea hedonică a acestuia ([Balleine și Dickinson, 2000] și [Small, 2010]). Nucleul accumbens și striatul dorsal, care primesc aport dopaminergic din zona tegmentală ventrală și substantia nigra, reglează proprietățile motivaționale și de stimulare ale alimentelor ([Baicy și colab., 2007], [Berridge, 1996], [Berridge, 2009], [Farooqi și colab., 2007], [Malik și colab., 2008] și [Söderpalm și Berridge, 2000]). Hipotalamusul lateral poate regla răspunsurile satisfăcătoare la mâncarea plăcută și poate determina comportamente de căutare a alimentelor (Kelley și colab., 1996). Aceste structuri cerebrale acționează într-o manieră concertată pentru a regla învățarea despre proprietățile hedonice ale alimentelor, deplasând atenția și efortul către obținerea recompenselor alimentare și reglând valoarea stimulativă a stimulilor de mediu care prezic disponibilitatea recompenselor alimentare (Dagher, 2009). Din motive de claritate, nu sunt prezentate toate interconectările dintre aceste structuri.
Zonele creierului similare sunt activate de alimente gustoase în creierul șobolanului ca cele activate la om, măsurate prin exprimarea genelor timpurii imediate (IEG) cum ar fi c-fos, arc sau zif268. Într-adevăr, mâncarea gustativă activează striatumul dorsal și ventral, VTA, hipotalamus lateral (LH) și nucleele centrale și bazolaterale ale amigdalei și structurile coriacere legate de recompensă la șobolani ([Angeles-Castellanos și colab., 2007] Carr, 1998] și [Schiltz și colab., 2007]). Interesant, imunoreactivitatea Fos a fost de fapt scăzută în habenula laterală și medială la șobolani după consumul de hrană gustos (LHb) (Park și Carr, 1998). La primatele neumane, LHb este activat de stimulente aversive sau omisiune de recompense așteptate și inhibat de livrarea unei recompense de suc gustoase (Matsumoto și Hikosaka, 2007). În plus, activitatea LHb inhibă neuronii care conțin mesoaccumbeni cu dopamină legați de recompensă printr-o cale indirectă care implică nucleul tegmental patromatic (RMTg) (Jhou și colab., 2009). Activitatea hibenulară este, prin urmare, legată în mod invers de hedonicii alimentare, sugerând că complexul habenular poate influența consumul non-homeostatic. Într-adevăr, activarea LHb a demonstrat recent scăderea consumului de sucroză la șobolani, în timp ce leziunile LHb cresc comportamentul de căutare a zaharozei (Friedman și colab., 2011). Considerând că complexul habenular este mic și provocator pentru identificarea și imaginea funcțională la om (Salas et al., 2010), acest lucru poate explica de ce alterarea activității habenulare nu a fost raportată în studiile imagistice umane ca răspuns la alimentele gustoase.
Circuitele cerebrale care reglează consumul hedonic: sisteme de dopamină de miez
Calea dopaminei mezoaccumbene este activată la oameni și la animale de laborator ca răspuns la hrana gustativă sau la apariția apetitului, legată de alimente și la leptină, grelină și alți regulatori ai activității apetitului în acest sistem. Acest lucru sugerează că sistemele de dopamină din creierul mijlociu joacă un rol important în consumul de alimente plăcute. Poate că cel mai clar indiciu că transmiterea dopaminei midbrain influențează consumul de alimente plăcute la om este faptul că pacienții cu boala Parkinson (PD), în care există degenerare de neuroni care conțin dopamină în midbrain, tind să consume mai puține alimente decât indivizii neafectați (Nirenberg și Waters, 2006). Mai mult, tratamentul pacienților cu PD cu agoniști ai receptorilor de dopamină poate declanșa consumul compulsiv de alimente gustoase ([Dagher și Robbins, 2009] și [Nirenberg și Waters, 2006]). De fapt, agoniștii receptorilor de dopamină pot induce supraalimentarea hedonică chiar și la indivizii non-PD (Cornelius și colab., 2010). La animale, soluțiile gustabile de zaharoză stimulează transmisia dopaminei în NAc (Hernandez și Hoebel, 1988), efect în concordanță cu studiile de imagistică a creierului uman (Small și colab., 2003). Folosind voltametria ciclică cu scanare rapidă, s-a arătat că indicii care prezic livrarea unei recompense de zaharoză sau livrarea neașteptată de zaharoză au evocat transmiterea dopaminei în NAc ([Roitman și colab., 2004] și [Roitman și colab., 2008]). Mai mult, livrarea neașteptată a soluțiilor nocive de chinină a avut efectul opus, scăzând transmisia de dopamină accumbală (Roitman și colab., 2008). În cele din urmă, șoarecii în care enzima tirozin hidroxilază (TH) a fost inactivată, determinându-i să fie deficienți în dopamină, demonstrează încă o preferință marcată pentru soluțiile de zaharoză (sau zaharină) în comparație cu apa, dar consumă cantități totale mai mici de zaharoză decât șoarecii martor ( Cannon și Palmiter, 2003). Acest lucru sugerează că șoarecii cu deficit de dopamină pot detecta în continuare gustul la zaharoză și preferă aceste soluții decât apa, dar nu sunt capabili să susțină consumul de soluții gustabile. Prin urmare, s-a propus că transmiterea dopaminei mezoaccumbene reglează aspectele motivaționale ale comportamentului hrănitorului care sunt implicate în achiziția de alimente și că alte sisteme de neurotransmițători reglează probabil aspectele hedonice ale consumului de alimente plăcute.
Circuitele cerebrale care reglează consumul hedonic: sistemele de striatohypothalamic
Infuzia de agoniști ai receptorilor de opioizi, cum ar fi [D-Ala2-N-Me-Phe4-gli-ol5] -enkefalina (DAMGO) în NAc stimulează comportamentul de hrănire la șobolani cu acces adițional la hrană (adică hrănire non-homeostatică) [Peciña și Berridge, 2005] și [Zhang și colab., 1998]). În schimb, antagoniștii receptorilor opioizi infuzați în NAc reduc consumul de alimente preferate fără a afecta aportul de alternative mai puțin gustoase (Kelley și colab., 1996). Aceste date sunt conforme cu opinia conform căreia sistemele striate opioide reglează proprietățile hedonice ale alimentelor gustoase. Regiunea de coajă a NAc și, în special, "puncte fierbinți" hedonice din regiunea rostrodorsală a cochiliei medii (Peciña și Berridge, 2005) și [Peciña et al., 2006b] joacă un rol deosebit de important în alimentația neomostatică. Deoarece activarea receptorului opioidic cu m-a determinat inhibarea activității neuronilor spinoși medii în NAc, s-a propus că coaja NAc exercită o influență inhibitoare tonică asupra consumului de alimente gustoase (Kelley și colab., 2005). În concordanță cu această viziune, stimularea receptorilor inhibitori GABAA sau GABAB ([Basso și Kelley, 1999] și [Stratford and Kelley, 1997]) sau blocarea receptorilor de glutamat ionotropic excitatori (Maldonado-Irizarry și colab., 1995) crește consumul de alimente. În mod similar, leziunea excitotoxică a carcasei NAc crește, de asemenea, consumul de alimente și mărește sensibilitatea la recompensarea alimentară ([Johnson și colab., 1996] și [Maldonado-Irizarry și Kelley, 1995]). În special, consumul de alimente gustoase din punct de vedere energetic este declanșat în mod preferențial de aceste manipulări ([Basso și Kelley, 1999], [Kelley și colab., 2005] și [Zhang et al., 1998]).
Având în vedere influența majoră a semnalizării acumbalate asupra hranei hedonice, Thompson și Swanson (2010) au folosit o procedură de urmărire a circuitelor pentru a identifica cu precizie rețelele anatomice precise prin care NAc poate influența consumul alimentar gustos. În aceste studii elegante, șobolanii au primit două injecții non-perturbatoare de markeri anterograd / retrograd (denumiți monede) în zone ale cochiliei NAc care influențează puternic consumul alimentar gustos și au fost identificate conexiunile aferente / eferente. Sa demonstrat că situsurile legate de hrănire din NAc extind proiecțiile inhibitoare predominant la LH anterioară și ventral pallidum (VP) (Thompson și Swanson, 2010). Spre deosebire de restul de NAc, care proiectează în mod dens la VTA, puncte fierbinți hedonice legate de alimente în proiectul shell NAc până la nucleul interfascicular (IFN), o structură localizată adiacentă VTA care extinde proiecțiile dopaminergice într-o manieră reciprocă înapoi la Carcasa NAc (Thompson și Swanson, 2010). Mai mult, proiectele LH anterioare ale LHb (Thompson și Swanson, 2010), sugerând din nou că complexul habenular poate juca un rol în hedonica alimentară (Friedman și colab., 2011).
Datele de mai sus arată că LH primește o intrare inhibitorie proeminentă din siturile din NAc care exercită o influență inhibitoare tonică asupra consumului alimentar gustos. LH are, de asemenea, conectivitate funcțională cu alte situsuri cerebrale corticale și limbice implicate în organizarea și dirijarea comportamentului spre obținerea alimentelor gustoase (Figura 1), cum ar fi OFC, insula și amigdala. Foarte important, inactivarea LH elimină efectele stimulative ale manipulărilor NAc asupra consumului de alimente ([Maldonado-Irizarry și colab., 1995] și [Will și colab., 2003]). Mai mult, inactivarea carcasei NAc sporește activitatea neuronilor LH, în special LH, care sintetizează ipocretinul neuropeptidic (cunoscut și ca orexin), măsurat prin imunoreactivitatea Fos ([Baldo și colab., 2004] și [Stratford and Kelley, 1999 ]). Într-adevăr, perfuzarea agonistului receptorului de opioid DAMGO în coaja NAc activează neuronii care conțin hipocretin în hipotalamus (Zheng și colab., 2007), și întreruperea transmiterii hipocretinului în VTA elimină admisia gustativă a alimentelor declanșată de perfuzii intra-NAc DAMGO (Zheng și colab., 2007). Astfel, punctele fierbinți hedonice din coaja NAc exercită o influență inhibitoare tonică asupra neuronilor LH și în special a neuronilor care conțin hipocretin (Louis et al., 2010), limitând astfel consumul de alimente gustoase. Întreruperea acestui "semnal de oprire" acumbalat, prin semnalizarea sporită a receptorilor opioizi, de exemplu, are ca rezultat o activitate îmbunătățită a LH care conduce la consumul non-homeostatic de alimente gustoase (Figura 2).
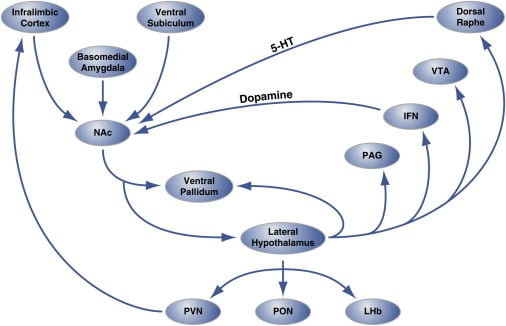
Figura 2. Organizarea la nivel de organizație a "punctelor fierbinți" din Nucleus Accumbens Shell care reglează consumul hedonic
Regiunea de coajă a nucleului accumbens (NAc) primește inervație din locurile creierului cortic și limbic și proiectează hipotalamusul lateral și pallidumul ventral. La rândul său, hipotalamusul lateral se prefigurează de asemenea la pallidum ventral și, de asemenea, nucleul PAG, IFN, VTA și dorsal raphe. IFN și rasa dorsală extind proiecțiile dopaminergice și serotoninergice, respectiv, înapoi la NAc. Hipotalamusul lateral generează, de asemenea, structuri talamice (PVN și PON) și epitalamic (LHb). Nu sunt prezentate proiecțiile minore de la hipotalamusul lateral până la zonele creierului septal. 5-HT, serotonină; IFN, nucleul interfascicular; LHb, habenula laterală; PON, nucleul preoptic; PVN, nucleul paraventricular al talamusului; VTA, zona tegmentală ventrală. Figura este adaptată cu permisiunea lui Thompson și Swanson (2010).
Circuitele cerebrale care reglează consumul hedonic: Sisteme striatopalidice
În plus față de LH, neuronii NAc coajă, de asemenea, proiect pentru VP (Figura 2). Într-o serie de experimente interesante, sa arătat că proiecțiile acumulate la VP și LH pot reglementa aspectele disociabile ale consumului non-omeostatic (Smith și Berridge, 2007). Infuzările DAMGO în carcasa NAc sau VP au crescut reacțiile orofacial la soluțiile de zaharoză, ipoteza că ar reflecta reacțiile de "plăcere" la șobolani (adică răspunsul la palatabilitate) și, de asemenea, creșterea consumului de alimente (Smith și Berridge, 2007). Infuzările de naloxonă fie în NAc, fie în VP au diminuat reacțiile de preferință facială la zaharoză, sugerând că transmisia sincronizată de opiacee în NAc și VP este necesară pentru a procesa gustul alimentelor legate de informație. Cu toate acestea, naloxona infuzată în NAc, dar nu VP, a scăzut consumul non-omeostatic (Smith și Berridge, 2007), sugerând că consumul non-homeostatic apare independent de această conectivitate NAc → VP și se bazează probabil pe calea NAc → LH Berridge, 2007] și [Taha și colab., 2009]). În concordanță cu ideea că aspectele legate de alimentația neomostatică pot fi disociate, înregistrările cu o singură unitate au arătat că o populație de neuroni NAc pare să codifice selectiv informații referitoare la proprietățile armate relative ale alimentelor (adică palatabilitatea) (Taha și Fields, 2005) . În aceleași șobolani, modificările activității oa doua populație de neuroni NAc păreau să coincidă cu inițierea comportamentului alimentar (Taha și Fields, 2005).
Circuitele cerebrale care reglează consumul hedonic: sistemele Amygdalar
Susținând în continuare ideea că aspectele consumului non-omeostatic sunt disociabile, infuziile naloxonei în coaja sau VP ale NAc, dar nu amigdala bazolaterală (BLA), au scăzut gustul soluțiilor de zaharoză (Wassum și colab., 2009). Cu toate acestea, atunci când antagoniștii receptorului opioidului m-naloxonă sau CTOP au fost perfuzați în carcasa BLA, dar nu în NAc sau în VP, a existat o atenuare marcată a motivației crescute de a răspunde la soluțiile de zaharoză observate în mod obișnuit într-o stare înfomată (Wassum și colab. ., 2011] și [Wassum și colab., 2009]). Acest lucru sugerează că proprietățile stimulative ale sucrozei sunt reglementate de circuitele amigdale. În ansamblu, concluziile de mai sus arată că diferite aspecte ale consumului hedonic, cum ar fi prelucrarea informațiilor legate de gustul alimentației, abordarea comportamentelor și creșterea valorii stimulative a alimentelor gustoase la animalele foame, sunt diferențiate prin microcircuituri discrete în contextul unei mai mare circuit corticolimbic-striatopallidal-hipotalamic-thalamocortic (Figura 2).
Adaptarea în circuitele hedonice ale creierului conduce la alimentația compulsivă?
Relevanța funcțională a hotspoturilor hedonice în coaja NAc și influența acestora asupra circuitelor legate de hrănire în creier au fost luate în considerare de către Kelley și colab. (2005). Ei presupun că calea NAH a coajă-LH, împreună cu regiunile creierului în amonte și în aval (Figura 2), servesc unui scop "sentinel" (Kelley și colab., 2005). În mod specific, ei propun ca, chiar și în cazul animalelor înfometați, atunci când unitatea de mâncare este puternică, abilitatea de a înceta comportamentul hrănirii trebuie reținută în cazul amenințărilor din mediul înconjurător (Kelley et al., 2005). Ca atare, activarea neuronilor de coajă NAc și inhibarea concomitentă a neuronilor LH pot perturba hrănirea continuă și facilitează comutarea comportamentului la răspunsuri adaptive mai adecvate, cum ar fi înghețarea sau scăparea (Kelley și colab., 2005). Dacă acest lucru este într-adevăr cazul, atunci va fi important să se investigheze dacă această cale NAc a coajă → LH este compromisă prin consumul excesiv de alimente gustoase sau prin factori genetici care influențează vulnerabilitatea la obezitate. În acest sens, laboratorul nostru și alții au raportat recent că consumul excesiv de alimente calde dense este asociat cu apariția comportamentului alimentar compulsiv la șobolani ([Johnson și Kenny, 2010], [Latagliata et al., 2010] și [Oswald și colab., 2010]). În mod specific, am constatat că consumul de alimente gustos la șobolanii obezi a fost rezistent la perturbări printr-un stimulent condiționabil aversiv care a prezis rezultatul negativ (piciorul electric) (Johnson și Kenny, 2010). Astfel, va fi important să se testeze dacă deficiențele din calea de control a coajă- lui NAc → LH declanșată de supraalimentare contribuie cel puțin parțial la eșecul evident al indivizilor supraponderali și obezi de a utiliza informații cu privire la consecințele dăunătoare ale comportamentului lor consumator pentru a-și atenua aportul alimentar .
Modificată activitatea de recompensare a creierului în obezitate: Studii imagistice ale creierului uman
Obținerea efectelor stimulative ale alimentelor gustoase asupra sistemelor de recompensare a creierului este considerat un factor important de motivație care contribuie la supraalimentarea. Astfel, o întrebare importantă este dacă modificările funcției de recompensare a creierului pot contribui la dezvoltarea obezității. O predicție intuitivă este că reacția îmbunătățită constitutivă a sistemelor de recompensare a creierului la alimente gustoase ar duce la supraalimentarea și creșterea în greutate. În concordanță cu această ipoteză, indivizii cu niveluri ridicate de sensibilitate la răsplata trasaturilor afișează o activitate intensă în regiunile creierului implicate în recompensarea alimentară, incluzând NAc, amigdala, OFC și VP, expuse la alimente gustoase precum prăjitura de ciocolată și pizza (Beaver et al. , 2006). Persoanele obeze manifestă în mod similar o creștere a activării circuitelor de recompensare a creierului ca răspuns la alimentele palpabile sau la indicii alimentari în comparație cu controalele slabe (Gautier și colab., 2000], [Karhunen și colab., 1997] și [Rothemund și colab., 2007 ]). Nivelurile ridicate ale sensibilității la recompense au fost, de asemenea, corelate cu creșterea greutății corporale la subiecții umani [Davis et al., 2004] și [Franken și Muris, 2005]). Este important, totuși, că femeia obeză (IMC> 30) a avut niveluri mai ridicate de anedonie (adică, sensibilitatea de bază redusă la recompensă) decât femeile supraponderale (IMC> 25 <30) (Davis și colab., 2004). In mod similar, Stice si colegii (2008b) au aratat ca fetele adolescente obezi au crescut activarea insulei si a altor regiuni ale creierului cortical ca raspuns la alimentele palpabile sau indiciile legate de alimente in comparatie cu subiectii de control slabit, dar ca activarea zonei caudate a striatum ca raspuns la alimentele gustoase a fost invers corelat cu IMC la subiectii obezi. Mai mult decât atât, femeile care au câștigat greutate pe o perioadă de timp de 6 au înregistrat o scădere semnificativă a activității striatale ca răspuns la alimentele gustoase în această perioadă, comparativ cu femeile care nu au câștigat în greutate (Stice et al., 2010a). Luând toate acestea împreună, se pare că hipersensibilitatea circuitelor de recompensă poate predispune un individ la supraalimentare și creștere în greutate (Stice et al., 2010b). Cu toate acestea, pe măsură ce creșterea în greutate crește, atunci pot să apară deficite în activitatea componentelor specifice ale sistemului de recompensare a creierului, în special a striatumului. Sa sugerat că apariția acestei stări de hiposensibilitate a recompenselor poate perpetua consumul excesiv de alimente gustoase pentru a depăși astfel de deficite de recompensă ([Stice et al., 2008a] și [Wang et al., 2002]). Prin urmare, recompensa prea mică sau prea mare de alimente pare să crească vulnerabilitatea la supraalimentare și obezitate (Stoeckel, 2010). Un cadru conceptual atrăgător pentru reconcilierea acestor puncte de vedere aparent contradictorii este acela că zonele corticolimbice implicate în organizarea comportamentului spre obținerea recompenselor alimentare și la realizarea predicțiilor despre recompensarea anticipată a alimentelor viitoare ar putea deveni hiperactive la persoanele supraponderale și la cele predispuse la obezitate. În schimb, site-urile creierului striat care procesează experiența reală a plăcerii de la consumul hedonic pot deveni treptat mai puțin funcționale în aceleași persoane. Valoarea relativă a motivației alimentelor gustoase ar trebui, prin urmare, să crească în timpul dezvoltării obezității, în același timp cu scăderea valorii hedonice obținute din consumul de alimente gustoase.
Modificată activitatea de recompensare a creierului în obezitate: Studiile cu privire la rozătoare
Efectele consumului gustativ de hrană asupra sistemelor de recompensare a creierului au fost evaluate direct la animalele de laborator utilizând procedura de recompensare a stimulării creierului (BSR). Este bine cunoscut faptul că stimularea electrică a LH, care primește o intrare inhibitorie tonică din petele fierbinți hedonice (Figura 2), este extrem de satisfăcătoare și șobolanii vor lucra din greu pentru a auto-stimula această regiune a creierului, de exemplu (Markou și Frank, 1987 ). Pe lângă susținerea comportamentului de auto-stimulare, stimularea electrică a LH poate provoca, de asemenea, tulburări intense de comportament alimentar (Margules and Olds, 1962) și sa propus ca proprietățile pline de stimulare a LH să poată fi legate de rolul intrinsec al acestei site-ul creierului în proprietățile apetitoare și stimulative ale alimentelor (Margules and Olds, 1962). În concordanță cu această viziune, pierderea foamei și a scăderii în greutate mărește sensibilitatea șobolanilor la auto-stimularea LH cu valoare de recompensă ([Blundell și Herberg, 1968], [Carr și Simon, 1984] și [Margules and Olds, 1962] care pot fi blocate prin perfuzie intracerebroventriculară de leptină (Fulton și colab., 2000). Dimpotrivă, auto-stimularea electrică a LH este inhibată la animalele cu sânge (Wilkinson și Peele, 1962). Într-adevăr, suprapunerea cu șobolani prin tubul de alimentare intragastric (Hoebel și Teitelbaum, 1962), distensia gastrică sau perfuzia intravenoasă cu glucagon care imită saturația postprandială [Hoebel, 1969], [Hoebel și Balagura, 1967] și [Mount and Hoebel, 1967] ), toate atenuând răspunsul pentru stimularea LH. De fapt, șobolanii care au răspuns mai devreme pentru a recompensa stimularea LH vor răspunde ca și cum această stimulare ar fi aversivă după consumul de alimente sau dezvoltarea obezității (Hoebel și Thompson, 1969). Prin urmare, restrângerea cronică a alimentelor și pierderea în greutate intensifică, în timp ce suprasolicitarea diminuează, sensibilitatea site-urilor legate de recompensă în LH. Sensibilitatea neuronilor LH la auto-stimularea electrică recompensă poate oferi, prin urmare, informații importante asupra funcționării circuitelor creierului care reglează răspunsurile hedonice la alimente.
Având în vedere că ușurința accesului la alimentele gustoase din punct de vedere energetic și consumul excesiv al acestora este considerată un factor major de mediu care contribuie la obezitate (Volkow și Wise, 2005), laboratorul nostru a folosit recent procedura BSR pentru evaluarea activității de recompensare a creierului la șobolani, cu acces extins la alimente gustoase . În mod specific, am înregistrat reacția pentru stimularea electrică a LH la șobolani care au avut acces ad-hoc la alimentația nutritivă singură sau la hrană în combinație cu accesul 18-23 hr zilnic la o dietă gustoasă. Această dietă consta din cheesecake, bacon, cârnați și alte produse alimentare apetisante (Johnson și Kenny, 2010). Am descoperit că șobolanii cu acces extins la alimentele gustoase au câștigat rapid cantități semnificative de greutate și au demonstrat un deficit de recompensă a creierului care se înrăutățește treptat (reflectat ca reacție diminuată la stimularea stimulării LH) (Johnson și Kenny, 2010, Figura 3). Acest lucru sugerează că dezvoltarea obezității induse de dietă este asociată cu o scădere treptată a reactivității locurilor de recompensă în LH (Johnson și Kenny, 2010). De asemenea, au fost raportate deficiențe în semnalizarea recompensării la șobolanii adulți care anterior aveau acces nelimitat la zaharoză sau alimente bogate în grăsimi în timpul adolescenței ([Teegarden et al., 2009], [Vendruscolo și colab., 2010a] și [Vendruscolo și colab. 2010b]). Aceste efecte la șobolani amintesc de scăderea activării striatale ca răspuns la recompensarea alimentară descrisă mai sus la subiecții umani, deoarece au câștigat greutate pe o perioadă de luni 6 (Stice și colab., 2010a, a se vedea Figura 4). Astfel de deficite de recompensă induse de dietă la șobolanii supraponderali și, probabil, la oameni, care cresc în greutate, reflectă probabil un răspuns contradictoriu în circuitele de recompensă alimentară pentru a se opune suprapresării lor de alimente gustoase (Johnson și Kenny, 2010). Un aspect important al acestei descoperiri constă în detectarea unor deficite similare în funcția de recompensă la șobolani care consumă excesiv cocaină sau heroină [Ahmed et al., 2002], [Kenny și colab., 2006] și [Markou și Koob, 1991]; Figura 3). De fapt, sa presupus că disfuncția de recompensă indusă de droguri poate contribui la trecerea de la consumul de droguri controlat la necontrolat prin furnizarea unei noi surse de motivație pentru consumarea medicamentului pentru a atenua starea persistentă a diminuării recompenselor (Ahmed și Koob , 2005] și [Koob și Le Moal, 2008]). Prin urmare, este posibil ca deficitele în sensibilitatea locurilor de recompensare din LH induse de supraalimentare să crească persistența pe termen lung a consumului de alimente gustoase la șobolanii supraponderali prin schimbarea preferinței dietetice față de produsele alimentare cu un impact hedonic mai mare pentru a atenua starea persistentă a negativului recompensă.
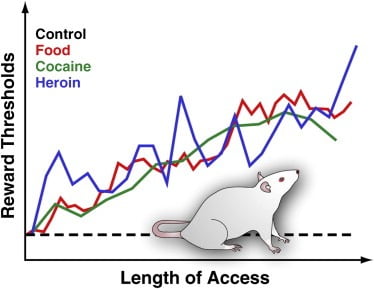
Figura 3. Rata de recompensă la șobolani cu acces zilnic extins la alimente palpabile, cocaină sau heroină
Pentru a măsura pragurile de recompensare, un electrod stimulant este implantat chirurgical în hipotalamusul lateral al șobolanilor, o regiune în care stimularea electrică este puternic recompensă și poate declanșa o criză intensă a comportamentului de hrănire. După recuperare, animalelor le este permis să se autodioteze această regiune prin rotirea unei roți. După stabilirea unui comportament stabil de auto-stimulare, se determină intensitatea minimă de stimulare care a menținut comportamentul de auto-stimulare (adică pragul de recompensă). Acest prag de recompensă oferă o măsură operațională a activității sistemului de recompense. Ratele de recompensare rămân stabile și neschimbate la șobolanii de control care au acces la chiuvetele de laborator standard și care rămân naivi la medicament. Cu toate acestea, pragurile cresc treptat la șobolani cu acces zilnic extins la o dietă gustoasă de energie, care constă în produse alimentare gustoase (de exemplu, cheesecake, bacon, ciocolată etc.). În mod similar, pragurile de recompensă au crescut progresiv la șobolani care au extins accesul zilnic la perfuzii intravenoase de cocaină sau heroină. Rata de recompense ridicată este interpretată astfel încât să reflecte sensibilitatea scăzută a sistemului de recompensare a creierului. Aceste efecte sugerează că consumul excesiv de alimente gustoase și creșterea asociată în greutate pot determina deficite profunde în recompensa creierului similare cu cele induse de consumul excesiv de droguri dependente
Figura 4. Striatal Plasticity in ObesityWeight Câștigul este asociat cu scăderea activării striatale ca răspuns la alimentele gustoase, măsurate prin fMRI, și niveluri mai scăzute ale disponibilității dopaminei dopaminei D2 (D2R) la om (vezi textul pentru detalii).
Deficitul dopaminei D2 Signaling Signaling în obezitate
Câteva rapoarte recente au dezvăluit mecanisme potențiale prin care pot apărea deficite de recompense ca răspuns la consumul excesiv de alimente gustoase în timpul dezvoltării obezității. După cum sa menționat mai sus, femeile care au câștigat greutate pe o perioadă de timp de 6 au înregistrat o scădere semnificativă a activității striate ca răspuns la alimentele gustoase în această perioadă, comparativ cu femeile care nu au câștigat în greutate (Stice et al., 2010a, Figura 4). Persoanele fizice cărora le-a fost permis să-și mănânce mesa preferată la saturație aveau niveluri mai scăzute de legare a raclopridei antagoniste D2 receptorului (D2R) în striatum (Small și colab., 2003), sugerând că semnalul D2R scade ca răspuns la consumul de alimente gustos. Într-adevăr, indivizii obezi au nivele mai scăzute de disponibilitate striatală D2R comparativ cu controalele slabe ([Barnard și colab., 2009], [Stice și colab., 2008a] și [Wang și colab., 2001] la pacienții obezi este asociat cu creșterea densității striate D4R (Wang și colab., 2). Având în vedere că transmisia striatală a dopaminei joacă un rol-cheie în reglarea consumului hedonic, scăderile adaptive ale semnalizării D2R pot contribui la reducerea receptivității striatului la alimentele gustoase la persoanele obeze. Pentru a testa această posibilitate, colegii mici și colegii au examinat activitatea în circuitele de recompensare a creierului ca răspuns la un milkshake gustos la indivizii de control și cei care poartă alela TaqIA A1 (Felsted și colab., 2010). Polimorfismul lungimii fragmentului de restricție TaqIA este în aval de gena D2R (Neville et al., 2004), iar indivizii care poartă alela A1 a polimorfismului au între 30% -40% mai puțini D2R striatali comparativ cu cei care nu poartă alela (Jönsson et al., 1999], [Ritchie și Noble, 2003] și [Stice și colab., 2010b]). În plus, purtătorii alelelor A1 au, de asemenea, un metabolism redus al glucozei în zonele creierului striat și cortic, implicate în răspunsurile hedonice la alimente (Jönsson și colab., 1999). Persoanele care adăpostesc alela TaqIA A1 sunt suprareprezentate în populațiile obeze ([Barnard și colab., 2009], [Stice și colab., 2008a] și [Wang și colab., 2001]). În plus, alela A1 crește și vulnerabilitatea față de dependența de alcool, opioid și stimulant psihomotor ([Lawford et al., 2000], [Noble et al., 1993] și [Noble et al., 2000]). S-a constatat că zonele de miez medie, care includ VTA și SN, care asigură intrarea dopaminergică în striat, au fost activate ca răspuns la un milkshake gustos la indivizi de control (Felsted și colab., 2010). În schimb, activitatea în aceste locuri de creier a fost de fapt scăzută ca răspuns la recompensa alimentară în purtătorii alelelor A1 (Felsted și colab., 2010). Au fost detectate răspunsuri inverse similare în activarea creierului între purtătorii alelici A1 și noncarrierii în situsurile creierului talamic și cortic (Felsted și colab., 2010). Aceste date sunt în concordanță cu rolul cheie al D2R în reglementarea receptivității mesostriatale la alimentele gustoase. Stice si colegii sai (2008a) au descoperit o corelatie inversa intre IMC si activarea striatumului (caudate si putamen) ca raspuns la gustul gustos de ciocolata gustos la pacientii umani. Mai mult, această relație inversă a fost cea mai evidentă la persoanele care poartă alela TaqIA A1 (Stice și colab., 2008a). Creșterea ulterioară în greutate la acești indivizi, măsurată 1 an după imagistica inițială a creierului, a arătat că mărimea activării striatale ca răspuns la alimentele gustoase a fost corelată negativ cu creșterea în greutate la subiecții cu alela A1 și corelată pozitiv în subiecții alelelor non-A1 Stice și colab., 2008a). Într-un studiu de urmărire, sa raportat că mărimea activării striatale ca răspuns la consumul imaginar de alimente gustoase, spre deosebire de consumul real, a fost invers proporțional cu creșterea în greutate în anul următor la subiecții cu alela A1, dar pozitiv corelată cu subiecții de alele non-A1 (Stice și colab., 2010b). Aceste descoperiri sugereaza ca D2Rs reglementeaza reactia striatala la alimentele gustoase si ca diminuarea semnalizarii D2R indusa de cresterea in greutate sau de factorii genetici poate creste vulnerabilitatea la obezitate.
Deficitul semnalului D2R contribuie la rata deficitului de obezitate
Similar cu nivelurile scăzute de D2R striatale la subiecții umani obezi, nivelurile D2R sunt de asemenea reduse la șoareci și șobolanii hrăniți cu o dietă gustoasă (de exemplu, [Colantuoni și colab., 2001], [Geiger et al., 2009] și [Johnson and Kenny , 2010]) și la șobolani predispuși genetic la obezitate (șobolani Zucker) (Thanos și colab., 2008). Laboratorul nostru a investigat în mod direct rolul de transmitere a dopaminei striate întrerupt, în general, și scade în semnalizarea D2R în special în deficitele de recompensă asemănătoare dependenței care apar la șobolani în timpul dezvoltării obezității (vezi Figura 5). Mai exact, am testat efectele reducerii expresiei D2Rs striatale la șobolani folosind interferența ARN mediată viral, apoi evaluarea pragurilor BSR când șobolanii au avut acces doar la hrană sau la hrană în combinație cu accesul zilnic 18-23 hr la o gustare de înaltă energie dieta (de exemplu, o dieta cu cafenea) (Johnson și Kenny, 2010). Am descoperit ca raspunsul pentru stimularea LH recompensa a inceput sa scada aproape imediat dupa expunerea la dieta cu cafeteria la sobolanii Knockdown D2R (Johnson si Kenny, 2010, Figura 5). Scăderea nivelului striatal al D2R accelerează rapid apariția hipofuncționalității recompensării la șobolani cu acces extins la alimente extrem de gustoase, proces care de obicei durează multe săptămâni pentru a apărea la șobolanii de control cu acces extins la o dietă gustoasă. Cu toate acestea, scăderea D2Rs striatale la șobolanii cu acces la hrană nu a modificat răspunsul pentru stimularea stimulației LH, sugerând că semnalarea diminuată a D2R striatal interacționează cu alte răspunsuri adaptive induse de dietă în circuitele de recompensare a creierului pentru a declanșa hiposensibilitatea recompensării. În plus față de nivelurile reduse de D2R, alte aspecte ale transmisiei dopaminergice striate sunt de asemenea modificate în creierul șobolanilor obezi. De exemplu, șobolanii Sprague-Dawley au crescut selectivitatea pentru a câștiga rapid o greutate pe o dietă cu consum mare de energie (șobolani cu obezitate predispusă) au niveluri bazale și evocate la NAc decât șobolani rezistenți la creșterea în greutate (șobolani rezistenți la obezitate) al., 2008, vezi, de asemenea, Rada și alții, 2010). De asemenea, șobolanii cu obezitate predispuși la scăderea nivelului de biosinteză a dopaminei și a mecanismelor de stocare, sugerând că un eșec în producerea și eliberarea dopaminei contribuie la deficiențe în transmisia dopaminei striate la șobolanii obezi (Geiger et al., 2008). Șobolanii care au dezvoltat obezitatea prin consumul unei diete gustoase cu consum mare de energie au avut, de asemenea, niveluri mai scăzute ale bazei și evocat dopamină în NAc comparativ cu șobolanii care au avut acces numai la chow standard ([Davis et al., 2008] și [Geiger et al. 2009]). Foarte important, o masă de hrană standard a fost suficientă pentru a crește nivelele de dopamină în NAc ale șobolanilor de control, în timp ce numai produsele alimentare foarte gustoase au fost suficiente pentru a declanșa eliberarea de dopamină acumulată la șobolanii obezi care aveau un istoric de acces extins la alimentele gustoase (Geiger și colab., 2009). Aceste constatări demonstrează că dezvoltarea obezității la șobolani este asociată cu disfuncții în transmisia de dopamină mesostriatală, cel mai vizibil la D2Rs striatal și că semnalarea deficitară D2R contribuie la apariția unor deficite de recompensă în timpul dezvoltării obezității la șobolani. Acest lucru este în concordanță cu faptul că reducerea reglajului D2Rs striatal este un răspuns neuroadaptiv notabil la creșterea în greutate la om ([Barnard și colab., 2009], [Stice și colab., 2008a] și [Wang și colab., 2001] și că semnalarea striatală deficitară D2R poate bloca răspunsurile striatale la alimentele hedonice la subiecții umani, predispunând astfel la creșterea individuală a greutății viitoare [Stice și colab., 2008a] și [Wang și colab., 2001]).
Figura 5. Receptorii de dopamină D2, disfuncția recompenselor și compulsivitatea la obezitate - Knockdown-ul receptorilor de dopamină D2 (D2R) în striatul șobolanului accelerează apariția disfuncției de recompensă și a consumului compulsiv la șobolani cu acces extins la alimente gustoase.
Deficitul semnalizării D2R poate declanșa consumarea compulsivă în obezitate
Obezitatea se caracterizează prin supraîncălzirea care persistă în ciuda dorinței exprimate de a limita consumul și cunoașterea consecințelor negative profunde ale sănătății și sociale ale consumului continuu excesiv ([Booth și colab., 2008], [Delin et al., 1997] și [Puhl et al., 2008]). Acest lucru este exemplificat de faptul că mulți pacienți obezi vor suferi o operație bariatrică potențial periculoasă (bypass gastric) pentru a-și controla greutatea (Yurcisin et al., 2009), dar adesea recidivează supraestimarea, chiar dacă operația scade evaluările subiective ale foamei și reduce capacitatea de a consuma cantități mari de alimente ([Kalarchian et al., 2002] și [Saunders, 2001]). Dependența de droguri este în mod similar definită ca o pierdere a controlului inhibitor asupra consumului de droguri și a persistenței în obișnuință, în ciuda conștientizării consecințelor potențial devastatoare asupra sănătății, sociale sau financiare (DSM-IV, American Psychiatric Association, 1994). Ca atare, obezitatea și dependența de droguri împărtășesc semnele distinctive ale tulburărilor compulsive prin faptul că există un eșec evidente în utilizarea informațiilor privind consecințele nocive viitoare asupra consumului moderat și a persistenței consumului, în ciuda disponibilității comportamentelor alternative mai puțin dăunătoare.
Comprimarea compulsivă a medicamentului a fost definită în mod operațional la rozătoare ca fiind un consum rezistent la suprimare prin pedeapsă sau stimuli de mediu care prevăd pedepsirea (Pelloux et al., 2007] și [Vanderschuren și Everitt, 2004]). Perioadele de acces extins la cocaină și alte medicamente de abuz pot conduce la apariția comportamentelor compulsive de asanare la șobolani ([Ahmed și Koob, 1998], [Deroche-Gamonet și alții, 2004] și [Vanderschuren și Everitt, 2004] ). Într-adevăr, șobolanii cu un istoric de consum extins de cocaină prezintă un aport care este rezistent la perturbări printr-un stimulent condițional aversiv (CS), care prezice rezultatul negativ (de exemplu, o lumină cue care prezice eliberarea unui footfoot aversiv) ([Belin et al., 2008] și [Vanderschuren și Everitt, 2004]). În schimb, același CS aversiv poate scădea profund reacțiile de căutare a medicamentului la șobolani cu acces relativ limitat la medicament. Având în vedere asemănările dintre consumul compulsiv de droguri în dependență și supraalimentarea în obezitate, am investigat recent dacă șobolanii obezi ar consuma alimente gustoase într-o manieră compulsivă și dacă D2Rs striatali joacă un rol în acest proces (Johnson și Kenny, 2010). Am constatat că șobolanii obezi cu o istorie a accesului extins la alimentele gustoase au continuat să mănânce mâncăruri gustoase chiar și în prezența unui CS nociv, care prezise livrarea unui picior aversiv (Johnson și Kenny, 2010). În schimb, același CS aversiv a perturbat consumul de alimente gustos la șobolani slabi, cu o expunere foarte limitată la alimente gustoase din punct de vedere energetic. Consumul de alimente palat poate deveni, prin urmare, compulsiv la șobolanii obezi în același mod în care consumul de cocaină poate deveni compulsiv. În concordanță cu această interpretare a datelor, șoarecii care anterior aveau acces la o dietă bogată în grăsimi au petrecut mai mult timp într-un mediu aversiv (luminat puternic) pentru a obține alimentele gustoase decât șoarecii care nu aveau experiență anterioară privind dieta (Teegarden și Bale , 2007). Din cauza fricii de dărâmare, arenele deschise luminate sunt foarte aversive pentru șoareci (Suarez și Gallup, 1981). Șoarecii devin astfel rezistenți la consecințele potențiale negative ale comportamentului lor de hrănire și vor risca dărâmarea pentru a obține alimente gustoase chiar și atunci când alimentele mai puțin gustoase sunt disponibile la un pericol mult mai mic.
Intr-adevar, alela A1 a polimorfismului TaqIA care are ca rezultat densitatea D2R striata (Noble, 2000) si activarea striatala bluntata ca raspuns la alimentele gustoase (Stice et al., 2008a) este, de asemenea, asociata cu deficite in invatare pentru a evita actiunile care au consecințe negative (Klein și colab., 2007). Exact acest tip de eșec utilizează informații legate de consecințele negative ulterioare ale supraalimentării, care pot contribui la dezvoltarea unei alimentații compulsive la persoanele obeze. Am constatat că apariția unei alimentații compulsive la șobolani cu acces la alimente gustoase a fost accelerată dramatic după knockdown striatal D2R (Johnson și Kenny, 2010). De fapt, șobolanii cu knockdown striatal D2R, care anterior aveau numai zile 14 de acces extins la alimente drăgălașe din punct de vedere energetic, au prezentat un consum de hrană gustos, care era rezistent la perturbări de un CS aversiv (Johnson și Kenny, 2010, Figura 5). Cu toate acestea, această perioadă de timp 14 de expunere limitată la alimentele gustoase nu a fost suficientă pentru a induce consumul de compulsivitate la șobolanii de control (Johnson și Kenny, 2010). Aceste descoperiri sugerează că aportul compulsiv de consum de alimente gustoase poate apărea la șobolanii obezi. În plus, semnalarea striatală deficitară D2R, care accelerează apariția hiposensibilității recompensării ca răspuns la consumul de alimente gustoase, accelerează, de asemenea, apariția consumului de tip compulsiv (Figura 5).
Interacțiunile dintre D2R și regulatorii hormonali ai echilibrului energetic în obezitate
Leptina exogenă administrată în VTA inhibă transmisia și comportamentul de alimentare cu dopamină în mesoaccumbeni (Hommel și colab., 2006] și [Krügel și colab., 2003]). În plus față de efectul său inhibitor acut asupra sistemelor de dopamină la miezul miezului, se acumulează dovezi că semnalarea tonică a leptinei poate fi, de asemenea, necesară pentru a menține nivelurile adecvate de semnalizare a dopaminei mesostriatale. Flier si colegii sai au descoperit ca soarecii ob / ob aveau nivele mai mici de hidroxilaza tirozinei in neuronii dopaminei midbrain, o enzima cheie in biosinteza dopaminei (Fulton si colab., 2006). În plus, șoarecii ob / ob au redus eliberarea dopaminei evocate în NAc (Fulton și colab., 2006) și au scăzut depozitele veziculare somatodendritice ale dopaminei în VTA și SN (Roseberry și colab., 2007). Aceste deficiențe în producția de dopamină și în mecanismele de transducție a semnalului la șoareci ob / ob au fost corectate prin tratamentul cu leptină ([Fulton și colab., 2006] și [Pfaffly și colab., 2010]). De fapt, leptina infuzată numai în LH a fost suficientă pentru a corecta transmisia disfuncțională a dopaminei la șoarecii ob / ob (Leinninger și colab., 2009), sugerând celulele care exprimă receptorul de leptină în actul LH pentru a menține nivelurile adecvate de semnalizare a dopaminei. În plus față de producția și eliberarea diminuată a dopaminei, șoarecii ob / ob au avut de asemenea tendința de a avea nivele mai mici de expresie D2R în striatum (Pfaffly și colab., 2010). Mai mult, tratamentul cu leptină exogenă în cadrul unui regim care are ca rezultat dezvoltarea insensibilității la semnalizarea leptinei (adică rezistența la leptină) a redus dramatic nivelurile D2R striatale la șoareci de tip sălbatic (Pfaffly și colab., 2010). Sobolanii obezi dezvoltă rezistență la leptină în VTA ([Matheny și colab., 2011] și [Scarpace și colab., 2010]) și au, de asemenea, niveluri mai scăzute de TH în VTA, scăderea eliberării de dopamină în striatum și reducerea nivelurilor striatale D2R și colab., 2008). Luate impreuna, aceste date demonstreaza ca leptina are actiuni complexe asupra sistemelor de dopamina midbrain. Pe de o parte, activarea acută a receptorilor de leptină în VTA exercită un efect inhibitor asupra transmisiei mezoacumbens de dopamină și poate inhiba comportamentul de hrănire [Hommel și colab., 2006] și [Krügel și colab., 2003]). Pe de altă parte, semnalizarea leptinei în miezul miezului este necesară pentru a menține producția adecvată de dopamină și transmiterea semnalului, iar deficitele genetice în semnalizarea leptinei sau dezvoltarea rezistenței la leptină în obezitate perturbă profund sistemele mezoaccumbens de dopamină. Ca atare, este o posibilitate interesantă că dezvoltarea rezistenței la leptină în neuronii dopaminergici ai midbrainului în timpul dezvoltării obezității poate juca un rol central în întreruperea semnalizării striatale D2R care pare să conducă la apariția disfuncției de recompensă asemănătoare dependenței și a suprapresiunii compulsive (Figura 5) la șobolani obezi.
În plus față de efectele complexe ale semnalizării leptinei asupra transmisiei dopaminergice mesostriatrale, există dovezi acumulate că D2Rs pot la rândul lor să regleze semnalizarea leptinei. Agonistul D2R bromocriptina reduce nivelul de circulație al leptinei ([Doknik și colab., 2002], [Kok și colab., 2006] și [Mastronardi și colab., 2001]), sugerând că D2Rs exercită o influență inhibitoare asupra nivelurilor de leptină. În plus, șoarecii cu mutație nulă în gena D2R au îmbunătățit semnalizarea leptinei în hipotalamus și sunt mai sensibili la efectele anorectice ale leptinei (Kim și colab., 2010). Este bine cunoscut faptul că nivelurile de leptină cresc în timpul dezvoltării obezității (hiperleptinemia), totuși există o scădere concomitentă a sensibilității la semnalizarea leptinei (adică rezistența la leptină) (Hamilton și colab., 1995). Astfel, este o posibilitate interesantă că scăderea semnalului striatal D2R în timpul dezvoltării obezității poate reprezenta un răspuns compensator la consumul excesiv de alimente gustoase și creșterea în greutate care crește nivelul leptinei circulante și crește eficiența de semnalizare pentru a depăși dezvoltarea rezistenței la leptină. O astfel de acțiune poate îmbunătăți efectele inhibitorii ale leptinei asupra sistemelor striatale care reglează capacitatea de reacție la alimentele gustoase (Farooqi și colab., 2007], [Fulton și colab., 2006] și [Hommel și colab., 2006] pentru a atenua răspunsurile hedonice la alimentele gustoase. Punând această constatare împreună cu rolul regulator al leptinei asupra D2Rs descrise mai sus, se pare că leptina și semnalizarea D2R pot fi cuplate într-o manieră reciprocă pentru a regla aspectele homeostatice și hedonice ale comportamentului alimentar.
Sistemele de stres creierului neregulat în obezitate
Leptina de semnalizare în miezul miezului acționează pentru a regla transmisia mezoacumbens dopamină și reacția la alimentele hedonice. Cu toate acestea, neuronii din VTA care exprimă receptorii de leptină se proiectează foarte rar la NAc și, în schimb, prezintă proiecții mai proeminente nucleului central al amigdalei (CeA) (Leshan și colab., 2010). În contextul comportamentului alimentar, se cunoaște că CeA reglementează efectele inhibitoare ale stimulilor nocivi asupra mediului asupra consumului alimentar (Petrovich și colab., 2009). Mai precis, leziunile CeA, dar nu și amigdala bazolaterală (BLA), elimină efectele inhibitoare ale unui stimulent conditionat asociat cu piciorul, sugerând că CeA este critică pentru controlul inhibitor asupra comportamentului hrănirii ca răspuns la indicii de mediu care prezică rezultatul negativ Petrovich și colab., 2009). Sobolanii obezi sau șobolanii neobosiți cu knockdown striatal D2R și accesul la alimente gustoase continuă să consume alimente gustoase în mod compulsiv în prezența unui CS aversiv. Aceste efecte sunt asemănătoare izbitor cu distrugerea reactivității la șobolanii aversivi CS la șobolanii cu leziuni (Petrovich și colab., 2009). Astfel, va fi important să se determine dacă modificările activității CeA, probabil ca o consecință a downregulării striatale D2R sau a dezvoltării rezistenței la leptină în midbrain, contribuie la apariția consumului de compulsivitate la șobolanii obezi.
Pe lângă reglarea efectelor stimulilor nocivi ai mediului asupra comportamentului alimentar, CeA poate juca, de asemenea, un rol cheie în alimentația hedonică legată de stres. La om, stresul motivează puternic selectarea și consumul de alimente gustoase, cu densitate energetică, independent de necesarul caloric ([Gluck și colab., 2004], [Kandiah și colab., 2006] și [O'Connor și colab., 2008]) , iar obezitatea este asociată cu o secreție crescută de glucocorticoizi legată de stres ([Björntorp și Rosmond, 2000] și [la Fleur, 2006]). Stresorii de mediu și sociali induc, de asemenea, hiperfagia alimentelor plăcute cu densitate energetică la rozătoare și maimuțe, consumul de alimente plăcute pot atenua efectele adverse ale stresului ([Dallman și colab., 2003], [Dallman și colab., 2006], [Pecoraro și colab. al., 2004] și [Wilson și colab., 2008]). Mai mult, medicamentul care evocă stresul, yohimbina, poate restabili răspunsurile la căutare de alimente gustative stinse anterior (apăsarea pârghiei) la șobolani, efect atenuat de antalarma receptorului antagonist al receptorului factorului de eliberare a corticotropinei (CRF-1) (Ghitza și colab., 1 ). Este important să subliniem că efectele precise ale stresului asupra consumului de alimente la om și la animalele de laborator depind de natura și amploarea factorului de stres, de tipul de alimente disponibile pentru consum (plăcut versus bland), de greutatea corporală și de sex (Dallman , 2006).
Șoarecii cu acces extins la o dietă bogată în grăsimi au scăzut expresia CRF a hormonului de stres în CeA (Teegarden și Bale, 2007). În schimb, șoarecii supuși unei "retrageri" din dieta gustoasă au crescut expresia CRF în CeA (Teegarden și Bale, 2007). Acest din urmă efect este foarte similar cu creșterea expresiei CRF în CeA detectată la șobolani care se retrag din toate drogurile majore de abuz (Koob, 2010). Deoarece utilizarea medicamentului în continuare poate normaliza acest răspuns neurobiologic aversiv la retragerea de droguri, sa emis ipoteza că transmiterea hiperactivă a CRF în CeA și alte structuri limbice poate facilita dezvoltarea consumului compulsiv de droguri (Koob și Zorrilla, 2010). În concordanță cu acest punct de vedere, șoarecii care se retrag din hrană gustoasă, care au avut valori ridicate ale concentrației de CRF în CeA, au cheltuit mult mai mult timp într-un mediu aversiv (luminos) pentru a obține alimente gustoase decât soareci, deși mai puțin gustos a fost disponibil într-un mediu nonaversiv (luminat întunecat) (Teegarden și Bale, 2007). Șoarecii devin astfel rezistenți la posibilele consecințe negative ale comportamentului lor de hrănire și au riscat predarea pentru a obține alimente gustoase, chiar dacă alimentele mai puțin gustoase sunt disponibile la un pericol mult mai mic, în parte pentru atenuarea transmiterii CRF în CeA (Teegarden și Bale, 2007). Mai multe dovezi suplimentare susțin un rol pentru transmisia CRF în consumul compulsiv. În special, un studiu recent a evaluat efectele antagonistului receptorului CRF-1 R121919 asupra consumului alimentar la șobolani care au suferit variații ciclice în dieta lor, în care au avut acces la zilele standard de gătit 5 pe săptămână și accesul la o dietă de zahăr gustos 2 zile pe săptămână (Cottone și colab., 2009). După săptămânile 7 ale acestei variații ciclice de dietă, R121919 a atenuat consumul excesiv al dietei foarte gustoase și a crescut consumul de hrană blandă (Cottone et al., 2009). Mai mult, nivelele de exprimare a CRF în CeA au fost crescute la șobolanii cicluri în timpul retragerii din dieta gustoasă, dar au revenit la nivelurile inițiale după re-expunerea la dieta palatabilă (Cottone și colab., 2009). În cele din urmă, reglarea CRF a transmisiei GABAergice în CeA a fost sporită la șobolanii cicluri care au fost retrași din dieta palatabilă în comparație cu șobolanii de control care anterior aveau acces doar la mâncarea ușoară, reflectată de faptul că R121919 a perturbat potențialul post-sinaptic inhibitor GABAergic evocat în CeA din șobolanii cicluri la o concentrație care nu a modificat transmisia în felii de la șobolanii de control (Cottone și colab., 2009). Interesant, un efect similar al CRF asupra transmisiei GABAergic în CeA a fost de asemenea observat la șobolanii care au fost retrași din expunerea cronică la etanol (Roberto și colab., 2010). În cele din urmă, nucleul patului CeA, structura stria terminalis (BNST) și coaja NAc constituie o structură contiguată mai mare numită "amygdala extinsă". Infuzarea CRF în cochilia NAc la locurile care stimulează consumul hedonic mărește importanța motivațională a mediului cue care anterior fusese asociat cu disponibilitatea unor alimente gustoase (Peciña et al., 2006a). Stresul poate, prin urmare, spori amploarea indicatorilor ecologici ai alimentelor prin modularea activității neuronilor NAc coajă. Luate împreună, aceste constatări sugerează că consumul excesiv de alimente gustoase sau medicamentele de abuz poate induce răspunsuri neuroadaptive similare în căile de stres extrahypotalamic din creier, ceea ce poate contribui la comportamente compulsive consumatoare.
Concluzii
Recent s-au făcut progrese semnificative în identificarea sistemelor cerebrale implicate în efectele hedonice ale alimentelor gustative și adaptările care apar în aceste circuite ca răspuns la consumul excesiv de alimente gustative și creșterea în greutate. Este izbitor faptul că sistemele cerebrale similare și răspunsurile adaptative comune sunt declanșate ca răspuns la consumul atât de alimente plăcute, cât și de droguri dependente. În special, consumul excesiv de alimente gustoase sau droguri de abuz induce deficite similare în sensibilitatea sistemelor de recompensare a creierului. Mâncarea plăcută și drogurile dependente induc deficite în transmiterea dopaminei striatale și exprimarea D2R striatale. Mâncarea plăcută și drogurile dependente declanșează, de asemenea, apariția unui comportament consumativ compulsiv la rozătoare și implică răspunsuri la stres extrahipotalamic. În cele din urmă, vulnerabilitățile genetice comune în sistemele de recompensare a creierului pot predispune indivizii la supraalimentare și obezitate, precum și la consumul de droguri și dependență. De fapt, pe baza acestor și a altor similitudini dintre obezitate și dependența de droguri, s-a argumentat că obezitatea ar trebui inclusă ca categorie de diagnostic în viitoarea DSM-V ([Devlin, 2007] și [Volkow și O'Brien, 2007] ). Având în vedere acest lucru, domeniile critice pentru cercetările viitoare vor implica investigarea în continuare a potențialelor suprapuneri neurobiologice dintre supraalimentarea compulsivă și consumul de droguri. De exemplu, va fi important să se testeze dacă obezitatea este legată de dezvoltarea unui comportament consumativ asemănător cu obiceiul rezultat din plasticitatea în striatul dorsal în același mod în care dependența de droguri poate fi legată de remodelarea striatală și apariția căutării de droguri asemănătoare obiceiurilor comportamente ([Everitt și Robbins, 2005], [Hollander și colab., 2010] și [Kasanetz și colab., 2010]). De asemenea, regiunile cerebrale corticale implicate în controlul executiv și luarea deciziilor (de exemplu, cortexul prefrontal) și în procesarea interoceptivă (cortexul insular) au fost puternic implicate în dependența de droguri ([Everitt și colab., 2008], [Fineberg și colab., 2010 ], [Koob și Volkow, 2010] și [Naqvi și Bechara, 2009]), dar se știe puțin despre rolul lor precis în alimentația compulsivă și obezitate, de exemplu ([Nair și colab., 2011] și [Volkow și colab. , 2009]). Luate împreună, datele revizuite mai sus susțin ideea că obezitatea și dependența de droguri pot apărea din răspunsuri neuroadaptative similare în circuitele de recompensare a creierului și sugerează că mecanismele cunoscute ale dependenței pot oferi un cadru euristic pentru înțelegerea obezității.
recunoasteri
Autorul este sustinut de subventii de la Institutul National pentru Abuzul de droguri (NIDA). Autorul este recunoscător lui Paul Johnson și Christie Fowler pentru observații și comentarii valoroase despre manuscris. Acesta este numărul manuscris 21042 de la Institutul de Cercetări Scripps.
Referinte
1.
o Abizaid și colab., 2006a
o A. Abizaid, Q. Gao, TL Horvath
o Gânduri pentru alimente: mecanisme de creier și echilibru energetic periferic
o Neuron, 51 (2006), pag. 691-702
o
2.
o Abizaid și colab., 2006b
o A. Abizaid, ZW Liu, ZB Andrews, M. Shanabrough, E. Borok, JD Elsworth, RH Roth, MW Sleeman, MR Picciotto, MH Tschöp și colab.
o Ghrelin modulează activitatea și organizarea sinaptică de intrare a neuronilor dopaminergici midbrain în timp ce promovează pofta de mâncare
o J. Clin. Invest., 116 (2006), pag. 3229-3239
o
3.
o Ahmed și Koob, 1998
o SH Ahmed, GF Koob
o Tranziția de la consumul de droguri moderat la excesiv: Schimbarea punctului setat hedonic
o Știință, 282 (1998), pag. 298-300
o
4.
o Ahmed și Koob, 2005
o SH Ahmed, GF Koob
o Tranziția la dependența de droguri: un model negativ de întărire bazat pe o scădere alostatică a funcției de recompensă
o Psychopharmacology (Berl.), 180 (2005), pag. 473-490
o
5.
o Ahmed și colab., 2002
o SH Ahmed, PJ Kenny, GF Koob, A. Markou
o Dovezi neurologice pentru alostasul hedonic asociat cu utilizarea escaladării cocainei
o Nat. Neurosci., 5 (2002), pag. 625-626
o
6.
o Allison și colab., 1999
o DB Allison, KR Fontaine, JE Manson, J. Stevens, TB VanItalie
o Decese anuale care pot fi atribuite obezității în Statele Unite
o JAMA, 282 (1999), pag. 1530-1538
o
7.
o Asociația Americană de Psihiatrie, 1994
o Asociația Americană de Psihiatrie
o Manualul Diagnostic și Statistic al Tulburărilor Mentale
o (ediția a patra) Asociația Americană de Psihiatrie, Washington, DC (1994)
o
8.
o Angeles-Castellanos și colab., 2007
o M. Angeles-Castellanos, J. Mendoza, C. Escobar
o Programări de hrană restricționate ritmuri zilnice de schimbare a fazei de imunofluorescență c-Fos și proteină Per1 în regiunile corticolimbice la șobolani
o Neuroștiință, 144 (2007), p. 344-355
o
9.
o Baicy și colab., 2007
o K. Baicy, ED Londra, J. Monterosso, ML Wong, T. Delibasi, A. Sharma, J. Licinio
o Înlocuirea leptinei modifică răspunsul creierului la indicațiile alimentare la adulții cu deficit de leptină genetică
o Proc. Natl. Acad. Sci. SUA, 104 (2007), pag. 18276-18279
o
10.
o Baldo și colab., 2004
o BA Baldo, L. Gual-Bonilla, K. Sijapati, RA Daniel, CF Landry, AE Kelley
o Activarea unei subpopulații a neuronilor hipotalamici care conțin orexină / ipocretin prin inhibarea mediată de receptorul GABAA a cochiliei nucleului accumbens, dar nu prin expunerea la un mediu nou
o Eur. J. Neurosci., 19 (2004), pag. 376-386
o
11.
o Balleine și Dickinson, 2000
o BW Balleine, A. Dickinson
o Efectul leziunilor cortexului insular asupra condiționării instrumentale: dovada unui rol în memoria stimulentelor
o J. Neurosci., 20 (2000), pag. 8954-8964
o
12.
o Barnard și colab., 2009
o ND Barnard, EP Noble, T. Ritchie, J. Cohen, DJ Jenkins, G. Turner-McGrievy, L. Gloede, AA Green, H. Ferdowsian
o Polimorfismul receptorului dopaminic D2, polimorfismul Taq1A, greutatea corporală și aportul alimentar în diabetul de tip 2
o Nutriție, 25 (2009), pag. 58-65
o
13.
o Basso și Kelley, 1999
o AM Basso, AE Kelley
o Hrănire indusă de stimularea receptorului GABA (A) în interiorul coajei nucleului accumbens: Cartografierea regională și caracterizarea preferințelor macronutrienților și gusturilor
o Behav. Neurosci., 113 (1999), pag. 324-336
o
14.
o Batterham și colab., 2007
o RL Batterham, DH ffytche, JM Rosenthal, FO Zelaya, GJ Barker, DJ Withers, SC Williams
Modularea PYY a zonelor cerebrale corticale și hipotalamice prezice comportamentul alimentar la om
o Nature, 450 (2007), pag. 106-109
o
15.
o Baxter și Murray, 2002
o MG Baxter, EA Murray
o Amigdala și recompensa
o Nat. Rev. Neurosci., 3 (2002), pag. 563-573
o
16.
o Bean și colab., 2008
o MK Bean, K. Stewart, ME Olbrisch
o Obezitatea în America: Implicații pentru psihologii clinici și de sănătate
o J. Clin. Psychol. Med. Setări, 15 (2008), p. 214-224
o
17.
o Beaver și colab., 2006
o JD Beaver, AD Lawrence, J. van Ditzhuijzen, MH Davis, A. Woods, AJ Calder
o Diferențele individuale în unitatea de recompensare prezic răspunsurile neuronale la imaginile alimentelor
o J. Neurosci., 26 (2006), pag. 5160-5166
o
18.
o Belin și colab., 2008
o D. Belin, AC Mar, JW Dalley, TW Robbins, BJ Everitt
o Impulsivitatea ridicată prezice trecerea la consumul de cocaină compulsiv
o Știință, 320 (2008), pag. 1352-1355
o
19.
o Berridge, 1996
o KC Berridge
o recompensa alimentară: substraturile creierului de dorință și plăcere
o Neurosci. Biobehav. Rev., 20 (1996), pag. 1-25
o
20.
o Berridge, 2009
o KC Berridge
Răsfoirea alimentelor "Liking" și "care doresc": Substraturile și rolurile creierului în tulburările de alimentație
o Physiol. Behav., 97 (2009), pag. 537-550
o
21.
o Björntorp și Rosmond, 2000
o P. Björntorp, R. Rosmond
o Obezitatea și cortizolul
o Nutriție, 16 (2000), pag. 924-936
o
22.
o Blundell și Herberg, 1968
o JE Blundell, LJ Herberg
o Efectele relative ale deficitului nutrițional și perioadei de deprivare asupra ratei de autostimulare electrică a hipotalamusului lateral
o Nature, 219 (1968), pag. 627-628
o
23.
o Booth și colab., 2008
o Booth ML, RL Wilkenfeld, DL Pagnini, SL Booth, LA King
o Percepțiile adolescenților asupra excesului de greutate și a obezității: Ponderea studiului de opinie
o J. Paediatr. Sănătatea copilului, 44 (2008), pag. 248-252
o
24.
o Bragulat și colab., 2010
o V. Bragulat, M. Dzemidzic, C. Bruno, CA Cox, T. Talavage, RV Considine, DA Kareken
o Sonele de miros legate de alimente ale circuitelor de recompensare a creierului în timpul foamei: un studiu pilot fMRI
o Obezitate, argintiu de argint, MD (2010)
o
25.
o Cabanac și Johnson, 1983
o M. Cabanac, KG Johnson
o Analiza unui conflict între gustativ și expunerea la rece la șobolani
o Physiol. Behav., 31 (1983), pag. 249-253
o
26.
o Campfield și colab., 1995
o LA Campfield, FJ Smith, Y. Guisez, R. Devos, P. Burn
o Proteină OB recombinantă de șoarece: dovada unui semnal periferic care leagă adipozitatea și rețelele neuronale centrale
o Știință, 269 (1995), pag. 546-549
o
27.
o Cannon și Palmiter, 2003
o CM Cannon, RD Palmiter
o Răsplată fără dopamină
o J. Neurosci., 23 (2003), pag. 10827-10831
o
28.
Carr și Simon, 1984
o KD Carr, EJ Simon
o Potențarea recompensării prin foamete este mediată de opioide
o Brain Res., 297 (1984), pag. 369-373
o
29.
Centrele pentru Controlul și Prevenirea Bolilor, 2009
Centrele pentru Controlul și Prevenirea Bolilor (2009). Tendințele obezității din SUA (Atlanta: Centrele pentru Controlul și Prevenirea Bolilor).
o
30.
o Colantuoni și colab., 2001
o C. Colantuoni, J. Schwenker, J. McCarthy, P. Rada, B. Ladenheim, JL Cadet, GJ Schwartz, TH Moran, BG Hoebel
o Consumul excesiv de zahăr modifică legarea la receptorii dopaminergici și mu-opioizi din creier
o Neuroreport, 12 (2001), pag. 3549-3552
o
31.
o Cornelius și colab., 2010
o JR Cornelius, M. Tippmann-Peikert, NL Slocumb, CF Frerichs, MH Silber
o tulburări de control al impulsului cu utilizarea agenților dopaminergici în sindromul picioarelor neliniștite: un studiu de caz-control
o Somn, 33 (2010), pag. 81-87
o
32.
o Cornier și colab., 2009
o MA Cornier, AK Salzberg, DC În final, DH Bessesen, DC Rojas, JR Tregellas
o Efectele supraproducției asupra răspunsului neuronal la indiciile alimentare vizuale la indivizii subțiri și la cei cu obezitate redusă
o PLoS ONE, 4 (2009), pag. e6310 http://dx.doi.org/10.1371/journal.pone.0006310
o
33.
o Cottone și colab., 2009
o P. Cottone, V. Sabino, M. Roberto, M. Bajo, L. Pockros, JB Frihauf, EM Fekete, L. Steardo, KC Rice, DE Grigoriadis et al.
o Recrutarea sistemului CRF mediază partea întunecată a consumului compulsiv
o Proc. Natl. Acad. Sci. SUA, 106 (2009), pag. 20016-20020
o
34.
o Dagher, 2009
o A. Dagher
o Neurobiologia apetitului: Foamea ca dependență
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pag. S30-S33
o
35.
o Dagher și Robbins, 2009
o A. Dagher, TW Robbins
o Personalitate, dependență, dopamină: informații despre boala Parkinson
o Neuron, 61 (2009), pag. 502-510
o
36.
o Dallman, 2010
o MF Dallman
o Obezitatea indusă de stres și sistemul nervos emoțional
o Tendințe Endocrinol. Metab., 21 (2010), pag. 159-165
o
37.
o Dallman și colab., 2003
o MF Dallman, N. Pecoraro, SF Akana, SE La Fleur, F. Gomez, H. Houshyar, ME Bell, S. Bhatnagar, KD Laugero, S. Manalo
o Stres cronic și obezitate: o nouă viziune a "alimentelor de confort"
o Proc. Natl. Acad. Sci. SUA, 100 (2003), pag. 11696-11701
o
38.
o Dallman și colab., 2006
o MF Dallman, NC Pecoraro, SE La Fleur, JP Warne, AB Ginsberg, SF Akana, KC Laugero, H. Houshyar, AM Strack, S. Bhatnagar, ME Bell
o Glucocorticoizi, stres cronic și obezitate
o Prog. Brain Res., 153 (2006), pag. 75-105
o
39.
o Davis și colab., 2004
C. Davis, S. Strachan, M. Berkson
o Sensibilitatea la recompensă: Implicații pentru supraalimentare și excesul de greutate
o Apetit, 42 (2004), pag. 131-138
o
40.
o Davis și colab., 2008
o JF Davis, AL Tracy, JD Schurdak, MH Tschöp, JW Lipton, DJ Clegg, SC Benoit
o Expunerea la niveluri ridicate de grăsimi dietetice atenuează rata de stimulare psihostimulantă și turnover-ul mezolimbic al dopaminei la șobolan
o Behav. Neurosci., 122 (2008), pag. 1257-1263
o
41.
o de Araujo și colab., 2010
o IE de Araujo, X. Ren, JG Ferreira
o Sensibilitatea metabolică în sistemele de dopamină din creier
o Rezultate Probl. Cell Differ., 52 (2010), pag. 69-86
o
42.
o Delin și colab., 1997
o CR Delin, JM Watts, JL Saebel, PG Anderson
o Consumul de alimente și experiența foamei în urma intervenției chirurgicale de by-pass gastric pentru obezitatea morbidă
o Obes. Surg., 7 (1997), pag. 405-413
o
43.
o Deroche-Gamonet și colab., 2004
o V. Deroche-Gamonet, D. Belin, PV Piazza
o Dovada comportamentului asemănător la șobolan
o Știință, 305 (2004), pag. 1014-1017
o
44.
o Devlin, 2007
o MJ Devlin
o Există un loc pentru obezitate în DSM-V?
o Int. J. Eat. Disord., 40 (Suppl) (2007), pag. S83-S88
o
45.
o Doknic și colab., 2002
o M. Doknic, S. Pekic, M. Zarkovic, M. Medic-Stojanoska, C. Dieguez, F. Casanueva, V. Popovic
Tonul dopaminergic și obezitatea: o perspectivă din prolactinoamele tratate cu bromocriptină
o Eur. J. Endocrinol., 147 (2002), pag. 77-84
o
46.
o Everitt și Robbins, 2005
o BJ Everitt, TW Robbins
o Sisteme neurale de armare pentru dependență de droguri: de la acțiuni la obiceiuri la constrângere
o Nat. Neurosci., 8 (2005), pag. 1481-1489
o
47.
o Everitt și colab., 2008
o BJ Everitt, D. Belin, D. Economidou, Y. Pelloux, JW Dalley, TW Robbins
o Revizuire. Mecanismele neuronale care stau la baza vulnerabilității de a dezvolta obiceiuri compulsive de căutare a drogurilor și dependență
o Philos. Trans. R. Soc. Lond. B Biol. Sci., 363 (2008), pag. 3125-3135
o
48.
o Farooqi și colab., 2007
o IS Farooqi, E. Bullmore, J. Keogh, J. Gillard, S. O'Rahilly, PC Fletcher
o Leptina reglează regiunile striatale și comportamentul alimentar uman
o știință, 317 (2007), p. 1355
o
49.
o Felsted și colab., 2010
o JA Felsted, X. Ren, F. Chouinard-Decorte, DM Mic
o Diferențe determinate genetic în răspunsul creierului la o recompensă primară de hrană
o J. Neurosci., 30 (2010), pag. 2428-2432
o
50.
o Figlewicz și colab., 2001
o DP Figlewicz, MS Higgins, SB Ng-Evans, PJ Havel
o Leptina inversează preferința locului condiționat de zaharoză la șobolanii cu restricție la alimente
o Physiol. Behav., 73 (2001), pag. 229-234
o
51.
o Figlewicz și colab., 2003
o DP Figlewicz, SB Evans, J. Murphy, M. Hoen, DG Baskin
o Exprimarea receptorilor pentru insulină și leptină în zona tegmentală ventrală / substantia nigra (VTA / SN) a șobolanului
o Brain Res., 964 (2003), pag. 107-115
o
52.
o Fineberg și colab., 2010
o NA Fineberg, MN Potenza, SR Chamberlain, HA Berlin, L. Menzies, A. Bechara, BJ Sahakian, TW Robbins, ET Bullmore, E. Hollander
o Prelevarea de comportamente compulsive și impulsive, de la modele animale la endofenotipuri: o revizuire narativă
o Neuropsihopharmacology, 35 (2010), pp. 591-604
o
53.
o Finkelstein și colab., 2005
o EA Finkelstein, CJ Ruhm, KM Kosa
Cauzele și consecințele economice ale obezității
o Annu. Rev. Sanatate Publica, 26 (2005), pp. 239-257
o
54.
o Flegal și colab., 2010
o KM Flegal, MD Carroll, CL Ogden, LR Curtin
o Prevalența și tendințele în obezitate în rândul adulților americani, 1999-2008
o JAMA, 303 (2010), pag. 235-241
o
55.
o Foo și Mason, 2005
o H. Foo, P. Mason
o Suprimarea senzorială în timpul hrănirii
o Proc. Natl. Acad. Sci. SUA, 102 (2005), pag. 16865-16869
o
56.
o Franken și Muris, 2005
o IH Franken, P. Muris
o Diferențele individuale în sensibilitatea recompensării sunt legate de dorința de alimentație și de greutatea relativă a corpului la femei sănătoase
o Apetit, 45 (2005), pag. 198-201
o
57.
o Friedman și colab., 2011
o A. Friedman, E. Lax, Y. Dikshtein, L. Abraham, Y. Flaumenhaft, E. Sudai, M. Ben-Tzion, G. Yadid
o Stimularea electrică a habenului lateral produce un efect inhibitor asupra auto-administrării sucrozei
o Neurofarmacologie, 60 (2011), pag. 381-387
o
58.
o Fulton și colab., 2000
o S. Fulton, B. Woodside, P. Shizgal
o Modularea circuitelor de recompensare a creierului prin leptină
o Știință, 287 (2000), pag. 125-128
o
59.
o Fulton și colab., 2006
o S. Fulton, P. Pissios, RP Manchon, L. Stiles, L. Frank, EN Pothos, E. Maratos-Flier, JS Flier
o Reglarea cu leptină a căii dopaminei mezoaccumbens
o Neuron, 51 (2006), pag. 811-822
o
60.
o Gao și Horvath, 2007
Q. Gao, TL Horvath
o Neurobiologia hrănirii și a cheltuielilor cu energia
o Annu. Rev. Neurosci., 30 (2007), pag. 367-398
o
61.
o Gautier și colab., 2000
o JF Gautier, K. Chen, AD Salbe, D. Bandy, RE Pratley, M. Heiman, E. Ravussin, EM Reiman, PA Tataranni
Răspunsurile diferențiate ale creierului la satierea la bărbații obezi și slabi
o Diabet, 49 (2000), pag. 838-846
o
62.
o Geiger și colab., 2008
o BM Geiger, GG Behr, LE Frank, AD Caldera-Siu, MC Beinfeld, EG Kokkotou, EN Pothos
o Dovezi pentru exocitoza mesolimbică defectă la șobolanii predispuși la obezitate
o FASEB J., 22 (2008), pag. 2740-2746
o
63.
o Geiger și colab., 2009
o BM Geiger, M. Haburcak, NM Avena, MC Moyer, BG Hoebel, EN Pothos
o Deficiturile neurotransmisiei mezolimbice de dopamină la obezitatea alimentară a șobolanilor
o Neuroștiință, 159 (2009), p. 1193-1199
o
64.
o Ghitza și colab., 2006
o UE Ghitza, SM Gray, DH Epstein, KC Rice, Y. Shaham
o Neuropsihopharmacology
o Medicamentul anxiogenic yohimbină reintroduce alimentele gustoase care caută într-un model de recădere la șobolan: Un rol al receptorilor CRF (1), 33 (2006), pp. 2188-2196
o
65.
o Gluck și colab., 2004
o ME Gluck, A. Geliebter, J. Hung, E. Yahav
o Cortizolul, foamea și dorința de a face hipoacuzie după un test de stres la femeile obeze cu tulburări de alimentație
o Psychosom. Med., 66 (2004), pag. 876-881
o
66.
o Goldstone și colab., 2009
o AP Goldstone, CG Prechtl de Hernandez, JD Beaver, K. Muhammed, C. Croese, G. Bell, G. Durighel, E. Hughes, AD Waldman, G. Frost, JD Bell
• Postul previn sistemele de recompensare a creierului față de alimentele cu conținut ridicat de calorii
o Eur. J. Neurosci., 30 (2009), pag. 1625-1635
o
67.
o Halaas și colab., 1995
o JL Halaas, KS Gajiwala, M. Maffei, SL Cohen, BT Chait, D. Rabinowitz, RL Lallone, SK Burley, JM Friedman
o Efectele de reducere a greutății ale proteinei plasmatice codificate de gena obeză
o Știință, 269 (1995), pag. 543-546
o
68.
o Hamilton și colab., 1995
o BS Hamilton, D. Paglia, AY Kwan, M. Deitel
o Expresie mRNA obeză crescută în celulele de grăsime omentală de la oameni masiv obezi
o Nat. Med., 1 (1995), pag. 953-956
o
69.
o Hernandez și Hoebel, 1988
o L. Hernandez, BG Hoebel
o Recompensa alimentară și cocaina măresc dopamina extracelulară în nucleul accumbens măsurată prin microdializă
o Life Sci., 42 (1988), pag. 1705-1712
o
70.
o Hill și colab., 2003
o JO Hill, HR Wyatt, GW Reed, JC Peters
o Obezitatea și mediul înconjurător: Unde mergem de aici?
o Știință, 299 (2003), pag. 853-855
o
71.
o Hoebel, 1969
o BG Hoebel
o Hrănire și auto-stimulare
o Ann. NY Acad. Sci., 157 (1969), pag. 758-778
o
72.
o Hoebel și Balagura, 1967
o BG Hoebel, S. Balagura
o Auto-stimularea hipotalamusului lateral modificat de insulină și glucagon
o Physiol. Behav., 2 (1967), pag. 337-340
o
73.
o Hoebel și Teitelbaum, 1962
o BG Hoebel, P. Teitelbaum
o Controlul hipotalamic al hrănirii și autostimulării
o Știință, 135 (1962), pag. 375-377
o
74.
o Hoebel și Thompson, 1969
o BG Hoebel, RD Thompson
o Aversiunea față de stimularea hipotalamică laterală cauzată de hrănirea intragastrică sau obezitatea
J. Comp. Physiol. Psychol., 68 (1969), pag. 536-543
o
75.
o Hofmann și colab., 2010
o W. Hofmann, GM van Koningsbruggen, W. Stroebe, S. Ramanathan, H. Aarts
o Pe măsură ce se dezvăluie plăcerea: răspunsurile hedonice la mâncarea tentantă
o Psychol. Sci., 21 (2010), pag. 1863-1870
o
76.
o Olanda și Gallagher, 2004
o PC Olanda, M. Gallagher
o Interactiuni frontale amigdala si speranta de recompensa
o Curr. Opin. Neurobiol., 14 (2004), pag. 148-155
o
77.
o Hollander și colab., 2010
o JA Hollander, HI Im, AL Amelio, J. Kocerha, P. Bali, Q. Lu, D. Willoughby, C. Wahlestedt, MD Conkright, PJ Kenny
o MicroRNA striat controlează consumul de cocaină prin semnalizarea CREB
o Nature, 466 (2010), pag. 197-202
o
78.
o Hommel și colab., 2006
o JD Hommel, R. Trinko, RM Sears, D. Georgescu, ZW Liu, XB Gao, JJ Thurmon, M. Marinelli, RJ DiLeone
o Semnalizarea receptorilor de leptină în neuronii dopaminei midbrain reglează hrănirea
o Neuron, 51 (2006), pag. 801-810
o
79.
o Imaizumi și colab., 2001
o M. Imaizumi, M. Takeda, A. Suzuki, S. Sawano, T. Fushiki
o Preferința pentru alimentele bogate în grăsimi la șoareci: cartofii prăjiți în comparație cu cartofii fierți
o Apetit, 36 (2001), pag. 237-238
o
80.
o Jerlhag și colab., 2006
o E. Jerlhag, E. Egecioglu, SL Dickson, M. Andersson, L. Svensson, JA Engel
o Ghrelin stimulează activitatea locomotorie și acumulează dopamină-reaprindere prin intermediul sistemelor colinergice centrale la șoareci: Implicații pentru implicarea sa în recompensarea creierului
o Dependenta. Biol., 11 (2006), pag. 45-54
o
81.
o Jerlhag și colab., 2007
o E. Jerlhag, E. Egecioglu, SL Dickson, A. Douhan, L. Svensson, JA Engel
o Administrarea ghrelinelor în zonele tegmentale stimulează activitatea locomotorie și crește concentrația extracelulară a dopaminei în nucleul accumbens
o Dependenta. Biol., 12 (2007), pag. 6-16
o
82.
o Jhou și colab., 2009
o TC Jhou, câmpurile HL, MG Baxter, CB Saper, PC Holland
o Nucleul tegmental patromedial (RMTg), un neuron al dopaminei aferente GABAergic, codifică stimulii aversivi și inhibă răspunsurile motorii
o Neuron, 61 (2009), pag. 786-800
o
83.
o Johnson și Kenny, 2010
- PM Johnson, PJ Kenny
Receptorii D2 ai dopaminei în disfuncția de recompensă și compulsivă la șobolanii obezi
o Nat. Neurosci., 13 (2010), pag. 635-641
o
84.
o Johnson și colab., 1996
o PI Johnson, MA Parente, JR Stellar
o Leziunile induse de NMDA ale nucleului accumbens sau pallidum ventral cresc eficacitatea satisfacatoare a alimentelor pentru sobolani lipsiti
o Brain Res., 722 (1996), pag. 109-117
o
85.
o Jönsson și colab., 1999
o EG Jönsson, MM Nöthen, F. Grünhage, L. Farde, Y. Nakashima, P. Propping, GC Sedvall
o Polimorfisme în gena receptorului D2 al dopaminei și relațiile lor cu densitatea receptorilor de dopamină striatală a voluntarilor sănătoși
o Mol. Psihiatrie, 4 (1999), pp. 290-296
o
86.
o Kalarchian și colab., 2002
o MA Kalarchian, MD Marcus, GT Wilson, EW Labouvie, RE Brolin, LB LaMarca
o Cheagul de alungare în rândul pacienților cu by-pass gastric la urmărirea pe termen lung
o Obes. Surg., 12 (2002), pag. 270-275
o
87.
o Kandiah și colab., 2006
J. Kandiah, M. Yake, J. Jones, M. Meyer
o Stresul influențează pofta de mâncare și confortul preferințelor alimentare la femeile din colegiu
o Nutr. Res., 26 (2006), pag. 118-123
o
88.
o Karhunen și colab., 1997
o LJ Karhunen, RI Lappalainen, EJ Vanninen, JT Kuikka, MI Uusitupa
o fluxul sanguin cerebral regional în timpul expunerii alimentare la femeile obeze și în greutate normală;
o Brain, 120 (1997), pag. 1675-1684
o
89.
o Kasanetz și colab., 2010
o F. Kasanetz, V. Deroche-Gamonet, N. Berson, E. Balado, M. Lafourcade, O. Manzoni, PV Piazza
o Tranziția la dependență este asociată cu o afectare persistentă în plasticitatea sinaptică
o Știință, 328 (2010), pag. 1709-1712
o
90.
o Kelley și colab., 1996
o AE Kelley, EP Bless, CJ Swanson
o Investigarea efectelor antagoniștilor de opiacee infuzați în nucleul accumbens asupra hranei și consumului de sucroză la șobolani
J. Pharmacol. Exp. Ther., 278 (1996), pag. 1499-1507
o
91.
o Kelley și colab., 2005
o AE Kelley, BA Baldo, WE Pratt, MJ Will
o Circuite corticostriatale-hipotalamice și motivație alimentară: integrarea energiei, a acțiunii și a recompensei
o Physiol. Behav., 86 (2005), pag. 773-795
o
92.
o Kenny și colab., 2006
o PJ Kenny, SA Chen, O. Kitamura, A. Markou, GF Koob
o Toleranța condiționată conduce la consumul de heroină și scade sensibilitatea la recompensă
o J. Neurosci., 26 (2006), pag. 5894-5900
o
93.
o Kim și colab., 2010
o KS Kim, YR Yoon, HJ Lee, S. Yoon, SY Kim, SW Shin, JJ An, MS Kim, SY Choi, W. Sun, JH Baik
o Semnalizarea intensității leptinei hipotalamice la șoareci lipsiți de receptorii dopaminergici D2
o J. Biol. Chem., 285 (2010), pag. 8905-8917
o
94.
o Klein și colab., 2007
o TA Klein, J. Neumann, M. Reuter, J. Hennig, DY von Cramon, M. Ullsperger
o Diferențe determinate genetic în învățarea de la erori
o Știință, 318 (2007), pag. 1642-1645
o
95.
o Kojima și colab., 1999
o M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa
o Ghrelin este o peptidă acilată eliberată de hormon de creștere din stomac
o Nature, 402 (1999), pag. 656-660
o
96.
o Kok și colab., 2006
o P. Kok, F. Roelfsema, M. Frölich, J. van Pelt, AE Meinders, H. Pijl
o Activarea receptorilor de dopamină D2 reduce concentrațiile de leptină circadiană la femeile obeze
o J. Clin. Endocrinol. Metab., 91 (2006), pag. 3236-3240
o
97.
o Koob, 2010
o GF Koob
o Rolul peptidelor CRF și CRF în partea întunecată a dependenței
o Brain Res., 1314 (2010), pag. 3-14
o
98.
o Koob și Le Moal, 2008
o GF Koob, M. Le Moal
o dependenta si sistemul antirewardal al creierului
o Annu. Rev. Psychol., 59 (2008), pag. 29-53
o
99.
o Koob și Volkow, 2010
o GF Koob, ND Volkow
o Neurocircuitarea dependenței
o Neuropsihopharmacology, 35 (2010), pp. 217-238
o
100.
o Koob și Zorrilla, 2010
o GF Koob, EP Zorrilla
o Mecanisme neurologice de dependență: Concentrați-vă pe factorul de eliberare a corticotropinei
o Curr. Opin. Investig. Droguri, 11 (2010), pag. 63-71
o
101.
o Kringelbach și colab., 2003
o ML Kringelbach, J. O'Doherty, ET Rolls, C. Andrews
o Activarea cortexului orbitofrontal uman la un stimulent alimentar lichid este corelată cu plăcerea lui subiectivă
o Cereb. Cortex, 13 (2003), pag. 1064-1071
o
102.
o Krügel și colab., 2003
o U. Krügel, T. Schraft, H. Kittner, W. Kiess, P. Illes
o Eliberarea dopaminei bazale și a hranei provocate de nucleul accumbens de șobolan este deprimată de leptină
o Eur. J. Pharmacol., 482 (2003), pag. 185-187
o
103.
o la Fleur, 2006
o SE la Fleur
o Efectele glucocorticoizilor asupra comportamentului hrănirii la șobolani
o Physiol. Behav., 89 (2006), pag. 110-114
o
104.
o LaBar și colab., 2001
o KS LaBar, DR Gitelman, TB Parrish, YH Kim, AC Nobre, MM Mesulam
o Foamea modulează selectiv activarea corticolimbică a stimulilor alimentari la om
o Behav. Neurosci., 115 (2001), pag. 493-500
o
105.
o Latagliata și colab., 2010
o EC Latagliata, E. Patrono, S. Puglisi-Allegra, R. Ventura
o Căutarea alimentelor, în ciuda consecințelor nocive, se face sub controlul prefrontal cortic noradrenergic
o BMC Neurosci., 11 (2010), p. 15
o
106.
o Lawford și colab., 2000
BR Lawford, RM Young, EP Noble, J. Sargent, J. Rowell, S. Shadforth, X. Zhang, T. Ritchie
o Alela D (2) a receptorului dopaminic A (1) și dependența de opioid: asocierea cu utilizarea heroinei și răspunsul la tratamentul cu metadonă
o Am. J. Med. Genet., 96 (2000), pag. 592-598
o
107.
o Leinninger și colab., 2009
o GM Leinninger, YH Jo, RL Leshan, GW Louis, H. Yang, JG Barrera, H. Wilson, DM Opland, MA Faouzi, Y. Gong și colab.
o Leptina acționează prin intermediul neuronilor hipotalamici laterali care exprimă receptorul leptinei pentru a modula sistemul dopaminic mezolimbic și a suprima hrănirea
o Cell Metab., 10 (2009), pag. 89-98
o
108.
o Lenoir și colab., 2007
o M. Lenoir, F. Serre, L. Cantin, SH Ahmed
o Dulceața intensă depășește rata de cocaină
o PLoS ONE, 2 (2007), pag. e698 http://dx.doi.org/10.1371/journal.pone.0000698
o
109.
o Leshan și colab., 2010
o RL Leshan, DM Opland, GW Louis, GM Leinninger, CM Patterson, CJ Rhodes, H. Münzberg, MG Myers Jr.
o Neuronii receptorilor de leptină din zona tegmentală a ventricularului proiectează în mod specific și reglementează neuronii transcriptați reglementați cu cocaină și amfetamină din amigdala centrală extinsă
o J. Neurosci., 30 (2010), pag. 5713-5723
o
110.
o Louis și colab., 2010
o GW Louis, GM Leinninger, CJ Rhodes, MG Myers Jr.
o Inervație și modulare directă a neuronilor de orexină prin neuroni hipotalamici laterali LepRb
o J. Neurosci., 30 (2010), pag. 11278-11287
o
111.
o Luppino și colab., 2010
o FS Luppino, LM de Wit, PF Bouvy, T. Stijnen, P. Cuijpers, BW Penninx, FG Zitman
o Excesul de greutate, obezitatea și depresia: o analiză sistematică și o meta-analiză a studiilor longitudinale
o Arch. Gen. Psihiatrie, 67 (2010), pag. 220-229
o
112.
o Lutter și Nestler, 2009
o M. Lutter, EJ Nestler
Semnalele homeostatice și hedonice interacționează în reglarea aportului alimentar
J. Nutr., 139 (2009), pag. 629-632
o
113.
o Macht și Mueller, 2007
o M. Macht, J. Mueller
o Efectele imediate ale ciocolatei asupra stărilor de stare induse experimental
o Apetit, 49 (2007), pag. 667-674
o
114.
o Maldonado-Irizarry și Kelley, 1995
o CS Maldonado-Irizarry, AE Kelley
o Leziunile excitotoxice ale subregiunilor de bază și coajă ale nucleului accumbens perturbă diferențiat reglarea greutății corporale și activitatea motrică la șobolan
o Brain Res. Bull., 38 (1995), pag. 551-559
o
115.
o Maldonado-Irizarry și colab., 1995
o CS Maldonado-Irizarry, CJ Swanson, AE Kelley
o Receptorii de glutamat din comportamentul de alimentare cu control al cochiliei nucleului accumbens prin intermediul hipotalamusului lateral
o J. Neurosci., 15 (1995), pag. 6779-6788
o
116.
o Malik și colab., 2008
o S. Malik, F. McGlone, D. Bedrossian, A. Dagher
o Ghrelin modulează activitatea creierului în domenii care controlează comportamentul apetit
o Cell Metab., 7 (2008), pag. 400-409
o
117.
o Man et al., 2009
o MS Man, HF Clarke, AC Roberts
o Rolul cortexului orbitofrontal și striatum medial în reglarea răspunsurilor prepotante la recompensele alimentare
o Cereb. Cortex, 19 (2009), pag. 899-906
o
118.
o Margules și Olds, 1962
o DL Margules, J. Olds
o sisteme "hrănite" și "recompense" identice în hipotalamusul lateral al șobolanilor
o Știință, 135 (1962), pag. 374-375
o
119.
o Markou și Frank, 1987
o A. Markou, RA Frank
o Efectul poziționării operatorului și electrodului asupra funcțiilor de răspuns ale duratei trenului de auto-stimulare
o Physiol. Behav., 41 (1987), pag. 303-308
o
120.
o Markou și Koob, 1991
o A. Markou, GF Koob
o Anhedonia postcocaină. Un model animal de retragere a cocainei
o Neuropsihopharmacology, 4 (1991), pp. 17-26
o
121.
o Mastronardi și colab., 2001
o CA Mastronardi, WH Yu, VK Srivastava, WL Dees, SM McCann
o Eliberarea leptinei indusă de lipopolizaharidă este controlată neuronal
o Proc. Natl. Acad. Sci. SUA, 98 (2001), pag. 14720-14725
o
122.
o Matheny și colab., 2011
o M. Matheny, A. Shapiro, N. Tumer, PJ Scarpace
o Rezistența la leptină celulară indusă de dietă și indusă de leptină include zona tegmentală ventrală la șobolani
o Neuropharmacology (2011) http://dx.doi.org/10.1016/j.neuropharm.2010.11.002 în presă. Publicat online Noiembrie 5, 2010
o
123.
o Matsumoto și Hikosaka, 2007
o M. Matsumoto, O. Hikosaka
o Habenula laterală ca sursă de semnale negative de recompensă în neuronii dopaminergici
o Nature, 447 (2007), pag. 1111-1115
o
124.
o Morton și colab., 2006
o GJ Morton, DE Cummings, DG Baskin, GS Barsh, MW Schwartz
Controlul sistemului nervos central asupra consumului de alimente și a greutății corporale
o Nature, 443 (2006), pag. 289-295
o
125.
o Muntele și Hoebel, 1967
o G. Muntele, BG Hoebel
o Auto-stimulare hipotalamică laterală: Pragul auto-determinat crește prin aportul de alimente
o Psychon. Sci., 9 (1967), pag. 265-266
o
126.
o Nair și colab., 2011
o SG Nair, BM Navarre, C. Cifani, CL Pickens, JM Bossert, Y. Shaham
o Rolul dopaminei corticale prefrontale dorsale D1-receptorii de familie în recidiva la alimentele cu conținut ridicat de grăsimi care caută induse de drogul anxiogen yohimbină
o Neuropsihopharmacology, 36 (2011), pp. 497-510
o
127.
o Nakazato și colab., 2001
o M. Nakazato, N. Murakami, Y. Data, M. Kojima, H. Matsuo, K. Kangawa, S. Matsukura
o Un rol pentru ghrelin în reglarea centrală a hrănirii
o Nature, 409 (2001), pag. 194-198
o
128.
o Naqvi și Bechara, 2009
o NH Naqvi, A. Bechara
o Insula ascunsă a dependenței: Insula
o Tendințe Neurosci., 32 (2009), pag. 56-67
o
129.
o Neville și colab., 2004
o MJ Neville, EC Johnstone, RT Walton
o Identificarea și caracterizarea ANKK1: o nouă genă kinază strâns legată de DRD2 pe banda cromozomilor 11q23.1
Hum. Mutat., 23 (2004), pag. 540-545
o
130.
o Nirenberg și Waters, 2006
o MJ Nirenberg, C. Waters
o Consumul compulsiv și creșterea în greutate asociată cu utilizarea de agoniști ai dopaminei
o Mov. Dezord., 21 (2006), pag. 524-529
o
131.
o Noble, 2000
o EP Noble
o Addiction și procesul său de recompensă prin polimorfisme ale genei receptorului dopaminic D2: O revizuire
o Eur. Psihiatrie, 15 (2000), pp. 79-89
o
132.
o Noble și colab., 1993
• EP Noble, K. Blum, ME Khalsa, T. Ritchie, A. Montgomery, RC Wood, RJ Fitch, T. Ozkaragoz, PJ Sheridan, MD Anglin și colab.
o Asocierea alilică a genei receptorului D2 cu dopamina cu dependența de cocaină
o Dependența de alcool de droguri, 33 (1993), pp. 271-285
o
133.
o Noble și colab., 2000
o EP Noble, X. Zhang, TL Ritchie, RS Sparkes
o Haplotipuri la locusul DRD2 și alcoolism sever
o Am. J. Med. Genet., 96 (2000), pag. 622-631
o
134.
o O'Connor și colab., 2008
o DB O'Connor, F. Jones, M. Conner, B. McMillan, E. Ferguson
o Efectele complicațiilor zilnice și stilul alimentar asupra comportamentului alimentar
o Health Psychol., 27 (1, Suppl) (2008), pag. S20-S31
o
135.
o O'Doherty și colab., 2002
o JP O'Doherty, R. Deichmann, HD Critchley, RJ Dolan
o Răspunsuri neuronale în timpul anticipării unei recompense primordiale de gust
o Neuron, 33 (2002), pag. 815-826
o
136.
o O'Rahilly, 2009
o S. O'Rahilly
o Genetica umană luminează căile spre bolile metabolice
o Nature, 462 (2009), pag. 307-314
o
137.
o Oswald și colab., 2010
o KD Oswald, DL Murdaugh, VL King, MM Boggiano
o Motivația pentru hrană gustoasă, în ciuda consecințelor unui model animal de hrănire
o Int. J. Eat. Dizord. (2010) http://dx.doi.org/10.1002/eat.20808 în presă. Publicat online februarie 22, 2010
o
138.
o Park și Carr, 1998
o TH Park, KD Carr
o Modele neuroanatomice de imunoreactivitate asemănătoare fosului induse de o masă gustabilă și mediu pereche de masă la șobolanii tratați cu ser fiziologic și cu naltrexonă
o Brain Res., 805 (1998), pag. 169-180
o
139.
o Peciña și Berridge, 2005
S. S. Peciña, KC Berridge
o Punct fierbinte hedonian în coajă nucleu accumbens: unde mu-opioidele provoacă un impact hedonic crescut al dulceții?
o J. Neurosci., 25 (2005), pag. 11777-11786
o
140.
o Peciña și colab., 2006a
S. S. Peciña, J. Schulkin, KC Berridge
o Factorul de eliberare a corticotropinei Nucleus accumbens crește motivația declanșată de stimulent pentru recompensa de zaharoză: Efecte paradoxale stimulative pozitive în stres?
o BMC Biol., 4 (2006), p. 8
o
141.
o Peciña și colab., 2006b
S. S. Peciña, KS Smith, KC Berridge
o Puncte fierbinți hedonice în creier
o Neuroscientist, 12 (2006), pp. 500-511
o
142.
o Pecoraro și colab., 2004
o N. Pecoraro, F. Reyes, F. Gomez, A. Bhargava, MF Dallman
o Stresul cronic stimulează hrănirea gustoasă, care reduce semnele de stres: Feedforward și efectele de feedback ale stresului cronic
o Endocrinologie, 145 (2004), pag. 3754-3762
o
143.
o Pelchat și colab., 2004
o ML Pelchat, A. Johnson, R. Chan, J. Valdez, JD Ragland
o Imagini ale dorintei: activarea alimentelor-craving in timpul fMRI
o Neuroimage, 23 (2004), pag. 1486-1493
o
144.
o Pelleymounter și colab., 1995
o MA Pelleymounter, MJ Cullen, MB Baker, R. Hecht, D. Winters, T. Boone, F. Collins
o Efectele produsului genei obeze asupra reglării greutății corporale la șoareci ob / ob
o Știință, 269 (1995), pag. 540-543
o
145.
o Pelloux și colab., 2007
o Y. Pelloux, BJ Everitt, A. Dickinson
o Medicament compulsiv care caută șobolani sub pedeapsă: Efectele istoriei consumului de droguri
o Psychopharmacology (Berl.), 194 (2007), pag. 127-137
o
146.
o Perello și colab., 2010
o M. Perello, I. Sakata, S. Birnbaum, JC Chuang, S. Osborne-Lawrence, SA Rovinsky, J. Woloszyn, M. Yanagisawa, M. Lutter, JM Zigman
o Ghrelin mărește valoarea de recompensă a dietei bogate în grăsimi într-o manieră dependentă de orexină
o Biol. Psihiatrie, 67 (2010), pp. 880-886
o
147.
o Petrovich și colab., 2009
o GD Petrovich, CA Ross, P. Mody, PC Olanda, M. Gallagher
o Amigdala centrală, dar nu bazolaterală, este esențială pentru controlul hrănirii prin indiciile aversive învățate
o J. Neurosci., 29 (2009), pag. 15205-15212
o
148.
o Pfaffly și colab., 2010
J. Pfaffly, M. Michaelides, GJ Wang, JE Pessin, ND Volkow, PK Thanos
o Leptina mărește legarea receptorilor de dopamină striatală D2 la șoarecii obezi cu deficit de leptină (ob / ob)
o Synapse, 64 (2010), pag. 503-510
o
149.
o Puhl și colab., 2008
o RM Puhl, CA Moss-Racusin, MB Schwartz, KD Brownell
o Stigmatizarea în greutate și reducerea părtinilor: Perspectivele adulților supraponderali și obezi
o Educație pentru sănătate. Res., 23 (2008), pag. 347-358
o
150.
o Rada et al., 2010
o P. Rada, ME Bocarsly, JR Barson, BG Hoebel, SF Leibowitz
o Reducerea dopaminei accumbens la șobolanii Sprague-Dawley predispuși la o ouă alimentară bogată în grăsimi
o Physiol. Behav., 101 (2010), pag. 394-400
o
151.
o Ritchie și Noble, 2003
o T. Ritchie, EP Noble
o Asocierea a șapte polimorfisme ale genei receptorului de dopamină D2 cu caracteristici de legare a receptorilor creierului
o Neurochem. Res., 28 (2003), pag. 73-82
o
152.
o Roberto și colab., 2010
o M. Roberto, MT Cruz, NW Gilpin, V. Sabino, P. Schweitzer, M. Bajo, P. Cottone, SG Madamba, DG Stouffer, EP Zorrilla et al.
o Eliberarea acidului gamma-aminobutiric indusă de factorul de eliberare a corticotropinei joacă un rol-cheie în dependența de alcool
o Biol. Psihiatrie, 67 (2010), pp. 831-839
o
153.
o Roitman și colab., 2004
o MF Roitman, GD Stuber, PE Phillips, RM Wightman, RM Carelli
o Dopamina funcționează ca modulator secundar al căutării alimentelor
o J. Neurosci., 24 (2004), pag. 1265-1271
o
154.
o Roitman și colab., 2008
o MF Roitman, RA Wheeler, RM Wightman, RM Carelli
o Răspunsurile chimice în timp real în nucleul accumbens diferențiază stimulii recompensați și aversivi
o Nat. Neurosci., 11 (2008), pag. 1376-1377
o
155.
o Rolls, 2008
o ET Rolls
o Funcțiile cortexului orbitofrontal și cingular pregenual în gust, olfacție, apetit și emoție
o Acta Physiol. Hung, 95 (2008), pag. 131-164
o
156.
o Rolls, 2010
o ET Rolls
o Gust, olfactiv și alimente textură de procesare de recompensă în creier și obezitate
o Int. J. Obes. (Londra) (2010) http://dx.doi.org/10.1038/ijo.2010.155 în presă. Publicat online august 3, 2010
o
157.
o Rolls și colab., 1983
o ET Rolls, BJ Rolls, EA Rowe
o Satisfacție specifică senzorilor și motivării pentru vederea și gustul alimentelor și apei la om
o Physiol. Behav., 30 (1983), pag. 185-192
o
158.
o Roseberry și colab., 2007
o AG Roseberry, T. Painter, GP Mark, JT Williams
o Depozitele de dopamină somatodendritice veziculare scăzute la șoarecii cu deficit de leptină
o J. Neurosci., 27 (2007), pag. 7021-7027
o
159.
o Rothemund și colab., 2007
o Y. Rothemund, C. Preuschhof, G. Bohner, HC Bauknecht, R. Klingebiel, H. Flor, BF Klapp
o Activarea diferențială a striatului dorsal prin stimuli vizibili de calorii vizuale cu calorii la persoanele obeze
o Neuroimage, 37 (2007), pag. 410-421
o
160.
o Salas și colab., 2010
R. Salas, P. Baldwin, M. de Biasi, PR Montague
o Răspunsuri BOLD la erorile de predicție a recompensei negative în habenula umană
o Față. Zumzet. Neurosci., 4 (2010), p. 36
o
161.
o Saper și colab., 2002
o CB Saper, TC Chou, JK Elmquist
o Necesitatea de hrănire: controlul homeostatic și hedonic al mâncării
o Neuron, 36 (2002), pag. 199-211
o
162.
o Saunders, 2001
o R. Saunders
o Alimentație compulsivă și intervenție chirurgicală bypass gastric: Ce are de-a face foamea cu ea?
o Obes. Surg., 11 (2001), pag. 757-761
o
163.
o Scarpace și colab., 2010
o PJ Scarpace, M. Matheny, Y. Zhang
o Rularea pe roți elimină preferința înaltă a grăsimilor și sporește semnalarea leptinei în zona tegmentală ventrală
o Physiol. Behav., 100 (2010), pag. 173-179
o
164.
o Schiltz și colab., 2007
o CA Schiltz, QZ Bremer, CF Landry, AE Kelley
o Indicațiile asociate cu alimentele modifică conectivitatea funcțională a creierului prealabil, evaluată cu expresia imediată a genei timpurii și a proenexfalinei
o BMC Biol., 5 (2007), p. 16
o
165.
o Schur și colab., 2009
o EA Schur, NM Kleinhans, J. Goldberg, D. Buchwald, MW Schwartz, K. Maravilla
o Activarea în reglarea energiei creierului și centrele de recompense prin indicații alimentare variază în funcție de alegerea stimulului vizual
o Int. J. Obes. (Lond.), 33 (2009), pag. 653-661
o
166.
o Sclafani și colab., 1998
o A. Sclafani, RJ Bodnar, AR Delamater
o Farmacologia preferințelor condiționate de alimente
o Apetit, 31 (1998), pag. 406
o
167.
o Sescousse și colab., 2010
o G. Sescousse, J. Redouté, JC Dreher
o Arhitectura codificării valorii de recompensă în cortexul orbitofrontal uman
o J. Neurosci., 30 (2010), pag. 13095-13104
o
168.
o Shomaker și colab., 2010
LB Shomaker, M. Tanofsky-Kraff, JM Zocca, A. Courville, M. Kozlosky, KM Columbo, LE Wolkoff, SM Brady, MK Crocker, AH Ali și colab.
o Alimentație în absența foamei la adolescenți: Admisie după o masă de masă mare comparativ cu cea după o masă standardizată
o Am. J. Clin. Nutr., 92 (2010), pag. 697-703
o
169.
o Simmons și colab., 2005
o WK Simmons, A. Martin, LW Barsalou
o Imaginile alimentelor apetisante activează cortexul gustativ pentru gust și recompensă
o Cereb. Cortex, 15 (2005), pag. 1602-1608
o
170.
o Mic, 2010
o DM Mic
o Reprezentarea gustului în insula umană
o Bract Struct. Funcție, 214 (2010), pag. 551-561
o
171.
o Small et al., 2003
o DM Mic, M. Jones-Gotman, A. Dagher
o Eliberarea indusă de hrănire a dopaminei în striatul dorsal se corelează cu evaluările plăcute ale meselor la voluntarii sănătoși
o Neuroimage, 19 (2003), pag. 1709-1715
o
172.
o Smith și Berridge, 2007
o KS Smith, KC Berridge
Circuitul limbic opioid pentru recompensă: interacțiunea dintre hotspoturile hedonice ale nucleului accumbens și ventralul pallidum
o J. Neurosci., 27 (2007), pag. 1594-1605
o
173.
o Söderpalm și Berridge, 2000
o AH Söderpalm, KC Berridge
o Consumul de alimente după diazepam, morfină sau muscimol: Microinjecții în nucleul accumbens shell
o Pharmacol. Biochem. Behav., 66 (2000), pag. 429-434
o
174.
o Stice și colab., 2008a
o E. Stice, S. Spoor, C. Bohon, DM Small
o Relația dintre obezitate și răspunsul striatal blunt la alimente este moderată de alela TaqIA A1
o Știință, 322 (2008), pag. 449-452
o
175.
o Stice și colab., 2008b
o E. Stice, S. Spoor, C. Bohon, MG Veldhuizen, DM Small
o Relația dintre recompensa de la aportul alimentar și consumul anticipat de alimente pentru obezitate: un studiu de imagistică prin rezonanță magnetică funcțională
o J. Abnorm. Psychol., 117 (2008), pag. 924-935
o
176.
o Stice și colab., 2010a
o E. Stice, S. Yokum, K. Blum, C. Bohon
o Creșterea în greutate este asociată cu un răspuns redus striatal la alimentele gustoase
o J. Neurosci., 30 (2010), pag. 13105-13109
o
177.
o Stice și colab., 2010b
o E. Stice, S. Yokum, C. Bohon, N. Marti, A. Smolen
o Răspunsul la circuitul de recompensă alimentelor prezice creșteri viitoare ale masei corporale: Efectele moderne ale DRD2 și DRD4
o Neuroimage, 50 (2010), pag. 1618-1625
o
178.
o Stoeckel, 2010
o Stoeckel, LE (2010). Principiul Goldilocks al obezității. Scientific American. Iunie 8, 2010. http://www.scientificamerican.com/article.cfm?id=the-goldilocks-principle-obesity.
o
179.
o Stratford și Kelley, 1997
o TR Stratford, AE Kelley
o GABA în cochilia nucleului accumbens participă la reglementarea centrală a comportamentului alimentar
o J. Neurosci., 17 (1997), pag. 4434-4440
o
180.
o Stratford și Kelley, 1999
o TR Stratford, AE Kelley
o Dovada relației funcționale între coaja nucleului accumbens și hipotalamus lateral care subordonează controlul comportamentului alimentar
o J. Neurosci., 19 (1999), pag. 11040-11048
o
181.
o Suarez și Gallup, 1981
o SD Suarez, GGJ Gallup
o O analiză etologică a comportamentului în câmp deschis la șobolani și șoareci
o Învățați. Motiv., 12 (1981), pag. 342-363
o
182.
o Sunday și colab., 1983
o duminică SR, SA Sanders, G. Collier
o Felurile de palatabilitate și de masă
o Physiol. Behav., 30 (1983), pag. 915-918
o
183.
o Swinburn și colab., 2009
o B. Swinburn, G. Sacks, E. Ravussin
o Cresterea aprovizionarii cu alimente este mai mult decat suficienta pentru a explica epidemia SUA de obezitate
o Am. J. Clin. Nutr., 90 (2009), pag. 1453-1456
o
184.
o Taha și câmpurile, 2005
o SA Taha, domenii HL
o Codificarea gustului și comportamentelor apetisante de către populațiile distincte neuronale din nucleul accumbens
o J. Neurosci., 25 (2005), pag. 1193-1202
o
185.
o Taha și colab., 2009
o SA Taha, Y. Katsuura, D. Noorvash, A. Seroussi, HL Fields
Circuitele convergente, nu seriale, striate și pallide regulează consumul de alimente induse de opioide
o Neuroștiință, 161 (2009), p. 718-733
o
186.
o Teegarden și Bale, 2007
o SL Teegarden, TL Bale
o Scăderea preferinței dietetice produce o emoționalitate crescută și un risc pentru recădere prin dietă
o Biol. Psihiatrie, 61 (2007), pp. 1021-1029
o
187.
o Teegarden și colab., 2009
o SL Teegarden, AN Scott, Baletul TL
o Expunerea timpurie la o dietă bogată în grăsimi promovează schimbări pe termen lung în preferințele dietetice și în semnalizarea recompensării centrale
o Neuroștiință, 162 (2009), p. 924-932
o
188.
o Thanos și colab., 2008
o PK Thanos, M. Michaelides, YK Piyis, GJ Wang, ND Volkow
o Restricția la hrană crește în mod semnificativ receptorul dopaminic D2 (D2R) într-un model de obezitate de șobolan, evaluat cu imaginarul in-vivo muPET (racloprida [11C]) și autoradiografia in vitro ([3H] spiperonă
o Synapse, 62 (2008), pag. 50-61
o
189.
o Thompson și Swanson, 2010
o RH Thompson, LW Swanson
o Analiza conectivității structurate pe baza ipotezei sprijină rețeaua pe modelul ierarhic al arhitecturii creierului
o Proc. Natl. Acad. Sci. SUA, 107 (2010), pag. 15235-15239
o
190.
o Vanderschuren și Everitt, 2004
o LJ Vanderschuren, BJ Everitt
o Căutarea de droguri devine compulsivă după administrarea prelungită de cocaină
o Știință, 305 (2004), pag. 1017-1019
o
191.
o Vendruscolo și colab., 2010a
LF Vendruscolo, AB Gueye, M. Darnaudéry, SH Ahmed, M. Cador
o Consumul excesiv de zahăr în timpul adolescenței modifică selectiv motivația și răsplata funcției la șobolanii adulți
o PLoS ONE, 5 (2010), pag. e9296 http://dx.doi.org/10.1371/journal.pone.0009296
o
192.
o Vendruscolo și colab., 2010b
o LF Vendruscolo, AB Gueye, JC Vendruscolo, KJ Clemens, P. Mormède, M. Darnaudéry, M. Cador
o Consumul redus de alcool la șobolanii adulți expuși la zaharoză în timpul adolescenței
o Neurofarmacologie, 59 (2010), pag. 388-394
o
193.
o Volkow și O'Brien, 2007
o ND Volkow, CP O'Brien
o Probleme pentru DSM-V: Ar trebui inclusă obezitatea ca o tulburare a creierului?
o Am. J. Psihiatrie, 164 (2007), pag. 708-710
o
194.
o Volkow și Wise, 2005
o ND Volkow, RA Wise
o Cum ne poate ajuta dependența de droguri să înțelegem obezitatea?
o Nat. Neurosci., 8 (2005), pag. 555-560
o
195.
o Volkow și colab., 2009
ND Volkow, GJ Wang, F. Telang, JS Fowler, RZ Goldstein, N. Alia-Klein, J. Logan, C. Wong, PK Thanos, Y. Ma, K. Pradhan
o Asociere inversă între IMC și activitatea metabolică prefrontală la adulții sănătoși
o Obezitatea (argintiu de argint), 17 (2009), pag. 60-65
o
196.
o Vucetic și Reyes, 2010
o Z. Vucetic, TM Reyes
o Circuite dopaminergice centrale care controlează consumul de alimente și recompensa: implicații pentru reglementarea obezității
o Wiley Interdiscip. Rev. Syst. Biol. Med., 2 (2010), pag. 577-593
o
197.
o Wang și colab., 2001
o GJ Wang, ND Volkow, J. Logan, NR Pappas, CT Wong, W. Zhu, N. Netusil, JS Fowler
o Dopamina creierului și obezitatea
o Lancet, 357 (2001), pag. 354-357
o
198.
o Wang și colab., 2002
o GJ Wang, ND Volkow, JS Fowler
o Rolul dopaminei în motivația pentru alimentație la om: Implicații pentru obezitate
o Expert Opin. Ther. Ținte, 6 (2002), pag. 601-609
o
199.
o Wang și colab., 2004a
GJ Wang, ND Volkow, F. Telang, M. Jayne, J. Ma, M. Rao, W. Zhu, CT Wong, NR Pappas, A. Geliebter, JS Fowler
o Expunerea la stimuli alimentari apetisanți activează în mod semnificativ creierul uman
o Neuroimage, 21 (2004), pag. 1790-1797
o
200.
o Wang și colab., 2004b
o GJ Wang, ND Volkow, PK Thanos, JS Fowler
o Similaritatea dintre obezitate și dependența de droguri, evaluată prin imagistica neurofuncțională: o revizuire a conceptului
o J. Addict. Dis., 23 (2004), pag. 39-53
o
201.
o Wang și colab., 2008
o GJ Wang, D. Tomasi, W. Backus, R. Wang, F. Telang, A. Geliebter, J. Korner, A. Bauman, JS Fowler, PK Thanos, ND Volkow
o Distensia gastrică activează circuitele de sațietate în creierul uman
o Neuroimage, 39 (2008), pag. 1824-1831
o
202.
o Wassum și colab., 2009
o KM Wassum, SB Ostlund, NT Maidment, BW Balleine
o Circuitele opioide distincte determină gustul și dorința de a recompensa evenimentele
o Proc. Natl. Acad. Sci. SUA, 106 (2009), pag. 12512-12517
o
203.
o Wassum și colab., 2011
o KM Wassum, IC Cely, BW Balleine, NT Maidment
o μ-Activarea receptorilor opioizi în amigdala bazolaterală mediază învățarea creșterilor dar nu scade valoarea stimulativă a unei recompense alimentare
o J. Neurosci., 31 (2011), pag. 1591-1599
o
204.
o Wilkinson și Peele, 1962
o HA Wilkinson, TL Peele
o Modificarea autostimulării intracraniene prin satietate a foamei
o Am. J. Physiol., 203 (1962), pag. 537-540
o
205.
o Will și colab., 2003
o MJ Will, EB Franzblau, AE Kelley
o Nucleus accumbens mu-opioide reglează aportul unei diete bogate în grăsimi prin activarea unei rețele creierului distribuite
o J. Neurosci., 23 (2003), pag. 2882-2888
o
206.
o Wilson și colab., 2008
o ME Wilson, J. Fisher, A. Fischer, V. Lee, RB Harris, TJ Bartness
o Cuantificarea aportului alimentar la maimuțele adăpostite social: efectele sociale asupra consumului caloric
o Physiol. Behav., 94 (2008), pag. 586-594
o Articolul PDF (553 K)
Vedeți înregistrarea în Scopus
| Citată de Scopus (22)
207.
o Yurcisin și colab., 2009
o BM Yurcisin, MM Gaddor, EJ DeMaria
o Obezitate și chirurgie bariatrică
o Clin. Chest Med., 30 (2009), pag. 539-553, ix
o
208.
o Zhang și colab., 1998
o M. Zhang, BA Gosnell, AE Kelley
o Consumul de alimente bogate în grăsimi este sporit selectiv prin stimularea mu receptorilor opioizi în nucleul accumbens
J. Pharmacol. Exp. Ther., 285 (1998), pag. 908-914
o Vizualizați înregistrarea în Scopus
| Citată de Scopus (148)
209.
o Zheng și colab., 2007
o H. Zheng, LM Patterson, HR Berthoud
Semnalele de tip Orexin în zona tegmentală ventrală sunt necesare pentru apetitul cu conținut ridicat de grăsimi indus de stimularea opioidă a nucleului accumbens
o J. Neurosci., 27 (2007), pag. 11075-11082
o Vizualizați înregistrarea în Scopus
| Citată de Scopus (64)
210.
o Zheng și colab., 2009
o H. Zheng, NR Lenard, AC Shin, HR Berthoud
o Controlul apetitului și reglementarea echilibrului energetic în lumea modernă: creierul condus de recompensă elimină semnalele de retenție
o Int. J. Obes. (Lond.), 33 (Suppl 2) (2009), pag. S8-S13
o Vizualizați înregistrarea în Scopus
| Citată de Scopus (34)