Rapoarte științifice volum 9, Numarul articolului: 16918 (2019)
Abstract
Consumul excesiv de zaharoză provoacă o poftă asemănătoare dependenței, care poate susține epidemia de obezitate. Opioidele și dopamina mediază efectele recompense ale drogurilor de abuz și ale recompenselor naturale de la stimuli, cum ar fi alimentele gustoase. Am investigat efectele zaharozei folosind imagistica PET cu [11C]carfentanil (agonist al receptorilor μ-opioizi) și [11C]raclopridă (antagonist al receptorului dopaminergic D2/3) la șapte femele de porci Göttingen anesteziați. Apoi le-am dat porcilor mini-porci acces la soluția de zaharoză timp de o oră în 12 zile consecutive și am efectuat din nou imagistica la 24 de ore după accesul final de zaharoză. Într-un eșantion mai mic de cinci porci mini, am efectuat un alt [11C]carfentanil ședință PET după prima expunere la zaharoză. Am calculat potențialele de legare în funcție de voxel (BPND) folosind cerebelul ca regiune de legare nedeplasabilă, a analizat diferențele cu cartografiere statistică neparametrică și a efectuat o analiză regională. După 12 zile de acces la zaharoză, BPND dintre ambii trasori au scăzut semnificativ în striat, nucleus accumbens, talamus, amigdală, cortex cingulat și cortex prefrontal, în concordanță cu reglarea în jos a densităților receptorilor. După o singură expunere la zaharoză, am constatat o legare scăzută a [11C]carfentanil în nucleul accumbens și cortexul cingulat, în concordanță cu eliberarea de opioide. Disponibilitatea mai scăzută a receptorilor opioizi și dopaminergici poate explica potențialul de dependență asociat cu aportul de zaharoză.
Introducere
Cinci la sută din populația lumii este obeză clinic1. Ca semn distinctiv al sindromului metabolic, obezitatea este asociată cu diabet de tip 2, boli cardiovasculare, probleme respiratorii și risc de depresie și posibil demență.2. Consumul crescut de alimente cu densitate energetică a exagerat distincția fiziologică dintre foamea homeostatică care urmează privării de hrană și foamea hedonică, sau „pofta”, care apare în absența deprivării.3,4. Deoarece regularea homeostatică singură nu poate explica creșterea actuală a obezității, este obligatoriu să se testeze efectul asupra mecanismelor creierului de recompensă și plăcere al proprietăților de dependență ale alimentelor foarte gustoase.
Consumul de zaharoză este asociat cu obezitatea, iar zaharoza este considerată din ce în ce mai mult o substanță care dă dependență5. Unele constatări sunt în contradicție cu această afirmație din cauza dificultăților de a separa consumul de alimente negustătoare de răspunsurile alimentare hedonice și de a determina ingredientul care provoacă dependență din alimentele procesate, precum și diferitele mecanisme prin care alimentele modifică circuitele creierului prin căi naturale.6. Cu toate acestea, în contexte specifice, aportul de zaharoză induce recompensă și dorință, comparabile ca amploare cu cele induse de drogurile care creează dependență, care duc la supraconsum și eventual obezitate.6,7.
Foamea este asociată cu „dorința”, care este strâns legată de efectele neurotransmisiei dopaminergice într-o serie de circumstanțe de recompensă.8, dar rămâne neclar modul în care acțiunea dopaminei (DA) este modulată ca răspuns la alimentația compulsivă. Consumul de alimente gustoase este legat de „apreciere”, mediat în primul rând de sistemul opioid endogen, în special de receptorul μ-opioid (μOR)9,10, care poate promova consumul excesiv atunci când este dereglementat. În prezentul raport, testăm afirmația că zaharoza duce la eliberarea de opioide și dopamină care scade disponibilitatea receptorilor μOR și DA D2/3. Disponibilitatea este un indice al numărului de receptori neocupați disponibili pentru legarea trasorului și, în principiu, nu face distincție între ocuparea ligandului și densitatea receptorului11.
Debutul alimentației compulsive depinde de mai mulți factori, iar studiile cauzale la oameni ridică probleme etice. Prin urmare, majoritatea studiilor se concentrează pe comportamentul de hrănire la șobolani12. Deși șobolanii au un „dinte dulce”, mecanismele lor homeostatice importante pentru creșterea în greutate, metabolismul și tipul de acumulare de grăsime, diferă semnificativ de cele ale oamenilor. Miniporcul Göttingen este un animal omnivor mare, cu un creier girencefalic bine dezvoltat, care poate fi fotografiat la o rezoluție suficientă. Regiunile sale corticale subcorticale și prefrontale bine definite13 permite o traducere mai directă la funcția creierului uman. Aici, utilizăm tomografia cu emisie de pozitroni (PET) pentru a testa in vivo Disponibilitatea μOR și DA D2/3 într-un model de miniporc de expunere subcronică la zaharoză. Într-un eșantion mai mic, am investigat efectele imediate asupra ocupării μOR după prima expunere la zaharoză. În cele din urmă, am testat relația dintre modificările disponibilității receptorilor celor doi trasori.
REZULTATE
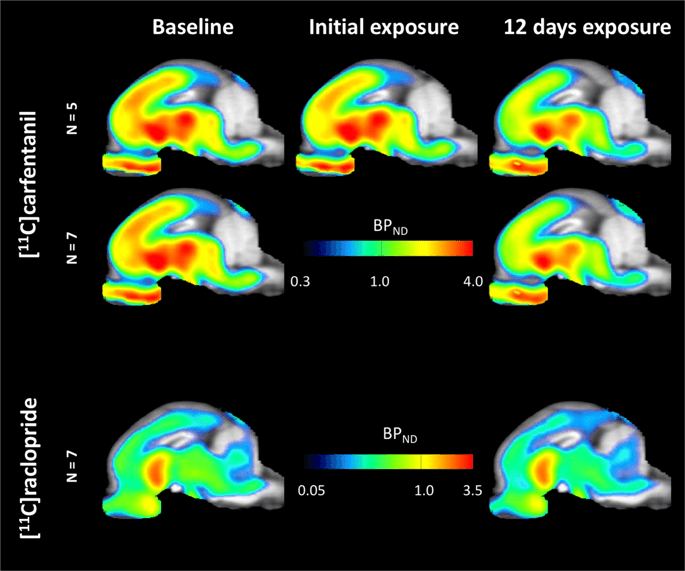
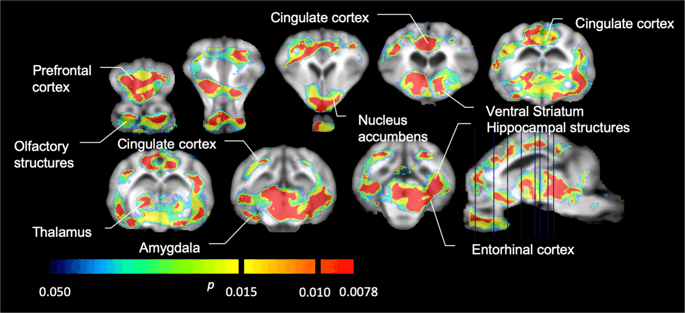
Hărți parametrice medii ale [11C] carfentanil și [11Potențialul de legare a raclopridei (BPND) sunt prezentate în fig. 1. Pentru a analiza modificările care apar după prima expunere la zaharoză la cinci porci mini, comparativ cu valoarea inițială și o zi după cei 12th Accesul zaharozei la șapte porci mini-porci comparativ cu valoarea inițială, am folosit teoria permutării și analiza întregului creier nerestricționată la nivel regional, metoda preferată pentru mostre de această dimensiune14.
Potențial mediu de legare nedeplasabil în funcție de voxel (BPND) hărți suprapuse imaginilor RMN în vedere sagitală. Datele sunt prezentate pentru [11C] carfentanil BPND dintre cei 5 porci minii fotografiați la momentul inițial, după expunerea inițială la zaharoză și după 12 zile de expunere la zaharoză (rândul de sus). [11C] carfentanil BPND din toți cei 7 miniporci fotografiați la momentul inițial și după 12 zile de acces la zaharoză sunt prezentați în rândul din mijloc. [11C] racloprid BPND din toți cei 7 miniporci fotografiați la momentul inițial și după 12 zile de acces la zaharoză sunt afișați în rândul de jos. Rețineți că scara de culori este exponențială pentru a evidenția [11C] racloprid BPND în regiunile extrastriatale.
Expunerea inițială la zaharoză
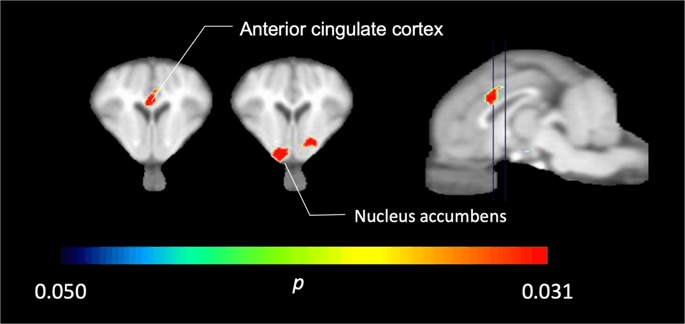
În cei cinci porci minii fotografiați cu [11C] carfentanil la momentul inițial și imediat după prima expunere la zaharoză, am găsit o legare semnificativ redusă a trasorului în cortexul cingulat anterior și nucleul accumbens ca răspuns la zaharoză, prezentată în culoare în Fig. 2, indicând p < 0.05. Am detectat o scădere cu până la 14% a legăturii trasorului în ambele zone în comparație cu valoarea inițială.
Scăderi semnificative ale [11C] carfentanil BPND după prima expunere la apă cu zaharoză comparativ cu valoarea inițială (n = 5). Doar voxeli cu (p < 0.05) scăderi sunt prezentate ca zone colorate proiectate pe tăieturi RMN ponderate T1 la nivelul cortexului cingulat anterior (stânga) și nucleului accumbens (mijloc) dintr-un atlas stereotaxic al creierului miniporc. Rețineți că nivelul maxim de semnificație care poate fi atins cu 5 animale este 2-5 ≈ 0.031 (vezi bara de culori). Datele sunt prezentate pe secțiunile coronale ale creierului de porc la nivelurile indicate pe imaginea sagitală (dreapta).
12 zile de acces la zaharoză
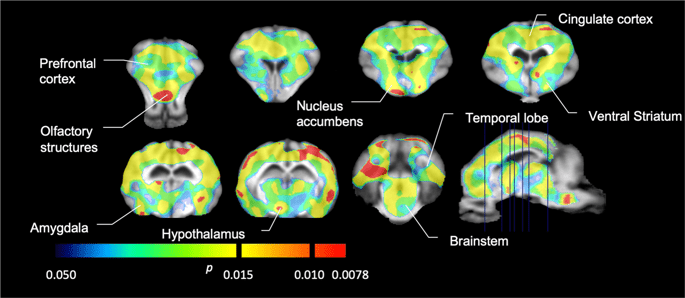
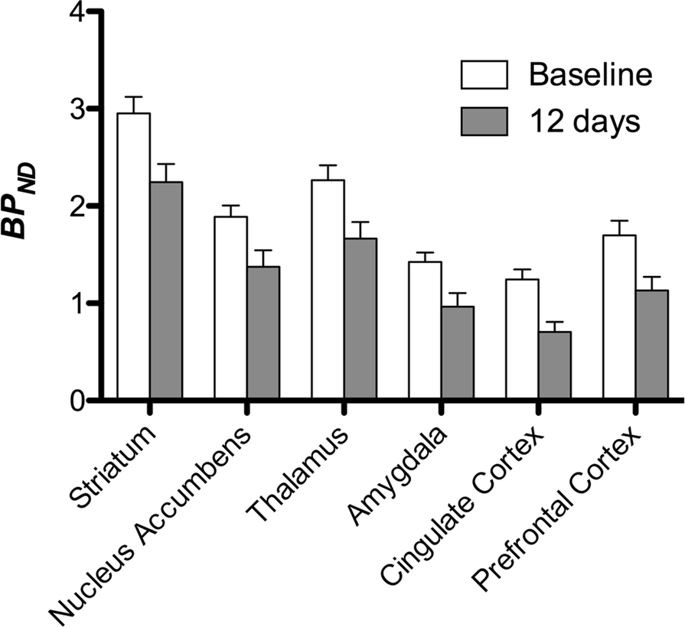
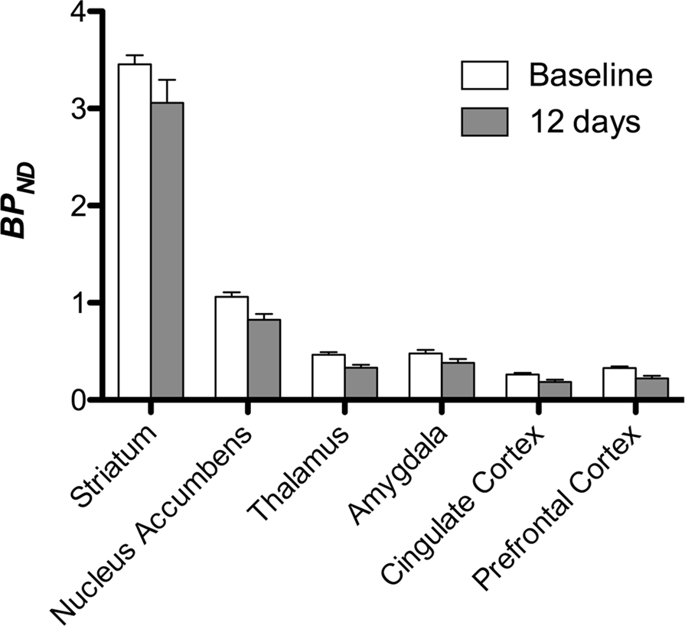
Apoi am efectuat analiza a șapte porci minii fotografiați cu [11C]carfentanil la momentul inițial și după 12 zile de acces la zaharoză și a constatat o legare semnificativ redusă a trasorului la animalele expuse la zaharoză în comparație cu valoarea inițială. Cele mai puternic afectate regiuni sunt prezentate cu roșu în Fig. 3 (p < 0.01) și includ părți ale structurilor olfactive, nucleul accumbens/striatul ventral și cortexul/lobul temporal, urmate de zonele prezentate în galben (p < 0.015) care includ părți ale cortexului prefrontal, cortexului cingulat, amigdală și trunchiului cerebral . Pentru a obține BPND valorile și evaluăm modificarea procentuală, am efectuat o analiză regională și am obținut valori medii în fiecare regiune la momentul inițial și după consumul de zaharoză (Fig. 4).
Scăderi semnificative ale [11Potențialul de legare a C]carfentanilului (BPND) între momentul inițial și după 12 zile de expunere la apă cu zaharoză (n = 7). Voxelii cu (p < 0.05) scăderile sunt arătate ca zone colorate proiectate pe tăieturi RMN ponderate T1 dintr-un atlas stereotaxic al creierului de miniporci. Datele sunt prezentate pe secțiuni coronale ale creierului la nivelurile indicate pe imaginea sagitală (dreapta jos). Rețineți că nivelul maxim de semnificație care poate fi atins cu 7 animale este 2-7 ≈ 0.0078 (vezi bara de culori).
Noi am folosit [11C]racloprida ca trasor al receptorilor DA D2/3 în regiunile creierului striat și extrastriat la porci mini la momentul inițial și după 12 zile de acces la zaharoză (Fig. 1). Am găsit o scădere a legării trasorului la animalele expuse la zaharoză, în comparație cu valoarea inițială cu efecte cele mai mari (p < 0.01) în zonele cortexului prefrontal, nucleus accumbens/striatul ventral, cortexul cingulat, amigdala, talamusul, mezencefalul, regiunile hipocampului și zonele olfactive. (Smochin. 5). Datele din analiza regională sunt prezentate în Fig. 6.
Scăderi semnificative ale [11Potențialul de legare a raclopridei (BPND) între momentul inițial și după 12 zile de expunere la apă cu zaharoză (n = 7). Voxelii cu (p < 0.05) scăderile sunt arătate ca zone colorate proiectate pe tăieturi RMN ponderate T1 dintr-un atlas stereotaxic al creierului de miniporci. Datele sunt prezentate pe secțiunile coronale ale creierului de porc la nivelurile indicate pe imaginea sagitală (dreapta jos). Rețineți că nivelul maxim de semnificație care poate fi atins cu 7 animale este 2-7 ≈ 0.0078 (vezi bara de culori).
Corelații între [11C] raclopridă și [11C]carfentanil date
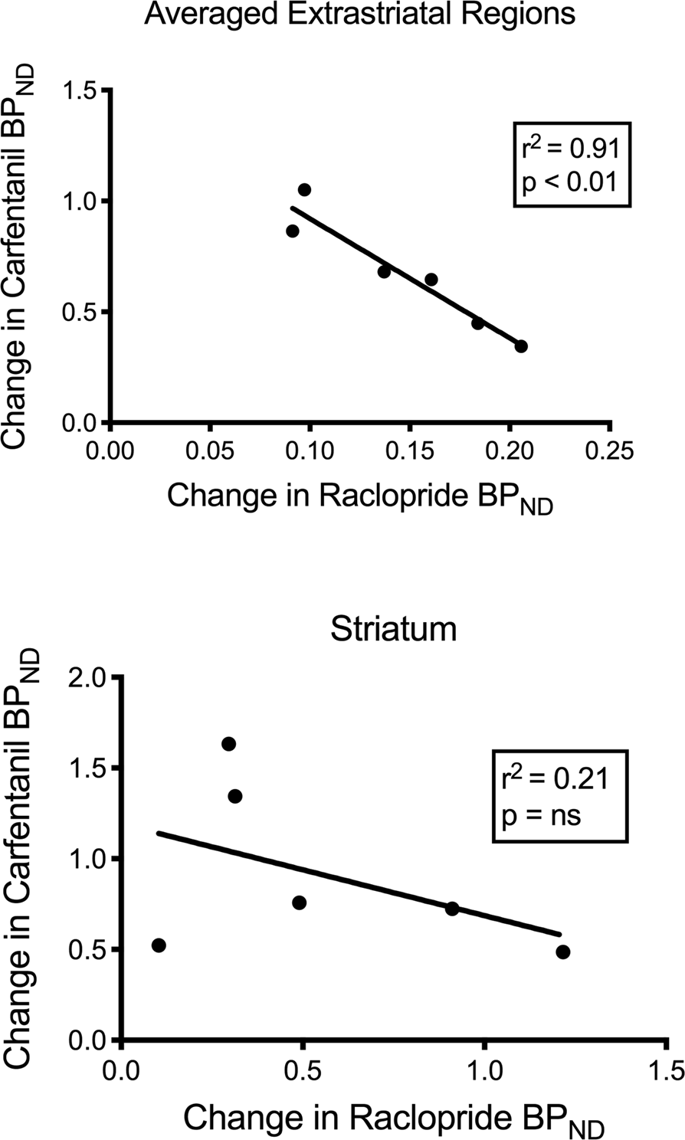
Am testat potențiala corelație între [11C] raclopridă și [11Valorile C]carfentanilului BPND în regiunile striatale și non-striatale la porci mini la momentul inițial și după 12 zile de aport de zaharoză, fără asocieri observate. Apoi am testat dacă scăderile legării trasorului au fost corelate și am comparat modificările TAND pentru [11C]raclopridă cu modificările TAND pentru [11C]carfentanil numai la porcii mini care au avut TA mai scăzutăND a ambilor trasori după aportul de zaharoză (n = 6). Am găsit corelații negative semnificative în extrastriatale medie (r2 = 0.91, p < 0.01), dar nu în regiunile striatale (Fig. 7).
Corelații între pre- minus post- scăderi de [11C] raclopridă și [11Potențialele de legare a C]carfentanilului (BPND) la porci mini cu legarea trasorului scăzută după aportul de zaharoză (n = 6). Sunt prezentate date din regiunile extrastriatale medii (sus) și striatum (jos). Coeficientul de determinare (r2) și valorile p sunt afișate pentru fiecare grafic.
Discuție
Am determinat efectele accesului intermitent repetat la zaharoză asupra neurotransmisiei opioidelor și DA în creierul mamiferelor. Longitudinal in vivo Imagistica PET a receptorilor μOR și DA D2/3 a dezvăluit o disponibilitate redusă a receptorilor în întregul circuit de recompensă, inclusiv nucleul accumbens, cortexul prefrontal și cortexul cingulat anterior. Rezultatele demonstrează clar că zaharoza afectează mecanismele de recompensă într-un mod similar cu cel al drogurilor de abuz.
Se știe că aportul de zaharoză ca substanță gustoasă eliberează DA și induce dependență la rozătoare15, cu zaharoza dovedit a fi chiar mai plăcută decât cocaina la rozătoare în anumite contexte. Astfel, rozătoarele lucrează mai intens pentru a obține zaharoză decât cocaina, chiar și în absența lipsei de hrană.5. Cu toate acestea, efectele zaharozei sunt reglate atât de sistemul homeostatic, cât și de circuitele hedonice de recompensă.16,17 care poate media distincția între aspectele nutriționale și hedonice ale acțiunii zaharozei18. Am optat pentru un program de o oră pe zi pentru a promova „bingingul”, deoarece studiile anterioare la șobolani au evidențiat un aport mai mare în prima oră de acces zilnic într-un program intermitent.15,19. Studiile comportamentale ale consumului de alimente vizează adesea animalele cu restricții alimentare, dar designul poate să nu reflecte neapărat aceleași mecanisme neuronale active în obezitate. Porcii din prezentul studiu nu au avut restricții alimentare și au fost hrăniți cu cantitățile obișnuite din dieta lor normală, în plus față de accesul la zaharoză.
Receptorii opioizi (OR) sunt exprimați pe scară largă în creier, în special în structuri cunoscute pentru modularea proceselor de alimentație și de recompensă.20. S-au dovedit a fi importante pentru efectele recompensatoare și recidivante ale cocainei21,22,23,24. Modificările legate de legare au fost, de asemenea, legate de răspunsurile homeostatice la mâncare și de plăcerea asociată cu alimentele gustoase.25. În special, „placerea” alimentelor este legată de sistemul opioid endogen, în special de μOR9,10 în învelișul nucleului accumbens și în pallidum ventral26. Infuziile unui agonist μOR în porțiuni distincte ale nucleului accumbens și pallidum ventral îmbunătățesc puternic comportamentele de „placere”, inclusiv proeminențele limbii și lingerea labelor, în urma aportului crescut de alimente.27,28,29. Alte dovezi pentru semnalizarea opioidelor în procesarea reglării hedoniste provin de la antagoniştii μOR care atenuează consumul de mâncare gustoasă în ambele ad libitum-animale hrănite și alimentate cu restricții, dar cu un efect mai limitat asupra aportului de pelete standard negustoase30,31. La om, antagoniștii μOR scad aportul alimentar pe termen scurt și reduc plăcerea alimentelor gustoase.32,33,34. Semnalizarea opioidelor din amigdala bazolaterală contribuie, de asemenea, la „dorința” de hrană prin modularea căutării recompensei și a valorii stimulative a alimentelor.35.
Cu [11C]carfentanil, am obținut imagini de legare a trasorului care este sensibilă atât la nivelurile de μOR, cât și la eliberarea de către creier a opioidelor endogene.36,37. Am detectat pierderea imediată a disponibilității μOR în zonele nucleului accumbens și ale cortexului cingulat anterior, regiuni specifice ale creierului ale căii recompensei, după consumul inițial de zaharoză de către cinci miniporci, în concordanță cu eliberarea opioidelor endogene. Studiile anterioare au arătat că mâncarea gustoasă poate duce la sentimente de plăcere38 prin stimularea eliberării opioidelor. După 12 zile de acces la zaharoză, am observat o scădere [11Legarea C]carfentanilului, care are mai multe explicații posibile39 inclusiv eliberarea endogenă a opioidelor și legarea la μOR, internalizarea μOR ca urmare a legării crescute a opioidelor și creșterea activării receptorului DA D2/3 care duce la desensibilizarea heterologă a μOR40.
În sprijinul prezentelor constatări, [11Studii cu C]carfentanil la pacienții cu bulimie41, obezitate42,43,44, și tulburarea de alimentație excesivă45, arată o disponibilitate scăzută a receptorilor. Cu toate acestea, acestea sunt afecțiuni cronice, în timp ce porcii mini au primit zaharoză doar timp de 12 zile. Într-un studiu al comportamentului alimentar acut la bărbații sănătoși, hrănirea a condus la o eliberare cerebrală endogenă robustă și pe scară largă, atât în prezența, cât și în absența hedoniei, sugerând că eliberarea de opioide reflectă răspunsuri metabolice și homeostatice, precum și hedonice.25. Acest studiu, împreună cu altul care a făcut imagini pacienților după o masă lichidă cu aromă de ciocolată44, este direct relevant pentru studiul acut pe cinci porci mini după prima expunere la zaharoză, dar este diferit de studiul subcronic de expunere la zaharoză timp de 12 zile, unde disponibilitatea redusă a receptorilor reflectă mai probabil suprastimularea repetată și reglarea concomitentă a μOR.
Cortexul prefrontal este important în luarea deciziilor și atribuirea de valoare articolelor și, prin urmare, μOR din cortexul prefrontal poate fi responsabil pentru evaluarea modificată a proeminenței alimentelor, ceea ce poate crește potențialul de dependență al alimentelor. Am găsit o legare scăzută în cortexul prefrontal, în concordanță cu studiile anterioare care arată că dieta bogată în grăsimi reduce nivelurile de ARNm μOR în cortexul prefrontal.46 și acea perfuzie a unui agonist μOR în cortexul prefrontal crește aportul de alimente dulci47. Din nou, totuși, se pune problema dacă dieta bogată în grăsimi este o afecțiune mai cronică care mediază mai probabil reglarea în jos a receptorului, în comparație cu designul de hrănire cu zaharoză pe termen mai scurt, sugerând eliberarea susținută a opioidelor endogene care înlocuiește carfentanilul trasor legat de μOR. , chiar și după 12 zile de zaharoză.
DA a fost implicat în recompense atât din partea drogurilor, cât și a comportamentului. S-a descoperit că consumul cronic de cocaină inhibă semnalizarea DA48. Nivelurile receptorilor DA D1 și D2/3 sunt modificate de nicotină în creierul de porc49și la primate non-umane cu antecedente de abuz de cocaină50, în concordanță cu reglarea în jos a receptorilor D2/3 din creierul dependenților de cocaină51,52. În ceea ce privește drogurile de abuz, s-a demonstrat că zaharoza reglează receptorii DA D119 și crește eliberarea DA53, întărind rolul DA în „dorință” în raport cu alimentele gustoase. Studiile PET anterioare au demonstrat o scădere a disponibilității receptorilor DA D2/3 striatali în obezitatea morbidă față de greutatea medie54,55, similară ca amploare cu reducerea numărului de pacienți dependenți de droguri56, iar la animale cu modele de obezitate57. În studiile la rozătoare, distrugerea receptorului D2/3 în striat promovează dezvoltarea căutării compulsive de hrană la șobolani cu acces la hrană gustoasă.57.
Observațiile noastre privind scăderea disponibilității receptorilor D2/3 la porc pot indica niveluri crescute de DA ca răspuns la importanța stimulentului asociată cu aportul de zaharoză, deoarece DA este eliberată ca parte a dorinței de droguri de abuz și a altor activități plăcute.52,58,59,60. Deoarece porcii au fost anesteziați în timpul imagisticii și nu au primit zaharoză în 24 de ore, a scăzut D2/3 BPND reflectă mai probabil o reducere a numărului de receptori ca răspuns la creșterea prelungită a eliberării DA la fiecare dintre cele 12 zile de acces la zaharoză. Reducerea poate crește pragurile de recompensă ale creierului, asociate cu reglarea în jos a receptorilor DA D2 striatali. Acest lucru poate explica susceptibilitatea crescută la droguri de abuz observată în studiile anterioare despre șobolanii care consumau exces de zaharoză, ceea ce a dus la sensibilizare încrucișată la cocaină, hiperactivitate după doze mici de amfetamina, consum crescut de alcool atunci când se abțin de la zaharoză și toleranță la efectele analgezice ale opiaceelor.6.
Un studiu anterior al obezității la porcul Göttingen a identificat scăderea fluxului sanguin cerebral în nucleul accumbens, zona tegmentală ventrală (VTA) și cortexul prefrontal, cu tomografie computerizată cu emisie de fotoni unici (SPECT) a creierului.61. În conformitate cu aceste constatări, am observat o legare redusă a DA D2/3 în regiunea ventroforencefal care conține nucleul accumbens și în cortexul prefrontal. Nivelurile extracelulare de DA sunt crescute de 3 ori în nucleul accumbens după aportul de zaharoză la șobolanii care se mișcă liber, supuși microdializei62. La animalele dependente de zaharoză, aportul repetat de zaharoză poate duce la eliberarea DA din coaja nucleului accumbens63. Animalele hrănite cu o dietă restricționată, cu acces limitat la zaharoză, au avut o legare mai mică a receptorului DA D2 în coaja nucleului accumbens și în striatul dorsal64. Dietele restricționate bogate în grăsimi și zaharoză pot duce la reglarea susținută în jos a ARNm a receptorilor D1 și D2 din nucleul accumbens65. Un studiu de microdializă a efectelor alimentelor gustoase a evidențiat o eliberare crescută de DA în nucleul accumbens și cortexul prefrontal atunci când mâncarea era încă considerată nouă; odată ce șobolanii s-au obișnuit cu noua hrană, eliberarea crescută a fost tocită în nucleul accumbens, dar nu și în cortexul prefrontal66. Susceptibilitatea diferențială la obișnuire și condiționare a activității în două regiuni poate explica creșterea mai mare observată în cortexul prefrontal decât în nucleul accumbens al porcilor mini-porci expuși la aceeași substanță gustoasă care și-a pierdut noutatea după douăsprezece zile. Cu toate acestea, deoarece nu am imaginat miniporci cu [11C]raclopridă după prima administrare de zaharoză, această explicație este speculativă.
Cortexul prefrontal modulează funcția executivă, luarea deciziilor și autocontrolul67. Neurotransmisia DA disfuncțională în cortexul prefrontal afectează modularea procesării recompensei, sugerând afectarea funcției executive și a abilităților de luare a deciziilor la persoanele obeze.68,69. Mai mult decât atât, un studiu PET uman a corelat scăderea metabolismului cortexului frontal cu scăderea legării D2 striatale în obezitate.70. Aici, găsim o disponibilitate redusă a receptorilor D2/3 în cortexul prefrontal, inclusiv cortexul orbitofrontal al porcilor expuși la regimul de zaharoză.
Neuronii dopaminergici ai VTA trimit proiecții către hipocamp și amigdală, unde susțin comportamente asemănătoare obiceiurilor71 și mediază codificarea și recuperarea condiționării la drog72,73 și indicii alimentare74,75. Imagistica creierului uman a arătat activarea hipocampului ca răspuns la pofta de mâncare și gust76. În concordanță cu constatările noastre privind o disponibilitate redusă a receptorilor D2/3 hipocampali și amigdalari ca răspuns la zaharoză, cartografierea creierului uman cu [18F]fallypride a arătat eliberare de DA indusă de cocaină în amigdală și hipocamp77. În creierul rozătoarelor, expunerea la cocaină a declanșat eliberarea DA în amigdala78, iar modificările nivelurilor de DA amigdalei au influențat comportamentul de căutare a cocainei indus de indicii79.
Într-un studiu efectuat pe indivizi obezi, asocierea dintre disponibilitățile D2/3 și μOR, despre care se știe că există în regiunile striate ale indivizilor slabi, a fost perturbată în striatul ventral.80. Am comparat valorile TAND dintre cei doi trasori pentru a testa dacă datele au reprodus acest efect. Spre deosebire de oamenii slabi, creierul actual al porcilor nu avea nicio corelație între valorile BPND dintre cei doi trasori, la momentul inițial sau după expunerea la zaharoză. Apoi am testat dacă animalele cu cele mai mari scăderi ale legării trasorului de raclopridă ar avea, de asemenea, cele mai mari scăderi ale legării trasorului de carfentanil, dar în schimb am găsit o corelație negativă în regiunile extrastriatale medii, sugerând că animalele cu cea mai mare modificare a potențialului de legare a trasorul de raclopridă a avut cea mai mică modificare a potențialului de legare al trasorului carfentanil. Relația inversă dintre modificări sugerează că efectele aportului de zaharoză asupra disponibilităților receptorilor respectivi sunt reglate în direcții opuse. Se știe că consumul excesiv de alimente gustoase sau de droguri poate fi determinat de dorință sau de plăcere, sau de ambele60,81. Este posibil ca amploarea dorinței determinată de dopamină să anuleze amploarea plăcerii determinată de opioide sau invers. Dovezile recente indică rolurile GABAA receptorii din VTA și terminalele colinergice din striat și posibil cortexul care acționează ca comutatori între mecanismele de acțiune opioide dependente de dopamină și independente de dopamină82,83 care poate explica reciprocitatea efectelor dopaminei și opioide în regiunile extrastriatale porcine determinate aici.
Un dezavantaj al PET, de asemenea, la animalele relativ mari, este rezoluția spațială limitată a tomografiei care afectează rezultatele din regiunile mici ale creierului implicate în comportamentele asociate cu alimentele. Cu toate acestea, în ciuda acestor preocupări, [11Legarea c]raclopridei a fost înregistrată anterior atât în regiunile striatale cât și extrastriatale84,85,86,87. Utilizarea [11C]racloprida pentru a eticheta același tip de receptori nu ridică nicio îngrijorare cu privire la potențialele diferențe de afinitate care pot afecta utilizarea de trasori separați pentru aceiași receptori în regiuni diferite. Studiile recente au inclus înregistrări ale legării extrastriatale a [11C]raclopridă. Alakurtti et al. a constatat o reproductibilitate bună a măsurilor de legare a raclopridei striate în striat, cu reproductibilitate numai bună până la moderată în cortex85. Într-un studiu ulterior, Svensson et al. a discutat mai multe probleme care afectează utilizarea [11C]racloprida ca marker al receptorilor extrastriatali D2/3 într-un studiu asupra oamenilor sănătoși, inclusiv reproductibilitatea slabă în cortex și declinul limitat al legării extrastriatale în cortexul frontal ca răspuns la un agent de blocare D2/388. Comparațiile test-retest au evidențiat variații de 4-7% în striat și 13-59% în regiunile corticale, dar timpul dintre examinări a fost în medie de 20 de zile, spre deosebire de cele mai informative 1-2 zile ale majorității studiilor. O serie de factori din viața acelor subiecți ar fi avut timp să influențeze concluziile. Într-adevăr, arătăm aici că simpla adăugare a consumului de zaharoză la o rutină de dimineață timp de 12 zile poate să fi influențat măsurile obligatorii obținute două săptămâni mai târziu. Alți factori la fel de frecventi precum jocul de jocuri video, cumpărăturile, intrarea în noi relații romantice și activități sexuale, consumul de droguri sau schimbarea dietei și exercițiile fizice pot influența nivelurile extrastriatale de dopamină cu potențial pentru o mare variație a setului de date. Studiul actual la porci mini a introdus un set-up bine controlat, singura variabilă fiind absența sau prezența zaharozei în dietă. În acest context, datele de la șapte animale au avut o variabilitate suficient de scăzută în regiunile extrastriatale relevante pentru a identifica o reducere semnificativă statistic a legării ca răspuns la zaharoză.
O limitare a studiului actual este utilizarea anestezicelor necesare pentru a asigura imobilitatea în timpul in vivo imagistica animalelor. Efectele anestezicelor specifice și interacțiunile lor cu medicamente sau alte intervenții pot încurca legarea radioliganzilor89,90. Ketamina este un medicament anti-glutamatergic cu efecte antidepresive rapide în doze sub-anestezice91,92,93, care nu reduc striata [11Legarea c]raclopridei la om94. Cu toate acestea, s-a descoperit că S-ketamină reduce disponibilitatea de legare a receptorilor dopaminergici D2/3 în striatul primatelor non-umane conștiente.95. Izofluranul este un anestezic comun în PET-ul animal. În studiile anterioare, am găsit acumularea striată de [11C]SCH23390, un radioligand al receptorilor dopaminergici D1, este semnificativ mai mare la porcii mini-anesteziați cu izofluran, mai degrabă decât cu propofol, ceea ce sugerează susceptibilitatea neurotransmisiei dopaminergice la efectele anesteziei.96. În studiul actual, toți porcii mini au fost fotografiați la ambele momente sub pre-medicație cu ketamina și anestezie cu izofluran, făcând comparațiile prezente valabile.
Concluzie
Consumul excesiv de alimente gustoase poate provoca și deveni rezultatul dependenței cu consecințe directe asupra sănătății prin obezitate. Am testat afirmația că opioidele și dopamina mediază recompense, importante pentru supraviețuire, precum și pentru abuzul de droguri. Miniporcii cu acces intermitent la o soluție de zaharoză timp de 12 zile consecutive au demonstrat o scădere a disponibilității receptorilor de dopamină D2/3 și μ-opioizi în regiunile striatale și extrastriatale ale creierului, ceea ce implică faptul că alimentele bogate în zaharoză influențează circuitele de recompensă ale creierului în moduri similare cu cele observate în cazul drogurilor care creează dependență. sunt consumate. Expunerea inițială unică la zaharoză a fost în concordanță cu eliberarea de opioide în regiunile creierului active în recompensă. Modificările disponibilității opioidelor și dopaminei explică potențialul de dependență al zaharozei consumate în exces.
Materiale și metode
Etica animalelor
Acest studiu a fost aprobat și reglementat de Inspectoratul Danez pentru Experimente pe Animale și toate experimentele au fost efectuate în conformitate cu directiva 2010/63/UE a Parlamentului European și a Consiliului privind protecția animalelor utilizate în scopuri științifice și cu liniile directoare ARRIVE. Am folosit șapte femele de porci Göttingen în vârstă de paisprezece luni (Ellegaard, Dalmose, Danemarca). Porcii au fost hrăniți cu o dietă cu pelete (6 dL, de 2 ori pe zi, Servicii de diete speciale, Aarhus, Danemarca) cu apă de la robinet disponibilă ad libitum. Temperatura mediului a fost de 20–22 °C, umiditatea relativă 50–55%, iar aerul a fost schimbat de opt ori la fiecare oră.
Consumul intermitent de zaharoză
Am fotografiat șapte porci mini cu [11C] raclopridă și [11C]carfentanil la momentul inițial și din nou la o zi după 12 zile consecutive de expunere la apă cu zaharoză. Expunerea la zaharoză a constat într-o oră de acces la apă la zaharoză (zaharoză, Dansukker, Copenhaga, Danemarca) (500 de grame de zaharoză în 2 litri de apă), zilnic, pe o perioadă de 12 zile. A fost înregistrată cantitatea de zaharoză și toți porcii au consumat 2 litri în fiecare zi. De asemenea, am fotografiat cinci dintre aceiași porci mini cu [11C]carfentanil, la 30 de minute după primul acces de zaharoză, pentru a studia eliberarea acută de opioide.
Porcii mini au câștigat o medie de 13.6% greutate corporală de la 25.4 kg (±0.73 SEM) la momentul inițial la 28.9 kg (±0.69 SEM) după expunerea de 12 zile la zaharoză, care a fost semnificativ mai mare (test t cu o singură coadă, p < 0.001) decât creșterile observate la un eșantion de porci martor miniporci obținut în studiile anterioare, unde greutățile au crescut în medie cu doar 4.9%, în aceeași perioadă de dezvoltare.
Imagistica PET a creierului
Am ținut porcii peste noapte cu acces liber la apă înainte de imagistică. Am premedicat și anesteziat miniporci așa cum s-a descris anterior97 și le-a plasat în decubit dorsal într-un dispozitiv PET/CT (Siemens Biograph 64 Truepoint PET). Am efectuat o scanare CT cu doze mici înainte de fiecare achiziție PET pentru definirea anatomică și corectarea atenuării datelor de emisie PET. Am administrat intravenos [11C]raclopridă la momentul inițial (360 ± 18 MBq, activitate specifică 77 ± 76 GBq/μmol, masa injectată 0.12 ± 0.08 μg/kg) și după 12 zile de zaharoză (374 ± 54 MBq, activitate specifică 127 ± 85 GBq/μmol, masa injectată 0.06 ± 0.05 μg/kg) și [11C]carfentanil la momentul inițial (377 ± 43 MBq, activitate specifică 311 ± 195 GBq/μmol, masa injectată 0.03 ± 0.02 μg/kg) și după 12 zile de zaharoză (337 ± 71 MBq, activitate specifică 177 ± 157 GBq/μmol) masa injectată 0.06 ± 0.08 μg/kg) prin vena urechii, în 10 ml ser fiziologic, în primul minut al unei scanări de 90 de minute. Am reconstruit datele PET folosind TrueX 3D OSEM (3 iterații, 21 de subseturi), o matrice de 256 × 256 × 109 și un filtru Gauss de 2 mm, folosind o structură de interval de timp de 5 × 60, 3 × 300, 4 × 600. , 2 × 900 de secunde (total 14 cadre, 90 de minute). La momentul inițial și după 12 zile de zaharoză, porcii mini au fost fotografiați cu ambii trasori injectați la cel puțin 100 de minute, datorită timpului de înjumătățire de [[11C] Trasoare PET. La finalizarea ultimei sesiuni de PET, am eutanasiat porci mini sub anestezie profundă printr-o supradoză intravenoasă de pentobarbital (100 mg/kg).
Analize cantitative și statistici
Am efectuat pași de preprocesare folosind PMOD 3.7 (PMOD Technologies Ltd, Zurich, Elveția). Pentru a defini parametrii de transformare stereotactică din imaginile PET cu medie în timp, am folosit șabloane specifice ligandului. Am aplicat matricele de transformare generate și câmpurile de deformare pe seria de timp PET dinamică corespunzătoare. Am generat imagini parametrice ale [11Potențialul de legare a raclopridei (BPND) prin metoda țesutului de referință multiliniar a lui Ichise și colaboratorii98. Am creat o mască personalizată a cerebelului care excludea vermisul pentru a obține radioactivitatea țesutului cerebelos în timp într-o regiune cu densitate neglijabilă a receptorului DA D2/3. Am generat imagini parametrice ale [11C]carfentanil folosind o implementare a modelului de țesut de referință Logan99,100 cu t* = 30 min. Studii ale [11Legarea C]carfentanilului în creierul uman a folosit cortexul occipital ca regiune de referință36; cu toate acestea, la porc, în conformitate cu curbele de activitate în timp, legarea nedeplasabilă a fost mai mică în cerebel decât în cortexul occipital, în concordanță cu constatările dintr-un studiu de autoradiografie la șobolan.101. Prin urmare, am selectat cerebelul ca regiune de referință în studiul actual.
analize statistice
Am supus hărțile unei analize în funcție de voxel cu cartografiere statistică non-parametrică (SnPM v13.01, http://warwick.ac.uk/snpm) Setul de instrumente SPM care utilizează teoria permutării non-parametrice pentru a oferi un cadru pentru inferența statistică, o abordare care s-a dovedit a funcționa bine pentru eșantioane mici datorită controlului strict al fals pozitive14 și aplicat așa cum s-a descris anterior102. Un expert în neuroanatomia porcului (DO) a comparat imaginile rezultate pragizate la un nivel de semnificație de 5% cu un atlas de miniporci Göttingen de înaltă rezoluție103,104 pentru a defini și a eticheta regiunile de DA D2/3 și μOR BP scăzuteND de la momentul inițial până la starea postzaharoză. Apoi am efectuat o analiză a regiunii de interes (ROI) pentru a extrage BPND valorile regiunilor specifice găsite a fi de interes pe baza analizei SnPM, inclusiv striatul, nucleul accumbens, talamusul, amigdala, cortexul cingulat și cortexul prefrontal. Nu s-au efectuat statistici suplimentare privind analiza ROI, deoarece aceste regiuni s-au dovedit deja semnificative folosind SnPM.
Referinte
- 1.
Smyth, S. & Heron, A. Diabet și obezitate: epidemiile gemene. Nat Med 12, 75-80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL și Curtin, LR Prevalența și tendințele obezității în rândul adulților din SUA, 1999–2008. JAMA 303, 235-241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al. Dopamina pentru „dorință” și opioide pentru „placere”: o comparație a adulților obezi cu și fără alimentație excesivă. Obezitatea (argintiu de argint) 17, 1220-1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obezitatea și mediul alimentar: densitatea energetică alimentară și costurile dietei. Jurnalul american de medicină preventivă 27, 154-162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Dulceața intensă depășește recompensa pentru cocaină. PLoS ONE 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. și Guillem, K. In Neuroștiința în secolul 21 (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Evoluții ulterioare în neurobiologia alimentelor și a dependenței: actualizare privind starea științei. Nutriţie 28, 341-343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Plăcerile creierului (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ și Bullmore, ET De la hedonismul gustului la unitatea motivațională: receptorii mu-opioizi centrali și comportamentul de alimentație excesivă. Int J Neuropsychopharmacol 12, 995-1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Recompensa alimentară: substraturi cerebrale ale dorinței și plăcerii. Neuroștiințe și recenzii biobehaviorale 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Maparea neuroreceptorilor la locul de muncă: privind definirea și interpretarea potențialelor de legare după 20 de ani de progres. Int Rev Neurobiol 63, 1-20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Modele animale ale consumului de zahăr și grăsimi: relație cu dependența de alimente și greutatea corporală crescută. Metode Mol Biol 829, 351-365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al. Cortexul prefrontal din creierul miniporcului Gottingen definit de criterii de proiecție neuronală și citoarhitectură. Brain Res Bull 70, 322-336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE și Holmes, AP Teste de permutare neparametrică pentru neuroimagistică funcțională: un primer cu exemple. Hum Brain Mapp 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Dovezi pentru dependența de zahăr: efecte comportamentale și neurochimice ale aportului intermitent, excesiv de zahăr. Neuroștiințe și recenzii biobehaviorale 32, 20-39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al. Sistemul de recompensă alimentară: perspective actuale și nevoi viitoare de cercetare. Nutr Rev 73, 296-307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Autoadministrarea zaharozei și activarea SNC la șobolan. Am J Physiol Regul Integral Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al. Circuitele separate codifică valorile hedonice și nutriționale ale zahărului. Neuroștiința naturii 19, 465-470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al. Aportul excesiv de zahăr modifică legarea de receptorii dopamină și mu-opioizi din creier. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ și Snyder, SH Receptor de opiacee: localizare autoradiografică în creierul șobolanului. Proc Natl Acad Sci SUA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Recompensa cocainei și hiperactivitate la șobolan: locuri de modulare a receptorului opioid mu. Neuroştiinţe 154, 1506-1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamina afectează auto-administrarea cocainei la șobolani care răspund pe un program progresiv de întărire. Farmacologie, biochimie și comportament 75, 301-307 (2003).
- 23.
Schroeder, JA et al. Un rol al receptorilor mu opioizi în activitatea indusă de cocaină, sensibilizare și recompensă la șobolan. Psychopharmacology 195, 265-272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Restabilirea indusă de cocaină necesită stimularea endogenă a receptorilor mu-opioizi din pallidum ventral. Jurnalul de neuroștiințe: jurnalul oficial al Societății pentru Neuroștiințe 25, 4512-4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al. Hrănirea eliberează opioide endogene la oameni. J Neurosci 37, 8284-8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Circuitul limbic opioid pentru recompensă: interacțiunea dintre punctele fierbinți hedonice ale nucleului accumbens și pallidum ventral. J Neurosci 27, 1594-1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Situl opioid din coaja nucleului accumbens mediază mâncarea și „placul” hedonic pentru mâncare: hartă bazată pe microinjecția pene Fos. Brain Res 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE Aportul de soluții de zaharină, sare și etanol este crescut prin perfuzia unui agonist mu opioid în nucleul accumbens. Psychopharmacology 159, 415-423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Aportul de alimente bogate în grăsimi este îmbunătățit selectiv prin stimularea receptorilor mu opioizi în nucleul accumbens. Jurnalul de farmacologie și terapie experimentală 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxone blochează acea parte a hrănirii determinată de gustul dulce la șobolanii cu restricții alimentare. Am J Physiol 268, R248–252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioide și aportul alimentar: căi neuronale funcționale distribuite? neuropeptides 33, 360-368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Un antagonist opioid, naltrexona, reduce preferința pentru zaharoză la oameni. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Efectul naltrexonei asupra detecției gustului și a pragului de recunoaștere. Apetit 32, 241-249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxona, un blocant de opiacee, reduce consumul de alimente dulci bogate în grăsimi la femeile obeze și slabe. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Circuitele opioide distincte determină palatabilitatea și dezirabilitatea evenimentelor recompensatoare. Proc Natl Acad Sci SUA 106, 12512-12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al. Eliberarea endogenă de opioide în sistemul de recompensă a creierului uman indusă de administrarea acută de amfetamine. Biol Psihiatrie 72, 371-377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, eu. et al. Eliberarea opioidelor endogene induse de amfetamine în creierul uman detectată cu [11C]carfentanil PET: replicare într-o cohortă independentă. Int J Neuropsychopharmacol, 1-6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Peptide opioide și controlul comportamentului ingestiv uman. Neuroștiințe și recenzii biobehaviorale 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Ce să înveți in vivo imagistica opioidergică a creierului? Eur J Pain 9, 117-121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interacțiuni dopamină-opioide în striatul șobolanului: un rol modulator pentru receptorii dopaminergici D1 în transducția semnalului mediată de receptorul opioid delta. Neuropharmacology 39, 372-381 (2000).
- 41.
Bencherif, B. et al. Legarea regională a receptorilor mu-opioizi în cortexul insular este scăzută în bulimia nervoasă și se corelează invers cu comportamentul de post. Jurnalul de medicină nucleară: publicație oficială, Society of Nuclear Medicine 46, 1349-1351 (2005).
- 42.
Karlsson, HK et al. Obezitatea este asociată cu o scădere a mu-opioidului, dar cu disponibilitatea nealterată a receptorilor dopaminergici D2 în creier. J Neurosci 35, 3959-3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al. Pierderea în greutate după intervenția chirurgicală bariatrică normalizează receptorii opioizi ai creierului în obezitatea morbidă. Mol psihiatrie 21, 1057-1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF și Zubieta, JK Mecanismele opioide endogene sunt implicate în obezitate și pierderea în greutate la oameni. J Clin Endocrinol Metab 100, 3193-3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al. Neurotransmisia dopaminei și opioidelor în dependențele comportamentale: un studiu PET comparativ în jocurile de noroc patologice și alimentația excesivă. Neuropsychopharmacology 42, 1169-1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Dieta cronică bogată în grăsimi conduce la reglarea epigenetică postnatală a receptorului mu-opioid din creier. Neuropsihofarmacologie: publicație oficială a Colegiului American de Neuropsihofarmacologie 36, 1199-1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Inducerea hiperfagiei și a aportului de carbohidrați prin stimularea receptorului mu-opioid în regiunile circumscrise ale cortexului frontal. Jurnalul de neuroștiințe: jurnalul oficial al Societății pentru Neuroștiințe 31, 3249-3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Cocaina cronică atenuează semnalizarea dopaminei în timpul intoxicației cu cocaină și dezechilibrează semnalizarea receptorului D1 față de D2. Jurnalul de neuroștiințe: jurnalul oficial al Societății pentru Neuroștiințe 33, 15827-15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al. Efectele nicotinei acute asupra hemodinamicii și legării [11C]raclopridei de receptorii dopaminergici D2,3 din creierul de porc. NeuroImage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Efectul autoadministrarii cocainei asupra receptorilor de dopamină D2 la maimuțele rhesus. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al. Indicații de cocaină și dopamină în striatul dorsal: mecanism de poftă în dependența de cocaină. Jurnalul de neuroștiințe: jurnalul oficial al Societății pentru Neuroștiințe 26, 6583-6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al. Ocuparea crescută a receptorilor de dopamină în striatul uman în timpul poftei de cocaină provocată de semnal. Neuropsychopharmacology 31, 2716-2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Stimularea orală cu zaharoză crește dopamina accumbens la șobolan. Am J Physiol Regul Integral Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. și Telang, F. Imaging rolul dopaminei în abuzul și dependența de droguri. Neuropharmacology 56(Supliment 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al. Brain dopamina și obezitatea. Lanţetă 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK și Fowler, JS Asemănarea dintre obezitate și dependența de droguri, așa cum este evaluată prin imagistica neurofuncțională: o revizuire a conceptului. Jurnalul bolilor dependente 23, 39-53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Receptorii de dopamină D2 în disfuncția recompensă asemănătoare dependenței și alimentația compulsivă la șobolanii obezi. Neuroștiința naturii 13, 635-641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Neuroștiința afectivă a plăcerii: recompensa la oameni și animale. Psychopharmacology 199, 457-480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Sisteme de plăcere în creier. Neuron 86, 646-664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Semnal de recompensă predictivă a neuronilor dopaminergici. J Neurophysiol 80, 1-27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Modificări ale activității creierului după o obezitate indusă de dietă. Obezitatea 19, 749-756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens mecanismele dopaminei în aportul de zaharoză. Brain Res 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Consumul zilnic de zahăr eliberează în mod repetat dopamină în coaja accumbens. Neuroştiinţe 134, 737-744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Accesul repetat la zaharoză influențează densitatea receptorului dopaminergic D2 în striat. Neuroreport 13, 1575-1578 (2002).
- 65.
Alsio, J. et al. Expresia genei receptorului D1 de dopamină scade în nucleul accumbens după expunerea pe termen lung la alimente gustoase și diferă în funcție de fenotipul obezității induse de dietă la șobolani. Neuroştiinţe 171, 779-787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Influența diferențială a mecanismelor de învățare asociativă și neasociativă asupra capacității de răspuns a transmiterii dopaminei prefrontale și accumbal la stimulii alimentari la șobolanii hrăniți ad libitum. J Neurosci 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Circuite neuronale dezechilibrate în dependență. Curr Opin Neurobiol 23, 639-648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexie, bulimie și obezitate: deficite comune de luare a deciziilor privind Iowa Gambling Task (IGT). J. Int Neuropsychol Soc 16, 711-715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Deficiențe decizionale și supraalimentare: un model de risc pentru obezitate. Obes Res 12, 929-935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al. Receptorii striatali D2 scăzuti de dopamină sunt asociați cu metabolismul prefrontal la subiecții obezi: posibili factori contributivi. NeuroImage 42, 1537-1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Nucleul central amigdalei interacționează cu striatul dorsolateral pentru a regla dobândirea obiceiurilor. J Neurosci 32, 1073-1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al. Activarea circuitelor de memorie în timpul poftei de cocaină provocată de semnal. Proc Natl Acad Sci SUA 93, 12040-12045 (1996).
- 73.
Childress, AR et al. Activarea limbică în timpul poftei de cocaină indusă de indicii. Am J Psihiatrie 156, 11-18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Ce și când să „doriți”? Concentrarea pe bază de amigdală a stimulentei asupra zahărului și sexului. Psychopharmacology 221, 407-426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF și Volkow, ND Neurobiologia dependenței: o analiză a neurocircuitului. Lancet Psihiatrie 3, 760-773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Activarea corticală ca răspuns la stimulii gustativi puri în timpul stărilor fiziologice de foame și sațietate. NeuroImage 44, 1008-1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotos, A. et al. Eliberarea de dopamină indusă de cocaină în amigdală și hipocamp: un studiu PET de înaltă rezoluție [(1)(8)F]fallypride la participanții dependenți de cocaină. Neuropsychopharmacology 38, 1780-1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al. Controlul comportamentului de căutare a cocainei prin stimuli asociați cu droguri la șobolani: efecte asupra recuperării nivelurilor de dopamină extracelulară și de răspuns operant stins în amigdala și nucleul accumbens. Proc Natl Acad Sci SUA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Antagonismul receptorilor de dopamină D1 sau D2 din amigdala bazolaterală modifică în mod diferențial achiziționarea asociațiilor indicii de cocaină necesare pentru restabilirea indusă de indicii a căutării de cocaină. Neuroştiinţe 137, 699-706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al. Interacțiunea aberantă mezolimbică dopamină-opiacee în obezitate. NeuroImage 122, 80-86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Semnale de dopamină comportamentală. Tendințe Neurosci 30, 203-210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. The neurobiology of opiate motivation. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Reglarea receptorilor nicotinici și opioizi a transmiterii mediate de receptorii D2 de dopamină striatale. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al. Scăderea în funcție de vârstă a disponibilității receptorului de dopamină D2/3 măsurată cu [C-11]raclopridă în regiunile creierului uman non-striatale: comparație a patru metode. NeuroImage 41, T133–T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al. Fiabilitatea test-retest pe termen lung a legării receptorilor dopaminergici D2/3 striatali și extrastriatali: studiu cu [(11)C]raclopridă și PET de înaltă rezoluție. J Cereb Metab de flux sanguin 35, 1199-1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Eliberarea endogenă de dopamină după provocările farmacologice în boala Parkinson. Ann Neurol 53, 647-653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al. Deficiențe cognitive și eliberare de dopamină striato-frontală în boala Parkinson. Creier 131, 1294-1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al. Validitatea și fiabilitatea cuantificării extrastriatale a legăturii [(11)C]raclopridei în creierul uman viu. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al. Anestezia cu izofluran sporește efectele inhibitoare ale cocainei și ale GBR12909 asupra transportorului de dopamină: studii PET în combinație cu microdializa în creierul maimuței. Brain Res 849, 85-96 (1999).
- 90.
Hassoun, W. et al. Studiul PET al legării [11C]raclopridei în striatul pisicii trează: efectele anestezicelor și rolul fluxului sanguin cerebral. Jurnalul european de medicină nucleară și imagistica moleculară 30, 141-148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Rolul ketamina în depresia rezistentă la tratament: o revizuire sistematică. Curr Neuropharmacol 12, 444-461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al. Efectele antidepresive ale ketamina la pacientii depresivi. Biol Psihiatrie 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. Efectele antidepresive ale ketamina: mecanisme care stau la baza antidepresivelor noi cu acțiune rapidă. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al. Ketamina nu scade legarea receptorului striatal al dopaminei D2 la om. Psychopharmacology 164, 401-406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Reducerea legării receptorilor de dopamină D2/3 în striat după o singură administrare de esketamină, dar nu R-ketamină: un PET studiul la maimuțe conștiente. Eur Arch Psychiatry Clin Neurosci 267, 173-176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, Alaska et al. Efectele anesteziei și ale speciilor asupra captării sau legării radioliganzilor in vivo în porcul Gottingen. BioMed cercetare internațională 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al. Imagistica PET monoaminergică longitudinală a inhibării cronice a proteazomului la porci mini. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategii pentru a îmbunătăți estimarea parametrilor neuroreceptor prin analiza de regresie liniară. J Cereb Metab de flux sanguin 22, 1271-1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al. Raportul volumului de distribuție fără prelevare de sânge din analiza grafică a datelor PET. J Cereb Metab de flux sanguin 16, 834-840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Cuantificarea receptorilor mu-opioizi cerebrali cu [11C]carfentanil: metode de țesut de referință. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. O hartă autoradiografică a legării (3H)diprenorfinei în creierul de șobolan: efectele interacțiunii sociale. Brain Res Bull 7, 405-410 (1981).
- 102.
Landau, AM et al. Stimularea electroconvulsivă afectează în mod diferențial legarea [(11)C]MDL100,907 la receptorii corticali și subcorticali 5HT2A din creierul porcin. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. The telencephalon of the Gottingen minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct 222, 2093-2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Atlas histologic online al creierului de miniporc de la Gottingen. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Mulţumiri
Un „grant pentru dezvoltarea proiectelor AU Ideas” al Universității Aarhus pentru AML a finanțat studiul. Suntem recunoscători pentru suportul tehnic din partea personalului de la Centrul PET al Spitalului Universitar din Aarhus și al Fermei Universității din Aarhus pentru ajutor cu tratamentul animalelor. Mulțumim profesorului Morten Kringelbach, profesorului Jørgen Scheel-Kruger și profesorului asociat Arne Møller pentru ajutor la inițierea acestor studii.
Declarații de etică
Interese concurente
Autorii nu declară interese concurente.
Informații suplimentare
Nota editorului Springer Nature rămâne neutră în ceea ce privește pretențiile jurisdicționale în hărțile publicate și afilierile instituționale.
Drepturi și permisiuni
Acces deschis Acest articol este licențiat în conformitate cu o licență internațională Creative Commons Attribution 4.0, care permite utilizarea, distribuirea, adaptarea, distribuirea și reproducerea în orice suport sau format, atât timp cât acordați credit adecvat autorului (autorilor) originali și sursei, furnizați un conectați-vă la licența Creative Commons și indicați dacă au fost efectuate modificări. Imaginile sau alte materiale terțe din acest articol sunt incluse în licența Creative Commons a articolului, cu excepția cazului în care se indică altfel într-o linie de credit a materialului. Dacă materialul nu este inclus în licența Creative Commons a articolului și utilizarea intenționată a dvs. nu este permisă prin regulamentul legal sau depășește utilizarea permisă, va trebui să obțineți permisiunea direct de la titularul dreptului de autor. Pentru a vizualiza o copie a acestei licențe, vizitați http://creativecommons.org/licenses/by/4.0/.