Dialogy Clin Neurosci. 2013 Dec;15(4):431-43.
abstraktné
Napriek dôležitosti mnohých psychosociálnych faktorov, v jeho jadre, drogová závislosť zahŕňa biologický proces: schopnosť opakovaného vystavenia drogy zneužívania na vyvolanie zmien v zraniteľnom mozgu, ktorý vedie k kompulzívnemu vyhľadávaniu a užívaniu drog a strate kontroly. pred užívaním drog, ktoré definujú stav závislosti. Tu uvádzame typy molekulárnych a bunkových adaptácií, ktoré sa vyskytujú v špecifických oblastiach mozgu, na sprostredkovanie behaviorálnych abnormalít spojených so závislosťou. Patria k nim zmeny v expresii génov, ktoré sú čiastočne dosiahnuté epigenetickými mechanizmami, plasticita neurofyziologického fungovania neurónov a synapsií a súvisiaca plasticita neuronálnej a synaptickej morfológie sprostredkovaná čiastočne zmenenou signalizáciou neurotrofického faktora. Každý z týchto typov liečivom vyvolaných modifikácií môže byť vnímaný ako forma „bunkovej alebo molekulárnej pamäte“. Okrem toho je zarážajúce, že väčšina foriem plasticity súvisiacich so závislosťou je veľmi podobná typom plasticity, ktoré sú spojené s klasickejšími formami „behaviorálnej pamäte“, čo možno odráža konečný repertoár adaptívnych mechanizmov, ktoré majú neuróny k dispozícii, keď sa stretávajú s environmentálnymi výzvy. Nakoniec, molekulárne a bunkové adaptácie závislé od závislosti zahŕňajú väčšinu rovnakých oblastí mozgu, ktoré sprostredkúvajú viac klasických foriem pamäti, čo je v súlade s názorom, že abnormálne spomienky sú dôležitými hnacími silami syndrómov závislosti. Cieľom týchto štúdií, ktorých cieľom je vysvetliť molekulárnu a bunkovú bázu drogovej závislosti, je nakoniec vyvinúť biologicky založené diagnostické testy, ako aj účinnejšie liečby porúch závislosti.
úvod
Drogová závislosť, ktorú možno definovať ako kompulzívne hľadanie a užívanie drog napriek strašným dôsledkom alebo strate kontroly nad užívaním drog, je spôsobená dlhodobými zmenami vyvolanými drogami, ku ktorým dochádza v určitých oblastiach mozgu.1 Len niektorí jedinci však podľahnú závislosti na opakovanej expozícii drogám, zatiaľ čo iní sú schopní používať liek náhodne a uniknúť syndrómu závislosti. Genetické faktory predstavujú približne 50% tejto individuálnej variability v zraniteľnosti závislosti a tento stupeň dedičnosti platí pre všetky hlavné triedy návykových liekov, vrátane stimulancií, opiátov, alkoholu, nikotínu a kanabinoidov..2 Doteraz nebolo možné identifikovať väčšinu génov, ktoré obsahujú toto genetické riziko, pravdepodobne v dôsledku zapojenia snáď stoviek genetických variácií, ktoré sa sčítajú v jedinom jedincovi, aby udelili zraniteľnosť (alebo u iných jedincov rezistenciu).
Zvyšných 50% rizika závislosti je spôsobených celým radom faktorov životného prostredia, ktoré sa vyskytujú počas celého života a ktoré interagujú s genetickým zložením jednotlivca, aby sa vo väčšej či menšej miere stali náchylnými na závislosť. Na závislosti sa podieľa niekoľko typov faktorov prostredia, vrátane psychosociálnych stresov, ale zďaleka najsilnejším faktorom je vystavenie sa drogovej závislosti. Ukázalo sa, že niektoré „vstupné“ lieky, najmä nikotín, zvyšujú zraniteľnosť človeka voči závislosti na inom lieku.3 Okrem toho existuje rastúci dôkaz, že napriek širokému spektru genetických rizík pre závislosť v celej populácii môže vystavenie dostatočne vysokým dávkam lieku počas dlhého časového obdobia transformovať niekoho, kto má relatívne nižšie genetické zaťaženie na narkomana..4
V posledných dvoch desaťročiach sa dosiahol veľký pokrok pri identifikácii diskrétnych oblastí mozgu, ktoré sú dôležité pri sprostredkovaní syndrómu závislosti, ako aj pri druhoch zmien na molekulárnej a bunkovej úrovni, ktoré drogy indukujú v týchto regiónoch, aby boli základom kľúčových aspektov. závislosti.1,5 Obvod, ktorý získal najväčšiu pozornosť, sa označuje ako mezolimbický dopamínový systém, ktorý zahŕňa dopamínové neuróny vo ventrálnej tegmentálnej oblasti (VTA) stredného mozgu inervujúcich stredne ostré neuróny v nucleus accumbens (NAc, časť ventrálneho striata). Tieto neuróny VTA tiež inervujú mnohé ďalšie oblasti predného mozgu, vrátane hipokampu, amygdaly a prefrontálneho kortexu (PFC).
Je zmysluplné zvážiť tieto mechanizmy drogovej závislosti v tomto objeme pamäte z troch prekrývajúcich sa dôvodov.6
- Po prvé, všetky adaptácie vyvolané liekmi možno považovať za typy „molekulárnej alebo bunkovej pamäte“, pričom nervová bunka, ktorá prechádza takýmito zmenami, sa líši v dôsledku expozície lieku, a preto reaguje odlišne od tej istej drogy, na iné drogy, alebo na celý rad ďalších podnetov.
- Po druhé, je zaujímavé, že mnohí, možno väčšina z typov zmien, ktoré boli spojené so stavom závislosti (napr. zmenená transkripcia génu, epigenetika, synaptická plasticita a celistvosť buniek a neuronálna morfológia a neurotrofické mechanizmy) sú tiež zapojené do tradičných foriem „behaviorálnej pamäte“, ako je priestorová pamäť, podmieňovanie strachu a operantné podmieňovanie.
- Po tretie, medzi oblasťami mozgu postihnutými drogami zneužívania sú tie, ktoré sú kľúčovými neurálnymi substrátmi pre behaviorálnu pamäť, vrátane hippocampu, amygdaly a PFC. To sa zhoduje s narastajúcim uvedomením si, že niektoré z najdôležitejších znakov závislosti pozorované klinicky (napr. Túžba po drogách a recidíva) odrážajú abnormality v tradičných pamäťových obvodoch s dlhodobými spomienkami na skúsenosti s drogami, ktoré slúžia ako silné faktory patológie závislostí.4,7,8 Naopak, oblasti odmeny v mozgu (napr. VTA a NAc) účinne ovplyvňujú behaviorálnu pamäť.
Tento článok poskytuje prehľad hlavných typov molekulárnych a bunkových zmien, ktoré sa vyskytujú v niekoľkých oblastiach mozgu na zvieracích modeloch závislosti a sústreďujú sa na nucleus accumbens, pre ktoré je v súčasnosti dostupná väčšina informácií. Dôležité je, že niektoré z týchto zmien v ľudskom narkomane je možné vo väčšej miere potvrdiť na základe štúdií postmortem mozgu. Napriek tomu, že drogy zneužívania majú odlišné chemické štruktúry a pôsobia na odlišné proteínové ciele, je pozoruhodné, že mnohé prominentné adaptácie závislé od závislosti sú spoločné mnohým, v niektorých prípadoch všetkým drogám zneužívania a pravdepodobne prispievajú k spoločným funkciám. syndróm závislosti.4,9 Na rozdiel od toho, mnohé iné adaptácie vyvolané liečivom sú špecifické pre daný liek a môžu sprostredkovať viac jedinečných aspektov danej závislosti. Zameriavame sa tu na stimulačné a opiátové drogy zneužívania, ktoré produkujú dramatickejšie účinky na zvieracích modeloch v porovnaní s inými drogami. Zdôrazňujeme tiež dôležité oblasti pre budúci výskum, ktoré budú ďalej zvyšovať naše vedomosti o syndrómoch závislostí a pretransformovať tieto pokroky do vylepšených diagnostických testov a liečebných postupov.
Transkripčné a epigenetické mechanizmy
Znalosti, že závislí môžu napriek zvýšeným rizikom relapsu zostať aj napriek rokom abstinencie, znamenajú, že závislosť zahŕňa zmeny vyvolané liečivami v mozgu, ktoré môžu byť veľmi stabilné. To viedlo niekoľko skupín k tomu, aby zvážili zmeny v expresii génov ako dôležitú súčasť procesu závislosti (Obrázok 1). Štúdie kandidátskych génov alebo genómové výskumy zahŕňajúce DNA mikročipy a novšie RNA-seq (vysokokapacitné sekvenovanie exprimovaných RNA) identifikoval početné gény, ktorých expresia sa v danej oblasti mozgu zmenila u modelov závislosti na hlodavcoch a primátoch a u ľudí závislých na drogách (napr. ref. 10-17). Príklady takýchto génov sú diskutované v nasledujúcich častiach tohto prehľadu.
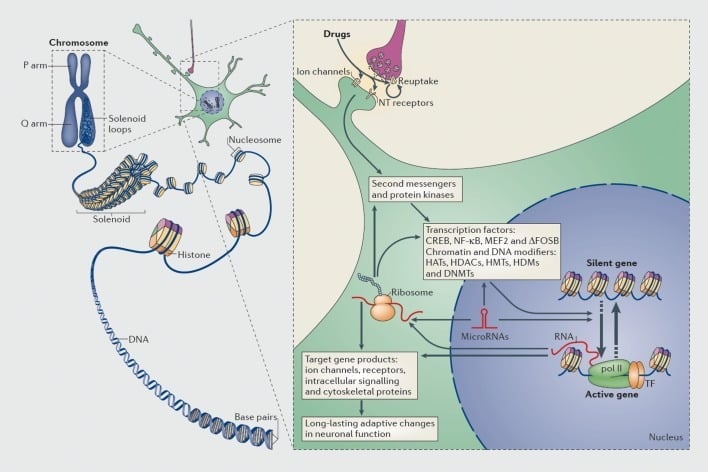
Mechanizmy transkripčnej a epigenetickej regulácie drogami zneužívania. V eukaryotických bunkách je DNA organizovaná obalením okolo histónových oktomérov za vzniku nukleozómov, ktoré sú potom ďalej organizované a kondenzované za vzniku chromozómov (ľavá časť). Len dočasným uvoľnením zhutneného chromatínu môže byť DNA špecifického génu sprístupnená transkripčnému aparátu. Lieky zneužívania pôsobia prostredníctvom synaptických cieľov, ako sú mechanizmy spätného vychytávania, iónové kanály a receptory neurotransmiterov (NT) na zmenu intracelulárnych signálnych kaskád (pravá časť). To vedie k aktivácii alebo inhibícii transkripčných faktorov (TFs) a mnohých ďalších nukleárnych cieľov, vrátane chromatín-regulačných proteínov (znázornených silnými šípkami); podrobné mechanizmy zapojené do synaptickej regulácie proteínov regulujúcich chromatín zostávajú zle pochopené. Tieto procesy v konečnom dôsledku vedú k indukcii alebo represii konkrétnych génov, vrátane tých, ktoré sú pre nekódujúce RNA, ako sú mikroRNA; zmenená expresia niektorých z týchto génov môže ďalej regulovať transkripciu génov. Predpokladá sa, že niektoré z týchto zmien vyvolaných liečivami na úrovni chromatínu sú extrémne stabilné a tým sú základom dlhodobého správania, ktoré definuje závislosť. CREB, cyklický AMP-responzívny element viažuci element; DNMT, DNA metyltransferázy; HAT, histón acetyltransferázy; HDAC, históndeacetylázy; HDM, demetylázy histónov; HMT, histón metyltransferázy; MEF2, enhancerový faktor špecifický pre myocyt, 2; NF-kB, jadrový faktor-KB; pol II, RNA polymeráza II. Reprodukované z ref. 44: Robison AJ, Nestler EJ. Transkripčné a epigenetické mechanizmy závislosti. Nat Rev Neurosci. 2011: 12: 623-637.
Podobne, mnohé typy transkripčných faktorov - proteínov, ktoré sa viažu na regulačné oblasti génov a tým zvyšujú alebo znižujú transkripciu týchto génov - sa podieľajú na sprostredkovaní dlhodobých účinkov zneužívania liekov na expresiu génov v mozgu, Medzi prominentné príklady patrí CREB (väzbový proteín pre cAMP odozvový prvok), AFosB (transkripčný faktor rodiny Fos), NFkB (nukleárny faktor kB), MEF2 (faktor zvyšujúci myocyty-2) a receptory glukokortikoidov, medzi niekoľkými ďalšími.5,10,18-22 Bolo čoraz viac možné porozumieť bunkovým signálnym dráham, cez ktoré zneužívané drogy aktivujú daný transkripčný faktor v mozgu, a kauzálne spojiť takúto aktiváciu s cieľovými génmi tohto transkripčného faktora a so špecifickými behaviorálnymi aspektmi závislosti (pozri Obrázok 1). Tento pokrok je ilustrovaný úvahami o CREB a AFosB, ktoré sú najlepšie študovanými transkripčnými faktormi v modeloch závislosti.
Proteín viažuci element cAMP
Aktivujú sa stimulačné a opiátové drogy CREB v niekoľkých oblastiach mozgu dôležitých pre závislosť, vrátane prominentných v NAc.23,24 Je známe, že CREB je aktivovaný v iných systémoch pomocou cAMP, Ca2+a dráhy rastového faktora,25 a zatiaľ nie je známe, ktorý z nich sprostredkováva jeho aktiváciu v NAc drogami zneužívania. Ukázalo sa, že aktivácia lieku CREB v NAc predstavuje klasický mechanizmus negatívnej spätnej väzby, pričom CREB slúži na zníženie citlivosti zvieraťa na prospešné účinky týchto liekov (tolerancia) a na sprostredkovanie negatívneho emočného stavu pri vysadení lieku (závislosť).18,26,27 Nedávno sa ukázalo, že tieto účinky vedú k zvýšeniu samoliečby liekov a relapsu, pravdepodobne prostredníctvom procesu negatívneho zosilnenia.28 Zdá sa, že tieto účinky CREB zahŕňajú obidva hlavné subtypy NAc stredných ostnatých neurónov, ktoré exprimujú prevažne D1 verzus D2 dopamínové receptory.24 IVeľký počet literatúry ukázal, že CREB, pôsobiaci v hipokampe a amygdale, je kľúčovou molekulou v behaviorálnej pamäti..29-31 Táto široká úloha v závislosti a behaviorálnej pamäti pravdepodobne odráža skutočnosť, že neuróny sú naplnené konečným počtom molekulárnych mechanizmov, s ktorými sa môže prispôsobiť neustále sa meniacemu prostrediu.
Cieľové gény pre CREB, ktoré sprostredkovávajú tento behaviorálny fenotyp, boli identifikované prostredníctvom testov na celom genóme, ako aj viac vybraných snáh.10,18,32 Jedným príkladom je opioidný peptid dynorphin: indukcia expresie dynorfínu stimulantmi v neurónoch NAc, sprostredkovaná prostredníctvom CREB, zvyšuje aktiváciu dnorfínu k opioidných receptorov na dopamínových neurónoch VTA a tým potláča dopaminergný prenos na NAc a poškodzuje odmenu.18 Ukázalo sa, že niekoľko ďalších cieľov CREB je dôležitých pre synaptickú plasticitu vyvolanú liečivom, ako je uvedené nižšie. Kým CREB je tiež aktivovaný v niekoľkých ďalších oblastiach mozgu stimulantmi a opiátmi,23,24 menej sa vie o dôsledkoch tohto účinku na správanie a cieľových génoch, prostredníctvom ktorých sa vyskytujú. Rovnako sa toho vie menej o úlohe CREB pri sprostredkovaní akcií iných drog proti zneužívaniu.19
ΔFosB
Akútne vystavenie prakticky akémukoľvek lieku so zneužívaním indukuje všetky transkripčné faktory rodiny Fos v NAc a niekoľkých ďalších oblastiach mozgu. Táto indukcia je rýchla, ale tiež veľmi prechodná, pričom hladiny Fos proteínu sa vracajú k normálu v rámci 8 na 12 hodín. Unikátne medzi týmito proteínmi Fos rodiny je AFosB, skrátený produkt FosB génu, ktoré sa vďaka svojej nezvyčajnej stabilite postupne akumulujú v priebehu opakovanej expozície lieku a stáva sa prevládajúcim proteínom Fos exprimovaným za týchto podmienok.22,33 Navyše kvôli tejto stabilite hladiny AFosB pretrvávajú niekoľko týždňov po vysadení lieku. Takáto chronická indukcia AFosB bola preukázaná prakticky pre všetky lieky na zneužívanie34 a pre väčšinu liekov je selektívny pre neuróny typu NA-typu NAc.34,35 Bolo to tiež preukázané u ľudí závislých na drogách.35 Veľké množstvo literatúry ukázalo, že taká indukcia AFosB v D1-neuróny typu NAc zvyšujú citlivosť zvieraťa na liek, ako aj jeho prirodzené vlastnosti a podporujú samopodanie lieku, pravdepodobne prostredníctvom procesu pozitívneho posilnenia (pozri odkazy 34 na 38). Je zaujímavé, že indukcia lieku AFosB v NAc je dramatickejšia u adolescentných zvierat, v čase väčšej zraniteľnosti voči závislosti,39 a jeho indukcia nikotínom preukázateľne sprostredkuje nikotínovej bráne podobné zvýšenie kokaínovej odmeny.40
Čo sa týka CREB, mnohé cieľové gény pre AFosB boli identifikované v NAc použitím prístupov kandidátskych génov a genómu.10,32 Zatiaľ čo CREB indukuje dynorfín, ΔFosB ho potláča, čo prispieva k účinkom rewardFosB na získanie odmeny.38 Ďalším cieľom AFosB je cFos: pretože AFosB sa akumuluje s opakovanou expozíciou liečiva, potláča c-Fos a prispieva k molekulárnemu prepínaču, pričom AFosB je selektívne indukovaný v chronickom stave liečeného liečiva..41 Ukázalo sa, že mnoho ďalších AFosB cieľov sprostredkováva schopnosť určitých liekov so zneužívaním indukovať synaptickú plasticitu v NAc a súvisiace zmeny v dendritickej arborizácii NAc stredných ostnatých neurónov, ako bude opísané nižšie.
Funkčné následky indukcie AFosB v iných oblastiach mozgu sú menej známe, hoci ich indukcia v orbitofrontálnom kortexe (OFC) bola študovaná v niektorých detailoch. V tomto prípade AFosB sprostredkováva toleranciu, ktorá sa vyskytuje pri kognitívno-rušivých účinkoch kokaínu v priebehu chronickej expozície, a táto adaptácia je spojená so zvýšeným samopodaním kokaínu..42,43
Testy na celom genóme navrhli niekoľko potenciálnych cieľových génov, ktoré sprostredkovávajú tieto účinky.42 Napriek jedinečným časovým vlastnostiam ΔFosB a vedomiu, že je indukovaný v tradičných pamäťových obvodoch (napr. V hipokampe), ešte nebol vykonaný prieskum úlohy ΔFosB v behaviorálnej pamäti, čo je zaujímavý predmet pre budúci výskum.
Epigenetické mechanizmy
V posledných rokoch sa štúdie transkripcie posunuli o krok ďalej k epigenetike44 (vidieť Obrázok 1), ktorá môže byť široko definovaná ako zmena v génovej expresii, ku ktorej dochádza v neprítomnosti zmeny v DNA sekvencii. Epigenetické mechanizmy riadia balenie DNA v jadre bunky prostredníctvom interakcií s histónmi a mnohými ďalšími typmi jadrových proteínov, ktoré spolu obsahujú chromatín. Expresia génu je riadená stavom tohto obalu prostredníctvom kovalentnej modifikácie histónov, iných proteínov a samotnej DNA. Ako len niektoré príklady, acetylácia histónov má tendenciu podporovať aktiváciu génu, metylácia histónov môže buď podporovať génovú aktiváciu alebo represiu v závislosti od zvyšku Lys, ktorý túto modifikáciu podrobuje, a metylácia DNA je vo všeobecnosti spojená s génovou represiou, hoci určité variantné formy metylácie ( 5-hydroxymetylácia) môže byť spojená s aktiváciou génu.
Epigenetika je príťažlivý mechanizmus, pretože v iných systémoch, napríklad vo vývojovej a rakovinovej biológii, môžu byť určité epigenetické modifikácie trvalé. Pre tento dôvod, epigenetika bola sledovaná tak v modeloch učenia, ako aj v pamäti (napr. ref. 45-48), ako aj v závislosti;44,49 v obidvoch systémoch boli zaznamenané hlboké zmeny v acetylácii a metylácii histónov av metylácii DNA. Ako jeden z príkladov sa histón metyltransferáza, G9a, zúčastňuje v oboch pamätiach50 a závislosť.51,52 V modeloch závislosti Expresia G9a je downregulovaná v NAc v reakcii na stimulanty alebo opiáty drogy zneužívania a tUkázalo sa, že jeho účinky zvyšujú odmeňovanie týchto liekov.51,52 Je zaujímavé, že kokaínová supresia G9a je sprostredkovaná AFosB. G9a katalyzuje dimetyláciu Lys9 histónu H3 (H3K9me2), hlavného mediátora génovej represie. ChIP-chip alebo ChIP-seq (imunoprecipitácia chromatínu nasledovaná promótorovými čipmi alebo vysokokapacitným sekvencovaním) sa použila na získanie genómových máp génov v NAc, ktoré vykazujú zmenenú H3K9me2 po expozícii stimulantom alebo opiátom.32,52,53 Prekrývaním týchto génových zoznamov so zoznamami zmien génovej expresie v širokom genóme a s mapami mnohých iných foriem epigenetických modifikácií (napr. Väzba AFosB, väzba CREB, iné modifikácie histónov atď.), Genómovo široké mapy mnohých iných foriem epigenetických modifikácií32,53 malo by byť možné identifikovať stále kompletnejší súbor génov, ktoré sú regulované drogami zneužívania a pochopiť základné epigenetické mechanizmy, ktoré sú s nimi spojené.
Ďalšou formou epigenetickej regulácie zapríčinenou pamäťou a závislosťou je tvorba mikroRNA. Tieto malé nekódujúce RNA sa viažu na komplementárne oblasti mRNA a tým potláčajú ich transláciu alebo indukujú ich degradáciu. Delécia Argonautu, proteínu, ktorý je rozhodujúci pre spracovanie miRNA, mení behaviorálne reakcie na kokaín, s výraznými účinkami pozorovanými pre stredne ostré neuróny D1-versus D2.54 Ukázalo sa tiež, že niekoľko špecifických miRNA je regulovaných expozíciou liečivom a následne ovplyvňuje behaviorálne reakcie na liečivá (napr. Ref. 55,56). V budúcich štúdiách bude vzrušujúce identifikovať ciele mRNA týchto miRNA a charakterizovať, ako ovplyvňujú proces závislosti.
Synaptická plasticita
Rovnaké všeobecné typy synaptických modifikácií pri glutamátergických synapsiách, ktoré sa podieľajú na hipokampe a amygdale v behaviorálnej pamäti (pozri ďalšie články v tejto problematike), sa podobne ukázali, že sa vyskytujú v regiónoch odmeňovania mozgov v modeloch závislosti a sú dôležité pri sprostredkovaní závislosť.57,58 Takáto synaptická plasticita vyvolaná liečivom bola opísaná v niekoľkých oblastiach mozgu, avšak my sa tu sústreďujeme na NAc, kde sa väčšina výskumu doteraz zameriavala (Obrázok 2).
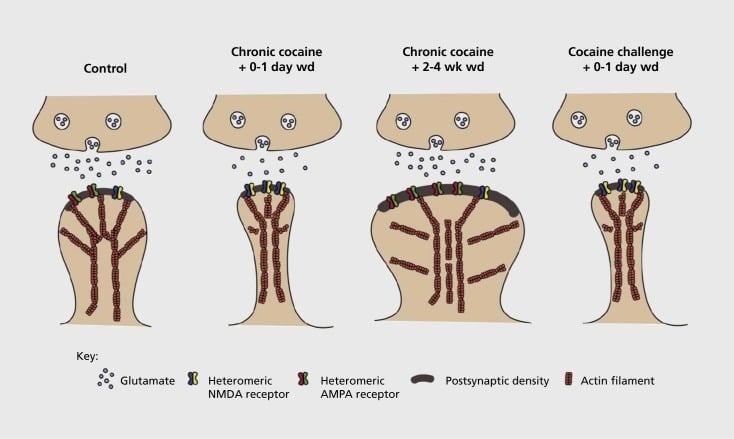
Model synaptickej a štrukturálnej plasticity súvisiacej so závislosťou v nucleus accumbens (NAc). Chronická expozícia kokaínu má za následok časovo závislú a prechodnú reorganizáciu kyseliny alfa-amino-3-hydroxy-5-metyl-4-izoxazolepropiónovej (AMPA) a receptorov glutamátu N-metyl-D-asparágovej kyseliny (NMDA) na médiu NAc synapsy ostnatého neurónu (MSN), ako aj štrukturálne zmeny v hlave chrbtice NAc MSN, ktoré korelujú s odlišnými formami synaptickej plasticity. Napríklad chronický kokaín indukuje povrchovú expresiu NMDA receptorov, tvorbu tichej synapsie a dlhodobú depresiu (LTD) v časných časových bodoch. Počas dlhšieho vysadenia (wd) sa tieto synaptické zmeny reverzujú, výsledkom čoho je zvýšená expresia povrchových AMPA receptorov, konsolidácia synapsie na hubovitý chrbticu a dlhodobá potenciácia (LTP). Tieto účinky sa opäť rýchlo vrátia po vystavení pôsobeniu stimulačnej dávky kokaínu, čo vedie k reštrukturalizácii chrbtice na tenké chrbtice a depresii synaptickej sily.
Počiatočné experimenty ukázali, že opakovaná expozícia stimulačným liekom na zneužívanie indukuje stav (dlhodobá depresia), podobný stavu pri glutamátergických synapsiách v NAc.59 Nedávna práca však ukázala, že takáto plasticita je vysoko závislá od času, pričom LTD sa vyskytuje skoro po poslednej expozícii kokaínu, ktorá sa vyvinula do podobného stavu ako LTP (dlhodobá potenciácia) po dlhších časových intervaloch.60,61 Táto práca, ktorá sa doteraz uskutočňovala primárne s použitím podávaných výskumníkov - na rozdiel od liekov podávaných samostatne - definovala potrebu systematickejšieho výskumu v modeloch samosprávy, ktoré sledujú formy synaptickej plasticity, ktoré sa vyskytujú pri glutamátergických synapsiách v NAc počas podrobného časového priebehu od získania vlastnej administrácie až po jej udržanie, cez rôzne časy abstinencie a extinkcie av reakcii na stimuly vyvolávajúce relaps. Doterajšie práce tiež definovali niektoré molekulárne mechanizmy, ktoré prispievajú k tejto synaptickej plasticite vyvolanej liečivom, vrátane prenosu receptorov AMPA na synapsiu, ktorá je čiastočne sprostredkovaná prostredníctvom CaMKII (Ca2+fosforylácia určitých podjednotiek AMPA receptora, ako aj zmenená expresia podjednotiek AMPA receptora (napr. 60,62-65, Obrázky 2 a 3). Úloha CREB a AFosB sa zapája do týchto javov, ako aj do súvisiacich zmien v morfológii glutamátergických synapsií (pozri nižšie). Napríklad GluAl je cieľ pre CREB v NAc, kde GluA2 a CaMKII sú cieľmi AFosB, v tejto oblasti mozgu .35,36,66,67 Vpred bude dôležité spojiť špecifické adaptácie na časovo závislé zmeny synaptickej funkcie a behaviorálnych znakov závislosti.
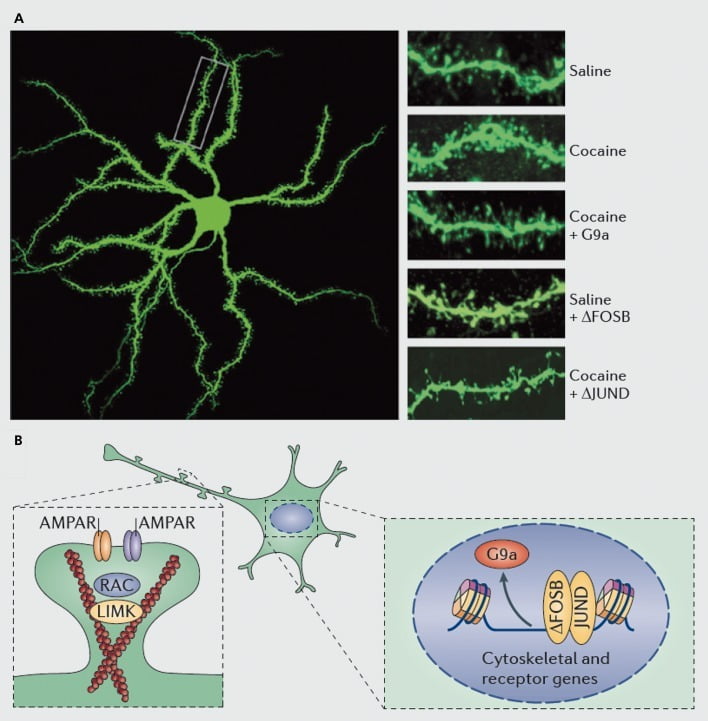
Molekulárne mechanizmy založené na indukcii kokaínu dendritických tŕňov na stredne ostnatých neurónoch nukleus accumbens (NAc). A) ukazuje zvýšenie počtu dendritických stavcov vyvolané kokaínom, ktoré môže byť blokované nadmernou vírusovou expresiou G9a alebo JunD (antagonista transkripcie sprostredkovanej AP1), alebo napodobnené nadmernou vírusovou expresiou FosB. B) Ukázalo sa, že dôležitú úlohu zohrávajú regulácia obchodovania s AMPA receptorom (AMPAR) a aktínového cytoskeletu (vľavo), ako aj regulácia transkripcie glutamátových receptorov a regulačných proteínov pre aktín (napr. Sprostredkovaná prostredníctvom ΔFosB, vpravo). pri sprostredkovaní kokaínu pri regulácii hustoty dendritickej chrbtice NAc. Kináza UMK, LIM domény; RAC, substrát C3 botulotoxínu súvisiaci s Ras.
Nové experimentálne nástroje umožňujú po prvýkrát definovať so zvyšujúcou sa presnosťou, ktoré konkrétne okruhy zobrazujú tieto formy synaptickej plasticity a aké behaviorálne abnormality sprostredkovávajú. Napríklad tsubregióny shell a core NAc vykazujú rozdiely v synaptickej plasticite vyvolanej liečivom, rovnako ako D1-versus D2-médium so strednými ostnatými neurónmi v každej subregióne.60,63,64,67 Podobne, optogenetické experimenty poskytli nový pohľad na príspevok konkrétnej formy synaptickej plasticity (napr. LTD) na špecifických populáciách glutamátergických synapsií v NAc, napríklad tých, ktoré sú výsledkom mediálneho PFC versus basolaterálneho amygdala versus ventrálneho subikula (hlavný výstup hipokampu).68-70 Nakoniec bude nevyhnutné prekryť molekulárne adaptácie vyvolané liekmi v každom z týchto aferentných neurónov adaptáciami špecifickými pre synapsie, ktoré sa vyskytujú v ich postsynaptických dendritoch, aby sa dosiahlo úplné pochopenie toho, ako zneužívané drogy modifikujú obvody mozgu tak, aby riadili konkrétne aspekty závislý štát. Toto úsilie si bude vyžadovať väčšie ocenenie plasticity vyvolanej liekmi pri inhibičných synapsách v tých istých mozgových oblastiach, oblasti, ktorej sa doteraz venovala veľmi malá pozornosť.65
Plasticita celých buniek
Zatiaľ čo väčšina výskumov zahŕňajúcich neurofyziologické zmeny v neurónoch vo fenoménoch zneužívania drog, ako vo fenoménoch učenia a pamäti, sa sústredila na synaptickú plasticitu, existuje stále viac dôkazov o dôležitosti plasticity celých buniek. Plasticita celých buniek, označovaná aj ako homeostatická plasticita,71 Zahrňuje zmeny vnútornej excitability celej nervovej bunky spôsobom, ktorý nie je špecifický pre synapsiu. Vzhľadom na to, že niektoré znaky drogovej závislosti zahŕňajú zvýšenú alebo zníženú citlivosť na liek, má zmysel, že k týmto adaptáciám na správanie prispieva zvýšená alebo znížená elektrická excitabilita určitých nervových buniek..5
najlepším príkladom plasticity celých buniek voči drogám zneužívania je schopnosť chronických opiátov zvýšiť vnútornú excitabilitu noradrenergných neurónov lokusu coeruleus (LC).72 Táto zvýšená excitabilita je sprostredkovaná prostredníctvom CREB a jeho indukciou určitých izoforiem adenylylcyklázy, čo vedie k zvýšenému vypaľovaniu LC neurónov, napríklad prostredníctvom indukcie Na + kanálov.72-75 Táto hyperexcitabilita LC neurónov predstavuje klasický mechanizmus tolerancie a závislosti a riadi niektoré príznaky a symptómy abstinenčného opiátu. Zaujímavé je, že CREB sprostredkováva podobnú formu plasticity celých buniek v NAc stredných ostnatých neurónoch, ktoré sa tiež stávajú hyperexcitibilnými chronickým vystavením návykovým látkam prostredníctvom CREB.76 Preto bude v budúcich skúškach kritické pochopiť, ako synaptická plasticita glutamátergických synapsií sprostredkovaná CREB na NAc stredných ostnatých neurónoch65,66 s CREB sprostredkovanou vnútornou hyperexcitabilitou týchto neurónov76 na kontrolu behaviorálnych znakov závislosti.
Ďalším príkladom plasticity celých buniek v modeloch závislosti je hyperexcitabilita neurónov dopamínu VTA, ku ktorým dochádza po chronickom vystavení opiátovým drogám abúzus.a (Obrázok 4).77,78 Táto adaptácia, ktorá je spojená s morfologickými zmenami v týchto nervových bunkách (pozri nasledujúcu časť), nie je sprostredkovaná CREB, ale namiesto toho sa dosahuje prostredníctvom regulácie neurotrofických signálnych kaskád, ako je opísané nižšie.

Pracovný model chronických morfínom indukovaných adaptácií v dopamínových neurónoch ventrálnej tegmentálnej oblasti (VTA). Chronický morfín znižuje veľkosť VTA dopamínu (DA) soma, ale zvyšuje neuronálnu excitabilitu, zatiaľ čo prenos dopamínu do nucleus accumbens je znížený. Čistý účinok morfínu je menej citlivá cesta odmeňovania, tj tolerančná tolerancia. Downregulácia signalizácie IRS2-AKT v VTA sprostredkováva účinky chronického morfínu na veľkosť soma a elektrickú excitabilitu; účinok na excitabilitu je sprostredkovaný znížením prúdov A-aminomaslovej kyseliny (GABA) A a potlačením expresie K 'kanála, Morfínom indukovaná downregulácia aktivity mTORC2 v VTA je kľúčová pre tieto morfologické a fyziologické adaptácie vyvolané morfínom, ako aj pre toleranciu k odmene. Na rozdiel od mT0RC2, chronický morfín zvyšuje aktivitu mTORCI, ktorá neovplyvňuje tieto morfínom indukované adaptácie. BDNF, neurotrofický faktor odvodený od mozgu; IRS, látka receptora inzulínu; komplex mTORC, mTOR; AKT, proteínkináza B Reprodukovaný z ref 77
Morfologická plasticita a neurotrofické mechanizmy
Zvyšujúci sa dôkaz, z veľkej časti zo štúdií hipokampálnych a mozgových kortikálnych neurónov, ukázal, že zmeny synaptickej plasticity sú spojené s morfologickými zmenami pri synapsiách. Napríklad LTD a generovanie tichých synapsií sú spojené s tvorbou tenkých alebo strnulých dendritických tŕňov, zatiaľ čo LTP je spojené s väčšími hríbovito tvarovanými chrbticami.79,80 Je teda zaujímavé, že oblasť zneužívania drog sa zameriavala na zmeny vyvolané drogami v dendritických tŕňoch> 15 rokov. Chronické vystavenie. \ T Stimulačné lieky zneužívania zvyšujú dendritickú hustotu chrbtice stredných ostnatých neurónov NAc, čo je zmena, ktorá prevláda u neurónov typu Dl.67,81,82 Indukcia chrbtice bola z väčšej časti spojená so senzibilizovanými reakciami správania na tieto lieky, hoci niektoré dôkazy sú v rozpore s týmto názorom.
Podobne ako pri štúdiách synaptickej plasticity je však potrebné oveľa viac práce na systematické definovanie zmien v dendritických spinoch, ktoré sa vyskytujú počas priebehu podávania liekov, vysadenia a recidívy. SDoterajšie štúdie zahŕňajúce výskumníkov a samostatne podávaných liekov naznačujú veľmi odlišné zmeny chrbtice, ktoré sa vyskytujú v rôznych časových intervaloch a v NAc škrupine verzus hlavné subregióny..83-86 Bude tiež dôležité definovať presné molekulárne mechanizmy, ktorými kokaín alebo iný stimulant vyvoláva tieto špecifické účinky závislé od času a typu buniek. Ukázalo sa, že AFosB je nevyhnutný a postačujúci na indukciu nezrelých spinov na neurónoch NAc typu NAc..35,51,67 Takáto regulácia nastáva v zhode s reguláciou kokaínu a AFosB niekoľkých proteínov, o ktorých je známe, že riadia reorganizáciu aktínového cytoskeletu. Ako jeden z príkladov, transkripčná regulácia niekoľkých faktorov výmeny guanínových nukleotidov a proteínov aktivujúcich GTPázu má podobu Rac1, malej GTPázy, na prechodné zníženie aktivity v reakcii na každú expozíciu kokaínu a takéto pulzatívne zníženie aktivity Rac1 bolo preukázané použitím optogenetickej kontroly. Rac1, na sprostredkovanie indukcie nezrelých spinov.87 Tieto účinky Raclu sa pravdepodobne vyskytujú prostredníctvom jeho kontroly kofilínových a iných aktínových regulačných proteínov, o ktorých sa tiež ukázalo, že sprostredkovávajú reguláciu kokaínového rastu chrbtice.87,88 Je však dôležité zdôrazniť, že toto je iba jedna cesta zapojená do regulácie kokaínu u nezrelých tŕňov, pretože sa ukázalo, že podstatnú úlohu zohráva aj niekoľko ďalších proteínov, vrátane CDK5 (cyklín-dependentná kináza-5), CaMKII, NFkB , MEF2, CREB, G9a a DNMT3 (DNA metyltransf vymazať 3a), aby sme vymenovali aspoň niektoré.20,21,35,51,67,89,90 Zaujímavé je, že regulácia kokaínu niektorých z týchto génov, vrátane indukcie CDK5, CaMKII a NFkB a represie G9a, je tiež sprostredkovaná prostredníctvom AFosB.20,35,51,91
Prekvapivo, opiátové drogy zneužívania vyvíjajú opačný účinok a znižujú dendritickú hustotu chrbtice NAc stredných ostnatých neurónov..81 Málo sa vie o dôsledkoch tejto adaptácie a súvisiacich molekulárnych mechanizmoch. Tento jav je, avšak prekvapujúce, vzhľadom na to, že CREB a AFosB sú indukované ako stimulantmi, tak opiátmi a obidve sa podieľajú na indukcii stimulačnej stimulácie NAc dendritickej hustoty chrbtice.. To vyvoláva otázku, ako opiáty potlačujú hustotu chrbtice NAc napriek ich indukcii týchto faktorov.
Ďalšou hlavnou formou morfologickej plasticity pozorovanej v modeloch zneužívania drog je fyzikálna redukcia veľkosti buniek soma VTA dopamínových neurónov indukovaná chronickým podávaním opiátov..77,92,93 Podobná adaptácia nastáva v reakcii na kanabinoidy.94 Toto zmenšenie neurónov VTA dopamínu, ku ktorému dochádza pri samopodávaní opiátov93 a bol dokumentovaný u ľudí závislých od heroínu, ktorí boli vyšetrení \ t77 Zdá sa, že sprostredkováva toleranciu odmeňovania a je spojený so zníženým uvoľňovaním dopamínu v NAc. Podstatné dôkazy teraz ukazujú, že toto zníženie veľkosti buniek soma je sprostredkované potlačením opiátov expresiou neurotrofického faktora odvodeného od mozgu (BDNF) v týchto neurónoch. Toto opiátmi indukované stiahnutie BDNF podpory a VTA neurónový úbytok sme priamo spojili so zníženou aktivitou downstream BDNF signálnych kaskád VTA dopamínových neurónov, špecificky zníženej aktivity IRS2 (substrát inzulínového receptora-2), AKT (serín-treonín kináza) a TORC2 (cieľ rapamycínu-2, ktorý je necitlivý na rapamycín).77,93 Túto downreguláciu BDNF signalizácie sme tiež priamo spojili so zvýšenou excitabilitou, ktorú morfín indukuje v týchto neurónoch, ako bolo uvedené vyššie.77,78 Skutočne, znížená veľkosť buniek soma a zvýšená excitabilita sú úzko spojené, pretože indukcia jedného vedie k druhému a naopak. Táto kontrola nad bunkovou excitabilitou zahŕňa potlačenie K+ a GABAA prúd v týchto neurónoch.
Táto úloha BDNF pri kontrole odpovedí morfínu na úrovni VTA kontrastuje s jeho veľmi odlišným zapojením do účinkov kokaínu a iných stimulantov. Stimulanty indukujú BDNF signalizáciu NAc, čo je dôsledok zvýšenej lokálnej syntézy BDNF, ako aj zvýšeného uvoľňovania z niekoľkých aferentných oblastí.95 Okrem toho sa ukázalo, že zvýšená signalizácia BDNF v NAc, ale nie vo VTA, podporuje behaviorálne účinky týchto liečiv, vrátane ich vlastného podávania.95,96 Opačná regulácia signalizácie BDNF v dráhe VTA-NAc opiátmi oproti stimulantom zvyšuje možnosť, že tieto rozdiely sprostredkujú opačnú reguláciu liekov dendritických tŕňov NAC, čo je v súčasnosti predmetom skúmania.
Budúce smerovanie
Vyššie uvedené rozprávanie podčiarkuje obrovské pokroky, ktoré boli dosiahnuté v pochopení molekulárnych a bunkových adaptácií, ktoré sa vyskytujú v oblastiach odmeňovania v mozgu v reakcii na opakované vystavenie drogy zneužívania, a v súvislosti s individuálnymi adaptáciami na určité behaviorálne znaky syndrómov závislosti na zvieracích modeloch. , Napriek týmto pokrokom pretrvávajú veľké otázky. Väčšina našich súčasných poznatkov sa zameriava na VTA a NAc, s oveľa menším množstvom informácií o iných kľúčových limbických oblastiach mozgu, ktoré sú tiež kľúčové pre drogovú závislosť. Okrem toho všetky experimentálne demonštrácie kauzálnej úlohy molekulárnej bunkovej adaptácie v správaní súvisiacom s liekom manipulovali individuálne adaptácie po jednom. Manipulovať s mnohými adaptáciami súčasne je jednoznačne oveľa ťažšie, ale je to tiež nevyhnutné, pretože vieme, že drogy produkujú veľké množstvo rôznych typov zmien aj v rámci jednotlivých neurónov, ktoré pravdepodobne spôsobujú komplikované spôsoby ovplyvňovania správania. Takýto prístup k systémovej biológii bude mať zásadný význam v konečnom dôsledku k praskaniu biologických základov závislosti. Nakoniec, snahy o pochopenie molekulárno-bunkových mechanizmov spomienok súvisiacich so závislosťou sa nachádzajú v bode, v ktorom všetky ostatné snahy o pochopenie biologického základu behaviorálnej pamäte teraz zápasia: naša schopnosť prepojiť biologické javy s komplexnou behaviorálnou pamäťou zostáva mimoriadne ťažká. Prekonanie tohto rozdelenia predstavuje snáď najväčšiu výzvu v oblasti neurovied.
Vybrané skratky a akronymy
- Nac
- nucleus accumbens
- CREB
- cAMP väzbový proteín viažuci element
- ΔFosB
- transkripčný faktor rodiny Fos
- VTA
- ventrálna tegmentová oblasť
- AMPA
- a-amino-3-hydroxy-5-metyl-4-izoxazolepropiónová kyselina
- LTD
- dlhodobá depresia
- LTP
- dlhodobé vystúpenie
- BDNF
- neurotrofický faktor odvodený z mozgu
- NKkB
- jadrový faktor kB
REFERENCIE