KOMENTÁRE: Vynikajúci prehľad takmer všetkých relevantných výskumov receptorov androgénov, dopamínu a sexuálnych funkcií. Fantastické kreslenie hypotalamus-odmenu obvod vzájomné vzťahy.
Horm Behav. 2008 May; 53(5): 647-658.
Publikované online 2008 Február 13. doi: 10.1016 / j.yhbeh.2008.01.010
abstraktné
Dospievanie je spojené so zvýšením správania, ktoré hľadá radosť, ktoré sú zase ovplyvnené pubertálnou aktiváciou hypotalamo-hypofyzárnej-gonádovej osi. Vo zvieracích modeloch prirodzene sa odmeňujúceho správania, ako je pohlavie, testikulárne androgény prispievajú k vývoju a prejavu správania u mužov. Aby sa dosiahlo dozrievanie v správaní, mozog prechádza počas dospievania významnou prestavbou a mnohé zo zmien sú rovnako citlivé na androgény, pravdepodobne pôsobiace prostredníctvom receptorov androgénov (AR). Vzhľadom na citlivú interakciu gonádových hormónov a vývoja mozgu nie je žiadnym prekvapením, že narušenie hladín hormónov počas tohto citlivého obdobia významne mení správanie adolescentov a dospelých. U mužských škrečkov je vystavenie testosterónu počas dospievania potrebné na normálne vyjadrenie sexuálneho správania dospelých. Muži zbavení androgénov počas puberty vykazujú pretrvávajúce deficity v párení. Naopak, androgény samotné nie sú dostatočné na vyvolanie párenia u prepubertálnych samcov, aj keď sú mozgové AR prítomné pred pubertou. Významným záujmom v tomto kontexte je široké použitie anabolických androgénnych steroidov (AAS) počas dospievania. Zneužívanie AAS má potenciál zmeniť časovanie a hladiny androgénov u adolescentných mužov. U škrečkov adolescentná expozícia AAS zvyšuje agresivitu a spôsobuje trvalé zmeny v systémoch neurotransmiterov. Okrem toho, AAS sú samé o sebe posilňujúce, ako je preukázané vlastným podávaním testosterónu a iných AAS. Nedávne dôkazy však naznačujú, že zosilňujúce účinky androgénov nemusia vyžadovať klasickú AR. Na lepšie pochopenie zneužívania AAS je preto potrebné ďalšie skúmanie interakcií medzi androgénmi a odmeňovaním správania v adolescentnom mozgu.
Prehľad
Dospievanie prebúdza mozog tak potešenie, ako aj riziko. V ľudských tínedžeroch to často prebieha vo forme experimentovania s drogami a sexom. V Spojených štátoch je medián veku prvého pohlavného styku u mužov 16.4 rokov a 65% má pohlavný styk podľa triedy 12th (Kaiser Family Foundation, 2005). Podobne, táto populácia má najvyššiu mieru užívania nelegálnych drog v Spojených štátoch. Podľa národného prieskumu 2004 o užívaní drog a zdraví, 38% mužov vo veku 18 – 25 používalo v uplynulom roku nelegálnu drogu (SAMHSA / OAS, 2005). Okrem toho, 31% dospievajúcich chlapcov používalo drogy alebo alkohol počas ich posledného sexuálneho stretnutia (Kaiser Family Foundation, 2005). Okrem toho je adolescencia kľúčovým časom v etiológii určitých psychopatológií, ako je depresia, úzkosť, porucha príjmu potravy a porucha správania. Predpokladáme, že pubertálna sekrécia gonádových hormónov, ich aktivácia steroidných receptorov v mozgu a interakcia medzi hormónom a skúsenosťami s vývojom adolescentného mozgu prispievajú k zmenám správania pozorovaným počas dospievania.
Naším cieľom je preskúmať dôkazy o tom, že gonádové androgény sprostredkovávajú dospievajúce dospievanie a výkonnosť motivovaného správania dospelých, ako aj odmeňujúce vlastnosti tohto správania. Predstavujeme tiež dôkaz, že testosterón sám o sebe je odmeňovaný, čo pravdepodobne prispieva k dozrievajúcim zmenám v motivovanom správaní počas dospievania, keď hladiny testosterónu stúpajú. Táto práca sa zameriava na naše štúdie nervových obvodov, ktoré sú základom mužského sexuálneho správania, najmä v škrečkoch sýrskych, s osobitným dôrazom na interakciu medzi testosterónom a dopamínom (DA). Navrhujeme, aby pubertálne androgény mali prechodné a dlhodobé účinky na okruhy odmeňovania a motivované správanie. Ďalej predpokladáme, že suplementácia exogénnymi androgénmi vo forme anabolicko-androgénnych steroidov (AAS) zvyšuje normálne vplyvy pubertálnych androgénov, čím nepriaznivo ovplyvňuje adolescentný vývoj mozgu a správania.
Dospievanie ako citlivé obdobie pre vývoj mozgu
Nakoniec je mozog spúšťačom aj cieľom pôsobenia androgénov počas dospievania. U mladých chlapcov (<12 rokov) a mladých škrečkov (vo veku <28 dní) sú cirkulujúce androgény a gonadotropíny na bazálnej úrovni. Pretože sekrécia luteinizačného hormónu z prednej hypofýzy stúpa v reakcii na hormón uvoľňujúci hypotalamický gonadotropín, cirkulujúce koncentrácie testosterónu sa významne zvyšujú. K tomu dochádza v Tannerovom štádiu II / III (14 rokov) u chlapcov a do 28 dní veku u škrečkov. V čase, keď chlapci dosiahnu Tannerovu fázu IV / V (približne 16 rokov), alebo keď sú škrečky 50–60 dní, je endogénny testosterón v rozmedzí pre dospelých mužov. Vylučovanie pubertálneho hormónu sa zhoduje s obdobím dospievania, ktoré u ľudí prebieha približne od 12 do 20 rokov. Pubertálne hormóny pôsobia nielen na periférne tkanivá, aby spôsobili výskyt sekundárnych pohlavných znakov, ktoré sú zjavnými znakmi puberty, ale tiež pôsobia centrálne na ovplyvnenie remodelácie mozgu dospievajúcich a dozrievania správania. Ďalej fyziologické a neurologické zmeny, ktoré spôsobujú pubertálne hormóny, vedú k významným zmenám v prežívaní jednotlivca, ktoré môžu sami výrazne zmeniť priebeh vývoja mozgu. Pubertálne zvýšenie pohlavných steroidných hormónov teda riadené vývojovým časovým dozrievaním reprodukčnej neuroendokrinnej osi zase formuje vývoj správania adolescentov prostredníctvom priamych aj nepriamych vplyvov na nervový systém.
Ľudská adolescencia je teraz uznávaná ako hlavné a dynamické obdobie nervového vývoja, počas ktorého sú behaviorálne okruhy remodelované a prepracované. Hoci mozog 5-ročného dieťaťa je už 90% jeho dospelej veľkosti (Dekaban, 1978), značná prestavba je ešte len prísť. Tento koncept bol zapálený výskumom u ľudí aj zvierat, ktoré dokumentujú, že mnohé zo základných vývojových procesov vyskytujúcich sa počas perinatálneho vývoja mozgu sú rekapitulované počas dospievania. Tieto procesy zahŕňajú neurogenézu (Eckenhoff a Rakic, 1988; On a Crews, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia a Guillamon, 2001; Rankin, Partlow, McCurdy, Giles a Fisher, 2003), programovaná bunková smrť (Nunez, Lauschke a Juraska, 2001; Nunez, Sodhi a Juraska, 2002), vypracovanie a prerezávanie dendritických arborizácií a synapsií (\ tAndersen, Rutstein, Benzo, Hostetter a Teicher, 1997; Huttenlocher a Dabholkar, 1997; Lenroot a Giedd, 2006; Sowell, Thompson, Leonard, Vitajte, Kan a Toga, 2004), myelinizácia (Beneš, korytnačka, Khan a Farol, 1994; Paus, Collins, Evans, Leonard, Pike a Zijdenbos, 2001; Sowell, Thompson, Tessner a Toga, 2001) a sexuálnej diferenciácie (Chung, De Vries a Swaab, 2002; Davis, Shryne a Gorski, 1996; Nunez a kol., 2001). Teda vývojová trajektória postnatálneho mozgu nie je lineárna, ale je skôr charakterizovaná adolescentným rýchlym vývojom a zahŕňa tak progresívne, ako aj regresívne udalosti. Ako každý vývojový biológ vie, obdobia rýchlej zmeny vývoja signalizujú zvýšenú citlivosť a zraniteľnosť voči zmenám závislým na skúsenostiach a na nepriaznivé následky rušenia a urážky, a nie je dôvod si myslieť, že vývoj ľudského adolescentného mozgu je výnimkou (Andersen, 2003; Spear, 2000). Predpokladá sa teda, že poruchy v načasovaní vplyvov pubertálneho hormónu na adolescentný mozog budú mať dlhodobé následky pre správanie dospelých.
Androgény a nervové obvody pre motivované správanie
Pretože adolescencia je prechodná a dynamická fáza vývoja, bolo by ťažké vyhodnotiť adolescentný mozog a správanie v izolácii. Namiesto toho, aby sme ocenili jedinečný charakter dospievania, je užitočné ho kontrastovať s mozgom a správaním dospelých dospelých. Preto, so zameraním tejto práce na mužské sexuálne správanie a odmenu, je dôležité zaviesť neurálne obvody pre kopuláciu a sexuálnu motiváciu u dospelých mužov vrátane úlohy gonádových steroidných hormónov pri behaviorálnej aktivácii a distribúcii receptorov pre androgény (AR) a estrogény (ER).
AR sú prítomné v bunkových skupinách, ktoré tvoria nervové okruhy sprostredkujúce odmeňovanie sociálneho správania, ako je sex. Okrem toho, AR mozog sa prejavuje pred pubertou u škrečkov a je regulovaný androgénmi u mladých aj dospelých mužov (Kashon, Hayes, Shek a Sisk, 1995; Meek, Romeo, Novak a Sisk, 1997). V mozgu hlodavcov sa značne prekrývajú distribúcie AR a ER (Drevo a Newman, 1995) a aromatázy (Celotti, Negri-Cesi a Poletti, 1997), vrátane a aj p foriem estrogénového receptora (Shughrue, Lane a Merchenthaler, 1997). Po naviazaní na ligand fungujú „klasické“ AR a ER ako transkripčné faktory na indukciu transkripcie a syntézy nových proteínov. Nie je prekvapením, že tieto účinky sledujú relatívne pomalý časový priebeh s oneskoreným nástupom účinku. Stimulácia pohlavného správania mužského škrečka (Noble a Alsum, 1975) je v súlade s akciami prostredníctvom klasických genomických akcií. Napríklad 2 týždne vystavenia steroidom sú potrebné na obnovenie párenia v dlhodobých kastrátoch. Novšie štúdie na potkanoch tiež ukázali rýchle bunkové účinky androgénov v oblastiach mozgu, ktoré majú málo klasických receptorov (Mermelstein, Becker a Surmeier, 1996). Predpokladá sa, že tieto steroidné účinky sú sprostredkované negenómovými receptormi. Keďže distribúcia klasického AR a ER v mozgu škrečka je relatívne obmedzená (Wood a Swann, 1999), potenciálne mozgové ciele pre negenomický androgénny účinok sú oveľa širšie.
Mediálna preoptická oblasť (MPOA) hrá ústrednú úlohu pri kopulácii u mužov od zlatých rybiek k ľuďom (pozri Hull, Wood a McKenna, 2006). Okrem toho, MPOA škrečka transdukuje gonádové steroidné hormóny prostredníctvom hojných AR a ER a implantáty testosterónu v MPOA sú dostatočné na obnovenie sexuálnej aktivity v dlhodobých kastrátoch (Wood a Swann, 1999). U samcov potkanov pôsobia gonádové steroidy v MPOA na reguláciu bazálneho uvoľňovania DA (Putnam, Sato a Hull, 2003a stimulovať párenie (Hull, Du, Lorrain a Matuszewich, 1995). Spočiatku dochádza k miernemu nárastu DA, keď je žena zobrazená za obrazovkou. Počas kopulácie sa MPOA DA ďalej zvyšuje (+ 50% základnej hodnoty) a tento účinok vyžaduje androgény (Hull a kol., 1995; Putnam a kol., 2003). Niet divu, že u kastrovaných samcov, ktorí sa nespárujú, sa MPOA DA nezvyšuje (Hull a kol., 1995). Je to trochu ťažké interpretovať tento výsledok, pretože nedostatok uvoľňovania DA je zmätený absenciou sexuálnej aktivity. Uvoľňovanie DA v MPOA však koreluje so stratou párenia v krátkodobých kastrátoch (Hull a kol., 1995) a s obnovením sexuálnej aktivity vyvolanej testosterónom v dlhodobých kastrátoch (Du, Lorrain a Hull, 1998; Putnam, Du, Sato a Hull, 2001).
V MPOA hlodavcov hrajú androgénne a estrogénové metabolity testosterónu špecifickú úlohu v regulácii párenia (Putnam a kol., 2003; Putnam, Sato, Riolo a Hull, 2005). Latencia na začatie kopulácie (mount alebo intromit) je jedným z meradiel sexuálnej motivácie. Latencia k sexuálnej aktivite je citlivá na estrogény prostredníctvom udržiavania syntázy oxidu dusnatého MPOA, ktorá zase udržiava bazálne hladiny DA. Kastráty ošetrené estrogénom vykazujú vysoké bazálne hladiny DA, ktoré silne korelujú so schopnosťou iniciovať kopuláciu. Neprejavujú však zvýšenie samičieho a kopulačného účinku pri uvoľňovaní DA, čo silne koreluje so sexuálnym výkonom. V dôsledku toho je ich sexuálny výkon pod úrovňou neporušených úrovní. Na druhej strane, kastráty liečené samotným ne-aromatizovateľným androgénom nevykazujú zvýšené bazálne hladiny DA a nedokážu iniciovať kopuláciu. Pre normálny sexuálny výkon sú teda potrebné estrogény aj androgény. Sexuálna výkonnosť sa obyčajne vyjadruje ako frekvenčné miery úchytov, intromácií a ejakulácií. Len v prípade, že sú nahradené estrogény aj androgény, vykazujú kastrovaní samci zvýšené hladiny DA (a kratšie latentné opatrenia) a samičie a kopulačne indukované zvýšenie DA (a zvýšené frekvencie). Týmto spôsobom estrogény v MPOA prispievajú k sexuálnej motivácii a estrogény aj androgény k sexuálnemu výkonu.
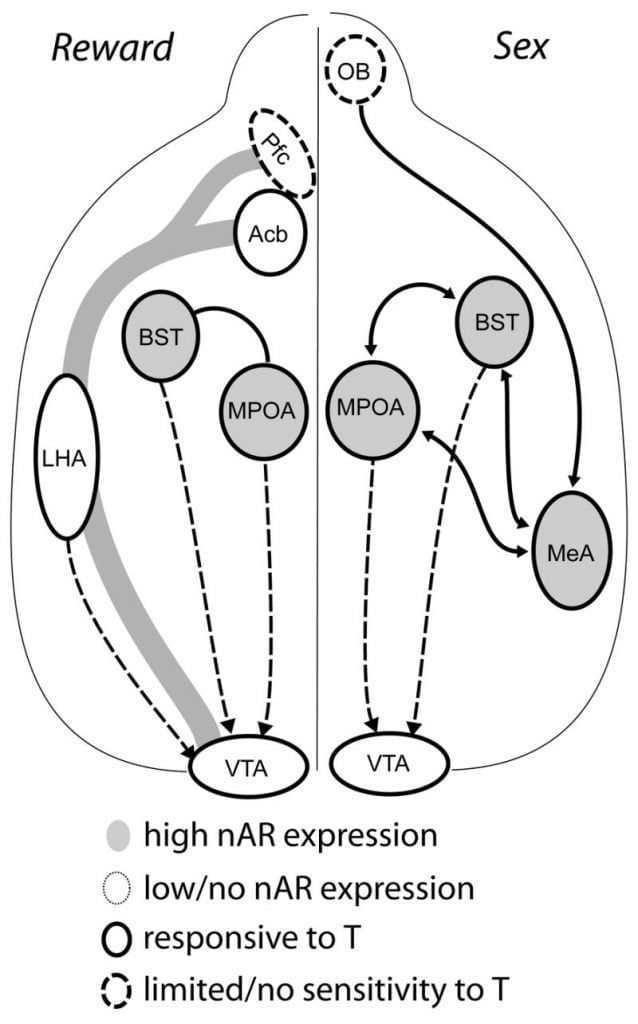
Aj keď je testosterón nevyhnutný na uvoľňovanie MPOA DA počas mužského kopulačného správania a na párenie samotného, ani testosterón, ani párenie samé o sebe nemôžu vyvolať DA v MPOA. Namiesto toho sa na uvoľňovanie DA v MPOA vyžadujú aj chemosenzorické podnety od špecifických samíc. U hlodavcov sú chemosenzorické stimuly primárnou zmyslovou modalitou na začatie mužského sexuálneho správania (Obr. 1). Chemosenzorické podnety sa prenášajú z čuchových cibúľ do MPOA cez stredové amygdaloidové jadro a jadro lôžka terminálu stria, štruktúry s bohatými AR a ER (Wood a Swann, 1999). Na určenie úlohy chemosenzorických podnetov pri párovaní indukovaných DA sme merali MPOA DA počas párenia v gonádovo intaktných mužských škrečkov s jednostrannou bulfomiou olfaktora (UBx, Triemstra, Nagatani a Wood, 2005). Hoci bilaterálne odstránenie čuchových cibuliek eliminuje sexuálnu aktivitu a uvoľňovanie MPOA DA, jednostranná bulterómia neinterferuje s párením. V tejto štúdii kopulácia indukovaná uvoľňovaním MPOA DA pri meraní kontralaterálne voči lézii olfaktorickej lézie, ale nie na ipsilaterálnej hemisfére (Obr. 2). Podobné výsledky boli pozorované u samcov potkanov s léziami mediálnej amygdaly (Dominguez, Riolo, Xu a Hull, 2001). V súvisiacej štúdii chemická stimulácia mediálnej amygdaly u potkanov indukovala uvoľňovanie MPOA DA rovnocenné s uvoľňovaním počas kopulácie (Dominguez a Hull, 2001). Celkovo vzaté, tieto údaje naznačujú, že testosterón vytvára permisívne prostredie, ktoré umožňuje vonkajším senzorickým stimulom dosiahnuť MPOA a indukovať uvoľňovanie DA počas kopulácie.

Obr. 2
V konečnom dôsledku sexuálne správanie a iné prirodzené odmeny aktivujú cesty neurálnej odmeny. Mesokortikolimický DA okruh pozostáva z ventrálnej tegmentálnej oblasti (VTA), nucleus accumbens (Acb) a prefrontálneho kortexu (Pfc). Telesá dopamínových buniek, ktoré sa nachádzajú v projekte VTA, rastrálne prechádzajú na Acb a Pfc (Koob a Nestler, 1997). U potkanov sa DA vylučuje do Acb počas pohlavného styku (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips a Fibiger, 1990). Mnohé drogy zneužívania tiež pôsobia v mezolimbickom DA systéme na zvýšenie uvoľňovania DA (amfetamíny) alebo inhibujú spätné vychytávanie DA (kokaín, Di Chiara a Imperato, 1988), čím sa posilnia ich návykové vlastnosti. Týmto spôsobom, testosterón má potenciál ovplyvniť uvoľňovanie DA v Acb, a to ako prostredníctvom jeho zvýšenia sexuálneho správania, tak prostredníctvom svojich aktivít ako drogy zneužívania (pozri nižšie).
Súčasné dôkazy naznačujú, že mesokortikolimbický DA systém dozrieva počas dospievania. Hustota Acb DA vlákien sa dramaticky zvyšuje počas dospievania u gerbilov, čo naznačuje, že počas dospievania dochádza k výraznému dozrievaniu dopaminergných projekcií VTA na Acb (Lesting, Neddens a Teuchert-Noodt, 2005). Okrem toho je dopamínergický vstup do GABA (kyselina y-aminomaslová) -ergických buniek v mediálnom prefrontálnom kortexe potkana obohatený a modulovaný serotonergnými systémami počas vývoja pubertu (Benes, Taylor a Cunningham, 2000) a manipulácia androgénov u dospelých potkanov vedie k zmenám v hustote dopaminergných axónov v prefrontálnom kortexe (Kritzer, 2003). Pfc, Acb a VTA majú málo AR alebo ER, hoci ERp je prítomný vo VTA (Shughrue a kol., 1997). Preto sa zdá pravdepodobné, že androgény ovplyvňujú mezokortikolimbický DA systém prostredníctvom androgen-senzitívnych aferentov alebo prostredníctvom ERp vo VTA ako v hypotalame (Handa et al., Tento problém). Naše údaje ukazujú, že androgén-senzitívne bunky u samcov škrečkov premietajú VTA zo štruktúr spojených so správaním citlivým na steroidy. Napríklad MPOA aj jadro lôžka stria terminalis (BST) obsahujú veľký počet AR-pozitívnych buniek premietajúcich do VTA (Sato a Wood, 2006). Ventrálna pallidum, hlavný cieľový Acb efferent cieľ (Zahm a Heimer, 1990), tiež obsahuje mnoho AR-pozitívnych buniek premietajúcich sa do VTA. Tieto projekcie poskytujú pre androgény možnosť modifikovať aktivitu mezokortikolimického DA systému.
Organizácia správania závislá od steroidov počas dospievania
Tradičný pohľad na pôsobenie hormónov na adolescentné správanie je založený na aktivačných účinkoch steroidných hormónov, ktoré sa týkajú schopnosti steroidov uľahčiť správanie v špecifických sociálnych kontextoch pôsobením v cieľových bunkách nervových obvodov, ktoré sú základom správania. Aktivačné účinky sú prechodné v tom zmysle, že prichádzajú a odchádzajú s prítomnosťou a neprítomnosťou hormónu a sú typicky spojené s prejavom správania dospelých. Naproti tomu organizačné účinky sa vzťahujú na schopnosť steroidov vytvárať nervový systém počas vývoja. Štrukturálna organizácia je trvalá, pretrváva aj po období vystavenia sa hormónu a určuje neurálne a behaviorálne reakcie na steroidy v dospelosti. Naše chápanie vývojového vzťahu medzi organizačnými a aktivačnými účinkami steroidných hormónov sa vyvinulo v priebehu posledných rokov 50. Phoenix a jeho kolegovia najprv navrhli, aby boli behaviorálne (aktivačné) reakcie dospelých na steroidné hormóny naprogramované (organizované) steroidnými hormónmi počas maximálne citlivého obdobia perinatálneho vývoja (Phoenix, Goy, Gerall a Young, 1959). Neskôr, Scott a kolegovia položili teoretické základy pre existenciu viacerých citlivých období pre progresívnu organizáciu nervového systému, a poznamenal, že citlivé obdobia sa s najväčšou pravdepodobnosťou vyskytujú počas období rýchlej zmeny vývoja (1974). Následne Arnold a Breedlove poukázali na to, že k organizácii mozgu závislej od steroidov môže dôjsť mimo citlivých období vývoja (Arnold a Breedlove, 1985). V posledných rokoch 15 výskum, ktorý využíva rôzne živočíšne modely a behaviorálne systémy, jasne ukazuje, že dospievajúci mozog je citlivý na aktivačné aj organizačné účinky gonádových steroidov. Sisk a Zehr, 2005). A podobne ako iné obdobia rýchlej zmeny vývoja, aj adolescencia predstavuje definovanú príležitosť na remodeláciu mozgu závislú od steroidov.
Naša práca s použitím škrečka ako zvieracieho modelu poskytuje dôkaz, že mužské sociálne správanie je modifikované steroidmi počas dospievania (Schulz, Menard, Smith, Albers a Sisk, 2006; Schulz a Sisk, 2006). Pred pubertou, liečba testosterónom nemôže aktivovať sexuálne správanie u škrečkov, čo naznačuje, že maturačné procesy, ktoré robia nervové okruhy náchylné na aktiváciu alebo organizáciu steroidnými hormónmi ešte nenastali (Meek a kol., 1997; Romeo, Richardson a Sisk, 2002a). Naopak, zatiaľ čo zjavná expresia mužského reprodukčného správania v dospelosti si absolútne nevyžaduje prítomnosť gonadálnych steroidov počas dospievania, maximálna expresia správania áno. Pri porovnaní mužského reprodukčného správania u samcov kastrovaných buď predpubertálne (NoT@P) alebo postpubertálne (T@P) a následne liečených testosterónom v dospelosti, prepubertálne kastrované NoT@P majú najmenej 50 % deficit v mužskom správaní v porovnaní so samcami kastrovanými po dospievaní (Obr. 3, Schulz, Richardson, Zehr, Osetek, Menard a Sisk, 2004). Okrem toho sú deficity v reprodukčnom správaní dlhodobé a nemožno ich prekonať ani dlhodobou liečbou testosterónom, ani sexuálnou skúsenosťou v dospelosti (Schulz a kol., 2004). Podobne po liečbe estrogénom a progesterónom muži NoT@P vykazujú kratšie latencie lordózy a dlhšie trvanie lordózy ako muži kastrovaní v dospelosti (Schulz a kol., 2004), čo naznačuje, že prepubertálne kastráty sú menej defeminizované ako muži vystavení pubertálnemu testosterónu.

Obr. 3
Je možné, že muži NoT@P trpia zníženou sexuálnou motiváciou. Jedným zo spôsobov, ako vyriešiť túto otázku, je porovnať latencie na zapojenie sa do anogenitálneho vyšetrenia (AGI) a nárastu medzi mužmi s gonadektómiou pred (NoT@P) a po puberte (T@P). Ak je sexuálna motivácia závislá od expozície gonadálnym hormónom počas dospievania, predpovedali by sme dlhšie latencie na zapojenie sa do sexuálneho správania u mužov NoT@P. V skutočnosti pri opakovanom vystavení estrálnym samiciam trvá samcom NoT@P dlhšie, kým začnú AGI a rastú v porovnaní s samcami T@P (Obr. 4). Zdá sa teda, že okrem organizovania aspektov sexuálnej výkonnosti hormóny v puberte organizujú aj odmeňujúce aspekty sexuálneho správania. Na podporu tejto možnosti centrálne podávanie DA agonistu apomorfínu v dospelosti obnovuje stúpajúce správanie samcov NoT@P na hladiny typické pre dospelých, čo naznačuje, že testosterón počas dospievania normálne organizuje dopaminergné nervové okruhy (Salas-Ramirez, Montalto a Sisk, 2006 ). Napriek tomu zostáva veľa zaujímavých otázok. Mal by samca barpress NoT@P pre estrálnu samicu alebo by si vyvinul podmienenú preferenciu miesta na párenie? Budúci výskum bude skúmať úlohu pubertálnych hormónov pri organizovaní sexuálnej motivácie a sexuálnej výkonnosti.

Obr. 4
Latencie a trvanie anogenitálneho vyšetrenia (AGI) prejavované samcami škrečkov s gonadektómiou pred pubertou (NoT@P) alebo po puberte (T@P). Všetci muži dostali testosterón v dospelosti 7 týždňov po gonadektómii a jeden týždeň pred prvým testom správania. A. T@P muži vykazovali podobné AGI latencie v troch testoch s estróznou samicou, zatiaľ čo NoT@P muži zvýšili AGI latencie počas tretieho testu s estróznou samicou. B. Samci T@P znížili latenciu prisadnutia v troch testoch správania s estróznou samicou, zatiaľ čo samce noT@P nevykazovali žiadnu zmenu v latencii prisadnutia v troch testoch správania. Tieto údaje naznačujú, že pubertálne gonadálne hormóny majú trvalé, uľahčujúce účinky na motiváciu dospelých mužov zapojiť sa do sexuálneho správania so ženou. (Nepublikované údaje od zvierat v Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA a Sisk, CL, 2004).
Prepubertálne behaviorálne reakcie na steroidy
Jedným z pretrvávajúcich hádaniek adolescentného správania je, prečo je aktivácia reprodukčného správania v reakcii na vystavenie steroidom oslabená u prepubertálnych mužských škrečkov. Ak nízke hladiny androgénov pred pubertou obmedzujú expresiu mužského pohlavného správania u prepubertálnych samcov, potom doplnenie endogénnych androgénov u prepubertálnych samcov by malo vyvolať párenie. Ukázalo sa, že to tak nie je (Meek a kol., 1997; Romeo, Cook-Wiens, Richardson a Sisk, 2001; Romeo, Wagner, Jansen, Diedrich a Sisk, 2002b), napriek skutočnosti, že počet a distribúcia AR a ER v celom páriacom okruhu sú podobné u hormonálne liečených prepubertálnych a dospelých kastrátov (Meek a kol., 1997; Romeo, Diedrich a Sisk, 1999; Romeo a kol., 2002a). Zdá sa teda, že androgény a AR sú nevyhnutné, ale nie dostatočné na expresiu mužského sexuálneho správania.
Úsilie o identifikáciu faktorov, ktoré obmedzujú sexuálnu aktivitu pred pubertou, bolo doteraz zmiešané. Odozvy Fos na chemosenzorické podnety z estrálnych samíc sú podobné u predkožných a dospelých samcov škrečkov (Romeo, Parfitt, Richardson a Sisk, 1998). Tieto údaje ukazujú, že mechanizmy zmyslovej transdukcie sú zrelé pred pubertou. Juvenilní muži sú teda schopní detekovať chemosenzorické podnety od samíc; kde sa líšia od dospelých, je to, ako reagujú na tieto podnety. Jedným z možných vysvetlení je, že prepubertálni muži nie sú motivovaní k sexuálnemu správaniu. Zistili sme, že prepubertálne mužské škrečky nevykazujú zvýšenú dopaminergnú odpoveď v MPOA v reakcii na ženské feromóny, zatiaľ čo pohlavne naivní dospelí muži vykazujú silné MPOA dopaminergné reakcie na rovnaké stimuly (Obr. 5, Schulz, Richardson, Romeo, Morris, Lookingland a Sisk, 2003). Podobne, prepubertálne samce nedokážu preukázať zvýšenie cirkulujúceho testosterónu v dospelosti po vystavení ženským feromónom (Parfitt, Thompson, Richardson, Romeo a Sisk, 1999). Zdá sa teda, že ženské feromóny sú bezpodmienečným stimulom pre neurochemické a neuroendokrinné reakcie u dospelých, ale nie u samcov prepubertálnych, čo svedčí o tom, že význam týchto spoločensky relevantných zmyslových podnetov sa mení v porovnaní s pubertálnym vývojom, čo pravdepodobne súvisí so získaním odmeňovania a sexuálnej motivácie. Okrem toho, aj keď testosterón uľahčuje AGI u samíc u prepubertálnych samcov, tento účinok závisí od toho, či muž mal predchádzajúcu expozíciu estrálnej samici alebo nie. Možno je prekvapujúce, že liečba testosterónom znižuje latenciu a zvyšuje trvanie AGI iba u pohlavne naivných prepubertálnych samcov (Obr. 6). Okrem toho prepubertálne samce, ktorí mali jednu predchádzajúcu skúsenosť so samičkou, vykazujú oveľa dlhšie AGI latencie a kratšie trvanie AGI ako muži, ktorí sa prvýkrát stretávajú s receptívnymi samičkami (Obr. 6). Tieto údaje naznačujú, že interakcie s estrálnou ženou sú skôr než puberta averzívne, a nie sú odmeňované, čím sa eliminujú akékoľvek uľahčujúce účinky testosterónu na AGI počas následných interakcií so ženou. Bolo by zaujímavé vedieť, či negatívne behaviorálne následky skorého vystavenia estrálnej ženy pretrvávajú v období adolescencie a dospelosti, najmä vzhľadom na to, že opakovaná expozícia estrálnym ženám počas dospievanie vo všeobecnosti uľahčuje vyjadrenie mužského reprodukčného správania (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto a Sisk, 2007).

Obr. 5
Prepubertálne a dospelé mužské mediálne preoptické oblasti (MPOA) dopaminergné reakcie na ženské feromóny obsiahnuté vo vaginálnych sekrétoch. Dospelí samci vykazujú zvýšenie MPOA dopaminergnej aktivity s expozíciou ženských vaginálnych sekrétov, zatiaľ čo prepubertálne samce nevykazujú zvýšené MPOA dopaminergné reakcie na ženské feromóny. (Prečiarknuté z Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ a Sisk, CL, 2003).

Hoci predpubertálna liečba androgénmi nemôže vyvolať kopuláciu, nedávna práca nášho laboratória naznačuje, že nervový systém škrečka je citlivý na organizačné účinky testosterónu na reprodukčné správanie pred dospievaním (Schulz, Zehr, Salas-Ramirez a Sisk, 2007). Kastrácia plus 19 dni vystavenia testosterónu pred alebo počas, ale nie po dospievaní, uľahčili montážne správanie, keď bol testosterón nahradený v dospelosti. Muži vystavení testosterónu prepubertálne tiež vykazovali viac intromácií v dospelosti ako muži vystavení testosterónu počas alebo po puberte (Schulz a kol., 2007). Tieto údaje naznačujú, že schopnosť testosterónu organizovať behaviorálne nervové okruhy sa s vekom znižuje a že adolescencia označuje koniec dlhého postnatálneho citlivého obdobia pre vystavenie testosterónu.
Farmakologické androgény
Predchádzajúce údaje naznačujú, že endogénne gonádové steroidy zvyšujú motivované správanie počas dospievania. Čo sa stane, ak človek sám podá androgény na úrovni až do normálnych fyziologických koncentrácií 100x? Toto je problém zneužívania anabolicko-androgénnych steroidov (AAS) (prehľad v Brower, 2002; Clark a Henderson, 2003). Je tu vhodná krátka odchýlka: všetky AAS sú deriváty testosterónu, všetky AAS majú uhlíkový skelet s fúzovanými kruhmi 4, väčšina z nich má uhlíky 19. AAS sa používajú hlavne pre ich anabolické účinky (budovanie svalov). Ako však napovedá ich názov, AAS má aj androgénne vlastnosti. Testosterón je logickou voľbou v štúdiách na zvieratách na skúmanie základných mechanizmov androgénnej odmeny. Zostáva populárnou voľbou aj pre ľudí, najčastejšie vo forme dlhodobo pôsobiacich esterov testosterónu, ako je napríklad testosterón propionát. V 2006 bol testosterón jedinou najbežnejšou zakázanou látkou, ktorá bola zistená v testoch moču v laboratóriách akreditovaných WADA (WADA, 2006). Testosterón predstavoval najväčší podiel (34%) AAS-pozitívnych testov moču na olympijských hrách 2000 v Sydney (Van Eenoo a Delbeke, 2003). Podobne, v testoch na moči u užívateľov AAS, 41% testoval pozitívne na testosterón (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). Pri vysokých dávkach AAS vyvolávajú významné zmeny správania. Najmä vzhľadom na ich blízky vzťah k testosterónu, použitie AAS v dospievajúcich rokoch by sa zdalo, že ruší normálne steroidné prostredie vyvíjajúceho sa ľudského adolescentného nervového systému, vrátane množstva, načasovania a typu vystavenia steroidom.
Tak ako pri iných nelegálnych drogách, aj zneužívanie ľudského AAS je problémom dospievania. Podľa Národného prieskumu domácností o užívaní drog 1994 (SAMHSA / OAS, 1996), vrcholy užívania steroidov v neskorej adolescencii vo veku 18. Okrem toho v prieskume Monitorovanie budúcnosti (Johnston, O'Malley a Bachman, 2003), celoživotný výskyt užívania steroidov u stredoškolských seniorov (2.7%) bol porovnateľný s výskytom kokaínu crack (3.5%) alebo heroínu (1.4%). Užívanie steroidov je tiež čoraz bežnejšie v mladšom veku: 2.5% pacientov triedy 8th (13 – 14 rokov) užívali steroidy podobné výskytu crackov (2.5%) a užívaniu heroínu (1.6%). Tento trend smerom k užívaniu AAS na začiatku dospievania je obzvlášť znepokojujúci vzhľadom na obavy 1), že adolescenti môžu byť obzvlášť zraniteľní voči zneužívaniu AAS a 2), že expozícia AAS u adolescentov na farmakologických úrovniach má potenciál podstatne zmeniť normálne dozrievanie mozgu a akútne a chronicky, aby sa dosiahlo prehnané morfologické a behaviorálne reakcie.
Nevhodná agresia je behaviorálna reakcia, ktorá sa najčastejšie spája so zneužívaním ľudského AAS. V publikovaných kazuistikách sa užívanie steroidov podieľa na niekoľkých násilných vraždách (Conacher a Workman, 1989; Pápež a Katz, 1990; Pápež, Kouri, Powell, Campbell, a Katz, 1996; Schulte, Hall a Boyer, 1993). V prieskumoch súčasných užívateľov AAS boli zvýšená agresivita a podráždenosť najčastejšími vedľajšími účinkami správania AAS (Bond, Choi a pápež, 1995; Galligani, Renck a Hansen, 1996; Midgley, Heather a Davies, 2001; Parrott, Choi a Davies, 1994; Perry, Kutscher, Lund, Yates, Holman a Demers, 2003). Vzhľadom na rozsah expozícií androgénov, rôznorodosť psychiatrických symptómov a potenciál pre už existujúcu psychiatrickú dysfunkciu je však ťažké určiť presnú úlohu AAS v týchto prípadoch ľudskej agresie. Výsledky prospektívnych štúdií humánnych dobrovoľníkov dostávajúcich injekcie AAS boli zmiešané: \ t Tricker et al (1996) a O'Connor a kol. (2004) nezaznamenali žiadne zvýšenie hnevu, zatiaľ čo iné štúdie pozorovali zvýšenú agresivitu (\ tDaly, Su, Schmidt, Pickar, Murphy a Rubinow, 2001; Hannan, Friedl, Zold, Kettler a Plymate, 1991; Kouri, Lukáš, pápež a Oliva, 1995; Pápež a Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz a Rubinow, 1993). Je však dôležité mať na pamäti, že dávky podávané ľudským dobrovoľníkom sú oveľa nižšie ako dávky odporúčané na webových stránkach na budovanie tela a trvanie liečby je vo všeobecnosti krátke. Na základe rovnováhy sa teda zdá, že je spravodlivé dospieť k záveru, že AAS má potenciál zvýšiť agonistické správanie, aspoň u citlivých jedincov. Pope et al (1994) zistili, že AAS vyvoláva psychiatrické symptómy u zraniteľných jedincov.
Štúdie na zvieratách tiež poskytli presvedčivé dôkazy o agresii vyvolanej AAS. Dospievajúci mužskí škrečkovia, ktorí sú chronicky liečení vysokými dávkami steroidov, majú v porovnaní s neošetrenými mužmi kratšie záchvaty a väčší počet útokov a uhryznutí na mužského votrelca (Harrison, Connor, Nowak, Nash a Melloni, 2000; Melloni, Connor, Hang, Harrison a Ferris, 1997). Mierna provokácia (chvostová špička) spôsobuje pretrvávajúci nárast agresivity u dospievajúcich samcov potkanov, vrátane agresie voči ženám (Cunningham a McGinnis, 2006). Ešte väčšia obava, adolescentná expozícia AAS u škrečkov spôsobuje trvalé zvýšenie agonistického správania, ktoré pretrváva aj po prerušení užívania steroidov (Grimes a Melloni, 2006). Tieto zmeny správania sú sprevádzané pretrvávajúcou remodeláciou nervových obvodov v prednom hypotalame. Najmä adolescentná expozícia AAS u škrečkov zvyšuje arginín vazopresín (AVP, Grimes a Melloni, 2006) a downreguluje serotonín a serotonergné receptory 5HT1A a 5HT1B (Ricci, Rasakham, Grimes a Melloni, 2006). Nemalo by byť prekvapením, že AAS mení aj hladiny mozgu. Chronická expozícia buď testosterónu alebo nandrolonu upreguluje bunkovú jadrovú AR u samcov potkanov (Menard a Harlan, 1993; Wesson a McGinnis, 2006). Existuje teda potenciál pre AAS na zvýšenie správania závislého od androgénov, a to ako doplnením endogénnych androgénov, tak zvýšením androgénnej reakcie prostredníctvom zvýšenej expresie AR.
V porovnaní s agonistickým správaním majú AAS menej výrazný vplyv na párenie u samcov hlodavcov a odpoveď závisí od konkrétneho použitého steroidu (pozri prehľad Clark a Henderson, 2003). U mužských škrečkov konzumujúcich testosterón v perorálnych roztokoch sa ejakulácie zvyšovali spôsobom závislým od dávky (Wood, 2002). Avšak, ani testosterón, ani nandrolon zosilnené párenie u dospievajúcich samcov potkanov. Stanozolol, relatívne menej účinný AAS s minimálnou androgénnou aktivitou, skutočne inhiboval tak párenie, ako aj agresiu (Farrell a McGinnis, 2003), pravdepodobne znížením hladín endogénnych androgénov.
Je obzvlášť dôležité poznamenať, že dospievajúci a dospelí škrečkovia môžu vykazovať rôzne reakcie správania na expozíciu AAS. Zatiaľ čo AAS výrazne zlepšil agonistické správanie u adolescentných mužov, rovnaká liečba v dospelosti viedla len k miernemu nárastu agresívneho správania a významne znížila sexuálne správanie (Salas-Ramirez, Montaldo a Sisk, 2008). To je v súlade s pojmom dospievania ako citlivým obdobím pre činnosť androgénov. Okrem toho, rovnako ako dospelí samci škrečkov získavajú toleranciu na exogénny testosterón (Peters a drevo, 2005), veríme, že vyvíjajúci sa muži získavajú toleranciu na testosterón, keď dozrievajú. Účinky zmeny AAS naprieč vývojom adolescentov a adolescentnej expozície AAS môžu spôsobiť nadmerné agresívne a sexuálne správanie, ktoré môže pretrvávať do dospelosti.
Posilňujúce účinky androgénov
Pářenie a bojovanie sú odmeňovaním (aspoň ak vyhráte boj). Samce potkanov opakovane tlačia páku, aby sa kopulovali so samičkou (Everitt a Stacey, 1987). Podobne, samce myší a samice škrečkov vytvoria podmienku preferovaného miesta (CPP) pre miesta, kde predtým vyhrali zápasy (Martinez, Guillen-Salazar, Salvador a Simon, 1995; Meisel a Joppa, 1994). Ak AAS môže zlepšiť odmeňovanie spoločenského správania nad úroveň normálne pozorovanú u gonád-intaktných samcov, je logické očakávať, že samotný testosterón môže byť odmeňovaný. To bolo testované s použitím dvoch dobre zavedených živočíšnych modelov pre odmeňovanie a posilnenie: CPP a samosprávy. Výsledky týchto štúdií ukazujú, že testosterón je v experimentálnom kontexte posilňujúci, kde anabolické účinky a atletický výkon sú irelevantné. Pri CPP sa testovaná látka opakovane spáruje s jedinečným prostredím (napríklad konkrétnou komorou v testovacom zariadení). Keď zviera spojí spevňujúcu testovaciu látku s týmto prostredím, bude hľadať životné prostredie aj bez odmeny. Prvé správy o androgénovej odmene u laboratórnych zvierat používali systémové injekcie testosterónu na indukciu CPP u samcov myší (Arnedo, Salvador, Martinez-Sanchis a Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis a Pellicer, 2002) a potkanov (Alexander, Packard a Hines, 1994; de Beun, Jansen, Slangen a Van de Poll, 1992). Následne naše laboratórium použilo samopodávanie testosterónu na demonštráciu posilnenia androgénu (Johnson a Wood, 2001). Zistili sme, že mužskí škrečkovia budú dobrovoľne konzumovať perorálne roztoky testosterónu pomocou testov 2-fľaše a pitia vyvolaného potravinami. V neskorších štúdiách sme demonštrovali iv samopodanie u samcov potkanov a škrečkov (Wood, Johnson, Chu, Schad a Self, 2004). Intravenózne podanie eliminuje potenciálne zmätočné účinky chuti alebo črevnej výplne na príjem androgénu.
V súvislosti so zneužívaním AAS je dôležité rozlišovať medzi centrálnymi a periférnymi účinkami androgénov. Vzhľadom k tomu, testosterón má rozšírené účinky v celom tele, to by mohlo byť argumentoval, že odmena a posilnenie s systémovými testosterón injekcie je sekundárne k testosterónu systémové anabolické a androgénne akcie. Inými slovami, možno testosterón znižuje únavu svalov a zlepšuje funkciu kĺbov tak, aby zvieratá jednoducho cítiť lepší. Toto vysvetlenie sa skutočne použilo v klinickej literatúre (aj keď bez experimentálnych dôkazov) na argumentáciu proti potenciálu závislosti a závislosti na AAS (DiPasquale, 1998). Packard a kol.Packard, Cornell a Alexander, 1997) ukázali, že injekcie testosterónu priamo do mozgu potkana môžu indukovať CPP. Podobne, naše laboratórium preukázalo intracerebroventrikulárne (icv) samopodávanie testosterónu u samcov škrečkov (Wood a kol., 2004). Intracerebrálna CPP a icv samopodávanie s testosterónom argumentujú pre centrálne ciele sprostredkujúce posilnenie androgénov.
Je pozoruhodné, že zosilnenie testosterónu nemusí nevyhnutne nasledovať tie isté mechanizmy, ktoré boli predtým stanovené pre účinky steroidov na sexuálne správanie. Ako bolo uvedené vyššie, MPOA je kľúčovým miestom pre organizáciu sexuálneho správania mužských hlodavcov (Hull, Meisel a Sachs, 2002). U škrečkov má MPOA hojné receptory steroidov a implantáty testosterónu v MPOA obnovujú sexuálnu aktivitu v dlhodobých kastrátoch (Wood a Swann, 1999). Časový priebeh týchto steroidných účinkov je pomalý: montážne správanie pretrváva niekoľko týždňov po orchidektómii a predĺžená expozícia steroidom je potrebná na obnovenie párenia v dlhodobých kastrátoch (Noble a Alsum, 1975). Injekcie testosterónu do MPOA samcov potkanov však neindukujú CPP (King, Packard a Alexander, 1999). To naznačuje, že iné mozgové oblasti sú dôležité pre posilnenie androgénov.
Naopak, samce potkanov budú tvoriť CPP na injekcie testosterónu v Acb (Packard a kol., 1997). Rovnako ako u iných liekov zneužívania, DA je pravdepodobne kľúčovým neurotransmiterom na posilnenie testosterónu: CPP indukovaná systémovou injekciou testosterónu je blokovaná antagonistami dopamínových receptorov D1 a D2 (Schroeder a Packard, 2000). Na rozdiel od iných liekov zneužívania však naše štúdie u škrečkov naznačujú, že testosterón nevyvoláva uvoľňovanie Acb DA (Triemstra, Sato a drevo, v tlači). Podobne štúdie na samcoch potkanov ukazujú, že androgény nemajú žiadny vplyv na bazálne hladiny DA alebo na uvoľňovanie DA stimulované amfetamínom (Birgner, Kindlundh-Hogberg, Nyberg a Bergstrom, 2006; ale tiež vidieť Clark, Lindenfeld a Gibbons, 1996). Okrem toho testosterón má relatívne malý vplyv na hladiny tkanív Acb DA (Thiblin, Finn, Ross a Stenfors, 1999). Tieto údaje spoločne naznačujú, že hoci zosilnenie testosterónu môže nakoniec zmeniť aktivitu DA v Acb, mechanizmy môžu byť odlišné od mechanizmov kokaínu alebo iných stimulantov. V tomto ohľade nedávne údaje naznačujú, že chronická expozícia AAS môže zmeniť citlivosť na DA zmenou metabolizmu DA (Kurling, Kankaanpaa, Ellermaa, Karila a Seppala, 2005), hladiny DA receptorov (\ tKindlundh, Lindblom, Bergstrom, Wikberg a Nyberg, 2001; Kindlundh, Lindblom a Nyberg, 2003) alebo dopravcu DA (Kindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom a Nyberg, 2002).
V súčasnosti nie sú známe špecifické steroidné signály, receptory a miesta pôsobenia mozgu na zosilnenie testosterónu. Na základe nedávnej štúdie škrečkov z nášho laboratória sa zdá, že zosilňujúce účinky testosterónu sú sprostredkované androgénmi aj estrogénmi (DiMeo a Wood, 2006). Bežne zneužívané AAS zahŕňajú aromatizovateľné aj nearomatizovateľné androgény (Gallaway, 1997; WADA, 2006). To znamená, že AR aj ER môžu prenášať steroidné stimuly za odmenu. Existuje ďalšia možnosť, že zosilnenie testosterónu môže byť sprostredkované kombináciou klasických a negenomických receptorov.
Niekoľko dôkazov poukazuje na pôsobenie negenómových receptorov na zosilňujúce účinky AAS. Okrem riedkej distribúcie AR v Acb a VTA je časový priebeh androgénnej výstuže rýchly (<30 min) a spracovanie signálu klasickou AR nemusí byť pre výstuž dosť rýchle. Preto sme na otestovanie úlohy negenómovej AR pri posilňovaní AAS použili dve doplnkové techniky (Obr. 7). V jednom experimente (Sato, Johansen, Jordan a Wood, 2006), sme potkanom s testikulárnou feminizačnou mutáciou (Tfm, pozri tento problém) povolili samo-podávanie dihydrotestosterónu (DHT), ktorý nie je aromatizovateľný androgén. Mutácia Tfm výrazne znižuje väzbu ligandu na AR. Tfm potkany a ich samčie súrodenci divokého typu si však sami podávali približne rovnaké množstvo DHT. Toto argumentuje pre negenomické účinky DHT. V následnej štúdii sme zistili, či by samci škrečkovia sami podávali DHT konjugovaný s albumínom hovädzieho séra (BSA, Obr. 8, Sato a Wood, 2007). Konjugáty DHT-BSA sú membránovo nepriepustné; ich účinky sú teda obmedzené na bunkový povrch. Škrečkovníci si sami podávali DHT, ako bolo predtým preukázané (DiMeo a Wood, 2006). Vykazovali podobnú preferenciu pre konjugáty DHT-BSA, ale nedokázali samostatne podávať BSA samostatne.

Obr. 7

Obr. 8
Tieto údaje smerujú k centrálnej úlohe bunkových povrchových AR v androgénnej výstuži. V súčasnosti nie je známa presná povaha takýchto receptorov. Predpokladá sa, že androgény môžu pôsobiť na povrchu bunky prostredníctvom väzby na vyhradenú membránovú AR (Thomas, dressing, Pang, Berg, Tubbs, Benninghoff a Doughty, 2006, pozri tiež túto otázku). To môže byť vo forme extra-nukleárneho klasického AR, ako je uvedené v hippocampus (Sarkey et al., V tomto čísle). Alternatívne predchádzajúce štúdie tiež opísali miesta viazania steroidov na iných systémoch neurotransmiterov. Špecificky, rôzne steroidné hormóny, vrátane AAS, môžu alostericky modulovať receptor GABA-A (Henderson, 2007; Lambert, Belelli, Peden, Vardy a Peters, 2003). Podobne môžu sulfatované neurosteroidy modifikovať aktivitu NmetylDsubtypy receptora aspartátu (Malajev, Gibbs a Farb, 2002) receptory. Toto je dôležitá oblasť pre budúci výskum.
Prečo by mala byť membránová AR? Ako už bolo uvedené, existuje úzka súvislosť medzi vylučovaním androgénu a odmeňovaním sociálneho správania. Môžeme špekulovať, že zvýšenie sekrécie testosterónu, ktoré nasleduje po párení alebo boji, slúži na posilnenie správania. Ak áno, je potrebné mať rýchle spojenie stimulu (správania) a odmeny (testosterónu). To sa dá najlepšie dosiahnuť väzbou na membránu AR. V tomto ohľade by bolo zaujímavé určiť, či upchávanie sekrécie androgénu počas párenia znižuje odmeňujúce účinky sexuálneho správania.
zhrnutie
Tu uvádzame dôkazy o tom, že androgény sú silnými mediátormi dospelého motivovaného správania, a ďalej, že načasovanie expozície androgénu počas rozvojových programov závisí od motivovaného správania závislého od androgénu v dospelosti. Anabolické steroidy sa rýchlo stávajú obľúbenou drogou zneužívania u adolescentov v USA. Kým AAS nemusí mať návykovú silu kokaínu alebo heroínu, práve začíname chápať potenciál pre posilnenie androgénov a závislosť. Najmä vzhľadom na to, že šport mládeže sa stáva konkurencieschopnejším, narastá tlak na vyvíjajúcich sa športovcov, aby používali steroidy od mladšieho veku. Tento trend je znepokojujúci vzhľadom na nové dôkazy o neuronálnom dozrievaní citlivom na steroidy u adolescentov.
Napriek zvýšenej informovanosti verejnosti a vedeckých komunít o hlbokých nervových zmenách sprevádzajúcich adolescenciu, experimentálne štúdium vývojovej neurobiológie puberty bolo obmedzené. Zvieracie modely vývoja adolescentov sú potrebné na zistenie, ako načasovanie vystavenia hormónom počas vývoja zvyšuje riziko jednotlivca pre psychopatológiu a užívanie drog, a aké typy skúseností zmierňujú alebo zosilňujú behaviorálne účinky odchýlok v časoch pubertálu. Napríklad sociálne faktory, ako je vzájomný vplyv, zhoršujú účinky pubertálneho načasovania užívania látok a alkoholu (Biehl, Natsuaki a Ge, 2007; Patton, Nový, Lee a Hickok, 2004; Simons-Morton a Haynie, 2003; Wichstrom a Pedersen, 2001). Zvieracie modely pubertálneho načasovania budú tiež informovať výskumné úsilie človeka a potenciálne povedú k efektívnejším terapeutickým intervenciám počas dospievania.
Poďakovanie
Ďakujeme Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers a Pamela Montalto za pomoc pri týchto štúdiách. Táto práca bola podporená grantmi z NIH (DA12843 na RIW, MH68764 na CLS a MH070125 na KMS).
poznámky pod čiarou
Zrieknutie sa zodpovednosti vydavateľa: Toto je súbor PDF s neupraveným rukopisom, ktorý bol prijatý na uverejnenie. Ako službu pre našich zákazníkov poskytujeme túto skoršiu verziu rukopisu. Rukopis sa podrobí kopírovaniu, sádzaniu a preskúmaniu výsledného dôkazu skôr, ako sa uverejní vo svojej konečnej podobe. Upozorňujeme, že počas výrobného procesu môžu byť zistené chyby, ktoré by mohli mať vplyv na obsah, a všetky právne zrieknutia sa zodpovednosti, ktoré sa vzťahujú na časopis.
Referencie
- Alexander GM, Packard MG, Hines M. Testosterón odmeňuje afektívne vlastnosti u samcov potkanov: dôsledky pre biologický základ sexuálnej motivácie. Behavioral Neuroscience. 1994;108: 424-8. [PubMed]
- Andersen SL. Trajektórie vývoja mozgu: bod zraniteľnosti alebo okne príležitosti? Neurovedy a biobehaviorálne recenzie. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Pohlavné rozdiely v nadmernej produkcii a eliminácii dopamínových receptorov. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, González-Bono E. Odmeňujúce vlastnosti testosterónu u intaktných samcov myší: pilotná štúdia. Farmakológia, biochémia a správanie. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Podobné odmeňujúce účinky testosterónu u myší hodnotených ako jedinci s krátkou a dlhou dobou trvania. Závislosť Biológia. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Organizačné a aktivačné účinky pohlavných steroidov na mozog a správanie: reanalýza. Hormóny a správanie. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Konvergencia a plasticita monoaminergných systémov v mediálnom prefrontálnom kortexe počas postnatálneho obdobia: implikácie pre rozvoj psychopatológie. Mozgová kôra. 2000;10: 1014-27. [PubMed]
- Benes FM, korytnačka M, Chán Y, Farol P. Myelinizácia kľúčovej reléovej zóny v hipokampálnej formácii sa vyskytuje v ľudskom mozgu v detstve, dospievaní a dospelosti. Archívy všeobecnej psychiatrie. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Vplyv pubertálneho načasovania na konzumáciu alkoholu a trajektórie ťažkého pitia. Časopis mládeže a dospievania. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Neuroscience Letters. 2006. Zmenené extracelulárne hladiny DOPAC a HVA v jadre potkana sa akumulujú v reakcii na sub-chronické nandrolonové podanie a následnú stimuláciu amfetamínom.
- Bond AJ, Choi PY, pápež HG., Jr Hodnotenie zaujatosti a nálady pozornosti u užívateľov a neužívateľov anabolických androgénnych steroidov. Závislosť od drog a alkoholu. 1995;37: 241-5. [PubMed]
- Brower KJ. Anabolické steroidy a závislosť. Aktuálne správy o psychiatrii. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Klinické hodnotenie a testovanie moču na anabolické androgénne užívanie steroidov a závislosť. American Journal of Drug & Alcohol Abuse. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Metabolizmus steroidov v mozgu cicavcov: 5alpha-redukcia a aromatizácia. Brain Research Bulletin. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Sexuálna diferenciácia jadra lôžka terminálu stria u ľudí sa môže rozšíriť do dospelosti. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Behaviorálne a fyziologické reakcie na anabolické androgénne steroidy. Neurovedy a biobehaviorálne recenzie. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Anabolické androgénne steroidy a odmena mozgu. Farmakológia, biochémia a správanie. 1996;53: 741-5.
- Conacher GN, Workman DG. Násilný trestný čin súvisiaci s užívaním anabolických steroidov. American Journal of Psychiatry. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Fyzická provokácia pubertálnych anabolických androgénnych steroidmi vystavených samcov potkanov vyvoláva agresiu voči ženám. Hormóny a správanie. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Cerebrospinálna tekutina a zmeny správania po podaní metyltestosterónu: predbežné zistenia. Archívy všeobecnej psychiatrie. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Štrukturálne sexuálne dimorfizmy v anteroventrálnom periventrikulárnom jadre potkanieho hypotalamu sú citlivé na gonádové steroidy perinatálne, ale vyvíjajú sa peripubertálne. Neuroendokrinologie. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Testosterón ako apetitívny a diskriminačný stimul u potkanov: účinky závislé od pohlavia a dávky. Fyziológia a správanie. 1992;52: 629-34. [PubMed]
- Dekaban AS. Zmeny hmotnosti mozgu v priebehu ľudského života: vzťah hmotnosti mozgu k telesnej výške a telesnej hmotnosti. Annals of Neurology. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Lieky zneužívané ľuďmi prednostne zvyšujú koncentrácie synaptických dopamínov v mezolimbickom systéme voľne sa pohybujúcich potkanov. Zborník Národnej akadémie vied Spojených štátov amerických. 1988;85: 5274-8. [Článok bez PMC] [PubMed]
- DiMeo AN, Wood RI. Samostatné podávanie estrogénu a dihydrotestosterónu u samcov škrečkov. Hormóny a správanie. 2006;49: 519-26. [PubMed]
- DiPasquale M. Anabolické steroidy. V: Tarter RE, Ammerman RT, Ott PJ, redaktori. Príručka zneužívania látok. Plenum Press; NY: 1998. s. 547 – 565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Regulácia prostredníctvom mediálnej amygády kopulácie a mediálneho predoptického uvoľňovania dopamínu. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stimulácia mediálnej amygdaly zlepšuje uvoľňovanie mediálneho preoptického dopamínu: dôsledky pre sexuálne správanie samcov potkanov. Brain Research. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastrácia znižuje extracelulárny stav, ale zvyšuje intracelulárny dopamín v mediálnej preoptickej oblasti samcov potkanov. Brain Research. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Príroda a osud proliferatívnych buniek v hipokampálnom dentálnom gýri počas života opice rhesus. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Štúdium inštrumentálneho správania se sexuálnou podporou u samcov potkanov (Rattus norvegicus): II. Účinky lézií preoptickej oblasti, kastrácie a testosterónu. Časopis komparatívnej psychológie. 1987;101: 407-19. [PubMed]
- Gallaway S. Biblia Steroid. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Profil osobnosti mužov používajúcich anabolické androgénne steroidy. Hormóny a správanie. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Predĺžené zmeny v serotonínovom nervovom systéme po zastavení expozície adolescentných anabolických androgénnych steroidov u škrečkov (Mesocricetus auratus) Behavioral Neuroscience. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Psychologické zmeny a zmeny v sérovej homovanillovej kyseline u mužov, ktorým sa podávali androgénne steroidy. Psychoneuroendocrinology. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr Chronická anabolicko-androgénna liečba steroidmi počas dospievania zvyšuje predný hypotalamický vazopresín a agresiu u intaktných škrečkov. Psychoneuroendocrinology. 2000;25: 317-38. [PubMed]
- On J, Crews FT. Neurogenéza klesá počas dozrievania mozgu z dospievania do dospelosti. Farmakológia, biochémia a správanie. 2007;86: 327-33.
- Henderson LP. Steroidná modulácia prenosu sprostredkovaného receptorom GABAA v hypotalame: účinky na reprodukčnú funkciu. Neuropharmacology. 2007;52: 1439-53. [Článok bez PMC] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Extracelulárny dopamín v mediálnej preoptickej oblasti: dôsledky sexuálnej motivácie a hormonálnej kontroly kopulácie. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Mužské sexuálne správanie. In: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, redaktori. Hormóny, mozog a správanie. Akademická tlač; New York: 2002. s. 3 – 137.
- Hull EM, Wood RI, McKenna KE. Neurobiológia mužského sexuálneho správania. In: Neill JD, editor. Fyziológia reprodukcie. Vol. 1. Elsevier Press; New York: 2006. s. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Regionálne rozdiely v synaptogenéze v ľudskej mozgovej kôre. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Perorálne samo-podávanie testosterónu u samcov škrečka. Neuroendokrinologie. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Študenti stredných škôl (NIH číslo publikácie 03 – 5375) I. Bethesda, MD: Národný inštitút pre zneužívanie drog; 2003. Monitorovanie výsledkov národného prieskumu o budúcnosti užívania drog, 1975 – 2002.
- Kaiser Family Foundation. Sexuálna aktivita v USA. 2005. pp. # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Regulácia imunoreaktivity mozgového androgénneho receptora androgénom u prepubertálnych samcov fretiek. Biológia reprodukcie. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminergné účinky po chronickej liečbe nandrolonom vizualizovaným v mozgu potkana pozitrónovou emisnou tomografiou. Pokrok v neuro-psychofarmakológii a biologickej psychiatrii. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Anabolicko-androgénny steroid nandrolon dekanoát ovplyvňuje hustotu dopamínových receptorov v mozgu samca potkana. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Chronické podávanie s nanoprolónom dekanoátu indukuje zmeny v obsahu génu-transkriptu dopamínových D (1) - a D (2) -receptorov v mozgu potkana. Brain Research. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Afektívne vlastnosti intra-mediálnych preoptických oblastí injekcií testosterónu u samcov potkanov. Neuroscience Letters. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Neurobiológia drogovej závislosti. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, pápež HG, Jr, Oliva PS. Zvýšená agresívna odpoveď u mužských dobrovoľníkov po podaní postupne sa zvyšujúcich dávok testosterónu cypionátu. Závislosť od drog a alkoholu. 1995;40: 73-9. [PubMed]
- Kritzer MF. Dlhodobá gonadektómia ovplyvňuje hustotu tyrozínhydroxylázovej, ale nie dopamín-beta-hydroxylázovej, cholín acetyltransferázovej alebo serotonínovej imunoreaktívnej axónov v mediálnych prefrontálnych kortikách dospelých samcov potkanov. Mozgová kôra. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Účinok sub-chronickej nano-nanolovej dekanoátovej liečby na dopaminergné a serotonergné neurónové systémy v mozgoch potkanov. Brain Research. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Neurosteroidná modulácia receptorov GABAA. Pokrok v neurobiológii. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Vývoj mozgu u detí a dospievajúcich: poznatky z anatomickej magnetickej rezonancie. Neuroveda a biobehaviorálne hodnotenie. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogenéza inaminácie dopamínu v nucleus accumbens gerbilov. Brain Research. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Inhibícia NMDA reakcie pregnenolón sulfátom odhaľuje subtyp selektívnu moduláciu NMDA receptorov sulfátovými steroidmi. British Journal of Pharmacology. 2002;135: 901-9. [Článok bez PMC] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Úspešná intermale agresia a preferované miesto u myší. Fyziológia a správanie. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Účinky testosterónu v prepubertálnych a postpubertálnych mužských škrečkoch: disociácia účinkov na reprodukčné správanie a imunoreaktivitu mozgového androgénneho receptora. Hormóny a správanie. 1997;31: 75-88.
- Meisel RL, Joppa MA. Podmienečné preferencie miesta u škrečkov po agresívnych alebo sexuálnych stretnutiach. Fyziológia a správanie. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Expozícia anabolických androgénnych steroidov počas adolescencie a agresívneho správania u zlatých škrečkov. Fyziológia a správanie. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Upregulácia imunoreaktivity receptora androgénu v mozgu potkana androgénnymi anabolickými steroidmi. Brain Research. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiol znižuje vápnikové prúdy u neostriálnych neurónov potkanov cez membránový receptor. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Úrovne agresie medzi skupinou užívateľov anabolických androgénnych steroidov. Medicína, veda a právo. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Dospievajúci sociálna skúsenosť obnovuje ejakulačné správanie dospelých u samčích škrečkov, ktorým chýba pubertálny testosterón. Spoločnosť pre behaviorálnu neuroendokrinológiu; Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Hormonálne závislé pohlavné dimorfizmy v zlatom škrečkovi (Mesocricetus auratus) Fyziológia a správanie. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Bunková smrť pri vývoji zadnej kortexu u samcov a samíc potkanov. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Vaječníkové hormóny po postnatálnom dni 20 znižuje počet neurónov v primárnej vizuálnej kôre potkana. Journal of Neurobiology. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Účinky testosterónu na náladu, agresiu a sexuálne správanie u mladých mužov: dvojito zaslepená, placebom kontrolovaná, krížová štúdia. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Odmeňovanie afektívnych vlastností intra-nucleus accumbens injekcií testosterónu. Behavioral Neuroscience. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH mRNA sa zvyšuje s pubertou v mozgu mužského sýrskeho škrečka. Journal of Neuroendokrinology. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Anabolické užívanie steroidov amatérskymi športovcami: účinky na psychologické stavy nálady. Journal of Sports Medicine & Physical Fitness. 1994;34: 292-8. [PubMed]
- Patton PE, Nový MJ, Lee DM, Hickok LR. Diagnóza a reprodukčný výsledok po chirurgickej liečbe kompletnej septálnej maternice, duplikovaného krčka maternice a vaginálnej priehradky. American Journal of Obstetrics & Gynecology. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Zretie bielej hmoty v ľudskom mozgu: prehľad štúdií magnetickej rezonancie. Brain Research Bulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Merania agresivity a zmeny nálady u mužských vzpieračov s použitím androgénnych anabolických steroidov a bez nich. Journal of Forensic Sciences. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Androgénna závislosť u škrečkov: predávkovanie, tolerancia a potenciálne opioidergické mechanizmy. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Sexuálne správanie zvyšuje centrálny prenos dopamínu u samcov potkanov. Brain Research. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC. Usporiadanie účinku prenatálne podávaného propionátu testosterónu na tkanivá sprostredkujúce párovacie správanie u samíc morčiat. Endocrinology. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Vývoj pohlavných rozdielov v locus coeruleus potkana. Brain Research Bulletin. 2001;56: 73-8. [PubMed]
- Pápež HG, Jr, Katz DL. Zabitie a zabitie zo strany užívateľov anabolických steroidov [pozri komentár] Journal of Clinical Psychiatry. 1990;51: 28-31. [PubMed]
- Pápež HG, Jr, Katz DL. Psychické a medicínske účinky užívania anabolických a androgénnych steroidov. Kontrolovaná štúdia športovcov 160. Archívy všeobecnej psychiatrie. 1994;51: 375-82. [PubMed]
- Pope HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Použitie anabolických androgénnych steroidov u väzňov 133. Komplexná psychiatria. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Obnovenie kopulačného správania testosterónom koreluje s mediálnym preoptickým uvoľňovaním dopamínu u kastrovaných samcov potkanov. Hormóny a správanie. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Účinky metabolitov testosterónu na kopuláciu a uvoľňovanie mediálneho preoptického dopamínu u kastrovaných samcov potkanov. Hormóny a správanie. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Účinky metabolitov testosterónu na kopuláciu, mediálny preoptický dopamín a NOS-imunoreaktivita u kastrovaných samcov potkanov. Hormóny a správanie. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Postnatálna neurogenéza v jadre vazopresínu a oxytocínu hypotalamu ošípaných. Brain Research. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A receptorová aktivita a expresia modulujú adolescentnú anabolickú / androgénnu steroidmi indukovanú agresiu u škrečkov. Farmakológia, biochémia a správanie. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosterón aktivuje sexuálne správanie u dospelých samcov škrečkov, ale nie u mladých jedincov. Fyziológia a správanie. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Imunoreaktivita estrogénového receptora u prepubertálnych a dospelých samčích škrečkov. Neuroscience Letters. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromóny vyvolávajú ekvivalentné hladiny imunoreaktivity Fos u prepubertálnych a dospelých samčích sýrskych škrečkov. Hormóny a správanie. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Puberta a zrenie mužského mozgu a sexuálneho správania: prepracovanie behaviorálneho potenciálu. Neurovedy a biobehaviorálne recenzie. 2002;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiol indukuje hypotalamové progesterónové receptory, ale neaktivuje párenie u samcov škrečkov (Mesocricetus auratus) pred pubertou. Behavioral Neuroscience. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Anabolické androgénne steroidy (AAS) odlišne ovplyvňujú sociálne správanie sa u dospievajúcich a dospelých samčích škrečkov. Hormóny a správanie. 2008 v tlači.
- SAMHSA / OAS. Číslo publikácie DHHS (SMA) 1996. 1994 Národný prieskum domácností o zneužívaní drog, hlavné zistenia 1994; s. 96 – 3085.
- SAMHSA / OAS. Výsledky z Národného prieskumu 2004 o užívaní drog a zdraví: Národné zistenia. 2005. NSDUH Séria H-28, publikácia DHHS č. SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Samopodávanie androgénu u potkanov Tfm. 10th Výročné stretnutie spoločnosti pre správanie Neuroendocrinology.2006.
- Sato SM, drevo RI. Samopodávanie membránovo nepriepustných anabolických androgénnych steroidov (aas) u škrečkov syrskej. 11th Výročné stretnutie spoločnosti fof Behavioral Neuroendocrinology.2007.
- Schroeder JP, Packard MG. Úloha subtypov dopamínových receptorov pri získavaní preferencie miesta testosterónu u potkanov. Neuroscience Letters. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Domáce násilie spojené so zneužívaním anabolických steroidov. American Journal of Psychiatry. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Expozícia testikulárneho hormónu počas dospievania organizuje správanie bočného značenia a väzbu vazopresínového receptora v laterálnej priehradke. Hormóny a správanie. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Mediálne preoptické oblasti dopaminergných odpovedí na ženské feromóny sa vyvíjajú počas puberty v mužskom sýrskom škrečkovi. Brain Research. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadálne hormóny maskulinizujú a defeminizujú reprodukčné správanie počas puberty v mužskom sýrskom škrečkovi. Hormóny a správanie. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Pubertálne hormóny, dospievajúci mozog a dozrievanie spoločenského správania: Poučenie zo sýrskeho škrečka. Molekulárna a bunková endokrinológia. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Plánovač stretnutí neurovied. Sandiego, CA: Spoločnosť pre neurovedy; 2007. Je adolescencia druhým citlivým obdobím pre organizačné účinky testosterónu na dospelé mužské reprodukčné správanie? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Kritické obdobia v organizácii systémov. Vývojová psychobiológia. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Porovnávacia distribúcia estrogénového receptora-alfa a -beta mRNA v centrálnom nervovom systéme potkana. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Psychosociálne prediktory zvýšenej fázy fajčenia medzi šiestimi zrovnávačmi. American Journal of Health Behavior. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Pubertálne hormóny organizujú adolescentný mozog a správanie. Hranice v neuroendokrinológii. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Vitajte SE, Kan E, Toga AW. Dlhodobé mapovanie kortikálnej hrúbky a rastu mozgu u normálnych detí. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Mapovanie pokračujúceho mozgového rastu a zníženia hustoty šedej hmoty v zadnej čelnej kôre: Inverzné vzťahy počas dozadového zrenia mozgu. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spear LP. Adolescentný mozog a prejav správania súvisiace s vekom. Neuroveda a biobehaviorálne hodnotenie. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neuropsychiatrické účinky anabolických steroidov u mužských zdravých dobrovoľníkov. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Zvýšené dopaminergné a 5-hydroxytryptaminergné aktivity v mozgu samcov potkanov po dlhodobej liečbe anabolickými androgénnymi steroidmi. British Journal of Pharmacology. 1999;126: 1301-6. [Článok bez PMC] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, receptory viazané na estrogén a androgén G-proteín v gonadách rýb. Steroidy. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Účinky suprafyziologických dávok testosterónu na nahnevané správanie u zdravých eugonadálnych mužov - štúdia klinického výskumného centra. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Chemosenzorické podnety sú nevyhnutné pre uvoľňovanie dopamínu indukovaného párením v MPOA samčích škrečkov. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testosterón a nucleus accumbens dopamín u mužského syrského škrečka. Psychoneuroendocrinology (v tlači)
- Van Eenoo P, Delbeke FT. Prevalencia dopingu vo Flámsku v porovnaní s prevalenciou dopingu v medzinárodných športoch. Medzinárodný žurnál športovej medicíny. 2003;24: 565-570. [PubMed]
- WADA. Nežiaduce analytické zistenia hlásené akreditovanými laboratóriami. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Stohovanie anabolických androgénnych steroidov (AAS) počas puberty u potkanov: neuroendokrinné a behaviorálne hodnotenie. Farmakológia, biochémia a správanie. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Použitie anabolicko-androgénnych steroidov v dospievaní: víťazstvo, dobrý vzhľad alebo zlé? Časopis štúdií o alkohole. 2001;62: 5-13. [PubMed]
- Drevo RI, Johnson LR, Chu L, Schad C, Self DW. Testosterónová výstuž: intravenózne a intracerebroventrikulárne samo-podávanie samcov potkanov a škrečkov. Psychopharmacology. 2004;171: 298-305. [PubMed]
- Drevo RI, Newman SW. Receptory androgénu a estrogénu koexistujú s jednotlivými neurónmi v mozgu škrečka sýrskeho. Neuroendokrinologie. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Neuronálna integrácia chemosenzorických a hormonálnych signálov, ktoré kontrolujú mužské sexuálne správanie. In: Wallen K, Schneider JS, redaktori. Reprodukcia v kontexte. MIT Stlačte; Cambridge: 1999. s. 423 – 444.
- Zahm DS, Heimer L. Dve transpallidálne dráhy pochádzajúce z jadra nucleus accumbens. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]