Vedecké správy objem 9, Číslo článku: 16918 (2019)
abstraktné
Nadmerná konzumácia sacharózy vyvoláva chuť na závislosť, ktorá môže podporovať epidémiu obezity. Opioidy a dopamín sprostredkujú prospešné účinky návykových látok a prírodných výhod z podnetov, ako je chutné jedlo. Skúmali sme účinky sacharózy pomocou PET zobrazovania pomocou [11C] karfentanil (agonista μ-opioidného receptora) a [11C] racloprid (antagonista dopamínového D2 / 3 receptora) u siedmich žien anestetizovaných miniprasami Göttingen. Potom sme umožnili miniprasiatkam prístup k roztoku sacharózy počas jednej hodiny počas 12 po sebe nasledujúcich dní a znova sme uskutočňovali zobrazovanie 24 hodín po finálnom prístupe k sacharóze. V menšej vzorke piatich miniprasiat sme vykonali ďalšiu skúšku [11C] relácia karfentanilu PET po prvej expozícii sacharózy. Vypočítali sme väzbové potenciály voxel (BPND) použitie mozgu ako oblasti nevypovedateľnej väzby, analyzovanie rozdielov so štatistickým neparametrickým mapovaním a vykonanie regionálnej analýzy. Po 12 dňoch prístupu k sacharóze, BPND z oboch indikátorov významne poklesol v striate, nucleus accumbens, thalamus, amygdala, cingulate cortex a prefrontal cortex, čo je v súlade so znížením hustoty receptorov. Po jednorazovej expozícii sacharóze sme zistili zníženú väzbu [11C] karfentanil v jadre accumbens a cingulate cortex, v súlade s uvoľňovaním opioidov. Nižšia dostupnosť opioidných a dopamínových receptorov môže vysvetľovať návykový potenciál spojený s príjmom sacharózy.
úvod
Päť percent svetovej populácie je klinicky obéznych1, Ako charakteristický znak metabolického syndrómu je obezita spojená s cukrovkou 2. typu, kardiovaskulárnymi chorobami, respiračnými problémami a rizikom depresie a možno demencie.2, Zvýšená spotreba energeticky hustých potravín prehĺbila fyziologické rozlíšenie medzi homeostatickým hladom, ktorý nasleduje po nedostatku potravy, a hedonickým hladom alebo „túžbou“, ku ktorej dochádza v prípade absencie nedostatku.3,4, Keďže samotná homeostatická regulácia nemôže zodpovedať za súčasný nárast obezity, je potrebné vyskúšať účinok odmeňovania a potešenia z návykových vlastností vysoko chutného jedla na mozgové mechanizmy.
Spotreba sacharózy je spojená s obezitou a sacharóza sa čoraz viac považuje za návykovú látku5, Niektoré nálezy sú v rozpore s týmto tvrdením z dôvodu ťažkostí pri oddeľovaní neochutnateľnej spotreby potravín od hedonických potravinových reakcií a pri určovaní návykovej zložky v spracovaných potravinách, ako aj z rôznych mechanizmov, ktorými potravina mení prirodzené dráhy mozgu.6, Napriek tomu v určitých kontextoch príjem sacharózy vyvoláva odmenu a túžbu porovnateľnú s tými, ktoré vyvolávajú návykové látky, čo vedie k nadmernej spotrebe a prípadnej obezite.6,7.
Hlad je spojený s „túžbou“, ktorá úzko súvisí s účinkami dopaminergnej neurotransmisie za mnohých okolností odmeňovania.8, ale nie je jasné, ako sa moduluje účinok dopamínu (DA) v reakcii na kompulzívne stravovanie. Spotreba chutných potravín je spojená s „obľubou“ sprostredkovanou predovšetkým endogénnym opioidným systémom, najmä μ-opioidným receptorom (μOR).9,10, ktoré môžu pri nadmernej spotrebe podporovať nadmernú spotrebu. V tejto správe testujeme tvrdenie, že sacharóza vedie k uvoľňovaniu opioidov a dopamínu, čo znižuje dostupnosť receptorov μOR a DA D2 / 3. Dostupnosť je index počtu neobsadených receptorov dostupných na naviazanie indikátorov a v zásade nerozlišuje medzi obsadením ligandu a hustotou receptorov11.
Nástup kompulzívneho stravovania závisí od viacerých faktorov a kauzálne štúdie u ľudí vyvolávajú etické problémy. Väčšina štúdií sa preto zameriava na stravovacie správanie u potkanov12, Aj keď potkany majú „sladký zub“, ich homeostatické mechanizmy dôležité pre prírastok na hmotnosti, metabolizmus a typ hromadenia tuku sa výrazne líšia od mechanizmov u ľudí. Mincovňa Göttingen je veľké všežravé zviera s dobre vyvinutým gyrencefálnym mozgom, ktoré je možné v dostatočnom rozlíšení zobraziť. Jeho dobre definované subkortikálne a prefrontálne kortikálne oblasti13 umožňujú priamejší preklad do funkcie ľudského mozgu. Na testovanie sa tu používa pozitrónová emisná tomografia (PET) in vivo dostupnosť μOR a DA D2 / 3 v minipraserovom modeli subchronickej expozície sacharóze. V menšej vzorke sme skúmali okamžité účinky na obsadenie μOR po prvom vystavení sacharóze. Nakoniec sme testovali vzťah medzi zmenami v dostupnosti receptorov týchto dvoch indikátorov.
výsledky
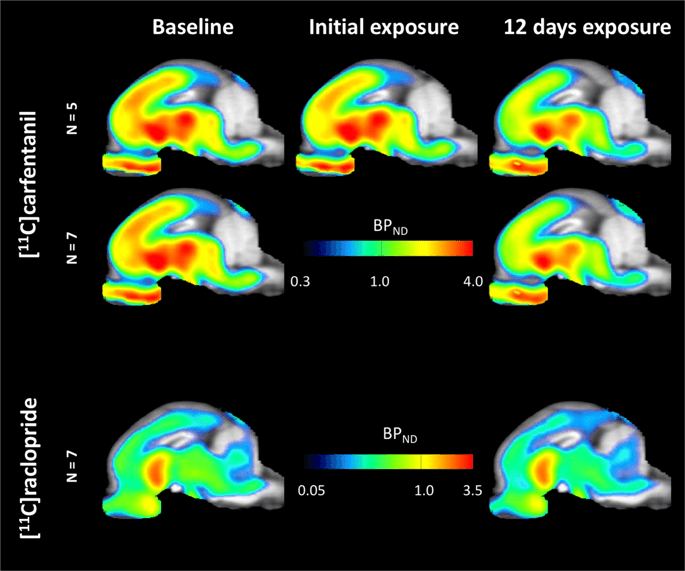
Priemerné parametrické mapy [11C] karfentanilu a [11C] raclopridový väzobný potenciál (BPND) sú znázornené na obr. 1, Analyzovať zmeny, ktoré nastali po prvej expozícii sacharózy u piatich miniprasiat v porovnaní s východiskovou hodnotou a jeden deň po 12th prístup k sacharóze v siedmich miniprasiach v porovnaní s východiskovou hodnotou, použili sme permutačnú teóriu a neregionálne obmedzenú analýzu celého mozgu, preferovanú metódu pre vzorky tejto veľkosti14.
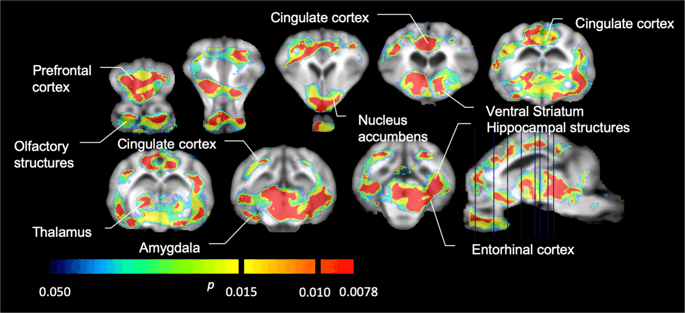
Priemerný nevoliteľný väzbový potenciál voxel (BPND) mapy prekrývajúce sa na obrázkoch MRI v sagitálnom zobrazení. Údaje sú uvedené pre [11C] karfentanil BPND z 5 miniprasiek zobrazených na začiatku, po počiatočnej expozícii sacharóze a po 12 dňoch expozície sacharózy (horný riadok). [11C] karfentanil BPND všetkých 7 miniprasiat zobrazených na začiatku a po 12 dňoch prístupu k sacharóze je uvedené v strednom riadku. [11C] racloprid BPND všetkých 7 miniprasiat zobrazených na začiatku a po 12 dňoch prístupu k sacharóze je zobrazené v dolnom riadku. Upozorňujeme, že farebná škála je exponenciálna na zvýraznenie [11C] racloprid BPND v mimozemských regiónoch.
Počiatočná expozícia sacharóze
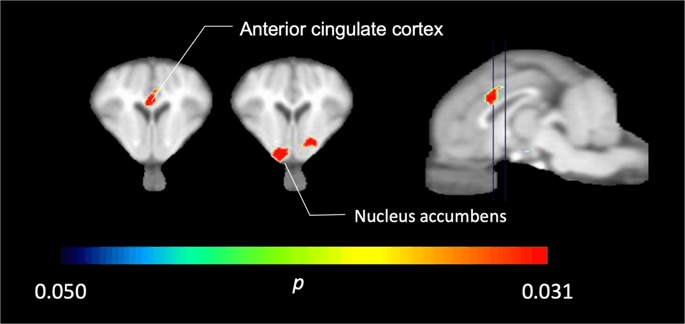
V piatich miniprasách zobrazených pomocou [11C] karfentanilu na začiatku a bezprostredne po prvej expozícii sacharózy sme zistili signifikantne zníženú väzbu indikátorov v kortexe predného cingulátu a jadra accumbens v reakcii na sacharózu, ako je znázornené farbou na obr. 2, čo naznačuje p <0.05. Zistili sme až 14% zníženie väzby značkovača v oboch oblastiach v porovnaní s východiskovou hodnotou.
Významné zníženie v [11C] karfentanil BPND po prvej expozícii sacharózovej vody v porovnaní s východiskovou hodnotou (n = 5). Iba voxely s významným (p <0.05) poklesy sú zobrazené ako farebné oblasti premietané na rezolúcie MRI vážené T1 na úrovni prednej cingulárnej kôry (vľavo) a nucleus accumbens (v strede) zo stereotaxického atlasu miniprasiat. Upozorňujeme, že maximálna úroveň významnosti dosiahnuteľná u 5 zvierat je 2-5 ≈ 0.031 (pozri farebný pruh). Údaje sú uvedené na koronálnych rezoch mozgu ošípaných na úrovniach uvedených na sagitálnom obrázku (vpravo).
12 dní prístupu k sacharóze
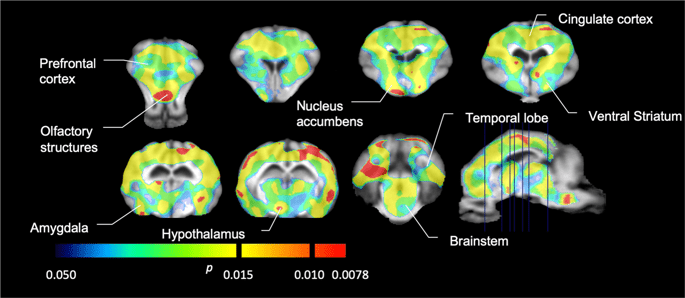
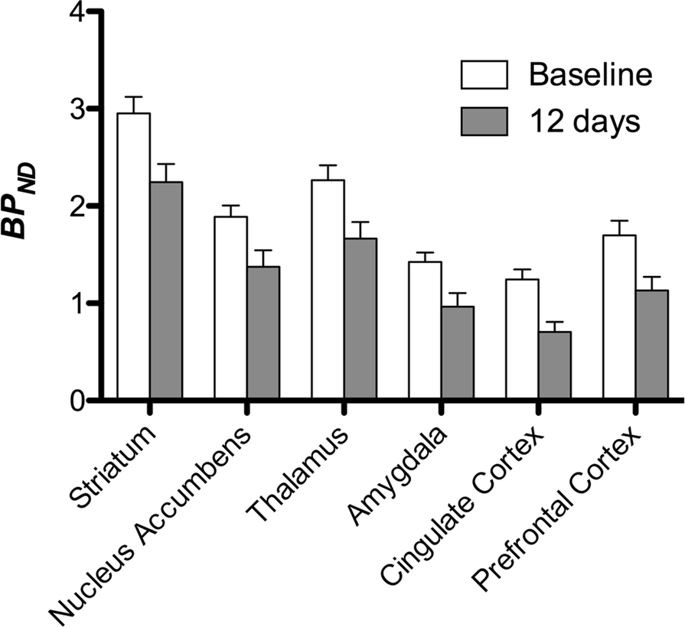
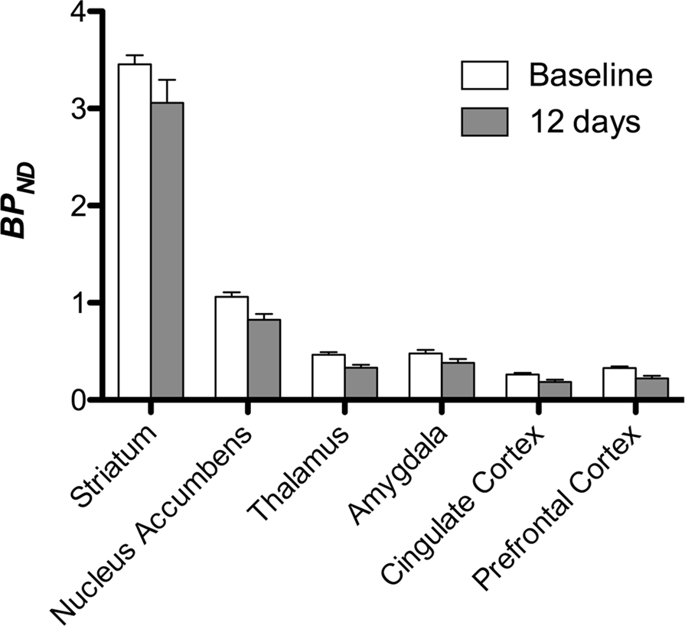
Potom sme vykonali analýzu siedmich miniprasiek zobrazených pomocou [11C] karfentanil na začiatku a po 12 dňoch prístupu k sacharóze a zistilo sa, že v porovnaní so vstupnou hladinou u zvierat vystavených sacharóze došlo k významnému zníženiu väzby na stopové látky. Najvýraznejšie postihnuté regióny sú na obr. 3 (p <0.01) a zahŕňajú časti čuchových štruktúr, nucleus accumbens / ventral striatum a temporálnu kôru / lalok, po ktorých nasledujú oblasti zobrazené žltou farbou (p <0.015), ktoré zahŕňali časti prefrontálnej kôry, cingulárnu kôru, amygdalu a mozgový kmeň . Za účelom získania BPND hodnoty a vyhodnotiť percentuálnu zmenu, vykonali sme regionálnu analýzu a získali priemerné hodnoty v každom regióne na začiatku a po konzumácii sacharózy (obr. 4).
Významné zníženie v [11C] potenciál viazania karfentanilu (BPND) medzi východiskovou hodnotou a po 12 dňoch expozície sacharózovej vody (n = 7). Voxely s významným (p <0.05) poklesy sú zobrazené ako farebné oblasti premietnuté na T1 vážené MRI strihy zo stereotaxického atlasu miniprasiat. Údaje sú prezentované na rezoch koronálneho mozgu v úrovniach uvedených na sagitálnom obrázku (vpravo dole). Upozorňujeme, že maximálna úroveň významnosti dosiahnuteľná u 7 zvierat je 2-7 ≈ 0.0078 (pozri farebný pruh).
Použili sme [11C] racloprid ako indikátor DA D2 / 3 receptorov v striatálnych a extrastriatálnych mozgových oblastiach v miniprasiach na začiatku a po 12 dňoch prístupu k sacharóze (obr. 1). Zistili sme zníženú väzbu značkovača u zvierat exponovaných sacharóze v porovnaní s východiskovou hodnotou s najväčšími účinkami (p <0.01) v oblastiach prefrontálnej kôry, nucleus accumbens / ventral striatum, cingulate cortex, amygdala, talamus, mesencephalon, hipokampálne oblasti a čuchové oblasti (Obr. 5). Dáta z regionálnej analýzy sú uvedené na obr. 6.
Významné zníženie v [11C] raclopridový väzobný potenciál (BPND) medzi východiskovou hodnotou a po 12 dňoch expozície sacharózovej vody (n = 7). Voxely s významným (p <0.05) poklesy sú zobrazené ako farebné oblasti premietnuté na T1 vážené MRI strihy zo stereotaxického atlasu miniprasiat. Údaje sú prezentované na koronálnych rezoch mozgu ošípaných v úrovniach uvedených na sagitálnom obrázku (vpravo dole). Upozorňujeme, že maximálna úroveň významnosti dosiahnuteľná u 7 zvierat je 2-7 ≈ 0.0078 (pozri farebný pruh).
Korelácie medzi [11C] racloprid a [11C] údaje karfentanilu
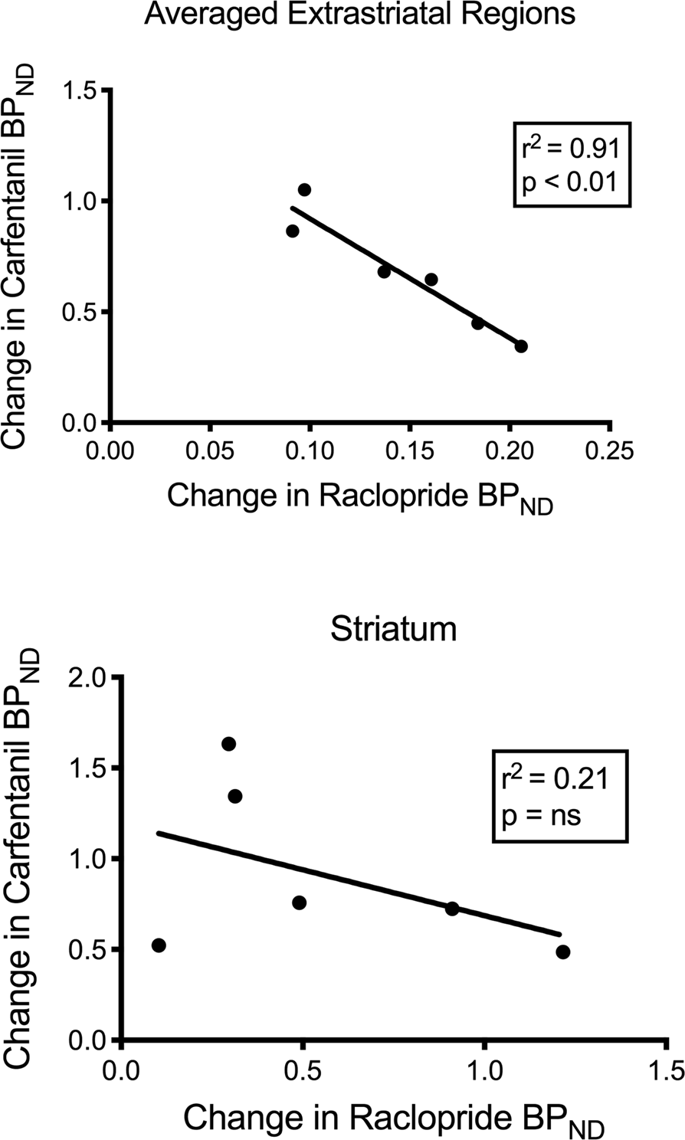
Testovali sme potenciálnu koreláciu medzi [11C] racloprid a [11C] hodnoty karfentanilu BPND v striatálnych a netriatálnych oblastiach miniprasiat na začiatku a po 12 dňoch príjmu sacharózy, bez pozorovania asociácií. Potom sme testovali, či pokles väzieb indikátorov koreloval, a porovnali sme zmeny BPND pre [11C] racloprid so zmenami BPND pre [11C] karfentanil iba v miniprasiatkach, ktoré mali nižší BPND oboch indikátorov po príjme sacharózy (n = 6). Zistili sme významné negatívne korelácie v spriemerovanom mimstriatálnom (r2 = 0.91, p <0.01), ale nie v striatálnych oblastiach (obr. 7).
Korelácie medzi pred a po odmietnutí [11C] racloprid a [11Potenciál viazania karfentanilu (BPND) u miniprasiat so zníženou väzbou indikátorov po príjme sacharózy (n = 6). Uvádzajú sa údaje z spriemerovaných mimstriatálnych oblastí (hore) a striatum (dole). Koeficient určenia (r2) a hodnoty p sú zobrazené pre každý graf.
Diskusia
Stanovili sme účinky opakovaného prerušovaného prístupu k sacharóze na opiátovú a DA neurotransmisiu v mozgu cicavcov. pozdĺžny in vivo PET zobrazovanie receptorov μOR a DA D2 / 3 odhalilo zníženú dostupnosť receptora v celom obvode odmeňovania vrátane jadra accumbens, prefrontálnej kôry a prednej cingulátnej kôry. Výsledky jasne ukazujú, že sacharóza ovplyvňuje mechanizmy odmeňovania podobným spôsobom ako zneužívanie drog.
Je známe, že príjem sacharózy ako chutnej látky uvoľňuje DA a vyvoláva závislosť u hlodavcov15, pričom sa ukázalo, že sacharóza je v niektorých kontextoch ešte príjemnejšia ako kokaín u hlodavcov. Hlodavce teda pracujú intenzívnejšie na získavaní sacharózy ako kokaín, a to aj bez nedostatku potravy5, Účinky sacharózy sú však regulované tak homeostatickým systémom, ako aj hedonickými systémami odmeňovania16,17 ktoré môžu sprostredkovať rozdiel medzi výživovými a hedonickými aspektmi pôsobenia sacharózy18, Rozhodli sme sa pre rozvrhnutie jednej hodiny denne, aby sme podporili „binging“, pretože predchádzajúce štúdie na potkanoch odhalili vyšší príjem počas prvej hodiny denného prístupu v prerušovanom režime.15,19, Behaviorálne štúdie príjmu potravy sa často zameriavajú na zvieratá s obmedzeným prístupom k potravinám, ale návrh nemusí nevyhnutne odrážať tie isté nervové mechanizmy, ktoré sú aktívne pri obezite. Ošípané v tejto štúdii neboli obmedzené na stravu a okrem prístupu k sacharóze boli kŕmené obvyklým množstvom ich normálnej stravy.
Opioidné receptory (OR) sú široko exprimované v mozgu, konkrétne v štruktúrach, o ktorých je známe, že modulujú procesy stravovania a odmeňovania20, Ukázalo sa, že najvzdialenejšie regióny sú dôležité pri odmeňovaní a recidíve účinkov kokaínu21,22,23,24, Zmeny vo väzbe boli tiež spojené s homeostatickými odpoveďami na stravovanie a radosťou spojenou s chutným jedlom25, Najmä „obľuba“ potravín je spojená s endogénnym opioidným systémom, najmä s μOR9,10 v škrupine nucleus accumbens a ventrálnom pallidum26, Infúzie agonistu μOR do rôznych častí nucleus accumbens a ventrálneho pallidum silne zvyšujú „sympatické“ správanie, vrátane výčnelkov jazyka a olizovania labky, po zvýšení chutného príjmu potravy27,28,29, Ďalší dôkaz opioidnej signalizácie pri spracovaní hedonickej regulácie pochádza od μOR antagonistov, ktoré znižujú spotrebu chutnej potravy v oboch podľa chuti- zvieratá s kŕmením a kŕmením, ale s obmedzenejším účinkom na príjem nechutných štandardných peliet30,31, U ľudí antagonisty μOR znižujú krátkodobý príjem potravy a znižujú príjemnosť chutných potravín32,33,34, Signalizácia opioidov v bazolaterálnom amygdale tiež prispieva k „nedostatku“ potravy prostredníctvom modulácie odmeňovania a stimulačnej hodnoty potravín35.
S [11C] karfentanil, získali sme obrázky väzby indikátorov, ktoré sú citlivé na hladiny μOR a na uvoľňovanie endogénnych opioidov do mozgu.36,37, Zistili sme okamžitú stratu dostupnosti μOR v oblastiach jadra accumbens a prednej cingulate cortex, špecifických oblastiach mozgu odmeňovacej dráhy, po počiatočnej konzumácii sacharózy piatimi miniprasami, čo je v súlade s endogénnym uvoľňovaním opioidov. Predchádzajúce štúdie ukázali, že chutné jedlo môže viesť k pocitom potešenia38 stimuláciou uvoľňovania opioidov. Po 12 dňoch prístupu k sacharóze sme pozorovali pokles [11C] väzba karfentanilu, ktorá má niekoľko možných vysvetlení39 vrátane endogénneho uvoľňovania opioidov a väzby na μOR, internalizácie μOR v dôsledku zvýšenej väzby opioidov a zvýšenej aktivácie DA D2 / 3 receptora, čo vedie k heterológnej desenzibilizácii μOR40.
Na podporu týchto zistení [11C] Štúdie karfentanilu u pacientov s bulímiou41, obezita42,43,44a porucha príjmu potravy45, ukazujú zníženú dostupnosť receptora. Sú to však chronické stavy, zatiaľ čo miniprasiatka dostávala sacharózu iba 12 dní. V štúdii o akútnom správaní potravy u zdravých mužov viedlo kŕmenie k rozsiahlemu a rozšírenému endogénnemu uvoľňovaniu opioidov v mozgu, a to v prítomnosti aj v neprítomnosti hedónie, čo naznačuje, že uvoľňovanie opioidov odráža metabolické a homeostatické, ako aj hedonické reakcie.25, Táto štúdia, spolu s ďalšou, ktorá zobrazovala pacientov po tekutom jedle s čokoládovou príchuťou44, je priamo relevantný pre akútnu štúdiu piatich miniprasiat po prvej expozícii sacharóze, líši sa však od subchronickej štúdie vystavenia sacharóze počas 12 dní, keď znížená dostupnosť receptora pravdepodobnejšie odráža opakovanú nadmernú stimuláciu a súbežnú reguláciu μOR.
Prefrontálny kortex je dôležitý pri rozhodovaní a priraďovaní hodnoty jednotlivým položkám, a preto μOR v prefrontálnom kortexe môže zodpovedať za pozmenené hodnotenie potravinovej významnosti, čo môže zvýšiť návykový potenciál potravín. Zistili sme zníženú väzbu v prefrontálnej kôre, v súlade s predchádzajúcimi štúdiami, ktoré ukazujú, že strava s vysokým obsahom tukov znižuje hladiny μOR mRNA v prefrontálnej kôre.46 a že infúzia agonistu μOR v prefrontálnej kôre zvyšuje príjem sladkého jedla47, Znovu však vyvstáva otázka, či strava s vysokým obsahom tukov je chronickejším stavom, ktorý s väčšou pravdepodobnosťou sprostredkuje reguláciu znižovania receptorov v porovnaní s krátkodobým dizajnom kŕmenia sacharózou, čo naznačuje trvalé uvoľňovanie endogénnych opioidov, ktoré vytesňujú stopový karfentanil naviazaný na μOR. , dokonca aj po 12 dňoch sacharózy.
DA sa zapája do odmien za drogy aj správanie. Zistilo sa, že chronické užívanie kokaínu inhibuje DA signalizáciu48, Hladiny DA D1 a D2 / 3 receptora sa v mozgu ošípaných menia nikotínom49a u primátov (okrem človeka) s anamnézou zneužívania kokaínu50, v súlade s downreguláciou D2 / 3 receptorov v mozgu závislých na kokaíne51,52, Pokiaľ ide o zneužívané lieky, ukázalo sa, že sacharóza upreguluje DA D1 receptory19 a zvýšiť uvoľňovanie DA53, posilnenie úlohy DA v „túžbe“ vo vzťahu k chutnému jedlu. Predchádzajúce štúdie PET preukázali pokles dostupnosti striatálneho receptora DA D2 / 3 v morbidnej obezite v porovnaní s priemernou hmotnosťou54,55, podobne ako v prípade pacientov závislých od drog56a u zvierat s modelmi obezity57, V štúdiách na hlodavcoch podporuje knockdown receptora D2 / 3 v striate vývoj nutkavého hľadania potravy u potkanov s prístupom k chutnému krmivu.57.
Naše pozorovania zníženej dostupnosti D2 / 3 receptora ošípaných môžu naznačovať zvýšené hladiny DA v reakcii na stimulačný význam spojený s príjmom sacharózy, pretože DA sa uvoľňuje ako súčasť potreby zneužívania drog a iných príjemných aktivít.52,58,59,60, Keďže ošípané boli anestetizované počas zobrazovania a nedostali sacharózu do 24 hodín, znížený D2 / 3 BPND pravdepodobnejšie odráža zníženie počtu receptorov v reakcii na predĺžené zvýšenie uvoľňovania DA v každom z 12 dní prístupu k sacharóze. Redukcia môže zvýšiť prahy odmeny v mozgu spojené s down-reguláciou striatálnych DA D2 receptorov. To môže vysvetľovať zvýšenú náchylnosť na zneužívanie drog, ktorá sa zaznamenala v predchádzajúcich štúdiách na potkanoch konzumujúcich sacharózu, ktoré viedli k skríženej senzibilizácii na kokaín, hyperaktivite po nízkej dávke amfetamínu, zvýšenému príjmu alkoholu pri abstinencii od sacharózy a tolerancii k analgetickým účinkom opiátov.6.
Predchádzajúca štúdia obezity v mincovníku Göttingen odhalila znížený prietok krvi mozgom v nucleus accumbens, ventrálnej oblasti tegmentálu (VTA) a prefrontálnej kôre, s počítačovou tomografiou s jednoduchou fotónovou emisiou (SPECT) v mozgu61, V súlade s týmito zisteniami sme pozorovali zníženú väzbu DA D2 / 3 v ventroforebrainovej oblasti obsahujúcej jadro accumbens a v prefrontálnej kôre. Extracelulárne hladiny DA sa v jadre accumbens zvýšia trikrát po prijatí sacharózy u voľne sa pohybujúcich potkanov podrobujúcich sa mikrodialýze.62, U zvierat závislých od sacharózy môže opakovaný príjem sacharózy viesť k uvoľňovaniu DA z obalu jadra accumbens63, Zvieratá kŕmené obmedzenou stravou s obmedzeným prístupom k sacharóze mali nižšiu väzbu k DA D2 receptoru v jadre accumbens a v dorzálnom striate64, Obmedzené diéty s vysokým obsahom tuku a sacharózy môžu viesť k trvalej regulácii mRNA receptorov D1 a D2 v nucleus accumbens65, Mikrodialyzačná štúdia účinkov chutného jedla odhalila zvýšené uvoľňovanie DA v jadre accumbens a prefrontálnej kôre, keď sa jedlo stále považovalo za nové; akonáhle boli potkany zvyknuté na nové jedlo, zvýšené uvoľňovanie bolo otupené v nucleus accumbens, ale nie v prefrontálnej kôre66, Rozdielna citlivosť na návyk a kondicionovanie aktivity v dvoch oblastiach môže vysvetliť väčšie zvýšenie pozorované v prefrontálnej kôre ako v jadrových accumbens minipras vystavených rovnakej chutnej látke, ktorá stratila novosť po dvanástich dňoch. Keďže sme však nezobrazili miniprasiatka s [11C] racloprid po prvom podaní sacharózy, toto vysvetlenie je špekulatívne.
Prefrontálna kôra moduluje výkonné funkcie, rozhodovanie a sebakontrolu67, Dysfunkčná DA neurotransmisia v prefrontálnej kôre zhoršuje moduláciu spracovania odmien, čo u obéznych jedincov naznačuje zhoršenú výkonnú funkciu a rozhodovacie schopnosti.68,69, Okrem toho štúdia humánneho PET korelovala znížený metabolizmus frontálnej kôry so zníženou väzbou striatálnej D2 pri obezite70, Tu nachádzame zníženú dostupnosť D2 / 3 receptora v prefrontálnej kôre, vrátane orbitofrontálnej kôry ošípaných vystavených režimu sacharózy.
Dopaminergné neuróny VTA vysielajú projekcie do hippocampu a amygdaly, kde podporujú zvyčajné správanie71 a sprostredkujú kódovanie a získavanie kondicionovania na liečivo72,73 a narážky na jedlo74,75, Zobrazovanie ľudského mozgu ukázalo, že hipokampálna aktivácia je reakciou na chuť a chuť potravín76, V súlade s našimi zisteniami o zníženej dostupnosti hipokampálneho a amygdalarového D2 / 3 receptora v reakcii na sacharózu, mapovanie ľudského mozgu pomocou [18F] fallyprid vykazoval uvoľňovanie DA vyvolané kokaínom v amygdale a hippocampe77, V mozgu hlodavcov vyvolala expozícia kokaínu DA uvoľnenie DA v amygdale78a zmeny hladín DA amygdaly ovplyvnili správanie vyhľadávané kokaínom79.
V štúdii obéznych jedincov bola prerušená súvislosť medzi dostupnosťou D2 / 3 a μOR, o ktorej je známe, že existuje v striatálnych oblastiach chudých jedincov, vo ventrálnom striatu.80, Porovnali sme hodnoty BPND dvoch indikátorov na testovanie, či údaje reprodukujú tento účinok. Na rozdiel od chudých ľudí, súčasné mozgy ošípaných nemali koreláciu medzi hodnotami BPND dvoch indikátorov, na začiatku alebo po expozícii sacharóze. Potom sme testovali, či by zvieratá s najväčším poklesom naviazania stopového raclopridu mali tiež najväčšie zníženie naviazania stopovacieho karfentanilu, ale namiesto toho sme našli negatívnu koreláciu v spriemerovaných mimstriatálnych oblastiach, čo naznačuje, že zvieratá s najväčšou zmenou väzbového potenciálu stopový racloprid mal najmenšiu zmenu väzbového potenciálu stopového karfentanilu. Inverzný vzťah medzi zmenami naznačuje, že účinky príjmu sacharózy na dostupnosť príslušných receptorov sú regulované v opačných smeroch. Je známe, že nadmerná konzumácia chutných potravín alebo drog môže byť poháňaná túžbou alebo páčením alebo oboma60,81, Je možné, že rozsah túžby poháňaný dopamínom neguje rozsah túžby poháňaný opioidmi alebo naopak. Posledné dôkazy poukazujú na úlohy GABAA receptory vo VTA a cholinergné terminály v striatu a pravdepodobne v kôre, ktoré pôsobia ako prepínače medzi mechanizmami opioidového účinku závislých od dopamínu a dopamínu82,83 čo môže vysvetľovať vzájomnosť vzájomného pôsobenia dopamínu a opioidov v mimovládnych oblastiach ošípaných.
Nedostatkom PET, tiež u pomerne veľkých zvierat, je obmedzené priestorové rozlíšenie tomografie, ktoré ovplyvňuje výsledky z malých mozgových oblastí zapojených do správania spojeného s potravinami. Napriek týmto obavám [11Väzba C] raclopridu bola predtým zaznamenaná v striatálnych aj extrastriatálnych oblastiach84,85,86,87, Použitie [11C] racloprid na označenie rovnakého typu receptorov nespôsobuje žiadne obavy z potenciálnych rozdielov afinity, ktoré môžu ovplyvniť použitie samostatných indikátorov pre rovnaké receptory v rôznych oblastiach. Posledné štúdie obsahovali záznamy o mimstriatálnej väzbe [11C] Raclopride. Alakurtti et al, našla dobrú reprodukovateľnosť mier striatálnej raclopridovej väzby v striatu, s iba dobrou až strednou reprodukovateľnosťou v kortexe85, V neskoršej štúdii Svensson et al, prediskutovalo niekoľko otázok ovplyvňujúcich použitie [11C] racloprid ako marker extrastriatálnych receptorov D2 / 3 v štúdii so zdravými ľuďmi vrátane zlej reprodukovateľnosti v kôre a obmedzeného poklesu extrastriatálnej väzby v čelnej kôre v reakcii na látku blokujúcu D2 / 388, Porovnania testov a opakovaných testov odhalili variabilitu 4–7% v striate a 13–59% v kortikálnych regiónoch, ale čas medzi vyšetreniami bol v priemere 20 dní, na rozdiel od informatívnejších 1–2 dní väčšiny štúdií. Mnohé faktory v živote týchto jedincov mohli mať čas na ovplyvnenie zistení. Skutočne tu ukazujeme, že iba pridanie spotreby sacharózy k rannej rutine počas 12 dní mohlo ovplyvniť väzbové opatrenia získané o dva týždne neskôr. Iné faktory, ktoré sú bežné, napríklad hranie videohier, nakupovanie, vstup do nových romantických vzťahov a sexuálna aktivita, užívanie drog alebo zmena stravovania a cvičenia, môžu ovplyvniť mimotelové hladiny dopamínu s potenciálom veľkej rozmanitosti súborov údajov. Súčasná štúdia s miniprasami zaviedla dobre regulované usporiadanie, pričom jedinou premennou je neprítomnosť alebo prítomnosť sacharózy v potrave. V tejto súvislosti mali údaje od siedmich zvierat dostatočne nízku variabilitu v relevantných mimastranálnych oblastiach na identifikáciu štatisticky významného zníženia väzby v reakcii na sacharózu.
Obmedzením súčasnej štúdie je použitie anestetík potrebných na zabezpečenie imobility počas liečby in vivo zobrazovanie zvierat. Účinky špecifických anestetík a ich interakcie s drogami alebo inými zásahmi môžu zmariť väzbu rádioligandov89,90, Ketamín je antimagamatergické liečivo s rýchlymi antidepresívnymi účinkami v sub anestetických dávkach91,92,93, ktoré neznižujú striatal [11C] viazanie raclopridu u ľudí94, Zistilo sa však, že S-ketamín znižuje väzbovú dostupnosť dopamínových D2 / 3 receptorov v striatu pri vedomí nehumánnych primátov.95, Isofluran je bežným anestetikom zvieracieho PET. V predchádzajúcich štúdiách sme zistili striatálnu akumuláciu [11C] SCH23390, rádioligand dopamínových D1 receptorov, ktorý má byť významne vyšší v miniprasách anestetizovaných skôr izofluranom ako propofolom, čo naznačuje náchylnosť dopaminergnej neurotransmisie na účinky anestézie96, V súčasnej štúdii sa všetky miniprasce zobrazili v oboch časových bodoch pod predliečením ketamínmi a anestéziou izofluranom, čo robí súčasné porovnania platnými.
záver
Nadmerná konzumácia chutných potravín môže spôsobiť a môže sa stať aj závislosťou s priamymi následkami na zdravie obezitou. Testovali sme tvrdenie, že opioidy a dopamín sprostredkujú odmeny, dôležité pre prežitie aj pre zneužívanie drog. Miniprasiatka s prerušovaným prístupom k roztoku sacharózy 12 po sebe nasledujúcich dní preukázali zníženú dostupnosť dopamínových D2 / 3 a μ-opioidných receptorov v striatálnych a extrastriatálnych mozgových oblastiach, z čoho vyplýva, že potraviny s vysokým obsahom sacharózy ovplyvňujú obvody odmeňovania mozgu podobným spôsobom, aký sa pozoruje pri návykových látkach. sú konzumované. Počiatočná jednorazová expozícia sacharóze bola konzistentná s uvoľňovaním opioidov v mozgových oblastiach aktívnych za odplatu. Zmeny dostupnosti opioidov a dopamínu vysvetľujú nadmerný návykový potenciál sacharózy.
Materiály a metódy
Etika zvierat
Túto štúdiu schválila a regulovala dánska inšpekcia pokusov na zvieratách a všetky pokusy sa uskutočnili v súlade so smernicou Európskeho parlamentu a Rady 2010/63 / EÚ o ochrane zvierat používaných na vedecké účely a usmerneniami ARRIVE. Použili sme sedem štrnásťmesačných samíc goltigénskych kociek (Ellegaard, Dalmose, Dánsko). Miniprasiatka boli kŕmené stravou vo forme peliet (6 dl, dvakrát denne, Special Diets Services, Aarhus, Dánsko) s dostupnou vodou z vodovodu. podľa chuti, Teplota okolia bola 20–22 ° C, relatívna vlhkosť 50–55% a vzduch sa menil osemkrát každú hodinu.
Prerušovaná spotreba sacharózy
Zobrazili sme sedem miniprasiek pomocou [11C] racloprid a [11C] karfentanil na začiatku a znovu jeden deň po 12 po sebe idúcich dňoch vystavenia sacharózovej vode. Expozícia sacharóze pozostávala z jednej hodiny prístupu vody k sacharóze (sacharóza, Dansukker, Kodaň, Dánsko) (500 gramov sacharózy v 2 litroch vody), denne počas 12 dní. Zaznamenalo sa množstvo príjmu sacharózy a všetky miniprasce spotrebovali každý deň 2 litre. Tiež sme zobrazili päť rovnakých miniprasičiek pomocou [11C] karfentanil 30 minút po prvom prístupe k sacharóze, aby sa študovalo akútne uvoľňovanie opioidov.
Miniprasiatka získali priemerne 13.6% telesnej hmotnosti z 25.4 kg (± 0.73 SEM) na začiatku liečby na 28.9 kg (± 0.69 SEM) po 12-dennej expozícii sacharóze, ktorá bola významne vyššia (jednostranný t-test, p < 0.001) ako nárasty pozorované na vzorke kontrolných miniprasiat získaných v predchádzajúcich štúdiách, kde sa hmotnosti v rovnakom vývojovom období zvýšili v priemere iba o 4.9%.
Zobrazovanie PET mozgu
Ošípané sme postili cez noc s voľným prístupom k vode pred zobrazením. Ako sme už uviedli, vopred sme medikovali a anestetizovali miniprasiatka97 a položili ich na ľahu do zariadenia PET / CT (Siemens Biograph 64 Truepoint PET). Pred každou akvizíciou PET sme vykonali CT sken s nízkou dávkou na anatomickú definíciu a korekciu útlmu údajov o emisiách PET. Intravenózne sme podali [11C] racloprid na začiatku (360 ± 18 MBq, špecifická aktivita 77 ± 76 GBq / μmol, injikovaná hmotnosť 0.12 ± 0.08 μg / kg) a po 12 dňoch sacharózy (374 ± 54 MBq, špecifická aktivita 127 ± 85 GBq / μmol, vstreknutá hmotnosť 0.06 ± 0.05 μg / kg) a [11C] karfentanil na začiatku štúdie (377 ± 43 MBq, špecifická aktivita 311 ± 195 GBq / μmol, injikovaná hmotnosť 0.03 ± 0.02 μg / kg) a po 12 dňoch sacharózy (337 ± 71 MBq, špecifická aktivita 177 ± 157 GBq / μmol, injektovaná hmota 0.06 ± 0.08 μg / kg) do ušnej žily v 10 ml fyziologického roztoku, počas prvej minúty 90-minútového skenovania. Rekonštruovali sme PET dáta pomocou TrueX 3D OSEM (3 iterácie, 21 podmnožín), matice 256 × 256 × 109 a 2 mm Gaussovho filtra pomocou štruktúry časových rámcov 5 × 60, 3 × 300, 4 × 600 , 2 × 900 sekúnd (celkom 14 snímok, 90 minút). Na začiatku a po 12 dňoch sacharózy sa miniprasce zobrazili obidvoma značkovačmi injektovanými najmenej 100 minút od seba kvôli polčasu [11C] PET indikátory. Po dokončení poslednej relácie PET sme eutanázovali miniprasy v hlbokej anestézii intravenóznym predávkovaním pentobarbitalom (100 mg / kg).
Kvantitatívne analýzy a štatistika
Kroky predbežného spracovania sme vykonali pomocou PMOD 3.7 (PMOD Technologies Ltd, Zürich, Švajčiarsko). Na definovanie stereotaktických transformačných parametrov z časovo spriemerovaných PET obrazov sme použili templáty špecifické pre ligand. Generované transformačné matice a deformujúce polia sme použili na zodpovedajúce dynamické časové rady PET. Vygenerovali sme parametrické obrázky [11C] raclopridový väzobný potenciál (BPND) pomocou metódy viacnásobného referenčného tkaniva podľa Ichise a spolupracovníkov98, Vytvorili sme masku na mieru vyrobenú z mozgu, ktorá vylučovala vermis na získanie rádioaktivity mozgového tkaniva v čase v oblasti zanedbateľnej hustoty receptora DA D2 / 3. Vygenerovali sme parametrické obrázky [11C] karfentanil pomocou implementácie referenčného modelu tkaniva Logan99,100 s t * = 30 min. Štúdie [11Väzba C] karfentanilu v ľudskom mozgu používa ako referenčnú oblasť okcipitálnu kôru36; u ošípaných však podľa kriviek časovej aktivity bola nevypovedateľná väzba v mozočku nižšia ako v týlnej kôre, čo je v súlade so zisteniami z autoradiografickej štúdie na potkanoch.101, Preto sme v tejto štúdii vybrali mozoček ako referenčný región.
Štatistická analýza
Mapy sme podrobili voxelovej analýze so štatistickým neparametrickým mapovaním (SnPM v13.01, http://warwick.ac.uk/snpm) SPM toolbox, ktorý využíva neparametrickú permutačnú teóriu na poskytnutie rámca pre štatistickú inferenciu, prístup sa ukázal ako vhodný pre malé vzorky kvôli prísnej kontrole falošných pozitív14 a aplikuje sa, ako už bolo opísané102, Odborník na neuroanatómiu ošípaných (DO) porovnal výsledné obrázky s prahovou hodnotou 5% významnosti s atlasom Göttingen minipig s vysokým rozlíšením103,104 na definovanie a označenie oblastí so zníženým DA D2 / 3 a μOR BPND od základného stavu po stav po sacharóze. Potom sme vykonali analýzu záujmového regiónu (ROI), aby sme extrahovali BPND hodnoty špecifických regiónov, o ktorých sa zistilo, že sú zaujímavé na základe analýzy SnPM, vrátane striata, nucleus accumbens, talamu, amygdaly, cingulate kôry a prefrontálnej kôry. Pokiaľ ide o analýzu návratnosti investícií, nevykonali sa žiadne ďalšie štatistické údaje, pretože sa zistilo, že tieto regióny sú už pomocou SnPM významné.
Referencie
- 1.
Smyth, S. & Heron, A. Diabetes a obezita: epidémie dvojčiat. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalencia a trendy v obezite u dospelých v USA, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al, Dopamín pre „túžbu“ a opioidy pre „túžbu“: porovnanie obéznych dospelých s nekonečným prejedaním. Obezita (strieborná pružina) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Obezita a potravinové prostredie: hustota energie v strave a náklady na stravu. Americký časopis preventívnej medicíny 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Intenzívna sladkosť prevyšuje odmenu za kokaín. PLoS jedna 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neuroveda v 21. storočí (ed. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Ďalší vývoj v neurobiológii potravín a závislostí: aktualizácia stavu vedy. Výživa 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Potešenie z mozgu (eds Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Od chuťovej hedoniky k motivačnému pudu: centrálne mu-opioidné receptory a prejedanie sa. Int J Neuropsychopharmacol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Odmena za jedlo: mozgové substráty túžby a chuti. Neurovedy a biologické správanie 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Mapovanie neuroreceptorov v práci: o definovaní a interpretácii väzbových potenciálov po 20 rokoch pokroku. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Zvieracie modely záchvatov cukru a tukov: vzťah k závislosti na jedle a zvýšenej telesnej hmotnosti. Metódy Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al, Prefrontálna kôra v mozgu Gottingenovho miniprasa definovaná kritériami neurálnej projekcie a cytoarchitektúrou. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Neparametrické permutačné testy pre funkčné neuroimaging: základ s príkladmi. Hum Brain Mapp 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Dôkazy závislosti na cukre: behaviorálne a neurochemické účinky prerušovaného nadmerného príjmu cukru. Neurovedy a biologické správanie 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al, Systém odmeňovania potravín: súčasné perspektívy a budúce potreby výskumu. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Podávanie sacharózy a aktivácia CNS u potkanov. Am J Physiol Regul Integ Comp Physiol 300, R876 – 884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al, Samostatné obvody kódujú hedonické a výživné hodnoty cukru. Prírodná neuroveda 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al, Nadmerný príjem cukru mení väzbu na dopamínové a mu-opioidné receptory v mozgu. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiátový receptor: autorádiografická lokalizácia v mozgu potkana. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Odmena kokaínu a hyperaktivita u potkanov: miesta modulácie mu opioidných receptorov. Neurovedy 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamín ovplyvňuje samopodanie kokaínu u potkanov reagujúcich na postupný harmonogram posilňovania. Farmakológia, biochémia a správanie 75, 301-307 (2003).
- 23.
Schroeder, JA et al, Úloha mu opioidných receptorov v aktivite vyvolanej kokaínom, senzibilizácii a odmeňovaní u potkanov. Psychofarmakológiu 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Obnovenie vyvolané kokaínom vyžaduje endogénnu stimuláciu mu-opioidných receptorov vo ventrálnom palide. The Journal of neuroscience: oficiálny časopis Spoločnosti pre neurovedy 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al, Kŕmenie uvoľňuje endogénne opioidy u ľudí. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioidný limbický okruh za odmenu: interakcia medzi hedonickými hotspotmi nucleus accumbens a ventral pallidum. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioidné miesto v jadre nucleus accumbens sprostredkováva stravovanie a hedonické „chutenie“ jedlu: mapa založená na mikroinjekcii Fos. Brain Res 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE Príjem roztokov sacharínu, solí a etanolu sa zvyšuje infúziou mu opioidného agonistu do nucleus accumbens. Psychofarmakológiu 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Príjem potravy s vysokým obsahom tuku je selektívne zvýšený stimuláciou mu opioidného receptora v jadre accumbens. Žurnál farmakológie a experimentálnych liečiv 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxon blokuje túto časť kŕmenia vyvolanú sladkou chuťou u potkanov s obmedzeným príjmom potravy. Am. J. Physiol 268R248 - 252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioidy a príjem potravy: distribuované funkčné nervové dráhy? neuropeptidy 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. Opioidný antagonista, naltrexón, znižuje preferenciu sacharózy u ľudí. Am. J. Physiol 251, R91 – 96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Účinok naltrexónu na prah detekcie a rozpoznania chuti. Chuť 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxón, blokátor opiátov, znižuje spotrebu sladkých jedál s vysokým obsahom tukov u obéznych a štíhlych požieračiek. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Rozdielne opioidné okruhy určujú chutnosť a vhodnosť odmeňovania udalostí. Proc Natl Acad Sci USA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al, Endogénne uvoľňovanie opioidov v systéme odmeňovania ľudského mozgu indukované akútnym podaním amfetamínu. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, ja et al, Amfetamínom indukované uvoľňovanie endogénneho opioidu v ľudskom mozgu zistené pomocou [11C] karfentanilu PET: replikácia v nezávislej kohorte. Int J Neuropsychopharmacol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Grey, RW opioidné peptidy a kontrola ľudského požívacieho správania. Neurovedy a biologické správanie 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Čo sa naučiť in vivo opioidergické zobrazovanie mozgu? Eur J Pain 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Interakcie dopamínu a opioidov v striate potkana: modulačná úloha receptorov dopamínu D1 pri signálnej transdukcii sprostredkovanej delta opioidnými receptormi. Neuropharmacology 39, 372-381 (2000).
- 41.
Bencherif, B. et al, Väzba regionálnych mu-opioidných receptorov v ostrovnej kôre je znížená u bulímie nervosa a koreluje nepriamo s správaním nalačno. Vestník nukleárneho lekárstva: úradná publikácia, Spoločnosť nukleárnej medicíny 46, 1349-1351 (2005).
- 42.
Karlsson, HK et al, Obezita je spojená so zníženou dostupnosťou mu-opioidov, ale nezmenenou dostupnosťou dopamínového D2 receptora v mozgu. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al, Chudnutie po bariatrickej chirurgii normalizuje mozgové opioidné receptory pri morbidnej obezite. Mol Psychiatry 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogénne opioidné mechanizmy sú implikované v obezite a chudnutí u ľudí. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al, Dopamínová a opioidná neurotransmisia v závislosti od správania: Porovnávacia štúdia PET v patologickom hraní a nadmernom stravovaní. neuropsychofarmakologie 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Chronická strava s vysokým obsahom tukov riadi postnatálnu epigenetickú reguláciu mu-opioidného receptora v mozgu. Neuropsychofarmakológia: oficiálna publikácia Americkej vysokej školy neuropsychofarmakológie 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Indukcia hyperfágie a príjmu uhľohydrátov stimuláciou mu-opioidných receptorov v vymedzených oblastiach frontálnej kôry. The Journal of neuroscience: oficiálny časopis Spoločnosti pre neurovedy 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Chronický kokaín tlmí dopamínovú signalizáciu počas intoxikácie kokaínom a nerovnováhu D1 nad signalizáciou receptora D2. The Journal of neuroscience: oficiálny časopis Spoločnosti pre neurovedy 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al, Účinky akútneho nikotínu na hemodynamiku a väzbu [11C] raclopridu na receptory dopamínu D2,3 v mozgu ošípaných. Neuroimage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Účinok samopodania kokaínu na dopamínové D2 receptory u opíc rhesus. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al, Kokaínové podnety a dopamín v dorzálnom striatu: mechanizmus túžby po závislosti od kokaínu. The Journal of neuroscience: oficiálny časopis Spoločnosti pre neurovedy 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al, Zvýšená obsadenosť dopamínových receptorov v ľudskom striate počas túžby po vyvolaní kokaínu. neuropsychofarmakologie 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Orálna stimulácia sacharózy zvyšuje accumbens dopamín u potkanov. Am J Physiol Regul Integ Comp Physiol 286, R31 – 37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Zobrazovanie úlohy dopamínu v zneužívaní drog a závislosti. Neuropharmacology 56(Príloha 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al, Mozog dopamín a obezita. Lanceta 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Podobnosť medzi obezitou a drogovou závislosťou hodnotená neurofunkčným zobrazením: preskúmanie koncepcie. Denník návykových chorôb 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamínové D2 receptory pri dysfunkcii odmeňovania podobnej závislosti a kompulzívnom jedení u obéznych potkanov. Prírodná neuroveda 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Afektívna neuroveda o slasti: odmena u ľudí a zvierat. Psychofarmakológiu 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Systémy potešenia v mozgu. Neurón 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Prediktívny signál odmeny dopamínových neurónov. J Neurophysiol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Zmeny v mozgovej aktivite po obezite vyvolanej diétou. Obezita 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens dopamínové mechanizmy pri príjme sacharózy. Brain Res 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM a Hoebel, BG Denné nadmerné dávkovanie cukru opakovane uvoľňuje dopamín v škrupine accumbens. Neurovedy 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Opakovaný prístup k sacharóze ovplyvňuje hustotu dopamínového D2 receptora v striate. Neuroreport 13, 1575-1578 (2002).
- 65.
Alsio, J. et al, Expresia génu receptora dopamínu D1 klesá v jadre accumbens pri dlhodobom vystavení chutnému jedlu a líši sa v závislosti od fenotypu obezity vyvolanej stravou u potkanov. Neurovedy 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Diferenciálny vplyv asociatívnych a neasociačných mechanizmov učenia na reakciu prefrontálneho a accumbálneho prenosu dopamínu na potravinové podnety u potkanov kŕmených ad libitum. J Neurosci 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Nevyvážené neuronálne okruhy v závislosti. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexia, bulímia a obezita: spoločné deficity rozhodovania o úlohe hazardných hier v Iowe (IGT). J. Int Neuropsychol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL Deficity v rozhodovaní a prejedanie sa: model rizika obezity. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al, Nízke dopamínové striatálne D2 receptory sú spojené s prefrontálnym metabolizmom u obéznych jedincov: možné prispievajúce faktory. Neuroimage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Centrálne jadro amygdaly interaguje s dorzolaterálnym striatom s cieľom regulovať získavanie návykov. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al, Aktivácia pamäťových obvodov počas chuťovej aktivity vyvolanej kokaínom. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73.
Childress, AR et al, Limbická aktivácia počas túžby vyvolanej kokaínom. Am J Psychiatria 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Čo a kedy „chcieť“? Amygdala sa zameriava na stimulačné zameranie na cukor a sex. Psychofarmakológiu 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiológia závislosti: neurocircuitárna analýza. Lancet Psychiatry 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Kortikálna aktivácia ako odpoveď na podnety čistej chuti počas fyziologických stavov hladu a sýtosti. Neuroimage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotros, A. et al, Uvoľňovanie dopamínu z kokaínu vyvolané u amygdaly a hippocampu: štúdia PET [(1) (8) F] fallypridu s vysokým rozlíšením u účastníkov závislých od kokaínu. neuropsychofarmakologie 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al, Kontrola správania sa pri vyhľadávaní kokaínu stimulmi spojenými s liekom u potkanov: účinky na obnovenie zhasnutých reakcií reagujúcich na operátora a extracelulárnych hladín dopamínu v amygdale a nucleus accumbens. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Antagonizmus dopamínových D1 alebo D2 receptorov v bazolaterálnej amygdale odlišne mení získavanie asociácií kokaín-tágo potrebné na opätovné vyvolanie hľadania kokaínu vyvolané tágom. Neurovedy 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al, Aberantná mezolimbická interakcia dopamín-opiát pri obezite. Neuroimage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Behaviorálne dopamínové signály. Trendy Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. Neurobiológia opiátovej motivácie. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Regulácia nikotínového a opioidného receptora sprostredkovaná transmisiou striatálneho dopamínového D2-receptora. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al, Pokles dostupnosti dopamínového D2 / 3 receptora v závislosti od veku meraný s [C-11] raclopridom v oblastiach bez striatálneho ľudského mozgu: Porovnanie štyroch metód. Neuroimage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al, Dlhodobá spoľahlivosť opakovaného testovania väzby striatálnych a extrastriatálnych dopamínových D2 / 3 receptorov: štúdia s [(11) C] raclopridom a PET s vysokým rozlíšením. J Cereb Blood Flow Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Endogénne uvoľňovanie dopamínu po farmakologických výzvach pri Parkinsonovej chorobe. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al, Kognitívne deficity a uvoľňovanie striato-frontálneho dopamínu pri Parkinsonovej chorobe. Mozog 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al, Platnosť a spoľahlivosť kvantifikácie extrastriatálnej [(11) C] raclopridu v živom ľudskom mozgu. Neuroimage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al, Isofluranová anestézia zvyšuje inhibičné účinky kokaínu a GBR12909 na dopamínový transportér: PET štúdie v kombinácii s mikrodialýzou v mozgu opíc. Brain Res 849, 85-96 (1999).
- 90.
Hassoun, W. et al, Štúdium PET väzby [11C] raclopridu v striatu prebudenej mačky: účinky anestetík a úloha toku krvi v mozgu. Európsky časopis o nukleárnej medicíne a molekulárnom zobrazovaní 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Úloha ketamínu v depresii rezistentnej na liečbu: systematické preskúmanie. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al, Antidepresívne účinky ketamínu u depresívnych pacientov. Biol Psychiatry 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. Antidepresívne účinky ketamínu: mechanizmy, ktoré sú základom rýchlo pôsobiacich nových antidepresív. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al, Ketamín neznižuje väzbu striatálneho dopamínového D2 receptora na človeka. Psychofarmakológiu 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Zníženie väzby dopamínových D2 / 3 receptorov v striate po jednorazovom podaní esketamínu, ale nie R-ketamínu: PET študovať u opíc pri vedomí. Psychiatrická klinika Eur Arch Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al, Účinky anestézie a druhov na absorpciu alebo väzbu rádioligandov in vivo na minipade Gottingen. BioMed výskum medzinárodný 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al, Pozdĺžne monoaminergné PET zobrazenie chronickej inhibície proteazómu u miniprasiat. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Stratégie na zlepšenie odhadu parametrov neuroreceptorov lineárnou regresnou analýzou. J Cereb Blood Flow Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al, Pomery distribučného objemu bez odberu krvi z grafickej analýzy údajov o PET. J Cereb Blood Flow Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kvantifikácia mozgových mu-opioidných receptorov s [11C] karfentanilom: metódy referenčných tkanív. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. Autorádiografická mapa väzby (3H) diprenorfínu v mozgu potkana: účinky sociálnej interakcie. Brain Res Bull 7, 405-410 (1981).
- 102.
Landau, AM et al, Elektrokonvulzívna stimulácia rozdielne ovplyvňuje väzbu [(11) C] MDL100,907 na kortikálne a subkortikálne 5HT2A receptory v mozgu ošípaných. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Telencephalon Gottingenského miniprasaťa, cytoarchitektúra a kortikálna anatómia povrchu. Funkcia štruktúry mozgu 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histologický atlas mozgu miniprasiat Gottingen. heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Poďakovanie
Štúdiu financovala Aarhus University „Granty na rozvoj projektov AU nápadov“ pre AML. Sme vďační za technickú podporu pracovníkov Centra PEThuského nemocnice v Aarhusu a Farma v Aarhus University za pomoc s liečením zvierat. Ďakujeme profesorovi Mortenovi Kringelbachovi, profesorovi Jørgenovi Scheel-Krugerovi a docentovi Arne Møllerovi za pomoc pri začatí týchto štúdií.
Etické vyhlásenia
Konkurenčné záujmy
Autori neuvádzajú žiadne konkurenčné záujmy.
Ďalšie informácie
Poznámka vydavateľa Spoločnosť Springer Nature zostáva neutrálna, pokiaľ ide o jurisdikčné tvrdenia v publikovaných mapách a inštitucionálnych vzťahoch.
Práva a povolenia
Otvorený prístup Na tento článok sa poskytuje licencia pod medzinárodnou licenciou Creative Commons Attribution 4.0, ktorá povoľuje použitie, zdieľanie, prispôsobenie, distribúciu a reprodukciu na akomkoľvek médiu alebo formáte, ak pôvodnému autorovi a zdroju poskytnete primeraný kredit, odkaz na licenciu Creative Commons a uveďte, či boli vykonané zmeny. Obrázky alebo iné materiály tretích strán v tomto článku sú zahrnuté v licencii Creative Commons, pokiaľ nie je v kreditnej linke k materiálu uvedené inak. Ak materiál nie je zahrnutý v licencii Creative Commons článku a vaše zamýšľané použitie nie je povolené zákonnými predpismi alebo presahuje povolené použitie, musíte získať povolenie priamo od držiteľa autorských práv. Kópiu tejto licencie si môžete pozrieť na stránke http://creativecommons.org/licenses/by/4.0/.