Dialogi Clin Neurosci. 2013 Dec;15(4):431-43.
Minimalizem
Kljub pomembnosti številnih psihosocialnih dejavnikov, odvisnost od drog vključuje biološki proces: sposobnost ponavljajoče se izpostavljenosti drogam, ki povzročajo spremembe v ranljivih možganih, ki poganjajo kompulzivno iskanje in jemanje drog ter izgubo nadzora. o uporabi drog, ki opredeljujejo odvisnost. Tu pregledujemo vrste molekularnih in celičnih prilagoditev, ki se pojavljajo v določenih regijah možganov, da posredujejo vedenjske nenormalnosti, povezane z odvisnostjo. Ti vključujejo spremembe v izražanju genov, ki se delno dosežejo z epigenetskimi mehanizmi, plastičnostjo v nevrofiziološkem delovanju nevronov in sinaps in s tem povezano plastičnostjo v nevronski in sinaptični morfologiji, ki je deloma posredovana s spremenjenim signalom nevrotrofnega faktorja. Vsako od teh tipov modificiranih zdravil lahko obravnavamo kot obliko "celičnega ali molekularnega spomina". Poleg tega je presenetljivo, da je večina plastičnosti, povezanih z zasvojenostjo, zelo podobna vrstam plastičnosti, ki so bile povezane z bolj klasičnimi oblikami »vedenjskega spomina«, kar morda odraža končni repertoar prilagoditvenih mehanizmov, ki so na voljo nevronov, ko se soočajo z okoljskimi težavami. izzivi. Končno, molekularne in celične prilagoditve, povezane z odvisnostjo, vključujejo večino istih možganskih regij, ki posredujejo bolj klasične oblike spomina, skladne s stališčem, da so nenormalni spomini pomembni gonilni sili sindromov odvisnosti. Cilj teh študij, katerih namen je razložiti molekularno in celično osnovo odvisnosti od drog, je, da sčasoma razvijejo biološko utemeljene diagnostične teste, pa tudi učinkovitejše zdravljenje odvisnosti.
Predstavitev
Odvisnost od drog, ki jo je mogoče opredeliti kot kompulzivno iskanje in jemanje drog kljub grozovitim posledicam ali izgubi nadzora nad uživanjem drog, povzročajo dolgotrajne spremembe zaradi drog, ki se pojavijo v določenih regijah možganov.1 Le nekateri posamezniki podležejo zasvojenosti zaradi ponavljajoče se izpostavljenosti drogam, medtem ko so drugi zmožni uporabljati drog in se izogibajo sindromu odvisnosti. Genetski dejavniki predstavljajo približno 50% te individualne variabilnosti ranljivosti odvisnosti, ta stopnja heritabilnosti pa velja za vse glavne razrede odvisnih zdravil, vključno s stimulansi, opiati, alkoholom, nikotinom in kanabinoidi..2 Vecina genov, ki sestavljajo to gensko tveganje, še ni mogoce identificirati, verjetno zaradi vpletenosti morda stotine genetskih variacij, ki povzamejo posameznega posameznika, da bi zagotovili ranljivost odvisnosti (ali, pri drugih posameznikih, odpornost).
Preostalih 50% tveganja za zasvojenost je posledica številnih okoljskih dejavnikov, ki se pojavljajo skozi celo življenje in vplivajo na posameznikovo gensko sestavo, da postanejo v večji ali manjši meri ranljivi za zasvojenost. V zasvojenost je vpletenih več vrst okoljskih dejavnikov, vključno s psihosocialnimi stresi, toda daleč najmočnejši dejavnik je izpostavljenost sami zlorabi drog. Dokazano je, da nekatera zdravila, zlasti nikotin, povečajo ranljivost posameznika za zasvojenost z drugo drogo.3 Poleg tega je vedno več dokazov, da je lahko kljub številnim genetskim tveganjem za zasvojenost med prebivalstvom izpostavljenost dovolj visokim odmerkom zdravila za daljše časovno obdobje preobrazila nekoga, ki ima relativno nizko genetsko obremenitev, v odvisnika..4
V zadnjih dveh desetletjih je bil dosežen velik napredek pri identifikaciji tako diskretnih regij možganov, ki so pomembne pri posredovanju sindroma odvisnosti, kot tudi vrstah sprememb na molekularni in celični ravni, ki jih droge povzročajo v teh regijah, da bi podprle ključne vidike. odvisnosti.1,5 Vezje, ki je prejelo največ pozornosti, se imenuje mezolimbični sistem dopamina, ki vključuje dopaminske nevrone v ventralnem tegmentalnem območju (VTA) srednjega možganskega inervirnega medija kostnega nevrona v nucleus accumbens (NAc, del ventralnega striatuma). Ti VTA nevroni tudi inervirajo številne druge predelne regije, vključno s hipokampusom, amigdalo in prefrontalnim korteksom (PFC).
Smiselno je razmisliti o teh mehanizmih odvisnosti zaradi drog v tem obsegu o spominu zaradi treh prekrivajočih se razlogov.6
- Prvič, vse prilagoditve, ki jih povzročajo droge, lahko razumemo kot vrste "molekularnega ali celičnega spomina": živčne celice, ki doživljajo takšne spremembe, so drugačne kot posledica izpostavljenosti zdravilu in se zato različno odzivajo na isto zdravilo, na druge droge ali na druge druge dražljaje.
- Drugič, zanimivo je, da je veliko, morda večina, vrst sprememb, ki so bile povezane z odvisnostjo (npr. spremenjena transkripcija gena, epigenetika, plastičnost sinaptične in celične celice ter morfologija nevronov in nevrotrofni mehanizmi) vpletene so tudi v tradicionalne oblike "vedenjskega spomina", kot so prostorski spomin, kondicioniranje strahu in operantno kondicioniranje, med drugim.
- Tretjič, med možganskimi regijami, ki jih prizadenejo droge, so tisti, ki so ključni živčni substrati za vedenjski spomin, vključno s hipokampusom, amigdalo in PFC. To sovpada z naraščajočim spoznanjem, da nekatere najpomembnejše značilnosti zasvojenosti, ki jih vidimo klinično (npr. Hrepenenje po drogah in ponovitev bolezni), odražajo nenormalnosti v tradicionalnih spominskih vezjih, pri čemer dolgoročni spomini na izkušnje z zdravilom služijo kot močni gonilniki patologije odvisnosti.4,7,8 Nasprotno pa regije nagrajevanja možganov (npr. VTA in NAc) močno vplivajo na vedenjski spomin.
V članku je podan pregled glavnih vrst molekularnih in celičnih sprememb, ki se pojavljajo v več regijah možganov v živalskih modelih zasvojenosti, osredotočenih na nucleus accumbens, za katere je trenutno na voljo večina informacij. Pomembno je, da je bilo možno vedno bolj potrditi nekatere od teh sprememb pri odvisnikih od ljudi na podlagi študij možganov po smrti. Kljub dejstvu, da imajo zlorabljene droge ločene kemijske strukture in delujejo na različne cilje beljakovin, je presenetljivo, da so številne pomembne prilagoditve, povezane z zasvojenostjo, skupne mnogim in v nekaterih primerih vse zlorabe drog in verjetno prispevajo k skupnim značilnostim sindrom odvisnosti.4,9 Nasprotno pa so številne druge prilagoditve, ki jih povzroča zdravilo, specifične za dano zdravilo in lahko posredujejo bolj edinstvene vidike določene odvisnosti. Tu se osredotočamo na stimulativne in opiatne droge zlorabe, ki povzročajo bolj dramatične učinke na živalskih modelih v primerjavi z drugimi drogami. Prav tako izpostavljamo pomembna področja za prihodnje raziskave, ki bodo dodatno povečale naše znanje o sindromih odvisnosti in ta napredek prevedli v izboljšane diagnostične teste in zdravljenje.
Transkripcijski in epigenetski mehanizmi
Znanje, da lahko odvisniki ostanejo izpostavljeni povečanemu tveganju za ponovitev bolezni, čeprav je to abstinentno leto, pomeni, da odvisnost vključuje spremembe v možganih, ki jih povzročajo droge in so lahko zelo stabilne. To je pripeljalo do tega, da je več skupin menilo, da so spremembe v izražanju genov pomembna sestavina procesa odvisnosti (Slika 1). V skladu s tem študije genov ali genetskih raziskav, ki vključujejo mikroarže DNA in v zadnjem času RNA-seq (visoko prepustno zaporedje izraženih RNA) je identificiral številne gene, katerih izražanje se spreminja v določeni regiji možganov pri modelih zasvojenosti in odvisnikov pri glodalcih in primatih (npr. ref. 10-17). Primeri takih genov so obravnavani v naslednjih poglavjih tega pregleda.
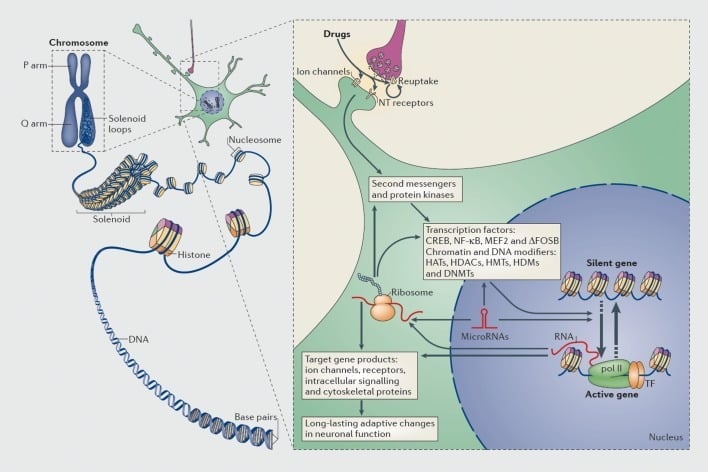
Mehanizmi transkripcijske in epigenetske regulacije z zlorabami drog. V evkariontskih celicah se DNK organizira z ovijanjem okoli histonskih oktomerjev, da se oblikujejo nukleosomi, ki se nato dodatno organizirajo in kondenzirajo, da tvorijo kromosome (levi del). Samo z začasnim razkrivanjem zgoščenega kromatina lahko DNA specifičnega gena postane dostopen za transkripcijski stroj. Droge zlorabe delujejo preko sinaptičnih ciljev, kot so mehanizmi prevzema, ionskih kanalov in receptorjev nevrotransmiterjev (NT), da spremenijo znotrajcelične signalne kaskade (desni del). To vodi do aktivacije ali inhibicije transkripcijskih faktorjev (TF) in mnogih drugih jedrskih ciljev, vključno s kromatin-regulatornimi proteini (prikazano z debelimi puščicami); podrobni mehanizmi, ki sodelujejo pri sinaptični regulaciji proteinov, ki uravnavajo kromatin, ostajajo slabo razumljeni. Ti postopki v končni fazi povzročijo indukcijo ali represijo določenih genov, vključno s tistimi za nekodirajoče RNA, kot so mikroRNA; spremenjena ekspresija nekaterih od teh genov lahko nadalje uravnava transkripcijo genov. Predlagano je, da so nekatere od teh sprememb zaradi drog na ravni kromatina izjemno stabilne in tako temeljijo na dolgotrajnem vedenju, ki opredeljuje odvisnost. CREB, ciklični AMP-odzivni proteinski vezni element; DNMT, DNA metiltransferaze; HAT, histon acetiltransferaze; HDAC, histon deacetilaze; HDM, histonske demetilaze; HMT, histon metiltransferaze; MEF2, miocit-specifični ojačevalni faktor 2; NF-kB, jedrski faktor-KB; pol II, RNA polimeraza II. Reproducirano iz ref 44: Robison AJ, Nestler EJ. Transkripcijski in epigenetski mehanizmi zasvojenosti. Nat Rev Neurosci. 2011: 12: 623-637.
Podobno so številni tipi transkripcijskih faktorjev - proteini, ki se vežejo na regulatorne regije genov in s tem povečajo ali zmanjšajo transkripcijo teh genov - vključeni v posredovanje dolgoročnih učinkov drog zlorabe na gensko ekspresijo v možganih.. Med pomembne primere spadajo CREB (cAMP odzivni element), ΔFosB (transkripcijski faktor Fosove družine), NFkB (jedrski faktor kB), MEF2 (miocitni faktor-2) in glukokortikoidni receptorji.5,10,18-22 Vse bolj je mogoče razumeti celične signalne poti, po katerih zloraba drog aktivira dani transkripcijski faktor v možganih, in takšno aktivacijo vzročno povezati s ciljnimi geni tega transkripcijskega faktorja in s posebnimi vedenjskimi vidiki odvisnosti (glej Slika 1). Ta napredek je ponazorjen z upoštevanjem CREB in ΔFosB, ki sta najbolje raziskana transkripcijska faktorja pri modelih odvisnosti.
cAMP odzivni element, ki veže beljakovine
Aktivirajo se stimulansi in opiatne droge zlorabe CREB v nekaterih regijah možganov, pomembnih za zasvojenost, vključno z vidno v NAc.23,24 Znano je, da se cREB aktivira v drugih sistemih s cAMP, Ca2+in poti rastnih faktorjev,25 in še ni znano, katera od njih posreduje njeno aktivacijo v NAc z zlorabo drog. Pokazalo se je, da aktivacija zdravila CREB v NAc predstavlja klasični negativni mehanizem povratnih informacij, pri čemer CREB služi za zmanjšanje občutljivosti živali na koristne učinke teh zdravil (toleranca) in za posredovanje negativnega čustvenega stanja med odvzemom droge (odvisnost).18,26,27 Ti učinki so nedavno pokazali, da povečujejo samo-dajanje zdravila in ponovitev bolezni, verjetno s procesom negativne ojačitve.28 Zdi se, da ti ukrepi CREB vključujejo obe večji podtipi NAc srednjih živčnih nevronov, tisti, ki izražajo pretežno D1 v primerjavi z D2 dopaminskih receptorjev.24 Iveliko število literature je pokazalo, da je CREB, ki deluje v hipokampusu in amigdali, ključna molekula v vedenjskem spominu.29-31 Ta široka vloga v odvisnosti in vedenjskem spominu verjetno odraža dejstvo, da so nevroni prežeti s končnim številom molekularnih mehanizmov, s katerimi se prilagajajo nenehno spreminjajočemu se okolju.
Ciljni geni za CREB, ki posredujejo ta vedenjski fenotip, so bili identificirani s pomočjo genoma, kot tudi z več izbranimi prizadevanji.10,18,32 En primer je opioidni peptid dynorphin: stimulacija ekspresije dynorphina v NAc nevronih, posredovanih preko CREB, poveča aktivacijo dinorfina k opioidnih receptorjev na VTA dopaminskih nevronih in tako zavira dopaminergični prenos na NAc in slabi nagrado.18 Pokazalo se je, da je več drugih CREB tarč pomembnih za zdravilno povzročeno sinaptično plastičnost, kot je opisano spodaj. CREB se aktivira tudi v nekaterih drugih regijah možganov s stimulansi in opiati,23,24 manj je znanega o vedenjskih posledicah tega učinka in ciljnih genih, skozi katere se pojavijo. Podobno je manj znanega o vlogi CREB pri posredovanju pri delovanju drugih zlorab drog.19
ΔFosB
Akutna izpostavljenost skoraj vsakemu zlorabljenemu zdravilu povzroči vse transkripcijske faktorje družine Fos v NAc in nekaterih drugih regijah možganov. Ta indukcija je hitra, vendar tudi zelo prehodna, pri čemer se raven Fos proteina vrne na normalno vrednost v času 8 do 12 ur. Edinstveno med temi beljakovinami družine Fos je ΔFosB, skrajšani produkt gena FosB, ki se zaradi svoje nenavadne stabilnosti postopoma kopiči skozi ponavljajočo se izpostavljenost zdravilu in postane prevladujoči Fos protein, izražen pod temi pogoji.22,33 Poleg tega zaradi te stabilnosti vsebnost ΔFosB traja tedne po odvzemu zdravila. Takšna kronična indukcija ΔFosB je bila dokazana za skoraj vsa zloraba zdravil34 in za večino zdravil je selektivna za Nl nevrone tipa Dl.34,35 Bilo je tudi dokazano pri ljudeh.35 Velika količina literature je pokazala, da takšna indukcija ΔFosB v D1-nevroni tipa NAc povečajo občutljivost živali na zdravila in naravne koristi ter spodbujajo samo-dajanje zdravil, verjetno s postopkom pozitivne okrepitve (Glej opombe 34 do 38). Zanimivo je, da je indukcija ΔFosB v NAc-ju bolj dramatična pri mladostnikih, v času večje ranljivosti odvisnosti.,39 in dokazano je, da njegova indukcija z nikotinom posreduje povečanju nagrajevanja kokaina v obliki nikotina.40
Kar se tiče CREB, so bili številni ciljni geni za ΔFosB identificirani v NAc z uporabo pristopa gena in genoma po celem svetu.10,32 Medtem ko CREB inducira dinorfin, ga ΔFosB zatre, kar prispeva k učinkom nagrajevanja ΔFosB.38 Druga tarča ΔFosB je cFos: ker se ΔFosB kopiči s ponavljajočo izpostavljenostjo zdravilu, zavira c-Fos in prispeva k molekulskemu preklopu, pri čemer se ΔFosB selektivno inducira v stanju kroničnega zdravljenja z zdravilom.41 Pokazalo se je, da veliko drugih tarč ΔFosB posreduje sposobnost nekaterih zdravil zlorabe, da inducirajo sinaptično plastičnost v NAc in s tem povezane spremembe v dendritični arborizaciji srednjih živčnih nevronov NAc, kot bomo obravnavali spodaj.
Funkcionalne posledice indukcije ΔFosB v drugih regijah možganov so manj razumljive, čeprav je bila njegova indukcija v orbitofrontalni skorji (OFC) podrobno proučena. V tem primeru ΔFosB posreduje toleranco, ki se pojavi pri kognitivno-motnih učinkih kokaina med kronično izpostavljenostjo, in ta prilagoditev je povezana s povečanim samokontrolo kokaina..42,43
Analize na celotnem genomu so predlagale več potencialnih ciljnih genov, ki posredujejo te učinke.42 Kljub edinstvenim časovnim lastnostim ΔFosB in zavedanju, da ga povzroča tradicionalna pomnilniška vezja (npr. Hipokampus), še ni bilo raziskovanja vloge ΔFosB v vedenjskem spominu, kar bi bilo zanimivo za prihodnje raziskave.
Epigenetski mehanizmi
V zadnjih letih so študije transkripcije še korak dlje do epigenetike44 (Glej Slika 1)ki se lahko na splošno opredeli kot sprememba v izražanju genov, ki se pojavi v odsotnosti spremembe zaporedja DNA. Epigenetski mehanizmi nadzorujejo pakiranje DNK znotraj celičnega jedra preko njegovih interakcij s histoni in številnimi drugimi vrstami jedrskih proteinov, ki skupaj obsegajo kromatin. Ekspresija genov je nadzorovana s stanjem te embalaže s kovalentno modifikacijo histonov, drugih beljakovin in same DNA. Kot samo nekateri primeri, acetilacija histonov nagiba k spodbujanju aktivacije gena, metilacija histonov lahko bodisi spodbuja aktivacijo gena ali zatiranje glede na ostanek Lys, ki je podvržen tej modifikaciji, in metilacija DNA je na splošno povezana z zatiranjem genov, čeprav nekatere oblike metilacije npr. 5-hidroksimetilacija) je lahko povezana z aktivacijo gena.
Epigenetika je privlačen mehanizem, ker so v drugih sistemih, na primer razvojne in rakaste biologije, določene epigenetske spremembe lahko trajne. Zaradi tega razloga, epigenetika se je uporabljala tako v modelih učenja kot spomina (npr. ref. 45-48) kot tudi v odvisnosti;44,49 v obeh sistemih so poročali o velikih spremembah v acetilaciji in metilaciji histona in metilaciji DNA. Kot samo en primer je histonska metiltransferaza, G9a, vključena v oba spomina50 in zasvojenosti.51,52 V modelih zasvojenosti, Izraz G9a je znižan v NAc kot odziv na zlorabo stimulansov ali opiatov in tdokazano je, da povečuje koristne učinke teh zdravil.51,52 Zanimivo je, da supresijo kokaina G9a posreduje ΔFosB. G9a katalizira dimetilacijo Lys9a histona H3 (H3K9me2), glavnega posrednika genske represije. ChIP-chip ali ChIP-seq (imunoprecipitacija s kromatinom, ki ji sledijo promotorski čipi ali sekvenciranje z veliko prepustnostjo) je bila uporabljena za pridobitev genomovih kart genov v NAc, ki prikazujejo spremenjeno H3K9me2 po izpostavljenosti stimulansom ali opiatom.32,52,53 S prekrivanjem teh seznamov genov s seznami genske ekspresije na celotnem genomu in z zemljevidi genomov mnogih drugih oblik epigenetskih modifikacij (npr. Vezava ΔFosB, vezave CREB, druge modifikacije histona itd.),32,53 obstajati bi moralo biti mogoče identificirati vse bolj popoln niz genov, ki jih urejajo droge zlorabe, in razumeti osnovne epigenetske mehanizme.
Druga oblika epigenetske regulacije, povezana s spominom in odvisnostjo, je generacija mikroRNA. Te majhne, nekodirajoče RNA se vežejo na komplementarne regije mRNA in tako zavirajo njihov prevod ali inducirajo njihovo razgradnjo. Izbris Argonauta, beljakovine, ki je ključnega pomena za obdelavo miRNA, spremeni vedenjske odzive na kokain, z izrazitimi učinki, opaženimi za srednje velike kosti nevronov tipa D1 proti D2.54 Pokazalo se je tudi, da je več specifičnih miRNA reguliranih z izpostavljenostjo zdravilu in da vplivajo na vedenjske odzive na zdravila (npr. Ref. 55,56). V prihodnjih študijah bo zanimivo identificirati cilje mRNA teh miRNA in opisati, kako vplivajo na proces odvisnosti.
Sinaptična plastičnost
Isti splošni tipi sinaptičnih modifikacij na glutamatergičnih sinapsah, ki so bili vpleteni v hipokampus in amigdalo v vedenjski spomin (glej druge članke v tej številki), so se prav tako pokazali v regijah, ki prejemajo nagrado za možgane, v modelih odvisnosti in so pomembne pri posredovanju. odvisnosti.57,58 Takšna sintetična plastičnost, ki jo povzroča zdravilo, je bila opisana v več regijah možganov, vendar se tukaj osredotočimo na NAc, kjer se je večina raziskav osredotočila do danes. (Slika 2).
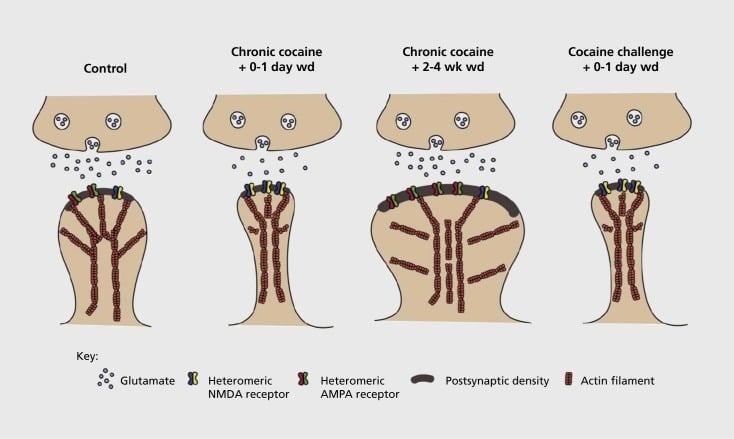
Model sinaptične in strukturne plastičnosti, povezane z odvisnostjo, v nucleus accumbens (NAc). Kronična izpostavljenost kokainu povzroči časovno odvisno in prehodno reorganizacijo receptorjev glutamata α-amino-3-hidroksi-5-metil-4-izoksazolepropionske kisline (AMPA) in N-metil-D-asparaginske kisline (NMDA) na sredstvu NAc sinapse, kot tudi strukturne spremembe v glavi hrbtenice MSN-jev NAc, ki so povezane z različnimi oblikami sinaptične plastičnosti. Na primer, kronični kokain povzroči površinsko izražanje NMDA receptorjev, tiho tvorbo sinapse in dolgoročno depresijo (LTD) v zgodnjih časih umika. Med daljšim umikom (wd) se te sinaptične spremembe obrnejo, rezultat pa je povečana ekspresija površinskih receptorjev AMPA, konsolidacija sinapse v hrbtenico v obliki gobe in dolgoročno povečanje (LTP). Ti učinki se hitro vrnejo po izpostavljenosti izzivnemu odmerku kokaina, ki vodi v prestrukturiranje hrbtenice v tanke hrbtenice in depresijo sinaptične moči.
Začetni poskusi so pokazali, da ponavljajoča se izpostavljenost stimulativnim drogam povzroča LTD (dolgoročno depresijo), podobno kot pri glutamatergičnih sinapsah v NAc.59 Vendar pa so novejša dela pokazala, da je takšna plastičnost zelo odvisna od časa, saj se LTD pojavi zgodaj po zadnji kokainski izpostavljenosti, ki se po daljših časih odvzema spremeni v bolj podobno stanje LTP (dolgoročno povečanje).60,61 Delo, ki je bilo do sedaj izvedeno predvsem z uporabo preiskovalca, ki je dal - v nasprotju s samoproizvajanjem - zdravil, je opredelilo potrebo po bolj sistematičnih raziskavah v modelih samouprave, ki sledijo oblikam sinaptične plastičnosti, ki se pojavljajo pri glutamatergičnih sinapsah pri NAc preko podrobnega časovnega poteka od pridobitve samoupravljanja do njegovega vzdrževanja, skozi različne čase umika in izumrtja ter kot odziv na dražljaje, ki vzbujajo ponovitev. Dosedanje delo je prav tako opredelilo nekatere molekularne mehanizme, ki prispevajo k tej zdravilni sintetični plastičnosti, vključno s prepovedjo AMPA receptorjev v sinapso, ki je morda posredovana delno preko CaMKII (Ca)2+/ kalmodulinom odvisna proteinska kinaza II) fosforilacija nekaterih podenot receptorja AMPA in spremenjena ekspresija podenot receptorja AMPA (npr. 60,62-65, Številke 2 in 3). Vloga za CREB in ΔFosB je bila vpletena v te pojave, kakor tudi v povezane spremembe morfologije glutamatergičnih sinaps (glej spodaj). Na primer, GluAl je tarča za CREB v NAc, kjer sta GluA2 in CaMKII tarča ΔFosB, v tej možganski regiji .35,36,66,67 Pomikanje naprej bo pomembno povezati posebne prilagoditve s časovno odvisnimi spremembami sinaptične funkcije in vedenjskih značilnosti odvisnosti.
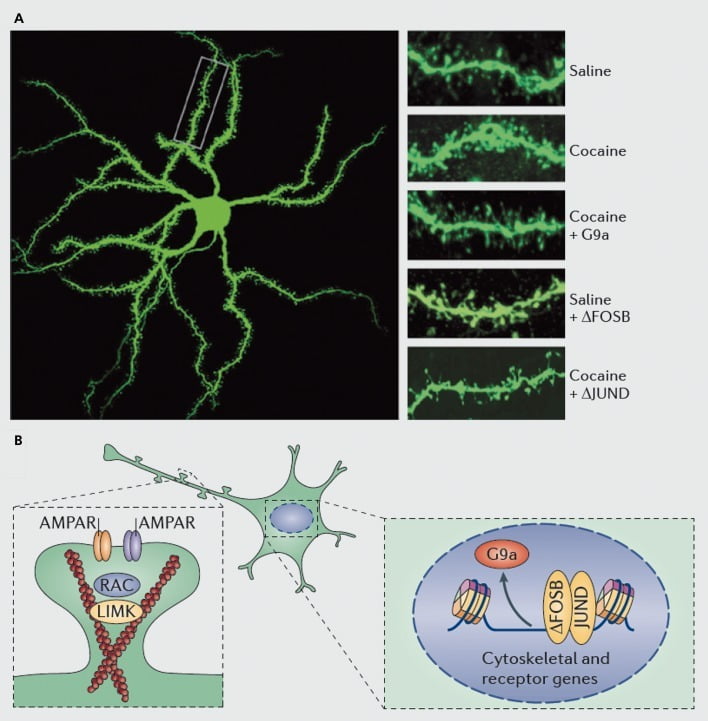
Molekularni mehanizmi, na katerih temelji kokainska indukcija dendritičnih bodic na srednjih trnih nevronih nucleus accumbens (NAc). A) prikazuje povečanje števila dendritičnih hrbtenic, ki ga povzroča kokain, ki ga lahko blokiramo z virusno prekomerno ekspresijo G9a ali JunD (antagonist transkripcije, posredovane z AP1) ali posnemamo z virusno prekomerno ekspresijo FosB. B) Izkazalo se je, da imata uravnavanje trgovine z receptorji AMPA (AMPAR) in aktinskega citoskeleta (levo) ter regulacija transkripcije glutamatnih receptorjev in aktinskih regulatornih proteinov (npr. Posredovani preko ΔFosB, desno) pomembno vlogo pri posredovanju regulacije kokaina za dendritično gostoto hrbtenice NAc. Kinaza domene UMK, LIM; RAC, substrat C3 botulinskega toksina, povezan z Ras.
Nova eksperimentalna orodja omogočajo, da se z vedno večjo natančnostjo določijo posamezna vezja, ki prikazujejo te oblike sinaptične plastičnosti in katere vedenjske nepravilnosti posredujejo. Na primer, tlupine in jedra subregionov NAc kažejo razlike v sinaptični plastičnosti, ki jo povzroča zdravilo, kot tudi D1- proti D2-srednjimi srednje velikimi nevroni v vsaki podregiji.60,63,64,67 Prav tako so optogenetski eksperimenti zagotovili nov vpogled v prispevek določene oblike sinaptične plastičnosti (npr. LTD) pri specifičnih populacijah glutamatergičnih sinaps v NAc, na primer tistih, ki izhajajo iz medialnega PFC v primerjavi z bazolateralnim amigdalam proti ventralni subikulum (glavni rezultat) hipokampusa).68-70 Konec koncev bo treba molekularne prilagoditve, ki jih povzročajo zdravila, v vsakem od teh aferentnih nevronov prekrivati s prilagoditvami, specifičnimi za sinapso, ki se pojavijo v njihovih postsinaptičnih dendritih, da se pripravi popolno razumevanje, kako zloraba drog spreminja možgansko vezje, da vodi posebne vidike odvisna država. Ta prizadevanja bodo zahtevala večjo oceno plastičnosti, ki jo povzročajo zdravila, v zaviralnih sinapsah znotraj istih možganskih regij, na področju, ki je bilo do danes deležno zelo malo pozornosti.65
Plastičnost celih celic
Medtem ko je večina raziskav, ki vključujejo nevrofiziološke spremembe nevronov v pojavih zlorabe drog, kot pri učenju in spominskih fenomenih, osredotočena na sinaptično plastičnost, je vedno več dokazov o pomembnosti plastičnosti celih celic. Plastičnost celih celic, imenovana tudi homeostatska plastičnost, \ t71 vključuje spremembe v notranji razdražljivosti celotne živčne celice na način, da ni specifičen za sinapse. Glede na to, da nekatere značilnosti zasvojenosti z drogami vključujejo povečano ali zmanjšano občutljivost na zdravilo, je smiselno, da povečana ali zmanjšana električna vzburljivost nekaterih živčnih celic prispeva k teh vedenjskim prilagoditvam..5
O Najbolj uveljavljen primer plastičnosti celice na zdravilo zlorabe je sposobnost kroničnih opiatov, da povečajo intrinzično razdražljivost noradrenergičnih nevronov locus coeruleus (LC)).72 Povečana ekscitabilnost je posredovana preko CREB in njegove indukcije nekaterih izooblik adenilil ciklaze, ki poganjajo večjo sprožitev LC nevronov, morda preko indukcije Na + kanalov.72-75 Ta hiperizčutljivost LC nevronov predstavlja klasičen mehanizem tolerance in odvisnosti ter povzroča nekatere znake in simptome umika opiatov. Zanimivo je, da CREB posreduje podobno obliko plastičnosti celih celic v NAc srednjih živčnih nevronih, ki so prav tako postali hiperecificirani s kronično izpostavljenostjo drogam prek CREB.76 Zato bo v prihodnjih raziskavah ključno razumeti, kako CREB-posredovana sinaptična plastičnost glutamatergičnih sinaps na NAc srednjih živčnih nevronih65,66 povzemanja s CREB-posredovano intrinzično hipereksitabilnostjo teh nevronov76 nadzorovati vedenjske značilnosti odvisnosti.
Še en primer plastičnosti celičnih celic v modelih zasvojenosti je hipereksitabilnost nevronov VTA dopamina, ki se pojavi po kronični izpostavljenosti drogam opiatovinSlika 4).77,78 Ta prilagoditev, ki je bila povezana z morfološkimi spremembami v teh živčnih celicah (glej naslednji odsek), ni posredovana s CREB, temveč je dosežena z regulacijo nevrotrofnih signalnih kaskad, kot je opisano spodaj.

Delovni model kroničnih morfin-induciranih prilagoditev v ventralnih tegmentalnih območjih (VTA) dopaminskih nevronov. Kronični morfij zmanjša velikost VTA dopamina (DA), vendar poveča razdražljivost nevronov, medtem ko se prenos dopamina v nucleus accumbens zmanjša. Neto učinek morfina je manj odzivna pot nagrajevanja, tj. Tolerantnost nagrajevanja. Dolgotrajno reguliranje signalizacije IRS2-AKT v VTA posreduje učinke kroničnega morfina na velikost soma in električno vzburjenost; učinek na razdražljivost se posreduje z zmanjšanimi tokovi γ-aminobuterne kisline (GABA) A in zatiranje izražanja K 'kanala. Morfinsko inducirano znižanje aktivnosti mTORC2 v VTA je ključno za morfijsko in fiziološke prilagoditve, ki jih povzročajo morfij, kot tudi za toleranco nagrajevanja. V nasprotju z mT0RC2, kronični morfin poveča aktivnost mTORCI, ki ne vpliva na te morfijem-inducirane prilagoditve. BDNF, nevrotrofni faktor iz možganov; IRS, insulinska receptorska snov; mTORC, mTOR kompleks; AKT, proteinska kinaza B Reproducirano iz ref 77
Morfološka plastičnost in nevrotrofni mehanizmi
Vse več dokazov, večinoma iz študij hipokampalnih in možganskih kortikalnih nevronov, je pokazalo, da so spremembe v sinaptični plastičnosti povezane z morfološkimi spremembami pri sinapsah. Na primer, LTD in generacija tihih sinapse sta povezana z nastajanjem tankih ali strnjenih dendritičnih bodic, medtem ko je LTP povezan z večjimi gobastimi bodicami.79,80 Zato je zanimivo, da se področje zlorabe drog že več kot 15 let osredotoča na spremembe v dendritičnih bodicah, ki jih povzročajo droge. Kronična izpostavljenost stimulirajoče droge povečujejo dendritično gostoto hrbtenice srednjih živčnih nevronov NAc, sprememba, ki prevladuje za nevrone tipa Dl.67,81,82 Indukcija bodic je bila večinoma povezana z občutljivimi vedenjskimi odzivi na ta zdravila, čeprav nekateri dokazi nasprotujejo temu mnenju.
Kot pri študijah sinaptične plastičnosti, pa je potrebno veliko več dela, da se sistemsko opredelijo spremembe dendritičnih hrbtenic, ki se pojavijo med potekom samo-dajanja zdravila, umikom in ponovitvijo bolezni. Sdo sedaj, vključno z drogami preiskovalca in samoproizvajalca, kažejo na zelo različne spremembe v hrbtenici, ki se pojavljajo na različnih točkah odtegnitvenega časa in v lupini NAc v primerjavi s temeljnimi podregijami.83-86 Prav tako bo pomembno opredeliti natančne molekularne mehanizme, s katerimi kokain ali drug stimulans proizvaja te časovno odvisne in celično specifične učinke. Pokazalo se je, da je ΔFosB hkrati potreben in zadosten za indukcijo nezrelih hrbtenic na NA-nevronih tipa Dl..35,51,67 Takšna regulacija se dogaja skupaj s kokainom in ΔFosB regulacijo več proteinov, za katere je znano, da nadzorujejo reorganizacijo aktinskega citoskeleta. Kot samo en primer, transkripcijska regulacija več faktorjev izmenjave gvaninskih nukleotidov in GTPase aktivirajočih proteinov pa zmanjša Rac1, majhno GTPazo, za prehodno zmanjšanje aktivnosti v odzivu na vsako izpostavljenost kokainu in so pokazali takšno pulsativno zmanjšanje aktivnosti Rac1 z uporabo optogenetskega nadzora Rac1, za posredovanje indukcije nezrelih bodic.87 Ti učinki zdravila Racl se verjetno pojavijo z njegovo kontrolo nad kofilinom in drugimi regulacijskimi beljakovinami aktina, za katere je dokazano, da posredujejo tudi pri uravnavanju kokaina pri rasti hrbtenice.87,88 Pomembno pa je poudariti, da je to le ena pot, ki sodeluje pri regulaciji kokaina pri nezrelih bodicah, saj se je izkazalo, da ima tudi več drugih proteinov pomembno vlogo, med drugim CDK5 (ciklin odvisna kinaza-5), CaMKII, NFkB , MEF2, CREB, G9a in DNMT3 (DNA metiltransf brisanje 3a), če naštejemo le nekatere.20,21,35,51,67,89,90 Zanimivo je, da kokainska regulacija več teh genov, vključno z indukcijo CDK5, CaMKII in NFkB, in zatiranje G9a, posreduje tudi preko ΔFosB.20,35,51,91
Presenetljivo je, da zlorabe opiatov povzročajo nasprotni učinek in zmanjšujejo dendritično gostoto hrbtenice NAc srednjih živčevja.81 O vedenjskih posledicah te prilagoditve in vključenih molekularnih mehanizmih je malo znanega. Ta pojav je, presenetljivo, glede na to, da sta CREB in ΔFosB inducirana s stimulansi in opiati in sta oba vpletena v indukcijo NAc dendritične gostote hrbtenice s stimulansom;. To postavlja vprašanje, kako opiati zavirajo gostoto hrbtenice NAc kljub njihovi indukciji teh dejavnikov.
Druga pomembna oblika morfološke plastičnosti, ki jo vidimo v modelih zlorabe drog, je fizično zmanjšanje velikosti celičnih somatov nevronov dopaminskih VTA, ki jih povzroča kronična uporaba.77,92,93 Podobna prilagoditev se pojavi kot odziv na kanabinoide.94 To krčenje VTA dopaminskih nevronov, ki se pojavi pri samopodobi opiatov93 in je bila dokumentirana pri ljudeh, ki so bili ovrednoteni zaradi heroina,77 se zdi, da posreduje toleranco nagrajevanja in je povezana z zmanjšanim sproščanjem dopamina v NAc. Znatni dokazi zdaj kažejo, da je to zmanjšanje velikosti celičnih somov posredovano z zaviranjem opiatov izražanja nevrotrofnega faktorja (BDNF) iz možganov znotraj teh nevronov. To opiatno inducirano umikanje podpore BDNF in zmanjšanje nevronov v VTA smo neposredno povezali z zmanjšano aktivnostjo nizvodnih signalnih kaskad BDNF v VTA dopaminskih nevronih, specifično zmanjšali aktivnost IRS2 (insulin receptor substrat-2), AKT (serin-treonin) kinaze) in TORC2 (tarča rapamicin-2, ki je neobčutljiva na rapamicin).77,93 Prav tako smo povezali to znižanje BDNF signalizacije neposredno s povečano razdražljivostjo, ki jo morfij inducira pri teh nevronih, kot smo že omenili.77,78 Dejansko je zmanjšana velikost celične some in povečana razdražljivost tesno povezana, saj indukcija enega vodi v drugo in obratno. Ta nadzor nad vznemirljivostjo celic vključuje zatiranje K+ GABAA tokov v teh nevronih.
Ta vloga BDNF pri nadzoru odzivov morfija na ravni VTA je v nasprotju z zelo različno vključenostjo v delovanje kokaina in drugih stimulansov. Stimulanti inducirajo BDNF signalizacijo v NAc, učinek zaradi povečane lokalne sinteze BDNF kot tudi povečanega sproščanja iz več afernih regij.95 Poleg tega je bilo dokazano, da povečano BDNF signaliziranje v NAc, vendar ne v VTA, spodbuja vedenjske učinke teh zdravil, vključno z njihovo samoupravo.95,96 Nasprotno uravnavanje signalizacije BDNF na poti VTA-NAc z opiati v primerjavi s poživili povečuje možnost, da takšne razlike posredujejo nasprotno uravnavanje drog NAc dendritičnih bodic, ki je zdaj v preiskavi.
Prihodnje usmeritve
Zgornja pripoved poudarja izjemen napredek, ki je bil dosežen pri razumevanju molekularnih in celičnih prilagoditev, ki se pojavljajo v regijah za nagrajevanje možganov kot odziv na ponavljajočo se izpostavljenost zlorabi drog, in v povezovanju posameznih prilagoditev z določenimi vedenjskimi značilnostmi sindromov odvisnosti v živalskih modelih. . Kljub temu napredku ostajajo glavna vprašanja. Večina naših obstoječih znanj se osredotoča na VTA in NAc, z veliko manj informacijami o drugih ključnih limbičnih regijah možganov, ki so prav tako pomembne za odvisnost od drog. Poleg tega so vse eksperimentalne demonstracije vzročne vloge molekularno-celične prilagoditve v obnašanju, povezanim z drogami, manipulirale posamezne prilagoditve. Hkrati je očitno veliko težje manipulirati s številnimi prilagoditvami, vendar je tudi bistvenega pomena, saj vemo, da droge proizvajajo veliko število neskladnih vrst sprememb tudi znotraj posameznih nevronov, ki se verjetno zbirajo na zapletenih načinih vplivanja na vedenje. Tak pristop sistemske biologije bo ključen za dokončno odpravo bioloških osnov zasvojenosti. Nenazadnje se prizadevanja za razumevanje molekularno-celičnih mehanizmov spominov, povezanih z odvisnostjo, znajdejo na točki, na kateri se zdaj borijo vsa druga prizadevanja za razumevanje biološke osnove vedenjskega spomina: naša sposobnost povezovanja bioloških pojavov s kompleksnim vedenjskim spominom ostaja zelo težka. Premagovanje tega razkoraka predstavlja morda največji izziv v nevroznanosti.
Izbrane okrajšave in kratice
- Nac
- nucleus accumbens
- CREB
- vezni protein cAMP odgovora
- ΔFosB
- Foskopski faktor družine Fos
- VTA
- ventralno tegmentalno območje
- AMPA
- α-amino-3-hidroksi-5-metil-4-izoksazolepropionska kislina
- LTD
- dolgoročno depresijo
- LTP
- dolgoročno protentiranje
- BDNF
- možganski nevrotrofični faktor
- NKkB
- jedrski faktor kB
VIRI