Pripombe: Ta pregled je pripravila vodja NIDA, Nora Volkow in njena ekipa. Ne pušča dvoma, da imajo kemijske in vedenjske odvisnosti enake ali podobne mehanizme in nevronsko vezje. To je popolnoma smiselno, saj kemične odvisnosti ugrabijo nevronsko vezje za vezanje, seks in prehranjevanje. Ker seks sprošča dvakrat več dopamina kot uživanje vaše najljubše hrane, uporabnik pornografije pa lahko dopamin vzdržuje več ur povišano, je noro predlagati, da zasvojenost s porno ne more obstajati.
Curr Top Behav Neurosci. 2011 oktober 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
vir
Nacionalni inštitut za zlorabo drog, izvršni Boulevard 6001 6001, soba 5274, dr. Bethesda, 20892, ZDA, [e-pošta zaščitena].
Minimalizem
Tako zasvojenost z drogami kot debelost je mogoče opredeliti kot motnje, pri katerih se vrednost strmosti ene vrste nagrade (drog in hrana) poveča nenormalno v primerjavi z drugimi in na račun drugih. Ta model je skladen z dejstvom, da imajo zdravila in hrana močne okrepitvene učinke - deloma posredovani z zvišanjem dopamina v limbičnem sistemu -, ki bi v določenih okoliščinah ali pri ranljivih posameznikih lahko premagali možganske homeostatske nadzorne mehanizme. Take vzporednice so vzbudile veliko zanimanja za razumevanje skupnih ranljivosti in usmeritev med odvisnostjo in debelostjo. Zdaj so odkritja slikanja možganov začela odkrivati skupne značilnosti med tema dvema pogojema in razmejevati nekatere možganske prekrivajoče se kroge, katerih disfunkcije lahko razlagajo stereotipne in s tem povezane vedenjske primanjkljaje pri človeških osebah. TRezultati hese kažejo, da tako pri debelih kot pri odvisnikih od drog trpijo motnje v dopaminergičnih poteh, ki uravnavajo nevronske sisteme, povezane ne le z občutljivostjo za nagrajevanje in spodbujevalno motivacijo, temveč tudi s kondicioniranjem (spomin / učenje), nadzorom impulza (vedenjsko zaviranje), stresno reaktivnostjo in interocepcijsko zavedanje. Tukaj vključujemo ugotovitve, ki izhajajo pretežno iz pozitronske emisijske tomografije, ki osvetljujejo vlogo dopamina pri odvisnosti od drog in debelosti, in predlagamo posodobljen delovni model, ki bo pomagal določiti strategije zdravljenja, ki bi lahko koristile obema pogojema.
1 Ozadje
2 Vloga dopamina v akutni nagradi za zdravila in hrano
3 Imaging DA kot odziv na droge in na pogojene naloge odvisnosti
4 Vpliv disfunkcije na inhibicijsko krmiljenje
5 Vključenost motivacijskih vezij
6 Vključenost interocepcijskega vezja
7 Circuitry of Aversion
8 Nagrada za patološka zdravila in hrano: posodobljen delovni model
1 Ozadje
Dopamin (DA) velja za ključnega pomena za koristne učinke naravnih in zdravilnih nagrad. Vendar je njegova vloga pri izgubi nadzora in kompulzivnega vedenja, ki sta povezana z odvisnostjo in debelostjo, veliko manj jasna. Študije PET so igrale odločilno vlogo pri opisovanju vloge možganskih DA sistemov pri odvisnosti (poleg njene vloge pri nagrajevanju z drogami) in pri debelosti. Ljudje zlorabljajo droge (vključno z alkoholom), ki jih uživajo laboratorijske živali, ki jih samoupravljajo, ker jih sam po sebi nagrajuje, kar je učinek, ki ga posredujejo njihove lastnosti DA-ja v mezolimbičnem sistemu (Wise 2009). Hvendar v primeru zasvojenosti slikovne študije razkrijejo, da motnja ne vpliva samo na nagrajevalni krog DA, ampak tudi na druge poti DA, ki so vključene v modulacijo kondicioniranja / navad, motivacije in izvršilnih funkcij (zaviralni nadzor, pripisovanje strjenosti in odločitev - in da lahko primanjkljaji DA sodelujejo tudi pri večji stresni reaktivnosti in motnjah interocepcijske zavesti, povezane z odvisnostjo. Predklinične in klinične študije so odkrile tudi druge nevrotransmiterje (in nevropeptide), ki igrajo pomembno vlogo pri nagrajevanju in odvisnosti od drog (tj. kanabinoidi, opioidi) in so tesno vključeni v nevroplastične spremembe, ki sledijo ponavljajoči se uporabi drog (tj. glutamat, opioidi, GABA, faktor, ki sprošča kortikotropin). V zvezi s tem je glutamatergični sistem še posebej izrazit, ker posreduje motnje tako dolgotrajne potenciranja kot tudi dolgotrajne depresije, ki so jih opazili pri živalskih modelih kroničnega dajanja zdravil (Thomas in sod. 2008). Ocene teh dodatnih sistemov najdete drugje (Kalivas 2009; Koob 1992).
Ker droge aktivirajo iste sisteme nagrajevanja, ki so podlaga za nagrado za hrano, ni povsem nepričakovano, da na splošno študije slikanja možganov podpirajo idejo, da bi bile okvare v krogih, moduliranih z DA, vpletene tudi v patološko, kompulzivno prehranjevalno vedenje. Namigi za hrano, kot na primer droge, povečujejo strični zunajcelični DA in spodbudijo motivacijo za vedenje, ki je potrebno za nabavo in uživanje hrane, kar dokazuje, da DA ne sodeluje samo v nagradi za hrano, ampak tudi v nehedonski motivaciji lastnosti hrane (tj. kalorične potrebe) in zmanjšanje zaviralnega nadzora, ki se kaže pri kompulzivnem prenajedanju (Avena et al. 2008; Volkow et al. 2008a).
Tu pregledujemo ugotovitve slikovnih študij, ki se posebej osredotočajo na prekrivanja možganskih vezi, ki so motene zaradi debelosti in odvisnosti od drog. Velja pa spomniti, da je regulacija vedenja zaužite hrane veliko bolj zapletena kot ureditev vnosa drog. Slednje večinoma posredujejo učinki drog, ki jih nagrajujejo, medtem ko prvo modulirajo ne le s svojimi učinki nagrajevanja (hedonski dejavniki), temveč tudi z več perifernimi in osrednjimi dejavniki, ki občutijo, da so v telesu potrebne hranilne snovi, potrebne za preživetje (homeostatski dejavniki). Zanimivo je, da je vedno več dokazov, da homeostatični dejavniki (npr. Inzulin, leptin, grelin) deloma modulirajo vnos hrane s povečanjem ali zmanjšanjem občutljivosti možganskih nagradnih vezi na dražitelje hrane (Volkow et al. 2011a).
2 Vloga dopamina v akutni nagradi za zdravila in hrano
Neposredno ali posredno vsa zdravila, ki zasvojijo odvisnost, pokažejo sposobnost povečanja DA v jedrskih jezmih (NAc) s specifičnimi interakcijami z različnimi molekularnimi tarčami (Nestler 2004) (Sl. 1). Mezolimbična DA-pot (celice DA v ventralnem tegmentalnem območju (VTA), ki štrlijo v NAc) se zdi ključna za nagrado drog (Wise 2009). Vendar pa, kot je opisano spodaj, tudi druge DA poti [meostriatalne (DA celice v resnici nigra štrlijo v dorzalni striatum) in mezokortikalne (DA celice v VTA, ki štrlijo v čelno skorjo)] prav tako prispevajo k nagradi in odvisnosti od drog (Wise 2009). Na splošno se zdi, da učinke zdravil na nagrajevanje in kondicioniranje večinoma poganja fazično odstranjevanje celic DA, kar vodi v velika in prehodna povečanja DA. V nasprotju s tem so spremembe v izvršni funkciji, ki se pojavljajo v odvisnosti, povezane s spremembami v toničnih DA celicnih strelih in povzročijo nižje, vendar stabilnejše ravni DA (Grace 2000; Wanat in sod. 2009). To pa kaže na D1 receptorje (D1R), ki so receptorji DA z nizko afiniteto, ki spodbujajo ciklično signaliziranje AMP, saj sodelujejo tako pri akutni nagradi zdravila kot kondicioniranju, saj so ti povezani s potrebnimi visokimi koncentracijami DA za stimulacijo D1R. Nasprotno pa D2Rs, ki zavirajo ciklično signaliziranje AMP, stimulirajo tako fazni kot tonski DA. Upoštevajte, da se je večina pomanjkljivih študij o učinkih zlorabe drog in odvisnosti v človeških možganih osredotočila na D1R zaradi pomanjkanja specifičnih radiotraktorjev za slikanje PET receptorjev DA tipa D3, D4, D5 in D2.
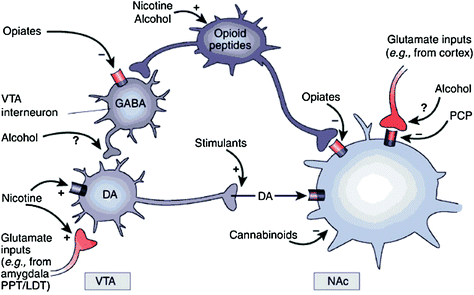
Slika 1 Zloraba drog deluje na nagrajevanje in pomožne kroge prek različnih mehanizmov, vendar vse skupaj vodijo do podobnih dopaminergičnih učinkov v VTA in NAc. Tako stimulansi neposredno povečajo akumbalni DA, medtem ko opiati to storijo z znižanjem zaviralnega tonusa GABAergičnih intervrovronov na DA, ki signalizirajo bodisi v VTA bodisi v takratni NAc. Medtem ko so mehanizmi zlorabe drugih zdravil manj jasni, obstajajo dokazi, ki nakazujejo, da nikotin lahko aktivira VTA DA neposredno preko nikotinskih acetilholinskih receptorjev (nAChR) na teh nevronih in posredno s stimulacijo njegovih receptorjev na glutamatergičnih živčnih terminalih, ki inervirajo celice DA. Zdi se, da alkohol zavira GABAergične terminale v VTA, kar vodi do dezinhibicije nevronov DA v VTA. Kanabinoidi med drugim delujejo z aktiviranjem receptorjev CB1 na glutamatergične in GABAergične živčne terminale v NAc in na samih nevronih NAc. Fenciklidin (PCP) lahko deluje tako, da zavira postsinaptične NMDA glutamatne receptorje v NAc. Poleg tega obstaja nekaj dokazov, ki nakazujejo, da lahko nikotin in alkohol medsebojno vplivata tudi na endogene opioidne in kanabinoidne poti (niso prikazani). PPT / LDT, pedunkularni pontinski tegmentum / stranski dorzalni tegmentum. Ponatisnjeno z dovoljenjem Nestler (2005)
Študije PET so pri ljudeh pokazale, da je več zdravil [poživila (Drevets et al. 2001; Volkow et al. 1999b), nikotin (Brody in sod. 2009), alkohol (Boileau et al. 2003) in marihuano (Bossong et al. 2009)] povečanje DA v hrbtnem in ventralnem striatumu (kjer se nahaja NAc). Te študije izkoristijo več radiotraktorjev, kot so [11C] rakloprid, ki se veže na D2R, vendar le, kadar ti niso vezavni endogeni DA (nezasedeni), ki v izhodiščnih pogojih ustreza 85 – 90% strijnega D2R (Abi-Dargham et al. 1998). Tako primerjava [11C] Vezava rakloprida po placebu in po dajanju zdravila nam lahko pomaga oceniti zmanjšanje razpoložljivosti D2R, ki ga povzroči zdravilo (ali drugi dražljaji, ki lahko povečajo DA). Ta zmanjšanja v [11C] vezava rakloprida je sorazmerna z zvišanjem DA (Breier et al. 1997). Te študije so pokazale, da so zvišanja DA v striatumu povzročena z drogami sorazmerna intenzivnosti subjektivne izkušnje evforije ali "visoke" [glej pregled (Volkow et al. 2009a)] (Sl. 2).
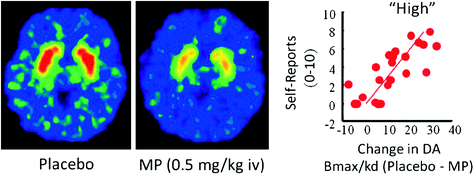
Slika 2 Učinki intravenskega metilfenidata (MP) na vezavo rakloprida in razmerje med strijatalnim DA povečujejo MP, ki jih sproži MP v striatumu, in samoporočanja o "visokih". Spremenjeno od Volkow et al. (1999b)
Študije PET so pokazale tudi jasno, neposredno povezavo med farmakokinetičnim profilom zdravila (tj. Hitrostjo, s katero vstopajo in zapustijo možgane) in njenimi okrepljenimi učinki. Natančneje, hitreje ko zdravilo doseže najvišjo raven v možganih, bolj intenzivno je "visoko" (Volkow et al. 2009a). Na primer, za enakovredno raven kokaina, ki doseže možgane (ocenjeno s PET), je kokain v možgane hitro vstopil (kadil ali dajal intravensko uporabo), sprožil intenzivnejši "visok" kot takrat, ko je vnašal počasneje (smrčal) (Volkow et al. 2000). To je v skladu s predkliničnimi raziskavami, ki kažejo podobno povezavo med farmakokinetičnim profilom zdravila in njegovimi krepitvenimi lastnostmi (Balster in Schuster 1973). t je smiselno domnevati, da lahko tako naglo in veliko povečanje DA, ki ga sprožijo zlorabe drog, posnema hitro in veliko povečanje DA, ki je posledica faznega streljanja DA, ki je bilo v možganih povezano z obdelavo informacij o nagradi in pravičnosti (Schultz 2010). Takšna zvišanja DA, ki jih povzroči uživanje drog, so morda potrebna zaradi zasvojenosti, vendar dejstvo, da se pojavljajo tudi pri posameznikih, ki niso zasvojeni, kaže, da ne zadostujejo za razlago impulzivne in kompulzivne uporabe drog, značilnih za zasvojenost.
Zdaj obstajajo dokazi, da so primerljivi dopaminergični odzivi povezani z nagrajevanjem hrane in da bodo ti mehanizmi verjetno igrali tudi vlogo pri čezmernem uživanju hrane in debelosti. Znano je, da se nekatera živila, zlasti tista, ki so bogata s sladkorjem in maščobo, močno obrestujejo (Lenoir et al. 2007). Visokokalorična hrana lahko spodbuja prekomerno prehranjevanje (prehranjevanje, ki ni povezano z energijskimi potrebami) in sproži naučene povezave med dražljajem in nagrado (pogojem). V evolucijskem smislu je bila ta lastnost okusne hrane včasih ugodna v okoljih, kjer so bili viri hrane pomanjkljivi in / ali nezanesljivi, saj je zagotovil, da se hrana poje, ko je na voljo, kar omogoča shranjevanje energije v telesu (kot maščoba) za nadaljnjo uporabo . Žal je v družbah, kot je naša, kjer je hrana bogata in je stalno na voljo, to prilagajanje postalo obveznost.
Več učinkov nevrotransmiterjev, vključno z DA, kanabinoidi, opioidi in serotoninom, pa tudi hormoni in nevropeptidi, ki sodelujejo pri homeostatskem uravnavanju vnosa hrane, kot so inzulin, oreksin, leptin in grelin, je bilo vključenih v učinke hrane za nagrajevanje (Atkinson 2008; Cason in sod. 2010; Cota in sod. 2006). Od tega je bila DA najbolj temeljito raziskana in je najbolje označena. Poskusi na glodalcih so pokazali, da se ob prvem izpostavljenosti nagradi s hrano izgorevanje DA nevronov v VTA poveča s posledičnim povečanjem sproščanja DA v NAc (Norgren et al. 2006). Podobno je bilo pri zdravih ljudeh z normalno telesno težo dokazano, da zaužitje okusne hrane sprosti DA v dorzalnem striatumu sorazmerno z ocenami prijetnosti obroka (Small et al. 2003) (Sl. 3). Vendar pa, kot je razvidno iz študij z uživalci drog, povečanje strijatalnega DA, ki ga povzroča hrana, ne more razložiti razlike med običajnim vnosom hrane in čezmernim kompulzivnim uživanjem hrane, saj se to pojavlja tudi pri zdravih ljudeh, ki ne jedo pretirano. Tako bodo, podobno kot pri odvisnosti, verjetno, da bodo nadaljnje prilagoditve izgubile nadzor nad vnosom hrane.
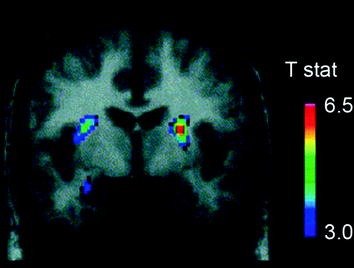
Slika 3 Sproščanje dopamina, povzročeno s hranjenjem. Koronalni odsek s T-zemljevida statistično pomembnih zmanjšanj v [11C] vezavni potencial rakloprida (BP) po hranjenju. Barvna vrstica predstavlja t statistične vrednosti. (Ponatisnjeno z dovoljenjem Small et al. 2003)
3 Imaging DA kot odziv na droge in na pogojene naloge odvisnosti
Vloga DA pri okrepitvi je bolj zapletena kot samo kodiranje nagrade kot take (hedonski užitek); na primer, dražljaji, ki sprožijo hitro in veliko povečanje DA, sprožijo tudi pogojene odzive in sprožijo spodbujevalno motivacijo za njihovo pridobivanje (Owesson-White et al. 2009). To je pomembno, ker s postopkom kondicioniranja nevtralni dražljaji, ki so povezani z ojačevalcem (bodisi naravnim bodisi z ojačevalcem drog), v pričakovanju nagrade pridobijo sposobnost povečanja DA v striatumu (vključno z NAc) in tako nastanejo močna motivacija za iskanje droge (Owesson-White et al. 2009). Vendar pa je odklop mehanizmov nagrajevanja in kondicioniranja v procesu odvisnosti od mamil zahtevnejši kot pri uživanju hrane, ker droge zaradi svojih farmakoloških učinkov neposredno aktivirajo nevrone DA (tj. Nikotin) ali povečajo sproščanje DA (tj. Amfetamina).
Študije slikanja možganov, ki so primerjale povečanje DA, ki ga je povzročil metilfenidat stimulansa (MP) ali amfetamin (AMPH) med osebami, odvisnimi od kokaina, v primerjavi s kontrolami, so pokazale izrazito slabljenje povečanja DA, ki ga povzroča MP ali AMPH, v striatumu (50% manj pri detoksificiranih zlorabah in 80% pri aktivnih zlorabah) in nižja samoporočanja o učinkih nagrajevanja zdravila v primerjavi s kontrolo, ki ne zlorablja droge (Martinez et al. 2007; Volkow et al. 1997) (Sl. 4). To je bilo presenetljivo, saj sta MP in AMPH farmakološko podobna kokainu oziroma metamfetaminu in uživalci drog med njimi ne morejo razlikovati. Ker so opazili izrazita zmanjšanja povečanja DA, ki so jih povzročili z drogami, ali so bili uživalci kokaina razstrupljeni ali ne, to kaže na to, da stanje umika ni moteč dejavnik (Volkow et al. 2011b). Ti in z njimi povezani rezultati (Volkow et al. 2009a) so skladni s hipotezo, da hedonski odziv pri posameznikih, odvisnih od drog, primanjkuje in še bolj krepijo predstavo, da akutni farmakološki učinki zdravila, ki izboljšujejo DA, ne morejo sami razložiti povečane motivacije za njihovo uživanje.
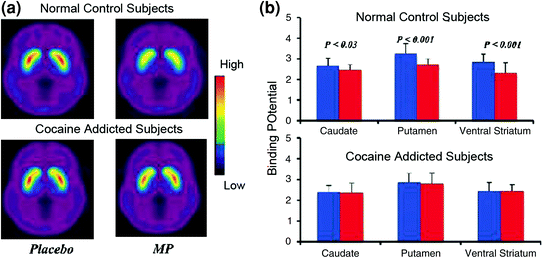
Slika 4 Spremembe DA, ki jih povzroča iv MP pri kontrolah in pri aktivnih osebah, odvisnih od kokaina. povprečna slika nespremenljivega ponudbenega potenciala (BPND) slik [11C] rakloprid pri aktivnih osebah, odvisnih od kokaina (n = 19) in pri kontrolah (n = 24), testiranih po placebu in po iv MP. b Razpoložljivost D2R (BPND) pri hudomu, motenju in ventralnem striatumu po placebu (modra) in po MP (rdeča) pri kontrolnih skupinah in pri osebah, odvisnih od kokaina. MP zmanjšal D2R pri kontrolah, ne pa pri osebah, odvisnih od kokaina. Upoštevajte, da uživalci kokaina kažejo tako zmanjšanje izhodiščne progaste razpoložljive vrednosti D2R (placebo ukrep) kot tudi zmanjšanje sproščanja DA ob dajanju iv MP (merjeno kot zmanjšanje razpoložljivosti D2R od osnovne vrednosti). Čeprav bi se lahko spraševalo, v kolikšni meri nizka prosta D2R razpoložljivost pri osebah, odvisnih od kokaina, omejuje sposobnost zaznavanja nadaljnjega zmanjšanja od MP, dejstvo, da preiskovanci, odvisni od kokaina, kažejo zmanjšanje razpoložljivosti D2R, ko so izpostavljeni kokainom, kaže na oslabljene učinke MP na [11C] vezava rakloprida odraža zmanjšano sproščanje DA. Ponatisnjeno z dovoljenjem (Volkow et al. 1997; Wang in sod. 2010)
Odziv nevronov VTA DA na nagrajevanje dražljajev se spreminja s ponavljajočo se izpostavljenostjo.
Medtem ko DA celice odpustijo ob prvi izpostavljenosti nove nagrade, ponavljajoča izpostavljenost DA povzroči, da nevroni prenehajo streljati ob porabi nagrade in namesto tega, ko so izpostavljeni dražljajem, ki napovedujejo nagrado (Schultz et al. 1997). To bo verjetno temeljilo na vlogi DA pri učenju in pripravljanju. Dejansko fazična DA signalizacija, ki jo povzroča droga, lahko sčasoma sproži nevroadaptacije v pomožnih krogih, ki so povezani z oblikovanjem navad in kondicijo vedenja. Tspremembe hez večinoma povzročajo signalizacijo D1R in sinaptične spremembe NMDA in AMPA receptorjev, ki so modulirani z glutamatom (Luscher in Malenka 2011; Zweifel in sod. 2009). Zapovedovanje teh krogov je pomembno pri napredovanju bolezni, ker slednji pogojeni odzivi pomagajo razložiti intenzivno željo po drogu (hrepenenje) in kompulzivno uporabo, ki se pojavi, ko so odvisniki izpostavljeni znakom, povezanim z drogami. Ta hipoteza je skladna z neodvisnimi opazovanji (Volkow et al. 2006b; Wong in sod. 2006), ki kažejo na moč izpostavljenosti kokainom, ki izvirajo pri izviranju ravni DA v dorzalnem striatumu in sprožijo sočasno povečanje subjektivne izkušnje hrepenenja z razstrupljenimi uživalci kokaina (sl. 5). Ker ima dorzalni striatum vlogo pri učenju navad (Belin et al. 2009; Yin et al. 2004) zveza verjetno odraža krepitev navad, ko kroničnost odvisnosti napreduje. To kaže, da se lahko osnovna motnja zasvojenosti nanaša na pogojene odzive, ki jih sproži DA, kar povzroči navade, ki vodijo do intenzivnega hrepenenja in kompulzivnega uživanja drog. Zanimivo je, da je pri aktivni uporabi oseb, odvisnih od kokaina, povečanje DA, ki ga sprožijo pogojni napisi, celo večje od tistih, ki jih proizvede spodbujevalno zdravilo, kot so ocenili pri dveh ločenih skupinah preiskovancev (Volkow et al. 2011b, 2006b), kar kaže na to, da lahko pogojeni odzivi sprožijo signal DA, ki ohranja motivacijo za jemanje zdravila, tudi če se zdi, da so njegovi farmakološki učinki zmanjšani. Čeprav lahko zdravila ob začetku sproščanja v ventralnem striatumu sprva sprožijo občutek takojšnje nagrajenosti z večkratno uporabo, in ko se navada razvija, se zdi, da je prišlo do prehoda z droga na pogojeni dražljaj. Glede na študije na laboratorijskih živalih te pogojene odzive posredujejo glutamatergične projekcije prefrontalne skorje in amigdale v VTA / SN in NAc (Kalivas 2009). Tako lahko samo napovedovanje nagrade sčasoma postane nagrada, ki motivira vedenje, potrebno za uživanje drog (ali hrane).
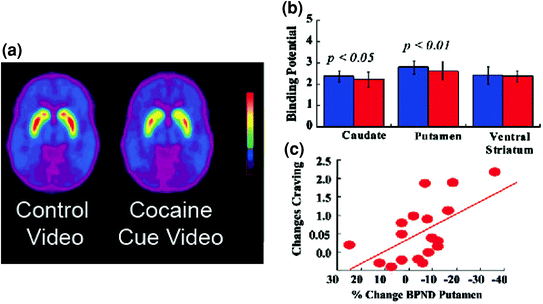
Slika 5 Spremembe DA, ki so jih povzročile pogojene podobe pri aktivnih osebah, odvisnih od kokaina. Povprečne slike nenadomestljivega veznega potenciala (BPND) slik [11C] rakloprida pri osebah, odvisnih od kokaina (n = 17), testirane med gledanjem nevtralnega videoposnetka (naravni prizori) in med gledanjem video posnetka s kokainom (osebe, ki dajejo kokain). b Razpoložljivost D2R (BPND) v kaudatu, putamenu in ventralnem striatumu za nevtralni video (modra) in videoposnetka s kokainom (rdeča). Znaki kokaina so znižali D2R v kaudatah in v moštvu. c Korelacije med spremembami v D2R (odražajo povečanje DA) in samodejnimi poročili o hreščanju kokaina, ki jih povzroča video posnetek kokaina. Spremenjeno iz ref. (Volkow et al. 2006b)
Inenavadno so poročali o tej vrsti funkcionalnega "stikala" tudi za naravne ojačevalce, ki bodo verjetno povzročili enakovreden in postopen premik povečanja DA, od ventralnega na bolj hrbtna področja striatuma med prehodom iz nove spodbude, ki je sama po sebi nagrajevanje s povezanimi znaki, ki to napovedujejo. Ta prehod poteka s signalizacijo DA, ki se zdi, da kodira "napako napovedovanja nagrad" (Schultz 2010). Obsežni glutamatergični aferanti na nevrone DA iz regij, ki sodelujejo pri predelavi senzoričnih (izola ali primarna gustatorna skorja), homeostatskih (hipotalamus), nagradnih (NAc), čustvenih (amigdala in hipokampus) in multimodalnih (orbitofrontalna skorja za pripisovanje izliva) , modulirajo svojo aktivnost kot odziv na nagrade in na pogojene naloge (Geisler in Wise) 2008). Natančneje, pri pogojenih odzivih na hrano so vključene projekcije amigdale in orbitofrontalne skorje (OFC) do nevronov DA in NAc. 2010). Slikovne študije so namreč pokazale, da so moški, ki niso bili debeli, prosili, da zavirajo hrepenenje po hrani, medtem ko so bili izpostavljeni prehrambenim izdelkom -, pokazali zmanjšano presnovno aktivnost v amigdali in OFC (pa tudi pri hipokampusu), instrici in striatumu, in da je bilo zmanjšanje OFC povezano z zmanjšanjem hrepenenja po hrani (Wang et al. 2009). Podobno inhibicijo presnovne aktivnosti v OFC (in tudi pri NAc) so opazili pri zlorabcih kokaina, ko so jih prosili, da bi ob izpostavitvi kokainim sredstvom zavirali hrepenenje po drogah (Volkow et al. 2009b).
Kljub temu pa pojav tako močne hrepenenja, ki je pogojena s hrano, tudi pri zdravih posameznikih, ki ne prenajedajo, ne bi bil tako uničujoč, če jih ne bi povezali z naraščajočim primanjkljajem v zmožnosti možganov, da zavirajo neprimerno vedenje.
4 Vpliv disfunkcije na inhibicijsko krmiljenje
Sposobnost zaviranja prepotentnih odzivov bo morala prispevati k posameznikovi zmožnosti, da se izogne vpletenju neprimernega vedenja, kot je uživanje drog ali prehranjevanje mimo točke sitosti, in s tem poveča svojo občutljivost za zasvojenost (ali debelost) (Volkow in Fowler 2000; Volkow et al. 2008a).
Študije PET so odkrile pomembna zmanjšanja razpoložljivosti D2R v striatumu zasvojenih oseb, ki trajajo mesece po dolgotrajni razstrupljanju [pregledali v (Volkow et al. 2009a)]. Podobno so predklinične študije pri glodavcih in primatih, razen človeka, pokazale, da so ponavljajoče se izpostavljenosti drogam povezane z zmanjšanjem nivoja striga D2R (Nader et al. 2006; Thanos in sod. 2007; Volkow et al. 2001). V striatumu D2R posredujejo signalizacijo v strijalni poti, ki modulira predfrontalna področja; izkazalo se je, da njegovo znižanje vpliva na občutljivost na učinke zdravil na živalskih modelih (Ferguson in sod. 2011). Pri ljudeh, odvisnih od drog, je zmanjšanje strijatalnega D2R povezano z zmanjšano aktivnostjo predfrontalnih regij, kar dokazuje zmanjšanje izhodiščnega metabolizma glukoze (marker možganske funkcije) v OFC, prednjem cingulatskem girusu (ACC) in dorsolateralnem predfrontalnem korteksu (DLPFC ) (Volkow et al. 2001, 1993, 2007) (Sl. 6). V kolikor so OFC, ACC in DLPFC vključeni v atribut strpnosti, zaviranje nadzora / uravnavanja čustev in odločanja, domnevalo se je, da lahko njihova nepravilna regulacija s pomočjo D2R posredovane signalizacije DA pri odvisnih osebah temelji na povečani motivacijski vrednosti drog v njihovem vedenju in izgubi nadzora nad uživanjem drog (Volkow in Fowler 2000). Poleg tega, ker so okvare OFC in ACC povezane z kompulzivnim vedenjem in impulzivnostjo (Fineberg et al. 2009), Lahko DA-jeva modulacija teh regij prispeva k kompulzivnemu in impulzivnemu vnosu drog, ki se kažejo v odvisnosti (Goldstein in Volkow 2002). Dejansko je bil pri zastrupiteljih metamfetamina nizko progasti D2R povezan z impulzivnostjo (Lee in sod. 2009), prav tako pa je napovedoval kompulzivno dajanje kokaina pri glodalcih (Everitt in sod. 2008). Povratni scenarij, pri katerem začetna ranljivost za uporabo drog obstaja v predfrontalnih regijah in s tem, da se ponavljajoča se uporaba drog še bolj zmanjša v strijnem D2R. V resnici je študija, opravljena pri osebah, ki kljub visokemu tveganju za alkoholizem (pozitivna družinska anamneza v družinski anamnezi) niso bili alkoholiki, pokazala večjo razpoložljivost D2R v strij, ki je bila povezana z normalno presnovo v OFC, ACC in DLPFC (Volkow et al. 2006a). To kaže, da je bila pri teh osebah, ki jim grozi alkoholizem, normalno predfrontalno delovanje povezano z okrepljeno striatalno D2R signalizacijo, kar jih je morda zaščitilo pred zlorabo alkohola.
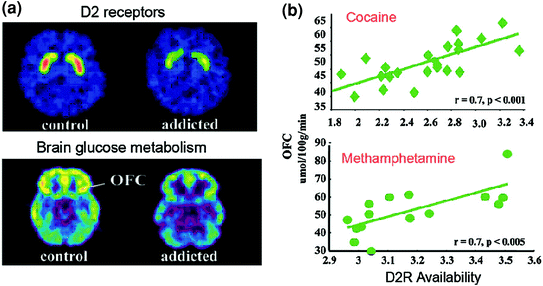
Slika 6 Korelacije med razpoložljivo striatalno D2R in presnovo v predfrontalnih možganskih regijah. Aksialne slike možganov za nadzor in osebe, odvisne od kokaina, za osnovne slike razpoložljivosti D2R v striatumu (dobljeno z [11C] rakloprid) in presnovo možganske glukoze v OFC (dobljeno z [18FDG). b Korelacije med strijatalnim D2R in metabolizmom OFC pri osebah, odvisnih od kokaina in metamfetamina. Ponatisnil Volkow et al. (2009a) Avtorske pravice (2009), z dovoljenjem družbe Elsevier
Predvidoma so pri debelih ljudeh našli tudi dokaze o motnjah regulacije v krmilnih vezjih. Tako predklinične kot klinične študije so pokazale dokaz o zmanjšani striatalni D2R signalizaciji, kar je, kot je bilo že omenjeno, povezano z nagrajevanjem (NAc), pa tudi z vzpostavitvijo navad in rutin (dorzalni striatum) pri obesituy (Geiger in sod. 2009; Wang in sod. 2001). Pomembno je, da je bila zmanjšana razpoložljivost striga D2R povezana s kompulzivnim vnosom hrane pri debelih glodavcih (Johnson in Kenny 2010) in z zmanjšano presnovno aktivnostjo pri OFC in ACC pri debelih ljudeh (Volkow et al. 2008b) (Sl. 7a – c). Glede na to, da disfunkcija v OFC in ACC povzroči kompulzivnost [glej pregled (Fineberg et al. 2009)], to je lahko del mehanizma, s katerim nizka progasta D2R signalizacija olajša hiperfagijo (Davis in sod. 2009). Poleg tega, ker lahko zmanjšana signalizacija, povezana z D2R, tudi zmanjša občutljivost za druge naravne nagrade, lahko ta primanjkljaj pri debelih osebah prispeva tudi k kompenzacijskemu prenajedanju. (Geiger in sod. 2008).
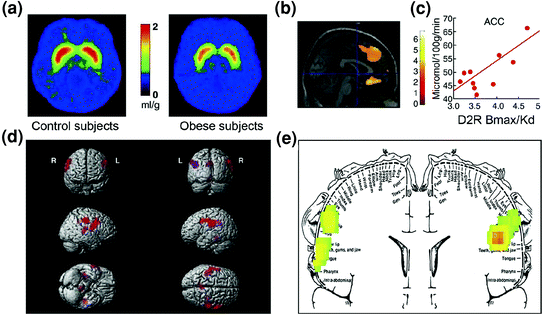
Slika 7 Hiperfagija je lahko posledica nagnjenja k nadomestitvi oslabljenega nagrajevalnega kroga (predelanega skozi kortikostriatalna vezja, urejena z dopaminom) v kombinaciji s povečano občutljivostjo za okusnost (hedonske lastnosti hrane, ki se delno predela prek somatosenzoričnega korteksa). povprečne slike za razpoložljivost receptorjev DA D2 (D2R) pri kontrolah (n = 10) in pri bolnikih s prekomerno debelostjo (n = 10). b Rezultati (statistično parametarsko preslikavo) SPM, ki identificira področja v možganih, kjer je bil D2R povezan z metabolizmom glukoze, med njimi so bili medial OFC, ACC in dorzolateralni PFC (regija ni prikazana). c Regresijski naklon med striatnim D2R in presnovno aktivnostjo v ACC pri debelih osebah. d Tridimenzionalno upodobljene slike SPM, ki prikazujejo območja z večjo presnovo pri debelih kot pri vitkih osebah (P <0.003, nepopravljeno). e Barvno kodirani rezultati SPM so prikazani v koronalni ravnini s superponiranim diagramom somatosenzoričnega homunculusa. Rezultati (vrednost z) so predstavljeni z mavrično lestvico, kjer je rdeča> rumena> zelena. V primerjavi z vitkimi preiskovanci so debeli preiskovanci imeli višjo presnovo v somatosenzoričnih predelih, kjer so zastopana usta, ustnice in jezik, ki sodelujejo pri predelavi okusnosti hrane. Spremenjeno z dovoljenjem Volkowa in sod. (2008a) (a – c) in Wang in sod. (2002) (d, e)
Ta hipoteza je skladna s predkliničnimi dokazi, ki kažejo, da zmanjšana aktivnost DA v VTA povzroči dramatično povečanje uživanja hrane z veliko maščob (Stoeckel idr. 2008). Podobno je bilo v primerjavi s posamezniki z normalno telesno maso debelih oseb, ki so jim bile predstavljene slike visokokalorične hrane (dražljaji, na katere so pogojeni), pokazali povečano nevralno aktivacijo v regijah, ki so del nagradnih in motivacijskih krogov (NAc, dorzalni striatum, OFC , ACC, amigdala, hipokampus in insula) (Killgore in Yurgelun-Todd 2005). Nasprotno pa je bilo pri nadzorovanju normalne telesne mase pri predstavitvi visokokalorične hrane negativno povezano z indeksom telesne mase (BMI) negativno povezano aktiviranje ACC in OFC (regije, ki sodelujejo pri pripisovanju plišanosti, ki se pripenjajo na NAc) ( Stice et al. 2008b). To kaže na dinamično interakcijo med količino zaužite hrane (ki se delno odraža v indeksu telesne mase) in reaktivnostjo regije nagrajevanja za visoko kalorično hrano (ki se odraža v aktiviranju OFC in ACC) pri posameznikih z normalno telesno težo, ki se izgubi v debelost.
Presenetljivo je, da so pri debelih posameznikih manj aktivacije nagradnih vezij pri dejanski porabi hrane (imenovane nagradna hrana) kot vitki posamezniki, medtem ko so pokazali večjo aktivacijo somatosenzoričnih kortikalnih regij, ki predelajo okusnost, ko so pričakovali porabo (Stice et al. 2008b). Slednje opazovanje je ustrezalo regijam, v katerih je prejšnja študija pokazala povečano aktivnost pri debelih osebah, preizkušenih na začetku (ne stimulacija) (Wang in sod. 2002) (Sl. 7d, e). Z okrepljeno dejavnostjo regij, ki obdelujejo okusnost, bi lahko debeli preiskovanci dajali prednost hrani pred drugimi naravnimi ojačevalci, medtem ko bi lahko manjša aktivacija dopaminergičnih ciljev z dejansko porabo hrane povzročila prekomerno porabo kot sredstvo za kompenzacijo šibke signalizacije, ki jo posreduje D2R (Stice et al. 2008a). Ta zmanjšan odziv nagradnega kroga na uživanje hrane pri debelih osebah spominja na zmanjšano povečanje DA, ki ga sproži uživanje drog pri odvisnikih v primerjavi z osebami, ki niso zasvojene.
Prefrontalna skorja (PFC) ima ključno vlogo pri izvršilni funkciji, vključno z zaviralnim nadzorom (Miller in Cohen 2001). Te procese modulirata z D1R in D2R (predvidoma tudi D4R), zato bo zmanjšana aktivnost PFC, tako v odvisnosti kot pri debelosti, verjetno prispevala k slabemu nadzoru in visoki obveznosti. Manjša razpoložljivost D2R v striatumu debelih posameznikov, kar je povezano z zmanjšano aktivnostjo PFC in ACC (Volkow et al. 2008b) bo verjetno prispeval k pomanjkljivemu nadzoru nad vnosom hrane. Dejansko je bila pri debelih poročana o negativni korelaciji med BMI in striatalnim D2R (Wang in sod. 2001) in pri prekomerni telesni teži (Haltia et al. 2007a) posamezniki to podpirajo. Boljše razumevanje mehanizmov, ki vodijo k oslabljenemu delovanju PFC pri debelosti (ali zasvojenosti), bi lahko olajšalo razvoj strategij za izboljšanje ali celo obratno spremembo specifičnih okvar na ključnih kognitivnih področjih. Na primer, diskontiranje z zamudami, ki je težnja po razvrednotenju nagrade, ki je odvisna od časovne zamude pri njeni izročitvi, je ena izmed najobsežnejših kognitivnih operacij v povezavi z motnjami, povezanimi z impulzivnostjo in kompulzivnostjo. Zamudno diskontiranje je bilo najbolj izčrpno raziskano pri uživalcih drog, ki imajo pretirano naklonjenost majhnim, a neposrednim nad velikim, vendar z zamudo (Bickel et al. 2007). Vendar pa je nekaj raziskav, opravljenih pri debelih osebah, odkrilo tudi dokaze o nagnjenosti k visokim, takojšnjim nagradam, kljub povečani možnosti, da bodo utrpeli večje prihodnje izgube (Brogan in sod. 2010; Weller et al. 2008). Pred kratkim pa je druga raziskava ugotovila pozitivno povezavo med indeksom BMI in hiperboličnim diskontiranjem, pri čemer se bodoči negativni izplačila znižujejo manj od prihodnjih pozitivnih izplačil (Ikeda in sod. 2010). Zanimivo je, da je popuščanje z zamudo odvisno od funkcije ventral striatuma (Gregorios-Pippas in sod. 2009) in PFC, vključno s stranskim OFC (Bjork et al. 2009) in je občutljiv na manipulacije DA (Pine et al. 2010). Natančneje, izboljšanje signalizacije DA (z zdravljenjem z L DOPA) je povečalo impulzivnost in časovno popust.
5 Vključenost motivacijskih vezij
Dopaminergična signalizacija modulira tudi motivacijo. Vedenjske lastnosti, kot so živahnost, vztrajnost in vlaganje nenehnih naporov za dosego cilja, so podvrženi modulaciji, ki jo DA deluje v več ciljnih regijah, vključno z NAc, ACC, OFC, DLPFC, amigdala, dorzalnim striatumom in ventralnim pallidumom (Salamone et al. 2007). Disregulirana signalizacija DA je povezana z izboljšano motivacijo za nabavo drog, kar je značilnost odvisnosti, zato se ljudje, odvisni od drog, pogosto ukvarjajo s skrajnim vedenjem, da bi pridobili droge, tudi če povzročijo znane hude in škodljive posledice (Volkow in Li 2005). Ker jemanje drog postane glavno motivacijsko sredstvo pri odvisnosti od drog (Volkow et al. 2003), odvisniki so vzburjeni in motivirani s postopkom pridobivanja droge, vendar so običajno izpostavljeni in apatični, kadar so izpostavljeni dejavnostim, ki niso povezane z drogo. Ta premik so preučevali s primerjanjem vzorcev možganske aktivacije, ki se pojavljajo pri izpostavljenosti pogojnim znakom, in tistih, ki se pojavljajo v odsotnosti takšnih signalov. V nasprotju s zmanjšanjem prefrontalne aktivnosti, o katerem poročajo pri razstrupljevalcih, ki zlorabljajo kokain, kadar ga ne stimulirajo z drogami ali drogami [glej pregled (Volkow et al. 2009a)], te predfrontalne regije se aktivirajo, ko so zlorabniki kokaina izpostavljeni dražljajem (bodisi drogam ali znakom) (Grant et al. 1996; Volkow et al. 1999a; Wang in sod. 1999). Ta rezultat spominja na ugotovitev, da so uživalci kokaina, preučeni kmalu po epizodi kokaina, pokazali povečanje presnovne aktivnosti v OFC in ACC (tudi dorzalni striatum), ki je bil povezan s hrepenenjem (Volkow et al. 1991).
Poleg tega se primerjajo odzivi na iv MP med posamezniki, odvisnimi od kokaina, in odvisniki, ki niso zasvojeni s kokainom, prvi se odzovejo s povečano presnovo v ventralnem ACC in medialnem OFC (učinek, povezan s hrepenenjem), medtem ko je drugi pokazal nasproten odziv, in sicer zmanjšal presnova v teh regijah (Volkow et al. 2005). To kaže, da je lahko aktiviranje teh predfrontalnih regij z izpostavljenostjo drogam specifično za zasvojenost in povezano s povečano željo po drogu. Poleg tega je raziskava, ki je preiskovala odvisnike od kokaina, da namerno zavirajo hrepenenje, ko so bili izpostavljeni drogam, pokazala, da so tisti, ki so bili uspešni pri zaviranju hrepenenja, zmanjšali metabolizem v medialnem OFC (ki procesira motivacijsko vrednost ojačevalca) in NAc (ki napoveduje nagrada) (Volkow idr. 2009b). Te ugotovitve še dodatno potrjujejo vpletenost OFC, ACC in striatum v okrepljeno motivacijo za nabavo drog, zasvojenih z odvisnostjo.
Predvidoma je bil OFC vpleten tudi v pripisovanje vrednosti vidnosti hrani (Grabenhorst in sod. 2008; Rolls in McCabe 2007), kar pomaga oceniti njegovo pričakovano prijetnost in okusnost kot funkcijo njegovega konteksta. Študije PET s FDG za merjenje presnove glukoze v možganih pri posameznikih z normalno telesno maso so poročale, da je izpostavljenost prehrambenim sredstvom povečala presnovno aktivnost v OFC, kar je bil vpliv na zaznavanje lakote in želje po hrani (Wang in sod. 2004). Povečana aktivacija OFC s spodbujanjem hrane verjetno odraža dopaminergične učinke na nižji stopnji in sodeluje pri vključevanju DA v prizadevanje za uživanje hrane. OFC igra vlogo pri učenju povezovanja spodbujevalcev in kondicioniranja (Cox et al. 2005; Gallagher in sod. 1999), podpira hranjenje s kondicijsko barvo (Weingarten) 1983) in verjetno prispeva k prenajedanju ne glede na signale lakote (Ogden in Wardle) 1990). Dejansko je disfunkcija OFC povezana s prenajedanjem (Machado in Bachevalier) 2007).
Podatki o slikanju možganov kljub nekaterim nedoslednostim med raziskavami podpirajo tudi mnenje, da so strukturne in funkcionalne spremembe v možganskih regijah, vključenih v izvršilno funkcijo (vključno z zaviralnim nadzorom), lahko povezane z visokim indeksom telesne mase pri sicer zdravih ljudeh. Na primer, raziskava MRI, narejena pri starejših ženskah, z uporabo morfometrije, ki temelji na vokselih, je odkrila negativno povezavo med BMI in količino sive snovi (vključno s čelnimi regijami), kar je bilo v OFC povezano z oslabljeno izvršilno funkcijo (Walther et al. 2010). Z uporabo PET za merjenje metabolizma glukoze v možganih pri zdravih kontrolah smo poročali o negativni povezanosti med BMI in presnovno aktivnostjo v DLPFC, OFC in ACC. V tej študiji je presnovna aktivnost v predfrontalnih regijah napovedovala uspešnost preiskovancev v testih izvršilne funkcije (Volkow et al. 2009c). Podobno je spektroskopska študija jedrske magnetne resonance (NMR) pri zdravih srednjih in starejših kontrolah pokazala, da je bil BMI negativno povezan z ravnmi N-acetil-aspartata (označevalca celovitosti nevronov) v čelnem korteksu in ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Študije slikanja možganov, ki primerjajo debele in vitke osebe, so poročale tudi o nižji gostoti sive snovi v čelnih regijah (frontalni operkulum in srednji frontalni gyrus) ter v post-centralnem gyrusu in putamen (Panakleulli et al. 2006). Druga študija pa ni ugotovila razlik v količini sive snovi med debelimi in vitkimi osebami, zabeležila je pozitivno povezavo med količino bele snovi v bazalnih možganskih strukturah in razmerjem pasu in kolkov, kar je bilo delno obrnjeno z dieto (Haltia et al. 2007b). Zanimivo je, da so se kortikalna območja, kot sta DPFC in OFC, ki sodelujejo pri zaviralnem nadzoru, tudi pri uspešnih dietih aktivirala kot odgovor na zaužitje obroka (DelParigi in sod. 2007), kar kaže na potencialno tarčo vedenjske prekvalifikacije pri zdravljenju debelosti (in tudi pri zasvojenosti).
6 Vključenost interocepcijskega vezja
Neuroimaging študije so pokazale, da ima srednja izola kritično vlogo pri hrepenenju po hrani, kokainu in cigaretah (Bonson in sod. 2002; Pelchat in sod. 2004; Wang in sod. 2007). Pomembnost insule je bila poudarjena s študijo, v kateri so poročali, da so kadilci s poškodbo te regije (vendar ne nadzorujejo kadilcev, ki so utrpeli zunajtelesne poškodbe) lahko enostavno prenehali kaditi in ne izkusili nobenega hrepenenja ali ponovitve (Naqvi et al . 2007). Izola, zlasti njena bolj sprednja območja, je vzajemno povezana z več limbičnimi regijami (npr. Ventromedialna prefrontalna skorja, amigdala in ventralni striatum) in se zdi, da ima interoceptivno funkcijo, ki povezuje avtonomne in visceralne informacije s čustvi in motivacijo ter tako zagotavlja zavestno zavedanje teh nagonov (Naqvi in Bechara) 2009). Študije lezij možganov kažejo, da sta ventromedial PFC in insula nujni sestavni deli porazdeljenih vezij, ki podpirajo čustveno odločanje (Clark in sod. 2008). V skladu s to hipotezo slikovne študije dosledno kažejo na diferencialno aktivacijo izola med hrepenenjem (Brody in sod. 2009; Goudriaan in sod. 2010; Naqvi in Bechara 2009; Wang in sod. 1999). V skladu s tem je bilo predlagano, da reaktivnost tega možganskega območja služi kot biomarker za pomoč pri napovedovanju ponovitve (Janes et al. 2010).
Izola je tudi primarno gustatorno območje, ki sodeluje v mnogih vidikih prehranjevalnega vedenja, kot je okus. Poleg tega rostralna izola (povezana z primarno skorjo okusa) nudi OFC informacije, ki vplivajo na njegovo multimodalno predstavitev prijetnosti ali vrednosti dohodne hrane (Rolls 2008). Zaradi vpletenosti insule v interoceptivni občutek telesa, v čustveno zavedanje (Craig 2003) in v motivaciji in čustvovanju (Rolls 2008), lahko pričakujemo prispevek otoške oslabitve pri debelosti. Detekcija želodca dejansko povzroči aktivacijo zadnjega insula, kar bo verjetno odražalo njegovo vlogo pri zavedanju telesnih stanj (v tem primeru polnosti) (Wang in sod. 2008). Poleg tega je pri vitkih, vendar ne pri debelih osebah odstranjevanje želodca povzročilo aktiviranje amigdale in deaktivacijo sprednje insule (Tomasi in sod. 2009). Pomanjkanje odziva amigdale pri debelih osebah bi lahko odražalo zapleteno interocepcijsko zavedanje telesnih stanj, povezanih s sitostjo (poln želodec). Čeprav je modulacija izolacijske aktivnosti s strani DA slabo raziskana, je prepoznano, da je DA vključen v odzive na degustacijo okusne hrane, ki je posredovana prek insule (Hajnal in Norgren 2005). Študije slikanja ljudi so pokazale, da je okušanje okusne hrane aktiviralo območje otoka in srednjega možganov (DelParigi in sod. 2005; Frank in sod. 2008). Vendar bo signalizacija DA morda potrebna tudi za zaznavanje vsebnosti kalorij v hrani. Na primer, ko so ženske z normalno telesno maso okusile sladilo s kalorijami (saharoza), sta se aktivirala območje insule in dopaminergični srednji možgan, medtem ko je okušanje sladila brez kalorij (sukraloza) samo aktiviralo insulo (Frank in sod. 2008). Pri okušanju tekočega obroka, ki je sestavljen iz sladkorja in maščobe, je pri debelih preiskovancih značilna večja izolacijska aktivacija kot običajna kontrola (DelParigi in sod. 2005). V nasprotju s tem pa osebe, ki so si opomogle zaradi anoreksije nervoze, pokažejo manj aktivacije v izoli pri okušanju saharoze in nobene povezave občutkov prijetnosti z otožno aktivacijo, kot so opazili pri običajnih kontrolah (Wagner et al. 2008). Če se združijo ti rezultati, je verjetno, da bi prišlo do motenega nadzorovanja različnih apetitnih vedenj, da bi nepravilnost otoka kot odziv na dražljaje okusa sodelovala pri oslabljenem nadzoru različnih apetitnih vedenj.
7 Circuitry of Aversion
Kot smo že omenili, trening (kondicioniranje) na iztočnici, ki napoveduje nagrado, vodi v odstranjevanje dopaminergičnih celic kot odziv na napoved nagrade in ne do same nagrade. Po drugi strani in v skladu s to logiko je bilo ugotovljeno, da dopaminergične celice odpustijo manj kot običajno, če se pričakovana nagrada ne uresniči (Schultz et al. 1997). Kumulativni dokazi (Christoph et al. 1986; Lisoprawski in sod. 1980; Matsumoto in Hikosaka 2007; Nishikawa in sod. 1986) opozarja na habenulo kot eno od regij, ki nadzoruje zmanjšanja odstranjevanja dopaminergičnih celic v VTA, ki lahko sledijo nepridobitvi pričakovane nagrade (Kimura in sod. 2007). Tako bi lahko povečana občutljivost habenule, ki je posledica kronične izpostavljenosti drogam, podlaga za večjo reaktivnost na znake zdravil. Dejansko je bila aktivacija habenule pri osebah, odvisnih od kokaina, povezana z obnašanjem vedenja med jemanjem drog po izpostavljanju (Brown et al. 2011; Zhang in sod. 2005). V primeru nikotina se zdi, da nikotinski receptorji α5 v habenuli modulirajo averzivne odzive na velike odmerke nikotina (Fowler et al. 2011); in receptorji α5 in α2 v habenuli so vpleteni v odvzem nikotina (Salas et al. 2009). Zaradi nasprotnega odziva habenule na odziv (neaktivacijo) DA nevronov in njegovo aktiviranje ob izpostavljenosti averzivnim dražljajem označujemo habenulski signal kot tisti, ki prenaša vhod "antireward".
Zdi se, da habenula igra podobno vlogo pri nagrajevanju hrane. Zelo prijetna prehrana lahko pri podganah povzroči debelost, pri čemer se teža povečuje s povečanjem vezave μ-opioidnih peptidov v bazolateralno in basomedialno amigdalo. Zanimivo je, da je medialna habenula pokazala občutno večjo vezavo μ-opioidnega peptida (za približno 40%) po izpostavitvi okusni hrani pri podganah, ki so pridobile na teži (tistih, ki so zaužile več hrane), ne pa pri tistih, ki tega niso storili (Smith in sod. 2002). To kaže, da je lahko habenula vpletena v prenajedanje pod pogoji razpoložljivosti živil. Poleg tega se nevroni v rostromedialnem tegmentalnem jedru, ki dobijo velik vložek iz stranske habenule, projicirajo v nevrone VTA DA in se aktivirajo po odvzemu hrane (Jhou in sod. 2009). Te ugotovitve so skladne z vlogo habenule pri posredovanju odzivov na averzivne dražljaje ali stanja, kot so tista, ki se pojavijo med dieto ali umikom drog.
Vključenost habenule kot antireward pesto v čustvenih omrežjih je skladna s predhodnimi teoretičnimi modeli odvisnosti, ki so postavili senzibilizirane odzive proti nagrajevanju (posredovani s povečano občutljivostjo amigdale in povečano signalizacijo, čeprav je dejavnik sproščanja kortikotropina) kot gonilo uživanja drog pri odvisnosti (Koob in Le Moal 2008). Podobni antirewardski odzivi lahko prav tako prispevajo k čezmernemu uživanju hrane pri debelosti.
8 Nagrada za patološka zdravila in hrano: posodobljen delovni model
Tnjegov sposobnost, da se upira nagonu po uživanju droge ali prehranjevanju mimo točke sitosti, zahteva pravilno delovanje nevronskih vezij, vključenih v nadzor od zgoraj navzdol, da nasprotuje pogojenim odzivom, ki napovedujejo nagrado zaradi zaužite hrane / droge in željo po zaužitju hrana / droga. Tu smo izpostavili šest teh sklopov: nagrajevanje / izrazitost, kondicijo / navade, zaviralno krmiljenje / izvršilno funkcijo, motivacijo / pogon, interocepcijo in odpornost proti izogibanju / stresnost (sl. 8). Na podlagi slikovnih podatkov, predstavljenih tukaj, predpostavljamo, da je odstopanje med pričakovanjem učinkov drog / hrana (pogojeni odzivi) in prikritega nevrofiziološkega učinka, ki vzdržuje jemanje drog ali prekomerno porabo hrane v poskusu doseči. pričakovana nagrada. Tudi pri testiranju med zgodnjimi ali dolgotrajnimi obdobji abstinence / diete zasvojeni / debeli preiskovanci kažejo nižji D2R v striatumu (vključno z NAc), ki je povezan z zmanjšanjem izhodiščne aktivnosti v čelnih možganskih regijah, povezanih z atribucijo izločanja (orbitofrontalna skorja) in zaviralno krmiljenje (ACC in DLPFC), katerega motnje povzročajo kompulzivnost in impulzivnost. Fpravzaprav se pojavljajo tudi dokazi o vlogi interoceptivnih in averzivnih vezij v sistemskih neravnovesjih, ki povzročajo kompulzivno uživanje drog ali hrane.
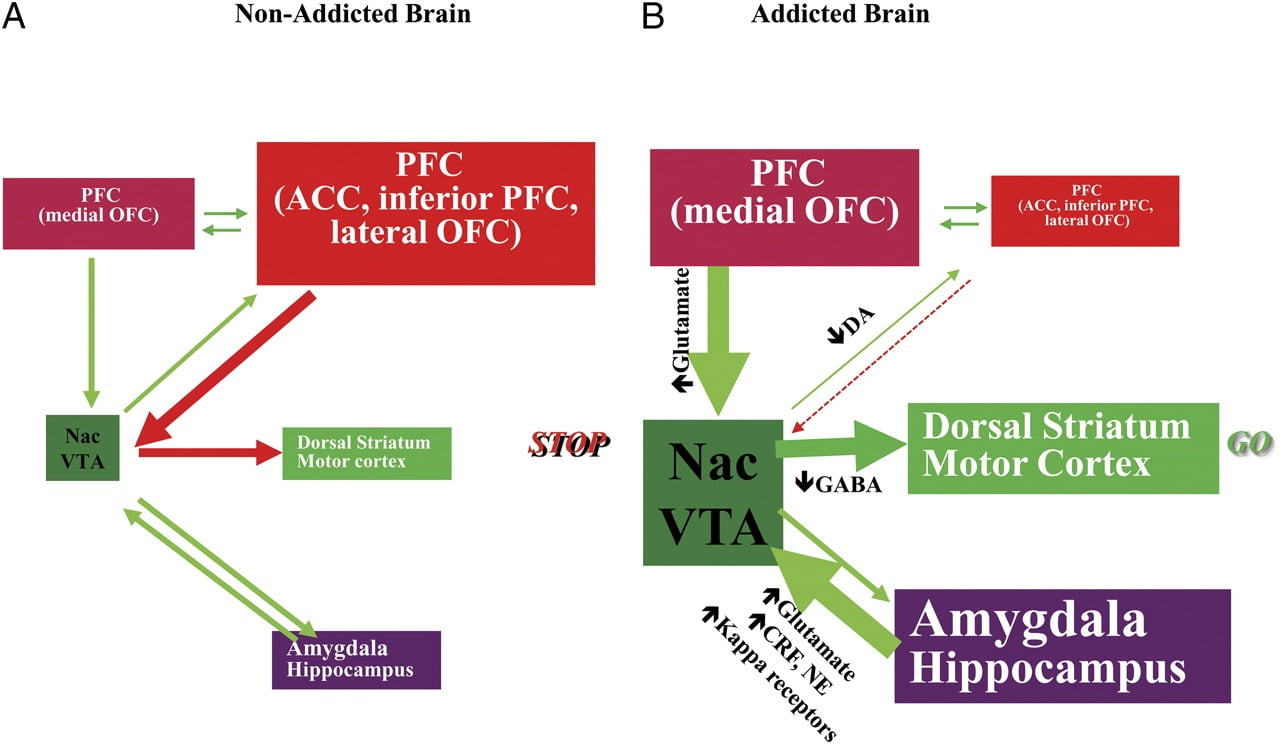
Slika 8 Model, ki predlaga mrežo interaktivnih vezij, motnje, ki prispevajo k zapletenemu naboru stereotipnih vedenj, ki temeljijo na odvisnosti od drog in kroničnem prenajedanju: nagrada (nucleus accumbens, VTA in ventral pallidum), kondicioniranje / spomin (amigdala, medialni OFC za pripisovanje strmosti, hipokampus in dorzalni striatum navadam), izvršilni nadzor (DLPFC, ACC, spodnja čelna skorja in bočni OFC), motivacija / pogon (medialni OFC za atribucijo saliency, ventral ACC, VTA, SN, dorzalni striatum in motorična skorja). Nac, jedrni jezgri, interocepcija (Insula in ACC) in averzija / izogibanje (Habenula). a Ko so ti tokokrogi uravnoteženi, je to posledica ustreznega zaviralnega nadzora in odločanja. b Med odvisnostjo, ko povečana pričakovalna vrednost zdravila v nagradnih, motivacijskih in spominskih krogih premaga krmilni tokokrog, daje prednost zanki s pozitivno povratno informacijo, ki jo sproži uživanje droge in ki jo ohranja okrepljeno aktiviranje motivacije / pogona spominska vezja. Ta vezja sodelujejo tudi z vezji, ki sodelujejo pri uravnavanju razpoloženja, vključno s stresno reaktivnostjo (ki vključuje amigdalo, hipotalamus, habenulo) in interocepcijo (ki vključuje insulo in ACC ter prispeva k ozaveščenosti o hrepenenju). V te nevroadaptacije je vključenih več nevrotransmiterjev, vključno z glutamatom, GABA, norepinefrinom, faktorjem sproščanja kortikotropina in opioidnimi receptorji. CRF, faktor, ki sprošča kortikotropin; NE, norepinefrin. Spremenjeno z dovoljenjem Volkow et al. (2011b)
Zaradi zaporednih motenj v teh krogih lahko posamezniki doživijo 1) povečano motivacijsko vrednost zdravila / živila (sekundarnega za naučene asociacije s kondicijo in navadami) na račun drugih ojačevalcev (sekundarno na zmanjšano občutljivost nagradnega kroga ), 2) oslabljena sposobnost zaviranja namernih (ciljno usmerjenih) dejanj, ki jih sproži močna želja po jemanju drog / živil (sekundarno do okvarjene izvršilne funkcije), ki povzročajo kompulzivno jemanje drog / hrane, in 3) povečano stresno reaktivnost in averzivno izogibanje, ki ima za posledico impulzivno jemanje drog za izhod iz averzivnega stanja.
Ta model predlaga večplastni terapevtski pristop k zasvojenosti, ki je zasnovan za zmanjšanje ojačevalnih lastnosti drog / hrane, ponovno vzpostavitev / izboljšanje koristnih lastnosti naravnih ojačevalcev, zaviranje pogojenih asociacij, povečanje motivacije za dejavnosti, ki niso povezane z uživanjem drog / živil, zmanjšanje stresne reaktivnosti , izboljšati razpoloženje in okrepiti splošno zaviralni nadzor.
Priznanja
Avtorji bi se radi zahvalili za podporo intramuralnemu programu NIAAA Nacionalnega inštituta za zdravje.
Reference