Znanstvena poročila Obseg 9, Številka članka: 16918 (2019)
Minimalizem
Prekomerno uživanje saharoze vzbuja hrepenenje, podobno odvisnosti, ki lahko temelji na epidemiji debelosti. Opioidi in dopamin posredujejo koristnim učinkom zlorabe drog in naravnih koristi od dražljajev, kot je okusna hrana. Raziskali smo učinke saharoze z uporabo PET slikanja z [11C] karfentanil (agonist p-opioidnih receptorjev) in [11C] rakloprid (antagonist receptorja dopamina D2 / 3) v sedmih ženskah, ki so anestezirale göttingenske minipigse. Nato smo minipikom omogočili 12 ur zapored dostop do raztopine saharoze in 24 ur po končnem dostopu saharoze opravili slikanje. V manjšem vzorcu petih minipigsov smo izvedli dodatno [11C] PET karfentanil seje po prvi izpostavljenosti saharozi. Izračunali smo voksalno vezne potenciale (BP)ND) z uporabo možganov kot območja neskladne vezave, analizirali razlike s statističnim neparametričnim preslikavanjem in izvedli regionalno analizo. Po 12 dneh dostopa saharoze BPND Obe sledilci so se v striatumu, jedrni jezgri, talamusu, amigdali, cingulatni skorji in prefrontalni skorji bistveno zmanjšali, kar je skladno z nižjo regulacijo gostote receptorjev. Po enkratni izpostavljenosti saharozi smo ugotovili zmanjšano vezavo [11C] karfentanil v nukleusnem okolju in cingulatna skorja, skladno s sproščanjem opioidov. Manjša razpoložljivost opioidnih in dopaminskih receptorjev lahko pojasni zasvojenost, ki je povezana z vnosom saharoze.
Predstavitev
Pet odstotkov svetovne populacije je klinično debelih1. Kot značilnost presnovnega sindroma je debelost povezana s sladkorno boleznijo tipa 2, boleznimi srca in ožilja, težavami z dihali ter tveganjem za depresijo in morda demenco2. Povečano uživanje energijsko goste hrane je pretirano povečalo fiziološko razlikovanje med homeostatsko lakoto, ki sledi pomanjkanjem hrane, in hedonsko lakoto ali "hrepenenjem", ki se pojavi brez pomanjkanja3,4. Ker samo homeostatična regulacija ne more upoštevati trenutnega porasta debelosti, je obvezno preizkusiti učinek na možganske mehanizme nagrajevanja in zadovoljstva zasvojenosti z visoko okusno hrano.
Uživanje saharoze je povezano z debelostjo, saharoza pa vedno bolj velja za zasvojenost5. Nekatere ugotovitve so v nasprotju s to trditvijo zaradi težav pri ločevanju neprimerne porabe hrane od hedonskih odzivov na hrano in pri določanju zasvojenosti s predelano hrano, pa tudi zaradi različnih mehanizmov, s katerimi hrana spreminja kroženje možganov po naravnih poteh6. Kljub temu v posebnih okoliščinah vnos saharoze povzroči nagrado in hrepenenje, primerljivo po obsegu s tistimi, ki jih povzročajo zasvojenost, ki vodijo do čezmerne porabe in morebitne debelosti.6,7.
Lakota je v številnih okoliščinah nagrajevanja povezana z "željo", ki je tesno povezana z učinki dopaminergičnega nevrotransmisije.8, vendar ostaja nejasno, kako se delovanje dopamina (DA) modulira kot odgovor na kompulzivno uživanje. Uživanje okusne hrane je povezano z "všečkanjem", ki ga posreduje predvsem endogeni opioidni sistem, zlasti μ-opioidni receptor (μOR)9,10, ki lahko spodbuja prekomerno porabo, če se odpravi. V tem poročilu testiramo trditev, da saharoza vodi do sproščanja opioidov in dopamina, kar zmanjšuje razpoložljivost receptorjev μOR in DA D2 / 3. Razpoložljivost je indeks števila nezasedenih receptorjev, ki so na voljo za vezavo sledilcev, in načeloma ne razlikuje med zasedenostjo liganda in gostoto receptorjev11.
Pojav kompulzivnega prehranjevanja je odvisen od več dejavnikov, vzročne študije pri ljudeh pa odpirajo etična vprašanja. Večina raziskav se zato osredotoča na hranjenje pri podganah12. Čeprav imajo podgane "sladki zob", se njihovi homeostatični mehanizmi, pomembni za povečanje telesne mase, presnovo in vrsto kopičenja maščob, bistveno razlikujejo od tistih pri ljudeh. Göttingenska minipig je velika vsejeda žival z dobro razvitimi girencefalnimi možgani, ki jih je mogoče slikati z zadostno ločljivostjo. Dobro opredeljene subkortikalne in prefrontalne kortikalne regije13 omogočiti bolj neposreden prevod na funkcijo človeških možganov. Tu za testiranje uporabljamo slikanje pozitronsko-emisijske tomografije (PET) vivo razpoložljivost μOR in DA D2 / 3 v modelu minipigov subkronične izpostavljenosti saharozi. V manjšem vzorcu smo raziskali takojšnje učinke na zasedenost μOR po prvi izpostavljenosti saharozi. Nazadnje smo preizkusili razmerje med spremembami razpoložljivosti receptorjev obeh sledilcev.
Rezultati
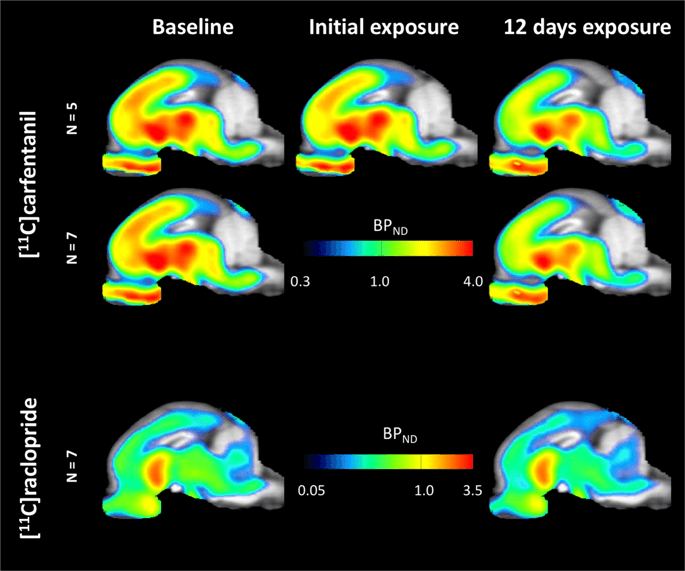
Povprečne parametrične karte [11C] karfentanil in [11C] potencial vezave rakloprida (BP)ND) so prikazani na Sl. 1. Analizirati spremembe, ki so se pojavile po prvi izpostavljenosti saharozi v petih minipigsih v primerjavi z izhodiščem in en dan po 12th dostop saharoze v sedmih mini prašičih v primerjavi z izhodiščem, uporabili smo teorijo permutacije in neregionalno omejeno analizo celih možganov, najprimernejšo metodo za vzorce te velikosti14.
Povprečni neodločljivi vezalni potencial, ki temelji na vokselu (BP)ND) zemljevidi, naloženi na MRI slike v sagitalnem pogledu. Podatki so predstavljeni za [11C] karfentanil BPND od petih majhnih prašičev, posnetih na začetku, po začetni izpostavljenosti saharozi in po 5 dneh izpostavljenosti saharozi (zgornja vrstica). [11C] karfentanil BPND od vseh 7 minipigsov, posnetih na začetku in po 12 dneh dostopa saharoze, so predstavljeni v srednji vrsti. [11C] rakloprid BPND od vseh 7 minipigsov, posnetih na začetku in po 12 dneh dostopa saharoze, so prikazane v spodnji vrstici. Upoštevajte, da je barvna lestvica eksponentna za poudarjanje [11C] rakloprid BPND v ekstrastriatalnih regijah.
Začetna izpostavljenost saharozi
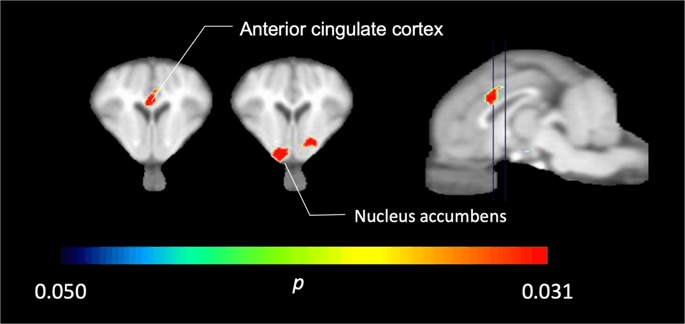
V petih minipičkih, posnetih z [11C] karfentanila v izhodišču in takoj po prvi izpostavljenosti saharozi smo ugotovili znatno zmanjšano vezavo sledilcev v sprednjem korteksu cingulata in jedru, ki se je odzvalo na saharozo, prikazano v barvi na sliki. 2, kar pomeni p <0.05. Zaznali smo kar 14% zmanjšano vezavo sledil na obeh področjih v primerjavi z izhodiščem.
Znatna zmanjšanja v [11C] karfentanil BPND po prvi izpostavljenosti saharozi vode v primerjavi z izhodiščno vrednostjo (n = 5). Samo voksli s pomembnimi (p Zmanjšanja <0.05) so prikazana kot barvna območja, projicirana na T1 ponderirane rezove z magnetno resonanco na ravni sprednje cingulativne skorje (levo) in nucleus accumbens (sredina) iz stereotaksičnega atlasa minipig možganov. Upoštevajte, da je največja stopnja pomembnosti, ki jo je mogoče doseči pri 5 živalih, 2-5 ≈ 0.031 (glej barvno vrstico). Podatki so predstavljeni na koronalnih odsekih prašičjih možganov na nivojih, ki so navedeni na sagitalni sliki (desno).
12 dni dostopa saharoze
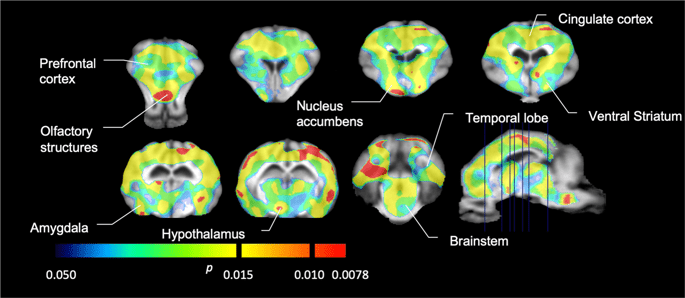
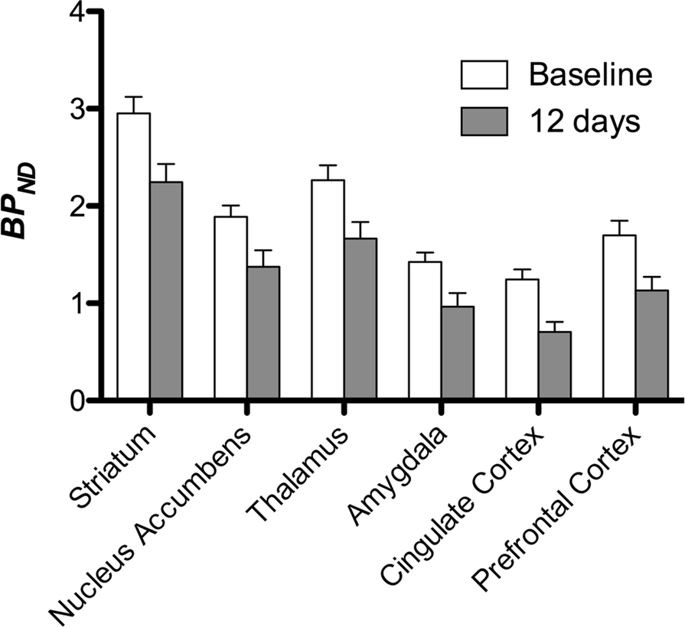
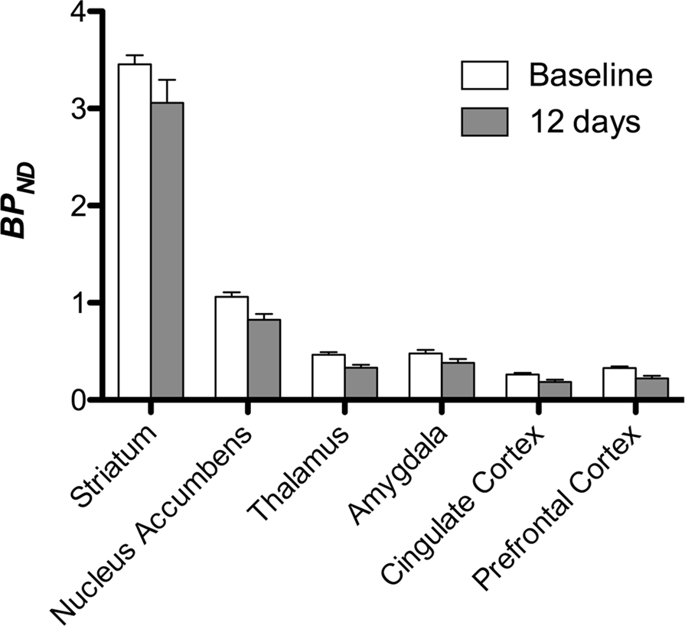
Nato smo opravili analizo sedmih minipigsov, posnetih s [11C] karfentanil na začetku in po 12 dneh dostopa do saharoze in ugotovil je znatno zmanjšano vezavo sledilcev na živali, ki so bile izpostavljene saharozi, v primerjavi z izhodiščno vrednostjo. Najbolj močno prizadeta območja so prikazana z rdečo na Sl. 3 (p <0.01) in vključujejo dele vohalnih struktur, nucleus accumbens / ventral striatum in temporal skorje / režnja, čemur sledijo rumeno prikazana območja (p <0.015), ki vključujejo dele predfrontalne skorje, cingulaste skorje, amigdale in možganskega debla . Da bi dobili BPND vrednosti in ocenili odstotno spremembo, izvedli smo regionalno analizo in v vsaki regiji dobili povprečne vrednosti in po porabi saharoze (sl. 4).
Znatna zmanjšanja v [11C] sposobnost vezanja karfentanila (BP)ND) med izhodiščem in po 12 dneh izpostavljenosti saharozi vode (n = 7). Vokseli s pomembnimi (p Znižanja <0.05) so prikazana kot barvna območja, projicirana na T1 ponderirane rezove MRI iz stereotaksičnega atlasa možganskih minipig. Podatki so predstavljeni na možganskih možganskih odsekih na nivojih, ki so navedeni na sagitalni sliki (spodaj desno). Upoštevajte, da je največja stopnja pomembnosti, ki jo je mogoče doseči pri 7 živalih, 2-7 ≈ 0.0078 (glej barvno vrstico).
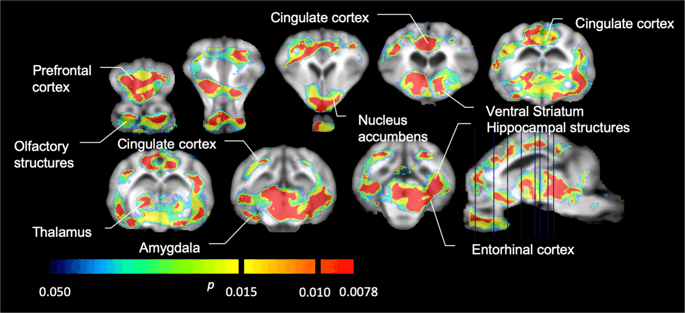
Smo uporabili [11C] rakloprid kot sledilnik DA D2 / 3 receptorjev v strijatalnih in ekstrastriatalnih regijah možganov v minipigsih na začetku in po 12 dneh dostopa do saharoze (sl. 1). Ugotovili smo zmanjšano vezavo sledil pri živalih, izpostavljenih saharozi, v primerjavi z izhodiščem z največjimi učinki (p <0.01) na predelih predfrontalne skorje, nucleus accumbens / ventral striatum, cingulate cortex, amigdala, talamus, mezencefalon, hipokampalna območja in vohalna območja (Sl. 5). Podatki iz regionalne analize so predstavljeni na sl. 6.
Znatna zmanjšanja v [11C] potencial vezave rakloprida (BP)ND) med izhodiščem in po 12 dneh izpostavljenosti saharozi vode (n = 7). Vokseli s pomembnimi (p Znižanja <0.05) so prikazana kot barvna območja, projicirana na T1 ponderirane rezove MRI iz stereotaksičnega atlasa možganskih minipig. Podatki so predstavljeni na koronalnih odsekih možganov prašičev na nivojih, ki so navedeni na sagitalni sliki (spodaj desno). Upoštevajte, da je največja stopnja pomembnosti, ki jo je mogoče doseči pri 7 živalih, 2-7 ≈ 0.0078 (glej barvno vrstico).
Korelacije med [11C] rakloprid in [11C] podatki karfentanila
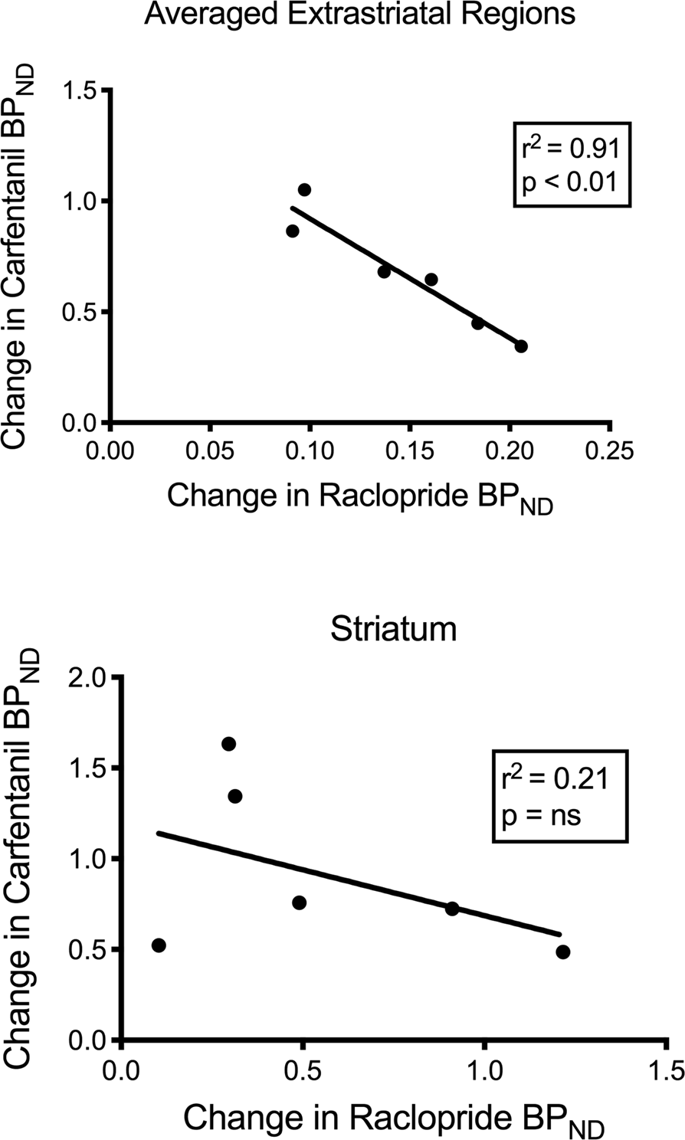
Testirali smo potencialno korelacijo med [11C] rakloprid in [11C] vrednosti karfentanila v BPND v območjih strijatalnih in nestrijalnih območij v minipigsih po izhodišču in po 12 dneh vnosa saharoze, pri čemer niso opazili nobenih povezav. Nato smo preizkusili, ali je upad sledenja povezan, in primerjali spremembe BPND za [11C] rakloprid s spremembami BPND za [11C] karfentanil le v miniparatih, ki so imele nižji krvni tlakND obeh sledov po vnosu saharoze (n = 6). Ugotovili smo pomembne negativne korelacije v povprečju ekstrastriatal (r2 = 0.91, p <0.01), vendar ne v striatalnih regijah (sl. 7).
Korelacije med predhodnimi popadki od [11C] rakloprid in [11C] potenciali vezave karfentanila (BP)ND) pri majhnih prašičih z zmanjšano vezavo sledilcev po vnosu saharoze (n = 6). Predstavljeni so podatki iz povprečnih ekstrastriatalnih regij (zgoraj) in striatum (spodaj). Koeficient določitve (r2) in p vrednosti so prikazane za vsak graf.
Razprava
Ugotovili smo učinke ponavljajočega se prekinitvenega dostopa saharoze na nevrotransmisijo opioidov in DA v možganih sesalcev. Vzdolžni vivo PET-slikanje receptorjev μOR in DA D2 / 3 je pokazalo zmanjšano razpoložljivost receptorjev v celotnem krogu nagrajevanja, vključno z jezgri jedra, predfrontalno skorjo in sprednjo cingulatno skorjo. Rezultati jasno kažejo, da saharoza vpliva na mehanizme nagrajevanja na podoben način kot pri zlorabi drog.
Znano je, da vnos saharoze kot prijetne snovi sprošča DA in povzroča odvisnost pri glodalcih15, pri čemer je saharoza pri glodalcih celo bolj prijetna kot kokain pri glodalcih. Tako glodalci delujejo intenzivneje, da pridobijo saharozo kot kokain, tudi če ni pomanjkanja hrane5. Vendar učinke saharoze uravnavata homeostatični sistem in hedonski nagrajevalni krogi16,17 ki lahko posredujejo med razlikovanjem med prehranskimi in hedonskimi vidiki delovanja saharoze18. Odločili smo se za urno uro na dan, da bi spodbudili "binganje", saj so prejšnje študije na podganah pokazale večji vnos v prvi uri vsakodnevnega dostopa v prekinitvenem urniku15,19. Študije vedenja vnosa hrane pogosto usmerjajo živali z omejeno hrano, vendar zasnova morda ne odraža nujno istih nevronskih mehanizmov, ki delujejo pri debelosti. Prašiči v tej študiji niso bili omejeni s hrano in so jih poleg dostopa do saharoze hranili običajne količine njihove običajne prehrane.
Opioidni receptorji (OR) so široko izraženi v možganih, zlasti v strukturah, za katere je znano, da modulirajo procese prehranjevanja in nagrajevanja20. Izkazalo se je, da so najbolj odporni učinki kokaina pomembni za nagrajevanje in ponovitev učinka21,22,23,24. Spremembe vezave so bile povezane tudi s homeostatskimi odzivi na prehranjevanje in užitkom, povezanim s okusno hrano25. Zlasti je "všečkanje" hrane povezano z endogenim opioidnim sistemom, zlasti z µOR9,10 v lupini jedra accumens in ventral pallidum26. Infuzije agonista µOR v različne dele jedrnega jedra in ventralni palidum močno povečujejo "všečno" vedenje, vključno z izrastki jezika in lizanjem šape, po povečanem sprejemljivem vnosu hrane27,28,29. Nadaljnji dokazi za opioidno signalizacijo pri predelavi hedonske regulacije izvirajo iz antagonistov μOR, ki zmanjšujejo porabo okusne paprike pri obeh ad libitum- živali z omejeno prehrano in hrano, vendar bolj omejeno vplivajo na vnos standardnih peletov, ki jih ni mogoče opustiti30,31. Pri ljudeh antagonisti µOR zmanjšajo kratkotrajni vnos hrane in zmanjšajo prijetnost živil32,33,34. Opioidna signalizacija v bazolateralni amigdali prispeva tudi k temu, da hrana "želi" z modulacijo iskanja nagrade in spodbujevalne vrednosti hrane35.
Z [11C] karfentanil, dobili smo slike vezave sledilcev, ki so občutljive tako na raven μOR kot na sproščanje endogenih opioidov v možganih36,37. Odkrili smo takojšnjo izgubo razpoložljivosti μOR na območjih jedra jedra in sprednje cingulatske skorje, specifičnih možganskih območjih nagradne poti, po začetni porabi saharoze v petih minipirih, kar je skladno z sproščanjem endogenega opioida. Prejšnje študije so pokazale, da lahko prijetna hrana privede do občutkov užitka38 s spodbujanjem sproščanja opioidov. Po 12 dneh dostopa saharoze smo opazili zmanjšanje [11C] vezava karfentanila, ki ima več možnih razlag39 vključno z sprostitvijo endogenega opioida in vezavo na μOR, internalizacijo μOR kot rezultat povečanega vezave opioidov in povečano aktivacijo receptorja DA D2 / 3, kar vodi v heterologno desenzibilizacijo μOR40.
V podporo sedanjim ugotovitvam [11C] študije karfentanila pri bolnikih z bulimijo41, debelost42,43,44in motnje prehranjevanja45, kažejo zmanjšano razpoložljivost receptorjev. Vendar so to kronična stanja, medtem ko so minipigje 12 dni prejemale saharozo. V študiji akutnega prehranjevalnega vedenja pri zdravih moških je hranjenje privedlo do močnega in razširjenega endogenega možganskega opioidnega sproščanja, tako v prisotnosti kot tudi v odsotnosti hedonije, kar kaže, da sproščanje opioidov odraža presnovne in homeostatske, pa tudi hedonične odzive25. Ta študija je skupaj z drugo raziskavo, ki je bolnike slikala po tekočem obroku s čokolado44, je neposredno pomemben za akutno študijo petih minipigsi po prvi izpostavljenosti saharozi, vendar se razlikuje od študije subkronične izpostavljenosti saharozi v 12 dneh, kjer zmanjšana razpoložljivost receptorjev verjetno kaže na ponavljajočo se prekomerno stimulacijo in sočasno upadanje μOR.
Prefrontalna skorja je pomembna pri odločanju in pripisovanju vrednosti predmetom, zato je µOR v predfrontalni skorji lahko odgovoren za spremenjeno oceno pomnoženosti živil, kar lahko poveča zasvojenost s potencialom hrane. Ugotovili smo zmanjšano vezavo v predfrontalni skorji, skladno s prejšnjimi študijami, ki kažejo, da dieta z veliko maščobe zmanjša raven µOR mRNA v prefrontalni skorji46 in da infuzija µOR agonista v predfrontalni skorji poveča vnos sladke hrane47. Vendar se spet pojavlja vprašanje, ali je dieta z veliko maščob bolj kronično stanje, ki bolj verjetno posreduje znižanje receptorjev v primerjavi s kratkotrajno zasnovo hranjenja s saharozo, kar kaže na trajno sproščanje endogenih opioidov, ki izpodriva sledovalni karfentanil, vezan na μOR , tudi po 12 dneh saharoze.
DA je bila vpletena v nagrade tako zaradi drog kot zaradi vedenja. Ugotovljeno je bilo, da kronično uživanje kokaina zavira signalizacijo DA48. Ravni receptorjev DA D1 in D2 / 3 se v prašičjih možganih spremenijo nikotin49in pri primatih razen človeka z zgodovino zlorabe kokaina50skladno z znižanjem regulacije D2 / 3 receptorjev v možganih človeških odvisnikov od kokaina51,52. Kar zadeva zlorabo zdravil, je bilo dokazano, da saharoza ponižuje receptorje DA D119 in povečati sproščanje DA53, okrepitev vloge DA pri "želenju" v zvezi s okusno hrano. Prejšnje študije PET so pokazale zmanjšanje razpoložljivosti receptorjev DA D2 / 3 pri morbidni debelosti v primerjavi s povprečno težo54,55, podobno po obsegu kot pri bolnikih, odvisnih od drog56, in pri živalih z modeli debelosti57. V študijah na glodalcih spodbijanje receptorjev D2 / 3 v striatumu spodbuja razvoj kompulzivnega iskanja hrane pri podganah z dostopom do okusne hrane57.
Naša opažanja o zmanjšani razpoložljivosti D2 / 3 za prašiča lahko kažejo na povečano koncentracijo DA kot odziv na spodbujevalno značilnost, povezano z vnosom saharoze, saj se DA sprošča kot del želje po zlorabi drog in drugih prijetnih dejavnostih52,58,59,60. Ker so bili prašiči med slikanjem anestezirani in niso prejeli saharoze v 24 urah, je zmanjšan D2 / 3 BPND verjetneje odraža zmanjšanje števila receptorjev kot odziv na dolgotrajno povečanje sproščanja DA na vsak od 12 dni dostopa saharoze. Zmanjšanje lahko poveča pragove za nagrado možganov, povezane z znižanjem regulacije strijatalnih receptorjev DA D2. To lahko razloži povečano dovzetnost za zlorabe drog, opaženo v prejšnjih študijah podgan, ki so prenajedli saharozo, kar je privedlo do navzkrižne preobčutljivosti na kokain, hiperaktivnost po amfetaminu z majhnimi odmerki, povečan vnos alkohola pri vzdržanju saharoze in toleranco na analgetične učinke opiatov6.
Prejšnja študija debelosti v minifuzi v Göttingenu je ugotovila zmanjšan možganski pretok krvi v jedru jedra, ventralno tegmentalno območje (VTA) in prefrontalno skorjo z enotno fotonsko emisijsko računalniško tomografijo (SPECT) možganov61. Skladno s temi ugotovitvami smo opazili zmanjšano vezavo DA D2 / 3 v ventroforebrain regiji, ki vsebuje jedro jedra in v predfrontalni skorji. Zunajcelične ravni DA se po vnosu saharoze pri prosto gibajočih se podganah, ki so podvržene mikrobiolizi, povišajo 3-krat.62. Pri živalih, odvisnih od saharoze, lahko ponavljajoči vnos saharoze povzroči sproščanje DA iz lupine jedrnih jeder63. Živali, ki so se hranile z omejeno prehrano z omejenim dostopom saharoze, so imele nižjo vezavo receptorja DA2 v lupini jedra in dorzalni striatum64. Omejena dieta z veliko maščob in saharoze lahko privede do dolgotrajne regulacije mRNA receptorjev D1 in D2 v jedru65. Mikrodialna študija učinkov okusne hrane je razkrila povečano sproščanje DA v jedru jedra in prefrontalni skorji, ko se je živilo še vedno štelo za novo; ko so se podgane navadile na novo hrano, se je povečano sproščanje zataknilo v jedru jedra, ne pa v predfrontalni skorji66. Različna dovzetnost za habituacijo in kondicioniranje aktivnosti v dveh regijah lahko pojasni večji porast opažen v predfrontalni skorji kot v jedrih majhnih drobtin, ki so bili izpostavljeni isti okusni snovi, ki so po dvanajstih dneh izgubili novost. Ker pa minipigsov nismo slikali z [11C] rakloprid po prvem dajanju saharoze, ta razlaga je špekulativna.
Predfrontalna skorja modulira izvršilno funkcijo, odločanje in samokontrolo67. Nefunkcionalna nevrotransmisija DA v predfrontalni skorji poslabša modulacijo obdelave nagrad, kar kaže na oslabljeno izvršilno funkcijo in spretnosti odločanja pri debelih osebah68,69. Poleg tega je študija pri človeškem PET povezovala zmanjšan metabolizem čelne skorje in zmanjšano striatalno vezavo D2 pri debelosti70. Tu najdemo zmanjšano razpoložljivost receptorjev D2 / 3 v predfrontalni skorji, vključno z orbitofrontalno skorjo prašičev, ki so izpostavljeni režimu saharoze.
Dopaminergični nevroni VTA pošiljajo projekcije v hipokampus in amigdalo, kjer podpirajo navadno podobno vedenje71 in posredujejo kodiranje in pridobivanje kondicioniranja na drogo72,73 in hrano74,75. Slike človeških možganov so pokazale aktivacijo hipokampa kot odziv na hrepenenje in okušanje hrane76. Skladno z našimi ugotovitvami o zmanjšani razpoložljivosti receptorjev D2 / 3 za hipokamp in odgovor na saharozo, preslikavo človeških možganov z [18F] fallypride je pokazal sproščanje DA s kokainom v amigdali in hipokampusu77. V možganih glodavcev je izpostavljenost kokainu izvlekla DA v amigdali78Spremembe ravni amigdale DA so vplivale na vedenje, ki ga povzroča kokain79.
V študiji debelih posameznikov je bila v ventralnem striatumu prekinjena povezava med razpoložljivostmi D2 / 3 in µOR, za katere je znano, da obstajajo v strijatalnih regijah vitkih posameznikov.80. Primerjali smo vrednosti BPND dveh sledilcev, da se preveri, ali podatki kažejo ta učinek. Za razliko od vitkih ljudi sedanji možgani prašičev niso imeli korelacije med vrednostmi BPND dveh sledilcev, na začetku ali po izpostavitvi saharozi. Nato smo preizkusili, ali bi imele živali z največjim upadom vezave sledilnega rakloprida največja zmanjšanja vezave sledljivega karfentanila, vendar smo namesto tega ugotovili negativno korelacijo v povprečnih ekstrastriatalnih regijah, kar kaže na to, da živali z največjo spremembo vezivnega potenciala sledljivi rakloprid je imel najnižjo spremembo vezivnega potenciala sledljivega karfentanila. Obratna povezava med spremembami kaže, da so učinki vnosa saharoze na razpoložljivost ustreznih receptorjev urejeni v nasprotnih smereh. Znano je, da lahko prekomerno uživanje okusne hrane ali mamil povzroči željo ali všeč ali oboje60,81. Mogoče je, da obseg želje, ki ga poganja dopamin, izniči obseg všečnosti, ki ga poganjajo opioidi, ali obratno. Nedavni dokazi kažejo na vlogo GABAA receptorji v VTA in holinergični terminali v striatumu in morda korteksu, ki delujejo kot preklop med mehanizmi opioidnega delovanja, odvisnimi od dopamina in neodvisnih od dopamina.82,83 To lahko pojasni vzajemnost učinka dopamina in opioidov v prašičjih ekstrastriatalnih regijah, določenih tukaj.
Pomanjkljivost PET, tudi pri sorazmerno velikih živalih, je omejena prostorska ločljivost tomografije, ki vpliva na rezultate majhnih možganskih regij, vključenih v vedenja, povezana s hrano. Kljub temu pa [11C] vezavo rakloprida prej smo zabeležili tako v striatalnih kot zunajstrastnih regijah84,85,86,87. Uporaba [11C] rakloprid za označevanje iste vrste receptorjev ne vzbuja skrbi glede potencialnih afinitetnih razlik, ki lahko vplivajo na uporabo ločenih sledilcev za iste receptorje v različnih regijah. Nedavne študije so vključevale zapise o zunajsodni vezavi [11C] rakloprid. Alakurtti sod. ugotovili dobro obnovljivost ukrepov vezave strijnega rakloprida v striatumu, z dobro do zmerno obnovljivostjo možganske skorje85. V kasnejši študiji Svensson sod. obravnavali več vprašanj, ki vplivajo na uporabo [11C] rakloprid kot marker ekstrastriatalnih D2 / 3 receptorjev v študiji na zdravih ljudeh, vključno s slabo obnovljivostjo korteksa in omejenim upadom ekstrastriatalne vezave v čelni skorji kot odgovor na zaviralno sredstvo D2 / 388. Primerjave med testom in ponovnim testiranjem so pokazale spremenljivosti 4–7% v striatumu in 13–59% v kortikalnih regijah, toda čas med pregledi je bil v povprečju 20 dni, za razliko od bolj informativnih 1-2 dni v večini raziskav. Številni dejavniki v življenju teh oseb so morda imeli čas, da vplivajo na ugotovitve. Tukaj resnično pokažemo, da bi zgolj dodajanje uživanja saharoze v jutranjo rutino 12 dni vplivalo na zavezujoče ukrepe, pridobljene dva tedna kasneje. Drugi pogosti dejavniki, kot so igranje video iger, nakupovanje, sklepanje novih romantičnih odnosov in spolne aktivnosti, uživanje drog ali sprememba prehrane in telovadbe, lahko vplivajo na ekstrastriatalno raven dopamina, kar lahko povzroči veliko variacijo nabora podatkov. Sedanja študija na mini prašičih je uvedla dobro nadzorovano ureditev, edina spremenljivka pa je odsotnost ali prisotnost saharoze v prehrani. V tem okviru so imeli podatki sedmih živali dovolj majhne variabilnosti v ustreznih ekstrastriatalnih regijah, da so lahko ugotovili statistično pomembno zmanjšanje vezave kot odziv na saharozo.
Omejitev trenutne študije je uporaba anestetikov, potrebnih za zagotovitev nepremičnosti med vivo slikanje živali. Učinki specifičnih anestetikov in njihovo medsebojno delovanje z zdravili ali drugimi posegi lahko ovirajo vezavo radioligandov89,90. Ketamin je anti-glutamatergično zdravilo s hitrimi antidepresivi v subanestetičnih odmerkih91,92,93, ki ne zmanjšajo strij [11C] vezava rakloprida pri ljudeh94. Vendar je bilo ugotovljeno, da je S-ketamin zmanjšal zavezujočo razpoložljivost receptorjev dopamina D2 / 3 v striatumu zavestnih primatov razen človeka95. Izofluran je pogost anestetik pri živalih iz PET. V prejšnjih raziskavah smo ugotovili, da se striatalno kopičenje [11C] SCH23390, radioligand receptorjev dopamina D1, ki je bistveno višji pri minipaših, anesteziranih z izofluranom in ne s propofolom, kar kaže na občutljivost dopaminergičnega nevrotransmisije na učinke anestezije96. V trenutni študiji so vse minipigje v obeh časovnih točkah slikali pod predhodnim zdravljenjem s ketaminom in anestezijo izoflurana, zaradi česar so današnje primerjave veljavne.
zaključek
Prekomerno uživanje okusne hrane lahko povzroči in postane posledica zasvojenosti z neposrednimi posledicami za zdravje zaradi debelosti. Testirali smo trditev, da opioidi in dopamin posredujejo nagrade, pomembne za preživetje in zlorabo drog. Mini-prašiči z vmesnim dostopom do raztopine saharoze 12 zaporednih dni so pokazali zmanjšano razpoložljivost dopamina D2 / 3 in µ-opioidnih receptorjev v strijatalnih in ekstrastriatalnih regijah možganov, kar pomeni, da živila, ki vsebujejo saharozo, vplivajo na možgansko nagradnjo na načine, podobne tistim, ki jih opazimo pri zasvojenosti z drogami se zaužijejo. Začetna enkratna izpostavljenost saharozi je bila skladna s sproščanjem opioidov v možganskih regijah, ki so bile dejavno nagrajene. Spremembe razpoložljivosti opioidov in dopamina pojasnjujejo zasvojenost potenciala saharoze, ki se porabi v presežku.
Materiali in metode
Živalska etika
To študijo je odobril in uredil danski inšpektorat za poskuse na živalih in vsi poskusi so bili izvedeni v skladu z direktivo 2010/63 / EU Evropskega parlamenta in Sveta o zaščiti živali, ki se uporabljajo v znanstvene namene in smernicami ARRIVE. Uporabili smo sedem štirinajstmesečnih ženskih mini gork Göttingen (Ellegaard, Dalmose, Danska). Mini-prašiči so se hranili s prehrano na pelete (6 dL, 2-krat na dan, posebne prehrane, Aarhus, Danska) z vodo iz pipe ad libitum. Temperatura okolja je bila 20–22 ° C, relativna vlažnost 50–55%, zrak pa se je spreminjal osemkrat vsako uro.
Vmesno uživanje saharoze
Posneli smo sedem minipigsov s [11C] rakloprid in [11C] karfentanil v izhodiščni vrednosti in spet en dan po 12 zaporednih dneh izpostavljenosti saharozi. Izpostavljenost saharozi je bila enourni dostop saharoze (saharoza, Dansukker, Kopenhagen, Danska) v vodi (500 gramov saharoze v 2 litrih vode) dnevno v obdobju 12 dni. Zabeležili smo količino saharoze in vsi minipiki so vsak dan zaužili 2 litra. Posneli smo tudi pet istih minipigsov z [11C] karfentanil, 30 minut po prvem dostopu saharoze, da bi raziskali akutno sproščanje opioidov.
Mini prašiči so v povprečju pridobili 13.6% telesne teže od 25.4 kg (± 0.73 SEM) na začetku do 28.9 kg (± 0.69 SEM) po 12-dnevni izpostavljenosti saharozi, kar je bilo bistveno večje (testa z enim repom, p < 0.001) od povečanj, opaženih na vzorcu kontrolnih mini prašičev, pridobljenih v prejšnjih študijah, kjer so se teže v istem razvojnem obdobju v povprečju povečale le za 4.9%.
Možgansko slikanje PET
Prašiče smo čez noč postili s prostim dostopom do vode pred slikanjem. Mini-prašiče smo predhodno zdravili in anestezirali, kot je opisano prej97 in jih namestili v ležišče v napravi PET / CT (Siemens Biograph 64 Truepoint PET). Pred vsako pridobitvijo PET smo izvedli nizko odmerek CT za anatomsko opredelitev in atenuacijsko korekcijo podatkov o emisijah PET. Intravensko smo dajali [11C] rakloprid v izhodišču (360 ± 18 MBq, specifična aktivnost 77 ± 76 GBq / μmol, injicirana masa 0.12 ± 0.08 µg / kg) in po 12 dneh saharoze (374 ± 54 MBq, specifična aktivnost 127 ± 85 GBq / μmol, injicirana masa 0.06 ± 0.05 μg / kg) in [11C] karfentanil v izhodiščni vrednosti (377 ± 43 MBq, specifična aktivnost 311 ± 195 GBq / μmol, injicirana masa 0.03 ± 0.02 µg / kg) in po 12 dneh saharoze (337 ± 71 MBq, specifična aktivnost 177 ± 157 GBq / μmol, injicirana masa 0.06 ± 0.08 µg / kg) v ušesno veno v 10 ml fiziološke raztopine v prvi minuti 90-minutnega skeniranja. Podatke PET smo rekonstruirali s pomočjo TrueX 3D OSEM (3 iteracije, 21 podmnožic), matriko 256 × 256 × 109 in 2-mm Gaussov filter s pomočjo časovnega okvira 5 × 60, 3 × 300, 4 × 600 , 2 × 900 sekund (skupaj 14 sličic, 90 minut). Na začetku in po 12 dneh saharoze so bile mini-prašiči slikani z obema sledilcema, injiciranima vsaj 100 minut narazen, zaradi razpolovne dobe [11C] sledilniki PET. Po zaključku zadnjega seansa PET smo evtanazirali minipase pod globoko anestezijo z intravenskim predoziranjem pentobarbitala (100 mg / kg).
Kvantitativne analize in statistika
Izvedli smo korake predhodne obdelave z uporabo PMOD 3.7 (PMOD Technologies Ltd, Zürich, Švica). Za določitev parametrov stereotaktične transformacije iz časovno povprečenih PET slik smo uporabili predloge za ligande. Na ustrezne dinamične časovne vrste PET smo uporabili generirane matrike transformacije in izkrivljena polja. Ustvarili smo parametrične slike [11C] potencial vezave rakloprida (BP)ND) s pomočjo večlinearnega referenčnega tkiva Ichise in sodelavcev98. Izdelali smo masko možganov po meri, ki je izključila vermis, da bi sčasoma dosegel radioaktivnost možganskega tkiva na območju zanemarljive gostote receptorjev DA D2 / 3. Ustvarili smo parametrične slike [11C] karfentanil z uporabo implementacije Logan modela referenčnega tkiva99,100 s t * = 30 min. Študije [11C] vezava karfentanila v človeških možganih je okcipitalno skorjo uporabila kot referenčno območje36; vendar je bilo pri prašiču, glede na krivulje časovne aktivnosti, neskladna vezava v možganu kot v okcipitalni skorji, kar je skladno z ugotovitvami študije avtoradiografije na podganah.101. Zato smo v trenutni študiji izbrali možganček kot referenčno regijo.
Statistična analiza
Zemljevide smo podvrgli vox-analiza s statističnim neparametričnim preslikavanjem (SnPM v13.01, http://warwick.ac.uk/snpm) Orodje SPM, ki uporablja neparametrično teorijo permutacije za zagotavljanje okvira za statistični sklep, pristop, ki je dokazano, da dobro deluje na majhnih vzorcih zaradi stroge kontrole lažnih pozitivnih rezultatov14 in se uporablja, kot je opisano prej102. Strokovnjak za nevroanatomijo prašičev (DO) je primerjal nastale slike na mejni vrednosti 5% z visoko ločljivostnim atlasom minipig Göttingen103,104 za določanje in označevanje območij zmanjšanega DA D2 / 3 in μOR BPND od izhodiščne do stanja po saharozi. Nato smo opravili analizo območja interesa (ROI), da bi izvlekli BPND vrednosti specifičnih regij, za katere je bilo ugotovljeno, da so zanimive na podlagi analize SnPM, vključno s striatumom, jedrnimi jezmi, talamusom, amigdalo, cingulatno skorjo in predfrontalno skorjo. Dodatne statistike o analizi ROI niso bile izvedene, saj je bilo za te regije že ugotovljeno, da so z uporabo SnPM pomembne.
Reference
- 1.
Smyth, S. in Heron, A. Diabetes in debelost: epidemije dvojčkov. Nat Med 12, 75 – 80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Razširjenost in trendi debelosti pri odraslih v ZDA, 1999–2008. JAMA 303, 235 – 241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, Kalifornija sod. Dopamin za "hočeš" in opioidi za "všeč": primerjava debelih odraslih z in brez prenajedanja. Debelost (Silver Spring) 17, 1220 – 1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Debelost in prehransko okolje: prehranska gostota energije in stroški prehrane. Ameriška revija preventivne medicine 27, 154 – 162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. in Ahmed, SH Intenzivna sladkost presega nagrado kokaina. Plos eden 2, e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. in Guillem, K. In Nevroznanost v 21. stoletju (ur. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. in Gold, MS Nadaljnji razvoj na področju nevrobiologije hrane in odvisnosti: posodobitev stanja znanosti. Prehrana 28, 341 – 343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Užitki možganov (ur. Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Od hedonike okusa do motivacijskega zagona: osrednji mu-opioidni receptorji in obnašanje pri popivanju. Int J Neuropsihofarmakol 12, 995 – 1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Nagrada za hrano: možganski substrati želja in všečkov. Nevroznanost in biobehevioralni pregledi 201-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Mapiranje nevroreceptorjev pri delu: o opredelitvi in interpretaciji vezavnih potencialov po 20 letih napredka. Int Rev Neurobiol 63, 1 – 20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Živalski modeli prenajedanja sladkorja in maščob: povezava z odvisnostjo od hrane in povečano telesno težo. Metode Mol Biol 829, 351 – 365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. sod. Prefrontalna skorja v možganih mini pig v Gottingenu, določena z merili nevronske projekcije in citoarhitekture. Brain Res Bull 70, 322 – 336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Neparametrični preskusi permutacije za funkcionalno nevroslikovanje: primer s primeri. Hum Brain Mapp 151-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Dokazi o zasvojenosti s sladkorjem: vedenjski in nevrokemični učinki prekinitvenega, čezmernega vnosa sladkorja. Nevroznanost in biobehevioralni pregledi 32, 20 – 39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. sod. Sistem nagrajevanja s hrano: trenutne perspektive in prihodnje potrebe po raziskavah. Nutr Rev 73, 296 – 307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Samoupravljanje saharoze in aktivacija CNS pri podganah. Am J Physiol Regul Integral Comp Fiziol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA sod. Ločeni sklopi kodirajo hedonske in prehranske vrednosti sladkorja. Naravna nevroznanost 19, 465 – 470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. sod. Prevelik vnos sladkorja spremeni vezavo na dopaminske in mu-opioidne receptorje v možganih. Nevroport 123549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiatni receptor: avtoradiografska lokalizacija v možganih podgan. Proc Natl Acad Sci ZDA 733729-3733 (1976).
- 21.
Soderman, AR in Unterwald, EM Nagrada za kokain in hiperaktivnost pri podganah: mesta modulacije mu opioidnih receptorjev. Nevroznanost 154, 1506 – 1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ in Roberts, DC Beta-funaltreksamin vpliva na samoumevno uporabo kokaina pri podganah, ki se odzivajo na progresivno razmerje okrepitve. Farmakologija, biokemija in vedenje 75301-307 (2003).
- 23.
Schroeder, JA sod. Vloga za mu opioidne receptorje pri aktivnosti, ki jih povzroča kokain, preobčutljivost in nagrada pri podganah. Psihofarmakologija 195, 265 – 272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. in Kalivas, PW Kokain povzročena ponovna vzpostavitev zahteva endogeno stimulacijo mu-opioidnih receptorjev v ventralnem pallidumu. Časopis za nevroznanost: uradna revija Društva za nevroznanost 25, 4512 – 4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ sod. Hranjenje sprošča endogene opioide pri ljudeh. J Neurosci 37, 8284 – 8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS in Berridge, KC Opioidni limbični krog za nagrado: interakcija med hedonskimi žariščnimi točkami jedra accumbens in ventralnim pallidumom. J Neurosci 27, 1594 – 1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. in Berridge, KC Opioidno mesto v lupini nucleus accumbens posreduje prehranjevanje in hedonsko "naklonjenost" hrani: zemljevid na osnovi mikroinjekcijskih peresov Fos. Brain Res 86371-86 (2000).
- 28.
Zhang, M. in Kelley, AE Vnos raztopin saharina, soli in etanola se poveča z infundiranjem mu opioidnega agonista v nakopičeno jedro. Psihofarmakologija 159, 415 – 423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA in Kelley, AE Vnos hrane z visoko vsebnostjo maščob selektivno poveča stimulacija mu opioidnih receptorjev znotraj nucleus accumbens. Časopis za farmakologijo in eksperimentalne terapevtike 285908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxone blokira tisti del hranjenja, ki ga pri podganah z omejeno hrano vodi sladek okus. Am J Physiol 268, R248–252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioidi in vnos hrane: porazdeljene funkcionalne živčne poti? Neuropeptidi 33, 360 – 368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. in Apfelbaum, M. Opioidni antagonist, naltrekson, zmanjšuje naklonjenost saharozi pri ljudeh. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Vpliv naltreksona na prag zaznavanja in prepoznavanja okusa. Appetite 32, 241 – 249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. in Gosnell, BA Naloxone, zaviralec opiatov, zmanjšuje uživanje sladke hrane z visoko vsebnostjo maščob pri debelih in suhih uživalcih pretiranih žensk. Am J Clin Nutr 611206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Izrazita opioidna vezja določajo okusnost in zaželenost nagrajevanja dogodkov. Proc Natl Acad Sci ZDA 106, 12512 – 12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A sod. Endogeno sproščanje opioidov v sistemu nagrajevanja človeških možganov, ki ga povzroči akutno dajanje amfetamina. Biol Psychiatry 72, 371 – 377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, jaz. sod. Z amfetaminom sproščeno endogeno sproščanje opioidov v človeških možganih, zaznano s [11C] karfentanil PET: podvajanje v neodvisni skupini. Int J Neuropsihofarmakol, 1 – 6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Opioidni peptidi in nadzor človeškega zaužitja. Nevroznanost in biobehevioralni pregledi 26713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. in Tolle, TR Kaj se lahko učimo vivo opioidergično slikanje možganov? Eur J Bolečina 9, 117 – 121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Dopamin-opioidne interakcije v striatumu podgan: modulatorna vloga za receptorje dopamina D1 v transdukciji signala, ki jo posreduje delta opioidni receptor. Neurofarmakologija 39372-381 (2000).
- 41.
Bencherif, B. sod. Regionalna vezava mu-opioidnih receptorjev v otoški skorji se zmanjša pri bulimiji nervozi in je obratno povezana s vedenjem na tešče. Časopis nuklearne medicine: uradna publikacija, Society of Nuclear Medicine 461349-1351 (2005).
- 42.
Karlsson, HK sod. Debelost je povezana z zmanjšano razpoložljivostjo mu-opioidnih, vendar nespremenjenih dopaminskih D2 receptorjev v možganih. J Neurosci 35, 3959 – 3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK sod. Izguba teže po bariatrični operaciji normalizira možganske opioidne receptorje pri morbidni debelosti. Mol psihiatrija 21, 1057 – 1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogeni opioidni mehanizmi so vpleteni v debelost in hujšanje pri ljudeh. J Clin Endocrinol Metab 100, 3193 – 3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. sod. Nevrotransmisija dopamina in opioidov pri vedenjskih odvisnostih: primerjalna študija PET na področju patoloških iger na srečo in prehranjevanja. Neuropsychopharmacology 42, 1169 – 1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Kronična dieta z visoko vsebnostjo maščob poganja postnatalno epigenetsko regulacijo mu-opioidnega receptorja v možganih. Neuropsychopharmacology: uradna publikacija American College of Neuropsychopharmacology 36, 1199 – 1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. in Baldo, BA Indukcija hiperfagije in vnosa ogljikovih hidratov s stimulacijo mu-opioidnih receptorjev v omejenih predelih čelne skorje. Časopis za nevroznanost: uradna revija Društva za nevroznanost 31, 3249 – 3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Kronični kokain duši dopaminsko signalizacijo med zastrupitvijo s kokainom in neravnovesje signaliziranja receptorjev D1 in D2. Časopis za nevroznanost: uradna revija Društva za nevroznanost 33, 15827 – 15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P sod. Učinki akutnega nikotina na hemodinamiko in vezavo [11C] rakloprida na receptorje dopamina D2,3 v prašičjih možganih. NeuroImage 191127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Vpliv samo-dajanja kokaina na dopaminske receptorje D2 pri rezusih opicah. Synapse 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND sod. Znaki kokaina in dopamina v dorzalnem striatumu: mehanizem hrepenenja v odvisnosti od kokaina. Časopis za nevroznanost: uradna revija Društva za nevroznanost 26, 6583 – 6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF sod. Povečana zasedenost dopaminskih receptorjev v človeškem striatumu med hrepenenjem po kokainu. Neuropsychopharmacology 31, 2716 – 2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Oralna stimulacija saharoze poveča akumenski dopamin pri podganah. Am J Physiol Regul Integral Comp Fiziol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. in Telang, F. Vloga dopamina pri slikanju pri zlorabi drog in zasvojenosti. Neurofarmakologija 56(Supll 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ sod. Možganski dopamin in debelost. Lancet 357354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Podobnost med debelostjo in odvisnostjo od drog, ocenjeno z nevrofunkcionalnim slikanjem: pregled koncepta. Časopis za odvisne bolezni 23, 39 – 53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopaminski receptorji D2 pri odvisnosti podobni disfunkciji nagrajevanja in kompulzivnem prehranjevanju pri debelih podganah. Naravna nevroznanost 13, 635 – 641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC in Kringelbach, ML Afektivna nevroznanost užitka: nagrada za ljudi in živali. Psihofarmakologija 199, 457 – 480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC in Kringelbach, ML Sistemi užitkov v možganih. Nevron 86, 646 – 664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Napovedni nagradni signal dopaminskih nevronov. J Neurofiziol 80, 1 – 27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. in Malbert, CH Spremembe možganske aktivnosti po debelosti, ki jo povzroča prehrana. Debelost 19, 749 – 756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. in Norgren, R. Akumulira mehanizme dopamina pri vnosu saharoze. Brain Res 90476-84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Vsakodnevno popivanje sladkorja večkrat sprošča dopamin v lupini akumensa. Nevroznanost 134, 737 – 744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Ponavljajoči dostop do saharoze vpliva na gostoto receptorjev dopamina D2 v striatumu. Nevroport 131575-1578 (2002).
- 65.
Alsio, J. sod. Ekspresija gena receptorjev dopamina D1 se v jedru zmanjša pri dolgotrajni izpostavljenosti okusni hrani in se razlikuje glede na prehrano povzročen fenotip debelosti pri podganah. Nevroznanost 171, 779 – 787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. in Di Chiara, G. Diferencialni vpliv asociativnih in neasociativnih učnih mehanizmov na odzivnost prefrontalnega in akumbalnega prenosa dopamina na prehranske dražljaje pri podganah, hranjenih ad libitum. J Neurosci 17851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. in Baler, RD Neuravnotežena nevronska vezja v odvisnosti. Curr Opin Neurobiol 23, 639 – 648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. in Pignatti, R. Anorexia, bulimija in debelost: deljeni primanjkljaji odločanja pri Igre na srečo v Iowi (IGT). J Int Nevropsihol Soc 16, 711 – 715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. in Kennedy, JL Primanjkljaji odločanja in prenajedanje: model tveganja za debelost. Obes Res 12, 929 – 935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND sod. Strialni receptorji D2 z nizkim dopaminom so povezani s prefrontalnim metabolizmom pri debelih osebah: možni dejavniki, ki prispevajo. NeuroImage 42, 1537 – 1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Osrednje jedro amigdale sodeluje z dorsolateralnim striatumom, da uredi pridobivanje navad. J Neurosci 32, 1073 – 1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. sod. Aktiviranje spominskih vezij med hrepenenjem po kokainu. Proc Natl Acad Sci ZDA 9312040-12045 (1996).
- 73.
Childress, AR sod. Limbična aktivacija med hrepenenjem po kokainu, ki ga povzroča iztočnica. Am J Psychiatry 156, 11 – 18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV in Berridge, KC Kaj in kdaj "želeti"? Osredotočanje spodbujevalne izpostavljenosti na sladkor in spol na osnovi amigdale. Psihofarmakologija 221, 407 – 426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Nevrobiologija odvisnosti: analiza nevrocirkuitrije. Lancetova psihiatrija 3, 760 – 773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. in Murphy, C. Kortikalna aktivacija kot odgovor na čiste dražljaje okusa med fiziološkimi stanji lakote in sitosti. NeuroImage 44, 1008 – 1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotros, A. sod. Sproščanje dopamina, ki ga povzroča kokain, v amigdali in hipokampusu: študija fallyprida PET [(1) (8) F] z visoko ločljivostjo pri udeležencih, odvisnih od kokaina. Neuropsychopharmacology 38, 1780 – 1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. sod. Nadzor vedenja, ki išče kokain, s pomočjo dražljajev, povezanih z drogami, pri podganah: učinki na obnovo ugaslih operaterskih odzivnih in zunajceličnih ravni dopamina v amigdali in jedrih. Proc Natl Acad Sci ZDA 974321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dotamin D1 ali D2 receptorski antagonizem znotraj bazolateralne amigdale različno spreminja pridobivanje asociacij kokaina in cue, potrebnih za ponovno vzpostavitev iskanja kokaina, ki jo povzroča iztočnica. Nevroznanost 137, 699 – 706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. sod. Aberantno delovanje mezolimbičnega dopamina in opiata pri debelosti. NeuroImage 122, 80 – 86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Vedenjski dopaminski signali. Trendi Neurosci 30, 203 – 210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR in van der Kooy, D. Nevrobiologija motiviranja opiatov. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Uravnavanje nikotinskih in opioidnih receptorjev prenosa prek D-receptorja D2 preko striatnega dopamina. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. sod. S starostjo povezano znižanje razpoložljivosti receptorjev dopamina D2 / 3, merjeno z [C-11] raklopridom v nestrijalnih regijah človeških možganov: Primerjava štirih metod. NeuroImage 41, T133 – T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. sod. Dolgoročna testna ponovna preizkušnja zanesljivosti strijatalne in ekstrastriatalne vezave na receptorje dopamina D2 / 3: študija z [(11) C] raklopridom in visoko ločljivostjo PET. J Cereb krvnega tlaka Metab 35, 1199 – 1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. in Brooks, DJ Endogeno sproščanje dopamina po farmakoloških izzivih pri Parkinsonovi bolezni. Ann Neurol 53, 647 – 653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. sod. Kognitivni primanjkljaji in sproščanje striato-čelnega dopamina pri Parkinsonovi bolezni. Brain 131, 1294 – 1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE sod. Veljavnost in zanesljivost določitve ekstrastriatalnega [(11) C] raklopriida v živih človeških možganih. NeuroImage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. sod. Anestezija z izofluranom poveča zaviralne učinke kokaina in GBR12909 na prenašalce dopamina: Študije PET v kombinaciji z mikrodializo možganov opice. Brain Res 84985-96 (1999).
- 90.
Hassoun, W. sod. PET študija vezave [11C] rakloprida v striatumu budne mačke: učinki anestetikov in vloga možganskega krvnega pretoka. Evropska revija za nuklearno medicino in molekularno slikanje 30, 141 – 148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Vloga ketamina pri depresiji, odporni na zdravljenje: sistematični pregled. Curr Neuropharmacol 12, 444 – 461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM sod. Antidepresivi učinki ketamina pri bolnikih z depresijo. Biol Psychiatry 47351-354 (2000).
- 93.
Browne, CA in Lucki, I. Antidepresivni učinki ketamina: mehanizmi, na katerih temeljijo hitro delujoči novi antidepresivi. Sprednji farmakol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. sod. Ketamin pri človeku ne zmanjša vezave strijatalnih dopaminskih D2 receptorjev. Psihofarmakologija 164, 401 – 406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. in Tsukada, H. Zmanjšanje vezave dopaminskih receptorjev D2 / 3 v striatumu po enkratni uporabi esketamina, ne pa tudi R-ketamina: PET študij pri zavestnih opicah. Klinika za psihiatrijo Eur Arch Neurosci 267, 173 – 176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK sod. Učinki anestezije in vrst na vnos ali vezavo radioligandov vivo v mini barki Gottingen. BioMed raziskave mednarodno 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP sod. Vzdolžno monoaminergično slikanje PET kronične inhibicije proteasomov pri miniigrjih. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategije za izboljšanje ocene parametrov nevroreceptorjev z linearno regresijsko analizo. J Cereb krvnega tlaka Metab 22, 1271 – 1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. sod. Količinska porazdelitvena razmerja brez vzorčenja krvi iz grafične analize PET podatkov. J Cereb krvnega tlaka Metab 16, 834 – 840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kvantifikacija možganskih mu-opioidnih receptorjev s [11C] karfentanilom: metode referenčnega tkiva. Nucl Med Biol 30177-186 (2003).
- 101.
Panksepp, J. in Bishop, P. Avtoradiografska karta vezave (3H) diprenorfina v možganih podgan: učinki socialne interakcije. Brain Res Bull 7405-410 (1981).
- 102.
Landau, AM sod. Elektrokonvulzivna stimulacija različno vpliva na [(11) C] MDL100,907 vezavo na kortikalne in podkortikalne 5HT2A receptorje v prašičjih možganih. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Telencefalon Gottingenske minipig, citoarhitekture in anatomije površinske skorje. Struktura možganov Funct 222, 2093 – 2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Spletni histološki atlas gottingenskih minipig možganov. Heliyon 5, e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Priznanja
Študijo je financirala univerza Aarhus z „Dotacijo za razvoj projektov za ideje za AU“ za AML. Hvaležni smo za tehnično podporo osebja na PET centru Univerzitetne bolnišnice v Aarhusu in na Univerzitetni kmetiji Aarhus za pomoč pri zdravljenju živali. Zahvaljujemo se profesorju Mortenu Kringelbachu, profesorju Jørgenu Scheel-Krugerju in izrednemu profesorju Arnu Møllerju za pomoč pri začetku teh študij.
Izjave etike
Konkurenčni interesi
Avtorji ne razkrivajo nobenih konkurenčnih interesov.
Dodatne informacije
Opomba založnika Springer Nature ostaja nevtralna glede trditev o sodnih pristojnostih v objavljenih zemljevidih in institucionalnih povezavah.
Pravice in dovoljenja
open Access Ta članek je licenciran pod mednarodno licenco Creative Commons Attribution 4.0, ki dovoljuje uporabo, skupno rabo, prilagajanje, distribucijo in razmnoževanje v katerem koli mediju ali obliki, če izvirnim avtorjem in virom dodelite ustrezno dobropis, navedite povezavo do licence Creative Commons in navedite, ali so bile izvedene spremembe. Slike ali drugo gradivo v tem članku so vključene v licenco Creative Commons, razen če je v kreditni vrstici materiala drugače navedeno. Če gradivo ni vključeno v licenco Creative Commons v članku in če predvidena uporaba ne dovoljuje zakonskih predpisov ali presega dovoljeno uporabo, boste morali pridobiti dovoljenje neposredno od imetnika avtorskih pravic. Če si želite ogledati kopijo te licence, obiščite http://creativecommons.org/licenses/by/4.0/.