KOMMENTARER: Utmärkt granskning av nästan all relevant forskning om androgenreceptorer, dopamin och sexuell funktion. Fantastisk ritning av förhållandena mellan hypotalamus-belöningskretsen.
Horm Behav. 2008 maj; 53(5): 647-658.
Publicerad online 2008 februari 13. doi: 10.1016 / j.yhbeh.2008.01.010
Abstrakt
Ungdom är förknippad med ökningar i nöjesökande beteenden, som i sin tur formas av den pubertala aktiveringen av hypothalamo-hypofysen-gonadalaxeln. I djurmodeller med naturligt givande beteenden, som kön, bidrar testikelandrogener till utvecklingen och uttrycket av beteendet hos män. För att åstadkomma beteendemognad genomgår hjärnan betydande ombyggnad under tonåren, och många av förändringarna är också känsliga för androgener, och antagligen verkar genom androgenreceptorer (AR). Med tanke på den känsliga interaktionen mellan gonadala hormoner och hjärnans utveckling är det inte förvånande att störning av hormonnivåerna under denna känsliga period väsentligt förändrar beteenden hos ungdomar och vuxna. Hos manliga hamstrar krävs exponering för testosteron under tonåren för normalt uttryck av sexuellt beteende hos vuxna. Män som berövas androgener under puberteten uppvisar långvariga brister i parningen. Omvänt är androgener ensamma inte tillräckliga för att framkalla parning hos prepubertala män, även om hjärnans AR finns före puberteten. I detta sammanhang är vidsträckt användning av anabola androgena steroider (AAS) under tonåren ett betydande problem. AAS-missbruk har potential att förändra både tidpunkten och nivåerna av androgener hos tonåriga män. Hos hamstrar ökar ungdomens AAS-exponering aggression och orsakar varaktiga förändringar i neurotransmitter-system. Dessutom förstärker AAS själva, vilket visas genom självadministrering av testosteron och annan AAS. Emellertid tyder nyligen på att de förstärkande effekterna av androgener kanske inte kräver klassisk AR. Därför krävs ytterligare undersökning av interaktioner mellan androgener och givande beteenden i ungdomars hjärna för att bättre förstå AAS-missbruk.
Översikt
Ungdom väcker hjärnan till både nöje och risk. Hos mänskliga tonåringar är detta ofta i form av experiment med droger och sex. I USA är medianåldern för första samlag hos män 16.4 år, och 65% har haft samlag med 12th klass (Kaiser Family Foundation, 2005). På samma sätt har denna befolkning de högsta andelen olaglig narkotikamisbruk i USA. Enligt 2004 National Survey on Drug Use and Health, använde 38% av män i åldrarna 18 – 25 ett olagligt läkemedel under det senaste året (SAMHSA / OAS, 2005). Dessutom använde 31% av tonårspojkar droger eller alkohol under deras senaste sexuella möte (Kaiser Family Foundation, 2005). Dessutom är tonåren en avgörande tid i etiologin för vissa psykopatologier, såsom depression, ångest, ostört ätande och uppförandestörningar. Vi säger att pubertal utsöndring av gonadala hormoner, deras aktivering av steroidreceptorer i hjärnan och samspelet mellan hormon och erfarenhet av ungdomars hjärnutveckling bidrar till beteendeförändringar som ses under tonåren.
Vårt mål här är att granska bevisen för att gonadala androgener förmedlar ungdomens mognad och vuxnas prestanda för motiverade beteenden, liksom de givande egenskaperna hos dessa beteenden. Vi presenterar också bevis på att testosteron själv är givande, vilket sannolikt bidrar till mognadsförändringar i motiverade beteenden under tonåren, när testosteronnivåerna ökar. Fokus för detta dokument är på våra studier av nervkretsar som ligger bakom manligt sexuellt beteende, särskilt i den syriska hamsteren, med särskild tonvikt på interaktionen mellan testosteron och dopamin (DA). Vi föreslår att pubertala androgener har både kortvariga och långvariga effekter på belöningskretsar och motiverat beteende. Vi antar vidare att tillskott med exogena androgener i form av anabola androgena steroider (AAS) ökar den normala påverkan av pubertala androgener, vilket därmed påverkar ungdomars utveckling av hjärna och beteende.
Ungdom som en känslig period för hjärnutveckling
I slutändan är hjärnan både en utlösare och ett mål för androgenåtgärd under tonåren. Hos unga pojkar (<12 år) och unga hamstrar (<28 dagar) är cirkulerande androgener och gonadotropiner vid basala nivåer. Eftersom utsöndringen av luteiniserande hormon från den främre hypofysen ökar som svar på hypotalamiskt gonadotropinfrisättande hormon ökar cirkulerande testosteronkoncentrationer signifikant. Detta inträffar vid Tanner-steg II / III (14 år) hos pojkar och vid 28 dagars ålder hos hamstrar. När pojkar når Tanner-steg IV / V (ca 16 år) eller när hamstrar är 50–60 dagar, är endogent testosteron inom det vuxna manliga intervallet. Utsöndring av pubertetshormon sammanfaller med ungdomsperioden, som äger rum från ungefär 12 till 20 år hos människor. Pubertala hormoner verkar inte bara på perifera vävnader för att orsaka sekundära könsegenskaper som är de uppenbara tecknen på puberteten, men de verkar också centralt för att påverka både ombyggnaden av den tonåriga hjärnan och beteendemognad. Vidare leder de fysiologiska och neurologiska förändringarna som orsakas av pubertetshormoner till betydande förändringar i en individs upplevelse, vilket i sig kan på ett djupgående sätt förändra hjärnans utveckling. Den pubertala ökningen av könssteroidhormoner, som drivs av utvecklingsmässig mognad av den reproduktiva neuroendokrina axeln, formar i sin tur ungdoms beteendeutveckling via både direkta och indirekta influenser på nervsystemet.
Mänsklig tonår är nu erkänd som en viktig och dynamisk period av nervutveckling under vilken beteendekretsar ombyggs och förfinas. Även om hjärnan hos ett 5-årigt barn redan är 90% av sin vuxna storlek (Dekaban, 1978), är en betydande ombyggnad fortfarande att komma. Detta koncept tändes av forskning i både människor och djur som dokumenterade att många av de grundläggande utvecklingsprocesserna som inträffade under perinatal hjärnutveckling sammanfattas under tonåren. Dessa processer inkluderar neurogenes (Eckenhoff och Rakic, 1988; Han och Crews, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia och Guillamon, 2001; Rankin, Partlow, McCurdy, Giles och Fisher, 2003), programmerad celldöd (Nunez, Lauschke och Juraska, 2001; Nunez, Sodhi och Juraska, 2002), utarbetande och beskärning av dendritiska arboriseringar och synapser (Andersen, Rutstein, Benzo, Hostetter och Teicher, 1997; Huttenlocher och Dabholkar, 1997; Lenroot och Giedd, 2006; Sowell, Thompson, Leonard, Welcome, Kan och Toga, 2004), myelination (Benes, Turtle, Khan och Farol, 1994; Paus, Collins, Evans, Leonard, Pike och Zijdenbos, 2001; Sowell, Thompson, Tessner och Toga, 2001) och sexuell differentiering (Chung, De Vries och Swaab, 2002; Davis, Shryne och Gorski, 1996; Nunez et al., 2001). Således är utvecklingsbanan för den postnatala hjärnan inte linjär, utan kännetecknas istället av en tonårig bristning av snabb förändring och involverar både progressiva och regressiva händelser. Som alla utvecklingsbiologer vet, signalerar perioder med snabb utvecklingsförändring känslighet och sårbarhet för både erfarenhetsberoende förändring och negativa konsekvenser av störningar och förolämpning, och det finns ingen anledning att tro att människors ungdomars hjärnutveckling är något undantag (Andersen, 2003; Spjut, 2000). Således förutspås störningar i tidpunkten för påverkan av pubertalt hormon på ungdomars hjärna att ha långvariga konsekvenser för vuxnas beteende.
Androgener och nervkretsar för motiverat beteende
Eftersom tonåren är en kortvarig och dynamisk utvecklingsfas skulle det vara svårt att utvärdera ungdomars hjärna och beteende isolerat. I stället för att uppskatta tonårens unika karaktär är det bra att kontrastera det med hjärnan och beteendet hos mogna vuxna. Således, med fokus på denna artikel på manligt sexuellt beteende och belöning, är det här viktigt att införa neuralkretsar för kopulation och sexuell motivation hos vuxna män, inklusive rollen som gonadala steroidhormoner i beteendeaktivering och distribution av receptorer för androgener (AR) och östrogener (ER).
AR finns i cellgrupper som bildar nervkretsar som förmedlar givande sociala beteenden, till exempel kön. Dessutom uttrycks hjärnans AR före puberteten i hamstrar och uppregleras av androgener hos både unga och vuxna män (Kashon, Hayes, Shek och Sisk, 1995; Meek, Romeo, Novak och Sisk, 1997). I gnagarhjärnan finns det betydande överlappningar i fördelningen av AR och ER (Wood och Newman, 1995) och aromatas (Celotti, Negri-Cesi och Poletti, 1997), inklusive både a- och p-former av östrogenreceptorn (Shughrue, Lane och Merchenthaler, 1997). Efter bindning till ligand fungerar "klassisk" AR och ER som transkriptionsfaktorer för att inducera transkription och syntes av nya proteiner. Inte överraskande följer dessa effekter en relativt långsam tidsförlopp med en försenad insats. Steroidstimulering av sexuellt beteende hos manlig hamster (Noble och Alsum, 1975) överensstämmer med handlingar genom klassiska genomiska handlingar. Exempelvis krävs 2 veckor av steroidexponering för att återställa parning i långvariga kastrater. Nyare studier på råttor har också visat snabba cellulära effekter av androgener i hjärnregioner som har få klassiska receptorer (Mermelstein, Becker och Surmeier, 1996). Dessa steroidverkningar tros vara förmedlade av icke-genomiska receptorer. Medan distributionen av klassisk AR och ER i hamsterhjärnan är relativt begränsad (Wood och Swann, 1999), är de potentiella hjärnmålen för icke-genomisk androgenverkan mycket bredare.
Det mediala preoptiska området (MPOA) spelar en central roll i samverkan hos män från guldfisk till människor (granskad i Hull, Wood och McKenna, 2006). Dessutom överför hamster MPOA gonadala steroidhormoner via rikligt med AR och ER, och testosteronimplantat i MPOA är tillräckliga för att återställa sexuell aktivitet i långvariga kastrater (Wood och Swann, 1999). Hos hanråttor verkar gonadala steroider i MPOA för att reglera basal DA-frisättning (Putnam, Sato och Hull, 2003) och stimulera parning (Hull, Du, Lorrain och Matuszewich, 1995). Till en början är det en blygsam ökning av DA när en kvinna presenteras bakom en skärm. Under samarbetet ökar MPOA DA ytterligare (+ 50% av baslinjen), och denna effekt kräver androgener (Hull et al., 1995; Putnam et al., 2003). Inte förvånande, hos kastrerade män som inte parar sig, ökar inte MPOA DA (Hull et al., 1995). Det är något svårt att tolka detta resultat, eftersom bristen på frisläppande av DA förvirras av avsaknaden av sexuell aktivitet. DA-frisläppande i MPOA korrelerar emellertid med förlusten av parning i kortvariga kastraterHull et al., 1995) och med testosteroninducerad restaurering av sexuell aktivitet i långvariga kastrater (Du, Lorrain och Hull, 1998; Putnam, Du, Sato och Hull, 2001).
Inom gnagaren MPOA spelar de androgena och östrogena metaboliterna av testosteron specifika roller i regleringen av parning (Putnam et al., 2003; Putnam, Sato, Riolo och Hull, 2005). Latensen för att initiera kopulation (montering eller intromit) är ett mått på sexuell motivation. Latensen för sexuell aktivitet är känslig för östrogener genom upprätthållande av MPOA kväveoxidsyntas, som i sin tur upprätthåller basala DA-nivåer. Östrogenbehandlade kastrater visar höga basala DA-nivåer, som starkt korrelerar med förmågan att initiera kopulation. Men de misslyckas inte med att uppvisa ökningar av kvinnor och copulation i DA-frisläppande, vilket starkt korrelerar med sexuell prestanda. Följaktligen ligger deras sexuella prestanda under intakta nivåer. Å andra sidan visar kastrater behandlade med enbart icke-aromatiserbar androgen inte förhöjda basala DA-nivåer, och de misslyckas med att initiera kopulation. För normal sexuell prestanda krävs därför både östrogener och androgener. Sexuell prestanda uttrycks vanligtvis som frekvensmätningar för fästen, intromissioner och utlösningar. Först när både östrogener och androgener ersätts, uppvisar kastrerade män förhöjda DA-nivåer (och kortare latensåtgärder) och kvinnor- och kopulationsinducerade DA-ökar (och ökade frekvensmått). På detta sätt bidrar östrogener i MPOA till sexuell motivation och både östrogener och androgener till sexuell prestation.
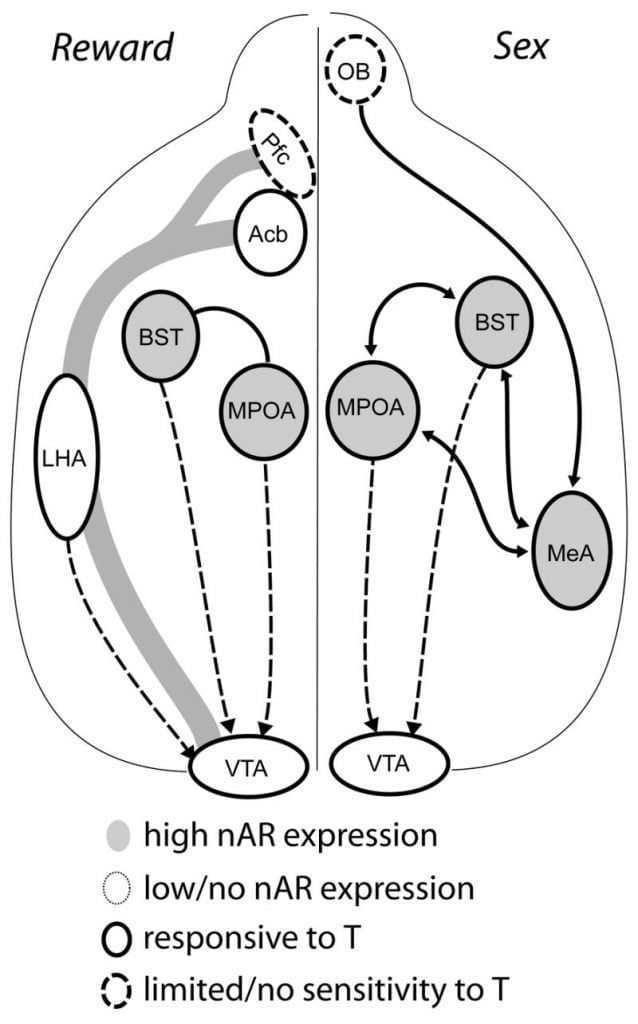
Även om testosteron är nödvändigt för MPOA-DA-frisläppande under manligt copulatoriskt beteende och för att para sig själv, kan varken testosteron eller parning ensam framkalla DA i MPOA. Istället krävs också kemosensoriska ledtrådar från specifika kvinnor för DA-frisättning i MPOA. I gnagare är kemosensoriska stimuli den primära sensoriska modaliteten för att initiera manligt sexuellt beteende (Fig 1). Kemosensoriska ledtrådar överförs från luktlamporna till MPOA via den mediala amygdaloidkärnan och bäddkärnan i stria terminalis, strukturer med rikligt med AR och ER (Wood och Swann, 1999). För att bestämma rollen för kemosensoriska ledtrådar i parningsinducerad DA, mätte vi MPOA DA under parning i gonad-intakta manliga hamstrar med ensidig olfaktorisk bulbektomi (UBx, Triemstra, Nagatani och Wood, 2005). Även om bilateral avlägsnande av luktlökarna eliminerar sexuell aktivitet och MPOA DA-frisläppande, stör inte ensidig bulbektomi med parningen. I denna studie inducerade kopulation MPOA DA-frisläppning när den mättes kontralateralt med den skadade luktkulan, men inte i den ipsilaterala halvklotet (Fig 2). Liknande resultat observerades hos hanråttor med lesioner i den mediala amygdala (Dominguez, Riolo, Xu och Hull, 2001). I en relaterad studie inducerade kemisk stimulering av den mediala amygdala hos råttor MPOA DA-frisättning motsvarande den under kopulation (Dominguez och Hull, 2001). Sammantaget tyder dessa data på att testosteron skapar en tillåtet miljö som tillåter externa sensoriska stimuli att nå MPOA och inducera DA-frisättning under kopulation.

Fig 2
I slutändan aktiverar sexuellt beteende och andra naturliga belöningar neurala belöningsvägar. Den mesocorticolimbic DA-kretsen består av det ventrale tegmentalområdet (VTA), nucleus accumbens (Acb) och prefrontal cortex (Pfc). Dopamincellkroppar bosatta i VTA-projektet rostralt till Acb och Pfc (Koob och Nestler, 1997). Hos råttor släpps DA till Acb under sex (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips och Fibiger, 1990). Många missbruksläkemedel verkar också i det mesolimbiska DA-systemet för att öka frisättningen av DA (amfetaminer) eller hämma återupptag av DA (kokain, Di Chiara och Imperato, 1988), vilket stärker deras beroendeframkallande egenskaper. På detta sätt har testosteron potential att påverka frisättningen av DA i Acb både genom att det förbättrar sexuellt beteende och genom dess åtgärder som missbruk av droger (se nedan).
Nuvarande bevis tyder på att det mesocorticolimbic DA-systemet mognar under tonåren. Acb DA-fiberdensiteter ökar dramatiskt under tonåren hos gerbils, vilket antyder att signifikant mognad av VTA-dopaminerga prognoser till Acb inträffar under tonåren (Lesting, Neddens och Teuchert-Noodt, 2005). Vidare berikas och dopamineras inmatning till GABA (y-aminobutyric acid) -ergiska celler i råttens mediala prefrontala cortex genom serotonergiska system under pubertalutveckling (Benes, Taylor och Cunningham, 2000), och manipulering av androgener hos vuxna råttor leder till förändringar i dopaminerg axon-densitet inom prefrontalbarken (Kritzer, 2003). Pfc, Acb och VTA har få AR eller ER, även om ERp är närvarande i VTA (Shughrue et al., 1997). Därför verkar det troligt att androgener påverkar det mesocorticolimbiska DA-systemet genom androgenkänsliga afferenter eller genom ERP i VTA som i hypothalamus (Handa et al., Denna fråga). Våra data visar att androgenkänsliga celler i manliga hamstrar projicerar till VTA från strukturer associerade med steroidkänsligt beteende. Till exempel innehåller både MPOA och bäddkärnan i stria terminalis (BST) ett stort antal AR-positiva celler som projicerar till VTA (Sato och trä, 2006). Ventral pallidum, det huvudsakliga Acb efferenta målet (Zahm och Heimer, 1990), innehåller också många AR-positiva celler som projicerar till VTA. Dessa prognoser ger androgener en möjlighet att modifiera aktiviteten i det mesocorticolimbic DA-systemet.
Steroidberoende organisation av beteende under tonåren
Den traditionella synen på hormonverkan på ungdomars beteende är baserad på aktiverande effekter av steroidhormoner, som hänvisar till steroidernas förmåga att underlätta beteende i specifika sociala sammanhang genom handling inom målceller i de neurala kretsarna som ligger bakom beteende. Aktiveringseffekter är övergående i den meningen att de kommer och går med närvaron och frånvaron av hormon, och de är vanligtvis förknippade med uttrycket av vuxens beteende. Däremot hänvisar organisatoriska effekter till steroidernas förmåga att skulptera nervsystemets struktur under utvecklingen. Strukturell organisation är permanent, kvarstår längre än exponeringen för hormon och bestämmer neurala och beteendespons på steroider i vuxen ålder. Vår förståelse av utvecklingsförhållandet mellan organisatoriska och aktiverande effekter av steroidhormoner har utvecklats under de senaste 50 åren. Phoenix och kollegor föreslog först att vuxnas beteendemässiga (aktiverande) svar på steroidhormoner programmeras (organiseras) av steroidhormoner under en maximalt känslig period av perinatal utveckling (Phoenix, Goy, Gerall och Young, 1959). Senare lägger Scott och kollegor det teoretiska grunden för förekomsten av flera känsliga perioder för den progressiva organisationen av nervsystemet och noterade att känsliga perioder troligen uppstår under perioder med snabb utvecklingsförändring (1974). Därefter påpekade Arnold och Breedlove att steroidberoende organisation av hjärnan kan inträffa utanför känsliga utvecklingsperioder (Arnold och Breedlove, 1985). Under de senaste 15-åren gör forskning med olika djurmodeller och beteendesystem tydligt att ungdomars hjärna är känslig för både aktiverande och organisatoriska effekter av gonadala steroider (granskad i Sisk och Zehr, 2005). Och som andra perioder med snabb utvecklingsförändring, representerar tonåren ett definierat fönster av möjligheter för steroidberoende hjärnombyggnad.
Vårt arbete med att använda hamster som en djurmodell ger bevis på att manliga sociala beteenden modifieras av steroider under tonåren (Schulz, Menard, Smith, Albers och Sisk, 2006; Schulz och Sisk, 2006). Före puberteten kan testosteronbehandling inte aktivera sexuellt beteende hos hamstrar, vilket antyder att mognadsprocesser som gör neuralkretsar mottagliga för aktivering eller organisation av steroidhormoner ännu inte har inträffat (Meek et al., 1997; Romeo, Richardson och Sisk, 2002a). Omvänt, även om det öppna uttrycket av manligt reproduktivt beteende i vuxen ålder inte absolut kräver närvaron av gonadala steroider under tonåren, gör det maximala uttrycket av beteende. Om man jämför maskulint reproduktionsbeteende hos män som kastrerats antingen prepubertalt (NoT@P) eller postpubertalt (T@P) och sedan behandlats med testosteron i vuxen ålder, har prepubertala NoT@P-kastrater minst 50 % underskott i maskulint beteende jämfört med män som kastrerats efter tonåren (Fig 3, Schulz, Richardson, Zehr, Osetek, Menard och Sisk, 2004). Dessutom är underskott i reproduktivt beteende långvariga och kan inte övervinnas varken genom långvarig testosteronbehandling eller genom sexuell erfarenhet i vuxen ålder (Schulz et al., 2004). På liknande sätt, efter behandling med östrogen och progesteron, uppvisar NoT@P-män kortare lordos latenser och längre lordosvaraktighet än män kastrerade som vuxna (Schulz et al., 2004), vilket tyder på att prepubertala kastrater är mindre defeminiserade än män som utsätts för pubertalt testosteron.

Fig 3
Det kan vara så att NoT@P-män lider av minskad sexuell motivation. Ett sätt att ta itu med denna fråga är att jämföra latenserna för att delta i både ano-genital undersökning (AGI) och montering mellan män som gonadektomerats före (NoT@P) och efter puberteten (T@P). Om sexuell motivation är beroende av exponering av gonadalhormon under tonåren, skulle vi förutsäga längre latenser för att engagera sig i sexuellt beteende hos NoT@P-män. Med upprepad exponering för brunstiga honor tar NoT@P-hanar längre tid att börja AGI och stiga jämfört med T@P-hanar (Fig 4). Således, förutom att organisera aspekter av sexuell prestation, verkar det som att pubertetshormoner också organiserar de givande aspekterna av sexuellt beteende. Till stöd för denna möjlighet återställer central administrering av DA-agonisten apomorfin i vuxen ålder stigande beteende hos NoT@P-män till vuxentypiska nivåer, vilket tyder på att testosteron under tonåren normalt organiserar dopaminerga neurala kretsar (Salas-Ramirez, Montalto och Sisk, 2006 ). Ändå återstår många intressanta frågor. Skulle en NoT@P hane barpress för en brunst hona eller utveckla en betingad platspreferens för en parningsplats? Framtida forskning kommer att utforska rollen av pubertetshormoner för att organisera sexuell motivation och sexuell prestation.

Fig 4
Anogenital undersökning (AGI) latenser och varaktigheter uppvisade av hanhamstrar gonadektomerade före puberteten (NoT@P) eller efter puberteten (T@P). Alla män var testosteron-primade i vuxen ålder 7 veckor efter gonadektomi och en vecka före det första beteendetestet. A. T@P-hanar visade liknande AGI-latenser i de tre testerna med en hona med brunst, medan NoT@P-hanar ökade AGI-latenserna under det tredje testet med en hona med brunst. B. T@P-hanar minskade monteringslatenser över de tre beteendetesterna med en brunsthona, medan noT@P-hanar inte visade någon förändring i monteringslatens över de tre beteendetesterna. Dessa data tyder på att könshormoner i puberteten har bestående, underlättande effekter på vuxna manliga motivation att engagera sig i sexuellt beteende med en kvinna. (Opublicerade data från djurförsök i Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA och Sisk, CL, 2004).
Prepubertal beteendespons på steroider
Ett av de varaktiga pussel för ungdomars beteendeutveckling är anledningen till att aktivering av reproduktivt beteende som svar på exponering för steroid dämpas i prepubertala manliga hamstrar. Om låga nivåer av androgener före puberteten begränsar uttrycket av manligt sexuellt beteende hos prepubertala män, bör komplettering av endogena androgener hos prepubertala män framkalla parning. Detta visar sig inte vara fallet (Meek et al., 1997; Romeo, Cook-Wiens, Richardson och Sisk, 2001; Romeo, Wagner, Jansen, Diedrich och Sisk, 2002b), trots att antalet och fördelningen av AR och ER genom parningskretsen är likartade i hormonbehandlade prepubertala och vuxna kastrater (Meek et al., 1997; Romeo, Diedrich och Sisk, 1999; Romeo et al., 2002a). Därför verkar det som androgener och AR är nödvändiga men inte tillräckliga för uttryck av manligt sexuellt beteende.
Hittills har man försökt att identifiera faktorer som begränsar sexuell aktivitet före puberteten. Fos-svar på kemosensoriska ledtrådar från estriska kvinnor är likartade i prepubertala och vuxna manliga hamstrar (Romeo, Parfitt, Richardson och Sisk, 1998). Dessa data visar att sensoriska transduktionsmekanismer är mogna före puberteten. Således kan unga män upptäcka kemosensoriska ledtrådar från kvinnor; där de skiljer sig från vuxna är hur de svarar på dessa signaler. En möjlig förklaring är att prepubertala män inte är motiverade att delta i sexuellt beteende. Vi har funnit att prepubertala manliga hamstrar inte uppvisar ökade dopaminergiska svar i MPOA som svar på kvinnliga feromoner, medan sexuellt naiva vuxna män uppvisar robusta MPOA-dopaminergiska svar på samma stimuli (Fig 5, Schulz, Richardson, Romeo, Morris, Lookingland och Sisk, 2003). På liknande sätt misslyckas prepubertala män med att visa den vuxen-typiska ökningen av cirkulerande testosteron efter exponering för kvinnliga feromoner (Parfitt, Thompson, Richardson, Romeo och Sisk, 1999). Således tycks feromoner av kvinnor vara en okonditionerad stimulans för neurokemiska och neuroendokrina svar hos vuxna, men inte prepubertala män, vilket tyder på att hälsotillståndet för dessa socialt relevanta sensoriska stimuli förändras över pubertal utveckling, eventuellt relaterat till förvärvet av givande egenskaper och sexuell motivation. Även om testosteron underlättar AGI hos en hona hos prepubertala män, beror denna effekt på huruvida hanen har haft tidigare exponering för en östlig kvinna. Kanske överraskande, testosteronbehandling minskar latensen och ökar varaktigheten av AGI endast hos sexuellt naiva prepubertala män (Fig 6). Dessutom visar prepubertala män som har haft en tidigare erfarenhet av en kvinnlig mycket längre AGI-latenser och kortare AGI-varaktigheter än män som interagerar med mottagliga kvinnor för första gången (Fig 6). Dessa data tyder på att interaktioner med en östlig kvinna är aversiva snarare än givande före puberteten, och därmed eliminerar alla underlättande effekter av testosteron på AGI vid efterföljande interaktioner med en kvinna. Det skulle vara intressant att veta om de negativa beteendekonsekvenserna av tidig exponering för en östlig kvinna kvarstår till tonåren och vuxen ålder, särskilt med tanke på att upprepad exponering för estriska kvinnor under tonåren underlättar i allmänhet uttrycket av manligt reproduktionsbeteende (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto och Sisk, 2007).

Fig 5
Prepubertala och vuxna manliga mediala preoptiska område (MPOA) dopaminerge svar på kvinnliga feromoner som ingår i vaginal sekret. Vuxna män visar ökningar i MPOA-dopaminergisk aktivitet med exponering för kvinnliga vaginala sekretioner, medan prepubertala män inte uppvisar ökade MPOA-dopaminergiska svar på kvinnliga feromoner. (Ritas om från Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Lookingland, KJ och Sisk, CL, 2003).

Även om prepubertal androgenbehandling inte kan framkalla kopulation, tyder det senaste arbetet från vårt laboratorium på att hamsternervesystemet är känsligt för testosteronens organiserande åtgärder på reproduktionsbeteende innan ungdomar (Schulz, Zehr, Salas-Ramirez och Sisk, 2007). Kastrering plus 19 dagar med exponering av testosteron före eller under men inte efter tonåren underlättade monteringsbeteendet när testosteron ersattes i vuxen ålder. Män som exponerats för testosteron på prepubertalt visade också fler intromissioner i vuxen ålder än män som utsatts för testosteron under eller efter puberteten (Schulz et al., 2007). Dessa data antyder att testosterons förmåga att organisera beteende neuralkretsar minskar med åldern och att tonåren markerar slutet på en utdragen postnatal känslig period för exponering för testosteron.
Farmakologiska androgener
De föregående uppgifterna antyder att endogena gonadala steroider ökar motiverade beteenden under tonåren. Vad händer nu om man själv administrerar androgener i nivåer upp till 100x normala fysiologiska koncentrationer? Detta är problemet med anabola androgena steroider (AAS) missbruk (granskad i Mäklare, 2002; Clark och Henderson, 2003). En kort digression är lämplig här: alla AAS är derivat av testosteron, alla AAS har ett kolskelett med 4 smälta ringar, de flesta har 19 kol. AAS används främst för deras anabola (muskelbyggande) effekter. Men som deras namn antyder har AAS också androgena egenskaper. Testosteron är ett logiskt val i djurstudier för att undersöka grundläggande mekanismer för androgenbelöning. Det är fortfarande ett populärt val för mänskliga användare också, oftast i form av långverkande testosteronestrar som testosteronpropionat. I 2006 var testosteron det enda vanligaste förbjudna ämnet som upptäcktes i urintester på WADA-ackrediterade laboratorier (WADA, 2006). Testosteron stod för den största fraktionen (34%) av AAS-positiva urintest vid 2000 OS i Sydney (Van Eenoo och Delbeke, 2003). På samma sätt testade 41% i urintest av AAS-användare positivt för testosteron (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). Vid höga doser ger AAS betydande beteendeförändringar. På grund av deras nära relation till testosteron verkar AAS-användning under tonåren verkar störa den normala steroidmiljön i det utvecklande mänskliga nervösa nervsystemet, inklusive mängden, tidpunkten och typen av steroidexponering.
Liksom med andra olagliga droger är mänskliga AAS-missbruk ett problem i tonåren. Enligt 1994 nationella hushållsundersökning om narkotikamissbruk (SAMHSA / OAS, 1996), steroidanvändningstoppar i sen tonåren vid 18 års ålder. I undersökningen Monitoring the Future (Johnston, O'Malley och Bachman, 2003), var livstidsfrekvensen av steroidanvändning bland gymnasieelever (2.7%) jämförbar med den för crackkokain (3.5%) eller heroin (1.4%). Steroidanvändning är också allt vanligare i yngre åldrar: 2.5% av eleverna i 8: a klass (13 – 14 år) har använt steroider, liknande förekomsten av spricka (2.5%) och heroinanvändning (1.6%). Denna trend mot AAS-användning i början av tonåren är särskilt oroande med tanke på oro 1) att ungdomar kan vara särskilt utsatta för missbruk av AAS, och 2) att ungdomars exponering för AAS på farmakologiska nivåer har potential att väsentligt förändra den normala mognaden hos hjärnan och beteende för att producera överdrivna morfologiska och beteende-svar, akut och kroniskt.
Olämplig aggression är det beteendemässiga svaret som oftast förknippas med mänskligt AAS-missbruk. I publicerade fallrapporter har steroidanvändning varit inblandat i flera våldsamma mord (Conacher och Workman, 1989; Påven och Katz, 1990; Påven, Kouri, Powell, Campbell och Katz, 1996; Schulte, Hall och Boyer, 1993). I undersökningar av aktuella AAS-användare var förhöjd aggression och irritabilitet de vanligaste biverkningarna av AAS-användning (Bond, Choi och påven, 1995; Galligani, Renck och Hansen, 1996; Midgley, Heather och Davies, 2001; Parrott, Choi och Davies, 1994; Perry, Kutscher, Lund, Yates, Holman och Demers, 2003). Med tanke på utbudet av androgenexponeringar, de olika psykiatriska symtomen och potentialen för befintlig psykiatrisk dysfunktion är det emellertid svårt att fastställa den exakta rollen för AAS i dessa fall av mänsklig aggression. Resultat från prospektiva studier av mänskliga frivilliga som fick injektioner av AAS har blandats: Tricker et al (1996) och O'Connor et al (2004) rapporterade inga ökningar i arg beteende medan andra studier har observerat ökad aggression (Daly, Su, Schmidt, Pickar, Murphy och Rubinow, 2001; Hannan, Friedl, Zold, Kettler och Plymate, 1991; Kouri, Lukas, påven och Oliva, 1995; Påven och Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz och Rubinow, 1993). Det är ändå viktigt att komma ihåg att doserna som administreras till mänskliga frivilliga är mycket lägre än de doser som förespråkas på kroppsbyggande webbplatser, och behandlingsvaraktigheten är i allmänhet kort. Således verkar det, i balans, vara rättvist att dra slutsatsen att AAS har potential att förbättra agonistiskt beteende, åtminstone hos mottagliga individer. Pope et al (1994) fann att AAS framkallar psykiatriska symtom hos utsatta individer.
Djurstudier har också gett tvingande bevis för AAS-inducerad aggression. Unga manliga hamstrar som behandlas kroniskt med högdossteroider har kortare attackstatenser och ett större antal attacker och bitar mot en manlig inkräktare jämfört med obehandlade män (Harrison, Connor, Nowak, Nash och Melloni, 2000; Melloni, Connor, Hang, Harrison och Ferris, 1997). På liknande sätt ger en mild provokation (svansen) en ihållande ökning av aggression hos tonåriga hanråttor, inklusive aggression mot kvinnor (Cunningham och McGinnis, 2006). Av ännu större oro orsakar exponering av ungdomar för AAS hos hamstrar varaktiga ökningar i agonistiskt beteende som kvarstår efter steroidanvändning upphör (Grimes och Melloni, 2006). Dessa beteendeförändringar åtföljs av varaktig ombyggnad av nervkretsar i den främre hypotalamus. I synnerhet ökar tonåringens AAS-exponering i hamstrar arginin vasopressin (AVP, Grimes och Melloni, 2006) och nedreglerar serotonin och de serotonergiska 5HT1A- och 5HT1B-receptorerna (Ricci, Rasakham, Grimes och Melloni, 2006). Det borde inte överraska att AAS också ändrar hjärnnivåerna av AR. Kronisk exponering för antingen testosteron eller nandrolon uppreglerar cellkärnan AR hos hanråttor (Menard och Harlan, 1993; Wesson och McGinnis, 2006). Således finns det potentialen för AAS att förbättra androgenberoende beteenden både genom att komplettera endogena androgener och genom att öka androgen responsivitet via ökat AR-uttryck.
Jämfört med agonistiskt beteende har AAS en mindre markant effekt på parningsbeteende hos manliga gnagare, och svaret beror på den speciella steroid som används (granskas i Clark och Henderson, 2003). Hos manliga hamstrar som konsumerar testosteron i orala lösningar ökade utlösningen på ett dosberoende sätt (Wood, 2002). Varken testosteron eller nandrolon förbättrade parningen hos tonåriga hanråttor. Stanozolol, en relativt mindre potent AAS med minimal androgen aktivitet, hämmade faktiskt både parning och aggression (Farrell och McGinnis, 2003), förmodligen genom att minska endogena androgennivåer.
Det är särskilt viktigt att notera att tonåringar och vuxna hamstrar kan visa olika beteendemässiga svar på AAS-exponering. Medan AAS markant ökade agonistiskt beteende hos unga män, gav samma behandling i vuxen ålder endast en blygsam ökning av aggressivt beteende och minskade avsevärt sexuellt beteende (Salas-Ramirez, Montaldo och Sisk, 2008). Detta överensstämmer med begreppet ungdomar som en känslig period för androgenhandling. Vidare, precis som vuxna manliga hamstrar får tolerans mot exogent testosteron (Peters och Wood, 2005) tror vi att utvecklande män får tolerans mot testosteron när de mognar. Således kan effekterna av AAS förändras i tonårens utveckling och ungdomars AAS-exponering kan orsaka alltför aggressiva och sexuella beteendemönster som kan fortsätta till vuxen ålder.
Förstärkande effekter av androgener
Parning och slåss är vardera givande (åtminstone om du vinner kampen). Hanråttor kommer att trycka på en spak upprepade gånger för att hantera en tik (Everitt och Stacey, 1987). På liknande sätt kommer hanmöss och kvinnliga hamstrar att bilda en betingad platspreferens (CPP) för platser där de tidigare har vunnit slagsmål (Martinez, Guillen-Salazar, Salvador och Simon, 1995; Meisel och Joppa, 1994). Om AAS kan förbättra givande sociala beteenden över nivåer som normalt observeras hos gonad-intakta män, är det logiskt att förvänta sig att testosteron själv kan vara givande. Detta har testats med hjälp av två väletablerade djurmodeller för belöning och förstärkning: CPP och självadministrering. Resultaten av dessa studier visar att testosteron förstärks i ett experimentellt sammanhang där anabola effekter och atletiska prestationer är irrelevanta. Med CPP kopplas testämnet upprepade gånger med en unik miljö (till exempel en viss kammare i testapparaten). När djuret associerar det förstärkande testämnet med den miljön kommer han att söka miljön även i frånvaro av belöning. De första rapporterna om androgenbelöning hos laboratoriedjur använde systemiska injektioner av testosteron för att inducera CPP hos hanmöss (Arnedo, Salvador, Martinez-Sanchis och Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis och Pellicer, 2002) och råttor (Alexander, Packard och Hines, 1994; de Beun, Jansen, Slangen och Van de Poll, 1992). Därefter använde vårt laboratorium självadministrering av testosteron för att demonstrera androgenförstärkning (Johnson och Wood, 2001). Vi fann att manliga hamstrar frivilligt konsumerar orala lösningar av testosteron med både 2-flaskvalstest och matinducerad dricka. I senare studier visade vi iv-självadministrering hos hanråttor och hamstrar (Wood, Johnson, Chu, Schad och Self, 2004). Intravenös tillförsel eliminerar potentiella förvirrande effekter av smak eller tarmfyllning på androgenintaget.
I samband med AAS-missbruk är det viktigt att skilja mellan centrala och perifera effekter av androgener. Eftersom testosteron har utbredda effekter i kroppen kan det hävdas att belöning och förstärkning med systemiska testosteroninjektioner är sekundärt till testosterons systemiska anabola och androgena åtgärder. Med andra ord, kanske testosteron minskar muskeltrötthet och förbättrar ledfunktionen så att djur bara känna bättre. Faktum är att denna förklaring har använts i den kliniska litteraturen (om än utan experimentella bevis) för att argumentera mot potentialen för beroende och beroende av AAS (DiPasquale, 1998). Packard et al (Packard, Cornell och Alexander, 1997) visade att injektioner av testosteron direkt i råttahjärnan kan inducera CPP. På samma sätt har vårt laboratorium visat intracerebroventrikulär (icv) testosteron självadministrering i manliga hamstrar (Wood et al., 2004). Intracerebral CPP och icv självadministrering med testosteron argumenterar för centrala mål som medierar androgenförstärkning.
Det är anmärkningsvärt att testosteronförstärkning inte nödvändigtvis följer samma mekanismer som tidigare upprättats för steroideffekter på sexuellt beteende. Som diskuterats tidigare är MPOA en nyckelplats för organisering av sexuellt beteende från gnagare hos män (Hull, Meisel och Sachs, 2002). I hamstrar har MPOA rikligt med steroidreceptorer, och testosteronimplantat i MPOA återställer sexuell aktivitet i långvariga kastrater (Wood och Swann, 1999). Tidsförloppet för dessa steroideffekter är långsam: monteringsbeteendet kvarstår i veckor efter orkidektomi, och utökad steroideksponering är nödvändig för att återställa parning i långvariga kastrater (Noble och Alsum, 1975). Injektioner av testosteron i MPOA hos hanråttor misslyckas emellertid inte med CPP (King, Packard och Alexander, 1999). Detta antyder att andra hjärnregioner är viktiga för androgenförstärkning.
Däremot kommer hanråttor att bilda en CPP för testosteroninjektioner i Acb (Packard et al., 1997). Liksom med andra missbruksläkemedel är DA troligtvis en viktig neurotransmitter för testosteronförstärkning: CPP inducerad av systemisk testosteroninjektion blockeras av D1 och D2 dopaminreceptorantagonister (Schroeder och Packard, 2000). Till skillnad från andra missbruksläkemedel tyder dock våra studier på hamstrar på att testosteron inte inducerar Acb DA-frisläppande (Triemstra, Sato och Wood, i pressen). På samma sätt visar studier av hanråttor att androgener inte har någon effekt på basala DA-nivåer eller amfetamin-stimulerad DA-frisättning (Birgner, Kindlundh-Hogberg, Nyberg och Bergström, 2006; men se också Clark, Lindenfeld och Gibbons, 1996). Vidare utövar testosteron ett relativt litet inflytande på Acb DA-vävnadsnivåer (Thiblin, Finn, Ross och Stenfors, 1999). Tillsammans tyder dessa data på att även om testosteronförstärkning i slutändan kan förändra DA-aktivitet i Acb, kan mekanismerna skilja sig från de från kokain eller andra stimulanter. I detta avseende tyder nyligen på att kronisk exponering för AAS kan förändra känsligheten för DA genom att förändra DA-metabolism (Kurling, Kankaanpaa, Ellermaa, Karila och Seppala, 2005), nivåer av DA-receptorer (Kindlundh, Lindblom, Bergström, Wikberg och Nyberg, 2001; Kindlundh, Lindblom och Nyberg, 2003) eller DA-transportören (Kindlundh, Bergström, Monazzam, Hallberg, Blomqvist, Langström och Nyberg, 2002).
För närvarande är de specifika steroidsignalerna, receptorerna och hjärnans verkningsställen för förstärkning av testosteron okända. Baserat på en nyligen genomförd studie av hamstrar från vårt laboratorium verkar de förstärkande effekterna av testosteron medieras av både androgener och östrogener (DiMeo och trä, 2006). Vanligt misshandlade AAS inkluderar både aromatiserbara och icke-aromatiserbara androgener (Gallaway, 1997; WADA, 2006). Detta innebär att både AR och ER kan transducera steroida stimuli för belöning. Det finns en ytterligare möjlighet att testosteronförstärkning kan förmedlas av en kombination av klassiska och icke-genomiska receptorer.
Flera bevis visar att icke-genomiska receptorer verkar i AAS-förstärkande effekter. Förutom den glesa fördelningen av AR i Acb och VTA är tidsförloppet för androgenförstärkning snabb (<30 min), och signalbehandling genom klassisk AR kanske inte är tillräckligt snabb för förstärkning. För att testa rollen som icke-genomisk AR i AAS-förstärkning använde vi därför två kompletterande tekniker (Fig 7). I ett experiment (Sato, Johansen, Jordanien och Wood, 2006), tillät vi råttor med testikel-feminiseringsmutationen (Tfm, se denna fråga) för att själv administrera dihydrotestosteron (DHT), en icke-aromatiserbar androgen. Tfm-mutationen minskar kraftigt ligandbindningen vid AR. Trots detta administrerade Tfm-råttor och deras manliga syskon av vildtyp ungefär samma mängd DHT. Detta argumenterar för icke-genomiska effekter av DHT. I en efterföljande studie bestämde vi om manliga hamstrar skulle själv administrera DHT konjugerat till bovint serumalbumin (BSA, Fig 8, Sato och trä, 2007). DHT-BSA-konjugat är membranogenomträngliga; följaktligen är deras effekter begränsade till cellytan. Hamsters självadministrerade DHT, som tidigare visats (DiMeo och trä, 2006). De visade en liknande preferens för DHT-BSA-konjugat, men misslyckades med att själv administrera BSA ensam.
Dessa data pekar mot en central roll för cellytans AR i androgenförstärkning. För närvarande är den exakta naturen hos sådana receptorer inte känd. Det har föreslagits att androgener kan verka vid cellytan genom bindning till dedicerat membran AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff och Doughty, 2006, se också denna fråga). Detta kan vara i form av extra-nukleär klassisk AR som rapporterats i hippocampus (Sarkey et al., I detta nummer). Alternativt har tidigare studier också beskrivit steroidbindande platser på andra neurotransmitter-system. Specifikt kan olika steroidhormoner inklusive AAS allosteriskt modulera GABA-A-receptorn (Henderson, 2007; Lambert, Belelli, Peden, Vardy och Peters, 2003). Likaså kan sulfaterade neurosteroider modifiera aktiviteten hos N-metyl-D-aspartatreceptorsubtyper (Malayev, Gibbs och Farb, 2002) receptorer. Detta är ett viktigt område för framtida forskning.
Varför ska det finnas ett membran AR? Som diskuterats tidigare finns det en nära koppling mellan androgen utsöndring och givande sociala beteenden. Vi kan spekulera i att ökningen av testosteronsekretion som följer parning eller slåss tjänar till att stärka beteendet. I så fall är det nödvändigt att ha en snabb koppling av stimulans (beteende) och belöning (testosteron). Detta kan bäst uppnås genom bindning till membran AR. I detta avseende vore det av intresse att avgöra om klämma androgenutsöndring under parning minskar de givande effekterna av sexuellt beteende.
Sammanfattning
Här granskar vi bevisen för att androgener är potenta medlar för vuxna motiverade beteenden, och vidare, att tidpunkten för androgen exponering under utvecklingsprogram androgenberoende motiverat beteende i vuxen ålder. Anabola steroider blir snabbt ett gynnat missbruk av ungdomar i USA. Även om AAS kanske inte har den beroendeframkallande styrkan av kokain eller heroin, börjar vi precis förstå potentialen för androgenförstärkning och beroende. När ungdomsidrott blir mer konkurrenskraftigt ökar trycket på att utveckla idrottare att använda steroider från och med yngre åldrar. Denna trend är oroande med tanke på nya bevis för steroidkänslig neural mognad hos ungdomar.
Trots ökad medvetenhet från både allmänheten och vetenskapliga samhällen om de djupa neurala förändringarna som följer med tonåren har experimentell studie av pubertets utvecklingsneurobiologi varit begränsad. Djurmodeller för ungdomars utveckling behövs för att undersöka hur tidpunkten för hormonexponering under utvecklingen ökar en individs risk för psykopatologi och läkemedelsanvändning, och vilka typer av upplevelser som mildrar eller förstärker beteendevirkningarna av avvikelser i pubertal timing. Exempelvis förvärrar sociala faktorer som gruppinflytande effekterna av pubertal timing för ämnes- och alkoholanvändning (Biehl, Natsuaki och Ge, 2007; Patton, Novy, Lee och Hickok, 2004; Simons-Morton och Haynie, 2003; Wichström och Pedersen, 2001). Djurmodeller för pubertal timing kommer också att informera mänskliga forskningsinsatser och potentiellt leda till effektivare terapeutiska ingrepp under tonåren.
Erkännanden
Vi tackar Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers och Pamela Montalto för hjälp med dessa studier. Detta arbete stöds av bidrag från NIH (DA12843 till RIW, MH68764 till CLS och MH070125 till KMS).
fotnoter
Ansvarsfriskrivning för förlag: Detta är en PDF-fil av ett oediterat manuskript som har godkänts för publicering. Som en tjänst till våra kunder tillhandahåller vi denna tidiga version av manuskriptet. Manuskriptet kommer att genomgå copyediting, uppsättning och granskning av det resulterande beviset innan det publiceras i sin slutliga formulär. Observera att under tillverkningsprocessen kan det upptäckas fel som kan påverka innehållet och alla juridiska ansvarsfrister som gäller för tidskriften avser.
Referensprojekt
- Alexander GM, Packard MG, Hines M. Testosteron har givande affektiva egenskaper hos hanråttor: konsekvenser för den biologiska grunden för sexuell motivation. Beteende neurovetenskap. 1994;108: 424-8. [PubMed]
- Andersen SL. Banor av hjärnans utveckling: Sårbarhetspunkt eller möjlighetsfönster? Neurovetenskap och biobeteende recensioner. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Könsskillnader i överproduktion och eliminering av dopaminreceptor. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Belöningsegenskaper hos testosteron i intakta hanmöss: en pilotstudie. Farmakologi, biokemi och beteende. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Liknande givande effekter av testosteron hos möss bedömda som korta och långa angreppslatensindivider. Addiction Biology. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Organisatoriska och aktiverande effekter av sexsteroider på hjärnan och beteende: en reanalys. Hormoner & beteende. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Konvergens och plasticitet av monoaminerga system i medial prefrontal cortex under postnataltiden: konsekvenser för utvecklingen av psykopatologi. Hjärnbarken. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Myelinering av en nyckelreläzon i hippocampalbildningen sker i människans hjärna under barndom, ungdom och vuxen ålder. Arkiv för allmän psykiatri. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Påverkan av pubertal timing på alkoholanvändning och tunga dricksbanor. Journal of Youth and Adolescence. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergström L. Neuroscience Letters. 2006. Förändrade extracellulära nivåer av DOPAC och HVA i råttkärnans accumbens skal som svar på sub-kronisk nandrolonadministration och en efterföljande amfetaminutmaning.
- Bond AJ, Choi PY, Pope HG., Jr Bedömning av uppmärksam bias och humör hos användare och icke-användare av anabola androgena steroider. Drog- och alkoholberoende. 1995;37: 241-5. [PubMed]
- Mäklare KJ. Anabola steroider missbruk och beroende. Aktuella psykiatrirapporter. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Klinisk bedömning och urintestning för missbruk och beroende av anabola androgena steroider. American Journal of Drug & Alcohol Abuse. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Steroidmetabolism i däggdjurshjärnan: 5alpha-reduktion och aromatisering. Hjärnforskningsbulletin. 1997;44: 365-75. [PubMed]
- Chung WC, De Vries GJ, Swaab DF. Sexuell differentiering av bäddkärnan i stria terminalis hos människor kan sträcka sig till vuxen ålder. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Beteende och fysiologiska svar på anabola androgena steroider. Neurovetenskap och biobeteende recensioner. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Anabola androgena steroider och hjärnbelöning. Farmakologi, biokemi och beteende. 1996;53: 741-5.
- Conacher GN, Workman DG. Våldsbrott som eventuellt är förknippat med anabola steroider. American Journal of Psychiatry. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Fysisk provokation av pubertala anabola androgena steroider exponerade hanråttor framkallar aggression mot kvinnor. Hormoner & beteende. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Cerebrospinalvätska och beteendeförändringar efter metyltestosteronadministration: preliminära resultat. Arkiv för allmän psykiatri. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Strukturella sexuella dimorfismer i den anteroventrala periventrikulära kärnan hos råtthypothalamus är känsliga för gonadala steroider perinatalt, men utvecklas peripubertalt. Neuroendokrinologi. 1996;63: 142-8. [PubMed]
- de Beun R, Jansen E, Slangen JL, Van de Poll NE. Testosteron som aptitretande och diskriminerande stimulans hos råttor: köns- och dosberoende effekter. Fysiologi och beteende. 1992;52: 629-34. [PubMed]
- Dekaban AS. Förändringar i hjärnvikter under mänskligt liv: relation mellan hjärnvikter och kroppsvikt och kroppsvikt. Annals of Neurology. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Läkemedel som missbrukas av människor ökar synaptiska dopaminkoncentrationer i mesolimbic-systemet med fritt rörliga råttor. Förhandlingar vid National Academy of Sciences i USA. 1988;85: 5274-8. [PMC gratis artikel] [PubMed]
- DiMeo AN, Wood RI. Självadministrering av östrogen och dihydrotestosteron i manliga hamstrar. Hormoner & beteende. 2006;49: 519-26. [PubMed]
- DiPasquale M. Anabola steroider. I: Tarter RE, Ammerman RT, Ott PJ, redaktörer. Handbok för missbruk av ämnen. Plenum Press; NY: 1998. sid. 547 – 565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Reglering genom medial amygdala för kopulation och medial preoptisk dopaminfrisättning. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Stimulering av den mediala amygdala förbättrar medial preoptisk dopaminfrisättning: implikationer för sexuellt beteende hos råttor hos män. Brain Research. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastrering minskar extracellulär, men ökar den intracellulära dopaminen i medialt preoptiskt område hos hanråttor. Brain Research. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Natur och öde för proliferativa celler i hippocampal dentatgyrus under rhesusapens livslängd. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Studier av instrumentalt beteende med sexuell förstärkning hos hanrotter (Rattus norvegicus): II. Effekter av preoptiska arealskador, kastration och testosteron. Journal of Comparative Psychology. 1987;101: 407-19. [PubMed]
- Gallaway S. Steroidbibeln. Belle International Press; Sacramento, Kalifornien: 1997.
- Galligani N, Renck A, Hansen S. Personlighetsprofil hos män som använder anabola androgena steroider. Hormoner & beteende. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Långvariga förändringar i nervsystemet serotonin efter upphörandet av ungdomars anabola-androgena steroidexponering i hamstrar (Mesocricetus auratus) Beteende neurovetenskap. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Psykologiska och serumförändringar av homovanillinsyra hos män som administreras androgena steroider. Psychon. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr Kronisk anabolisk-androgen steroidbehandling under tonåren ökar främre hypotalamisk vasopressin och aggression i intakta hamstrar. Psychon. 2000;25: 317-38. [PubMed]
- Han J, Crews FT. Neurogenes minskar under hjärnmognad från ungdom till vuxen ålder. Farmakologi, biokemi och beteende. 2007;86: 327-33.
- Henderson LP. Steroidmodulering av GABAA-receptormedierad transmission i hypotalamus: effekter på reproduktionsfunktionen. Neuro. 2007;52: 1439-53. [PMC gratis artikel] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Extracellulär dopamin i det mediala preoptiska området: implikationer för sexuell motivation och hormonell kontroll av copulation. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Manligt sexuellt beteende. I: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, redaktörer. Hormoner, hjärna och beteende. Academic Press; New York: 2002. sid. 3 – 137.
- Hull EM, Wood RI, McKenna KE. Neurobiologi för manligt sexuellt beteende. I: Neill JD, redaktör. Reproduktionsfysiologi. Vol. 1. Elsevier Press; New York: 2006. sid. 1729 – 1824.
- Huttenlocher PR, Dabholkar AS. Regionala skillnader i synaptogenes i human cerebral cortex. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Oral testosteron självadministrering i manliga hamstrar. Neuroendokrinologi. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Gymnasieelever (NIH-publikation nr. 03 – 5375) I. Bethesda, MD: National Institute on Drug Abuse; 2003. Övervakning av framtida nationella undersökningsresultat om narkotikamissbruk, 1975 – 2002.
- Kaiser Family Foundation. USA: s sexuella aktivitet. 2005. sid. # 3040 – 02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Reglering av immunoreaktivitet hos hjärnan androgenreceptor genom androgen i prepubertala manliga illrar. Reproduktionsbiologi. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dopaminergiska effekter efter kronisk behandling med nandrolon visualiserad i råttahjärna genom positronemissionstomografi. Framsteg inom neuropsychopharmacology & biologisk psykiatri. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. Det anabola androgena steroid nandrolondekanoatet påverkar tätheten av dopaminreceptorer i den manliga råttahjärnan. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Kronisk administration med nandrolondekanoat inducerar förändringar i gen-transkriptionsinnehållet i dopamin D (1) - och D (2) -receptorer i råttahjärnan. Brain Research. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Affektiva egenskaper hos intra-mediala preoptiska injektioner av testosteron hos hanråttor. Neuroscience Letters. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. Neurobiologi av narkotikamissbruk. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, påven HG, Jr, Oliva PS. Ökad aggressiv respons hos manliga frivilliga efter administrering av gradvis ökande doser av testosteronscypionat. Drog- och alkoholberoende. 1995;40: 73-9. [PubMed]
- Kritzer MF. Långvarig gonadektomi påverkar tätheten av tyrosinhydroxylas- men inte dopamin-beta-hydroxylas-, kolinacetyltransferas- eller serotoninimmunoreaktiva axoner i de mediala prefrontala kortikonen hos vuxna hanrotter. Hjärnbarken. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Effekten av subkronisk nandrolondekanoatbehandling på dopaminerga och serotonerga nervsystem i hjärnan hos råttor. Brain Research. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Neurosteroidmodulering av GABAA-receptorer. Framsteg i neurobiologi. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Hjärnutveckling hos barn och ungdomar: Insikter från anatomisk magnetisk resonansbildning. Neuroscience & Biobehavioral Review. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ontogeny av dopamin-inervering i kärnan på ryggen. Brain Research. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Inhibering av NMDA-svaret med pregnenolonsulfat avslöjar subtyp selektiv modulering av NMDA-receptorer med sulfaterade steroider. British Journal of Pharmacology. 2002;135: 901-9. [PMC gratis artikel] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Framgångsrik intermale aggression och konditionerade platspreferens hos möss. Fysiologi och beteende. 1995;58: 323-8. [PubMed]
- Meek LR, Romeo RD, Novak CM, Sisk CL. Åtgärder av testosteron i prepubertala och postubertala manliga hamstrar: dissociation av effekter på reproduktivt beteende och immunoreaktivitet i hjärnan androgenreceptor. Hormoner och beteenden. 1997;31: 75-88.
- Meisel RL, Joppa MA. Konditionerad platspreferens hos kvinnliga hamstrar efter aggressiva eller sexuella möten. Fysiologi och beteende. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Anabolisk-androgen steroidexponering under tonåren och aggressivt beteende hos gyllene hamstrar. Fysiologi och beteende. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Uppreglering av androgenreceptorimmunreaktivitet i råttahjärnan med androgena anabola steroider. Brain Research. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiol minskar kalciumströmmar i neostriatala neuroner hos råttor via en membranreceptor. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Nivåer av aggression bland en grupp anabola androgena steroider. Medicin, vetenskap och juridik. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Ungdomars sociala erfarenhet återställer ejakulärt beteende hos vuxna hos manliga syriska hamstrar som saknar pubertaltestosteron. Society for Behavioural Neuroendocrinology; Pacific Grove, Kalifornien: 2007.
- Noble RG, Alsum PB. Hormonberoende könsdimorfismer i den gyllene hamsteren (Mesocricetus auratus) Fysiologi och beteende. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Celldöd i utvecklingen av den bakre cortex hos han- och kvinnliga råttor. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Ovariehormoner efter postnatal dag 20 minskar neuronantalet i råttens primära visuella cortex. Journal of Neurobiology. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Effekter av testosteron på humör, aggression och sexuellt beteende hos unga män: en dubbelblind, placebokontrollerad, cross-over-studie. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Belöna affektiva egenskaper hos intra-nucleus accumbens injektioner av testosteron. Beteende neurovetenskap. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH-mRNA ökar med puberteten i den manliga syriska hamsterhjärnan. Journal of Neuroendocrinology. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Anabole steroidanvändningar av amatörsidrottare: effekter på psykologiska humörtillstånd. Journal of Sports Medicine & Physical Fitness. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Diagnos och reproduktionsresultat efter kirurgisk behandling av fullständig septat livmoder, duplicerad livmoderhals och vaginal septum. American Journal of Obstetrics & Gynecology. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Mognad av vit materia i människans hjärna: en genomgång av magnetiska resonansstudier. Hjärnforskningsbulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lund BC, Yates WR, Holman TL, Demers L. Mätningar av aggression och humörförändringar hos manliga viktlyftare med och utan androgen anabola steroider. Journal of Forensic Sciences. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Androgenberoende hos hamstrar: överdosering, tolerans och potentiella opioidergiska mekanismer. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Sexuellt beteende förbättrar central dopaminöverföring hos hanråttan. Brain Research. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Young WC. Organisering av prenatalt administrerat testosteronpropionat på vävnaderna som förmedlar parningsbeteende hos den kvinnliga marsvinet. Endokrinologi. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodriguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Utvecklingen av könsskillnader i locus coeruleus hos råtta. Hjärnforskningsbulletin. 2001;56: 73-8. [PubMed]
- Påven HG, Jr, Katz DL. Mord och nästan mord av anabola steroider. [Se kommentar] Journal of Clinical Psychiatry. 1990;51: 28-31. [PubMed]
- Påven HG, Jr, Katz DL. Psykiatriska och medicinska effekter av anabola androgena steroider. En kontrollerad studie av 160-idrottare. Arkiv för allmän psykiatri. 1994;51: 375-82. [PubMed]
- Pope HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Anabola androgena steroider bland 133 fångar. Omfattande psykiatri. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Testosteronåterställning av copulatoriskt beteende korrelerar med medial preoptisk dopaminfrisättning hos kastrerade hanråttor. Hormoner & beteende. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Effekter av testosteronmetaboliter på kopulation och medial preoptisk dopaminfrisättning hos kastrerade hanråttor. Hormoner & beteende. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Effekter av testosteronmetaboliter på kopulation, medial preoptisk dopamin och NOS-immunreaktivitet hos kastrerade hanråttor. Hormoner & beteende. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Postnatal neurogenes i vasopressin och oxytocininnehållande kärna i svinhypotalamus. Brain Research. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A-receptoraktivitet och uttrycksmodulerar ungdomars anabola / androgena steroidinducerade aggression hos hamstrar. Farmakologi, biokemi och beteende. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosteron aktiverar sexuellt beteende hos vuxna manliga hamstrar men inte hos ungdomar. Fysiologi och beteende. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Östrogenreceptorimmunreaktivitet i prepubertala och vuxna manliga syriska hamstrar. Neuroscience Letters. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Feromoner framkalla ekvivalenta nivåer av Fos-immunreaktivitet i prepubertala och vuxna manliga syriska hamstrar. Hormoner & beteende. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Pubertet och mognad av manlig hjärna och sexuellt beteende: omarbetning av beteendemotion. Neurovetenskap och biobeteende recensioner. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiol inducerar hypotalamiska progesteronreceptorer men aktiverar inte parningsbeteende hos manliga hamstrar (Mesocricetus auratus) före puberteten. Beteende neurovetenskap. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Anabola androgena steroider (AAS) påverkar differentierat socialt beteende hos ungdomar och vuxna manliga syriska hamstrar. Hormoner & beteende. 2008 i pressen.
- SAMHSA / OAS. DHHS-publikationsnummer (SMA) 1996. 1994 Nationella hushållsundersökning om narkotikamissbruk, viktigaste resultat 1994; sid. 96 – 3085.
- SAMHSA / OAS. Resultat från 2004 National Survey on Drug Use and Health: National Findings. 2005. NSDUH-serien H-28, DHHS-publikation nr. SMA 05 – 4062.
- Sato SM, Johansen J, Jordan CL, Wood RI. Androgen självadministrering i Tfm-råttor. 10th årliga mötet för samhället för beteendemässig neuroendokrinologi.2006.
- Sato SM, Wood RI. Självadministrering av membranomträngliga anabola androgena steroider (aas) i syriska hamstrar. 11th årliga mötet för samhället fof Behavioral Neuroendocrinology.2007.
- Schroeder JP, Packard MG. Roll av dopaminreceptorsubtyper vid förvärv av en testosteronbetingad ställning företrädesvis hos råttor. Neuroscience Letters. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Inhemskt våld förknippat med anabola steroider. American Journal of Psychiatry. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Testikelhormonsexponering under tonåren organiserar flankmarkeringsbeteende och vasopressinreceptorbindning i sidoseptum. Hormoner & beteende. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Lookingland KJ, Sisk CL. Mediala preoptiska dopaminerge responser på kvinnliga feromoner utvecklas under puberteten i den manliga syriska hamsteren. Brain Research. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadalhormoner maskuliniserar och defeminiserar reproduktionsbeteenden under puberteten i den manliga syriska hamsteren. Hormoner & beteende. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Pubertalhormon, tonårshjärna och modning av sociala beteenden: Lärdomar från den syriska hamstern. Molekylär och cellulär endokrinologi. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Mötesplanerare för neurovetenskap. Sandiego, CA: Society for Neuroscience; 2007. Är tonåren en andra känslig period för testosterons organiserande effekter på vuxet manligt reproduktionsbeteende? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Kritiska perioder i systemorganisationen. Utvecklingspsykobiologi. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Jämförande fördelning av östrogenreceptor-alfa och -beta-mRNA i råttens centrala nervsystem. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Psykosociala prediktorer för ökat rökstadium bland sjätte klassare. American Journal of Health Behaviour. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Pubertalhormon organiserar ungdomens hjärna och beteende. Gränser i Neuroendocrinology. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Welcome SE, Kan E, Toga AW. Längsgående kartläggning av kortikaltjocklek och hjärntillväxt hos normala barn. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Kartläggning fortsatte hjärntillväxt och reduktion av grå materia täthet i dorsal frontal cortex: Inverse relationer under postadolescent hjärnmognad. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spjut LP. Den ungdomliga hjärnan och åldersrelaterade beteendemässiga manifestationer. Neuroscience & Biobehavioral Review. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neuropsykiatriska effekter av anabola steroider hos normala manliga frivilliga. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Ökade dopaminergiska och 5-hydroxytryptaminergiska aktiviteter i manlig råttahjärna efter långvarig behandling med anabola androgena steroider. British Journal of Pharmacology. 1999;126: 1301-6. [PMC gratis artikel] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestin, östrogen och androgen G-protein-kopplade receptorer i fiskgonader. Steroider. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S.Effekterna av suprafysiologiska doser av testosteron på arg beteende hos friska eugonadala män - en klinisk forskningscentrumstudie. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Kemosensoriska ledtrådar är viktiga för parning-inducerad dopaminfrisättning i MPOA hos manliga syriska hamstrar. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testosteron och nucleus accumbens dopamin i den manliga syriska hamsteren. Psychon (i pressen)
- Van Eenoo P, Delbeke FT. Förekomsten av dopning i Flandern jämfört med förekomsten av dopning i internationella sporter. International Journal of Sports Medicine. 2003;24: 565-570. [PubMed]
- WADA. Negativa analysresultat rapporterade av ackrediterade laboratorier. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Stapling av anabola androgena steroider (AAS) under puberteten hos råttor: en neuroendokrin bedömning och beteende. Farmakologi, biokemi och beteende. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Användning av anabola androgena steroider i tonåren: att vinna, se bra ut eller vara dålig? Journal of Studies on Alcohol. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Schad C, Self DW. Testosteronförstärkning: intravenös och intracerebroventrikulär självadministrering hos hanråttor och hamstrar. Psychopharmacology. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Androgen- och östrogenreceptorer samexisterar med i enskilda neuroner i hjärnan i den syriska hamsteren. Neuroendokrinologi. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Neuronal integration av kemosensoriska och hormonella signaler som styr manligt sexuellt beteende. I: Wallen K, Schneider JS, redaktörer. Reproduktion i sammanhang. MIT Press; Cambridge: 1999. sid. 423 – 444.
- Zahm DS, Heimer L. Två transpallida vägar som har sitt ursprung i råttkärnorna. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]