Kommentarer: Denna recension producerades av chefen för NIDA, Nora Volkow och hennes team. Det lämnar liten tvekan om att kemiska missbruk och beteendemissbruk delar samma eller liknande mekanismer och neuralkretsar. Detta är perfekt förnuftigt eftersom kemiska missbruk kapar nervkretsarna för bindning, sex och ätande. Eftersom sex släpper dubbelt så mycket dopamin som att äta din favoritmat, och en porranvändare kan hålla dopamin högt i timmar, är det galet att föreslå att porrberoende inte kan existera.
Curr Top Behav Neurosci. 2011 okt 21.
Volkow ND, Wang GJ, Fowler JS, Tomasi D, Baler R.
Källa
National Institute on Drug Abuse, 6001 Executive Boulevard 6001, Room 5274, Bethesda, MD, 20892, USA, [e-postskyddad].
Abstrakt
Både narkotikamissbruk och fetma kan definieras som störningar i vilka förmågan hos en typ av belöning (läkemedel respektive mat) förbättras onormalt i förhållande till och på bekostnad av andra. Denna modell överensstämmer med det faktum att både läkemedel och mat har kraftfulla förstärkande effekter - delvis medierade av dopaminökningar i det limbiska systemet - som under vissa omständigheter eller hos utsatta individer kan överväldiga hjärnans homeostatiska kontrollmekanismer. Sådana paralleller har skapat ett stort intresse för att förstå de delade sårbarheterna och banorna mellan missbruk och fetma. Nu har hjärnbildsupptäckten börjat avslöja vanliga särdrag mellan dessa två tillstånd och att avgränsa några av de överlappande hjärnkretsarna vars dysfunktioner kan förklara stereotypa och relaterade beteendemissbruk hos mänskliga ämnen. THese resultat tyder på att både överviktiga och drogberoende individer lider av nedsatthet i dopaminergiska vägar som reglerar neuronala system associerade inte bara med belöningskänslighet och incitamentmotivering, utan också med konditionering (minne / lärande), impulskontroll (beteendehämning), stressreaktivitet och interoceptiv medvetenhet. Här integrerar vi fynd främst härledda från positronemissionstomografi som belyser dopamins roll i drogberoende och i fetma och föreslår en uppdaterad arbetsmodell för att identifiera behandlingsstrategier som kan gynna båda dessa tillstånd.
1 Bakgrund
2 Rollen av dopamin i akut belöning för droger och livsmedel
3 Imaging DA som svar på droger och på konditionerade signaler i beroende
4 Effekten av dysfunktion i hämmande kontroll
5 Involvering av motivationskretsar
6 Engagemang för interceptiva kretsar
7 The Circuitry of Aversion
8 Patologiskt läkemedel och belöning av livsmedel: En uppdaterad fungerande modell
1 Bakgrund
Dopamin (DA) anses vara en nyckel till de givande effekterna av naturliga och medicinska belöningar. Men dess roll i förlusten av kontroll och tvångsmässiga beteenden som är förknippade med missbruk och fetma är mycket mindre tydliga. PET-studier har spelat en avgörande roll för att karakterisera hjärnans DA-system i beroende (utöver dess roll i drogbelöning) och i fetma. I själva verket konsumeras droger av missbruk (inklusive alkohol) av människor eller självadministreras av laboratoriedjur eftersom de i sig är givande, en effekt som förmedlas genom deras DA-förbättrande egenskaper i det mesolimbiska systemet (Wise 2009). Hnär det gäller missbruk har imaging-studier visat att störningen inte bara påverkar DA-belöningskretsen utan också andra DA-vägar som är involverade i modulering av konditionering / vanor, motivation och verkställande funktioner (hämmande kontroll, förmåga attribut och beslut) -tillverkning), och att DA-brister också kan delta i den förbättrade stressreaktiviteten och störningen av interoceptiv medvetenhet i samband med beroende. Prekliniska och kliniska studier har också avslöjat andra neurotransmittorer (och neuropeptider) som spelar viktiga roller i läkemedelsbelöning och beroende (dvs. cannabinoider, opioider) och är intimt involverade i de neuroplastiska förändringarna som följer upprepad läkemedelsanvändning (dvs. glutamat, opioider, GABA, kortikotropinfrisättande faktor). Det glutamatergiska systemet är särskilt framträdande i detta avseende eftersom det medierar störningarna i både långvarig förstärkning och långvarig depression som har observerats i djurmodeller för kronisk läkemedelsadministrering (Thomas et al. 2008). Recensioner avseende dessa ytterligare system kan hittas någon annanstans (Kalivas 2009; Koob 1992).
Eftersom läkemedel aktiverar samma belöningssystem som ligger till grund för matbelöning, är det inte helt oväntat att i allmänhet studier av hjärnavbildning har stött uppfattningen att funktionsnedsättningar i DA-modulerade kretsar också är inblandade i patologiska, tvångsmässiga ätbeteenden. Livsmedels-ledtrådar, som droger, ökar striatal extracellular DA och driver motivationen att engagera sig i beteenden som är nödvändiga för att skaffa och äta maten, vilket ger bevis för engagemang av DA, inte bara i matbelöning utan också i den icke-hedoniska motiveringen livsmedelsegenskaper (dvs kalorikrav) och minskningen av hämmande kontroll som ses vid tvångsmässig överätning (Avena et al. 2008; Volkow et al. 2008).
Här granskar vi fynd från avbildningstudier som specifikt fokuserar på överlappningar i hjärnkretsarna som störs i fetma och i drogberoende. Det är dock värt att komma ihåg att regleringen av livsmedelsintagets beteende är mycket mer komplex än regleringen av läkemedelsintaget. Den senare medieras främst av de givande effekterna av läkemedel medan den förstnämnda moduleras inte bara av dess givande effekter (hedoniska faktorer) utan också av flera perifera och centrala faktorer som känner näringsbehov i kroppen som är nödvändiga för överlevnad (homeostatiska faktorer). Intressant nog finns det växande bevis för att homeostatiska faktorer (t.ex. insulin, leptin, ghrelin) modulerar matintag delvis genom att öka eller minska känsligheten hos hjärnans belöningskretsar för matstimuli (Volkow et al. 2011).
2 Rollen av dopamin i akut belöning för droger och livsmedel
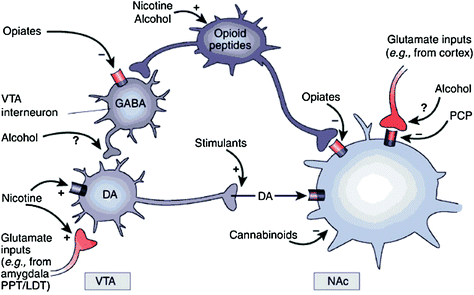
Oavsett om det är direkt eller indirekt, alla beroendeframkallande läkemedel visar en förmåga att öka DA i nucleus accumbens (NAc) via specifika interaktioner med olika molekylära mål (Nestler 2004) (Fig. 1). Den mesolimbiska DA-vägen [DA-celler i ventral tegmental area (VTA) som projicerar in i NAc] verkar vara avgörande för läkemedelsbelöning (Wise 2009). Som beskrivs nedan, bidrar dock andra DA-vägar [mesostriatal (DA-celler i substantia nigra som projicerar till dorsalt striatum) och mesokortikala (DA-celler i VTA som projicerar i frontal cortex) också till läkemedelsbelöning och missbruk (Wise 2009). Sammantaget verkar det som att de givande och konditionerande effekterna av läkemedel främst drivs av fasisk DA-cellbränning, vilket leder till stora och övergående DA-ökningar. Däremot är de nedströms förändringar i verkställande funktion som uppstår i beroende kopplade till förändringar i tonic DA-cellbränning och resulterar i lägre men mer stabila DA-nivåer (Grace 2000; Wanat et al. 2009). Detta pekar i sin tur på D1-receptorerna (D1R), som är DA-receptorer med låg affinitet som stimulerar cyklisk AMP-signalering, eftersom de är involverade både i akut läkemedelsbelöning såväl som i konditionering, eftersom dessa är associerade med de höga DA-koncentrationerna som är nödvändiga för att stimulera D1R. Däremot stimuleras D2R: er, som hämmar cyklisk AMP-signalering av både fasisk och tonisk DA. Observera att på grund av avsaknaden av specifika radiospårare för PET-avbildning av DA-receptorer av D1-, D3-, D4- och D5-typerna har de flesta studier av effekterna av droger av missbruk och missbruk i den mänskliga hjärnan fokuserat på D2R.
Fig 1 Misbruksmedicin verkar på belöningen och tillhörande kretsar genom olika mekanismer, men alla leder till liknande dopaminergiska effekter i VTA och NAc. Således stimulerar stimulanter acumbal DA direkt, medan opiater gör detta genom att sänka den hämmande tonen för GABAergic interneuroner på DA-signalering både antingen i VTA eller i då NAc. Medan mekanismerna för andra missbruksläkemedel är mindre tydliga, finns det bevis som tyder på att nikotin kan aktivera VTA DA direkt genom nikotinacetylkolinreceptor (nAChR) på dessa neuroner och indirekt via stimulering av dess receptorer på glutamatergiska nervterminaler som innerverar DA-cellerna. Alkohol verkar hämma GABAergiska terminaler i VTA, vilket leder till DA-neuroner som avbröts i VTA. Cannabinoider verkar bland annat genom aktivering av CB1-receptorer på glutamatergiska och GABAergiska nervterminaler i NAc och på själva NAc-nervcellerna. Fencyclidine (PCP) kan verka genom att hämma postsynaptiska NMDA-glutamatreceptorer i NAc. Dessutom finns det några bevis som tyder på att nikotin och alkohol också kan interagera med endogena opioid- och cannabinoidvägar (visas inte). PPT / LDT, peduncular pontine tegmentum / lateral dorsal tegmentum. Omtryckt med tillstånd Nestler (2005)
Hos människor har PET-studier visat att flera läkemedel [stimulanser (Drevets et al.). 2001; Volkow et al. 1999b), nikotin (Brody et al. 2009), alkohol (Boileau et al. 2003) och marijuana (Bossong et al. 2009)] öka DA i dorsal och ventral striatum (där NAc finns). Dessa studier drar nytta av flera radiospårare, såsom [11C] racloprid, som binder till D2R men endast när dessa inte är bindande endogena DA (obebodda), som under baslinjeförhållanden motsvarar 85 – 90% av den striatal D2R (Abi-Dargham et al. 1998). En jämförelse av [11C] raclopridbindning efter placebo och efter läkemedelsadministration kan hjälpa oss att uppskatta minskningarna i D2R-tillgänglighet inducerad av läkemedlet (eller andra stimuli som kan öka DA). Dessa minskar i [11C] raclopridbindning är proportionell mot DA-ökningarna (Breier et al. 1997). Dessa studier har visat att läkemedelsinducerade DA-ökningar i striatum är proportionella mot intensiteten av den subjektiva upplevelsen av eufori eller "hög" [se översyn (Volkow et al.). 2009)] (Fig. 2).
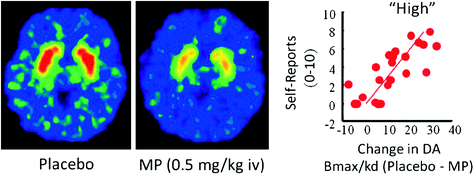
Fig 2 Effekterna av intravenös metylfenidat (MP) vid raclopridbindning och förhållandet mellan striatal DA ökar inducerat av MP i striatum och självrapporteringen om "hög". Modifierad från Volkow et al. (1999b)
PET-studier har också avslöjat ett tydligt, direkt samband mellan läkemedlets farmakokinetiska profil (dvs. hastigheten med vilken det går in i och lämnar hjärnan) och dess förstärkande effekter. Specifikt, ju snabbare ett läkemedel når toppnivåer i hjärnan, desto intensivare är den "höga" (Volkow et al. 2009). Till exempel, för en motsvarande nivå av kokain som når hjärnan (bedömd genom PET), när kokain kom in i hjärnan snabbt (rökt eller iv-administrering), framkallade det en mer intensiv "hög" än när den gick in i en långsammare takt (snört) (Volkow et al. 2000). Detta överensstämmer med prekliniska studier som visar en liknande korrelation mellan läkemedlets farmakokinetiska profil och dess förstärkande egenskaper (Balster och Schuster 1973). jagDet är rimligt att antaga att sådana plötsliga och stora DA-ökningar, som utlöses av missbruksläkemedel, kan härma de snabba och stora DA-ökningarna som är resultatet av fasisk DA-bränning som har förknippats i hjärnan med bearbetning av information om belöning och förmåga (Schultz 2010). Sådana läkemedelsinducerade DA-ökningar i NAc kan vara nödvändiga för missbruk, men det faktum att de förekommer också hos icke-beroende individer indikerar att de är otillräckliga för att förklara det impulsiva och tvångsmässiga läkemedelsanvändning som är karakteristiskt för missbruk.
Det finns nu bevis för att jämförbara dopaminergiska svar är kopplade till matbelöning och att dessa mekanismer sannolikt också kommer att spela en roll i överdriven matkonsumtion och fetma. Det är välkänt att vissa livsmedel, särskilt de som är rika på socker och fett, är mycket givande (Lenoir et al. 2007). Livsmedel med höga kalorier kan främja överätande (äta som inte är kopplat från energiska behov) och utlösa lärda samband mellan stimulans och belöning (konditionering). I evolutionära termer brukade den här egenskapen av smakliga livsmedel vara fördelaktig i miljöer där livsmedelskällorna var knappa och / eller opålitliga, eftersom det säkerställde att maten ätdes när den var tillgänglig, vilket möjliggjorde förvaring av energi i kroppen (som fett) för framtida användning . Tyvärr, i samhällen som vårt, där maten är riklig och ständigt tillgänglig, har denna anpassning blivit ett ansvar.
Flera neurotransmittorer, inklusive DA, cannabinoider, opioider och serotonin, såväl som hormoner och neuropeptider involverade i homeostatisk reglering av matintag, såsom insulin, orexin, leptin och ghrelin, har varit inblandade i de givande effekterna av mat (Atkinson 2008; Cason et al. 2010; Cota et al. 2006). Av dessa har DA varit den mest grundliga utredningen och är den bäst karakteriserade. Experiment med gnagare har visat att vid första exponering för en livsmedelsbelöning ökar avfyrningen av DA-neuroner i VTA med en resulterande ökning av DA-frisläppande i NAc (Norgren et al. 2006). På samma sätt, hos friska människor med normal vikt, har intag av smakliga livsmedel visat sig frisätta DA i ryggstrimatet i proportion till bedömningen av måltidens behaglighet (Small et al. 2003) (Fig. 3). Men som man såg i studier med missbrukare kan livsmedelsinducerade ökningar av enbart dödlig DA inte förklara skillnaden mellan normalt matintag och överdrivet tvångsmatskonsumtion eftersom dessa också förekommer hos friska individer som inte äter för mycket. Såsom är fallet för missbruk är anpassningar nedströms troligtvis involverade i förlusten av kontroll över matintaget.
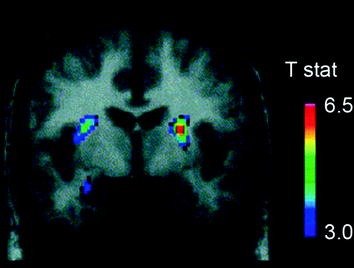
Fig 3 Dopaminfrisättning inducerad genom utfodring. Koronalsnitt från T-kartan över statistiskt signifikanta minskningar i [11C] racloprids bindningspotential (BP) efter utfodring. Färgfältet representerar t-statistikvärdena. (Omtryckt med tillstånd Small et al. 2003)
3 Imaging DA som svar på droger och på konditionerade signaler i beroende
DA: s roll i förstärkning är mer komplex än bara kodning för belöning i sig (hedoniskt nöje); till exempel stimuli som inducerar snabba och stora DA-ökar utlöser också konditionerade svar och framkallar incitamentmotivering för att skaffa dem (Owesson-White et al. 2009). Detta är viktigt eftersom neutrala stimuli som är kopplade till förstärkaren (vare sig en naturlig eller en läkemedelsförstärkare) förvärvar förmågan för sig att öka DA i striatum (inklusive NAc) i väntan på belöningen genom att konditionera processen. en stark motivation att söka läkemedlet (Owesson-White et al. 2009). Emellertid är frikoppling av belönings- och konditioneringsmekanismer i processen med drogberoende mer utmanande än för livsmedelskonsumtion eftersom missbruk av droger, genom deras farmakologiska effekter, direkt aktiverar DA-neuroner (dvs nikotin) eller ökar DA-frisättningen (dvs. amfetamin).
Studier av hjärnavbildning som jämförde DA-ökningarna inducerade av det stimulerande läkemedlet metylfenidat (MP) eller amfetamin (AMPH) bland personer med kokainberoende jämfört med kontroller visade en markant dämpning av MP- eller AMPH-inducerade DA-ökningar i striatum (50% lägre i detoxifierade missbrukare) och 80% hos aktiva missbrukare) och lägre självrapporter om läkemedlets givande effekter relativt kontroller som inte missbrukar läkemedel (Martinez et al. 2007; Volkow et al. 1997) (Fig. 4). Detta var förvånande eftersom MP och AMPH är farmakologiskt lika med kokain respektive metamfetamin, och läkemedelsmisbrukare kan inte skilja mellan dem när de administreras intravenöst. Eftersom de markanta minskningarna av de läkemedelsinducerade DA-ökningarna observerades oavsett om kokainmissbrukarna hade avgiftats eller inte, indikerar detta att tillståndet för tillbakadragande inte är en besvärande faktor (Volkow et al. 2011b). Dessa och relaterade resultat (Volkow et al. 2009) överensstämmer med hypotesen om att den hedoniska responsen blir brist på läkemedelsberoende individer och ytterligare stärker uppfattningen att de akuta farmakologiska DA-förbättrande effekterna av läkemedlet i NAc inte själva kan förklara den ökade motivationen att konsumera dem.
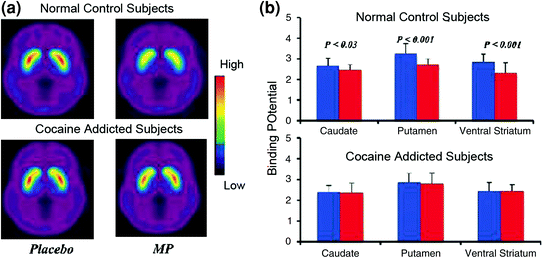
Fig 4 DA-förändringar inducerade av iv MP i kontroller och hos aktiva kokainberoende personer. en genomsnittlig nollställbar biding potential (BPND) bilder av [11C] racloprid i aktiva kokainberoende personer (n = 19) och i kontroller (n = 24) testade efter placebo och efter iv MP. b D2R-tillgänglighet (BPND) i caudate, putamen och ventral striatum efter placebo (blått) och efter MP (rött) i kontroller och hos kokainberoende personer. MP reducerade D2R i kontroller men inte hos personer som var beroende av kokain. Observera att kokainmissbrukare visar båda minskningar i baseline-striatal D2R-tillgänglighet (placebo-mått) och minskningar i DA-frisättning när det ges iv MP (mätt som minskningar i D2R-tillgänglighet från baslinjen). Även om man skulle kunna ifrågasätta i vilken utsträckning den låga striatala D2R-tillgängligheten hos kokainberoende subjekt begränsar förmågan att upptäcka ytterligare minskningar från MP, tyder det faktum på att kokainberoende försökspersoner visar minskningar i D2R tillgänglighet när de utsätts för kokainkoder att de försvagade effekterna av MP på [11C] raclopridbindning återspeglar minskad DA-frisättning. Omtryckt med tillstånd (Volkow et al. 1997; Wang et al. 2010)
Svaret från VTA DA-neuroner på belöna stimuli förändras med upprepad exponering.
Medan DA-celler avfyras vid den första exponeringen för en ny belöning får upprepad exponering för DA neuronerna att sluta skjuta efter belöningskonsumtion och eld istället när de utsätts för stimuli som förutsäger belöningen (Schultz et al. 1997). Detta kommer sannolikt att ligga till grund för DA: s roll i lärande och konditionering. Faktiskt kan läkemedelsinducerad fasisk DA-signalering så småningom utlösa neuroadaptationer i tillhörande kretsar som är relaterade till vanorbildning och beteendekonditionering. Tdessa förändringar induceras övervägande av D1R-signalering och synaptiska förändringar i glutamatmodulerade NMDA- och AMPA-receptorer (Luscher och Malenka 2011; Zweifel et al. 2009). Rekrytering av dessa kretsar är betydelsefullt vid sjukdomens progression eftersom de efterföljande konditionerade svaren hjälper till att förklara den intensiva önskan efter läkemedlet (begär) och den tvångsmässiga användningen som uppstår när beroende personer utsätts för läkemedelsassocierade ledtrådar. Denna hypotes är förenlig med oberoende observationer (Volkow et al. 2006b; Wong et al. 2006) som visar kraften hos kokainassocierad exponering för att höja DA-nivåer i ryggstratum och utlösa en samtidig ökning av den subjektiva upplevelsen av sug hos avgiftande kokainmissbrukare (Fig. 5). Eftersom dorsal striatum spelar en roll i vanliga inlärning (Belin et al. 2009; Yin et al. 2004) kommer föreningen sannolikt att återspegla förstärkningen av vanor när beroendets kronik fortskrider. Detta antyder att en grundläggande störning i missbruk kan relatera till de DA-utlösta konditionerade svar som resulterar i vanor som leder till intensiv begär och tvångsmässig läkemedelskonsumtion. Intressant nog, när man aktivt använder kokainberoende försökspersoner, verkar DA-höjningarna som utlöses av konditionerade ledtrådar vara ännu större än de som produceras av det stimulerande läkemedlet i sig, som bedömts i två separata grupper av individer (Volkow et al. 2011b, 2006b), vilket tyder på att konditionerade svar kan driva DA-signalering som upprätthåller motivationen att ta läkemedlet även om dess farmakologiska effekter verkar vara minskade. Även om läkemedel initialt kan framkalla känslor av omedelbar belöning genom frisläppning av DA i det ventrala striatum, med upprepad användning, och när vanan utvecklas, verkar det finnas en övergång från läkemedlet till den konditionerade stimulansen. Enligt studier på laboratoriedjur medierar glutamatergiska prognoser från prefrontalbarken och från amygdala till VTA / SN och NAc dessa konditionerade svar (Kalivas 2009). På detta sätt kan den bara förutsägelsen av en belöning så småningom bli den belöning som motiverar det beteende som krävs för drog (eller mat) konsumtion.
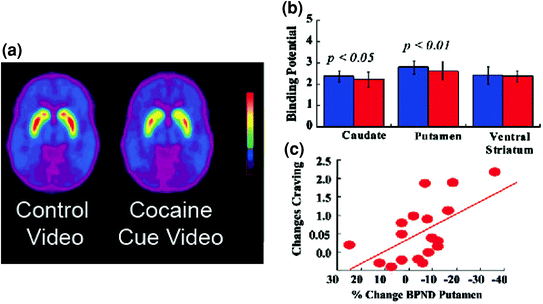
Fig 5 DA-förändringar inducerade av konditionerade ledtrådar i aktiva kokainberoende personer. en genomsnittlig nondisplacerbar bindningspotential (BPND) -bilder av [11C] raclopride i kokainberoende försökspersoner (n = 17) testade medan man tittade på en neutral video (naturscener) och medan man tittade på en kokain-cues-video (försökspersoner som administrerar kokain). b D2R-tillgänglighet (BPND) i caudate, putamen och ventral striatum för den neutrala videon (blå) och kokain-cues-videon (röd). Kokainpunkterna minskade D2R i caudat och putamen. c Korrelationer mellan förändringar i D2R (återspeglar DA-ökar) och självrapporter om kokaintrang som inducerats av videoen med kokain-cues. Ändrad från ref. (Volkow et al. 2006b)
Interestingly, denna typ av funktionell "switch" har också rapporterats för naturliga förstärkare, som sannolikt kommer att leda till en motsvarande och gradvis förskjutning av DA-ökningar, från ventral till mer ryggområden i striatum under övergången från en ny stimulans som är inneboende givande för de tillhörande ledtrådarna som förutsäger det. Denna övergång förmedlas genom DA-signalering, som tycks koda för ett "belöningsförutsägelsefel" (Schultz 2010). De omfattande glutamatergiska afferenterna till DA-nervceller från regioner som är involverade i bearbetning av sensorisk (insula eller primär gustatory cortex), homeostatisk (hypothalamus), belöning (NAc), emotionell (amygdala och hippocampus) och multimodal (orbitofrontal cortex för uppmärksamhet) , modulera sin aktivitet som svar på belöningar och på konditionerade ledtrådar (Geisler och Wise 2008). Mer specifikt är projektioner från amygdala och orbitofrontal cortex (OFC) till DA-neuroner och NAc involverade i konditionerade svar på mat (Petrovich 2010). I själva verket visade bildstudier att när icke-överviktiga manliga individer ombads hämma deras sug efter mat medan de utsattes för livsmedier, visade de minskad metabolisk aktivitet i amygdala och OFC (såväl som i hippocampus), insula och striatum, och att minskningarna i OFC var förknippade med minskningar av mattrang (Wang et al. 2009). En liknande hämning av den metaboliska aktiviteten i OFC (och även i NAc) har observerats hos kokainmissbrukare när de ombads hämma deras läkemedelsbegär efter exponering för kokainkoder (Volkow et al. 2009b).
Ändå uppkomsten av sådana kraftfullt kus-konditionerade begär, som för livsmedel också förekommer hos friska individer som inte äter mycket, skulle inte vara lika förödande om de inte kombinerades med växande underskott i hjärnans förmåga att hämma missbildande beteenden.
4 Effekten av dysfunktion i hämmande kontroll
Förmågan att hämma prepotenta svar är förmodligen att bidra till en individs förmåga att undvika att delta i olämpliga beteenden, som att ta droger eller äta förbi mättnadssteget och därmed öka hans / hennes sårbarhet för missbruk (eller fetma) (Volkow och Fowler) 2000; Volkow et al. 2008).
PET-studier har avslöjat signifikanta minskningar av D2R-tillgängligheten i striatumet för beroende personer som kvarstår i månader efter långvarig avgiftning [granskad i (Volkow et al. 2009)]. På liknande sätt har prekliniska studier på gnagare och icke-humana primater visat att upprepade läkemedelseksponeringar är förknippade med reduktioner i striatal D2R-nivåer (Nader et al. 2006; Thanos et al. 2007; Volkow et al. 2001). I striatum förmedlar D2Rs signalering i den striatal indirekta vägen som modulerar prefrontala regioner; och dess nedreglering har visat sig öka sensibiliseringen för effekterna av läkemedel i djurmodeller (Ferguson et al. 2011). Hos människor som är beroende av läkemedel är reduktionen i striatal D2R associerad med minskad aktivitet av prefrontala regioner, vilket framgår av minskningar i baslinjen glukosmetabolism (en markör för hjärnfunktion) i OFC, anterior cingulate gyrus (ACC) och dorsolateral prefrontal cortex (DLPFC) ) (Volkow et al. 2001, 1993, 2007) (Fig. 6). I den mån OFC, ACC och DLPFC är involverade i försiktighetsattribution, hämmande kontroll / känsloreglering respektive beslutsfattande, det har antagits att deras felaktiga reglering genom D2R-medierad DA-signalering i missbrukare skulle kunna ligga till grund för det ökade motivationsvärdet för läkemedel i deras beteende och förlusten av kontroll över läkemedelsintag (Volkow och Fowler 2000). Eftersom funktionsnedsättningar i OFC och ACC dessutom är förknippade med tvångsmässigt beteende och impulsivitet (Fineberg et al. 2009), DA: s försämrade modulering av dessa regioner kommer sannolikt att bidra till det tvångsmässiga och impulsiva läkemedelsintaget sett i beroende (Goldstein och Volkow 2002). I metamfetaminmisbrukare var faktiskt låg striatal D2R associerad med impulsivitet (Lee et al. 2009), och den förutspådde också tvångskokainadministrering hos gnagare (Everitt et al. 2008). Ett omvändt scenario, där en initial sårbarhet för prexister för läkemedelsanvändning i prefrontala regioner, och där upprepad läkemedelsanvändning utlöser ytterligare minskningar i striatal D2R, är också möjligt. I själva verket avslöjade en studie som gjordes på individer som trots en hög risk för alkoholism (positiv familjehistoria med alkoholism) inte var alkoholister, en högre än normal striatal D2R-tillgänglighet som var associerad med normal metabolism i OFC, ACC och DLPFC (Volkow et al. 2006). Detta antyder att hos dessa personer med risk för alkoholism var den normala prefrontala funktionen kopplad till förbättrad striatal D2R-signalering, vilket i sin tur kan ha skyddat dem mot alkoholmissbruk.
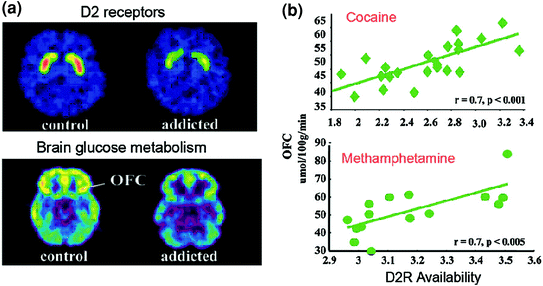
Fig 6 Samband mellan striatal D2R tillgänglighet och metabolism i prefrontala hjärnregioner. a Axial hjärnbilder för en kontroll och för ett kokainberoende motiv för baslinjebilder av tillgänglighet i D2R i striatum (erhållet med [11C] rakloprid) och glukosmetabolism i hjärnan i OFC (erhållen med [18FDG). b Korrelationer mellan striatal D2R och metabolism i OFC hos kokainberoende och metamfetaminberoende personer. Omtryckt från Volkow et al. (2009) Copyright (2009), med tillstånd från Elsevier
Förutsägbart har bevis för dysreglering i kontrollkretsar också funnits bland feta individer. Både prekliniska och kliniska studier har visat bevis på minskad striatal D2R-signalering, som, som nämnts ovan, är kopplad till belöning (NAc) men också med fastställandet av vanor och rutiner (dorsal striatum) i obesity (Geiger et al. 2009; Wang et al. 2001). Det är viktigt att minskad striatal D2R-tillgänglighet har kopplats till tvångsmatigt intag av mat hos feta gnagare (Johnson och Kenny 2010) och med minskad metabolisk aktivitet i OFC och ACC hos överviktiga människor (Volkow et al. 2008b) (Fig. 7växelström). Med tanke på att dysfunktion i OFC och ACC resulterar i tvång [se översyn (Fineberg et al.) 2009)], kan detta vara en del av mekanismen genom vilken låg striatal D2R-signalering underlättar hyperfagi (Davis et al. 2009). Eftersom minskad D2R-relaterad signalering också sannolikt kommer att minska känsligheten för andra naturliga belöningar, kan detta underskott hos överviktiga individer också bidra till kompensatorisk överätande (Geiger et al. 2008).
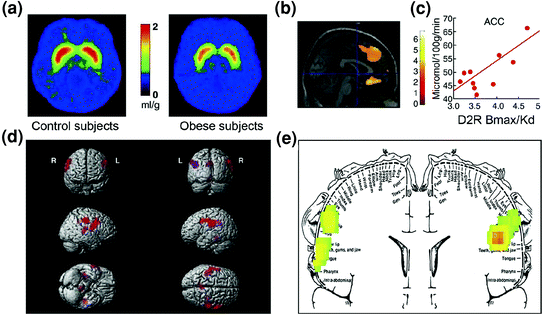
Fig 7 Hyperfagi kan vara resultatet av en drivkraft för att kompensera för en försvagad belöningskrets (bearbetad genom dopaminreglerade kortikostriatala kretsar) i kombination med en ökad känslighet för smakbarhet (hedoniska egenskaper hos livsmedel som delvis bearbetas genom den somatosensoriska cortex). a Genomsnittliga bilder för tillgänglighet för DA D2-receptor (D2R) i kontroller (n = 10) och hos sjukligt överviktiga personer (n = 10). b Resultat från (Statistical Parametric Mapping) SPM som identifierade de områden i hjärnan där D2R var associerad med glukosmetabolism, dessa inkluderade den mediala OFC, ACC och den dorsolaterala PFC (regionen visas inte). c Regressionslutning mellan striatal D2R och metabolisk aktivitet i ACC hos överviktiga personer. d Tredimensionellt återgivna SPM-bilder som visar områden med högre ämnesomsättning hos överviktiga än hos magra försökspersoner (P <0.003, okorrigerad). e Färgkodade SPM-resultat visas i ett koronalt plan med ett överlagrat diagram över den somatosensoriska homunculus. Resultaten (z-värde) presenteras med hjälp av regnbågsskalan där röd> gul> grön. Jämfört med magra försökspersoner hade överviktiga ämnen en högre metabolism vid baslinjen i de somatosensoriska områdena där mun, läppar och tunga är representerade och som är involverade i bearbetning av matens smak. Modifierad, med tillstånd, från Volkow et al. (2008) (a – c) och Wang et al. (2002(d, e)
Denna hypotes stämmer överens med prekliniska bevis som visar att minskad DA-aktivitet i VTA resulterar i en dramatisk ökning av konsumtionen av livsmedel med hög fetthalt (Stoeckel et al. 2008). Jämfört med individer med normal vikt, visade feta individer som presenterades med bilder av högkalorimat (stimuli som de är konditionerade) ökad neural aktivering i regioner som ingår i belönings- och motivationskretsar (NAc, dorsal striatum, OFC , ACC, amygdala, hippocampus och insula) (Killgore och Yurgelun-Todd 2005). Däremot visade man sig att normal aktivering av ACC och OFC (regioner som är involverade i attitydfördelning som projicerar i NAc) under presentation av kalorifoder var negativt korrelerade med deras kroppsmassaindex (BMI) ( Stice et al. 2008b). Detta antyder en dynamisk interaktion mellan mängden mat som ätits (återspeglas delvis i BMI) och reaktiviteten hos belöningsregioner mot högkalorifoder (återspeglas i aktiveringen av OFC och ACC) hos individer med normal vikt, vilket förloras i fetma.
Överraskande visade feta individer mindre aktivering av belöningskretsar från den faktiska livsmedelskonsumtionen (kallad fulländad matbelöning) än magra individer, medan de visade större aktivering av somatosensoriska kortikala regioner som bearbetar smakbarhet när de förutsåg konsumtion (Stice et al. 2008b). Den senare observationen motsvarade regioner där en tidigare studie hade avslöjat förbättrad aktivitet hos feta ämnen testade vid baslinjen (icke-stimulering) (Wang et al. 2002) (Fig. 7d, e). En förbättrad aktivitet av regioner som bearbetar smakbarhet kan göra att överviktiga individer gynnar mat framför andra naturliga förstärkare, medan minskad aktivering av dopaminergiska mål med den faktiska livsmedelsförbrukningen kan leda till överförbrukning som ett medel för att kompensera för svag D2R-medierad signalering (Stice et al. 2008). Detta minskade svar från belöningskretsarna på livsmedelskonsumtion hos feta individer påminner om de minskade DA-ökningarna som utlöses av drogkonsumtion hos beroende personer jämfört med icke-beroende personer.
Den prefrontala cortex (PFC) spelar en avgörande roll i verkställande funktion, inklusive hämmande kontroll (Miller och Cohen 2001). Dessa processer moduleras av D1R och D2R (förmodligen också D4R) och således kan den minskade aktiviteten i PFC, både i beroende och i fetma, sannolikt bidra till dålig kontroll och hög kompulsivitet. Den lägre än normala tillgängligheten av D2R i striatum för överviktiga individer, vilket har associerats med reducerad aktivitet i PFC och ACC (Volkow et al. 2008b) kommer därför sannolikt att bidra till deras bristande kontroll över matintaget. Faktum är att den negativa korrelationen mellan BMI och striatal D2R rapporterades hos överviktiga (Wang et al. 2001) och i övervikt (Haltia et al. 2007) individer stöder detta. En bättre förståelse av mekanismerna som leder till nedsatt PFC-funktion vid fetma (eller missbruk) kan underlätta utvecklingen av strategier för att förbättra, eller kanske till och med vända, specifika nedsättningar inom avgörande kognitiva domäner. Exempelvis är fördröjningsdiskontering, som är en tendens att devalvera en belöning som en funktion av den temporära förseningen av dess leverans, en av de mest omfattande undersökta kognitiva operationerna i förhållande till störningar associerade med impulsivitet och tvång. Förseningsrabatter har undersökts mest uttömmande hos missbrukare som uppvisar en överdriven preferens för små men omedelbara framför stora men försenade belöningar (Bickel et al. 2007). Emellertid har de få studierna som utförts med överviktiga individer också avslöjat bevis på att de föredrar höga, omedelbara belöningar, trots en ökad chans att drabbas av högre framtida förluster (Brogan et al. 2010; Weller et al. 2008). Och nyligen fann en annan studie en positiv korrelation mellan BMI och hyperbolisk diskontering, varigenom framtida negativa utbetalningar diskonteras mindre än framtida positiva utbetalningar (Ikeda et al. 2010). Intressant nog verkar förseningsdiskontering bero på funktionen hos ventral striatum (Gregorios-Pippas et al. 2009) och av PFC, inklusive lateral OFC (Bjork et al. 2009) och är känslig för DA-manipulationer (Pine et al. 2010). Specifikt ökade DA-signalering (med L DOPA-behandling) ökad impulsivitet och temporär diskontering.
5 Involvering av motivationskretsar
Dopaminerg signalering modulerar också motivation. Beteendeegenskaper som kraft, uthållighet och investera en fortsatt ansträngning för att uppnå ett mål är alla föremål för modulering av DA som agerar genom flera målregioner, inklusive NAc, ACC, OFC, DLPFC, amygdala, dorsal striatum och ventral pallidum (Salamone et al. 2007). Dysreglerad DA-signalering är förknippad med en ökad motivation att skaffa droger, ett kännetecken för beroende, varför drogberoende individer ofta engagerar sig i extremt beteende för att få läkemedel, även när de medför kända allvarliga och negativa konsekvenser (Volkow och Li 2005). Eftersom narkotikamissbruk blir den främsta drivkraften i narkotikamissbruk (Volkow et al. 2003), beroende försökspersoner väcks och motiveras av processen för att få läkemedlet men tenderar att bli tillbaka och apatiska när de utsätts för icke-drogrelaterade aktiviteter. Denna förskjutning har studerats genom att jämföra hjärnaktiveringsmönstret som inträffar med exponering för konditionerade signaler med de som förekommer i frånvaro av sådana signaler. I motsats till minskningarna i prefrontalaktivitet som rapporterats hos avgiftande kokainmissbrukare när de inte stimuleras med läkemedels- eller läkemedelsvisningar [se översyn (Volkow et al.). 2009)], dessa prefrontala regioner aktiveras när kokainmissbrukare utsätts för begärande-inducerande stimuli (antingen läkemedel eller signaler) (Grant et al. 1996; Volkow et al. 1999; Wang et al. 1999). Detta resultat påminner om observationen att kokainmissbrukare, som studerades kort efter ett avsnitt av kokainbingning, visade en ökning av metabolisk aktivitet i OFC och ACC (även dorsal striatum) som var förknippat med begär (Volkow et al.). 1991).
När svaren på iv MP jämförs mellan kokainberoende och icke-beroende individer svarade dessutom de förstnämnda med ökad ämnesomsättning i ventral ACC och medial OFC (en effekt associerad med begär), medan den senare visade motsatt respons, nämligen minskad ämnesomsättning i dessa regioner (Volkow et al. 2005). Detta antyder att aktiveringen av dessa prefrontala regioner med exponering av läkemedel kan vara specifik för beroende och associerad med den ökade önskan om läkemedlet. Dessutom visade en studie som fick patienter som var beroende av kokain medvetet att hämma begär när de utsattes för läkemedelssiffror att de försökspersoner som lyckades hämma begär visade minskad ämnesomsättning i medial OFC (som behandlar motivationsvärde för en förstärkare) och NAc (som förutspår belöning) (Volkow et al. 2009b). Dessa fynd bekräftar ytterligare involvering av OFC, ACC och striatum i den ökade motivationen att skaffa läkemedlet sett i missbruk.
Förutsägbart har OFC också varit inblandat i att tillskriva livsmedelsförsörjningsvärde (Grabenhorst et al. 2008; Rolls och McCabe 2007), som hjälper till att bedöma dess förväntade behaglighet och smaklighet som en funktion av dess sammanhang. PET-studier med FDG för att mäta hjärnglukosmetabolismen hos individer med normal vikt rapporterade att exponering för matvaror ökade den metaboliska aktiviteten i OFC, vilket var en effekt förknippad med uppfattningen av hunger och önskan efter mat (Wang et al. 2004). Den förbättrade OFC-aktiveringen med livsmedelsstimuleringen återspeglar sannolikt dopaminergiska effekter nedströms och deltar i DA: s engagemang i drivkraften för matkonsumtion. OFC spelar en roll i att lära sig stimulansförstärkande föreningar och konditionering (Cox et al. 2005; Gallagher et al. 1999), stöder konditionerad cue framkallad utfodring (Weingarten 1983), och bidrar antagligen till överätande oavsett hungersignaler (Ogden och Wardle 1990). Faktum är att dysfunktionen i OFC har kopplats till överätande (Machado och Bachevalier 2007).
Trots vissa inkonsekvenser bland studierna stöder data om hjärnavbildning också uppfattningen att strukturella och funktionella förändringar i hjärnregioner som är involverade i exekutiv funktion (inklusive hämmande kontroll) kan vara associerade med hög BMI hos annars friska individer. Till exempel fann en MR-studie som utfördes på äldre kvinnor med voxelbaserad morfometri en negativ korrelation mellan BMI och gråmaterialvolymer (inklusive frontala regioner), som i OFC var förknippade med nedsatt utövande funktion (Walther et al. 2010). Med hjälp av PET för att mäta hjärnglukosmetabolism i friska kontroller rapporterade vi en negativ korrelation mellan BMI och metabolisk aktivitet i DLPFC, OFC och ACC. I denna studie förutsagde den metaboliska aktiviteten i prefrontala regioner individenas prestanda i tester av exekutiv funktion (Volkow et al. 2009c). På liknande sätt visade en nukleär magnetisk resonans (NMR) -spektroskopisk studie i frisk medelålder och äldre kontroller att BMI var negativt associerat med nivåerna av N-acetyl-aspartat (en markör för neuronal integritet) i frontala cortex och ACC (Gazdzinski et al. 2008; Volkow et al. 2009c).
Studier av hjärnavbildning som jämför fetma och mager individer har också rapporterat lägre gråmaterialtäthet i frontala regioner (frontal operculum och mittre frontal gyrus) och i postcentral gyrus och putamen (Pannacciulli et al. 2006). En annan studie hittade inga skillnader i gråmaterialvolymer mellan feta och magra individer. det registrerade en positiv korrelation mellan volym av vit substans i basala hjärnstrukturer och kvot till höftförhållanden, en trend som delvis vändes genom bantning (Haltia et al. 2007b). Intressant nog har kortikala områden, som DPFC och OFC som är involverade i hämmande kontroll, också visat sig aktiveras i framgångsrika dieters som svar på konsumtion av måltider (DelParigi et al. 2007), vilket föreslår ett potentiellt mål för omskolning i beteenden vid behandling av fetma (och även i beroende).
6 Engagemang för interceptiva kretsar
Neuroimaging-studier har visat att den mellersta insulaen spelar en avgörande roll i sugen efter mat, kokain och cigaretter. (Bonson et al. 2002; Pelchat et al. 2004; Wang et al. 2007). Insulans betydelse har framhävts av en studie som rapporterade att rökare med skador på detta område (men inte kontrollerar rökare som hade drabbats av extrainsulära skador) kunde sluta röka enkelt och utan att uppleva någon begär eller återfall (Naqvi et al. . 2007). Insulaen, i synnerhet dess mer främre regioner, är ömsesidigt förbundna med flera limbiska regioner (t.ex. ventromedialt prefrontalt cortex, amygdala och ventral striatum) och verkar ha en interoceptiv funktion, som integrerar den autonoma och viscerala informationen med känslor och motivation, och därmed tillhandahåller medveten medvetenhet om dessa behov (Naqvi och Bechara 2009). Faktum är att hjärnlesionsstudier tyder på att ventromedial PFC och insula är nödvändiga komponenter i de distribuerade kretsarna som stöder emotionellt beslutsfattande (Clark et al. 2008). I överensstämmelse med denna hypotese visar bildbehandlingsstudier konsekvent differentiell aktivering av insulaen under begär (Brody et al. 2009; Goudriaan et al. 2010; Naqvi och Bechara 2009; Wang et al. 1999). Följaktligen har reaktiviteten i denna hjärnregion föreslagits att fungera som en biomarkör för att förutsäga återfall (Janes et al. 2010).
Insula är också ett primärt gustatory område som deltar i många aspekter av ätbeteenden, till exempel smak. Dessutom tillhandahåller den rostrala insulaen (ansluten till primär smakbark) information till OFC som påverkar dess multimodala representation av den behagliga eller belöningsvärdet för inkommande mat (Rolls 2008). På grund av insulans inblandning i den interoceptiva känslan av kroppen, i känslomässig medvetenhet (Craig 2003) och i motivation och känslor (Rolls 2008), kan ett bidrag av insulär nedsättning av fetma förväntas. I själva verket resulterar magstörning i aktivering av den bakre insulaen, vilket sannolikt återspeglar dess roll i medvetenheten om kroppstillstånd (i detta fall av fullhet) (Wang et al. 2008). Vid mager, men inte hos feta individer, resulterade dessutom magstörning i aktivering av amygdala och deaktivering av den främre insulaen (Tomasi et al. 2009). Avsaknaden av amygdala-respons hos överviktiga individer skulle kunna återspegla en trubbig interoceptiv medvetenhet om kroppsliga tillstånd kopplade till mättnad (full mage). Även om DA: s modulering av insulär aktivitet har undersökts dåligt, är det erkänt att DA är involverat i svaret på provsmakning av smakliga livsmedel som förmedlas genom insula (Hajnal och Norgren 2005). Mänskliga avbildningsstudier har visat att smak av smakliga livsmedel aktiverade insula- och mellanhjärnområden (DelParigi et al. 2005; Frank et al. 2008). DA-signalering kan dock också vara nödvändig för att avkänna kaloriinnehållet i maten. Till exempel, när kvinnor med normal vikt smakade ett sötningsmedel med kalorier (sackaros), aktiverades både insula- och dopaminergiska mellanhjärnområden, medan smaken av ett kalorifri sötningsmedel (sukralos) endast aktiverade insula (Frank et al. 2008). Feta personer uppvisar större insulär aktivering än normala kontroller när de smakar på en flytande måltid som består av socker och fett (DelParigi et al. 2005). I motsats härtill visar personer som har återhämtat sig från anorexia nervosa mindre aktivering i insula när de smakade sackaros och ingen förening av känslor av behaglighet med insulär aktivering som observerats i normala kontroller (Wagner et al. 2008). I kombination gör dessa resultat det troligt att dysreglering av insulaen som svar på smakstimuli kan vara involverad i försämrad kontroll av olika aptitliga beteenden.
7 The Circuitry of Aversion
Som nämnts tidigare leder träning (konditionering) på en ledning som förutsäger belöning till dopaminergiska celler som avfyras som svar på förutsägelsen av belöning och inte till belöningen i sig. Å andra sidan och i överensstämmelse med denna logik har det observerats att dopaminerge celler kommer att avfyra mindre än normalt om den förväntade belöningen inte lyckas realisera sig (Schultz et al. 1997). Kumulativa bevis (Christoph et al. 1986; Lisoprawski et al. 1980; Matsumoto och Hikosaka 2007; Nishikawa et al. 1986) pekar på habenulan som en av regionerna som kontrollerar minskningarna i avfyrningen av dopaminerga celler i VTA som kan följa misslyckandet med att få en förväntad belöning (Kimura et al. 2007). Således skulle en förbättrad känslighet för habenulan, som ett resultat av kronisk exponering av läkemedel, kunna ligga till grund för en större reaktivitet mot läkemedelsledningar. Faktum är att aktivering av habenulan, hos personer som är beroende av kokain, har förknippats med beteendemässigt återfall till läkemedel vid exponering av kö (Brown et al. 2011; Zhang et al. 2005). I fallet med nikotin verkar de α5 nikotinreceptorerna i habenulan modulera det aversiva svaret på stora doser nikotin (Fowler et al. 2011); och α5- och α2-receptorerna i habenulan är inblandade i nikotinuttag (Salas et al. 2009). På grund av habenulans motsatta svar på DA-neuronerna för att belöna (deaktivering) och dess aktivering vid exponering för aversiv stimuli, hänvisar vi här till habenulasignaleringen som en som förmedlar en "antireward" -inmatning.
Havsbotten tycks spela en liknande roll när det gäller matbelöning. En mycket smakrik matdiet kan inducera fetma hos råttor, med vikten ökar korrelerande med ökningar i μ-opioid peptidbindning i basolaterala och basomediala amygdala. Intressant nog uppvisade den mediala habenulaen signifikant högre μ-opioidpeptidbindning (med ungefär 40%) efter exponering för den smakliga maten hos de råttor som fick vikt (de som konsumerade mer mat) men inte hos de som inte gjorde det (Smith et al. 2002). Detta antyder att habenulan kan vara involverad i överätning under villkor för tillgång till smaklig mat. Dessutom projicerar neuroner i den rostromediala tegmentala kärnan, som får en viktig insats från den laterala habenulan, till VTA DA-neuroner och aktiveras efter matförsämring (Jhou et al. 2009). Dessa fynd överensstämmer med en roll för habenulan i att förmedla svar på aversiva stimuli eller tillstånd som de som inträffar under bantning eller drogstopp.
Engagemanget av habenulan som ett intilliggande nav i känslomässiga nätverk överensstämmer med tidigare teoretiska beroendemodeller som postulerade sensibiliserade anti-belöningsrespons (medieras genom förbättrad känslighet hos amygdala och ökad signalering om kortikotropinfrisättningsfaktorn) som driver läkemedelsintag i beroende (Koob och Le Moal 2008). Liknande antireward-svar kan också bidra till överdriven matkonsumtion vid fetma.
8 Patologiskt läkemedel och belöning av livsmedel: En uppdaterad fungerande modell
Thans förmåga att motstå lusten att använda ett läkemedel eller äta förbi mättnadspunkten kräver en korrekt funktion av neuronala kretsar som är involverade i top-down-kontroll för att motsätta sig de konditionerade svar som förutsäger belöning från intag av mat / läkemedel och önskan att äta upp mat / läkemedel. Här lyfte vi fram sex av dessa kretsar: belöning / förmåga, konditionering / vanor, hämmande kontroll / verkställande funktion, motivation / drivkraft, interoception, och motvilje undvikande / stressreaktivitet (Fig. 8). Baserat på de avbildningsdata som presenteras här, postulerar vi att det är skillnaden mellan förväntningarna på läkemedels / livsmedelseffekter (konditionerade svar) och de trubbiga neurofysiologiska effekterna som upprätthåller läkemedlet eller överförbrukningen av livsmedel i ett försök att uppnå förväntad belöning. Oavsett om de testades under tidiga eller utdragna perioder med avhållsamhet / bantning visar beroende / överviktiga personer lägre D2R i striatum (inklusive NAc), som är förknippade med minskningar i baslinjeaktiviteten i frontala hjärnregioner som är inblandade i attityd attribut (orbitofrontal cortex) och hämmande kontroll (ACC och DLPFC), vars störningar resulterar i tvång och impulsivitet. Fi princip har bevis också framkommit om interoceptiva och aversiva kretsers roll i de systemiska obalanserna som resulterar i tvångsmässig konsumtion av antingen läkemedel eller mat.
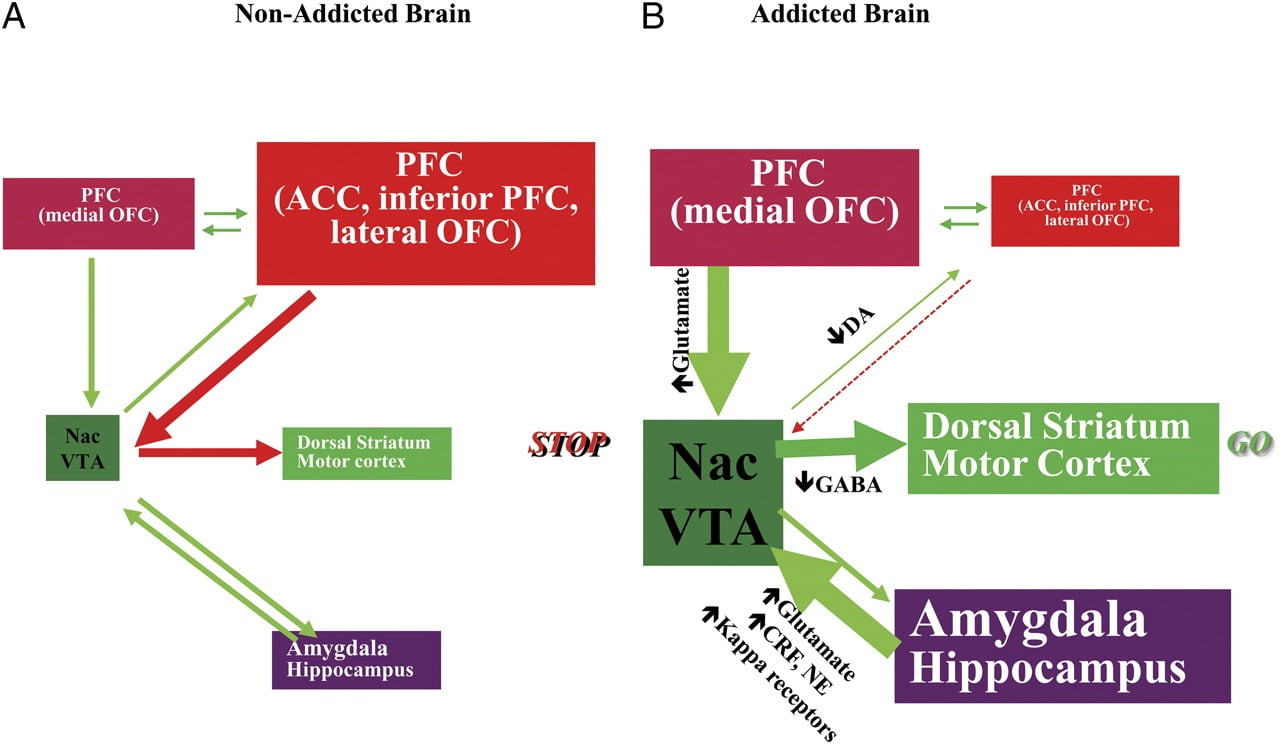
Fig 8 Modell som föreslår ett nätverk av interaktiva kretsar, störningar som bidrar till den komplexa uppsättningen stereotypa beteenden som ligger bakom narkotikamissbruk och kronisk överätande: belöning (nucleus accumbens, VTA och ventral pallidum), konditionering / minne (amygdala, medial OFC för attribution av förmåga, hippocampus och dorsal striatum för vanor), exekutiv kontroll (DLPFC, ACC, inferior frontal cortex och lateral OFC), motivation / drivkraft (medial OFC för attribut till förmåga, ventral ACC, VTA, SN, dorsal striatum och motor cortex). Nac, nucleus accumbens, interoception (Insula och ACC) och aversion / undvikande (Habenula). a När dessa kretsar är balanserade, resulterar detta i korrekt hämmande kontroll och beslutsfattande. b Under beroende, när det förbättrade förväntningsvärdet för läkemedlet i belöning, motivation och minneskretsar övervinner kontrollkretsen, gynnar en positiv återkopplingsslinga initierad av konsumtionen av läkemedlet och upprätthålls av den förbättrade aktiveringen av motivationen / drivningen och minneskretsar. Dessa kretsar interagerar också med kretsar som är involverade i humörreglering, inklusive stressreaktivitet (som involverar amygdala, hypotalamus, habenula) och interoception (som involverar insula och ACC och bidrar till medvetenhet om sug). Flera neurotransmittorer är inblandade i dessa neuroadaptationer, inklusive glutamat, GABA, norepinefrin, kortikotropinfrisättande faktor och opioidreceptorer. CRF, kortikotropinfrisättande faktor; NE, noradrenalin. Ändrad med tillstånd från Volkow et al. (2011b)
Som en följd av den sekventiella störningen i dessa kretsar kan individer uppleva 1) ett ökat motivationsvärde för läkemedlet / maten (sekundärt till lärda föreningar genom konditionering och vanor) på bekostnad av andra förstärkare (sekundär till minskad känslighet hos belöningskretsen ), 2) en nedsatt förmåga att hämma de avsiktliga (målinriktade) åtgärderna som utlöses av den starka önskan att ta läkemedlet / maten (sekundär till nedsatt utövande funktion) som resulterar i tvångsmässigt läkemedels- / mattagande, och 3) förbättrad stressreaktivitet och aversivt undvikande som resulterar i impulsivt läkemedelsintag för att undgå det aversiva tillståndet.
Denna modell föreslår ett mångfaldigt terapeutiskt tillvägagångssätt för beroende utformat för att minska de förstärkande egenskaperna för läkemedel / livsmedel, återupprätta / förbättra de givande egenskaperna hos naturliga förstärkare, hämma konditionerade lärda föreningar, förbättra motivationen för icke-drog / livsmedelsrelaterade aktiviteter, minska stressreaktiviteten , förbättra humöret och stärka den allmänna hämmande kontrollen.
Erkännanden
Författarna vill tacka stödet från NIAAA: s intramurala program från National Institute of Health.
Referensprojekt