Vetenskapliga rapporter volym 9, Artikelnummer: 16918 (2019)
Abstrakt
Överdriven sackaroskonsumtion framkallar ett beroendeliknande begär som kan underbygga fetmaepidemin. Opioider och dopamin förmedlar de givande effekterna av missbruksdroger och naturliga belöningar från stimuli som välsmakande mat. Vi undersökte effekterna av sackaros med PET-avbildning med [11C]karfentanil (μ-opioidreceptoragonist) och [11C]rakloprid (dopamin D2/3-receptorantagonist) i sju sövda Göttingen-minigrisar av honkön. Vi gav sedan minigrisar tillgång till sackaroslösning i en timme under 12 på varandra följande dagar och utförde avbildning igen 24 timmar efter den slutliga sackarosåtkomsten. I ett mindre urval av fem minigrisar utförde vi ytterligare [11C]carfentanil PET-session efter den första sackarosexponeringen. Vi beräknade voxelvisa bindningspotentialer (BPND) använde lillhjärnan som en region av icke-förskjutbar bindning, analyserade skillnader med statistisk icke-parametrisk kartläggning och utförde en regional analys. Efter 12 dagars tillgång till sackaros, BPND av båda spårämnena hade minskat signifikant i striatum, nucleus accumbens, thalamus, amygdala, cingulate cortex och prefrontal cortex, i överensstämmelse med nedreglering av receptordensiteter. Efter en enda exponering för sackaros fann vi minskad bindning av [11C]karfentanil i nucleus accumbens och cingulate cortex, i överensstämmelse med opioidfrisättning. Den lägre tillgängligheten av opioid- och dopaminreceptorer kan förklara den beroendeframkallande potentialen i samband med intag av sackaros.
Beskrivning
Fem procent av världens befolkning är kliniskt överviktiga1. Som ett kännetecken för det metabola syndromet är fetma associerad med typ 2-diabetes, hjärt-kärlsjukdomar, andningsproblem och risk för depression och eventuellt demens2. Den ökade konsumtionen av energitäta livsmedel har överdrivit den fysiologiska skillnaden mellan homeostatisk hunger som följer matbrist och hedonisk hunger, eller "sug", som uppstår i frånvaro av deprivation3,4. Eftersom den homeostatiska regleringen ensam inte kan förklara den nuvarande ökningen av fetma, är det obligatoriskt att testa effekten på hjärnans mekanismer för belöning och njutning av de beroendeframkallande egenskaperna hos mycket välsmakande mat.
Sackaroskonsumtion är förknippat med fetma, och sackaros anses alltmer som ett beroendeframkallande ämne5. Vissa fynd strider mot detta påstående på grund av svårigheter med att separera icke-smaklig matkonsumtion från hedoniska matsvar och att bestämma den beroendeframkallande ingrediensen i bearbetad mat, såväl som de olika mekanismerna genom vilka mat förändrar hjärnans kretsar genom naturliga vägar6. Ändå, i specifika sammanhang, inducerar intag av sackaros belöning och begär, jämförbar i omfattning med de som induceras av beroendeframkallande droger, som leder till överkonsumtion och eventuell fetma6,7.
Hunger är förknippat med "att vilja" som är nära relaterat till effekterna av dopaminerg neurotransmission i ett antal belöningsförhållanden8, men det är fortfarande oklart hur verkan av dopamin (DA) moduleras som svar på tvångsmässigt ätande. Konsumtion av välsmakande mat är kopplat till "tycke", främst förmedlat av det endogena opioidsystemet, särskilt μ-opioidreceptorn (μOR)9,10, vilket kan främja överkonsumtion vid avreglering. I den här rapporten testar vi påståendet att sackaros leder till frisättning av opioid och dopamin som sänker tillgängligheten av μOR- och DA D2/3-receptorer. Tillgängligheten är ett index på antalet lediga receptorer som är tillgängliga för spårämnesbindning och skiljer i princip inte mellan ligandbeläggning och receptordensitet11.
Uppkomsten av tvångsmässigt ätande beror på flera faktorer, och orsaksstudier på människor väcker etiska frågor. Majoriteten av studierna fokuserar därför på ätbeteende hos råttor12. Även om råttor har en "söt tand", skiljer sig deras homeostatiska mekanismer som är viktiga för viktökning, metabolism och typ av fettackumulering avsevärt från människors. Göttingen-minigrisen är ett stort allätande djur med en välutvecklad gyrencefalisk hjärna, som kan avbildas med tillräcklig upplösning. Dess väldefinierade subkortikala och prefrontala kortikala regioner13 möjliggöra en mer direkt översättning till mänsklig hjärnfunktion. Här använder vi positronemissionstomografi (PET) avbildning för att testa in vivo- Tillgänglighet av μOR och DA D2/3 i en minigrismodell av subkronisk sackarosexponering. I ett mindre urval undersökte vi de omedelbara effekterna på μOR-beläggning efter den första exponeringen för sackaros. Slutligen testade vi förhållandet mellan förändringarna i receptortillgänglighet för de två spårämnena.
Resultat
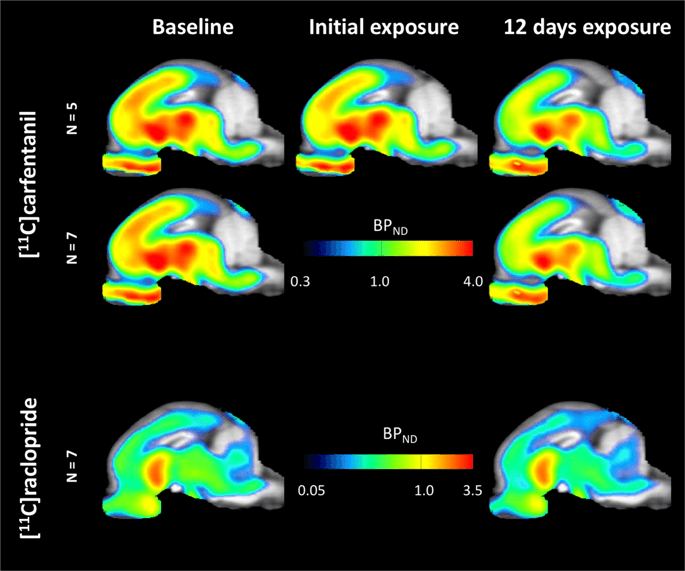
Genomsnittliga parametriska kartor av [11C] karfentanil och [11C]raklopridbindningspotential (BPND) visas i fig. 1. Att analysera förändringarna som inträffade efter den första sackarosexponeringen hos fem minigrisar jämfört med baslinjen och en dag efter de 12th sackarosåtkomst hos sju minigrisar jämfört med baslinjen, vi använde permutationsteori och icke-regionalt begränsad helhjärnaanalys, den föredragna metoden för prover av denna storlek14.
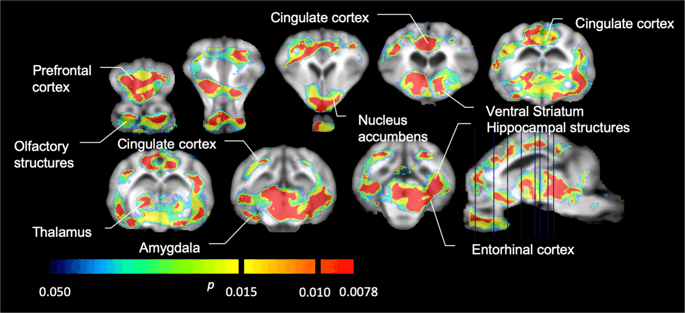
Genomsnittlig voxelvis icke-förskjutbar bindningspotential (BPND) kartor överlagrade på MRI-bilder i sagittal vy. Data presenteras för [11C] karfentanil BPND av de 5 minigrisarna avbildade vid baslinjen, efter initial exponering för sackaros och efter 12 dagars sackarosexponering (översta raden). [11C] karfentanil BPND av alla 7 minigrisar avbildade vid baslinjen och efter 12 dagars sackarosåtkomst presenteras i mittenraden. [11C] racloprid BPND av alla 7 minigrisar avbildade vid baslinjen och efter 12 dagars sackarosåtkomst visas i den nedre raden. Observera att färgskalan är exponentiell för att markera [11C] racloprid BPND i extrastriatal regioner.
Initial sackarosexponering
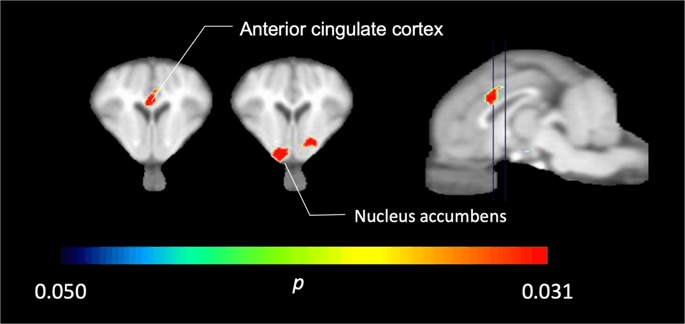
I de fem minigrisarna avbildade med [11C] karfentanil vid baslinjen och omedelbart efter den första sackarosexponeringen, fann vi signifikant minskad spårämnesbindning i den främre cingulate cortex och nucleus accumbens som svar på sackaros, visat i färg i fig. 2, vilket indikerar p < 0.05. Vi upptäckte så mycket som 14 % minskad spårämnesbindning i båda områdena jämfört med baslinjen.
Betydande minskningar i [11C] karfentanil BPND efter den första exponeringen för sackarosvatten jämfört med baslinjen (n = 5). Endast voxlar med signifikanta (p < 0.05) minskningar visas som färgade områden projicerade på T1-viktade MRI-snitt i nivå med den främre cingulate cortex (vänster) och nucleus accumbens (mitten) från en stereotaktisk minigrishjärnatlas. Observera att den maximala signifikansnivån som kan uppnås med 5 djur är 2-5 ≈ 0.031 (se färgfältet). Data presenteras på koronala sektioner av grishjärnan vid de nivåer som anges på den sagittala bilden (höger).
12 dagars tillgång till sackaros
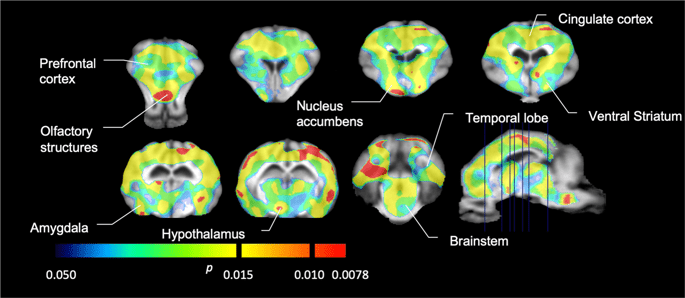
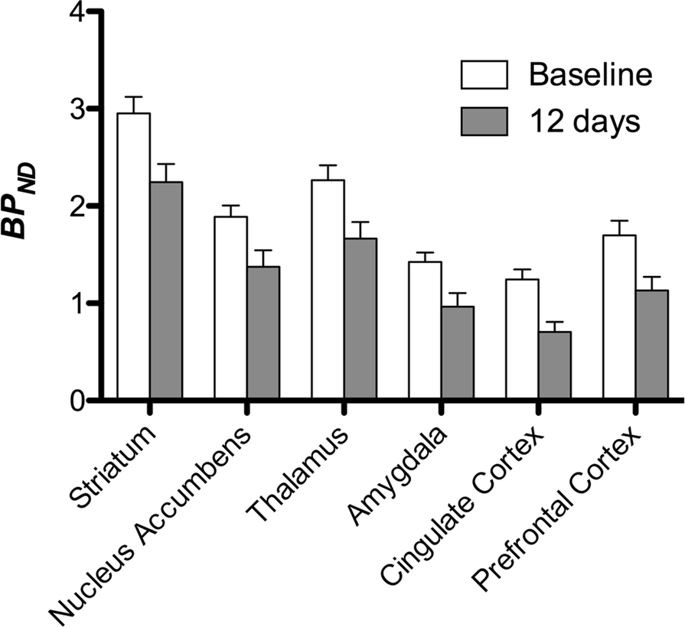
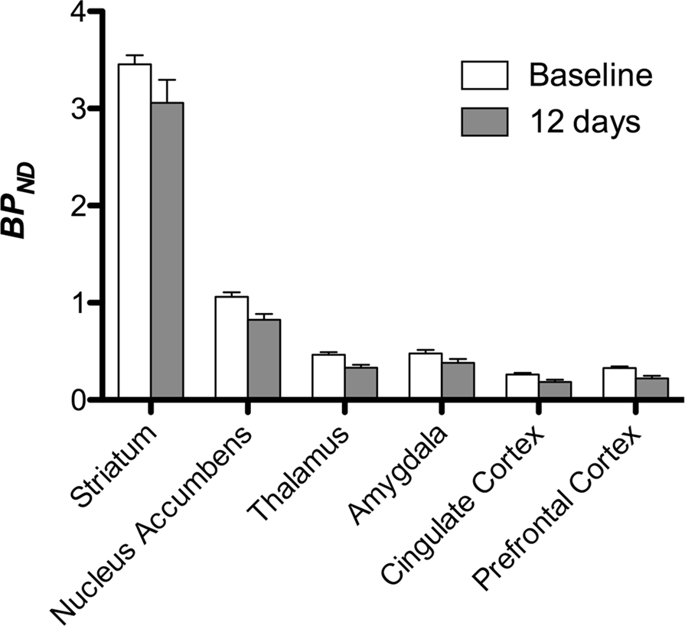
Vi utförde sedan analysen av sju minigrisar avbildade med [11C]karfentanil vid baslinjen och efter 12 dagars tillgång till sackaros och fann signifikant minskad spårämnesbindning hos sackarosexponerade djur jämfört med baslinjen. De mest kraftigt drabbade regionerna visas i rött i fig. 3 (p < 0.01) och inkluderar delar av luktstrukturerna, nucleus accumbens/ventral striatum och tinningbarken/loben, följt av områden som visas i gult (p < 0.015) som inkluderade delar av prefrontal cortex, cingulate cortex, amygdala och hjärnstammen . För att få BPND värden och bedöma procentuell förändring, utförde vi regional analys och fick medelvärden i varje region vid baslinjen och efter sackaroskonsumtion (Fig. 4).
Betydande minskningar i [11C]karfentanilbindningspotential (BPND) mellan baslinjen och efter 12 dagars exponering för sackarosvatten (n = 7). Voxlarna med betydande (p < 0.05) minskningar visas som färgade områden projicerade på T1-viktade MRI-snitt från en stereotaktisk minigrishjärnatlas. Data presenteras på koronala hjärnsektioner på de nivåer som anges på den sagittala bilden (nedre till höger). Observera att den maximala signifikansnivån som kan uppnås med 7 djur är 2-7 ≈ 0.0078 (se färgfältet).
Vi använde [11C] rakloprid som spårämne för DA D2/3-receptorer i striatala och extrastriatala hjärnregioner hos minigrisar vid baslinjen och efter 12 dagars sackarosåtkomst (Fig. 1). Vi fann minskad spårämnesbindning hos sackarosexponerade djur, jämfört med baseline med största effekter (p < 0.01) i områden av prefrontal cortex, nucleus accumbens/ventral striatum, cingulate cortex, amygdala, thalamus, mesencephalon, hippocampusregioner och luktområden (Fikon. 5). Data från regional analys presenteras i fig. 6.
Betydande minskningar i [11C]raklopridbindningspotential (BPND) mellan baslinjen och efter 12 dagars exponering för sackarosvatten (n = 7). Voxlarna med betydande (p < 0.05) minskningar visas som färgade områden projicerade på T1-viktade MRI-snitt från en stereotaktisk minigrishjärnatlas. Data presenteras på koronala sektioner av grishjärnan på de nivåer som anges på den sagittala bilden (nedre till höger). Observera att den maximala signifikansnivån som kan uppnås med 7 djur är 2-7 ≈ 0.0078 (se färgfältet).
Korrelationer mellan [11C] rakloprid och [11C]karfentanildata
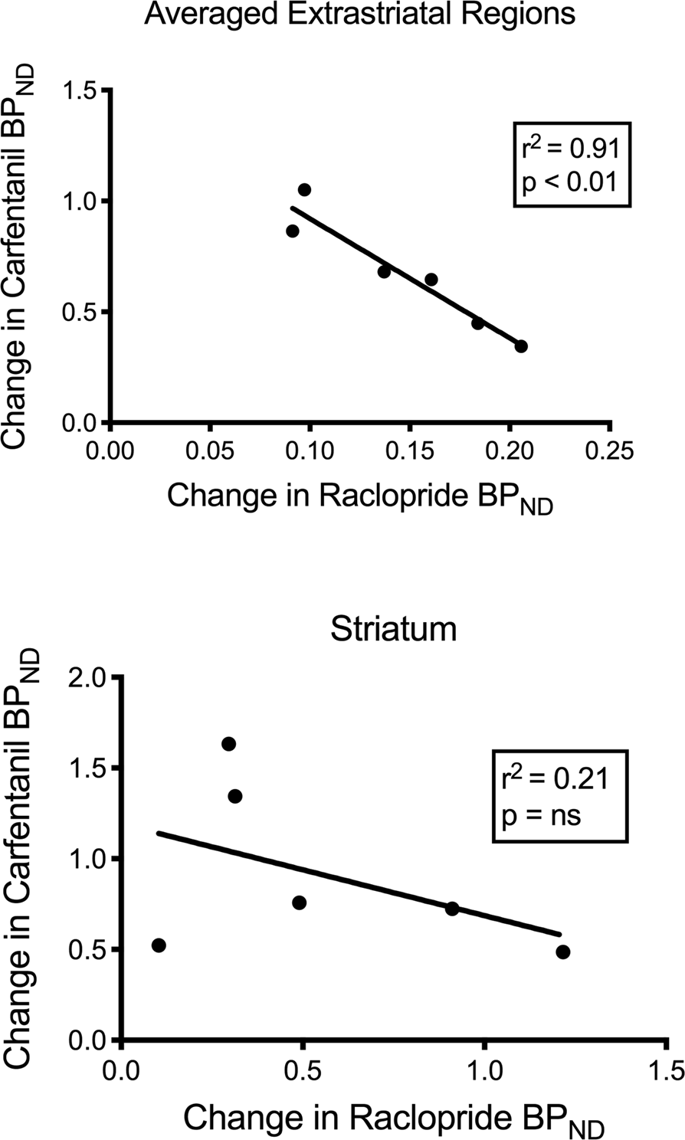
Vi testade den potentiella korrelationen mellan [11C] rakloprid och [11C]karfentanilvärden för BPND i striatala och icke-striatala regioner hos minigrisar vid baslinjen och efter 12 dagars sackarosintag, utan några samband observerade. Vi testade sedan om minskningar av spårämnesbindning var korrelerade, och vi jämförde förändringarna av BPND för [11C]rakloprid med förändringar av BPND för [11C]karfentanil endast hos minigrisar som hade lägre blodtryckND av båda spårämnena efter sackarosintag (n = 6). Vi hittade signifikanta negativa korrelationer i genomsnittliga extrastriatala (r2 = 0.91, p < 0.01), men inte i striatala regioner (Fig. 7).
Korrelationer mellan pre-minus post-nedgångar av [11C] rakloprid och [11C]karfentanilbindningspotentialer (BPND) hos minigrisar med minskad spårämnesbindning efter sackarosintag (n = 6). Data från de genomsnittliga extrastriatala regionerna (överst) och striatum (nederst) presenteras. Bestämningskoefficienten (r2) och p-värdena visas för varje graf.
Diskussion
Vi bestämde effekterna av upprepad intermittent tillgång till sackaros på opioid- och DA-neurotransmission i däggdjurshjärna. Längsgående in vivo- PET-avbildning av μOR- och DA D2/3-receptorerna avslöjade minskad receptortillgänglighet i hela belöningskretsen, inklusive nucleus accumbens, prefrontal cortex och den främre cingulate cortex. Resultaten visar tydligt att sackaros påverkar belöningsmekanismer på ett sätt som liknar det för missbruk av droger.
Intaget av sackaros som ett välsmakande ämne är känt för att frigöra DA och inducera beroende hos gnagare15, med sackaros visat sig vara ännu mer njutbart än kokain hos gnagare i vissa sammanhang. Således arbetar gnagare mer intensivt för att få sackaros än kokain, även i frånvaro av matbrist5. Men effekterna av sackaros regleras både av det homeostatiska systemet och av hedoniska belöningskretsar16,17 som kan förmedla skillnaden mellan näringsmässiga och hedoniska aspekter av sackarosverkan18. Vi valde ett schema på en timme per dag för att främja "binging", eftersom tidigare studier på råttor hade visat ett högre intag under den första timmen av daglig åtkomst i ett intermittent schema15,19. Beteendestudier av födointag är ofta inriktade på djur med föda, men designen behöver inte nödvändigtvis återspegla samma neurala mekanismer som är aktiva vid fetma. Grisar i den föreliggande studien var inte begränsade till mat och fick de vanliga mängderna av sin normala kost utöver tillgång till sackaros.
Opioidreceptorer (OR) uttrycks brett i hjärnan, särskilt i strukturer som är kända för att modulera ät- och belöningsprocesser20. yttersta randområdena har visat sig vara viktiga för de givande och återfallande effekterna av kokain21,22,23,24. Förändringar i bindning har också kopplats till de homeostatiska reaktionerna på att äta och njutningen i samband med välsmakande mat25. Speciellt är att "gilla" mat kopplat till det endogena opioidsystemet, särskilt μOR9,10 i skalet av nucleus accumbens och ventral pallidum26. Infusioner av en μOR-agonist i distinkta delar av nucleus accumbens och ventral pallidum förstärker starkt "gillande" beteenden, inklusive tungutsprång och tassslickning, efter ökat välsmakande intag av mat27,28,29. Ytterligare bevis för opioidsignalering vid bearbetning av hedonisk reglering kommer från μOR-antagonister som dämpar konsumtionen av välsmakande chow i båda AD libitum- utfodrade och matbegränsade djur, men med en mer begränsad effekt på intaget av icke välsmakande standardpellets30,31. Hos människor minskar μOR-antagonister kortsiktigt födointag och minskar behagligheten hos välsmakande livsmedel32,33,34. Opioidsignalering i den basolaterala amygdala bidrar också till att mat "vilja" genom modulering av belöningssökande och matens incitamentvärde35.
Med [11C]carfentanil, fick vi bilder av spårämnesbindning som är känslig både för μOR-nivåer och för hjärnans frisättning av endogena opioider36,37. Vi upptäckte omedelbar förlust av μOR-tillgänglighet i områden av nucleus accumbens och främre cingulate cortex, specifika hjärnregioner av belöningsvägen, efter initial konsumtion av sackaros av fem minigrisar, i överensstämmelse med endogen opioidfrisättning. Tidigare studier har visat att välsmakande mat kan leda till känslor av njutning38 genom att stimulera frisättning av opioid. Efter 12 dagars tillgång till sackaros observerade vi minskad [11C]karfentanilbindning, vilket har flera möjliga förklaringar39 inklusive endogen opioidfrisättning och bindning till μOR, μOR internalisering som ett resultat av ökad opioidbindning och ökad DA D2/3-receptoraktivering som leder till heterolog desensibilisering av μOR40.
Till stöd för föreliggande slutsatser [11C]karfentanilstudier av patienter med bulimi41, fetma42,43,44och hetsätningsstörning45, visar minskad receptortillgänglighet. Detta är dock kroniska tillstånd medan minigrisarna bara fick sackaros i 12 dagar. I en studie av akut matbeteende hos friska män ledde matning till robust och utbredd endogen cerebral opioidfrisättning, både i närvaro och frånvaro av hedonia, vilket tyder på att opioidfrisättning återspeglar metaboliska och homeostatiska, såväl som hedoniska, reaktioner25. Denna studie, tillsammans med en annan som avbildade patienter efter en flytande måltid med chokladsmak44, är direkt relevant för den akuta studien av fem minigrisar efter den första sackarosexponeringen, men skiljer sig från den subkroniska sackarosexponeringsstudien över 12 dagar där den minskade receptortillgängligheten mer sannolikt återspeglar upprepad överstimulering och åtföljande nedreglering av μOR.
Den prefrontala cortexen är viktig i beslutsfattande och för att tillskriva föremål värde och därför kan μOR i den prefrontala cortex vara ansvarig för den förändrade utvärderingen av matens framträdande karaktär, vilket kan öka matens beroendeframkallande potential. Vi har funnit minskad bindning i den prefrontala cortexen, i linje med tidigare studier som visar att diet med hög fetthalt minskar nivåerna av μOR mRNA i den prefrontala cortex46 och att infusion av en μOR-agonist i den prefrontala cortex ökar intaget av söt mat47. Återigen uppstår emellertid frågan huruvida dieten med hög fetthalt är ett mer kroniskt tillstånd som mer sannolikt förmedlar nedreglering av receptorer, jämfört med den kortsiktiga sackaros-utfodringsdesignen, vilket tyder på fördröjd frisättning av endogena opioider som förskjuter spårkarfentanil bundet till μOR även efter 12 dagars sackaros.
DA har varit inblandad i belöningar både från droger och beteende. Kronisk kokainanvändning har visat sig hämma DA-signalering48. DA D1- och D2/3-receptornivåerna förändras av nikotin i grishjärnan49, och hos icke-mänskliga primater med en historia av kokainmissbruk50, i överensstämmelse med nedregleringen av D2/3-receptorer i hjärnan hos mänskliga kokainmissbrukare51,52. När det gäller droger har sackaros visat sig uppreglera DA D1-receptorer19 och öka DA-frisättningen53, förstärker DA:s roll när det gäller "att vilja" i förhållande till välsmakande mat. Tidigare PET-studier har visat en minskning av striatal DA D2/3-receptortillgänglighet vid sjuklig fetma jämfört med genomsnittlig vikt54,55, liknande i storleksordningen minskningen av drogberoende patienter56, och hos djur med modeller av fetma57. I gnagarstudier främjar D2/3-receptornedbrytning i striatum utvecklingen av tvångsmässig matsökning hos råttor med tillgång till välsmakande mat57.
Våra observationer av minskad D2/3-receptortillgänglighet hos grisen kan indikera ökade DA-nivåer som svar på incitamentframträdandet som är förknippat med sackarosintaget eftersom DA frisätts som en del av missbruksdroger och andra njutbara aktiviteter52,58,59,60. Eftersom grisarna sövdes under avbildningen och inte hade fått sackaros på 24 timmar, minskade D2/3 BPND mer sannolikt återspeglar en minskning av antalet receptorer som svar på förlängd ökning av DA-frisättning vid var och en av de 12 dagarna av sackarosåtkomst. Minskningen kan höja trösklarna för hjärnans belöning, associerad med nedreglering av striatala DA D2-receptorer. Detta kan förklara den ökade känsligheten för missbruk av droger som setts i tidigare studier av råttor som överäter sackaros som ledde till korssensibilisering mot kokain, hyperaktivitet efter lågdos amfetamin, ökat alkoholintag när man avstår från sackaros och tolerans mot de smärtstillande effekterna av opiater6.
En tidigare studie av fetma i Göttingen minigris identifierade minskat cerebralt blodflöde i nucleus accumbens, ventral tegmental area (VTA) och prefrontal cortex, med enkel foton emission datortomografi (SPECT) av hjärnan61. I enlighet med dessa fynd observerade vi minskad DA D2/3-bindning i ventroforebrain-regionen som innehåller nucleus accumbens och i prefrontal cortex. Extracellulära nivåer av DA ökar tre gånger i nucleus accumbens efter sackarosintag hos fritt rörliga råttor som genomgår mikrodialys62. Hos sackarosberoende djur kan upprepat sackarosintag leda till frisättning av DA från skalet på nucleus accumbens63. Djur som fick en begränsad diet med begränsad tillgång till sackaros hade lägre DA D2-receptorbindning i nucleus accumbens skal och dorsala striatum64. Begränsade dieter med hög fetthalt och sackaros kan leda till varaktig nedreglering av D1- och D2-receptor-mRNA i nucleus accumbens65. En mikrodialysstudie av effekterna av välsmakande mat avslöjade ökad DA-frisättning i nucleus accumbens och prefrontal cortex när maten fortfarande ansågs ny; när råttorna väl var vana vid den nya maten, avtrubbades den ökade frisättningen i nucleus accumbens, men inte i den prefrontala cortex66. Den differentiella känsligheten för tillvänjning och konditionering av aktiviteten i två regioner kan förklara den större ökningen som observerats i prefrontal cortex än i nucleus accumbens hos minigrisar som exponerats för samma välsmakande substans som förlorade nyhet efter tolv dagar. Men eftersom vi inte avbildade minigrisar med [11C]rakloprid efter den första sackarosadministreringen är denna förklaring spekulativ.
Den prefrontala cortexen modulerar exekutiva funktioner, beslutsfattande och självkontroll67. Dysfunktionell DA-neurotransmission i den prefrontala cortex försämrar moduleringen av belöningsbearbetning, vilket tyder på nedsatt exekutiva funktion och beslutsfattande färdigheter hos överviktiga individer68,69. Dessutom korrelerade en human PET-studie minskad frontal cortex-metabolism med minskad striatal D2-bindning vid fetma70. Här finner vi minskad D2/3-receptortillgänglighet i den prefrontala cortex inklusive orbitofrontal cortex hos grisar som exponerats för sackarosregimen.
Dopaminerga neuroner av VTA skickar projektioner till hippocampus och amygdala, där de stöder vaneliknande beteenden71 och förmedla kodningen och återhämtningen av konditionering till drog72,73 och matköer74,75. Human hjärnavbildning har visat hippocampus aktivering som svar på matbegär och smak76. I överensstämmelse med våra fynd av minskad hippocampus och amygdalar D2/3-receptortillgänglighet som svar på sackaros, kartläggning av mänsklig hjärna med [18F]fallypride visade kokain-cue-inducerad DA-frisättning i amygdala och hippocampus77. I gnagarhjärnor utlöste exponering av kokainsignal DA-frisättning i amygdala78, och förändringar av amygdala DA-nivåer påverkade cue-inducerat kokainsökande beteende79.
I en studie av överviktiga individer stördes sambandet mellan D2/3 och μOR-tillgänglighet, som är känt för att existera i striatala regioner hos magra individer, i ventral striatum80. Vi jämförde värdena för BPND av de två spårämnena för att testa om data reproducerade denna effekt. Till skillnad från magra människor hade grisarnas nuvarande hjärnor ingen korrelation mellan BP-värdenaND av de två spårämnena, vid baslinjen eller efter exponeringen för sackaros. Vi testade sedan om djuren med den största minskningen av spårämnes raclopridbindning också skulle ha den största minskningen av spårämnes karfentanilbindning, men istället hittade vi en negativ korrelation i de genomsnittliga extrastriatala regionerna, vilket tyder på att djur med den största förändringen av bindningspotentialen av spårämne racloprid hade den lägsta förändringen av bindningspotentialen för spårämne karfentanil. Det omvända förhållandet mellan förändringarna tyder på att effekterna av sackarosintag på tillgängligheten av respektive receptorer regleras i motsatta riktningar. Det är känt att överdriven konsumtion av välsmakande mat, eller droger, kan orsakas av att vilja eller tycka om, eller båda60,81. Det är möjligt att storleken på önskan som drivs av dopamin förnekar storleken på tyckandet som drivs av opioider, eller vice versa. Nya bevis pekar på roller för GABAA receptorer i VTA och kolinerga terminaler i striatum och eventuellt cortex som fungerar som växlar mellan dopaminberoende och dopaminoberoende mekanismer för opioidverkan82,83 som kan förklara ömsesidigheten mellan dopamin- och opioideffekter i extrastriatala grisregioner som bestäms här.
En brist hos PET, även hos jämförelsevis stora djur, är den begränsade rumsliga upplösningen av tomografin som påverkar resultaten från små hjärnregioner involverade i matrelaterade beteenden. Men trots dessa farhågor, [11C]raklopridbindning tidigare registrerades både i striatala och extrastriatala regioner84,85,86,87. Användningen av [11C]rakloprid för att märka samma typ av receptorer ger ingen oro för potentiella affinitetsskillnader som kan påverka användningen av separata spårämnen för samma receptorer i olika regioner. Nyligen genomförda studier inkluderade uppgifter om extrastriatal bindning av [11C]rakloprid. Alakurtti et al,. fann god reproducerbarhet av mått på striatal raclopridbindning i striatum, med endast god till måttlig reproducerbarhet i cortex85. I en senare studie, Svensson et al,. diskuterade flera frågor som påverkar användningen av [11C]rakloprid som en markör för extrastriatala D2/3-receptorer i en studie av friska människor, inklusive dålig reproducerbarhet i cortex och begränsad minskning av extrastriatal bindning i frontal cortex som svar på ett D2/3-blockerande medel88. Jämförelserna av test-omtest visade variationer på 4–7 % i striatum och 13–59 % i kortikala regioner, men tiden mellan undersökningarna var i genomsnitt 20 dagar, till skillnad från de mer informativa 1–2 dagarna i de flesta studier. Ett antal faktorer i livet för dessa försökspersoner kan ha haft tid att påverka resultaten. Faktum är att vi visar här att bara tillsats av sackaroskonsumtion till en morgonrutin i 12 dagar kan ha påverkat bindande åtgärder som erhållits två veckor senare. Andra faktorer som är så vanliga som att spela tv-spel, shoppa, gå in i nya romantiska relationer och sexuell aktivitet, använda droger eller ändra kost och motion kan påverka extrastriatala dopaminnivåer med potential för stor variation av datamängder. Den aktuella studien på minigrisar introducerade en välkontrollerad uppsättning där den enda variabeln är frånvaron eller närvaron av sackaros i kosten. I detta sammanhang hade data från sju djur tillräckligt låg variation i relevanta extrastriatala regioner för att identifiera en statistiskt signifikant minskning av bindning som svar på sackaros.
En begränsning av den aktuella studien är användningen av bedövningsmedel som krävs för att säkerställa orörlighet under in vivo- avbildning av djur. Effekterna av specifika anestetika, och deras interaktioner med läkemedel eller andra ingrepp, kan förvirra bindningen av radioligander89,90. Ketamin är ett anti-glutamatergiskt läkemedel med snabba antidepressiva effekter i sub-anestetiska doser91,92,93, som inte minskar striatal [11C]raklopridbindning hos människor94. S-ketamin visade sig dock minska bindningstillgängligheten för dopamin D2/3-receptorer i striatum hos medvetna icke-mänskliga primater95. Isofluran är ett vanligt bedövningsmedel i PET från djur. I tidigare studier fann vi striatal ackumulering av [11C]SCH23390, en radioligand av dopamin D1-receptorerna som är signifikant högre hos minigrisar bedövade med isofluran snarare än propofol, vilket tyder på mottaglighet hos den dopaminerga neurotransmissionen för effekter av anestesi96. I den aktuella studien avbildades alla minigrisar vid båda tidpunkterna under ketaminpremedicinering och isofluranbedövning, vilket gör de nuvarande jämförelserna giltiga.
Slutsats
Överdriven konsumtion av välsmakande mat kan både orsaka, och bli resultatet av, beroende med direkta konsekvenser för hälsan av fetma. Vi testade påståendet att opioider och dopamin förmedlar belöningar, viktiga för överlevnad såväl som för missbruk av droger. Minigrisar med intermittent tillgång till en sackaroslösning under 12 på varandra följande dagar visade minskad tillgänglighet av dopamin D2/3 och μ−opioidreceptorer i striatala och extrastriatala hjärnregioner, vilket antyder att livsmedel med högt innehåll av sackaros påverkar hjärnans belöningskretsar på ett sätt som liknar de som observeras när beroendeframkallande droger konsumeras. Initial enstaka exponering för sackaros överensstämde med frisättning av opioid i hjärnregioner som var aktiva i belöning. Förändringarna av opioid- och dopamintillgänglighet förklarar den beroendeframkallande potentialen hos sackaros som konsumeras i överskott.
Material och metoder
Djuretik
Denna studie godkändes och reglerades av den danska djurförsöksinspektionen och alla försök utfördes i enlighet med 2010/63/EU-direktivet från Europaparlamentet och rådet om skydd av djur som används för vetenskapliga ändamål och ARRIVE-riktlinjerna. Vi använde sju fjorton månader gamla Göttingen-minigrisar (Ellegaard, Dalmose, Danmark). Minigrisar fick en pelletsdiet (6 dL, 2 gånger dagligen, Special Diets Services, Aarhus, Danmark) med kranvatten tillgängligt AD libitum. Omgivningstemperaturen var 20–22 °C, relativ luftfuktighet 50–55 % och luften byttes åtta gånger i timmen.
Intermittent sackaroskonsumtion
Vi avbildade sju minigrisar med [11C] rakloprid och [11C]karfentanil vid baslinjen och igen en dag efter 12 på varandra följande dagar av sackarosvattenexponering. Sackarosexponering bestod av en timmes sackaros (sackaros, Dansukker, Köpenhamn, Danmark) vattentillgång (500 gram sackaros i 2 liter vatten), dagligen under en 12-dagarsperiod. Mängden sackarosintag registrerades och alla minigrisar konsumerade 2 liter varje dag. Vi avbildade också fem av samma minigrisar med [11C]karfentanil, 30 minuter efter den första sackarosåtkomsten, för att studera akut frisättning av opioid.
Minigrisarna gick upp i genomsnitt 13.6 % kroppsvikt från 25.4 kg (±0.73 SEM) vid baslinjen till 28.9 kg (±0.69 SEM) efter 12 dagars sackarosexponering, vilket var signifikant högre (ensidigt t-test, p < 0.001) än de ökningar som observerats i ett urval av kontrollminigrisar som erhållits i tidigare studier, där vikten i genomsnitt ökade med endast 4.9 % under samma utvecklingsperiod.
PET-avbildning av hjärnan
Vi fastade grisar över natten med fri tillgång till vatten före bildtagning. Vi förmedicinerade och bedövade minigrisar som beskrivits tidigare97 och placerade dem liggande i en PET/CT-enhet (Siemens Biograph 64 Truepoint PET). Vi utförde en lågdos CT-skanning före varje PET-förvärv för anatomisk definition och dämpningskorrigering av PET-emissionsdata. Vi administrerade intravenöst [11C]rakloprid vid baslinjen (360 ± 18 MBq, specifik aktivitet 77 ± 76 GBq/μmol, injicerad massa 0.12 ± 0.08 μg/kg) och efter 12 dagars sackaros (374 ± 54 MBq, specifik aktivitet 127 ± 85 GBq/mol, μmol, GBq/kg) injicerad massa 0.06 ± 0.05 μg/kg), och [11C]karfentanil vid baslinjen (377 ± 43 MBq, specifik aktivitet 311 ± 195 GBq/μmol, injicerad massa 0.03 ± 0.02 μg/kg) och efter 12 dagars sackaros (337 ± 71 MBq, specifik aktivitet 177 ± 157, GB) injicerad massa 0.06 ± 0.08 μg/kg) via öronven, i 10 ml koksaltlösning, under den första minuten av en 90-minuters skanning. Vi rekonstruerade PET-data med TrueX 3D OSEM (3 iterationer, 21 delmängder), en 256 × 256 × 109 matris och ett 2-mm Gauss-filter, med en tidsramstruktur på 5 × 60, 3 × 300, 4 × 600 , 2 × 900 sekunder (totalt 14 bilder, 90 minuter). Vid baslinjen och efter 12 dagars sackaros, avbildades minigrisar med båda spårämnena injicerade med minst 100 minuters mellanrum, på grund av halveringstiden för [11C] PET-spårämnen. Efter slutförandet av den sista PET-sessionen avlivade vi minigrisar under djup anestesi genom en intravenös överdos av pentobarbital (100 mg/kg).
Kvantitativa analyser och statistik
Vi utförde förbehandlingssteg med PMOD 3.7 (PMOD Technologies Ltd, Zürich, Schweiz). För att definiera de stereotaktiska transformationsparametrarna från tidsgenomsnittade PET-bilder använde vi ligandspecifika mallar. Vi applicerade de genererade transformationsmatriserna och skevningsfälten på motsvarande dynamiska PET-tidsserier. Vi genererade parametriska bilder av [11C]raklopridbindningspotential (BPND) med hjälp av den multilinjära referensvävnadsmetoden av Ichise och medarbetare98. Vi skapade en skräddarsydd mask av lillhjärnan som uteslöt vermis för att få den cerebellära vävnadens radioaktivitet över tid i en region med försumbar DA D2/3-receptordensitet. Vi genererade parametriska bilder av [11C]karfentanil med användning av en implementering av Logan referensvävnadsmodell99,100 med t* = 30 min. Studier av [11C]karfentanilbindning i mänsklig hjärna har använt occipital cortex som referensregion36; Men hos grisen, enligt tidsaktivitetskurvorna, var den icke-förskjutbara bindningen lägre i lillhjärnan än i den occipitala cortex, vilket överensstämmer med fynden från en autoradiografistudie på råtta101. Vi valde därför lillhjärnan som referensregion i den aktuella studien.
Statistisk analys
Vi utsatte kartor för en voxel-vis analys med statistisk icke-parametrisk kartläggning (SnPM v13.01, http://warwick.ac.uk/snpm) SPM-verktygslåda som använder icke-parametrisk permutationsteori för att tillhandahålla ett ramverk för statistisk slutledning, ett tillvägagångssätt som visat sig fungera bra för små prover på grund av strikt kontroll av falska positiva14 och tillämpas som tidigare beskrivits102. En expert på gris neuroanatomi (DO) jämförde de resulterande bilderna med tröskelvärden på 5 % signifikansnivå med en högupplöst Göttingen minigrisatlas103,104 för att definiera och märka regioner med minskad DA D2/3 och μOR BPND från baslinjen till tillståndet efter sackaros. Vi utförde sedan en region-of-interest (ROI) analys för att extrahera BPND värden för specifika regioner som befunnits vara av intresse baserat på SnPM-analysen, inklusive striatum, nucleus accumbens, thalamus, amygdala, cingulate cortex och prefrontal cortex. Ingen ytterligare statistik utfördes på ROI-analysen, eftersom dessa regioner redan befanns vara signifikanta med SnPM.
Referensprojekt
- 1.
Smyth, S. & Heron, A. Diabetes och fetma: tvillingepidemierna. Nat Med 12, 75-80, https://doi.org/10.1038/nm0106-75 (2006).
- 2.
Flegal, KM, Carroll, MD, Ogden, CL & Curtin, LR Prevalens och trender i fetma bland amerikanska vuxna, 1999–2008. JAMA 303, 235-241, https://doi.org/10.1001/jama.2009.2014 (2010).
- 3.
Davis, CA et al,. Dopamin för "att vilja" och opioider för att "gilla": en jämförelse av feta vuxna med och utan hetsätning. Fetma (Silver Spring) 17, 1220-1225, https://doi.org/10.1038/oby.2009.52 (2009).
- 4.
Drewnowski, A. Fetma och matmiljön: kostens energitäthet och kostkostnader. Amerikansk tidskrift för förebyggande medicin 27, 154-162, https://doi.org/10.1016/j.amepre.2004.06.011 (2004).
- 5.
Lenoir, M., Serre, F., Cantin, L. & Ahmed, SH Intensiv sötma överträffar kokainbelöning. PloS en 2e698, https://doi.org/10.1371/journal.pone.0000698 (2007).
- 6.
Ahmed, S., Avena, NM, Berridge, KC, Gearhardt, A. & Guillem, K. In Neurovetenskap på 21-talet (red. Phaff, DW) (Springer, 2012).
- 7.
Avena, NM, Gold, JA, Kroll, C. & Gold, MS Ytterligare utvecklingar inom neurobiologin för mat och beroende: uppdatering om vetenskapens tillstånd. Kostrådgivning 28, 341-343, https://doi.org/10.1016/j.nut.2011.11.002 (2012).
- 8.
Leyton, M. In Nöjen av hjärnan (red Kringelbach, ML & Berridge, KC) (Oxford University Press, 2010).
- 9.
Nathan, PJ & Bullmore, ET Från smakhedonik till motivationsdrift: centrala mu-opioidreceptorer och hetsätningsbeteende. Int J Neuropsychopharmacol 12, 995-1008, https://doi.org/10.1017/S146114570900039X (2009).
- 10.
Berridge, KC Matbelöning: hjärnans substrat för att vilja och tycka om. Neurovetenskap och biobeteende 20, 1-25 (1996).
- 11.
Gjedde, A., Wong, DF, Rosa-Neto, P. & Cumming, P. Kartläggning av neuroreceptorer på jobbet: om definition och tolkning av bindningspotentialer efter 20 års framsteg. Int Rev Neurobiol 63, 1-20, https://doi.org/10.1016/S0074-7742(05)63001-2 (2005).
- 12.
Avena, NM, Bocarsly, ME & Hoebel, BG Djurmodeller av socker- och fettsjukande: förhållande till matberoende och ökad kroppsvikt. Metoder Mol Biol 829, 351-365, https://doi.org/10.1007/978-1-61779-458-2_23 (2012).
- 13.
Jelsing, J. et al,. Den prefrontala cortexen i Göttingens minigrishjärna definierad av neurala projektionskriterier och cytoarkitektur. Brain Res Bull 70, 322-336, https://doi.org/10.1016/j.brainresbull.2006.06.009 (2006).
- 14.
Nichols, TE & Holmes, AP Icke-parametriska permutationstester för funktionell neuroimaging: en primer med exempel. Hum Brain Mapp 15, 1-25 (2002).
- 15.
Avena, NM, Rada, P. & Hoebel, BG Bevis för sockerberoende: beteendemässiga och neurokemiska effekter av intermittent, överdrivet sockerintag. Neurovetenskap och biobeteende 32, 20-39, https://doi.org/10.1016/j.neubiorev.2007.04.019 (2008).
- 16.
Alonso-Alonso, M. et al,. Matbelöningssystem: nuvarande perspektiv och framtida forskningsbehov. Nutr Rev 73, 296-307, https://doi.org/10.1093/nutrit/nuv002 (2015).
- 17.
Figlewicz, DP, Bennett-Jay, JL, Kittleson, S., Sipols, AJ & Zavosh, A. Självadministrering av sackaros och CNS-aktivering hos råtta. Am J Physiol Regul Integr Comp Physiol 300, R876–884, https://doi.org/10.1152/ajpregu.00655.2010 (2011).
- 18.
Tellez, LA et al,. Separata kretsar kodar sockers hedoniska och näringsmässiga värden. Naturens neurovetenskap 19, 465-470, https://doi.org/10.1038/nn.4224 (2016).
- 19.
Colantuoni, C. et al,. Överdrivet sockerintag förändrar bindningen till dopamin- och mu-opioidreceptorer i hjärnan. Neuroreport 12, 3549-3552 (2001).
- 20.
Pert, CB, Kuhar, MJ & Snyder, SH Opiatreceptor: autoradiografisk lokalisering i råtthjärna. Proc Natl Acad Sci USA 73, 3729-3733 (1976).
- 21.
Soderman, AR & Unterwald, EM Kokainbelöning och hyperaktivitet hos råtta: platser för mu-opioidreceptormodulering. Neuroscience 154, 1506-1516, https://doi.org/10.1016/j.neuroscience.2008.04.063 (2008).
- 22.
Ward, SJ, Martin, TJ & Roberts, DC Beta-funaltrexamin påverkar självadministration av kokain hos råttor som svarar på ett progressivt förstärkningsschema. Farmakologi, biokemi och beteende 75, 301-307 (2003).
- 23.
Schroeder, JA et al,. En roll för mu-opioidreceptorer i kokain-inducerad aktivitet, sensibilisering och belöning hos råttan. Psychopharmacology 195, 265-272, https://doi.org/10.1007/s00213-007-0883-z (2007).
- 24.
Tang, XC, McFarland, K., Cagle, S. & Kalivas, PW Kokain-inducerad återinsättning kräver endogen stimulering av mu-opioidreceptorer i ventral pallidum. Journal of neuroscience: den officiella tidskriften för Society for Neuroscience 25, 4512-4520, https://doi.org/10.1523/JNEUROSCI.0685-05.2005 (2005).
- 25.
Tuulari, JJ et al,. Matning frisätter endogena opioider hos människor. J Neurosci 37, 8284-8291, https://doi.org/10.1523/JNEUROSCI.0976-17.2017 (2017).
- 26.
Smith, KS & Berridge, KC Opioid limbisk krets för belöning: interaktion mellan hedoniska hotspots av nucleus accumbens och ventral pallidum. J Neurosci 27, 1594-1605, https://doi.org/10.1523/JNEUROSCI.4205-06.2007 (2007).
- 27.
Pecina, S. & Berridge, KC Opioidplats i nucleus accumbens skal förmedlar ätning och hedonisk "tycke" för mat: karta baserad på mikroinjektion Fos-plymer. Brain Res 863, 71-86 (2000).
- 28.
Zhang, M. & Kelley, AE Intaget av sackarin-, salt- och etanollösningar ökar genom infusion av en mu-opioidagonist i nucleus accumbens. Psychopharmacology 159, 415-423, https://doi.org/10.1007/s00213-001-0932-y (2002).
- 29.
Zhang, M., Gosnell, BA & Kelley, AE Intag av mat med hög fetthalt förbättras selektivt genom stimulering av mu-opioidreceptorer i nucleus accumbens. The Journal of pharmacology and experimental therapeutics 285, 908-914 (1998).
- 30.
Levine, AS, Weldon, DT, Grace, M., Cleary, JP & Billington, CJ Naloxon blockerar den del av utfodringen som drivs av söt smak hos råttor med begränsad mat. Am J Physiol 268R248-252 (1995).
- 31.
Glass, MJ, Billington, CJ & Levine, AS Opioider och födointag: distribuerade funktionella neurala vägar? neuropeptider 33, 360-368, https://doi.org/10.1054/npep.1999.0050 (1999).
- 32.
Fantino, M., Hosotte, J. & Apfelbaum, M. En opioidantagonist, naltrexon, minskar preferensen för sackaros hos människor. Am J Physiol 251, R91–96, https://doi.org/10.1152/ajpregu.1986.251.1.R91 (1986).
- 33.
Arbisi, PA, Billington, CJ & Levine, AS Effekten av naltrexon på smakdetektering och igenkänningströskel. Aptit 32, 241-249, https://doi.org/10.1006/appe.1998.0217 (1999).
- 34.
Drewnowski, A., Krahn, DD, Demitrack, MA, Nairn, K. & Gosnell, BA Naloxone, en opiatblockerare, minskar konsumtionen av söt mat med hög fetthalt hos feta och magra kvinnliga hetsätare. Am J Clin Nutr 61, 1206-1212 (1995).
- 35.
Wassum, KM, Ostlund, SB, Maidment, NT & Balleine, BW Distinkta opioidkretsar bestämmer smakligheten och önskvärdheten av givande händelser. Proc Natl Acad Sci USA 106, 12512-12517, https://doi.org/10.1073/pnas.0905874106 (2009).
- 36.
Colasanti, A. et al,. Endogen frisättning av opioid i det mänskliga hjärnans belöningssystem inducerad av akut amfetaminadministration. Biolpsykiatri 72, 371-377, https://doi.org/10.1016/j.biopsych.2012.01.027 (2012).
- 37.
Mick, jag. et al,. Amfetamininducerad endogen opioidfrisättning i den mänskliga hjärnan upptäckt med [11C]carfentanil PET: replikering i en oberoende kohort. Int J Neuropsychopharmacol, 1-6, https://doi.org/10.1017/S1461145714000704 (2014).
- 38.
Yeomans, MR & Gray, RW Opioidpeptider och kontroll av mänskligt förtäringsbeteende. Neurovetenskap och biobeteende 26, 713-728 (2002).
- 39.
Sprenger, T., Berthele, A., Platzer, S., Boecker, H. & Tolle, TR Vad ska man lära sig av in vivo- opioidergisk hjärnavbildning? Eur J Pain 9, 117-121, https://doi.org/10.1016/j.ejpain.2004.07.010 (2005).
- 40.
Unterwald, EM & Cuntapay, M. Dopamin-opioidinteraktioner i råttstriatum: en modulerande roll för dopamin D1-receptorer i delta-opioidreceptormedierad signaltransduktion. Neuro 39, 372-381 (2000).
- 41.
Bencherif, B. et al,. Regional mu-opioidreceptorbindning i insulär cortex minskar vid bulimia nervosa och korrelerar omvänt med fastebeteende. Journal of nuclear medicine: officiell publikation, Society of Nuclear Medicine 46, 1349-1351 (2005).
- 42.
Karlsson, HK et al,. Fetma är associerad med minskad mu-opioid men oförändrad dopamin D2-receptortillgänglighet i hjärnan. J Neurosci 35, 3959-3965, https://doi.org/10.1523/JNEUROSCI.4744-14.2015 (2015).
- 43.
Karlsson, HK et al,. Viktminskning efter bariatrisk operation normaliserar hjärnans opioidreceptorer vid sjuklig fetma. Mol psykiatri 21, 1057-1062, https://doi.org/10.1038/mp.2015.153 (2016).
- 44.
Burghardt, PR, Rothberg, AE, Dykhuis, KE, Burant, CF & Zubieta, JK Endogena opioidmekanismer är inblandade i fetma och viktminskning hos människor. J Clin Endocrinol Metab 100, 3193-3201, https://doi.org/10.1210/jc.2015-1783 (2015).
- 45.
Majuri, J. et al,. Dopamin och opioidneurotransmission i beteendeberoende: En jämförande PET-studie i patologiskt spelande och hetsätning. Neuropsychopharmacology 42, 1169-1177, https://doi.org/10.1038/npp.2016.265 (2017).
- 46.
Vucetic, Z., Kimmel, J. & Reyes, TM Kronisk högfettsdiet driver postnatal epigenetisk reglering av mu-opioidreceptorn i hjärnan. Neuropsychopharmacology: officiell publikation av American College of Neuropsychopharmacology 36, 1199-1206, https://doi.org/10.1038/npp.2011.4 (2011).
- 47.
Mena, JD, Sadeghian, K. & Baldo, BA Induktion av hyperfagi och kolhydratintag genom mu-opioidreceptorstimulering i avgränsade regioner av frontal cortex. Journal of neuroscience: den officiella tidskriften för Society for Neuroscience 31, 3249-3260, https://doi.org/10.1523/JNEUROSCI.2050-10.2011 (2011).
- 48.
Park, K., Volkow, ND, Pan, Y. & Du, C. Kroniskt kokain dämpar dopaminsignalering under kokainförgiftning och obalanserar D1 över D2-receptorsignalering. Journal of neuroscience: den officiella tidskriften för Society for Neuroscience 33, 15827-15836, https://doi.org/10.1523/JNEUROSCI.1935-13.2013 (2013).
- 49.
Cumming, P. et al,. Effekter av akut nikotin på hemodynamik och bindning av [11C]rakloprid till dopamin D2,3-receptorer i gris hjärna. Neuroimage 19, 1127-1136 (2003).
- 50.
Moore, RJ, Vinsant, SL, Nader, MA, Porrino, LJ & Friedman, DP Effekt av självadministration av kokain på dopamin D2-receptorer hos rhesusapor. Synapsen 30, 88–96, doi:10.1002/(SICI)1098-2396(199809)30:1<88::AID-SYN11>3.0.CO;2-L (1998).
- 51.
Volkow, ND et al,. Kokainsignaler och dopamin i dorsal striatum: mekanism för begär i kokainberoende. Journal of neuroscience: den officiella tidskriften för Society for Neuroscience 26, 6583-6588, https://doi.org/10.1523/JNEUROSCI.1544-06.2006 (2006).
- 52.
Wong, DF et al,. Ökad beläggning av dopaminreceptorer i mänskligt striatum under cue-framkallat kokainbegär. Neuropsychopharmacology 31, 2716-2727, https://doi.org/10.1038/sj.npp.1301194 (2006).
- 53.
Hajnal, A., Smith, GP & Norgren, R. Oral sackarosstimulering ökar accumbens dopamin hos råtta. Am J Physiol Regul Integr Comp Physiol 286, R31–37, https://doi.org/10.1152/ajpregu.00282.2003 (2004).
- 54.
Volkow, ND, Fowler, JS, Wang, GJ, Baler, R. & Telang, F. Imaging dopamin roll i drogmissbruk och beroende. Neuro 56(bilaga 1), 3–8, https://doi.org/10.1016/j.neuropharm.2008.05.022 (2009).
- 55.
Wang, GJ et al,. Hjärndopamin och fetma. Lansetten 357, 354-357 (2001).
- 56.
Wang, GJ, Volkow, ND, Thanos, PK & Fowler, JS Likhet mellan fetma och drogberoende bedömd av neurofunktionell avbildning: en konceptgranskning. Journal of beroendesjukdomar 23, 39-53, https://doi.org/10.1300/J069v23n03_04 (2004).
- 57.
Johnson, PM & Kenny, PJ Dopamin D2-receptorer i missbruksliknande belöningsdysfunktion och tvångsmässigt ätande hos överviktiga råttor. Naturens neurovetenskap 13, 635-641, https://doi.org/10.1038/nn.2519 (2010).
- 58.
Berridge, KC & Kringelbach, ML Affektiv neurovetenskap av njutning: belöning hos människor och djur. Psychopharmacology 199, 457-480, https://doi.org/10.1007/s00213-008-1099-6 (2008).
- 59.
Berridge, KC & Kringelbach, ML Njutningssystem i hjärnan. Neuron 86, 646-664, https://doi.org/10.1016/j.neuron.2015.02.018 (2015).
- 60.
Schultz, W. Prediktiv belöningssignal för dopaminneuroner. J Neurophysiol 80, 1-27, https://doi.org/10.1152/jn.1998.80.1.1 (1998).
- 61.
Val-Laillet, D., Layec, S., Guerin, S., Meurice, P. & Malbert, CH Förändringar i hjärnaktivitet efter en dietinducerad fetma. Fetma 19, 749-756, https://doi.org/10.1038/oby.2010.292 (2011).
- 62.
Hajnal, A. & Norgren, R. Accumbens dopaminmekanismer vid sackarosintag. Brain Res 904, 76-84 (2001).
- 63.
Rada, P., Avena, NM & Hoebel, BG Dagligt hetsande av socker frisätter upprepade gånger dopamin i ackumbens skal. Neuroscience 134, 737-744, https://doi.org/10.1016/j.neuroscience.2005.04.043 (2005).
- 64.
Bello, NT, Lucas, LR & Hajnal, A. Upprepad sackarosåtkomst påverkar dopamin D2-receptordensiteten i striatum. Neuroreport 13, 1575-1578 (2002).
- 65.
Alsio, J. et al,. Dopamin D1-receptorgenuttrycket minskar i nucleus accumbens vid långvarig exponering för välsmakande mat och skiljer sig beroende på diet-inducerad fetma-fenotyp hos råttor. Neuroscience 171, 779-787, https://doi.org/10.1016/j.neuroscience.2010.09.046 (2010).
- 66.
Bassareo, V. & Di Chiara, G. Differentiell påverkan av associativa och ickeassociativa inlärningsmekanismer på lyhördheten hos prefrontal och ackumbal dopaminöverföring till matstimuli hos råttor som matas ad libitum. J Neurosci 17, 851-861 (1997).
- 67.
Volkow, ND, Wang, GJ, Tomasi, D. & Baler, RD Obalanserade neuronala kretsar i missbruk. Curr Opin Neurobiol 23, 639-648, https://doi.org/10.1016/j.conb.2013.01.002 (2013).
- 68.
Brogan, A., Hevey, D. & Pignatti, R. Anorexi, bulimi och fetma: delade beslutsunderskott på Iowa Gambling Task (IGT). J Int Neuropsychol Soc 16, 711-715, https://doi.org/10.1017/S1355617710000354 (2010).
- 69.
Davis, C., Levitan, RD, Muglia, P., Bewell, C. & Kennedy, JL. Beslutsunderskott och överätande: en riskmodell för fetma. Obes Res 12, 929-935, https://doi.org/10.1038/oby.2004.113 (2004).
- 70.
Volkow, ND et al,. Låga dopamin striatala D2-receptorer är associerade med prefrontal metabolism hos överviktiga personer: möjliga bidragande faktorer. Neuroimage 42, 1537-1543, https://doi.org/10.1016/j.neuroimage.2008.06.002 (2008).
- 71.
Lingawi, NW & Balleine, BW Amygdalas centrala kärna interagerar med dorsolateral striatum för att reglera förvärvet av vanor. J Neurosci 32, 1073-1081, https://doi.org/10.1523/JNEUROSCI.4806-11.2012 (2012).
- 72.
Grant, S. et al,. Aktivering av minneskretsar under cue-framkallat kokainbegär. Proc Natl Acad Sci USA 93, 12040-12045 (1996).
- 73.
Barnklänning, AR et al,. Limbisk aktivering under cue-inducerat kokainbegär. Am J Psykiatri 156, 11-18, https://doi.org/10.1176/ajp.156.1.11 (1999).
- 74.
Mahler, SV & Berridge, KC Vad och när ska man "vill"? Amygdala-baserad fokusering av incitamentframträdande på socker och sex. Psychopharmacology 221, 407-426, https://doi.org/10.1007/s00213-011-2588-6 (2012).
- 75.
Koob, GF & Volkow, ND Neurobiologi av beroende: en neurokretsanalys. Lancet Psychiatry 3, 760-773, https://doi.org/10.1016/S2215-0366(16)00104-8 (2016).
- 76.
Haase, L., Cerf-Ducastel, B. & Murphy, C. Kortikal aktivering som svar på rena smakstimuli under de fysiologiska tillstånden av hunger och mättnad. Neuroimage 44, 1008-1021, https://doi.org/10.1016/j.neuroimage.2008.09.044 (2009).
- 77.
Fotos, A. et al,. Kokain cue-inducerad dopaminfrisättning i amygdala och hippocampus: en högupplöst PET [(1)(8)F]fallypride-studie i kokainberoende deltagare. Neuropsychopharmacology 38, 1780-1788, https://doi.org/10.1038/npp.2013.77 (2013).
- 78.
Weiss, F. et al,. Kontroll av kokainsökande beteende genom drogassocierade stimuli hos råttor: effekter på återhämtning av släckta operant-reagerande och extracellulära dopaminnivåer i amygdala och nucleus accumbens. Proc Natl Acad Sci USA 97, 4321-4326 (2000).
- 79.
Berglind, WJ, Case, JM, Parker, MP, Fuchs, RA & See, RE Dopamin D1- eller D2-receptorantagonism inom den basolaterala amygdala förändrar differentiellt förvärvet av kokain-cue-föreningar som är nödvändiga för cue-inducerad återupprättande av kokainsökning. Neuroscience 137, 699-706, https://doi.org/10.1016/j.neuroscience.2005.08.064 (2006).
- 80.
Tuominen, L. et al,. Avvikande mesolimbisk dopamin-opiatinteraktion vid fetma. Neuroimage 122, 80-86, https://doi.org/10.1016/j.neuroimage.2015.08.001 (2015).
- 81.
Schultz, W. Beteende dopaminsignaler. Trender Neurosci 30, 203-210, https://doi.org/10.1016/j.tins.2007.03.007 (2007).
- 82.
Ting, AKR & van der Kooy, D. The neurobiology of opiat motivation. Cold Spring Harb Perspect Med 2, https://doi.org/10.1101/cshperspect.a012096 (2012).
- 83.
Mamaligas, AA, Cai, Y. & Ford, CP Nikotin- och opioidreceptorreglering av striatal dopamin D2-receptormedierad överföring. Sci Rep 6, 37834, https://doi.org/10.1038/srep37834 (2016).
- 84.
Nomura, Y. et al,. Åldersrelaterad nedgång av dopamin D2/3-receptortillgänglighet mätt med [C-11]rakloprid i icke-striatala mänskliga hjärnregioner: Jämförelse av fyra metoder. Neuroimage 41, T133–T133, https://doi.org/10.1016/j.neuroimage.2008.04.101 (2008).
- 85.
Alakurtti, K. et al,. Långtidstest-retesttillförlitlighet av striatal och extrastriatal dopamin D2/3-receptorbindning: studie med [(11)C]rakloprid och högupplöst PET. J Cereb Blood Flow Metab 35, 1199-1205, https://doi.org/10.1038/jcbfm.2015.53 (2015).
- 86.
Piccini, P., Pavese, N. & Brooks, DJ Endogen frisättning av dopamin efter farmakologiska utmaningar vid Parkinsons sjukdom. Ann Neurol 53, 647-653, https://doi.org/10.1002/ana.10526 (2003).
- 87.
Sawamoto, N. et al,. Kognitiva brister och striato-frontal dopaminfrisättning vid Parkinsons sjukdom. Hjärna 131, 1294-1302, https://doi.org/10.1093/brain/awn054 (2008).
- 88.
Svensson, JE et al,. Validitet och tillförlitlighet av extrastriatal [(11)C]raklopridbindande kvantifiering i den levande mänskliga hjärnan. Neuroimage, 116143, https://doi.org/10.1016/j.neuroimage.2019.116143 (2019).
- 89.
Tsukada, H. et al,. Isoflurananestesi förstärker de hämmande effekterna av kokain och GBR12909 på dopamintransportör: PET-studier i kombination med mikrodialys i aphjärnan. Brain Res 849, 85-96 (1999).
- 90.
Hassoun, W. et al,. PET-studie av [11C]raklopridbindningen i striatum hos den vakna katten: effekter av anestetika och rollen av cerebralt blodflöde. European Journal of Nuclear Medicine and Molecular Imaging 30, 141-148, https://doi.org/10.1007/s00259-002-0904-4 (2003).
- 91.
Serafini, G., Howland, RH, Rovedi, F., Girardi, P. & Amore, M. Ketamins roll i behandlingsresistent depression: en systematisk översikt. Curr Neuropharmacol 12, 444-461, https://doi.org/10.2174/1570159X12666140619204251 (2014).
- 92.
Berman, RM et al,. Antidepressiva effekter av ketamin hos deprimerade patienter. Biolpsykiatri 47, 351-354 (2000).
- 93.
Browne, CA & Lucki, I. Antidepressiva effekter av ketamin: mekanismer bakom snabbverkande nya antidepressiva medel. Front Pharmacol 4, 161, https://doi.org/10.3389/fphar.2013.00161 (2013).
- 94.
Aalto, S. et al,. Ketamin minskar inte striatal dopamin D2-receptorbindning hos människa. Psychopharmacology 164, 401-406, https://doi.org/10.1007/s00213-002-1236-6 (2002).
- 95.
Hashimoto, K., Kakiuchi, T., Ohba, H., Nishiyama, S. & Tsukada, H. Reduktion av dopamin D2/3-receptorbindning i striatum efter en enda administrering av esketamin, men inte R-ketamin: en PET studera på medvetna apor. Eur Arch Psychiatry Clin Neurosci 267, 173-176, https://doi.org/10.1007/s00406-016-0692-7 (2017).
- 96.
Alstrup, AK et al,. Effekter av anestesi och arter på upptag eller bindning av radioligander in vivo- i Göttingens minigris. BioMed forskning internationellt 2013, 808713, https://doi.org/10.1155/2013/808713 (2013).
- 97.
Lillethorup, TP et al,. Longitudinell monoaminerg PET-avbildning av kronisk proteasomhämning hos minigrisar. Sci Rep 8, 15715, https://doi.org/10.1038/s41598-018-34084-5 (2018).
- 98.
Ichise, M., Toyama, H., Innis, RB & Carson, RE Strategier för att förbättra neuroreceptorparameteruppskattning genom linjär regressionsanalys. J Cereb Blood Flow Metab 22, 1271-1281, https://doi.org/10.1097/01.WCB.0000038000.34930.4E (2002).
- 99.
Logan, J. et al,. Distributionsvolymförhållanden utan blodprov från grafisk analys av PET-data. J Cereb Blood Flow Metab 16, 834-840, https://doi.org/10.1097/00004647-199609000-00008 (1996).
- 100.
Endres, CJ, Bencherif, B., Hilton, J., Madar, I. & Frost, JJ Kvantifiering av hjärnans mu-opioidreceptorer med [11C]karfentanil: referensvävnadsmetoder. Nucl Med Biol 30, 177-186 (2003).
- 101.
Panksepp, J. & Bishop, P. En autoradiografisk karta över (3H)diprenorfinbindning i råtthjärna: effekter av social interaktion. Brain Res Bull 7, 405-410 (1981).
- 102.
Landau, AM et al,. Elektrokonvulsiv stimulering påverkar differentiellt [(11)C]MDL100,907-bindning till kortikala och subkortikala 5HT2A-receptorer i grishjärna. J Psychopharmacol, 269881119836212, https://doi.org/10.1177/0269881119836212 (2019).
- 103.
Bjarkam, CR, Glud, AN, Orlowski, D., Sorensen, JCH & Palomero-Gallagher, N. Telencephalon av Göttingen-minigrisen, cytoarkitektur och kortikal ytanatomi. Brain Struct Funct 222, 2093-2114, https://doi.org/10.1007/s00429-016-1327-5 (2017).
- 104.
Orlowski, D., Glud, AN, Palomero-Gallagher, N., Sorensen, JCH & Bjarkam, CR Online histologisk atlas över Göttingens minigrishjärna. Heliyon 5e01363, https://doi.org/10.1016/j.heliyon.2019.e01363 (2019).
Tack
Ett ”AU Ideas Project Development Grant” från Aarhus Universitet till AML finansierade studien. Vi är tacksamma för det tekniska stödet från personalen på Aarhus Universitetssjukhus PET Center och Aarhus Universitetsgård för hjälp med behandlingen av djuren. Vi tackar professor Morten Kringelbach, professor Jørgen Scheel-Kruger och docent Arne Møller för hjälpen med initieringen av dessa studier.
Etiska förklaringar
Konkurrerande intressen
Författarna förklarar inga konkurrerande intressen.
Ytterligare information
Förlagets anteckning Springer Nature är fortsatt neutral när det gäller jurisdiktionsanspråk i publicerade kartor och institutionella anslutningar.
Rättigheter och behörigheter
Open Access Den här artikeln är licensierad under en Creative Commons Attribution 4.0 International License, som tillåter användning, delning, anpassning, distribution och reproduktion i vilket medium eller format som helst, så länge du ger lämplig kredit till den eller de ursprungliga författaren och källan, tillhandahåller en länk till Creative Commons-licensen och ange om ändringar har gjorts. Bilderna eller annat material från tredje part i denna artikel ingår i artikelns Creative Commons-licens, om inte annat anges i en kreditgräns till materialet. Om material inte ingår i artikelns Creative Commons-licens och din avsedda användning inte är tillåten enligt lagstadgade regler eller överskrider den tillåtna användningen, måste du få tillstånd direkt från upphovsrättsinnehavaren. För att se en kopia av denna licens, besök http://creativecommons.org/licenses/by/4.0/.