Dialogues Clin Neurosci 2013 Dec;15(4):431-43.
นามธรรม
แม้ความสำคัญของปัจจัยด้านจิตสังคมหลายประการที่เป็นแกนหลักของการติดยาเสพติดเกี่ยวข้องกับกระบวนการทางชีวภาพ: ความสามารถในการสัมผัสกับยาเสพติดซ้ำเพื่อกระตุ้นให้เกิดการเปลี่ยนแปลงในสมองที่มีช่องโหว่ที่ผลักดันการค้นหาและรับยาเสพติด มากกว่าการใช้ยาที่กำหนดสถานะของการติดยาเสพติด ที่นี่เราตรวจสอบประเภทของการดัดแปลงโมเลกุลและเซลล์ที่เกิดขึ้นในพื้นที่สมองที่เฉพาะเจาะจงเพื่อเป็นสื่อกลางความผิดปกติของพฤติกรรมติดยาเสพติดที่เกี่ยวข้อง เหล่านี้รวมถึงการเปลี่ยนแปลงในการแสดงออกของยีนที่ประสบความสำเร็จส่วนหนึ่งผ่านกลไก epigenetic ปั้นในการทำงาน neurophysiological ของเซลล์ประสาทและประสาทและพลาสติกที่เกี่ยวข้องในการถ่ายทอดทางสัณฐานวิทยาของเส้นประสาทและ synaptic ในส่วนโดยการเปลี่ยนสัญญาณปัจจัย neurotrophic การปรับเปลี่ยนยากระตุ้นแต่ละประเภทเหล่านี้สามารถดูได้ในรูปแบบของ "หน่วยความจำระดับเซลล์หรือโมเลกุล" ยิ่งไปกว่านั้นเป็นที่น่าสังเกตว่ารูปแบบที่เกี่ยวข้องกับการเสพติดส่วนใหญ่มีลักษณะคล้ายกับประเภทพลาสติกที่เกี่ยวข้องกับรูปแบบคลาสสิกของ“ หน่วยความจำพฤติกรรม” ซึ่งอาจสะท้อนถึงขอบเขตอัน จำกัด ของกลไกการปรับตัวที่มีอยู่ในเซลล์ประสาทเมื่อเผชิญกับสิ่งแวดล้อม ความท้าทาย ในที่สุดโมเลกุลที่เกี่ยวข้องกับการติดยาเสพติดและการปรับตัวที่เกี่ยวข้องกับส่วนใหญ่ของสมองส่วนที่ไกล่เกลี่ยรูปแบบคลาสสิกของหน่วยความจำมากขึ้นสอดคล้องกับมุมมองที่ความทรงจำที่ผิดปกติเป็นตัวขับเคลื่อนสำคัญของอาการติดยาเสพติด เป้าหมายของการศึกษาเหล่านี้ซึ่งมีวัตถุประสงค์เพื่ออธิบายพื้นฐานของโมเลกุลและเซลล์ของการติดยาเสพติดคือการพัฒนาการทดสอบวินิจฉัยทางชีววิทยาและการรักษาที่มีประสิทธิภาพมากขึ้นสำหรับความผิดปกติของการติดยา
บทนำ
การติดยาเสพติดซึ่งสามารถนิยามได้ว่าเป็นการแสวงหาและรับยาแม้จะมีผลกระทบที่น่ากลัวหรือการสูญเสียการควบคุมการใช้ยาเกิดจากการเปลี่ยนแปลงที่เกิดจากยาในระยะยาวที่เกิดขึ้นในสมอง1 อย่างไรก็ตามมีเพียงบางคนเท่านั้นที่ยอมแพ้ในการเผชิญกับการสัมผัสกับยาซ้ำหลายครั้งในขณะที่คนอื่น ๆ สามารถใช้ยาอย่างไม่เป็นทางการและหนีจากอาการเสพติดได้ ปัจจัยทางพันธุกรรมคิดเป็นร้อยละ 50% ของความแปรปรวนของแต่ละบุคคลในความอ่อนแอของการติดยาเสพติดและความสามารถในการถ่ายทอดทางพันธุกรรมในระดับนี้ถือเป็นความจริงสำหรับยาเสพติดทุกประเภทที่สำคัญ ๆ รวมถึงสารกระตุ้น, opiates, แอลกอฮอล์, นิโคตินและกัญชา.2 ยังไม่สามารถระบุยีนส่วนใหญ่ที่ประกอบไปด้วยความเสี่ยงทางพันธุกรรมซึ่งอาจเกิดจากการมีส่วนร่วมของการแปรปรวนทางพันธุกรรมหลายร้อยครั้งที่เรียกรวมกันในบุคคลเดียวเพื่อรับรองความอ่อนแอของการติดยาเสพติด (หรือในบุคคลอื่น ๆ
อีก 50% ของความเสี่ยงในการติดยาเสพติดเกิดจากปัจจัยแวดล้อมหลายอย่างที่เกิดขึ้นตลอดชีวิตซึ่งมีปฏิสัมพันธ์กับองค์ประกอบทางพันธุกรรมของแต่ละบุคคลเพื่อทำให้เขาหรือเธอเสี่ยงต่อการเสพติดในระดับที่มากขึ้นหรือน้อยลง ปัจจัยแวดล้อมหลายประเภทมีส่วนเกี่ยวข้องกับการเสพติดรวมถึงความเครียดทางจิตสังคม แต่ปัจจัยที่ทรงพลังที่สุดคือการได้รับยาเสพติดในทางที่ผิด มีการแสดงให้เห็นว่ายา "เกตเวย์" บางชนิดโดยเฉพาะนิโคตินเพิ่มความเสี่ยงต่อการติดยาชนิดอื่น3 นอกจากนี้ยังมีหลักฐานที่เพิ่มขึ้นว่าแม้จะมีความเสี่ยงทางพันธุกรรมในการติดยาเสพติดทั่วทั้งประชากรการได้รับยาในปริมาณที่สูงอย่างเพียงพอเป็นเวลานานสามารถเปลี่ยนคนที่มีการโหลดทางพันธุกรรมค่อนข้างต่ำ.4
ความก้าวหน้าครั้งยิ่งใหญ่ได้เกิดขึ้นในช่วงสองทศวรรษที่ผ่านมาในการระบุพื้นที่สมองที่แยกออกจากกันซึ่งมีความสำคัญในการไกล่เกลี่ยกลุ่มอาการติดยาเสพติดรวมถึงประเภทของการเปลี่ยนแปลงในระดับโมเลกุลและระดับเซลล์ที่ยากระตุ้นในภูมิภาคเหล่านี้ ของการติดยาเสพติด1,5 วงจรที่ได้รับความสนใจมากที่สุดนั้นเรียกว่าระบบ mesolimbic dopamine ซึ่งเกี่ยวข้องกับ dopamine neurons ใน ventral tegmental area (VTA) ของ midbrain innervating spiny neurons กลางในนิวเคลียส accumbens (NAc ซึ่งเป็นส่วนหนึ่งของ ventral striatum) เซลล์ประสาท VTA เหล่านี้ยังคงมีอิทธิพลต่อภูมิภาค forebrain อื่น ๆ อีกมากมายรวมถึงฮิบโป, amygdala และ prefrontal cortex (PFC)
มันสมเหตุสมผลที่จะพิจารณากลไกการติดยาที่ทำให้เกิดยาในปริมาณนี้ในหน่วยความจำด้วยเหตุผลสามประการที่ทับซ้อนกัน6
- ประการแรกการปรับตัวที่เกิดจากยาทั้งหมดสามารถมองได้ว่าเป็น“ หน่วยความจำระดับโมเลกุลหรือเซลลูลาร์:” เซลล์ประสาทที่ได้รับการเปลี่ยนแปลงดังกล่าวจะแตกต่างกันเนื่องจากการได้รับยาและดังนั้นจึงตอบสนองต่อยาชนิดเดียวกันนั้นแตกต่างกัน ยาอื่น ๆ หรือเป็นโฮสต์ของสิ่งเร้าอื่น ๆ เป็นผล.
- ประการที่สองเป็นที่น่าสนใจว่าประเภทการเปลี่ยนแปลงที่เกี่ยวข้องกับสถานะของการเสพติด (เช่นการถอดความยีนที่เปลี่ยนแปลง epigenetics, synaptic และทั้งเซลล์พลาสติกและสัณฐานวิทยาของเซลล์ประสาทและกลไก neurotrophic) มีส่วนเกี่ยวข้องในรูปแบบดั้งเดิมของ“ ความจำเชิงพฤติกรรม” เช่นความจำเชิงพื้นที่การปรับสภาพความกลัวและการปรับสภาพของผู้ปฏิบัติงาน
- ประการที่สามในบรรดาพื้นที่สมองที่ได้รับผลกระทบจากยาเสพติดคือสิ่งที่เป็นสารตั้งต้นทางประสาทที่สำคัญสำหรับหน่วยความจำด้านพฤติกรรมรวมถึงฮิบโปแคมตัม, อะมิกดาลาและ PFC สิ่งนี้เกิดขึ้นพร้อมกับความตระหนักที่เพิ่มขึ้นซึ่งคุณสมบัติที่สำคัญที่สุดบางประการของการติดยาที่เห็นทางคลินิก (เช่นความอยากยาและการกำเริบของโรค) สะท้อนถึงความผิดปกติในวงจรความจำแบบดั้งเดิมด้วยความทรงจำระยะยาว4,7,8 ในทางกลับกันบริเวณที่ให้รางวัลของสมอง (เช่น VTA และ NAc) มีอิทธิพลอย่างมากต่อความจำเชิงพฤติกรรม
บทความนี้แสดงภาพรวมของการเปลี่ยนแปลงระดับโมเลกุลและเซลล์ชนิดสำคัญที่เกิดขึ้นในบริเวณสมองหลายแห่งในรูปแบบการเสพติดสัตว์โดยมุ่งเน้นที่นิวเคลียส accumbens ซึ่งข้อมูลส่วนใหญ่มีอยู่ในปัจจุบัน ที่สำคัญมีความเป็นไปได้มากขึ้นที่จะตรวจสอบการเปลี่ยนแปลงบางอย่างในผู้ติดยาเสพติดของมนุษย์จากการศึกษาสมองหลังการตาย แม้จะมีความจริงที่ว่ายาเสพติดมีโครงสร้างทางเคมีที่แตกต่างกันและดำเนินการตามเป้าหมายโปรตีนที่แตกต่างกัน แต่ก็เป็นที่น่าสังเกตว่าการดัดแปลงที่เกี่ยวข้องกับการเสพติดที่โดดเด่นเป็นเรื่องธรรมดาสำหรับหลาย ๆ คนและในบางกรณี ซินโดรมติดยาเสพติด.4,9 ในทางตรงกันข้ามการปรับตัวที่เกิดจากยาอื่น ๆ มีความเฉพาะเจาะจงกับยาเสพติดที่กำหนดและอาจเป็นสื่อกลางในลักษณะเฉพาะของการติดยาเสพติด เรามุ่งเน้นที่นี่เพื่อกระตุ้นและยาเสพติดยาเสพติดของการละเมิดซึ่งผลิตผลอย่างมากในรูปแบบสัตว์เมื่อเทียบกับยาเสพติดอื่น ๆ นอกจากนี้เรายังเน้นประเด็นสำคัญสำหรับการวิจัยในอนาคตที่จะเพิ่มพูนความรู้เรื่องอาการติดยาและแปลความก้าวหน้าเหล่านี้ไปสู่การทดสอบวินิจฉัยและการรักษาที่ดีขึ้น
กลไกการถอดรหัสและ epigenetic
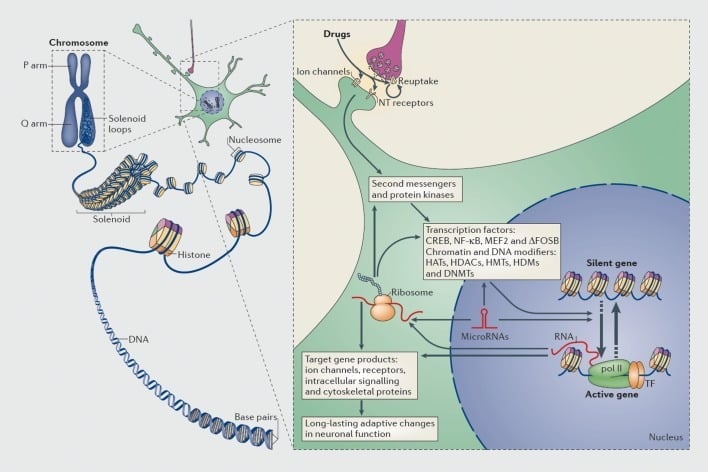
ความรู้ที่ผู้ติดยายังคงมีความเสี่ยงเพิ่มขึ้นสำหรับการกำเริบของโรคแม้จะมีการงดเว้นหลายปีหมายความว่าการติดการเสพติดนั้นเกี่ยวข้องกับการเปลี่ยนแปลงที่เกิดจากยาในสมองซึ่งมีความเสถียรมาก สิ่งนี้ทำให้หลายกลุ่มพิจารณาการเปลี่ยนแปลงในการแสดงออกของยีนในฐานะองค์ประกอบสำคัญของกระบวนการติดยาเสพติด (รูป 1) ดังนั้นการศึกษายีนของผู้สมัครหรือการตรวจสอบทั่วทั้งจีโนมที่เกี่ยวข้องกับ DNA microarrays และ RNA-seq เมื่อเร็ว ๆ นี้ (การเรียงลำดับปริมาณสูงของ RNA ที่แสดงออก) ได้ระบุยีนจำนวนมากที่มีการเปลี่ยนแปลงการแสดงออกในพื้นที่สมองที่กำหนดในรูปแบบการติดยาเสพติดหนูและเจ้าคณะของและติดยาเสพติดของมนุษย์ (เช่นอ้างอิง 10-17) ตัวอย่างของยีนดังกล่าวถูกกล่าวถึงในส่วนถัดไปของการตรวจสอบนี้
กลไกของการควบคุมการถอดเสียงและ epigenetic โดยยาเสพติด ในเซลล์ยูคาริโอต DNA ถูกจัดระเบียบโดยการพันรอบฮิสโตโมนเพื่อสร้างนิวคลีโอโซมซึ่งจะมีการจัดระเบียบเพิ่มเติมและรวมตัวเป็นโครโมโซม โดยการถอดโครมาตินแบบชั่วคราวที่ทำได้เพียงการถอดรหัสดีเอ็นเอของยีนที่เฉพาะเจาะจงเท่านั้น การใช้ยาในทางที่ผิดผ่านเป้าหมาย synaptic เช่นกลไกการเก็บข้อมูลช่องไอออนและตัวรับสารสื่อประสาท (NT) เพื่อปรับเปลี่ยนการส่งสัญญาณภายในเซลล์ (ส่วนขวา) สิ่งนี้นำไปสู่การกระตุ้นหรือยับยั้งปัจจัยการถอดความ (TFs) และของเป้าหมายนิวเคลียร์อื่น ๆ อีกมากมายรวมถึงโปรตีนโครมาติ - กฎระเบียบ (แสดงโดยลูกศรหนา); กลไกรายละเอียดที่เกี่ยวข้องในการควบคุม synaptic ของโปรตีนที่ควบคุมโครมาตินยังคงเข้าใจได้ไม่ดี กระบวนการเหล่านี้ส่งผลให้เกิดการเหนี่ยวนำหรือการปราบปรามของยีนที่เฉพาะเจาะจงในที่สุดรวมถึงกระบวนการสำหรับการเข้ารหัส RNA ที่ไม่ได้เข้ารหัสเช่น microRNA การแสดงออกที่เปลี่ยนแปลงของยีนเหล่านี้สามารถควบคุมการถอดรหัสของยีนได้ มีการเสนอว่าการเปลี่ยนแปลงที่เกิดจากยาบางตัวในระดับโครมาตินนั้นมีความเสถียรสูงและเป็นพฤติกรรมที่ติดทนนาน CREB, โปรตีนที่จับกับองค์ประกอบแอมป์ที่ตอบสนองต่อวงจร; DNMTs, DNA methyltransferases; หมวกฮิสโตน acetyltransferases; HDACs ฮิสโตนดีเซส HDMs, ฮิสโตน demethylases; HMTs, ฮิสโตน methyltransferases; MEF2 ปัจจัยการเพิ่มเฉพาะ myocyte 2; NF-kB, ปัจจัยนิวเคลียร์ - KB; pol II, RNA polymerase II ทำซ้ำจากการอ้างอิง 44: Robison AJ, Nestler EJ กลไกการติดยาเสพติดและการถอดรหัส Nat Rev Neurosci 2011; 12: 623-637
ในทำนองเดียวกันปัจจัยการถอดความหลายชนิด - โปรตีนที่ผูกกับส่วนบังคับของยีนและเพิ่มหรือลดการถอดความของยีนเหล่านั้น - มีส่วนเกี่ยวข้องในการไกล่เกลี่ยผลกระทบระยะยาวของยาเสพติดต่อการแสดงออกของยีนในสมอง. ตัวอย่างที่เด่นชัด ได้แก่ CREB (โปรตีนตอบสนองการจับองค์ประกอบของค่าย), ΔFosB (ปัจจัยการถอดรหัสครอบครัว Fos), NFkB (ปัจจัยทางนิวเคลียร์ kB), MEF2 (ปัจจัยกระตุ้นเซลล์กล้ามเนื้อ -2) และตัวรับสัญญาณกลูโคคอร์ติคอยด์5,10,18-22 มีความเป็นไปได้มากขึ้นที่จะเข้าใจวิถีการส่งสัญญาณของเซลล์ซึ่งยาเสพติดที่ใช้ในทางที่ผิดจะกระตุ้นปัจจัยการถอดความที่กำหนดในสมองและเชื่อมโยงการกระตุ้นดังกล่าวกับยีนเป้าหมายของปัจจัยการถอดความนั้นและกับลักษณะพฤติกรรมเฉพาะของการเสพติด (ดู รูปที่ 1). ความคืบหน้านี้แสดงให้เห็นโดยพิจารณาจาก CREB และΔFosBซึ่งเป็นปัจจัยการถอดรหัสที่ดีที่สุดในรูปแบบการติดยาเสพติด
ค่ายตอบสนององค์ประกอบที่มีผลผูกพันโปรตีน
ยากระตุ้นและยาเสพติดในทางที่ผิดเปิดใช้งาน CREB ในหลายพื้นที่ของสมองที่สำคัญสำหรับการติดยาเสพติดรวมถึงผงาดใน NAc.23,24 CREB นั้นถูกเรียกใช้ในระบบอื่นโดย cAMP, Ca2+และเส้นทางปัจจัยการเจริญเติบโต25 และยังไม่เป็นที่ทราบแน่ชัดว่ากลุ่มยาใดที่เปิดใช้งาน NAc ด้วยยาเสพติด การเปิดใช้งานยาของ CREB ใน NAc นั้นแสดงให้เห็นถึงกลไกการตอบรับเชิงลบแบบคลาสสิก, โดยที่ CREB ทำหน้าที่ลดความไวของสัตว์ต่อผลที่ได้รับจากยาเหล่านี้ (ความอดทน) และเพื่อเป็นสื่อกลางในสภาวะอารมณ์เชิงลบระหว่างการถอนยา.18,26,27 ผลกระทบเหล่านี้ได้รับการแสดงเมื่อเร็ว ๆ นี้เพื่อผลักดันการบริหารจัดการยาเสพติดด้วยตนเองและการกำเริบของโรคเพิ่มขึ้นสันนิษฐานว่าผ่านกระบวนการเสริมแรงทางลบ28 การกระทำเหล่านี้ของ CREB ดูเหมือนจะเกี่ยวข้องกับเซลล์ย่อยทั้งสองของเซลล์ประสาทไขสันหลังขนาดกลางของ NAc ซึ่งเป็นเซลล์ที่แสดงออกอย่างเด่นชัด D1 กับ D2 ตัวรับโดพามีน.24 Interestingly ร่างใหญ่ของวรรณกรรมแสดงให้เห็นว่า CREB ซึ่งทำหน้าที่ในฮิบโปและ amygdala เป็นโมเลกุลสำคัญในหน่วยความจำพฤติกรรม.29-31 บทบาทในวงกว้างในเรื่องการเสพติดและความทรงจำเกี่ยวกับพฤติกรรมน่าจะสะท้อนถึงความจริงที่ว่าเซลล์ประสาทนั้นถูกฝังอยู่กับกลไกโมเลกุลจำนวน จำกัด ซึ่งปรับให้เข้ากับสภาพแวดล้อมที่เปลี่ยนแปลงตลอดเวลา
ยีนเป้าหมายสำหรับ CREB ที่เป็นสื่อกลางฟีโนไทป์ของพฤติกรรมนี้ได้รับการระบุผ่านการตรวจสอบจีโนมกว้างเช่นเดียวกับความพยายามที่เลือกมากขึ้น10,18,32 ตัวอย่างหนึ่งคือ opioid peptide dynorphin: การเหนี่ยวนำการกระตุ้นของการแสดงออกของ dynorphin ในเซลล์ประสาท NAc, สื่อผ่าน CREB, เพิ่มการเปิดใช้งาน dynorphin ของผู้รับ k opioid บนเซลล์ประสาทโดปามีน VTA และยับยั้งการส่งโดปามินอิกไปยัง NAc และลดการให้รางวัล.18 เป้าหมายของ CREB อื่น ๆ อีกมากมายได้แสดงให้เห็นว่ามีความสำคัญต่อการเกิด synaptic plasticity ที่เกิดจากยาตามที่อธิบายไว้ด้านล่าง ในขณะที่ CREB ยังเปิดใช้งานในส่วนอื่น ๆ ของสมองโดยการกระตุ้นและหลับใน23,24 ไม่ค่อยมีใครรู้เกี่ยวกับผลทางพฤติกรรมของผลกระทบนี้และยีนเป้าหมายที่เกิดขึ้น ในทำนองเดียวกันไม่ค่อยมีใครรู้เกี่ยวกับบทบาทของ CREB ในการไกล่เกลี่ยการกระทำของยาเสพติดอื่น ๆ ในทางที่ผิด19
ΔFosB
การได้รับยาเฉียบพลันจากการใช้ยาในทางที่ผิดก่อให้เกิดปัจจัยการถอดความจากครอบครัว Fos ทั้งหมดใน NAc และบริเวณสมองอื่น ๆ การเหนี่ยวนำนี้เป็นไปอย่างรวดเร็ว แต่ก็มีความผันแปรสูงด้วยระดับโปรตีน Fos ที่กลับคืนสู่ภาวะปกติภายใน 8 ถึง 12 ชั่วโมง เอกลักษณ์ของโปรตีนในตระกูล Fos เหล่านี้คือΔFosBผลิตภัณฑ์ที่ถูกตัดทอนของยีน FosB ซึ่งโดยอาศัยอำนาจตามความมั่นคงที่ผิดปกติของมันค่อยๆสะสมผ่านหลักสูตรของการสัมผัสยาซ้ำ และกลายเป็นโปรตีน Fos เด่นที่แสดงภายใต้เงื่อนไขเหล่านี้22,33 นอกจากนี้เนื่องจากความเสถียรนี้ระดับของΔFosBยังคงมีอยู่หลายสัปดาห์หลังจากการถอนยา การเหนี่ยวนำแบบเรื้อรังของΔFosBนั้นแสดงให้เห็นถึงยาเสพติดแทบทั้งหมด34 และสำหรับยาส่วนใหญ่จะเลือกใช้เซลล์ประสาท NA-Dl-type34,35 ก็ยังได้รับ แสดงให้เห็นในการติดยาเสพติดของมนุษย์35 วรรณกรรมขนาดใหญ่แสดงให้เห็นว่าการชักนำΔFosBใน D1-เซลล์ประสาทชนิด NAc ช่วยเพิ่มความไวของสัตว์ต่อยาตลอดจนผลตอบแทนจากธรรมชาติและส่งเสริมการบริหารตนเองของยาโดยสันนิษฐานได้จากกระบวนการเสริมแรงในเชิงบวก (ดูอ้างอิง 34 ถึง 38). สิ่งที่น่าสนใจคือการเหนี่ยวนำยาของΔFosBใน NAc นั้นน่าทึ่งยิ่งกว่าในสัตว์วัยรุ่นซึ่งเป็นช่วงเวลาของความอ่อนแอของการติดยาเสพติด,39 และการชักนำโดยนิโคตินได้แสดงให้เห็นเพื่อเป็นสื่อกลางในการเพิ่มประสิทธิภาพของโคเคนเกตเวย์ของนิโคติน.40
สำหรับ CREB ยีนเป้าหมายจำนวนมากสำหรับΔFosBได้รับการระบุใน NAc โดยการใช้ยีนที่มีตัวเลือกและวิธีการที่กว้างของจีโนม10,32 ในขณะที่ CREB กระตุ้น dynorphin แต่ ,FosB จะยับยั้งมันซึ่งก่อให้เกิดผลตอบแทนจากโปรของΔFosB.38 เป้าหมายΔFosBอีกอันคือ cFos: เมื่อΔFosBสะสมด้วยการสัมผัสกับยาซ้ำ ๆ มันจะอัด c-Fos และก่อให้เกิดการเปลี่ยนโมเลกุลโดยที่ΔFosBจะถูกเลือกโดยการชักนำในสภาวะที่ได้รับการรักษาด้วยยาเรื้อรัง.41 เป้าหมายΔFosBอื่น ๆ อีกมากมายได้แสดงให้เห็นถึงความสามารถของยาเสพติดบางชนิดในการใช้เพื่อกระตุ้นให้เกิดความสัมพันธ์กับ synaptic plasticity ใน NAc และการเปลี่ยนแปลงที่เกี่ยวข้องในการทำ arborization dendritic ของเซลล์ประสาทไขสันหลังกลางของ NAc ดังที่จะกล่าวถึงด้านล่าง
ผลที่ได้จากการทำงานของการเหนี่ยวนำ osFosB ในบริเวณสมองอื่นนั้นไม่ค่อยมีความเข้าใจที่ดีแม้ว่าการเหนี่ยวนำในเยื่อหุ้มสมอง orbitofrontal (OFC) ได้รับการศึกษาในรายละเอียดบางอย่าง ที่นี่ΔFosBไกล่เกลี่ยที่เกิดขึ้นกับผลกระทบที่เกิดจากการรับรู้ของโคเคนในระหว่างการสัมผัสเรื้อรังและการปรับตัวนี้มีความเกี่ยวข้องกับการบริหารโคเคนที่เพิ่มขึ้น.42,43
การตรวจสอบจีโนมกว้างได้แนะนำยีนเป้าหมายที่มีศักยภาพหลายอย่าง42 แม้จะมีคุณสมบัติทางเวลาที่เป็นเอกลักษณ์ของΔFosBและความรู้ที่เกิดขึ้นในวงจรหน่วยความจำแบบดั้งเดิม (เช่นฮิปโปแคมปัส) แต่ยังไม่มีการสำรวจบทบาทของΔFosBในความจำเชิงพฤติกรรมซึ่งเป็นเรื่องที่น่าสนใจสำหรับการวิจัยในอนาคต
กลไกทางพันธุกรรม
ในช่วงไม่กี่ปีที่ผ่านมาการศึกษาเรื่องการถอดความได้ถูกผลักออกไปอีกหนึ่งก้าวสู่ epigenetics44 (ดู รูปที่ 1)ซึ่งสามารถนิยามได้อย่างกว้าง ๆ ว่าเป็นการเปลี่ยนแปลงในการแสดงออกของยีนที่เกิดขึ้นในกรณีที่ไม่มีการเปลี่ยนแปลงในลำดับดีเอ็นเอ กลไก Epigenetic ควบคุมบรรจุภัณฑ์ของ DNA ภายในนิวเคลียสของเซลล์ผ่านการโต้ตอบกับฮิสโตนและโปรตีนนิวเคลียร์ชนิดอื่น ๆ ซึ่งรวมกันประกอบด้วยโครมาติน การแสดงออกของยีนถูกควบคุมโดยสถานะของบรรจุภัณฑ์นี้ผ่านการดัดแปลงโควาเลนต์ของฮิสโตน, โปรตีนอื่น ๆ และ DNA เอง มีเพียงตัวอย่างบางส่วน acetylation ของฮิสโตนมีแนวโน้มที่จะส่งเสริมการทำงานของยีน methylation ของฮิสโตนสามารถส่งเสริมการกระตุ้นการทำงานของยีนหรือการกดขี่ทั้งนี้ขึ้นอยู่กับ Lys ตกค้างที่อยู่ระหว่างการปรับเปลี่ยนนี้และ methylation ของ DNA มักเกี่ยวข้องกับการหักห้ามใจของยีน เช่น 5-hydroxymethylation) อาจเกี่ยวข้องกับการกระตุ้นยีน
Epigenetics เป็นกลไกที่น่าดึงดูดเพราะในระบบอื่นเช่นชีววิทยาการพัฒนาและมะเร็งการดัดแปลง epigenetic บางอย่างอาจเป็นการถาวร สำหรับเหตุผลนี้, epigenetics ได้รับการติดตามทั้งในรูปแบบการเรียนรู้และหน่วยความจำ (เช่น refs 45-48) เช่นเดียวกับการเสพติด44,49 ในทั้งสองระบบมีการรายงานการเปลี่ยนแปลงอย่างลึกซึ้งในฮิสโตนอะซิติเลชั่นและเมทิลเลชั่นและในดีเอ็นเอเมทิลเลชั่น ดังตัวอย่างหนึ่งฮิสโตนเมธิลทรานเฟอร์เฟอเรสต์คือ G9a ซึ่งเกี่ยวข้องในหน่วยความจำทั้งสอง50 และการติดยาเสพติด51,52 ในรูปแบบการติดยาเสพติด การแสดงออกของ G9a นั้นลดลง ใน NAc เพื่อตอบสนองต่อยากระตุ้นหรือยาเสพติดในทางที่ผิดและเขาได้รับการแสดงเพื่อเพิ่มผลรางวัลของยาเหล่านี้.51,52 ที่น่าสนใจคือการปราบปรามโคเคนของ G9a นั้นมีการใช้สื่อกลางโดยΔFosB G9a เปิดใช้งาน dimethylation ของ Lys9 ของฮิสโตน H3 (H3K9me2) ผู้ไกล่เกลี่ยที่สำคัญของการปราบปรามของยีน ChIP-chip หรือ ChIP-seq (ตามมาด้วยการกระตุ้นด้วยโครมาตินตามลำดับโดยโปรโมเตอร์ชิพหรือการเรียงลำดับความเร็วสูง) ถูกนำมาใช้เพื่อให้ได้แผนที่จีโนมกว้างของยีนใน NAc ที่แสดงการเปลี่ยนแปลง H3K9me2meUMNUMX32,52,53 ด้วยการทับซ้อนรายการยีนเหล่านี้กับรายการการเปลี่ยนแปลงการแสดงออกของยีนทั่วทั้งจีโนมและกับแผนที่จีโนมกว้างของรูปแบบอื่น ๆ ของการดัดแปลง epigenetic (เช่น bindingFosB binding, CREB binding, การปรับฮิสโตนอื่น ๆ ฯลฯ ),32,53 มันควรจะเป็นไปได้ที่จะระบุชุดของยีนที่สมบูรณ์มากขึ้นที่ถูกควบคุมโดยยาเสพติดของการละเมิดและเพื่อทำความเข้าใจกลไก epigenetic พื้นฐานที่เกี่ยวข้อง
รูปแบบของการควบคุม epigenetic ที่เกี่ยวข้องในหน่วยความจำและติดยาเสพติดคือการสร้างของ microRNAs RNA ที่ไม่มีการเข้ารหัสขนาดเล็กเหล่านี้เชื่อมโยงกับพื้นที่เสริมของ mRNAs และยับยั้งการแปลหรือทำให้เกิดการย่อยสลาย Deletion of Argonaut ซึ่งเป็นโปรตีนสำคัญสำหรับการประมวลผลของ miRNAs เปลี่ยนแปลงการตอบสนองเชิงพฤติกรรมต่อโคเคนโดยมีผลกระทบที่แตกต่างกันสำหรับ D1- กับ D2 ชนิดเซลล์ประสาทหนามขนาดกลาง54 miRNAs ที่เฉพาะเจาะจงจำนวนมากได้รับการแสดงเช่นเดียวกันว่าควบคุมโดยการสัมผัสกับยาและในทางกลับกันก็มีผลต่อพฤติกรรมการตอบสนองต่อยา (เช่น refs 55,56) มันจะน่าตื่นเต้นในการศึกษาในอนาคตเพื่อระบุเป้าหมาย mRNA ของ miRNAs เหล่านี้และอธิบายลักษณะที่พวกเขามีผลต่อกระบวนการติดยาเสพติด
ซินแนปติกพลาสติก
ประเภททั่วไปของการปรับเปลี่ยน synaptic ที่ glutamatergic synapses ซึ่งมีส่วนเกี่ยวข้องใน hippocampus และ amygdala ในพฤติกรรมความจำ (ดูบทความอื่น ๆ ในฉบับนี้) มีการแสดงให้เห็นว่าเกิดขึ้นในสมองของภูมิภาคในรูปแบบการติดยาเสพติด กระบวนการติดยาเสพติด.57,58 พลาสติกซินแนปทีฟที่เกิดจากยาดังกล่าวได้ถูกอธิบายไว้ในหลาย ๆ ส่วนของสมองอย่างไรก็ตามเรามีสมาธิที่นี่กับ NAc ซึ่งงานวิจัยส่วนใหญ่มุ่งเน้นไปที่วันที่ (รูป 2).
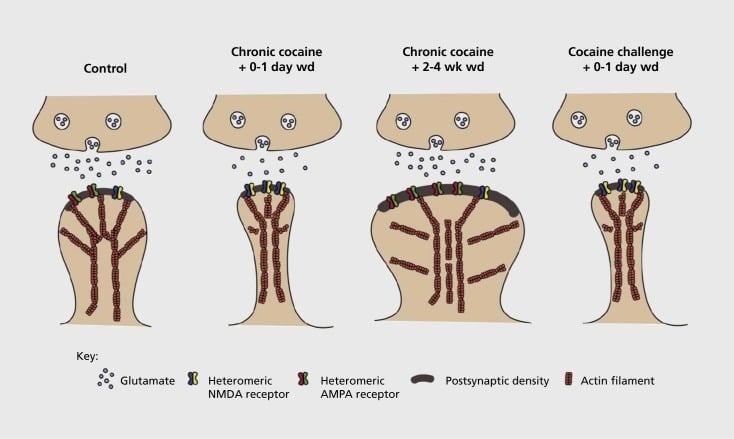
รูปแบบของการติดยาเสพติดที่เกี่ยวข้องกับ synaptic และปั้นพลาสติกในนิวเคลียส accumbens (NAc) การได้รับโคเคนแบบเรื้อรังส่งผลให้มีการปรับโครงสร้างของตัวรับกลูตาเมตα-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA) และ N-methyl-D-aspartic acid (NMDA) spiny neuron (MSN) synapses เช่นเดียวกับการเปลี่ยนแปลงโครงสร้างในหัวกระดูกสันหลังของ NAc MSNs ที่มีความสัมพันธ์กับรูปแบบที่แตกต่างกันของพลาสติก synaptic ตัวอย่างเช่นโคเคนเรื้อรังก่อให้เกิดการแสดงออกที่พื้นผิวของตัวรับ NMDA การก่อตัวของไซแนปส์เงียบและภาวะซึมเศร้าในระยะยาว (LTD) ที่จุดเวลาถอนต้น ในระหว่างการถอนตัวนานขึ้น (wd) การเปลี่ยนแปลง synaptic เหล่านี้กลับกับผลลัพธ์ที่เพิ่มขึ้นการแสดงออกของตัวรับ AMPA บนพื้นผิวการรวมของ synapse เข้าไปในกระดูกสันหลังรูปเห็ดและ potentiation ระยะยาว (LTP) ผลกระทบเหล่านี้จะย้อนกลับอย่างรวดเร็วอีกครั้งเมื่อสัมผัสกับความท้าทายของโคเคนที่นำไปสู่การปรับโครงสร้างของกระดูกสันหลังให้เป็นกระดูกสันหลังบางและภาวะซึมเศร้าของความแข็งแรงของ synaptic
การทดลองเริ่มต้นแสดงให้เห็นว่าการได้รับสารกระตุ้นจากยาเสพติดซ้ำ ๆ ทำให้เกิดสภาวะเหมือน LTD (ภาวะซึมเศร้าในระยะยาว) ที่ glutamatergic synapses ใน NAc59 อย่างไรก็ตามงานที่ผ่านมาได้แสดงให้เห็นถึงความเป็นพลาสติกเช่นนี้ซึ่งขึ้นอยู่กับเวลาเป็นอย่างมากโดยมี LTD เกิดขึ้นในช่วงแรกหลังจากการสัมผัสโคเคนครั้งสุดท้ายที่พัฒนาไปสู่สถานะ LTP (potentiation ระยะยาว) มากขึ้น60,61 งานนี้ซึ่งได้รับการดำเนินการในปัจจุบันโดยใช้นักวิจัยบริหาร - เมื่อเทียบกับตัวเอง - ยาเสพติดได้กำหนดความต้องการสำหรับการตรวจสอบอย่างเป็นระบบมากขึ้นในรูปแบบการบริหารตนเองที่ติดตามรูปแบบของ synaptic พลาสติกที่เกิดขึ้นที่ synutes glutamatergic NAc ในช่วงเวลาที่มีรายละเอียดตั้งแต่การได้มาของการบริหารตนเองไปจนถึงการบำรุงรักษาผ่านช่วงเวลาต่าง ๆ ของการถอนและการสูญพันธุ์และเพื่อตอบสนองต่อสิ่งเร้าที่กำเริบ การทำงานจนถึงปัจจุบันได้กำหนดกลไกโมเลกุลบางอย่างที่มีส่วนช่วยให้เกิดการสร้างแบบซินแนปติกที่เป็นยานี้รวมถึงการค้าขายเครื่องรับ AMPA ไปยังไซแนปส์ซึ่งอาจเป็นสื่อกลางในส่วนผ่าน CaMKII (Ca2+/ การเปลี่ยนแปลงของโปรตีนขึ้นอยู่กับโปรตีน kinase II) การสงบของหน่วยรับ AMPA บางอย่างรวมทั้งการแสดงออกของการเปลี่ยนแปลงของหน่วยย่อยตัวรับ AMPA (เช่น 60,62-65, ตัวเลข 2 และ 3). บทบาทของ CREB และΔFosBมีส่วนเกี่ยวข้องในปรากฏการณ์เหล่านี้เช่นเดียวกับการเปลี่ยนแปลงที่เกี่ยวข้องในลักษณะทางสัณฐานวิทยาของกลูตามาเทอจิกซินเซส (ดูด้านล่าง) ตัวอย่างเช่น GluAl เป็นเป้าหมายสำหรับ CREB ใน NAc โดยที่ GluA2 และ CaMKII เป็นทั้งเป้าหมายของΔFosBในพื้นที่สมองนี้ .35,36,66,67 การก้าวไปข้างหน้ามันเป็นสิ่งสำคัญที่จะต้องเชื่อมโยงการดัดแปลงเฉพาะกับการเปลี่ยนแปลงตามเวลาในฟังก์ชั่น synaptic และคุณสมบัติเชิงพฤติกรรมของการเสพติด
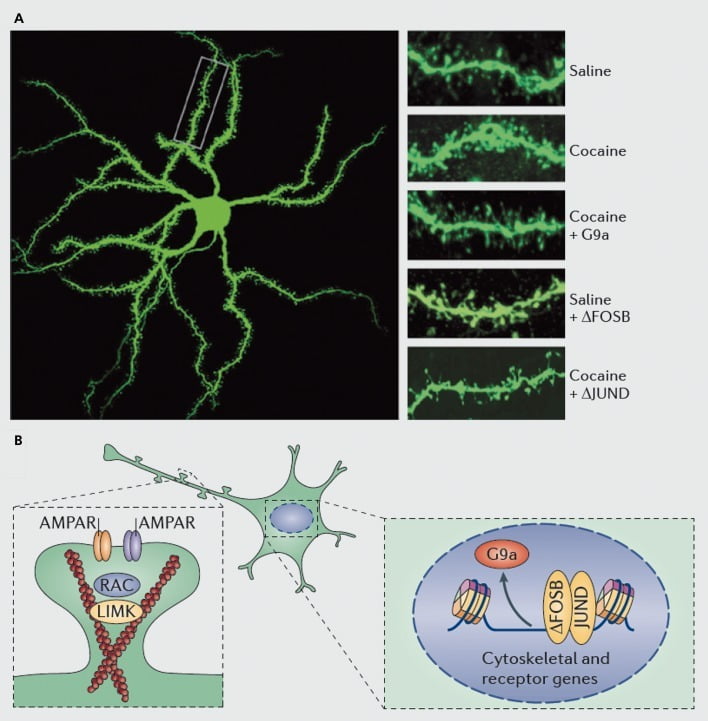
กลไกระดับโมเลกุลที่อยู่ภายใต้การเหนี่ยวนำโคเคนของเงี่ยงเดนไดรติกบนเซลล์ประสาทหนามกลางนิวเคลียสแอคคัมเบนส์ (NAc) A) แสดงการเพิ่มขึ้นของจำนวนกระดูกสันหลังที่เกิดจากโคเคนซึ่งสามารถถูกปิดกั้นได้โดยการแสดงออกที่มากเกินไปของไวรัสของ G9a หรือ JunD (ซึ่งเป็นปฏิปักษ์ของการถอดความ AP1 -mediated) หรือเลียนแบบโดยการแสดงออกของไวรัส FosB ที่มากเกินไป B) กฎข้อบังคับของการค้ามนุษย์ตัวรับ AMPA (AMPAR) และโครงกระดูกของแอกติน (ซ้าย) ตลอดจนการควบคุมการถอดความของตัวรับกลูตาเมตและโปรตีนควบคุมแอคติน (เช่นเป็นสื่อกลางผ่านΔFosBขวา) แสดงให้เห็นว่ามีบทบาทสำคัญ ในการไกล่เกลี่ยกฎระเบียบของโคเคนเกี่ยวกับความหนาแน่นของกระดูกสันหลัง NAc dendritic UMK, โดเมนไคเนส LIM; RAC, สารตั้งต้นของสารพิษ C3 botulinum ที่เกี่ยวข้องกับ Ras
เครื่องมือทดลองใหม่ ๆ ทำให้มันเป็นไปได้เป็นครั้งแรกในการกำหนดด้วยความแม่นยำที่เพิ่มขึ้นซึ่งวงจรเฉพาะแสดงรูปแบบเหล่านี้ของพลาสติกซินแนปและสิ่งที่พฤติกรรมผิดปกติที่พวกเขาเป็นสื่อกลาง ตัวอย่างเช่น tเขาเปลือกและ subregions หลักของ NAc แสดงความแตกต่างในปั้นพลาสติก synaptic ที่เกิดขึ้นเช่นเดียวกับ D1- เมื่อเทียบกับ D2 ชนิดเซลล์ประสาทกลางประเภทหนามภายในแต่ละภูมิภาคย่อย60,63,64,67 ในทำนองเดียวกันการทดลองออพโตเจเนติกส์ได้ให้ข้อมูลเชิงลึกเกี่ยวกับการมีส่วนร่วมของรูปแบบเฉพาะของซินแนปติกพลาสติก (เช่น LTD) ในประชากรที่เฉพาะเจาะจงของกลูตามาเทอริกซิกซินเซสใน NAc เช่นที่เกิดจาก medial PFC กับ basolateral amygdala ของฮิบโป)68-70 ในท้ายที่สุดจำเป็นต้องซ้อนทับการปรับตัวของโมเลกุลที่เกิดจากยาในเซลล์ประสาทแต่ละเซลล์เหล่านี้ด้วยการปรับตัวเฉพาะของไซแนปส์ที่เกิดขึ้นในเดนไดรต์ postynaptic เพื่อรวบรวมความเข้าใจที่สมบูรณ์เกี่ยวกับวิธีการที่ยาเสพติดในทางที่ผิดปรับเปลี่ยนวงจรของสมองเพื่อขับเคลื่อนลักษณะเฉพาะของ ติดสถานะ ความพยายามนี้จะต้องได้รับการชื่นชมมากขึ้นของความเป็นพลาสติกที่เกิดจากยาที่ซินแนปส์ที่ยับยั้งภายในบริเวณสมองเดียวกันซึ่งเป็นพื้นที่ที่ได้รับความสนใจน้อยมากในปัจจุบัน65
เซลล์พลาสติกทั้งหมด
ในขณะที่การวิจัยส่วนใหญ่เกี่ยวกับการเปลี่ยนแปลงทางเซลล์ประสาทในเซลล์ประสาทในปรากฏการณ์ยาเสพติดเช่นเดียวกับในการเรียนรู้และปรากฏการณ์ความทรงจำได้มุ่งเน้นไปที่ synaptic ปั้น แต่ก็มีหลักฐานเพิ่มขึ้นสำหรับความสำคัญของพลาสติกทั้งเซลล์เช่นกัน ทั้งพลาสติกปั้นเรียกว่าปั้น homeostatic71 เกี่ยวข้องกับการเปลี่ยนแปลงในความตื่นเต้นง่ายของเซลล์ประสาททั้งหมดในลักษณะที่ไม่เฉพาะเจาะจงไซแนปส์ เนื่องจากคุณสมบัติบางอย่างของการติดยาเกี่ยวข้องกับความไวที่เพิ่มขึ้นหรือลดลงต่อยามันทำให้รู้สึกว่าการเพิ่มหรือลดความตื่นเต้นทางไฟฟ้าของเซลล์ประสาทบางอย่างมีส่วนช่วยในการปรับพฤติกรรมเหล่านี้.5
พื้นที่ ตัวอย่างที่ดีที่สุดที่สร้างขึ้นจากความเป็นพลาสติกทั้งเซลล์ต่อยาที่ใช้ในทางที่ผิดคือความสามารถในการหลับในเรื้อรังเพื่อเพิ่มความตื่นเต้นง่ายภายในของเซลล์ประสาท noradrenergic ของ locus coeruleus (LC).72 การปลุกปั่นที่เพิ่มขึ้นนี้ถูกสื่อผ่าน CREB และการเหนี่ยวนำให้เกิดไอโซฟอร์มของอะดีนีลีลไซโคสซึ่งทำให้การยิงเซลล์ประสาท LC เพิ่มขึ้นอาจผ่านการเหนี่ยวนำของ Na + ช่องทาง72-75 hyperexcitabilty ของ LC neurons นี้แสดงให้เห็นถึงกลไกคลาสสิกของความอดทนและการพึ่งพาอาศัยกันและผลักดันบางส่วนของสัญญาณและอาการของการถอนยาเสพติด ที่น่าสนใจคือ CREB ไกล่เกลี่ยรูปแบบที่คล้ายกันของความเป็นพลาสติกทั้งเซลล์ในเซลล์ประสาทแบบหนามกลางแบบ NAc ซึ่งมีการให้แสงจากการสัมผัสกับยาเสพติดผ่านทาง CREB76 มันจะเป็นสิ่งสำคัญในการสืบสวนในอนาคตเพื่อที่จะเข้าใจว่า CREAP-mediated synaptic plasticity ของ glutamatergic synapses ในเซลล์ประสาทหนามกลางของ NAc65,66 ปิดท้ายด้วย hyperexcitability ภายในของ CREB-mediated ของเซลล์ประสาทเหล่านี้76 เพื่อควบคุมคุณสมบัติเชิงพฤติกรรมของการเสพติด
อีกตัวอย่างหนึ่งของความเป็นพลาสติกทั้งเซลล์ในแบบจำลองการติดยาเสพติดคือ hyperexcitability ของเซลล์ประสาทโดปามีน VTA ที่เกิดขึ้นหลังจากได้รับยาเสพติดของ abus แบบเรื้อรังและ (รูป 4).77,78 การปรับตัวนี้ซึ่งเชื่อมโยงกับการเปลี่ยนแปลงทางสัณฐานวิทยาในเซลล์ประสาทเหล่านี้ (ดูหัวข้อถัดไป) ไม่ได้เป็นสื่อกลางโดย CREB แต่ได้รับความสำเร็จแทนผ่านระเบียบของการส่งสัญญาณประสาท neurotrophic ดังที่อธิบายไว้ด้านล่าง

รูปแบบการทำงานของการปรับตัวที่เกิดจากมอร์ฟีนเรื้อรังในเซลล์ประสาทพื้นที่หน้าท้อง (VTA) มอร์ฟีนเรื้อรังลดขนาด Soma VTA dopamine (DA) แต่เพิ่มความตื่นเต้นง่ายของเส้นประสาทในขณะที่โดพามีนส่งไปยังนิวเคลียส accumbens จะลดลง ผลกระทบสุทธิของมอร์ฟีนเป็นเส้นทางที่ได้รับผลตอบแทนน้อยกว่าเช่นความอดทนต่อรางวัล การลดลงของการส่งสัญญาณ IRS2-AKT ใน VTA ไกล่เกลี่ยผลกระทบของมอร์ฟีนเรื้อรังต่อขนาดโสมและความตื่นเต้นง่ายทางไฟฟ้า ผลต่อความสามารถในการปลุกปั่นเป็นสื่อกลางผ่านกรดγ-aminobutyric ที่ลดลง (GABA) กระแสและการปราบปรามการแสดงออกของช่อง K '. การลดลงของมอร์ฟีนจากการลดลงของกิจกรรม mTORC2 ใน VTA นั้นมีความสำคัญต่อการปรับตัวทางสรีรวิทยาและสรีรวิทยาที่เกิดจากมอร์ฟีนที่เกิดจากมอร์ฟีน ตรงกันข้ามกับ mT0RC2 มอร์ฟีนเรื้อรังจะเพิ่มกิจกรรม mTORCI ซึ่งไม่ส่งผลต่อการปรับตัวที่เกิดจากมอร์ฟีนเหล่านี้ BDNF ปัจจัย neurotrophic จากสมอง; IRS, สารรับอินซูลิน; mTORC ซับซ้อน mTOR; AKT โปรตีนไคเนส B ผลิตซ้ำจาก ref 77
ลักษณะทางสัณฐานวิทยาของพลาสติกและกลไกของระบบประสาท
หลักฐานที่เพิ่มขึ้นส่วนใหญ่มาจากการศึกษาของ hippocampal และเซลล์ประสาทสมองแสดงให้เห็นว่าการเปลี่ยนแปลงใน synaptic ปั้นมีความสัมพันธ์กับการเปลี่ยนแปลงทางสัณฐานวิทยาที่ synapses ตัวอย่างเช่น LTD และการสร้าง synapses แบบเงียบนั้นเกี่ยวข้องกับการก่อตัวของเงี่ยง dendritic บางหรือแข็งทื่อในขณะที่ LTP เกี่ยวข้องกับกระดูกสันหลังรูปเห็ดขนาดใหญ่79,80 จึงเป็นที่น่าสนใจว่าสาขาการใช้ยาเสพติดได้ให้ความสำคัญกับการเปลี่ยนแปลงที่เกิดจากยาในเงี่ยงเดนไดรติกเป็นเวลามากกว่า 15 ปี การได้รับสารเรื้อรัง ยากระตุ้นการละเมิดเพิ่มความหนาแน่นของกระดูกสันหลัง dendritic ของเซลล์ประสาทกลางหนามของ NAc การเปลี่ยนแปลงที่ครอบงำสำหรับเซลล์ Dl ประเภท.67,81,82 การเหนี่ยวนำของกระดูกสันหลังมีความสัมพันธ์ส่วนใหญ่กับการตอบสนองพฤติกรรมไวต่อยาเหล่านี้แม้ว่าหลักฐานบางอย่างขัดแย้งกับมุมมองนี้
เช่นเดียวกับการศึกษาเรื่องพลาสติกซินแนปท์ (synaptic plasticity) จำเป็นต้องมีการทำงานมากขึ้นในการกำหนดการเปลี่ยนแปลงของกระดูกสันหลังที่เกิดขึ้นในระหว่างการใช้ยาด้วยตนเองการถอนและการกำเริบของโรค Studies จนถึงปัจจุบันที่เกี่ยวข้องกับยาเสพติดของผู้ตรวจสอบและผู้ดูแลตนเองแนะนำการเปลี่ยนแปลงของกระดูกสันหลังที่แตกต่างกันมากที่เกิดขึ้นที่จุดถอนเวลาที่แตกต่างกันและใน NAc เชลล์เมื่อเทียบกับภูมิภาคย่อยหลัก.83-86 มันจะเป็นสิ่งสำคัญเช่นกันในการกำหนดกลไกระดับโมเลกุลที่แม่นยำซึ่งโคเคนหรือสารกระตุ้นอื่นสร้างผลกระทบเฉพาะด้านเวลาและเซลล์ชนิดนี้ ΔFosBแสดงให้เห็นว่ามีความจำเป็นและเพียงพอสำหรับการเหนี่ยวนำของกระดูกสันหลังที่ยังไม่บรรลุนิติภาวะในเซลล์ประสาท NAl ชนิด Dl.35,51,67 ระเบียบดังกล่าวเกิดขึ้นพร้อมกับโคเคนและกฎระเบียบ osFosB ของโปรตีนหลายชนิดที่รู้จักกันในการควบคุมการปรับโครงสร้างองค์กรของโครงร่างโครงกระดูก ตัวอย่างหนึ่งคือกฎการถอดความของปัจจัยการแลกเปลี่ยนนิวคลีโอไทด์ guanine และ GTPase ที่กระตุ้นการทำงานของโปรตีนที่เป็นอันตรายต่อ Rac1, GTPase ขนาดเล็กสำหรับการลดลงชั่วคราวของกิจกรรมในการตอบสนองต่อการสัมผัสโคเคนในแต่ละกิจกรรมและ Rs1 ลดลง ของ Rac1 เพื่อเป็นสื่อกลางในการเหนี่ยวนำของเงี่ยงอ่อน87 ผลกระทบเหล่านี้ของ Racl น่าจะเกิดขึ้นผ่านการควบคุมของ cofilin และโปรตีนแอคตินอื่น ๆ ที่ได้รับการแสดงเพื่อเป็นสื่อกลางในการควบคุมโคเคนของการเจริญเติบโตของกระดูกสันหลัง87,88 อย่างไรก็ตามสิ่งสำคัญคือต้องเน้นว่านี่เป็นเพียงเส้นทางเดียวที่เกี่ยวข้องกับการควบคุมกระดูกสันหลังที่ยังไม่บรรลุนิติภาวะของโคเคนเนื่องจากโปรตีนอื่น ๆ อีกหลายชนิดแสดงให้เห็นว่ามีบทบาทสำคัญเช่นกัน ได้แก่ CDK5 (ไคเนส -5 ที่ขึ้นกับไซโคล), CaMKII, NFkB , MEF2, CREB, G9a และ DNMT3 (DNA methyltransf ลบ 3a) เพื่อตั้งชื่อไม่กี่20,21,35,51,67,89,90 สิ่งที่น่าสนใจคือการควบคุมโคเคนของยีนเหล่านี้รวมถึงการเหนี่ยวนำของ CDK5, CaMKII, และ NFkB และการควบคุม G9a นั้นก็ถูกสื่อผ่านΔFosB20,35,51,91
น่าแปลกที่ยาเสพติดที่ใช้ในทางที่ผิดออกแรงกระทำผลตรงกันข้ามและลดความหนาแน่นของกระดูกสันหลัง dendritic ของเซลล์ประสาทหนามกลาง NAc.81 ไม่ค่อยมีใครรู้จักเกี่ยวกับผลกระทบทางพฤติกรรมของการปรับตัวนี้และกลไกระดับโมเลกุลที่เกี่ยวข้อง ปรากฏการณ์นี้คือ อย่างไรก็ตามน่าประหลาดใจเนื่องจาก CREB และΔFosBถูกกระตุ้นโดยทั้งตัวกระตุ้นและ opiates และมีส่วนร่วมในการชักนำให้เกิดการกระตุ้นโดยสื่อกลางของความหนาแน่นกระดูกสันหลัง NAc dendritic. สิ่งนี้ทำให้เกิดคำถามว่าผู้หลับในระงับความหนาแน่นของกระดูกสันหลังอย่างไรแม้ว่าการเหนี่ยวนำของปัจจัยเหล่านี้
รูปแบบที่สำคัญอื่น ๆ ของลักษณะทางสัณฐานวิทยาของพลาสติกที่เห็นในแบบจำลองการใช้ยาเสพติดคือการลดขนาดทางกายภาพของขนาดเซลล์ soma ของ VTA เซลล์ประสาทโดปามีนที่เกิดจากการบริหารยาเสพติดเรื้อรัง.77,92,93 การปรับตัวที่คล้ายกันเกิดขึ้นในการตอบสนองต่อกัญชา94 การหดตัวของเซลล์ประสาทโดปามีน VTA นี้ซึ่งเกิดขึ้นกับยาเสพติดการบริหารตนเอง93 และได้รับการบันทึกไว้ในผู้ติดยาเสพติดเฮโรอีนที่ตรวจร่างกายหลังการตาย77 ดูเหมือนว่าจะไกล่เกลี่ยความอดทนของรางวัลและเกี่ยวข้องกับการลดโดปามีนที่ลดลงใน NAc. ขณะนี้มีหลักฐานสำคัญแสดงให้เห็นว่าการลดขนาดเซลล์ของโซมานี้เป็นสื่อกลางโดยการปราบปรามการแสดงออกของเซลล์ประสาทที่มาจากสมอง (BDNF) ในเซลล์ประสาท เราได้เชื่อมโยงโดยตรงกับการถอนตัวแบบเปิดของการสนับสนุน BDNF และการหดตัวของเซลล์ประสาท VTA เพื่อลดกิจกรรมของการส่งสัญญาณลดหลั่น BDNF ในเซลล์ประสาทโดปามีน VTA โดยเฉพาะลดกิจกรรมของ IRS2 (อินซูลินตัวรับสารตั้งต้น -2), AKT kinase) และ TORC2 (เป้าหมายของ rapamycin-2 ซึ่งไม่ไวต่อ rapamycin)77,93 นอกจากนี้เรายังเชื่อมโยงการลดลงของสัญญาณ BDNF โดยตรงกับความตื่นเต้นที่เพิ่มขึ้นซึ่งมอร์ฟีนเหนี่ยวนำให้เกิดขึ้นในเซลล์ประสาทเหล่านี้ตามที่ระบุไว้ก่อนหน้านี้77,78 แท้จริงขนาดเซลล์ที่ลดลงของ Soma และความตื่นเต้นง่ายที่เพิ่มขึ้นนั้นถูกผนวกเข้าด้วยกันอย่างแน่นหนาเนื่องจากการเหนี่ยวนำของสิ่งหนึ่งนำไปสู่อีกทางหนึ่งและในทางกลับกัน การควบคุมความตื่นเต้นง่ายของเซลล์นี้เกี่ยวข้องกับการปราบปราม K+ แชแนลและของ GABAA ปัจจุบันในเซลล์ประสาทเหล่านี้
บทบาทของ BDNF ในการควบคุมการตอบสนองของมอร์ฟีนในระดับ VTA นั้นขัดแย้งกับการมีส่วนร่วมที่แตกต่างกันมากในการกระทำของโคเคนและสารกระตุ้นอื่น ๆ การกระตุ้นกระตุ้น BDNF ส่งสัญญาณไปยัง NAc ซึ่งเป็นผลมาจากการสังเคราะห์ BDNF ในท้องถิ่นที่เพิ่มขึ้นรวมถึงการเพิ่มการปล่อยจากภูมิภาคที่มีอวัยวะที่หลากหลาย95 ยิ่งกว่านั้นสัญญาณ BDNF ที่เพิ่มขึ้นใน NAc แต่ไม่ใช่ใน VTA ได้รับการแสดงเพื่อส่งเสริมผลพฤติกรรมของยาเหล่านี้รวมถึงการบริหารตนเอง95,96 กฎระเบียบตรงกันข้ามของการส่งสัญญาณ BDNF ในเส้นทาง VTA-NAc โดย opiates กับสารกระตุ้นทำให้เกิดความเป็นไปได้ที่ความแตกต่างดังกล่าวจะไกล่เกลี่ยกฎระเบียบที่ตรงกันข้ามของยาเสพติดของกระดูกสันหลัง dendritic ของ NAc ซึ่งเป็นไปได้ที่อยู่ระหว่างการตรวจสอบ
ทิศทางในอนาคต
การเล่าเรื่องข้างต้นเป็นการเน้นย้ำถึงความก้าวหน้าอันยิ่งใหญ่ที่เกิดขึ้นในการทำความเข้าใจการปรับตัวของโมเลกุลและเซลล์ที่เกิดขึ้นในบริเวณที่ได้รับผลตอบแทนจากสมองในการตอบสนองต่อการสัมผัสกับยาเสพติดซ้ำแล้วซ้ำเล่า . แม้จะมีความก้าวหน้าเหล่านี้คำถามสำคัญยังคงอยู่ ความรู้ที่มีอยู่ส่วนใหญ่ของเรามุ่งเน้นไปที่ VTA และ NAc ด้วยข้อมูลที่น้อยกว่ามากเกี่ยวกับบริเวณที่มีสมองลีบที่สำคัญอื่น ๆ ที่สำคัญสำหรับการติดยาเสพติด นอกจากนี้การสาธิตการทดลองทั้งหมดของบทบาทเชิงสาเหตุของการปรับตัวของเซลล์โมเลกุลในพฤติกรรมที่เกี่ยวข้องกับยาเสพติดได้จัดการกับการปรับตัวของแต่ละบุคคลทีละครั้ง เพื่อจัดการกับการดัดแปลงมากมายในเวลาเดียวกันนั้นยากกว่า แต่ก็เป็นสิ่งสำคัญเช่นกันเพราะเรารู้ว่ายาเสพติดทำให้เกิดการเปลี่ยนแปลงในรูปแบบที่แตกต่างกันจำนวนมากแม้ในเซลล์ประสาทส่วนบุคคลซึ่งอาจสรุปได้ด้วยวิธีที่ซับซ้อน วิธีการทางชีววิทยาของระบบดังกล่าวจะมีความสำคัญต่อการถอดรหัสการติดยาเสพติดในที่สุด ในที่สุดความพยายามที่จะเข้าใจกลไกระดับโมเลกุลของความทรงจำที่เกี่ยวข้องกับการเสพติดพบว่าตนเองกำลังพยายามทำความเข้าใจพื้นฐานทางชีววิทยาของความทรงจำเชิงพฤติกรรมในขณะนี้ความสามารถของเราในการเชื่อมโยงปรากฏการณ์ทางชีววิทยากับความจำเชิงพฤติกรรมที่ซับซ้อน การเอาชนะการแบ่งแยกนี้อาจเป็นความท้าทายที่ยิ่งใหญ่ที่สุดในประสาทวิทยาศาสตร์
ตัวย่อและคำย่อที่เลือก
- Nac
- นิวเคลียส accumbens
- CREB
- องค์ประกอบตอบสนองที่ค่ายผูกพันโปรตีน
- ΔFosB
- ปัจจัยการถอดความครอบครัว Fos
- VTA
- ท้องที่
- AMPA
- α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid
- , LTD
- ภาวะซึมเศร้าในระยะยาว
- LTP
- การประท้วงระยะยาว
- BDNF
- neurotrophic factor ที่ได้จากสมอง
- NKkB
- ปัจจัยนิวเคลียร์ kB
ข้อมูลอ้างอิง