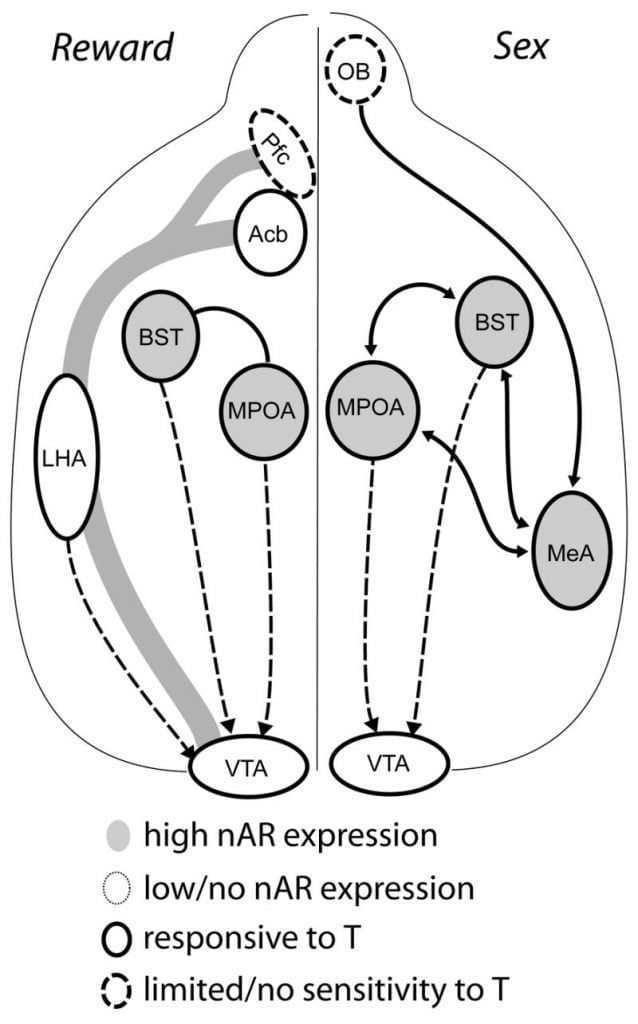
评论:对雄激素受体,多巴胺和性功能的几乎所有相关研究的优秀评论。 神奇地绘制了下丘脑 - 奖励电路之间的相互关系。
Horm Behav。 2008 May; 53(5):647 658。
在线发布2008二月13。 DOI: 10.1016 / j.yhbeh.2008.01.010
抽象
青春期与寻求愉悦行为的增加有关,而这反过来又是由下丘脑 - 垂体 - 性腺轴的青春期激活所决定的。 在自然有益行为的动物模型中,例如性,睾丸雄激素有助于男性行为的发展和表达。 为了实现行为成熟,大脑在青春期经历显着的重塑,并且许多变化同样对雄激素敏感,可能通过雄激素受体(AR)起作用。 鉴于性腺激素与大脑发育的微妙相互作用,在这个敏感时期激素水平的破坏显着改变青少年和成年人的行为也就不足为奇了。 在雄性仓鼠中,青春期暴露于睾酮是正常表达成人性行为所必需的。 在青春期期间被剥夺雄激素的雄性在交配中表现出持续的缺陷。 相反,即使在青春期之前存在脑AR,单独的雄激素不足以在青春期前的雄性中诱导交配。 在这种情况下,在青春期广泛使用合成代谢雄激素类固醇(AAS)是一个重要的问题。 AAS滥用有可能改变青春期男性的雄激素的时间和水平。 在仓鼠中,青春期AAS暴露增加了攻击性,并导致神经递质系统的持久变化。 此外,AAS本身也在加强,正如睾酮和其他AAS的自我管理所证明的那样。 然而,最近的证据表明,雄激素的增强作用可能不需要经典的AR。 因此,需要进一步检查雄激素之间的相互作用和青少年大脑中的奖励行为,以便更好地理解AAS滥用。
概述
青春期唤醒大脑的愉悦和风险。 在人类青少年中,这通常采取药物和性行为的实验形式。 在美国,男性首次性交的中位年龄为16.4年,而65%的年龄为12级(凯撒家庭基金会,2005)。 同样,这一人口在美国的非法药物使用率最高。 根据2004全国药物使用和健康调查,38%的18-25男性在过去一年中使用过非法药物(SAMHSA / OAS,2005)。 此外,31%的青少年男孩在上次性交时使用过毒品或酒精(凯撒家庭基金会,2005)。 此外,青春期是某些精神病理学病因学的关键时期,如抑郁,焦虑,饮食失调和行为障碍。 我们认为,性腺激素的青春期分泌,大脑中类固醇受体的激活,以及激素与青春期大脑发育经验之间的相互作用,促成了青春期的行为变化。
我们的目标是回顾性腺雄激素介导青少年成熟和动机行为的成人表现的证据,以及这些行为的有益特性。 我们还提供证据证明睾丸激素本身是有益的,这可能有助于青春期动机行为的成熟变化,此时睾丸激素水平飙升。 本文的重点是我们对男性性行为的神经回路的研究,特别是在叙利亚仓鼠中,特别强调睾酮和多巴胺(DA)之间的相互作用。 我们建议青春期雄激素对奖励回路和动机行为都有短暂和长期影响。 我们进一步假设补充合成代谢雄激素类固醇(AAS)形式的外源性雄激素会增加青春期雄激素的正常影响,从而对青少年的大脑发育和行为产生不利影响。
青春期是大脑发育的敏感时期
最终,大脑既是青春期雄激素作用的触发点,又是其靶点。 在年轻男孩(<12岁)和年轻仓鼠(<28天年龄)中,循环中的雄激素和促性腺激素处于基础水平。 随着下丘脑释放促性腺激素的释放,垂体前叶促黄体激素的分泌增加,循环睾丸激素的浓度显着增加。 男生发生在坦纳(Tanner)II / III期(14岁),仓鼠发生到28天。 当男孩达到Tanner IV / V阶段(约16岁)或仓鼠为50-60天时,内源性睾丸激素已进入成年男性范围。 青春期激素分泌与青春期相吻合,青春期发生在人类大约12至20岁之间。 青春期激素不仅作用于周围组织,从而引起性的第二性征的出现,这是青春期的明显体征,而且它们还起到集中作用,既影响青春期大脑的重塑,也影响行为成熟。 此外,青春期激素引起的生理和神经变化导致个人经历的重大变化,这本身就可以深刻地改变大脑的发育过程。 因此,由生殖神经内分泌轴的发育定时成熟驱动的性类固醇激素的青春期增加,又通过对神经系统的直接和间接影响而塑造了青少年的行为发育。
人类青春期现在被认为是神经发育的主要和动态时期,在此期间行为回路被重塑和改进。 虽然5岁儿童的大脑已经达到成人体型的90%(Dekaban,1978),重大改造仍在继续。 这一概念是通过人类和动物的研究得到的,记录了围产期大脑发育期间发生的许多基本发育过程在青春期被概括。 这些过程包括神经发生(Eckenhoff和Rakic,1988; 他和克鲁斯,2007; Pinos,Collado,Rodriguez-Zafra,Rodriguez,Segovia和Guillamon,2001; Rankin,Partlow,McCurdy,Giles和Fisher,2003),程序性细胞死亡(Nunez,Lauschke和Juraska,2001; Nunez,Sodhi和Juraska,2002),树枝状树枝和突触的细化和修剪(Andersen,Rutstein,Benzo,Hostetter和Teicher,1997; Huttenlocher和Dabholkar,1997; Lenroot和Giedd,2006; Sowell,Thompson,Leonard,Welcome,Kan和Toga,2004),髓鞘形成(Benes,Turtle,Khan和Farol,1994; Paus,Collins,Evans,Leonard,Pike和Zijdenbos,2001; Sowell,Thompson,Tessner和Toga,2001)和性别分化(Chung,De Vries和Swaab,2002; Davis,Shryne和Gorski,1996; Nunez等人,2001)。 因此,出生后大脑的发育轨迹不是线性的,而是以青春期快速变化的爆发为特征,并涉及进行性和退行性事件。 正如任何发育生物学家所知,快速发育变化的时期表明敏感性和易受经验依赖性变化以及扰动和侮辱的不良后果的敏感性提高,并且没有理由认为人类青少年大脑发育是任何例外(安徒生,2003; Spear,2000)。 因此,预计青春期激素对青春期大脑的影响时间的扰动会对成年人的行为产生长期影响。
用于激励行为的雄激素和神经回路
由于青春期是一个短暂而动态的发展阶段,因此很难单独评估青少年的大脑和行为。 相反,要欣赏青春期的独特性,将其与大脑和成熟成年人的行为进行对比是有帮助的。 因此,本文的重点是男性性行为和奖励,重要的是在成年男性中引入交配和性动机的神经回路,包括性腺类固醇激素在行为激活中的作用和雄激素受体的分布。 (AR)和雌激素(ER)。
AR存在于形成神经回路的细胞群中,所述神经回路介导有益的社交行为,例如性。 此外,脑AR在仓鼠青春期前表达,并且在幼年和成年男性中都被雄激素上调(Kashon,Hayes,Shek和Sisk,1995; Meek,Romeo,Novak和Sisk,1997)。 在啮齿动物大脑中,AR和ER的分布存在实质性重叠(Wood和Newman,1995)和芳香酶(Celotti,Negri-Cesi和Poletti,1997),包括雌激素受体的α和β形式(Shughrue,Lane和Merchenthaler,1997)。 在与配体结合后,“经典的”AR和ER作为转录因子起作用以诱导新蛋白质的转录和合成。 毫不奇怪,这些影响遵循相对缓慢的时间过程,延迟起效。 类固醇刺激雄性仓鼠的性行为(Noble和Alsum,1975)与经典基因组行为的行为一致。 例如,需要2周的类固醇暴露才能恢复长期阉割的交配。 最近对大鼠的研究也证明了雄激素在具有很少经典受体的大脑区域中的快速细胞效应(Mermelstein,Becker和Surmeier,1996)。 这些类固醇作用被认为是由非基因组受体介导的。 而仓鼠大脑中经典AR和ER的分布相对受限(Wood和Swann,1999),非基因组雄激素作用的潜在脑靶标要广泛得多。
内侧视前区(MPOA)在从金鱼到人类的雄性交配中起着重要作用(综述于 Hull,Wood和McKenna,2006)。 此外,仓鼠MPOA通过丰富的AR和ER转导性腺类固醇激素,MPOA中的睾酮植入物足以恢复长期阉割的性活动(Wood和Swann,1999)。 在雄性大鼠中,性腺类固醇在MPOA中起作用以调节基础DA释放(Putnam,Sato和Hull,2003)并刺激交配(Hull,Du,Lorrain和Matuszewich,1995)。 最初,当女性出现在屏幕后面时,DA会略有增加。 在交配期间,MPOA DA进一步增加(基线的+ 50%),这种效应需要雄激素(Hull等,1995; Putnam等人,2003)。 毫不奇怪,在不交配的阉割雄性中,MPOA DA不会增加(Hull等,1995)。 解释这一结果有点困难,因为没有性活动会导致缺乏DA释放。 然而,MPOA中的DA释放与短期阉割中的交配丧失相关(Hull等,1995),以及长期阉割中睾酮诱导的性活动恢复(Du,Lorrain和Hull,1998; Putnam,Du,Sato和Hull,2001).
在啮齿动物MPOA中,睾酮的雄激素和雌激素代谢物在交配调节中发挥特定作用(Putnam等人,2003; Putnam,Sato,Riolo和Hull,2005)。 启动交配的延迟(坐骑或插入)是性动机的一种衡量标准。 性活动的潜伏期对雌激素敏感,通过维持MPOA一氧化氮合酶,反过来维持基础DA水平。 雌激素治疗的阉割显示出高的基础DA水平,这与启动交配的能力密切相关。 然而,它们未能显示女性和交配诱导的DA释放增加,这与性表现密切相关。 因此,他们的性表现低于完整水平。 另一方面,仅用不可芳香化的雄激素处理的阉割剂没有显示升高的基础DA水平,并且它们不能引发交配。 因此,对于正常的性表现,需要雌激素和雄激素。 性表现通常表示为坐骑,插入和射精的频率测量。 只有当雌激素和雄激素都被替换时,阉割的雄性大鼠才会表现出DA水平升高(以及更短的潜伏期测量),并且雌性和交配诱导的DA增加(并且频率测量值增加)。 以这种方式,MPOA中的雌激素有助于性动机,并且雌激素和雄激素都有助于性功能。
虽然睾酮是男性交配行为期间MPOA DA释放和自身交配所必需的,但睾丸激素和单独交配都不能引发MPOA中的DA。 相反,MPOA中DA释放也需要来自同种雌性的化学感应线索。 在啮齿动物中,化学感受刺激是引发男性性行为的主要感觉方式(图。 1)。 化学感应线索通过内侧杏仁核和纹状体末端的床核从嗅球传递到MPOA,结构具有丰富的AR和ER(Wood和Swann,1999)。 为了确定化学感应线索在交配诱导的DA中的作用,我们测量了在性腺完整雄性仓鼠与单侧嗅球切除术(UBx,交配)交配期间的MPOA DA。 Triemstra,Nagatani和Wood,2005)。 虽然双侧切除嗅球消除了性活动和MPOA DA释放,但单侧球囊切除术不会干扰交配。 在这项研究中,交配诱导MPOA DA释放时,在损伤的嗅球对侧测量,而不是在同侧半球(图。 2)。 在具有内侧杏仁核损伤的雄性大鼠中观察到类似的结果(Dominguez,Riolo,Xu和Hull,2001)。 在一项相关研究中,大鼠内侧杏仁核的化学刺激诱导MPOA DA释放相当于交配期间的释放(Dominguez和Hull,2001)。 总之,这些数据表明睾酮创造了一种允许外部感觉刺激到达MPOA并在交配期间诱导DA释放的允许环境。

图。 2
最终,性行为和其他自然奖励激活神经奖励途径。 中脑皮质边缘DA回路由腹侧被盖区(VTA),伏隔核(Acb)和前额皮质(Pfc)组成。 多巴胺细胞体位于VTA项目中,位于Acb和Pfc(Koob和Nestler,1997)。 在大鼠中,DA在性交过程中释放到Acb中(Pfaus,Damsma,Nomikos,Wenkstern,Blaha,Phillips和Fibiger,1990)。 许多滥用药物也在中脑边缘DA系统中起作用,以增加DA释放(安非他明)或抑制DA再摄取(可卡因, Di Chiara和Imperato,1988),从而增强其成瘾性。 通过这种方式,睾丸激素有可能通过增强性行为和通过其作为滥用药物的行为来影响Acb中DA的释放(见下文)。
目前的证据表明,中脑皮质激素DA系统在青春期成熟。 在沙土鼠的青春期,Acb DA纤维密度显着增加,表明在青春期期间VTA多巴胺能投射对Acb的显着成熟(Lesting,Neddens和Teuchert-Noodt,2005)。 此外,大鼠内侧前额叶皮质中的多巴胺能输入GABA(γ-氨基丁酸) - 细胞在青春期发育过程中被5-羟色胺能系统富集和调节(Benes,Taylor和Cunningham,2000并且,成年大鼠中雄激素的操作导致前额皮质内多巴胺能轴突密度的变化(Kritzer,2003)。 虽然ERβ存在于VTA中,但Pfc,Acb和VTA几乎没有AR或ER(Shughrue等人,1997)。 因此,雄激素似乎可能通过雄激素敏感性传入或通过VTA中的ERβ影响中脑皮质激素DA系统,如下丘脑(Handa等,本期)。 我们的数据显示雄性仓鼠中的雄激素敏感细胞从与类固醇敏感行为相关的结构投射到VTA。 例如,MPOA和纹状体末端(BST)的床核都含有大量投射到VTA的AR阳性细胞(佐藤和伍德,2006)。 腹侧苍白球,主要的Acb传出目标(Zahm和Heimer,1990),还包含许多投射到VTA的AR阳性细胞。 这些预测为雄激素提供了改变中脑皮质边缘DA系统活性的机会。
青春期的类固醇依赖性行为组织
激素对青少年行为的传统观点基于类固醇激素的激活作用,类固醇激素指的是类固醇通过神经回路潜在行为中的靶细胞内的作用促进特定社会环境中的行为的能力。 激活效应是短暂的,因为它们存在和不存在激素,并且它们通常与成人行为的表达相关。 相反,组织效应是指类固醇在发育过程中塑造神经系统结构的能力。 结构组织是永久性的,持续超过激素暴露期,并决定成年期对类固醇的神经和行为反应。 我们对类固醇激素的组织和激活作用之间发育关系的理解在过去50年代已经发生了变化。 凤凰城及其同事首次提出,在围产期最严重的敏感期内,类固醇激素对类固醇激素的成人行为(激活)反应进行编程(组织)(Phoenix,Goy,Gerall和Young,1959)。 后来,斯科特及其同事为神经系统的进行性组织存在多个敏感期奠定了理论基础,并指出敏感期最有可能发生在快速发育变化期间(1974)。 随后,Arnold和Breedlove指出大脑的类固醇依赖性组织可能发生在敏感的发育期之外(Arnold和Breedlove,1985)。 在过去15年,使用各种动物模型和行为系统的研究表明青少年大脑对性腺类固醇的激活和组织效应敏感(综述于 Sisk和Zehr,2005)。 而且,与其他快速发育变化的时期一样,青春期代表了类固醇依赖性脑重塑的明确机会之窗。
我们使用仓鼠作为动物模型的工作提供了证据表明男性社交行为在青春期被类固醇修饰(Schulz,Menard,Smith,Albers和Sisk,2006; Schulz和Sisk,2006)。 在青春期之前,睾丸激素治疗不能激活仓鼠的性行为,这表明神经回路容易被类固醇激素激活或组织的成熟过程尚未发生(Meek等人,1997; 罗密欧,理查森和Sisk,2002a)。 相反,虽然成年期男性生殖行为的公开表达并不绝对需要青春期期间性腺类固醇的存在,但行为的最大表达却需要。 比较青春期前 (NoT@P) 或青春期后 (T@P) 阉割并在成年后接受睾酮治疗的男性的男性生殖行为,与青春期后阉割的男性相比,青春期前 NoT@P 阉割者的男性行为至少有 50% 的缺陷(图。 3, Schulz,Richardson,Zehr,Osetek,Menard和Sisk,2004)。 此外,生殖行为的缺乏是持久的,无法通过长期睾丸激素治疗或成年期的性经验来克服(Schulz等人,2004)。 同样,在用雌激素和黄体酮治疗后,NoT@P 男性比成年后被阉割的男性表现出更短的脊柱前凸潜伏期和更长的脊柱前凸持续时间(Schulz等人,2004),表明青春期前阉割比暴露于青春期睾丸激素的男性更少被贬低。

图。 3
NoT@P 男性可能会遭受性动机下降的困扰。 解决这个问题的一种方法是比较青春期前 (NoT@P) 和青春期后 (T@P) 性腺切除的男性进行肛门生殖器检查 (AGI) 和安装的潜伏期。 如果性动机取决于青春期期间性腺激素的暴露,我们预计 NoT@P 男性进行性行为的潜伏期会更长。 事实上,随着反复接触发情雌性,与 T@P 雄性相比,NoT@P 雄性需要更长的时间才能开始 AGI 和安装(图。 4)。 因此,除了组织性表现的方面之外,青春期激素似乎还组织性行为的奖励方面。 为了支持这种可能性,成年期中央给予 DA 激动剂阿扑吗啡可将 NoT@P 雄性的生长行为恢复至成人典型水平,表明青春期睾酮正常组织多巴胺能神经回路(Salas-Ramirez、Montalto 和 Sisk,2006) )。 尽管如此,仍然存在许多有趣的问题。 NoT@P 雄性会对发情雌性产生抑制作用,或者对交配地点产生条件性地点偏好吗? 未来的研究将探讨青春期激素在组织性动机和性表现中的作用。

图。 4
青春期前 (NoT@P) 或青春期后 (T@P) 性腺切除的雄性仓鼠表现出的肛门生殖器检查 (AGI) 潜伏期和持续时间。 所有男性在性腺切除后 7 周和第一次行为测试前一周在成年期接受睾酮激发。 A. T@P 雄性在对发情雌性的三次测试中表现出相似的 AGI 潜伏期,而 NoT@P 雄性在对发情雌性的第三次测试中 AGI 潜伏期增加。 B. T@P 雄性在发情雌性的三项行为测试中减少了坐骑潜伏期,而 noT@P 雄性在三项行为测试中表现出坐骑潜伏期没有变化。 这些数据表明,青春期性腺激素对成年男性与女性发生性行为的动机具有持久的促进作用。 (来自动物受试者的未发表数据 Schulz,KM,Richardson,HN,Zehr,JL,Osetek,AJ,Menard,TA和Sisk,CL,2004).
对类固醇的青春期前行为反应
青春期行为发育的持久难题之一是为什么在青春期前雄性仓鼠中减少了对类固醇暴露的生殖行为的激活。 如果青春期前低水平的雄激素限制了青春期前男性的男性性行为,那么补充青春期前男性的内源性雄激素应引起交配。 结果并非如此(Meek等人,1997; Romeo,Cook-Wiens,Richardson和Sisk,2001; Romeo,Wagner,Jansen,Diedrich和Sisk,2002b尽管在激素治疗的青春期前和成人阉割中,整个交配环路中AR和ER的数量和分布相似,但是Meek等人,1997; Romeo,Diedrich和Sisk,1999; 罗密欧等人,2002a)。 因此,似乎雄激素和AR是必需的,但不足以表达男性性行为。
迄今为止,努力确定限制青春期前性活动的因素。 在青春期前和成年雄性仓鼠中,Fos对动情女性化学感觉线索的反应相似(Romeo,Parfitt,Richardson和Sisk,1998)。 这些数据表明感觉转导机制在青春期前是成熟的。 因此,幼年男性能够检测女性的化学感觉线索; 他们与成年人的不同之处在于他们如何回应这些暗示。 一个可能的解释是,青春期前的男性没有动机从事性行为。 我们发现青春期前的雄性仓鼠在MPOA中对雌性信息素没有显示出增加的多巴胺能反应,而性天真的成年雄性对相同的刺激显示出强烈的MPOA多巴胺能反应(图。 5, Schulz,Richardson,Romeo,Morris,Lookingland和Sisk,2003)。 同样,青春期前的雄性未能显示接触雌性信息素后循环睾酮的成人典型增加(Parfitt,Thompson,Richardson,Romeo和Sisk,1999)。 因此,女性信息素似乎是成人中神经化学和神经内分泌反应的无条件刺激,而不是青春期前男性,这表明这些社会相关的感觉刺激的显着性改变了青春期发育,可能与获得有益的性质和性动机有关。 此外,尽管睾丸激素确实促进青春期前男性的女性AGI,但这种效果取决于男性先前是否曾接触过发情的女性。 也许令人惊讶的是,睾丸激素治疗只会降低性行为的青春期前男性的潜伏期并增加AGI的持续时间(图。 6)。 此外,曾经有过一次女性经历的青春期前男性首次表现出更长的AGI潜伏期和更短的AGI持续时间,而男性首次与接受性女性相互作用(图。 6)。 这些数据表明,与发情性雌性的相互作用在青春期之前是厌恶而不是奖励,从而在随后与雌性相互作用期间消除睾酮对AGI的任何促进作用。 知道早期接触发情女性的负面行为后果是否持续到青春期和成年期会很有意思,特别是考虑到反复接触发情的女性 ,我们将参加 青春期通常促进男性生殖行为的表达(Molenda-Figueira,Salas-Ramirez,Schulz,Zehr,Montalto和Sisk,2007).

图。 5
青春期和成年男性内侧视前区(MPOA)对阴道分泌物中含有的雌性信息素的多巴胺能反应。 成年雄性在暴露于女性阴道分泌物时显示MPOA多巴胺能活性增加,而青春期前雄性不显示对女性信息素的增加的MPOA多巴胺能反应。 (重绘自 Schulz,KM,Richardson,HN,Romeo,RD,Morris,JA,Lookingland,KJ和Sisk,CL,2003).

尽管青春期前雄激素治疗不能诱导交配,但我们实验室最近的研究表明,仓鼠神经系统对青春期前睾酮对生殖行为的组织作用很敏感(Schulz,Zehr,Salas-Ramirez和Sisk,2007)。 阉割加19天睾丸激素暴露在青春期之前或期间但未在青春期之后,在成年期更换睾酮时促进了安装行为。 青春期前后暴露于睾丸激素的男性在成年期也表现出比在青春期期间或之后暴露于睾酮的男性更多的插入(Schulz等人,2007)。 这些数据表明,睾酮组织行为神经回路的能力随着年龄的增长而降低,并且青春期标志着睾丸激素暴露的长期产后敏感期的结束。
药理雄激素
前面的数据表明,内源性性腺类固醇增强了青春期的动机行为。 现在,如果一个人自我管理的雄激素水平高达100x正常的生理浓度,会发生什么? 这是合成代谢 - 雄激素类固醇(AAS)滥用的问题(综述于 Brower,2002; 克拉克和亨德森,2003)。 这里有一个简短的题外话:所有AAS都是睾酮的衍生物,所有AAS都有一个含有4稠环的碳骨架,大多数都含有19碳。 AAS主要用于其合成代谢(肌肉构建)效果。 然而,顾名思义,AAS也具有雄激素特性。 睾丸激素是动物研究中探索雄激素奖励基本机制的合理选择。 它仍然是人类使用者的流行选择,通常以长效睾酮酯如丙酸睾酮的形式存在。 在2006中,睾酮是世界反兴奋剂机构认可实验室尿液检测中检测到的最常见的禁用物质(WADA,2006)。 在34悉尼奥运会上,睾酮占AAS阳性尿检的最大比例(2000%)(Van Eenoo和Delbeke,2003)。 同样,在AAS使用者的尿液检测中,41%检测为睾酮阳性(Brower,Catlin,Blow,Eliopulos,Beresford,1991)。 在高剂量时,AAS产生显着的行为改变。 特别是,由于它们与睾酮的密切关系,在青少年时期使用AAS似乎会扰乱正在发育的人类青春期神经系统的正常类固醇环境,包括类固醇暴露的数量,时间和类型。
与其他非法药物一样,人类AAS滥用是青春期的问题。 根据1994全国家庭吸毒调查(SAMHSA / OAS,1996),在18年龄的青春期后期,类固醇使用达到峰值。 此外,在监测未来调查中(约翰斯顿,奥马利和巴克曼,2003),高中学生使用类固醇的终身发病率(2.7%)与可卡因(3.5%)或海洛因(1.4%)相当。 类固醇的使用在年轻时也越来越常见:2.5%的8级学生(13-14年)使用类固醇,类似于裂缝发生率(2.5%)和海洛因使用(1.6%)。 鉴于1认为青少年可能特别容易受到滥用AAS和2认为青少年在药理学水平接触AAS有可能大大改变大脑的正常成熟,因此青少年早期使用AAS的趋势特别令人不安。行为以敏锐和长期的方式产生夸大的形态和行为反应。
不恰当的攻击行为是最常与人类AAS滥用相关的行为反应。 在已发表的病例报告中,类固醇的使用与一些暴力谋杀案有牵连(Conacher和Workman,1989; 教皇和卡茨,1990; Pope,Kouri,Powell,Campbell和Katz,1996; Schulte,Hall和Boyer,1993)。 在对当前AAS使用者的调查中,升高的攻击性和易怒性是AAS使用的最常见的行为副作用(邦德,崔和教皇,1995; Galligani,Renck和Hansen,1996; Midgley,Heather和Davies,2001; Parrott,Choi和Davies,1994; Perry,Kutscher,Lund,Yates,Holman和Demers,2003)。 然而,考虑到雄激素暴露的范围,各种精神症状以及预先存在的精神障碍的可能性,很难确定AAS在这些人类攻击案例中的确切作用。 接受AAS注射的人类志愿者的前瞻性研究结果好坏参半: Tricker等(1996) 和 O'Connor等人(2004) 据报道,其他研究发现侵略性增加时,愤怒行为没有增加(Daly,Su,Schmidt,Pickar,Murphy和Rubinow,2001; Hannan,Friedl,Zold,Kettler和Plymate,1991; Kouri,Lukas,Pope和Oliva,1995; 教皇和卡茨,1994; Su,Pagliaro,Schmidt,Pickar,Wolkowitz和Rubinow,1993)。 尽管如此,重要的是要记住,给予人类志愿者的剂量远远低于健身网站所倡导的剂量,并且治疗的持续时间通常很短。 因此,总的来说,似乎可以得出结论,AAS具有增强激动行为的潜力,至少在易感个体中是这样。 教皇等人(1994) 发现AAS在易受伤害的个体中引发精神症状。
动物研究也为AAS诱导的攻击提供了令人信服的证据。 与未经治疗的雄性相比,长期接受高剂量类固醇治疗的青少年雄性仓鼠的攻击潜伏期较短,对男性入侵者的攻击和咬伤次数较多(Harrison,Connor,Nowak,Nash和Melloni,2000; Melloni,Connor,Hang,Harrison和Ferris,1997)。 同样,温和的挑衅(尾巴捏)会导致青春期雄性大鼠的攻击性持续增加,包括对女性的攻击(Cunningham和McGinnis,2006)。 更令人担忧的是,青少年在仓鼠中接触AAS导致激素行为持续增加,这种行为在使用类固醇后仍然存在(Grimes和Melloni,2006)。 这些行为改变伴随着下丘脑前部神经回路的持续重塑。 特别是仓鼠中的青春期AAS暴露可增强精氨酸加压素(AVP, Grimes和Melloni,2006)和下调5-羟色胺和5-羟色胺能5HT1A和5HT1B受体(Ricci,Rasakham,Grimes和Melloni,2006)。 AAS改变AR的大脑水平也就不足为奇了。 长期暴露于睾酮或诺龙可上调雄性大鼠的细胞核AR(Menard和Harlan,1993; Wesson和McGinnis,2006)。 因此,AAS有可能通过补充内源性雄激素和通过增加AR表达来增加雄激素反应性来增强雄激素依赖性行为。
与激动行为相比,AAS对雄性啮齿动物的交配行为影响较小,且反应取决于所使用的特定类固醇(综述于 克拉克和亨德森,2003)。 在口服溶液中消耗睾酮的雄性仓鼠中,射精以剂量依赖性方式增加(Wood,2002)。 然而,睾丸激素和诺龙都没有增强青春期雄性大鼠的交配。 康力龙是一种相对不太有效的AAS,具有最小的雄激素活性,实际上可以抑制交配和攻击(Farrell和McGinnis,2003),可能是通过降低内源性雄激素水平。
特别重要的是要注意,青少年和成年仓鼠可以对AAS暴露表现出不同的行为反应。 虽然AAS显着增强了青春期男性的激动行为,但成年期的相同治疗只能使攻击行为适度增加并且性行为显着下降(Salas-Ramirez,Montaldo和Sisk,2008)。 这与青春期作为雄激素作用的敏感期的概念一致。 此外,正如成年雄性仓鼠获得对外源性睾酮的耐受性(彼得斯和伍德,2005),我们相信发育中的雄性成熟时会对睾酮产生耐受性。 因此,AAS的影响在青少年发展中发生变化,青少年AAS暴露可能会导致过度的侵略性和性行为模式,这种模式可能会持续到成年期。
增强雄激素的作用
交配和战斗都是有益的(至少如果你赢得了战斗)。 雄性大鼠将反复按压杠杆以与雌性交配(Everitt和Stacey,1987)。 同样,雄性老鼠和雌性仓鼠将形成一个条件性的地方偏好(CPP),用于他们之前赢得过战斗的地方(Martinez,Guillen-Salazar,Salvador和Simon,1995; Meisel和Joppa,1994)。 如果AAS能够将有益的社会行为提升到通常在性腺完整雄性中观察到的水平以上,那么期望睾丸激素本身可能是有益的是合乎逻辑的。 这已经使用两种成熟的动物模型进行了测试,用于奖励和强化:CPP和自我管理。 这些研究的结果表明,在合成代谢效应和运动表现无关的实验环境中,睾酮正在加强。 利用CPP,测试物质重复地与独特环境(例如,测试设备中的特定腔室)配对。 一旦动物将增强测试物质与该环境联系起来,即使没有奖励,他也会寻找环境。 实验动物中雄激素奖励的首次报道使用全身注射睾酮来诱导雄性小鼠的CPP(Arnedo,Salvador,Martinez-Sanchis和Gonzalez-Bono,2000; Arnedo,Salvador,Martinez-Sanchis和Pellicer,2002)和老鼠(Alexander,Packard和Hines,1994; de Beun,Jansen,Slangen和Van de Poll,1992)。 随后,我们的实验室使用睾酮的自我管理来证明雄激素强化(约翰逊和伍德,2001)。 我们发现雄性仓鼠将使用2瓶选择测试和食物诱导饮用自愿服用口服睾酮溶液。 在后来的研究中,我们证明了雄性大鼠和仓鼠的自我管理(Wood,Johnson,Chu,Schad和Self,2004)。 静脉输送消除了味道或肠道填充对雄激素摄入的潜在混杂影响。
在AAS滥用的背景下,区分雄激素的中枢和外周影响很重要。 由于睾酮在整个身体中具有广泛的作用,因此可以认为用全身性睾酮注射进行的奖励和强化是继发于睾酮的全身合成代谢和雄激素作用。 换句话说,也许睾酮可以减少肌肉疲劳,改善关节功能,使动物只需 感觉 更好。 事实上,这种解释已被用于临床文献(尽管没有实验证据),以反对对AAS的依赖和成瘾的可能性(DiPasquale,1998)。 然而,Packard等(Packard,Cornell和Alexander,1997)表明直接向大鼠脑内注射睾酮可诱导CPP。 同样,我们的实验室已证明雄性仓鼠的脑室内(icv)睾酮自我管理(Wood等,2004)。 脑内CPP和icv自我给药与睾丸激素争论中枢靶向介导雄激素增强。
值得注意的是,睾酮强化不一定遵循先前针对性行为的类固醇效应所建立的相同机制。 如前所述,MPOA是组织男性啮齿动物性行为的关键场所(Hull,Meisel和Sachs,2002)。 在仓鼠中,MPOA具有丰富的类固醇受体,MPOA中的睾酮植入物可以恢复长期阉割的性活动(Wood和Swann,1999)。 这些类固醇效应的时间过程缓慢:在睾丸切除术后持续数周的安装行为,并且延长类固醇暴露对于恢复长期阉割的交配是必要的(Noble和Alsum,1975)。 然而,注射雄性大鼠MPOA中的睾酮不能诱导CPP(King,Packard和Alexander,1999)。 这表明其他大脑区域对雄激素增强很重要。
相比之下,雄性大鼠将形成CPP注射Acb中的睾丸激素(Packard等,1997)。 与其他滥用药物一样,DA可能是睾酮强化的关键神经递质:全身性睾酮注射诱导的CPP被D1和D2多巴胺受体拮抗剂阻断(施罗德和帕卡德,2000)。 然而,与其他滥用药物不同,我们对仓鼠的研究表明,睾丸激素不会诱导Acb DA释放(Triemstra,Sato和Wood, 在新闻)。 同样,对雄性大鼠的研究表明,雄激素对基础DA水平或苯丙胺刺激的DA释放没有影响(Birgner,Kindlundh-Hogberg,Nyberg和Bergstrom,2006; 但也看到了 克拉克,林登菲尔德和吉本斯,1996)。 此外,睾酮对Acb DA组织水平的影响相对较小(Thiblin,Finn,Ross和Stenfors,1999)。 总之,这些数据表明尽管睾酮强化可能最终改变Acb中的DA活性,但其机制可能与可卡因或其他兴奋剂的机制不同。 在这方面,最近的数据表明长期暴露于AAS可能通过改变DA代谢改变对DA的敏感性(Kurling,Kankaanpaa,Ellermaa,Karila和Seppala,2005),DA受体水平(Kindlundh,Lindblom,Bergstrom,Wikberg和Nyberg,2001; Kindlundh,Lindblom和Nyberg,2003)或DA运输车(Kindlundh,Bergstrom,Monazzam,Hallberg,Blomqvist,Langstrom和Nyberg,2002).
目前,睾酮强化的特定类固醇信号,受体和脑部作用位点尚不清楚。 根据我们实验室最近对仓鼠的研究,睾丸激素的增强作用似乎是由雄激素和雌激素介导的(DiMeo和Wood,2006)。 常见的AAS包括可芳香和不可芳香的雄激素(加拉威,1997; WADA,2006)。 这意味着AR和ER都可以转导甾体刺激以获得奖励。 还有可能通过经典和非基因组受体的组合介导睾酮强化。
有几条证据表明非基因组受体在AAS增强作用中的作用。 除了Acb和VTA中AR的稀疏分布外,雄激素强化的时间过程也很迅速(<30分钟),并且通过经典AR进行的信号处理可能不够快。 因此,为了测试非基因组AR在AAS增强中的作用,我们利用了两种互补技术(图。 7)。 在一个实验中(Sato,Johansen,Jordan和Wood,2006),我们允许大鼠睾丸女性化突变(Tfm,见本期)自我给予二氢睾酮(DHT),一种不可芳香化的雄激素。 Tfm突变极大地减少了AR处的配体结合。 尽管如此,Tfm大鼠及其野生型男性兄弟姐妹自我施用大致相同量的DHT。 这支持DHT的非基因组效应。 在随后的一项研究中,我们确定雄性仓鼠是否会自我施用与牛血清白蛋白结合的DHT(BSA, 图。 8, 佐藤和伍德,2007)。 DHT-BSA缀合物是膜不可渗透的; 因此它们的作用仅限于细胞表面。 仓鼠自我管理DHT,如先前所示(DiMeo和Wood,2006)。 他们对DHT-BSA结合物表现出类似的偏好,但未能单独自行给予BSA。
这些数据指出细胞表面ARs在雄激素增强中的核心作用。 目前,这种受体的确切性质尚不清楚。 有人提出,雄激素可能通过与专用膜AR结合而在细胞表面起作用(Thomas,Dressing,Pang,Berg,Tubbs,Benninghoff和Doughty,2006,也看到这个问题)。 这可能是海马中报道的超核经典AR的形式(Sarkey等,本期)。 或者,先前的研究还描述了其他神经递质系统上的类固醇结合位点。 具体而言,包括AAS在内的多种类固醇激素可以变构调节GABA-A受体(亨德森,2007; Lambert,Belelli,Peden,Vardy和Peters,2003)。 同样,硫酸化神经甾体可以改变活性 N - 甲基D- 天冬氨酸受体亚型(Malayev,Gibbs和Farb,2002)受体。 这是未来研究的重要领域。
为什么要有膜AR? 如前所述,雄激素分泌与奖励社会行为之间存在密切关联。 我们可以推测,交配或战斗后睾酮分泌的增加有助于加强这种行为。 如果是这样,有必要快速耦合刺激(行为)和奖励(睾丸激素)。 这可以通过与膜AR结合来实现。 在这方面,确定在交配期间夹闭雄激素分泌是否会降低性行为的奖赏效果将是有意义的。
总结
在这里,我们回顾了雄激素是成人动机行为的有效介质的证据,并且进一步说明了在成年期开发程序中雄激素依赖性动机行为的雄激素暴露时间。 合成代谢类固醇正在迅速成为美国青少年滥用的药物。 虽然AAS可能没有可卡因或海洛因的成瘾能力,但我们才刚刚开始了解雄激素强化和成瘾的可能性。 特别是,随着青少年体育运动的竞争越来越激烈,开发运动员使用类固醇的压力越来越大,从年轻时开始。 鉴于青少年类固醇敏感性神经成熟的新证据,这种趋势令人不安。
尽管公众和科学界对青春期伴随的深刻神经变化的认识有所提高,但青春期发育神经生物学的实验研究却受到限制。 需要研究青少年发育的动物模型,以研究在发育过程中激素暴露的时间如何增加个体患精神病理学和药物的风险,以及哪种类型的经验减轻或放大了青春期时间偏差的行为影响。 例如,同伴影响等社会因素加剧了青春期时间对物质和酒精使用的影响(Biehl,Natsuaki和Ge,2007; Patton,Novy,Lee和Hickok,2004; Simons-Morton和Haynie,2003; Wichstrom和Pedersen,2001)。 青春期时间的动物模型也将为人类研究工作提供信息,并可能在青春期引发更有效的治疗干预措施。
致谢
我们感谢Eleni Antzoulatos,Cortney Ballard,Lucy Chu,Kelly Peters,Jennifer Triemstra,Jane Venier,Lisa Rogers和Pamela Montalto对这些研究的帮助。 这项工作得到了NIH(DA12843到RIW,MH68764到CLS,MH070125到KMS)的资助。
脚注
发布者的免责声明: 这是未经编辑的手稿的PDF文件,已被接受发布。 作为对我们客户的服务,我们正在提供该手稿的早期版本。 在以最终的可引用形式发布之前,稿件将进行复制,排版和审查。 请注意,在制作过程中可能会发现可能影响内容的错误,以及适用于该期刊的所有法律免责声明。
参考资料
- Alexander GM,Packard MG,Hines M. Testosterone在雄性大鼠中具有有益的情感特性:对性动机的生物学基础的影响。 行为神经科学。 1994;108:424-8。 [考研]
- 安徒生SL。 大脑发育的轨迹:脆弱点还是机会之窗? 神经科学与生物行为学评论。 2003;27:3-18。 [考研]
- Andersen SL,Rutstein M,Benzo JM,Hostetter JC,Teicher MH。 多巴胺受体过量产生和消除的性别差异。 “神经。 1997;8:1495-8。 [考研]
- Arnedo MT,Salvador A,Martinez-Sanchis S,Gonzalez-Bono E.在完整雄性小鼠中评估睾酮的特性:一项试验性研究。 药理学,生物化学与行为。 2000;65:327-32。
- Arnedo MT,Salvador A,Martinez-Sanchis S,Pellicer O.睾丸激素在小鼠中的类似奖励效果被评为短期和长期攻击潜伏期个体。 成瘾生物学。 2002;7:373-9。 [考研]
- Arnold AP,Breedlove SM。 性类固醇对大脑和行为的组织和激活作用:再分析。 激素与行为。 1985;19:469-98。 [考研]
- Benes FM,Taylor JB,Cunningham MC。 出生后内侧前额叶皮层单胺能系统的收敛性和可塑性:对精神病理学发展的影响。 大脑皮质。 2000;10:1014-27。 [考研]
- Benes FM,Turtle M,Khan Y,Farol P.海马结构中关键中继区的髓鞘形成发生在儿童,青春期和成年期的人脑中。 普通精神病学档案。 1994;51:477-84。 [考研]
- Biehl MC,Natsuaki MN,Ge XJ。 青春期时间对酒精使用和饮酒量大的影响。 青年与青少年杂志。 2007;36:153-167。
- Birgner C,Kindlundh-Hogberg AM,Nyberg F,Bergstrom L. 神经科学快报。 2006。 响应于亚慢性诺龙给药和随后的苯丙胺攻击,改变大鼠伏核中的DOPAC和HVA的细胞外水平。
- Bond AJ,Choi PY,Pope HG。,Jr评估合成代谢 - 雄激素类固醇的使用者和非使用者的注意力偏差和情绪。 毒品和酒精依赖。 1995;37:241-5。 [考研]
- Brower KJ。 合成代谢类固醇滥用和依赖。 目前的精神病学报告。 2002;4:377-87。 [考研]
- Brower KJ,Catlin DH,Blow FC,Eliopulos GA,Beresford TP。 合成代谢雄激素类固醇滥用和依赖的临床评估和尿液检测。 美国药物与酒精滥用杂志。 1991;17:161-171。 [考研]
- Celotti F,Negri-Cesi P,Poletti A.哺乳动物大脑中的类固醇代谢:5α-还原和芳构化。 脑研究公报。 1997;44:365-75。 [考研]
- Chung WC,De Vries GJ,Swaab DF。 人类纹状体末端床核的性别分化可延伸至成年期。 神经科学杂志。 2002;22:1027-33。 [考研]
- Clark AS,Henderson LP。 对合成代谢雄激素类固醇的行为和生理反应。 神经科学与生物行为学评论。 2003;27:413-36。 [考研]
- Clark AS,Lindenfeld RC,Gibbons CH。 合成代谢雄激素类固醇和大脑奖励。 药理学,生物化学与行为。 1996;53:741-5。
- Conacher GN,Workman DG。 暴力犯罪可能与合成代谢类固醇的使用有关。 美国精神病学杂志。 1989;146:679。 [考研]
- Cunningham RL,McGinnis MY。 青春期合成代谢雄激素类固醇暴露的雄性大鼠的物理激发引发对雌性的攻击。 激素与行为。 2006;50:410-6。 [考研]
- Daly RC,Su TP,Schmidt PJ,Pickar D,Murphy DL,Rubinow DR。 甲基睾酮给药后脑脊液和行为改变:初步结果。 普通精神病学档案。 2001;58:172-7。 [考研]
- Davis EC,Shryne JE,Gorski RA。 大鼠下丘脑前室周围核的结构性二态性对围产期类固醇敏感,但在青春期前发育。 神经内分泌学。 1996;63:142-8。 [考研]
- de Beun R,Jansen E,Slangen JL,Van de Poll NE。 睾丸激素作为大鼠的食欲和辨别刺激:性别和剂量依赖性影响。 生理与行为。 1992;52:629-34。 [考研]
- Dekaban AS。 人类生命跨度中脑重量的变化:脑重与身高和体重的关系。 神经病学年鉴。 1978;4:345-56。 [考研]
- Di Chiara G,Imperato A.被人类滥用的药物优先增加自由活动大鼠的中脑边缘系统中的突触多巴胺浓度。 美利坚合众国国家科学院院刊。 1988;85:5274-8。 [PMC免费文章] [考研]
- DiMeo AN,Wood RI。 雄性仓鼠中雌激素和二氢睾酮的自我给药。 激素与行为。 2006;49:519-26。 [考研]
- DiPasquale M.合成代谢类固醇。 在:Tarter RE,Ammerman RT,Ott PJ,编辑。 物质滥用手册。 全会出版社; 纽约:1998。 pp.547-565。
- Dominguez J,Riolo JV,Xu Z,Hull EM。 内侧杏仁核对交配和内侧视前多巴胺释放的调节作用。 神经科学杂志。 2001;21:349-355。 [考研]
- Dominguez JM,Hull EM。 内侧杏仁核的刺激增强了内侧视前多巴胺的释放:对雄性大鼠性行为的影响。 脑研究。 2001;917:225-229。 [考研]
- Du J,Lorrain DS,Hull EM。 阉割减少细胞外,但增加雄性大鼠内侧视前区的细胞内多巴胺。 脑研究。 1998;782:11-17。 [考研]
- Eckenhoff MF,Rakic P.在恒河猴生命期间海马齿状回中增殖细胞的性质和命运。 神经科学杂志。 1988;8:2729-47。 [考研]
- Everitt BJ,Stacey P.关于雄性大鼠(Rattus norvegicus)性强化器官行为的研究:II。 视前区病变,去势和睾酮的影响。 比较心理学杂志。 1987;101:407-19。 [考研]
- 加拉威 类固醇圣经。 百丽国际出版社; 萨克拉门托,加利福尼亚州:1997。
- Galligani N,Renck A,Hansen S.使用合成代谢雄激素类固醇的男性的人格特征。 激素与行为。 1996;30:170-5。 [考研]
- Grimes JM,Melloni RH。,Jr在仓鼠(Mesocricetus auratus)停止青春期合成代谢雄激素类固醇暴露后血清素神经系统的长期改变 行为神经科学。 2006;120:1242-51。 [考研]
- Hannan CJ,Jr,Friedl KE,Zold A,Kettler TM,Plymate SR。 男性给予雄激素类固醇的心理和血清高香草酸变化。 心理神经。 1991;16:335-43。 [考研]
- Harrison RJ,Connor DF,Nowak C,Nash K,Melloni RH。,Jr慢性合成代谢 - 雄激素类固醇治疗在青春期增加前下丘脑血管加压素和完整仓鼠的攻击性。 心理神经。 2000;25:317-38。 [考研]
- He J,Crews FT。 从青春期到成年期,脑成熟过程中神经发生减少。 药理学,生物化学与行为。 2007;86:327-33。
- 亨德森LP。 类固醇调节GABAA受体介导的下丘脑传播:对生殖功能的影响。 神经药理学。 2007;52:1439-53。 [PMC免费文章] [考研]
- Hull EM,Du J,Lorrain DS,Matuszewich L.内侧视前区的细胞外多巴胺:对性交动和交配激素控制的影响。 神经科学杂志。 1995;15:7465-7471。 [考研]
- Hull EM,Meisel RL,Sachs BD。 男性性行为。 在:Pfaff DW,Arnold AP,Etgen AM,Fahrbach SE,Rubin RT,编辑。 激素,大脑和行为。 学术出版社; 纽约:2002。 pp.3-137。
- Hull EM,Wood RI,McKenna KE。 男性性行为的神经生物学。 在:Neill JD,编辑。 生殖生理学。 卷。 1。 爱思唯尔出版社; 纽约:2006。 pp.1729-1824。
- Huttenlocher PR,Dabholkar AS。 人类大脑皮层突触发生的区域差异。 比较神经病学杂志。 1997;387:167-78。 [考研]
- 约翰逊LR,伍德罗。 雄性仓鼠口服睾酮自我给药。 神经内分泌学。 2001;73:285-92。 [考研]
- Johnston LD,O'Malley PM,Bachman JG。 中学生(NIH出版物编号03-5375) I. Bethesda,MD:国家药物滥用研究所; 2003。 监测未来全国药物使用调查结果,1975-2002。
- 凯撒家庭基金会。 美国青少年的性活动。 2005。 pp。#3040-02。
- Kashon ML,Hayes MJ,Shek PP,Sisk CL。 青春期雄性雪貂雄激素对脑雄激素受体免疫反应的调节作用。 生殖生物学。 1995;52:1198-205。 [考研]
- Kindlundh AM,Bergstrom M,Monazzam A,Hallberg M,Blomqvist G,Langstrom B,Nyberg F.用正电子发射断层扫描在大鼠脑中观察到的长诺龙治疗后的多巴胺能效应。 神经心理药理学和生物精神病学的进展。 2002;26:1303-8。
- Kindlundh AM,Lindblom J,Bergstrom L,Wikberg JE,Nyberg F.合成代谢雄激素类固醇诺龙癸酸酯影响雄性大鼠脑中多巴胺受体的密度。 欧洲神经科学杂志。 2001;13:291-6。 [考研]
- Kindlundh AM,Lindblom J,Nyberg F.癸酸诺龙的慢性给药诱导大鼠脑中多巴胺D(1)和D(2)受体基因转录物含量的改变。 脑研究。 2003;979:37-42。 [考研]
- King BE,Packard MG,Alexander GM。 内侧视前区注射雄性大鼠睾酮的情感特性。 神经科学快报。 1999;269:149-52。 [考研]
- Koob GF,Nestler EJ。 吸毒成瘾的神经生物学。 神经精神病学与临床神经科学杂志。 1997;9:482-97。 [考研]
- Kouri EM,Lukas SE,Pope HG,Jr,Oliva PS。 在逐渐增加剂量的睾酮环丙酸盐给药后,男性志愿者的积极响应增加。 毒品和酒精依赖。 1995;40:73-9。 [考研]
- Kritzer MF。 长期性腺切除术影响成年雄性大鼠的内侧前额叶皮质中酪氨酸羟化酶 - 但不是多巴胺-β-羟化酶 - ,胆碱乙酰转移酶 - 或5-羟色胺 - 免疫反应性轴突的密度。 大脑皮质。 2003;13:282-296。 [考研]
- Kurling S,Kankaanpaa A,Ellermaa S,Karila T,Seppala T.亚慢性诺龙癸酸酯治疗对大鼠脑内多巴胺能和5-羟色胺能神经系统的影响。 脑研究。 2005;1044:67-75。 [考研]
- Lambert JJ,Belelli D,Peden DR,Vardy AW,Peters JA。 神经类固醇调节GABAA受体。 神经生物学的进展。 2003;71:67-80。 [考研]
- Lenroot RK,Giedd JN。 儿童和青少年的大脑发育:解剖学磁共振成像的见解。 神经科学与生物行为学评论。 2006;30:718-29。
- Lesting J,Neddens J,Teuchert-Noodt G.在沙鼠伏隔核中多巴胺神经支配的拓扑结构。 脑研究。 2005;1066:16-23。 [考研]
- Malayev A,Gibbs TT,Farb DH。 孕烯醇酮硫酸盐对NMDA反应的抑制揭示了硫酸化类固醇对NMDA受体的亚型选择性调节。 英国药理学杂志。 2002;135:901-9。 [PMC免费文章] [考研]
- Martinez M,Guillen-Salazar F,Salvador A,Simon VM。 小鼠成功的人际攻击和条件性位置偏好。 生理与行为。 1995;58:323-8。 [考研]
- Meek LR,Romeo RD,Novak CM,Sisk CL。 青春期前和青春期后雄性仓鼠中睾酮的作用:对生殖行为和脑雄激素受体免疫反应性的影响的解离。 激素与行为。 1997;31:75-88。
- Meisel RL,Joppa MA。 在侵略性或性接触后的雌性仓鼠的条件性地方偏好。 生理与行为。 1994;56:1115-8。 [考研]
- Melloni RH,Jr,Connor DF,Hang PT,Harrison RJ,Ferris CF. 青春期的合成代谢雄激素类固醇暴露和金黄地鼠的攻击行为。 生理学和行为学。 1997;61:359-64。 [考研]
- Menard C,Harlan R.通过雄激素 - 合成代谢类固醇上调大鼠脑中雄激素受体免疫反应性。 脑研究。 1993;622:226-236。 [考研]
- Mermelstein PG,Becker JB,Surmeier DJ。 雌二醇通过膜受体减少大鼠新纹状体神经元中的钙电流。 神经科学杂志。 1996;16:595-604。 [考研]
- Midgley SJ,Heather N,Davies JB。 一组合成代谢雄激素类固醇使用者的攻击水平。 医学,科学与法律。 2001;41:309-14。
- Molenda-Figueira HN,Salas-Ramirez KY,Schulz KM,Zehr JL,Montalto PR,Sisk CL。 青少年社交经验恢复了缺乏青春期睾丸激素的雄性叙利亚仓鼠的成人射精行为。 行为神经内分泌学会; Pacific Grove,CA:2007。
- 贵族RG,Alsum PB。 金黄地鼠(Mesocricetus auratus)中的激素依赖性二态性 生理与行为。 1975;14:567-74。 [考研]
- Nunez JL,Lauschke DM,Juraska JM。 雄性和雌性大鼠后皮质发育过程中的细胞死亡。 比较神经病学杂志。 2001;436:32-41。 [考研]
- Nunez JL,Sodhi J,Juraska JM。 出生后20后的卵巢激素减少大鼠初级视皮层的神经元数量。 神经生物学杂志。 2002;52:312-21。 [考研]
- O'Connor DB,Archer J,Wu FC。 睾丸激素对年轻男性情绪,攻击性和性行为的影响:双盲,安慰剂对照,交叉研究。 临床内分泌与代谢杂志。 2004;89:2837-45。 [考研]
- Packard MG,Cornell AH,Alexander GM。 奖励伏隔核内注射睾酮的情感特性。 行为神经科学。 1997;111:219-24。 [考研]
- Parfitt DB,Thompson RC,Richardson HN,Romeo RD,Sisk CL。 GnRH mRNA在雄性叙利亚仓鼠脑中随着青春期而增加。 神经内分泌学杂志。 1999;11:621-7。 [考研]
- Parrott AC,Choi PY,Davies M. Anabolic类固醇由业余运动员使用:对心理情绪状态的影响。 运动医学与健身杂志。 1994;34:292-8。 [考研]
- Patton PE,Novy MJ,Lee DM,Hickok LR。 完全隔膜子宫,重复子宫颈和阴道隔膜手术治疗后的诊断和生殖结果。 美国妇产科杂志。 2004;190:1669-75。 1675-8。 [考研]
- Paus T,Collins DL,Evans AC,Leonard G,Pike B,Zijdenbos A.人脑中白质的成熟:磁共振研究综述。 脑研究公报。 2001;54:255-66。 [考研]
- Perry PJ,Kutscher EC,Lund BC,Yates WR,Holman TL,Demers L.使用和不使用雄激素合成代谢类固醇的男性举重运动员的攻击性和情绪变化的测量。 法医学杂志。 2003;48:646-51。 [考研]
- Peters KD,Wood RI。 仓鼠中的雄激素依赖:过量,耐受和潜在的opioidergic机制。 神经科学。 2005;130:971-81。 [考研]
- Pfaus JG,Damsma G,Nomikos GG,Wenkstern DG,Blaha CD,Phillips AG,Fibiger HC。 性行为增强雄性大鼠的中枢多巴胺传递。 脑研究。 1990;530:345-348。 [考研]
- Phoenix CH,Goy RW,Gerall AA,Young WC。 组织产前施用丙酸睾酮对介导雌性豚鼠交配行为的组织的作用。 内分泌。 1959;65:369-82。 [考研]
- Pinos H,Collado P,Rodriguez-Zafra M,Rodriguez C,Segovia S,Guillamon A.大鼠蓝斑中性别差异的发展。 脑研究公报。 2001;56:73-8。 [考研]
- 教皇HG,Jr,Katz DL。 合成代谢类固醇使用者的凶杀和近杀人。[见评论] 临床精神医学杂志。 1990;51:28-31。 [考研]
- 教皇HG,Jr,Katz DL。 使用合成代谢雄激素类固醇的精神和医学影响。 160运动员的对照研究。 普通精神病学档案。 1994;51:375-82。 [考研]
- Pope HG,Jr,Kouri EM,Powell KF,Campbell C,Katz DL。 133囚犯使用合成代谢雄激素类固醇。 综合精神病学。 1996;37:322-7。 [考研]
- Putnam SK,Du J,Sato S,Hull EM。 睾酮恢复交配行为与阉割雄性大鼠的内侧视前多巴胺释放相关。 激素与行为。 2001;39:216-224。 [考研]
- Putnam SK,Sato S,Hull EM。 睾酮代谢物对去势雄性大鼠交配和内侧视前多巴胺释放的影响。 激素与行为。 2003;44:419-26。 [考研]
- Putnam SK,Sato S,Riolo JV,Hull EM。 睾酮代谢物对去势雄性大鼠交配,内侧视前多巴胺和NOS免疫反应的影响。 激素与行为。 2005;47:513-522。 [考研]
- Rankin SL,Partlow GD,McCurdy RD,Giles ED,Fisher KR。 产后神经发生在下丘脑猪的加压素和含催产素的细胞核中。 脑研究。 2003;971:189-96。 [考研]
- Ricci LA,Rasakham K,Grimes JM,Melloni RH。,Jr 5-羟色胺-1A受体活性和表达调节青春期合成代谢/雄激素类固醇诱导的仓鼠攻击。 药理学,生物化学与行为。 2006;85:1-11。
- Romeo RD,Cook-Wiens E,Richardson HN,Sisk CL。 二氢睾酮可激活成年雄性仓鼠的性行为,但不会侵袭青少年。 生理与行为。 2001;73:579-84。 [考研]
- Romeo RD,Diedrich SL,Sisk CL。 青春期前和成年雄性叙利亚仓鼠的雌激素受体免疫反应性。 神经科学快报。 1999;265:167-70。 [考研]
- Romeo RD,Parfitt DB,Richardson HN,Sisk CL。 信息素在青春期前和成年雄性叙利亚仓鼠中引起相同水平的Fos免疫反应性。 激素与行为。 1998;34:48-55。 [考研]
- Romeo RD,Richardson HN,Sisk CL。 青春期和男性大脑的成熟和性行为:重塑行为潜力。 神经科学与生物行为学评论。 2002a;26:381-91。 [考研]
- Romeo RD,Wagner CK,Jansen HT,Diedrich SL,Sisk CL。 雌二醇诱导下丘脑黄体酮受体,但在青春期前不会激活雄性仓鼠(Mesocricetus auratus)的交配行为。 行为神经科学。 2002b;116:198-205。 [考研]
- Salas-Ramirez KY,Montalto PR,Sisk CL。 合成代谢雄激素类固醇(AAS)差异性地影响青少年和成年男性叙利亚仓鼠的社会行为。 激素与行为。 2008 在新闻。
- SAMHSA /美洲国家组织。 DHHS出版号(SMA) 1996。 1994全国家庭药物滥用调查,主要调查结果1994; pp.96-3085。
- SAMHSA /美洲国家组织。 2004全国药物使用和健康调查结果:国家调查结果。 2005。 NSDUH系列H-28,DHHS出版号SMA 05-4062。
- Sato SM,Johansen J,Jordan CL,Wood RI。 雄激素在Tfm大鼠中自我给药。 10th行为神经内分泌学会年会.2006。
- Sato SM,Wood RI。 在叙利亚仓鼠中自我施用膜不可渗透的合成代谢雄激素类固醇(aas)。 11th行为神经内分泌学会年会.2007。
- Schroeder JP,Packard MG。 多巴胺受体亚型在获得大鼠睾酮条件性位置偏爱中的作用。 神经科学快报。 2000;282:17-20。 [考研]
- Schulte HM,Hall MJ,Boyer M.家庭暴力与合成代谢类固醇滥用有关。 美国精神病学杂志。 1993;150:348。 [考研]
- Schulz KM,Menard TA,Smith DA,Albers HE,Sisk CL。 青春期睾丸激素暴露在侧隔中组织侧翼标记行为和血管加压素受体结合。 激素与行为。 2006;50:477-83。 [考研]
- Schulz KM,Richardson HN,Romeo RD,Morris JA,Lookingland KJ,Sisk CL。 在雄性叙利亚仓鼠的青春期期间,对女性信息素的内侧视前区多巴胺能反应发展。 脑研究。 2003;988:139-45。 [考研]
- Schulz KM,Richardson HN,Zehr JL,Osetek AJ,Menard TA,Sisk CL。 性腺激素在雄性叙利亚仓鼠的青春期期间男性化和摧毁生殖行为。 激素与行为。 2004;45:242-9。 [考研]
- Schulz KM,Sisk CL。 青春期激素,青春期大脑和社会行为的成熟:叙利亚仓鼠的教训。 分子与细胞内分泌学。 2006:254–255. 120–6.
- Schulz KM,Zehr JL,Salas-Ramirez KY,Sisk CL。 神经科学会议策划人。 加利福尼亚州桑迪戈:神经科学学会; 2007。 青春期是睾丸激素对成年男性生殖行为组织影响的第二个敏感期吗? 2007 Online。
- Scott JP,Stewart JM,De Ghett VJ。 系统组织的关键时期。 发展心理生物学。 1974;7:489-513。 [考研]
- Shughrue PJ,Lane MV,Merchenthaler I.雌激素受体-α和-beta mRNA在大鼠中枢神经系统中的比较分布。 比较神经病学杂志。 1997;388:507-25。 [考研]
- Simons-Morton BG,Haynie DL。 六年级学生吸烟阶段增加的社会心理预测因素。 美国健康行为杂志。 2003;27:592-602。 [考研]
- Sisk CL,Zehr JL。 青春期激素组织青春期的大脑和行为。 神经内分泌学的前沿。 2005;26:163-74。 [考研]
- Sowell ER,Thompson PM,Leonard CM,Welcome SE,Kan E,Toga AW。 正常儿童皮质厚度和脑发育的纵向绘图。 神经科学杂志。 2004;24:8223-31。 [考研]
- Sowell ER,Thompson PM,Tessner KD,Toga AW。 绘制持续的大脑生长和背侧额叶皮层的灰质密度减少:在青春期后脑成熟过程中的反向关系。 神经科学杂志。 2001;21:8819-29。 [考研]
- Spear LP。 青春期大脑和年龄相关的行为表现。 神经科学与生物行为学评论。 2000;24:417-63。
- Su TP,Pagliaro M,Schmidt PJ,Pickar D,Wolkowitz O,Rubinow DR。 合成代谢类固醇在男性正常志愿者中的神经精神效应。 1537-1538。 1993;269:2760-4。 [考研]
- Thiblin I,Finn A,Ross SB,Stenfors C.在长期使用合成代谢雄激素类固醇治疗后,雄性大鼠脑中多巴胺能和5-羟基色胺能活性增加。 英国药理学杂志。 1999;126:1301-6。 [PMC免费文章] [考研]
- Thomas P,Dressing G,Pang Y,Berg H,Tubbs C,Benninghoff A,Doughty K. Progestin,雌激素和雄激素G蛋白偶联受体在鱼类性腺中。 类固醇。 2006;71:310-6。 [考研]
- Tricker R,Casaburi R,Store TW,Clevenger B,Berman N,Shirazi A,BhasinS。超生理剂量的睾丸激素对健康的性腺男子生气行为的影响-临床研究中心研究。 临床内分泌与代谢杂志。 1996;81:3754-8。 [考研]
- Triemstra JL,Nagatani S,Wood RI。 化学感应线索对雄性叙利亚仓鼠MPOA中交配诱导的多巴胺释放至关重要。 神经精神药理学。 2005;30:1436-42。 [考研]
- Triemstra JL,Sato SM,Wood RI。 雄性叙利亚仓鼠中的睾酮和伏隔核多巴胺。 心理神经 (在新闻)
- Van Eenoo P,Delbeke FT。 与国际体育中使用兴奋剂的比例相比,法兰德斯使用兴奋剂的普遍程度。 国际运动医学杂志。 2003;24:565-570。 [考研]
- 世界反兴奋剂机构。 经认可的实验室报告的不良分析结果。 2006. http://www.wada-ama.org.
- Wesson DW,McGinnis MY。 在大鼠青春期堆积合成代谢雄激素类固醇(AAS):神经内分泌和行为评估。 药理学,生物化学与行为。 2006;83:410-9。
- Wichstrom L,Pedersen W.在青春期使用合成代谢雄激素类固醇:获胜,看起来好还是坏? 酒精研究杂志。 2001;62:5-13。 [考研]
- Wood RI,Johnson LR,Chu L,Schad C,Self DW。 睾酮强化:雄性大鼠和仓鼠的静脉内和脑室内自我给药。 精神药理学。 2004;171:298-305。 [考研]
- Wood RI,Newman SW。 雄激素和雌激素受体与叙利亚仓鼠大脑中的个体神经元共存。 神经内分泌学。 1995;62:487-97。 [考研]
- Wood RI,Swann JM。 控制男性性行为的化学感受和激素信号的神经元整合。 在:Wallen K,Schneider JS,编辑。 在上下文中复制。 MIT出版社; 剑桥:1999。 pp.423-444。
- Zahm DS,Heimer L.两种起源于大鼠伏隔核的晶状体通路。 比较神经病学杂志。 1990;302:437-46。 [考研]