伏隔核多巴胺介导苯丙胺诱导的一夫一妻制啮齿动物社会结合的损害
伏隔核多巴胺介导苯丙胺诱导的一夫一妻制啮齿动物社会结合的损害
Proc Natl Acad Sci US A. Jan 19,2010; 107(3):1217-1222。
在线发布Dec 29,2009。 DOI: 10.1073 / pnas.0911998107
PMCID:PMC2824263
神经
刘艳,a,b 布兰登J.阿拉戈纳,c 金伯利A.杨,a,b 大卫M.迪茨,b,d,e 穆罕默德卡巴伊,b,d Michelle Mazei-Robison,e Eric J. Nestler,e 和 王作新a,b,1
这篇文章已经 被引用 PMC的其他文章。
抽象
草原田鼠(Microtus ochrogaster)是一种社会一夫一妻制的啮齿动物物种,在交配后形成配对键,这是一种与中枢多巴胺(DA)有牵连的行为。 在这里,我们使用雄性草原田鼠来检查药物暴露对配对结合和相关神经回路的影响。 在我们的第一个实验中,使用条件性位置偏爱(CPP)范例检查安非他明(AMPH)动机行为,并且显示由D1样DA受体的激活介导。 接下来,我们检查了重复AMPH暴露对配对键合的影响。 完整和盐水预处理的对照雄性显示出交配诱导的伴侣偏好,而以有效诱导CPP的剂量用AMPH预处理的雄性不能显示交配诱导的伴侣偏好。 这种AMPH治疗也增强了D1,但在伏隔核(NAcc)中没有D2,DA受体表达。 此外,NAcc中D1样DA受体的药理学阻断挽救了AMPH处理的雄性中交配诱导的伴侣偏好。 总之,我们的数据表明重复的AMPH暴露可能通过NAcc中的DA受体特异性机制缩小雄性草原田鼠的行为库,导致配对键形成的损害。
人们普遍认为,促进健康的动机和情绪行为受到包括中脑边缘多巴胺(DA)系统在内的脑回报电路的调节(1, 2)。 虽然这个系统经常与食物摄入和性行为有关(3, 4),它也与其他自然发生的动机行为有关,例如青少年之间的社交游戏和父母与子女之间的社会联系(5–9)。 在研究中通常代表性不足的是成年配偶之间形成的社会纽带,即配对债券。 最近的调查使用社会一夫一妻制的啮齿动物物种,草原田鼠(Microtus ochrogaster)(10–12),表明在伏隔核(NAcc)内发生了大量的对键形成和维持的神经调节(13–15) - 中脑边缘脑区对于调节动机行为至关重要(1, 2, 16).
虽然动机电路进化到促进健身增强行为,如喂养,交配和社交联系(1, 17),它很容易受到滥用药物的人为篡夺(8)。 例如,滥用精神兴奋剂药物如可卡因和苯丙胺(AMPH)会导致中脑边缘DA活性的持续改变(18, 19)。 这些和其他成瘾药物对这条赛道的强烈影响被认为会降低自然激励的感知价值(20),包括社会性质的(8)。 虽然众所周知吸毒成瘾者的社交行为受损(21),对药物经验与社会依恋之间相互作用的神经调节知之甚少。 这是因为,部分地,这种相互作用难以在传统的实验室啮齿动物中建模,所述传统的实验室啮齿动物不表现出成年同种之间的社会联系。
这种社会依恋的神经生物学,特别是成年人之间的结合,已经在草原田鼠中进行了广泛的研究(10–12),最近,该物种已成为检验AMPH动机价值的可行模型(22)。 此外,对键形成和AMPH强化都至少部分地通过NAcc内的DA传递介导(14, 15, 23)。 因此,本研究使用草原田鼠模型建立行为测定法来研究药物暴露对社会结合的影响,并集中于NAcc DA信号系统,以揭示这些行为效应背后的神经机制。
成果
AMPH诱导条件性位置偏爱(CPP)由DA以受体特异性方式介导。
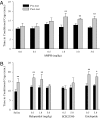
CPP的形成定义为相对于预测试,在AMPH调节的3天后,在后测试期间AMPH配对笼中花费的时间显着增加。 生理盐水注射和含有两种最低剂量AMPH的盐水(0.1和0.5 mg / kg)都没有改变笼子的喜好(图。 1A)。 然而,男性接受更高剂量的AMPH,包括1.0(t = 2.87, P <0.01),3.0(t = 3.63, P <0.01)或5.0 mg / kg(t = 3.03, P <0.01),显示的CPP(图。 1A).
因为AMPH显着增加草原田鼠的DA神经传递(24)和DA介导其他物种的AMPH增强(23),我们接下来检测了雄性草原田鼠中AMPH诱导的CPP的DA受体(DAR)调节。 在CPP范例中预先测试受试者,在调节的1.0天期间用AMPH(3mg / kg)注射之前用含有不同剂量的非选择性DAR拮抗剂(氟哌啶醇)的盐水或盐水治疗,然后在测试后测试CPP。 用盐水治疗的受试者(t = 2.69, P <0.01)或含两种最低剂量氟哌啶醇(0.1 mg / kg; t = 3.62, P <0.01; 1.0 mg / kg; t = 3.89, P <0.01)之前AMPH调理显示AMPH诱导的CPP,而5.0 mg / kg的氟哌啶醇则阻断了AMPH诱导的CPP,表明DARs参与了AMPH的行为效应(图。 1B)。 为了确定哪种DAR亚型介导AMPH诱导的CPP,我们接下来在调节期间在AMPH注射之前施用D1样特异性拮抗剂(SCH23390)或D2样特异性拮抗剂(依替必利)。 D2样拮抗作用不会阻断AMPH诱导的CPP(t = 3.15, P 0.01 mg / kg <0.5 t = 2.60, P 对于0.05 mg / kg埃替普利特<5.0,但D1样受体的阻滞消除了AMPH诱导的CPP(图。 1B),证明AMPH诱导的CPP是由雄性草原田鼠中D1样活化而非D2样受体激活介导的。
AMPH经验改变了由交配引起的伙伴偏好形成。
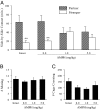
尽管AMPH诱导的CPP需要激活D1样受体(图。 1B),我们之前已经证明D1样受体的激活可以防止交配诱导的双键形成(14)。 因此,我们假设AMPH预处理会干扰雄性草原田鼠中交配诱导的配对结合。 将雄性分为四组,其未接受注射(完整),盐水注射,或注射1.0或5.0 mg / kg AMPH用于3天(足以诱导CPP的注射范例)。 在第四天,所有男性都与24 h的性接受女性配对,然后测试伴侣偏好。 与之前的研究一致(14, 25–27),在交配前3天接受盐水注射的完整雄性和雄性表现出交配诱导的伴侣偏好(完整的雄性; t = 3.05, P <0.01,注射生理盐水的雄性; t = 3.21, P <0.01; 图。 2A)。 然而,在交配前用3天剂量AMPH预处理的雄性不能显示伴侣偏好(图。 2A)。 重要的是,AMPH预处理不会影响同居期间的交配频率(F(3,26) = 0.26, P = 0.85; 图。 2B)或伴侣偏好测试期间的运动活动(F(3,26)= 2.34, P = 0.10; 图。 2C),表明AMPH直接干扰交配引起的伴侣偏好。
AMPH体验提升了NAcc的D1受体。
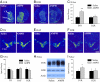
鉴于AMPH预暴露会影响伴侣偏好以及AMPH诱导的CPP(见上文)和配对结合(14由NAcc DA调节,我们假设AMPH会显着改变雄性草原田鼠的中脑边缘DA电路。 处理来自上述行为实验的受试者的脑用于DA标记mRNA的原位标记。 用AMPH治疗的男性(1.0 mg / kg)显示D1受体显着增加(D1R; t = 3.06, P <0.01),但不接受D2受体(D2R),NAcc中的mRNA标记,与接受盐水预处理的雄性相比(图。 3 A–C)。 但是,在腹侧被盖区(VTA)内的酪氨酸羟化酶(TH),DA转运蛋白(DAT)或D2R的mRNA标记的密度上没有发现组差异-脑区是向NAcc提供主要多巴胺能输入的大脑区域(图。 3 D–G)。 通过蛋白质印迹进一步证实了NAcc中D1R的表达增加(t = 1.90, P <0.05; 图。 3 H 和 I)。 总之,这些数据表明AMPH暴露对雄性草原田鼠的中脑边缘DA系统具有受体和位点特异性影响 - 增加了NAcc中D1R的水平。
NAcc中的D1受体调解合作伙伴偏好的AMPH损害。
我们之前已经证明,在雄性草原田鼠中,NAcc内D1R的激活阻止了伴侣偏好的形成(14),目前的研究表明,AMPH暴露上调了NAcc中的D1Rs(图。 3)。 因此,我们测试了AMPH诱导的伴侣偏好损伤由NAcc内的D1R介导的假设。 男性接受立体定向插管,双侧瞄准NAcc外壳(图。 4A)。 在1天数调节期间,在AMPH注射(23390 mg / kg)之前,将单独的人工脑脊髓液(CSF)或含有不同剂量的D1.0样受体拮抗剂SCH3的CSF注射到NAcc中。 此后,受试者与女性配对24 h,然后测试伴侣偏好。 与上面的实验一样(图。 2),AMPH暴露可防止接受NAF内注射CSF或低剂量SCH23390的男性中交配诱导的伴侣偏好(图。 4B)。 然而,注射高剂量SCH23390(100 ng / kg)的男性显示出伴侣偏好(t = 2.55, P <0.05),表明NAcc中的D1R阻断消除了AMPH诱导的伴侣偏好形成障碍(图。 4B)。 在伴侣偏好测试期间,在同居或运动活动期间没有发现组间交配频率的差异。
讨论
在这项研究中,我们复制了我们之前的发现,即AMPH暴露在雄性草原田鼠中诱导CPP(22并证明NAN中的D1R激活对于这种行为是必需的,这一结果与其他啮齿动物物种的研究一致(28)。 这一发现与早期研究一起表明,NAcc中不同的DAergic机制调节AMPH和伴侣动机行为:AMPH动机行为(CPP)由D1R介导,而伴侣动机行为(伴侣偏好)由D2R促进激活并在NAcc内激活D1R(13–15)。 [值得注意的是,在NAcc中,D2R激活在某些条件下介导药物诱导的CPP(29)和D1R激活涉及其他社会动机行为,例如针对后代的行为(7, 30)]。
CPP和伴侣偏好形成的差异性DAergic调节最有可能通过激活不同DAR亚型的刺激诱发的DA浓度的差异来实现。 由于结合亲和力的差异,DA浓度的强烈升高需要激活低亲和力D1R,而DA浓度的适度增加优先激活高亲和力D2Rs(31)。 在草原田鼠中,AMPH引起DA浓度的更大增加(24与交配引起的相比(15, 25)。 这些数据表明社交互动期间DA浓度相对适度增加(15, 25)允许特异性激活高亲和力D2R,从而促进配对键形成。 相反,AMPH施用后DA浓度的强烈增加可能足以激活低亲和力D1R,从而促进AMPH诱导的CPP。
DA的受体特异性行为调节与自由活动的大鼠的细胞外电生理学研究一致,表明药物和自然刺激由NAcc内的不同神经元群体处理(32)。 虽然这种电生理学研究无法识别单个神经元上表达的DA受体亚型,但解剖学研究表明,NAcc由表达D1Rs或D2Rs的投射神经元组成,共表达非常少(33)。 精神兴奋剂优先激活D1R下游的细胞内信号通路(由信号分子磷酸化增加决定)(34并且我们之前已经表明,这些信号通路的激活增加会阻止伴侣偏好的形成(35)。 因此,虽然NAcc内的DA传递在对AMPH的反应和伴侣偏好的形成中起重要作用,但这些行为可能通过包含纹状体投影系统的不同微循环介导(33, 36)。 这是特别令人感兴趣的,因为配对键形成是由表达D2R的神经元激活介导的,这些神经元优先投射到腹侧苍白球(33),另一个对配对重要的大脑区域(26).
在本研究中,我们提供了AMPH经验可防止交配诱导的配对结合的证据。 由于这些实验中的伴侣偏好测试在最后一次AMPH暴露后(即,在药物完全代谢后)进行了48 h,这些数据表明AMPH对社会结合的持续影响。 一种潜在的机制,与AMPH在其他物种中的作用一致(37, 38),AMPH可能通过增加NAcc内的D1R表达而损害配对键合。 NAcc D1Rs在伴侣偏好形成中的拮抗作用支持了这一观点(14, 24并且通过目前的数据证明在AMPH治疗的动物中通过NAcc内D1R阻断来挽救交配诱导的伴侣偏好(图。 4)。 有趣的是,我们之前已经证明,在雄性草原田鼠中,在1周对结合后上调NAcc D2R有助于对同种陌生人(包括有性接受的雌性)的选择性攻击,这表明这种神经可塑性是雄性田鼠的进化机制。保持已建立的配对债券(14)。 目前的研究表明,AMPH人为地触发了这种神经可塑性,导致配对键合的AMPH损伤。 AMPH治疗的雄性也可能使雌性与AMPH戒断的厌恶状态相关联,因此这种负相关可能构成配对结合的AMPH损伤的基础。 之前的一项研究表明,戒断不断增加的d-苯丙胺剂量计划会削弱雄性大鼠的性行为(39)。 然而,在我们的研究中,来自不同治疗组的田鼠表现出相似的交配次数(图。 2B),表明他们可能没有从安非他明撤出的状态。 然而,这种可能性需要进一步调查。
众所周知,药物诱导的神经可塑性是药物成瘾的基础(40)。 精神兴奋剂显着改变中脑边缘DA系统的结构可塑性(41并且有证据表明这种变化在D1表达神经元中更持久(37)。 此外,电生理学研究表明,可卡因经验可以减少NAcc内的后续神经可塑性(42)。 事实上,NAcc的药物诱导神经重组减弱了新型暴露于复杂环境后的自然发生的神经重组(43)。 因此,虽然药物成瘾被广泛认为是一种学习和记忆障碍(1, 40, 44),经常被低估的是,药物诱导的中脑边缘电路中额外改变的可能性丧失对于成瘾也是必不可少的。 可塑性的这种降低可能限制了寻求药物的行为特征。 因此,AMPH处理的田鼠表现出降低的配对键合行为并不奇怪。 AMPH暴露对配对结合的当前影响与以前的研究一致,这些研究说明了精神兴奋剂对其他社会行为的有害影响,包括母性行为(45–47)和社交游戏(48–50)。 总之,这些工作提供了一种承诺,即检查药物和社会刺激如何在大脑中相互作用可以显着扩展我们对社会行为与人类吸毒之间强烈相互作用的理解(21).
材料和方法
学科。
受试者是来自实验室繁殖群体的性天真的雄性草原田鼠。 受试者在21天龄断奶并且在塑料笼中以同性同胞对饲养(12×28×16cm),其中随意提供水和食物。 所有笼子保持在14:10明暗循环下,温度约为20℃。 所有受试者在测试时均为90天龄。 立体定向插管和DA药物的部位特异性输注已在别处详细描述(14).
行为测试。
如前所述进行CPP测试(22)以下例外情况。 在30日的1-min预测试中确定每个受试者的初始笼优选。 然后在40分钟期间将受试者用AMPH调节至非优选笼,并将盐水调节至优选笼(同一天给予AMPH和盐水注射,6 h除以),连续3天(2-4天)。 此后,在5天测试受试者(后测试)是否存在CPP。
合作伙伴偏好测试如前所述进行(14)。 简而言之,测试装置由中空笼(12×28×16 cm)组成,中心笼由空心管(7.5×16 cm)连接到两个平行的相同笼子,每个笼子容纳刺激动物。 刺激动物是熟悉的“伙伴”(受试者的女性伴侣)和一个不熟悉的“陌生人”(以前没有遇到过这个主题的女性),它们松散地系在他们各自的笼子里而没有彼此直接接触。 在3-h测试开始时,将受试者置于中央笼中并使其在整个装置中自由移动。 使用延时视频记录系统记录行为。 对操作视而不见的实验者审查了录像带并记录了受试者的行为。 合作伙伴偏好被定义为主题与合作伙伴并肩消费的时间明显多于陌生人,如配对样本所示 t 测试(27).
原位杂交和Western免疫印迹。
特异性反义核糖核酸探针(表1)用于D1R,D2R,TH和DAT原位mRNA标记。 用标签进行标记 35如前所述,每种DA标记的S标记探针和有义mRNA对照(51)。 对于Western印迹分析,从NAcc组织冲头的上清液中提取DAR蛋白并如前所述进行测定(52).
数据量化和分析。
CPP和合作伙伴偏好由配对样本确定 t 试验。 通过ANOVA分析在伴侣偏好测试期间与女性和笼子条目配对的第一次6 h期间交配发作的组间差异。 使用计算机化图像程序(NIH IMAGE 1)从放射自显影图中定量NAcc中D2R和D2R mRNA标记的光密度以及VTA中的TH,DAT和D1.64R mRNA标记。 数据表示为盐水对照组平均值的变化百分比,并且通过分析组间差异 t 试验。 最后,通过蛋白质印迹实验分析了X射线胶片上D1R和D2R标记的光密度。 t 试验。
实验设计。
实验1a建立了AMPH诱导的CPP的剂量 - 反应曲线。 受试者在第1天在CPP装置中进行预测试,随机分配到六个实验组中的一个,其接受ip(ip)注射含有不同浓度的AMPH的盐水[0(n = 12),0.1(n = 8),0.5(n = 9),1.0(n = 12),3.0(n = 12),或5.0 mg / kg(n 在13天(3-2天)调节期间,然后在4天后测试中测试CPP。= 5)]。
实验1b揭示了DA受体在AMPH诱导的CPP中的作用。 受试者在CPP装置中进行预先测试,并随机分配到接受sc(sc)注射盐水的八个实验组中的一个(n = 10)或含有不同浓度的非选择性DA受体拮抗剂的盐水[氟哌啶醇; 0.1(n = 8),1.0(n = 8),或5.0mg / kg(n = 8)],或类似D1(SCH23390; 0.5(n = 7)或5.0 mg / kg(n = 7)]或D2样特异性DA受体拮抗剂[eticlopride; 0.5(n = 8)或5.0 mg / kg(n = 8)]。 30分钟后,在实验1.0a中诱导CPP的阈值剂量AMPH(1mg / kg)用于AMPH调节。 在3天的AMPH调理后,所有受试者都接受CPP后测试。
实验2检查AMPH经验是否干扰配对键合。 受试者被随机分配到接受腹腔注射生理盐水的三个实验组之一(n = 8)或含有1.0 mg / kg的生理盐水(n = 8)或5.0 mg / kg(n = 7)AMPH每天一次连续3天 - 一种诱导雄性草原田鼠CPP的范例。 在第四天,受试者与雌激素引发的女性配对24 h(14),然后在3-h伙伴偏好测试中进行测试。 为了控制注射对配对结合的潜在影响,第四个完整雄性的实验组没有接受任何注射(n = 6)与雌激素引发的雌性配对24 h,然后测试伴侣偏好。 所有的行为测试都是录像带,用于验证交配。 对受试者与伴侣和陌生人并排接触的持续时间进行量化。 此外,在6-h伴侣偏好测试期间,在配对的第一次3小时期间交配发作的频率和通过笼交叉指示的运动活动被定量。 在伴侣偏好测试后,立即杀死受试者。 收获所有脑,在干冰上冷冻,并在-80℃下储存,用于DA标记mRNA的原位杂交标记。
实验3检查AMPH受损的配对结合是否与中脑边缘DA活性的变化相关。 来自接受盐水的受试者的大脑(n = 8)或1.0 mg / kg AMPH(n 实验8中的2在低温恒温器上切成冠状切片(14μm厚度),将其解冻安装在Superfrost / plus载玻片(Fisher Scientific)上。 处理98-μm间隔的脑切片用于D1R,D2R,TH和DAT mRNA的原位杂交标记。 因为1.0 mg / kg AMPH的田鼠显示D1R增加,而不是D2R,NAcc中的mRNA标记,与注射盐水的对照相比,产生了另外两组接受盐水注射的受试者(n = 6)或1.0 mg / kg AMPH(n = 6),24 h交配,然后是伙伴偏好测试,如上所述。 将受试者断头并将脑在300μm厚度的低温恒温器上切片。 取自NAcc的双侧组织穿孔进行D1R和D2R Western印迹处理。
实验4检查了NAcc中D1型受体的激活是否是造成配对键合的AMPH损伤的原因。 对象植入双侧针对NAcc外壳的引导插管。 在3天恢复后,他们被随机分配到三个实验组中的一个,在这些实验组中他们接受了NAF内注射CSF(200 nL / side, n = 11),或包含0.4的CSF(n = 6)或100 ng / side(n = 7)SCH23390。 三十分钟后,他们接受了ip注射1.0 mg / kg AMPH。 在3连续几天重复该过程。 在第四天,受试者与雌激素引发的女性配对24 h,然后测试伴侣偏好。
致谢
作者感谢Kyle Gobrogge,Claudia Lieberwirth,Kelly Lei和Melissa Martin批判性地阅读了这份手稿。 这项工作得到美国国立卫生研究院资助MHR01-58616,DAR01-19627和DAK02-23048到ZW的支持
参考资料