Athugasemdir: Frábær endurskoðun á næstum öllum viðeigandi rannsóknum á andrógenviðtökum, dópamíni og kynlífi. Frábær teikning á blóðþrýstingi-verðlaun hringrás tengsl.
Horm Behav. 2008 maí; 53(5): 647-658.
Birt á netinu 2008 febrúar 13. doi: 10.1016 / j.yhbeh.2008.01.010
Abstract
Unglingsstúlka tengist aukinni hegðun sem hefur áhrif á ánægju, sem aftur á móti eru í lagi með kynþroska virkjun hypothalamo-heiladinguls-gonadal ásarinnar. Í dýraheilbrigðum af náttúrulega gefandi hegðun, svo sem kynlífi, eistu andrógena stuðla að þróun og tjáningu hegðunar hjá körlum. Til að hafa áhrif á hegðunarþroska fer heilinn um verulega endurgerð á unglingsárum og margir breytingar eru einnig viðkvæmir fyrir andrógenum, sem líklega virkar með andrógenviðtökum (AR). Miðað við viðkvæma samskipti gonadal hormóna og heilaþroska er ekki á óvart að truflun á hormónastyrkum á þessu viðkvæma tímabili breytir verulega unglinga- og fullorðinshegðun. Í karlkyns hamstrum er krabbameinsvaldandi krabbamein krabbameinsvaldandi krabbamein í kynlífi. Karlar sviptir andrógeni á kynþroska sýna viðvarandi galla í samúð. Hins vegar er andrógen eitt sér ekki nægjanlegt til að örva samúð hjá karlkyns karlmönnum, þó að heila AR sé til staðar fyrir kynþroska. Í þessu sambandi er víðtæk notkun á vefaukandi andrógenic sterum (AAS) á unglingsárum mikilvægt áhyggjuefni. AAS misnotkun hefur tilhneigingu til að breyta bæði tímasetningu og magn andrógena hjá unglingum. Í hamstra, eykur unglingabólga AAS árásargirni og veldur varanlegum breytingum á taugakerfi. Að auki styrkja AAS sig sjálft, eins og sýnt er fram á með sjálfsafgreiðslu testósteróns og annarra AAS. Nýlegar vísbendingar benda hins vegar til þess að styrkandi áhrif andrógena megi ekki krefjast klassískrar AR. Því er þörf á frekari athugunum á milliverkunum milli androgens og gefandi hegðun hjá unglingahópnum til að öðlast betri skilning á AAS misnotkun.
Yfirlit
Unglingar vekja heilann bæði ánægju og áhættu. Í karlkyns unglingum tekur þetta oft til dæmis tilraunir með lyfjum og kynlífi. Í Bandaríkjunum er miðgildi aldurs fyrir fyrstu samfarir hjá körlum 16.4 ára og 65% hefur átt samfarir eftir 12th bekk (XNUMX)Kaiser Family Foundation, 2005). Sömuleiðis hefur þessi íbúa hæsta hlutfall af ólöglegri notkun lyfja í Bandaríkjunum. Samkvæmt 2004 National Survey on Drug Use and Health, notað 38% karlmanna 18-25 ólöglegt lyf á síðasta ári (SAMHSA / OAS, 2005). Þar að auki notuðu 31% unglingabarnanna eiturlyf eða áfengi á síðasta kynferðislegu fundi þeirra (Kaiser Family Foundation, 2005). Að auki er unglinga lykilatriði í siðferðisfræði ákveðinna geðdeildarlyfja, svo sem þunglyndis, kvíða, skertrar ávana og hegðunarvandamála. Við tökum því fram að kynþroska seytingar hormónabólga, virkjun þeirra á steraviðtökum í heilanum og samspil hormónanna og reynslu af unglingahugsun stuðla að hegðunarbreytingum sem sjást á unglingsárum.
Markmið okkar hér er að endurskoða sönnunargögnin um að gonadal andrógen miðli unglingaþroska og fullorðinsárangri hvetjandi hegðun, auk þess sem gefandi eiginleika þessara hegðunar. Við leggjum einnig fram sönnunargögn um að testósterón sjálft sé gefandi, sem líklega stuðlar að þroskahömlun á áhugasömum hegðun á unglingsárum þegar stig testósteróns hækka. Áherslan í þessari grein er á rannsóknum okkar á taugakerfinu sem liggur undir karlkyns kynferðislega hegðun, einkum í Sýrlandi hamstur, með sérstakri áherslu á samspil testósteróns og dópamíns (DA). Við leggjum til að kynþroska andrógena hafi bæði tímabundin og langtímaáhrif á hringrás verðlauna og áhugasamlegrar hegðunar. Við fullyrðum frekar að viðbót við utanaðkomandi andrógen í formi vefaukandi andrógena stera (AAS) eykur eðlilega áhrif kynþroska andrógena og hefur þar með neikvæð áhrif á unglingaþróun heilans og hegðunar.
Unglinga sem viðkvæmt tímabil fyrir þróun heila
Að lokum er heilinn bæði kveikja og skotmark andrógenvirkni á unglingsárum. Hjá ungum drengjum (<12 ára) og ungum hamstrum (<28 daga aldur) eru andrógen í blóðrás og gónadótrópín í basalþéttni. Þar sem seyting lúteiniserandi hormóns frá fremri heiladingli hækkar sem svar við hormóni sem losar um gónadótrópín, þá eykst styrkur testósteróns í blóðrás verulega. Þetta gerist á Tanner stigi II / III (14 ára) hjá strákum og með 28 daga aldri í hamstrum. Þegar strákar ná Tanner stigi IV / V (u.þ.b. 16 ára) eða þegar hamstrar eru 50–60 daga gamall er innrænt testósterón innan fullorðins karla. Seyting kynþroskahormóns fellur saman við tímabil unglingsáranna sem á sér stað frá um það bil 12 til 20 ára aldri hjá mönnum. Kynþroskahormón hafa ekki aðeins áhrif á útlæga vefi til að valda útliti á kynseinkennum sem eru augljós merki um kynþroska, heldur virka þau einnig miðlæg til að hafa áhrif á bæði endurgerð unglingsheila og þroska hegðunar. Ennfremur leiða lífeðlisfræðilegar og taugasjúkdómar af völdum kynþroskahormóna til verulegra breytinga á upplifun einstaklingsins, sem getur sjálfur breytt verulega þróun heilans. Þannig er kynþroskaaukning kynhormóna, knúin áfram af þroskaðri þroska á æxlunar taugakvata ásnum, mótar aftur á móti atferlisþroska unglinga bæði með beinum og óbeinum áhrifum á taugakerfið.
Mannleg unglinga er nú viðurkennt sem meiriháttar og öflugt tímabil taugaþróunar þar sem hegðunarrásir eru endurbyggðar og hreinsaðar. Þó að heila 5 ára barns sé þegar 90% af stærð fullorðinna sinna (Dekaban, 1978), veruleg endurgerð er enn að koma. Þetta hugtak var kveikt á rannsóknum bæði hjá mönnum og dýrum sem benti til þess að mörg grundvallarþroskaferli sem komu fram við lifrarfrumukrabbamein eru endurtekin á unglingsárum. Þessar aðferðir fela í sér taugabólgu (Eckenhoff og Rakic, 1988; Hann og áhöfn, 2007; Pinos, Collado, Rodriguez-Zafra, Rodriguez, Segovia og Guillamon, 2001; Rankin, Partlow, McCurdy, Giles og Fisher, 2003), forritað klefi dauða (Nunez, Lauschke og Juraska, 2001; Nunez, Sodhi og Juraska, 2002), útfærsla og pruning dendritic arborizations og synapses (Andersen, Rutstein, Benzo, Hostetter og Teicher, 1997; Huttenlocher og Dabholkar, 1997; Lenroot og Giedd, 2006; Sowell, Thompson, Leonard, Velkomin, Kan og Toga, 2004), mýking (Benes, skjaldbaka, Khan og Farol, 1994; Paus, Collins, Evans, Leonard, Pike og Zijdenbos, 2001; Sowell, Thompson, Tessner og Toga, 2001) og kynferðislegt aðgreining (Chung, De Vries og Swaab, 2002; Davis, Shryne og Gorski, 1996; Nunez o.fl., 2001). Þannig er þróunarbrautin eftir fæðingu heilans ekki línuleg, heldur einkennist hún af unglingabólum af hraðri breytingu og felur í sér bæði framsækin og árásargirni. Eins og allir þroska líffræðingur vita, tíma öndunarbreytingar merki aukið næmni og varnarleysi bæði reynslu-háð breytingu og til skaðlegra afleiðinga truflunar og móðgunar og það er engin ástæða til að hugsa að mannleg unglingahugsun sé einhver undantekning (Andersen, 2003; Spjót, 2000). Þannig er talið að truflanir í tímasetningu kynhormónsáhrifa á unglingahópinn væru fyrir langvarandi afleiðingar fyrir hegðun fullorðinna.
Androgen og tauga hringrás til að hvetja hegðun
Vegna þess að unglinga er tímabundin og öflug þróunarþáttur, væri erfitt að meta unglingahópa og hegðun í einangrun. Í stað þess að þakka einstökum einkennum unglingsárs, er það gagnlegt að koma í veg fyrir það með heilanum og hegðun fullorðinna fullorðinna. Með áherslu á þessari grein um kynferðislega hegðun karla og verðlaun er því mikilvægt að kynna taugakerfið fyrir samhæfingu og kynferðislega hvatningu hjá fullorðnum körlum, þar með talið hlutverk hormónameðferðar hormóna í hegðunarvirkjun og dreifingu viðtaka fyrir andrógena (AR) og estrógen (ER).
AR er til staðar í frumufyrirtækjum sem mynda tauga hringrásina sem miðla umbunandi félagslegum hegðun, svo sem kynlíf. Ennfremur eru heila AR tjáð fyrir kynþroska í hamstrum og eru reglulegar af andrógenum bæði hjá ungum og fullorðnum körlum (Kashon, Hayes, Shek og Sisk, 1995; Meek, Romeo, Novak og Sisk, 1997). Í hjörtu nagdýr er veruleg skörun á dreifingu AR og ER (Wood og Newman, 1995) og arómatasi (Celotti, Negri-Cesi og Poletti, 1997), þar á meðal bæði α og ß formi estrógenviðtakans (Shughrue, Lane og Merchenthaler, 1997). Við bindingu við bindiefni, "klassísk" AR og ER virka sem uppskriftarþættir til að örva uppskrift og nýmyndun nýrra próteina. Ekki kemur á óvart að þessi áhrif fylgja tiltölulega hægan tíma, með seinkunartilfinningu. Steraörvun kynferðislegrar hegðunar á karlkyns hamstur (Noble og Alsum, 1975) er í samræmi við aðgerðir með klassískum gjöfum. Til dæmis er þörf á 2 vikum af váhrifum á stera til að endurheimta slímhúð í langtíma kastratum. Nýlegri rannsóknir á rottum hafa einnig sýnt fram á hraðar frumuáhrif andrógena á svæðum heila sem hafa fáein klassísk viðtaka (Mermelstein, Becker og Surmeier, 1996). Þessar stera aðgerðir eru talin vera miðlað af ónæmum viðtökum. Dreifing klassískrar AR og ER í hamarhvolfinu er tiltölulega takmörkuð (Wood og Swann, 1999) eru hugsanleg markmið hjartans fyrir ógegnsæ andrógenvirkni miklu breiðari.
Miðgildi preoptic area (MPOA) gegnir lykilhlutverki í samsöfnun hjá körlum úr gullfiski til manna (endurskoðað í Hull, Wood og McKenna, 2006). Þar að auki umbreytir hamarinn MPOA gonadal sterat hormón í gegnum mikið AR og ER og testósterónígræðslur í MPOA eru nægjanlegar til að endurheimta kynferðislega virkni í langtíma kastratum (Wood og Swann, 1999). Hjá karlkyns rottum starfa gonadal sterar í MPOA til að stjórna basal DA losun (Putnam, Sato og Hull, 2003) og örva pörun (Hull, Du, Lorrain og Matuszewich, 1995). Upphaflega er lítilsháttar aukning í DA þegar kona er kynnt á bak við skjá. Meðan á meðferð stendur eykst MPOA DA frekar (+ 50% af upphafsgildi) og þessi áhrif þurfa andrógen (Hull et al., 1995; Putnam et al., 2003). Ekki kemur á óvart, í castrated karlmenn sem ekki maka, MPOA DA eykst ekki (Hull et al., 1995). Það er nokkuð erfitt að túlka þessa niðurstöðu, þar sem skortur á DA losun er skelfilegur vegna þess að engin kynferðisleg virkni er fyrir hendi. Hins vegar losnar DA í MPOA í samhengi við tap á parning í skammtíma kastratum (Hull et al., 1995) og með testósterón-framkölluð endurheimt kynferðislegrar virkni í langtíma kastratum (Du, Lorrain og Hull, 1998; Putnam, Du, Sato og Hull, 2001).
Innan MPOA nagdýrsins eru andrógen og estrógen umbrotsefnin af testósteróni gegnir sérstöku hlutverki í reglugerðinni um mökun (Putnam et al., 2003; Putnam, Sato, Riolo og Hull, 2005). Leyndin til að hefja samhæfingu (fjall eða intromit) er eitt mál um kynferðislega hvatningu. Leyndarmál kynhneigðarinnar er næm fyrir estrógenum, með því að viðhalda MPOA köfnunarefnisoxíðsýnatasa, sem heldur áfram með basal DA stig. Estrógen meðhöndlaðir kastrates sýna háa basal DA stig, sem er mjög í samhengi við getu til að hefja þéttingu. Hins vegar eru þær ekki sýnilegar aukningar kvenna og afleiðinga í DA losun, sem eindregið tengist kynferðislegri afleiðingu. Afleiðingin er að kynferðisleg árangur þeirra er undir ósnortnum stigum. Á hinn bóginn, castrates, sem eru meðhöndlaðir með ópíumhæfðum andrógeni einum, sýna ekki hækkun á basal DA stigum, og þau koma ekki í veg fyrir að lyfið sé samsett. Fyrir eðlilega kynferðislega afköst er því bæði estrógen og andrógen krafist. Kynferðislegt frammistöðu er venjulega gefið upp sem tíðni ráðstafanir af fjalli, uppköstum og sáðlát. Eingöngu þegar bæði estrógen og andrógen skipta út, sýna kastað karlmenn hækkun á DA stigum (og styttri tímabundnar ráðstafanir) og aukning kvenna og afleiðingar (DA) aukning (og aukin tíðniaðgerðir). Á þennan hátt stuðlar estrógen í MPOA að kynferðislegri hvatningu, og bæði estrógen og andrógen til kynferðislegrar frammistöðu.
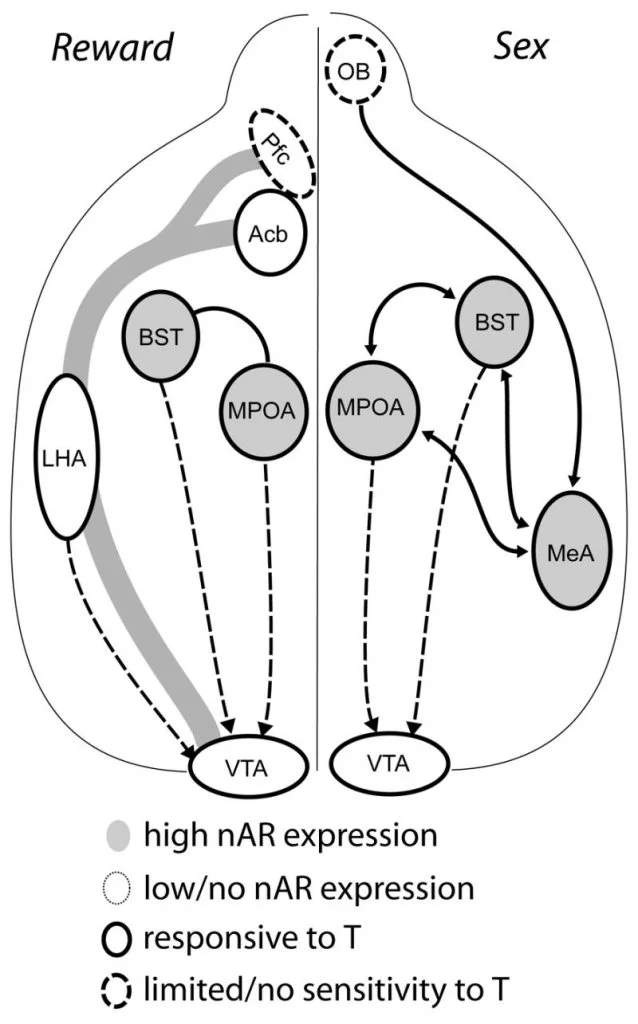
Þrátt fyrir að testósterón sé nauðsynlegt fyrir losun MPOA DA meðan á copulatory hegðun stendur og til að mæta sig, getur hvorki testósterón né mökun ein sér dregið fram DA í MPOA. Þess í stað eru einnig krabbameinsvaldar frá einkennum kvenna krafist fyrir DA losun í MPOA. Í nagdýrum eru krabbameinsvaldandi áreynsla aðal skynjunarmáttur til að hefja kynferðislega hegðun karlkynsFig. 1). Chemosensory cues eru send frá Lyktarskynfæri ljósaperur til MPOA gegnum miðlæga amygdaloid kjarnanum og rúm kjarna Stria Terminalis, mannvirki með mikið AR og ER (Wood og Swann, 1999). Til að ákvarða hlutverk krabbameinsvaldandi vísbendinga í samskeyttum DA, mældum við MPOA DA við samdrátt í karlkyns hamströmbum með ósjálfráða lyktarskynjun (UBx, Triemstra, Nagatani og Wood, 2005). Þó að tvíhliða flutningur á lyktarskynduðum glóperum útrýma kynlífi og MPOA DA losun, truflar einhliða bulbectomy ekki mökun. Í þessari rannsókn var afleiðing af völdum MPOA DA losunar þegar það var mælt samhliða lömunarljósinu, en ekki í Ipsilateral halið (Fig. 2). Svipaðar niðurstöður komu fram hjá karlkyns rottum með skemmdum á miðgildi amygdala (Dominguez, Riolo, Xu og Hull, 2001). Í tengdum rannsóknum valdi efnafræðileg örvun miðgildi amygdala hjá rottum MPOA DA losun sem jafngildir því við samloðun (Dominguez og Hull, 2001). Samanlagt bendir þessi gögn til þess að testósterón skapi leyfilegt umhverfi sem gerir utanaðkomandi skynjunartæki kleift að ná MPOA og örva DA losun við samsöfnun.

Fig. 2
Að lokum virkja kynferðisleg hegðun og aðrar náttúrulegar umbunir taugakerfisbætur. The mesocorticolimbic DA hringrás samanstendur af ventral tegmental svæði (VTA), kjarna accumbens (Acb) og prefrontal heilaberki (Pfc). Dópamínfrumur sem búa í VTA verkefninu rostrally til Acb og Pfc (Koob og Nestler, 1997). Hjá rottum er DA gefið út í Acb meðan á kyni stendur (Pfaus, Damsma, Nomikos, Wenkstern, Blaha, Phillips og Fibiger, 1990). Margir eiturlyfja misnotkun starfa einnig í mesólimbískum DA-kerfinu til að auka DA losun (amfetamín) eða hamla DA endurupptöku (kókaín, Di Chiara og Imperato, 1988), þannig að efla ávanabindandi eiginleika þeirra. Á þennan hátt hefur testósterón möguleika á að hafa áhrif á losun DA í Acb bæði með aukinni kynferðislegri hegðun og með aðgerðum sínum sem misnotkunarefni (sjá hér að neðan).
Núverandi sönnunargögn benda til þess að mesocorticolimbic DA kerfið þroskist á unglingsárum. Acb DA fiber þéttleiki eykst verulega á unglingsárum í gerbils, sem bendir til þess að marktæk þroskun VTA dópamínvirkra spár á Acb á sér stað á unglingsárinu (Lesting, Neddens og Teuchert-Noodt, 2005). Ennfremur er dopamínvirka inntaka GABA (γ-amínósmjörsýru) -gervra frumna í miðtaugakerfi með rottum auðgað og mótað með serótónvirkum kerfum meðan á þróun kynþroska stendur (Benes, Taylor og Cunningham, 2000) og meðhöndlun andrógena hjá fullorðnum rottum leiðir til breytinga á dópamínvirkri öxlþéttni innan prefrontal heilaberki (Kritzer, 2003). Pfc, Acb og VTA hafa fáein AR eða ER, þótt ERβ sé til staðar í VTA (Shughrue o.fl., 1997). Því virðist líklegt að andrógenar hafi áhrif á mesocorticolimbic DA kerfið með andrógenviðkvæmum afferðum eða með ERβ í VTA eins og í líkamshita (Handa o.fl., þetta mál). Gögnin okkar sýna að andrógenviðkvæm frumur í karlkyns hamstrum eru í VTA frá mannvirki sem tengist steraviðkvæmum hegðun. Til dæmis innihalda bæði MPOA og rúmkjarna stranda flugstöðvarinnar (BST) fjölda AR-jákvæða frumna sem valda VTA (Sato og Wood, 2006). The ventral pallidum, helstu Acb efferent markmiðið (Zahm og Heimer, 1990), inniheldur einnig margar AR-jákvæðar frumur sem eru að vísa til VTA. Þessar áætlanir veita tækifæri fyrir andrógen til að breyta virkni mesocorticolimbic DA kerfisins.
Steraháð skipulag hegðunar á unglingsárum
Hin hefðbundna sýn á hormónastarfsemi á unglingalegum hegðun byggist á virkjunaráhrifum af sterahormónum, sem vísa til hæfileika sterum til að auðvelda hegðun í sérstökum félagslegum aðstæðum með aðgerðum innan markfrumna í taugakerfinu sem er undirliggjandi hegðun. Virkniáhrif eru tímabundin í þeim skilningi að þau koma og fara með nærveru og fjarveru hormóns, og þeir eru venjulega í tengslum við tjáningu fullorðinnahegðunar. Hins vegar vísar skipulagsáhrif til hæfileika sterum til að mynda taugakerfi uppbyggingu meðan á þróun stendur. Byggingarskipulagning er varanleg, heldur áfram utan tímabilsins fyrir hormón og ákvarðar tauga- og hegðunarviðbrögð við sterum í fullorðinsárum. Skilningur okkar á þróunarsamskiptum milli skipulags- og virkjunaráhrifa af sterumhormónum hefur þróast á undanförnum 50 árum. Phoenix og samstarfsmenn lagði fyrst fram að fullorðnahegðunarsvörun (virkni) við sterahormóni sé áætluð (skipulögð) með sterahormónum á hámarks næmu tímabili með fæðinguPhoenix, Goy, Gerall og Young, 1959). Síðar, Scott og samstarfsmenn lagði fræðilega grunninn að því að tilvist margra viðkvæma tímana fyrir framsækna skipulagi taugakerfisins kom fram og benti á að líklegustu viðkvæmu tímabilin muni eiga sér stað á tímabilum hröðrar þróunarbreytingar (1974). Í kjölfarið benti Arnold og Breedlove á að steraháð skipulag heilans getur komið fram utan viðkvæmra þroskaþroska (Arnold og Breedlove, 1985). Undanfarin 15 ár hefur rannsóknir sem nota ýmsar dýra módel og hegðunarskerfi ljóst að unglingahópurinn er viðkvæm fyrir bæði virkni og skipulagi áhrifum á stungustað (endurskoðuð í Sisk og Zehr, 2005). Og eins og önnur tímabil hröðrar þróunarbreytingar, táknar unglinga skilgreindan möguleika á möguleika á steraháðri umbreytingu heila.
Vinna okkar með hamsturinn sem dýralíkan gefur vísbendingar um að karlleg félagsleg hegðun sé breytt með sterum á unglingsárum (Schulz, Menard, Smith, Albers og Sisk, 2006; Schulz og Sisk, 2006). Fyrir kynþroska getur testósterónmeðferð ekki virkjað kynferðislega hegðun í hamstrum og bendir til þess að þroskunarferli sem gera taugakerfisrásir næm fyrir virkjun eða stofnun með sterahormónum hafa ekki enn átt sér stað (Meek et al., 1997; Romeo, Richardson og Sisk, 2002a). Hins vegar, á meðan augljós tjáning á æxlunarhegðun karla á fullorðinsárum krefst ekki algerlega tilvist kynkirtlastera á unglingsárum, gerir hámarks tjáning hegðunar það. Þegar karlkyns æxlunarhegðun er borin saman hjá körlum sem eru annaðhvort geldir fyrir kynþroska (NoT@P) eða eftir kynþroska (T@P) og síðan meðhöndlaðir með testósteróni á fullorðinsárum, þá hafa NoT@P geldingar fyrir kynþroska að minnsta kosti 50% halla á karllægri hegðun samanborið við karlmenn sem gelda eftir unglingsár. (Fig. 3, Schulz, Richardson, Zehr, Osetek, Menard og Sisk, 2004). Þar að auki eru skortur á æxlunartruflunum langvarandi og ekki hægt að vinna bug á annaðhvort með langvarandi meðferð með testósteróni eða með kynferðislegri reynslu við fullorðinsár (Schulz et al., 2004). Að sama skapi, eftir meðferð með estrógeni og prógesteróni, sýna NoT@P karlmenn styttri dvalartíma og lengri lordosis en karlmenn sem eru geldnir sem fullorðnir (Schulz et al., 2004), sem bendir til þess að prepubertal castrates séu minna defeminized en karlar verða fyrir kynþroska testósteróni.

Fig. 3
Það kann að vera að NoT@P karlmenn þjáist af minnkaðri kynhvöt. Ein leið til að bregðast við þessari spurningu er að bera saman leynd til að taka þátt í rannsókn á ann-kynfærasjúkdómum (AGI) og uppbyggingu milli karlkyns kynkirtlaskurðar fyrir (NoT@P) og eftir kynþroska (T@P). Ef kynferðisleg hvatning er háð kynkirtlahormónaútsetningu á unglingsárum myndum við spá fyrir um lengri leynd til að taka þátt í kynferðislegri hegðun hjá NoT@P karlmönnum. Reyndar, með endurtekinni váhrifum af bröntum kvendýrum, taka NoT@P karldýr lengri tíma að byrja AGI og hækka samanborið við T@P karldýr (Fig. 4). Svona, auk þess að skipuleggja þætti kynferðislegrar frammistöðu, virðist sem kynþroskahormón skipuleggja einnig gefandi þætti kynhegðunar. Til stuðnings þessum möguleika endurheimtir miðlæg gjöf DA örvandi apómorfíns á fullorðinsárum vaxandi hegðun NoT@P karldýra í dæmigerð fullorðinsstig, sem bendir til þess að testósterón á unglingsárum skipuleggi venjulega dópamínvirk taugakerfi (Salas-Ramirez, Montalto og Sisk, 2006 ). Engu að síður eru margar áhugaverðar spurningar eftir. Myndi NoT@P karlkyns barpressa fyrir unga konu eða þróa með sér skilyrtan stað fyrir pörunarstað? Framtíðarrannsóknir munu kanna hlutverk kynþroskahormóna við að skipuleggja kynhvöt og kynferðislega frammistöðu.

Fig. 4
Töf og tímalengd vegna kynþroskarannsókna (AGI) sem karlhamstrar sýndu kynkirtlanám fyrir kynþroska (NoT@P) eða eftir kynþroska (T@P). Allir karlmenn fengu testósterón-bólstraða á fullorðinsaldri 7 vikum eftir kynkirtilsnám og einni viku fyrir fyrsta hegðunarprófið. A. T@P karlmenn sýndu svipaða AGI leynd í prófunum þremur með ungfrú konu, en NoT@P karlmenn jók AGI leynd í þriðju prófinu með estru konu. B. T@P karlmenn lækkuðu töf á fjalli í hegðunarprófunum þremur með estru konu, en noT@P karldýr sýndu enga breytingu á fjallleynd í hegðunarprófunum þremur. Þessar upplýsingar benda til þess að kynþroska kynkirtlahormón hafi varanleg, auðvelda áhrif á hvatningu fullorðinna karlmanna til að taka þátt í kynferðislegri hegðun með konu. (Óbirt gögn frá dýrum í Schulz, KM, Richardson, HN, Zehr, JL, Osetek, AJ, Menard, TA og Sisk, CL, 2004).
Prepubertal hegðunarvandamál við sterum
Eitt af þrálátum þrautum unglingalegrar hegðunarþroska er afleiðing þess að virkjun æxlunar hegðunar til að bregðast við útsetningu fyrir sterum er dregin úr í karlkyns hamstrum úr prepubertali. Ef lítið magn androgens fyrir kynþroska takmarkar tjáningu karlkyns kynferðislegrar hegðunar hjá prepubertal-körlum, þá ætti að bæta innræna andrógen hjá prepubertal karlmönnum að lenda í mökun. Þetta reynist ekki vera raunin (Meek et al., 1997; Romeo, Cook-Wiens, Richardson og Sisk, 2001; Romeo, Wagner, Jansen, Diedrich og Sisk, 2002b), þrátt fyrir þá staðreynd að fjöldi og dreifing AR og ER um samdráttarrásina eru svipuð í hormónameðhöndluðu prepubertali og fullorðnum kastratum (Meek et al., 1997; Romeo, Diedrich og Sisk, 1999; Romeo o.fl., 2002a). Því virðist sem andrógen og AR eru nauðsynlegar en ekki nægjanlegar til að tjá karlkyns kynferðislega hegðun.
Tilraunir til að greina þætti sem takmarka kynhneigð fyrir kynþroska hafa hingað til verið blandað saman. Fos svörun við efnafræðilegum vísbendingum frá öldruðum konum er svipuð í prepubertal og fullorðnum karlkyns hamstrum (Romeo, Parfitt, Richardson og Sisk, 1998). Þessar upplýsingar sýna að skynjunarleiðir eru þroskaðir fyrir kynþroska. Þannig geta ungmenni karlar fundið kjarnaklefann frá kvenna; þar sem þau eru frábrugðin fullorðnum er í því hvernig þau bregðast við þessum vísbendingum. Ein hugsanleg skýring er að prepubertal karlmenn eru ekki hvattir til að taka þátt í kynferðislegri hegðun. Við höfum komist að því að karlkyns hamsters úr prepubertali sýna ekki aukin dópamínvirk áhrif í MPOA til að bregðast við kvenkyns ferómónum, en kynferðislegir karlkyns karlmenn sýna sterkar MPOA dópamínvirkar svör við sömu áreiti (Fig. 5, Schulz, Richardson, Romeo, Morris, Útlendingur og Sisk, 2003). Á sama hátt er ekki vitað að prepubertal karlmenn sýna fullorðna-dæmigerð aukning í testósterón í blóðrás eftir að konur hafa verið útsettir (pheromones)Parfitt, Thompson, Richardson, Romeo og Sisk, 1999). Þannig virðist kvenkyns ferómón vera óskilyrt hvati fyrir taugafræðilegum og taugakvilla viðbrögð hjá fullorðnum, en ekki prepubertalar karlar, sem bendir til þess að þolgæði þessara félagslega viðeigandi skynjunartækja breytist í þróun kynþroska, hugsanlega tengd kaupum á gefandi eiginleika og kynferðislegri hvatningu. Þar að auki, þrátt fyrir að testósterón stuðli að AGI kvenkyns hjá konum sem eru karlkyns hjá konum, fer þessi áhrif eftir því hvort karlmaður hafi áður fengið útsetningu fyrir estróus konum. Kannski kemur fram að testósterón meðferð minnkar tíðni og eykur lengd AGI eingöngu hjá kynlífsmönnum sem ekki eru kynþroskaFig. 6). Enn fremur hafa karlkyns karlmenn, sem hafa fengið fyrri reynslu af kvenskjánum, lengra AGI seinkanir og styttri AGI tíma en karlmenn hafa samskipti við móttækileg kvenna í fyrsta skipti (Fig. 6). Þessar upplýsingar benda til þess að milliverkanir við estróus konur séu aversive frekar en gefandi fyrir kynþroska, þar með að útrýma öllum auðveldandi áhrifum testósteróns á AGI við síðari milliverkanir við konu. Það væri áhugavert að vita hvort neikvæðar hegðunarafleiðingar snemma útsetningar fyrir estrous konu haldist í unglingsárum og fullorðinsaldri, sérstaklega vegna þess að endurtekin útsetning fyrir estrous konum á unglinga auðveldar yfirleitt tjáningu á æxlun hegðunar karla (Molenda-Figueira, Salas-Ramirez, Schulz, Zehr, Montalto og Sisk, 2007).

Fig. 5
Prepubertal og fullorðinn karlkyns miðgildi fyrirbyggjandi svæði (MPOA) dópamínvirka svörun við kvenkyns ferómónum sem eru í leggöngum. Fullorðnir karlar sýna aukna dópamínvirk áhrif MPOA við útsetningu fyrir kviðverkjum í kviðarholi, en prepubertalar konur sýna ekki aukin MPOA dópamínvirk áhrif á kvenkyns ferómón. (Redrawn frá Schulz, KM, Richardson, HN, Romeo, RD, Morris, JA, Útland, KJ og Sisk, CL, 2003).

Þrátt fyrir að prepubertal andrógen meðferð geti ekki valdið samhæfingu bendir nýleg vinna frá rannsóknarstofu okkar að taugakerfi hamastarfsins sé viðkvæm fyrir skipulagningu aðgerða testósteróns á æxlunartilfinningu fyrir unglinga (Schulz, Zehr, Salas-Ramirez og Sisk, 2007). Castration auk 19 daga af úthreinsun testósteróns fyrir eða meðan en ekki eftir unglinga auðveldaði uppbyggingu hegðunar þegar testósterón var skipt út fyrir fullorðinsár. Karlar sem voru fyrir áhrifum af testósteróni sýndu einnig fleiri svekktur í fullorðinsárum en karlar sem verða fyrir testósteróni á meðan eða eftir kynþroskaSchulz et al., 2007). Þessar upplýsingar benda til þess að getu testósteróns til að skipuleggja hegðunar taugahringa minnki með aldri og að unglinga markar lok langvarandi næstu tímabils eftir fæðingu testósteróns.
Lyfjafræðilega andrógen
Framangreind gögn benda til þess að innrænar gonadal sterar auki áherslu á hegðun á unglingsárum. Nú, hvað gerist ef einn sjálfstýrir andrógeni á allt að 100x eðlilegan lífeðlisfræðilegan styrk? Þetta er vandamálið við misnotkun á vefaukandi androgenic steroid (AAS) (endurskoðuð í Brower, 2002; Clark og Henderson, 2003). Stuttur þjöppun er viðeigandi hér: öll AAS eru afleiður testósteróns, öll AAS eru með kolefnisbeinagrind með 4 smjörðum hringjum, flestir hafa 19 kolefni. AAS er notað aðallega fyrir vefaukandi áhrif þeirra (vöðvauppbyggingu). Hins vegar, eins og nafnið gefur til kynna, hafa AAS einnig andrógen eiginleika. Testósterón er rökrétt val í dýrarannsóknum til að kanna grundvallaraðferðir androgenlauna. Það er enn vinsælt val fyrir mönnum, og oftast í formi langverkandi testósterón esterar eins og testósterón própíónat. Í 2006 var testósterón eitt algengasta bönnuð efnið sem greint var frá í rannsóknum á þvagi hjá WADA-viðurkenndum rannsóknarstofum (WADA, 2006). Testósterón grein fyrir stærsta brot (34%) AAS-jákvæð þvagpróf á 2000 Sydney Ólympíuleikunum (Van Eenoo og Delbeke, 2003). Á sama hátt, í rannsóknum á þvagi AAS notenda, prófuð 41% jákvætt fyrir testósterón (Brower, Catlin, Blow, Eliopulos, Beresford, 1991). Við stóra skammta framleiða AAS marktækar hegðunarbreytingar. Sérstaklega vegna þess að þeir hafa náið samband við testósterón, virðist notkun AAS á unglingaárunum trufla eðlilega steraefnið í þroskavefnum sem þróar manneskju, þar á meðal magn, tímasetningu og tegund stera útsetningu.
Eins og hjá öðrum ólöglegum fíkniefnum er misnotkun manna AAS misnotkun unglinga. Samkvæmt 1994 National Household Survey on Drug Use (SAMHSA / OAS, 1996), stera notkun tindar í lok unglingsárs á 18 ára aldri. Þar að auki, í vöktun framtíðar könnunarinnar (Johnston, O'Malley og Bachman, 2003), var tíðni notkun stera á meðal eldri menntaskóla (2.7%) sambærileg við það fyrir sprunga kókaín (3.5%) eða heróíni (1.4%). Steranotkun er einnig algengari hjá yngri aldri: 2.5% nemenda í 8X bekknum (13-14 ára) hafa notað sterum, svipað og tíðni sprunga (2.5%) og notkun heróíns (1.6%). Þessi tilhneiging til að nota AAS í upphafi unglinga er sérstaklega áhyggjuefni með tilliti til áhyggjuefna 1) að unglingar geta verið sérstaklega viðkvæmir fyrir misnotkun AAS og 2) að útsetning fyrir unglingum í AAS við lyfjafræðilega stig getur haft veruleg áhrif á eðlilega þroska heilans og hegðun til að framleiða ýktar formfræðileg og hegðunarvandamál, bráð og tímabundið.
Óviðeigandi árásargirni er hegðunarvandamálin sem oftast tengist AAS misnotkun manna. Í birtum tilvikum hefur verið greint frá notkun steramíða í nokkrum ofbeldisfullum morðum (Conacher og Workman, 1989; Páfi og Katz, 1990; Pope, Kouri, Powell, Campbell og Katz, 1996; Schulte, Hall og Boyer, 1993). Í könnunum á núverandi AAS-notendum voru hækkaðir árásargirni og pirringur algengustu hegðunarverkanirnar af notkun AAS (Bond, Choi og Pope, 1995; Galligani, Renck og Hansen, 1996; Midgley, Heather og Davies, 2001; Parrott, Choi og Davies, 1994; Perry, Kutscher, Lund, Yates, Holman og Demers, 2003). Hins vegar er erfitt að ákvarða nákvæmlega hlutverk AAS í þessum tilfellum mannaárásargirni miðað við fjölda andrógenskammta, fjölbreytni geðrænna einkenna og hugsanlegrar geðrænnar truflunar. Niðurstöður úr tilvonandi rannsóknum á sjálfboðaliðum, sem fengu inndælingar á AAS, hafa verið blandaðar: Tricker o.fl. (1996) og O'Connor o.fl. (2004) greint ekki frá aukinni reiði á meðan önnur rannsóknir hafa komið fram aukin árásargirni (Daly, Su, Schmidt, Pickar, Murphy og Rubinow, 2001; Hannan, Friedl, Zold, Kettler og Plymate, 1991; Kouri, Lukas, páfi og Oliva, 1995; Páfi og Katz, 1994; Su, Pagliaro, Schmidt, Pickar, Wolkowitz og Rubinow, 1993). Engu að síður er mikilvægt að hafa í huga að skammtar sem gefnar eru til sjálfboðaliða hjá mönnum eru mun lægri en skammtar sem mælt er fyrir um á vefsíðum til að byggja upp líkama og meðferðarlengd er yfirleitt stutt. Svona, á jafnvægi, það virðist sanngjarnt að álykta að AAS geti aukið örvandi hegðun, að minnsta kosti hjá næmum einstaklingum. Pope et al (1994) komist að því að AAS þekki geðræn einkenni hjá viðkvæmum einstaklingum.
Dýrarannsóknir hafa einnig veitt sannfærandi sannanir fyrir AAS-völdum árásargirni. Ungir karlkyns hamstur, sem meðhöndlaðir eru með háskammta stera, hafa styttri árásargjöld og fleiri árásir og bitar gagnvart karlkyns innbrotum samanborið við ómeðhöndlaða karlmenn (Harrison, Connor, Nowak, Nash og Melloni, 2000; Melloni, Connor, Hang, Harrison og Ferris, 1997). Á sama hátt veldur vægur provocation (hnakkur) viðvarandi aukning á árásargirni hjá ungum karlkyns rottum, þ.mt árásargirni gagnvart konum (Cunningham og McGinnis, 2006). Jafnvel meiri áhyggjuefni veldur unglingabólga í AAS í hamstrum langvarandi aukningu á örvandi hegðun sem haldist eftir að notkun stera er hætt (Grimes og Melloni, 2006). Þessar hegðunarbreytingar fylgja með varanlegri endurgerð á tauga rafrásir í framhálsi. Einkum útsetning fyrir AAS í unglingum hjá hamlum eykur argínín vasópressín (AVP, Grimes og Melloni, 2006) og niðurstilla serótónín og serótónínvirk 5HT1A og 5HT1B viðtaka (Ricci, Rasakham, Grimes og Melloni, 2006). Það ætti ekki að koma á óvart að AAS breytist einnig á heila stigum AR. Langvarandi útsetning fyrir testósteróni eða nandrólóni uppreglir frumukjarna AR í karlkyns rottum (Menard og Harlan, 1993; Wesson og McGinnis, 2006). Þannig er möguleiki á AAS að auka andrógenháðan hegðun bæði með því að bæta innandi andrógen og með því að auka andrógenviðbrögð með aukinni AR-tjáningu.
Í samanburði við örvandi hegðun hefur AAS minni áhrif á hnút hjá karlkyns nagdýrum og svarið fer eftir tilteknu stera sem notað er (endurskoðað í Clark og Henderson, 2003). Í karlkyns hamstur, sem neytti testósterón í lausnum til inntöku, jókst sáðlát á skammtaháðan hátt (Wood, 2002). Hins vegar hefur hvorki testósterón né nandrónón aukið samúð hjá ungum karlkyns rottum. Stanózólól, tiltölulega minna öflugur AAS með lágmarks andrógenvirkni, reyndi í raun bæði mökun og árásargirni (Farrell og McGinnis, 2003), væntanlega með því að draga úr innrænum andrógenmagnum.
Það er sérstaklega mikilvægt að hafa í huga að unglingar og fullorðnir hamstur geta sýnt mismunandi hegðunarvandamál við útsetningu AAS. Þó að AAS hafi veruleg aukning á ósjálfráða hegðun hjá unglingum, sýndi sama meðferð í fullorðinsárum aðeins lítilsháttar aukningu á árásargjarn hegðun og verulega minnkað kynferðislega hegðun (Salas-Ramirez, Montaldo og Sisk, 2008). Þetta er í samræmi við hugtakið unglingsár sem viðkvæmt tímabil fyrir andrógenverkun. Enn fremur, eins og fullorðinn karlkyns hamstur, öðlast umburðarlyndi fyrir utanaðkomandi testósteróni (Peters og Wood, 2005), teljum við að þroska karla fái þol gegn testósteróni eins og þeir þroskast. Þannig breytast áhrif AAS á þroska unglinga og útsetningar AAS fyrir unglinga getur valdið of miklum árásargjarnum og kynferðislegum hegðunarmynstri sem geta haldið áfram í fullorðinsárum.
Styrkja áhrif andrógena
Mating og berjast eru hver gefandi (að minnsta kosti ef þú vinnur í baráttunni). Karlkyns rottur munu ýta endurtekið á lyftistöng til að vinna saman við konu (Everitt og Stacey, 1987). Á sama hátt myndast karlmús og kvenkyns hamstur með skilyrt staðvalmöguleika (CPP) fyrir staði þar sem þeir hafa áður unnið átök (Martinez, Guillen-Salazar, Salvador og Simon, 1995; Meisel og Joppa, 1994). Ef AAS getur aukið gefandi félagslega hegðun yfir stigum sem venjulega koma fram hjá konum sem eru með ósjálfráðar konur, er rökrétt að búast við því að testósterón sjálft gæti verið gefandi. Þetta hefur verið prófað með tveimur vel þekktum dýrum fyrir verðlaun og styrking: CPP og sjálfstjórn. Niðurstöður þessara rannsókna sýna að testósterón styrkir í tilraunasamhengi þar sem vefaukandi áhrif og íþróttastarfsemi eru óviðkomandi. Með CPP er prófunarefnið ítrekað parað við einstakt umhverfi (til dæmis tiltekið hólf í prófunarbúnaðinum). Þegar dýrið hefur samband við styrkjandi prófunarefnið við það umhverfi mun hann leita umhverfisins, jafnvel án þess að fá laun. Fyrstu skýrslur um andrógenverðlaun í rannsóknardýrum notuðu almennar inndælingar testósteróns til að örva CPP í karlmúsum (Arnedo, Salvador, Martinez-Sanchis og Gonzalez-Bono, 2000; Arnedo, Salvador, Martinez-Sanchis og Pellicer, 2002) og rottur (Alexander, Packard og Hines, 1994; de Beun, Jansen, Slangen og Van de Poll, 1992). Í kjölfarið notaði rannsóknarstofan okkar sjálfa gjöf testósteróns til að sýna fram á andrógen styrkingu (Johnson og Wood, 2001). Við komumst að því að karlkyns hamstur muni sjálfviljugur neyta munnlausna testósteróns með því að nota bæði val á 2-flöskum og matvælaörvandi drykkju. Í seinna rannsóknum sýndu sýnt fram á sjálfsskammt hjá karlkyns rottum og hamstra (Wood, Johnson, Chu, Schad og Self, 2004). Innrennsli í bláæð útilokar hugsanlega skaðleg áhrif bragðs eða þörmunar á inntöku andrógen.
Í tengslum við AAS misnotkun er mikilvægt að greina á milli miðlægra og útlægra áhrifa andrógena. Þar sem testósterón hefur víðtæka áhrif um allan líkamann gæti verið haldið því fram að laun og styrkleiki með kerfisbundnum testósterónstungum sé í viðbót við kerfisbundin vefaukandi og andrógenvirkni testósteróns. Með öðrum orðum, kannski dregur testósterón vöðvaþreytu og bætir sameiginlega virkni þannig að dýrin bara finnst betra. Reyndar hefur þessi skýring verið notuð í klínískum bókmenntum (að vísu án tilrauna) til að halda því fram að líkurnar á ósjálfstæði og fíkn séu á AAS (DiPasquale, 1998). Hins vegar Packard et al (Packard, Cornell og Alexander, 1997) sýndi að inndælingar testósteróns beint inn í rottum heilann geta valdið CPP. Sömuleiðis hefur rannsóknarstofan sýnt fram á að sjálfsstjórnun í sjálfsstjórnun á intracerebroventricular (icv) testósteróni í karlkyns hamstra (Wood et al., 2004). Intracerebral CPP og ICV sjálfs gjöf með testósteróni argue fyrir miðlægum markmiðum miðla andrógen styrking.
Það er athyglisvert að styrking testósteróns fylgir ekki endilega sömu aðferðum sem áður hafa verið staðfestar fyrir steraáhrif á kynferðislega hegðun. Eins og fjallað var um áður, er MPOA lykillinn að því að skipuleggja kynferðislega hegðun karlkyns nagdýr (Hull, Meisel og Sachs, 2002). Í hamstrunum hefur MPOA nóg steríóviðtaka og testósterónígræðslur í MPOA endurheimta kynferðislega virkni í langtíma kastratum (Wood og Swann, 1999). Tímamörk þessara steraáhrifa er hæg: Uppbygging hegðarinnar er viðvarandi í vikum eftir orkudectomy og langtímameðferð með stera er nauðsynleg til að endurheimta mökun í langtíma kastratum (Noble og Alsum, 1975). Hins vegar hefur inndælingar testósteróns í MPOA af karlkyns rottum ekki örvað CPP (King, Packard og Alexander, 1999). Þetta bendir til þess að önnur heila svæði séu mikilvæg fyrir andrógen styrking.
Hins vegar mun karlkyns rottur mynda CPP við testósterón stungulyf í Acb (Packard et al., 1997). Eins og við á um önnur misnotkunarefni er DA líkleg til að vera lykilviðtaka fyrir styrkingu testósteróns: CPP af völdum kerfisbundins próteósteróns innspýtingar er læst af D1 og D2 dópamín viðtaka mótlyfjum (Schroeder og Packard, 2000). Hins vegar, ólíkt öðrum fíkniefnum, benda rannsóknir okkar á hamstrum til þess að testósterón valdi ekki Acb DA losun (Triemstra, Sato og Wood, í stuttu). Sömuleiðis sýna rannsóknir á karlkyns rottum að andrógenar hafi engin áhrif á basal DA stig eða amfetamín örvað DA losun (Birgner, Kindlundh-Hogberg, Nyberg og Bergstrom, 2006; en einnig sjá Clark, Lindenfeld og Gibbons, 1996). Enn fremur hefur testósterón tiltölulega lítil áhrif á þéttni Acb DA vefja (Thiblin, Finn, Ross og Stenfors, 1999). Saman benda þessar upplýsingar til þess að þrátt fyrir að testósterón styrking geti breytt á endanum DA virkni í Acb, geta þær aðferðir verið mismunandi frá kókaíni eða öðrum örvandi lyfjum. Í þessu sambandi benda nýlegar upplýsingar til þess að langvarandi útsetning fyrir AAS getur breytt næmi fyrir DA með því að breyta DA efnaskipti (Kurling, Kankaanpaa, Ellermaa, Karila og Seppala, 2005), magn DA viðtaka (Kindlundh, Lindblom, Bergstrom, Wikberg og Nyberg, 2001; Kindlundh, Lindblom og Nyberg, 2003) eða DA flutningsaðilinnKindlundh, Bergstrom, Monazzam, Hallberg, Blomqvist, Langstrom og Nyberg, 2002).
Í augnablikinu eru sérstök stera merki, viðtaka og heila verkunarstaðir til að styrkja testósterón óþekkt. Byggt á nýlegri rannsókn á hamstrum frá rannsóknarstofu okkar virðist styrking áhrif testósteróns vera miðlað af bæði andrógenum og estrógenum (DiMeo og Wood, 2006). Algengt-misnotuð AAS innihalda bæði arómatískt og óviðunandi andrógen (Gallaway, 1997; WADA, 2006). Þetta felur í sér að bæði AR og ER mega umbreyta sterumörvum til umbunar. Það er til viðbótar möguleiki að styrking testósteróns geti verið miðlað af blöndu af klassískum og ógegnum viðtökum.
Nokkrar sönnunargögn benda til aðgerða viðtaka sem ekki eru erfðafræðilega við styrkjandi áhrif AAS. Til viðbótar við dreifða dreifingu AR í Acb og VTA, er tímalengd andrógen styrkinga hröð (<30 mín), og vinnsla merkja í gegnum klassískt AR er kannski ekki nógu hröð til styrktar. Í samræmi við það, til að prófa hlutverk AR sem ekki er erfðafræðilegt í styrkingu AAS, notuðum við tvær viðbótartækni (Fig. 7). Í einni tilraun (Sato, Johansen, Jordan og Wood, 2006), leyftum við rottum með stökkbreytingu á eistum kvenna (Tfm, sjá þetta mál) til að gefa sjálfstætt dihydrotestosteron (DHT), sem er ekki arómatískt andrógen. Tfm stökkbreytingin dregur verulega úr bindiefni við AR. Engu að síður, Tfm rottur og villt-tegund karlkyns systkini þeirra sjálf gefið um það bil sama magn af DHT. Þetta bendir til ónæmisáhrifa DHT. Í síðari rannsókn ákváðum við að karlkyns hamstur myndi sjálfstætt gefa DHT samtengdum nautgripasalbúmíni (BSA, Fig. 8, Sato og Wood, 2007). DHT-BSA samtengingar eru himnaeiginleikar; Þannig eru áhrif þeirra takmörkuð við frumuyfirborðið. Hamstur sjálfstætt DHT, eins og áður hefur verið sýnt fram á (DiMeo og Wood, 2006). Þeir sýndu svipaða möguleika á DHT-BSA samtengingu en ekki tókst að gefa BSA eitt sér sjálf.
Þessar upplýsingar benda til lykilhlutverki fyrir frumuyfirborði ARs í androgen styrking. Eins og er, nákvæmlega eðli slíkra viðtaka er ekki þekkt. Það hefur verið lagt til að andrógen megi starfa við frumuyfirborðið með því að binda til hollur himna AR (Thomas, Dressing, Pang, Berg, Tubbs, Benninghoff og Doughty, 2006, sjáðu einnig þetta mál). Þetta getur verið í formi viðbótar-kjarnorku klassíska AR eins og greint var frá í hippocampus (Sarkey et al., Í þessu tölublaði). Að öðrum kosti hafa fyrri rannsóknir einnig lýst sterabindandi stöðum á öðrum taugakerfi. Nánar tiltekið getur fjölbreytni af sterahormónum, þar á meðal AAS, mótað alheimslega GABA-A viðtakann (Henderson, 2007; Lambert, Belelli, Peden, Vardy og Peters, 2003). Sömuleiðis geta súlfaðir taugakerfi breytt virkni þess N-metýl-D-aspartat viðtaka undirgerðir (Malayev, Gibbs og Farb, 2002) viðtaka. Þetta er mikilvægt svæði fyrir framtíðarrannsóknir.
Afhverju ætti að vera himna AR? Eins og fjallað var um áður, er náið samband milli andrógen seytingar og gefandi félagsleg hegðun. Við getum ímyndað sér að aukningin í testósterón seytingu sem fylgir mökun eða baráttu þjónar til að styrkja hegðunina. Ef svo er er nauðsynlegt að hafa örugga tengingu við hvatningu (hegðun) og laun (testósterón). Þetta er best hægt að ná með því að binda til himna AR. Í þessu sambandi væri áhugavert að ákvarða hvort spenna androgen seytingu við samdráttur dregur úr gefandi áhrifum kynferðislegrar hegðunar.
Yfirlit
Hér erum við að skoða sönnunargögnin um að andrógenir séu öflugir sáttasemjendur fullorðinna áhugasamlegra hegðunar og ennfremur að tímasetning útsetningar andrógen í þróunaráætlunum andrógen-háð hvetjandi hegðun í fullorðinsárum. Anabolic sterar eru fljótlega að verða greidd eiturlyf af misnotkun unglinga í Bandaríkjunum. Þó að AAS megi ekki hafa ávanabindandi virkni kókaíns eða heróíns, erum við bara að byrja að skilja hugsanlega andrógen styrkingu og fíkn. Einkum vegna þess að ungmennaíþróttir verða samkeppnishæfari, er aukin þrýstingur á að þróa íþróttamenn að nota sterum, byrjað á yngri aldri. Þessi þróun er áhyggjufull með hliðsjón af nýjum vísbendingum um stera- næmur taugaþroska hjá unglingum.
Þrátt fyrir aukna meðvitund bæði almennings og vísindasamfélaganna um djúpstæð taugabreytingar sem fylgja með unglingsár, hefur tilraunakönnun á þroskaþroskaþroska kynhneigðarinnar verið takmörkuð. Dýraríkjur unglingastarfs eru nauðsynlegar til að kanna hvernig tímasetning útsetningar hormóna við þróun eykur áhættu einstaklings fyrir geðhvarfafræði og fíkniefnaneyslu og hvaða tegundir af reynslu draga úr hegðunaráhrifum fráviks í kynþroska tímasetningu. Til dæmis auka félagsleg þættir, svo sem áhrif á jafningja, áhrif á kynþroska tímasetningu fyrir efna og áfengisnotkun (Biehl, Natsuaki og Ge, 2007; Patton, Novy, Lee og Hickok, 2004; Simons-Morton og Haynie, 2003; Wichstrom og Pedersen, 2001). Dýra módel af kynþroska tímasetningu mun einnig upplýsa mannlegar rannsóknaraðgerðir og hugsanlega leiða til skilvirkari meðferðar við inngöngu á unglingsárum.
Acknowledgments
Við þökkum Eleni Antzoulatos, Cortney Ballard, Lucy Chu, Kelly Peters, Jennifer Triemstra, Jane Venier, Lisa Rogers og Pamela Montalto til aðstoðar við þessar rannsóknir. Þessi vinna styður styrk frá NIH (DA12843 til RIW, MH68764 til CLS og MH070125 til KMS).
Neðanmálsgreinar
Fyrirvari útgefanda: Þetta er PDF skjal af óskráðri handriti sem hefur verið samþykkt til birtingar. Sem þjónustu við viðskiptavini okkar erum við að veita þessa snemma útgáfu handritsins. Handritið verður undirritað afrita, gerð og endurskoðun sönnunargagna áður en hún er gefin út í endanlegri bönnuð formi. Vinsamlegast athugaðu að á framleiðsluferlinu má finna villur sem gætu haft áhrif á efnið og öll lögboðin frávik sem gilda um dagbókina eiga við.
Meðmæli
- Alexander GM, Packard MG, Hines M. Testósterón hefur gefandi áverkanareiginleika hjá karlkyns rottum: afleiðingar fyrir líffræðilegan grundvelli kynferðislegrar hvatningar. Hegðunarvandamál. 1994;108: 424-8. [PubMed]
- Andersen SL. Trajectories of brain development: benda á varnarleysi eða möguleika glugga? Taugavísindi og lífhegðunarrýni. 2003;27: 3-18. [PubMed]
- Andersen SL, Rutstein M, Benzo JM, Hostetter JC, Teicher MH. Kynmismunur á ofvirkni og brotthvarf dópamínsviðtaka. Neuroreport. 1997;8: 1495-8. [PubMed]
- Arnedo MT, Salvador A, Martinez-Sanchis S, Gonzalez-Bono E. Verðlaun eiginleika testósteróns í ósnortnum karlmúsum: tilraunaverkefni. Lyfjafræði, lífefnafræði og hegðun. 2000;65: 327-32.
- Arnedo MT, Salvador A, Martinez-Sanchis S, Pellicer O. Svipaðar umbunandi áhrif testósteróns í músum sem eru til skamms tíma og langvarandi árásartímabil. Fíkniefni. 2002;7: 373-9. [PubMed]
- Arnold AP, Breedlove SM. Skipulag og virkni áhrif kynhormóna á heila og hegðun: endurgreining. Hormónar og hegðun. 1985;19: 469-98. [PubMed]
- Benes FM, Taylor JB, Cunningham MC. Samleitni og plasticity monoaminergic kerfi í miðlægum prefrontal heilaberki á eftir fæðingu tímabil: afleiðingar fyrir þróun sálfræðinnar. Heilabörkur. 2000;10: 1014-27. [PubMed]
- Benes FM, Turtle M, Khan Y, Farol P. Mýking á lykilhlutfalli í hippocampal myndun á sér stað í heilanum í æsku, unglinga og fullorðinsárum. Archives of General Psychiatry. 1994;51: 477-84. [PubMed]
- Biehl MC, Natsuaki MN, Ge XJ. Áhrif kynþroska tímasetningar á áfengisnotkun og miklum drykkjarbrautum. Journal of Youth and Adolescence. 2007;36: 153-167.
- Birgner C, Kindlundh-Hogberg AM, Nyberg F, Bergstrom L. Neuroscience Letters. 2006. Breyting á utanfrumuþéttni DOPAC og HVA í rottum kjarnanum, sem fylgir skel sem viðbragð við langvarandi nandrolón gjöf og síðari amfetamín áskorun.
- Bond AJ, Choi PY, Pope HG., Jr Mat á áreynslu hlutdrægni og skapi hjá notendum og ónotendum á vefaukandi andrógena sterum. Fíkniefni og áfengi háð. 1995;37: 241-5. [PubMed]
- Brower KJ. Anabolic steroid misnotkun og ósjálfstæði. Núverandi geðdeildarskýrslur. 2002;4: 377-87. [PubMed]
- Brower KJ, Catlin DH, Blow FC, Eliopulos GA, Beresford TP. Klínískar athuganir og þvagprófanir á misnotkun og ósjálfstæði á vefaukandi og andrógena stera. American Journal of Drug & Alcohol Abuse. 1991;17: 161-171. [PubMed]
- Celotti F, Negri-Cesi P, Poletti A. Umbrot stera í spendýrum: 5alpha-lækkun og aromatization. Brain Research Bulletin. 1997;44: 365-75. [PubMed]
- Chung salerni, De Vries GJ, Swaab DF. Kynferðislegt aðgreining á kjarna kjarnans í Stria Terminalis hjá mönnum getur náð í fullorðinsár. Journal of Neuroscience. 2002;22: 1027-33. [PubMed]
- Clark AS, Henderson LP. Hegðunar- og lífeðlisfræðileg viðbrögð við vefaukandi andrógenískum sterum. Taugavísindi og lífhegðunarrýni. 2003;27: 413-36. [PubMed]
- Clark AS, Lindenfeld RC, Gibbons CH. Anabolic-andrógenic sterum og heila umbun. Lyfjafræði, lífefnafræði og hegðun. 1996;53: 741-5.
- Conacher GN, Workman DG. Ofbeldi glæpur sem hugsanlega tengist notkun vefaukandi steróíða. American Journal of Psychiatry. 1989;146: 679. [PubMed]
- Cunningham RL, McGinnis MY. Líkamleg reynsla af kynfærum og sýkingu af völdum vefaukandi andrógena stera, sem verða fyrir karlkyns rottum, veldur árásargirni gagnvart konum. Hormónar og hegðun. 2006;50: 410-6. [PubMed]
- Daly RC, Su TP, Schmidt PJ, Pickar D, Murphy DL, Rubinow DR. Brjósthimnufrumur og hegðunarbreytingar eftir gjöf methyltestósteróns: bráðabirgðatölur. Archives of General Psychiatry. 2001;58: 172-7. [PubMed]
- Davis EC, Shryne JE, Gorski RA. Uppbygging kynferðislega dimorphisms í anteroventral kjarni kjarnans í rottum blóðþrýstingi eru viðkvæm fyrir gonadal sterum perinatally, en þróast peripubertally. Neuroendocrinology. 1996;63: 142-8. [PubMed]
- De Beun R, Jansen E, Slangen JL, Van de Poll NE. Testósterón sem ætandi og mismunandi hvati hjá rottum: kyn- og skammtaháð áhrif. Lífeðlisfræði og hegðun. 1992;52: 629-34. [PubMed]
- Dekaban AS. Breytingar á heilaþyngd meðan á mannslífi stendur: tengsl heilans við líkamshæð og líkamsþyngd. Annálum Neurology. 1978;4: 345-56. [PubMed]
- Di Chiara G, Imperato A. Fíkniefni sem misnotuð eru af mönnum auka í upphafi synaptískan dópamínþéttni í mesólimbísku kerfinu, sem eru frjálsir flutningsratar. Málsmeðferð við National Academy of Sciences í Bandaríkjunum. 1988;85: 5274-8. [PMC ókeypis grein] [PubMed]
- DiMeo AN, Wood RI. Sjálf-gjöf estrógen og díhýdrótestósteróns í karlkyns hamstrum. Hormónar og hegðun. 2006;49: 519-26. [PubMed]
- DiPasquale M. Anabolic Steroids. Í: Tarter RE, Ammerman RT, Ott PJ, ritstjórar. Handbók um efni misnotkun. Plenum Press; NY: 1998. bls. 547-565.
- Dominguez J, Riolo JV, Xu Z, Hull EM. Reglugerð með miðlægum amygdala af samhæfingu og miðlægri preoptic dópamín losun. Journal of Neuroscience. 2001;21: 349-355. [PubMed]
- Dominguez JM, Hull EM. Örvun miðgildi amygdala eykur miðgildi foroptísk losun dópamíns: áhrif á kynhvöt hjá karlkyns rottum. Brain Research. 2001;917: 225-229. [PubMed]
- Du J, Lorrain DS, Hull EM. Kastróknun dregur úr utanfrumu, en eykur innanfrumu, dópamín á miðlægu preoptic svæði karlkyns rottum. Brain Research. 1998;782: 11-17. [PubMed]
- Eckenhoff MF, Rakic P. Náttúra og örlög fjölgunarefna í hippocampal dentate gyrus á líftíma rhesus api. Journal of Neuroscience. 1988;8: 2729-47. [PubMed]
- Everitt BJ, Stacey P. Rannsóknir á verkfærum með kynferðislegri aukningu hjá karlkyns rottum (Rattus norvegicus): II. Áhrif preopsic svæðisskemmda, kastrunar og testósteróns. Journal of Comparative Psychology. 1987;101: 407-19. [PubMed]
- Gallaway S. The Steroid Bible. Belle International Press; Sacramento, CA: 1997.
- Galligani N, Renck A, Hansen S. Persónuleika prófíl karla sem nota vefaukandi andrógen stera. Hormónar og hegðun. 1996;30: 170-5. [PubMed]
- Grimes JM, Melloni RH., Jr Langvarandi breytingar á serótónín taugakerfinu eftir að unglingastyrkur á vefaukandi andrógena andrógena stera í hamar (Mesocricetus auratus) Hegðunarvandamál. 2006;120: 1242-51. [PubMed]
- Hannan CJ, Jr, Friedl KE, Zold A, Kettler TM, Plymate SR. Sálfræðileg og sermisþéttni homovanillic sýru hjá körlum sem gefa andrógenstera. Psychoneuroendocrinology. 1991;16: 335-43. [PubMed]
- Harrison RJ, Connor DF, Nowak C, Nash K, Melloni RH., Jr. Meðferð á anabolic-androgenic steroid meðferð meðan á unglingastarfsemi stendur, eykur foræðsþéttni vasópressíns og árásargirni í óbreyttum hamstrum. Psychoneuroendocrinology. 2000;25: 317-38. [PubMed]
- Hann J, áhafnir FT. Neurogenesis minnkar við þroska heilans frá unglingsárum til fullorðinsárs. Lyfjafræði, lífefnafræði og hegðun. 2007;86: 327-33.
- Henderson LP. Stera mótum GABAA viðtakamiðils miðlunar í blóðþrýstingi: áhrif á æxlun. Neuropharmacology. 2007;52: 1439-53. [PMC ókeypis grein] [PubMed]
- Hull EM, Du J, Lorrain DS, Matuszewich L. Extracellular dópamín á miðlægu preoptic svæðinu: afleiðingar kynferðislegrar hvatningar og hormónastýringu eftirlits. Journal of Neuroscience. 1995;15: 7465-7471. [PubMed]
- Hull EM, Meisel RL, Sachs BD. Karlkyns kynferðisleg hegðun. Í: Pfaff DW, Arnold AP, Etgen AM, Fahrbach SE, Rubin RT, ritstjórar. Hormónar, heila og hegðun. Academic Press; New York: 2002. bls. 3-137.
- Hull EM, Wood RI, McKenna KE. Neurobiology karlkyns kynferðislega hegðun. Í: Neill JD, ritstjóri. Endurmyndun lífeðlisfræði. Vol. 1. Elsevier Press; New York: 2006. bls. 1729-1824.
- Huttenlocher PR, Dabholkar AS. Svæðisbundinn munur á synaptogenesis í heilaberki manna. Journal of Comparative Neurology. 1997;387: 167-78. [PubMed]
- Johnson LR, Wood RI. Sjálfsstjórnun á testósteróni í karlkyns hamstrum. Neuroendocrinology. 2001;73: 285-92. [PubMed]
- Johnston LD, O'Malley PM, Bachman JG. Framhaldsskólanemar (NIH Útgáfa nr. 03-5375) I. Bethesda, MD: National Institute of Drug Abuse; 2003. Að fylgjast með árangri í innlendum könnunum um notkun lyfja, 1975-2002.
- Kaiser Family Foundation. US unglinga kynlíf. 2005. bls. # 3040-02.
- Kashon ML, Hayes MJ, Shek PP, Sisk CL. Reglugerð um ónæmisviðbrögð í heila andrógenviðtaka með andrógeni í karlkyns frettum úr prepubertali. Líffræði af æxlun. 1995;52: 1198-205. [PubMed]
- Kindlundh AM, Bergstrom M, Monazzam A, Hallberg M, Blomqvist G, Langstrom B, Nyberg F. Dópamínvirk áhrif eftir langvarandi meðferð með nandrólóni sem sýndar eru í rottum heila með tómstundavökvunartóm. Framfarir í taugasjúkdómi og líffræðilegri geðlækningu. 2002;26: 1303-8.
- Kindlundh AM, Lindblom J, Bergstrom L, Wikberg JE, Nyberg F. The anabolic-andrógenic steroid nandrolone decanoate hefur áhrif á þéttleika dópamínviðtaka í karlkyns rottaheilanum. European Journal of Neuroscience. 2001;13: 291-6. [PubMed]
- Kindlundh AM, Lindblom J, Nyberg F. Langvarandi gjöf með nandrónónóndeanóati veldur breytingum á genritunarinnihald dópamín D (1) og D (2) -viðtaka í rottum heilans. Brain Research. 2003;979: 37-42. [PubMed]
- King BE, Packard MG, Alexander GM. Áhrifaríkar eiginleikar miðpróteins í miðtaugakerfi á testósteróni hjá karlkyns rottum. Neuroscience Letters. 1999;269: 149-52. [PubMed]
- Koob GF, Nestler EJ. The neurobiology eiturlyf fíkn. Journal of Neuropsychiatry & Clinical Neurosciences. 1997;9: 482-97. [PubMed]
- Kouri EM, Lukas SE, Pope HG, Jr, Oliva PS. Aukin árásargjarn viðbrögð hjá karlkyns sjálfboðaliðum eftir gjöf smám saman vaxandi skammta af testósterón cypionate. Fíkniefni og áfengi háð. 1995;40: 73-9. [PubMed]
- Kritzer MF. Langvarandi sveiflukenning hefur áhrif á þéttleika týrósínhýdroxýlasa en ekki dópamín-beta-hýdroxýlasa-, kólínasetýltransferasa- eða serótónín-ónæmisviðbrögðum axons í miðgildisskortum fullorðnum karlkyns rottum. Heilabörkur. 2003;13: 282-296. [PubMed]
- Kurling S, Kankaanpaa A, Ellermaa S, Karila T, Seppala T. Áhrif langvinnrar nandrolone decanoate meðferðar á dópamínvirkum og serótónvirkum taugakerfi í heilum rottum. Brain Research. 2005;1044: 67-75. [PubMed]
- Lambert JJ, Belelli D, Peden DR, Vardy AW, Peters JA. Taugakerfi mótun GABAA viðtaka. Framfarir í taugakvillafræði. 2003;71: 67-80. [PubMed]
- Lenroot RK, Giedd JN. Brainþroska hjá börnum og unglingum: innsýn frá líffræðilegum segulómunarmyndun. Taugavísindi og lífshegðunarmat. 2006;30: 718-29.
- Lesting J, Neddens J, Teuchert-Noodt G. Ógleði dopamín innervation í kjarnanum accumbens af gerbils. Brain Research. 2005;1066: 16-23. [PubMed]
- Malayev A, Gibbs TT, Farb DH. Hömlun á NMDA svöruninni með pregnenólonsúlfat sýnir sértækt mótun NMDA viðtaka undir tegundar með súlfum sterum. British Journal of Pharmacology. 2002;135: 901-9. [PMC ókeypis grein] [PubMed]
- Martinez M, Guillen-Salazar F, Salvador A, Simon VM. Árangursrík millistig árásargirni og skilyrt staðvalbúnaður í músum. Lífeðlisfræði og hegðun. 1995;58: 323-8. [PubMed]
- Mjög LR, Romeo RD, Novak CM, Sisk CL. Aðgerðir testósteróns í prepubertal og postpubertal karlkyns hamstrum: dissociation áhrif á æxlun og ónæmissvörun heilans andrógenviðtaka. Hormónar og hegðun. 1997;31: 75-88.
- Meisel RL, Joppa MA. Skilyrt staðvalla í kvenkyns hamstrum eftir árásargjarn eða kynferðislegan kynni. Lífeðlisfræði og hegðun. 1994;56: 1115-8. [PubMed]
- Melloni RH, Jr, Connor DF, Hang PT, Harrison RJ, Ferris CF. Sýklalyfja- og andrógensteraótefni á unglingsárum og árásargjarn hegðun í gullnu hamstrum. Lífeðlisfræði og hegðun. 1997;61: 359-64. [PubMed]
- Menard C, Harlan R. Uppbygging á andrógenviðtaka andrógenviðtaka í rottum heilanum með andrógenískum vefaukandi sterum. Brain Research. 1993;622: 226-236. [PubMed]
- Mermelstein PG, Becker JB, Surmeier DJ. Estradiól dregur úr kalsíumstraumum í taugafrumum í nefstíflum með himnuviðtökum. Journal of Neuroscience. 1996;16: 595-604. [PubMed]
- Midgley SJ, Heather N, Davies JB. Stig af árásargirni hjá hópi notkunar í vefaukandi andrógena stera. Læknisfræði, vísindi og lög. 2001;41: 309-14.
- Molenda-Figueira HN, Salas-Ramirez KY, Schulz KM, Zehr JL, Montalto PR, Sisk CL. Unglingafélagsleg reynsla endurheimtir fullorðna sáðlát hegðun hjá karlkyns Sýrlendinga hamstur sem skortir kynþroska testósterón. Samfélag fyrir hegðunarvandamál Pacific Grove, CA: 2007.
- Noble RG, Alsum PB. Hormón háð kynlíf dimorphisms í Golden Hamster (Mesocricetus auratus) Lífeðlisfræði og hegðun. 1975;14: 567-74. [PubMed]
- Nunez JL, Lauschke DM, Juraska JM. Frumdauði í þroska í baklægum heilaberki hjá körlum og kvenkyns rottum. Journal of Comparative Neurology. 2001;436: 32-41. [PubMed]
- Nunez JL, Sodhi J, Juraska JM. Eggjastokkar í eggjastokkum eftir fæðingardegi 20 dregur úr taugafrumum í rottum aðal sjónræn heilaberki. Journal of Neurobiology. 2002;52: 312-21. [PubMed]
- O'Connor DB, Archer J, Wu FC. Áhrif testósteróns á skap, árásargirni og kynferðislega hegðun hjá ungum mönnum: tvíblind, samanburðarrannsókn með lyfleysu. Journal of Clinical Endocrinology & Metabolism. 2004;89: 2837-45. [PubMed]
- Packard MG, Cornell AH, Alexander GM. Endurheimta áhrifamikla eiginleika kjarna í bláæðum, þar sem testósterón er gefið. Hegðunarvandamál. 1997;111: 219-24. [PubMed]
- Parfitt DB, Thompson RC, Richardson HN, Romeo RD, Sisk CL. GnRH mRNA eykst með kynþroska í karlkyns Sýrlendinga hamstur heila. Journal of Neuroendocrinology. 1999;11: 621-7. [PubMed]
- Parrott AC, Choi PY, Davies M. Anabolic steroid notkun hjá áhugamönnum íþróttamanna: Áhrif á sálfræðilegan skapandi ríki. Tímarit um íþróttalækningar og líkamsrækt. 1994;34: 292-8. [PubMed]
- Patton PE, Novy MJ, Lee DM, Hickok LR. Greiningin og æxlunarástandið eftir skurðaðgerð á heilu sigti legi, tvíblindar leghálsi og leggöngum. American Journal of Obstetrics & Kvensjúkdómafræði. 2004;190: 1669-75. 1675-8. [PubMed]
- Paus T, Collins DL, Evans AC, Leonard G, Pike B, Zijdenbos A. Matur hvítra efnis í heilanum: endurskoðun á segulómun. Brain Research Bulletin. 2001;54: 255-66. [PubMed]
- Perry PJ, Kutscher EC, Lundur BC, Yates WR, Holman TL, Demers L. Aðgerðir á árásargirni og skapbreytingum hjá karlkyns þyngdarlifum með og án andrógenískrar vefaukandi steraprófunar. Journal of réttar vísindi. 2003;48: 646-51. [PubMed]
- Peters KD, Wood RI. Andoxun í hamstrum: ofskömmtun, umburðarlyndi og hugsanlega ópíóíðvirkni. Neuroscience. 2005;130: 971-81. [PubMed]
- Pfaus JG, Damsma G, Nomikos GG, Wenkstern DG, Blaha CD, Phillips AG, Fibiger HC. Kynferðisleg hegðun eykur miðlæga dópamín flutning í karlkyns rottum. Brain Research. 1990;530: 345-348. [PubMed]
- Phoenix CH, Goy RW, Gerall AA, Ungt salerni. Skipuleggjandi verkun próteinat própíónats á prenatallyðan hátt á vefjum sem miðlar mökunarhætti í kvenkyns naggrísum. Endocrinology. 1959;65: 369-82. [PubMed]
- Pinos H, Collado P, Rodríguez-Zafra M, Rodriguez C, Segovia S, Guillamon A. Þróun kynlífs munur á rottum locus coeruleus. Brain Research Bulletin. 2001;56: 73-8. [PubMed]
- Pope HG, Jr, Katz DL. Múslimar og nánast múslimar með vefaukandi sterumnotendum. [Sjá athugasemd] Journal of Clinical Psychiatry. 1990;51: 28-31. [PubMed]
- Pope HG, Jr, Katz DL. Geðræn og læknisfræðileg áhrif á notkun á vefaukandi og andrógena stera. Stýrð rannsókn á 160 íþróttamönnum. Archives of General Psychiatry. 1994;51: 375-82. [PubMed]
- Pope HG, Jr, Kouri EM, Powell KF, Campbell C, Katz DL. Anabolic-androgenic steroid notkun meðal 133 fanga. Alhliða geðdeildarfræði. 1996;37: 322-7. [PubMed]
- Putnam SK, Du J, Sato S, Hull EM. Tópósterón endurreisn ákvæðandi hegðunar fylgir með miðlægri preoptic dópamín losun í castrated karlkyns rottum. Hormónar og hegðun. 2001;39: 216-224. [PubMed]
- Putnam SK, Sato S, Hull EM. Áhrif umbrotsefna testósteróns við samloðun og miðgildi preoptic dópamín losun í castrated karlkyns rottum. Hormónar og hegðun. 2003;44: 419-26. [PubMed]
- Putnam SK, Sato S, Riolo JV, Hull EM. Áhrif umbrotsefna testósteróns við samloðun, miðgildi fyrirbyggjandi dópamíns og NOS-ónæmissvörun í castrated karlkyns rottum. Hormónar og hegðun. 2005;47: 513-522. [PubMed]
- Rankin SL, Partlow GD, McCurdy RD, Giles ED, Fisher KR. Fósturlát eftir fæðingu í vasopressíni og oxýtósín-innihaldsefnum kjarna svifshormónsins. Brain Research. 2003;971: 189-96. [PubMed]
- Ricci LA, Rasakham K, Grimes JM, Melloni RH., Jr Serotonin-1A viðtaka virkni og tjáningu móta unglinga með ofnæmisviðbrögðum / andrógena stera sem veldur ofbeldi í hamstra. Lyfjafræði, lífefnafræði og hegðun. 2006;85: 1-11.
- Romeo RD, Cook-Wiens E, Richardson HN, Sisk CL. Dihydrotestosteron virkjar kynferðislega hegðun hjá fullorðnum karlkyns hamstrum en ekki hjá seiði. Lífeðlisfræði og hegðun. 2001;73: 579-84. [PubMed]
- Romeo RD, Diedrich SL, Sisk CL. Ónæmissvörun estrógensviðtaka í prepubertal og fullorðnum karlkyns Sýrlendinga hamstur. Neuroscience Letters. 1999;265: 167-70. [PubMed]
- Romeo RD, Parfitt DB, Richardson HN, Sisk CL. Pheromones framkalla jafngildi Fos-ónæmissvörunar í prepubertal og fullorðnum karlkyns Sýrlendinga hamstur. Hormónar og hegðun. 1998;34: 48-55. [PubMed]
- Romeo RD, Richardson HN, Sisk CL. Puberty og þroska karlkyns heila og kynferðislega hegðun: endurreisa hegðunarmöguleika. Taugavísindi og lífhegðunarrýni. 2002a;26: 381-91. [PubMed]
- Romeo RD, Wagner CK, Jansen HT, Diedrich SL, Sisk CL. Estradiól örvar prógesterónviðtaka í segavarnarlyfjum en virkar ekki með því að mæta hegðun í karlkyns hamstur (Mesocricetus auratus) fyrir kynþroska. Hegðunarvandamál. 2002b;116: 198-205. [PubMed]
- Salas-Ramirez KY, Montalto PR, Sisk CL. Anabolic androgenic steroids (AAS) hafa mismunandi áhrif á félagslega hegðun hjá unglingum og fullorðnum karlkyns Sýrlendinga hamstrum. Hormónar og hegðun. 2008 í stuttu.
- SAMHSA / OAS. DHHS útgáfu nr. (SMA) 1996. 1994 National House Survey on Drug Abuse, Helstu niðurstöður 1994; bls. 96-3085.
- SAMHSA / OAS. Niðurstöður úr 2004 National Survey on Drug Use and Health: National Findings. 2005. NSDUH Series H-28, DHHS útgáfu nr. SMA 05-4062.
- Sato SM, Johansen J, Jórdanía CL, Wood RI. Androgen sjálfs gjöf í Tfm rottum. 10th ársfundur félagsins fyrir hegðunarvandamálum. 2006.
- Sato SM, Wood RI. Sjálfstjórn á himnaleygjanlegum vefaukandi andrógenískum sterum (aas) í syrianhamsterum. 11th ársfundur félagsins fof Hegðunarvanda Neuroendocrinology.2007.
- Schroeder JP, Packard MG. Hlutverk dopamín viðtaka undirhópa við kaup á testósteróni sem hefur verið valið í rottum. Neuroscience Letters. 2000;282: 17-20. [PubMed]
- Schulte HM, Hall MJ, Boyer M. Heimilisofbeldi í tengslum við ofbeldisfíkniefni. American Journal of Psychiatry. 1993;150: 348. [PubMed]
- Schulz KM, Menard TA, Smith DA, Albers HE, Sisk CL. Áhrif útsetningu á eistum á hormónum meðan á unglingastarfi stendur, skipuleggur flankmarkandi hegðun og vasopressín viðtaka bindingu í hliðarsvipinu. Hormónar og hegðun. 2006;50: 477-83. [PubMed]
- Schulz KM, Richardson HN, Romeo RD, Morris JA, Útlendingur KJ, Sisk CL. Miðlægu augnþrýstingslækkandi svörun við kvenkyns ferómónum þróast meðan á kynþroska stendur í karlkyns Sýrlendingahamsteri. Brain Research. 2003;988: 139-45. [PubMed]
- Schulz KM, Richardson HN, Zehr JL, Osetek AJ, Menard TA, Sisk CL. Gonadal hormón masculinize og defeminize æxlun hegðun á kynþroska í karlkyns Sýrlendinga hamstur. Hormónar og hegðun. 2004;45: 242-9. [PubMed]
- Schulz KM, Sisk CL. Krabbameinshormón, unglingahópur og þroska félagslegra hegðunar: Lærdómur frá Sýrlendinga hamstur. Sameinda- og frumu- innkirtlafræði. 2006:254–255. 120–6.
- Schulz KM, Zehr JL, Salas-Ramirez KY, Sisk CL. Neuroscience Meeting Planner. Sandiego, CA: Samfélag fyrir taugavinnu; 2007. Er unglinga annað viðkvæmt tímabil til að skipuleggja áhrif testósteróns á fullorðinsárum karlkyns æxlunarhegðun? 2007 Online.
- Scott JP, Stewart JM, De Ghett VJ. Mikilvægt tímabil í skipulagi kerfa. Þroskaþjálfi. 1974;7: 489-513. [PubMed]
- Shughrue PJ, Lane MV, Merchenthaler I. Samanburður á dreifingu estrógenviðtaka alfa og beta-mRNA í miðtaugakerfi rottunnar. Journal of Comparative Neurology. 1997;388: 507-25. [PubMed]
- Simons-Morton BG, Haynie DL. Sálfélagslegar spár fyrir aukinni reykingarstig meðal sjötta stigara. American Journal of Health Hegðun. 2003;27: 592-602. [PubMed]
- Sisk CL, Zehr JL. Krabbameinshormón skipuleggja unglingaheilann og hegðunina. Landamærin í neuroendocrinology. 2005;26: 163-74. [PubMed]
- Sowell ER, Thompson PM, Leonard CM, Velkomin SE, Kan E, Toga AW. Lengd kortlagning á cortical þykkt og heila vöxt hjá venjulegum börnum. Journal of Neuroscience. 2004;24: 8223-31. [PubMed]
- Sowell ER, Thompson PM, Tessner KD, Toga AW. Kortlagning áframhaldandi vaxtarhraði og þyngdaraukning grárs efnisþéttni í dorsal framhliðshópnum: Andstæðar sambönd á meðan á hjartsláttartruflunum stendur. Journal of Neuroscience. 2001;21: 8819-29. [PubMed]
- Spjót LP. Unglingaheilinn og aldurstengdar atferlisgreinar. Taugavísindi og lífshegðunarmat. 2000;24: 417-63.
- Su TP, Pagliaro M, Schmidt PJ, Pickar D, Wolkowitz O, Rubinow DR. Neuropsychiatric áhrif á vefaukandi sterum hjá karlkyns, sjálfboðaliðum. JAMA. 1993;269: 2760-4. [PubMed]
- Thiblin I, Finn A, Ross SB, Stenfors C. Aukin dópamínvirk og 5-hýdroxýtryptamínvirk starfsemi í karlkyns rottum heila eftir langvarandi meðferð með vefaukandi andrógensteraum. British Journal of Pharmacology. 1999;126: 1301-6. [PMC ókeypis grein] [PubMed]
- Thomas P, Dressing G, Pang Y, Berg H, Tubbs C, Benninghoff A, Doughty K. Progestín, estrógen og andrógen G-prótein tengdar viðtökur í fiskgonadýrum. Sterar. 2006;71: 310-6. [PubMed]
- Tricker R, Casaburi R, Storer TW, Clevenger B, Berman N, Shirazi A, Bhasin S. Áhrif supraphysiologískra skammta af testósteróni á reiða hegðun hjá heilbrigðum eugonadal körlum - klínísk rannsókn á rannsóknarmiðstöð. Journal of Clinical Endocrinology & Metabolism. 1996;81: 3754-8. [PubMed]
- Triemstra JL, Nagatani S, Wood RI. Efnafræðilegir vísbendingar eru nauðsynlegir til að koma í veg fyrir meðhöndlun dópamíns í MPOA af karlkyns Sýrlendinga hamstrum. Neuropsychopharmacology. 2005;30: 1436-42. [PubMed]
- Triemstra JL, Sato SM, Wood RI. Testósterón og kjarna byggjast á dópamíni í karlkyns Sýrlendingahamsteri. Psychoneuroendocrinology (í stuttu)
- Van Eenoo P, Delbeke FT. Algengi doping í Flanders í samanburði við algengi lyfja í alþjóðlegum íþróttum. International Journal of Sports Medicine. 2003;24: 565-570. [PubMed]
- WADA. Óæskilegar niðurstöður greiningar hjá viðurkenndum rannsóknarstofum. 2006. http://www.wada-ama.org.
- Wesson DW, McGinnis MY. Stöðva vefaukandi andrógenstera (AAS) á kynþroska hjá rottum: taugakvilla og hegðunarmat. Lyfjafræði, lífefnafræði og hegðun. 2006;83: 410-9.
- Wichstrom L, Pedersen W. Notkun á vefaukandi andrógenstera í unglingsárum: að vinna, líta vel út eða vera slæmt? Journal of Studies on Alcohol. 2001;62: 5-13. [PubMed]
- Wood RI, Johnson LR, Chu L, Skad C, Sjálf DW. Styrkur testósteróns: sjálfs gjöf í bláæð og intracerebroventricular í karlkyns rottum og hamstrum. Psychopharmacology. 2004;171: 298-305. [PubMed]
- Wood RI, Newman SW. Androgen og estrógenviðtökur eru samhliða með einstökum taugafrumum í heila sýrlensku hamstranna. Neuroendocrinology. 1995;62: 487-97. [PubMed]
- Wood RI, Swann JM. Neuronal samþætting efnafræðilegra og hormónalegra einkenna sem stjórna kynferðislegri hegðun karlkyns. Í: Wallen K, Schneider JS, ritstjórar. Fjölföldun í samhengi. MIT Press; Cambridge: 1999. bls. 423-444.
- Zahm DS, Heimer L. Tvær transpallidal leiðir upprunnar í rottum kjarnanum accumbens. Journal of Comparative Neurology. 1990;302: 437-46. [PubMed]