ნეიროსი ბიობიჰავა Rev. 2011 იანვარი (35) 3-939. doi: 55 / j.neubiorev.10.1016. Epub ნოემბერი 9 ნოემბერს.
- 1ბერნარ ბროდი ნეირომეცნიერების დეპარტამენტი, Cagliari University, Cittadella Universitaria, Monserrato, CA, იტალია. [ელ.ფოსტით დაცულია]
ᲐᲑᲡᲢᲠᲐᲥᲢᲣᲚᲘ
ოქსიტოცინი არის ცენტრალურ ნერვულ სისტემაში ინექციისას კალციუმის ერექციის ძლიერი ინჰიბიტორი. მამრობითი ვირთხებში, ოქსიტოცინის პრო-ეეტერალური ეფექტის ყველაზე მგრძნობიარე ტვინის ფართობი ჰიპოთალამუსის პარავენენტულულ ბირთვს წარმოადგენს. ეს ბირთვი და მიმდებარე რეგიონები შეიცავს ყველა ოქსიოტექნიკური ნეირონების უჯრედებს, რომლებიც ითვალისწინებენ დამატებით ჰიპოთალამური ტვინის ტერიტორიებსა და ზურგის ტვინს. ეს მიმოხილვა გვიჩვენებს, რომ ოქსიტოცინი იწვევს პენიალურ ერექციას, აგრეთვე, ზოგიერთ ნაწილში გაჟღენთილი (მაგ., ვენტრალური თირკმლის არეალი, ჰიპოკამპუსის ვენტრალური სუბიექტი, ამიგდალას და თორკო-წელის ზურგის ტვინის კეროვანი ბირთვი). მიკროინექციური კვლევები, რომლებიც შედიან ინტრა-ცერებრალური მიკროდოლიზმით და ორმაგი იმუნოფლუორესცენციის კვლევებით, ამ ოქსიტოცინის ამ ნაწილებში პირდაპირ ან ირიბად მოქმედებს (ძირითადად გლუტამაზმის მჟავას) მეზოოლიმბური დოპამინერგული ნეირონების. ბირთვში გამოყოფის დოპამინი თავის მხრივ ააქტიურებს ნერვულ გზას, რომელიც იწვევს პარავენენტულულ ბირთვებში ინერერტო-ჰიპოთალამური დოპამინერგული ნეირონების გააქტიურებას. ეს ააქტიურებს არა მარტო ოქსიტოცინერგული ნეირონებს ზურგის ტვინისა და შუამავლების რეზისტენტობის პროვოცირებას, არამედ იმ დამატებით ჰიპოთალამურ სფეროებს, რომლებიც პირდაპირ ან არაპირდაპირ (გლუტამაზმჟავას მეშვეობით) მოდიფიცირებას ახდენენ მეზოოლიმბური დოპამინერგული ნეირონების მოქმედებას და მოტივაციას. ეს ნერვული გზები შეიძლება შეიცავდეს კომპლექსურ ჰიპოთეკურ წრედს, რომელიც როლს ასრულებს არა მხოლოდ სექსუალურ მოქმედებად მოქმედებაში (ერექციული ფუნქცია და სპექტაკლი), არამედ სექსუალური ქცევის წინაპირობების ფაზის მოტივაციო და დაჯილდოების ასპექტში.
1.Introduction
Penile rerection არის მამრობითი სქესობრივი პასუხი, რომელიც მნიშვნელოვან როლს ასრულებს ძუძუმწოვრების რეპროდუცირებაში, მათ შორის კაცს და ეს შეიძლება ასევე შეინიშნება რეპროდუქციის მკაცრად დაკავშირებული კონტექსტით. დამოკიდებულია კონტექსტში, რომლის მიმართაც ხდება penile erection, მისი რეგლამენტში მონაწილეობენ სხვადასხვა ცენტრალური და პერიფერიული ნერვული და / ან ჰუმორული მექანიზმები (იხ. Meisel and Sachs, XXII; Argiolas and Melis, XXX, XXIII, Sachs, XXX; ჯულიანო და რამპინი, 1994, XXII, ანდერსონი, მელი და არგოლასი, ჰალუი და სხვები, 1995). ცენტრალურ ნეიროტრანსმიტერებსა და ნეიროპეპტიდებებს შორის პენიტენციურ ერექციის კონტროლი, ყველაზე ცნობილია დოპამინი, სეროტონინი, გამაღიზიანებელი ამინომჟავები, აზოტის ოქსიდი, ადრენკორტიკოტროპინი, ოქსიტოცინი და ოპიოიდური პეპტიდები. მათ შეუძლიათ ხელი შეუწყონ ან აიცილონ penile rerection მოქმედებს რამდენიმე ტვინის სფეროებში, ჰიპოთალამუსის პარავენტრიკულური ბირთვი, ვენტრალური თირკმლის არეალი, ჰიპოკამპუსი, ამგიგდალა, სტრია ტერმინალილის საწინააღმდეგო ბირთვი, ბირთვი აკუმბუნები, შუალედური ტუბერტა და ზურგის ტვინი (იხ. Meisel and Sachs, XX; Witt and Insel, XX; Stancampiano et al., Argiolas და Melis, გერმანია, Bancila et al., ჯულიანო და Rampin, XXX; მაკკენა, ანდერსონი, ჰალმა და სხვ., Coolen et al., 1).
ოქსიტოცინი, ნეიროჰიფიოფილური პეპტიდი, რომელიც ცნობილია ლაქტაციისა და პარკუჭში, ასევე შეიცავს ქალებსა და მამაკაცებში, არა მხოლოდ ნეირონებში, რომელიც მდებარეობს ნეიროჰიპოფციზზე ჰიპოთალამუსის პროთეზულ-სამკურნალო პრეპარატებისა და ნეიროჰიფობიის პრეპარატებში. პარავენტრიკულური ბირთვიდან და მიმდებარე სტრუქტურებისგან ექსჰჰიპოთოთალური ტვინის არეებიდან (ანუ სეპტიმი, ვენტრალური თერგმენტური ტერიტორია, ჰიპოკამპუსი, ამიგდალა, მედულასო ტუკანტატა და ზურგის ტვინი). ეს ნეირონები ფიქრობენ, რომ ჩართული მრავალი ცენტრალური ფუნქცია, როგორიცაა მეხსიერების, სწავლის, ფსიქოლოგიური და სოციალურ-სექსუალური ქცევები, მათ შორის penile erection და copulatory ქცევა (იხ. Buijs, 1978, არგოროსი და Gessa, 1983; Pedersen et al ., კარტერი, ვაგნერი და კლემენსი, ივერი და რასელი, კარტერი, სხვ., ტონგ და სხვ., ვერონიე-ლოგგვინვილი, 1991). მართლაც, ოქსიტოცინი ხელს უწყობს ელიქსიური ფუნქციისა და მამრობითი სქესის ქცევას თაგვებში, ვირთხებში, კურდღლებსა და მაიმუნებში (იხ. არგოლისა და გესას, კარტერი, პეტერსენი, გერმანია, არგოროსი და მელიისი, მე -3, არგოროსი, 1992). ეს შეიძლება მოხდეს ადამიანებშიც, ვინაიდან პლაზმური ოქსიტოცინი გაზრდილია სექსუალური სტიმულაციით, განსაკუთრებით ეგაქულაციით (კარმიახალი და სხვ., მერფი და სხვები), ასევე მკერდისა და გენიტალიის მანიპულირება, რაც, როგორც წესი, კავშირი (თინდალე, 1992).
მამრობითი სქესობრივი ქცევის შესახებ ოქსიტოცინის ეფექტურობის შედეგი პირველად აჩვენა, რომ ინტრავენური ოქსიტოცინის უნარი პირველივე ეგაქულაციის შეწყვეტას და მამაკაცის კურდღლების სექსუალური ამოწურვის შეჩერებას (მელინი და კიჰლტრომს, 1963). თუმცა, ოქსიტოცინის სექსუალური ეფექტები საბოლოოდ მხოლოდ ოთხმოცდაათში იყო აღიარებული. ოქსიტოცინს მიეკუთვნებოდა ნანოგრამის თანხების ცენტრალურ ნაწილში, შემდეგ კი ვერ იპოვეს კალციუმის რეაქციის (არგოლიას და ა.შ., 1985, XXX) კოპულაციური ქცევის (Arletti et al., 1986) მამრობითი ვირთხებში, და ბერტოლინი, კალდველი და სხვები.), როგორც ჩანს, საშვილოსნოს ტიპის ოქსიოტექნიკური რეცეპტორების მოქმედება (იხ. არგოლისა და მელიისი, გერმანია, არგლიოსი, მელისი და არგიოლია, XXX; ოქსიტოცინი აუმჯობესებს სექსუალურ ქცევას არა მარტო სქესობრივი გზით მამაკაცის ვირთაგვებში (არლეტი და სხვ.), არამედ ასაკის მამრობითი ვირთხებში (არლეტი და სხვ.), და დომინანტებში, მაგრამ არა ქვედანაყოფში, მამაკაცის ციყვიანი მაიმუნები (ვინსლოუ და Insel , 1985).
ოქსიტოცინის პროფიექციური ეფექტი არის ტესტოსტერონის დამოკიდებულება, რადგან იგი გააუქმებს ჰიპოფიცემია და კასტრირება და აღდგება ტესტოსტერონის ან მისი მეტაბოლიტების, ესტრადიოლისა და 5- დიჰიდრო-ტესტოსტერონის დამატებასთან ერთად (Melis et al., 1994). ოქსიტოცინის მიერ კალციუმის ერექციის ინდუცირებისთვის ყველაზე მგრძნობიარე ტვინის ფართობია ჰიპოთალამუსის პარავენენტრიკულური ბირთვი (მელისი და სხვ.), საიდანაც წარმოიქმნება ყველა ჰიპოთალამური ოქსიტოცინირების პროგნოზები (იხ. ზემოთ). აქ, ოქსიტოცინი აღმოჩნდა, რომ შესაძლებელი იყო პენსიალური ერექციის (და გაყალბების) გამოყოფისას, როდესაც დოზებში შეყვანა, როგორც მინიმუმ 1986 საათის განმავლობაში (იხ. ნაწილი 3). ოქსიტოცინი გამოწვეული penile erection ასევე, როდესაც გაუკეთეს ორმხრივად შევიდა CA2.1 სფეროში ჰიპოკამპის, მაგრამ არა დორსალური subiculum (იხ 1 ქვემოთ), გვერდითი ძგიდის caudate ბირთვს, მედიალური preoptic ტერიტორია, ventromedial nucleus ჰიპოთალამუსის და სუროპეტური ბირთვი (მელი და სხვ., 2.3). რაც შეეხება იმ მექანიზმს, რომლის მიხედვითაც ოქსიტოცინი მოქმედებს პარავენენტულულ ბირთვში ამ სექსუალური რეაქციის გამოწვევისას, მრავალი კვლევის თანახმად, ოქსიტოცინი ატარებს თავის ნეირონებს. ამ ჰიპოთეზის შესაბამისად, სექსუალური ურთიერთქმედება ზრდის FOS, ადრეული გენის გენოფონდის გენური პროდუქტი პარავენტრიკულური ოქსიოტექნიკური ნეირონების პროტეინირებას ზურგის ტვინის მიმართ, რომლებიც ჩართულნი არიან კალციუმის ერექციის კონტროლში (იხ. Witt and Insel, 1994 და References მასში) და სექსუალური იმპოტენცია (მაგ., ზრდასრულ მამაკაცის ღვიძლის უუნარობა, რომელიც ხელს უწყობს ეზრაიქტომირებული ესტროგენი-პროგესტერონპრომირებული მგრძნობელობის მქონე ქალს), ასოცირებულია მამრობითი ვიტრაჟით ოქსიტოცინის mRNA- ის დაბალი დონეები ჰიპოთალამუსის პარავენენტულულ ბირთვში (Arletti et ალ., 1997).
გაურკვეველია თუ არა ოქსიტოცინი ანტიტეროლოგიური ფაზის ან სექსუალური ქცევის მომაკვდინებელი ფაზის გავლენით. როგორც ოქსიტოცინი იწვევს პენიტენციურ ერექციას და ოქსიტოცინის ძირითად ეფექტს კოპულატორული ქცევის შესახებ წარმოადგენს პოსტ-ეჟაკულატორულ ინტერვალში მამრობითი ვირთხებში (არლეტი და სხვ.), გონივრულია ვივარაუდოთ, რომ პეპტიდი აუმჯობესებს სექსუალურ მუშაობას. თუმცა, როგორც ოქსიტოცინი ზრდის სოციალურ-სექსუალურ ურთიერთქმედებას (იხ. Pedersen et al., კარტერი et al., ივოლ და რასელ, 1985) და ოქსიტოცინის რეცეპტორების ანტაგონისტები ხელს უშლიან არაკონკურენტულ ერექციებს (მელიც et al., 1992a) განიხილება, როგორც სქესობრივი აღშფოთების მაჩვენებელი (იხ. საჩები, 1997, 1995, XIX, XIX, XX, XX, 1999b და მასში მითითება), ოქსიტოცინის შესაძლო როლი სქესობრივი აღშფოთებისა და სექსუალური მოტივაციის შესაძლო როლს ვერ გამორიცხავს.
ეს მიმოხილვა აჯამებს ბოლო კვლევების გამოქვეყნებულ და გამოუქვეყნებელ შედეგებს, რომლებიც აჩვენებს, რომ ოქსიტოცინი იწვევს პენიტენციურ ერექციას არა მხოლოდ ჰიპოთალამუსის პარავენენტულულ ბირთვში, არამედ სხვა დამატებითი ჰიპოთალამური ტვინის არეებში, როგორიცაა ვენტრალური თერგმენტური არეალი (Melis et al., 2007, XXII, Succu et al., 2009), tის ჰიპკამპუსის ვენტრალური სუბიექტისა და ამიგდალას გვერდითი ბირთვი (Melis et al., 2009b, 2010), რომლებიც ლიმბური სისტემის მნიშვნელოვანი შემადგენლები არიან და ფიქრობენ, რომ გადამწყვეტ როლს ითამაშებენ მოტივაციისა და ჯილდოების პროცესში. ეს კვლევები ცხადყოფს, რომ ოქსიტოცინი მონაწილეობს ნერვული სქემით, რომელშიც შედის სხვა ნეიროტრანსმიტერები, როგორიცაა დოპამინი და გლუტანი მჟავა და სხვა ტვინის არეები, გარდა პარავენენტრიკულური ბირთვიდან, მაგ. ვენტრალური თერგმენტური ტერიტორია, ბირთვი accumbens, ჰიპოკამპუსი და ტერიტორიები გამოვლენილია. ეს სქემები სავარაუდოდ შუამავლებენ მეზოლიმბურსა და ინერერტო-ჰიპოთალამური დოფამინერგურ სისტემას შორის ურთიერთქმედებას და როლს არა მარტო მამაკაცის სქესობრივი ქცევის მოხმარების ფაზაში (მაგ. Penile erection and copulation), არამედ სექსუალური მოტივაციისა და სქესობრივი კავშირის როლისთვის აქედან გამომდინარე, რაც უზრუნველყოფს ნერვულ სუბსტრატს სექსუალური აქტივობის სამოტივაციო და დაჯილდოების თვისებების გამოსაყენებლად.
2. ოქსიტოცინი გავლენას ახდენს penile rerection სხვადასხვა მოქმედებებში
2.1. ჰიპოთალამუსის პარავენტრიკულური ბირთვი
როგორც ზემოთ აღვნიშნეთ, ჰიპოთალამუსის პარავენტრიკულური ბირთვი მალევე იდენტიფიცირებულია ტვინის არეში, რომელიც ყველაზე მგრძნობიარეა ოქსიტოცინის პროელექტიულ ეფექტზე. ამ ბირთვში ცალმხრივად გააქტიურდა, ოქსიტოცინი აქტიურ დოზებში აღმოჩნდა მინიმუმ 3 (3 სთ) (მელი და სხვ.). სტრუქტურა-აქტივობის ურთიერთობების კვლევებმა აჩვენა, რომ ოქსიტოცინით გამოწვეული პენიალური ერექცია შუამავლის ოქსიტოცინის რეცეპტორების შუამავლობით იყო ჩართული, გარდა ამისა, ოქსიტოცინერგიული ნეირონების საკანში ორგანიზმში Ca1986 + შემოდინება დამატებით ჰიპოთალამური ტვინის ტერიტორიებზე და აზოტის ოქსიდის სინთეზის გააქტიურებას. ნატრიკული ოქსიდი, როგორც უჯრედული მაცნეის მოქმედება, რომელსაც ჯერ არ უცნობი მექანიზმი აქვს (არ მოიცავს გინელექტარული ციკლაზას), იწვევს ოქსიტოცინერგიული ნეირონების გააქტიურებას ზურგის ტვინისა და დამატებითი ჰიპოთალამური ტვინის ზონების პროგნოზირებაში, რაც იწყებს კალციუმის ერექციის (ნახაზი 2) (იხ. ქვემოთ და არგოლისა და მელიისი, 1, 1995, 2004 და მასში მითითებები). ოქსიტოცინის უნარი საკუთარი ნეირონების გააქტიურება
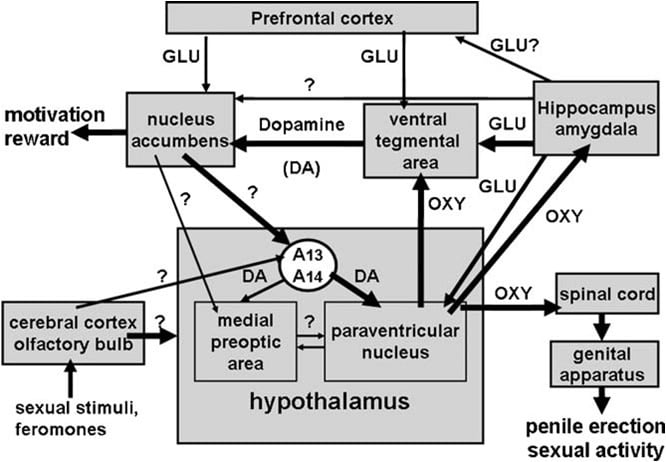
ნახ. ოქსიტოცინეზური ნეირონების სქემატური წარმომადგენლობა, რომლებიც წარმოიქმნება ჰიპოთალამუსის და პროჰიდრაკულური ბირთვში ჰიპოთალამური ტვინის ტერიტორიებზე, როგორიცაა ზურგის ტვინი, VTA, ჰიპოკამპუსი, ამიგდალა და ა.შ. ამ ნეირონების აქტივაცია დოპამინი, ექსტრაქტი ამინომჟავები, ოქსიტოცინი, ჰექსარელის ანალოგური პეპტიდები და VGF- გამომუშავებული პეპტიდები იწვევენ penile erection- ს, რომელიც შეიძლება შემცირდეს ან / და გააუქმოს GABAergic, ოპიოიდური და კანაბინოიდული CB1 რეცეპტორების სტიმულირება. ოქსიოტექნიკური ნეირონების აქტივაცია საშუალოა ამ ნეირონებში მოქმედი აზოტის ოქსიდის სინთეზის გააქტიურებაზე. მართლაც ენდოგენური აზოტის ოქსიდის მიერ ჩამოყალიბებული სტიმულირების დოფამინის, ამგზნები ამინომჟავის და ოქსიტოცინი რეცეპტორებს ან ეგზოგენური აზოტის ოქსიდის, როგორც, რომ მიღებული აზოტის ოქსიდის დონორების უშუალოდ შევიდა paraventricular ბირთვი, ააქტიურებს oxytocinergic ნეირონების ჯერჯერობით დაუდგენელმა მექანიზმი, როგორც ჩანს, არ არის დაკავშირებული გინელექტარული ციკლის სტიმულირება. ეს იწვევს ზურგის ტვინის ოქსიტოცინის გათავისუფლებას და დამატებით ჰიპოთალამურ ტვინში. ზოგიერთ დეტალებზე, რომელთა საშუალებითაც ოქსიტოცინი იწვევს პენიტენციურ განზავებას ამ ტერიტორიებზე გათავისუფლებისას, მაგალითად, VTA, ვენტრალური სუბიკლიუმი და ამიგგდალა აღწერილია შესაბამის ტვინის არეალში. აქ, ოქსიტოცინი ატარებს საკუთარ რეცეპტორებს და ზრდის NO წარმოება, რაც იწვევს პენიტენციურ ერექციას როგორც PVN- ში. თუმცა, ეწინააღმდეგება PVN, in caudal VTA NO გააქტიურებს guanylate cyclase. ეს იწვევს cGMP- ის კონცენტრაციის ზრდას, რასაც მიეკუთვნება mesolimbic dopaminergic ნეირონების აქტივაცია და penile rerection. VS- ში არ მოქმედებს გლუტამატერგური ნეირონების ექსტრაქტოპალურ ზონებში, მათ შორის VTA- ს ჩათვლით. გლუტის მჟავა VTA ააქტიურებს თავის მხრივ mesolimbic dopaminergic ნეირონების როგორც ნაპოვნი ოქსიტოცინის. ზემოთ აღწერილი მექანიზმები, როგორც წესი, მოქმედებს აგრეთვე ფიზიოლოგიურ კონტექსტში, კერძოდ, როდესაც მამრობითი ვირთხები მოთავსებულია მიუწვდომელი მგრძნობელობის მქონე ქალის (მაგ. არაკონკურენტული erections) ან კოპულაციის დროს.
პარავენტრულულ ბირთვში მხარს უჭერდნენ კვლევებს, რომლებიც გვიჩვენებს, რომ: (1) ოქსიტოცინის რეცეპტორები იმყოფებიან ამ ჰიპოთალამური ბირთვში (ფრონდ-მერსიერი და სხვ., ფრონდ-მერსიერი და სტეოკელი, 1987); (2) ოქსიტოცინი ხელს უწყობს თავის გათავისუფლებას vitro და vivo (ფრონდ-მერსიერი და რიჩარდი, 1981, XOSX, Moos et al., XX); და (3) ოქსიტოცინი ატარებს თავის ნეირონებს პარავტენტულულ ბირთვში მოქმედებაში (Yamashita et al., 1987). უფრო მეტიც, ჰიპოთალამუსის პარავავრიკულური და სუპროსოპტიკური ბირთვში გამოვლენილია ოქსიტოცინერგიული სინაპეციები მაგნიოკულური ოქსიოტექნიკური ნეირონების უჯრედებში (თეოდოზი, 1985). საბოლოო ჯამში, ცენტრალურ ნერვულ სისტემასა და ზურგის ტვინის მთლიანად დამონტაჟებულ ცენტრალურ ნერვულ სისტემებზე და ზურგის ტვინის ექსტრატოტოქსიური დაზიანებით, ცენტრალური ოქსიტოცინერგიული ნეირონების განადგურება, რომელიც არღვევს ოქსიტოცინის პრო-ეტექსიურ ეფექტს, არამედ ხელს უშლის ნარკოტიკების მოქმედებას penile erection და noncontact erections (იხ. ქვემოთ და Argiolas სხვ., 1987, B; Liu და სხვა., 1997 და მასში). პარავენენტრიკულური ბირთვების დაზიანების მქონე მსგავსი შედეგები გვხვდება პოტენციურ და შერჩეულ ოქსიტოცინის რეცეპტორ ანტაგონისტებთან. სინამდვილეში ეს ნაერთები ნანოგრამის რაოდენობებში პარავენენტულულ ბირთვში გაჟღენთილ იქნა სრულიად ოქსიტოცინით გამოწვეული პენიალური ერექცია, ხოლო პარალიზებულ პარკუჭებში შეყვანილი არა მხოლოდ ოქსიტოცინის მიერ გამოწვეული პენიციალური რეაქციები, არამედ ნარკოტიკების გამოწვეული პენიალური ერექცია (იხ. ნაწილი 3 და არალიოლასი და მელიისი, 1995, 2004, 2005 და მასში მითითებები) და არაკონკურენტული უთანხმოებები (მელი და სხვ.), და უფრო მეტად ეფექტური იყო სქესობრივი პოტენციურ მამრობითი ვირთხების კოლაბორაციული ქცევაზე (Argiolas et al., 1999). გარდა ამისა, სექსუალური ურთიერთქმედება ზრდის FOS, ადრეული ადრეული გენი c-fos- ის გრანული პროდუქტი პარავენტრიკულური ოქსიოტექნიკური ნეირონების პროთეზირებაზე ზურგის ტვინის თირკმელზედა ჯირკვლის რეგენერაციის პროცესში (იხ. Witt და Insel, 1988 და მასში მითითება). და ბოლოს, სექსუალური იმპოტენცია (მაგალითად, ზრდასრული ვაზის უძილობა, რათა დაამყაროს estrogen- პროგესტერონისრეპტირებული მგრძნობიარე ქალი)ასევე ასოცირდება მამრობითი ვირთხა ოქსიტოცინის mRNA- ის დაბალი დონისა და ჰიპოთალამუსის პარავენენტულულ ბირთვებში ნიტრიკ-ოქსიდის სინთეზის (ბენელი და სხვ., არლეტი და სხვები.) (ამ კვლევების ვრცელი მიმოხილვის სანახავად იხ. არგოლიასი, არგლიოსი და მელიისი, 1995, 1997).
2.2. ვენტრალური თერმოსილი ტერიტორია
ვენტრალური თერგმენტური არეალი სულ ცოტა ხნის წინ აღმოჩნდა, როგორც ტვინის გვერდი, რომელშიც ოქსიტოცინი იწვევს კალციუმის ერექციას. ეს არეალი შეიცავს პაროვენტრიკულურ ბირთვულ და ოქსიტოცინის რეცეპტორებში წარმოქმნილ ოქსიტოცინერგული ნერვულ დაბოლოებებს (ფრიუნდ-მერსიერი და სხვ., ვაქცარი et al., 1987). კერძოდ, ოქსიტოცინი იპოვეს Iტუბერკულოზური ერექციის შეყვანა, როდესაც გაუკეთეს ცალმხრივად კაუადში, მაგრამ არა როსტრალურ ვენტრალურ სეგმენტში დოზაზე დამოკიდებული გზით (მელი და სხვ., 2007). აქტიური დოზები უფრო მაღალი იყო, ვიდრე აუცილებელი იყო პარავენენტულულ ბირთვში შეყვანა და ჰეპკამპუსის ვენტრალური სუბიექტის ინექციური მიღებისას ანგიგდალას (იხ. ქვევით) პოსტერმედიულ კორტიკურ ბირთვებში. სავარაუდოდ, პროსელექტიური ეფექტი შუამავალდება მეზოოლიმბური დოპამინერგული ნეირონების გააქტიურებით ბირთვული ჭრილობის ჭურვიზე, რაც, თავის მხრივ, ააქტიურებს ჯერ კიდევ უცნობი ნერვულ გზებს, რომლებიც ითვალისწინებენ პარავენტრიკულური ოქსიოტექნიკური ნეირონების შუამავლობის ნეირონების ინტენციურ ჰიპოთალამური დიპამინერგული ნეირონების მიმართ. (Melis et al., 2007, 2009).
რაც შეეხება იმ მექანიზმს, რომლის მიხედვითაც ოქსიტოცინი ატარებს დოფამინერგული ნეიროტრანსმიმირებას ვენტრალური თერგმენტური არეალში, ხელმისაწვდომი მონაცემები მიუთითებს ოქსიტოცინი ხელს უწყობს მექსოლიმბური დოპამინერგული ნეირონების უჯრედში მდებარე ოქსიტოცინერგენურ რეცეპტორებს. ეს გაზრდის Ca2 + შემოდინებას დოპამინერგული ნეირონების უჯრედში, რითაც ამარტივებს ნიტრიკ ოქსიდის სინთეზს (Succu et al., 2008). პარავენენტულულ ბირთვთან (ეწინააღმდეგება სექცია 3), ეწინააღმდეგება ნიტრიკ ოქსიდს, რომელიც ააქტიურებს კლანის ციკლასს, აქედან გამომდინარე, ციკლური GMP- ის კონცენტრაციის გაზრდა. ამ მექანიზმის მიხედვით, 2-ORN5- ვოსტოცინის, ძლიერი ოქსიტოცინის ანტაგონისტის, ან S- მეთილ-თი-სი- ციტრალური, ნეირონალური აზოტის ოქსიდის სინთეზის ძლიერი ინჰიბიტორი, ოქსიტოცინამდე კადალური ვენტრალური ტერმინალური ფართობი, გაუქმებული penile ერექცია და ზრდის უჯრედული დოპამინის კონცენტრაციის ზრდა ოქსიტოცინით გამოწვეული ბირთვების ჭურვი. უფრო მეტიც, XSSX- ბრომო-ციკლური GMP, აქტიური ფოსფოიდერიტაზას რეზისტენტული ციკლური GMP ანალოგი, იწვევს პანელის ერექციას, როდესაც კუდის ვენური თერაპიული არეში გააქტიურებს და ზრდის უჯრედის დოპამინის კონცენტრაციას ბირთვში ჭრილში, როგორც აღმოჩნდა ოქსიტოცინის შეყვანა კაუტალური ვენტრალური ტერმინალური სივრცე (Succu et al., XIX, Melis et al.) (იხ. აგრეთვე ნახაზი 2).
ამ მექანიკასთან ერთად, ჰალოპერიდოლი, ძლიერი დოპამინი D2 რეცეპტორის ანტაგონისტი, რომელიც ბირთვში შეყვანილი ჭრილობის ჭრილში იწყება, ამცირებს ოქსიტოცინით გამოწვეულ კალციტურ ერექციას ventral tegmental- ის ტერიტორიაზე (Melis et al., 2007). აღნიშნული მექანიზმი ასევე მხარს უჭერს ორმაგი იმუნო-ფლუორესცენტული კვლევების მიერ, რომელიც აჩვენებს, რომ ოქსიტოცინის ბოჭკოები დიპამინერგული ნეირონების საკანში ორგანიზმში კადალურ ვენტრალურ თერაპიულ ზონაში, რომლებიც ადრე იდენტიფიცირებულ იქნა რეტროგრადული ტრაქტორების ფლუოროგოლდთან ერთად ბუშტის ბირთვში ჭრილში ( Melis et al., Succu et al., XXII). ამ დოპამინერგული ნეირონების და დოპამინის რეცეპტორების აქტივობა ბირთვში აღინიშნება ნევროლოგიური გზების გააქტიურებასთან დაკავშირებით, რომლებიც იდენტიფიცირებულია ნერვული გზების გააქტიურებაზე, რომლებიც ხელს უწყობენ ინერერტო ჰიპოთალამური დოპამინერგული ნეირონების მიერ პარავენტრიკულური ბირთვში დოპამინის გათავისუფლებას და ამით ახდენს ოქსიტოცინერგიული ნეირონების პროექცირებას ზურგის ტვინის და შუამავლის შებრუნებული ერექციის შუამდგომლობა (იხ. ზემოთ და მელილის სხვ., სუკუ და სხვ., 2007, 2007). მართლაც, ოქსიტოცინმა კუდის ვენტრალური თერგმენტური არეალში შეყვანა იმ დოზით, რომელიც იწვევდა პენიალურ ერექციას, გაიზარდა დამატებით უჯრედული დოპამინის კონცენტრაცია დიზეზიტზე, მიღებული არა მხოლოდ ბირთვიდან, არამედ პარავენტრიკულური ბირთვიდან (Succu et al., 2008).
2.3. ჰიპოკამპუსი
ჰიპოკამპუსის CA1 სფერო იყო ოქსიტოცინირების ბოჭკოების სხვა ტვინის ფართობი და რეცეპტორების მიერ გამოვლენილი ადრეული კვლევები, რომელშიც ოქსიტოცინის ინექცია იწვევდა პენიალურ ერექციას (იხ. ბუზი, 1978, სოფოროვი, 1983). თუმცა, პარავენენტულულ ბირთვთან ერთად ეწინააღმდეგება ოქსიტოცინს, რომელიც იძლევა მხოლოდ პენსილურად განვითარებას, მხოლოდ ორსულობისა და უმაღლესი დოზების გატარებას, ვიდრე პარავენენტულულ ბირთვში აქტიური აღმოჩენილია (მელიც et al., 1986, Chen et al., 1992). ოქსიტოცინის ინექციები სუბიკურში შევიდა ამ ადრეულ კვლევებში უმოქმედო აღმოჩნდა. თუმცა, ბოლო და უფრო ფრთხილად მიკროორგანიზაციის კვლევები იწვევს იდენტიფიცირებას ვენტრალური სუბიექტის რეგიონი რომელშიც ოქსიტოცინის ინექცია შეძლებდა დოზით დამოკიდებულ მეთოდებში (მელიის და ალ., 2009b). ამ ტვინში მოთავსებული ოქსიტოცინის პროექტოქსიკური ეფექტი შეინიშნებოდა პეროვანური ბირთვში, როგორც ცალმხრივი ინექციის შემდეგ (ტერმინალი, 2007) ცალმხრივი ინტრავენური სექტორის აქტივობის დროს. სავარაუდოდ, ოქსიტოცინი გააქტიურდება ვენტრალურ სუბიექტებში, რომელიც იწვევს ნორმალური ოქსიდის სინთეზის ნეირონებში ოქსიტოცინერგენური რეცეპტორების გააქტიურებას, რითაც იწვევს ნიტრიკ ოქსიდის წარმოების ზრდას. ნიტრიკული ოქსიდი, თავის მხრივ, intercellular messenger- ის მოქმედებით იწვევს გლუტამაზმის მჟავას ნეიროტრანსმიმირებას, შესაძლებელია ნერვული (გლუტამოტარგიური) ეფექტიანი პროგნოზით გამოვლინებული ვენტრალური სუბიექტისგან დამატებითი ჰიპოკამპალური ტვინის ზონებში, რომლებიც მოქმედებენ მეზოოლიმბური დოპამინერგული ნეირონების (მაგალითად, ვენტრალური თერგმენტური არეალი, პრეფრონტალური ქერქის, პარავავენთური ბირთვი) (იხ. ქვემოთ და მელიისი, 2007, X; Succu et al., 2009).
მოქმედების ეს მექანიზმი მხარს უჭერს ინტრა-ცერებრალური მიკროდიალიზის ექსპერიმენტებს, რომლებიც აჩვენებენ, რომ ოქსიტოცინმა შეწოვა ვენერალური სუბიექტის დროს დოზების მიღებისას, რომლებიც ზრდის პენიალური ერექციის, ზრდის აზოტის ოქსიდის წარმოქმნას და უჯრედში მჟავას კონცენტრაციას დიალიზირებულ ვენტრალურ სუბკულუმში (მელიის ეტ. , 2010) და უჯრედული დოპამინის ბირთვში (მელიც et al., 2007). ეს რეაქციები არა მხოლოდ ოქსიტოცინის რეცეპტორების ანტაგონისტის (CH2) 5-ORN2- ვასტოცენინის, არამედ ნეირონული აზოტის ოქსიდის სინთეზის ინჰიბიტორით S- მეთილ-თიო-ლიციტრულინისა და ნიტრიკ ოქსიდის სკავენერის ჰემოგლობინის მიერ ვენტრალურ სუბიქსში ოქსიტოცინამდე რამდენიმე წუთით ადრე (მელიც et al., 8).
უფრო მეტიც, მოქმედების ამ მექანიზმის შესაბამისად, NMDA მიერ გლუტამოტარგიური ნეიროტრანსმიმის გააქტიურება გააქტიურდება უჯრედულ სუბიექტებში, რომელიც იწვევს პენიტენციურ ერექციას (მელი და სხვ.). ვენტრალური სუბიექტისგან ეფექტიანი პროგნოზების ფენოტიპი, რომელიც იწვევენ მეზოლიმბური დოპამინერგული ნეირონების გააქტიურებას და ბირთვული დოპამინის გაზრდის ბირთვში, ამჟამად უცნობია. თუმცა, ვენტრალური სუბიექტის ინექციებში მოთავსებული კალციუმის ერექციის შემდეგ ხდება უჯრედული გლუტამინის მჟავის მომატებული დრეზიცეტში ვენტრალური თირკმლის ფართობიდან, მაგრამ არა ბირთვიდან და არ არის ანტაგონისტი (+) MK-2010, NMDA subtype (ვუდროფი et al., 801) - ს ექსპერიმენტული ამინომჟავის რეცეპტორების პოტენციური არაკონკურენტული ანტაგონისტი, რომელიც გადის ვენტრალურ სეგმენტებში, მაგრამ არა ბირთვებში. (იხ. სურათი 1987 და Melis et al., 2b) , სავარაუდოა, რომ ეს პროგნოზები გამოიწვიოს გლუტამოტარგიური ნეიროტრანსმიმირების გააქტიურება ვენტრალური თერაპიული არეალში, რაც, თავის მხრივ, ახდენს ბირთვული დოპამინერგული ნეირონების პროგნოზირებას ბირთვში. ვენტრალური სუბკულუმში ოქსიტოცინის ინექციის შემდეგ ვენტრალური თერაპიული არეალში გამოვლენილი გლუტამინის მჟავის გაზრდის კონცენტრაცია გამოდის სუბიკურში ან სხვა ტვინში (მაგალითად, პრეფრონტალური ქერქის) წარმოქმნილი ნეირონებიდან, რომლებიც ამჟამად უცნობია. მიუხედავად ამისა, ეს იწვევს მეზოლიმბური დოპამინერგული ნეირონების გააქტიურებას და ბირთვში დოპამინის გაზრდას აჩქარებს. აქ დოპამინის რეცეპტორების აქტივაცია იწვევს ინერერტო ჰიპოთალამური დოპამინერგული ნეირონების გააქტიურებას, პარავენენტულულ ბირთვში დოპამინის გათავისუფლებას, რითაც ზურგის ტვინისკენ მიმართული ოქსიტოცინერიკულ ნეირონების გააქტიურებას და შარდის ვენტილაციის შუამავლობას (იხ. ზემოთ და მელი და სხვები., 2007, XXX, Succu et al., 2009).
2.4. ამიგდალა
ამიჰდალა არის ტვინის ზონა ოქსიტოცინის ბოჭკოებისა და რეცეპტორების მდიდარია (იხ. ფრონდ-მერსიერი და სხვ., ვაქცარი და სხვ., უჰლ-ბრონერი და სხვები). აქედან გამომდინარე, ოქსიტოცინი ჩართულია სხვადასხვა ფუნქციებში, ანონიოზის, სოციალური მეხსიერებისა და შემეცნების, სოციალურად გაძლიერებული სწავლის, ემოციური თანაგრძნობა, ემოციური სახეობის დამუშავებისა და ადამიანის შიშით ემოციური ფუნქციისა და სექსუალური ქცევისგან (იხ. კონდო და სხვები. ალჟირი, ემბერი და სხვები, ჰუბერი და სხვები, ჯამბაზები და სხვ., პეტრევიჩი და სხვები, მე -3, ლიტერა და სხვა, დონალდსი და ახალგაზრდა, ჰერმემენი და სხვები. , 1987). თუმცა, ოქსიტოცინის უნარის მოქმედება მამრობითი ვირთაგვების წარმოქმნისას ამიგგალალის პოსტრამიდული კორტიკულ ბირთვში გამოწვეული იქნა მხოლოდ ცოტა ხნის წინ (მელიის და სხვები, 1998b). ეს რეაქცია ერთდროულად მოხდა უჯრედული დოპამინის კონცენტრაციის ზრდადი ბირთვიდან მიღებულ დიალიზის დროს, როგორც აღმოჩნდა ოქსიტოცინის ინექციის შემდეგ ვენტრალური სუბიექტის (მელიის და სხვები, 2005b). მექანიზმი, რომლის დროსაც ოქსიტოცინი გაჟღენთილია პოსტმედოდიურ კორტიკულ ბირთვში ამგიგდალის იწვევს პენიალური ერექციის დროს. არსებული მონაცემები აჩვენებს, რომ ბირთვული ერექცია და ბირთვული დოპამინის კონცენტრაციის ზრდა ბირთვიდან მიღებულ დიაციტატში ხდება შაქრიანი ოქსიტოცინერგენური რეცეპტორების გააქტიურებით, რადგან ორივე რეაქცია გაუქმდა ოქსიტოცინის რეცეპტორების ანტაგონისტის (CH1998) 2001Tyr (CH2005) მე) XYX-ORN2005- ვოსტოცინის ამოქსიკალურ ბირთვში ოქსიტოცინამდე რამდენიმე წუთით ადრე (Melis et al., 2007b) ინექცია.
ოქსიტოცინის არტერიული აქტივობა ამეგდალას პოსტრამდემიურ კორტიკურ ბირთვში ააქტიურებს, პეპტიდის მიერ გამოწვეული სექსუალური რეაქციის გაუქმება ხდება ყველა დოფამინერგული რეცეპტორების ბლოკირებით ციკ-ფლპენთჰიქსოლთან ერთად ბირთვის ბაქტერიების ჭრილში და NMDA რეცეპტორების ბლოკადათ. +) MK-801 გააქტიურდა ვენტრალურ თერგმენტურ სივრცეში, მაგრამ არა ბირთვში, როგორც აღმოჩნდა, ოქსიტოცინით გამოწვეული კალციუმის ერექციის გამოყოფა ვენტრალური სუბიკუუმში (Melis et al., 2009b). ეს იმას მიუთითებს, რომ ოქსიტოცინმა გააქტიურდა პოსტმედოდიულ ბირთვებში ამიჰდალა ააქტიურებს გლუტამინური მჟავა ნეიროტრანსმიმირებას ვენტრალური თერგმენტაციის არეალში. ეს იწვევს მეზოლიმბური დოპამინერგული ნეირონების გააქტიურებას, რასაც მიმართავენ penile rerection. კვლევის თვალსაზრისით, ამირგალას ამ ბირთვებთან ურთიერთდაკავშირების ნერვული ბილიკებით (კანტერას და სხვა, ფრანგ და ტოტტელდი, 1995), ამ დასკვნების გაზრდის შესაძლებლობა იძლევა შესაძლებლობას, რომ ურთიერთქმედების არსებობა არსებობდეს ამ ორ ტვინს შორის, თუმცა პირდაპირი აღწერილი გზები აღინიშნა ან ბირთვის ან ბირთვული თხრილის არეში აღწერილია (კელლი და დომშიკი, XIX, Witter, 2003).
2.5. ზურგის ტვინი
ზურგის ტვინი ცენტრალური ნერვული სისტემის კიდევ ერთი არეალია, რომელიც შეიცავს ოქსიტოცინირების ბოჭკოებს და რეცეპტორებს (ფრიუნდ-მერსიერი და სხვ., Uhl-Bronner et al., XXX), რომელშიც ოქსიტოცინი იძენს penile ერექციას (Tang et al., 1987 ვერონიუ-ლოგგვრივი და სხვები, გიულიანო და რამპინი, ჯულიანო და სხვები, 2005). ზემოთ ნახსენებია, ამ ოქსიოტექნიკური ბოჭკოები წარმოიქმნება ჰიპოთალამუსის პარავენენტრიკულურ ბირთვში და ხელს უწყობენ ზურგის ავტონომიური ნეირონების მაკონტროლებელი ქვეითი გზავნილების შუამავლობას. სინამდვილეში ეს ბოჭკოები ქმნიან სინაფსურ კონტაქტებს, რომლებიც ძირტკბილოვანი და პარაზიმპათეზური უჯრედების სვეტებში თორკო-წელისა და ლუმბოს-საკრალური ტრაქტატის მქონე ზურგის ნეირონებისგან (მარსონ და მაკკენა, ჯულიანო და რამპინი, ჯულიანო და სხვ. , 1996). ეს სინაფსური კონტაქტები აჩვენა პენისიდან წარმოქმნილი ზურგის ნეირონების ეტიკეტირება და ზურგის ტვინის მიღება სპეციფიკური რეტროგრადული ტრაქეებით, რომელიც გაჟღენთილია კავეროზულ კორპორაციაში, ორმაგი იმუნო-ფლუორესცენტებისა და კონფიგურაციის ლაზერული მიკროსკოპული კვლევების (Tang et al., 1998; Veronneau-Longueville და სხვ., 1999). ამ კვლევების მიხედვით, ანესთეზირებული მამაკაცის ვირთაგვებში ოქსიტოცინის კუმულაციური დოზების ინტრატრალურ ინექცია lumbo-sacral- ზე, მაგრამ არა თრომბო-წელის დონეზე, არტერიული წნევის მომატება დოზებზე დამოკიდებული გზით იზრდება. ეს ეფექტი გაუქმდა ოქსიტოცინერგიული რეცეპტორების ბლოკირებით D (CH2) 5TY (Me) 2-ORN8 ვაზოტოცინით და მენჯის ნერვების (Giuliano და Rampin, XUL, Giuliano et al., 2000). ეს შედეგები გვიჩვენებს, რომ ოქსიტოცინი, რომელიც მოქმედებს lumbo-sacral ზურგის ტვინში, ზრდის intracavernous ზეწოლის და ვარაუდობს, რომ ოქსიტოცინი, რომელიც გათავისუფლდა პარავენენტულულ ბირთვში ფიზიოლოგიური აქტივობის დროს, არის ზურგის კორპორაციის პროპეციალური ნეირონების ძლიერი აქტივატორი. საინტერესოა, რომ პროსელექტიური ვენური ნეირონები, რომლებზეც ოქსიტოცინი ახდენს თავის პროთეზულ ეფექტს, იღებს სეროტონინერგული ნეირონების სინტაქსურ კონტაქტებს, რომლებიც წარმოიქმნება ბირთვის პარაგიგანტექლუარულში, შპრიცის ფორმირებისა (მარსონ და მაკკენა, 1992; ., 1998). ამ სეროტონინერგული ნეირონების განადგურება ხელს უწყობს ეაკულაციას და კალციკულ რეფლექსებს მამაკაცებში. მას შემდეგ, რაც ნარკოტიკების, რომ სტიმულირება 5HT2 რეცეპტორების ხელი შეუწყოს penile erection როდესაც მოცემული intracerebroventricularly, მაგრამ არა paraventricular ბირთვი და ნარკოტიკების, რომ ბლოკი 5HT2C რეცეპტორების შემცირება ასევე dopamine agonistand oxytocin გამოწვეული penile ერექცია, ხოლო dopamine ანტაგონისტები არ შეამციროს 5HT2 agonist გამოწვეული penile erection ( იხ. Stancampiano et al., 1994 და მასში მითითებები), ასევე ითქვა, რომ ოქსიტოცინი ხელს უწყობს პრომექსლელური 5HT2C რეცეპტორების მოქმედებს lumbo-sacral ზურგის ტვინის დონეზე (Stancampiano et al., 1994). გარდა ამისა, ოქსიტოცინმა შესაძლოა გავლენა მოახდინოს ზურგის დაქვეითებული სეროტონინერგული ნეირონების მოქმედებაზე პირდაპირ ბირთვში პარაგგამაგონელულურში, სადაც ამ ნეირონების წარმოქმნა ხდება (იხ. Stancampiano et al., 1994).
3. ოქსიტოცინის, დოპამინისა და გლუტანის მჟავას შორის ცენტრალური ნერვული სისტემაში
როგორც სექცია 1- ში აღინიშნა, ცენტრალური ნერვულ სისტემაში არსებული ყველა ოქსიოტექნიკური ნეირონები წარმოიქმნება პარავენენტულულ ბირთვებში და მიმდებარე სტრუქტურებში. ამ ნეირონების საქმიანობა სხვადასხვა ნეიროტრანსმიტერებისა და / ან ნეიროპეპტიდების კონტროლის ქვეშ იმყოფება. პარავენენტულურ დონეზე ყველაზე შესწავლილნი არიან დოპამინი, გლუტმული მჟავა, გამა-ამინოობიტური მჟავა (GABA), აზოტის ოქსიდი, ენდოკანაბინოიდები, ოპიოიდური პეპტიდები, ზრდის ჰორმონი-გათავისუფლების პეპტიდები, VGF- ის პეპტიდები და ოქსიტოცინი. დოპამინი, გლუტმული მჟავა, ზრდის ჰორმონის პეპტიდები, VGF- გამომუშავებული პეპტიდები და ოქსიტოცინი არის სტიმულირება, მაგ. ეს ნაერთები და მათი აგონისტები ხელს უწყობენ პარაანტრულიკულური ბირთვში ინექციისას, ხოლო GABA, ოპიოიდური პეპტიდები და ენდოკანაბინოიდები ინჰიბიტორულია, მაგალითად, ეს ნაერთები ან მათი agonists ზღუდავენ penile erection (იხ. Meisel and Sachs, XVIII, ვითიმი და ინელი, არგოლისა და მელიისი, გიულიანო და რამპინი, მაკკენა, XX; ანდერსონი, ჰალმა და სხვები, 1994).
ექსპერიმენტული მტკიცებულების რამდენიმე ხაზი ცხადყოფს, რომ ეს ოქსიტოცინერგული ნეირონები და ზემოთ ნეიროტრანსმიტერები და ნეიროპეპტიდები ჩართულია სხვადასხვა ფიზიოლოგიურ კონტექსტში ერექციული ფუნქციისა და სექსუალური ქცევის კონტროლში. უფრო მეტიც, ოქსიტოცინი გამოიყოფა ზედმეტად ჰიპოთალამური თავის ტვინის არეებში, როგორიცაა ვენტრალური თირკმლის არეალი, ჰიპოკამპუსი და მისი რეგიონები, ამიგგდალა და ზურგის ტვინი შეიძლება გავლენა მოახდინოს იმ ნეირონების აქტივობაზე, რომელზედაც ხდება ოქსიტოცინერგიული სინაპები. ამ დროისათვის, მხოლოდ იმ ნეირონებს, რომლებსაც მნიშვნელოვანია penile ერექცია, რომლის მიხედვითაც ოქსიტოცინერგიული სინაპეციები იდენტურია, რომლებიც იდენტიფიცირებულია იდენტურია, არის კუდის ვენური ტრაქტის სეზონური მეზოლიმბური დოფამინერგული ნეირონების უჯრედების ორგანოები, რომლებიც ახდენენ ბირთვების ჭურვი (მელისი და სხვები (იხ. აგრეთვე, სექციები 2007 და 2008) (იხ. აგრეთვე აგრეთვე სექციები 2000 და 2001) (იხ. ასევე, და ა.შ.), და პრომეთელექტიური ზურგის ნეირონები პროვოცირება lumbo-sacral ტრაქტატიდან კავეროვან კორპორაციასთან (იხ. Giuliano და Rampin, . სინამდვილეში, მიუხედავად იმისა, რომ ოქსიტოზინერგიული სინაპსიები და რეცეპტორები გამოვლენილია ვენტრალური სუბიექტის, ამიგდალასა და ზურგის ტვინში, რომლებიც ყველასათვის მნიშვნელოვანია penile erection (იხ. ზემოთ), ამ მიმართულებით ნეიროტრანსმიტერის / ნეიროტრანსპორტის ტიპი რომელიც ოქსიტოცინირების ნერვული დაბოლოების იმპულსურია, ჯერ კიდევ უცნობია.
განხილვის ამ ნაწილში მოკლედ მიმოიხილა ახლო ლიტერატურა იმ მექანიზმებზე, რომლებიც ექვემდებარებიან ოქსიტოცინის პროეტექტოზის ეფექტს კუდის ვენტრალური თერაპიის არეში, ჰიპოკამპუსის ვენტრალური სუბიექტისა და ზურგის ტვინში. განსაკუთრებული ყურადღება ენიჭება პეპტიდის ურთიერთქმედება დოპამინისა და გლუტმული მჟავით ამ ტერიტორიებზე და როლი ამ ურთიერთქმედება შეიძლება ითამაშოს Erectile ფუნქციის ცენტრალურ კონტროლში. პარავენენტულულ ბირთვში დოპამინისა და გლუტამინის მჟავის ეფექტის მოკლე მიმოხილვა პარავენენტულულ ბირთვში, რომელიც ასევე მნიშვნელოვან როლს ასრულებს Erectile ფუნქციაში, იმისათვის, რომ მკითხველმა იცოდეს ამ სფეროში კვლევის ადრეული მდგომარეობის შესახებ ეს კვლევები უკვე განიხილეს ინტენსიურად (იხ. არგოლისა და მელიისი, 1995, 2004, Melis and Argiolas, 2005). ამასთანავე, განსაკუთრებულ ყურადღებას უთმობს უახლეს შედეგებს, რომლებიც მნიშვნელოვან როლს ასრულებენ როგორც დოპამინ-ოქსიტოცინის ბმულით და ასევე გლუტმული მჟავა-ოქსიტოცინის ბმულით, არა მარტო სექსუალური შესრულებით (penile erection and copulation), არამედ სექსუალურ ემოციური და სექსუალური მოტივაცია.
3.1. დოპამინ-ოქსიტოცინის ურთიერთქმედება პარავენენტულულ ბირთვში
ის დოპამინის აგონისტების უნარი, რომლებიც იწვევენ კალციუმის რეზისტენტობას ცენტრალური ოქსიოტექნიკური ნეირონების გააქტიურების გზით აღმოჩნდა მას შემდეგ, რაც ატომორფინი იწვევს პანორენციულ ბირთვში (მელისი და სხვ.), როდესაც ოქსიტოცინის რეცეპტორების ანტაგონისტი D (CH1987) 2Tyr (Me) 5-ORN2- ვოსტოციკინი ინტრაქერებრობრუკინტრიკულურად (icv) იქნა ნაპოვნი შეუძლია შეამციროს თითქმის მთლიანად penile erection არა მხოლოდ ოქსიტოცინის მიერ მოცემული icv, არამედ apomorphine, მოცემული subcutaneously (Argiolas et al., 8b). ამ შედეგებს მოჰყვა სხვა კვლევების შედეგები, რომლებიც აჩვენებდნენ მსგავს შედეგებს, როდესაც X (XX) 1987-VOSOTOCIN- ს მიეწოდათ icv და აპომორფინი უშუალოდ პარავენტრულულ ბირთვში (Melis et al., 2b),იმის გათვალისწინებით, რომ დოპამინი აგონისტები იწვევენ პენიტენციურ ოქსიოტექნიკური ნეირონების გააქტიურებას პათოლოგიური ერექციის ექსტრაქტომიული ტვინის ტერიტორიებზე და კერძოდ ზურგის ტვინის (იხ. არგოლისა და მელიისი, 1995, 2004, 2005). ამ ჰიპოთეზასთან ერთად, ანესთეზირებული ვირთაგვებში, არალეპტიდური ოქსიტოცინის რეცეპტორების ანტაგონისტის მიერ გამოვლენილი პათოიდური ოქსიტოცინის რეცეპტორების ანტაგონისტური რეცეპტორების ბლოკადა ცოტა ხნის წინ იქნა აღმოჩენილი დოპამინის აგონისტური აპომორფინის მიერ გამოწვეული ინტრაკორკულარული წნევის მოქმედი ატომორფინით გამოწვეული ზრდის გაუქმება, პენვერიკულური-ზურგის ოქსიტოცინერგიული გზა, რომელიც ჩართულია კალციუმის ერექციის (Baskerville et al., 2009).
სწავლა მიზნად ისახავს მოზრდილთა რეაქციის გამომწვევი დოპამინის რეცეპტორის იდენტიფიცირება, დადგინდა, რომ პარავენენტულულ ბირთვში დოფამინის რეცეპტორ აგონისტებში ასევე შედიან კალციუმის ერექცია D2 ოჯახის დოფამინის რეცეპტორებზე, როგორც აღმოჩენილია დოპამინის რეცეპტორების აგონისტებით სისტემატურად (იხ. Melis et al., Eaton et al., Melis and Argiolas, 1987). აქედან გამომდინარე, ატომორფინის, ძლიერი შერეული D1991 / D1995 რეცეპტორების აგონისტი და კვინპიროლი, ძლიერი შერჩევითი D1ceptect agonist, მაგრამ არა SKF 2, შერჩევითი DNANUMX რეცეპტორების agonist, გაუკეთეს შევიდა ჰიპოთალამური ბირთვი იპოვეს შეუძლია გამოიწვიოს penile ერექციის დოზა დამოკიდებული გზით და ამ სქესობრივი რეაქციის შედეგად გამოწვეული დეპრესიის აგონისტების მიერ აღინიშნა D2 რეცეპტორების ანტაგონისტების მიერ, როგორიცაა ჰალოპერიდოლი და L- სულპირიდი, მაგრამ არა შერჩევა XXX რეცეპტორების ანტაგონისტი (Melis et al., 38393). პლოვენტრიკულური ბირთვში შეყვანისას აპომორფინის უნარი გამოიწვიოს პალვატრიკულური ბირთვში, ასევე ადასტურებს, რომ პარავენენტულულ ბირთვში შეყვანილი დოპამინის აგონისტი შეუძლია გაიზარდოს შუალედური წნევა ღვიძლის ვირუსებით სისტემატური არტერიული წნევის შეცვლის გარეშე (ჩენ et al. , ჯულიანო და ალარდი, 1), როგორც სისტემური ინექციის შემდეგ (ბერნაბე და სხვები, 2). ეს კვლევებიც დაადასტურა D2 რეცეპტორების უმთავრესი როლი, რადგან D1 რეცეპტორების აგონისტები, ჩვეულებრივ, ვერ ახერხებდნენ ზედმეტი წნევის გაზრდას პარავენენტულულ ბირთვში (ჩენ et al., 1999).
ექსპერიმენტული მტკიცებულებების რამდენიმე ხაზი იყო შესაძლებელი იმის გათვალისწინებით, რომ პარავენტრიკულური D2 რეცეპტორები, რომელთა სტიმულაცია იწვევს პენიალურ ერექციას, მდებარეობს ოქსიოტექნიკური ნეირონების უჯრედებში. პირველ რიგში, პარავენენტულულ ბირთვს შეიცავს დოპინამერგიული ნერვული ტერმინალები, რომლებიც მიეკუთვნება ე.წ. ინკერტოჰიპოთალამური დოპამინერგული ნეირონების. ამ ნეირონების საკანში ორგანოები განლაგებულია A13 და A14 ჯგუფში Dahlstrom- ისა და Fuxe- ის (1964) ინტენსივობითა და ჰიპოთალამური სტრუქტურების შემსუბუქებას, მათ შორის ნეიროჰიპოფილების და / ან დამატებითი ჰიპოთალამური ტვინის ტერიტორიებზე (ბუჟესი და სხვები, Lindvall et al., 1984), პარავენტრიკულური ოქსიტოცინერგიული ნეირონების პროთეზირება.
ამ დოპინამერგიული ნეირონების ჩართვა პარავენენტულურ დონეზე პენიატრიული ერექციისა და კოპულაციის კონტროლზე მხარს უჭერს მიკროდიალიზის კვლევებს, რომლებიც აჩვენებენ, რომ ექსტრაკულოზური დოპამინისა და 3,4- დიჰიდროქსიფენიილჰეილაციტური მჟავა (DOPAC), მისი ძირითადი მეტაბოლიტის კონცენტრაციები იზრდება დიზეზიტისგან პარავენტრიკულური ბირთვი სქესობრივი პოტენციური მამრობითი ვირთხების ჩვენება არაკონკურენტული ერექციის დროს, როდესაც აღინიშნება მიუწვდომელი ovariectomized estrogen + პროგესტერონის- primed receptive ქალი (Melis et al., 2003).
დოპამინისა და DOPAC- ის კონცენტრაციის გაზრდა კიდევ უფრო მაღალი იყო, როდესაც მგრძნობიარე ქალებთან ერთად (MELIS et al., 2003) დაქვეითდა, როგორც მედიალური პრეოპტიკური მიდამოში (Hull et al., 1995) და ბირთვის accumbens (Pfaus და Everitt, 1995). მეორე, რამდენიმე კვლევამ აჩვენა, რომ პარავენტრიკულური D2 რეცეპტორების სტიმულაციით გამოწვეული penile ერექცია შუაშია ოქსიტოცინით. აქედან გამომდინარე, აპომორფინი, რომელიც იწვევდა დოზას, რომელიც იწვევდა პენიციურ ერექციას, აღმოაჩნდა ოქსიტოცინის კონცენტრაციის გაზრდა, არა მხოლოდ ვირთხებისა და მაიმუნების პლაზმაში (მელისი და სხვ., კემერონი და სხვ.), არამედ დამატებით ჰიპოთალამური ტვინის ისეთ ადგილებში, როგორიცაა ჰიპოკამპი (მელიც et al., 1989). ამ შედეგების მიხედვით, აპომორფინი პარავავრული ბირთვში შეიყვანეს იმ დოზით, რომელიც ამცირებს კალციუმის ერექციას ახლახანს აჩვენებს ბირთვული დოპამინის კონცენტრაციის გაზრდას ბირთვში, ოქსიტოცინის რეცეპტორების ანტაგონისტი D (CH2) 5I-XXX-VASOTOCINE გააქტიურდა ვენტრალურ სექტურულ სივრცეში (Succu et al., XIX, Melis et al.) (იხ. აგრეთვე სექცია 2). მესამე, პარავენტრიკულური ბირთვის ორმხრივი ელექტროლიტური დაზიანებები, რომლებიც თითქმის მთლიანად აღმოფხვრიან ოქსიტოცინს დამატებითი ჰიპოთალამური ტვინის ტერიტორიებიდან (ჰათლორნი და სხვა), გააუქმეთ აპომორფინით გამოწვეული პენიალური ერექცია (არგოლიას და სხვები), და შერჩევითი ოქსიტოცინის რეცეპტორების ანტაგონისტები პაროვატრული ბირთვში შეყვანისას, დოზის შედედების შემცირება, ოქსიტოცინის რეცეპტორების ბლოკირებისას ამ ნივთიერების პარალელურად პარალელურად პომპეზური პარალელური ერექციის შეწოვა (მელიის და ალ., 8B). ოქსიტოცინის რეცეპტორების ანტაგონისტები ასევე ძალზე ძლიერია მამაკაცის სექსუალური ქცევის გაადვილების შემცირებისას არა მარტო ოქსიტოცინით, არამედ აპმოორფინით (არგოლიას და სხვები, 2007, 2009).
რაც შეეხება მექანიზმს, რომლის საშუალებითაც დოპამინის ან დოპამინის რეცეპტორების აგონისტების მიერ გააქტიურებული D2 რეცეპტორები, ზრდის ოქსიოტექნიკური ნეირონების აქტივობას, რითაც ოქსიტოცინის ექსტრაფიპოთალმური ტვინის არეებში და ზურგის ტვინის გამოყოფა, მრავალი ექსპერიმენტული მონაცემებიჰიპოთეზაა, რომ D2 რეცეპტორების სტიმულირება ზრდის ოქსიტოცინერგიული ნეირონების უჯრედში არსებულ უჯრედებს Ca2 + იონების კონცენტრაციას, რაც ხელს უწყობს აზოტის ოქსიდის სინთეზის აქტივაციას, ამ საკნის ორგანოებში (Vincent და Kimura, Torres et al., Sanchez et al., Sato-Suzuki et al., XXX) - ის Ca2 + - კალმოდულინზე დამოკიდებული ფერმენტი. გაზრდილი აზოტის ოქსიდის წარმოება იწვევს ოქსიოტექნიკური ნეირონების გააქტიურებას. შესაბამისად, (1992) apomorphineinduced penile erection ხელი შეუშალა ორგანული კალციუმის არხების ბლოკატორები და by_- კონოტოქსინი GVIA, N- ტიპის ძაბვის-დამოკიდებული Ca1993 + არხების ძლიერი და შერჩევითი ბლოკატორი (McCleskey et al., 1994), რომელიც პარავენენტულულ ბირთვი (იხ. არგოლიას და სხვები, 1998 და მასში მითითებები); (1) apomorphine გამოწვეული penile erection ხელი შეუშალა მიერ აზოტის ოქსიდის- synthase ინჰიბიტორები გადაეცა paraventricular ბირთვი (Melis et al., 2c); (1987) apomorphine და სხვა D1990 რეცეპტორების agonists მიერ მიღებული დოზების, რომ გამოიწვიოს penile erection გაზრდის აზოტის ოქსიდის წარმოების პარავენტრიკულური დიალიზით მიღებული შიდა ცერებრალური მიკროდიალიზის, ზრდა, რომელიც შეამცირა ინჰიბიტორების paraventricular აზოტის ოქსიდი სინთეზით მოცემულია დოზით რეცეპტორი agonistinduced penile ერექცია (Melis et al., 2). მექანიზმი, რომლის საშუალებითაც აზოტის ოქსიდი პარავენტრიკულური ოქსიოტექნიკური ნეირონების გააქტიურებაა, ჯერჯერობით უცნობია, თუმცა ხელმისაწვდომი მონაცემები მიუთითებს, რომ აზოტის ოქსიდი მოქმედებს როგორც უჯრედული მაცნეზე და რომ არ არის ჩართული კლანური ციკალი. სინამდვილეში, ციკლური GMP- ის, 1994- ბრომო-ციკლური GMP- ის აქტიური phosphodiesteraseresist ანალოგი ვერ იპოვეს პარალელური ერექციის მიღებისას პარავენენტულულ ბირთვებში (ნახაზი XIXX) (იხ. მელიისი და არგოლიასი, 3b და მასში მითითებები).
ზემოხსენებული ინტერპრეტაცია ხშირად არ არის დამაჯერებელი, ვინაიდან დოპამინის D2 რეცეპტორების სტიმულირება, როგორც წესი, ინჰიბირებასთან ერთად, ვიდრე ამ რეცეპტორების შემცველი ნეირონების უჯრედების ორგანიზმებს, სხვადასხვა G პროტეინების მექანიზმების მეშვეობით (იხ. სოკოლოფი და შვარცი, 1995). თუმცა, ამ ხარვეზის შესაძლო შესაძლო განმარტება, რომელიც შეესაბამება დოპამინის მიერ პარავენტრიკულური ოქსიოტექნიკური ნეირონების პირდაპირ სტიმულაციას, ცოტა ხნის წინ შესთავაზეს G ცილოვანი დოპამინი D4 რეცეპტორი, D2 რეცეპტორის ოჯახის წევრი (D2, D3 და D4), რომლის სტიმულაცია ზრდის Ca2 + შემოდინებას უჯრედების პრეპარატებში ამ რეცეპტორების ქვეგანყოფილების კლონირებული ვერსიით (Moreland et al., 2004). უფრო მნიშვნელოვანია, რომ შერჩეული D4 რეცეპტორების აგონისტი (მაგ., ABT 724) (N-methyl-4- (2- ციანოპენილის) piperazynil-3methylbenzamide maleate) აღმოჩნდა, რომ შესაძლებელი იყო მამრობითი ვირთხების ჩასუნთქვისას, როდესაც ეს სისტემატურად არის მოცემული (Brioni et al. 2004). ეს ეფექტი ვერ მოიძებნა შერჩევითი D2 რეცეპტორების აგენტური PNU-95666E (R-5,6-dihydro-N, N-dimethyl-4Himidazo [4,5,1-i] quinolin-5 amine) (Hsieh et al., 2004) ასევე შეუძლებელი იყო CX2 + შემოდინება იმ საკნებში, რომლებიც შეიცავს D4 რეცეპტორების ქვეგანყოფილების (Brioni et al., 2004, Moreland et al., 2004) კლონირებული ვერსია. ზემოხსენებული ჰიპოთეზა და დასკვნების მიხედვით, PD 168,077 (N-Methyl-4- (2- ციანოპენილის) piperazynil-3methylbenzamide maleate), PIP-3EA (2- [4-methoxyphenyl) piperazin-2-ylmethyl] imidazo [1-a] pyridine) და სხვა შერჩევითი მეორე რეცეპტორების აგონისტები (Heier et al., XX საუკუნეებში, XX საუკუნეებში, XX საუკუნეებში), აღმოჩნდა, რომ პენსილურად ჩამოყალიბება შესაძლებელი იყო, როდესაც ინექცია სისტემატურად, icv და paraventricular ბირთვი, თუმცა ნაკლებად ეფექტურად, ვიდრე apomorphine. ამ D1,2 რეცეპტორების აგონისტების პრო-ეერგიული ეფექტი შეუშალეს L-4- ის (1997- (XL) -მთილ- 2006H- პიროლოზით [2009-B] პირრიან ტრიჰიდროქლორიდს), შერჩევითი მეორე რეცეპტორი ანტაგონისტი (Patel et al., XIX, Melis et al., XXIII, Löber et al., 4).
საბოლოო ჯამში, ზემოხსენებული D4 რეცეპტორების აგონისტების პროთელექტიური ეფექტი ასევე შემცირდა აზოტის ოქსიდის სინთეზის ინჰიბიტორებით, რომლებიც შედიოდნენ პარავტენტულულ ბირთვში, და D (CH2) 5Tyr (Me) 2-ORN8 ვაზოტოცინი, შერჩევითი ოქსიტოცინის რეცეპტორის ანტაგონისტი მოცემული icv მაგრამ არა პარავენენტულურ ბირთვში. ეს შედეგები შეესაბამება ჰიპოთეზას, რომ D4 რეცეპტორების აგონისტები ასევე ახდენენ ოქსიოტექნიკური ნეირონების სტიმულირებას აზოტის ოქსიდის სინთეზის გააქტიურებით და ექსტრაპოფოთალამიური ტვინის ტერიტორიებზე ოქსიტოცინის გათავისუფლებას, რაც, თავის მხრივ, ხელს უწყობს ქსოვილის ერექციას, როგორც ნაჩვენებია ატომორფინისა და კლასიკური DNANUMX აგონისტებისთვის (Melis et al ., 2, 2005; Löber et al., 2006).
ზემოაღნიშნული დასკვნები ასევე ხელს უწყობს ჰიპოთეზას, რომელიც დოპამინს იწვევს პენიატრიულ რეაქციებს, რომლებიც მოქმედებენ პაროვენტრიკულური ოქსიოტექნიკური ნეირონების უჯრედულ ორგანოებში და ამან გამოიწვიოს ოქსიტოზინეზული ნეირონების უჯრედული ორგანოების გაზრდა, რაც გაზრდის აზოტის ოქსიდის წარმოქმნას. აზოტის ოქსიდი აქტიურად ახდენს ოქსიტოცინერგიული ნეირონების გააქტიურებას ოქსიტოცინის გათავისუფლებას ზედმეტად ჰიპოთალამური ტვინის ზონებში და ზურგის ტვინში, როგორც უკვე განიხილეს. Ამ მხრივ, აღსანიშნავია, რომ დოპამინის რეცეპტორები იდენტიფიცირებულია პლოვენტრიკულური ბირთვში ოქსიოტექნიკური ნეირონების საკანში ორგანოებში სულ ცოტა ხნის წინ ორმაგი იმუნო-ფლუორესცენტული კვლევა ჩატარდა მაღალი შერჩევით D2, D3 და D4 რეცეპტორების ანტისხეულებთან და ოქსიტოცინის ანტისხეულებთან. ამ კვლევებმა აჩვენა სამივე D2ceptcept subtypes (D2, D3 და D4) გამოხატულება, რომელიც პარავენენტულულ ბირთვებში (ასევე სარაბოლური ბირთვში და მედიალური პრეოპტიკური მიდამოში) ოქსიტოცინერგიული ნეირონების უჯრედში ორგანოების ცალკეული ლოკალიზებულია და დუგლასი, ბასერვერლი და სხვები, 2008).
ეს უზრუნველყოფს ძლიერ ნეიროანოტოლოგურ მხარდაჭერას იმის თაობაზე, რომ D2 ტიპის დოპამინისა და დოპამინის რეცეპტორების აგონისტები პირდაპირ ოქსიოტექნიკური ნეირონების გააქტიურებით, ექსტრაპეპოთალამური ტვინის ტერიტორიებზე აღინიშნება ზემოთ, მაგალითად, ზურგის ტვინი, ვენტრალური თერმოსილი ტერიტორია, ჰიპოკამპი და ამიგდალა. თუმცა, ეს მონაცემები არ ითვალისწინებს D2 რეცეპტორების ქვეპუნქტორის საიდენტიფიკაციო დახმარებას, რომლის სტიმულაცია იწვევს Erectile რეაქციას. სამწუხაროდ, დახმარების მიღება არ არის შესაძლებელი პარავენენტულულ ბირთვში დოპამინის რეცეპტორების აგონისტების მიერ გააქტიურებული ოქსიოტექნიკური ნეირონების განსაზღვრის მიზნით. მართლაც, სხვადასხვა დოპამინის რეცეპტორების ქვედანაყოფების, ან შერეული დოპამინის რეცეპტორების აგონისტების (მაგ., აპომორფინის) ან შერჩევითი D2 რეცეპტორების აგონისტების (მაგ., კვინპიროლი, რომელიც მოქმედებს ყველა D2 რეცეპტორების ქვეტიპიზე) ან სელექტიური D4 რეცეპტორების აგონისტების ოქსიოტექნიკური ნეირონების გააქტიურება, როგორც პარავენტრიკულური ბირთვი პაროცენულური ოქსიტოცინერიკულ ნეირონებში (ბიტნერი და სხვ.), FOS ცილის გაზრდის მიხედვით. თუმცა, ეს გამოკვლევა ცოტა ხნის წინ დაკვირვებოდა, რადგან პარავენტრიკულური ოქსიოტექნიკური ნეირონების FOS- ის პროტეინი იზრდებოდა მხოლოდ მაშინ, როდესაც პენილეტის ერექცია გამოწვეული იყო კვინერონის მიერ, რომელიც ძირითადად მოქმედებს D2006 და D2 რეცეპტორების ქვედანაყოფებში, მაგრამ არა PD 3- ის რეცეპტორ აგონისტი, მიუხედავად იმისა, რომ ორივე ნაერთის უნარი გამოიწვიოს სექსუალური რეაგირება (Baskerville et al., 168077).
შემდგომი ექსპერიმენტები სხვა D2 რეცეპტორების ქვედანაყოფების (ძირითადად D2 და D3) შერჩევით აგონებთან ერთად აუცილებელია თითოეული დოპამინის რეცეპტორის ქვეპუნქტის ზუსტი როლი იერარქიული ფუნქციის კონტროლში პარავავრიკულ დონეზე. ამასთან დაკავშირებით, როგორც უკვე აღინიშნა, აპომორფინი, რომელიც ყველა დოფამინის რეცეპტორის ქვეპუნქტში ახდენს მტკიცედ მოქმედებს (იხ. Brioni et al., 2004 და მასში მითითება), უფრო ეფექტურია, ვიდრე D4 რეცეპტორების აგონისტები, რომლებიც იწვევენ პარავანტრულულში ბირთვი. ეს შეიძლება აიხსნას ატომორფინის ატომორფინის მაღალმა ასპექტმა D4 რეცეპტორ აგონისტებთან შედარებით, ან ალტერნატიულად, D4 რეცეპტორ აგონისტებს შეუძლიათ მოქმედებენ როგორც ნაწილობრივი აგონისტები, ან სხვა დოფამინის რეცეპტორების ქვედანაყოფების თანმხლები აქტივაცია აპომორფინის მიერ აწარმოოს ოქსიოტექნიკური ნეირონების უფრო მაღალ აქტივაცია შარდის ერექციის შუამავლობით, ვიდრე D4 რეცეპტორების აგონისტების აქტივაცია მხოლოდ D4 რეცეპტორების ქვეტიპი.
Dopamine D1 და D2 რეცეპტორებს შორის ურთიერთქმედება უკვე აღწერილია სექსუალური ქცევის კონტროლში მედიალური პრეოპტიკური მიდამოების დონეზე (იხ. Hull et al., 1989). იმ შემთხვევაში, თუ შერჩევითი D2 რეცეპტორების აგონისტების შეუძლებლობა მოხდება პენილეტის რეციდივის (Hsieh et al., 2004) დიაგნოზის დასამტკიცებლად (დაინახავთ Depoortère et al., 2009), მაგალითად, მაშინაც კი, ამ ნაერთების ინჟექციის შემდეგ პარავენენტულულ ბირთვში საჭიროა ანალიზში დეტალურად გაანალიზდეს ოქსიტოცინერგიული ნეირონების აქტიური გამოყენებისას D3 რეცეპტორების ცალკე ან ერთად D4 რეცეპტორების უმნიშვნელოვანესი როლი (იხ. Baskerville et al., 2009). სამწუხაროდ, შერჩევითი D2 და D3 რეცეპტორების აგონისტები (მაგ., რომლებიც განსხვავდებიან ამ ორი რეცეპტორის ქვეპუნქტებში მათი შედარებით მინიმუმ ოთხი / ხუთი ბრძანებით ვიტრაჟში). ამ მიზეზით, ბოლო წინადადება, რომ D3 რეცეპტორები შუამავლობის რეცეპტორ აგონისტების მიერ ინიშნება კალციუმის ერექციის შუამავლობით, რომელიც ეფუძნება ძირითადად D2 რეცეპტორების ანტაგონისტების მიერ გამოვლენილი ინ ვიტრო ექსპერიმენტებში, რათა შეამცირონ კლასიკური D3 აგონისტების მიერ გამოვლენილი penile erection apomorphine, quinpirol და pramipexole, რომელიც მტკიცედ გაააქტიურებს ყველა dopamine D2 რეცეპტორების ქვეტიპი (კოლინზი და სხვ., 2), რა თქმა უნდა, უნდა გადამოწმდეს სხვა ექსპერიმენტი. ეს დადასტურებაა საჭირო, რადგან ამ კვლევაში აღმოჩენილია D4 რეცეპტორების აგონისტების გავლენა ამ კვლევაში, ზემოთ მოყვანილი კვლევების შედეგებისგან განსხვავებით, რომელიც გამოხატავს D4 რეცეპტორების აგონისტების პრო-ექლექტი ეფექტს. მართლაც, აპომორფინის უნარ-ჩვევებიც კი, XXxX რეცეპტორის ნოკაუტის თაგვებში გამოსაყენებელი პლანშეტური ერექციის (იოუნინგი) უნარის მქონე ტუბერკულოზის მატარებლების იდენტურია, რომელიც გამოიყურებოდა ველური ტიპის D4 რეცეპტორების საწინააღმდეგო მაუსისა და D4 რეცეპტორების ანტაგონისტების უნარზე, რათა გააუქმოს ატომორფინის რეაქცია ამ ცხოველებზე ( კოლინზი და სხვ., 3) არ შეიძლება ჩაითვალოს განმსაზღვრელი მტკიცებულება D2009 რეცეპტორების აგონისტი-გამოწვეული პენილეტის ერექციის D3 რეცეპტორის ქვეპუნქტის შერჩევითი როლისთვის. ნეიროტრანსმიტრი / ნეიროპეპტიდი / ნეიროტრანსმიტრი / ნეიროპეპტიდი რეცეპტორის გენი აბლაცია (ნეიროტრანსმიტრი / ნეიროპეპტიდი და / ან ნეიროტრანსმიტრი / ნეიროპეპპტიდის რეცეპტორის ნოკაუტის ცხოველები), როგორც წესი, დაემატა შემდგომი დაბნეულობა და გართულებები ნევროტრანსმიტერების სავარაუდო სექსუალური როლის დადასტურებისას ან ნეიროპეპტიდები და მათი რეცეპტორები. კერძოდ, ოქსიტოცინის გენი აბლაცია აწარმოებს ოქსიტოცინს და იკვებებს თაგვებს, რომლებიც თანამოაზრებენ და ჩვეულებრივ ასრულებენ, თითქოს ოქსიტოცინი არასასურველია მათთვის, რაც მათ სუნთქვისა და კოპულაციისთვის არასასურველია. ასევე ჰომოოზური ქალბატონი ოქსიტოცინის საწინააღმდეგო მაკარონი ჩვეულებრივი სმენისა და ნაყოფის გამოხატულებაა, თუმცა აღინიშნება რძის შელახვის გაუარესება (Nishimori et al., Young et al., 1996). ნეირონარული ოქსიდის სინთეზის გენი კოდირება, ასევე აწარმოებს აზოტის ოქსიდის სინთეზს, რომელიც აყალიბებს მაუსებს, რომლებიც ჩვეულებრივ (ჰუანგი და სხვები). თუმცა, ეს დასკვნები, ალბათ, რეპროდუქციული ფიზიოლოგიის მნიშვნელოვან მახასიათებელს მიუთითებს, ანუ ცენტრალური კონტროლისა და პერიფერიული დონის კონტროლის პროცესში ჩართული სისტემების გადაჭარბება.
ამგვარი გამოსწორება, რა თქმა უნდა, ევოლუციური წარმომავლობაა, ვინაიდან იგი მომავალი თაობის გადარჩენისათვის გენების გადასვლის გარანტიას იძლევა. აქედან გამომდინარე, D4 რეცეპტორების გენის აბლაცია არ შეცვლის ატომორფინის პრო-ექტქტილურ ეფექტს, ვარაუდობს, რომ D4 რეცეპტორები, როგორიცაა ოქსიტოცინი და აზოტის ოქსიდი, მხოლოდ რამდენიმე შუამავალია, რომლებიც მუშაობენ სისტემებში, რომლებიც აკონტროლებენ ერექციული ფუნქციის კონტროლს ვარაუდობენ, რომ არ არსებობს როლი რეცეპტორების კონტროლი penile erection და სექსუალური ქცევა. D4- ის აგონისტების გაუქმება penile ერექციის წარმოქმნისას, როდესაც სისტემატიურად განსხვავდება სხვადასხვა შტამების მამრობითი ვირთხების შესახებ, ცოტა ხნის წინ მოყოლილი იქნა კიდევ ერთი კვლევა (Depoortère et al., 2009). თუმცა, განსხვავებით კოლინზი და ა.შ. (2009), და სურათის როლი სხვადასხვა D2 რეცეპტორების ქვედანაყოფების კონტროლში penile erection კონტროლის კიდევ უფრო puzzling, ეს კვლევა ასევე გვიჩვენებს, რომ სავარაუდო შერჩევითი D3 რეცეპტორების ანტაგონისტების მიერ სისტემატურად ვერ შეამციროს apomorphine გამოწვეული penile ერექციის მამაკაცის ვირთაგვებში უფრო მგრძნობიარეა ატომორფინის პრო-ეტექსიალური ეფექტისადმი, ხოლო სექსუალური რეაქცია (და იოანინგი) იყო ანტიგნიტური მიერ შერჩევითი D2 ანტაგონისტი L-XXX (741,626 - [3-4-chlorophenyl) -4-hydroxypiperidin (XXX-Yl] Methyl-4H-indole), რომლებიც ავტორები მიიჩნევენ, რომ D1 რეცეპტორები, ვიდრე D1 და D2 რეცეპტორები, არიან ისეთებიც, რომლებიც თამაშობენ მნიშვნელოვან როლს D3 აგონისტების მიერ გამოწვეული penile ერექციის (Depoortère et al., 4). საბოლოო ჯამში, დოპამინის რეცეპტორების აგონისტების ექსპრესიული ეფექტი ოქსიტოცინერგიული ნეირონების შუამდგომლობაზე, ნაწილობრივ ნაწილობრივ, არაპირდაპირია, ვიდრე პირდაპირი, მაგალითად, შუამავლობით ან გავლენა მოახდინა სხვა ნეიროტრანსმიტერების მოქმედების ცვლილებებით ნეიროპეპტიდებით მოქმედება ოქსიოტექნიკური ნეირონები პარავენტრულულ ბირთვში, არ შეიძლება სრულიად გამორიცხული.
3.2. გლუტამინური მჟავა- ოქსიტოცინის ურთიერთქმედება პარავენენტულულ ბირთვში
ჰიპოთალამუსის პარავენტრიკულური ბირთვი ძალიან მდიდარია სინაპეციებში, რომლებიც შეიცავს ნატრიუმის მჟავას, როგორც ნეიროტრანსმიტრს (მაგ. გლუტმჟავა და ასპარტინის მჟავა) (ვან დენ პოლ, 1991). ამ ბირთვში ამოსული ამინომჟები ჩართულია მრავალრიცხოვან ფუნქციებში, მათ შორის penile erection და სექსუალური ქცევა (Roeling et al., Melis et al., 1991, 1994, 2000). შესაბამისად, NMDDA რეცეპტორების ქვეგანყოფილების შერჩევითი აგონისტი N-Methyl-d-aspartic acid (NMDA), მაგრამ არა (±) -_- ამინომჟავას-ჰიდროქსი-2004- მეთილ- იზოზაზოლი-3- პროპიონიუმის მჟავა (AMPA) , AMPA რეცეპტორების ქვეგანყოფილების შერჩევითი აგონისტი ან (±) -ტრანს (5) -ამინო-4- ციკლოპენთური დიკარბოქსილის მჟავა (ACPD), მეტაბოლური რეცეპტორების ქვეტექსტის შერჩევითი აგონისტი, აღმოჩნდა, რომ შესაძლებელი იყო penile erection inducing პარავენტრიკულური ბირთვი თავისუფლად მოძრავი ვირთხებით (მელიც და სხვები, 1b). 1,3 MR Melis, A. Argiolas / Neuroscience და Biobehavioral მიმოხილვების პროსელექტიური ეფექტი 1994-948 NMDA შეუშალა (+) MK-35, არაკონკურენტული NMDA რეცეპტორების ანტაგონისტი (ვუდროფი et al., 2011 ), გაჟღენთილი შევიდა paraventricular ბირთვი (Melis et al., 939b). ამ შედეგების მიხედვით, ტრიმეტრული კვლევების ჩატარება მიზნად ისახავს ინტრაკარვერნული წნევის მონიტორინგს, NMDA გაცილებით უფრო აქტიური აღმოჩნდა, ვიდრე სხვა გამაღიზიანებელი ამინომჟავების რეცეპტორების ქვეგანყოფილების აგონისტები, როდესაც პარავავრიკულური ბირთვში ინექცია ინტრაკვერვერნაზული წნევის გაზრდისას ანთება ან ანესთეზირებული მამრობითი ვირთხების დროს (Zahran et ალ., ჩენ და ჩანგი, 955).
როგორც ოქსიტოცინისა და დოპამინისთვის რეკომენდებულია NMDA რეცეპტორების შუამდგომლობა შპრიცის ერექციის შუალედშია ოქსიტოცინერგიული ნეირონების უჯრედებში, ვინაიდან აღინიშნება ამინომჟავას ნერვული დაბოლოებები იმპლანტაციურ ნივთიერებებზე, რომლებიც ახდენენ პარავენენტულულ ბირთვში (ვან დენ პოლ, 1991). დოპამინის რეცეპტორების აგონისტების ანალოგიაში, NMDA- ის პრო-ექტქტილური ეფექტი აშკარად შუამავლობით ახდენს ოქსიოტექნიკური ნევროტრანსმიმის გააქტიურებით, რომელიც არღვევს ოქსიტოცინის ანტაგონისტის (CH2) 5Tyr (Me) 2-Orn8-vasotocin icv არა პარავენენტულულ ბირთვში (იხ. არგოლიასი და მელიისი, 1995, 2004, 2005 და მასში მითითებები). გარდა ამისა, NMDA- ს გამოხატული ოქსიტოცინეზური ნეიროტრანსციის გააქტიურება ასევე მოქმედებს აზოტის ოქსიდის სინთეზის გააქტიურებაში, ვინაიდან NMDA- ს გამოწვეული ზრდის რეზისტენტობა ხელს უშლის აზოტის ოქსიდის სინთეზის ინჰიბიტორებს (N-Nitro-N-methyll-arginine methyl ester და N- მეთილ-თიო-ლ-ციტრულლაინი) და პარავენენტრიკულური ბირთვში შეყვანილი პარავენენტრიკულური ბირთვში შეყვანილი დოზების დროს, რომლებიც ზრდის კალციუმის რეზისტენტობას, ზრდის აზოტის ოქსიდის წარმოებას ჰიპოთალამურში არსებულ ბირთვში (იხ. Argiolas and Melis, 1995, 2004, 2005, ). რაც შეეხება დოპამინის რეცეპტორ აგონისტებს, ნატრიუმის ოქსიდისინთეზის გააქტიურებას შეიძლება ასევე იყენებენ Ca2 + არხიდან დაწყებული NMDA რეცეპტორების მეშვეობით ოქსიტოცენზიკური უჯრედების ორგანიზმში გაზრდილი Ca2 + შემოდინება, როგორც ნაჩვენებია რამდენიმე ნერვული პრეპარატებით (იხ. Snyder, 1992; სამხრამი და გართვატი, შუმანი და მედისონი, 1993 და მასში მითითებები). ნატრიკული ოქსიდი თავის მხრივ ააქტიურებს ოქსიოტექნიკური ნევროტრანსმიის (იხ. ზემოთ). გლუტამოტარგიური პროგნოზების წარმოშობა, რომლებიც იწვევენ პარავენტრიკულური ოქსიტოცინერგიული ნეირონების შუამდგომლობას, არ არის ცნობილი, თუმცა ზოგიერთი ნეიროანომატური და ელექტროფიზიოლოგიური მტკიცებულება ცხადყოფს, რომ ისინი შეიძლება წარმოიშვას ნაწილობრივ ჰიპოკამპუსში (საფიერი და ფელდმანი, 1987, ჩენ et al., 1992) . მიუხედავად იმისა, რომ შემდგომი მუშაობა აუცილებელია გლუტამატეგიული პრეპარატების წარმოშობის უკეთესად წარმოდგენის მიზნით პარავავენტულულ ბირთვში, პარავენტრიკულური ბირთვში გლუტმული მჟავების ჩართვა კალციუმის ერექციისა და სქესობრივი ქცევის კონტროლის თვალსაზრისით მტკიცედ უჭერს მხარს მიკროდიალიზის კვლევებს. შესაბამისად, გლუტამინური მჟავებისა და ასპარტინის მჟავების დამატებით ფიჭურ კონცენტრაციებში გაიზარდა მამაკაცის ვირთაგვებში პარავენენტრიკულური ბირთვიდან მიღებული დიაციტატი, რომელიც არათანაბარი ესტროგენი + პროგესტერონის პროგესტერონის რეცეპტული ქალის ვირთხების თანდასწრებით (Melis et al. 2004b), პენიტური erections, რომლებიც ასევე შუამავლობით ცენტრალური ოქსიტოცინირების ტრანსმისიით (Melis et al., 1999a, b) გააქტიურებით. ასეთი იზრდება უფრო მაღალი აღმოჩნდა, როდესაც რეცეპტირებულ ქალს ეხმარებოდა copulation (Melis et al., 2004a). ჰიპოთეზაა, რომ პარავენენტულურ ბირთვში პარავენენტულულ ბირთვში აღინიშნება ექსპერიმენტული ამინომჟავების მომატებული აქტივობა პენიატრიკულური ბირთვში პარალელური ერექციისა და კოპულაციის დროს, როგორც არაკონკურენტული erections და copulatory ქცევა (რომლის დროსაც copula penile erections იქმნება) მცირდება NMDA რეცეპტორების ბლოკადათ paraventricular ბირთვში , და ამ შემცირებას მოჰყვება შემცირება ნიტრიკ ოქსიდის წარმოების გაზრდისას, რაც ამ ჰიპოთალამურ ბირთვში ამ ფიზიოლოგიურ კონტექსტში ხდება (მელი და სხვ.). ექსტრაცენლექური გლუტამომჟავას კონცენტრაციის მომატება GABAergic ნერვული დაბოლოებისგან, რომელიც იწვევდა ოქსიტოცინერგიული უჯრედების ორგანიზმში აღინიშნა ამინდულ აეიდერულ სინაპებზე, ასევე გამოიკვეთა პარავენენტულულ ბირთვში CB1 ანტაგონისტი SR 1A მიერ კანნაბინოიდული CB141761 რეცეპტორების ბლოკადა, პედიატრიულ ბირთვებში ან პირდაპირ პარავენტრულულ ბირთვებში შეყვანისას, რომლებიც იწვევენ კალმახურ ერექციას (იხ. Succu et al., Castelli et al., 2006). ამგვარმა ზრდამ გამოიწვია ოქსიტოცინერგიული ნეირონების საკანში ორგანიზმში აზოტის ოქსიდის სინთეზის გააქტიურება, რაც გაზრდის აზოტის ოქსიდის წარმოებას. აზოტის ოქსიდი თავის მხრივ ააქტიურებს ოქსიოტექნიკური ნეირონების შუამავლობას, როგორც ზემოთ აღწერილია. ამ მექანიზმის შესაბამისად, SR 141761A გამოწვეული პენიმური ერექცია შემცირდა NMDA რეცეპტორების ბლოკირებით და აზოტის ოქსიდის სინთეზის ინჰიბიტორების მიერ, მაგრამ არა პარავენტრულულ ბირთვში დოპამინის ან ოქსიტოცინის რეცეპტორების ბლოკადათ, ცენტრალური ოქსიტოცინის რეცეპტორები ოქსიტოცინის რეცეპტორების ანტაგონისტების მიერ
3.3. ოქსიტოცინ-დოპამინის ურთიერთქმედება ვენტრალური თერაპიულ ზონაში
ოქსიტოცინი იწვევს თირკმელზედა თირკმლის არტერიულ კუტურ ნაწილში დოზის დამოკიდებულებისას (Melis et al., 2007). ყველაზე დაბალი აქტიური დოზა გაუკეთეს ცალმხრივად 20- ს, ხოლო ყველაზე მაღალი დოზა ტესტირებულია 100. ოქსიტოცინის ეფექტი შუამავლობით მოქმედებს ოქსიტოცინერგიული რეცეპტორების აქტივობით, რადგანაც სექსუალური რეაქცია გაუქმებულია ოქსიტოცინის ანტაგონისტის (CH2) 5Tyr (Me) 2-ORN8 ვაზოტოცინის წინასწარ ინექცია კაუტალური ვენტრალური თერაპიული არეალში. ეს რეცეპტორები ლოკალიზებულია დოპამინერგული ნეირონების საკანში, რომლებიც ძირითადად უჯრედის ჭურვი აჭარბებს. შესაბამისად, ორმაგი იმუნო-ფლუორესცენტული გამოკვლევები აჩვენებს, რომ კაუტალური ვენტრალური თხევადი ოქსიოტექნიკური ბოჭკოების დიპლომიერ ნეირონების უჯრედული ორგანოების მჭიდრო კავშირია, რომელთა უმრავლესობამ დადებითად შეაფასა თიროზინი-ჰიდროქსილაზასთვის და შემცველი რეტროგრადული ტრაქტორია ფლუროგოდოლი ბირთვული თირკმლის არტერიის ოქსიტოცინით გამოწვეული პენიალური ერექციის შეწოვა ხდება უჯრედული დოპამინის კონცენტრაციის ზრდისას, რომელიც მიიღება დიალიზის ჭურვიდან ბირთვი accumbens (Melis et al., 1). ოქსიტოცინით გამოწვეული პენიალური ერექცია ასევე ხდება ნატრიუმის ოქსიდის წარმოქმნის ზრდად ვენტრალურ სეგმენტურ ზონაში და ორივე რეაქცია უტოლდება არა მხოლოდ (CH2) 5Tyr (Me) 2-ORN8 ვაზოტოცინის და ნიტრიკ ოქსიდის სინთეზის ინჰიბიტორის S- მეთილ-თიო-სი-ციტრულინს, არამედ _-კონოტოქსინს, ძაბვაზე დაფუძნებულ Ca2 + არხების ბლოკერსა და ODQ- ის (1H- [1,2,4] ოდადიზაოლის [4,3-a] კვინონოქსინი- 1- ის ერთეული), გენიალტის ძლიერი ინჰიბიტორი ციკლასი, ყველა ოქსიტოცინამდე (სუკუ და სხვები, 2008) ადრე კადალურ ვენტრალურ სეგმენტებში. იმდენად, რამდენადაც ფლუორგოლდოლში მოთავსებულმა დოპამინერგურმა უჯრედებმა დაუკავშირდნენ ოქსიტოცინერგიული ბოჭკოების მიერ, დადებითი აღმოჩნდა თირკმლის ჰიდროქსილაზასთვის კაუტალური ვენტრალური თერგმენტაციის არეალში, ასევე დადებითი იყო ნიტრიკ-ოქსიდის სინთეზისა და გინელეტარული ციკლისისთვის (Succu et al., 2008), ოქსიტოცინის იშვიათი penile erection შეიძლება შუამდგომლობით შემდეგი მექანიზმი. დოპამინერგული რეცეპტორების გააქტიურება დოპამინერგურ უჯრედებში პეპტიდის საშუალებით იზრდება Ca2 + შემოდინება დოპამინერგული ნეირონების საკანში ორგანოებში. ეს ააქტიურებს აზოტის ოქსიდის სინთეზს, Ca2 + - კალმოდულინს-დამოკიდებული ფერმენტის, რითაც გაზრდის აზოტის ოქსიდის წარმოებას. ნატრიკული ოქსიდი თავის მხრივ ააქტიურებს მწვავე ციკლასს, რაც ხელს უწყობს ციკლური GMP- ის გაზრდას. ციკლური GMP ააქტიურებს დოპინამერიკულ ნეირონებს ბირთვის აჩქარებას. ციკლური გმპ-ის როლი ციტოლური ვენტრალური თერგმენტაციის სივრცეში ოქსიტოცინით გამოწვეული კალციუმის ერექციის როლს ასევე უჭერს მხარს ციკლური GMP- ის აქტიური phosphodiesterase- რეზისტენტული ანალოგი 8- ბრომო-ციკლური GMP- ს უნარით, რათა გამოიწვიოს penile ერექცია, როდესაც ინექცია კაუტალური ვენტრალური თერაპიული არეალი და გაზრდის უჯრედული დოპამინის გაზრდის დიაგნოსტიდან ბირთვის accumbens (Succu et al., 2008; Melis et al., 2009). ეს ეწინააღმდეგება იმ მექანიზმს, რომლის მიხედვითაც აზოტის ოქსიდი ახდენს ოქსიოტექნიკური ნეირონების პარავენენტულულ ბირთვებში, რომელიც მოქმედებს 8- ბრომო-ციკლური GMP- ს, ვერ ახერხებს ამ ბირთვში ინექციისას (მელიისი და არგიოლასი, 1995b). 2). რაც შეეხება ნერვულ გზებს ბაქოში დოფამინის მიერ გააქტიურებული პნევმატური ერექციისკენ, ეს ჯერ კიდევ უცნობია. თუმცა, არსებული მონაცემები აჩვენებს, რომ ეს გზები ჰიპოთალამუსის პარავენენტულულ ბირთვში დოპამინის ნეიროტრანსმიმის გადაადგილებას ააქტიურებს. შესაბამისად, ოქსიტოცინის გამოწვეული პენიალური ერექცია ხდება თანდათანობით უჯრედული დოპამინის ზრდაზე არა მხოლოდ ბირთვი accumbens, არამედ paraventricular ბირთვი, და antagonized მიერ dopamine რეცეპტორების ანტაგონისტი haloperidol გაუკეთეს შევიდა paraventricular ბირთვი (Melis et al., 2007). აამ შედეგებს მხარს ვუჭერთ იდეას, რომ პარავენენტულულ ბირთვში წარმოქმნილი ოქსიტოცინერგული ნეირონები და კადალური ვენტრალური თერაპიული არეალის პროთეზირება, ამ აქტივობის გააქტიურებისას ოქსიტოცინის გააქტიურებით და ამით ახდენს NO- ციკლური GMP სიგნალის სისტემის გააქტიურებას, რაც თავის მხრივ აძლიერებს მეზოოლიმბური დოპამინერგული ნეირონების (Melis et al., 2007, XXII, Succu et al., 2009). დოპამინი გამოიყოფა ბირთვის accumbens თავის მხრივ ააქტიურებს ნერვულ გზებს, რომლებიც იწვევენ ინერერტო-ჰიპოთალამური დოპამინერგული ნეირონების გააქტიურებას, რაც ხელს უწყობს პარავენტრიკულური ოქსიტოცინერგიული ნეირონების სტიმულირებას ზურგის ტვინის შუამავლობით მკურნალობისას. ამავდროულად, პარავენენტულულ ბირთვში გამოტანილ დოპამინს შეუძლია ასევე მოახდინოს ოქსიტოცინერგიული ნეირონების ექსტრაქტომირებული ტვინის არეების პროვოცირება, როგორიცაა ვენტრალური სეგმენტი, ჰიპოკამპუსი, ამიგგდალა და სხვა ტვინის სფეროები.
როგორც ზემოთ აღინიშნა, ამ ჰიპოთეზის შესაბამისად, აპომორფინი პარავტენტულულ ბირთვში შეყვანა დოზით, რომელიც იწვევს კალციუმის ერექციას, ასევე ზრდის ბირთვულ დოპამინის კონცენტრაციას ბირთვში, ოქსიტოცინის რეცეპტორების ანტაგონისტი (CH2) 5Tyr (Me) ) 2-ORN8- ვასტოცენზი გაჟღენთილი ვენტრალური სეგმენტური არეალში (სუკუ და სხვ., მელსი და სხვები, 2007). გარდა ამისა, ზემოთ ნერვული გზები შეიძლება წარმოადგენდეს ჰიპოთეტური ნევროლოგიური სქემით, რომელიც მოიცავს დოპამინის, ოქსიტოცინის და სხვა ნეიროტრანსმიტერების (მაგ., გლუტმული მჟავას, ქვემოთ) გავლენას არა მხოლოდ სექსუალური მოქმედებაზე, არამედ სექსუალური მოტივაცია და სექსუალური დაჯილდოება (იხ. ნაწილი 4).
3.4. ჰიპოკამპუსის ვენტრალურ სუბკულუმში ოქსიტოცინ-გლუტამომჟავა ურთიერთქმედება
ოქსიტოცინი იწვევს პენსილურად განვითარებას ვენტრალურ ნაწილში, მაგრამ არა დოზალური სუბიექტის დროს, დოზის დამოკიდებულების მიხედვით (მელიის და სხვები, 2009b). ოქსიტოცინის რეცეპტორების სტიმულაციით სექსუალური რეაქცია შუამავლობითაა მოშლილი, რომელიც არღვევს ოქსიტოცინის ერთნაირი ადგილისთვის XXX-ORN2- ვოსტოცინის (XX) 5TY (Me) 2- ის წინასწარ ინექციას, როგორც სხვა ტვინში (იხ. ზემოთ) . რაც შეეხება ამ რეცეპტორების ლოკალიზაციას, არსებული მონაცემების მიხედვით, ისინი ლოკალიზებულია ნეიტრონების უჯრედების ორგანოებში, რომლებიც ნიტრიკ ოქსიდის სინთეზში მდიდარია.
შესაბამისად, მიკროდიალიზის კვლევები აჩვენებს, რომ ოქსიტოცინით გამოწვეული პენიალური ერექცია ხდება უპირატესად ვენტრალური სუბიექტის ნატრიუმის ოქსიდის წარმოქმნის ზრდით და ამ ზრდა გააუქმებს არა მხოლოდ ნიტრიკ ოქსიდიანთეზას ინჰიბიტორს S-methyl-thio-l-citrulline აგრეთვე ნიტრიკ ოქსიდის ჰემოგლობინი, არამედ X (XX) 2-XXX-VASOTOCIN- ის მიერ, ყველა იმ ოქსიტოცინის ერთნაირი უბანზე, რომლებიც ანაწილებენ კალციუმის ერექციის (მელისი და ალ., 5). უფრო მნიშვნელოვანია, რომ ოქსიტოცინით გამოწვეული პენიალური ერექცია ასევე ხდება უჯრედული გლუტამინის მჟავის კონცენტრაციის ზრდად ventral subiculum, რომელიც მხოლოდ ნაწილობრივ antagonized მიერ არასამთავრობო კონკურენტუნარიანი NMDA რეცეპტორების ანტაგონისტი (+) MK-2 მოცემულია ვენტრალური სუბსილიუმი (Melis et al., 8). ამასთან ერთად, ეს შედეგები ცხადყოფს, რომ ახლად ჩამოყალიბებული აზოტის ოქსიდი, intercellular messenger- ის მოქმედებით, გლუტამინური მჟავა ნეიროტრანსმიმირებას ახდენს კალციუმის ერექციისკენ, რაც შესაძლოა ნერვული ეფექტიანი პროგნოზებით დამატებითი ჰიპოკამპალი ტვინის ტერიტორიებზე. ამ ჰიპოთეზის შესაბამისად, NMDA გააქტიურებულია ventral subiculum იწვევს penile ერექციის დოზა დამოკიდებული გზით, და ეს ეფექტი antagonized მთლიანად ადრე ინექცია იმავე საიტზე (+) MK-801, მაგრამ არა S-methyl-thio-l-citrulline , ჰემოგლობინი ან D (CH2) 5Tyr (Me) 2- ორნაქს-ვოსტოცინი (Melis et al., 8). რაც შეეხება ნერვულ ეფექტურ გზებს, რომლებიც ახდენენ ჰიპოკამპოლური ტვინის არეალებს, რომლებიც გააქტიურებულია ამინომჟავების (მაგ., გლუტამომჟავა) მიერ ventral subiculum, სავარაუდოა, რომ ეს არის გლუტამათერგიური, როგორც უმრავლესობა ჰიპოკამპის ექსპერიმენტული პროგნოზები. ამ ეტაპზე შეიძლება მხოლოდ ვარაუდი, რომ ეს პროგნოზები მოქმედებას mesolimbic dopaminergic ნეირონების მოქმედებას ახდენს, რაც, თავის მხრივ, პარავენტრულულ ბირთვებში ინერერტო-ჰიპოთალამური დოფამინერგული ნეირონების მოქმედებას ახდენს, რასაც მოჰყვება ოქსიოტექნიკური ნეირონების აქტივაცია შუამავლის შუამავლობის შუამდგომლობა უკვე განიხილეს (იხილეთ ზემოთ).
შესაბამისად, ვენტრალური სუბიკულური ოქსიტოცინის გამოწვეული კალციუმის ერექცია ხდება უჯრედული დოპამინის კონცენტრაციის ზრდისას ბირთვული ნაწილის ჭურვიში და ამ ზრდა, როგორც კალციუმის ერექცია, გაუქმებულია D (CH2) 5Tyr (Me) 2- ორნიქს-ვოსტოცინი მიეწოდება ვენტრალურ სუბიქსს ოქსიტოცინამდე (მელიის ეტ., 8b). გარდა ამისა, ვენტრალური სუბკულუმი ოქსიტოცინმა გამოიწვია კალციუმის ერექცია ასევე შემცირდა (+) MK-2009 მიერ ventral tegmental ტერიტორიაზე, მაგრამ არა ბირთვის accumens (Melis et al., 801b) და ხდება თანმიმდევრულად ზრდა დამატებითი ფიჭური გლუტმული მჟავა ვენტრალური თირკმლის არეში, მაგრამ არა ბირთვში, რადგან ორივე რეაქცია უქმდება d (CH2009) 2Tyr (Me) -Orn5-ვასტოციკინი, გაუკეთეს ვენტრალურ სუბიქსულში ოქსიტოცინამდე (იხ. ნახაზი 8), სავარაუდოა, რომ მეზოოლიმბური დოპამინერგული ნეირონების გააქტიურება საშუალოა გლუტამოტარგიური ნეიროტრანსმიმის გაზრდით ვენტრალური თერაპიის არეში. ეს გულისხმობს, რომ გლუტამინური მჟავა-დოპამინის ურთიერთქმედების კონტროლი პენილელური ერექციის საშუალებით არსებობს ვენტრალური ტექსტურით. შემდგომი კვლევები საჭიროა იმის დასადგენად, არის თუ არა ტერმინალური ტერმინალური სივრცის სუბკულაციის გლუტემეტერიკური გზები პროგნოზირებული პირდაპირი ან არაპირდაპირი გზით, ანუ წინასწარგანტული ქერქის ან სხვა ტვინის ზონების მეშვეობით (იხ. მელიისი და სხვ. ვინაიდან პარავენენტულულ ბირთვს ასევე იღებს ჰიპკორპამუსის გლუტამატერგური პროგნოზები (იხ. ზემოთ და საფფიერი და ფელდმანი, 2009), მდე გლუტმული მჟავა ააქტიურებს პარავენტრიკულური ოქსიტოცინერგიული ნეირონების ჩათვლით, მათ შორის, რომლებიც მიმართულია ვენტრალური ტექსტურით (იხ. არგოლისა და მელიისი, 2005 და მასში მითითებები) ოქსიტოცინი ვენტრალურ თერაპიულ ზონაში იწვევს პენიალურ ერექციას და ზრდის მეზოოლიმბური დოპამინერგული ნეირონის აქტივობას(იხ. ზემოთ), ეს არის მაფიოზური ვარაუდი, რომ გვორალტოკულური ოქსიტოცინერგიული ნეირონები შეიძლება ჩართულნი იქნას, ნაწილობრივ მაინც, მეზოოლიმბური დოპამინერგული ნეირონების გააქტიურებით ოქსიტოცინის მიერ გაჟღენთილ ვენტრალურ სუბკულუმში (იხ. ნაწილი 4).
4. დასკვნითი შენიშვნები
კვლევების ზემოთ განხილულია და ადგენს ადრეული დასკვნები, რომ მამრობითი ვირთხებში ოქსიტოცინი მნიშვნელოვან როლს ასრულებს ჰიპოთალამუსის და ზურგის ტვინის პარავენტრულულ ბირთვებზე მაღალ დონეზე. კერძოდ, ყველაზე მეტადკვლევებმა ცხადყო, რომ ოქსიტოცინი გავლენას ახდენს penile ერექციის საშუალებით, აგრეთვე მოქმედებს სხვა ტვინის არეებში, ანუ ვენტრალური თირკმლის არეში, ვენტრალური სუბიკუუმში და ამეგდალის პოსტერმედიულ კორტიკურ ბირთვს.
Paraventricular დონეზე, ყველაზე მნიშვნელოვანი ახალი აღმოჩენა, ალბათ, ექსპლუატაციის აღმოჩენა D2 ოჯახიდან (D2, D3 და D4) ოქსიტოცინერიკულ ნეირონების უჯრედში ორგანოებში პარავენენტულულ ბირთვში (და სუროპური ბირთვში მედიალური პრეპოპტიკური სივრცე) (ბასერველი და დუგლასი, ბასერვერლი და სხვები, 2008). ეს უზრუნველყოფს ძლიერ ნეიროანომალურს ჰიპოთეზის მხარდაჭერა დოპამინისა და დოპამინის რეცეპტორების აგონისტებისთვის აქტიურია ოქსიტოზინერგული ნეირონების პირდაპირი ჩართვა, რომლებიც ჩართულნი არიან ერექციული ფუნქციის დროს და არა მხოლოდ ზურგის ტვინის, არამედ დამატებით ჰიპოთალამური ტვინის ტერიტორიებზე. ამასთან დაკავშირებით მნიშვნელოვანია აღმოჩენა, რომ დოპამინური რეცეპტორის აგონისტის გამოწვეული ზრდის მომატება ზრდის ოქსიტოცინერგენური რეცეპტორების ბლოკადა lumbo-sacral ზურგის ტვში (Baskerville et al., 2009). სინამდვილეში, მიუხედავად იმისა, რომ ამგვარი მტკიცებულებები მიღებულია ანესთეზირებული მამაკაცის ვირთაგვებში, აღმოჩნდა, ადასტურებს დოპამინის რეცეპტორების აგონისტის მიერ გამოწვეული პარალელურ-ზურგის ოქსიტოცინირების ქვედა მარშრუტის გააქტიურებას. ჰოქსივე, ჯერ კიდევ დადგენილია თუ არა ოქსიტოცინირების უჯრედში არსებული დოპამინის რეცეპტორების სტიმულაციით გამოწვეული კალციუმის ერექცია, საშუალოა D2 ოჯახის (D2, D3 ან D4) სპეციფიკური დოპამინის რეცეპტორის ქვეპუნქტის აქტივაციაზე, ან თუ ეს რეცეპტორების ქვედანაყოფები ითანამშრომლებენ Erectile რეაქციის მოდიფიცირებაში, შესაძლოა განსხვავებულ კონტექსტში, რომელიც დამოკიდებულია კონტექსტში, რომლის მიხედვითაც ხდება penile ერექცია (იხ. Moreland et al., Engnghard-Gueiffier et al., XXIII, Melis et al. ჯორჯია, ბ, ლორი და სხვები, კოლინზი და სხვ., დეპოორდერი და სხვა., Baskerville et al., 2004).
კიდევ ერთი მნიშვნელოვანი ახალი დასკვნა იმაში მდგომარეობს, რომ ოქსიტოცინი იწვევს პენიტენციურ ერექციას, როდესაც იწვევდა არა მხოლოდ პარავენტრულულ ბირთვში ან ჰიპოკამპუსის CA1 ველში, არამედ ვენტრალური თირკმლის არეში, ვენტრალურ სუბკულუმში და ამეგდალას პოსტერმედიულ კორტიკურ ბირთვს. ეს ტვინის არეები არ ჩატარებულა ადრეულ კვლევებში, რომ ოქსიტოცინი სპონტანური პენიალური ერექციის ეპიზოდები მამაკაცის ვირთხებში გაიზარდა, თუმცა პარავენენტრიკულური ბირთვიდან ოქსიტოცინერგიული პროგნოზების მსგავსად ისინი იღებდნენ. ოქსიტოცინი მართლაც გვხვდებოდა სპონტანური პენსიური ერექციის ეპიზოდების გაზრდის შესაძლებლობით, რომლებიც მოზრდილ მამრობაში მოჰყავთ რაიმე სქესობრივი სტიმის არარსებობის შემთხვევაში, როგორიცაა ის, რაც წარმოიშვა ხელმისაწვდომი ან მიუწვდომელი რეცეპტის (ესტროგენ-პროგესტერონის პრაიმუდის) წარმოშობის ქალბატონებისგან გენიტალიის მანიპულირება, პარავენტრიკულური ბირთვში და ჰიპოკამპუსის CA1 ველში, მაგრამ არა დორსალური სუბიექტის, გვერდითი სვეტის, კაუადური ბირთვი, მედიალური პრეოპტიკური მიდამოში, კანქვეშა უჯრედისა და სუროპეტური ბირთვში (მელიის ეტლ. , 1986). ამ კვლევებში ჩვეულებრივ ითვლიდა, როდესაც პენისიდან ამოვარდნილი მამაკაცის მიერ დამკვირვებლის მიერ გამოვლენილი პენიზი, რომელიც წინასწარ იყო ექსპერიმენტის დროს, ან მოგვიანებით ვიდეოთვალის ვიდეოკამერაზე დაფიქსირებული ექსპერიმენტის დაცვით. თითოეული penile rerection ეპიზოდი გრძელდება 0.5-1 და ჩვეულებრივ თან ახლავს penile grooming და / ან ჰიპ flexions. არ არის ექსპერიმენტი, როგორც წესი, ამ ვირთაგვებში, რათა დადგინდეს სექსუალური გამოცდილების, ასაკის, ან თუ ეს ვირთხები შეიძლება დაიყოს დაბალი ან მაღალი რეაგირების მქონე პაციენტებში ოქსიტოცინის პრო-ეექტოლის ეფექტს სხვადასხვა ტვინში. ეს ასევე ეხება კვლევების უმრავლესობას სხვა ნეიროპეპტიდების და ნარკოტიკების მოქმედებაზე, რომლებიც სპონტანური პენიალური ერექციის ეპიზოდების, მათ შორის დოპამინური აგონისტების, აღმშრალი ამინომჟავების, ACTH-MSH, hexarelin და VGF პეპტიდების გაზრდის მიზნით. თუმცა, ამ ნაერთების პრო-ერექციული ეფექტი განმეორებით დაადასტურა ტელემეტრიული მეთოდებით, რომლებიც განსაზღვრავენ ქსოვილის ერექციის წარმოქმნას ინტრაკერნული ზეწოლის ზრდისას, რაც ხდება სპონტანურად ან მას შემდეგ, რაც ამ ნაერთების ადმინისტრირება სხვადასხვა მარშრუტების მეშვეობით ხდება, ანუ სისტემატურად, intracerebroventricularly ან პირდაპირ კონკრეტულ ტვინის ბირთვებში, მას შემდეგ, რაც იმპლანტის წნევის microtransducer- ის პირდაპირ ქვაბულურ კორპორაციაში (იხ. ბერნაბე et al., 1999). ვენტრალური თერგმენტური არეალში, ამიგდალალის ვენტრალური სუბიკლი და პოსტერმედიული ბირთვი ასევე ოქსიტოცინი იწვევს ოქსიოტექნიკური რეცეპტორების მოქმედებას. ეს ხელს უწყობს მეზოლიმბური დოპამინერგული ნეირონების გააქტიურებას ვენტრალურ სეგმენტურ უბნებში წარმოქმნას და ბირთვული ჭრილობის ჭრისკენ, როგორც იზომება ბაქტერიის დოზამინის კონცენტრაციის ზრდისას ბირთვული ჭრილობის ჭურვიდან და ამორტიზური რეაქციის შემცირებით პეპტიდის მიერ გამოვლენილი ამ დამატებითი ჰიპოთალამური ტერიტორიების გაჩენას, რომლებიც აღმოჩენილია დოპამინერგიული რეცეპტორების ბლოკადაში ბირთვი accumbens (იხ. ქვემოთ). რაც შეეხება ოქსიტოცინერგიული რეცეპტორების სტიმულაციით გააქტიურებულ მექანიზმებს ამ ტვინში, რომელიც გამოიწვიოს მეზოლიმბური დოპამინერგული ნეირონების აქტივობასა და პენიტენციურ ერექციასთან, საუკეთესო განმარტებებია კადალური ვენტრალური თერგმენტაციის ტერიტორიაზე. სინამდვილეში, აქ ფარმაკოლოგიური და იმუნო-ფლუორესცენტული შედეგები აჩვენებს, რომ ოქსიტოცინის ნერვული დაბოლოებები იმპლანტის ნეირონების საკანში ორგანიზმში ახდენს ბირთვული ნაწილის ჭრილობას (მელიც et al., 2007A, Succu et al., 2009). ამ ნეირონების უმრავლესობა მდიდარია ნიტრიკ ოქსიდის სინთეზში და გინელექტრო ციკლაზე. ამ დოპამინერგული ნეირონების უჯრედში არსებულ ოქსიტოცინერგიული რეცეპტორების სტიმულირება იწვევს ნიტრიკ ოქსიდის სინთეზის გააქტიურებას, რაც გაზრდის აზოტის ოქსიდის წარმოქმნას. ნატრიკული ოქსიდი თავის მხრივ ააქტიურებს მწვავე ციკლასს, რითაც იზრდება ციკლური GMP- ის კონცენტრაცია, რაც იწვევს მეზოოლიმბური დოპამინერგული ნეირონების გააქტიურებას და ბირთვში დოპამინის გათავისუფლებას, როგორც გაზომვა დიალიზის დელიზიტის ზრდის გზით, ბირთვიდან მიღებულ ბირთვებში, რომლებიც მიღებულია ინტრა-ცერებრალური მიკროდოლიზით (Succu et al., 2008 ). დოპამინი გამოიყოფა ბირთვის accumbens თავის მხრივ ააქტიურებს ნერვულ გზებს, რასაც მივყავართ penile rerection. ეს მხარს უჭერს დოპამინის რეცეპტორების ანტაგონისტების ჰალოპერიდოლის ან / და ციზფლპენტგენოლის უნარ-ჩათვლით ბაქტერიების ჩათვლით, რათა შეამცირონ ventral tegmental არეალი ოქსიტოცინით გამოწვეული penile urection (Succu et al., 2008). ერთ-ერთი პროთეზული გზები, როგორც ჩანს, ინერტული ჰიპოთალამური დოფამინერგული ნეირონების გააქტიურებაა, კერძოდ, ის, რომ პროექტი პარავენტრიკულური ოქსიოტექნიკური ნეირონების საკანში ორგანიზმში. მართლაც ოქსიტოცინი კუდილურ ვენტრალურ თერაპიულ ზონაში გააქტიურდება უჯრედული დოპამინის არა მხოლოდ ბირთვში, არამედ პარავენენტულულ ბირთვებში, ხოლო პარავენენტულულ ბირთვში დოპამინის რეცეპტორების ბლოკადა მნიშვნელოვნად ამცირებს ვენტრალური თირკმლის არეალს ოქსიტოცინით გამოწვეული კალციუმის ერექციის (Succu et al. , 2007, 2008, Melis et al., 2007, 2009). ამ ბირთვის არსებობა დოფამინი-პარავენტრიკულური დოპამინი-პარავენტრიკულური ოქსიტოცინ-ტერტრალური თხევადი ოქსიტოცინის-დოპამინის ბმულები ასევე ითვალისწინებს აორმოორფინის პრო-ექექტოლის დოზისა და D4 რეცეპტორების აგონისტის PD168077- ის პარავენტრულულ ბირთვში შეყვანისას, რათა გაიზარდოს უჯრედული დოპამინი ბირთვული ჭრილობის ჭურვი (Succu et al., 2007), რეაგირება რომელიც აკრძალულია d (CH2) 5Tyr (Me) -Orn8- ვასტოცენზი, რომელიც მიეკუთვნება ვენტრალური თხრილების არეალს (მელიც et al., 2009a, იხ. ქვემოთ). თუმცა, აუცილებელია შემდგომი მუშაობა ნერვული გზების იდენტიფიცირებისათვის, რომლებიც დაკავშირებულია ბირთვთან დაკავშირებისას ინკერტო-ჰიპოთალამური დოფამინერგული სისტემის მიმართ.
მექანიზმი, რომლის საშუალებითაც ოქსიტოცინი იწვევს პენიალურ ერექციას და ახდენს მეზოლიმბური დოპამინერგული ნეირონების გააქტიურებას, როდესაც ამინგდალებში გადის ვენტრალური სუბიკუუმში ან პოსტერმედიულ ბირთვებში შეყვანა ნაწილობრივ მხოლოდ ნაწილობრივ. ამასთან, ოქსიტოცინი ააქვს საკუთარი რეცეპტორები, რომლებიც ხელს უწყობენ აზოტის ოქსიდის სინთეზის გააქტიურებას, რითაც გაზრდის აზოტის ოქსიდის წარმოებას. აზოტის ოქსიდი თავის მხრივ იწვევს უცნობი ეფექტურ პროგნოზებს, რაც, სავარაუდოდ, გაზრდის გლუტამოტარგიულ ნეიროტრანსმიზაციას ვენტრალურ სეგმენტურ ზონაში. გლუტმული მჟავა შემდეგ ასტიმულირებს მეზოოლიმბურ დიპამინერგურ ნეირონებს, რასაც მიმართა penile ერექცია. ეს ჰიპოთეზა მხარს უჭერს ძირითადად ოქსიტოცინის გააქტიურებას ventral subiculum in გაზრდის ზედმეტი ფიჭური glutamic მჟავა ventral tegmental ფართობი (ნახ. 3), და არაკონკურენტული NMDA რეცეპტორის ანტაგონისტი (+) MK-801 გააქტიურდა ვენტრალურ სეგმენტურ სივრცეში, მაგრამ არა ბირთვში, რომელიც შეამცირებს ოქსიტოცინის მიერ გამოწვეული კალციუმის ერექციის შემცირებას, ან გააქტიურდება ვენტრალურ სუბკულუმში ან პოსტერმედიულ ბირთვში ამიგდალა (მელიისი და სხვები, 2009b). ამ ეტაპზე უფრო დეტალურად არის ხელმისაწვდომი ოქსიტოცინით გამოწვეული კალციუმის ვენტრალური სუბიექტი. ოქსიტოცინით გამოწვეული პენიალური ერექცია, როგორც ჩანს, საშუალოა ოქსიტოცინერგენური რეცეპტორების აქტივაცია, რომელიც მდებარეობს ნიტრიკ ოქსიდის სინთეზსთან დაკავშირებული ნეირონების საკანში არსებულ ორგანოებში. ეს ხელს უწყობს ნიტრიკ ოქსიდის წარმოქმნას, რომელიც ხელს უწყობს გლუტამოტარგიულ ნეიროტრანსმიმირებას მოქმედებაში, როგორც intercellular messenger, როგორც მექანიზმი, რომელიც აღწერილია გრძელვადიანი პოტენციალით (იხ. Snyder, 1992; Southam and Garthwaite, შუმანი და მედისონი, 1993) . ამ ჰიპოთეზის ოქსიტოცინის ინდუცირებული პენიალური ერექციის შემადგენლობაში შედიან უჯრედული გლუტამინის მჟავის გაზრდა ვენტრალური სუბიექტისგან დიალიზიტის დროს და ნატრიუმის მჟავას რეცეპტორების სტიმულაცია NMDA მიერ ventral subiculum, იწვევს penile erection. გლუტმული მჟავა თავის მხრივ ააქტიურებს ნერვულ ეფექტურ პროგნოზებს, რაც გამოიწვიოს მეზოლიმბური დოპამინერგული ნეირონების აქტივობა ვენტრალური თერგმენტაციის არეალში, როგორც ზემოთ აღინიშნა. თუ ამ მექანიზმებს ოპერატიულია, ამიაგდალის პოსტერმინეულ ბირთვში დღემდე უცნობია. გარდა ამისა, საჭიროა შემდგომი კვლევების დასამტკიცებლად, რომ (მაგ.) ოქსიტოცინირების ნერვული დაბოლოებები და რეცეპტორები ვენტრალური სუბიექტისა და ამიგგალალის პოსტრამედრეულ ბირთვებში ნატრიუმის ოქსიდის სინთეზის შემცველი ნეირონების საკანში ორგანოებში ლოკალიზებულია, თუ ეს ნეირონები საბოლოო ჯამში ნატრიუმის ოქსიდის მიერ გააქტიურებული სიგნალიზაციის სისტემის იდენტიფიცირების მიზნით, ექსცენტრიური ამინომჟავის (გლუტამოტარგიური) სინაფსების და (1) კონტროლის ქვეშ. ამ თვალსაზრისით, აღსანიშნავია, რომ ოქსიტოცინის უნარი გაზრდის აზოტის ოქსიდის სინთეზის აქტივობას დოპამინერგული ნეირონების საკანში ორგანიზმში კადალური ვენტრალური თერაპიული არეალში და ჯერ კიდევ უცნობი ნეირონების მიმართ ვენტრალური სუბიკუუმში და ამიაგდალას პოსტერმედიული ბირთვი, იხსენებს ოქსიტოცინის უნარი, პარავენტრიკულურ ბირთვში ოქსიოტექნიკური ნეირონების საკანში ორგანიზმში აზოტის ოქსიდის სინთეზის გააქტიურება (მელიის და სხვები, 1997). თუმცა, ვენტრალური თერაპიის არეალში დოპამინერგული ნეირონების უჯრედების ორგანიზმში ნატრიკული ოქსიდის მომატებული წარმოება იწვევს ამ ნეირონების გააქტიურებას გლანიტის ციკლის გააქტიურებით და ციკლური GMP- ის გაზრდით, ეს არ ხდება პარავენენტულულ ბირთვში. შესაბამისად, პარავენენტულულ ბირთვში 8- ბრომო-ციკლური გმპ-ი არ იწვევს პენიტენციურ ერექციას, მაშინ როდესაც ეს ხდება ვენტრალური თერგმენტაციის არეში. კიდევ ერთი სიგნალიზაციის გზა, რომელიც განსხვავდება აზოტის ოქსიდეციკლური გენმოდიფიცირებული სისტემისგან, მაშინ ჩართულია პაროვენტრიკულურ დონეზე ოქსიოტექნიკური ნეირონების გააქტიურება ენდოგენური ან / და ეგზოგენური აზოტის ოქსიდის (მელიისი და არგიოლასი, მელიის და სხვები) მიერ . 1). მეორეს მხრივ, cyclic GMP- ის ვენტრალური თერაპიული არეალში ჩანს ასევე მნიშვნელოვანი როლი mesolimbic dopaminergic ნეირონების გააქტიურებაში და ზრდის მამაკაცური ვირთხების ბირთვიდან მიღებული დიალიზის დროს მოქმედი უჯრედული დოპამინის ზრდაში არჩეული არ არის ნაჩვენები ან არ აჩვენებს არაკონკურენტურ penile erections, როდესაც დასვა მიუწვდომელი ovariectomized რეცეპტი (estrogen + პროგესტერონის დამუშავებული) ქალი Rat. ამ ექსპერიმენტულ პირობებში, მამრობითი ვირთხებით, რომლებიც აჩვენებენ არაკონკურენტულ პენსიონულ ეფექტებს, დამატებით ფიჭური დოპამინის კონცენტრაციის ზრდა მოსალოდნელია და ეს ზრდა კიდევ უფრო გაიზარდა, თუმცა მხოლოდ მოკრძალებულად, კადალური ვენტრალური თერაპიული არეალში ჩაჟღერებული ფოსფოიდერით ინჰიბიტორების მიერ (Sanna et et ალ., 2009).
ოქსიტოცინის გააქტიურებას ვენტრალური თირკმლის არეში, ამირგალალას დაქვემდებარებულ ნაწილში, ასევე პოსტომერიკულ ბირთვში შეყვანილ დოპამინურ აგონისტებთან ერთად, პენიალური ერექციის წარმოქმნისა და მეზოლიმბური დოპამინერგული ნეირონების გააქტიურება. . პირველ რიგში, ზემოთ მოხსენიებული მექანიზმები შეიძლება ოპერატიულად იქნას გამოყენებული, როდესაც ფიზიოლოგიურ კონტექსტში ხდება penile erection, როგორიცაა სპექტრის დროს (როდესაც copula penile erections ხდება) ან არასასურველი penile erections დროს. ეს ერვეზები არის ფერომონის შუამავლები, რომლებიც გამოწვეული არიან ნარკოტიკების ან ოქსიტოცინისგან, რომლებიც წარმოიქმნებიან სქესობრივი პოტენციურ მამრობითი ვირთხების მიერ მიუწვდომელი რეცეპტის (ovariectomized estrogen + პროგესტერონის primed) ქალი ვირთაგვასთან და განიხილება როგორც სექსუალური ინდექსის ეპიზოდები (საჩები, 1997, 2007). სინამდვილეში, მიუხედავად იმისა, რომ ეს შედეგები არ აჩვენებს იმას, რომ ოქსიტოცინი ამ სფეროების როლს ასრულებს ფიზიოლოგიურ კონტექსტში ან ნარკოტიკების მოხმარების შემდეგ, ისინი ადრეული დასკვნების შემდგომ ძალას აწვდიან იმ აზრს, რომ ამ ტვინის ტერიტორიები მიეკუთვნება იმას, სადაც ოქსიტოცინი მიეკუთვნება ცენტრალურ აქტებს არა მხოლოდ სპონტანური ერექციის ეპიზოდები არაპროგნოზული ნარკოტიკების შემდეგ, არამედ მამაკაცისა და სქესობრივი ქცევის გასაუმჯობესებლად (იხ. არგოროსი და მელიისი, 2004 და მასში მითითებები). შესაბამისად, ოქსიტოცინის კონცენტრაცია იზრდება მამრობითი ვირთხების ჰიპოკამპებში, რომლებიც მკურნალობდნენ აპომორფინის პრო-ექექტოლის დოზით, კლასიკური დოპამინის აგონისტი (მელი და სხვ., 1990) და D (CH2) 5Tyr (Me) -Orn8-ვასტოცინი, რომელიც ბლოკავს ოქსიტოცინს რეცეპტორები, ძალიან ეფექტურია არა მხოლოდ კოპულატორული ქცევის (არგოლიას და სხვა, 1987A), არამედ აპოლოორფინის მაპროვოცირებელი ეფექტი მამრობითი კოპულატორული ქცევის შესახებ (Argiolas et al., 1987b) სქესობრივი პოტენციურ მამრობითი ვირთხებში, რომლის დროსაც კოპულა penile rerection მოხდეს. (CH2) 5Tyr (Me) -Orn8-vasotocin ასევე უკიდურესად ძლიერია არაკონსტანციური უჯრედების შემცირება სქესობრივი გზით მოზარდის ვირთხებში, როდესაც ნანოგრამში შეტანილია გვერდითი პარკუჭებში, მაგრამ არა PVN- ში (Melis et al., 1999A).
მეორე, mesolimbic dopaminergic ნეირონების გადამწყვეტი როლი ბუნებრივი და გამაძლიერებელი სტიმულის, როგორიცაა საკვები, წყალი და სექსუალური აქტივობის სამოტივაციო და დაჯილდოების თვისებები (ფიბიგერი და ფილიპსი, XXX; ბრძენი და რომპეი, EVERIT, 1988). კერძოდ, ამ ნეირონებისგან გამოთავისუფლებული დოპამინი ითვლება ბუნებრივი სტიმულის მოტივაციური ასპექტების ტრანსლაცია შუალედურ ქცევებში, მაგალითად სექსუალური აქტივობის შემთხვევაში, სქესობრივი პარტნიორისა და სქესობრივი კავშირის ძიება ჯილდოს და კმაყოფილების მისაღწევად (Goto და Grace, 2005). შესაბამისად, უჯრედული დოპამინის კონცენტრაცია იზრდება სქესობრივი პოტენციური მამრობითი ვირთაგვების ბირთვიდან დიალიზიტის დროს, მიუწვდომელი ovariectomized estrogen + პროგესტერონის- primed receptive მდედრობითი ვირთაგვის დროს, და ამგვარი ზრდა კიდევ უფრო მაღალი იყო, როდესაც მამრობითი ვირთხა მიეცათ მოპასუხე ქალი (Pfaus და Everitt, 1995).
მესამე, წინამდებარე შედეგები ხელს უწყობს ჰიპოთეზას, რომელიც ნერვულ წრეში აკავშირებს პარავენენტულულ ბირთვს უშუალოდ ან ირიბად ვენტრალური სეგმენტური ზონის პირდაპირ ან ირიბად (ვენტრალური სუბიექტის ან / და პლაზმური კოორდული ბირთვი ამიგგალას) და ბირთვი accumbens და აქედან უცნობი პარავენტრიკულური ბირთვებისკენ მიმავალ გზაზე პარავენტრიკულური ბირთვების კონტროლზე კონტროლი ზურგის ტვინის შარდის შუალედური პენიალური ერექციისა და ოქსიტოცინერბული ნეირონების პროგნოზირებისას ვენტრალური თერგმენტური არეალის, ვენტრალური სუბიკულუმისა და ამეგდალის პოსტერმედიული კორტიკალური ბირთვის პროგნოზირება, ამ გზით მოდიფიცირება მეზოოლიმბური დოპამინერგული ნეირონების აქტივობა (ნახაზი 4). ეს კომპლექსური ნერვული წრე შეიძლება როლი შეასრულოს ნეიროურ საქმიანობაში ინტეგრირებაზე, რომელიც ჩართულია მომხმარებელთა (ელეკილურ-ეჟაკულატორული) და ფიზიოლოგიურ კონტექსტში მამრობითი სქესის ქცევის წინაპირობაზე (სამოტივაციო და დაჯილდოების) ასპექტებზე. სინამდვილეში, უჯრედული დოპამინი იზრდება ბირთვის accumbens (Pfaus და Everitt, 1995) და პარავენენტულულ ბირთვში სქესობრივი პოტენციური მამრობითი ვირთხების დროს მიუწვდომელი მგრძნობიარე ქალბატონებისთვის, როდესაც არასასურველი რეაქციები წარმოიქმნება და უფრო მეტიც, მაგალითად, როდესაც copula penile erections ხდება (Melis et al., 2003). ამდენად, მიუხედავად იმისა, რომ შემდგომი კვლევები აუცილებელია ენდოგენური ოქსიტოცინის როლის გასინჯვისას ვენტრალური თირკმლის არეში, ვენტრალური სუბიკულუმისა და ამიგდალა არაკონტრაქტურ ეერენციებსა და სექსუალური ქცევის დროს, შეიძლება მაშინვე გონივრული იყოს ვივარაუდოთ, რომ ეს ჰიპოთეტური ნერვული წრე, სექსუალური ქცევის გამომწვევი ასპექტები, ამავდროულად შეიძლება ასევე გაააქტიუროთ მეზოოლიმბური დოპინამერგული სისტემა, რომელიც უზრუნველყოფს ნერვულ სუბსტრატს სექსუალური აქტივობის დაჯილდოების თვისებების დასაფიქსირებლად (Everitt, 1990; Pfaus and Everitt, 1995). ამასთან დაკავშირებით აღსანიშნავია, რომ ოქსიტოცინის გააქტიურებული მეზოლიმბური დოპინამერგენური სისტემა გააქტიურებულია ვენტრალურ სექტურულ სეგმენტში, რომელიც ააქტიურებულია ბოროტად გამოყენებისას, როგორიცაა ოპიატების, კანნაბინოიდების, ამფეტამინის, კოკაინის და ალკოჰოლური სასმელების (Tanda et al., 1997), და რომ ოქსიტოცინი იქნა აღმოჩენილი ტოლერანტობის შემცირებისა და კოკაინის, მორფინის, ალკოჰოლური და კანნაბინოიდების დამოკიდებულების შემცირებაზე (კოვაკები და სხვ., XI, კუი და სხვები, 1998). დასკვნის სახით, როგორც ჩანს, ოქსიტოცინი არა მხოლოდ ვენტრალური თირკმლის არეში გამოდის, არამედ ვენტრალური სუბიკულუმითა და ამიგდალას პოსტრმემედიალური კორტიკალური ბირთვით, შეიძლება გაააქტიუროთ მეზოოლიმბური დოპამინერგული ნეირონები, რაც შეიძლება იყოს ჩართული სექსუალური მოქმედებაში . მეზოოლიმბური დოპამინერგული ნეირონების აქტივობა შეიძლება პირდაპირ იყოს ოქსიტოცინერგენური რეცეპტორების მეშვეობით მეზოოლიმბური დოპამინერგული ნეირონების საკანში ორგანოებში, ან არაპირდაპირი გზით, გლუკოზის მჟავა ნეიროტრანსმიმის გააქტიურებით ventral tegmental ტერიტორიაზე.
დოპამინი გამოაქვეყნა ბირთვში შეკუმშული ჭრილობა, გარდა ამისა, პარავენტრიკულურ ბირთვებში ინერერტო ჰიპოთალამური დოფამინერგული ნეირონების აქტივობა (ზურგის ტვინის პროტექციის ოქსიტოცინერიკულ ნეირონების გააქტიურების გზით) ან სექსუალური მოტივაცია და ჯილდო (ოქსიტოცინერგიული აქტივაციის გზით ნეირონები, რომლებიც მიმართულია ვენტრალური თირკმლის არეში, ვენტრალური სუბიკულური ან ამეგდალას პოსტერმედიული კორტიკალური ბირთვი). მას შემდეგ, რაც დოპამინი ასევე გამოიყოფა ბირთვში ჭრილში და პარავენენტულულ ბირთვში, როდესაც პენიალური ერექცია ხდება ფიზიოლოგიურ კონტექსტში (მაგ., არაკონკურენტული erections და copulation) (Succu et al., XIX, Melis et al., 2007, XX) სავარაუდოა, რომ ცენტრალური ოქსიოტექნიკური ნეირონები მონაწილეობენ ნევროლოგიურ წრეებში, რომლებიც ხელს უწყობენ ურთიერთქმედება მეზოოლიმბურსა და ინერერტო ჰიპოთალამური დოპინამერგული სისტემას შორის. ეს ნერვული სქემები შეიძლება როლს შეასრულონ არა მხოლოდ სექსუალური ქცევის მოხმარების ფაზაში (მაგ., Penile erection and copulation), არამედ სექსუალური მოტივაცია, სექსუალური აღშფოთება და სექსუალური ჯილდო.
ჰიპოთეტური ნერვული სქემის სქემატური წარმომადგენლობა, რომელიც მოიცავს ოქსიტოცინს, რომელიც გავლენას ახდენს სექსუალური მოტივაციის, დაჯილდოების და სექსუალური მოქმედებების შესახებ, როგორც ამ თავში მიღებული შედეგები და წინა ანგარიშები. პარავენენტულულ ბირთვში წარმოქმნილი ოქსიტოცინერგიული ნეირონები და ზურგის ტვინის პროვოცირება, როდესაც დოპამინისა და გლუტანის მჟავას (გარდა ამისა, სხვა ნეიროტრანსმიტერებისა და / ან ნეიროპეპტიდების საშუალებით) აქტიურია, ზურგის ტვინის პროგნოზირებისას ოქსიოტექნიკური ნეირონების გააქტიურების გზით გააუმჯობესოს penile ერექცია და სექსუალური აქტივობა. პარავენენტულულ ბირთვში დოპამინი და გლუტანი მჟავა (არამედ ნეიროტრანსმიტერები და ნეიროპეპტიდები) ასევე ააქტიურებს ოქსიტოცინერგული ნეირონების პროტექცირებას ვენტრალური თერგმენტური არეალის მიმართ, რაც განაპირობებს მეზოლიმბური დოპამინერგული ნეირონების პროვოცირებას ბირთვის accumbens, მოდულაცია სექსუალური მოტივაცია და ჯილდო. დიკამინით გამოთავისუფლებული ბირთვის accumbens (NAs) ააქტიურებს ჯერ კიდევ უცნობი ნერვულ გზებს, რომლებიც ზრდის ინექტორი ჰიპოთალამური დოფამინერგული ნეირონების აქტივობას (წარმოიქმნება Dahlstrom და FXX- ის A13-A14 ჯგუფები) იმპლანტირებადი პაციენტები ოქსიტოცინერგიული ნეირონების შესახებ, მათ შორის, ზურგის ტვინის, რასაც მიმართა penile rerection. ეს სქემა შეიძლება გააქტიურდეს ოქსიტოცინის მიერ არა მხოლოდ კადალურ ვენტრალურ თერაპიულ სივრცეში, არამედ ვენტრალური სუბიექტისა და ამიგგალალაში, რომელიც ასევე იღებს პაქტენტარულური ბირთვიდან ოქსიტოცინეიერგურ ინერვაციას, შესაძლოა პირდაპირი ან არაპირდაპირი გლუტამოტარგიური საშუალებებით tegmental ფართობი, რასაც მოდელის ორივე სქესობრივი მოტივაცია და penile rerection. საბოლოო ჯამში, ეს სქემა შეიძლება გააქტიურდეს სქესობრივი სტიმულისა და ფერომოვანი საშუალებებით, რადგან ზედმეტი უჯრედოვანი დოპამინი და გლუტმული მჟავა პარავენენტულულ ბირთვებში (და მედიალური პრეოპტიკური მიდამოში) გაიზრდება ფერომონით-შუამავლიანი არაკონტრაქტით გამოწვეული ეპუნქციებისა და კოპულაციის დროს (შესაბამისი მითითებების სანახავად ლიტერატურის სია).
მადლობა ეს ნამუშევარი ნაწილობრივ მხარს უჭერდა იტალიის უნივერსიტეტსა და კვლევის AA და MRM- ის გრანტს
ლიტერატურა
ანდერსონი, კეი, 2001. Penile ერექციის ფარმაკოლოგია. ფარმაკოლი. Rev. 53, 417- დან. არგოლისები, ა., 1994. ნატრიკული ოქსიდი პენიალური ერექციის ცენტრალური შუამავალია. ნეიროფარმაკოლოგია 33, 1339- დან. არგოლისები, ა., 1999. ნეიროპეპტიდები და სექსუალური ქცევა. ნევროსი. ბიობჰავა. Rev. 23, 1127- დან. არგიოლასი, ა., გესსა, გლ., 1991. ოქსიტოცინის ცენტრალური ფუნქციები. ნევროსი. ბიობჰავა. Rev. 15, 217- დან. არგოლიასი, ა., მელიისი, მრ, 1995. ნეირომოდულაცია კალციუმის ერექციის: ნეიროტრანსმიტერებისა და ნეიროპეპტიდების როლის მიმოხილვა. Prog. ნეირობიოლი. 47, 235- დან. არგოლიასი, ა., მელიისი, მრ, 2004. ოქსიტოცინის როლი და პარავცენტრული ბირთვი მამრობითი სქესის სექსუალურ ქცევებში. ფიზიოლი. იყავი. 83, 309- დან. არგოლიასი, ა., მელიისი, მრ, 2005. კალციუმის ერექციის ცენტრალური კონტროლი: ჰიპოთალამუსის პარავავრული ბირის როლი. Prog. ნეირობიოლი. 76, 1- დან. არგოლიასი, ა., კოლუ, მ., გესსა, გელი, მელიისი, მრ, სერრა, გ., 1988. ოქსიტოცინის ანტაგონისტი D (CH2) 5Tyr (Me) -Orn8-ვასტოცინი antagonizes მამაკაცის copulatory ქცევის rats. E. J. ფარმაკოლი. 149, 389- დან. Argiolas, A., Collu, M., D'Aquila, P., Gessa, GL, Melis, MR, Serra, G., 1989. მამრობითი სპონტანური ქცევის ატომორფინის სტიმულაცია ხელს უშლის ოქსიტოცინის ანტაგონისტის (CH2) 5Tyr (Me) -Orn8-ვასტოცინის ვირთაგვებში. ფარმაკოლი. Biochem. იყავი. 33, 81- დან. არგოლიასი, ა., მელიისი, მრ, გესსა, გლ, ჯუმბასტი. ინტრავენტრიკულური ოქსიტოცინი ხელს უწყობს ვირთხებში და კალციკულური ერექციის დროს. E. J. ფარმაკოლი. 117, 395- დან. არგოლიასი, ა., მელიისი, მრ, გესსა, გლ, ჯუმბასტი. ოქსიტოცინი: მამაკაცის ვირთაგვებში კალციუმის ერექციის უკიდურესად ძლიერი ინჰიბიტორი. E. J. ფარმაკოლი. 130, 265- დან. არგოლიასი, ა., მელიისი, მრ, მაური, ა., გესსა, გლ, ჯუნს. პარავავრიკულური ბირთვის დაზიანება ხელს უშლის ემოორფინით და ოქსიტოცინით გამოწვეულ yawning და penile erection- ს, მაგრამ არა ვირთაგვებში. ტვინის რეს. 421, 349- დან. არგოლიასი, ა., მელიისი, მრ, ვარგუი, ლ., მაური, ა., გესსა, გლ, 1987b. (CH2) 5Tyr (Me) -Orn8-vasotocin, ძლიერი ოქსიტოცინის ანტაგონისტი, antagonizes penile erection და yawning გამოწვეული oxytocin და apomorphine, მაგრამ არა ACTH 1-24. E. J. ფარმაკოლი. 134, 221- დან. არგოლიასი, ა., მელიისი, მრ, სტანპამპიანო, რ., გესსა, გლ, ჯუმბერ. _-კონოტოქსინი ხელს უშლის აპროორფინით და ოქსიტოცინით გამოწვეულ მამრობითი თერაპიას და მამაკაცის ვირთაგვას. ფარმაკოლი. Biochem. იყავი. 37, 253- დან. არლეტი, რ., ბერტოლინი, ა., 1985. ოქსიტოცინი ხელს უწყობს სარძევე ჯირკვლის ქცევას ქალთა ვირთაგვებში. ნეიროპეპტიდები 6, 247-255. არლეტი, რ., ბაჟანი, კ., კასტელი, მ., ბერტოლინი, ა., 1985. ოქსიტოცინი აუმჯობესებს მამაკაცის ქოლეპტორულ მუშაობას ვირთაგვებში. Horm. იყავი. 19, 14- დან. არლეტი, რ., ბენელი, ა., ბერტოლინი, ა., 1990. დაბერების მამაკაცის ვირთაგვების სქესობრივი ქცევის სტიმულირება ხდება ოქსიტოცინის მიერ. E. J. ფარმაკოლი. 179, 377- დან. არლეტი, რ., კალზა, ლ., გიორდინო, ლ., ბენიელი, ა., კავაზზუტი, ე., ბერტოლინი, ა. სექსუალური იმპოტენცია უკავშირდება ოქსიტოცინის შემცირებას და ჰიპოთალამუსის პარავენენტულულ ბირთვში ოპიოიდური პეპტიდების გაზრდას. ნევროსი. ლეტ. 233, 65- დან. ბანილა, მ., გიულიანო, ფ., რამპინი, ო., ფოსტა, პ., ბრიზორგუილი, მ.ჯ., კლაუსი, ა., ვერგე, დ., 2002. მტკიცებულება პირდაპირი პროექციისათვის ჰიპოთალამუსის პარავენტრიკულური ბირთვიდან, ბირთვული პარაგიგანტეროლულური პროცესის სეროტონინერგულ ნეირონებს, რომლებიც ჩართულია ვირთხებში ერექციის კონტროლში. E. J. ნევროსი. 16, 1240- დან. Burnett, AL, Lowenstein, CJ, Bredt, DS, Chang, TSK, Snyder, SH, 1992. აზოტის ოქსიდი: კალციუმის ერექციის ფიზიოლოგიური შუამავალი. მეცნიერება, 257-401. Baskerville, TA, დუგლასი, AJ, 2008. ურთიერთქმედება დოპამინსა და ოქსიტოცინს შორის სექსუალური ქცევის კონტროლში. Prog. ტვინის რეს. 170, 277- დან. ბასერველი, ტა, ალარდი, ჯ., ვაიმანი, გ., დუგლასი, ა.ჯ., 2009. დოპამინ-ოქსიტოცინის ურთიერთქმედება კალციუმის ერექციაში. E. J. ნევროსი. 30, 2151- დან. ბენიელი, ა., ბერტოლინი, ა., პოგიოლიოლი, რ., კავაზზუტი, ე., კალზა, ლ., გიორდინო, ლ., არლეტი, რ. ნიტრიკ ოქსიდი ჩართულია მამაკაცის სექსუალური ქცევის ვირთაგვებში. E. J. ფარმაკოლი. 294, 505- დან. ბერნაბე, ჯ., რამპინი, ო., საჩესი, BD, ჯულიანო, ფ., 1999. ინტერაქვერნული ზეწოლა ვირთხებში ერექციის დროს: ტელემეტრიული ჩაწერის საფუძველზე ინტეგრაციული მიდგომა. ვარ. J. ფიზიოლი. 276, R441-R449. Bitner, RS, Nikkel, AL, Otte, S., Martino, B., Barlow, EH, Bhatia, P., Stewart, AO, Brioni, JD, Decker, MW, Moreland, RB, 2006. დოპამინი D4 რეცეპტორული სიგნალი ვირთაგვას პარავენტრიკულური ჰიპოთალამური ბირთვში: ბუნებრივი წარმოშობის მტკიცებულება, რომელიც გულისხმობს ადრეული გენის ინექციისა და მიტოგენის აქტიურ პროტეინ კინაზას ფოსფორილაციას. ნეიროფარმაკოლოგია 50, 521- დან. ბრაიონი, ჯ.დ., მოლდოვა, რ.ბ.კოვარტი, მ., ჰესი, გ.კ., სტიუარტი, ა.ო., ჰედლუნდი, პ., დონელი-რობერტსი, დ.ლ., ნააკანე, მ., ლინჩი 3.R., ჯ., კოლაზა, თ., პოლოკოვსკი , JS, Osinski, MA, Marsh, K., Andersson, KE, Sullivan, JP, 2004. დოპამინის D4 რეცეპტორების აქტივაცია ABT-724- ის მიერ იწყება კალციუმის რეციდირების ვირთაგვებში. Proc. Natl. აკად. მეცნიერება. ამერიკის შეერთებული შტატები 101, 6758- დან. Buijs, RM, 1978. ინტრა-და ჰიპოთალამური ვაზოპრესინის და ოქსიტოცინის გზების ვირთაგვებში. უჯრედის ქსოვილის რეს. 192, 423- დან. ბუიზი, რ., გეფარდი, მ., აუზი, CW, ჰორნმანი, EMD, 1984. სუპეროპური და პარავენენტულური ბირთვების დოფამინერგული ინერვაცია. მსუბუქი და ელექტრონული მიკროსკოპული კვლევა. ტვინის რეს. 323, 65- დან. კალდველი, JD, Prancis, AJ, Pedersen, CA, 1986. ოქსიტოცინი ხელს უწყობს ესტროგენის დამუშავებული ქალის ვირთხების სექსუალურ რეცეპტირებას. ნეიროპეპტიდები 7, 175-189. კამერონი, JL, პომერანტი, SM, ლეიდენი, LM, Amico, JA, 1992. ოქსიტოცინის კონცენტრაციის დოპინამერგიული სტიმულაცია მამრობითი და მდედრობითი მაიმუნების პლაზმში აპომორფინისა და D2 რეცეპტორების აგონისტების მიერ. J. Clin. ენდოკრინოლი. მეტაბ. 75, 855- დან. კანტერები, NS, Simerly, RB, Swanson, LW, 1995. AMYGADALA- ს მედიალური ბირთვის პროგნოზების ორგანიზება: PHAL კვლევა ვირთაგვებში. J. კომპ. Neurol. 360, 213- დან. კარმიიკელი, მესი, ჰუმბერტი, რ., დიქსენი, ჯ., პალმიშანო, გ., გრეილეფი, ვ., დევიდსონი, ჯ.მ. პლაზმური ოქსიტოცინი ადამიანის სექსუალურ რეაქციაში იზრდება. J. Clin. ენდოკრინოლი. მეტაბ. 64, 27- დან. კარტერი, CS, 1992. ოქსიტოცინი და სექსუალური ქცევა. ნევროსი. ბიობჰავა. Rev. 16, 131- დან. კარტერი, CS, ლედერჰედლერი, II, კირქპატიკი, ბ., XX. ინტერაქტიული ინტერაქტიული ნეირობიოლოგია, ნიუ-იორკის მეცნიერებათა აკადემიის ანალები, ტომი. 807. ნიუ-იორკის მეცნიერებათა აკადემია, ნიუ-იორკი. კასტელი, დეპუტატი, პარიზი, AP, მელიისი, თ., სუკუ, ს., სანა, ფ., მელიისი, მრ, კოლუ, ს., ენნა, მ.გ. დიასი, გ., მაკე, კ., არგოროასი, ა. , 2007. კარაბინიდური CB1 რეცეპტორები პარავენენტულულ ბირთვში და კალციუმის ერექციის ცენტრალური კონტროლი: იმუნოციტოტექემია, ავტოორგანიზაცია და ქცევითი კვლევები. ნეირომეცნიერებები 147, 197-206. ჩენ, კ.კ., ჩანგი, LS, 2003. ამონიუმის მჟავას რეცეპტორების აგონისტების გავლენა კალციუმის რეციდივებზე ჰიპოთალამუსის პარავენენტულულ ბირთვებში შეყვანის შემდეგ. J. Urol. 62, 575- დან. ჩენი, კ.კ., ჩან, ჯეიჰ, ჩანგი, ლ., ჩენ, მ.ტ., შანხაი, შჰი, 1992. ზრდის ჰიპოკამპალური ფორმირების გააქტიურების შემდეგ კალციუმის გაცხელება. ნევროსი. ლეტ. 141, 218- დან. ჩენ, კ.კ., ჩან, ჯეიჰ, ჩანგი, ლ., 1999. ჰიპოთალამუსის პარავენენტულულ ბირთვზე დოპინამერგულმა ნეიროტრანსმიმაცია ვირთაგვებში კალციუმის რეციდირების ცენტრალურ რეგულაციაში. J. Urol. 162, 237- დან. კოლინზი, GT, ტრიკონი, ა., ჰაჯი-აბდი, F., ნიუმან, AH, გრუნდტი, P., რაისი, KC, Husbands, SM, ხარკი, BM, ენგუჰარდ-გუიფერი, C., გუიფერი, ა. , ჯ., ვანგი, ს., კეტზი, ჯლ, გრანდი, დ.კ., სუნაჰარა, რკ, ვუდსი, ჯ.ჰ. დოპამინის პროტოქსიკური ეფექტები D2- ის მსგავსი აგონისტები შუამავლებსა და თაგვებში D3 რეცეპტორებით შუაგულნი არიან. J. ფარმაკოლი. Exp. Ther. 329, 210- დან. Coolen, LM, Allard, J., Truitt, WA, McKenna, KE, 2004. ეაკულაციის ცენტრალური რეგულირება. ფიზიოლი. იყავი. 83, 203- დან. Cui, SS, Bowen, RC, Gu, GB, Hannesson, BK, Yu, PH, Zhang, X., X. ლითუმის მიერ კანზავოიდური გამოსვლის სინდრომის პრევენცია: ოქსიტოცინირების ნეირონთა აქტივაციის ჩართვა. J. ნევროსი. 21, 9867- დან. დჰლსტრომი, ა., ფიქსი, კ., 1964. ცენტრალური ნერვული სისტემაში მონოამინის შემცველი ნეირონების არსებობის მტკიცებულება. I. მონოსნობის დემონსტრირება ტვინის ნეიტრონების საკანში ორგანოებში. ფიზიკა ფიზიოლი. სკანდი 62 (Suppl. 232), 1-54. დეპოორდერი, რ., ბარდინი, ლ., როდრიგუსი, მ., აბრილერი, ე., ალიგა, მ., ნიუმან-ტარკრედი, ა. კალციუმის რეაქციები და გამონაყარი გამოწვეული Dopamine D2 მსგავსი რეცეპტორების agonists ვირთხებში: შებოჭვის გავლენა და დოპამინის შენატანი D2, მაგრამ არა D3 და D4 რეცეპტორები. იყავი. ფარმაკოლი. 20, 303- დან. დომენები, გ., ჰაინრიხსი, მ., ბუჩელი, C., ბრაუსი, DF, ჰერპერტსი, SC, 2007. ოქსიტოცინი პასუხობს ამაღელლას პასუხებს ემოციური სახეების მიმართ, მიუხედავად იმისა, ბიოლი. ფსიქიატრია 62, 11871190. დომინგუზი, ჯ. რიოოო, ჯ.ვ.ვ., ჟუ, ზ., ჰოლი, მე, მე. რეგულაცია მედიალური ამგეგალას მიერ კოპულაციის და მედიალური პრეოპტიკური დოპამინის გათავისუფლების გზით. J. ნევროსი. 21, 349- დან. დონალდსონი, ზრ, ახალგაზრდა, LJ, 2009. ოქსიტოცინი, ვასოპრესინი და სოციუმობის ნეიროგენეტიკები. მეცნიერება, 322-900. Eaton, RG, Markowski, VF, Lumley, LA, ტომპსონი, JT, მოსე, ჯ., Hull, EM, 1991. პანორენციულ ბირთვში დიამეტრი რეცეპტორები არეგულირებენ გენიტალური რეაქციებს და მამაკაცების ვირთაგვებში. ფარმაკოლი. Biochem. იყავი. 39, 177- დან. ებნერი, კ., ბოშჩი, ო.ჟ., კრომერი, ს.ა.საუველდი, ნ. ნეიმანი, ID, 2005. ოქსიტოცინის გათავისუფლება ღამის ცენტრალურ ამღადალებში მოდიფიცირებულია სტრესის შემსუბუქების ქცევასა და ამინომჟავების გამონაბოლქვის გათავისუფლებაზე. ნეიროფსიქოფარმაკოლოგია 30, 223-230. ენგუჰარდ-გუიფიერი, გ., ჰუფნერი, ჰ., ელ ჰაკმაუი, ა, ალუჩი, ჰ., გმეინერი, პ., არგოლიასი, ა., მელიისი, მრ, გუჩიერი, ა. 2 - [(4-Phenylpiperazin-1-yl) methyl] imidazo (di) ცისფერი შერჩევითი D4-ligands. კალციუმის ერექციის ინდუქცია 2- (4- მეტოქსიფენილი) piperazin-2-ylmethyl imidazo [1-a] pyridine (PIP1,2EA), ძლიერი და შერჩევითი აგონისტი. J. Med. Chem. 49, 3938- დან. ევერიტი, BJ, 1990. სექსუალური მოტივაცია: ნორმალური და ქცევითი ანალიზი მექანიზმები, რომლებიც ფუძემდებლური და კოპულაციური რეაგირების სქესის ვირთაგვებშია. ნევროსი. ბიობჰავა. Rev. 14, 217- დან. ფიბიგერი, HC, ფილიპსი, AG, 1988. მეზოსტოკოლიმბმიური დოპამინის სისტემა და ჯილდო. Ann. N. Y. აკად. მეცნიერება. 5, 206- დან. ფრანგული, ს.ჯ., ტოტერდელი, ს., ინდივიდუალური ბირთვი accumbens-projection ნეირონების მიიღებს ორივე basolateral amygdala და ventral subicular afferents in rats. ნეირომეცნიერებები 119, 19-31. 954 MR მელიისი, ა. არგოროლას / ნეირომეცნიერებისა და ბიოეაბოლური მიმოხილვები 35-2011 Freund-Mercier, MJ, რიჩარდ, P., 939. ოქსიტოცინის ინტრავენტრიკულური ინექციების გამონაყარი ეფექტი რძის გამონაბოლქვის რეფლექსზე. ნევროსი. ლეტ. 23, 193- დან. ფრონდ-მერსიერი, MJ, რიჩარდ, P., 1984. ოქსიტოცინის ნეირონების ხელსაყრელი კონტროლისთვის ელექტროფიზიოლოგიური მტკიცებულებები ოქსიტოცინით ვირთხში suckling დროს. J. ფიზიოლი. (ლონდონი.) 352, 447- დან. ფრონდ-მერსიერი, MJ, Stoeckel, ME, 1995. სომატოდედრიტული ავტოტექტოპტორები ოქსიტოცინის ნეირონების შესახებ. In: Ivell, რ, Russel, JA (ედსი), ოქსიტოცინი, ფიჭური და მოლეკულური მიდგომა მედიცინაში და კვლევაში. Adv. Exp. Med. ბიოლი., 365. პლენუმი პრესა, ნიუ იორკი და ლონდონი, გვ. 185-194. ფრონდ-მერსიერი, MJ, Stoeckel, ME, Palacios, JM, Pazos, JM, რიჩარდ, PH, Porte, ა. ფარმაკოლოგიური თვისებები და 3H ოქსიტოცინის სავალდებულო ადგილების ანატომიური განაწილება Wistar რატ ტვინში, რომელიც სწავლობდა ავტორადოგრაფიას. ნეირომეცნიერებები 20, 599-614. ჯულიანო, ფ., რამპინი, ო., 2000. Penile ერექციის ცენტრალური კონტროლი. ნევროსი. ბიობჰავა. Rev. 24, 517- დან. ჯულიანო, ფ., ალარდი, ჯ., 2001. დოპამინი და სექსუალური ფუნქცია. Int. J. გაღიზიანება Res. 13 (Suppl. 3), 18-28. ჯულიანო, ფ., რამპინი, ო., 2004. ერექციის ნერვული კონტროლი. ფიზიოლი. იყავი. 83, 189- დან. ჯულიანო, ფ., ბერნაბე, ჯ., მაკკენა, კე, ლოგგვუვი, ფ., რამპინი, ო., 2001. ოქსიტოცინის ზურგის პროლექტული ეფექტი ანესთეზირებული ვირთაგვებში. ვარ ჯ ფიზიოლი. რეგულაცია. ინტეგრაცია. კომპ. ფიზიოლი. 280, R1870-R1877. გოტო, ი., გრეისი, ა, ი. ბირთვული და კორტიკალური დიკამინირების დოფამინერგული მოდულაცია მიზნად ორიენტირებული ქცევის დროს. Nat. ნევროსი. 8, 805- დან. ჰოთნორნი, ჯ., ანგლი, ვითი, ჯენკინსი, ჯ. ჰიპოთალამური პარავენტრიკულური, სუპეროპტიკური და სუპრიმიზმული ბირთვების დაზიანების შედეგები ვასოპრესინისა და ოქსიტოცინის დროს რათ ტვინისა და ზურგის ტვინში. ტვინის რეს. 346, 51- დან. მარინე, LJ, მურაგისი, MA, Piercey, MF, Nichols, NF, Schreur, PJ, სმიტი, MW, მთვარე, MW, XI, ჰაერი, RF, Dolak, LA, Duncan, JN, Hyslop, DK, Lipton, MF, სინთეზი და ბიოლოგიური აქტივობა (R) -5,6- დიჰიდრო- N, N-dimethyl-4H-imidazo [4,5,1-ij] quinolin-5-amine) და მისი მეტაბოლიტები. J. Med. Chem. 40, 639- დან. Hsieh, GC, Hollingsworth, PR, Martino, B., Chang, R., Terranova, MA, O'Neill, AB, Lynch, JJ, Moreland, RB, Donnelly-Roberts, DL, Kolasa, T., Mikusa, JP , McVey, JM, Marsh, KC, Sullivan, JP, Brioni, JD, 2004 წ. ცენტრალური მექანიზმები, რომლებიც რეგენერაციის მეთოდებზე რეგენერაციას ახორციელებენ: დოპამინერგული სისტემები apomorphine- ის პრორექტქციული ეფექტისადმი. J. ფარმაკოლი. Exp. Ther. 308, 330- დან. ჰუანგი, PL, Dawson, TM, Bredt, DS, Snyder, SH, Fishman, MC, X. ნეირონარული აზოტის ოქსიდის სინთეზის გენის მიზანმიმართული დარღვევა. უჯრედი 75, 1273-1286. ჰუბერი, დ., ვეინანტი, პ., სტოპი, რ., 2005. ვოსეპრესინი და ოქსიტოცინი ახდენენ ცენტრალური ნეიგიდალაში ნეირონურ პოპულაციებს. მეცნიერება, 308-245. Hull, EM, Warner, RK, Bazzett, TJ, Eaton, RC, Thompson, JT, 1989. D2 / D1 კოეფიციენტი მედიალური პრეოპტიკური ნაწილში მოქმედებს მამრობითი ვირთხების კოპულაციაში. J. ფარმაკოლი. Exp. Ther. 251, 422- დან. Hull, EM, Du, J., Lorrain, DS, Matuszewich, L., 1995. ექსტრა-ფიჭური დოპამინი მედიალური პრეოპტიკური ნაწილში: სექსუალური მოტივაციისა და ჰორმონალური კონტროლის სპოპეტური კონტროლი. J. ნევროსი. 15, 7465- დან. Hull, EM, Meisel, RL, Sachs, BD, 2002. მამრობითი სქესობრივი ქცევა. In: Pfaff, DW, არნოლდ, AP, Etgen, AM, Fahrbach, SE, რუბინი, RT (ედსი), ჰორმონები, ტვინი და ქცევა. აკადემიური პრესა, ნიუ-იორკი, გვ. 3-137. მ.კ., დაგიბეკი, ი., გალინატი, ჯ., ვაგნერი, მ., მაიერი, ვ., კანდრიკი, KM, 2010. ოქსიტოცინი ხელს უწყობს ამაღელდაზე დამოკიდებულ, სოციალურად გაძლიერებულ სწავლებას და ემოციურ თანაგრძნობას ადამიანებში. J. ნევროსი. 30, 4999- დან. ივერი, რ., რასელი, ჯ.ა., 1995. ოქსიტოცინი: ფიჭური და მოლეკულური მიდგომა მედიცინაში და კვლევაში. მიღწევები ექსპერიმენტულ მედიცინაში და ბიოლოგიაში, ტომი. 395. პლენუმი პრესა, ნიუ-იორკი. კელი, AE, დომესკი, VB, 1982. ჰიპოკამპალური ფორმირების პროგნოზირება ბირთვში აჩქარებს: ანტეროგრადი და რეტროგრადულ-ჰერერაცირესი პეროქსიდაზის კვლევა. ნეირომეცნიერებები 7, 2321-2335. კიმურა, ი., ნეითუ, ი., ვანიბუჩი, ფ., იამაგუჩი, თ., 2008. 5-HT (2C) რეცეპტორების აქტივაცია არის ატომორფინის, ოქსიტოცინისა და მელანოტან-II II ვირუსების პრორექტული ეფექტის საერთო მექანიზმი. E. J. ფარმაკოლი. 589, 157- დან. კონდო, ი., საჩესი, ბიდი, საქუა, ი. მედიალური ამიგდალის მნიშვნელობა წითელი კალციუმის ერექციის დროს გამოწვეული შორეული სტიმულებით გამოწვეული ქალებისგან. იყავი. ტვინის რეს. 91, 215- დან. კოვუკსი, გელი, სარანია, ზ., სოფო, გ., 1998. ოქსიტოცინი და დამოკიდებულება: მიმოხილვა. ფსიქოროეენდოკრინოლოგია 23, 945-962. ლი, HJ, მაკბეტი, AH, Pagani, JH, Scott Young 3rd, W., 2009. ოქსიტოცინი: სიცოცხლის დიდი ხელშემწყობი. Prog. ნეირობიოლი. 88, 127- დან. ლინდვალი, ო., ბიორგლუნდი, ა., სკაგერგერგი, გ., 1984. დოპამინის ტერმინალის სისტემების შერჩევითი იზოტექნიკური დემონსტრირება რათ-დიელსა და ტელენცეფალოში: ჰიპოთალამური ნეიროცეცეკრიმენტული ბირთვების დოპინამიური ინერვაციის ახალი მტკიცებულებები. ტვინის რეს. 306, 19- დან. ლიუ, YC, სალამონი, JD, Sachs, BD, 1997. ჰიპოთალამუსის პარავტენტულულ ბირთვში მამაკაცის ვირთაგვებში აღინიშნება სექსუალური რეაქცია. იყავი. ნევროსი. 111, 1361- დან. ლორბერი, ს., ცამამერი, ნ., ჰებნერი, ჰ., მელიისი, მრ, არგოლიასი, ა., გერმერი, გვ. ასულიანი ჩარჩო, როგორც რომანის ბიოეზერტერა: ძლიერი დოფამინის დიზაინი, რეცეპტორების ლიგონების პროდიუსერი penile rerection. Chem. Med. Chem. 4, 325- დან. McCleskey, EW, Fox, AP, Feldman, DH, კრუზი, LJ, ოლივერა, BM, Tsien, RW, Yoshikami, D., 1987. _-კონოტოქსინი: ნეირონების სპეციფიური ტიპის კალციუმის არხების პირდაპირი და მუდმივი ბლოკადა, მაგრამ არა კუნთში. პრო. Nat. აკად. მეცნიერება. ამერიკის შეერთებული შტატები 84, 4327- დან. McKenna, KE, 2000. ზოგიერთ წინადადებას სასჯელაღსრულების სისტემის ცენტრალური ნერვული სისტემის კონტროლის შესახებ. ნევროსი. ბიობჰავა. Rev. 24, 535- დან. მარსონი, ლ., მაკკენა, კეი, 1992. როლი 5- ჰიდროქსიტრიპტამპინის როლი ზურგის სექსუალური რეფლექსების დათრგუნვისას. Exp. ტვინის რეს. 88, 313- დან. მარსონი, ლ., მაკკენა, კეი, 1996. ცნს-ის უჯრედების ჯგუფები, რომლებიც ჩართულნი არიან ისიციოკავარნოსოზისა და ბლბოჩონგოსოუს კუნთების კონტროლზე: ტრანსნეორონალური კვლევა ფსევდორაბების ვირუსის გამოყენებით. J. კომპ. Neurol. 374, 161- დან. Meisel, RL, Sachs, BD, 1994. მამაკაცის სექსუალური ქცევის ფიზიოლოგია. In: Knobil, E., ნილ, ჯ (ედსი), რეპროდუქციის ფიზიოლოგია, ტ. 2, მეორე გამოცემა. რავენ პრესა, ნიუ-იორკი, გვ. 3-96. მელინი, პ., კიჰლსტრომი, JE, 1963. ოქსიტოცინის გავლენა სექსუალურ ქცევებზე მამრობითი კურდღლებზე. ენდოკრინოლოგია 73, 433-435. მელიისი, მრ, არგოლიასი, ა., მე -3. დოპამინი და სექსუალური ქცევა. ნევროსი. ბიობჰავა. Rev. 19, 19- დან. მელიისი, მრ, არგოლიასი, ა., 1995b. ნიტრიკ ოქსიდის დონორები იწვევენ კალციკულური ერექციისა და იონების დროს, როდესაც ინტრავენური ღვიძლის ცენტრალურ ნერვულ სისტემაში ინექცია. E. J. ფარმაკოლი. 294, 1- დან. მელიისი, მრ, არგოლიასი, ა., 2003. ცენტრალური ოქსიოტექნიკური ნეიროტრანსმიმიზაცია: პრეპარატის მიზნობრივი პისტოგენური ერექციული დისფუნქციის თერაპია. კურსორი წამლის სამიზნეები, სამთო მელიისი, მრ, არგოლიასი, ა., გესსა, გლ, 1986. ოქსიტოცინით გამოწვეული იონინგი და კალციუმის ერექცია: ტვინის მოქმედების საიტი. ტვინის რეს. 398, 259- დან. მელიისი, მრ, არგოლიასი, ა., გესსა, გლ, 1987. Apomorphine გამოწვეული yawning და penile rerection: საიტის აქცია ტვინის. ტვინის რეს. 415, 98- დან. მელიისი, მრ, არგოლიასი, ა., გესსა, გლ, ჯუნს. ალომარფინი ზრდის პლაზმურ ოქსიტოცინის დონეს. ნევროსი. ლეტ. 98, 351- დან. მელიისი, MR, არგოლიასი, ა., გესსა, გლ, 1989b. მტკიცებულება, რომ apomorphine იწვევს penile erection და yawning გათავისუფლების ოქსიტოცინის ცენტრალურ ნერვულ სისტემაში. E. J. ფამაკოლი. 164, 565- დან. მელიისი, მრ, არგოლიასი, ა., სტანპამბიანო, რ., გესსა, გლ, ჯუმბერ. ოქსიტოცინის კონცენტრაციის აპომოფინის ეფექტი სხვადასხვა ტვინში და მამრობითი ვირთხების პლაზმში. E. J. ფარმაკოლი. 182, 101- დან. Melis, MR, Mauri, ა, Argiolas, ა, 1994. აპომორფინი- და ოქსიტოცინით გამოწვეული penile erection და yawning in ხელუხლებელი და კასტრირებული მამრობითი ვირთხები: ეფექტი სექსუალური სტეროიდების. ნეიროენდოკრინოლოგია 59, 349-354. Melis, MR, Stancampiano, R., Argiolas, ა, 1994b. პარავენტრიკულური NMDA ინექციების მიერ გამოწვეული სპინალური ერექცია და გამონაყარი აქტიურია ოქსიტოცინის მიერ. ფარმაკოლი. Biochem. იყავი. 48, 203- დან. Melis, MR, Stancampiano, R., Argiolas, ა, 1994c. პრეპარატი ატომორფინისა და ოქსიტოცინის ინდუცირებული penile ერექციისა და yawning of NG-nitro-l-arginine methyl ester- ის მიერ: ტვინის მოქმედების ადგილი. ფარმაკოლი. Biochem. იყავი. 48, 799- დან. Melis, MR, Succu, S., Argiolas, ა, 1996. დოპამინ აგონისტები ჰიპოთალამუსის პარავენენტულულ ბირთვებში ნიტრიკ ოქსიდის წარმოქმნას ზრდის: კორელაცია კალციუმის ერექციისა და იოანესით. E. J. ნევროსი. 8, 2056- დან. Melis, MR, Succu, S., Iannucci, U., Argiolas, ა, 1997. ოქსიტოცინი ზრდის ნიტრიკ ოქსიდის წარმოებას ჰიპოთალამუსის პარავენენტულულ ბირთვში: კორელაცია კალციუმის ერექციისა და იოანგით. რე. პეპტიდები, 69-105. Melis, MR, Succu, S., Mauri, ა, Argiolas, ა, 1998. ნიტრიკ ოქსიდის წარმოება გაიზარდა მამრობითი ვირთხების ჰიპოთალამუსის პარავენენტულულ ბირთვში არასასურველი კალციუმის ეერენციებისა და კოპულაციის დროს. E. J. ნევროსი. 10, 1968- დან. Melis, MR, Spano, MS, Succu, S., Argiolas, ა., XX. ოქსიტოცინის ანტაგონისტი D (CH2) 5TY (Me) 2-ORN8- ვასტოციკინი ამცირებს არაკონსულტაციურ penile erections მამრობითი ვირთხებში. ნევროსი. ლეტ. 265, 171- დან. Melis, MR, Succu, S., Spano, MS, Argiolas, ა, 1999b. ჰიპოთალამუსის პარავავრიკულური ბირთვში მორფინი იწვევს არასასურველ რეაქციებს და ხელს უშლის კოპულაციას: აზოტის ოქსიდის ჩართვა. E. J. ნევროსი. 11, 1857- დან. Melis, MR, Spano, MS, Succu, S., Argiolas, ა, X. ექსცენტრიული ამინომჟავის, დოპამინის და ოქსიტოცინის რეცეპტორების ანტაგონისტების ეფექტი არასასურთო პენილეტის გამონაბოლქვებში და პარავენენტკულარულ ნიტრიკ ოქსიდის წარმოებაში მამრობითი ვირთხებში. იყავი. ნევროსი. 114, 849- დან. მელიისი, მრ, სუკუ, ს., მუსია, მ., კორტი, ლ., არგოლიასი, ა. ექსტრა-ფიჭური დოპამინი იზრდება მამრობითი ვირთხების პარავენტულულ ბირთვში სექსუალური აქტივობის დროს. E. J. ნევროსი. 17, 1266- დან. Melis, MR, Succu, S., Mascia, MS, Argiolas, ა, 2004. კანაფინოიდული CBXNUM რეცეპტორების ანტაგონისტი მამრობითი ვირთხების პარავენენტულულ ბირთვში იწვევს პენილეულ ერექციას. ნევროსი. ლეტ. 359, 17- დან. Melis, MR, Succu, S., Mascia, MS, კორტი, L., Argiolas, ა, 2004b. ექსტრა-ფიჭური სადღეღამისო ამინომჟავები სექსუალური აქტივობის დროს მამრობითი ვირთხების პარავენენტულულ ბირთვში იზრდება: NMDA რეცეპტორების მთავარი როლი Erectile ფუნქციაში. E. J. ნევროსი. 19, 2569- დან. Melis, MR, Succu, S., Mascia, MS, Argiolas, ა, 2005. PD-168,077, სელექციური დოპამინი D4 რეცეპტორების აგონისტი, იწვევს მამრობითი ვირთხების პარავტენტულულ ბირთვში შეყვანისას პენიმური ერექციის. ნევროსი. ლეტ. 379, 59- დან. მელიისი, მრ, სუკუ, ს., მუსია, მ., სანა, ფ., მელიისი, თ., სუკუ, ს., კასტელი, დეპუტატი, არგოლიასი, ა. SR 141716A- ინდუცირებული penile ერექცია მამრობითი ვირთხებში: პარავენტრიკულური გლუტამაზმის მჟავა და აზოტის ოქსიდის ჩართვა. ნეიროფარმაკოლოგია 50, 219- დან. მელისი, მრ, სუკუს, ს., სანა, ფ., მაშია, მ., მელიისი, თ., ენგუჰარდ-გუიფიერი, გ., ჰუბნერი, ჰ., გემენიე, პ., გუიფიერი, ა., არგოლიასი, ა. 2006b. PIP3EA და PD168077, ორი შერჩევითი დოპამინი D4 რეცეპტორების agonists, გამოიწვიოს penile ერექციის მამრობითი rats: საიტი და მექანიზმი მოქმედების ტვინის. E. J. ნევროსი. 24, 2021- დან. Melis, MR, Melis, T., Cocco, C., Succu, S., Sanna, F., Pillolla, G., Boi, ა, Ferri, GL, Argiolas, ა, 2007. ოქსიტოცინი გააქტიურდება ვენტრალურ თერაპიულ ზონაში, იწვევს კალციუმის გაცხელებას და ზრდის დამატებით ფიჭურ დოპამინს ბირთვში. მელიისი, ა. არგოროლას / ნეირომეცნიერებისა და ბიოეაბოლური მიმოხილვები 35-2011 939 და მამრობითი ვირთხების ჰიპოთალამუსის პარავენტრიკულური ბირთვი. E. J. ნევროსი. 26, 1026- დან. Melis, MR, Sanna, F., Succu, S., Zarone, P., Boi, ა, Argiolas, ა, 2009. ოქსიტოცინის როლი მამრობითი ვირთაგვების ქცევის წინასწარმეტყველებისა და პრეპარატის ფაზებზე. In: Jastrow, H., Feuerbach, დ (Eds.), ოქსიტოცინის კვლევის სახელმძღვანელო: სინთეზი, შენახვისა და გათავისუფლება, აქციები და ნარკოტიკების ფორმები. ნოვა პუბლიუსები ინ., ნიუ-იორკი, აშშ, გვ. 109-125. Melis, MR, Succu, S., Sanna, F., Boi, ა, Argiolas, ა, 2009b. ოქსიტოცინი გააქტიურდება ვენტრალურ სუბკულუმში ან ამღალდალის პოსტრმემედიალური კორტიკული ბირთვი, რომელიც იწვევს კალციუმის ერექციას და ზრდის უჯრედულ დოპამინს მამაკაცის ვირთხებში. E. J. ნევროსი. 30, 1349- დან. Melis, MR, Succu, S., Cocco, C., Caboni, ე, Sanna, F., Boi, ა, Ferri, GL, Argiolas, ა, 2010. ოქსიტოცინი იწვევს წვრილ ნაწილში ვენტილაციის სუბკულუმში გაჟღენთვას: ნატრიკული ოქსიდისა და გლუტმული მჟავების როლს. ნეიროფარმაკოლოგია 58, 1153- დან. შანხაი, რ., უჩიჩი, მე, ტარანოვა, მაგისტრალი, გუბინები, ეჯ, ჰელფრიხი, რ.ჯ., ნამოვიჩი, მ.ტ., ელ-კუჰენი, OF, სამაგისტრო, JN, Brioni, JD, 2004. ადამიანის დოპამინის D (2) შედარებითი ფარმაკოლოგია - რეცეპტორის სტაბილური უჯრედის ხაზების მსგავსად, კალციუმის ნაკადი გალაფა (QX5). Biochem. ფარმაკოლი. 68, 761- დან. Moos, F., Freund-Mercier, MJ, Guerne, Y., Guerne, JM, Stoeckel, ME, რიჩარდ, P., 1984. ოქსიტოცინისა და ვასოპრესინის გათავისუფლება მაგნელოლულური ბირთვების მიხედვით ვიტროში: ოქსიტოცინის სპეციფიური ხელსაწყო ეფექტი საკუთარი გათავისუფლებისას. J. ენდოკრინოლი. 102, 63- დან. მერფი, მრ, სეკელი, ჯ., ბარტონი, ს., ჩეკილი, SA, Lightman, SL, 1987. ოქსიტოცინისა და ვაზოპრესინის სეკრეციის ცვლილებები მამაკაცებში სექსუალური აქტივობის დროს. J. Clin. ენდოკრინოლი. მეტაბ. 65, 738- დან. ნიშიმორი, კ., ახალგაზრდა, ლ.ჯ., გუ, ქ., ვანგი, ზ., ინელი, TR, მაცუკი, MM, 1996. ოქსიტოცინი საჭიროა საექთნოსათვის, მაგრამ არ არის აუცილებელი პრეპარატის ან რეპროდუქციული ქცევისათვის. Proc. Natl. აკად. მეცნიერება. ამერიკის შეერთებული შტატები 93, 11699- დან. პეტელი, ს., ფრედმენი, ს., ჩპმანი, კლემი, ემსი, ფ., ფლეტჩერი, ა.ე., ნოულსი, მ., მარვუდი, რ., მკალისტერი, გ. მიერსი, ჯ., კურტისი, ჯ. კულაგოვსკი, JJ, Leeson, PD, Ridgill, M., Graham, M., Matheson, S., Rathbone, D., Watt, AP, Bristow, LJ, Rupniak, NM, Baskin, E., Lynch, JJ, Ragan, CI , 1997. ბიოლოგიური პროფილი L745,870, შერჩევითი ანტაგონისტი მაღალი affinity for dopamine D4 რეცეპტორი. J. ფარმაკოლი. Exp. Ther. 283, 636- დან. პედერასონი, CA, კალდველი, JD, ჯირკოვსკი, GF, Insel, TR, 1992. ოქსიტოცინი დედათა, სექსუალურ და სოციალურ ქცევებში, ნიუ-იორკის მეცნიერებათა აკადემიის ანალები, ტომი. 652. ნიუ-იორკის მეცნიერებათა აკადემია, ნიუ-იორკი. პეტროვიკი, პ., კალიში, რ., მომღერალი, თ., დოლანი, რ.ჯ. ოქსიტოცინი აუმჯობესებს განპირობებული სახეებისა და ამიგდალის აქტივობის ეფექტურ შეფასებას. J. ნევროსი. 28, 6607- დან. პაფუა, ჯ.გ., ევერტიტი, ბ.ჯ., 1995. სექსუალური ქცევის psychopharmacology. In: Knobil, FE, Kupfer, DJ (Eds.), Psychopharmacology: პროგრესის მეოთხე თაობა. რავენ პრესა, ნიუ-იორკი, გვ. 742-758. რაჟფერი, ჯ., არონსონი, ჯეი, ბუში, პაი, დორი, ფ.ჯ., იგნარრო, ლ.ჯ. არატრადიციული, არაქოლინერგული ნეიროტრანსმიმირების საპასუხოდ კორპუსის კავეროზუმის რელაციის შუამავლად ნიტრიკ ოქსიდი. N. ენგლი J. Med. 326, 90- დან. Roeling, TAP, ვან Erp, AMM, Meelis, W., Kruk, MR, Veening, JG, 1991. NMDA- ს ქცევის ეფექტი ვიტამინის ჰიპოთალამური პარავენტრიკულური ბირთვში. ტვინის რეს. 550, 220- დან. საჩესი, BD, 1997. Erection გამოიწვია მამრობითი ვირთხები მიერ სადესანტო სუნი ეგზოტიკური ქალები. ფიზიოლი. იყავი. 62, 921- დან. საჩესი, BD, 2000. კონცეპტუალური მიდგომები ფიზიოლოგიის და ერექციული ფუნქციის კლასიფიკაციის, ერექციული დისფუნქციისა და სექსუალური უკმარისობის შესახებ. ნევროსი. ბიობჰავა. Rev. 24, 541- დან. საჩესი, BD, 2007. მამაკაცური სქესობრივი აღშფოთების შინაარსობრივი განმარტება. Horm. იყავი. 51, 569- დან. სანჩესი, ფ., ალონსო, ჯ., არველალო, რ., ბლანკო, ე., აიონი, ჯ., ვაზკესი, რ., 1994. NADPH-diaphorase- ის თანაფარდობა ვაზოპრესინისა და ოქსიტოცინთან ერთად ვირთაგვის ჰიპოთალამური მაგნელოლულური ნეიროცეკრეკის ბირთვებში. უჯრედის ქსოვილის რეს. 276, 31- დან. Sanna, F., Succu, S., Boi, ა, Melis, MR, Argiolas, ა, 2009. Phosphodiesterase type 5 ინჰიბიტორები ხელს უწყობენ არაკონტაქტურ erections მამრობითი ვირთხებში: ტვინის მოქმედების საიტი და მოქმედების მექანიზმი. J. სექსი. Med. 6, 2680- დან. საფიერი, დ., ფელდმანი, ს., 1987. პარპენენტრიური ბირთვის ნეირონების დროს სეპტალის და ჰიპოკამპალური სტიმულის ეფექტები. ნეირომეცნიერებები 20, 749-755. სატო-სუზუკი, ი., ქიტა, ი., ოგური, მ., არიტა, ჰ., 1998. სტერეოტიპული იონური რეაქციები გამოწვეული ვირთხის პარავენენტულულ ბირთვებში ელექტრო და ქიმიური სტიმულაციით. J. ნეიროფიზიოლი. 80, 2765- დან. შუმანი, EM, მედისონი, DV, 1994. ნატრიკული ოქსიდი და სინაფსური ფუნქცია. Ann. Rev. ნევროსი. 17, 153- დან. Snyder, SH, 1992. აზოტის ოქსიდი: პირველი ნეიროტრანსმიტერების ახალ კლასში? მეცნიერება, 254-494. Sofroniew, MV, 1983. ვაზოპრესინი და ოქსიტოცინი ძუძუმწოვრებისა და ზურგის ტვინში. ტენდენციები ნევროსი. 6, 467- დან. სოკოლოფი, პ., შვარცი, ჯ.კ., 1995. დელამინის რეცეპტორების ნახევარი ათწლეულის შემდეგ. ტენდენციები ფარმაკოლი. მეცნიერება. 16, 270- დან. სამხრეთი, ე., გარტვატი, ჯ., 1993. აზოტის ოქსიდის- ციკლური GMP სიგნალიზაციის გზა, რათ ტვინში. ნეიროფარმაკოლოგია 32, 1267- დან. Stancampiano, რ., მელიისი, MR, არგოლიასი, ა., 1994. მამაკაცის ვირთაგვებში 5-HT1 აგონისტების მიერ გამოვლენილი სპინალური ერექცია და გაღიზიანება: დიპამინერგული და ოქსიტოცინერგენური გადაყვანა. E. J. ფარმაკოლი. 261, 149- დან. სუკუ, ს., მაუსია, მ., სანა, ფ., მელიისი, თ., არგოლიასი, ა., მელიისი, მრ, 2006. კანაბაინიდური CB1 რეცეპტორების ანტაგონისტი SR 141716A იწვევს კალციუმის რეაქციას, რომელიც ზრდის დამატებით ფიჭურ გლუტამაზმ მჟავას მამრობითი ვირთხების პარავენენტულულ ბირთვში. იყავი. ტვინის რეს. 169, 274- დან. სუკუ, ს., სანა, ფ., მელიისი, თ., ბოი, ა., არგოლიასი, ა., მელიისი, მრ, 2007. დოპამინის რეცეპტორების სტიმულაცია მამრობითი ვირთხების ჰიპოთალამუსის პარავენენტულულ ბირთვებში პენიალური ერექციის იდენტიფიცირებაში და ზრდის ბირთვულ დოპამინს ბირთვში: ცენტრალური ოქსიტოცინის ჩართვა. ნეიროფარმაკოლოგია 52, 1034- დან. სუკუ, ს., სანა, ფ., კოკო, C., მელიისი, თ., ბოი, ა., ფრირი, გელი, არგოლიასი, ა., მელიისი, მრ, 2008. ოქსიტოცინი იწვევს პენიტენციურ ერექციას, როდესაც გააქტიურებულია მამრობითი ვირთხის ვენტრალური თხრილის არეში: აზოტის ოქსიდის და ციკლური გმპის როლი. E. J. ნევროსი. 28, 813- დან. ტანდა, გ., პონტიერი, ფეე, დი გირა, გ., 1997. მენოლიმბური დოპამინის ტრანსმისიის კარბინოიდები და ჰეროინის აქტივაცია საერთო ოქსოიდური რეცეპტორების მექანიზმის მიერ. მეცნიერება, 276-2048. ტანგი, ი., რამპინი, ო., კალასი, ა., ფაჩინეტი, ფ., გიულიანო, ფ., 1998. გამოვლენილი lumbosacral ბირთვების ოქსიტოცინერგული და სეროტონინერგური ინერვაცია მამაკაცის ვირთაგვებში პენსილურად ჩატარების კონტროლი. ნეირომეცნიერებები 82, 241-254. თეოდოზი, DT, 1985. ოქსიტოცინი-იმუნორატიული ტერმინალები შპრიცული ბირთვების ოქსიტოცინის ნეირონებზე გადანაწილება. ბუნება (ლონდონი) 313, 682-684. თინდალი, ჯ. სტიმული, რომელიც იწვევს ოქსიტოცინის გათავისუფლებას. In: Geiger, SR, Knobil, E., Sawyer, WH, Greef, R., Astwood, EB (ედსი), ფიზიოლოგიის სახელმძღვანელო. სექცია 7, ენდოკრინოლოგია, ტ. IV. ამერიკული ფიზიოლოგიის საზოგადოება, ვაშინგტონი DC, გვ. 257-267. ტორესი, გ., ლი, ს., რივარი, C., 1993. ნეიროპეპტიდების ვირთაგვის ჰიპოთალამური ნიტრიკ ოქსიდის სინთეზისა და კოლოქალიზაციის Ontogeny. მოლ. უჯრედი. ნევროსი. 4, 155- დან. უჰლ-ბრონნერი, ს., უოლტისპერჯერი, ე., მარტინეზ-ლორენზანა, გ., კონდესი, ლმ, ფრონდ-მერსიერი, MJ, 2005. ოქსიტოცინის სავალდებულო ადგილის სქესობრივი დიმორფული გამოხატვა ვირთაგვასა და ზურგის ტვინის სარტყელში. ნეირომეცნიერებები 135, 147-154. ვაქცარი, გ., ლოლიტი, ს.ჯ., ოსტროვსკი, ნ.ლ. ტვინის ვიზროპრესინის V1b და ოქსიტოცინის რეცეპტორის მაცდური ribonucleic მჟავების შედარებითი განაწილება. ენდოკრინოლოგია 139, 5015-5033. ვან დენ პოლ, ა. გლუტამატი და ასპარტენტური იმუნორაქტიურობა ჰიპოთალამური პრეზინაფსური აქტონებში. J. ნევროსი. 11, 2087- დან. ვერონაეუ-ლონგლვილი, ფ., რამპინი, ო., ფრონდ-მერსიერი, მ.ჯ., თანგი, ი., კალი, ა., მარტონი, ლ., მაკკენა, კე, სტეოკელი, მე, ბონოიტი, გ., გიულიანო, ფ. , 1999. ავტონომიური უჯრედების ოქსიტოცინერბულური ინერვაცია ვირთაგვებში პენიალური რეაქციის კონტროლი. ნეირომეცნიერებები 93, 1437-1447. ვინსენტი, სრ, კიმურა, ჰ., 1992. აზოტის ოქსიდის სინთეზის ჰისტოქიმიური რუკები რათ ტვინში. ნეირომეცნიერებები 46, 755-784. ვაგნერი, CK, Clemens, LG, 1993. ჰიპოთალამუსის პარავენტარული ბირთვიდან ნეიროფინინის შემცველი ბილიკი სქესობრივი დიმორფული საავტომობილო ბირთვიდან წელის ზურგზე. J. კომპ. Neurol. 336, 106- დან. უინსლოუ, JT, Insel, TR, 1991. სოციალური სტატუსის მქონე მამაკაცის მამაკაცის ციყვი მაიმუნები განსაზღვრავენ ცენტრალური ოქსიტოცინის ადმინისტრაციის ქცევითი რეაქციას. J. ნევროსი. 11, 2032- დან. ბრძენი, RA, რომპრეი, P.-P., 1989. ტვინის დოპამინი და ჯილდო. Ann. Rev. ფსიქოლი. 40, 191- დან. Witt, DM, Insel, TR, 1994. მამრობითი სქესობრივი ქცევის ააქტიურებს c-fos მსგავსი ცილის ოქსიტოცინის ნეირონების in paraventricular ბირთვების ჰიპოთალამუსის. J. ნეიროენცეკრინოლი. 6, 13- დან. Witter, დეპუტატი, 2006. ვირთხის სუბიექტის კავშირი: ტოპოგრაფია სვეტარინისა და ლამინირების ორგანიზაციის მიმართ. Behav ტვინის Res. 174, 251- დან. ვუდრუფი, GN, Foster, AC, Gill, R., კემპ, JA, Wong, EH, Iversen, LL, 1987. ურთიერთქმედება MK-801 და რეცეპტორებს შორის N-Methyl-d-aspartate: ფუნქციური შედეგები. ნეიროფარმაკოლოგია 26, 903- დან. იამაშიტა, ჰ., შიგერი, ო., ინენაგა, კ., კასიი, მ., უზეუგი, ს., კაანი, ჰ., კანკეო, თ. ოქსიტოცინი უპირატესად ახარებს ოქსიტოცინის ნეირონების ინტრავენურ ვიტრაჟში ვირთაგვებში. ტვინის რეს. 416, 364- დან. Yells, DP, ჰენდრიქსი, SE, წინამძღაგი, MA, 1992. ბირთვების პარაგიგანტოცელულოზის დაზიანება: ეფექტი მამაკაცის ვირთაგვებზე. ტვინის რეს. 596, 73- დან. ახალგაზრდა, WS, შეპარდი, ე, Amico, J., Hennighausen, L., LaMarca, ME, McKinney, C., Ginns, EI, 1996. თაგვის ოქსიტოცინის დეფიციტი ხელს უშლის რძის გამონაბოლქვას, მაგრამ არა ნაყოფს ან ნაწილობრივ. J. ნეიროენცეკრინოლი. 8, 847- დან. Zahran, AR, Vachon, P., Courtois, F., Carrier, S., 2000. ანესთეზირებული ვირთხების ჰიპოთალამური პარავენტრიკულური ბირთვში ამცირებს მჟავა რეცეპტორების აგონისტების ამინომჟავების ინექციურ ინექტორებს. J. Urol.